Прием антибиотиков в первый месяц жизни затормозил рост мальчиков
Ученые из Германии, Израиля и Финляндии, проанализировав данные почти 15 тысяч детей, пришли к выводу, что использование антибиотиков в неонатальном периоде (первый месяц жизни) приводит к задержке роста у мальчиков. Как сообщается в журнале Nature Communications, такой эффект антибиотиков связан с их действием на кишечную микробиоту ребенка, что удалось подтвердить в эксперименте с гнотобиотическими мышами. Кроме того, использование антибиотиков у детей в первые шесть лет жизни в дальнейшем коррелировало с высоким индексом массы тела.
Исследователи все чаще находят связь между применением антибиотиков в ранние периоды жизни ребенка и различными нарушениями их здоровья позднее. Так, в одном исследовании ученые нашли корреляцию между антибиотикотерапией в раннем возрасте с целым набором заболеваний, а в другом — с задержкой роста детей в первый год жизни. Однако влияние антибиотиков на рост в долгосрочной перспективе оставалось неизученным.
Столь негативные эффекты антибиотикотерапии ученые связывают с ее влиянием на микробиоту кишечника. Известно, что от нее зависят процессы метаболизма в организме ребенка и что ее патологическое изменение ведет к риску ожирений в долгосрочной перспективе. Поэтому Самули Раутава (Samuli Rautava) из Университета Турку и Омри Корен (Omry Koren) из Университета имени Бар-Илана исследовали связь между воздействием антибиотиков в неонатальном и более поздних периодах и физическим развитием детей до шести лет отдельно у мальчиков и девочек, поскольку они по-разному подвержены побочным эффектам антибиотикотерапии.
Всего ученые исследовали 14969 детей из Финляндии и Германии. В финскую когорту попало 12422 доношенных ребенка, родившихся от одноплодной беременности без генетических аномалий или значительных патологий. Однако в течение первых 14 дней жизни антибиотики потребовались 1151 (9,3 процента) новорожденным. Подавляющее большинство получили комбинацию бензилпенициллина и гентамицина. Чтобы различать эффект от антибиотиков и от самой инфекции ученые разделили детей на две группы: краткосрочное лечение антибиотиками до момента исключения диагноза инфекции (513 новорожденных или 4,1 процента) и антибиотикотерапия при подтвержденной (лабораторно или клинически) инфекции (638 новорожденных или 5,1 процента).
Чтобы различать эффект от антибиотиков и от самой инфекции ученые разделили детей на две группы: краткосрочное лечение антибиотиками до момента исключения диагноза инфекции (513 новорожденных или 4,1 процента) и антибиотикотерапия при подтвержденной (лабораторно или клинически) инфекции (638 новорожденных или 5,1 процента).
Коррекция моделей проводилась с гестационным возрастом, массой тела при рождении, способом родов, индексом массы тела (ИМТ) матери до беременности и внутриутробным лечением антибиотиками. В скорректированной модели мальчики, подвергшиеся обоим видам антибиотикотерапии, имели значительно более низкий вес по сравнению с не подвергшимися воздействию детьми в течение первых шести лет жизни (р = 0,007 для инфицированных мальчиков и р = 0,031 для неинфицированных мальчиков). Мальчики с подтвержденной инфекцией, подвергшиеся антибиотикотерапии, также демонстрировали значительно более низкий рост (р = 0,011) и ИМТ в возрасте от 2 до 6 лет (р = 0,037). У девочек статистически значимой связи между неонатальным воздействием антибиотиков и массой тела, ИМТ и ростом в течение первых шести лет жизни не наблюдалось.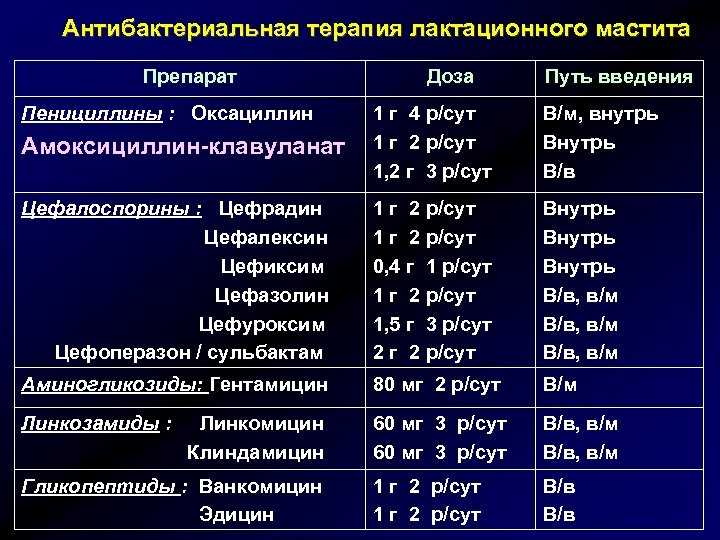
В немецкой когорте из 535 детей подвергшиеся в неонатальном периоде антибактериальной терапии мальчики имели более низкий вес (p < 0,0488) и рост (p < 0,008) в течение первых пяти лет жизни по сравнению с детьми, которых не лечили антибиотиками. Немецкие девочки показали аналогичные финским результаты: у них статистически значимых эффектов на рост антибиотикотерапия не вызывала.
Помимо этого, ученые изучали влияние антибиотиков на рост и вес детей после неонатального периода — до шести лет. В скорректированной модели у финских детей количество курсов антибиотиков после неонатального периода, но в течение первых шести лет жизни, оказалось связано со значительно более высокими ИМТ как у мальчиков (р < 0,001), так и у девочек (p < 0,001). Однако никаких патологий роста у таких детей не наблюдалось.
В предыдущем исследовании ученые выяснили, что у младенцев в возрасте одного месяца, подвергшихся воздействию антибиотиков, наблюдается значительно более низкое разнообразие микробиома кишечника по сравнению с контрольной группой. При этом к шестимесячному возрасту они все же достигали контрольного уровня бактериального разнообразия, а в возрасте одного и двух лет оно становилось выше, чем у детей из контрольной группы. Сильнее всего антибиотики ударили по роду Bifidobacterium — одному из главенствующих в кишечнике детей до года.
При этом к шестимесячному возрасту они все же достигали контрольного уровня бактериального разнообразия, а в возрасте одного и двух лет оно становилось выше, чем у детей из контрольной группы. Сильнее всего антибиотики ударили по роду Bifidobacterium — одному из главенствующих в кишечнике детей до года.
Чтобы установить, существуют ли причинно-следственные связи между неонатальным воздействием антибиотиков, изменением кишечной микробиоты и патологией роста, ученые пересадили кал от младенцев из обеих групп мышам-гнотобионтам (без микробов). У самцов мышей, которые получили фекальную микробиоту от младенцев через один месяц после лечения антибиотиками наблюдалось значительное снижение относительной прибавки веса по сравнению с самцами из контрольной группы (p < 0,001). Кроме того, нарушение роста наблюдалось и у самцов мышей при пересадке образцов, собранных через два года после воздействия антибиотика. У самок мышей таких эффектов ученые не обнаружили ни в одной временной точке.
По мнению ученых потенциальная причинно-следственная связь между воздействием антибиотиков в неонатальном периоде и патологией роста опосредована нарушениями в развивающемся кишечном микробиоме. Данные этого исследования к тому же свидетельствуют о более глубоком и длительном воздействии антибиотиков на колонизацию кишечника. Однако эта работа имеет значительные ограничения. Несмотря на разделение детей в финской когорте по формату получения антибиотикотерапии, оно не исключает иных причин, которые могли бы привести к патологии роста. Кроме того, изучение кишечного микробиома детей оставляло почти без внимания вид вскармливания детей.
Кстати, со вскармливанием детей все тоже обстоит неоднозначно. В материале «Порошок, уходи» мы пытаемся разобраться, чем молочные смеси не угодили миру, и так ли они хороши для ребенка, его кишечного микробиома и здоровья.
Вячеслав Гоменюк
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Антибиотики при внутрибольничной пневмонии у новорожденных младенцев и детей
Вопрос обзора
Какой режим приема антибиотиков является более безопасным и эффективным при лечении новорожденных младенцев и детей с внутрибольничной пневмонией?
Актуальность
Внутрибольничная пневмония — это воспаление тканей одного или обоих легких, вызванное инфекцией, возникающее во время пребывания в больнице (т. е. через 48 часов или более с момента поступления в больницу). Это одна из наиболее распространенных внутрибольничных инфекций у детей во всем мире, связанная с высоким уровнем смертности. Большинство наших представлений о внутрибольничной пневмонии у детей основано на результатах исследований, проведенных среди взрослых. Насколько нам известно, это первый обзор с мета-анализом, в котором оценивается польза и вред различных схем применения антибиотиков у новорожденных и детей с внутрибольничной пневмонией.
е. через 48 часов или более с момента поступления в больницу). Это одна из наиболее распространенных внутрибольничных инфекций у детей во всем мире, связанная с высоким уровнем смертности. Большинство наших представлений о внутрибольничной пневмонии у детей основано на результатах исследований, проведенных среди взрослых. Насколько нам известно, это первый обзор с мета-анализом, в котором оценивается польза и вред различных схем применения антибиотиков у новорожденных и детей с внутрибольничной пневмонией.
Дата поиска
Доказательства актуальны по состоянию на февраль 2021 года.
Характеристика исследований
Мы включили четыре исследования, в которых 84 ребенка с внутрибольничной пневмонией были рандомизированы по группам с различными схемами применения антибиотиков. Три исследования были многоцентровыми из США, Латинской Америки, Европы и одно из Южной Африки. Южноафриканское исследование включало один исследовательский центр в Малайзии.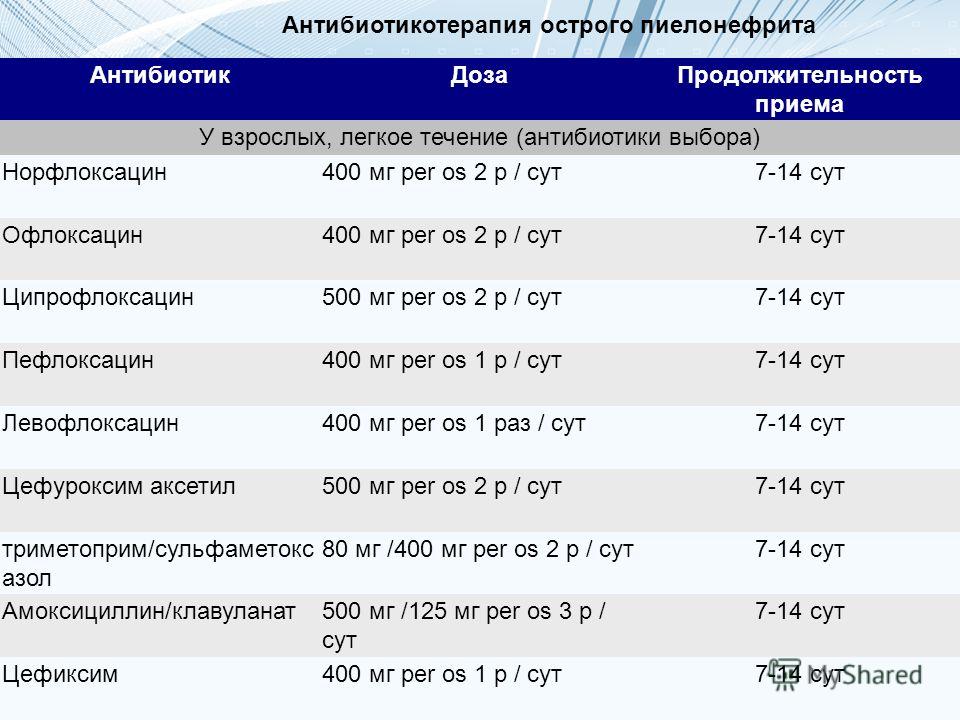
Источники финансирования исследований
Три исследования были финансированы фармацевтическими компаниями (Zeneca Pharmaceuticals, Pharmacia Corp и Basilea Pharmaceutica International Ltd.), что указывает на возможный риск смещения (систематической ошибки / предвзятости), связанный с риском корыстной заинтересованности.
Основные результаты
В каждом из четырех включенных исследований сравнивали различные схемы применения антибиотиков: цефепим против цефтазидима; линезолид против ванкомицина; меропенем против цефотаксима; цефтобипрол против цефалоспорина.
Только в одном исследовании сообщили о наших первичных исходах, таких как смерть от всех причин и серьезные неблагоприятные события (основные осложнения). В трех исследованиях сообщили о такой вторичной конечной точке (вторичном исходе), как неудача лечения. В двух исследованиях в основном включили детей с внебольничными пневмониями и госпитализированных детей с бактериальными инфекциями, поэтому дети с внутрибольничной пневмонией составляли лишь подгруппы от общего числа исследуемых.
В трех исследованиях сообщили о такой вторичной конечной точке (вторичном исходе), как неудача лечения. В двух исследованиях в основном включили детей с внебольничными пневмониями и госпитализированных детей с бактериальными инфекциями, поэтому дети с внутрибольничной пневмонией составляли лишь подгруппы от общего числа исследуемых.
Там, где были представлены результаты по исходам, определённость доказательств была очень низкой для каждого из сравнений. Мы не смогли сделать никаких значимых выводов из численных результатов.
Ни одно из включенных исследований не оценивало связанное со здоровьем качество жизни, смертность от пневмонии или несерьезные нежелательные явления (незначительные осложнения).
Выводы
Имеющиеся доказательства не позволяют предположить, что один режим приема антибиотиков безопаснее и эффективнее другого при лечении новорожденных и детей с внутрибольничной пневмонией. Необходимы дальнейшие исследования.
Определенность доказательств
В целом, определённость доказательств очень низкая. Все четыре включенных исследования имели высокий риск смещения (т.е. исследования были разработаны таким образом, что результаты могли быть искажены). Кроме того, во включенных исследованиях участвовало малое число участников, что, вероятно, привело к неточным результатам.
Заметки по переводу:
Перевод: Разумовская Елена Анатольевна. Редактирование: Зиганшина Лилия Евгеньевна. Координация проекта по переводу на русский язык: Cochrane Russia — Кокрейн Россия на базе Российской медицинской академии непрерывного профессионального образования (РМАНПО). По вопросам, связанным с этим переводом, пожалуйста, обращайтесь по адресу: [email protected]
Антибиотики для новорожденных — PubMed
Обзор
. 2009; 22 Дополнение 3:46-9.
дои: 10. 1080/14767050903192192.
1080/14767050903192192.
Гаэтано Кирико 1 , Фабиана Барбьери, Клаудия Кирико
принадлежность
- 1 Отделение неонатологии и интенсивной терапии новорожденных, Spedali Civili, Брешиа, Италия. [email protected]
- PMID: 19718590
- DOI: 10.1080/14767050903192192
Обзор
Гаэтано Кирико и др. J Matern Fetal Neonatal Med. 2009.
дои: 10. 1080/14767050903192192.
1080/14767050903192192.
Авторы
Гаэтано Кирико 1 , Фабиана Барбьери, Клаудия Кирико
принадлежность
- 1 Отделение неонатологии и интенсивной терапии новорожденных, Spedali Civili, Брешиа, Италия. [email protected]
- PMID: 19718590
- DOI: 10.1080/14767050903192192
Абстрактный
Из-за высокой восприимчивости к инфекциям антибиотики являются наиболее широко используемыми препаратами у новорожденных. Однако на результат применения антибиотиков может сильно влиять особая физиология новорожденного, характеризующаяся тонким процессом адаптации от внутриутробной к внеутробной жизни.

Похожие статьи
Применение антибиотиков при неонатальном сепсисе.
Юрдакёк М. Юрдакок М. Терк Дж. Педиатр. 1998 г., январь-март; 40(1):17-33. Терк Дж. Педиатр. 1998. PMID: 9722468 Обзор.
Азитромицин у младенцев с экстремально низкой массой тела при рождении для профилактики бронхолегочной дисплазии: пилотное исследование.

Баллард Х.О., Анстед М.И., Шук Л.А. Баллард Х.О. и др. Дыхание Рез. 2007 5 июня; 8 (1): 41. дои: 10.1186/1465-9921-8-41. Дыхание Рез. 2007. PMID: 17550598 Бесплатная статья ЧВК. Клиническое испытание.
Концентрация С-реактивного белка при начальном (эмпирическом) лечении неонатального сепсиса.
Янкович Б., Пасич С., Маркович М., Велькович Д., Миличич М. Янкович Б. и др. Серп Арх Целок Лек. 2001 май-июнь;129Приложение 1:17-22. Серп Арх Целок Лек. 2001. PMID: 15637985 Сербский.
Короткая антибиотикопрофилактика бактериальных инфекций в отделении интенсивной терапии новорожденных: рандомизированное контролируемое исследование.
Аурити К.
 , Рава Л., Ди Чиоммо В., Ронкетти М.П., Орзалези М.
Аурити С. и др.
Джей Хосп заражает. 2005 г., апрель; 59(4):292-8. doi: 10.1016/j.jhin.2004.09.005.
Джей Хосп заражает. 2005.
PMID: 15749316
Клиническое испытание.
, Рава Л., Ди Чиоммо В., Ронкетти М.П., Орзалези М.
Аурити С. и др.
Джей Хосп заражает. 2005 г., апрель; 59(4):292-8. doi: 10.1016/j.jhin.2004.09.005.
Джей Хосп заражает. 2005.
PMID: 15749316
Клиническое испытание.Антимикробная терапия и новорожденный.
Яффе С.Дж. Яффе С.Дж. Акушерство Гинекол. 1981 ноябрь; 58 (5 Дополнение): 85S-94S. Акушерство Гинекол. 1981. PMID: 7031545 Обзор.
Посмотреть все похожие статьи
Цитируется
Генетические полиморфизмы и сепсис у недоношенных новорожденных.
Эспозито С., Зампьеро А., Пуни Л., Табано С., Пелуччи С., Гирарди Б., Терранова Л., Миоццо М.
 , Моска Ф., Принципи Н.
Эспозито С. и др.
ПЛОС Один. 7 июля 2014 г .; 9 (7): e101248. doi: 10.1371/journal.pone.0101248. Электронная коллекция 2014.
ПЛОС Один. 2014.
PMID: 25000179
Бесплатная статья ЧВК.
, Моска Ф., Принципи Н.
Эспозито С. и др.
ПЛОС Один. 7 июля 2014 г .; 9 (7): e101248. doi: 10.1371/journal.pone.0101248. Электронная коллекция 2014.
ПЛОС Один. 2014.
PMID: 25000179
Бесплатная статья ЧВК.Рандомизированные контролируемые испытания антибиотиков при неонатальных инфекциях: систематический обзор.
Кагуелиду Ф., Тернер М.А., Чунара И., ван ден Анкер Дж., Манцони П., Альберти С., Лангендрис Дж.П., Жак-Эгрейн Э. Кагелиду Ф. и др. Бр Дж Клин Фармакол. 2013 июль; 76 (1): 21-9. doi: 10.1111/bcp.12113. Бр Дж Клин Фармакол. 2013. PMID: 23488627 Бесплатная статья ЧВК. Обзор.
Типы публикаций
термины MeSH
вещества
Исследование связывает использование антибиотиков у новорожденных с задержкой роста мальчиков
Новое исследование, проведенное международной группой ученых, обнаружило связь между использованием антибиотиков в первые несколько дней жизни и снижением роста и веса у мальчиков в раннем детстве.
В исследовании, опубликованном вчера в Nature Communications, группа под руководством ученых из Финляндии и Израиля изучила последствия применения антибиотиков в неонатальном периоде на двух больших группах детей и обнаружила, что у обоих мальчиков, подвергшихся воздействию антибиотиков в течение первых 14 дней жизни, в течение первых 6 лет прибавлялся меньший вес и рост. жизни по сравнению с мальчиками, которые не подвергались воздействию антибиотиков. Однако результаты не наблюдались у девочек.
Напротив, когда исследователи изучили воздействие антибиотиков в младенчестве после неонатального периода, они обнаружили, что как у мальчиков, так и у девочек использование антибиотиков было связано с увеличением веса в течение первых 6 лет жизни — открытие, которое согласуется с предыдущими данными. исследования.
«Таким образом, влияние антибиотиков на рост ребенка, по-видимому, зависит от возраста», — сказал в электронном письме Самули Раутава, доктор медицинских наук, соавтор исследования, неонатолог и преподаватель клинической педиатрии в Университете Турку в Финляндии.
Дополнительные результаты исследования показывают, что влияние антибиотиков на рост и вес связано с вызванными антибиотиками изменениями в кишечном микробиоме младенцев — скоплении микробов, обитающих в желудочно-кишечном тракте.
Нехватка, повышающая риск инфекций
Исследование является дополнением к растущему объему исследований, которые связывают воздействие антибиотиков в раннем возрасте с потенциальными долгосрочными последствиями для роста и набора веса. Многие исследования обнаружили положительную связь с увеличением веса, но с заметными различиями в наблюдаемом эффекте.
В отличие от предыдущих исследований, посвященных использованию антибиотиков в первые месяцы жизни, сказал Раутава, это исследование открывает новые возможности, поскольку оно сосредоточено на новорожденных, которые очень восприимчивы к инвазивным бактериальным инфекциям и получают эмпирическую терапию антибиотиками, если у них проявляются клинические признаки. инфекции. Также рассматривались последствия после первых нескольких недель жизни.
«Наше исследование — первое, в котором основное внимание уделяется долгосрочным последствиям воздействия антибиотиков в самые первые дни жизни», — сказал он.
Для исследования Раутава и его коллеги проанализировали данные о 12 422 детях из когорты новорожденных Юго-Западной Финляндии, в которую входят почти 15 000 детей, рожденных в университетской больнице Турку с 2008 по 2010 год. Из этих детей 1 151 (9,3%) получали антибиотики в течение первые 14 дней жизни. Чтобы провести различие между воздействием антибиотиков и основной инфекцией, они классифицировали этих детей как получающих краткосрочное эмпирическое лечение антибиотиками (513 новорожденных) или антибиотики, вводимые по поводу подтвержденной или клинической инфекции (638 новорожденных).
После исключения потенциальных искажающих факторов, которые могут быть связаны с воздействием антибиотиков и могут повлиять на рост, они обнаружили, что мальчики, подвергшиеся либо краткосрочному эмпирическому воздействию, либо лечению антибиотиками по поводу инфекции, показали значительно более низкие вес, рост и индекс массы тела (ИМТ) по сравнению с мальчиками.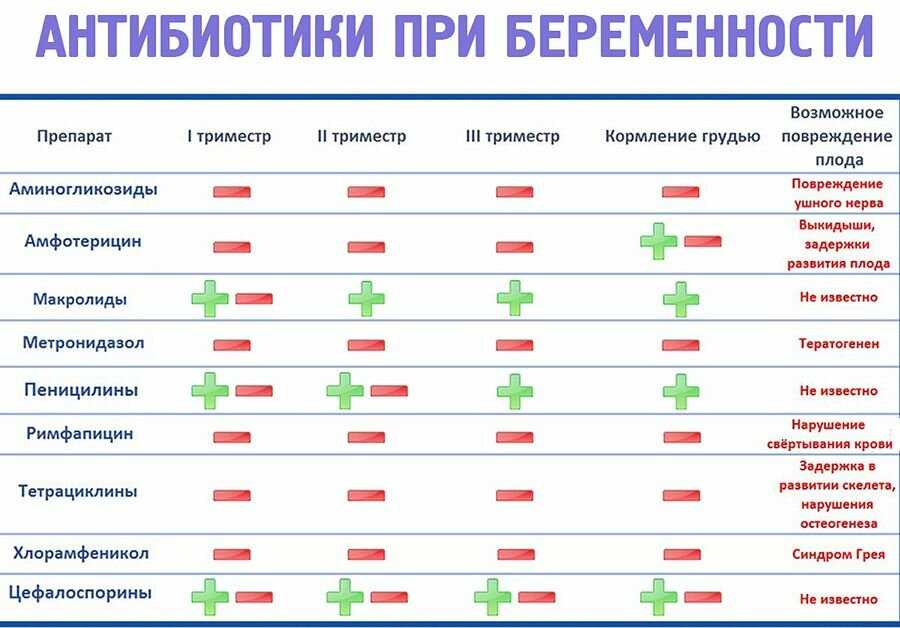 дети, не подвергавшиеся воздействию, в течение первых 6 лет жизни. Нарушение роста оказалось несколько более выраженным у новорожденных, получивших полный курс антибиотиков.
дети, не подвергавшиеся воздействию, в течение первых 6 лет жизни. Нарушение роста оказалось несколько более выраженным у новорожденных, получивших полный курс антибиотиков.
Затем исследователи подтвердили этот вывод у детей из когорты PEACHES (Программирование повышенного риска ожирения в детском возрасте — ранний скрининг), которая состоит из 1707 немецких детей и матерей, набранных с 2010 по 2015 год. Из 535 проанализированных детей 6,4% (34 новорожденных) перенесли инфекцию и антибиотикотерапию. Результаты показали, что мальчики, подвергшиеся воздействию антибиотиков в неонатальном периоде, но не девочки, имели значительно меньший вес и рост в первые 5 лет жизни по сравнению с теми, кто не получал антибиотики в период новорожденности.
Когда исследователи вернулись к финской когорте и изучили воздействие антибиотиков после периода новорожденности, они обнаружили, что кумулятивное количество курсов антибиотиков в течение первых 6 лет жизни было связано со значительно более высокими показателями ИМТ как у мальчиков, так и у девочек. и больший вес только у мальчиков. Не было обнаружено связи между развитием роста и использованием антибиотиков.
и больший вес только у мальчиков. Не было обнаружено связи между развитием роста и использованием антибиотиков.
Раутава сказал, что у них пока нет объяснения связи между использованием антибиотиков новорожденными и нарушением роста в зависимости от пола. Но он отметил, что предыдущие исследования показали, что мальчики более склонны к увеличению ИМТ, связанному с приемом антибиотиков, после неонатального периода — это открытие также наблюдалось у мышей.
«В совокупности мальчики, по-видимому, более восприимчивы к долгосрочным побочным эффектам антибиотиков, но причина в настоящее время неизвестна», — сказал он.
Воздействие антибиотиков на микробиом кишечника
Зная, что предыдущие исследования показали, что у новорожденных, получающих антибиотики, наблюдается изменение состава микробиома кишечника в течение первых нескольких недель жизни, исследователи затем получили и проанализировали образцы фекалий 13 младенцев, подвергшихся воздействию антибиотиков в период новорожденности.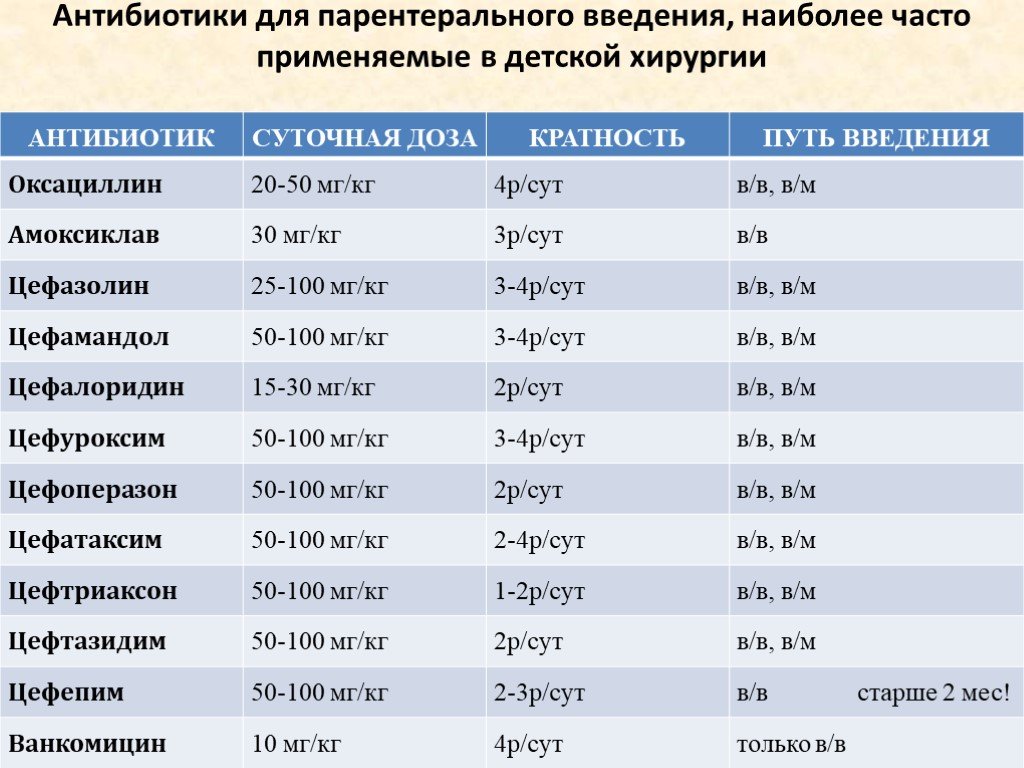 и 20 не подвергшихся воздействию младенцев в университетской больнице Турку. Они хотели посмотреть, сохраняются ли эти изменения дольше нескольких недель.
и 20 не подвергшихся воздействию младенцев в университетской больнице Турку. Они хотели посмотреть, сохраняются ли эти изменения дольше нескольких недель.
Они обнаружили, что через 1 месяц у младенцев, получавших антибиотики, было значительно более низкое богатство кишечного микробиома по сравнению с младенцами, не подвергавшимися воздействию антибиотиков. Однако в возрасте 6 месяцев дети, которых лечили антибиотиками, имели тот же уровень бактериального богатства, что и дети из контрольной группы. К 12 и 24 месяцам у них был более высокий уровень бактериального богатства по сравнению с детьми из контрольной группы.
Таксономический и метагеномный анализ показал, что самая большая разница в микробиомах кишечника младенцев, получавших антибиотики, заключалась в относительном количестве и разнообразии Bifidobacterium , один из основных родов бактерий, образующих желудочно-кишечный тракт млекопитающих. Бифидобактерии очень распространены в кишечнике в младенчестве, особенно когда младенцы находятся на грудном вскармливании, но Раутава и его коллеги отметили, что это было меньше у младенцев, которые получали антибиотики в период новорожденности во все периоды времени, за исключением 6 месяцев после лечения.
Соавтор исследования Омри Корен, доктор философии, профессор Университета Бар-Илан в Израиле, изучающий роль микробиома в развитии болезней, сказал, что будущие исследования будут углубляться в эту роль.0142 Bifidobacterium может играть роль в замедлении роста.
«Мы определенно думаем, что это играет роль, и в настоящее время проводим эксперименты, чтобы попытаться выявить механизм», — сказал он.
Сделав еще один шаг в своем исследовании, исследователи обнаружили аналогичное влияние на рост стерильных мышей после того, как они вводили бактерии кишечного микробиома младенцам, подвергавшимся и не подвергавшимся воздействию антибиотиков, с помощью трансплантации фекальной микробиоты (ТФМ). В течение 43-дневного периода наблюдения и даже через 24 месяца самцы мышей, получавших ТФМ от младенцев, подвергшихся воздействию, набирали меньше веса, чем мыши-самцы, получавшие ТФМ от младенцев, не подвергавшихся воздействию. Опять же, эффект не наблюдался у самок мышей.
«Эти данные свидетельствуют о том, что замедление роста у мальчиков и долгосрочные нарушения в микробиоме кишечника после неонатального воздействия антибиотиков связаны причинно-следственной связью», — пишут они в исследовании.
Необходимы дальнейшие исследования
Раутава и его коллеги предупреждают, что эти выводы имеют ограничения. Во-первых, несмотря на их попытки провести различие между новорожденными, прошедшими кратковременную эмпирическую терапию антибиотиками, и теми, у кого были инфекции, результаты могут быть искажены основными причинами, которые привели к воздействию антибиотиков.
Другим является отсутствие данных о грудном вскармливании. Поскольку грудное молоко может воздействовать на определенные бифидобактерии в кишечнике, различия в частоте и продолжительности грудного вскармливания могут объяснить снижение численности, наблюдаемое у младенцев, получавших антибиотики.
Тем не менее, они говорят, что результаты предполагают, что введение антибиотиков новорожденным может иметь пагубные последствия, поскольку известно, что нарушение роста у детей связано с плохими исходами развития нервной системы.
