Бактериофаги. Безопасные антибактериальные препараты. Эффективная альтернатива антибиотикам
Бактериофаги. Безопасные антибактериальные препараты. Эффективная альтернатива антибиотикамsection-container news-container
что такое бактериофаги
Бактериофаги — современные антимикробные препараты природного происхождения. Это микроорганизмы, способные точечно уничтожать только болезнетворные бактерии. Бактериофаги используются в профилактике и антибактериальной терапии заболеваний, возбудителями которых являются патогенные бактерии.
в природе
- Присутствуют повсюду в нашем мире — в океане, почве, глубоководных источниках, питьевой воде и пище.
- Самая распространённая форма жизни на Земле; в биосфере содержится от 1030 до 1032 фаговых частиц.
- Старейшие из известных микроорганизмов — их возраст оценивают примерно в 3 миллиарда лет.

- Играют ключевую роль в поддержании баланса всех исследованных человеком экосистем.
- Контролируют количество микробной флоры и сдерживают её патологический рост.
в медицине
- История применения бактериофагов насчитывает более 100 лет. Мировое врачебное и научное сообщество активно исследует фаги в качестве антимикробных агентов.
- Биотехнологи научились создавать медицинские антибактериальные препараты на основе бактериофагов и применять их для лечения пациентов.
- Современная медицина позволяет использовать бактериофаговую терапию против большинства бактериальных инфекций.
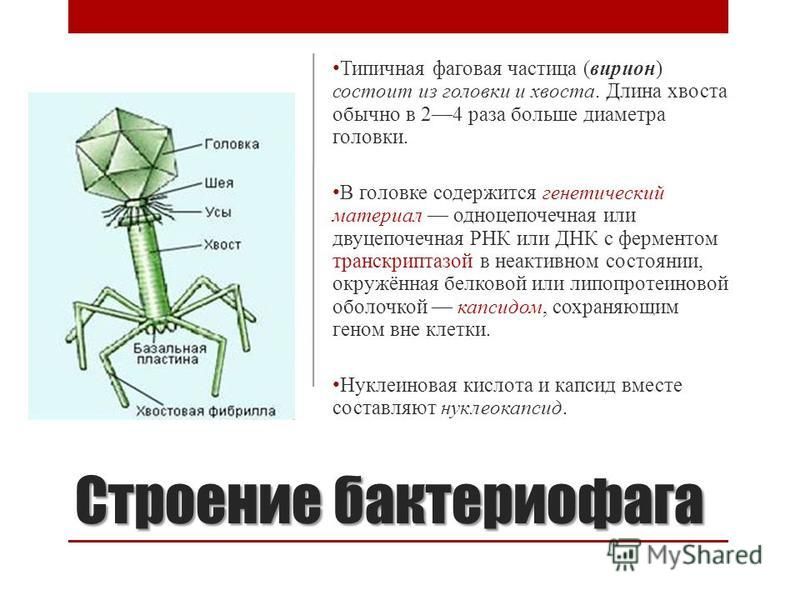
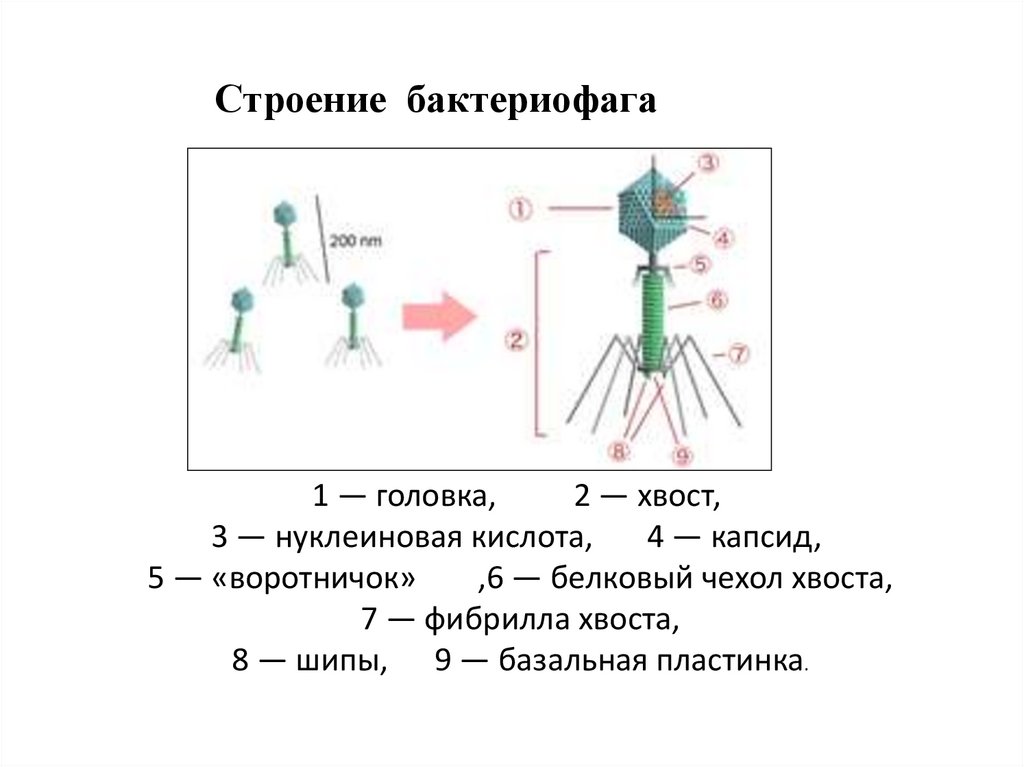
Строение бактериофага
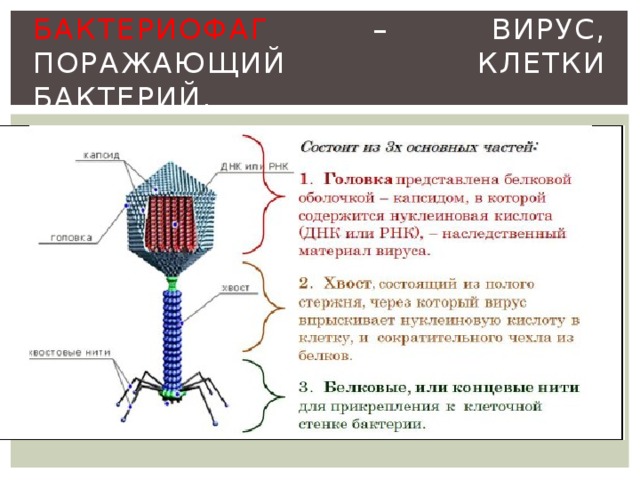
Бактериофаги имеют кубическую, нитевидную или форму головастика. Головка бактериофага содержит нуклеиновую кислоту (ДНК или РНК), заключённую в белковую оболочку.
Ниже расположен хвостовой отросток , состоящий из внутреннего стержня и сократительного чехла.
Передвигается бактериофаг с помощью ножек-фибрилл, скреплённых в центре базальной пластиной. Размер бактериофага в сотни и тысячи раз меньше микробных клеток.
Факты о бактериофагах
Бактериофаги – антибактериальные агенты и природные антисептики
Безопасны и нетоксичны, побочные эффекты редки, применяются у новорождённых детей, беременных и кормящих женщин
Действие бактериофагов не затрагивает полезную микрофлору организма, в отличие от антибиотиков
Бактериофаги совместимы со всеми лекарственными препаратами. Применение бактериофагов не ограничивает использование других лекарств и не влияет на их эффективность
Воздействует лишь на чувствительные к ним болезнетворные бактерии, вызывающие инфекционное заболевание, разрушая их изнутри
Бактериофаги выводятся из организма естественным путем
Как работают бактериофаги
Бактериофаги (от лат. phagos — пожирающий бактерии) — особые вирусы, которые способны размножаться только в присутствии определенного вида болезнетворных бактерий. Бактериофаги воспроизводят себе подобных только за счёт бактерий. Но человеку эта особенность только на руку: бактериофаг питается клетками вредных бактерий и полностью разрушает их.
phagos — пожирающий бактерии) — особые вирусы, которые способны размножаться только в присутствии определенного вида болезнетворных бактерий. Бактериофаги воспроизводят себе подобных только за счёт бактерий. Но человеку эта особенность только на руку: бактериофаг питается клетками вредных бактерий и полностью разрушает их.
6
этаповработы
бактериофагов
1
Прикрепление бактериофагов
на бактериальных клетках
Инъекция нуклеиновой кислоты бактериофага внутрь бактерии
3
Синтез белковых и нуклеиновых компонентов бактериофагов
4
Соединение белковых и нуклеиновых компонентов фагов
5
Сборка новых фаговых частиц
6
Выход зрелых фагов и гибель бактерии
Условные обозначения
Бактерия
ДНК бактерии
Бактериофаг
ДНК фага
Что лечат бактериофагами
Препараты бактериофагами применяются для лечения и профилактики инфекционных заболеваний в следующих областях: гастроэнтерология, урология, гинекология, хирургия, оториноларингология, пульмонология, инфекционные заболевания желудочно-кишечного тракта (ЖКТ), гнойно-воспалительные заболевания кожи и слизистых.
Гастроэнтерология
Холецистит, гастроэнтероколит, дисбактериоз кишечника
Урогинекология
Цистит, пиелонефрит, кольпит, уретрит, эндометрит
Хирургия
Абсцесс, панариций, парапроктит, остеомиелит, мастит, перитонит, фурункулы, ожоги, гнойные раны, профилактика внутрибольничных инфекций
Оториноларингология
Синусит, тонзиллит, фарингит, ларингит, бронхит, ангина, гайморит, отит
Пульмонология
Трахеит, плеврит, ларингит, бронхит, пневмония
Инфекционные заболевания ЖКТ
Бактериальная дизентерия, дисбактериоз, энтероколит, колит, диспепсия
Гнойно-воспалительные заболевания кожи и слизистых
Омфалит, пиодермия, конъюнктивит, кератоконъюнктивит, сепсис, пемфигус и другие
ПРОИЗВОДСТВО БАКТЕРИОФАГОВ
Опыт применения бактериофагов насчитывает более 80 лет. Единственным в России производителем лекарственных препаратов бактериофагов является АО «НПО «Микроген» , выпускающее более 11 уникальных разновидностей препаратов данного вида.
На предприятии разрабатываются первый в мире мире универсальный бактериофаг против бактерий рода энтеробактер. Ведутся работы по созданию новых фаговых коктейлей, включая препарат, который действует на синегнойную палочку и бактерии рода ацинетобактер баумани.
Регистрационные удостоверения
Лекарственные препараты бактериофаги сертифицированы в соответствии с государственными стандартами Российской Федерации.
Бактериофаги и антибиотики
Сравнение профилактического и терапевтического эффекта фагов и антибиотиков
Бактериофаги
антибиотики
Селективность действия
Предельно селективны. Уничтожают специфичных патогенов, не затрагивая нормальную бактериальную флору. Сохраняют микробный баланс организма.
Атакуют не только возбудителей заболеваний, но также все чувствительные микроорганизмы, включая нормальную микрофлору хозяина.
Побочные эффекты
Индивидуальная непереносимость. С клинической точки зрения фаги безопасны, поскольку люди с рождения встречаются с ними. Фаги – постоянные спутники организма, они были обнаружены в желудочно-кишечном тракте, на коже, в моче, во рту. Благодаря этому препараты можно назначать даже новорождённым детям.
Кишечные расстройства, аллергии, вторичные инфекции, подавление иммунитета, токсическое воздействие на печень и почки.
Разработка новых лекарств
Получение новых литических фагов происходит быстро благодаря естественной эволюции бактерий и фагов.
Создание новых антибиотиков (например, против антибиотикоустойчивых бактерий) требует временных затрат и может занять много лет.
Новости
«Микроген» провел научно-практическую конференцию по бактериофагам
С 20 по 21 октября 2022 года на уфимском предприятии НПО «Микроген» состоялась двухдневная научно-практическая конференция «Бактериофаги: биология, производство и применение в клинической практике», посвященная различным фундаментальным и прикладным аспектам изучения биологии бактериофагов, а также технологиям производства препаратов на их основе.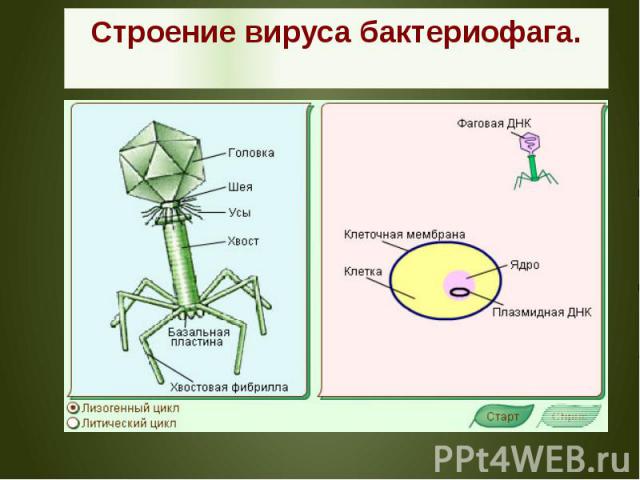
Подробнее
Эксперт НПО «Микроген» рассказал читателям «Комсомольской правды» о преимуществах бактериофагов
Руководитель проектного офиса «Развитие бактериофагов» НПО «Микроген», дочерней организации холдинга «Нацимбио» (Госкорпорация Ростех), Александр Жарников принял участие в обсуждении перспектив преодоления антибиотикорезистентности в России в рамках еженедельного мероприятия «Деловая пятница» издательского дома «Комсомольская правда».
Подробнее
Препараты бактериофагов включены в Федеральные Клинические рекомендации по острому синуситу
Лекарственные препараты бактериофагов рекомендованы в качестве консервативной терапии острого синусита в Федеральных Клинических рекомендациях – Острый синусит – 2021-2022-2023 (01.09.2021). Разработчик клинических рекомендаций — Национальная медицинская ассоциация оториноларингологов. Рекомендации одобрены Научно-практическим Советом Минздрава РФ.
Подробнее
Все новости
Механизм действия бактериофагов, как это работает.
 Фагочувствительность
Фагочувствительностьоткрытие пенициллина – первого антибиотика природного происхождения, воспринималось поначалу как шанс раз и навсегда победить инфекционные заболевания, уносившие миллионы жизней. Однако во второй половине прошлого века первоначальная эйфория пошла на убыль: выяснилось, что бактерии благодаря мутациям могут приобретать устойчивость к любому антибиотику и даже обмениваться между собой этими генами. Так началась «гонка вооружений» человека и бактерий.
Между препаратами бактериофагов и химическими антибиотиками существует принципиальное различие: антибиотик, в отличие от фагового препарата, убивает всё на своем пути, включая содружество полезных микроскопических обитателей организма.
Cовместная эволюция бактерий и фагов за последние 3 миллиарда лет привела к тому, что практически для любой болезнетворной бактерии имеется соответствующий вирус-«убийца».
В отличие от обычных антибиотиков, бактериофаги модифицируют свои генетические программы сами, что снимает проблему устойчивости. Результат – высокая избирательность: конкретный бактериофаг обычно эффективен в отношении лишь одного определенного бактериального вида или даже штамма бактерий.
Результат – высокая избирательность: конкретный бактериофаг обычно эффективен в отношении лишь одного определенного бактериального вида или даже штамма бактерий.
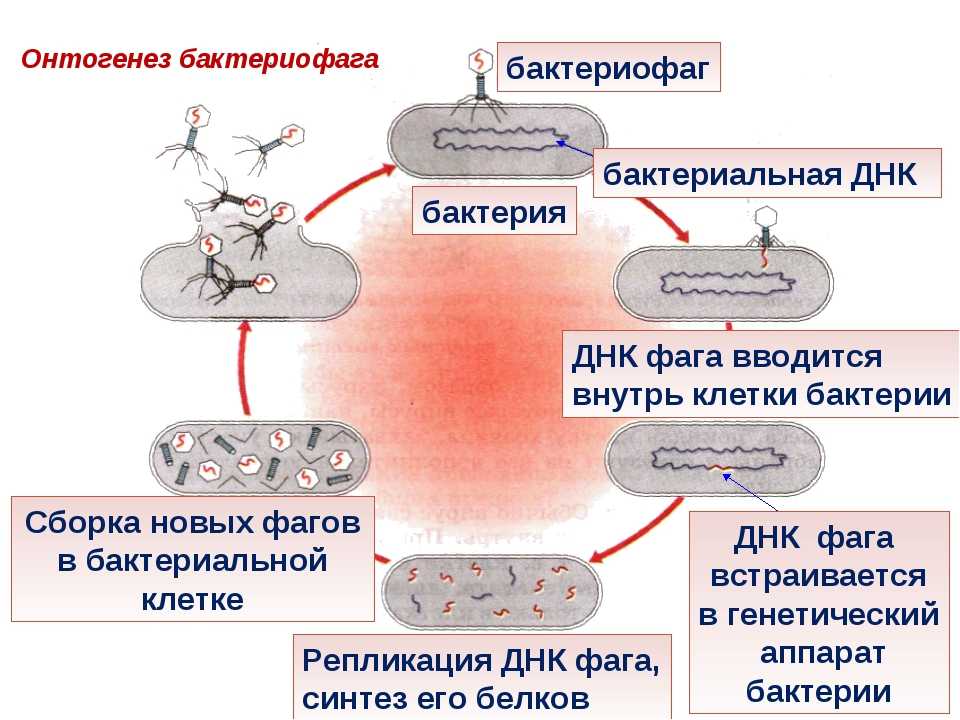
Процесс уничтожения бактериальной клетки бактериофагом включает в себя несколько строго запрограммированных шагов.
Действие бактериофагов
Очень важным является то, что бактериофаги не трогают не «свои» бактерии, поэтому не вызывают гибель «хорошей» микрофлоры и, конечно, абсолютно безопасны для клеток высших организмов, включая человека.
При фаготерапии отсутствуют побочные эффекты, такие как аллергия, дисбактериоз, вторичные инфекции (например, грибковые), что нередко наблюдается при приеме антибиотиков. Бактериофаги могут применяться в комбинированной терапии с любыми лекарственными препаратами, включая антибиотики.
Препараты бактериофагов представляют собой раствор, используют их либо местно (например, на кожу или слизистые), либо принимают внутрь. В организме бактериофаги концентрируются в местах наибольшего поражения и размножаются до тех пор, пока находят бактерии-«мишени».
Главная цель фаготерапии – остановить и повернуть вспять инфекционный процесс, чтобы дать иммунной системе организма возможность справиться с болезнью.
С помощью бактериофагов лечат
| |
| |
| |
| Гнойно-воспалительные заболевания кожи и слизистых | Внутрибольничные инфекции |
В идеальном случае перед началом лечения у конкретного больного следует выделить болезнетворную бактерию в культуру и подобрать бактериофаг из «коллекции» уже известных бактериальных вирусов.
Препараты бактериофагов трудно поддаются стандартизации из-за специфики производства. Даже опытный специалист не всегда может заранее предсказать эффективность того или иного препарата у конкретного пациента, так как разные бактериальные штаммы бактерий могут вызывать схожие проявления болезни. Выход – производство «коктейлей» из фагов, способных убивать разные штаммы и даже виды возбудителей. И такие препараты уже существуют — это комплексные, или поливалентные препараты бактериофагов
6 этапов работы бактериофагов
Условные обозначения
Бактерия
ДНК бактерии
Бактериофаг
ДНК фага
Адсорбция бактериофагов на бактериальных клетках
Специальные элементы фага, расположенные на поверхности в виде фибрилл или шипов, связываются со специфичными поверхностными молекулами — рецепторами на своей жертве — бактерии.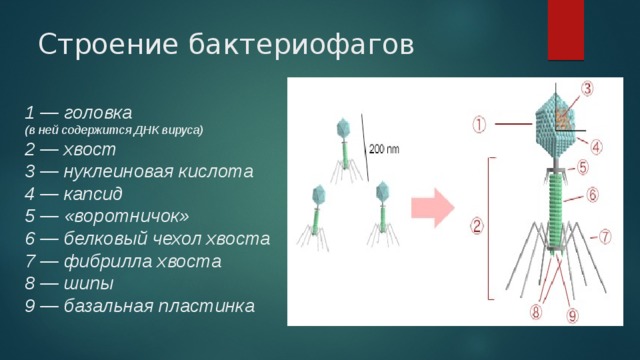 Пока бактериофаг достаточно плотно не закрепится на поверхности бактерии, следующей стадии не происходит. Так как существует специальная система блокировки.
Пока бактериофаг достаточно плотно не закрепится на поверхности бактерии, следующей стадии не происходит. Так как существует специальная система блокировки.
Инъекция нуклеиновой кислоты бактериофага внутрь клетки
После плотного прикрепления фага (адсорбции) происходит внедрение генетического материала бактериофага в тело бактерии. Для этого в структуре фага природа предусмотрела наличие специальных структур, которые действуют по типу шприца. Именно за счет этого фаг как бы делает инъекцию, растворяет оболочку и вводит свой генетический материал в бактерию. Для этого у фага есть агрессивный фермент для прокалывания бактерии.
Сборка фаговых частиц
Сборка молодых фагов начинается с упаковывания генетического материала в икосаэдрические белковые оболочки. Далее к фагам присоединяется хвост, на головке фага появляются различные, необходимые для его жизнедеятельности белки. Количество молодых фагов внутри бактерии возрастает. Новое поколение готовится к выходу из бактериальной клетки.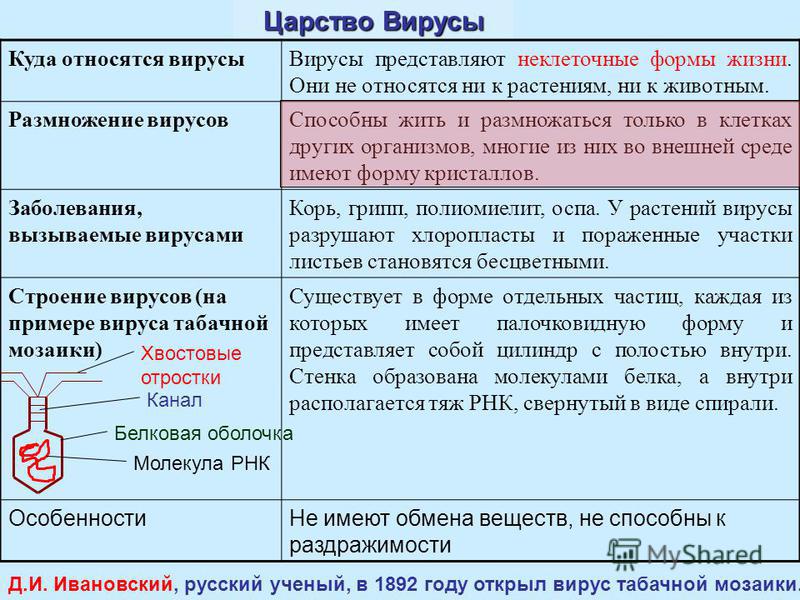
Репликация копий нуклеиновой кислоты бактериофага
Когда ДНК фага попадает в бактерию она может раствориться ферментами бактерии. Однако фаг защищает свою ДНК специальными липкими белками, которые замыкают молекулу в кольцо, делая ее неуязвимой. Далее происходит тиражирование генетического материала (ДНК) фага прямо в клетке бактерии.
Синтез белковых и нуклеиновых частиц
После заражения бактерии начинается перестройка клеточного метаболизма под нужды фага: разрушаются некоторые клеточные белки. Далее происходит включение генетического материала фага в метаболизм бактерии и начинается сборка новых, молодых фагов.
Выход зрелых фагов и смерть бактерии
Финал жизненного цикла фага — клеточный лизис. Молодые фаги используют для разрушения бактериальной клетки набор ферментов, которые расщепляют оболочки бактерий (лизины), и белков, создающих поры во внутренней мембране бактерии и обеспечивающих ускорение действия фермента лизина.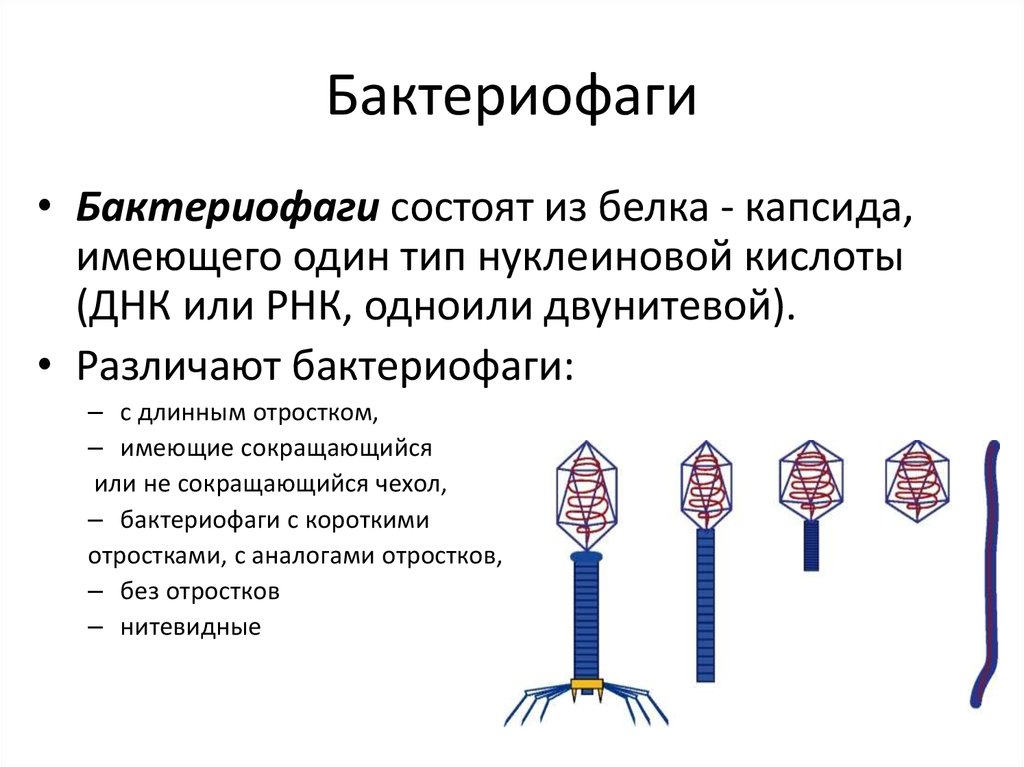
Противопоказания
Только индивидуальная непереносимость.
С клинической точки зрения фаги достаточно безопасны, поскольку люди с рождения встречаться с ними. Фаги – это постоянные спутники организма, они были обнаружены в желудочно кишечном тракте, коже, моче, во рту, где они содержаться в слюне. Бактериофаги являются безопасной альтернативой антибиотикам.
Сравнение профилактического и терапевтического использования фагов и антибиотиков
Бактериофаги
Антибиотики
Воздействие на бактерии
Фаги эффективно убивают чувствительные клетки бактерий (их действие бактерицидное).
Некоторые антибиотики (например, хлорамфеникол) бактериостатические; они скорее ингибируют рост бактерий, чем убивают клетки.
Селективность действия
Высокая селективность бактериофагов позволяет нацеливаться на специфичных патогенов, не затрагивая нормальную бактериальную флору (например, маловероятно, что фаги будут враждебны по отношению к нормофлоре пациентов).
Антибиотики атакуют не только бактерий – возбудителей заболеваний, но также все чувствительные микроорганизмы, включая нормальную – и часто полезную – микрофлору хозяина. Поэтому их неселективное действие нарушает микробный баланс в организме пациента, что может привести к различным побочным эффектам.
Побочные эффекты
Незначительные побочные эффекты при применении лечебных фагов (могут быть вызваны высвобождением эндотоксинов из бактерий, лизированных in vivo фагами).
Для антибиотиков характерно множество побочных эффектов, включая кишечные расстройства, аллергии и вторичные инфекции (например, грибковые инфекции).
Разработка новых препаратов
Естественная коэволюция бактерий и фагов может облегчить получение новых литических фагов против фагоустойчивых бактерий, появляющихся в результате действия других фагов или естественных изменений в бактериальных популяциях.
Создание новых антибиотиков (например, против антибиотикоустойчивых бактерий) требует временных затрат и может занять много лет.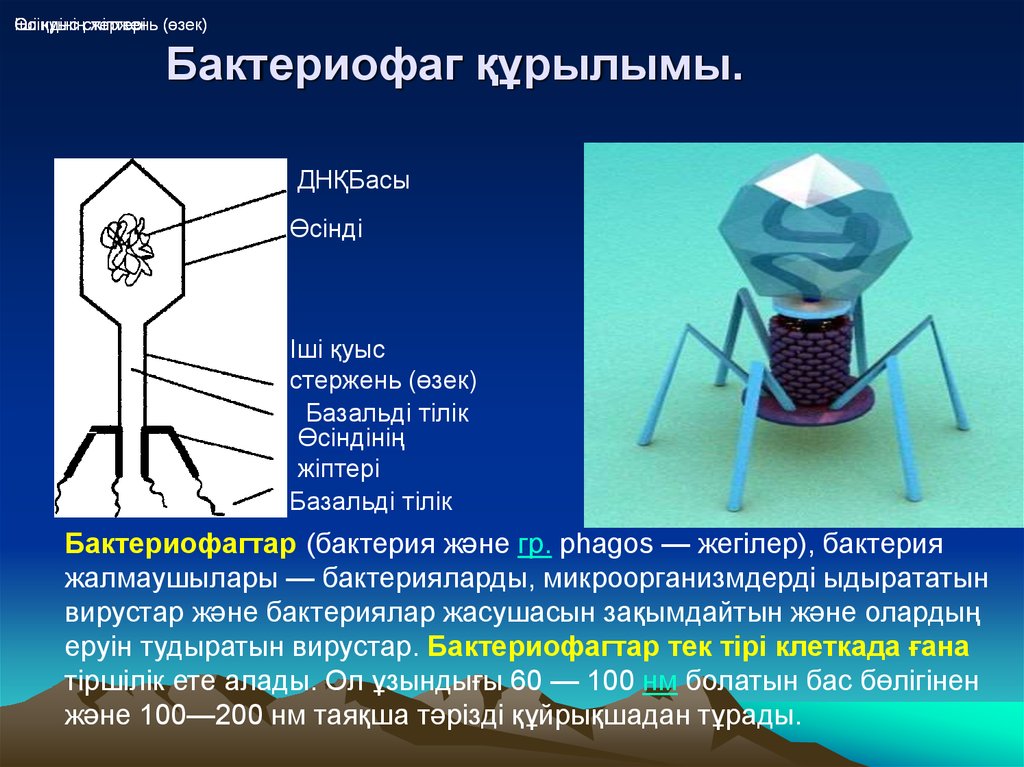
Устойчивость бактерий к действию препарата
Из-за специфичности фагов маловероятно появление устойчивости у других бактериальных видов, не являющихся мишенями терапии.
Из-за широкого спектра активности антибиотики могут приводить к отбору устойчивых мутантов многих видов бактерий, а не только у штаммов мишени.
Применение препарата
Из-за специфичности фагов их успешное использование для предупреждения и лечения бактериальных инфекций требует идентификации этиологического агента и определения его фагочувствительности к препарату in vivo перед началом фагового лечения.
Эмпирически назначенные до идентификации этиологического агента антибиотики с большей вероятностью будут эффективны нежели фаговые препараты.
Бактериофаг | Определение, жизненный цикл и исследования
бактериофаг
Посмотреть все СМИ
- Ключевые люди:
- Рудольф Йениш Грегори П. Винтер Джордж П. Смит Феликс д’Эрель Сальвадор Лурия
- Похожие темы:
- фи-Х 174 λ-бактериофаг бактериофаг Т4 профаг лизогенный фаг
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
Изучите, как бактериофаги размножаются путем введения нуклеиновой кислоты в клетку бактерии для создания вирионов
Просмотреть все видео к этой статье бактериофаг , также называемый фаг или бактериальный вирус , любой из группы вирусов, поражающих бактерии. Бактериофаги были открыты независимо друг от друга Фредериком В. Туортом в Великобритании (1915) и Феликса д’Эреля во Франции (1917). Д’Эрелль ввел термин бактериофаг , что означает «пожиратель бактерий», для описания бактерицидной способности агента. Бактериофаги также заражают одноклеточные прокариотические организмы, известные как археи.
Бактериофаги были открыты независимо друг от друга Фредериком В. Туортом в Великобритании (1915) и Феликса д’Эреля во Франции (1917). Д’Эрелль ввел термин бактериофаг , что означает «пожиратель бактерий», для описания бактерицидной способности агента. Бактериофаги также заражают одноклеточные прокариотические организмы, известные как археи.
Характеристики бактериофагов
Существуют тысячи разновидностей фагов, каждая из которых может инфицировать только один или несколько типов бактерий или архей. Фаги относятся к ряду семейств вирусов; некоторые примеры включают Inoviridae, Microviridae, Rudiviridae и Tectiviridae. Как и все вирусы, фаги представляют собой простые организмы, состоящие из ядра генетического материала (нуклеиновой кислоты), окруженного белковым капсидом. Нуклеиновая кислота может представлять собой ДНК или РНК и может быть двухцепочечной или одноцепочечной. Существуют три основные структурные формы фага: икосаэдрическая (20-гранная) головка с хвостом, икосаэдрическая головка без хвоста и нитевидная форма.
Жизненные циклы бактериофагов
Во время инфекции фаг прикрепляется к бактерии и встраивает в клетку свой генетический материал. После этого фаг обычно проходит один из двух жизненных циклов: литический (вирулентный) или лизогенный (умеренный). Литические фаги берут на себя механизмы клетки, чтобы производить компоненты фага. Затем они разрушают или лизируют клетку, высвобождая новые фаговые частицы. Лизогенные фаги включают свою нуклеиновую кислоту в хромосому клетки-хозяина и реплицируются с ней как единое целое, не разрушая клетку. При определенных условиях лизогенные фаги можно заставить следовать литическому циклу.
Существуют и другие жизненные циклы, включая псевдолизогению и хроническую инфекцию. При псевдолизогении бактериофаг проникает в клетку, но не кооптирует механизм клеточной репликации и не интегрируется стабильно в геном хозяина. Псевдолизогения возникает, когда клетка-хозяин сталкивается с неблагоприятными условиями роста и, по-видимому, играет важную роль в выживании фага, обеспечивая сохранение генома фага до тех пор, пока условия роста хозяина снова не станут благоприятными.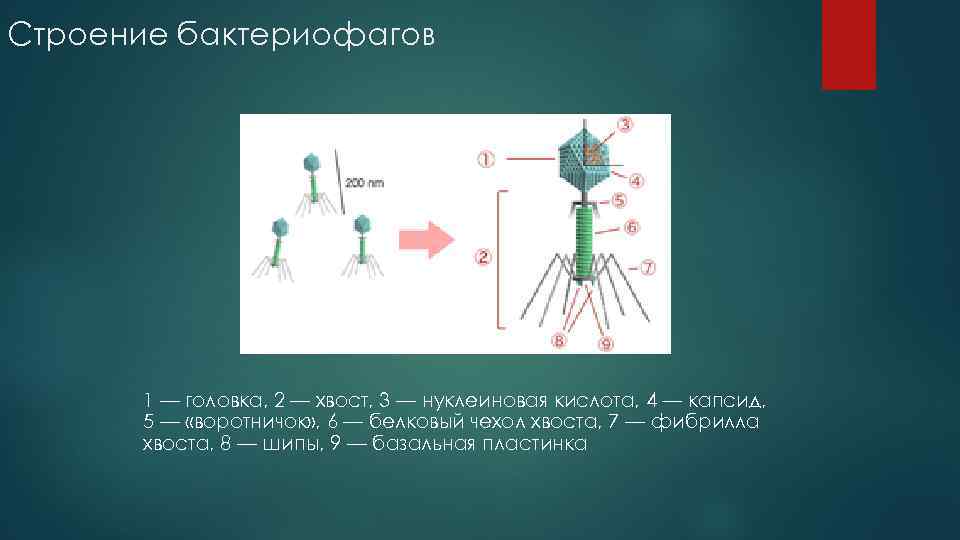 При хронической инфекции новые фаговые частицы продуцируются непрерывно в течение длительных периодов времени, но без явного уничтожения клеток.
При хронической инфекции новые фаговые частицы продуцируются непрерывно в течение длительных периодов времени, но без явного уничтожения клеток.
Роль в лабораторных исследованиях
Фаги сыграли важную роль в лабораторных исследованиях. Первыми изученными фагами были фаги, обозначенные как тип 1 (T1) — тип 7 (T7). Т-четные фаги Т2, Т4 и Т6 использовали в качестве модельных систем для изучения размножения вируса. В 1952 году Альфред Дэй Херши и Марта Чейз использовали бактериофаг Т2 в известном эксперименте, в котором они продемонстрировали, что для их репликации в бактериях необходимы только нуклеиновые кислоты молекул фага. Результаты эксперимента подтвердили теорию о том, что ДНК является генетическим материалом. За работу с бактериофагами Херши был удостоен Нобелевской премии по физиологии и медицине в 1919 г.69. Он разделил награду с биологами Сальвадором Лурией и Максом Дельбрюком, чьи эксперименты с фагом Т1 в 1943 году (флуктуационный тест) показали, что устойчивость бактерий к фагам является продуктом спонтанной мутации, а не прямой реакцией на факторы окружающей среды. Некоторые фаги, такие как лямбда, Mu и M13, используются в технологии рекомбинантной ДНК. Фаг ϕX174 был первым организмом, у которого была определена вся его нуклеотидная последовательность, и этот подвиг был совершен Фредериком Сэнгером и его коллегами в 1977.
Некоторые фаги, такие как лямбда, Mu и M13, используются в технологии рекомбинантной ДНК. Фаг ϕX174 был первым организмом, у которого была определена вся его нуклеотидная последовательность, и этот подвиг был совершен Фредериком Сэнгером и его коллегами в 1977.
В 1980-х годах американский биохимик Джордж П. Смит разработал технологию, известную как фаговый дисплей, которая позволила создавать искусственные белки. Такие белки были получены путем слияния чужеродных или сконструированных фрагментов ДНК с фаговым геном III. Ген III кодирует белок, экспрессируемый на поверхности вириона фага. Таким образом, слитые белки гена III, захваченные фагами, экспонировались на поверхности частиц вириона. Затем исследователи могли использовать антитела, разработанные для распознавания фрагмента чужеродного белка, для очистки культур слитых фагов, тем самым эффективно амплифицируя последовательность чужеродного гена для дальнейшего изучения. Британский биохимик Грегори П. Винтер впоследствии усовершенствовал технологию фагового дисплея для разработки белков человеческих антител.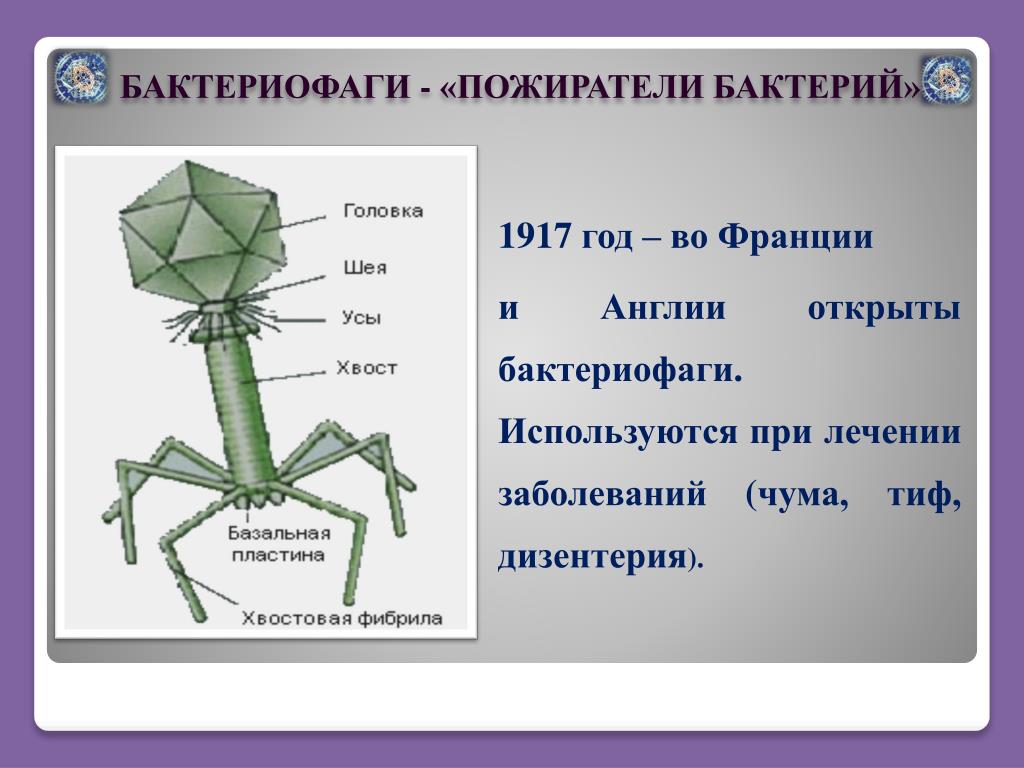 Такие белки могут быть использованы для лечения заболеваний у людей с меньшим риском вызвать потенциально опасные иммунные реакции по сравнению с предыдущими терапевтическими антителами, полученными от животных. Адалимумаб (Хумира), используемый для лечения ревматоидного артрита, был первым полностью человеческим антителом, полученным с помощью фагового дисплея, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (одобрено в 2002 г.). За свои открытия, связанные с фаговым дисплеем, Смит и Винтер были удостоены доли Нобелевской премии по химии 2018 года.
Такие белки могут быть использованы для лечения заболеваний у людей с меньшим риском вызвать потенциально опасные иммунные реакции по сравнению с предыдущими терапевтическими антителами, полученными от животных. Адалимумаб (Хумира), используемый для лечения ревматоидного артрита, был первым полностью человеческим антителом, полученным с помощью фагового дисплея, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (одобрено в 2002 г.). За свои открытия, связанные с фаговым дисплеем, Смит и Винтер были удостоены доли Нобелевской премии по химии 2018 года.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Фаготерапия
Вскоре после открытия Творт и д’Эрель начали использовать фаги для лечения бактериальных заболеваний человека, таких как бубонная чума и холера. Фаговая терапия не увенчалась успехом, и после открытия антибиотиков в 1940-х годах от нее практически отказались. Однако с появлением устойчивых к антибиотикам бактерий терапевтический потенциал фагов вновь привлек внимание.
Однако с появлением устойчивых к антибиотикам бактерий терапевтический потенциал фагов вновь привлек внимание.
Эта статья была недавно пересмотрена и обновлена Карой Роджерс.
Классификация неклассифицированных: метод классификации фагов
1. Chow C.-E.T., Suttle C.A. Биогеография вирусов в море. Анну. Преподобный Вирол. 2015;2:41–66. doi: 10.1146/annurev-virology-031413-085540. [PubMed] [CrossRef] [Google Scholar]
2. Suttle C.A. Морские вирусы — главные игроки глобальной экосистемы. Нац. Преподобный Микробиолог. 2007; 5: 801–812. doi: 10.1038/nrmicro1750. [PubMed] [CrossRef] [Академия Google]
3. Adams M.J., Lefkowitz E.J., King A.M.Q., Harrach B., Harrison R.L., Knowles N.J., Kropinski A.M., Krupovic M., Kuhn J.H., Mushegian A.R., et al. 50 лет Международному комитету по таксономии вирусов: прогресс и перспективы. Арка Вирол. 2017; 162:1441–1446. doi: 10.1007/s00705-016-3215-y. [PubMed] [CrossRef] [Google Scholar]
4. Ackermann H.W. Классификация бактериофагов. В: Календарь Р., изд. Бактериофаги. Издательство Оксфордского университета; Нью-Йорк, штат Нью-Йорк, США: 2006. с. 746. [Google Академия]
Ackermann H.W. Классификация бактериофагов. В: Календарь Р., изд. Бактериофаги. Издательство Оксфордского университета; Нью-Йорк, штат Нью-Йорк, США: 2006. с. 746. [Google Академия]
5. Simmonds P., Adams M.J., Benk M., Breitbart M., Brister J.R., Carstens E.B., Davison A.J., Delwart E., Gorbalenya A.E., Harrach B., et al. Заявление о консенсусе: таксономия вирусов в эпоху метагеномики. Нац. Преподобный Микробиолог. 2017; 15:161–168. doi: 10.1038/nrmicro.2016.177. [PubMed] [CrossRef] [Google Scholar]
6. Adriaenssens EM, Rodney Brister J. Как назвать и классифицировать ваш фаг: неофициальное руководство. Вирусы. 2017;9:70. doi: 10.3390/v9040070. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Ру С., Солоненко Н.Е., Данг В.Т., Поулос Б.Т., Швенк С.М., Голдсмит Д.Б., Коулман М.Л., Брейтбарт М., Салливан М.Б. К количественной виромике как для двухцепочечных, так и для одноцепочечных ДНК-вирусов. Пир Дж. 2016;4:e2777. doi: 10.7717/peerj.2777. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Roux S., Tournayre J., Mahul A., Debroas D., Enault F. Metavir 2: Новые инструменты для сравнения вирусного метагенома и собранного вирома анализ. БМК Биоинформ. 2014; 15 doi: 10.1186/1471-2105-15-76. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Roux S., Tournayre J., Mahul A., Debroas D., Enault F. Metavir 2: Новые инструменты для сравнения вирусного метагенома и собранного вирома анализ. БМК Биоинформ. 2014; 15 doi: 10.1186/1471-2105-15-76. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Крупович М., Дутиль Б.Е., Адриансенс Э.М., Виттманн Дж., Вогенсен Ф.К., Салливан М.Б., Румниекс Дж., Прангишвили Д., Лавин Р., Кропински А.М., и соавт. Таксономия прокариотических вирусов: обновленная информация подкомитета ICTV по бактериальным и архейным вирусам. Арка Вирол. 2016; 161:1095–1099. doi: 10.1007/s00705-015-2728-0. [PubMed] [CrossRef] [Google Scholar]
10. Лефковиц Э.Дж., Демпси Д.М., Хендриксон Р.К., Ортон Р.Дж., Сидделл С.Г., Смит Д.Б. Таксономия вирусов: база данных Международного комитета по таксономии вирусов (ICTV) Nucleic Acids Res. 2018;46:D708–D717. дои: 10.1093/нар/gkx932. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Шапиро Дж. В., Путонти С. Сети совпадения генов отражают экологию и эволюцию бактериофагов.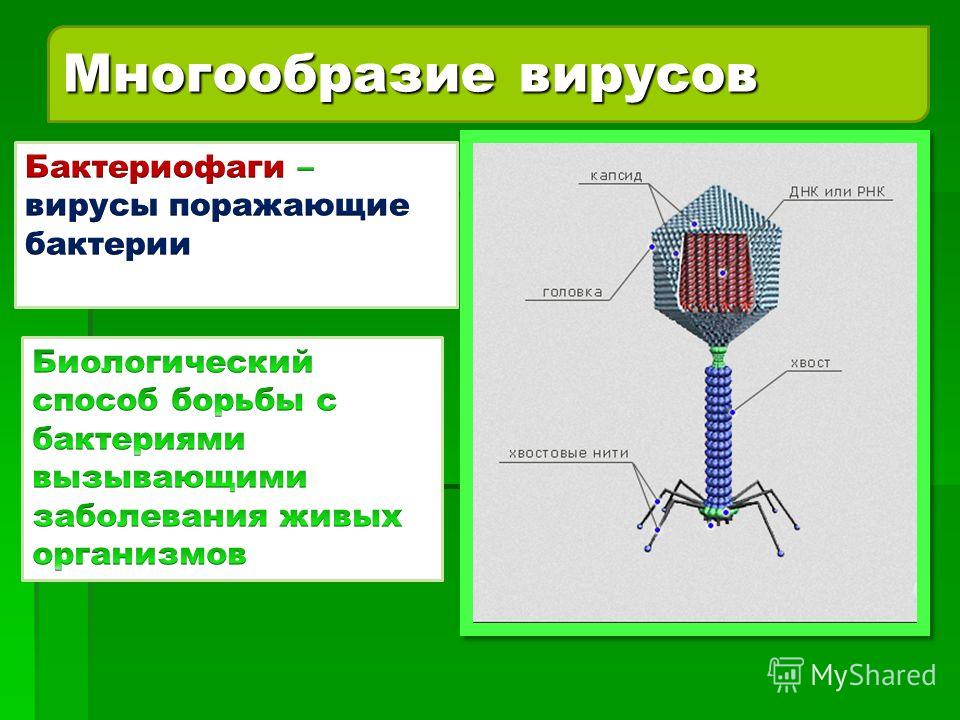 МБио. 2018; 9:1–14. doi: 10.1128/mBio.01870-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
МБио. 2018; 9:1–14. doi: 10.1128/mBio.01870-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Quast C., Pruesse E., Yilmaz P., Gerken J., Schweer T., Yarza P., Peplies J., Glöckner F.O. Проект базы данных генов рибосомной РНК SILVA: улучшенная обработка данных и веб-инструменты. Нуклеиновые Кислоты Res. 2013;41:590–596. doi: 10.1093/nar/gks1219. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Мэдслиен Э. Х., Олсен Дж. С., Гранум П. Э., Блатни Дж. М. Генотипирование B. licheniformis на основе новой схемы многолокусного типирования последовательности (MLST). БМС микробиол. 2012;12:230. дои: 10.1186/1471-2180-12-230. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Гонсалес-Эскалона Н., Джолли К.А., Рид Э., Мартинес-Уртаза Дж. Парагемолитический вибрион. Дж. Клин. микробиол. 2017; 55:1682–1697. doi: 10.1128/JCM.00227-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Рейес А., Алвес Дж. М. П., Дарем А. М., Грубер А. Использование скрытых марковских моделей профиля в обнаружении вирусов: текущие идеи. Доп. Геномика Генет. 2017;7:29–45. doi: 10.2147/AGG.S136574. [CrossRef] [Google Scholar]
М. П., Дарем А. М., Грубер А. Использование скрытых марковских моделей профиля в обнаружении вирусов: текущие идеи. Доп. Геномика Генет. 2017;7:29–45. doi: 10.2147/AGG.S136574. [CrossRef] [Google Scholar]
16. Meier-Kolthoff J.P., Göker M. VICTOR: Геномная филогения и классификация прокариотических вирусов. Биоинформатика. 2017; 33:3396–3404. doi: 10.1093/биоинформатика/btx440. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Ру С., Халлам С.Дж., Войк Т., Салливан М.Б. Вирусная темная материя и взаимодействия вирус-хозяин выделены из общедоступных микробных геномов. Элиф. 2015; 4:1–20. doi: 10.7554/eLife.08490. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Лима-Мендез Г., Ван Хелден Дж., Туссен А., Лепла Р. Сетчатое представление эволюционных и функциональных отношений между фаговыми геномами. Мол. биол. Эвол. 2008 г.: 10.1093/molbev/msn023. [PubMed] [CrossRef] [Академия Google]
19. Иранзо Дж., Крупович М., Кунин Е.В. Виросфера двухцепочечной ДНК как модульная иерархическая сеть обмена генами. МБио. 2016;7:1–21. doi: 10.1128/mBio.00978-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Виросфера двухцепочечной ДНК как модульная иерархическая сеть обмена генами. МБио. 2016;7:1–21. doi: 10.1128/mBio.00978-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Deschavanne P., DuBow M.S., Regeard C. Использование расстояния геномной сигнатуры между бактериофагами и их хозяевами отображает эволюционные отношения и определение цикла роста фага. Вирол. Дж. 2010; 7:1–12. doi: 10.1186/1743-422X-7-163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Castillo D., Kau K., Hussain F., Kalatzis P., Rørbo N., Polz M.F., Middelboe M. Широкое распространение кодируемых профагами факторов вирулентности в сообществах морских вибрионов. науч. 2018; 8:9973. doi: 10.1038/s41598-018-28326-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Насер И.Б., Хок М.М., Абдулла А., Бари С.М.Н., Гош А.Н., Фарук С.М. Экологические бактериофаги, действующие на биопленки и планктонные формы токсигенных холерных вибрионов: потенциальное значение в эпидемиологии холеры.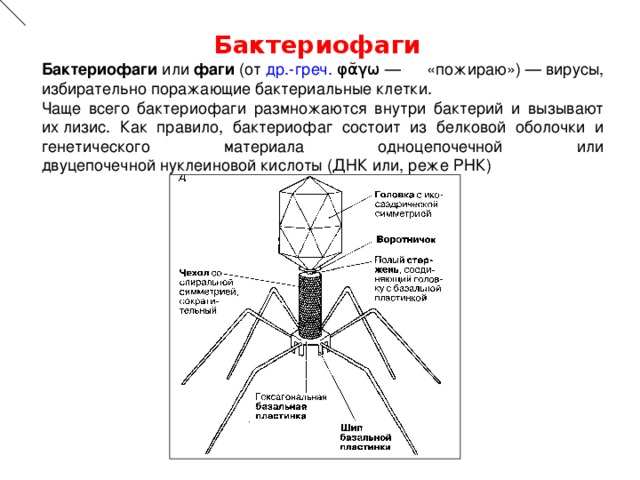 ПЛОС ОДИН. 2017;12:e0180838. doi: 10.1371/journal.pone.0180838. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2017;12:e0180838. doi: 10.1371/journal.pone.0180838. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Bolduc B., Jang H.B., Doulcier G., You Z.-Q., Roux S., Sullivan M.B. vConTACT: инструмент iVirus для классификации двухцепочечных ДНК-вирусов, инфицирующих Archaea и Bacteria . Пир Дж. 2017;5:e3243. doi: 10.7717/peerj.3243. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
24. Aiewsakun P., Adriaenssens E.M., Lavigne R., Kropinski A.M., Simmonds P. Оценка геномного разнообразия вирусов, заражающих бактерии, археи и эукариоты, с использованием общая биоинформатическая платформа: шаги к единой таксономии. Дж. Генерал Вирол. 2018;99: 1331–1343. doi: 10.1099/jgv.0.001110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Kim E.J., Yu HJ, Lee J.H., Kim J.-O., Han S.H., Yun C.-H., Chun J., Nair Г.Б., Ким Д.В. Репликация Vibrio cholerae классического фага СТХ. проц. Натл. акад. науч. США.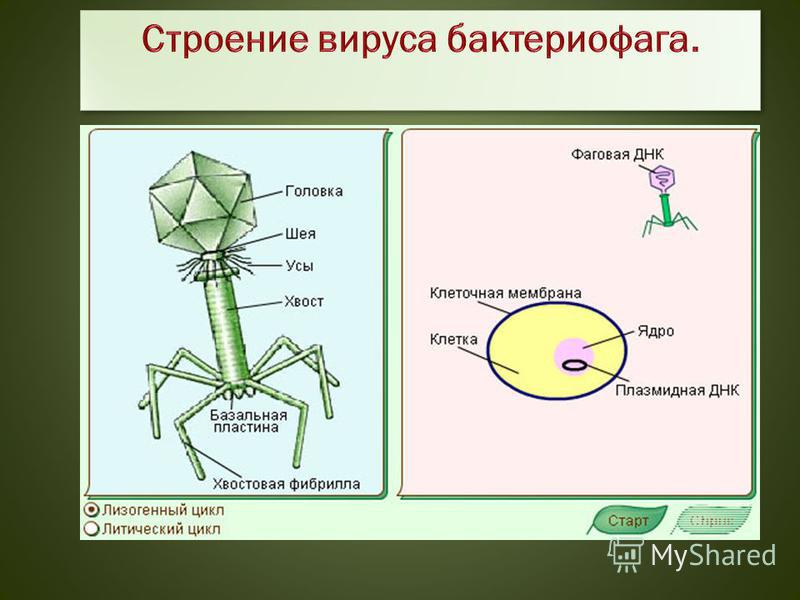 2017;114:2343–2348. doi: 10.1073/pnas.1701335114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2017;114:2343–2348. doi: 10.1073/pnas.1701335114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Фан Ф., Кан Б. Выживание и пролиферация лизогенного бактериофага CTXΦ в холерных вибрионах. Вирол. Грех. 2015;30:19–25. doi: 10.1007/s12250-014-3550-7. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
27. Смил С.В., Шмитт М.А., Перейра Р.Р., Прасад А., Фиск Дж.Д. Моделирование жизненного цикла M13 I: Сборка генетически структурированного детерминированного химического вещества кинетическое моделирование. Вирусология. 2017; 500: 259–274. doi: 10.1016/j.virol.2016.08.017. [PubMed] [CrossRef] [Google Scholar]
28. Mai-Prochnow A., Hui JGK, Kjelleberg S., Rakonjac J., McDougald D., Rice S.A. Большие вещи в маленьких упаковках: генетика нитевидных фагов и эффекты на пригодность их хозяина. ФЭМС микробиол. Ред. 2015; 39: 465–487. doi: 10.1093/femsre/fuu007. [PubMed] [CrossRef] [Google Scholar]
29. Wendling C.C., Piecyk A., Refardt D., Chibani C. , Hertel R., Liesegang H., Bunk B., Overmann J., Roth O. Трехсторонние виды взаимодействие: эукариотические хозяева больше страдают от восприимчивых к фагам, чем от устойчивых к фагам бактерий. БМС Эвол. биол. 2017;17:98. doi: 10.1186/s12862-017-0930-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Hertel R., Liesegang H., Bunk B., Overmann J., Roth O. Трехсторонние виды взаимодействие: эукариотические хозяева больше страдают от восприимчивых к фагам, чем от устойчивых к фагам бактерий. БМС Эвол. биол. 2017;17:98. doi: 10.1186/s12862-017-0930-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Нельсон Э.Дж., Харрис Дж.Б., Моррис Дж.Г., младший, Калдервуд С.Б., Камилли А. Передача холеры: динамика хозяина, патогена и бактериофага. Нац. Преподобный Микробиолог. 2009 г.;7 doi: 10.1038/nrmicro2204. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Смил С.В., Шмитт М.А., Перейра Р.Р., Прасад А., Фиск Дж.Д. Моделирование жизненного цикла М13 II: Исследование механизмов контроля инфекции М13 и создание государства-перевозчика. Вирусология. 2017; 500: 275–284. doi: 10.1016/j.virol.2016.08.015. [PubMed] [CrossRef] [Google Scholar]
32. Сенчило А., Лухтанен А.-М., Саариярви М., Бамфорд Д.Х., Ройне Э. Холодоактивные бактериофаги из льдов Балтийского моря имеют разнообразные геномы и вирусоподобные взаимодействия хоста.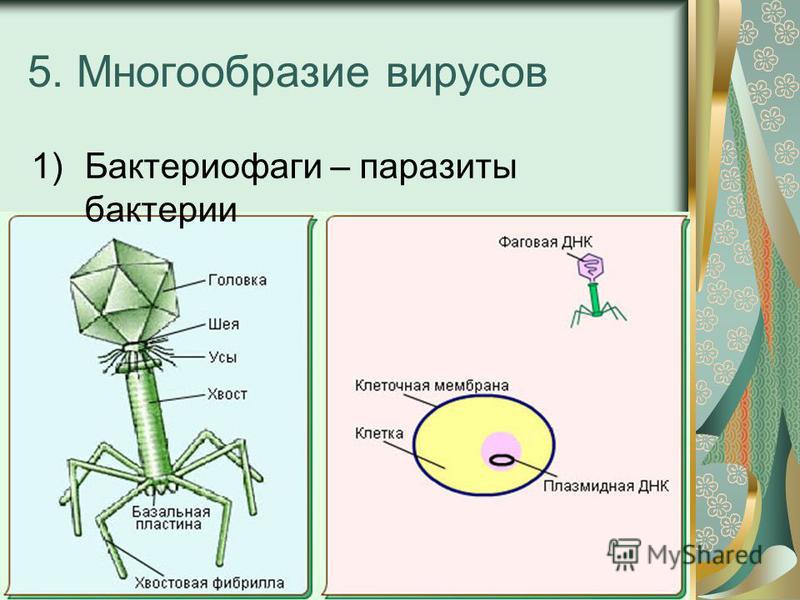 Окружающая среда. микробиол. 2014 г.: 10.1111/1462-2920.12611. [PubMed] [CrossRef] [Google Scholar]
Окружающая среда. микробиол. 2014 г.: 10.1111/1462-2920.12611. [PubMed] [CrossRef] [Google Scholar]
33. Досс Дж., Калбертсон К., Хан Д., Камачо Дж., Барекзи Н. Обзор фаговой терапии против бактериальных патогенов водных и наземных организмов. Вирусы. 2017;9:50. doi: 10.3390/v9030050. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
34. Tan D., Gram L., Middelboe M. Вибриофаги и их взаимодействие с рыбным патогеном Vibrio anguillarum. заявл. Окружающая среда. микробиол. 2014;80:3128–3140. doi: 10.1128/AEM.03544-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Алвес Дж.М.П., Де Оливейра А.Л., Сандберг Т.О.М., Морено-Галлего Дж.Л., Де Толедо М.А.Ф., Де Моура Э.М.М., Оливейра Л.С., Дарем А.М., Менерт Д.У., Де Занотто П.М.А., и др. GenSeed-HMM: инструмент для прогрессивной сборки с использованием профиля HMMS в качестве семян и его применение для обнаружения вирусов Alpavirinae на основе метагеномных данных. Передний. микробиол. 2016; 7:1–15.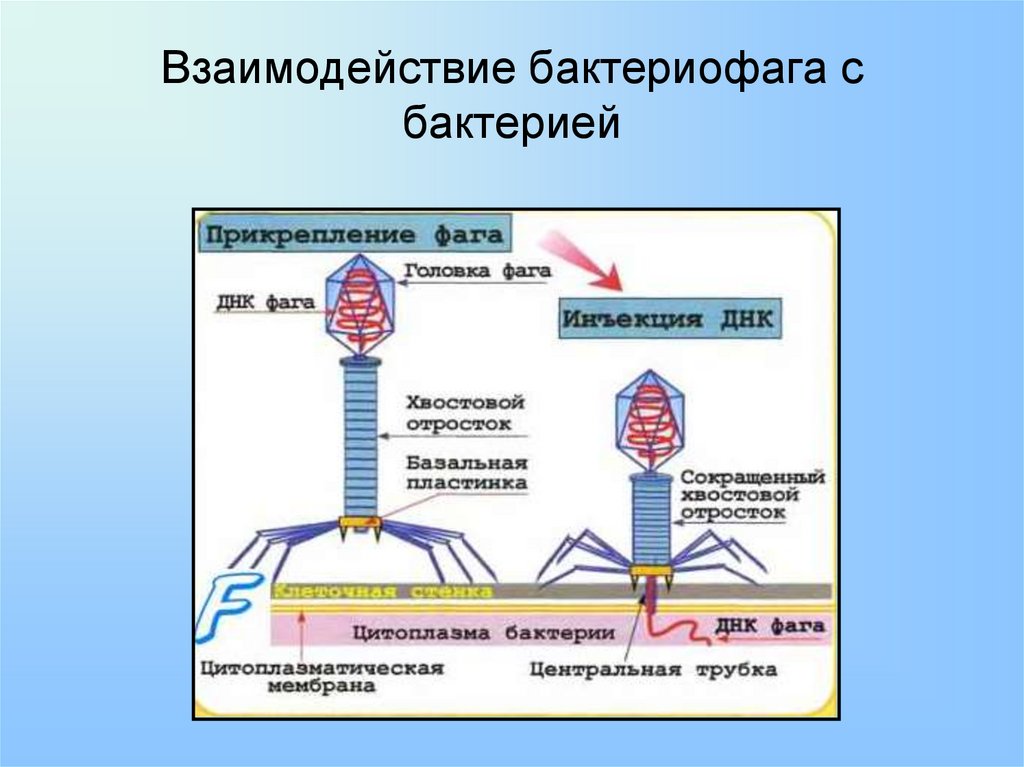 doi: 10.3389/fmicb.2016.00269. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.3389/fmicb.2016.00269. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Enright A.J., Van Dongen S., Ouzounis C.A. Эффективный алгоритм для крупномасштабного обнаружения белковых семейств. Нуклеиновые Кислоты Res. 2002; 30: 1575–1584. дои: 10.1093/нар/30.7.1575. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Ли В., Годзик А. Cd-hit: быстрая программа для кластеризации и сравнения больших наборов последовательностей белков или нуклеотидов. Биоинформатика. 2006; 22:1658–1659. doi: 10.1093/биоинформатика/btl158. [PubMed] [CrossRef] [Google Scholar]
38. Эдди С.Р. Ускоренный поиск профиля HMM. PLoS-компьютер. биол. 2011; 7 doi: 10.1371/journal.pcbi.1002195. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Лавин Р., Сето Д., Махадеван П., Акерманн Х.В., Кропински А.М. Объединение классической и молекулярной таксономической классификации: анализ Podoviridae с использованием инструментов на основе BLASTP.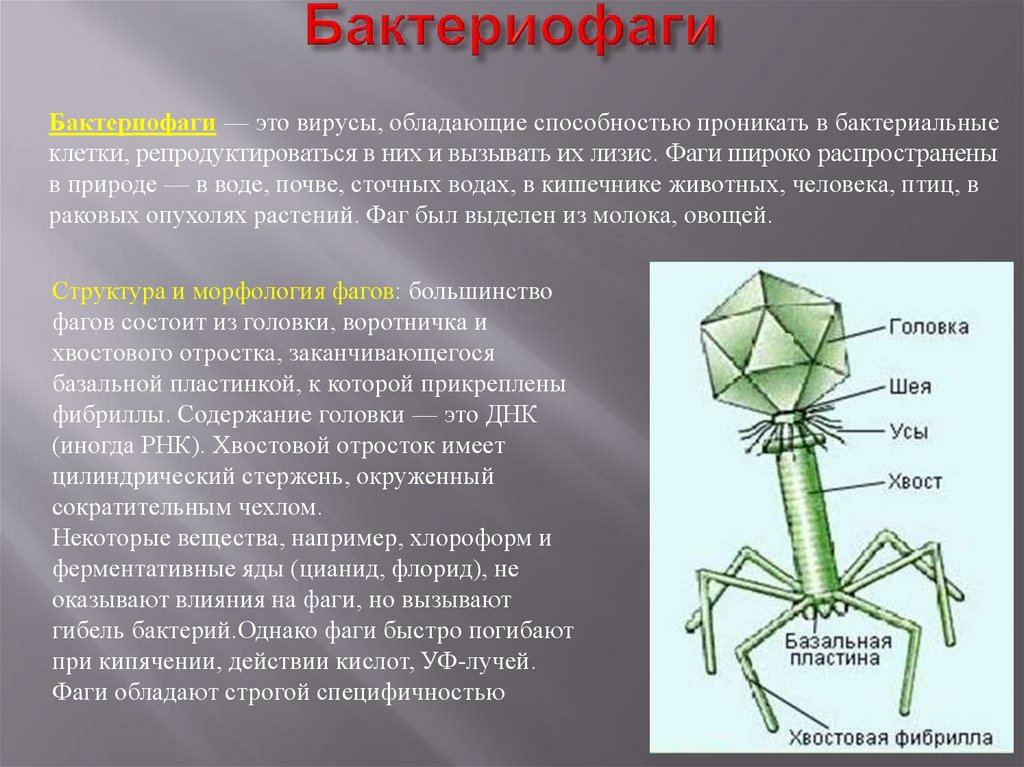 Рез. микробиол. 2008; 159: 406–414. doi: 10.1016/j.resmic.2008.03.005. [PubMed] [CrossRef] [Google Scholar]
Рез. микробиол. 2008; 159: 406–414. doi: 10.1016/j.resmic.2008.03.005. [PubMed] [CrossRef] [Google Scholar]
40. Day L.A. Inoviridae. Таксон вируса. 2012: 375–383. [Google Scholar]
41. Вислер Д., Камбийо К. Общее эволюционное происхождение функциональных модулей хвостатых бактериофагов и бактериальных механизмов. микробиол. Мол. биол. 2011; 75:423–433. doi: 10.1128/MMBR.00014-11. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Lee J.-H., Shin H., Ryu S. Характеристика и сравнительный геномный анализ бактериофагов, инфицирующих членов группы Bacillus cereus. Арка Вирол. 2014; 159: 871–884. doi: 10.1007/s00705-013-1920-3. [PubMed] [CrossRef] [Google Scholar]
. Сигнальная система белка рецептора циклического АМФ (цАМФ)-цАМФ опосредует устойчивость штаммов Vibrio cholerae O1 к множеству бактериофагов окружающей среды. заявл. Окружающая среда. микробиол. 2010;76:4233–4240. doi: 10.1128/AEM.00008-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Фарук С.М., Мекаланос Дж.Дж. Фаго-бактериальные взаимодействия в эволюции токсигенных Vibrio cholerae . Вирулентность. 2012;3:556–565. doi: 10.4161/viru.22351. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Фарук С.М., Мекаланос Дж.Дж. Фаго-бактериальные взаимодействия в эволюции токсигенных Vibrio cholerae . Вирулентность. 2012;3:556–565. doi: 10.4161/viru.22351. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Аггарвал Г., Рамасвами Р. Идентификация генов Ab initio: аннотация генома прокариот с помощью GeneScan и GLIMMER. Дж. Биоци. 2002; 27:7–14. doi: 10.1007/BF02703679. [PubMed] [CrossRef] [Google Scholar]
46. Зееманн Т. Прокка: Быстрая аннотация генома прокариот. Биоинформатика. 2014;30:2068–2069. doi: 10.1093/биоинформатика/btu153. [PubMed] [CrossRef] [Google Scholar]
47. Gao F., Zhang C.-T. Ori-Finder: веб-система для поиска oriC в неаннотированных бактериальных геномах. БМК Биоинформ. 2008; 9:79. дои: 10.1186/1471-2105-9-79. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Linke B., McHardy A.C., Neuweger H., Krause L., Meyer F. REGANOR: Сервер предсказания генов для прокариотических геномов и база данных высококачественные предсказания генов прокариот.