Сочетание туберкулеза и рака легкого (сложности диагностики) Текст научной статьи по специальности «Клиническая медицина»
УДК 616.24-006+616.24-002.5
© М.Н. Добренький, В.Д. Ничога, Б.С. Наконечнев, П.В. Яворский, Е.М. Добренькая, 2010
11 2 2 1 М.Н. Добренький , В.Д. Ничога , Б.С. Наконечнев , П.В. Яворский , Е.М. Добренькая
СОЧЕТАНИЕ ТУБЕРКУЛЕЗА И РАКА ЛЕГКОГО (СЛОЖНОСТИ ДИАГНОСТИКИ)
1ГОУ ВПО «Астраханская государственная медицинская академия Росздрава»
2ГУЗ «Областной противотуберкулезный диспансер», г. Астрахань
На основании комплексного обследования 2366 больных туберкулезом представлены ранние рентгенологические признаки центрального рака легкого, возникшего на фоне туберкулезного процесса: перемежающая гиповентиляция, эмфизема одного из сегментов или всей доли пораженного легкого, появление в нем свежих очагов или фокусов дольковых ателектазов и опухолевого пневмонита, которые рассасываются при проведении противовоспалительной терапии, но затем быстро рецидивируют.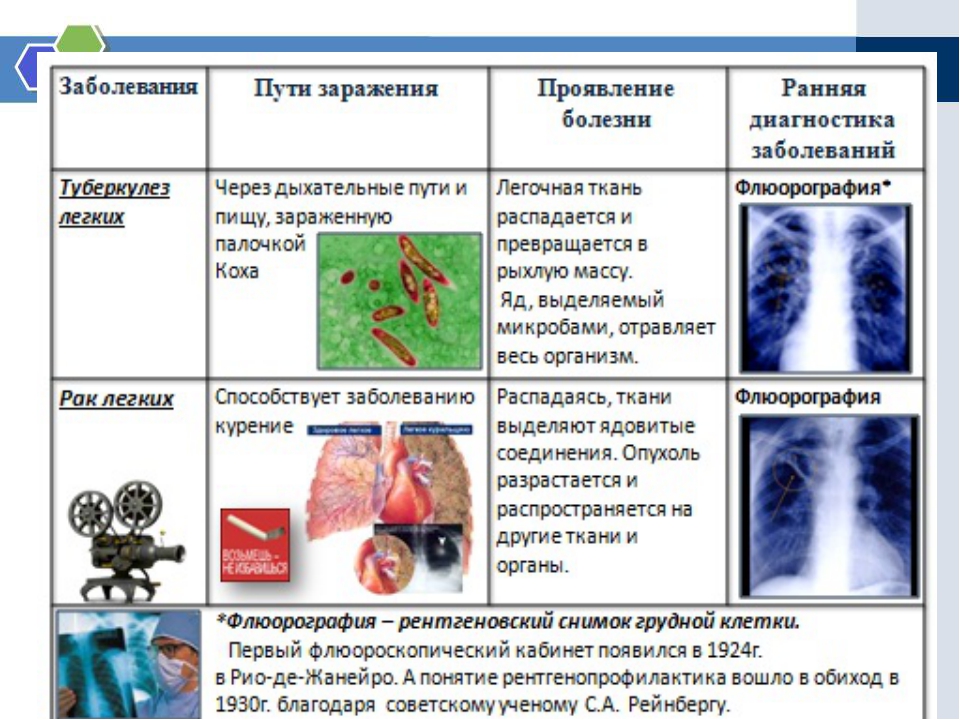
При диспансеризации за больными туберкулезом органов дыхания должна иметь место онкологическая настороженность.
Ключевые слова: туберкулез, рак легкого, диагностика.
M.N. Dobrenkyi, V.D. Nichoga, B.S. Nakonechnev, P.V. Yavorskyi, E.M. Dobrenkaya
On the base of complex investigation of 2366 patients with tuberculosis there were presented the early roentgenologic features of central lung cancer appeared on the field of tubercular process: intermittent hypoventilation, emphysema of one of the segments or the whole lobe of damaged lung, appearance the fresh foci in it or some types of lobular atelectasis and tumor pneumonitis which may be resolved in case of anti-inflammatory therapy but then they may quickly reappear.
Key words: tuberculosis, lung cancer, diagnostics.
В структуре онкологической заболеваемости населения России ведущее место занимает рак легкого, составляя 16,8%. При этом заболеваемость раком легкого имеет выраженную тенденцию к росту. Диагностика рака легкого до сих пор остается сложной клинической задачей.
Благоприятным фоном для развития рака легкого являются все хронические воспалительные процессы, осложненные циррозом и склерозом, в том числе и туберкулез. Цирротическая перестройка ткани легкого при туберкулезе нарушает метаболизм и активность ферментативных процессов. Большое значение в этом процессе имеет также формирование очагов метаплазии эпителия слизистой бронхов или участков эпителизации стенок каверн. Это клиническое проявление предраковых изменений [6, 7].
Исследованиями последних лет установлено, что биохимический состав экстрацеллюлярного матрикса рубцов периферического рака легкого, метатуберкулезных и метапневмонических участков является идентичным [4, 5].
Проблема раннего выявления и лечения рака легких, развивающегося на фоне туберкулезного процесса, далека от своего решения [2, 3, 8]. Это обусловлено как чрезвычайным разнообразием клинических вариантов течения этих двух заболеваний, так и сходством ряда клинических симптомов и данных инструментальных методов исследования.
Существовавшие ранее представления об антагонизме туберкулеза и рака не подтвердились, напротив, установлено, что рак легкого у больных туберкулезом и лиц с остаточными изменениями после излеченного туберкулеза встречается чаще, чем у лиц, не болевших туберкулезом. По данным литературы [3, 8], среди больных туберкулезом частота выявления рака легких в возрастной категории 40-49 лет в 4-4,5 раза выше, чем в популяции в целом в этой же возрастной категории, а в возрастной категории старше 50 лет — в 6,6 раза и более.
стороны, некоторые противотуберкулезные препараты ускоряют рост опухоли и ведут к генерализации онкопроцесса [3]. По мнению многих авторов, для лучшего понимания патогенетических связей рака и туберкулеза и построения оптимальных алгоритмов диагностического поиска необходимо выявление групп пациентов, имеющих сходные клинико-морфологические характеристики рака, туберкулеза и их сочетание [1, 2, 7].
Цель исследования. Повысить качество диагностики больных раком легких в сочетании с туберкулезом органов дыхания на основе выявления групп пациентов, имеющих сходные клинико-морфологические характеристики рака, туберкулеза и их сочетание.
Методы исследования. В основу настоящего исследования включены данные обследования 2366 больных, находившихся на лечении в стационаре № 2 ГУЗ ОПТД за 2006-2008 гг.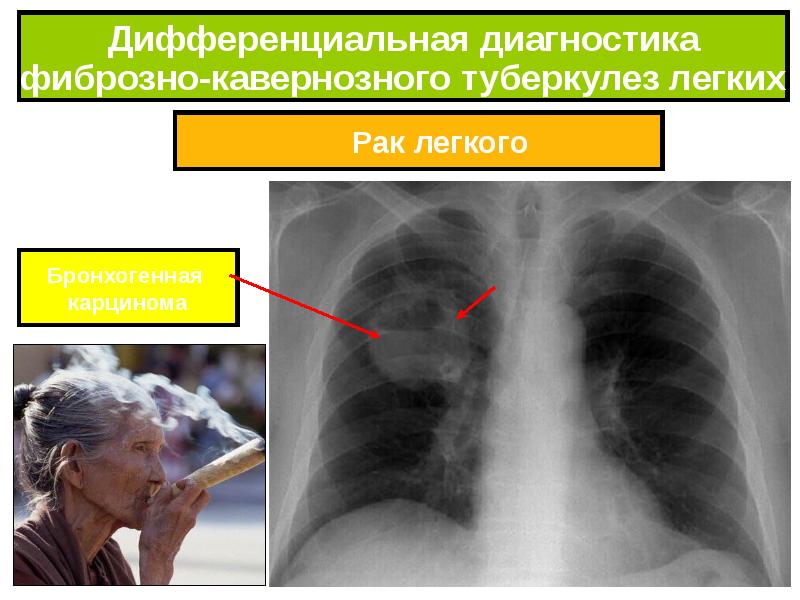
Результаты исследования. Онкологическая патология выявлена у 40 больных, что составило 1,26% от общего числа обследуемых больных. Сочетание туберкулеза и рака легкого выявлено в 16 случаях (0,67%), туберкулеза и рака гортани — в 6 случаях (0,25%), туберкулеза и рака желудка — в 4 случаях (0,16%), туберкулеза и рака шейки матки — в 4 случаях (0,16%). По два случая (0,08%) выявлено сочетание туберкулеза с раком пищевода, яичка, нижней губы, нижней челюсти, кожи.
Среди больных, у которых выявлено сочетание туберкулеза и рака легких, мужчины составили 87,5% (14 человек), женщины — 12,5% (2 женщины). По возрасту больные распределились следующим образом: 30-39 лет — 2 (12,5%), 50-59 лет — 2 (12,5%), 60 лет и старше — 12 (75%).
По возрасту больные распределились следующим образом: 30-39 лет — 2 (12,5%), 50-59 лет — 2 (12,5%), 60 лет и старше — 12 (75%).
Из 16 больных центральная форма рака легких выявлена в 10 случаях (62,5%), периферическая — в 6 случаях (37,5%). У 10 больных (62,5%) туберкулез легких был выявлен впервые, у 4 больных (25%) был рецидив туберкулеза и у 2 больных (12,5%) — хроническое течение туберкулеза. У 8 больных (50%) отмечен туберкулезный процесс с поражением одного легкого и у 8-х (50%) — с поражением обоих легких. Из форм туберкулеза с одинаковой частотой встретились диссеминированный и инфильтративный — по 8 случаев. Деструктивный процесс туберкулезного очага отмечен в 8 случаях (50%), в 12 случаях (75%) отмечено бактериовыделение.
По нашим данным, сочетание первичной бронхокарциномы и туберкулеза легких преимущественно встречается у мужчин старше 40 лет, чаще встречалась центральная бронхокарцинома, реже — периферическая, что согласуется с данными литературы.
— аденокарциномы и на последнем месте — низкодифференцированные раки. Опухоли располагались преимущественно в III, VIII, X сегментах правого легкого.
Наиболее ранними рентгенологическими признаками при присоединении к туберкулезу центрального рака легкого служат перемежающая гиповентиляция и эмфизема одного из сегментов или всей доли пораженного легкого. Отмечается появление в нем свежих очагов или фокусов в результате дольковых ателектазов и опухолевого пневмонита, которые под влиянием противовоспалительной терапии быстро рассасываются, однако в дальнейшем практически всегда рецидивируют. Такое течение туберкулезу не свойственно. Наиболее убедительными, хотя и поздними, рентгенологическими признаками центрального рака являются ателектаз сегмента или доли, а также увеличение тени корня легкого, что редко встречается при вторичном туберкулезе.
Бронхологическое исследование является очень информативным при подозрении на сочетанное поражение легких. При этом необходим не только осмотр бронхиального дерева
— обнаружение стенозов, но и одновременная биопсия и пункция бифуркационных лимфатических узлов, цитологическое исследование промывных вод. Инвазивные методы исследования (эндобронхиальное исследование, трансторакальная пункция) следует применять только в том случае, когда клинические симптомы и рентгенологическая картина позволяют заподозрить рак легкого. Необходимо отметить, что хорошо известные клинические симптомы рака легкого: уменьшение массы тела, боли в груди, кашель, кровохарканье могут быть обусловлены туберкулезом, поэтому иногда даже их появление не настораживает больного и не служит для врача поводом для проведения целенаправленной диагностики рака легкого.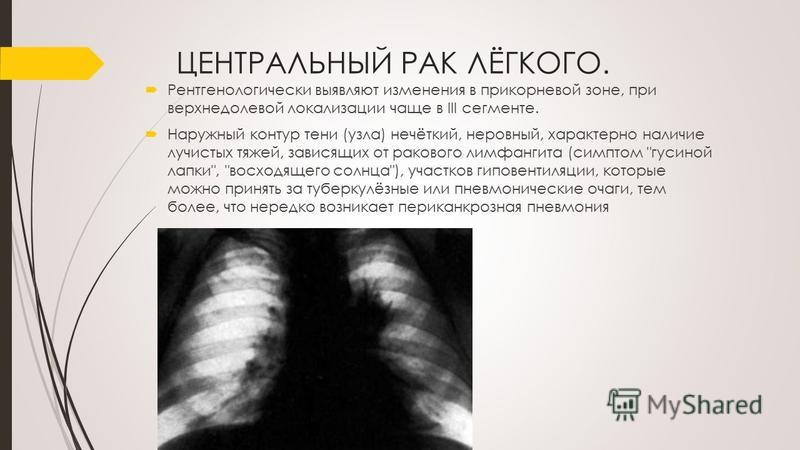 Следовательно, тщательный анализ рентгенологической картины в динамике при появлении признаков, не укладывающихся в картину туберкулеза, требует исключения онкопатологии.
Следовательно, тщательный анализ рентгенологической картины в динамике при появлении признаков, не укладывающихся в картину туберкулеза, требует исключения онкопатологии.
В том случае, если с помощью указанных методов не удается уточнить диагноз заболевания, могут быть применены хирургические методы — торакоскопия, торакотомия и открытая биопсия легкого.
Таким образом, при осуществлении диспансерного наблюдения за больными туберкулезом органов дыхания и лицами с остаточными изменениями после излеченного туберкулеза должна иметь место определенная онкологическая настороженность, особенно применительно к лицам, у которых повышен риск развития рака легкого: курящим, мужчинам старше 40 лет, лицам, у которых выявлен метатуберкулезный синдром, на фоне которого часто развиваются воспалительные заболевания легких, а также группам населения, в течение длительного времени подвергающихся воздействию профессиональных или природных канцерогенных факторов.
Развитие злокачественного онкопроцесса у больных туберкулезом перестало быть редкостью. Любое подозрение, нетипичная клиническая или рентгенологическая картина, должны стать поводом для консультации онколога.
ЛИТЕРАТУРА
1. Агапова Р. К. Дискриминантный анализ лабораторных показателей при диагностике и лечении туберкулеза и рака легкого // Вестник Российской АМН. — 1999.- № 1.- С. 47-51.
2. Галкин В.Б. Информативность диагностических признаков туберкулеза и рака легких. Диагностика и дифференциальная диагностика // Пульмонология. — 1991.- № 2. — С.65-69.
3. Жингель И. П., Цимлиринов И. Е. Диагностика рака легкого у больных туберкулезом и лиц с посттуберкулезными изменениями в легких // Проблемы туберкулеза. — 1989. — № 6.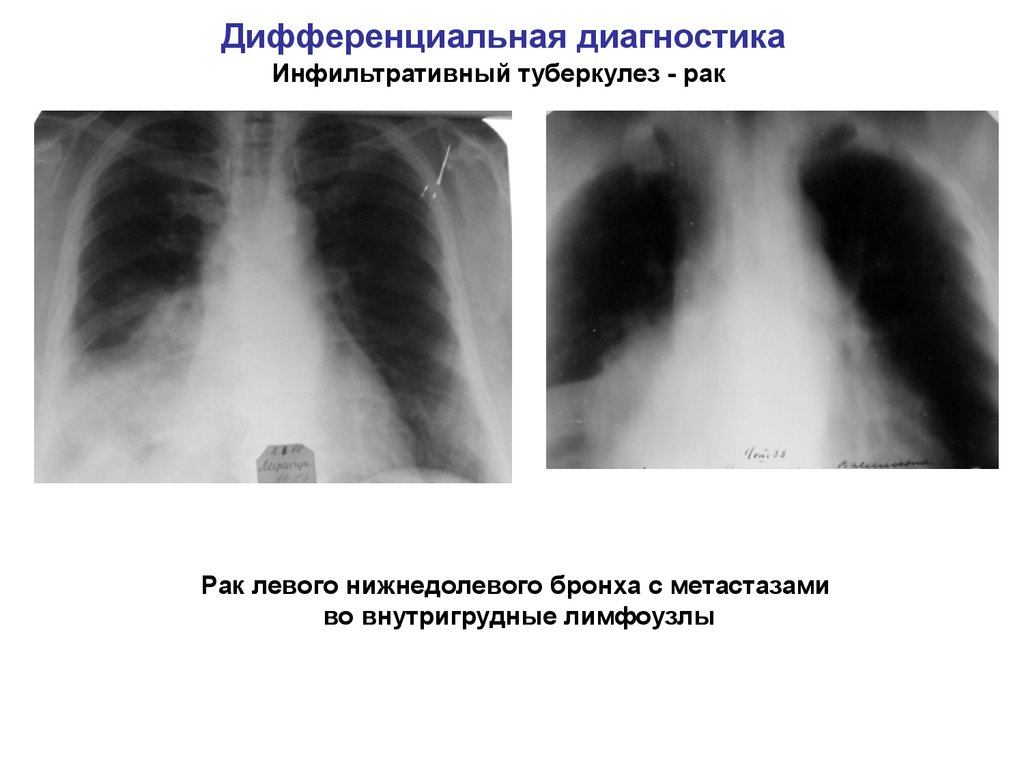 — С.26-29.
— С.26-29.
4. Коган Е.А., Ганзен Т.Н., Серов В.В.Склероз и канцерогенез // Архив патологии. — 1992. — № 8. — С. 2631.
5. Коган Е.А., Секамова С.М., Цейтлин А.И. Экстрацеллюрный матрикс периферического рака легкого в рубце и пневмосклероз различного происхождения // Архив патологии. — 1991. — № 5. С. 48-54.
6. Малышева О.К., Шнигер Н.Ч., Молодык А.А. Выявление групп онкориска у больных инфильтративным туберкулезом легких // Пульмонология. — 2000. — № 1. — С. 19-23.
7. Раданов Р.И., Тодоров С.Н. Туберкулез легких в сочетании с другими заболеваниями. — София: Медицина и физкультура, 1974. — 157с.
8. Садовников А.А., Панченко К.И. Рак легкого на почве остаточных явлений после перенесенного туберкулеза // Грудная и сердечно-сосудистая хирургия. — 2001. — № 1. — С. 51-57.
— 2001. — № 1. — С. 51-57.
Добренький Михаил Николаевич, доктор медицинских наук, профессор кафедры онкологии с курсом лучевой диагностики и лучевой терапии ГОУ ВПО «Астраханская государственная медицинская академия Росздрава», Россия, 414000, г. Астрахань, ул. Бакинская, 121, тел. (8512) 44-74-96, e-mail: [email protected]
Ничога Владимир Данилович, кандидат медицинских наук, доцент кафедры онкологии с курсом лучевой диагностики и лучевой терапии ГОУ ВПО «Астраханская государственная медицинская академия Росздрава», Россия, 414000, г. Астрахань, ул. Бакинская, 121, тел. (8512) 44-74-96, e-mail: [email protected]
Наконечнев Борис Сергеевич, заведующий рентген-кабинетом стационара № 2, ГУЗ «Областной
противотуберкулезный диспансер», Россия, 414014, г. Астрахань, ул. Бехтерева, 16, тел. (8512) 36-92-42
(8512) 36-92-42
Яворский Павел Васильевич, заведующий III терапевтическим отделением стационара № 2, ГУЗ «Областной противотуберкулезный диспансер», Россия, 414014, г. Астрахань, ул. Бехтерева, 16, тел. (8512) 36-92-42
Добренькая Екатерина Михайловна, клинический ординатор кафедры онкологии с курсом лучевой диагностики и лучевой терапии ГОУ ВПО «Астраханская государственная медицинская академия Росздрава», Россия, 414000, г. Астрахань, ул. Бакинская, 121, тел. (8512) 44-74-96, e-mail: [email protected]
PET/CT | Диагностика рака — История выжившего пациента с раком лёгких
Опубликовано в Истории пациентов.
Мужчина, 48 лет, рак лёгких
Вероятно, я был крепким орешком для пульмонологов, поскольку они долго не могли обнаружить, что со мной не так. Прежде чем я заболел, я вдыхал разные вещи. Работая в строительстве, я не всегда использовал маску для лица, и я регулярно делал перекуры. Да, я много курил. Я знаю, что это не лучшая вещь, которую можно было бы дать своим легким, но когда вы здоровы, вы не часто думаете о многих вещах … Когда осенью 3 года назад я простудился и стал кашлять кровью, я действительно испугался.
Прежде чем я заболел, я вдыхал разные вещи. Работая в строительстве, я не всегда использовал маску для лица, и я регулярно делал перекуры. Да, я много курил. Я знаю, что это не лучшая вещь, которую можно было бы дать своим легким, но когда вы здоровы, вы не часто думаете о многих вещах … Когда осенью 3 года назад я простудился и стал кашлять кровью, я действительно испугался.
Я пошел к своему семейному врачу, и она отправила меня на рентген грудной клетки. Он показал изменения, и мне назначили антибиотики. После 10-дневного курса антибиотиков у меня было повторное рентгеновское обследование, но оно все же показало изменения. Врач отправил меня на компьютерную томографию легких, которая также показала, цитируя на медицинскую карту: значительное воспаление в левом легком. Это было первым признаком возможных злокачественных изменений. В этот момент слово «изменения» начало вызывать у меня мурашки…
Я был госпитализирован для дальнейшего обследования. Врачи думали, что это может быть либо туберкулез, либо бронхит, либо .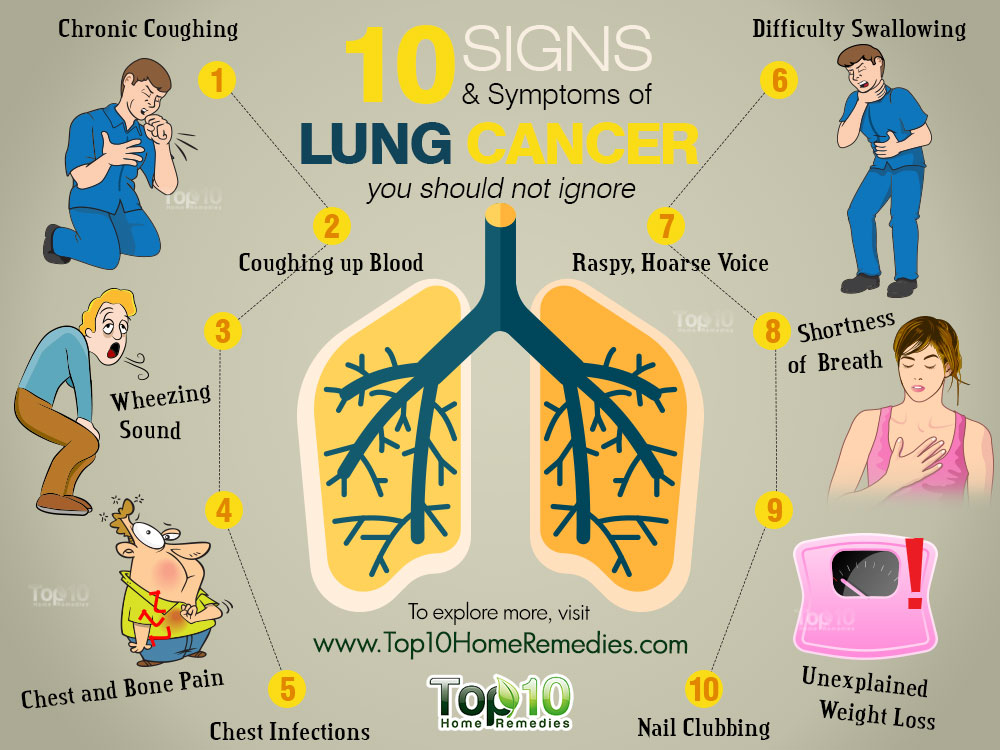 .. рак. Туберкулез вскоре был исключен. Чтобы установить причину моего состояния, я прошел несколько обследований. Я провел в больнице почти месяц и у меня было 3 бронхоскопии с биопсией как под общим, так и под местным наркозом, и у меня взятли образцы из моих легких. Ничего злокачественного не было обнаружено. Хирургический консилиум решил выписать меня из больницы, вести наблюдение за мной еще шесть месяцев и назначил повторное обследование, чтобы принять решение о необходимости операции на лёгких. Летом я прошёл повторное обследование и бронхоскопию, и ничего не было найдено. Врачи решили наблюдать за мной еще 6 месяцев.
.. рак. Туберкулез вскоре был исключен. Чтобы установить причину моего состояния, я прошел несколько обследований. Я провел в больнице почти месяц и у меня было 3 бронхоскопии с биопсией как под общим, так и под местным наркозом, и у меня взятли образцы из моих легких. Ничего злокачественного не было обнаружено. Хирургический консилиум решил выписать меня из больницы, вести наблюдение за мной еще шесть месяцев и назначил повторное обследование, чтобы принять решение о необходимости операции на лёгких. Летом я прошёл повторное обследование и бронхоскопию, и ничего не было найдено. Врачи решили наблюдать за мной еще 6 месяцев.
Прошлой осенью я простудился и был госпитализирован. Я прошел торакоскопическую операцию с помощью видео, и врачи взяли еще 2 образца клеток моих легких. В образцах они обнаружили раковые клетки. Врачи считают, что пораженное легкое следует удалить, но перед серьезной хирургической операцией они должны знать точное местоположение рака и проверить наличие каких-либо метастазов. Поэтому в конце концов я прошёл обследование ПЭТ/КТ. По сравнению со всеми предыдущими процедурами это было увлекательно – не надо было лежать в больнице, не было наркоза и какой-либо боли, быстро … Сканирование ПЭТ/КТ дало точный ответ о том, где что находится. Теперь я должен ждать, пока врачи примут свое окончательное решение. Возможно мне следовало пройти обследование ПЭТ/КТ намного раньше, когда было первое подозрение на злокачественные изменения. Но теперь ничего уже не изменить…»
Поэтому в конце концов я прошёл обследование ПЭТ/КТ. По сравнению со всеми предыдущими процедурами это было увлекательно – не надо было лежать в больнице, не было наркоза и какой-либо боли, быстро … Сканирование ПЭТ/КТ дало точный ответ о том, где что находится. Теперь я должен ждать, пока врачи примут свое окончательное решение. Возможно мне следовало пройти обследование ПЭТ/КТ намного раньше, когда было первое подозрение на злокачественные изменения. Но теперь ничего уже не изменить…»
Комментарий рентгенолога-диагноста
«Пациент был отправлен на обследование ПЭТ/КТ, чтобы определить распространение рака легкого, и принять решение о необходимости хирургического вмешательства. Пациентау провели ПЭТ/КТ обследование всего тела с использованием 18F-FDG. Во время визуализации мы обнаружили три ФДГ-патологические гиперметаболические фокальные точки – две в легких, а также крошечные метастазы в корне легкого, которые еще не были визуализированы во время других обследований.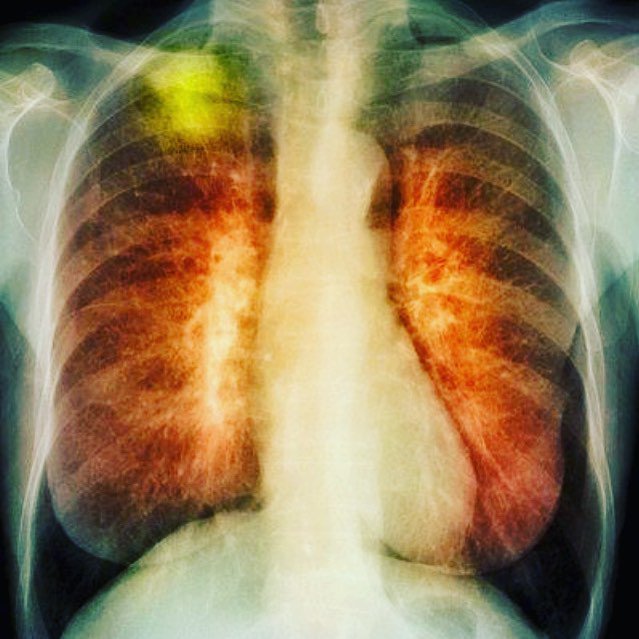 Другие образования в легких, диагностированные во время предыдущих исследований (КТ, МРТ), не накапливали ФДГ, поэтому они не являются злокачественными.»
Другие образования в легких, диагностированные во время предыдущих исследований (КТ, МРТ), не накапливали ФДГ, поэтому они не являются злокачественными.»
Мнение доктора , Диагностика рака, Рак лёгких
Виден ли рак легких на рентгене, показывает ли рак флюорография? | 74.ru
— Основные факторы риска рака легкого — они уникальны?
— Они известны и неуникальны: это то, что мы пьем и едим, чем мы дышим. Все прекрасно знают, насколько курение опасно. При этом жалуются, что бросить сигарету архисложно, что это невозможно, и так далее. Но я вижу много бывших курильщиков — у себя в отделении, где лежат люди с диагнозом «рак легкого». В тот момент, когда уже все случилось, человек находит и моральные, и физические силы, и все остальное, чтобы бросить курить. Тогда становится обидно и печально, что он не сделал этого раньше, что вот этот общепризнанный фактор риска до сих пор работает.
На каждую выкуренную сигарету в организме появляется три мутации — это доказано. А мутации — это то, с чего начинается формирование злокачественной опухоли. И при курении легкие первые, которые с этим сталкивается. А потом риск развития практически всех локализаций — ЖКТ, желудка, пищевого тракта, мочеполовой системы, — возрастает. И точно так же возрастает риск развития сердечно-сосудистых заболеваний. В определенном смысле, курение можно рассматривать как самоубийство.
Второе — еда. Все известно, все написано: больше клетчатки, употреблять в пищу рыбу, овощи-фрукты, причем своего региона, а не какую-то экзотику, которая вместо пользы может обернуться аллергией.
И еще один момент — заботиться о себе нужно каждый день, постоянно. Врачи говорят, питание должно быть рациональным, полезным. Физкультура и активный образ жизни — когда человек дышит не в полную силу, не полной грудью, не все участки легкого участвуют в дыхании, не все альвеолы — конечные структуры легкого — задействованы, поэтому не вентилируются и не снабжаются кислородом. Как только это происходит, сразу меняется механизм кровоснабжения. Почему туберкулез любит верхушки легкого — потому что они первые выключаются из процесса дыхания.
Как только это происходит, сразу меняется механизм кровоснабжения. Почему туберкулез любит верхушки легкого — потому что они первые выключаются из процесса дыхания.
Профилактика простая: пойти в парк, сделать дыхательную гимнастику, и это нужно делать каждый день! Пешие прогулки — и легкие будут работать вместе со всем телом. Подойдут и танцы, и плаванье, и ходьба — это и профилактика хронической обструктивной болезни легких (ХОБЛ). Соблюдение простых правил позволит самим россиянам сохранять бодрость тела и духа на многие годы, а здравоохранению сэкономить ресурсы, чтобы направить на лечение действительно сложных и тяжелых — врожденных, генетических болезней у детей, например. Вот тогда можно говорить о продолжительности и качестве жизни.
У нас есть собственный канал в Telegram, где мы публикуем самые интересные новости Челябинска. Если вы хотите одним из первых читать эти материалы, подписывайтесь: t.me/news_74ru.
Туберкулез и рак. Фтизиатрия. Справочник
Туберкулез и рак
Выражение: «Туберкулез готовит ложе для рака» достоверно отражает частоту развития рака у больных туберкулезом. По многочисленным данным, рак развивается в 7–13 раз чаще при туберкулезе, чем у остального населения. Рак легкого в России занимает первое место среди злокачественных новообразований. За последние 20 лет число больных раком удвоилось (по данным 1995 г.) и заболеваемость составила 87,5 на 100 тыс. населения. Чаще заболевают многокурящие мужчины в возрасте 40–50 лет и старше.
По многочисленным данным, рак развивается в 7–13 раз чаще при туберкулезе, чем у остального населения. Рак легкого в России занимает первое место среди злокачественных новообразований. За последние 20 лет число больных раком удвоилось (по данным 1995 г.) и заболеваемость составила 87,5 на 100 тыс. населения. Чаще заболевают многокурящие мужчины в возрасте 40–50 лет и старше.
Клиническими наблюдениями установлено, что рак чаще локализуется в стенке каверны, в зоне фиброзных изменений, заживших очаговых образований. Но рак может развиться и в неизмененной легочной ткани как на стороне локализации туберкулеза, так и в другом легком.
Существует ли патогенетически обусловленная взаимосвязь сочетанного поражения легких?
Еще в середине XIX в. утверждали, что туберкулез и рак легких являются антагонистами. Такой точки зрения придерживался известный австрийский патологоанатом К. Рокитанский. Впоследствии данное положение отвергли, объясняя это ранней смертью больных туберкулезом, а рак, как известно, чаще поражает старшие возрастные группы населения. Другая точка зрения сводилась к тому, что рак и туберкулез легких поражают людей без какой-либо взаимосвязи, просто велика распространенность этих заболеваний.
Другая точка зрения сводилась к тому, что рак и туберкулез легких поражают людей без какой-либо взаимосвязи, просто велика распространенность этих заболеваний.
Современная концепция частого сочетания этих двух заболеваний обосновывается структурно-морфологическими изменениями бронхолегочной системы при туберкулезе, которая заключается в метаплазии цилиндрического эпителия в плоский. Это способствует атипичному росту эпителия бронхов и увеличению концентрации канцерогенных веществ в легких, что и является основой для развития рака. Известно также, что более чем у 80% больных туберкулезом легких наблюдаются неспецифические изменения в бронхах, которые затрудняют бронхиальный эффективный дренаж, приводят к нарушению функции мукоцилиарного аппарата, играющего важную роль в защите бронхолегочной системы от вредных факторов внешней среды. Очевидно, что причинно-следственная связь существует, однако полного разрешения проблемы пока нет.
С практической точки зрения важно, что рак существенно утяжеляет течение туберкулезного процесса, увеличивается частота деструкции легких и бактериовыделения – более 62% (у впервые выявленных больных туберкулезом – 48–49%), а туберкулез легких существенного влияния на клинические проявления рака легких не оказывает. Сочетание этих двух заболеваний может протекать от малосимптомного до выраженных проявлений: упорный сухой кашель, боль в грудной клетке, одышка, температурная реакция, нарастающая слабость, снижение аппетита. Но эти симптомы присущи каждому отдельно взятому заболеванию. При туберкулезе на фоне специфической терапии они уменьшаются или проходят через 2–3 недели, но опухолевая симптоматика остается или состояние значительно ухудшается, выраженность симптомов нарастает: усиливается боль в грудной клетке, кашель становится изнуряющим, нарастает одышка, анорексия, наблюдаются потеря массы тела, адинамия, нередко появляется экссудативный плеврит.
Сочетание этих двух заболеваний может протекать от малосимптомного до выраженных проявлений: упорный сухой кашель, боль в грудной клетке, одышка, температурная реакция, нарастающая слабость, снижение аппетита. Но эти симптомы присущи каждому отдельно взятому заболеванию. При туберкулезе на фоне специфической терапии они уменьшаются или проходят через 2–3 недели, но опухолевая симптоматика остается или состояние значительно ухудшается, выраженность симптомов нарастает: усиливается боль в грудной клетке, кашель становится изнуряющим, нарастает одышка, анорексия, наблюдаются потеря массы тела, адинамия, нередко появляется экссудативный плеврит.
Диагностический алгоритм должен включать:
1) углубленный сбор анамнеза заболеваний:
• возможный контакт с бациллярными больными;
• ранее перенесенный туберкулез любой локализации;
• факторы, способствующие развитию туберкулеза;
• возможный опухолевый процесс в анамнезе;
• наследственная отягощенность;
2) микробиологические и цитологические исследования;
3) тщательное рентгенотомографическое исследование, в том числе компьютерную томографию и МРТ;
4) эндоскопическое обследование с возможной биопсией и бронхоальвеолярным лаважем.
Из всех форм рака мелкоклеточный рак легкого составляет 25–30% и характеризуется ранним метастазированием в печень, почки, кости, ЦНС. Рентгенологически определяется центральное расположение, нередко с поражением лимфатических узлов корня и средостения, часто развивается ателектаз.
Значительные трудности представляет распознавание очагового туберкулеза и рака легких. Литературные источники свидетельствуют, что у 1/3 больных раком обнаруживаются различные формы туберкулеза в силу того, что клинически и рентгенологически они трудноразличимы. Фактор локализации очагов и рака не имеет решающего значения. Туберкулез и рак в верхних долях легких встречаются одинаково часто. Изменение легочного рисунка встречается и при раке за счет гиповентиляции.
Для диагностически неясных больных рекомендуются иммуноферментный (ИФА) и иммунохроматографический (ИХА) анализы. ИФА обладает чувствительностью 79,3% и специфичностью 88,9%; ИХА – 72,4 и 96,3% соответственно. Более высокая специфичность ИХА позволяет уменьшить число лиц с ложноположительными результатами ИФА. В связи с тем что клинико-рентгенологические сведения туберкулеза и рака легких имеют большую схожесть, при отсутствии достоверных данных рекомендуется хирургическое вмешательство.
В связи с тем что клинико-рентгенологические сведения туберкулеза и рака легких имеют большую схожесть, при отсутствии достоверных данных рекомендуется хирургическое вмешательство.
Лучевая и химиотерапия, как правило, приводят к прогрессированию туберкулеза.
Пробная терапия туберкулеза с целью дифференциальной диагностики не показана, так как за этот период может развиться метастазирование опухоли.
Очень важно для раннего выявления рака и туберкулеза регулярное флюорографическое обследование – 2 раза в год (группа риска). Ежегодная флюорография позволяет выявить рак у 52% заболевших, из них у 42% – на I–II стадиях, у 25,8% – на IV стадии. Двукратная флюорография в год выявляет рак у 59,1% больных, из них на I–II стадиях – у 76,9%, на IV стадии – у 15,4%. К группе риска относятся: вредные условия труда, хронические неспецифические заболевания легких, длительный стаж курения, наследственная отягощенность, возраст старше 50 лет. Эти же факторы способствуют развитию туберкулеза легких.
При сочетании туберкулеза легких и неоперабельного рака показана комплексная противотуберкулезная и симптоматическая терапия.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесDifferential diagnosis of lung cancer and tuberculosis: review | Belova
The neglect of lung cancer and the unsatisfactory results of its treatment depend to a large extent on untimely diagnosis in the early stages of the disease. The reason for this is the absence of pathognomonic clinical signs and a specific radiographic picture of early lung cancer, which has to be differentiated from other respiratory diseases, including those occurring with infiltrative changes. According to statistical data, hyperdiagnosis of infiltrative pulmonary tuberculosis in patients with oncological diseases of the respiratory system was from 14 to 39%, which leads to long-term monitoring of patients with lung cancer in phthisiological institutions with anti-tuberculosis therapy, which causes delays in the treatment of patients with lung cancer. The pronounced visual similarity of various pathological processes of the lungs, the mixed incidence and immunodeficiency combined with subjective factors, such as gaps in the training of doctors, omissions in the survey method and the lack of continuity, can collectively be the cause of differential diagnostic errors. This article describes the similarities and differences between these diseases, the main causes of erroneous diagnosis, as well as the prospects for the development of modern diagnostic methods.
Рак легкого (РЛ) является самой частой причиной летальных исходов среди всех онкологических заболеваний. По данным Вcемирной организации здравоохранения (ВОЗ) на 2017 г., ежегодно в мире диагностируется более 1 млн новых случаев этой болезни. В России на РЛ приходится 15% всех случаев смерти от онкологических заболеваний: более 50 тыс. пациентов в год при заболеваемости в среднем в 60 тыс. Многие исследователи отмечают, что от 60 до 90% больных РЛ при первичном обращении подвергаются необоснованному лечению [1]. По данным М.В.Шеляховского [2], при первом обращении больным РЛ в 29% случаев устанавливается диагноз «туберкулез легких», роль которого в общемировой структуре заболеваемости и смертности также значительна. Туберкулез по-прежнему является распространенной причиной заболеваемости и смертности во всем мире. Одной из ключевых эпидемиологических детерминант туберкулеза является миграция, причины которой разнообразны и включают экономические, социально-политические и климатические факторы. По данным ВОЗ, в 2016 г. туберкулезом заболели 10,4 млн человек, более 2 млрд человек, инфицированных микобактерией туберкулеза (МБТ), имеют бессимптомное, латентное течение инфекции. Продолжающаяся эпидемия ВИЧ-инфекции привела к распространению туберкулеза в мире за последние 40 лет. Более 1,7 млн человек умерли от этой болезни в 2017 г. (среди них 0,4 млн пациентов с ВИЧ-инфекцией). Именно поэтому очень важными являются полнота обследования пациента, использование наиболее информативных диагностических средств. В настоящее время заболеваемость туберкулезом у пожилых людей имеет тенденцию к увеличению из-за большого числа пациентов со скомпрометированным иммунным статусом (диабет, ВИЧ и т.д.), а РЛ нередко встречается у молодых лиц [3]. Таким образом, фтизионастороженность у молодых больных и онконастороженность у пожилых больных в ряде случаев могут являться причиной гипер- и гиподиагностики. Хотя возраст пациента не является определяющим критерием дифференциальной диагностики и решение о тактике диагностики и лечения должно приниматься в каждом конкретном случае с учетом всех факторов, все же, согласно рекомендациям Флейшнеровского общества (Guidelines for Management of Incidental Pulmonary Nodules Detected on CT Images: From the Fleischner Society 2017), у лиц в возрасте до 35 лет в случае впервые выявленных изменений в легких прежде всего следует исключить их инфекционную этиологию [4]. Существует много общего между этими заболеваниями: они имеют высокую распространенность, поражают паренхиму легких, часто характерно малосимптомное, стертое течение в дебюте заболевания. Тщательно собранный анамнез и осмотр имеют большое значение на начальном этапе диагностического пути. С клинико-рентгенологических позиций целесообразно различать формы РЛ: центральный, периферический рак, разновидность периферического рака — рак Панкоста и довольно редкий бронхиолоальвеолярный рак [5]. Проекция центрального рака локализуется в области корня легкого, потому он чаще выявляется по обращению, характеризуясь выраженными клиническими проявлениями, преимущественно кашлем. Кашель — наиболее ранний признак центрального РЛ. Характер кашля меняется в зависимости от стадии болезни и степени распространения опухоли, постепенно становясь сухим и мучительным. Другими частыми, хотя и не патогномоничными, симптомами центрального рака являются одышка и кровохарканье. Однако при наличии кровохарканья рак обнаруживается у сравнительно небольшого числа больных, не более 20%: в большинстве случаев одной из самых частых причин возникновения геморрагических осложнений среди заболеваний легких остается туберкулез [6]. Дискомфорт и боли в груди без четкой локализации, по данным разных авторов, встречаются у 50-80% больных с центральной локализацией РЛ [5]. Периферический рак длительно не вызывает респираторных симптомов и выявляется случайно при рентгенографии грудной клетки, выполненной по какой-то другой причине. Клиническая симптоматика возникает лишь при распространении опухоли на соседние структуры и грудную стенку. В случаях, когда периферический рак подвергается распаду, могут развиваться признаки интоксикации. Рак Панкоста, являясь разновидностью периферического рака, локализующегося в верхушке легкого, характеризуется инфильтративным ростом, разрушением ребер, резкими болями в руке и характерной триадой Горнера. Бронхиолоальвеолярный рак, распространяющийся внутри просвета бронхиального дерева, клинически ничем не проявляется на ранних стадиях, отличается медленными темпами роста. С прогрессированием процесса появляются кашель с мокротой (характерна обильная пенистая водянистая мокрота), одышка, повышение температуры, слабость. При ограниченном распространении процесса у больных туберкулезом органов дыхания жалобы также могут отсутствовать. В ряде случаев могут преобладать жалобы общего характера, клинические симптомы неспецифичны, многообразны. Наиболее часто отмечается длительный «малый» субфебрилитет с повышением температуры до 37,2-37,5°С, что мало отражается на общем состоянии больного. Однако чаще характерны постепенное появление и развитие симптоматики. Наличие ряда симптомов воспалительного бронхолегочного заболевания, сопровождающихся явлениями интоксикации длительностью более 3 нед, должно нацелить лечащего врача на проведение дифференциальной диагностики туберкулеза органов дыхания. Кашель при туберкулезе чаще не выражен, сухой либо малопродуктивный, присутствует в виде покашливания. Кровохарканье у лиц молодого возраста бывает первым признаком болезни, появляется, как правило, при осложнениях хронического легочного процесса. Боли в грудной клетке и одышка появляются при обширных легочных процессах, экссудативных плевритах и осложнениях туберкулеза [7]. Симптомы интоксикации проявляются в виде повышенной утомляемости, общей слабости, ночной или предутренней «холодной» потливости верхних отделов грудной клетки, потери аппетита, похудения. Эти симптомы могут быть выражены по-разному и встречаться в разных сочетаниях. Несмотря на возможности современных методов диагностики заболеваний легких, все же нельзя пренебрегать данными анамнеза и физикального осмотра пациента, которые в ряде случаев могут привнести дополнительные данные в пользу того или иного заболевания, выделить группы риска. При сборе анамнеза жизни важно учитывать сведения о легочных и иммунных болезнях у родственников пациента, материально-бытовые условия, характер работы, профессиональных вредностей. В случае туберкулеза уделяется большое значение выделению групп риска. К группе повышенного риска заболевания туберкулезом относят пациентов с хроническими заболеваниями, такими как сахарный диабет, профессиональные (пылевые) заболевания легких, хронические заболевания желудочно-кишечного тракта, хроническая обструктивная болезнь легких, выраженная кахексия. Сюда же относятся пациенты, состоящие на диспансерном учете в наркологических и психиатрических учреждениях; лица, получающие кортикостероидную, цитостатическую или лучевую терапию по поводу разных заболеваний; женщины в послеродовом периоде; лица, пострадавшие от аварии на Чернобыльской АЭС; лица, находящиеся (находившиеся) в длительном тесном бытовом или профессиональном контакте с источником туберкулезной инфекции. Должны насторожить перенесенные болезни, часто имеющие туберкулезную природу: экссудативный и рецидивирующий сухой плеврит, полиаденопатия, фликтенулезный кератоконъюнктивит, узловатая эритема. Более 100 лет диагностика скрытого туберкулеза основывалась на кожных туберкулиновых пробах. В настоящее время приходится считаться со снижением дифференциально-диагностической значимости туберкулиновых проб, обусловленным происходящим в последние годы изменением реактивности организма больных туберкулезом [5]. Также у лиц, привитых вакциной БЦЖ, у сенсибилизированных нетуберкулезными микобактериями результаты теста могут быть ложноположительными, в то время как у пациентов с иммуносупрессией результаты теста могут быть ложноотрицательными [3]. В связи с развитием иммунологических методов диагностики туберкулеза (T-SPOT и квантифероновый тест) в последние 10 лет пытались решить некоторые из этих трудностей: с их появлением и внедрением в практику нивелируются противопоказания к проведению исследований (тесты проводятся in vitro), и, как следствие, отсутствуют побочные реакции и ограничения, как после проведения кожных проб; вакцинация БЦЖ также не влияет на результаты тестов. Отличие тестов состоит в том, что квантифероновый тест определяет интерферон (ИФН)-g, вырабатываемый в ответ на внедрение МБТ, а T-SPOT определяет сами Т-клетки, которые вырабатывают ИФН-g на присутствие МБТ. В настоящее время они считаются методами современной диагностики туберкулезной инфекции, так как являются высокоспецифичными, в исследованиях показали высокую достоверность результатов при латентной инфекции, а также у пациентов с иммунодефицитом. Однако и эти методы имеют свои недостатки, такие как недостаточная чувствительность, неспособность дифференцировать латентную форму заболевания от активной. Продолжаются исследования и поиск способов улучшения диагностики. И тем не менее эти тесты не должны быть использованы для исключения/подтвеждения туберкулеза легких с целью подтвердить или отвергнуть диагноз РЛ [3]. Естественно, что нахождение микобактерий в мазке мокроты имеет решающее диагностическое значение в этиологической верификации заболевания. По данным исследований, чувствительность бактериоскопии мазков мокроты чаще всего гораздо ниже чувствительности культуральных методов исследования, и только в совокупности они повышают точность диагностики до 98%. Продолжительность бактериологических методик сокращена современными технологиями с 8 до 2 нед. К сожалению, выявляемость МБТ в среднем не превышает 30-40% [8]. Для сокращения периода времени, необходимого для диагностики, были разработаны молекулярные тесты с целью как диагностики наличия комплекса МБТ, так и для обнаружения мутаций, приводящих к развитию резистентности к наиболее распространенным противотуберкулезным препаратам, а именно — изониазиду и/или рифампицину [9]. В 2008 г. ВОЗ было одобрено использование тест-системы GenoType MTBDRplus (версия 1.0) с целью быстрого обнаружения комплекса МБТ и его чувствительности к воздействию рифампицина и изониазида. Однако данный тест позволяет получить эффективные результаты только в 14-16% случаев при работе с отрицательными по мазку образцами пациентов. По этой причине данная версия теста используется только при работе с положительными по мазку образцами пациентов [9]. GenoType MTBDRplus (версия 2.0), а также система Xpert MTB/RIF, одобренная ВОЗ в 2010 г., обладают схожими диагностическими свойствами, чувствительностью более 70% и специфичностью, составляющей 100%. Тест-систему GenoType MTBDRplus (2.0) можно использовать вместе с системой Xpert MTB/RIF для оценки резистентности к рифампицину и получения информации относительно восприимчивости к изониазидам. Кроме того, использование тест-системы GenoType MTBDRplus (2.0) позволит получить фармакогенетическую информацию, которая может иметь очень важное значение в процессе лечения пациентов. Сегодня для выявления туберкулеза и РЛ альтернативы лучевому методу исследования нет. Внедрение в клиническую практику современных методов диагностики увеличивает вероятность выявления заболеваний на ранних стадиях. Традиционная рентгенография дает недостаточно диагностической информации, и потому «последнее слово» в дифференциации заболеваний легких в настоящее время принадлежит компьютерной томографии (КТ), хотя она и не внесла принципиально новых дополнений в рентген-семиотику туберкулеза легких. Лучевая диагностика туберкулеза органов дыхания на раннем этапе и протекающего в виде скрытой туберкулезной инфекции является одним из наиболее важных разделов фтизиатрии [10]. Очаговый туберкулез с характерной для него беcсимптомностью клинических проявлений традиционно рассматривается в основном как понятие рентгенологическое [6]. При центральном РЛ, когда рентгенологически определяются расширение и деформация корня с наличием опухолевого узла, как при узловой форме, или деформация корня с веерообразным его расширением при разветвленной форме, понятие ранней диагностики рака уже весьма относительно, так как больные имеют неблагоприятный прогноз в отношении лечения и отдаленных его результатов [6]. В корне легкого прямые признаки узлового образования можно выявить только в том случае, если диаметр узла достиг 2 см. Прямые признаки центрального рака (а именно — выявление опухолевого узла в корне легкого) могут быть выявлены гораздо позже по сравнению с периферическим раком, компенсируется это разве что достаточно быстрым развитием симптомов заболевания и более высокой обращаемостью по сравнению с периферическим раком. В тех случаях, когда туберкулез не подтверждается микробиологическими методами, диагностика туберкулеза основывается на сопоставлении клинико-рентгенологических проявлений заболевания, что может служить причиной как гипо-, так и гипердиагностики. На основании анализа причин ошибочной диагностики РЛ по результатам лучевых методов исследования показано, что при начальном исследовании велика вероятность переоценки фактора локализации процесса. Считается, что предпочтительной областью локализации туберкулеза является верхняя доля легкого. Туберкулез действительно в 70-80% случаев локализуется в верхушечном и заднем сегментах верхней доли, однако только благодаря одному этому факту невозможно исключить диагноз РЛ. Не стоит забывать, что 2/3 всех случаев РЛ (как центрального, так и периферического) локализуется также в верхних долях. Что касается сегментарного распределения — при раке, по данным исследований, разница в частоте поражения сегментов верхней доли не столь велика, чтобы ей придавать значение. В своих исследованиях П.В.Власов и соавт. показали ошибочность суждения о том, что РЛ поражает исключительно передний сегмент верхней доли [11]. Проанализировав группу больных центральным раком верхнедолевой локализации, они установили, что суммарная частота поражения верхушечного и заднего сегментов верхней доли оказалась даже больше, чем частота поражения переднего сегмента. Анализ выявил особенности рентгеноморфологических проявлений рака в разных сегментах верхней доли, а именно — что при локализации рака в переднем сегменте, как правило, наблюдается опухолевый узел в корне, в то время как опухоли заднего и верхушечного сегментов имеют выраженную склонность к инфильтративному, преимущественно перибронхиальному, росту и в 30% случаев узел в корне отсутствовал. Именно поэтому существует заблуждение среди клиницистов, что туберкулез поражает исключительно задний и верхушечный сегмент верхней доли, а рак — преимущественно передний сегмент. Установлено, что именно эти пациенты дольше наблюдались с ошибочным диагнозом [11]. Сходство картины центрального рака и некоторых форм туберкулеза может быть обусловлено развитием бронхостеноза и, как следствие, гиповентиляции, что приводит к сгущению сосудисто-бронхиального рисунка в участках с сохранившейся воздушностью, вдобавок ко всему опухоль распространяется в перибронхиальной и периваскулярной интерстициальной ткани, что увеличивает количество линейных теней на единицу площади рентгенограммы. Однако для метатуберкулезного пневмосклероза характерны хаотичность направления тяжистых тенеобразований, их полиморфизм и преобладание на периферии; при раке, наоборот, они нарастают к корню легкого [11]. Наиболее характерным радиологическим признаком туберкулеза легких является так называемый признак «дерево в почках», который представляет собой мелкие центрилобулярные разветвленные Y- или V-образные структуры толщиной до 1-2 мм с утолщениями на концах. Морфологическим субстратом этих центрилобулярных узелков является утолщение стенок бронхиол и заполнение их расширенного просвета слизью или гноем (что позволяет визуализировать эти невидимые в норме анатомические структуры). На рентгенограмме при РЛ также может выявляться веерообразная тяжистость от корня к периферии, обусловленная задержкой секрета в бронхах по типу ретенционных бронхоэктазов. На КТ выявляется картина так называемой муцинозной бронхографии. В области уплотненных вследствие гиповентиляции сегментов легкого выявляются более прозрачные ветвистые структуры заполненных слизью бронхов [12]. Учитывая неспецифичность радиологической картины центрального РЛ на ранних этапах развития, большое значение в диагностике этой формы заболевания приобретает бронхоскопия, которая не только дает возможность установить причину бронхостеноза, но также позволяет получить материал для морфологического подтверждения диагноза. В целях ранней диагностики центрального РЛ обязательному эндоскопическому исследованию подлежат больные, имеющие жалобы на упорный надсадный кашель в течение 3 нед, легочное кровотечение или кровохарканье; с затянувшейся или рецидивирующей пневмонией одной и той же локализации; с любыми впервые выявленными изменениями легочной ткани сегментарного или долевого характера без полного обратного развития под влиянием противовоспалительной, противопневмонической или противотуберкулезной терапии; больные с подозрением на очаговый или инфильтративный туберкулез с мономорфной очаговостью и объемным уменьшением одного-двух сегментов, не подтвержденный бактериологически; если рентгенологически выявлены деформация и изменение положения корня легкого [5]. Возможности этого метода ограничены при центральном раке верхнедолевой локализации, особенно при перибронхиальном росте опухоли, потому даже отрицательный результат эндоскопического исследования не должен заставлять клиницистов отказаться от поиска злокачественной опухоли. Фактор локализации при периферическом РЛ также не имеет решающего дифференциально-диагностического значения: опухолевый узел может располагаться в любом сегменте легкого. Как и при центральном раке, отмечается некоторое преобладание частоты в верхних долях. Периферический РЛ на разных этапах развития опухоли имеет разную макро-морфологическую и рентгенологическую картину. На начальных стадиях, когда опухоль склонна к инфильтративному росту, она может иметь вид небольшого неоднородного очага уплотнения неправильной или звездчатой формы, с нечеткими контурами. Позднее, когда размеры опухоли превышают 2,5 см диаметром, ее контуры становятся бугристыми и более четкими. Если опухоль мультицентрична, то может приобретать вид конгломерата из сливающихся очагов уплотнения. Одновременно с ростом опухоли в ней развиваются некробиотические процессы, которые стимулируют реактивную и стромогенную реакцию соединительной ткани. Вследствие этого в зоне опухоли формируется нечто подобное звездчатому рубцу. Впоследствии в результате ракового лимфангита, а также в результате сморщивания опухоли появляется характерный симптом «лучистости» в виде веерообразно расходящихся отростков по периферии опухоли, так называемая соrona maligna. Симптом имеет большое значение в диагностике и наблюдается примерно в 2/3 случаев периферического рака. Еще один из характерных, хотя и нечасто встречающихся симптомов, так называемый симптом вырезки — локальное втяжение медиального контура опухоли, обусловленное, вероятно, обрастанием опухолью прилежащего крупного сосуда. Когда опухоль прилежит к междолевой щели, можно видеть легкое втяжение утолщенной плевры (симптом паруса). На более поздних этапах развития появляется дорожка ракового лимфангита, связывающая опухоль с корнем. В корне появляются увеличенные лимфоузлы. В этих случаях говорят о фазе биполярности. Распространение опухолевого процесса на крупный бронх вызывает его обструкцию, присоединяется ателектаз — происходит так называемая централизация периферического рака [5]. В дифференциально-диагностический ряд с периферическим раком можно поставить десятки заболеваний, сопровождающихся формированием уплотнения в легком. Однако практически в подавляющем большинстве случаев приходится иметь дело с ограниченным кругом патологических процессов. Периферическую форму РЛ рентгенологически чаще всего приходится дифференцировать с туберкулемой. Туберкулема и рак на ранних стадиях развития обычно протекают без видимых клинических симптомов, а при появлении симптоматики они, как правило, не имеют особенностей, характерных только для одного из этих заболеваний. При физикальном исследовании обычно не находят дифференциально-диагностических отличий, особенно при малых размерах изменений в легком. МБТ обнаруживают лишь у части больных, нередко лишь при многократных исследованиях. При этом нередко встречается сочетание рака и туберкулеза в одном конгломерате. Выделение МБТ с мокротой у больных раком может быть связано с расплавлением старого туберкулезного очага в полости распадающейся раковой опухоли. Диагноз туберкулемы, образовавшейся у больного туберкулезом в период наблюдения и специального лечения, обычно не вызывает затруднений. Трудности в дифференциальной диагностике туберкулемы и рака возникают при единичной опухоли в легком. Клиническое обследование в этом случае не выявляет никаких особенностей, характерных для того или иного процесса. В этом случае большое диагностическое значение имеет рентгенологическое исследование. Тень раковой опухоли более интенсивна, очертания ее менее резкие, волнистые, бугристые, тяжистые. И все же основной акцент в дифференциальной диагностике в данном случае делается на выявление туберкулезного фона: у большинства больных с туберкулемами выявляются туберкулезные изменения в окружающей легочной ткани (пневмосклероз, кальцинированные включения) или в другом легком. В корне легкого у больного с туберкулемой могут быть выявлены кальцинированные лимфоузлы [13]. В случае метастатического поражения легких имеет значение количество очагов, в то время как множественные туберкулемы встречаются редко, так же как им не свойственно распространение на соседнюю долю — чаще их рост ограничен междолевой плеврой. При двух и более туберкулемах в окружающей ткани постоянно обнаруживаются туберкулезные очаги, посттуберкулезный склероз. Бронхоскопия при дифференциальной диагностике туберкулемы и периферического РЛ, представленного солитарным узлом, малоинформативна, особенно при небольших размерах образования. В этих случаях программу дообследования больного завершают чрескожная трансторакальная и эндоскопическая трансбронхиальная пункции. Рак Панкоста, являясь разновидностью периферического рака, локализуется в верхушке легкого, характеризуется инфильтративным ростом и отличается тенденцией к распространению на грудную клетку, что проявляется характерной симптоматикой. Бронхиолоальвеолярный рак, напротив, не имеет предпочтительной локализации, как и характерной рентгенологической картины, и на протяжении длительного времени может не обнаруживать динамики роста. При бронхиолоальвеолярном раке встречаются разнообразные рентгенологические проявления: это могут быть солитарный периферический узел или пневмониеподобный инфильтрат, группа очагов, симулирующих туберкулез, прикорневое уплотнение, долевое или субдолевое уплотнение, уплотнение всего легкого, мелкоузелковая диссеминация и т.д. Среди этого многообразия наиболее часто встречаются три формы: узловая, пневмониеподобная и диссеминированная. Процесс может быть односторонним и двусторонним. Учитывая многообразие рентгенологических проявлений, решающее значение в диагностике бронхиолоальвеолярного рака приобретает цитологическое исследование мокроты или пункционная и катетеризационная биопсия. Не стоит забывать о метастатических опухолях легких. Множественные легочные узелки у пациента с известной злокачественной опухолью в первую очередь наводят на мысли о метастазах, однако есть немало пациентов со множественными изменениями в легких, у которых нет указаний на какую-либо первичную злокачественную опухоль в анамнезе, и в ряде случаев ее так и не удается обнаружить. Наиболее распространенной КТ-картиной легочных метастазов является наличие нескольких легочных узелков, чаще всего располагающихся в основании легких вследствие высокого сосудистого питания. Эти узелки находятся в случайном распределении и имеют разные размеры. Множественные метастазы в легких располагаются диффузно, без какого-либо определенного анатомического распределения; когда узелков мало, они преимущественно субплевральны. Края легочного метастаза гладкие, хорошо ограничены, однако по мере роста опухоли, врастания ее в интерстициальное и альвеолярное пространство края ее становятся нерегулярными, плохо определяющимися [14]. Из-за этой неспецифичности трудно отличить метастазы от других рентгенологически схожих поражений, и ввиду этого характер контура очага в легком не может выступать в качестве дифференцирующего признака. Только соответствующий клинический анамнез и КТ в динамике могут отразить эволюцию неопределенных помутнений в легких до более организованных отграниченных узелков, отсутствие динамики их роста либо регрессирование, в то время как метастатическое поражение легких будет отмечаться прогрессированием роста очагов. Хотя эти классические особенности динамики очагов чрезвычайно полезны в сужении круга дифференциальной диагностики, однако в повседневной практике встречаются атипичные радиологические признаки легочных метастазов [14], что затрудняет их дифференциальную диагностику с другими, не злокачественными легочными образованиями и процессами. Эти признаки включают: кавитацию (образование полости распада), кальцификацию, кольцевидные тени, кровоизлияния вокруг опухолевого узла, пневмоторакс, опухолевую эмболию, эндобронхиальные метастазы, единичные опухолевые массы, расширение сосудов в опухолевой массе и «стерилизованные» метастазы. Детальное изучение особенностей атипичных форм метастатических опухолей легких, а также понимание гистопатологического фона их развития имеет важное значение в постановке правильного диагноза. Результаты и возможности рентгеновской КТ в выявлении и дифференциальной диагностике периферических новообразований легкого ряд исследователей сопоставляли с результатами магнитно-резонансной томографии (МРТ). К преимуществам МРТ по сравнению с другими методами радиологической диагностики относят неинвазивный характер исследований и безвредность вследствие отсутствия лучевой нагрузки [15]. При стадировании РЛ МРТ позволяет добиться лучшей визуализации поражений плевры, диафрагмы и грудной стенки по сравнению с КТ. В то же время МРТ менее применима в оценке состояния легочной паренхимы из-за меньшего пространственного разрешения. Поскольку МРТ является более дорогим и менее доступным методом исследования, этот способ диагностики используют в качестве резервного для оценки опухолей, которые затруднительно оценить посредством КТ (например, опухоль Панкоста) [16]. Динамическая МРТ может играть более специфическую и/или точную роль для диагностики и лечения узловых образований легкого благодаря возможности оценки ангиогенеза опухоли для дифференциации злокачественных одиночных узловых образований в легком от доброкачественных. Тем не менее с ее помощью трудно дифференцировать активную инфекцию и другие причины развития патологического очага в легком. Внедрение в клиническую практику современных методов диагностики увеличивает вероятность выявления заболеваний на ранних стадиях. Несмотря на высокий уровень современных технологий в области визуализации органов дыхания, проблема ранней и точной диагностики их заболеваний остается актуальной. Улучшение результатов лечения в значительной степени зависит от своевременной и точной диагностики. Традиционная рентгенография дает недостаточно диагностической информации. Современные цифровые рентгеновские аппараты нового поколения с высоким пространственным разрешением позволяют не только выявлять, но и в ряде случаев диагностировать патологию на ранних этапах ее развития. Высокотехнологичные методы, такие как цифровая линейная томография (томосинтез), мультиспиральная КТ, МРТ, ультразвуковая томография и радионуклидная диагностика, играют важную роль в уточняющей диагностике. Превратив зрительно воспринимаемый образ в цифровой аналог, с помощью высокоразрешающей КТ удалось существенно детализировать оценку диссеминированных состояний при разных заболеваниях легких [10]. Методики контрастных усилений позволили успешнее решать вопросы дифференциации округлых образований. Из-за большого количества активированных воспалительных клеток с высокими уровнями гликолитита активные туберкулезные поражения обычно проявляют интенсивное поглощение фтордезоксиглюкозы (ФДГ). В связи с этим изучаются возможности применения позитронно-эмиссионной томографии (ПЭТ)/КТ в диагностике воспалительных и инфекционных заболеваний легких, благодаря которой удается выявить не только легочную, но и внелегочную формы туберкулеза одновременно (что приводит к экономии времени и экономической эффективности), а также оценить ранний ответ на лечение [17]. Однако ввиду отсутствия специфичности и неспособности четко отличать гранулематозную болезнь от злокачественного процесса на основе стандартизированных значений поглощения результаты ПЭТ/КТ следует интерпретировать с осторожностью. В качестве полезного метода для распознавания острой воспалительной реакции от злокачественных новообразований рекомендуется использовать двойную временную визуализацию [18], основанную на разнице скоростей дефосфорилирования ФДГ-6-фосфата: при злокачественных опухолях активность ФДГ будет постоянно высокой после пикового поглощения, в отличие от воспалительных и инфекционных состояний. Еще одной важной областью исследования является открытие новых биологических радиофармацевтических препаратов. Например, аналоги рецепторов соматостатина, меченные цитратом галлия, используются для визуализации инфекционных заболеваний, а С-ацетат накапливается опухолями, но не накапливается в очагах воспаления, что потенциально способствует дифференцировке воспаления от новообразований у пациентов с туберкулезом [17]. Несмотря на достаточно изученную семиотику инфильтративно-пневмонических, диссеминированных процессов, округлых образований в легких, далеко не всегда можно провести дифференциальную диагностику только по данным лучевого исследования. Определяющим в диагностике и выборе тактики лечения у пациентов с туберкулезом и РЛ являются молекулярно-генетическое и бактериологическое, а также гистологическое исследование биопсийного материала, полученного в ходе проведения бронхоскопии с комплексом биопсий, применение бронхоальвеолярного лаважа (с определением эндоцитограммы, микробиологическим и молекулярно-генетическим исследованием на МБТ), браш-биопсий, эндолюминальной биопсии слизистой оболочки или патологических образований бронха; трансбронхиальной биопсии легкого; чрескожной трансторакальной пункции или видеоассистированных торакоскопических биопсий легкого и внутригрудных лимфоузлов. Заключение У пациентов с известными опухолевыми заболеваниями в анамнезе, имеющих большой риск метастазирования, и пациентов с иммунодефицитными состояниями, подверженных риску инфекционных осложнений, тактика диагностики и лечения основывается на конкретной клинической ситуации. Дифференциальная диагностика инфильтративных процессов в легких является мультидисциплинарной проблемой медицины. Основные причины дифференциально-диагностических ошибок в отношении РЛ и туберкулеза обусловлены сходством (мимикрией) их клинико- рентгенологической картины, а также патоморфозом, рентгенологической изменчивостью легочных заболеваний. Иногда встречаются случаи достаточно трудной дифференциальной диагностики рака и туберкулеза легких, особенно при их сочетании в одном конгломерате. Таким образом, с целью дифференцирования инфильтративных изменений в легких следует придерживаться определенного алгоритма диагностики. Очень важно уделить внимание анамнезу развития заболевания, выявлению групп риска, провести анализ результатов обследования больных и определить комплекс дополнительных методов обследования, в том числе высокотехнологичных. Всем пациентам следует провести КТ органов грудной клетки. Порой для установления диагноза может потребоваться применение высокотехнологичных методов обследования: бронхоскопии с комплексом биопсий, трансторакальных пункций и видеоторакоскопических вмешательств, поэтому недостаточное применение уточняющих методик диагностики, лечение без верификации диагноза могут привести к позднему обращению пациента в профильное учреждение, отсроченному лечению или вообще к его отсутствию. В диагностике важными являются полнота обследования, использование наиболее информативных диагностических средств, отсутствие неприемлемо длительного периода ожидания этих исследований больным. Поэтому при отсутствии возможности этиологической или морфологической верификации диагноза при обследовании в медицинских организациях муниципального и областного уровней в течение 1 мес необходимо направлять больных в медицинские учреждения федерального уровня для определения дальнейшей тактики обследования с применением высокотехнологичных методов.
O S Belova
N.N.Blokhin National Medical Research Center of Oncology of the Ministry of Health of the Russian Federation Email: [email protected]
115478, Russian Federation, Moscow, Kashirskoe sh., d. 23
I G Komarov
N.N.Blokhin National Medical Research Center of Oncology of the Ministry of Health of the Russian Federation; Russian Medical Academy of Continuous Professional Education of the Ministry of Health of the Russian Federation Email: [email protected]
115478, Russian Federation, Moscow, Kashirskoe sh., d. 23
- Лаушкина Ж.А., Филимонов П.Н. Гипердиагностика туберкулеза у больных со злокачественными новообразованиями легких. Туберкулез и болезни легких. 2014; 5: 56-9
- Шеляховский М.В. Дифференциальная диагностика рака и туберкулеза. Грудная хирургия. 1963; 2: 66-72.
- Vikas Pilaniya, Kamal Gera, Shekhar Kunal, Ashok Shah. Pulmonary tuberculosis masquerading as metastatic lung disease. Eur Respir Rev 2016; 25: 97-8.
- MacMahon H, Naidich D.P et al. Guidelines for Management of Incidental Pulmonary Nodules Detected on CT Images: From the Fleischner Society 2017. Radiology: 2017; 284 (1): 229-30.
- Власов В.П. Рентгенодиагностика рака легкого. Мед. визуализация. 2005; 2: 49-55.
- Мишин В.Ю., Григорьев Ю.Г., Митронин А.В. Фтизиопульмонология, Фтизиопульмонология. Учебник. М.: ГЭОТАР-Медиа, 2010; с. 129-31.
- Холманских В.О. Актуальные вопросы клиники, диагностики и дифференциальной диагностики туберкулеза. Воен. медицина. 2011; 4: 153-6.
- Чучалин А.Г. Первичные системные и легочные васкулиты. Рус. мед. журн. 2001; 9 (21): 912-9.
- Barnard M, Albert H, Coetze G et al. Rapid molecular screening for multidrug-resistant tuberculosis in a hight-volume public health laboratory in South Africa. Am J Respir Crit Care Med 2008; 177: 787-92.
- Ратобыльский Г.В., Никитин М.М., Лазарева М.М. и др. Современные лучевые методы в выявлении и диагностике туберкулеза. Рос. электронный журн. лучевой диагностики. 2014; с. 31-4.
- Власов П.В., Гуревич Л.А., Федченко Г.Г. Клинико-рентгенологическая диагностика центрального рака верхушечного и верхне-заднего сегментов верхних долей легких. Вестн. рентгенологии и радиологии. 1982; 1: 7-13.
- Glazer H.S, Anderson D.J, Sagel S.S. Bronhial impaction in lobar collapse: CT demonstration and pathologic corre lation. Am J Roentg 1989; 153: 485-8.
- Перельман М.И., Корякин В.А., Богадельникова И.В. Фтизиатрия. Учебник. 3-е изд., перераб. и доп. М.: Издательство «Медицина», 2004; с. 264-69.
- Tanay Patel, Prabhakar Rajiah. Lung Metastases Imaging. 2015. www.medscape.com
- Гамова Е.В., Нуднов Н.В. Дифференциальная МР-диагностика периферического рака и доброкачественной опухоли легкого. Мед. визуализация. 2006; 3: 39-44.
- Sanjay Manocha, Sat Sharma. Solitary Pulmonary Nodule Imaging. 2015 www.medscape.com
- Selene Capitanio, Abdul Jalil Nordin, Abdul Rahim Noraini. PET/CT in nononcological lung diseases: current applications and future perspectives. Eur Respir Rev 2016; 25: 247-58.
- Zhuang H, Pourdehnad M, Lambright E.S et al. Dual time point 18F-FDG PET imaging for differentiating malignant from inflammatory processes. J Nucl Med 2001; 42: 1412-7.
- Лепихина Д.Н. Рентгеновская компьютерная томография в дифференциальной диагностике туберкулеза легких на амбулаторном этапе. Дис.. канд. мед. наук. М., 2006. http://www. dissercat.com
Views
Abstract — 195
PDF (Russian) — 22
Cited-By
Article Metrics
PlumX
Dimensions
Refbacks
- There are currently no refbacks.
Рак, туберкулез и подаренная надежда — история борьбы Наташи Ростовой
Эта история началась внезапно, как, наверное, и все ей подобные. В июне прошлого года я нащупала у себя в правой груди горошинку. В ту минуту я не могла вообразить, что эта горошинка спасла мне жизнь, образно говоря… Сейчас объясню.
Конечно, я сразу сделала маммографию. Уплотнение, по мнению врача из поликлиники, было всего лишь доброкачественной фиброаденомой, за которой нужно просто следить, только и всего. Тут стоит сказать, что весь предшествующий год меня не покидало тяжелое ощущение приближающейся беды и потому я не поверила ни врачу, ни фиброаденоме и пошла на УЗИ. Конечно, картина прояснилась…
Потом, как в калейдоскопе, пронеслись консультации в Российском Научном Центре Рентгенорадиологии, пункция, биопсия, гистология, диагноз инвазивный рак 2 степени без метастаз в лимфоузлы и быстро назначенный день операции. Вот тебе неделя для сбора анализов — сказали врачи, — и ждем в оперблоке.
Первым пунктом в листе обследований значился рутинный рентген легких. Его я делала пару месяцев до этого, когда ложилась с ребенком в больницу, и сейчас была спокойна. Булыжники в груди заворочались, когда с моим снимком вышел мрачнее тучи врач и сообщил, что в правом легком затемнение, похожее на …туберкулез. «Может быть, это метастаз?» — спросила я с дурацкой надеждой. Старый доктор высказался в том плане, что дурочка, моли Бога, чтоб это был туберкулез, а не то, что ты сейчас назвала. КТ подтвердила диагноз, это был кавернозный туберкулез. Онкологи быстро умыли руки, таких пациентов как я, у них сроду не было, меня отправили у тубдиспансер.
А я стала гуглить. Я вошла в ничтожный процент несчастливцев, которые заимели сразу две смертельные болячки. Каждый врач, встреченный мною на этом нелегком пути, получал от меня вопрос: были такие пациенты как я, и каковы мои перспективы? От каждого я слышала только одно слово — нет. Не было. Не видели. Что делать? Ну, что — лечить. А как? Оперировать. И легкое, и грудь. А я выдержу? Две операции — вряд ли. Надо одномоментно. Кто может сделать? Вопрос ставил в тупик…
Попробуем туббольницу номер 7. Это замечательное место. В том смысле, что его не забудешь никогда. Я получила туда направление и явилась с вещами в солнечный теплый день 24 августа. Милые тетки в приемном покое измерили мне давление — оно зашкаливало, я тряслась как осиновый лист, потому что было ощущение, что попала в западню. Да почему сразу в хирургию-то, — спросили тетки, — ах, онкология… Смотрели на меня с жалостью, и я потом поняла, почему.
Хирургическое отделение туббольницы номер 7 встретило меня матерящимися мужчинами и испитыми женскими лицами. По обшарпанному коридору ползали калеки всех мастей: дама без половины лица; тетка со страшными свищами; люди без ног, без рук, желтые, черные, синие лица… В одной из палат у послеоперационной женщины случился припадок. Дородные медсестры вырубили несчастную уколом и привязали. Мы с Кириллом были в шоке. Я приклеилась к стулу и поклялась себе убежать оттуда при первой возможности. В этот момент для меня принесли ворох тряпья — постельное белье, то есть — и расположили рядом с дамой без лица. Она была с ВИЧ.
Да, в эту больницу свозят всех бомжей, алкоголиков, наркоманов, сифилитиков и прочих, которым нужна помощь хирургов. Они лежат там годами, практически как дома. У меня началась истерика. Я не помню, как мы ушли оттуда, что делали, как убедили, какие бумаги подписали… Мы обзвонили всех, кого можно и выяснили, что в России есть всего два хирурга-фтизиатра, которые имеют допуски к операциям онкобольным. И один из них работает в НИИ Фтизиопульмонологии.
Профессор, доктор медицинских наук Гиллер Дмитрий Борисович успокоил меня сразу одним своим видом. Предложил одномоментную двойную операцию. Предупредил, что она будет тяжелой, но он сделает все, чтобы спасти меня. У него был четкий план и квота на легочную операцию.
2 сентября состоялась 7-часовая операция. В том, что она была сложной и виртуозной, мне потом рассказал заведующий реанимацией. В какой-то момент, сказал он, я даже отворачивался, было страшно, но то, что сотворил Мастер, было чудом. 4 дня в реанимации, 10 дней затемненного сознания, полтора месяца бесконечной боли, но я осталась жива.
В НИИ Фтизиопульмонологии меня усиленно лечили от туберкулеза, а впереди маячила химиотерапия от рака. 9 ноября сделали первый блок. Этому предшествовал целый месяц поиска химиотерапевта, который не побоялся бы взять на себя такую ответственность. Им оказался глава отделения в РНЦРР. Два курса я прошла там, и они были тяжелыми. Поскольку Центр не имел возможности госпитализировать меня, пришлось лечь в частную клинику и пройти там еще два блока химиотерапии. После последней я была в очень плохом состоянии. Собрала все мыслимые побочные эффекты 4 степени, было понятно, что врачи не справляются и уже сами готовы отказаться от такой сложной пациентки.
И тут в моей жизни появился Фонд Православие И Мир. Благодаря ему меня перевезли в клинику при Онкоцентре на Каширке. Собрали деньги на лечение и реабилитацию. Стабилизировали мое состояние, и главное — вселили надежду, что всё будет хорошо.
Я пока в середине сложного пути. Трое моих детей месяцами не видят маму. Но я знаю, что справлюсь, потому что упертая и жизнелюбивая. Меня поддерживают миллионы незнакомых людей. Мой Кирилл живет со мной по больницам, не оставляя ни на день. Моя мама всегда рядом, помогая с детьми. А друзья?! Вот еще один источник бесконечного позитива. Меня ждет эфир на радио. А я жду того светлого дня, когда врачи всех мастей скажут мне: Ростова, иди домой, и не прикидывайся тут больной! 🙂
И да, спасибо той горошинке и тому дню вообще. Все произошло очень вовремя, болезни застали в начале подрывного пути… Берегите себя.
Вы можете помочь другим подопечным фонда. Например, Сергей Звягин борется с хондросаркомой и ему сейчас очень нужна ваша помощь!
Британский онколог назвал отличия симптомов рака легких и COVID-19 :: Общество :: РБК
Симптомы рака легких и коронавируса очень похожи. В связи с этим рак легких стало сложнее диагностировать в период пандемии. Об этом в интервью The Sun рассказал глава британской ассоциации по борьбе с раком легких Роберт Ринтул.
«COVID-19 стал причиной задержки в диагностике и лечении всех типов рака. Однако с раком легких возникает дополнительная путаница из-за схожих с COVID-19 симптомов», — заявил он.
К симптомам рака легких относятся долгий кашель (более 2–3 недель), кашель с кровью, боль при дыхании, одышка, постоянная усталость, потеря аппетита и веса. Большинство из них можно отнести и к коронавирусной инфекции. Однако, по словам Ринтула, бить тревогу стоит, если кашель не проходит уже долгое время, а также сопровождается кровотечением. Также одним из наиболее распространенных симптомов COVID-19 является проблема с обонянием, которая не наблюдается при раке легких.
Иммунолог назвал способ избавиться от последствий COVID-19Ученый отметил, что оба заболевания необходимо диагностировать на ранних этапах. Он подчеркнул, что для решения проблемы диагностики рака легких и коронавирусной инфекции необходимо вмешательство властей. Как сообщает издание Manchester Evening News, органы здравоохранения Великобритании намерены провести соответствующую просветительскую кампанию. Например, на автобусных основах развесят рекламные плакаты, которые будут напоминать гражданам о необходимости посещения врача при появлении таких симптомов.
Выявление рака легких у пациентов с активным туберкулезом легких — Parker
Введение
Согласно последнему отчету Всемирной организации здравоохранения о раке (1), 5-летняя выживаемость оставляет желать лучшего. примерно 15% (1). Смертность значительно увеличивается на более поздних этапах диагностики, о чем свидетельствует публикация программы Национального института рака по надзору, эпидемиологии и конечным результатам в 2012 году, показавшая 5-летнюю выживаемость 52.5% при локализованном раке, ограниченном первичным очагом злокачественности, по сравнению с 3,7% при метастатическом раке (2). Приблизительно 57% пациентов с раком легких имеют диагноз IV стадии и только 16% диагностируются, когда их заболевание остается локализованным, ограниченным первичным очагом рака без поражения регионарных лимфатических узлов (2). Высокая частота поздней диагностики, вероятно, связана с бессимптомным характером раннего заболевания или неспецифическими симптомами, такими как кашель, одышка и одышка (3).Рак легких лучше всего поддается лечению на ранней стадии; поэтому важно иметь высокий индекс подозрения на злокачественное новообразование при оценке подозрительных рентгенологических поражений у пациентов из группы высокого риска с неспецифическими симптомами.
Туберкулез легких может стать проблемой для клиницистов при исключении злокачественности у пациента и диагностике рака легких у пациентов с инфекцией микобактериального комплекса туберкулеза в анамнезе, с помощью кожной туберкулиновой пробы (TST) или анализа высвобождения интерферона гамма (IGRA), а рентгенографические поражения легких могут быть отсрочены, поскольку злокачественные образования могут быть ошибочно приняты за активный туберкулез легких.Согласно ежегодному отчету Центров по контролю за заболеваниями за 2015 г., в США ежегодно регистрируется более 9000 новых подтвержденных случаев активного туберкулеза, при этом гораздо больше людей со скрытой болезнью подвержены риску реактивации (4). Хотя заболеваемость в Соединенных Штатах снизилась с 2015 по 2016 год на 2,7%, при нынешних темпах снижения цель ликвидации туберкулеза в Соединенных Штатах не будет достигнута в этом столетии (5). Во всем мире туберкулезная инфекция продолжает оставаться серьезной угрозой для здоровья с оценочной заболеваемостью 10 человек.4 миллиона человек в 2016 году и около 1,674 миллиона смертей, связанных с этим заболеванием, в 2016 году, согласно глобальному докладу Всемирной организации здравоохранения о туберкулезе за 2017 год (6). Эта диагностическая дилемма будет мучить врачей еще много десятилетий.
Различие между активным туберкулезом легких и раком легких или выявление сосуществования двух болезненных процессов во время диагностической оценки пациента с поражением легких имеет особое значение, поскольку было показано, что активная легочная инфекция микобактериальным комплексом более вероятна. возникают у пациентов с раком легких (7–9), а заболеваемость и смертность от злокачественных новообразований легких возрастает, если они сопровождаются активным диагнозом туберкулеза легких (10,11).Следовательно, не только более вероятно, что у пациента с туберкулезом одновременно будет злокачественное новообразование легких, чем у пациента, не имеющего туберкулезной инфекции, но и что более срочно необходимо провести ускоренную диагностику злокачественного новообразования. .
Это особенно проблематично, поскольку клинический диагноз туберкулезной инфекции приемлем, когда у пациента есть оценка, указывающая на активный туберкулез легких, на основании рентгенографии грудной клетки и таких клинических симптомов, как кашель, одышка, кровохарканье, ночная потливость, потеря веса и усталость, которые характерны для микобактериальной инфекции и злокачественных новообразований легких (2,4), а также положительный результат тестирования с помощью TST или IGRA.Это не только может привести к неправильной диагностике активного туберкулеза легких у пациентов с раком и латентной инфекцией, предшествующей инфекцией или ложноположительной TST в анамнезе из-за вакцинации Bacillus Calmett-Guérin (BCG) в анамнезе, но также не сможет идентифицировать пациентов с как активная туберкулезная инфекция, так и скрытая легочная злокачественная опухоль. Обычной практикой является эмпирическое лечение пациентов с клиническим диагнозом туберкулеза с последовательной повторной оценкой поражения после лечения.Продолжительность лечения, необходимого для активного туберкулеза легких, минимум шесть месяцев с расширенной терапией полостного заболевания, может привести к значительной задержке взятия проб ткани и диагностики, если имеется основная злокачественная опухоль. Кроме того, частичный ответ на терапию антибиотиками на простых рентгенограммах может ограничивать дальнейшие изображения, которые в противном случае могли бы идентифицировать рост из-за скрытой злокачественной опухоли. Ниже мы приводим обзор современной литературы по выявлению рака легких у пациентов с активным или хроническим туберкулезом легких.
Мы провели обзор текущей литературы и политик, доступных в онлайн-библиотеке Университета Брауна. Были проанализированы литература и политика, касающиеся диагностики рака легких и туберкулеза легких, с особым вниманием к тем, которые изучали специфичность метода для одного из этих патологических состояний по сравнению с другим. Публикации исключались, если они не были доступны на английском языке.
Рентгенография
Исследования, изучающие рентгенографию грудной клетки в качестве метода скрининга рака легких, показали, что она не является ни чувствительной, ни специфической из-за невозможности визуализировать небольшие поражения и неспецифические признаки, неотличимые от других этиологий, в том числе инфекционной природы (12-15).Злокачественные новообразования легких обычно не видны на рентгенограмме грудной клетки на ранних стадиях заболевания диаметром менее одного сантиметра (см), и по мере прогрессирования заболевания они могут проявляться в виде неспецифических очаговых уплотнений с неровными границами и обычно с кальцификациями и обычно с твердым телом. компонент по сравнению с внешним видом матового стекла (16). Несмотря на то, что есть некоторые классические находки, позволяющие предположить наличие туберкулеза, они также могут быть весьма разнообразными, иногда обнаруживая неспецифические данные, такие как паренхиматозные уплотнения при первичном заболевании, фиброз и рубцевание с паренхиматозными и узловыми кальцификациями при неактивном заболевании и более плохо определяемые пятнистые уплотнения. при реактивированном заболевании (17), все из которых также могут соответствовать диагнозу рака легкого.
Компьютерная томография (КТ)
КТ в настоящее время рекомендована Ассоциацией торакальной хирургии в качестве метода визуализации при скрининге злокачественных новообразований легких в группах высокого риска (18) на основании исследований, показывающих, что с его помощью можно раньше выявлять потенциально злокачественные образования и снижается смертность от рака легких. на 20% по сравнению со скринингом с помощью рентгенографии (18). Однако основным недостатком КТ с низкой дозой является то, что она не очень специфична и, следовательно, имеет высокий уровень ложноположительных результатов из-за наличия доброкачественных образований, в том числе от предыдущей инфекции, таких как туберкулез, воспалительные состояния или фиброз от другие причины (18).В нескольких исследованиях изучалась ценность дифференциации злокачественных и доброкачественных заболеваний легких на основе радиоплотности компьютерной томографии, как это определено подразделениями Хаунсфилда (HU). Свенсен и др. провел многоцентровое исследование, чтобы изучить способность отличать доброкачественные легочные узелки от злокачественных, основываясь на предположении, что злокачественные новообразования имеют значительно более сосудистую структуру и, следовательно, будут демонстрировать повышенное усиление. Они обнаружили, что могут диагностировать злокачественные новообразования, используя усиление более 15 HU с 98% чувствительностью и 54% специфичностью, что указывает на то, что это позволит лучше определить узел как доброкачественный, а скорее точно диагностировать поражение как злокачественное.Что касается инфекции микобактериального туберкулезного комплекса, они обнаружили, что неактивные туберкулемы легко распознаются по более низким уровням усиления, но активные поражения с активным воспалением не могут быть дифференцированы на этом основании (19). Этот вывод согласуется с другими ранее проведенными исследованиями (20,21). Се опирался на это исследование и изучил эффективность различения доброкачественных воспалительных процессов и злокачественных заболеваний на основе рентгеноплотности на усиленной, а не на простой компьютерной томографии, и обнаружил, что усиление рака легких в целом умеренное (HU 46.5–79,5) и неоднородным, тогда как усиление туберкулеза легких было от слабого до умеренного (38,2–67,5 HU), а также неоднородным (22). Это указывает на то, что в то время как поражения, которые демонстрируют умеренно высокую радиоплотность на усиленной КТ, более вероятно, будут злокачественными, между туберкулезом легких и злокачественными поражениями существует совпадение. Таким образом, одной только усиленной компьютерной томографии недостаточно для различения этих двух заболеваний.
Позитронно-эмиссионная томография (ПЭТ)
Во многих исследованиях использовались ПЭТ-сканирование и ПЭТ / КТ-сканирование, чтобы различать доброкачественные воспалительные заболевания и немелкие поражения рака легких.Lindell et al. обнаружил, что ПЭТ уступает КТ в обнаружении злокачественных образований менее одного сантиметра в диаметре (23). Кроме того, Zheng et al. обнаружил сходное поглощение 18F-фтор-2-дезокси-D-глюкозы (18F-FDG) при туберкулезе, особенно активном туберкулезе, и злокачественных новообразованиях, что затрудняет дифференциацию между туберкулезом легких и злокачественными новообразованиями при использовании ПЭТ с 18F-FDG (24) . Метаанализ 2001 года показал, что ПЭТ с 18F-FDG очень эффективен для выявления злокачественных новообразований с чувствительностью 96.8%, но имеет специфичность 77,8%, но анализ не прокомментировал долю включенных исследований, которые проводились в эндемичных по туберкулезу районах, или точность при конкретной попытке дифференцировать злокачественную и активную этиологию туберкулеза (25). Недавнее исследование Niyonkuru et al. исследовал использование 18F-FDG ПЭТ / КТ для оценки узелков в легких в популяциях с высокой распространенностью туберкулеза и обнаружил высокий уровень ложноположительных результатов, приводящих к ненужному инвазивному сбору тканей и резекциям в этих популяциях (26). .Таким образом, хотя ПЭТ / КТ с 18F-ФДГ является чувствительным инструментом для постановки диагноза рака легких с поражениями размером более одного см, он не обладает достаточной специфичностью для выявления рака легких у пациента с туберкулезом легких.
Биологические маркеры
Помимо радиографической оценки, значительный интерес вызывает возможность использования биомаркеров для различения доброкачественных и злокачественных заболеваний, и на сегодняшний день исследованы многочисленные маркеры.
Исследование, посвященное использованию карциноэмбрионального антигена (CEA) и фрагментов цитокератина 19 (CYFRA 21-1) в качестве диагностических инструментов для дифференциации доброкачественных и злокачественных заболеваний легких, обнаружило использование повышенных уровней каждого из этих опухолевых маркеров для диагностики злокачественных новообразований. быть нечувствительными (CEA 69%, CYFRA 21–1 43%) с лишь предельной специфичностью (CEA 68%, CYFRA 21–1 89%), когда каждый из них используется индивидуально. Кроме того, когда маркеры использовались вместе — с повышением обоих маркеров, используемых для постановки диагноза злокачественного новообразования, специфичность улучшилась до 95% с соответствующим падением чувствительности до 33% (27).Следовательно, одновременное повышение как CEA, так и CYFRA 21-1 явно указывает на злокачественную этиологию, но может привести к множеству ложноотрицательных результатов.
Гош и др. . изучили CEA, углеводный антиген 15-3 (CA15-3), углеводный антиген 19-9 (CA19-9) и углеводный антиген 125 (CA125) в образцах сыворотки и бронхоальвеолярного лаважа (БАЛ) при диагностике рака легких и имели более обнадеживающие результаты, особенно на образцах БАЛ, с чувствительностью и специфичностью соответственно 91.3% и 90% для CEA, 89,13% и 45% для CA 15-3, 91,3% и 77,5% для CA19-9 и 89,13% и 75% для CA 125 (28). В этом исследовании специально не изучали уровни этих маркеров при активном туберкулезе легких, и Kim et al . обнаружили, что СА 125 значительно повышен в сыворотке крови пациентов с туберкулезными и нетуберкулезными микобактериальными инфекциями (29), что потенциально ограничивает полезность этого маркера при идентификации рака легких у пациента с туберкулезом.Было показано, что антиген плоскоклеточной карциномы (SCC Ag) повышен у пациентов с плоскоклеточной карциномой легкого (30), но уровни не исследовались специально у пациентов с активной инфекцией туберкулеза легких.
В ходе недавнего метаанализа изучался уровень сывороточного белка 4 придатка яичка человека (HE4), также известного как белок сывороточной кислоты четвертого типа, дисульфидного ядра 2 (WFDC2), в качестве потенциального маркера злокачественного новообразования легких, и было обнаружено, что уровни HE4 имеют высокую специфичность при диагностике легких. рак и уровни, как правило, повышаются с тяжестью заболевания, но чувствительность к выявлению злокачественных новообразований легких оставляет желать лучшего (31).Более раннее исследование Liu et al. специально исследовал уровни HE4 в сыворотке как метод различия между туберкулезом легких и злокачественными новообразованиями и обнаружил, что уровни значительно выше у пациентов с немелкоклеточным раком легкого (НМРЛ), но не у пациентов с туберкулезом или у здоровых людей (32). Это говорит о том, что у пациента с туберкулезом положительный результат анализа сыворотки на HE4 может указывать на одновременное присутствие злокачественных новообразований, но отрицательный результат не может его исключить.
Абд-Эль-Фаттах et al. исследовал экспрессию различных форм микро-рибонуклеиновой кислоты (miR) на основе уровней экспрессии, обнаруженных в сыворотке пациентов со злокачественными новообразованиями легких и доброкачественными заболеваниями, включая туберкулез, и обнаружил, что miR-182 была значительно повышена при НМРЛ, но не в пациенты с туберкулезом легких (33). В более недавнем исследовании также оценивали сывороточные уровни miR-182 у пациентов с НМРЛ и обнаружили, что они повышены, что позволяет им дифференцировать сыворотку пациентов с НМРЛ от людей без заболевания с чувствительностью 63.4% и специфичность 80%. Это исследование также показало, что пациенты с НМРЛ имели повышенные уровни miR-183, miR-210 и CEA, а также сниженные уровни miR-126 у пациентов с НМРЛ по сравнению с контрольной группой. Используя эту панель повышенных miR-182, miR-183, miR-210 и CEA с пониженным miR-126, чувствительность и специфичность были улучшены до 88,5% и 92,5% соответственно. В этом исследовании специально не оценивалось использование этой панели у пациентов с туберкулезом; поэтому необходимы дальнейшие исследования, чтобы определить, сохраняется ли эта специфичность в популяции с высокой распространенностью туберкулеза (34).
Наконец, исследования недавно были сосредоточены на идентификации и количественной оценке внеклеточной ДНК (вкДНК) в сыворотке с целью выявления НМРЛ на ранних стадиях. Этот метод разделяет и амплифицирует вкДНК с помощью полимеразной цепной реакции (ПЦР), разделяя короткие и длинные фрагменты. Фрагменты с короткой и длинной цепью, а также общая концентрация вкДНК затем количественно оцениваются и используются в качестве маркера злокачественности с более высокой общей концентрацией и более длинными фрагментами, обнаруженными в сыворотке тех, у кого злокачественная опухоль (35).Ленг et al. недавно провел специальную оценку, чтобы отличить НМРЛ от туберкулеза. Это исследование показало, что оценка вкДНК более чувствительна и специфична для дифференциации НМРЛ от туберкулеза, чем CA125, NSE и CEA (35). Этот метод основан на способности амплифицировать вкДНК посредством ПЦР для получения уровней, поддающихся обнаружению, а также на многих других молекулярных методах оценки, таких как цифровая ПЦР, секвенирование следующего поколения и гранулы, эмульсия, амплификация и магнетизм при качественный анализ вкДНК на предмет специфических мутаций (36).Эти подходы в настоящее время являются дорогостоящими и имеют низкую пропускную способность; тем не менее, эти методы становятся более эффективными и недорогими, так что вскоре может появиться возможность, что это станет тестом в кармане многих передовых клиницистов.
Выводы
У пациента с признаками и симптомами активной микобактериальной туберкулезной инфекции легких крайне важно исключить диагноз рака легких с достаточной степенью уверенности до начала длительной схемы лечения туберкулеза.Взаимная симптоматика, повышенная частота рака легких у пациентов с активной инфекцией и воспалением, ассоциированным с туберкулезом легких (37), а также повышенная частота активного туберкулеза у пациентов с основным злокачественным новообразованием, приводящим к иммунодефицитному состоянию, приводят к диагностической проблеме (10). Мы рекомендуем пациентам с высоким риском рака легких (возраст> 55 лет и количество курящих> 30 лет) пройти компьютерную томографию грудной клетки на предмет наличия злокачественных новообразований до начала лечения туберкулеза, даже при наличии клинических или клинических проявлений. микробиологическая диагностика туберкулеза.У пациентов с неоднозначными результатами КТ эти тесты — исследование онкомаркеров miR128, miR210, miR126 вместе с CEA — доступны для клиницистов. HE4 также может оказаться хорошим тестом для постановки диагноза злокачественного новообразования, если индекс подозрения на злокачественное новообразование высок. CfDNA вряд ли будет доступной или достаточно своевременной для среднестатистического провайдера, чтобы использовать ее в качестве диагностического инструмента, но выглядит многообещающим по мере развития технологий, чтобы сделать тест более практичным. Тем, у кого нет доступа к тесту на онкомаркеры, у пациентов с сомнительными результатами КТ мы рекомендуем раннее повторное КТ через шесть месяцев, чтобы оценить реакцию на лечение туберкулеза.При отсутствии ответа мы рекомендуем тканевую диагностику.
Благодарности
Нет.
Конфликт интересов: Авторы не заявляют о конфликте интересов.
Список литературы
- Стюарт Б.В., Дикий CP. Мировой доклад о раке, 2014 г. Лион: ВОЗ, 2014 г.
- Национальные институты здоровья.Информационные бюллетени SEER stat: рак легких и бронхов. Роквилл, Мэриленд: Национальные институты здравоохранения, 2016 г.
- Лехнер А.Дж., Матущак Г.М., Бринк Д.С. Респираторные органы: комплексный подход к болезни. Китай: McGraw-Hill Companies, Inc., 2012. Access Medicine Web. 6 февраля 2016 года.
- Скотт С., Киркинг Х.Л., Джеффрис С. и др. Тенденции туберкулеза — США, 2014 г. MMWR. MMWR Morb Mortal Wkly Rep 2015; 64: 265-9. [PubMed]
- Шмит К.М., Вансаула З., Пратт Р. и др.Туберкулез-США, 2016. MMWR. MMWR Morb Mortal Wkly Rep 2017; 66: 289-94. [Crossref] [PubMed]
- Всемирная организация здравоохранения. Глобальный доклад о туберкулезе, 2017 г. Женева, Швейцария: Всемирная организация здравоохранения, 2017 г.
- Ча С.И., Шин К., Ли Дж.В. и др. Клиническое течение туберкулеза органов дыхания у больных раком легкого. Int J Tuberc Lung Dis 2009; 13: 1002-7. [PubMed]
- Hong S, Mok Y, Jeon C и др.Туберкулез, курение и риск заболеваемости и смертности от рака легких. Int J Cancer 2016; 139: 2447-55. [Crossref] [PubMed]
- Сильва Д. Р., Валентини Д. Ф. Джуниор и др. Туберкулез легких и рак легких: одновременное и последовательное возникновение. J Bras Pneumol 2013; 39: 484-9. [Crossref] [PubMed]
- Liang HY, Li XL, Yu XS и др. Факты и вымыслы о связи между существовавшим ранее туберкулезом и риском рака легких: систематический обзор.Int J Cancer 2009; 125: 2936-44. [Crossref] [PubMed]
- Heuvers ME, Aerts JG, Hegmans JP и др. История туберкулеза как независимый прогностический фактор выживаемости при раке легкого. Рак легких 2012; 76: 452-6. [Crossref] [PubMed]
- Gurney JW. Определение вероятности злокачественного образования одиночных легочных узелков с помощью байесовского анализа. Часть I. Теория. Радиология 1993; 186: 405-13. [Crossref] [PubMed]
- Gurney JW, Lyddon DM, McKay JA.Определение вероятности злокачественного образования одиночных легочных узелков с помощью байесовского анализа. Часть II. Заявление. Радиология 1993; 186: 415-22. [Crossref] [PubMed]
- Soda H, Kohno S, Oka M и др. Ограничение ежегодного скринингового рентгенологического исследования грудной клетки для диагностики рака легких. Ретроспективное исследование. Рак 1993; 72: 2341-6. [Crossref] [PubMed]
- Меламед М.Р., Флехингер Б.Дж., Заман МБ и др. Скрининг на ранний рак легких: результаты исследования Memorial Sloan-Kettering в Нью-Йорке.Chest 1984; 86: 44-53. [Crossref] [PubMed]
- Purandare NC, Rangarajan V. Визуализация рака легких: влияние на стадию и лечение. Индийский журнал J Radiol Imaging 2015; 25: 109. [Crossref] [PubMed]
- Скура Э., Зумла А., Боманджи Дж. Визуализация при туберкулезе. Int J Infect Dis 2015; 32: 87-93. [Crossref] [PubMed]
- Хеншке К.И., Янкелевиц Д.Ф., Миеттинен О.С. Компьютерный томографический скрининг на рак легких. Arch Intern Med 2006; 166: 321-5.[Crossref] [PubMed]
- Swensen SJ, Viggiano RW, Midthun DE, et al. Увеличение узелков в легких на КТ: многоцентровое исследование. Радиология 2000; 214: 73-80. [Crossref] [PubMed]
- Ямасита К., Мацунобе С., Цуда Т. и др. Одиночный легочный узел: предварительное исследование оценки с помощью инкрементной динамической КТ. Радиология 1995; 194: 399-405. [Crossref] [PubMed]
- Чжан М., Коно М. Одиночные легочные узелки: оценка структуры кровотока с помощью динамической КТ.Радиология 1997; 205: 471-8. [Crossref] [PubMed]
- Xie M. Значение радиоплотности, определяемое с помощью расширенной компьютерной томографии для дифференциальной диагностики новообразований в легких. Иран Дж Радиол 2011; 8: 145. [Crossref] [PubMed]
- Линделл Р.М., Хартман Т.Э., Свенсен С.Дж. и др. Опыт скрининга рака легкого: ретроспективный обзор ПЭТ при 22 немелкоклеточных карциномах легких, обнаруженных при скрининговом КТ грудной клетки в популяции высокого риска. AJR Am J Roentgenol 2005; 185: 126-31.[Crossref] [PubMed]
- Zheng Z, Pan Y, Guo F и др. Мультимодальная ФДГ ПЭТ / КТ внешний вид туберкуломы легкого, имитирующий рак легкого, и патологическая корреляция в стране, эндемичной по туберкулезу. South Med J 2011; 104: 440-5. [Crossref] [PubMed]
- Gould MK, Maclean CC, Kuschner WG и др. Точность позитронно-эмиссионной томографии для диагностики легочных узелков и массовых поражений: метаанализ. JAMA 2001; 285: 914-24. [Crossref] [PubMed]
- Niyonkuru A, Bakari KH, Lan X.18F-Фтор-2-дезокси-d-глюкоза ПЭТ / Компьютерная томография для оценки рака легкого в популяциях с высокой распространенностью туберкулеза и других гранулематозных заболеваний. ПЭТ Клин 2018; 13: 19-31. [Crossref] [PubMed]
- Окамура К., Такаяма К., Идзуми М. и др. Диагностическая ценность онкомаркеров CEA и CYFRA 21-1 при первичном раке легкого. Рак легких 2013; 80: 45-9. [Crossref] [PubMed]
- Ghosh I, Bhattacharjee D, Das AK, et al. Диагностическая роль онкомаркеров CEA, CA15-3, CA19-9 и CA125 при раке легкого.Индийский журнал J Clin Biochem 2013; 28: 24-9. [Crossref] [PubMed]
- Kim SY, Hong Y, Choi CM, et al. Повышенный уровень СА-125 в сыворотке крови у пациентов с нетуберкулезными микобактериальными заболеваниями легких. Респирология 2010; 15: 357-60. [Crossref] [PubMed]
- Ким Ю.С., Пак К.О., Чой И.С. и др. Сравнение сыворотки CYFRA 21-1 и SCC Ag в диагностике плоскоклеточного рака легкого. Корейский журнал J Intern Med 1996; 11:50. [Crossref] [PubMed]
- Чжун Х, Цянь Й, Фанг С. и др.Экспрессия HE4 при раке легких, метаанализ. Clin Chim Acta 2017; 470: 109-14. [Crossref] [PubMed]
- Лю В., Ян Дж., Чи П.Д. и др. Оценка клинического значения сывороточных уровней HE4 при раке легких и туберкулезе легких. Int J Tuberc Lung Dis 2013; 17: 1346-53. [Crossref] [PubMed]
- Абд-Эль-Фаттах А.А., Садик Н.А., Шейкер О.Г. и др. Дифференциальная экспрессия микроРНК в сыворотке крови больных раком легких, туберкулезом легких и пневмонией.Cell Biochem Biophys 2013; 67: 875-84. [Crossref] [PubMed]
- Zhu W, Zhou K, Zha Y и др. Диагностическая ценность сывороточных уровней miR-182, miR-183, miR-210 и miR-126 у пациентов с немелкоклеточным раком легкого на ранней стадии. PLoS One 2016; 11. [Crossref] [PubMed]
- Ленг С., Чжэн Дж, Джин И и др. Уровень внеклеточной ДНК в плазме и ее целостность как биомаркеры, позволяющие отличить немелкоклеточный рак легкого от туберкулеза. Clin Chim Acta 2018; 477: 160-5.[Crossref] [PubMed]
- Vendrell JA, Mau-Them FT, Béganton B и др. Обнаружение циркулирующей бесклеточной опухолевой ДНК как рутинный инструмент ведения пациентов с раком легкого. Int J Mol Sci 2017; 18: 264. [Crossref] [PubMed]
- Налбандян А, Ян Б.С., Пичугин А и др. Канцерогенез легких, вызванный хронической туберкулезной инфекцией: экспериментальная модель и генетический контроль. Онкоген 2009; 28: 1928. [Crossref] [PubMed]
Цитируйте эту статью как: Parker CS, Siracuse CG, Litle VR.Выявление рака легких у больных активным туберкулезом легких. J Thorac Dis 2018; 10 (Дополнение 28): S3392-S3397. DOI: 10.21037 / jtd.2018.07.11
Эффект противоракового и противотуберкулезного лечения у больных раком легкого с активным туберкулезом: ретроспективный анализ | BMC Cancer
Главный вывод настоящего исследования заключается в том, что пациенты с сосуществующим раком легких и активным туберкулезом могут безопасно получать как противораковое, так и противотуберкулезное лечение.Эта информация поможет врачам принимать решения по клиническому лечению пациентов с сосуществующим раком легких и активным туберкулезом.
Рак легких и туберкулез — две основные проблемы общественного здравоохранения в Китае. Было продемонстрировано, что в 2014 г. в Китае было 28,49 смертей от рака легких на 100 000 населения [1] и 2,6 смертей от туберкулеза на 100 000 населения в 2017 г. [2]. Между тем между раком легких и туберкулезом сложная взаимосвязь, а значит, они являются факторами риска друг для друга.В нашей стране с высоким бременем туберкулеза заболеваемость туберкулезом среди онкологических больных достигала 12,72% [16]. В текущем исследовании пациенты были пожилого возраста с распространенным НМРЛ. Кроме того, большинству пациентов в группе лечения ТБ был поставлен новый диагноз. Следовательно, следует проявлять осторожность в отношении риска туберкулеза у пациентов с раком легких.
Лечение туберкулеза у онкологических больных до сих пор не дает окончательных результатов, особенно для пациентов с запущенным немелкоклеточным раком легкого, которые проходят синхронную противотуберкулезную и противораковую терапию [17].Kim et al. показали, что у онкологических больных (пациенты с раком легкого составляли 8% обследованных) противораковая химиотерапия не является препятствием для лечения туберкулеза [7]. Hirashima et al. Продемонстрировали, что пациентам с метастатическим колоректальным раком можно безопасно и эффективно одновременно проводить химиотерапию рака и лечение туберкулеза [8]. Ученый также продемонстрировал, что лечение рака и туберкулеза можно безопасно и эффективно назначать пациентам с различными типами злокачественных новообразований (включая рак легких) и активным туберкулезом [9].В нашем исследовании большинство пациентов получали схему лечения 6HRE (74%), 2 пациента получали схему лечения 2HRZE / 4HR и 6 пациентов получали схему лечения 9HR из-за повреждения печени / почек на исходном уровне. Показатель успешности лечения туберкулеза составил 80,7%, что немного ниже, чем у новых и рецидивов в Китае в 2017 году [2]. С другой стороны, серьезных побочных эффектов, связанных с противотуберкулезным лечением, не наблюдалось. Наиболее частым побочным эффектом в группе лечения ТБ было повреждение печени, большинство из которых было несерьезным и вылечилось соответствующим вмешательством.Результаты показали, что противотуберкулезное лечение может быть эффективным у пациентов с раком легких и активной формой ТБ.
В нашем исследовании сумма случаев неудачного лечения туберкулеза и числа потерянных для последующего наблюдения достигла почти 20%. Корректировка схемы противотуберкулезного лечения и отмена, вероятно, были объяснены неудачей (корректировка схемы у 5 пациентов, прерывание лечения у 2 пациентов и активное прекращение у 4 пациентов). Другая причина может быть в MRT-TB / RR-TB. Из-за ограниченных ресурсов тестирование лекарственной чувствительности к туберкулезу было проведено в 3% новых случаев в Китае в 2013 г. [18].MRT-TB / RR-TB обычно не тестировался в течение периода исследования. Следовательно, следует проявлять больше осторожности в отношении инфекции MRT-TB / RR-TB у пациентов с раком легких.
Наше исследование было сосредоточено на пациентах с раком легких с активным, а не латентным туберкулезом. В настоящее время скрининг и лечение латентного туберкулеза становятся новым приоритетным направлением деятельности по искоренению туберкулеза среди населения высокого риска. Распространенность латентного туберкулеза, диагностированного с помощью анализа высвобождения гамма-интерферона, в Китае колебалась от 13 до 20% в популяционном исследовании [19].Из-за большой численности латентной популяции ТБ лечение латентного ТБ систематически не применяется в национальных руководствах, а ограничивается пациентами с различными иммунодефицитами, такими как ВИЧ, силикоз, получающими лечение противоопухолевым фактором некроза, получающими диализ, трансплантацию органов или гематологию. [20, 21]. Из-за более простой схемы лечения латентного ТБ по сравнению с активным ТБ профилактическая химиотерапия латентного ТБ может быть предпочтительнее для пациентов с раком легких. Однако экономическая эффективность профилактического лечения латентного ТБ у пациентов с раком легкого заслуживает дальнейшего исследования.
Что касается противоракового лечения, не было обнаружено различий между двумя группами, таких как режим лечения, частота ответа, среднее время выживания, изменение KPS и серьезные побочные эффекты. Результат означал, что противотуберкулезное лечение не мешало противораковому лечению у пациентов с раком легких с активным туберкулезом. Среднее время выживания у больных ТБ составляло 52 недели, что было короче, чем в Шанхае (16 месяцев при немелкоклеточном раке легкого III / IV стадии) [22]. Это может быть связано с разницей в экономическом и медицинском уровне между двумя регионами.Таким образом, наши результаты предполагают, что как противораковые, так и противотуберкулезные методы лечения могут быть безопасно и эффективно назначены пациентам с распространенным раком легких с туберкулезом.
В настоящее время иммунотерапия рака, такая как ингибиторы иммунных контрольных точек (ICB), нацеленные на цитотоксический антиген, связанный с Т-лимфоцитами 4, запрограммированную гибель клеток 1 (PD-1) и лиганд запрограммированной смерти 1 (PD-L1), произвела революцию в лечении различные виды рака, в том числе рак легких. Однако все чаще сообщается о туберкулезной инфекции, связанной с этими возбудителями [23, 24].Механизмы активации туберкулеза после лечения ICB еще не определены. Усиление Th2-опосредованных воспалительных реакций с помощью блокады PD-1, введение стероидов или агентов противоопухолевого фактора некроза альфа для преодоления иммунных побочных эффектов и лимфопении являются одними из потенциальных механизмов [25, 26]. Следовательно, во время лечения ИКБ следует уделять больше внимания туберкулезной инфекции. Для предотвращения активного ТБ может быть показан скрытый скрининг на ТБ и химиопрофилактика перед контрольной терапией.
Ограничения
Во-первых, это было ретроспективное исследование с неизбежной ошибкой отбора.Во-вторых, размер выборки был небольшой группой пациентов, что ограничивало возможности статистического анализа. В-третьих, пациенты, получавшие молекулярную таргетную терапию, были исключены, поскольку не было случаев для анализа. В-четвертых, из-за ограниченных ресурсов MRT-TB / RR-TB в нашем исследовании не тестировался. В-пятых, нельзя полностью исключить нетуберкулезные микобактерии у наших пациентов из-за ограничений мазка мокроты и / или посева. Однако влияние невелико, потому что лечение против ТБ не удалось только у двух пациентов.
Рак легкого у больных туберкулезом | World Journal of Surgical Oncology
В период с 1990 по 2005 год 2218 больных раком легких прошли хирургическое лечение в отделении торакальной хирургии и онкологии Института онкологии Вильнюсского университета. У 46 (2,1%) пациентов диагностировано сосуществование рака легких и туберкулеза. Использовались следующие методы диагностики: рентгенография грудной клетки, компьютерная томография (КТ), бронхоскопия, бактериоскопическое, бактериологическое и цитологическое исследование мокроты, патологическое исследование.
Диагноз сосуществования рака и туберкулеза был установлен до операции у 18 (39,1%) пациентов, у остальных 28 (60,8%) диагноз был установлен после патологического исследования резецированных препаратов. Несмотря на адекватное противотуберкулезное лечение всех 46 пациентов (4–5 месяцев лечения препаратами выбора), у 15 (32,6%) пациентов в мокроте до операции были обнаружены микобактерии (TM +).
Рентгенологические, томографические и патологические методы выявили сосуществование рака и туберкулеза в очагах перенесенного туберкулеза у 32 (69.5%) пациентов, у 8 (17,4%) пациентов. изменения были выявлены односторонне по отношению к туберкулезу, причем у 6 (13,0%) изменений в интактном легком. Случаи по стадиям представлены в Таблице 1.
Таблица 1 Случаи с сосуществующими раком и туберкулезом по стадиямОперации были выполнены в соответствии с критериями, упомянутыми выше, а степень опухоли представлена в Таблице 2.
Таблица 2 Операции, выполненные у пациентов с сосуществующими рак легкого и туберкулезСледует отметить, что такие травматические операции проводились из-за клинической ситуации.У больных туберкулезом обычно наблюдаются плевральные спайки, фиброз и склероз легочной ткани и рубцовые изменения.
Патологическое исследование удаленного препарата показало, что фиброзно-кавернозный туберкулез у 15 (30,5%) пациентов, инфильтративный у 12 (26,0%), диссеминированный у 5 (10,8%) и пневмосклероз вследствие туберкулеза (большие кальцинаты, твердые очаги, одиночные и множественные туберкулемы). , цирроз легких) у 14 (30,6%) пациентов соответственно. Морфологический тип рака представлен в таблице 3.
Таблица 3 Морфология рака у оперированных пациентовУ 12 (26,0%) пациентов с прогрессирующим раком легкого, находящимся в области посттуберкулезных изменений, наблюдали деструкцию опухоли с деструкцией легочной ткани и диссеминацию туберкулеза вокруг опухоли. Адъювантное лечение было проведено 23 (50%) пациентам: из них 12 (52%) получали лучевую терапию (42 Гр), 11 (48%) получали химиотерапию (этопозид + цисплатин × 6 циклов), 5 (21,7%) пациентов из этой группы в дальнейшем получали противотуберкулезное лечение в связи с обострением туберкулеза.
Рак легкого у пациентов, перенесших торакопластику по поводу туберкулеза легких | Японский журнал клинической онкологии
Аннотация
Справочная информация: В 1950-х годах в Японии торакопластика была мощным средством лечения туберкулеза легких. Сейчас есть много пожилых людей, у которых есть последствия туберкулеза, вызванные торакопластикой. Мы столкнулись с некоторыми случаями рака легких среди этих людей.
Методы: Чтобы выяснить особенности рака легких, возникающего после торакопластики по поводу туберкулеза легких, мы рассмотрели для анализа 20 таких случаев.
Результаты: Было 17 мужчин и три женщины в возрасте от 55 до 78 лет (в среднем 65 лет). У всех была респираторная дисфункция, и большинство из них курили сигареты. Рак легких был локализован в верхних долях в девяти случаях, в средней доле в одном и в нижних долях в 10. Десять случаев рака легкого были обнаружены в торакопластированном легком, а остальные 10 — в противоположном легком. Гистологически преобладала плоскоклеточная карцинома (11 случаев). Восемь случаев рака легких были обнаружены на стадии I и II и 12 — на стадии III и IV.Большинство раковых поражений были отделены от поражений туберкулеза. Хирургическая резекция была выбрана только в трех случаях из 11 стадий l – IIIA с учетом респираторной дисфункции и / или дыхательной недостаточности вследствие торакопластики. Химиотерапия и / или лучевая терапия были выполнены девяти пациентам, а только поддерживающая терапия — восьми. Четырнадцать пациентов умерли от рака легких и четверо умерли от легочного сердца из-за последствий туберкулеза. Пятилетняя выживаемость была достигнута только в одном хирургическом случае. Восемь из девяти пациентов, получавших химиотерапию или лучевую терапию, умерли в течение 1 года, и, кроме того, семь из восьми пациентов, получавших поддерживающую терапию, умерли в течение 6 месяцев.
Заключение: Рак легкого у пациентов, перенесших торакопластику, возник в каждом легком и каждой доле, независимо от торакопластики. Кроме того, задержка обнаружения была такой, что случаи III – IV стадии были в большинстве, имелись некоторые ограничения в терапевтических преимуществах, связанных с торакопластикой, и прогноз был очень плохим. Врачам следует избегать задержки в выявлении рака легких путем тщательного наблюдения за такими пациентами.
Введение
Раньше туберкулез был чрезвычайно распространен в Японии, и в 1950-х годах 3 миллиона человек болели туберкулезом в активной форме.В то время не было мощных средств против туберкулеза, таких как рифампицин, и торакопластика была одним из эффективных методов лечения туберкулеза легких. Торакопластика привела к клиническому излечению от туберкулеза у многих пациентов, но позже эти пациенты постарели, и у многих возникли последствия туберкулеза, вызванные необратимыми анатомическими изменениями легкого (1).
В нашей больнице мы столкнулись с несколькими случаями рака легких среди этих пациентов. Со времени первого доклада Бейля (2) о сосуществовании рака легких и туберкулеза легких в 1810 году, связь между этими двумя заболеваниями сообщалась и обсуждалась многими исследователями.Однако исследований рака легких после торакопластики было немного. Поэтому мы оценили 20 случаев рака легких для анализа, чтобы прояснить клинические особенности рака легких у пациентов, перенесших торакопластику.
Пациенты
С 1982 по 1998 год в Токийскую национальную грудную больницу поступило 1635 пациентов с раком легких. Из этих пациентов мы встретили 20, которые ранее перенесли торакопластику по поводу туберкулеза легких. Путем анализа рентгенограмм грудной клетки, тестов функции легких и других медицинских записей мы оценили клинические детали этих пациентов, такие как последствия туберкулеза, особенности рака легких, лечение и течение.
Таблица 1
Клинический фон больных на момент выявления рака легкого
ЖЕЛ, жизненная емкость легких; ОФВ 1,0 , объем форсированного выдоха за 1 с; NE, не обследован из-за плохого системного и респираторного состояния.
Таблица 1
Клиническая картина пациентов на момент выявления рака легкого
ЖЕЛ, жизненная емкость легких; ОФВ 1,0 , объем форсированного выдоха за 1 с; NE, не обследован из-за плохого системного и респираторного состояния.
Результаты
Из 20 пациентов 17 мужчин и трое женщин. Возраст, в котором рак легких был обнаружен в нашей больнице, варьировался от 55 до 78 лет (в среднем 65 лет), с самым высоким уровнем заболеваемости в шестом десятилетии жизни. Клиническая история этих пациентов представлена в Таблице 1. Туберкулез чаще всего болел в 1940–1950-х годах, и многим пациентам была сделана торакопластика в 1950–1960-х годах. У четырех из 20 пациентов лобэктомия или сегментэктомия также выполнялись в дополнение к торакопластике.У большинства пациентов интервал между торакопластикой и обнаружением рака легких составлял более 20 лет. Статус работоспособности составлял 1-2 степени у 14 пациентов и 3-4 степени у шести пациентов. У всех были хронические симптомы, такие как кашель, мокрота и / или одышка. Легочная дисфункция от легкой до тяжелой была очевидна у всех 17 пациентов, которым проводились исследования функции легких, и у четырех пациентов проводилась домашняя кислородная терапия. Шестнадцать пациентов курили сигареты в прошлом или в настоящее время, и 13 из 16 выкуривали более 20 сигарет в день в течение как минимум 20 лет.
Таблица 2
Характеристики рака легкого
RUL, правая верхняя доля; RML, правая средняя доля; RLL, правая нижняя доля; LUL, левая верхняя доля; LLL, левая нижняя доля.
Таблица 2
Характеристики рака легкого
RUL, правая верхняя доля; RML, правая средняя доля; RLL, правая нижняя доля; LUL, левая верхняя доля; LLL, левая нижняя доля.
Характеристики рака легких показаны в таблице 2. Двенадцать из них были в правом легком и восемь — в левом; девять были в верхних долях, одна — в средней и 10 — в нижней; и 10 были в легком с торакопластикой и 10 — в противоположном легком.Клиническими стадиями заболевания были стадия IA у двух пациентов, стадия IB у трех, стадия IIB у трех, стадия IIIA у трех, стадия IIIB у трех и стадия IV у шести. Гистологически 11 из 20 случаев рака легких были плоскоклеточной карциномой, пять — аденокарциномой, три — мелкоклеточной карциномой, а оставшаяся одна — крупноклеточной карциномой. Кроме того, семь из 11 плоскоклеточных карцином, все пять аденокарцином, одна из трех мелкоклеточных карцином и одна крупноклеточная карцинома возникли в периферических полях легких.Локализация рака не различалась между гистологическими типами (таблица 3).
Полные рентгенологические наблюдения показали, что раковые поражения, по-видимому, отделены от неактивных туберкулезных поражений, за исключением одного ракового поражения, происходящего из паренхимы легкого рядом с местом торакопластики. Все 12 пациентов, у которых была выявлена стадия III – IV, были направлены в нашу больницу после увеличения теней опухоли на рентгеновских снимках грудной клетки, в то время как все пять пациентов, у которых рак был обнаружен на стадии I, находились в больнице и выходили из нее. нашу больницу из-за обострения хронической респираторной недостаточности.
Таблица 3
Анатомическая связь между торакопластикой и гистологическим типом рака легкого
Таблица 3
Анатомическая связь между торакопластикой и гистологическим типом рака легкого
Таблица 4
Взаимосвязь между локализацией рака легких и лечением
Таблица 4
Взаимосвязь между локализацией рака легких и лечением
Подробная информация о лечении пациентов с раком легких представлена в таблице 4.Лечебная резекция была выполнена только в трех случаях (1/5 стадия I, 1/3 стадия II и 1/3 стадия IIIA). У двух из этих трех пациентов (стадия I, стадия II) раковое поражение находилось в торакопластированном легком. Хотя объем форсированного выдоха за 1 с (ОФВ 1,0 ) у этих пациентов был низким (990 и 1020 мл), пневмонэктомия была выполнена без тяжелых респираторных осложнений. У третьего пациента (стадия IIIA) рак легкого был локализован в противоположном легком. Несмотря на значение FEV 1,0 , равное 1390 мл, после лобэктомии у пациента возникла тяжелая респираторная недостаточность.У остальных пяти пациентов с I – IIIA стадией болезни четыре пациента с I стадией получали кислородную терапию в домашних условиях, и хирургическая резекция была невозможна. Кроме того, два из трех злокачественных опухолей легкого стадии II и два из трех случаев рака легкого стадии IIIA были расположены в противоположном, относительно здоровом легком, и операция не рассматривалась из-за вероятности тяжелого респираторного расстройства в результате не только лобэктомии, но и также частичной резекции здорового легкого.
Таблица 5
Связь между лечением и исходом
Таблица 5
Связь между лечением и исходом
Паллиативная лучевая терапия была проведена четырем (две стадии IIIB, две стадии IV) пациентам с преобладанием рака торакопластированного легкого (три случая ) по сравнению с противоположным легким (один случай).Облучение в диапазоне от 47 до 55 Гр было проведено без побочных эффектов, но также без положительного эффекта. Химиотерапия, содержащая цисплатин, применялась в пяти случаях (один этап II, два этапа IIIA, два этапа IV) без положительных эффектов. Все пять пациентов завершили один цикл приема. Остальным восьми пациентам противораковая терапия не проводилась с учетом таких факторов, как возраст, работоспособность, степень заболевания, респираторная функция и расположение рака легких.
Результат лечения 20 пациентов показан в таблице 5. Хирургическая резекция дала хорошее течение в двух случаях, когда рак легкого возник в торакопластированном легком. Один из этих пациентов выжил в течение 102 месяцев после пневмонэктомии без рецидива опухоли (рис. 1), а другой — через 20 месяцев после пневмонэктомии без рецидива. Однако третий пациент, которому была проведена операция и у которого был рак легкого в противоположном легком, умер через 9 месяцев после операции из-за рецидива рака.
Время выживания четырех пациентов, получивших лучевую терапию, составляло от 2 до 16 месяцев, и все, кроме одного пациента, умерли в течение 1 года. У пяти пациентов, получавших химиотерапию, период выживания был плохим, от 3 до 8 месяцев (рис. 2). Кроме того, семь из восьми пациентов, получавших только поддерживающую терапию, умерли в течение 6 месяцев после постановки диагноза рака легких. Что касается причины смерти пациентов, которым не была проведена хирургическая резекция, трое пациентов с раком I стадии умерли от легочного сердца из-за последствий туберкулеза.Считалось, что причина смерти у остальных 13 пациентов связана с раком, но плохое респираторное заболевание, по-видимому, сократило период выживания.
Рисунок 1
Рак легкого обнаружен в правой нижней доле на рентгенограмме грудной клетки (стрелка). Была проведена пневмонэктомия, патологическое исследование показало, что рак находится на стадии IA. Рецидива опухоли не произошло, и через 102 месяца пациенты умерли от легочного сердца.
Рисунок 1
Рак легкого обнаружен в правой нижней доле на рентгенограмме грудной клетки (стрелка).Была проведена пневмонэктомия, патологическое исследование показало, что рак находится на стадии IA. Рецидива опухоли не произошло, и через 102 месяца пациенты умерли от легочного сердца.
Рисунок 2
Ателектаз левой верхней доли, вызванный раком легкого, обнаруженный на рентгенограмме грудной клетки. Хотя клинически предполагалось, что рак находится на стадии IIB, хирургическая резекция была невозможна из-за плохих респираторных и системных заболеваний. Была проведена бронхиальная артериальная инфузия цисплатина, но она оказалась неэффективной.Через 8 месяцев пациент умер от рака легких.
Рисунок 2
Ателектаз левой верхней доли, вызванный раком легкого, обнаруженный на рентгенограмме грудной клетки. Хотя клинически предполагалось, что рак находится на стадии IIB, хирургическая резекция была невозможна из-за плохих респираторных и системных заболеваний. Была проведена бронхиальная артериальная инфузия цисплатина, но она оказалась неэффективной. Через 8 месяцев пациент умер от рака легких.
Обсуждение
Было проведено множество исследований рака легких, связанных с туберкулезом легких, и возможная взаимосвязь между этими двумя заболеваниями обсуждалась в течение многих лет с этиологических и / или патогенных аспектов (3–8).В Японии туберкулез был наиболее часто встречающимся инфекционным заболеванием, и в настоящее время есть много людей, которые болеют туберкулезом в активной или неактивной форме. Поэтому было опубликовано множество японских отчетов о сосуществовании рака легких и туберкулеза легких, в которых показано, что рак легких встречается у 1% пациентов с активным туберкулезом и что, наоборот, активный туберкулез встречается у 4% пациентов с раком легких (9–2). 11). В данной серии мы не оценивали частоту рака легких у пациентов с неактивным туберкулезом с этиологического аспекта, потому что пожилые пациенты, поступающие в нашу больницу, обычно имеют некоторую степень неактивных туберкулезных теней помимо торакопластики на рентгеновских снимках грудной клетки, с или без история приема лекарств от туберкулеза.Интерес к этому исследованию вызвала патогенетическая взаимосвязь между туберкулезом легких и раком легких, включая особое влияние окружающей среды на канцерогенез, вызванное торакопластикой.
В предыдущих отчетах гистологический тип рака легких у пациентов с туберкулезными поражениями варьировал. Многие отчеты показали, что преобладала плоскоклеточная карцинома (9–14), а другие показали, что не было значительных различий между гистологическими типами рака легких, возникших с туберкулезом легких или без него (15,16).Кроме того, некоторые исследования показали, что гистологический тип может различаться у пациентов с активным и неактивным туберкулезом. Mirany et al. (17) показали, что плоскоклеточный рак преобладает у пациентов с неактивным туберкулезом, но аденокарцинома преобладает у пациентов с активным туберкулезом, тогда как Yatsuka et al. (18) показали, что плоскоклеточный рак преобладает при активном туберкулезе. В нашей серии исследований преобладала плоскоклеточная карцинома. На более высокий уровень плоскоклеточного рака могут влиять внешние факторы, такие как курение, потому что в нашей серии пациентов большинство пациентов были заядлыми и хроническими курильщиками сигарет.
Локализация рака легких и туберкулезных поражений также обсуждалась с патогенетических аспектов. В ранних сообщениях анатомические изменения, вызванные туберкулезом, такие как метаплазия и хроническое раздражение бронхов и паренхимы легких, могли быть канцерогенными (7,19). Также была отмечена теория «рака шрама», описанная Фридрихом (20) в 1939 году, и некоторые сообщения показали, что рак легких возник в легочных рубцах, которые были результатом излеченной туберкулезной инфекции (21,22). Однако более поздние патологические анализы (23,24) показали, что рубцевание является результатом, а не предшественником опухолевого роста периферического рака легкого.Фактически, многие японские исследования показали, что раковые и туберкулезные поражения обычно обнаруживаются в одной и той же доле, но располагаются независимо друг от друга; смесь двух поражений встречается редко (8–10,25,26). В этом исследовании все, кроме одного, рак легких были обнаружены на рентгенограмме грудной клетки отдельно от туберкулезных поражений, включая участки вокруг торакопластики. Мы считаем, что у пациентов, перенесших торакопластику, рак рубца встречается редко.
Еще одним патогенным фактором канцерогенеза наших онкологических заболеваний может быть нарушение дыхания из-за торакопластики.Йонеяма и др. (27) сообщили, что у 46 пациентов с ранее существовавшим односторонним заболеванием легких, в том числе у восьми пациентов, которым была сделана торакопластика, была гораздо более высокая частота рака легких в легких с лучшей вентиляцией и что большинство так называемых видов рака группы I Крейберга (28) , такие как плоскоклеточная карцинома и мелкоклеточная карцинома, возникали в легких с лучшей вентиляцией. Они предположили, что из-за воздействия окружающей среды на рак бронхиальный эпителий здорового легкого более подвержен воздействию экзогенных канцерогенов, чем эпителий больного невентилируемого легкого, что приводит к высокому риску развития рака I группы Крейберга.Более поздние сообщения (18,29) аналогичным образом показали, что рак легкого у пациентов, перенесших торакопластику, был склонен возникать в противоположном, относительно здоровом легком. В нашей серии, однако, не было различий в заболеваемости раком легкого в торакопластированном легком и раком противоположного легкого, и, кроме того, мы не обнаружили связи между торакопластикой и раком I группы Крейберга. Мы пришли к выводу, что у пациентов, перенесших торакопластику по поводу туберкулеза, рак легкого может возникать в каждом легком и каждой доле, независимо от торакопластики.
Было указано, что ранее существовавшие легочные заболевания, вызванные неактивным туберкулезом, вызывают некоторые трудности при обнаружении с помощью рентгенографии грудной клетки теней малого рака легкого и при ведении пациентов с раком легкого (30). В этом исследовании мы выяснили клинические проблемы рака легких у пациентов, перенесших торакопластику. Во-первых, рак легких обычно находится на далеко зашедших стадиях. Однако на самом деле рак легких в основном отличался от туберкулеза, и частые рентгенологические исследования позволили выявить рак легких на ранней стадии у пациентов, которые часто приходили в нашу больницу и выписывались из нее.Во-вторых, из-за нарушения дыхания, вызванного торакопластикой, польза от местной терапии, такой как хирургическая резекция и, возможно, лучевая терапия, была ограничена. Наконец, прогноз пациентов был очень плохим, что может быть связано не только с запущенной стадией обнаружения, но и с основным плохим респираторным заболеванием.
В данной серии исследований многие из наших пациентов находились в неподходящем для лечения раке состоянии, что привело к плохому прогнозу. Однако у некоторых из наших пациентов, у которых рак был обнаружен на ранней стадии и локализован в торакопластированном легком и, кроме того, у которых системные и респираторные заболевания были относительно сохранены, была возможна агрессивная терапия, такая как пневмонэктомия, что дало хороший прогноз.Поэтому врачи должны проявлять осторожность, чтобы не откладывать диагноз рака легких путем тщательного наблюдения за пациентами, перенесшими торакопластику.
Список литературы
1Отделение совместных исследований респираторной недостаточности в национальном санатории в Японии
Клинический анализ дыхательной недостаточности, вызванной туберкулезом легких, включая его последствия, за последние 12 лет в национальном санатории Японии
,IRYO
,1986
, vol.40
(стр.155
—61
) 2.,Recherches sur la Phthisie Pulmonaire
,1810
Париж
Габон
стр.310
3.,Руководство по патологической анатомии
,1855
, vol.1
Филадельфия
Бланшар и Ли
(стр.237
—8
) 4.Entwickelung eines primaren Карциномы в einer tuberculosen Caveme
,Virchows Arch
,1926
, vol.149
(стр.329
—40
) 5.Ассоциация бронхогенной карциномы и активного туберкулеза легких
,Dis Chest
,1953
, vol.23
(стр.207
—16
) 6.Связь между коэффициентами смертности от рака и туберкулеза
,Br J Cancer
,1961
, vol.15
(стр.10
—8
) 7,,,.Сопутствующая бронхогенная карцинома и туберкулез легкого
,Dis Chest
,1962
, vol.41
(стр.610
—7
) 8.Повышенная заболеваемость раком легких среди больных туберкулезом легких
,Jpn J Clin Oncol
,1993
, vol.23
(стр.205
—20
) 9,,.Исследование сосуществования бронхогенной карциномы и активного туберкулеза легких
,Kekkaku
,1981
, vol.56
(стр.49
—55
) 10,,,,, и др.Исследование активного туберкулеза легких с сопутствующей карциномой легких
,Nihon Kyobu Rinsho
,1990
, vol.49
(стр.901
—7
) 11,,,,, и др.Клиническое исследование сосуществования активного туберкулеза легких и рака легких
,Kekkaku
,1992
, vol.67
(стр.119
—25
) 12,.Туберкулез легких, бронхоэктазы и кальциноз в связи с бронхогенной карциномой
,Am Rev Tuberc
,1951
, vol.64
(стр.620
—9
) 13,.Связь между туберкулезом легких и бронхогенной карциномой. Топографическое исследование
,Am Rev Respir Dis
,1969
, vol.99
(стр.229
—36
) 14,,,,.Укороченная выживаемость пациентов с раком легкого, у которых изначально был туберкулез легких
,Jpn J Clin Oncol
,1996
, vol.26
(стр.322
—7
) 15,.Ассоциация туберкулеза и рака легкого
,Eschr Tuberk Erkrank Thoraxorgen
,1967
, vol.126
(стр.277
—9
) 16,,.Сосуществующая бронхогенная карцинома и активный туберкулез легких
,J Thorac Cardiovasc Surg
,1978
, vol.76
(стр.469
—72
) 17,,.Сосуществующие бронхогенная карцинома и туберкулез
,Dis Chest
,1996
, vol.50
(стр.258
—64
) 18,,,,, и др.Туберкулез легких и карцинома легких с клинической точки зрения на основе 4000 случаев, зарегистрированных Национальной группой исследования рака легких в санаториях
,Haigan
,1980
, vol.20
Доп.
(стр.21
—32
) 19,,,,.Анатомические отношения между бронхогенной карциномой и кальцинированными узелками в легком
,Am Rev Tuberc
,1952
, vol.66
(стр.151
—60
) 20.Periphere Lungenkrebse auf dem Boden pleuranaher Narben
,Virchows Arch
,1939
, vol.304
(стр.230
—47
) 21,.Рак рубца легких
,Br J Tuberc Dis Chest
,1957
, vol.51
(стр.237
—45
) 22,,.Рак легкого рубца. Увеличение за 21 год
,Рак
,1979
, т.43
(стр.636
—42
) 23,,,,, и др.Прогностические последствия фиброзного очага (рубца) при небольших периферических раках легких
,Am J Surg Pathol
,1980
, vol.4
(стр.365
—73
) 24,.Рак легкого рубца: происхождение и значение
,Hum Pathol
,1984
, vol.l5
(стр.625
—3l
) 25,,,,.Морфологическое исследование 406 случаев бронхогенной карциномы в Японии
,GANN
,1955
, т.46
(стр.523
—48
) 26,,,.Сосуществование рака легких и туберкулеза
,Nihon Kyobu Rinsho
,1979
, vol.38
(стр.197
—201
) 27,,,.Бронхиальная карцинома у пациентов с ранее существовавшим односторонним заболеванием легких
,Thorax
,1976
, vol.31
(стр.650
—1
) 28.Гистологические типы рака легкого; морфологическая и биологическая корреляция
,Acta Pathol Microbiol Scand
,1962
, vol.157
Suppl
(стр.1
—92
) 29,,,,, и др.Рак легкого развился у пациентов с ранее существовавшими односторонними легочными заболеваниями
,Nihon Kyobu Rinsho
,1978
, vol.37
(стр.618
—21
) 30,,,,.Туберкулез и рак легкого
,Chest
,1968
, vol.54
(стр.427
—32
)© 1999 Фонд содействия исследованиям рака
туберкулеза ведет к увеличению риска рака легких | Голос Америки
Согласно новому исследованию, проведенному на Тайване, у людей, заболевших туберкулезом, больше шансов заболеть раком легких.Врачи давно отметили, что пациенты с диагнозом туберкулез часто продолжают иметь другие проблемы с легкими даже спустя долгое время после излечения от туберкулеза. Но это первый раз, когда была задокументирована прямая связь между туберкулезом и повышенным риском рака легких.
Эпидемиолог Джон Сун из Китайского медицинского университета и больницы в Тайбэе постоянно слышал от врачей в противотуберкулезных клиниках, что у их пациентов часто может развиваться рак легких. Но никаких исследований это явление не изучалось.Итак, Сун получил записи из национального плана страхования страны, чтобы найти ссылку.
Он выбрал один миллион пациентов из 23 миллионов по данным страхования с 1990 по 2002 год. Из этого миллиона пациентов Сун идентифицировал около 4500 пациентов с диагнозом туберкулез. Затем он сравнил, у скольких из больных туберкулезом развился рак легких за последующее десятилетие, по сравнению с остальными людьми в группе данных, которые никогда не болели туберкулезом.
«Мы обнаружили, что среди больных туберкулезом заболеваемость составляет 26.3 на тысячу человеко-лет, а для населения в целом — 2,4, — говорит Сун. — Таким образом, у больных туберкулезом этот показатель примерно в 11 раз выше, чем у населения в целом. Это действительно высокий уровень ».
Сун говорит, что не имело значения, курили ли пациенты с ТБ или имели другие факторы риска рака легких. Достаточно было просто переболеть туберкулезом. Сун также обнаружил, что бывшие больные туберкулезом имеют повышенный риск для других потенциально смертельные хронические заболевания легких. Масштабы роста стали неожиданностью для врачей клиники.
«Согласно наблюдениям, они знали, что пациенты с туберкулезом имеют высокий риск, но они не знали, насколько высок», — говорит Сун. «Они не ожидали, что заболеваемость так высока».
Выводы Сунга предполагают, что врачи, лечащие туберкулез, должны следить за своими пациентами после того, как их туберкулез будет излечен, и им следует следить за признаками рака легких. Больные туберкулезом также должны продолжать бдительно следить за своим здоровьем, чтобы в случае возникновения проблемы они могли получить лечение раньше.
Исследование Сунга опубликовано в Журнале торакальной онкологии.
Рак легких или туберкулез ?? | Рак чат
Здравствуйте, я решил присоединиться к этому форуму, так как моя семья только что узнала, что мой отец (61), который плохо себя чувствовал в течение 6 недель, возможно, болен раком легких. Это еще не подтверждено. Я вкратце расскажу о событиях на данный момент:
6 недель назад: была загруженная многострановая командировка. Вернулся и почувствовал себя разбитым. Потеря аппетита и лихорадка почти каждую ночь.Также частое мочеиспускание по ночам. Врач назначил ему амилтриптилин от частых мочеиспусканий. Это немного помогло. Нет восстановления после лихорадки и потери аппетита. Сильно похудела. GP послал его на рентген и сказал, что они что-то видят в его легких. Он получает направление в онкологическую клинику двухнедельного ожидания.
Консультант онкологической клиники не понимает, что папа там делает. Говорит, что у него, скорее всего, туберкулез. Они делают биопсию, и результаты неубедительны. Сделана КТ-биопсия. Пока мы не получили полных результатов, но нам сказали, что у него киста со злокачественными клетками.У него были опухшие узелки в легких, и сегодня он пошел в операционную на медиастиноскопию, чтобы узнать, вызваны ли опухшие узелки туберкулезом или распространился ли рак. Медиастиноскопия будет последним обследованием, которое ему предстоит пройти. После этого мы сможем получить четкое представление о том, что на самом деле не так. Какой рак, распространился ли он и есть ли у него туберкулез. Надеюсь, результаты будут через 7-10 дней. Пока что все было в NHS, кроме медиастиноскопии, которую он сегодня делает в частной больнице из-за того, что не хочет ждать 3-4 недели в NHS.
Это стало огромным шоком для всех нас. Папа в целом здоров, и это действительно внезапно.
Итак, я присоединился к этому форуму в надежде, что смогу почерпнуть некоторую информацию от людей, которые были на нашем месте. Я просто не хочу тратить часы на Google, запутывая себя и читая неверные заголовки о лечении рака!
спасибо за чтение x
Доказательства повышенного риска рака легких среди больных туберкулезом — ScienceDaily
Хотя четкую связь туберкулеза с раком легких еще предстоит установить, новое исследование, опубликованное в январском выпуске журнала Journal of Thoracic Oncology предоставляет убедительные доказательства повышенного риска рака легких у людей с туберкулезом.
Исследователи из Китайского медицинского университета и больницы на Тайване случайным образом отобрали 1 миллион пациентов, охваченных национальной программой национального медицинского страхования (NHI). Все пациенты в возрасте 20 лет и старше с новым диагнозом туберкулеза в период с 1998 по 2000 год были идентифицированы как подвергавшаяся воздействию когорта, а все люди без туберкулеза в анамнезе были когортой, не подвергавшейся воздействию. Пациенты с каким-либо диагнозом рака были исключены, чтобы гарантировать, что у всех участников не было рака в начале обеих когорт.В целом для анализа подходили 716 872 взрослых: 4480 в когорте туберкулеза и 712 392 в когорте нетуберкулеза.
Обе группы наблюдались с 2001 по 2007 годы. Результаты показали, что у больных туберкулезом вероятность развития рака легких в 10,9 раз выше, чем у пациентов, не страдающих туберкулезом (26,3 против 2,41 на 10 000 человеко-лет). Смертность также была намного выше у больных туберкулезом, чем у пациентов, не страдающих туберкулезом (51,1 против 8,2 на 10 000 человеко-лет).
«Туберкулез — очень распространенное хроническое заболевание во всем мире; больше всего от него страдают люди в развивающихся и неразвитых регионах», — сказал доктор Чи-И Чен, один из исследователей. «Хорошо известно, что рак легких причинно связан с курением. Меньше внимания уделялось тому, подвержены ли люди с туберкулезом более высокому риску развития рака легких. С помощью данных всеобщего медицинского страхования Тайваня мы выявили 4480 больных туберкулезом. из группы из 716 872 человек и следили за ними в течение восьми или более лет.Заболеваемость раком легких у этих больных туберкулезом была в 11 раз выше, чем у людей без туберкулеза. Риск рака легких может возрасти почти в 16 раз, если больные туберкулезом также страдают хронической обструктивной болезнью легких. Это исследование показывает, что в кампании против туберкулеза также важно следить за профилактикой рака легких ».
Исследование было поддержано Национальным научным советом, Исполнительный Юань, Тайвань; Департамент здравоохранения, клинические испытания и научно-исследовательский центр передового опыта; Госпиталь Китайского Медицинского Университета; и Тайваньское министерство здравоохранения, Больница передового опыта в области онкологии Китайского медицинского университета.
