10 препаратов, эффективность которых снижает табачный дым
Как курение табачных изделий влияет на действие некоторых лекарственных средств.
Теофиллин является алкалоидом, производным метилксантина, который метаболизируется с участием фермента CYP1A2. У курильщиков клиренс (показатель скорости очищения биологических жидкостей или тканей организма) теофиллина значительно увеличивается (на 56-100%), уменьшая вдвое период полувыведения. Это взаимодействие также проявляется у пассивных курильщиков. Теофиллин относится к препаратам с узким терапевтическим индексом. Его концентрацию следует контролировать как у активных, так и пассивных курильщиков, а также у пациентов, бросивших курить. В случае курения большого количества сигарет или постоянного воздействия табачного дыма, пациенты могут потребовать даже двойной дозы препарата, тогда как те, кто бросает курить, должны уменьшить дозу.
Курение также может влиять на эффективность действия антикоагулянтов. Например, варфарина.
У курильщиков с ишемической болезнью, принимающих клопидогрел, наблюдается более сильный ингибирующий эффект на AДФ-зависимую агрегацию тромбоцитов и, таким образом, повышается риск осложнений кровотечения. Это связано с индукцией CYP1A2 (белок, кодируемый одноименным геном, расположенным у людей на коротком плече 15-й хромосомы) компонентами табачного дыма и повышенной конверсией клопидогреля к активному метаболизму.
Галоперидол

Ранитидин при его употребления курильщиками снижает клиренс никотина примерно на 30%, что может вызвать токсические эффекты, связанные с передозировкой никотином (рвота, тошнота, диарея, головокружение или боли в животе). Кроме этого, курение может снизить концентрацию препарата и тем самым нивелировать терапевтический эффект.
У курильщиков существует взаимодействие в фармакодинамеческой фазе между компонентами сигаретного дыма и ингаляционными ГКС (флутиказон, беклометазон), приводящего к снижению их антиастматической и противовоспалительной эффективности. Курильщикам с хронической астмой необходимо применять более высокие дозы глюкокортикоидов.
Курение приводит к снижению всасывания инсулина. Кроме того, может привести к высвобождению эндогенных веществ, которые индуцируют резистентность к инсулину. Часто курильщикам нужны более высокие дозы (на 15-30%).
У курильщиков наблюдается увеличение клиренса психотропных препаратов с анксиолитическим эффектом, расслабление мышц, усиление седативного действия (при приеме 
Онлазапин – это нейролептик, который метаболизируется CYP1A2 и CYP2D6. У курильщиков концентрация в обычном состоянии, то есть когда скорость введения препарата в организм равна скорости элиминации, в 5 раз ниже, а клиренс увеличивается до 98%.
Курение вызывает ослабление благоприятного эффекта снижения артериального давления и частоты сердечных сокращений бета-блокаторов, среди которых бисопролол, атенолол, карведилол, метопролол, пропранолол. Курильщикам нужны более высокие дозы этого лекарства.
Влияние табакокурения на метаболизм и эффективность противоопухолевой лекарственной терапии | partners
Табачная эпидемия признана одной из наиболее серьезных угроз для здоровья населения. По данным ВОЗ, более 1,1 миллиардов людей имеют такую вредную привычку, как курение, от которого ежегодно во всем мире умирает более 8 миллионов людей [1]. Помимо роли табака в возникновении сердечно-сосудистых заболеваний, заболеваний дыхательной и других систем, доказана канцерогенность табачного дыма [2].
Потенциальное влияние табака на фармакокинетические процессы, многогранно. Продукты неполного сгорания табака индуцируют активность ферментов метаболизма лекарственных средств. Так, например, еще во второй половине прошлого века R. Kushinsky и C. J. Louis заметили, что введение такого компонента табачного дыма, как бензо(a)пирена, вызывает значительное увеличение веса печени и содержания цитохрома Р450 (CYP) у крыс [7]. В настоящее время известно, что другие канцерогенные соединения сигаретного дыма, полициклические ароматические углеводороды, ответственны за индукцию нескольких изоформ ферментов семейства цитохрома Р450 (CYP1A1, 1A2, 1B1, 2D6 и 3A4), а также уридиндифосфат-глюкуронозилтрансферазы (UGT) – фермента глюкуронирования, при котором образуются водорастворимые, экскретируемые метаболиты [5]. Еще один потенциальный механизм связан с увеличением концентрации циркулирующего белка, связывающего лекарства [5]. Подобные модификации процессов биотрансформации в конечном счете приводят к ускоренному метаболизму и уменьшению экспозиции противоопухолевых препаратов. Учитывая узкий терапевтический индекс цитостатиков, у курильщиков даже небольшие изменения в их концентрации в плазме могут повлиять на эффективность лечения.
Так, например, еще во второй половине прошлого века R. Kushinsky и C. J. Louis заметили, что введение такого компонента табачного дыма, как бензо(a)пирена, вызывает значительное увеличение веса печени и содержания цитохрома Р450 (CYP) у крыс [7]. В настоящее время известно, что другие канцерогенные соединения сигаретного дыма, полициклические ароматические углеводороды, ответственны за индукцию нескольких изоформ ферментов семейства цитохрома Р450 (CYP1A1, 1A2, 1B1, 2D6 и 3A4), а также уридиндифосфат-глюкуронозилтрансферазы (UGT) – фермента глюкуронирования, при котором образуются водорастворимые, экскретируемые метаболиты [5]. Еще один потенциальный механизм связан с увеличением концентрации циркулирующего белка, связывающего лекарства [5]. Подобные модификации процессов биотрансформации в конечном счете приводят к ускоренному метаболизму и уменьшению экспозиции противоопухолевых препаратов. Учитывая узкий терапевтический индекс цитостатиков, у курильщиков даже небольшие изменения в их концентрации в плазме могут повлиять на эффективность лечения.
Таксаны. Химиотерапия на основе цитостатиков таксанового ряда является стандартной терапией для многих злокачественных новообразований. Ее эффективность главным образом зависит от степени связывания с белками плазмы крови, в т.ч. с альфа-1-кислым гликопротеином – одним из самых распространенных белков сыворотки крови, концентрация которого заметно повышена у курильщиков [7]. Ретроспективные данные, свидетельствуют о том, что уровень альфа-1-кислого гликопротеина в плазме крови напрямую связан с исходом лечения доцетакселом [7]. За счет уменьшения свободной фракции препарата, непосредственно оказывающей терапевтический эффект, у таких больных ниже частота объективного ответа, но вместе с тем в 1,5-2 раза меньше частота нейтропений 3-4 степени тяжести по сравнению с некурящими больными [8]. Интересно отметить, что у заядлых курильщиков до старта лечения паклитакселом наблюдается повышенное количество лейкоцитов и нейтрофилов [8].
Иринотекан. Исследования in vitro показали, что у курильщиков понижена плазменная концентрация иринотекана [9]. Вероятно, это связано с тем, что такие компоненты табачного дыма, как ариламин, непосредственно препятствуют взаимодействию эритроцитов с цитостатиком. Поскольку эритроциты играют ключевую роль в переносе лекарственных средств, то более низкие концентрации иринотекана и любых других препаратов у курильщиков по сравнению с некурящими пациентами могут приводить к негативным клиническим последствиям.
В другом исследовании было показано, что у курильщиков клиренс иринотекана ускорен на 18%, а системная экспозиция его активного метаболита SN-38 снижена на 40% [10]. Кроме того, частота глубокой нейтропении была значительно ниже: 6% против 38% соответственно (р<0,001), что также указывает на потенциальный риск низкой эффективности лечения. И хотя точный основной механизм еще предстоит выяснить, влияние курения на действие иринотекана может быть приписано индукции и модуляции некоторых изоферментов семейства Р450 и UGT1A1, которые участвуют в его метаболизме.
И хотя точный основной механизм еще предстоит выяснить, влияние курения на действие иринотекана может быть приписано индукции и модуляции некоторых изоферментов семейства Р450 и UGT1A1, которые участвуют в его метаболизме.
Гемцитабин. Этот противоопухолевый препарат из группы аналогов пиримидина метаболизируется в клетке под действием цитидиндеаминазы до неактивного метаболита – 2′-дезокси-2′,2′-дифторуридина. Сверхэкспрессия цитидиндеаминазы, вызванная курением, может привести к ускоренному метаболизму и снижению эффективности гемцитабина у нынешних и бывших курильщиков. Как следствие, это также приводит к более низкой гематологической токсичности. Например, по данным исследования M. Kanai и соавт., частота гемцитабин-индуцированной нейтропении 3-4 степени тяжести среди курящих и некурящих больных различными солидными опухолями составила 23,6% и 55,7% соответственно (р < 0,001), причем этот результат был более выраженным по мере увеличения индекса пачек/лет [11].
Препараты платины. Общепризнано, что повреждение ДНК и последующая индукция апоптоза являются основными цитотоксическими механизмами платиновых соединений. В свою очередь, никотин и никотинопроизводные нитрозамины, содержащиеся в сигаретном дыме, могут подавлять терапевтический эффект препаратов платины за счет прямого блокирования апоптоза и стимуляции клеточной пролиферации [12]. Это наглядно продемонстрировали китайские коллеги [12]. При совместной обработке клеток Tca8113 цисплатином и никотином наблюдалась незначительная ядерная фрагментация и малое количество апоптотических тел. Также было замечено, что истощение сурвивина, одного из белков семейства ингибиторов апоптоза, снижало ингибирующий эффект никотина на апоптоз, вызванный действием цисплатина. Таким образом, авторы сделали вывод, что воздействие табачного дыма негативно влияет на апоптотический потенциал химиотерапевтических препаратов, а сурвивин играет ключевую роль в антиапоптотическом эффекте никотина.
Иматиниб. Данный противоопухолевый препарат является ингибитором рецепторов тирозинкиназы для фактора роста тромбоцитов и фактора стволовых клеток. Лишь в одном исследовании было показано, что у курящих пациентов, получающих иматиниб по поводу гастроинтестинальной стромальной опухоли, общая выживаемость ниже, а частота анемии и астении выше по сравнению с контрольной группой [13]. Возможно это связано с индукцией изоферментов цитохрома Р450 (преимущественно CYP3A4, в меньшей степени – CYP1A2, 2D6, 2C9 и 2C19) или с высокой степенью связывания иматиниба с альфа-1-кислым гликопротеином вследствие курения [14].
Эрлонитиб. Известно, что данный селективный ингибитор тирозинкиназы рецептора эпидермального фактора роста метаболизируется в основном при участии CYP3A4 и в меньшей степени CYP1A2 и CYP1A1. В связи с этим было выдвинуто предположение, что курение может влиять на фармокинетику эрлотиниба посредством индукции изоформ цитохрома Р450. И действительно, несколько исследований показали, что у курильщиков значительно снижена плазменная концентрация и ускорен метаболический клиренс эрлотиниба. Так, в исследовании, проведенном группой американских ученых, после однократного приема эрлотиниба в дозе 150 мг или 300 мг отмечена меньшая экспозиция препарата у больных, продолжающих курить во время лечения [15]. После приема 150 мг эрлотиниба средняя геометрическая величина AUC0-infinity у курильщиков была в 2,8 раза ниже, чем у некурящих, и сопоставима с таковой у некурящих при приеме 300 мг эрлотиниба. Максимальная концентрация эрлотиниба (Сmах) у курильщиков составила 2/3 от таковой у некурящих, а средняя концентрация препарата через 24 часа (C24h) была в 8,3 раза ниже, чем у некурящих. В другом исследовании было выявлено, что у курильщиков при увеличении дозы эрлотиниба со 150 мг до 300 мг (максимально переносимой дозы) наблюдается аналогичная концентрация препарата и вместе с тем частота возникновения сыпи и диареи, как у больных, которые никогда не курили либо бросили курить, получающих эрлотиниб в суточной дозе 150 мг [16].
И действительно, несколько исследований показали, что у курильщиков значительно снижена плазменная концентрация и ускорен метаболический клиренс эрлотиниба. Так, в исследовании, проведенном группой американских ученых, после однократного приема эрлотиниба в дозе 150 мг или 300 мг отмечена меньшая экспозиция препарата у больных, продолжающих курить во время лечения [15]. После приема 150 мг эрлотиниба средняя геометрическая величина AUC0-infinity у курильщиков была в 2,8 раза ниже, чем у некурящих, и сопоставима с таковой у некурящих при приеме 300 мг эрлотиниба. Максимальная концентрация эрлотиниба (Сmах) у курильщиков составила 2/3 от таковой у некурящих, а средняя концентрация препарата через 24 часа (C24h) была в 8,3 раза ниже, чем у некурящих. В другом исследовании было выявлено, что у курильщиков при увеличении дозы эрлотиниба со 150 мг до 300 мг (максимально переносимой дозы) наблюдается аналогичная концентрация препарата и вместе с тем частота возникновения сыпи и диареи, как у больных, которые никогда не курили либо бросили курить, получающих эрлотиниб в суточной дозе 150 мг [16]. На основании этих данных было сделано предположение о том, что суточная доза эрлотиниба у нынешних курильщиков должна быть увеличена до 300 мг.
На основании этих данных было сделано предположение о том, что суточная доза эрлотиниба у нынешних курильщиков должна быть увеличена до 300 мг.
Концепция снижения вреда
Отказ от курения, безусловно, является оптимальным решением для пациента, проходящего противоопухолевую терапию. Однако в силу человеческой природы и недостаточного доступа к эффективным услугам по прекращению потребления табака большинство пациентов с онкологическими заболеваниями продолжает курить. Недавний опрос показал, что среди 26365 больных, наблюдавшихся в онкологических центрах, назначенных NCI (Национальным институтом рака США), в течение первых 18 месяцев реализации программы по отказу от курения, лишь 17,22% пациентов, употребляющих табак, согласились пойти к специалисту по лечению табачной зависимости [17]. Среди тех, кто отказался обращаться за медицинской помощью, 65,84% не были готовы бросать курить, хотя 27,01% пытались сделать это самостоятельно.
Поскольку процент успешных отказов от курения по-прежнему остается невысоким, предприняты попытки по снижению негативных последствий, связанных с курением, что укладывается в концепцию снижения вреда – комплекса методов и программ, направленных на максимальное уменьшение вреда здоровью для людей, не имеющих возможности, либо не желающих прекратить опасные действия или поведение. В частности, таким больным возможно рассмотреть переход на альтернативные способы доставки никотина (электронные сигареты или системы нагревания табака (СНТ)). Особенность данных продуктов заключается в химическом составе аэрозоля, который образуется при их применении: при относительно аналогичной концентрации никотина количество веществ с канцерогенным потенциалом значительно снижено [18-19]. Ярким примером служит исследование японских коллег [20]. Ученые доказали, что при употреблении СНТ даже через 5 дней концентрация 1-аминонафталина в моче ниже на 95%, бензола – 84%, 2-аминонафталина – 82%, 4-аминобифенила – 81%, акрилонитрила – на 78%, 1,3-бутадиона – 76%, бенз(а)пирена – на 70%, нитрозамина (NNN) – 69%, пирена – 53%, оксида углерода в крови – на 52%, 4-(метилnнитрозамино)-1-(3-пиридил)-1-бутанона (NNK) – 50%, o-толуидина – 49%, акролеина – на 47% по сравнению с традиционными сигаретами. Другие исследования также убедительно подтверждают снижение уровней маркеров экспозиции к канцерогенным компонентам сигаретного дыма, что позволяет сократить факторы риска у больных, полностью перешедших на подобные продукты [21-22].
В частности, таким больным возможно рассмотреть переход на альтернативные способы доставки никотина (электронные сигареты или системы нагревания табака (СНТ)). Особенность данных продуктов заключается в химическом составе аэрозоля, который образуется при их применении: при относительно аналогичной концентрации никотина количество веществ с канцерогенным потенциалом значительно снижено [18-19]. Ярким примером служит исследование японских коллег [20]. Ученые доказали, что при употреблении СНТ даже через 5 дней концентрация 1-аминонафталина в моче ниже на 95%, бензола – 84%, 2-аминонафталина – 82%, 4-аминобифенила – 81%, акрилонитрила – на 78%, 1,3-бутадиона – 76%, бенз(а)пирена – на 70%, нитрозамина (NNN) – 69%, пирена – 53%, оксида углерода в крови – на 52%, 4-(метилnнитрозамино)-1-(3-пиридил)-1-бутанона (NNK) – 50%, o-толуидина – 49%, акролеина – на 47% по сравнению с традиционными сигаретами. Другие исследования также убедительно подтверждают снижение уровней маркеров экспозиции к канцерогенным компонентам сигаретного дыма, что позволяет сократить факторы риска у больных, полностью перешедших на подобные продукты [21-22].
Заключение
Во всем мире табакокурение остается актуальной медико-социальной проблемой, особенно для онкобольных в связи повышенным риском развития рецидива, первично-множественных опухолей и снижением общей выживаемости в целом. Доклинические данные свидетельствуют о том, что никотин сам по себе обладает пролиферативным и антиапоптотическим действием в клеточных культурах. В связи с этим борьба с курением среди онкологических больных все больше признается как неотъемлемая часть лечения. Статус курения, его анамнез, включая способы потребления табака, должны быть тщательно изучены, а отказ от курения должен быть принят во внимание при разработке планов лечения. Рассмотренные в статье примеры и механизмы фармакокинетического взаимодействия могут позволить врачам проводить соответствующий мониторинг для индивидуализации дозирования. Учитывая, что курение приводит к ускоренному клиренсу противоопухолевых препаратов, можно предположить, что у курильщиков (включая тех, кто недавно бросил курить) увеличение суточной дозы лекарства позволит достичь желаемого терапевтического эффекта. Однако для подтверждения этой гипотезы необходимы проспективные исследования, сравнивающие результаты лечения онкологических больных в зависимости от статуса курения и применяемой дозы препарата.
Однако для подтверждения этой гипотезы необходимы проспективные исследования, сравнивающие результаты лечения онкологических больных в зависимости от статуса курения и применяемой дозы препарата.
Больному же на каждой консультации или госпитализации необходимо разъяснять потенциальные риски и прогнозы лечения при продолжении потребления табака. При составлении плана терапии также рекомендовано проводить тест на определение степени никотиновой зависимости, так называемый тест Фагерстрема, и тест для оценки готовности бросить курить. В зависимости от их результатов выстраивается тактика лечащего врача по практическим способам прекращения табакокурения на основе краткого индивидуального консультирования по общепринятой схеме 5 «С», «стратегического» консультирования для готовых бросить курить либо мотивационного консультирования по схеме 5 «П» для не совсем готовых бросить курить).
Для пациентов с низкой мотивацией к отказу от курения на первом этапе возможен переход на СНТ – альтернативные продукты доставки никотина, но с меньшим содержанием токсичных веществ в выделяемом аэрозоле за счет отсутствия процесса горения, характерного для традиционных сигарет. Такой подход особенно актуален для курильщиков, отягощенных наличием онкологической и другой патологией.
Такой подход особенно актуален для курильщиков, отягощенных наличием онкологической и другой патологией.
КОНФЛИКТ ИНТЕРЕСОВ. Автор статьи подтвердил отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
- WHO report on the global tobacco epidemic 2021: addressing new and emerging products. URL: https://www.who.int/publications/i/item/9789240032095
- Pfeifer G. P., Denissenko M. F., Olivier M., Tretyakova N., Hecht S. S., Hainaut P. Tobacco smoke carcinogens, DNA damage and p53 mutations in smoking-associated cancers // Oncogene. 2002. 21(48):7435-51.
- Khuder S. A., Dayal H. H., Mutgi A. B., Willey J. C., Dayal G. Effect of cigarette smoking on major histological types of lung cancer in men // Lung Cancer. 1998;22(1):15-21.
- Videtic G. M., Stitt L. W., Dar A. R., Kocha W. I., Tomiak A. T., Truong P. T.
 , Vincent M. D., Yu E. W. Continued cigarette smoking by patients receiving concurrent chemoradiotherapy for limited-stage small-cell lung cancer is associated with decreased survival // J Clin Oncol 2003;21:1544-9.
, Vincent M. D., Yu E. W. Continued cigarette smoking by patients receiving concurrent chemoradiotherapy for limited-stage small-cell lung cancer is associated with decreased survival // J Clin Oncol 2003;21:1544-9. - Zevin S., Benowitz N. L. Drug interactions with tobacco smoking. An update // Clin Pharmacokinet 1999;36:425-38.
- Kushinsky R., Louis C. J. The effect of cigarette smoke on aryl hydrocarbon hydroxylase activity and cytochrome P450 content in rat liver and lung microsomes // Oncology. 1976; 33:197–200.
- Veyrat-Follet C., Bruno R., Olivares R., Rhodes G. R., Chaikin P. Clinical trial simulation of docetaxel in patients with cancer as a tool for dosage optimization // Clin. Pharmacol. Ther. 2000;68:677–687.
- de Graan A. J., Loos W. J., Friberg L. E., Baker S. D., van der Bol J. M., van Doorn L., Wiemer E. A., van der Holt B., Verweij J., Mathijssen R. H. Influence of smoking on the pharmacokinetics and toxicity profiles of taxane therapy // Clin Cancer Res.
 2012;18(16):4425-32.
2012;18(16):4425-32. - Dumez H., Guetens G., De Boeck G., Highley M. S., de Bruijn E. A., van Oosterom A. T., Maes R. A. In vitro partition of irinotecan (CPT-11) in human volunteer blood: the influence of concentration, gender and smoking // Anticancer Drugs 2005;16:893–895.
- van der Bol J. M., Mathijssen R. H., Loos W. J., Friberg L. E., van Schaik R. H., de Jonge M. J., Planting A. S., Verweij J., Sparreboom A., de Jong F. A. Cigarette smoking and irinotecan treatment: pharmacokinetic interaction and effects on neutropenia // J Clin Oncol. 2007;25(19):2719-26.
- Kanai M., Morita S., Matsumoto S., Nishimura T., Hatano E., Yazumi S., Sasaki T., Yasuda H., Kitano T., Misawa A., Ishiguro H., Yanagihara K., Ikai I., Doi R., Fukushima M. A. A history of smoking is inversely correlated with the incidence of gemcitabine-induced neutropenia // Ann Oncol. 2009;20(8):1397-401.
- Xu J., Huang H., Pan C., Zhang B., Liu X., Zhang L. Nicotine inhibits apoptosis induced by cisplatin in human oral cancer cells // Int J Oral Maxillofac Surg.
 2007 Aug;36(8):739-44.
2007 Aug;36(8):739-44. - van Erp N., Gelderblom H., van Glabbeke M., Van Oosterom A., Verweij J., Guchelaar H. J., Debiec-Rychter M., Peng B., Blay J. Y., Judson I. Effect of cigarette smoking on imatinib in patients in the soft tissue and bone sarcoma group of the EORTC // Clin Cancer Res. 2008;14:8308–8313.
- Delbaldo C., Chatelut E., Ré M., Deroussent A., Séronie-Vivien S., Jambu A., Berthaud P., Le Cesne A., Blay J. Y., Vassal G. Pharmacokinetic-pharmacodynamic relationships of imatinib and its main metabolite in patients with advanced gastrointestinal stromal tumors // Clin Cancer Res. 2006; 12:6073–6078.
- Hamilton M., Wolf J. L., Rusk J., Beard S. E., Clark G. M., Witt K., Cagnoni P. J. Effects of smoking on the pharmacokinetics of erlotinib // Clin Cancer Res. 2006 Apr 1;12(7 Pt 1):2166-71.
- Hughes A. N., O’Brien M. E., Petty W. J., Chick J. B., Rankin E., Woll P. J., Dunlop D., Nicolson M., Boinpally R., Wolf J., Price A.
 Overcoming CYP1A1/1A2 mediated induction of metabolism by escalating erlotinib dose in current smokers // J Clin Oncol. 2009 Mar 10;27(8):1220-6.
Overcoming CYP1A1/1A2 mediated induction of metabolism by escalating erlotinib dose in current smokers // J Clin Oncol. 2009 Mar 10;27(8):1220-6. - Burris J. L., Borger T. N., Shelton B. J., Darville A. K., Studts J. L., Valentino J., Blair C., Davis D. B., Scales J. Tobacco Use and Tobacco Treatment Referral Response of Patients With Cancer: Implementation Outcomes at a National Cancer Institute-Designated Cancer Center // JCO Oncol Pract. 2021 Jun 29:OP2001095.
- Drope J., Cahn Z., Kennedy R., Liber A. C., Stoklosa M., Henson R., Douglas C. E., Drope J. Key issues surrounding the health impacts of electronic nicotine delivery systems (ENDS) and other sources of nicotine // CA Cancer J Clin. 2017 Nov;67(6):449-471.
- Bentley M.C., Almstetter M., Arndt D., Knorr A., Martin E., Pospisil P., Maeder S. Comprehensive chemical characterization of the aerosol generated by a heated tobacco product by untargeted screening // Anal Bioanal Chem. 2020;412(11):2675-2685.

- Haziza C., de La Bourdonnaye G., Merlet S., Benzimra M., Ancerewicz J., Donelli A., Baker G., Picavet P., Lüdicke F. Assessment of the reduction in levels of exposure to harmful and potentially harmful constituents in Japanese subjects using a novel tobacco heating system compared with conventional cigarettes and smoking abstinence: A randomized controlled study in confinement // Regul Toxicol Pharmacol. 2016;81:489-499.
- Lüdicke F., Picavet P., Baker G., Haziza C., Poux V., Lama N., Weitkunat R. Effects of Switching to the Tobacco Heating System 2.2 Menthol, Smoking Abstinence, or Continued Cigarette Smoking on Biomarkers of Exposure: A Randomized, Controlled, Open-Label, Multicenter Study in Sequential Confinement and Ambulatory Settings (Part 1) // Nicotine Tob Res. 2018;20(2):161-172.
- Yuan J. M., Butler L. M., Stepanov I., Hecht S. S. Urinary tobacco smoke-constituent biomarkers for assessing risk of lung cancer // Cancer Res. 2014;74(2):401-11.

Е. А. Дегтярёва, аспирант
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Контактная информация: [email protected]
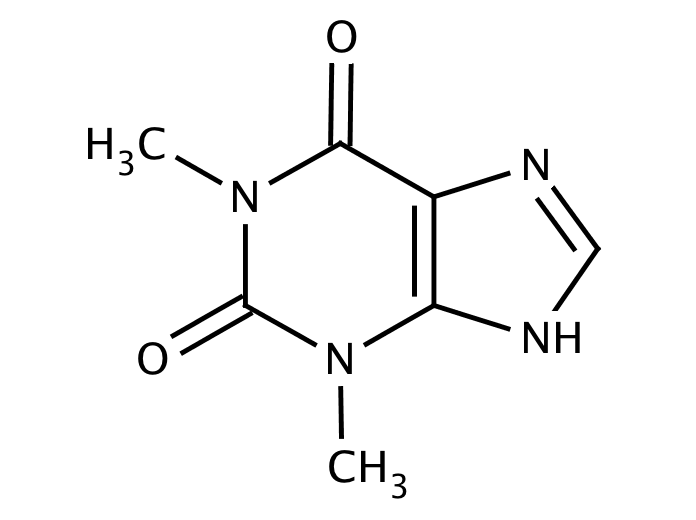
Влияние курения на выделение теофиллина
. 1976 г., май; 19 (5, часть 1): 546–51.
doi: 10.1002/cpt1976195part1546.
С. Н. Хант, В. Дж. Юско, А. М. Юрчак
- PMID: 1277710
- DOI: 10.1002/cpt1976195part1546
С. Н. Хант и др. Клин Фармакол Тер. 1976 май.
. 1976 г., май; 19 (5, часть 1): 546–51.
1976 г., май; 19 (5, часть 1): 546–51.
doi: 10.1002/cpt1976195part1546.
Авторы
С. Н. Хант, В. Дж. Юшко, А. М. Юрчак
- PMID: 1277710
- DOI: 10.1002/cpt1976195part1546
Абстрактный
Фармакокинетику теофиллина исследовали в группе некурящих и заядлых курильщиков (1–2 пачки в день) до и через 3–4 мес после прекращения курения сигарет. Период полувыведения теофиллина у курильщиков в среднем составлял 4,3 часа (SD = 1,4), что значительно короче среднего значения у некурящих (7,0, SD = 1,7 часа). Кажущийся объем распределения теофиллина был несколько больше у курильщиков (0,50 ± 0,12 л/кг), чем у некурящих (0,38 ± 0,04 л/кг). Клиренс теофиллина из организма был значительно выше и относительно более изменчив у курильщиков (100 ± 44 мл/мин/1,73 м2), чем у некурящих (45 ± 13 мл/мин/1,73 м2). Сывороточные концентрации тиоцианата, продукта биотрансформации цианида, который вдыхается с дымом, использовались для контроля статуса курения субъектов. Клиренс теофиллина из организма показал хорошую корреляцию (r = 0,785, p менее 0,001) с концентрацией тиоцианата в сыворотке. Из 8 курильщиков только 4 удалось воздержаться от курения в течение как минимум 3 месяцев, и у этих субъектов не было обнаружено значительных изменений в элиминации теофиллина. Увеличение клиренса теофиллина, вызванное курением, вероятно, является результатом индукции ферментов, метаболизирующих лекарственные средства, которые не сразу нормализуются после прекращения курения.
Клиренс теофиллина из организма был значительно выше и относительно более изменчив у курильщиков (100 ± 44 мл/мин/1,73 м2), чем у некурящих (45 ± 13 мл/мин/1,73 м2). Сывороточные концентрации тиоцианата, продукта биотрансформации цианида, который вдыхается с дымом, использовались для контроля статуса курения субъектов. Клиренс теофиллина из организма показал хорошую корреляцию (r = 0,785, p менее 0,001) с концентрацией тиоцианата в сыворотке. Из 8 курильщиков только 4 удалось воздержаться от курения в течение как минимум 3 месяцев, и у этих субъектов не было обнаружено значительных изменений в элиминации теофиллина. Увеличение клиренса теофиллина, вызванное курением, вероятно, является результатом индукции ферментов, метаболизирующих лекарственные средства, которые не сразу нормализуются после прекращения курения.
Похожие статьи
Влияние курения сигарет и секса на распределение теофиллина.

Пауэлл Дж. Р., Тьерселин Дж. Ф., Возех С., Сансом Л., Ригельман С. Пауэлл Дж. Р. и соавт. Ам преподобный Респир Дис. 1977 г., июль; 116 (1): 17–23. doi: 10.1164/обр.1977.116.1.17. Ам преподобный Респир Дис. 1977. PMID: 879596
Курение сигарет и метаболизм теофиллина: эффекты циметидина.
Кьюсак Б.Дж., Доусон Г.В., Мерсер Г.Д., Вестал Р.Э. Кьюсак Б.Дж. и др. Клин Фармакол Тер. 1985 март; 37(3):330-6. doi: 10.1038/clpt.1985.48. Клин Фармакол Тер. 1985. PMID: 3971657
Усиленная биотрансформация теофиллина у курильщиков марихуаны и табака.
Юско В.Дж., Шентаг Дж.Дж., Кларк Дж.Х., Гарднер М., Юрчак А.М. Юско В.Дж. и соавт. Клин Фармакол Тер. 1978 окт; 24 (4): 405-10. Клин Фармакол Тер.
 1978.
PMID: 688731
1978.
PMID: 688731[Взаимодействие между курением и наркотиками].
Кимельский Р. Кимельский Р. Вид Лек. 1986 1 января; 39 (1): 31-4. Вид Лек. 1986 год. PMID: 3521099 Обзор. польский.
Влияние курения сигарет на метаболизм наркотиков у человека.
Юшко WJ. Юшко В.Дж. Препарат Метаб Ред. 1979;9(2):221-36. дои: 10.3109/03602537908993892. Препарат Метаб Рев. 1979. PMID: 385272 Обзор.
Посмотреть все похожие статьи
Цитируется
Терапевтический лекарственный мониторинг антипсихотических препаратов второго и третьего поколения — влияние курения и воспаления на фармакокинетику.

Мощный Н., Хефнер Г., Грохманн Р., Эккерманн Г., Майер Х.Б., Зайферт Дж., Хек Дж., Фрэнсис Ф., Блайх С., Тото С., Мейснер К. Мощный Н. и соавт. Фармацевтика (Базель). 2021 27 мая; 14 (6): 514. дои: 10.3390/ph24060514. Фармацевтика (Базель). 2021. PMID: 34071813 Бесплатная статья ЧВК. Обзор.
Ингибирование и индукция ферментов CYP у людей: обновление.
Хаккола Дж., Хукканен Дж., Турпейнен М., Пелконен О. Хаккола Дж. и др. Арх Токсикол. 2020 ноябрь;94(11):3671-3722. doi: 10.1007/s00204-020-02936-7. Epub 2020 27 октября. Арх Токсикол. 2020. PMID: 33111191 Бесплатная статья ЧВК. Обзор.
Использование низких доз перорального теофиллина в качестве дополнения к ингаляционным кортикостероидам для предотвращения обострений хронической обструктивной болезни легких: протокол исследования для рандомизированного контролируемого исследования.

Деверо Г., Коттон С., Барнс П., Бриггс А., Бернс Г., Чаудхури Р., Кристин Х., Дэвис Л., Де Сойза А., Филдинг С., Гомперц С., Хони Дж., Ли А.Дж., Маккормак К., Макферсон Г., Морис А. , Норри Дж., Салливан А., Уилсон А., Прайс Д. Деверо Г. и соавт. Испытания. 2015 10 июня; 16:267. doi: 10.1186/s13063-015-0782-2. Испытания. 2015. PMID: 26058585 Бесплатная статья ЧВК. Клиническое испытание.
Прогнозирование клиренса наркотиков у курильщиков: моделирование влияния переменного потребления сигарет на индукцию CYP1A2.
Plowchalk DR, Rowland Yeo K. Плаучалк Д.Р. и др. Eur J Clin Pharmacol. 2012 июнь; 68 (6): 951-60. doi: 10.1007/s00228-011-1189-y. Epub 2012 19 января. Eur J Clin Pharmacol. 2012. PMID: 22258279 Клиническое испытание.
Рофлумиласт: первый ингибитор фосфодиэстеразы 4, одобренный для лечения ХОБЛ.

Giembycz MA, Field SK. Giembycz MA, et al. Препарат Des Devel Ther. 2010 21 июля; 4: 147-58. дои: 10.2147/dddt.s7667. Препарат Des Devel Ther. 2010. PMID: 20689641 Бесплатная статья ЧВК. Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Теофиллиновые взаимодействия — The Pharmaceutical Journal
Альвеолы легких повреждаются эмфиземой, уменьшая площадь поверхности для газообмена и ограничивая поглощение кислорода 2014. Мы не рекомендуем вам принимать какие-либо клинические решения на основе этой информации, не убедившись сначала, что вы ознакомились с последними рекомендациями. Кейт Джонс — 50-летняя учительница. Она использовала ингаляторы сальбутамола и флутиказона/салметерола, а также теофиллин с модифицированным высвобождением перорально (400 мг два раза в день) для лечения эмфиземы, формы хронической обструктивной болезни легких (ХОБЛ), в течение нескольких лет. Она была заядлым курильщиком большую часть своей жизни и недавно решила бросить. Она спрашивает вашего совета о том, может ли она начать заместительную никотиновую терапию (НЗТ) во время приема теофиллина.
Она была заядлым курильщиком большую часть своей жизни и недавно решила бросить. Она спрашивает вашего совета о том, может ли она начать заместительную никотиновую терапию (НЗТ) во время приема теофиллина.
Теофиллин представляет собой производное ксантина, используемое при лечении астмы и стабильной ХОБЛ для расслабления гладкой мускулатуры бронхов. Имеет узкий терапевтический индекс; Концентрация теофиллина в сыворотке 10-20 мг/л необходима большинству пациентов, хотя некоторые могут счесть более низкие уровни теофиллина достаточными для контроля их симптомов.
Небольшое повышение концентрации в сыворотке крови может привести к токсичности, особенно у пациентов с концентрацией более 20 мг/л. Пациенты могут испытывать серьезные симптомы интоксикации, такие как судороги и аритмии, до появления таких симптомов, как тошнота и рвота.
Для перорального теофиллина в Британском национальном формуляре [1] указано, что концентрацию в сыворотке следует измерять через пять дней после начала терапии и не менее чем через три дня после каждой корректировки дозы. После установления поддерживающей дозы уровни теофиллина можно контролировать каждые 6–12 месяцев 9.0135 [2] .
После установления поддерживающей дозы уровни теофиллина можно контролировать каждые 6–12 месяцев 9.0135 [2] .
Важно, чтобы пациенты получали теофиллин с модифицированным высвобождением одной и той же марки на протяжении всего лечения. Это позволяет избежать ненужных изменений концентрации теофиллина в сыворотке из-за возможных различий в скорости абсорбции между различными брендами.
Симптомы отравления теофиллином
- Тошнота
- Рвота
- Раздражение желудка
- Диарея
- Сердцебиение
- Тахикардия
- Арритмии
- Головная боль
- Стимуляция центральной нервной системы
- Insomnia
- Конвульсии
. Метаболизм. Сэмпийл. Многие препараты взаимодействуют с теофиллином, подавляя или усиливая его метаболизм с помощью CYP1A2 (см. «Часто используемые препараты, взаимодействующие с теофиллином»). Индукция CYP1A2 приводит к более быстрому выведению теофиллина, что приводит к снижению и, скорее всего, к субтерапевтической концентрации теофиллина в сыворотке.

| Benzodiazepines | Theophylline appears to antagonise the sedative and anxiolytic effects of benzodiazepines |
| H 2 -receptor antagonists | Theophylline concentrations are increased by cimetidine, however, famotidine, nizatidine, and ranitidine do not appear взаимодействовать |
| Ципрофлоксацин | Ципрофлоксацин вызывает значительное повышение концентрации теофиллина |
| Эритромицин | Клиренс теофиллина может быть уменьшен с помощью эритромицина, а экспозиция эритромицина может быть уменьшена с помощью теофиллина |
| Левотироксин | Дисфункция щитовидной железы может незначительно влиять на потребность в теофиллине; сообщалось об отдельных случаях токсичности теофиллина у пациентов, получавших лечение от гипотиреоза |
| Метотрексат | Метотрексат снижает клиренс теофиллина, а теофиллин может снижать нейротоксичность, вызванную метотрексатом; существует вероятность того, что это может также снизить эффективность метотрексата |
| Фенитоин | Фенитоин увеличивает клиренс теофиллина, а теофиллин может также снижать концентрации в сыворотке |
 Сообщалось о более высоком клиренсе теофиллина у здоровых женщин в пременопаузе по сравнению со здоровыми мужчинами; считалось, что эта разница вызвана факторами, связанными с полом, в печеночном метаболизме3 [3][4] . Однако другое исследование показало, что пол не влияет на клиренс теофиллина [5] .
Сообщалось о более высоком клиренсе теофиллина у здоровых женщин в пременопаузе по сравнению со здоровыми мужчинами; считалось, что эта разница вызвана факторами, связанными с полом, в печеночном метаболизме3 [3][4] . Однако другое исследование показало, что пол не влияет на клиренс теофиллина [5] .Генетические различия в функции CYP1A2 также могут влиять на метаболизм теофиллина. В настоящее время неизвестно, в какой степени эти различия могут повлиять на метаболизм или долю пациентов, которые страдают.
Отказ от курения
Курильщикам, принимающим теофиллин, как правило, требуются более высокие дозы, чем некурящим, поскольку табачный дым содержит полициклические углеводороды, которые индуцируют CYP1A2. Таким образом, отказ от курения приведет к увеличению концентрации теофиллина в сыворотке крови и, возможно, к токсичности, если доза не будет снижена.
Если Кейт Джонс захочет бросить курить, ей необходимо будет наблюдать за изменениями концентрации теофиллина в сыворотке; всего через одну неделю может потребоваться снижение дозы на треть [6] . Кейт Джонс следует посоветовать обсудить свое желание бросить курить и то, как это повлияет на лечение теофиллином, со своим лечащим врачом, прежде чем назначить дату отказа от курения.
Кейт Джонс следует посоветовать обсудить свое желание бросить курить и то, как это повлияет на лечение теофиллином, со своим лечащим врачом, прежде чем назначить дату отказа от курения.
Поскольку именно полициклические углеводороды в табачном дыме, а не никотин, повышают клиренс теофиллина, НЗТ не повлияет на концентрацию теофиллина у миссис Джонс, и ее можно прописать или продать ей.
Бупропион или варениклин также могут быть назначены, чтобы помочь Кейт Джонс бросить курить. Однако бупропион имеет небольшой дозозависимый риск судорог. Производители бупропиона заявляют, что одновременное применение теофиллина может снизить судорожный порог, что еще больше увеличивает риск судорожных припадков у пациентов, и рекомендуют максимальную дозу бупропиона 150 мг в день [7] .
Флуконазол
Через месяц после начала попытки бросить курить Кейт Джонс возвращается и просит купить пероральный противогрибковый препарат без рецепта от симптомов вагинальной молочницы.
Вы рассматриваете возможность продажи Кейт флуконазола без рецепта.
Перекрестное исследование с участием пяти здоровых добровольцев показало, что прием флуконазола в дозе 100 мг каждые 12 часов в семи дозах вызывал 16% снижение клиренса однократной пероральной дозы 300 мг аминофиллина, что не было статистически значимым [8] . У девяти человек, принимавших флуконазол 400 мг один раз в день в течение 10 дней, клиренс однократной пероральной дозы теофиллина 6 мг/кг снизился на 13% [9] . Другое исследование с участием десяти здоровых добровольцев показало, что прием флуконазола в дозе 100 мг один раз в день в течение одной недели не влиял на концентрацию теофиллина в сыворотке крови в дозе 150 мг два раза в день9.0135 [10] . Однако в отчете об отдельном случае описано необъяснимое повышение концентрации теофиллина у пациента, принимавшего флуконазол. [11]
На основании этих исследований флуконазол не взаимодействует с теофиллином в клинически значимой степени. Однако возможно, что у пациентов, принимающих флуконазол, иногда могут возникать изменения концентрации теофиллина. Таким образом, при возникновении любого необъяснимого снижения эффективности теофиллина или усиления побочных эффектов, связанных с теофиллином (например, головной боли, тошноты или тремора), следует учитывать взаимодействие, и следует соответствующим образом контролировать концентрацию теофиллина.
Однако возможно, что у пациентов, принимающих флуконазол, иногда могут возникать изменения концентрации теофиллина. Таким образом, при возникновении любого необъяснимого снижения эффективности теофиллина или усиления побочных эффектов, связанных с теофиллином (например, головной боли, тошноты или тремора), следует учитывать взаимодействие, и следует соответствующим образом контролировать концентрацию теофиллина.
В случае г-жи Джонс клинически значимое взаимодействие маловероятно при однократном пероральном приеме 150 мг флуконазола, и ей можно продать капсулу после соответствующего консультирования.
Зверобой
Через несколько месяцев Кейт Джонс возвращается в аптеку за советом. Она чувствует себя довольно подавленной после внезапной смерти матери и беспокоится о предстоящих похоронах. Она спрашивает, может ли она принимать зверобой, который, как она надеется, не должен быть проблемой, поскольку это «натуральное» лекарство. Большинство клинически значимых взаимодействий с зверобоем, о которых сообщалось, опосредуются CYP3A412 [12] , из которых зверобой является умеренным индуктором. Метаболизм теофиллина этим изоферментом не известен.
Метаболизм теофиллина этим изоферментом не известен.
В одном отчете об отдельном случае описано значительное снижение концентрации теофиллина в сыворотке у человека, принимающего зверобой продырявленный 300 мг один раз в день с теофиллином 300 мг два раза в день [13] . Однако в исследовании с участием 12 здоровых людей, принимавших зверобой продырявленный по 300 мг три раза в день с однократной пероральной дозой 400 мг теофиллина 9, не было отмечено фармакокинетического взаимодействия.0135 [14] , а механистические исследования предполагают умеренное взаимодействие не более [15] .
В 2000 году Комитет по безопасности лекарственных средств рекомендовал пациентам, принимающим теофиллин, избегать приема зверобоя продырявленного и прекратить прием зверобоя, а дозу теофиллина контролировать и при необходимости корректировать для пациентов, уже принимающих комбинацию [17][]. 16] . Однако это руководство было выпущено до проведения фармакокинетического исследования, которое предполагает, что взаимодействие в целом маловероятно.
До получения дополнительных данных, подтверждающих отсутствие взаимодействия, следует рассмотреть возможность взаимодействия в случае развития побочных эффектов теофиллина.
Вы должны сообщить миссис Джонс, что, хотя взаимодействие обычно не ожидается, если она решит принимать зверобой продырявленный, ей следует проявлять бдительность в отношении любого увеличения побочных эффектов от теофиллина. Вам следует посоветовать ей обратиться к своему терапевту, если ее плохое настроение сохраняется.
СИОЗС
Через несколько недель вам звонит врач общей практики Кейт Джонс, который объясняет, что решил начать прием селективного ингибитора обратного захвата серотонина (СИОЗС) в сочетании с когнитивно-поведенческой терапией (КПТ).
Обычно он выбирает флуоксетин или или циталопрам, но, поскольку она принимает теофиллин , он хотел бы знать, какой из двух вариантов будет наиболее подходящим.
Исследование с участием 13 здоровых субъектов, принимавших перорально теофиллин с циталопрамом [18] , и исследование с участием восьми здоровых субъектов, принимавших аминофиллин внутривенно с флуоксетином [19] , не выявили каких-либо изменений фармакокинетики теофиллина. Было показано, что циталопрам и флуоксетин лишь слабо ингибируют CYP1A2 in vitro . Следовательно, ожидается, что ни один из препаратов не будет взаимодействовать с теофиллином.
Было показано, что циталопрам и флуоксетин лишь слабо ингибируют CYP1A2 in vitro . Следовательно, ожидается, что ни один из препаратов не будет взаимодействовать с теофиллином.
Однако может существовать риск удлинения интервала QT при одновременном применении теофиллина и циталопрама, поскольку было замечено, что циталопрам вызывает дозозависимое увеличение интервала QTcF. Хотя производители флуоксетина заявляют, что имеются постмаркетинговые отчеты об удлинении интервала QT, исследований препаратов, удлиняющих интервал QT, не проводилось [20] . Пожилые пациенты, особенно женщины, а также пациенты с заболеваниями сердца и некоторыми метаболическими нарушениями предрасположены к удлинению интервала QT, что может привести к аритмии типа torsades de pointes.
Хотя сами по себе ксантены не удлиняют интервал QT, в избыточных дозах они могут снижать концентрацию калия в сыворотке крови, что может усиливать эффект удлинения интервала QT циталопрама.
В этом случае вы можете сообщить лечащему врачу миссис Джонс, что она может принимать либо СИОЗС с теофиллином; однако ему следует контролировать уровень калия, если он решит назначить циталопрам.
Ссылки
- Объединенный формулярный комитет. Британский национальный формуляр. 67-е изд. Лондон: BMJ Group and Pharmaceutical Press, 2014.
- Sweetman SC. Мартиндейл: полный справочник по наркотикам. 38-е изд. Лондон: Фармацевтическая пресса. 2011.
- Нафцигер А.Н. и Бертино Дж.С. Половые различия в фармакокинетике теофиллина. Eur J Clin Pharmacol:1989;37:97–100.
- Дженнингс Т.С., Нафцигер А.Н., Дэвидсон Л. и др. Гендерные различия в печеночной индукции и ингибировании фармакокинетики и метаболизма теофиллина. J Lab Clin Мед: 1993;122:208–216.
- Пауэлл Дж. Р., Тьерселин Дж. Ф., Возех С. и др. Влияние курения сигарет и секса на распределение теофиллина. Am Rev Respir Dis: 1977; 116: 17–23.
- Ли Б.Л., Беновиц Н.Л. и Джейкоб П. Воздержание от сигарет, никотиновая жевательная резинка и расположение теофиллина. Энн Стажер Мед: 1987; 106: 553–5.
- Зибан (бупропиона гидрохлорид). ГлаксоСмитКляйн. Сводка характеристик продукта для Великобритании.
 Ноябрь 2013 г.
Ноябрь 2013 г. - Кониши Х., Морита К. и Ямаджи А. Влияние флуконазола на распределение теофиллина у людей. EUR J Clin Pharmacol: 1994;46:309–12.
- Фойзи М.М., Никс Д., Миддлтон Э. и др. Влияние однократной дозы флуконазола (SD FLU) по сравнению с многократными дозами флуконазола (MD FLU) на фармакокинетику (PK) теофиллина (THL) у молодых здоровых добровольцев. Intersci Conf Antimicrob Agents Chemother: 1995; 39: 7.
- Фейл Р.А., Риндон Дж.П., Моррилл Г.Б. и др. Влияние низких доз флуконазола на концентрацию теофиллина в сыворотке крови у здоровых добровольцев. J Pharm Technol 1995;11:267–269.
- Тетт С., Кэри Д. и Ли Х-С. Лекарственные взаимодействия с флуконазолом. Мед J авг 1992;156:365.
- Ван З., Горски Дж. К., Хамман М. А. и др. Влияние зверобоя продырявленного (Hypericum perforatum) на активность цитохрома Р450 человека. Clin Pharmacol Ther 2001;70:317–326.
- Моримото Т., Котегава Т., Цуцуми К. и др. Влияние зверобоя на фармакокинетику теофиллина у здоровых добровольцев.

