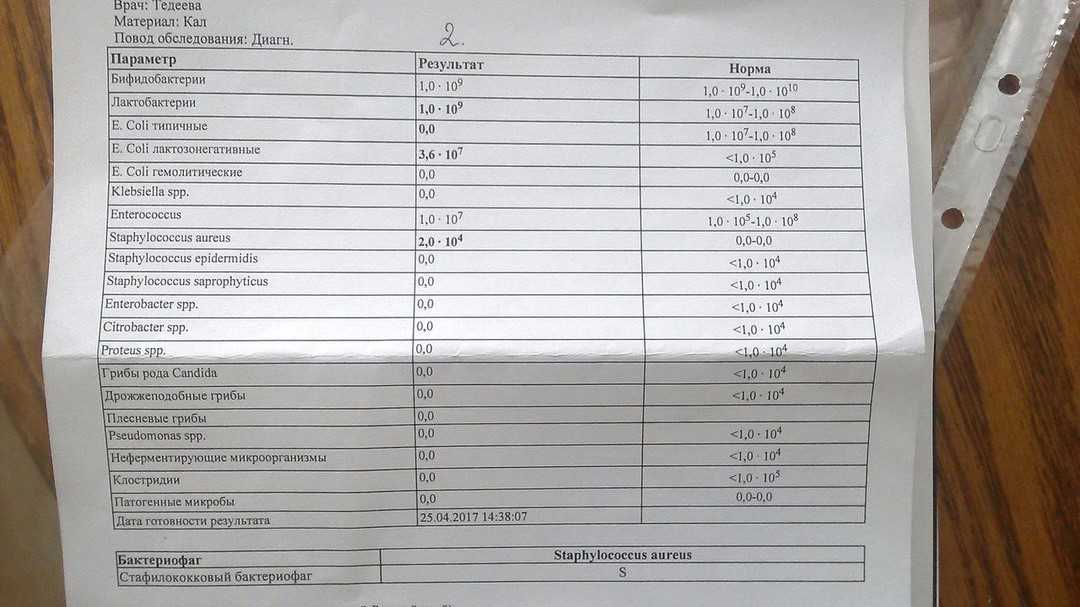
клебсиелла пневмония в кале — 25 рекомендаций на Babyblog.ru
страшная сказка о стуле и стафиллококке у ребенка.
Страшная сказка о стафилококке. Возвращаясь к той же теме.
Сколько бы я ни отвечала, сколько бы ни говорила о том, что наличие стафилококка и клиника стафилококковой инфекции – это не одно и тоже, поток вопросов не становится меньше. Многие наши участковые врачи толи от нежелания искать истинную причину, толи от незнания понятий о микробиологии – списывают сыпи, аллергии, дерматиты, жидкие и(ли) зеленые стулы, запоры, поносы, икоты, рвоты, нарушение сна, аппетита, поведения, развития (нужное из представленного подчеркнуть) – загадочным и в тоже время всеобъемлющим диагнозом «ДИСБАКТЕРИОЗ». И начинают пичкать несчастные маленькие создания тоннами препаратов начиная от пробиотиков кончая кишечными антисептиками. В лучшем случае – толку нет, в худшем прибавляются новые напасти. И о боже!!!! В стуле высеян стафилококк!!!
Тут же строчатся в форум вопросы: «У нас стафиллококк в носу, в зеве, в попе (выберите нужное сами)! что же нам делать!?». И мамы делают круглые глаза и крутят у виска, когда я им говорю – «ну и что? Ничего не делать». Вы спросите почему? Да потому что сам по себе стафилококк никакой опасности для вашего малыша не представляет. Особенно это касается тех детей, которых мамы кормят грудью. Объясню популярно.
И мамы делают круглые глаза и крутят у виска, когда я им говорю – «ну и что? Ничего не делать». Вы спросите почему? Да потому что сам по себе стафилококк никакой опасности для вашего малыша не представляет. Особенно это касается тех детей, которых мамы кормят грудью. Объясню популярно.
В период внутриутробного развития желудочно-кишечный тракт (ЖКТ) плода стерилен. Там нет никаких бактерий и других микроорганизмов. Когда ребенок рождается, ЖКТ заселяется, или колонизируется, бактериями, которые попадают ему в рот во время прохождения через родовые пути матери. Бактерии могут также попасть ребенку из материнского стула во время родов. Именно так создается нормальная и здоровая микрофлора кишечника. После рождения ЖКТ ребенка заселяется бактериями, которые находятся в окружающей среде, во рту и на коже матери. Это происходит во время кормления грудью, при поцелуях и прикосновениях к ребенку.
Стафилококки являются очень распространенными микробами, и мы знакомимся с ними буквально с рождения. Стафилококки (особенно S. epidermidis) представляют собой представителей нормальной микрофлоры кожного покрова человека, дыхательных путей и тракта пищеварения; их также регулярно находят в воздухе и окружающей среде.
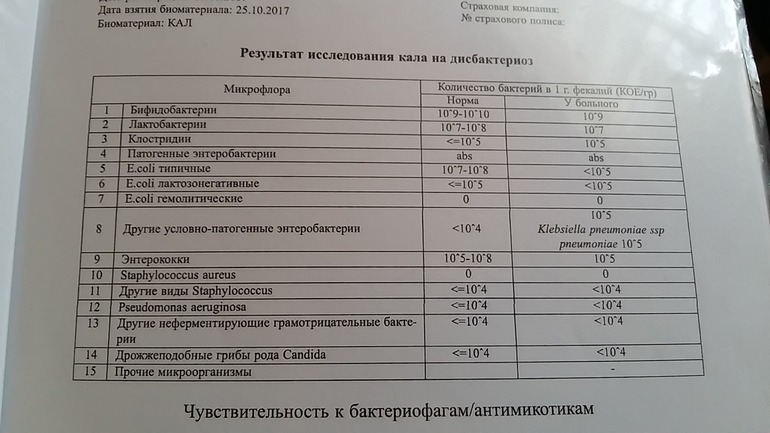
Стафилококки (особенно S. epidermidis) представляют собой представителей нормальной микрофлоры кожного покрова человека, дыхательных путей и тракта пищеварения; их также регулярно находят в воздухе и окружающей среде.
Здоровая мама – здоровый малыш. При появлении на свет бактерии начинают проникать в организм новорожденного: в кишечник, желудок, на кожу, это нормальный процесс – происходит адаптация малыша к окружающей среде. Если сама мама здорова, беременность и роды прошли гладко, значит, у ребенка флора будет в норме. Соответственно – при первом же контакте ребенка с окружающей средой его организм (в том числе и кишечник с носоглоткой – откуда и высевают их потом особо желающие лечиться товарищи) начинает знакомство с этим микробом. Соответственно иммунная система вырабатывает антитела, препятствующие размножению стафилококка и сдерживает его активацию. А если ребенок грудничок, тогда он защищен вдвойне, потому как на помощь собственным антителам спешат антитела, которые выработала мама и передает малышку со своим молочком. Отсюда какой напрашивается вывод, а??? Самое лучшее средство борьбы и профилактика стафилококковой инфекции это грудное вскармливание. В принципе и искусственники могут спокойно сосуществовать с стафилококками, при условии правильно организованного питания и ухода. Потому кА иммунная система ребенка начинает работать с самого его рождения и борьбу со всеми условно-патогенными микробами ведет постоянно.
Отсюда какой напрашивается вывод, а??? Самое лучшее средство борьбы и профилактика стафилококковой инфекции это грудное вскармливание. В принципе и искусственники могут спокойно сосуществовать с стафилококками, при условии правильно организованного питания и ухода. Потому кА иммунная система ребенка начинает работать с самого его рождения и борьбу со всеми условно-патогенными микробами ведет постоянно.
Так и живут они мирно и дружно – стафилококк и организм – и будут жить и далее, если им не мешать своими якобы лечебными мерами и ковыряниями в какашках абсолютно нормального ребенка.
Лечат стафилококковую инфекцию, а не стафилококк (в частности). Очень (!) важно – всегда следует разграничивать такие понятия, как стафилококк и стафилококковая инфекция (о ней речь пойдет в конце моего повествования). Обнаружение стафилококка при отсутствии реальных симптомов болезни – вовсе не повод к незамедлительному глотанию лекарств.
Дорогие мои родители – стафилококковая инфекция очень отличается по клинике от того, что лечите вы. Наличие бумажки с написанными в ней стафилококками в какой-то степени и зеленые каки в памперсе малыша не повод к активным боевым действиям. Факторов влияющих на стул малыша и на его изменение много.
Наличие бумажки с написанными в ней стафилококками в какой-то степени и зеленые каки в памперсе малыша не повод к активным боевым действиям. Факторов влияющих на стул малыша и на его изменение много.
Многие микроорганизмы (в том числе и золотистый стафилококк) в норме живут на различных участках тела человека (включая и маленького ребенка). Это кишечник, кожа, рот, нос, глотка, уши, слизистая глаз. И инфекции не вызывают. Их и называют — нормальная микрофлора. Но попав в несоответствующие условия, они могут вызвать заболевание. Стафилококк, попадая например в рану, может вызвать нагноение. Поэтому эти микроорганизмы названы условно-патогенными. Эти микробы не приносят в норме вреда, так как живут в сообществе других микроорганизмов и там все друг друга взаимно сдерживают.
Стафилококк в кале? Не паниковать!
Стафилококк в кишечнике – это нормально, если нет клинических тревожных (температура, гнойники на коже, стул с кровью) проявлений. Ребенок прекрасно сосет грудь, у него нормальный стул, он хорошо прибавляет в весе, в таком случае вмешиваться в естественный процесс не надо! Индивидуальный уровень флоры желудочно-кишечного тракта у каждого человека свой.
Носительство стафилококка — совершенно обычное явление и не является показанием для какого-либо лечения. Посевы со слизистой оболочки носа и зева с последующим определением чувствительности микрофлоры к антибиотикам чаще всего влекут за собой необоснованное назначение антибиотиков и прочих препаратов. Санация при носительстве золотистого стафилококка не показана.
Носительство стафилококка на слизистых не может быть причиной ни температуры, ни головных болей, ни тошноты и рвоты, ни запора, ни вздутия живота и колик, а соответственно и плача ребенка. Следовательно, нужно искать причину, а не лечить несчастный, ни в чем не повинный стафилококк.
А что же тогда считать нормальным стулом? Там же в памперсе такие ужасы!!!
Вот и разберем ваши основные ужасы (хотя нормам стула я уже посвятила целую статью «Стул у ребенка» Но видно не все ее прочитали.
Итак объясняю популярно.
Ребенок на ГВ имеет право на любой стул. Это означает, что цвет какашек должен волновать маму в последнюю очередь, если малыш спокоен, весел, развивается и растет нормально, прибавляет в весе более 500 г в первые месяцы.
Кстати стул грудного ребенка очень сильно меняться в первые месяцы жизни (обратите внимание, что речь идет пока только о стуле ребенка который находится полностью на ГВ. На СВ, и тем более на ИВ все иначе, потому как даже допаивание водой может повлиять на стул).
С рождения до 2-3 дней выделяется меконий (первородный кал), густой, черно-зеленый, от 2 до 4 раз в сутки. Но обычно это бывает в роддоме и мамы по этому поводу не переживают – им пока еще не до копания в какашках малыша, пока еще не прошла эйфория от родов и встречи с долгожданным чадушкой (ну по крайней мере так было у меня!).
В первые три дня после рождения число опорожнений кишечника должно соответствовать возрасту ребенка – в первые сутки ребенок должен опорожнить кишечник один раз, на вторые сутки – два, на третьи – три. После прихода молока грудной ребенок опорожняет кишечник минимум 3-4 раза в сутки, и количество стула довольно значительное. Большинство грудных детей опорожняют кишечник намного чаще, нередко после каждого кормления. Даже неопытная мама без труда распознает радостный залп похода в туалет у грудничка – его невозможно не услышать и пропустить.
Даже неопытная мама без труда распознает радостный залп похода в туалет у грудничка – его невозможно не услышать и пропустить.
С 2-3 дней до 4-6 недель ребенок может ходить больше 4 раз в сутки, каждый раз — чуть более ложечки, обычно консистенция мягкая или жидкая, цвет горчичный, запах обычно сладкий, молочный, но может быть кислый, возможны вкрапления свернутого молока, что говорит о том, что малыш получает достаточно молока. И даже с избытком, который и выводится виде створоженных крошек. Допускаются пропукивания с водичкой, неоднородность в самих какашках.
По мере взросления, в районе 6 недель от рождения или чуть раньше, многие грудные дети переходят на более редкий режим дефекации – от раза в несколько дней до раза в неделю или даже реже. При этом отсутствуют признаки запора (то есть сухой, твердый стул) – стул ребенка по прежнему неоформленный, пюреобразный. Поэтому не нужно лезть к ребенку с клизмами и прочими средствами «помощи».
Характерно, что у новорожденных и детей грудного возраста с калом выделяется неизмененный билирубин, в связи с чем испражнения имеют характерный зеленоватый цвет. Обычно цвет меняется при соприкосновении билирубина с воздухом. То есть малыш покакал, а вы сменили памперс не сразу, а спустя немного времени – тогда как раз и получите романтично-зеленые (которые и приводят многих мам в ужас) какашки. Если ребенка они не беспокоят – а чаще всего именно так и есть, спокойно выкиньте памперс и забудьте о нем.
Обычно цвет меняется при соприкосновении билирубина с воздухом. То есть малыш покакал, а вы сменили памперс не сразу, а спустя немного времени – тогда как раз и получите романтично-зеленые (которые и приводят многих мам в ужас) какашки. Если ребенка они не беспокоят – а чаще всего именно так и есть, спокойно выкиньте памперс и забудьте о нем.
Реакция на билирубин остается положительной до 4-5-месячного возраста, затем параллельно с билирубином начинает определяться стеркобилин (он то и придает фекалиям их цвет) в результате восстанавливающего действия нормальной бактериальной флоры толстой кишки. К 6-8 месячному возрасту в кале определяется только стеркобилин – поэтому к этому времени обычно и зелень с якобы имеющимися в ней стафилококками проходит. И, о чудо, мама ликует – мы вылечили дисбактериоз, а его и не было, это просто возрастные нормы.
Зеленый стул с пеной или слизью — может быть связан с переменой погоды, активным заселением флоры кишечника в первые недели жизни, болезнью мамы, диетой мамы. Не всегда это патология и не стоит сразу бежать на анализы.
Не всегда это патология и не стоит сразу бежать на анализы.
А пенистый стул, оказывается, свидетельствует о бродильной дисперсии, связанная с чрезмерным употреблением в пищу углеводов (сахара, меда, мучных продуктов, фруктов, винограда, гороха, бобов, капусты и т. д.), но грудничок ведь грудное молоко только пьет, а значит пенистый стул связан с питанием мамы и маме нужно убрать из своего рациона именно эти продукты.
Второй вариант пенистого стула – это дисбаланс переднего и заднего молока. Если малыш получает только переднее молоко, богатое лактозой, то его стул может пениться. Возникает это потому, что в первые недели жизни имеется относительный недостаток фермента лактазы, которая расщепляет эту самую лактозу (молочный сахар). При избытке молочного сахара(при питании передним молоком) лактазы для расщепления не хватает, и сахар попадает в толстый кишечник, где его расщепляют кишечные бактерии с образованием избытка газиков – поэтому получается пена. И стафилококки с клебсиеллами тут не причем.
После установления у мамы активной лактации у младенца появляется «зрелый» стул, который сохранится до введения прикорма или докорма. Он представляет собой однородную желтую кашицу консистенции негустой сметаны с запахом кислого молока. Такой стул свидетельствует о хорошем переваривании материнского молока. Что касается нормальной частоты стула, большинство новорожденных опорожняют кишечник чуть ли не после каждого кормления, то есть число дефекаций в сутки может достигать 5-8, а иногда даже 10.
Как вариант нормы, рассматривается состояние, когда материнское молоко настолько полностью переваривается, что практически ничего в кишечнике не остается, и опорожнение кишечника может происходить 1 раз в несколько дней, иногда даже 1 раз в неделю. Нормой подобное состояние может считаться на фоне полностью грудного вскармливания (исключительно, даже вода не дается, и плантексы, травки-муравки тоже) и при условии хорошего самочувствия малыша (нормальном поведении, отсутствии болей в животе и значительного натуживания при дефекации). Как правило, такая особенность развивается у некоторых грудничков не ранее 3 месяцев жизни.
Как правило, такая особенность развивается у некоторых грудничков не ранее 3 месяцев жизни.
Кстати, тужиться, сучить ножками, кряхтеть, краснеть и даже плакать при акте дефекации малыш вполне может и это не патология (ну если конечно стул у него не как орехи или козьи какашки). Просто акт дефекации для малыша – это тоже труд, на него он затрачивает усилия. Чтобы покакать малышку нужно создать в просвете прямой кишки определенное давление. И только это будет способствовать расслаблению мышц ануса и победному залпу! И не нужно при натуживании малыша хватать его вместе с какашками и нестись их сдавать. Это нормальное поведение!
Прикорм. Введение любой другой пищи помимо грудного молока приведет к изменению консистенции, цвета и запаха стула у грудного ребенка. Если вы начали вводить прикорм, стул начнет становиться более оформленным, в стуле можно будет заметить кусочки пищи, которую вы даете ребенку. И кстати цвет тоже зависит от того, какую пищу ест ребенок – в принципе, что съели, то и вышло. До полного переваривания пищи у малыша пока говорить еще рано. Так что введенное мамой пюре может и выйти почти неизменной кучкой, и это не страшно.
До полного переваривания пищи у малыша пока говорить еще рано. Так что введенное мамой пюре может и выйти почти неизменной кучкой, и это не страшно.
Кстати, нормы детей на грудном вскармливании значительно отличаются от показателей и детей на смешанном и искусственном вскармливании. Например, флора кишечника младенца на искусственном вскармливании уже в 2 недели почти не отличается от взрослого человека. У детей на искусственном вскармливании более редкая дефекация, а также более оформленный стул с заметным типичным запахом.
При искусственном вскармливании стул может быть таким же, как и при естественном, или иметь более густую консистенцию и более темную, коричневатую, окраску. Дефекация обязательно должна происходить не реже 1 раза в сутки (ну максимум раз в двое суток), все прочее считается запором. Число испражнений в течение первого полугодия обычно 3-4 раза в день, а во втором полугодии – 1-2 раза в день. Количество кала 30-40 г в сутки. При искусственном и смешанном вскармливании в связи с преобладанием процессов гниения в кале много кишечной палочки, бродильная флора (бифидофлора, молочнокислые палочки) имеется в меньшем количестве.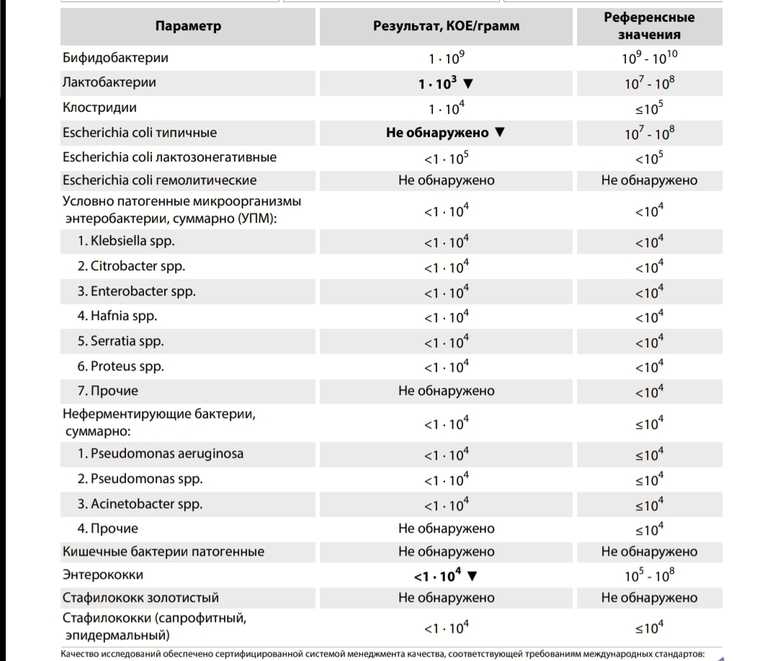 Небольшому количеству слизи не стоит придавать значения, как и небольшим белесоватым крошкам, показывающим только, что молоко содержит излишек жира, который ребенок не успевает переварить.
Небольшому количеству слизи не стоит придавать значения, как и небольшим белесоватым крошкам, показывающим только, что молоко содержит излишек жира, который ребенок не успевает переварить.
Содержимое подгузника, на которое следует обратить внимание.
Отклонения от нормы частоты и внешнего вида стула не всегда означает, что ребенок обязательно чем-то болен. Однако, стул ребенка может быть полезным признаком достаточности питания или симптомом аллергии. В таких случаях изменение способа кормления или устранения аллергена – все что требуется для решения проблемы.
Частый, водянистый, зеленый и/или пенистый стул, примесь слизи может быть признаком недоедания. Нередко такой стул бывает в сочетании с медленным набором веса. Иногда такое состояние называют дисбаланс переднего и заднего молока. Ребенок высасывает много переднего молока с низким содержанием жира, которое проходит через пищеварительную систему слишком быстро и вызывает вышеуказанные симптомы. Обычно это легко разрешается изменением поведения во время кормлений, а именно увеличение продолжительности сосания у одной груди. Это позволяет малышу дососаться до жирного заднего молока, которое переваривается медленнее.
Это позволяет малышу дососаться до жирного заднего молока, которое переваривается медленнее.
Если у малыша постоянно зеленый и водянистый стул, это может быть признаком аллергии. Помимо этого у ребенка может быть рвота, слизь или кровь в стуле, а также раздражительность, высыпания на коже. В этом случае особенно важно продолжать кормить грудью, т.к. отлучение от груди сопряжено с повышением риска аллергий.
Если ваш малыш пачкает более 12-16 подгузников в сутки, и стул плохо пахнет и водянистый — это понос. Обычно понос у грудных детей быстро проходит сам по себе и без всяких осложнений. Причиной поноса может стать инфекция, лечение антибиотиками, введение прикорма, чрезмерное потребление фруктовых соков. В случае острого поноса или поноса при приеме антибиотиков ребенка обязательно нужно как можно больше кормить грудью. В грудном молоке содержится все необходимое для предотвращения обезвоживания, а также антитела, которые помогают ребенку справится с инфекцией, и также факторы, которые позволяют восстановить нормальную флору кишечника.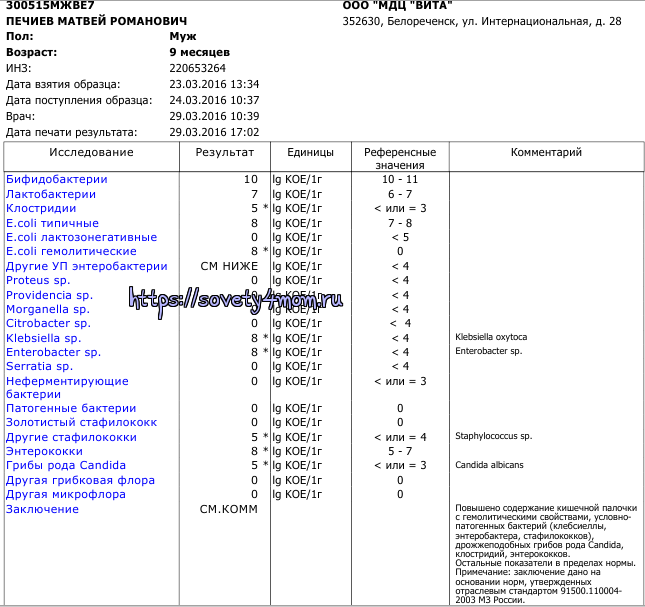 Если же причиной поноса стало введение прикорма или соки, возможно нужно отложить введение прикорма на некоторое время.
Если же причиной поноса стало введение прикорма или соки, возможно нужно отложить введение прикорма на некоторое время.
Ну и вновь возвращаюсь к нашей любимой теме – дисбактериоз! Знакомое слово? Российский родитель, который не слышал его от своего педиатра, может прислать свой портрет на конкурс «Самый счастливый родитель года». Страшный недуг, поразивший всех наших детей, подобравшийся к взрослым, мучительный и неприличный, но легко излечимый регулярной едой чего-либо, выпиванием чего-то по утрам, в общем регулярным переводом денег на чей то счет, пришел в наш мир.
Столкнувшись с самым грандиозным обманом современной педиатрии, считаю своим долгом поставить точки над i, чтобы не повторять бесчисленно в каждой второй теме форумов одно и тоже.
Обозначить симптомы дисбактериоза трудно, а точнее сказать невозможно, так как это состояние не является заболеванием согласно «Международной статистической классификации болезней и проблем, связанных со здоровьем» Десятого пересмотра (МКБ-10) — документу Всемирной организации здравоохранения, который является общепринятой международной диагностической классификацией в здравоохранении.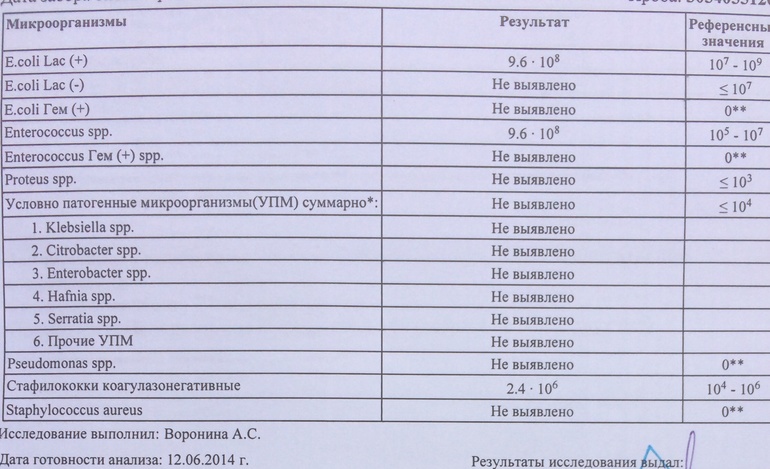 То есть, в мире, да и в России кстати тоже (мы же, врачи-педиатры, пользуемся МКБ-10 в постановке диагнозов как и все врачи в мире) такого состояния не существует. Но почему же тогда его упорно лечат. Как можно лечить то, чего нет?
То есть, в мире, да и в России кстати тоже (мы же, врачи-педиатры, пользуемся МКБ-10 в постановке диагнозов как и все врачи в мире) такого состояния не существует. Но почему же тогда его упорно лечат. Как можно лечить то, чего нет?
Обычно, показанием к анализу на дисбактериоз является непроходящий в течение двух или трех суток понос. У взрослых людей и детей на искусственном вскармливании понос определяется как частый и жидкий стул. Как уже было сказано выше, для грудных детей частый, неоформленный жидкий стул является нормой, поэтому не может являться показанием для анализов. Среди других симптомов, которые служат поводом для лабораторных исследований на дисбактериоз могут быть зеленоватый стул, стул со слизью, запор (редкий стул у грудных детей часто ошибочно принимают за запор), пенистый стул, частички непереваренной пищи. Все эти симптомы в старшем возрасте действительно сопровождают поносы, которые часто вызваны патогенными бактериями и требуют лечения антибиотиками. У детей до года же каждый из перечисленных признаков может являться разновидностью нормы.
Итак, что нужно знать о дисбактериозе кишечника:
1. Главное – дисбактериоза… не существует! Нет ни такого заболевания, ни состояния, которое могло бы иметь отношение к понятию, ни необходимости его искать, ни необходимости его лечить. Подробнее…
2. Просвет кишечной трубки у родившегося ребенка стерилен (как стерилен и сам ребенок). В течение короткого промежутка времени он, как сообщающийся с внешней средой, колонизируется микроорганизмами, которые живут в нем всю жизнь человека.
3. Эти микроорганизмы могут быть полезными, принимающими участие в процессе пищеварения; нейтральными, коих большинство (живут и живут – должен же кто-нибудь жить в просвете кишечника) и вредными, вызывающими кишечные заболевания.
4. Количество микроорганизмов в кишечнике, а также их соотношение у каждого человека разное и зависит от бесчисленного множества факторов – от того в городе или в деревне живет человек, что он ест, насколько тщательно соблюдает правила гигиены, здоров он или болен в данный момент и т. д. Нет единых норм содержания микробов в просвете кишечника. Это первое что нужно понять. Человек имеет право на индивидуальную микрофлору.
д. Нет единых норм содержания микробов в просвете кишечника. Это первое что нужно понять. Человек имеет право на индивидуальную микрофлору.
5. Отсутствие норм, масштабных исследований в этом направлении связано, в первую очередь с тем, что исследования такие не нужны клинической медицине и не несут никакой смысловой нагрузки! От количества и состава микробных колоний ничего не зависит. И это второй вывод нашей беседы.
6. Далее, следует различать содержание микроорганизмов в каловых массах — в просвете кишечника (которые так активно исследуют иные доктора) и содержание их же собственно в кишечнике, т.е. на кишечной стенке — там, где они могут иметь хоть какое-то гипотетическое значение. Нет никаких убедительных данных, что количество микроорганизмов в кале хоть каким-то образом соответствует соотношению их в кишке. Таким образом, что мы определяем абсолютно непонятно. Запоминаем третье правило «Нет, не было и не может быть анализа на дисбактериоз» Любое исследование, которое Вам предлагают пройти в этой связи – бессмысленно, неинформативно и направлено только на имитацию лечения.
Так почему же этот самый дисбактериоз не лечит только ленивый?!!!
А вот на этот вопрос ответа нет. Отчасти потому что проще всего лечить несуществующую болезнь – то, чего не было, обязательно пройдет. Отчасти потому, что прочитать рекламную брошюрку очередных производителей для некоторых коллег легче, чем серьезный учебник (он же еще и денег стоит, да и написан чаще на английском)… В некоторых случаях потому, что проще списать непонятные симптомы на некую мифическую, но общеизвестную проблему – ведь то, что мы пишем сегодня, не исключает существования множества заболеваний желудочно-кишечного тракта, каждое из которых имеет свою клинику, свой набор анализов и свое лечение. Но это болезни. Здоровых детей лечить не надо.
Степень обмана дошла до того, что помимо бессмысленных лекарств для лечения несуществующей болезни нам предлагают покупать даже продукты!!! «Покупайте у нас постоянно и у Вас не будет дисбактериоза!!!». Мы надеемся, что прочитав эти слова, Вы всегда будете скептически относиться к подобной рекламе, насколько бы убедительна она не была.
А как же антибиотики? Почему же тогда при их приеме нередко «расстраивается желудок».
Рутинной ошибкой, впрочем, и распространенным добросовестным заблуждением является мнение, что при назначении антибиотиков обязательно происходит нарушение микробного равновесия в толстом кишечнике Как правило, и в большинстве случаев, применение антибиотиков не влечет за собой каких-либо расстройств и не требует дополнительной коррекции микробного баланса.
Но. Для ряда препаратов, временная диарея является побочным эффектом применения. Например популярный антибиотик амоксиклав вызывает диарею примерно в 7-10% случаев. Таким образом, временное учащение и разжижение стула надо рассматривать не как самостоятельную проблему, требующую коррекции, а как одно из действий препарата.
Так как же поддержать организм ребенка? Какие действия предпринять? Может среди сотен товаров, которые нам предлагают, есть что-то действительно полезное?.. Что бы в кишечнике моего ребенка жили только полезные микробы???
Ничего, абсолютно ничего экстраординарного делать не надо. Кормите детей вкусно и разнообразно. Приучите их мыть фрукты и руки перед едой. Обучите элементарным правилам гигиены и считайте, что на этом Ваша миссия выполнена.
Кормите детей вкусно и разнообразно. Приучите их мыть фрукты и руки перед едой. Обучите элементарным правилам гигиены и считайте, что на этом Ваша миссия выполнена.
Насколько показательны анализы на дисбактериоз у здоровых грудных детей? Изучение состава кишечной флоры у здорового грудного ребенка, то есть ребенка без видимых симптомов заболевания, в данном случае поноса, представляет интерес для ученых, но не для родителей или практикующих врачей. Многочисленные исследования показали, что грудное молоко защищает детей от заболеваний, даже если кишечник колонизирован патогенными микроорганизмами. Например, в грудном молоке содержатся антитела и факторы против кишечной палочки, холерного вибриона, сальмонеллы, стафиллококов, клебсиелл, шигеллы, ротавируса и лямблии. Это значит, что в стуле может высеваться патологический микроорганизм, но ребенок при этом не проявляет никаких симптомов заболевания.
И вновь вернусь к стафилококку. Мы разобрались, когда его лечить не нужно. Когда есть анализ (бумажка с каким-то числом микробных КОЕ 10 в какой-нибудь степени) и никаких жалоб не предъявляющий ребенок.
Другое дело — стафилококковая инфекция. И о ней тоже нужно знать.
Патогенный стафилококк — проблема родильных домов испокон веков. В роддомах строгий санэпидрежим, практически все регулярно протирается дезинфицирующими средствами, убивая на поверхностях всю микрофлору (патогенную и непатогенную, без разбора). Первым, кто быстро занимает «освободившуюся квартиру» — золотистый стафилококк (разносясь с кожи и слизистых людей). И так как ему там нет конкуренции (все же убиты) — начинает неконтролируемо размножаться и, затем, через воздух или руки попадает и к женщинам, и к новорожденным детям.
Новорожденные дети, не успев колонизироваться нормальной человеческой микрофлорой кожи матери, в том числе и её золотистым стафилококком в компании других микроорганизмов (что обеспечивается ранним прикладыванием и совместным пребыванием), поражаются больничным золотистым стафилококком, который вызывает различные заболевания (в основном кожные, но бывает и что посерьезнее). Они же еще не успели выработать на него антитела. А мама не успела передать их с молочком.
А мама не успела передать их с молочком.
Женщина же при наличии кровоточащей после родов матки и грудного молока (это прекрасная среда для размножения микробов) тоже имеет риск получить больничную инфекцию.
Такое случается во всем мире.
СТАФИЛОКОККОВАЯ ИНФЕКЦИЯ. Стафилококковые заболевания поражают преимущественно детей младшего возраста или детей, ослабленных другими заболеваниями.
Клиническое течение стафилококковой инфекции характеризуется многообразием — от тяжелейших, генерализованных форм до легких: сепсис, пневмония, менингит, абсцессы внутренних органов, энтероколит, эндокардит, гинекологические заболевания, стафилококковая инфекция со скарлатиноподобным синдромом, гнойно-воспалительные заболевания кожи и мягких тканей и др. Причем отметьте про зеленый стул с пропуками, запор и прочие проблемы обращений – тут не слова. Стафилококковая инфекция если она есть – заболевание тяжелое. И чаще всего лечится стационарно массивно антибиотиками, а не бактериофагами, клизмочками и всякими биопрепаратами препаратами.
Основные мероприятия, которые проводятся в мире для снижения риска:
— роддома не должны быть излишне закрыты от посетителей и излишне дезинфицировать поверхности, чтобы там сохранялась нормальная микрофлора окружающего мира, а не больничный стафилококк.
— ранее прикладывание и совместное с матерью пребывание.
— короткий срок пребывания матери и ребенка в роддоме после обычных родов (пару дней — и домой, в обычную микрофлору), чтобы было меньше риска обсеменения больничной микрофлорой.
— стандартные мероприятия инфекционного контроля.
Ваш ребенок имеет в кишечнике, как и все другие люди на земле, золотистый стафилококк. В кишечнике у людей вообще много кто живет в норме. Бывает что и возбудитель столбняка. И это тоже норма.
симптомы и лечение klebsiella pneumoniae в кишечнике
Нередким явлением для маленького малыша является появление коликов в животе, кишечное расстройство. У новорожденного сразу же нарушается сон, он становится беспокойным. Иногда причиной этого недуга бывает клебсиелла, в кале у ребенка ее легко обнаружить при проведении анализа.
Иногда причиной этого недуга бывает клебсиелла, в кале у ребенка ее легко обнаружить при проведении анализа.
Попадая к ребенку, бактерия вызывает дисбактериоз, кишечные расстройства, вздутие, также может вызывать пневмонию. Если во взрослом организме здорового человека эта палочка может не вызывать развития воспалений, то у маленького малыша может вызвать необратимые последствия, особенно при запоздалом лечении.
Диагностика этой болезни затрудняется, по причине схожести симптомов с другими патологиями желудочно-кишечного тракта.
Клебсиелла: чем она опасна для детского здоровья
Это заболевание относится к группе патогенных микроорганизмов, которые при нормальном состоянии могут обитать в кишечнике человека, а при ослаблении организма развиваться.
Всего существует 7 разновидностей заболевания, но чаще всего встречается 2 типа:
- Клебсиелла пневмония;
- Клебсиелла окситока.
У грудничков возбудителем заболевания чаще всего выступает klebsiella pneumoniae, в кале у ребенка обнаруживает при обследовании./10/10.jpg)
Представляется опасность потому, что помимо кишечника бактерии могут проникнуть в мозговую оболочку, кости, мочевыделительную систему, кровь, что создаст угрозу для жизни малыша. Таким образом, может развиться сепсис.
При здоровом организме малыша также могут обнаружить эти бактерии, при этом состояние его не будет ухудшаться.
Проникновение из окружающей среды, происходит следующими путями:
- загрязненные руки;
- через питье неочищенной воды;
- от зараженного молока;
- при неправильной обработке сосков перед кормлением;
- воздушным путем;
- из почвы, пыли;
- через невымытые овощи и фрукты.
У детей нередко бывают ослаблены иммунные функции организма, что способствует развитию воспалительных процессов, после чего клебсиелла в кишечнике у ребенка начинает активизироваться.
На первые месяцы жизни появление патологий связывают со следующими причинами:
- Слабо развитая иммунная система;
- Отсутствие необходимого количества микрофлоры на коже, в кишечнике, дыхательных путях.
Для развития бактерий, наиболее благоприятны такие условия:
- аллергические реакции;
- патологии ЖКТ;
- ослабленный организм, при недостатке витаминов;
- долгое и бесконтрольное лечение антибиотиками.
Если приходилось часто проводить лечение с помощью антибиотиков, это лишь затруднит лечение заболевание. Все потому, что чувствительность бактерий ко многим видам лекарственных средств значительно снижается.
Как развивается заболевание в кишечнике
Клебсиелла имеет вид палочки, довольно внушительного размера. Она не подвижна, снаружи защищена специальной капсулой, с мощью которой имеет высокую устойчивость к высоким и низким температурам.
Бактерия не погибает даже при охлаждении и не все антибиотики способны ее разрушать. Как показали исследования, при кипячении бактерия теряет свою жизнеспособность.
Попадая в кишечник малыша, может не проявлять какого-либо развития, но в самый неблагоприятный момент, при снижении защитных функций организма будет происходить стремительное развитие.
Найденная клебсиелла пневмония в кале у ребенка это повод для беспокойства и дальнейшего обследования всех органов ЖКТ. При попадании в толстый кишечник может представлять серьезную угрозу для здоровья малыша, особенно на первые месяцы после рождения.
Симптоматика у ребенка
Многие родители путают это заболевание с дисбактериозом, которому подвержены практически все дети в первые недели после рождения.
Когда присутствует клебсиелла в кишечнике, симптомы у детей на первых месяцах жизни проявляются следующим образом:
- вздутие живота и газообразование;
- срыгивания после еды;
- колики;
- понос с примесями слизи, а иногда и кровяными сгустками;
- повышение температуры тела;
- лихорадочные приступы;
- болевые ощущения в животе.
Определить дисбактериоз это или клебсиелла можно только после проведения анализа. Чаще всего, когда обнаруживается клебсиелла в кале у ребенка, симптомы будут означать, что происходит развитие болезни.
При тяжелом течении недуга у ребенка может наступить обезвоживание, рвота повторяется несколько раз за день. Наблюдают следующие симптомы:
- сниженный аппетит;
- упадок жизненных сил.
Клебсиелла пневмония вызывает у ребенка резкое повышение температуры тела, иногда даже выше 39°С.
У больного появляется кашель с выделением мокроты, которая имеют неприятный запах и может содержать кровяные сгустки. Определяется клебсиелла пневмония в кале у ребенка, после проведения анализа.
Рентгеновский снимок позволяет более точно поставить диагноз. Таким образом, врач определяет все очаги поражения. Болезнь чаще всего сопровождается и другими респираторными заболеваниями.
Иногда кишечная инфекция протекает совместно с пневмонией. Тогда у ребенка могут возникнуть такие симптомы:
- частые судороги;
- энтероколит;
- ацидоз.
При своевременной помощи можно излечить этот недуг. Однако часто родители прибегают к медицинской помощи, когда заболевание переходит в затяжную форму.
У ребенка могут наблюдаться следующие осложнения:
- инфекции в кишечнике;
- менингит;
- гайморит;
- конъюнктивит.
У новорожденных малышей заболевание начинает развиваться на кожных покровах головы, особенно при наличии родовых травм от щипцов.
Могут возникать поражения конечностей и суставов, обычно это проявляется припухлостью на месте поражения. Ребенок при пеленании начинает беспокойно себя вести, при этом температура тела не всегда превышает норму.
Лечение для детей
Если заболевание протекает легко, грудничкам назначают лекарственные препараты бактериологического типа. К ним относятся:
- Бактериофаги;
- Пребиотики.
Таким образом, восстанавливается микрофлора кишечника у малыша. Однако при затяжном течении болезни, этим методом не обойтись, тогда назначают антибиотики.
Однако весь период лечения малыш находится под тщательным надзором специалистов.
Кроме того, пациенту назначают курс витаминов для повышения иммунных функций.
Заключение
Чтобы избежать развития этого заболевания необходимо тщательно следить за личной гигиеной малыша. При грудном вскармливании предварительно обрабатывать соски.
Если была обнаружена клебсиелла в кишечнике у ребенка, лечение не должно затягиваться. Тогда можно справиться с недугом без каких-либо последствий для малыша.
Количественное и качественное исследование кишечной флоры новорожденных
J Glob Infect Dis. 2012 г., октябрь-декабрь; 4(4): 188–192.
DOI: 10.4103/0974-777X.103895
, , и 1
Авторская информация об авторских правах и информация о лицензии Отказ от ответственности
Фоны:
В период рово оптимальная защита слизистой оболочки от инфекции. Важную роль в этом процессе играет формирование нормальной комменсальной микрофлоры.
Важную роль в этом процессе играет формирование нормальной комменсальной микрофлоры.
Цели:
Определение аэробных и анаэробных бактерий количественными и качественными методами в образцах фекалий новорожденных.
Установки и дизайн:
Проспективное исследование было проведено в двух группах в больнице третичного уровня: группа А — недоношенные дети и группа В — доношенные дети.
Материалы и методы:
В исследование были включены шестьдесят два недоношенных ребенка с массой тела < 1500 г и гестационным возрастом < 34 недель и двадцать девять доношенных детей в возрасте 4 недель. Количественную оценку бактериальной нагрузки проводили десятикратными серийными разведениями на соответствующих средах.
Статистический анализ:
Данные были проанализированы с использованием EPIINFO-Ver 6.04.
Результаты и выводы:
Преобладающей аэробной бактерией была Klebsiella pneumoniae . У недоношенных детей аэробные бактерии были колонизированы в среднем 2,1, а анаэробные бактерии — 0,1. Количественный анализ показал количество фекальных бактериальных колоний в диапазоне от 10 4 до 10 13 КОЕ/г. Количество грамотрицательных и грамположительных бактерий постепенно увеличивалось в течение 2-3 недель. Среднее значение log КОЕ грамотрицательных и грамположительных бактерий было статистически незначимым с 3-го по 14-й день (9).0038 P > 0,05). На 21-й день наблюдалось значительное изменение колонизации обоих видов бактерий ( P <0,05). В кишечной флоре недоношенных детей, находящихся на вскармливании в неонатальном отделении, преобладают потенциально патогенные аэробные бактерии. Необходимо изучить меры по устранению этого дисбаланса в микроэкологии кишечника недоношенных детей.
Количественный анализ показал количество фекальных бактериальных колоний в диапазоне от 10 4 до 10 13 КОЕ/г. Количество грамотрицательных и грамположительных бактерий постепенно увеличивалось в течение 2-3 недель. Среднее значение log КОЕ грамотрицательных и грамположительных бактерий было статистически незначимым с 3-го по 14-й день (9).0038 P > 0,05). На 21-й день наблюдалось значительное изменение колонизации обоих видов бактерий ( P <0,05). В кишечной флоре недоношенных детей, находящихся на вскармливании в неонатальном отделении, преобладают потенциально патогенные аэробные бактерии. Необходимо изучить меры по устранению этого дисбаланса в микроэкологии кишечника недоношенных детей.
Ключевые слова: Бактериальная флора, Фекалии, Кишечник, Новорожденные, Количественный анализ
В неонатальном периоде важную роль в развитии защиты слизистой оболочки ЖКТ играет формирование нормальной комменсальной микрофлоры. Сообщалось, что бактериальная флора недоношенных детей в отделении интенсивной терапии новорожденных (ОИТН) отличается от таковой у нормальных доношенных детей. [1,2] У здоровых желудочно-кишечный тракт доношенных новорожденных был заселен разнообразной микрофлорой. в течение 10 дней жизни, тогда как у недоношенных детей микрофлора не получает возможности для колонизации. У младенцев с низкой массой тела при рождении это является важным фактором риска неонатальной смертности и заболеваемости, включая сепсис и желудочно-кишечные расстройства. [3,4] Большинство таких младенцев обычно лечат антибиотиками широкого спектра действия в условиях отделения интенсивной терапии вскоре после рождения. Таким образом, бактериальная флора этих детей характеризуется отсроченной колонизацией желудочно-кишечного тракта ограниченным количеством бактерий.[5] Тем не менее, литература по микробной флоре у недоношенных детей, особенно у детей с низкой массой тела при рождении (< 1500 г), предрасположенных к различным инфекционным и желудочно-кишечным осложнениям, таким как некротизирующий энтероколит (НЭК), ограничена.
Сообщалось, что бактериальная флора недоношенных детей в отделении интенсивной терапии новорожденных (ОИТН) отличается от таковой у нормальных доношенных детей. [1,2] У здоровых желудочно-кишечный тракт доношенных новорожденных был заселен разнообразной микрофлорой. в течение 10 дней жизни, тогда как у недоношенных детей микрофлора не получает возможности для колонизации. У младенцев с низкой массой тела при рождении это является важным фактором риска неонатальной смертности и заболеваемости, включая сепсис и желудочно-кишечные расстройства. [3,4] Большинство таких младенцев обычно лечат антибиотиками широкого спектра действия в условиях отделения интенсивной терапии вскоре после рождения. Таким образом, бактериальная флора этих детей характеризуется отсроченной колонизацией желудочно-кишечного тракта ограниченным количеством бактерий.[5] Тем не менее, литература по микробной флоре у недоношенных детей, особенно у детей с низкой массой тела при рождении (< 1500 г), предрасположенных к различным инфекционным и желудочно-кишечным осложнениям, таким как некротизирующий энтероколит (НЭК), ограничена. Поэтому данное исследование было проведено с целью определения микрофлоры кала у недоношенных детей, поступивших в отделение интенсивной терапии специализированного стационара, с целью оценки риска развития желудочно-кишечных осложнений у этих детей.
Поэтому данное исследование было проведено с целью определения микрофлоры кала у недоношенных детей, поступивших в отделение интенсивной терапии специализированного стационара, с целью оценки риска развития желудочно-кишечных осложнений у этих детей.
Проспективное исследование (Фаза-I) было проведено в двух группах во Всеиндийском институте медицинских наук, Нью-Дели, Индия, после того, как оно было одобрено с этической точки зрения. В группу А вошли 62 недоношенных ребенка с массой тела < 1500 г и гестационным возрастом < 34 недель. Из 62 случаев в 34 образцах стула был проведен количественный анализ, а в 28 — качественный анализ фекальной бактериальной флоры. Образцы были собраны на 3, 7, 14, 21 день (все ± 2 дня) у 34 младенцев. В группе Б - исследовано двадцать девять доношенных детей. Образцы фекалий были качественно проанализированы.
Один грамм образца стула переносили во флакон со стеклянными шариками (SIGMA Chemicals Co.USA), содержащий 1 мл стерильного физиологического раствора, и перемешивали вортексом.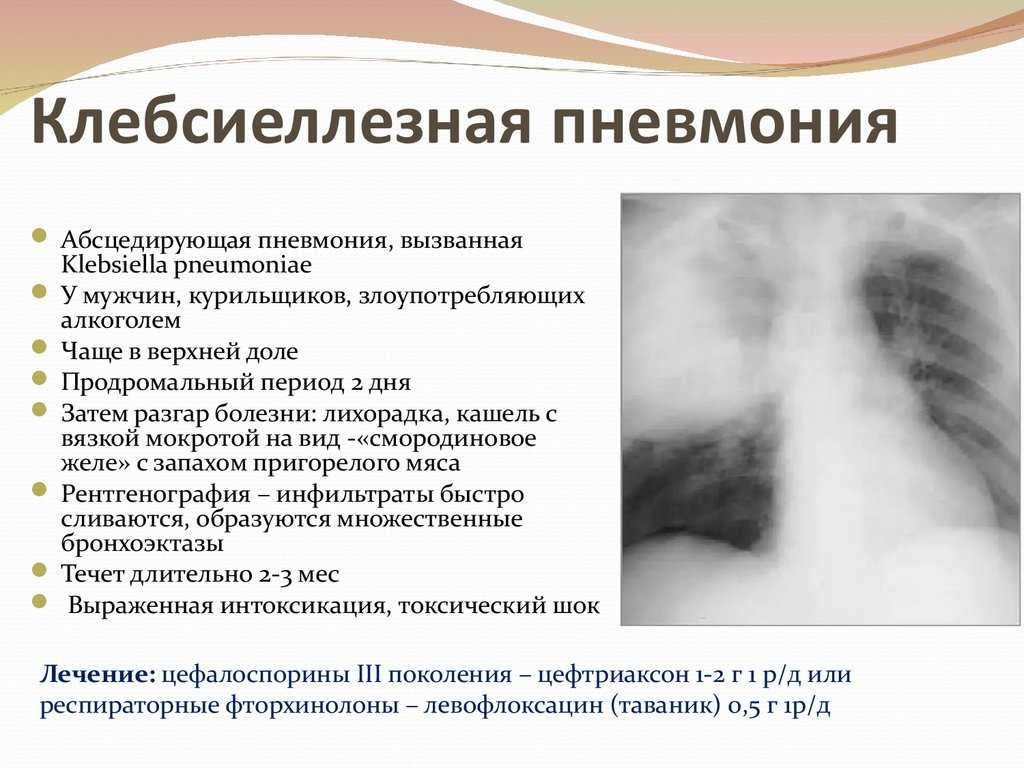 Готовили десятикратные серийные разведения (10 2 -10 9 ) и 10 мкл каждого разведения культивировали на 5% овечьей крови и агаре МакКонки (Difco Chemicals) для аэробных бактерий. Планшеты инкубировали при 37°С в течение 48 часов и исследовали через 24 часа и 48 часов. Бактерии идентифицировали с помощью обычных биохимических тестов, а также с помощью системы API, т.е. теста API 20 E, теста API на стафилококк/стрептококк (bioMerieux Vitek Inc.), для различных грамположительных и отрицательных организмов. Для анаэробной культуры образцы стула инокулировали на агар с инфузией мозгового сердца (Hi-Media Laboratories, Pvt. Ltd., Индия), дополненный гемином (Hi-Media Laboratories, Pvt. Ltd., Индия) и витамином К (Hi-Media Laboratories, Pvt. Ltd. Индия) и инкубировали в анаэробных условиях при 37°C в течение от 48 до 72 часов. Анаэробные бактерии идентифицировали обычными биохимическими методами и системой RapID ANA (Innovative Diagnostic System Inc Norcross, GA).
Готовили десятикратные серийные разведения (10 2 -10 9 ) и 10 мкл каждого разведения культивировали на 5% овечьей крови и агаре МакКонки (Difco Chemicals) для аэробных бактерий. Планшеты инкубировали при 37°С в течение 48 часов и исследовали через 24 часа и 48 часов. Бактерии идентифицировали с помощью обычных биохимических тестов, а также с помощью системы API, т.е. теста API 20 E, теста API на стафилококк/стрептококк (bioMerieux Vitek Inc.), для различных грамположительных и отрицательных организмов. Для анаэробной культуры образцы стула инокулировали на агар с инфузией мозгового сердца (Hi-Media Laboratories, Pvt. Ltd., Индия), дополненный гемином (Hi-Media Laboratories, Pvt. Ltd., Индия) и витамином К (Hi-Media Laboratories, Pvt. Ltd. Индия) и инкубировали в анаэробных условиях при 37°C в течение от 48 до 72 часов. Анаэробные бактерии идентифицировали обычными биохимическими методами и системой RapID ANA (Innovative Diagnostic System Inc Norcross, GA).
Общее количество бактерий на грамм стула сообщалось в каждом образце количественного исследования.
Статистика
Количество колоний организмов выражали в виде log 10 подсчет. Для статистических сравнений использовали среднее значение log КОЕ. Данные были проанализированы с использованием EPIINFO-Ver 6.04. Статистический метод для непрерывных переменных использовался путем применения t-теста или критерия Манна-Уитни (где это применимо), а для категориальных переменных использовался хи-квадрат или точный критерий Фишера (для сравнения количества колонизированных младенцев). Значимость была замечена, если Р < 0,05.
В это исследование был включен в общей сложности 91 младенец для определения картины кишечной флоры у новорожденных.
Общее количество колоний аэробных бактерий варьировалось от 10 4 до 10 13 КОЕ/г. Показатели колонизации наиболее часто выделяемых бактерий приведены на рис. Характер колонизации изменялся через разные промежутки времени в конце сбора образцов (d21). Количество фекальных бактерий, как грамотрицательных, так и грамположительных, постепенно увеличивалось в течение 2-3 недель. Некоторые образцы невозможно было собрать через определенные промежутки времени, поскольку у детей не было стула.
Некоторые образцы невозможно было собрать через определенные промежутки времени, поскольку у детей не было стула.
Таблица 1
Общее количество бактериальных изолятов у недоношенных детей (группа А)
Открыть в отдельном окне
Колонизация грамотрицательных микроорганизмов увеличивалась с 1-го по 21-й день пребывания в ОИТН. Наблюдалось последовательное увеличение общего числа видов бактерий и значительные изменения в характере колонизации отдельными видами бактерий с течением времени. К концу первого месяца жизни значительный процент детского стула был заселен Клебсиелла пневмония ; 17,8% на 3-й день, 50% на 7-й день, 61% на 14-й день, 60% на 21-й день ( P <0,05) и E. coli ; 35% на 3-й день, 40% на 7-й день, 38% на 14-й день и 60% на 21-й день. ). На 21-й день наблюдалось значительное изменение колонизации обоих видов бактерий ( P <0,05) []. Salmonella senftenberg, Salmonella typhi, Salmonella gallinarum, Klebsiella oxytoca , были обнаружены только у детей с клиническим анамнезом НЭК.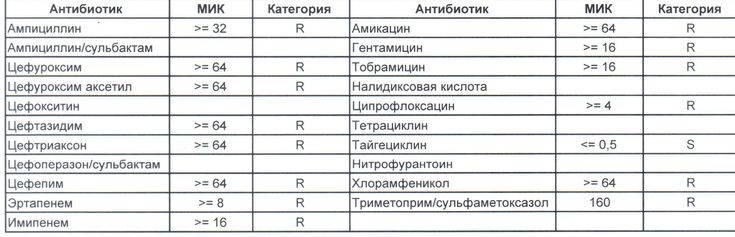
Таблица 2
Средний журнал log CFU у детей <1500 GM
Открыто в отдельном окне
Колонизированные грамогативные и положительные аэробные организмы были Klebsiella pneumoniae 41,3%, Escherichia Coli 24.1%, , , , , , , , , , , , , , , , , , , , , , , , . 10,3%, Enterococcus faecium 34,4%, Staphylococcus epidermidis 6,8% и Micrococcus sp 3,4% [] и колонизация анаэробных организмов составила Bifidobacterium sp (13,4%) и Clostridium bifermentans (3,4%). Наблюдалась статистически значимая разница в росте грамположительных микроорганизмов в обеих группах ( P < 0,05), которая оказалась низкой у недоношенных детей. Рост защитных организмов (полезных бактерий) был статистически недостоверен ( P > 0,05) в обеих группах.
Таблица 3
Общее количество видов бактерий у недоношенных и доношенных детей
Открыть в отдельном окне
Характер бактериальной колонизации кишечника новорожденного зависит от различных факторов; срок беременности, способ родоразрешения, тип вскармливания, бактериальные взаимодействия, антимикробная терапия и другие факторы окружающей среды. Сообщалось, что колонизация микрофлоры при грудном вскармливании отличается от таковой при вскармливании смесью. [4,5] Некоторые авторы обнаружили, что фекальная микрофлора у детей, вскармливаемых грудью и смесью, по существу одинакова; другие продемонстрировали, что
Сообщалось, что колонизация микрофлоры при грудном вскармливании отличается от таковой при вскармливании смесью. [4,5] Некоторые авторы обнаружили, что фекальная микрофлора у детей, вскармливаемых грудью и смесью, по существу одинакова; другие продемонстрировали, что
Исеки К. изучал развитие фекальной флоры, как аэробной, так и анаэробной, при введении различных пищевых смесей и наблюдал за колонией кишечника новорожденных представителями  Однако количество других бактерий (энтеробактерий) было больше у детей, находящихся на искусственном вскармливании, чем у детей, находящихся на грудном вскармливании. Эти результаты свидетельствуют о том, что грудное вскармливание защищает незрелый кишечник от системной инфекции.[10] Ира HG
Однако количество других бактерий (энтеробактерий) было больше у детей, находящихся на искусственном вскармливании, чем у детей, находящихся на грудном вскармливании. Эти результаты свидетельствуют о том, что грудное вскармливание защищает незрелый кишечник от системной инфекции.[10] Ира HG 
 coli . Скорость колонизации грамотрицательными бактериями была высокой как у недоношенных, так и у доношенных детей, тогда как количество грамположительных бактерий было меньше у недоношенных детей. Бактериальная колонизация кишечника недоношенных, вероятно, играет роль в патогенезе и предрасположенности к желудочно-кишечным осложнениям, таким как некротизирующий энтероколит (НЭК). Вестра-Мейер
coli . Скорость колонизации грамотрицательными бактериями была высокой как у недоношенных, так и у доношенных детей, тогда как количество грамположительных бактерий было меньше у недоношенных детей. Бактериальная колонизация кишечника недоношенных, вероятно, играет роль в патогенезе и предрасположенности к желудочно-кишечным осложнениям, таким как некротизирующий энтероколит (НЭК). Вестра-Мейер 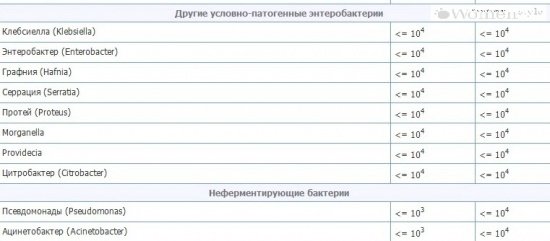 В их исследовании аэробные и анаэробные виды бактерий колонизировали в среднем 2,1 и 0,8 на грамм стула соответственно. Они предположили, что не было существенной разницы в характере колонизации бактерий между исследуемой и контрольной группой. Важным отличием было то, что колонизация Klebsiella sp была выше у тех детей, у которых был диагностирован НЭК в анамнезе, [14] тогда как в текущем исследовании у этих младенцев выращивали Salmonella senftenberg, E.coli, Salmonella typhi, Salmonella gallinarum и Klebsiella oxytoca . которым был поставлен диагноз НЭК. Было высказано предположение, что патогенная кишечная флора может играть роль в предрасположенности новорожденных к нозокомиальному сепсису и НЭК [15,16]. Hoy et al . сообщили, что снижение количества некоторых видов бактерий в фекальной флоре из-за изменения рН после бактериальной ферментации в тонкой кишке изменяет внутрипросветные условия и предшествует клиническому началу НЭК [17].
В их исследовании аэробные и анаэробные виды бактерий колонизировали в среднем 2,1 и 0,8 на грамм стула соответственно. Они предположили, что не было существенной разницы в характере колонизации бактерий между исследуемой и контрольной группой. Важным отличием было то, что колонизация Klebsiella sp была выше у тех детей, у которых был диагностирован НЭК в анамнезе, [14] тогда как в текущем исследовании у этих младенцев выращивали Salmonella senftenberg, E.coli, Salmonella typhi, Salmonella gallinarum и Klebsiella oxytoca . которым был поставлен диагноз НЭК. Было высказано предположение, что патогенная кишечная флора может играть роль в предрасположенности новорожденных к нозокомиальному сепсису и НЭК [15,16]. Hoy et al . сообщили, что снижение количества некоторых видов бактерий в фекальной флоре из-за изменения рН после бактериальной ферментации в тонкой кишке изменяет внутрипросветные условия и предшествует клиническому началу НЭК [17]. Холл и др.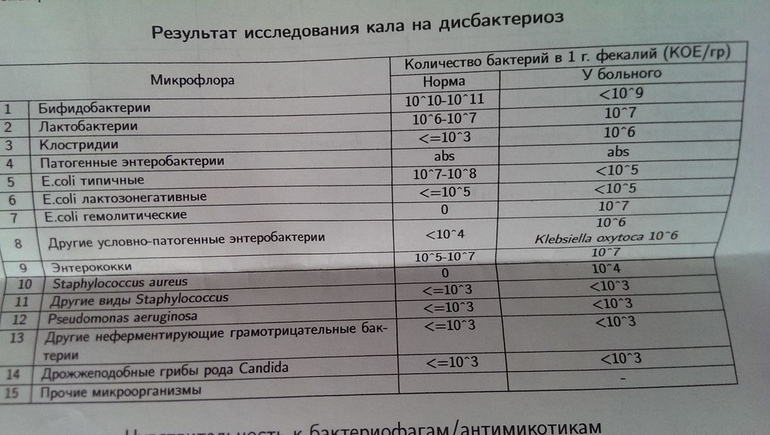 . обнаружили дефицит Lactobacillus по сравнению с колиформными бактериями у недоношенных детей, которые находились на грудном вскармливании в отделении интенсивной терапии новорожденных, и высокое количество Lactobacillus у доношенных детей к 30-дневному возрасту. Это исследование указывает на недостаток полезной флоры у недоношенных детей.[18] Аэробные и анаэробные виды бактерий у недоношенных детей с НЭК или без него были колонизированы в среднем 2,1 и 0,1 на грамм стула соответственно. В настоящем исследовании Лактобациллы зр. был выделен только в одном образце стула на 7-14 день, тогда как у доношенных детей Bifidobacterium sp были выделены у 4/29 (13,7%), что контрастирует с Rubatelli et al . из Италии, который сообщил о высокой распространенности Bifidobacterium sp. (47,6%) у детей, находящихся на грудном вскармливании, и Klessen et al . которые сообщили, что у 89% детей, находящихся на грудном вскармливании, на 7 день жизни этот показатель увеличился до 95% к 30 дню, Lactobacilli были выделены в 12/19 (63%) образцах стула на 79010-й -й день и увеличились до 80-85% в течение двух месяцев [19,20].
. обнаружили дефицит Lactobacillus по сравнению с колиформными бактериями у недоношенных детей, которые находились на грудном вскармливании в отделении интенсивной терапии новорожденных, и высокое количество Lactobacillus у доношенных детей к 30-дневному возрасту. Это исследование указывает на недостаток полезной флоры у недоношенных детей.[18] Аэробные и анаэробные виды бактерий у недоношенных детей с НЭК или без него были колонизированы в среднем 2,1 и 0,1 на грамм стула соответственно. В настоящем исследовании Лактобациллы зр. был выделен только в одном образце стула на 7-14 день, тогда как у доношенных детей Bifidobacterium sp были выделены у 4/29 (13,7%), что контрастирует с Rubatelli et al . из Италии, который сообщил о высокой распространенности Bifidobacterium sp. (47,6%) у детей, находящихся на грудном вскармливании, и Klessen et al . которые сообщили, что у 89% детей, находящихся на грудном вскармливании, на 7 день жизни этот показатель увеличился до 95% к 30 дню, Lactobacilli были выделены в 12/19 (63%) образцах стула на 79010-й -й день и увеличились до 80-85% в течение двух месяцев [19,20].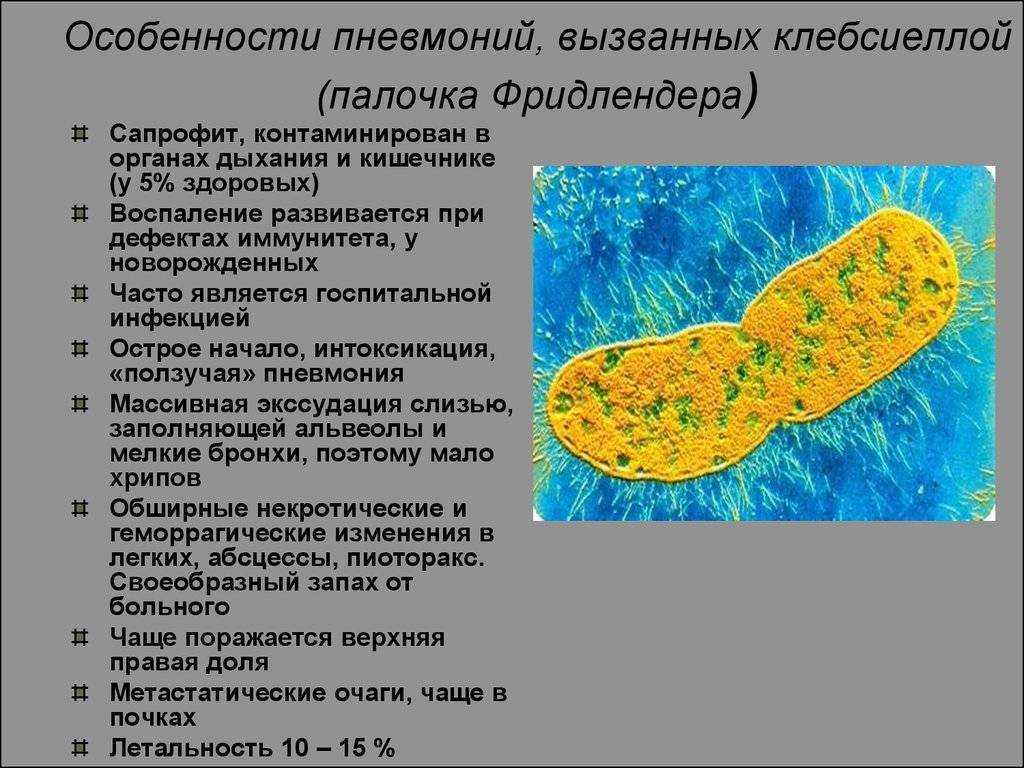 Однако удивительно, что в настоящем исследовании Лактобациллы не были обнаружены ни в одном образце стула детей, вскармливаемых грудью, в течение 1-2 месяцев. Также выделение Bifidobacterium sp. у доношенных детей был низким по сравнению с вышеуказанным исследованием. В связи с нашим открытием необходимо рассмотреть важный вопрос: лучше ли в нашей стране дети, находящиеся на грудном вскармливании, колонизируются анаэробами? Большинство недоношенных детей в ОИТН получали терапию антибиотиками широкого спектра действия и частично или полностью вскармливались сцеженным грудным молоком, что может быть фактором, ограничивающим бактериальную колонизацию кишечника. Необходимо изучить вмешательство, которое «нормализует» микробную экологию кишечника. У здоровых доношенных детей грудное молоко способствует колонизации Bifidobacterium и Lactobacillus sp.[21] Показание к грудному вскармливанию только на основании того, что оно помогает нормальному развитию кишечной флоры для борьбы с кишечной инфекцией, нуждается в переоценке.
Однако удивительно, что в настоящем исследовании Лактобациллы не были обнаружены ни в одном образце стула детей, вскармливаемых грудью, в течение 1-2 месяцев. Также выделение Bifidobacterium sp. у доношенных детей был низким по сравнению с вышеуказанным исследованием. В связи с нашим открытием необходимо рассмотреть важный вопрос: лучше ли в нашей стране дети, находящиеся на грудном вскармливании, колонизируются анаэробами? Большинство недоношенных детей в ОИТН получали терапию антибиотиками широкого спектра действия и частично или полностью вскармливались сцеженным грудным молоком, что может быть фактором, ограничивающим бактериальную колонизацию кишечника. Необходимо изучить вмешательство, которое «нормализует» микробную экологию кишечника. У здоровых доношенных детей грудное молоко способствует колонизации Bifidobacterium и Lactobacillus sp.[21] Показание к грудному вскармливанию только на основании того, что оно помогает нормальному развитию кишечной флоры для борьбы с кишечной инфекцией, нуждается в переоценке.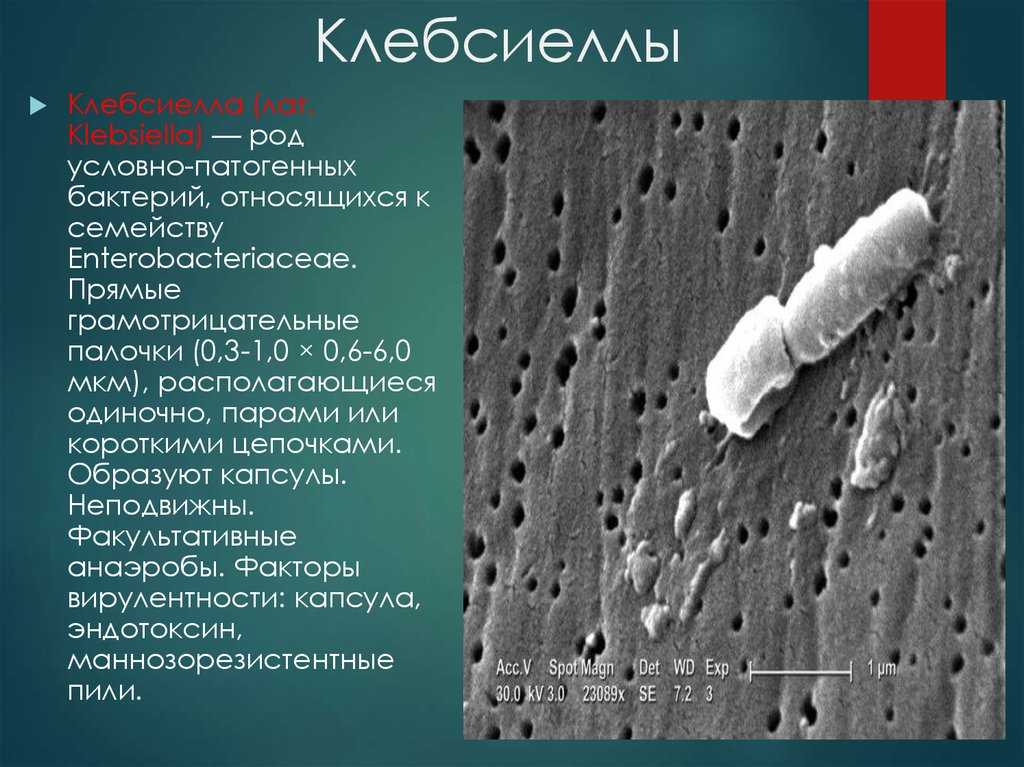 Циркулирующее микробное давление окружающей среды в развивающихся странах, таких как Индия, может препятствовать колонизации анаэробными не образующими спор грамположительными бациллами, такими как Bifidobacterium , а также Lactobacillus . В нашем предыдущем исследовании мы обнаружили умеренную степень колонизации Lactobacilli у более крупных недоношенных детей (> 1500 г), получающих пробиотик Lactobacillus rahmnosus ГГ . В последние годы несколько исследований, включая наше исследование, показали, что многие препараты Lactobacillus могут колонизировать кишечник недоношенных новорожденных и изменять кишечную флору, но еще предстоит выяснить, приведет ли такая колонизация к клинически значимому усилению. 23]
Циркулирующее микробное давление окружающей среды в развивающихся странах, таких как Индия, может препятствовать колонизации анаэробными не образующими спор грамположительными бациллами, такими как Bifidobacterium , а также Lactobacillus . В нашем предыдущем исследовании мы обнаружили умеренную степень колонизации Lactobacilli у более крупных недоношенных детей (> 1500 г), получающих пробиотик Lactobacillus rahmnosus ГГ . В последние годы несколько исследований, включая наше исследование, показали, что многие препараты Lactobacillus могут колонизировать кишечник недоношенных новорожденных и изменять кишечную флору, но еще предстоит выяснить, приведет ли такая колонизация к клинически значимому усилению. 23]
Представленные здесь данные основаны на микробиологическом выделении в обычных аэробных и анаэробных средах. В недавних сообщениях предлагаются молекулярные инструменты, основанные на сходстве последовательностей 16 S рДНК, такие как флуоресцентный 9Гибридизация 0038 in situ (FISH) и денатурирующий градиентный гель-электрофорез (DGGE) помогли преодолеть ограничения традиционных методов микробиологического культивирования при изучении состава фекальной микрофлоры. Эти инструменты были успешно применены для изучения развития микрофлоры младенцев, изменений в микрофлоре человека в процессе старения, влияния пре- и пробиотиков на состав микрофлоры человека и влияния диетических вмешательств на микрофлору кишечника [24]. ]
Эти инструменты были успешно применены для изучения развития микрофлоры младенцев, изменений в микрофлоре человека в процессе старения, влияния пре- и пробиотиков на состав микрофлоры человека и влияния диетических вмешательств на микрофлору кишечника [24]. ]
Мы пришли к выводу, что специфическая микробная экология картины колонизации и отсутствие защитных грамположительных анаэробных бактерий, особенно Bifidobacterium sp. и Lactobacillus sp в незрелом кишечнике могут иметь решающее значение в патогенезе НЭК. Предполагается, что использование пробиотиков (содержащий препарат Lactobacillus ) может играть защитную роль у этих детей, предотвращая НЭК и другие желудочно-кишечные осложнения.
Эта работа была поддержана грантом Fogarty 1 RO3 TW 00601 от NIH, США. Мы хотели бы поблагодарить участвующую команду отделения педиатрии отделения интенсивной терапии новорожденных, AIIMS за предоставление случаев.
Источник поддержки: Fogarty Grant 1RO3 TW 00601 от NIH, USA
Конфликт интересов: Не заявлено
1. Shi HN, Walker A. Бактериальная колонизация и развитие защиты кишечника. Можно J Гастроэнтерол. 2004; 18: 493–500. [PubMed] [Google Scholar]
Shi HN, Walker A. Бактериальная колонизация и развитие защиты кишечника. Можно J Гастроэнтерол. 2004; 18: 493–500. [PubMed] [Google Scholar]
2. Старк П.Л., Ли А. Микробная экология толстого кишечника младенцев, находящихся на грудном и искусственном вскармливании, в течение первого года жизни. J Med Microbiol. 1982; 15: 189–203. [PubMed] [Академия Google]
3. Лонг С.С., Свенсон Р.М. Развитие анаэробной фекальной флоры у здоровых новорожденных. J.Педиатр. 1977; 91: 289–301. [Google Scholar]
4. Хуурре А., Каллиомяки М., Раутава С., Ринне М., Салминен С., Изолаури Э. Способ доставки — влияние на микробиоту кишечника и гуморальный иммунитет. Неонатология. 2008; 93: 236–40. [PubMed] [Google Scholar]
5. Penders J, Thijis C, Vink C, Stelma FF, Snijders B, Kummeling I, et al. Факторы, влияющие на состав кишечной микробиоты в раннем периоде заболевания. Педиатрия. 2006; 118: 511–21. [PubMed] [Академия Google]
6. Томпсон-Чагоян О.К., Мальдонадо Дж., Гил А.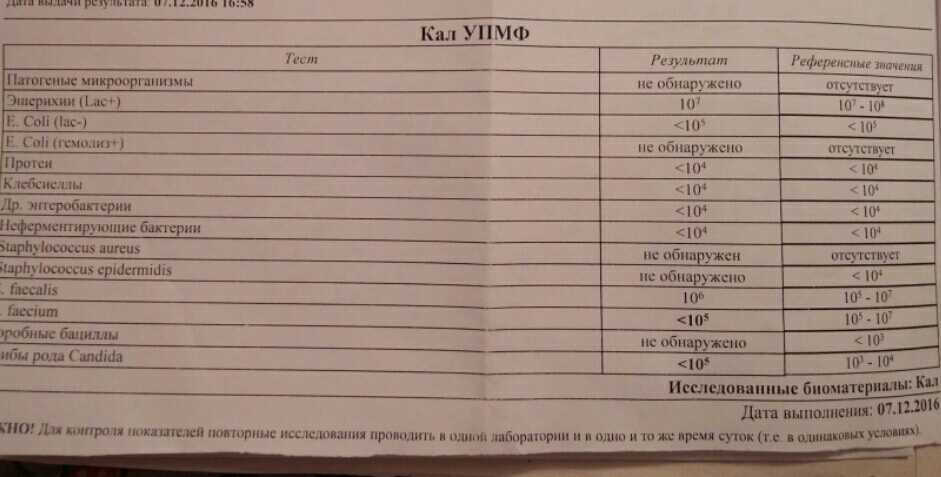 Колонизация и влияние болезней и других факторов на микробиоту кишечника. Dig Dis Sci. 2007;52:2069–77. [PubMed] [Google Scholar]
Колонизация и влияние болезней и других факторов на микробиоту кишечника. Dig Dis Sci. 2007;52:2069–77. [PubMed] [Google Scholar]
7. Balmer SE, Whaton BA. Диета и фекальная флора у новорожденных: грудное молоко и детская смесь. Арч Дис Чайлд. 1989; 64: 1672–7. [PMC free article] [PubMed] [Google Scholar]
8. Lundequist B, Nord CE, Winberg J. Состав фекальной микрофлоры у детей, находящихся на грудном и искусственном вскармливании, от рождения до восьми недель. Acta Pediatr Scand. 1985;74:45–51. [PubMed] [Google Scholar]
9. Simbon A, Dauglas JR, Drasar BS, Soothill JF. Влияние кормления на фекальную флору младенцев. Арч Дис Чайлд. 1982; 57: 54–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Исэки К. Развитие кишечной флоры у новорожденных. Хоккайдо Игаку Засси. 1987; 62: 895–906. [PubMed] [Google Scholar]
11. Ира Х.Г., Ричард С.С., Вики Л.Т., Трейси С.Х., Пинаки П. Микробная флора стула у младенцев с экстремально низкой массой тела при рождении.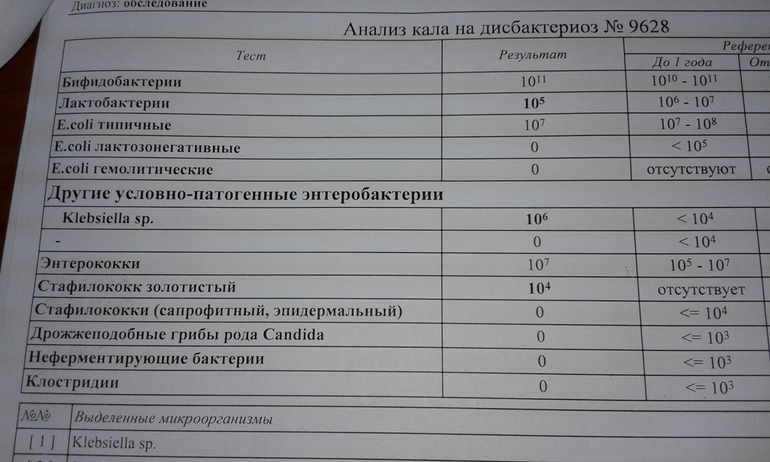 Arch Dis Child Fetal Neonatal Ed. 1999;80:F167–173. [PMC free article] [PubMed] [Google Scholar]
Arch Dis Child Fetal Neonatal Ed. 1999;80:F167–173. [PMC free article] [PubMed] [Google Scholar]
12. Borderon JC, Lionnet C, Rondeau C, Suc AL, Laugier J, Gold F. Актуальные аспекты фекальной флоры новорожденных без антибиотикотерапии в первые 7 дней жизни: энтеробактерии, энтерококки, стафилококки. Pathol Biol (Париж) 1996; 44:416–22. [PubMed] [Google Scholar]
13. Stevenon DK, Yancg C, Kerner JA, Jr, Year AS. Кишечная флора на второй неделе жизни у госпитализированных недоношенных детей, получающих замороженное грудное молоко или запатентованную смесь. Клин Педиатр (Фила) 1985;24:338–41. [PubMed] [Google Scholar]
14. Willoughby RE, Jr, Pickering LK. Некротические энтероколиты и инфекции. Клин Перинатол. 1994; 21: 307–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Kosloske AM. Объединяющая гипотеза патогенеза и профилактики некротического энтероколита. J Педиатр. 1990;117:S68–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Westra-Meijer CM, Degener JE, Dzoljic-Danilovic G, Michel MF, Mettau JW. Количественное исследование аэробной и анаэробной фекальной флоры при неонатальном некротическом энтероколите. Арч Дис Чайлд. 1983;58:523–528. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Westra-Meijer CM, Degener JE, Dzoljic-Danilovic G, Michel MF, Mettau JW. Количественное исследование аэробной и анаэробной фекальной флоры при неонатальном некротическом энтероколите. Арч Дис Чайлд. 1983;58:523–528. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Hoy C, Millar MR, Mackay P, Godwin PG, Langdale V, Levene MI. Количественные изменения фекальной микрофлоры, предшествующие некротическому энтероколиту у недоношенных новорожденных. Арч Дис Чайлд. 1990;65:1057-9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Hall MA, Cole CB, Smith SL, Fuller R, Rolles CJ. Фактор, влияющий на наличие фекальных лактобацилл в раннем детстве. Арч Дис Чайлд. 1990; 65: 185–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Rubaltelli FF, Biadaiali R, Pecile P, Nicaletti P. Кишечная флора у грудных детей и детей из бутылочек. J Перинат Мед. 1998; 26: 186–91. [PubMed] [Google Scholar]
20. Kleessen B, Bunke H, Tovar K, Noaek J, Sawatzki G. Влияние двух детских смесей и грудного молока на развитие фекальной флоры у новорожденных. Акта Педиатр. 1995; 84: 1347–56. [PubMed] [Google Scholar]
Акта Педиатр. 1995; 84: 1347–56. [PubMed] [Google Scholar]
21. Эль Мохандес А.Е., Пикард М.Б., Симменс С.Дж., Кайзер Дж.Ф. Использование грудного молока в отделениях интенсивной терапии снижает заболеваемость внутрибольничным сепсисом. Дж. Перинатол. 1997;17:130–4. [PubMed] [Google Scholar]
22. Agarwal R, Sharma N, Chaudhry R, Deorari A, Paul VK, Gewolb T, et al. Влияние пероральных Lactobacillus gg на кишечную микрофлору у новорожденных с низкой массой тела при рождении. J Pediatr Gastroenterol Nutr. 2003; 36: 397–402. [PubMed] [Google Scholar]
23. Langhendries JP, Detry J, van Hees J, Lamboray JM, Darimont J, Mozin MJ, et al. Влияние ферментированной смеси для детского питания, содержащей бифидобактерии viale, на состав фекальной флоры и рН здоровых доношенных детей. J Pediatr Gastroenterol Nutr. 1995;21:177–81. [PubMed] [Google Scholar]
24. Tanaka S, Kobayashi T, Songjinda P, Tateyama A, Tsubouchi M, Kiyohara C, et al. Влияние антибиотикотерапии в раннем постнатальном периоде на развитие кишечной микробиоты.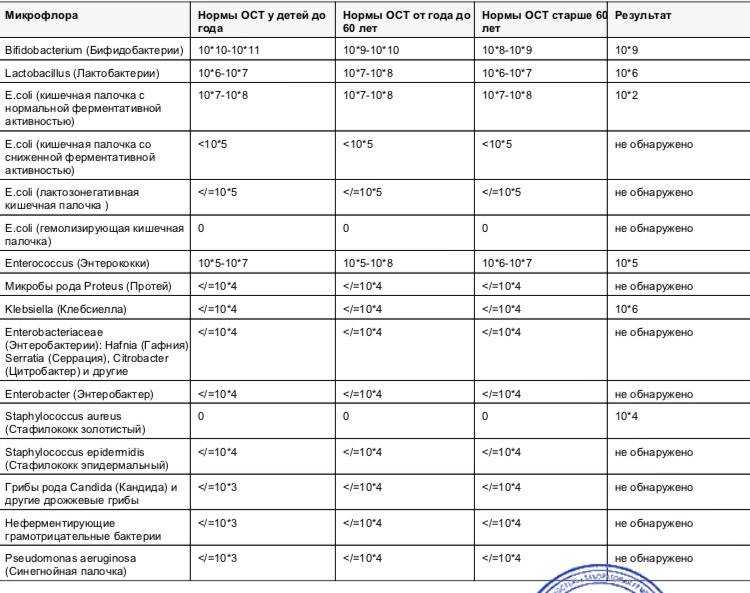 FEMS Immunol Med Microbiol. 2009;56:80–7. [PubMed] [Google Scholar]
FEMS Immunol Med Microbiol. 2009;56:80–7. [PubMed] [Google Scholar]
Недоношенные дети являются носителями различных популяций клебсиелл, включая атипичные виды, которые кодируют и продуцируют множество факторов, связанных с устойчивостью к противомикробным препаратам и вирулентностью
1. Уорд Д.В., Шольц М., Золфо М., Тафт Д.Х., Шиблер К.Р. и соавт. Метагеномное секвенирование с разрешением на уровне штамма выявило причастность уропатогенной E. coli к некротизирующему энтероколиту и смертности у недоношенных детей. Cell Rep. 2016; 14:2912–2924. doi: 10.1016/j.celrep.2016.03.015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Korpela K, de Vos WM. Колонизация кишечника человека в раннем возрасте: микробы важны повсюду. Curr Opin Microbiol. 2018;44:70–78. doi: 10.1016/j.mib.2018.06.003. [PubMed] [CrossRef] [Академия Google]
3. Ньюбург Д.С., Уокер В.А. Защита новорожденного врожденной иммунной системой развивающегося кишечника и грудного молока./14-20/17-1.jpg) Педиатр рез. 2007; 61: 2–8. doi: 10.1203/01.pdr.0000250274.68571.18. [PubMed] [CrossRef] [Google Scholar]
Педиатр рез. 2007; 61: 2–8. doi: 10.1203/01.pdr.0000250274.68571.18. [PubMed] [CrossRef] [Google Scholar]
4. Wandro S, Osborne S, Enriquez C, Bixby C, Arrieta A, et al. Микробиом и метаболом стула недоношенных детей индивидуализированы и не зависят от последствий для здоровья, включая некротизирующий энтероколит и поздний сепсис. мсфера. 2018; 3 doi: 10.1128/mSphere.00104-18. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Ван Ю., Хёниг Д.Д., Малин К.Дж., Камар С., Петроф Э.О. и соавт. Анализ фекальной микробиоты недоношенных детей с некротизирующим энтероколитом и без него на основе гена 16S рРНК. ISME J. 2009; 3: 944–954. doi: 10.1038/ismej.2009.37. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. DiBartolomeo ME, Claud EC. Развивающийся микробиом недоношенного ребенка. Клин Тер. 2016; 38: 733–739. doi: 10.1016/j.clithera.2016.02.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Magne F, Abély M, Boyer F, Morville P, Pochart P, et al. Низкое видовое разнообразие и высокая межиндивидуальная изменчивость в фекалиях недоношенных детей, выявленные последовательностями генов 16S рРНК и профилями гель-электрофореза в ПЦР-временном градиенте температуры. FEMS Microbiol Ecol. 2006; 57: 128–138. doi: 10.1111/j.1574-6941.2006.00097.x. [PubMed] [CrossRef] [Google Scholar]
Низкое видовое разнообразие и высокая межиндивидуальная изменчивость в фекалиях недоношенных детей, выявленные последовательностями генов 16S рРНК и профилями гель-электрофореза в ПЦР-временном градиенте температуры. FEMS Microbiol Ecol. 2006; 57: 128–138. doi: 10.1111/j.1574-6941.2006.00097.x. [PubMed] [CrossRef] [Google Scholar]
8. Mai V, Torrazza RM, Ukhanova M, Wang X, Sun Y, et al. Нарушения развития кишечной микробиоты, связанные с поздним сепсисом у недоношенных детей. ПЛОС Один. 2013;8:e52876. doi: 10.1371/journal.pone.0052876. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Shaw AG, Sim K, Randell P, Cox MJ, McClure ZE, et al. Поздняя инфекция кровотока и нарушение созревания микробиоты желудочно-кишечного тракта у недоношенных детей. ПЛОС Один. 2015;10:e0132923. doi: 10.1371/journal.pone.0132923. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Warner BB, Tarr PI. Некротизирующий энтероколит и кишечные бактерии недоношенных детей. Semin Fetal Neonatal Med. 2016;21:394–399. doi: 10.1016/j.siny.2016.06.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Semin Fetal Neonatal Med. 2016;21:394–399. doi: 10.1016/j.siny.2016.06.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Robertson C, Savva GM, Clapuci R, Jones J, Maimouni H, et al. Заболеваемость некротизирующим энтероколитом до и после введения рутинных профилактических пробиотиков Lactobacillus и Bifidobacterium . Arch Dis Child Fetal Neonatal Ed. 2019: фетальный неонатальный-2019-317346. doi: 10.1136/archdischild-2019-317346. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Lu L, Claud EC. Внутриутробное воспаление, эпигенетика и микробиом влияют на здоровье недоношенных детей. Curr Pathobiol Rep. 2018; 6:15–21. дои: 10.1007/s40139-018-0159-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Адеолу М., Альнаджар С., Наушад С., Гупта С. Р. Геномная филогения и таксономия « Enterobacteriales» : предложение для Enterobacterales орд. ноябрь подразделяются на семейства Enterobacteriaceae , Erwiniaceae сем. nov., Pectobacteriaceae сем. nov., Yersiniaceae сем. nov., Hafniaceae сем. ноябрь, Morganellaceae фам. nov. и Budviciaceae сем. ноябрь Int J Syst Evol Microbiol. 2016;66:5575–5599. doi: 10.1099/ijsem.0.001485. [PubMed] [CrossRef] [Google Scholar]
nov., Pectobacteriaceae сем. nov., Yersiniaceae сем. nov., Hafniaceae сем. ноябрь, Morganellaceae фам. nov. и Budviciaceae сем. ноябрь Int J Syst Evol Microbiol. 2016;66:5575–5599. doi: 10.1099/ijsem.0.001485. [PubMed] [CrossRef] [Google Scholar]
14. Pammi M, Cope J, Tarr PI, Warner BB, Morrow AL, et al. Дисбактериоз кишечника у недоношенных детей, предшествующий некротизирующему энтероколиту: систематический обзор и метаанализ. Микробиом. 2017;5:31. doi: 10.1186/s40168-017-0248-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Olm MR, Bhattacharya N, Crits-Christoph A, Firek BA, Baker R, et al. Некротизирующему энтероколиту предшествует повышенная репликация кишечных бактерий, Klebsiella и бактерии, кодирующие фимбрии, которые могут стимулировать рецепторы TLR4. bioRxiv. 2019;558676 [бесплатная статья PMC] [PubMed] [Google Scholar]
16. Claud EC, Keegan KP, Brulc JM, Lu L, Bartels D, et al. Структура бактериального сообщества и функциональный вклад в возникновение здорового или некротизирующего энтероколита у недоношенных детей. Микробиом. 2013;1:20. дои: 10.1186/2049-2618-1-20. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
Структура бактериального сообщества и функциональный вклад в возникновение здорового или некротизирующего энтероколита у недоношенных детей. Микробиом. 2013;1:20. дои: 10.1186/2049-2618-1-20. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
17. Sim K, Shaw AG, Randell P, Cox MJ, McClure ZE, et al. Дисбиоз, предшествующий некротизирующему энтероколиту у глубоконедоношенных детей. Clin Infect Dis Off Publ Infect Dis Soc Am. 2015;60:389–397. doi: 10.1093/cid/ciu822. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Torrazza RM, Ukhanova M, Wang X, Sharma R, Hudak ML, et al. Кишечная микробная экология и факторы окружающей среды, влияющие на некротизирующий энтероколит. ПЛОС Один. 2013;8:e83304. doi: 10.1371/journal.pone.0083304. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
19. Alcon-Giner C, Dalby MJ, Caim S, Ketskemety J, Shaw A, et al. Добавка микробиоты с Bifidobacterium и Lactobacillus модифицирует кишечную микробиоту и метаболом недоношенных детей. bioRxiv. 2019;698092 [Google Scholar]
bioRxiv. 2019;698092 [Google Scholar]
20. Kiu R, Caim S, Alcon-Giner C, Belteki G, Clarke P, et al. Штаммы Clostridium tertium , Clostridium cadaveris и Clostridium paraputrificum , ассоциированные с недоношенными детьми: геномная и эволюционная информация. Геном Биол Эвол. 2017;9:2707–2714. doi: 10.1093/gbe/evx210. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Harris SR, Feil EJ, Holden MTG, Quail MA, Nickerson EK, et al. Эволюция MRSA при внутрибольничной передаче и межконтинентальном распространении. Наука. 2010; 327: 469–474. doi: 10.1126/science.1182395. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Segata N, Waldron L, Ballarini A, Narasimhan V, Jousson O, et al. Профилирование метагеномного микробного сообщества с использованием уникальных маркерных генов, специфичных для клады. Нат Методы. 2012;9:811–814. doi: 10.1038/nmeth.2066. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Эббот Дж.К. BugBuilder — конвейер автоматизированной сборки и анализа микробного генома. bioRxiv. 2017;148783 [Google Scholar]
Эббот Дж.К. BugBuilder — конвейер автоматизированной сборки и анализа микробного генома. bioRxiv. 2017;148783 [Google Scholar]
24. Джейн С., Родригес-Р. Л.М., Филлиппи А.М., Константинидис К.Т., Алуру С. Высокопроизводительный анализ ANI 90 000 прокариотических геномов выявляет четкие границы видов. Нац коммун. 2018;9:5114. doi: 10.1038/s41467-018-07641-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Джолли К.А., Брей Дж.Э., Maiden MCJ. Геномика бактериальной популяции в открытом доступе: программное обеспечение BIGSdb, веб-сайт PubMLST.org и их приложения. Добро пожаловать в открытое разрешение. 2018;3:124. doi: 10.12688/wellcomeopenres.14826.1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Lam MMC, Wyres KL, Duchêne S, Wick RR, Judd LM, et al. Популяционная геномика гипервирулентной Klebsiella pneumoniae клональной группы 23 показывает раннее возникновение и быстрое глобальное распространение. Нац коммун. 2018;9 doi: 10. 1038/s41467-018-05114-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1038/s41467-018-05114-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Wick RR, Heinz E, Holt KE, Wyres KL. Kaptive Web: Удобное для пользователя предсказание серотипа капсулы и липополисахарида для геномов Klebsiella . Дж. Клин Микробиол. 2018; 56 doi: 10.1128/JCM.00197-18. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Wyres KL, Wick RR, Gorrie C, Jenney A, Follador R, et al. Идентификация локусов синтеза капсул Klebsiella из данных полного генома. Геномика микробов. 2016;2:e000102. doi: 10.1099/mgen.0.000102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Chen L, Zheng D, Liu B, Yang J, Jin Q. VFDB 2016: иерархический и уточненный набор данных для анализа больших данных — 10 лет спустя. Нуклеиновые Кислоты Res. 2016;44:D694–D697. doi: 10.1093/nar/gkv1239. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Jia B, Raphenya AR, Alcock B, Waglechner N, Guo P, et al. Карта 2017: расширение и модельно-ориентированное курирование всеобъемлющей базы данных по устойчивости к антибиотикам. Нуклеиновые Кислоты Res. 2017;45:D566–D573. doi: 10.1093/nar/gkw1004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Карта 2017: расширение и модельно-ориентированное курирование всеобъемлющей базы данных по устойчивости к антибиотикам. Нуклеиновые Кислоты Res. 2017;45:D566–D573. doi: 10.1093/nar/gkw1004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Eren AM, Esen Özcan C., Quince C, Vineis JH, Morrison HG, et al. Anvi’o: продвинутая платформа анализа и визуализации «омических данных». Пир Дж. 2015;3:e1319. doi: 10.7717/peerj.1319. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Hyatt D, Chen G-L, LoCascio PF, Land ML, Larimer FW, et al. Prodigal: распознавание прокариотических генов и идентификация сайта инициации трансляции. Биоинформатика BMC. 2010;11:119. дои: 10.1186/1471-2105-11-119. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. van Dongen S, Abreu-Goodger C. Использование MCL для извлечения кластеров из сетей. Методы Mol Biol Clifton NJ. 2012; 804: 281–295. [PubMed] [Google Scholar]
34. Schwyn B, Neilands JB. Универсальный химический тест для обнаружения и определения сидерофоров. Анальная биохимия. 1987; 160:47–56. doi: 10.1016/0003-2697(87)-9. [PubMed] [CrossRef] [Google Scholar]
Универсальный химический тест для обнаружения и определения сидерофоров. Анальная биохимия. 1987; 160:47–56. doi: 10.1016/0003-2697(87)-9. [PubMed] [CrossRef] [Google Scholar]
35. Kim D, Song L, Breitwieser FP, Salzberg SL. Центрифуга: быстрая и чувствительная классификация метагеномных последовательностей. Геном Res. 2016; 26:1721–1729. doi: 10.1101/gr.210641.116. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Chen Y. Геномный анализ грамотрицательных бактерий, выделенных из фекалий недоношенных детей, и полногеномный анализ Klebsiella oxytoca [MSc] Imperial College London; 2018. [Google Scholar]
37. Зееманн Т. Прокка: быстрая аннотация генома прокариот. Биоинформатика. 2014;30:2068–2069. doi: 10.1093/биоинформатика/btu153. [PubMed] [CrossRef] [Google Scholar]
38. Page AJ, Cummins CA, Hunt M, Wong VK, Reuter S, et al. Roary: быстрый крупномасштабный пангеномный анализ прокариот. Биоинформатика. 2015;31:3691–3693. doi: 10. 1093/биоинформатика/btv421. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1093/биоинформатика/btv421. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Прайс М.Н., Дехал П.С., Аркин А.П. FastTree: вычисление больших минимальных деревьев эволюции с профилями вместо матрицы расстояний. Мол Биол Эвол. 2009; 26:1641–1650. doi: 10.1093/molbev/msp077. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Scholz M, Ward DV, Pasolli E, Tolio T, Zolfo M, et al. Микробная эпидемиология на уровне штамма и популяционная геномика из дробовиковой метагеномики. Нат Методы. 2016;13:435–438. doi: 10.1038/nmeth.3802. [PubMed] [CrossRef] [Академия Google]
41. Lê S, Josse J, Husson F. FactoMineR: пакет R для многомерного анализа. J Stat Softw [Internet] 2008;25 [Google Scholar]
42. Банкевич А., Нурк С., Антипов Д., Гуревич А.А., Дворкин М. и др. SPAdes: новый алгоритм сборки генома и его приложения для секвенирования отдельных клеток. J Comput Mol Cell Biol. 2012; 19: 455–477. doi: 10.1089/cmb.2012.0021. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Parks DH, Imelfort M, Skennerton CT, Hugenholtz P, Tyson GW. CheckM: оценка качества микробных геномов, восстановленных из изолятов, отдельных клеток и метагеномов. Геном Res. 2015;25:1043–1055. doi: 10.1101/gr.186072.114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Parks DH, Imelfort M, Skennerton CT, Hugenholtz P, Tyson GW. CheckM: оценка качества микробных геномов, восстановленных из изолятов, отдельных клеток и метагеномов. Геном Res. 2015;25:1043–1055. doi: 10.1101/gr.186072.114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Bowers RM, Kyrpides NC, Stepanauskas R, Harmon-Smith M, Doud D, et al. Минимум информации о единичном амплифицированном геноме (MISAG) и геноме, собранном на основе метагенома (MIMAG) бактерий и архей. Нац биотехнолог. 2017; 35:725–731. doi: 10.1038/nbt.3893. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Buchfink B, Xie C, Huson DH. Быстрое и чувствительное выравнивание белков с помощью алмаза. Нат Методы. 2015;12:59–60. doi: 10.1038/nmeth.3176. [PubMed] [CrossRef] [Академия Google]
46. Chen Y, Brook TC, Alcon-Giner C, Clarke P, Hall LJ, et al. Черновые последовательности генома штаммов Citrobacter freundii и Citrobacter murliniae , выделенных из фекалий недоношенных детей. Microbiol Resour объявляет. 2019;8:e00494–19. doi: 10.1128/MRA.00494-19. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Microbiol Resour объявляет. 2019;8:e00494–19. doi: 10.1128/MRA.00494-19. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Chen Y, Brook T, Alcon-Giner C, Clarke P, Hall L, et al. Черновая последовательность генома Raoultella ornithinolytica P079F W, изолятов из фекалий недоношенного ребенка. Microbiol Resour объявляет. 2019;8:e00493–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Dobbler PT, Procianoy RS, Mai V, Silveira RC, Corso AL, et al. Низкое микробное разнообразие и аномальная микробная последовательность связаны с некротизирующим энтероколитом у недоношенных детей. Фронт микробиол. 2017;8:2243. doi: 10.3389/fmicb.2017.02243. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Greenwood C, Morrow AL, Lagomarcino AJ, Altaye M, Taft DH, et al. Раннее эмпирическое применение антибиотиков у недоношенных детей связано с более низким бактериальным разнообразием и более высокой относительной численностью Энтеробактер . J Педиатр. 2014; 165:23–29. doi: 10.1016/j.jpeds.2014.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J Педиатр. 2014; 165:23–29. doi: 10.1016/j.jpeds.2014.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Itani T, Ayoub Moubareck C, Melki I, Rousseau C, Mangin I, et al. У недоношенных детей с некротизирующим энтероколитом наблюдается несбалансированная микробиота кишечника. Акта Педиатр. 2018;107:40–47. doi: 10.1111/apa.14078. [PubMed] [CrossRef] [Google Scholar]
51. Vergnano S, Menson E, Kennea N, Embleton N, Russell AB, et al. Неонатальные инфекции в Англии: сеть эпиднадзора NeonIN. Arch Dis Child Fetal Neonatal Ed. 2011;96:F9–F14. doi: 10.1136/adc.2009.178798. [PubMed] [CrossRef] [Google Scholar]
52. Rodrigues C, Passet V, Rakotondrasoa A, Diallo TA, Criscuolo A, et al. Описание Klebsiella africanensis sp. nov., Klebsiella variicola subsp. tropicalensis subsp. ноябрь и Klebsiella variicola subsp. натуральной оспы subsp. ноябрь Рез микробиол. 2019;170:165–170. doi: 10.1016/j.resmic. 2019.02.003. [PubMed] [CrossRef] [Академия Google]
2019.02.003. [PubMed] [CrossRef] [Академия Google]
53. Holt KE, Wertheim H, Zadoks RN, Baker S, Whitehouse CA, et al. Геномный анализ разнообразия, структуры популяции, вирулентности и устойчивости к противомикробным препаратам у Klebsiella pneumoniae , серьезной угрозы для здоровья населения. Proc Natl Acad Sci U S A. 2015;112:E3574–E3581. doi: 10.1073/pnas.1501049112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Turton JF, Payne Z, Coward A, Hopkins KL, Turton JA, et al. Гены вирулентности в изолятах Klebsiella pneumoniae из Великобритании в течение 2016 г., в том числе среди положительных по гену карбапенемазы гипервирулентных K1-ST23 и «негипервирулентных» типов ST147, ST15 и ST383. J Med Microbiol. 2018;67:118–128. doi: 10.1099/jmm.0.000653. [PubMed] [CrossRef] [Google Scholar]
55. Turton JF, Perry C, Elgohari S, Hampton CV. ПЦР-характеристика и типирование Klebsiella pneumoniae с использованием капсульных типоспецифических тандемных повторов с переменным числом и мишеней генов вирулентности. J Med Microbiol. 2010; 59: 541–547. дои: 10.1099/Джмм.0.015198-0. [PubMed] [CrossRef] [Google Scholar]
J Med Microbiol. 2010; 59: 541–547. дои: 10.1099/Джмм.0.015198-0. [PubMed] [CrossRef] [Google Scholar]
56. Fung CP, Hu BS, Chang FY, Lee SC, Kuo BI, et al. Пятилетнее исследование сероэпидемиологии Klebsiella pneumoniae: высокая распространенность капсульного серотипа K1 на Тайване и влияние на эффективность вакцины. J заразить Dis. 2000;181:2075–2079. дои: 10.1086/315488. [PubMed] [CrossRef] [Google Scholar]
57. Нишино К., Сенда Ю., Ямагучи А. Регулятор СРБ модулирует множественную лекарственную устойчивость Escherichia coli путем репрессии генов множественного оттока лекарств mdtEF . Дж Антибиот. 2008; 61: 120–127. doi: 10.1038/ja.2008.120. [PubMed] [CrossRef] [Google Scholar]
58. Нагакубо С., Нишино К., Хирата Т., Ямагути А. Предполагаемый регулятор ответа BaeR стимулирует множественную лекарственную устойчивость Escherichia coli с помощью новой системы экспорта многих лекарств, MdtABC. J Бактериол. 2002; 184:4161–4167. doi: 10.1128/JB.184.15.4161-4167.2002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1128/JB.184.15.4161-4167.2002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Доменек-Санчес А., Эрнандес-Аллес С., Мартинес-Мартинес Л., Бенеди В.Дж., Альберти Себастьян, Альберти С. Идентификация и характеристика нового гена порина Klebsiella pneumoniae : его роль в устойчивости к β-лактамным антибиотикам . J Бактериол. 1999;181:2726–2732. doi: 10.1128/JB.181.9.2726-2732.1999. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Gunn JS, Lim KB, Krueger J, Kim K, Guo L, et al. PmrA-PmrB-регулируемые гены, необходимые для модификации 4-аминоарабинозного липида а и устойчивости к полимиксину. Мол микробиол. 1998;27:1171–1182. doi: 10.1046/j.1365-2958.1998.00757.x. [PubMed] [CrossRef] [Google Scholar]
61. Bohn C, Bouloc P. Ген Escherichia coli cmlA кодирует мультилекарственный эффлюксный насос Cmr/MdfA и отвечает за исключение изопропил-β-d-тиогалактопиранозида и чувствительность к спектиномицину. . J Бактериол. 1998; 180:6072–6075. doi: 10.1128/JB.180.22.6072-6075.1998. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1998; 180:6072–6075. doi: 10.1128/JB.180.22.6072-6075.1998. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Шринивасан В.Б., Раджамохан Г., КпнЭФ Р.Г. KpnEF, новый член Klebsiella pneumoniae регулон реакции на стресс клеточной оболочки представляет собой эффлюксный насос SMR-типа, участвующий в устойчивости к противомикробным препаратам широкого спектра действия. Противомикробные агенты Chemother. 2013;57:4449–4462. doi: 10.1128/AAC.02284-12. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
63. Сринивасан В.Б., Сингх Б.Б., Приядарши Н., Чаухан Н.К., Раджамохан Г. Роль новой мультилекарственной эффлюксной помпы, участвующей в лекарственной устойчивости у Klebsiella pneumoniae . ПЛОС Один. 2014;9:e96288. doi: 10.1371/journal.pone.0096288. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Esterly JS, Richardson CL, Eltoukhy NS, Qi C, Scheetz MH. Генетические механизмы устойчивости к противомикробным препаратам Acinetobacter baumannii . Энн Фармакотер. 2011;45:218–228. doi: 10.1345/aph.1P084. [PubMed] [CrossRef] [Google Scholar]
Энн Фармакотер. 2011;45:218–228. doi: 10.1345/aph.1P084. [PubMed] [CrossRef] [Google Scholar]
65. Tärnberg M, Nilsson LE, Monstein HJ. Молекулярная идентификация генов β-лактамаз blaSHV, blaLEN и blaOKP в Klebsiella pneumoniae путем двунаправленного секвенирования универсальных ампликонов blaSHV-PCR, меченных последовательностями SP6 и T7. Молекулярные зонды. 2009 г.;23:195–200. doi: 10.1016/j.mcp.2009.01.005. [PubMed] [CrossRef] [Google Scholar]
66. Regué M, Climent N, Abitiu N, Coderch N, Merino S, et al. Генетическая характеристика кластера генов Klebsiella pneumoniae waa , участвующих в биосинтезе основного липополисахарида. J Бактериол. 2001; 183:3564–3573. doi: 10.1128/JB.183.12.3564-3573.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Follador R, Heinz E, Wyres KL, Ellington MJ, Kowarik M, et al. Разнообразие Klebsiella pneumoniae поверхностные полисахариды. Микробная геномика. 2016; 2 doi: 10.1099/mgen. 0.000073. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
0.000073. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Beaugerie L, Metz M, Barbut F, Bellaiche G, Bouhnik Y, et al. Klebsiella oxytoca как возбудитель антибиотик-ассоциированного геморрагического колита. Клиническая гастроэнтерология и гепатология. 2003; 1: 370–376. doi: 10.1053/S1542-3565(03)00183-6. [PubMed] [CrossRef] [Google Scholar]
69. Högenauer C, Langner C, Beubler E, Lippe IT, Schicho R, et al. Klebsiella oxytoca как возбудитель антибиотик-ассоциированного геморрагического колита. N Engl J Med. 2006; 355: 2418–2426. doi: 10.1056/NEJMoa054765. [PubMed] [CrossRef] [Google Scholar]
70. Raveh-Sadka T, Thomas BC, Singh A, Firek B, Brooks B, et al. Кишечные бактерии редко встречаются у совместно госпитализированных недоношенных детей, независимо от развития некротизирующего энтероколита. электронная жизнь. 2015; 4 doi: 10.7554/eLife.05477. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Brisse S, Verhoef J. Филогенетическое разнообразие клинических изолятов Klebsiella pneumoniae и Klebsiella oxytoca , выявленное с помощью случайно амплифицированной полиморфной ДНК, секвенирования генов gyrA и parC и автоматического риботипирования. Int J Syst Evol Microbiol. 2001; 51: 915–924. doi: 10.1099/00207713-51-3-915. [PubMed] [CrossRef] [Google Scholar]
Филогенетическое разнообразие клинических изолятов Klebsiella pneumoniae и Klebsiella oxytoca , выявленное с помощью случайно амплифицированной полиморфной ДНК, секвенирования генов gyrA и parC и автоматического риботипирования. Int J Syst Evol Microbiol. 2001; 51: 915–924. doi: 10.1099/00207713-51-3-915. [PubMed] [CrossRef] [Google Scholar]
72. Herzog KAT, Schneditz G, Leitner E, Feierl G, Hoffmann KM, et al. Генотипы изолятов Klebsiella oxytoca от пациентов с внутрибольничной пневмонией отличаются от генотипов изолятов от пациентов с антибиотикоассоциированным геморрагическим колитом. Дж. Клин Микробиол. 2014; 52:1607–1616. doi: 10.1128/JCM.03373-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Passet V, Brisse S. Описание Klebsiella grimontii sp. ноябрь Int J Syst Evol Microbiol. 2018; 68: 377–381. doi: 10.1099/ijsem.0.002517. [PubMed] [CrossRef] [Google Scholar]
74. Саха Р., Фарранс К.Э., Вергезе Б. , Хонг С., Донофрио Р.С. Klebsiella michiganensis sp. nov., новая бактерия, выделенная из держателя зубной щетки. Карр микробиол. 2013;66:72–78. doi: 10.1007/s00284-012-0245-x. [PubMed] [CrossRef] [Google Scholar]
, Хонг С., Донофрио Р.С. Klebsiella michiganensis sp. nov., новая бактерия, выделенная из держателя зубной щетки. Карр микробиол. 2013;66:72–78. doi: 10.1007/s00284-012-0245-x. [PubMed] [CrossRef] [Google Scholar]
75. Merla C, Rodrigues C, Passet V, Corbella M, Thorpe HA, et al. Описание Klebsiella spallanzanii sp. ноябрь и Klebsiella pasteurii sp. ноябрь Фронт микробиол. 2019;10:2360. doi: 10.3389/fmicb.2019.02360. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. Морадигараванд Д., Мартин В., Пикок С.Дж., Паркхилл Дж. Структура популяции Klebsiella oxytoca с множественной лекарственной устойчивостью в больницах Соединенного Королевства и Ирландии идентифицирует общие гены вирулентности и устойчивости с K. pneumoniae . Геном Биол Эвол. 2017;9: 574–584. doi: 10.1093/gbe/evx019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Hu Y, Wei L, Feng Y, Xie Y, Zong Z. Klebsiella huaxiensis sp. nov., выделенный из мочи человека. Int J Syst Evol Microbiol. 2019;69:333–336. doi: 10.1099/ijsem.0.003102. [PubMed] [CrossRef] [Google Scholar]
nov., выделенный из мочи человека. Int J Syst Evol Microbiol. 2019;69:333–336. doi: 10.1099/ijsem.0.003102. [PubMed] [CrossRef] [Google Scholar]
78. Шибу П. Исследования видов, устойчивых к карбапенемам Klebsiella , и связанные с ними клинические соображения. Лондон: Вестминстер; 2019. [Google Академия]
79. Chun J, Oren A, Ventosa A, Christensen H, Arahal DR, et al. Предложены минимальные стандарты использования данных генома для таксономии прокариот. Int J Syst Evol Microbiol. 2018; 68: 461–466. doi: 10.1099/ijsem.0.002516. [PubMed] [CrossRef] [Google Scholar]
80. Goris J, Konstantinidis KT, Klappenbach JA, Coenye T, Vandamme P, et al. Значения гибридизации ДНК-ДНК и их связь со сходством последовательностей всего генома. Int J Syst Evol Microbiol. 2007; 57: 81–91. дои: 10.1099/ijs.0.64483-0. [PubMed] [CrossRef] [Google Scholar]
81. Рихтер М., Росселло-Мора Р. Изменение золотого стандарта генома для определения прокариотических видов. Proc Natl Acad Sci U S A. 2009;106:19126–19131. doi: 10.1073/pnas.0906412106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2009;106:19126–19131. doi: 10.1073/pnas.0906412106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Zheng B, Xu H, Yu X, Lv T, Jiang X и др. Идентификация и геномная характеристика изолята Klebsiella michiganensis , продуцирующего KPC-2, NDM-1 и NDM-5. J Антимикробная химиотерапия. 2018; 73: 536–538. дои: 10.1093/JAC/DKX415. [PubMed] [CrossRef] [Google Scholar]
83. Pedersen T, Sekyere JO, Govinden U, Moodley K, Sivertsen A, et al. Распространение карбапенемаз NDM-1 и GES-5, кодируемых плазмидами, среди энтеробактерий Enterobacteriaceae с широкой лекарственной устойчивостью и лекарственной устойчивостью в Дурбане, Южная Африка. Противомикробные агенты Chemother. 2018; 62 doi: 10.1128/AAC.02178-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Seiffert SN, Wüthrich D, Gerth Y, Egli A, Kohler P, et al. Первый клинический случай КПК-3 – производящий Klebsiella michiganensis в Европе. Новые микробы Новые инфекции. 2019;29:100516. doi: 10.1016/j.nmni.2019.100516. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2019;29:100516. doi: 10.1016/j.nmni.2019.100516. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Chou HC, Lee CZ, Ma LC, Fang C-T, Chang S-C и др. Выделение хромосомного участка Klebsiella pneumoniae , связанного с метаболизмом аллантоина и инфекцией печени. Заразить иммун. 2004; 72:3783–3792. doi: 10.1128/IAI.72.7.3783-3792.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Fevre C, Passet V, Weill François-Xavier, Grimont PAD, Brisse S. Варианты хромосомной бета-лактамазы Klebsiella pneumoniae OKP делятся на две основные группы: OKP-A и OKP-B. Противомикробные агенты Chemother. 2005; 49: 5149–5152. doi: 10.1128/AAC.49.12.5149-5152.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
87. Cano V, March C, Insua JL, Aguiló N, Llobet E, et al. Klebsiella lebsiella pneumoniae выживает в макрофагах, избегая попадания в лизосомы. Клеточная микробиология. 2015;17:1537–1560. doi: 10. 1111/cmi.12466. [PubMed] [CrossRef] [Академия Google]
1111/cmi.12466. [PubMed] [CrossRef] [Академия Google]
88. Скаар Э.П. Битва за железо между бактериальными патогенами и их позвоночными хозяевами. PLoS Патог. 2010;6:e1000949. doi: 10.1371/journal.ppat.1000949. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Flo TH, Smith KD, Sato S, Rodriguez DJ, Holmes MA, et al. Липокалин 2 опосредует врожденный иммунный ответ на бактериальную инфекцию путем секвестрации железа. Природа. 2004; 432:917–921. doi: 10.1038/nature03104. [PubMed] [CrossRef] [Google Scholar]
90. Bachman MA, Oyler JE, Burns SH, Caza M, Lépine F, et al. Klebsiella pneumoniae yersiniabactin способствует инфекции дыхательных путей за счет уклонения от липокалина 2. Infect Immun. 2011;79:3309–3316. doi: 10.1128/IAI.05114-11. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Lawlor MS, O’Connor C, Miller VL. Yersiniabactin является фактором вирулентности Klebsiella pneumoniae во время легочной инфекции.
