Роль селективных антагонистов лейкотриеновых рецепторов в терапии бронхиальной астмы, аллергического ринита и бронхоспазма, индуцированного физической нагрузкой
15.11.2016
Статья в формате PDF.
Признание важности лейкотриенов в патогенезе бронхиальной астмы (БА) в 70-80-х годах XX века привело к разработке нового класса препаратов для лечения данного заболевания – модификаторов лейкотриенов. Первый из представителей этого класса – зафирлукаст – был зарегистрирован в середине 90-х годов прошлого века. А наиболее изученным препаратом из группы антагонистов лейкотриеновых рецепторов в настоящее время является монтелукаст, возможности и преимущества которого в лечении ряда заболеваний рассмотрены в данной статье.
Монтелукаст – флагман класса антагонистов лейкотриеновых рецепторов
Несмотря на продолжающиеся дискуссии и исследования, антагонисты лейкотриеновых рецепторов прочно вошли в протоколы лечения БА в разных странах, в том числе в Украине.
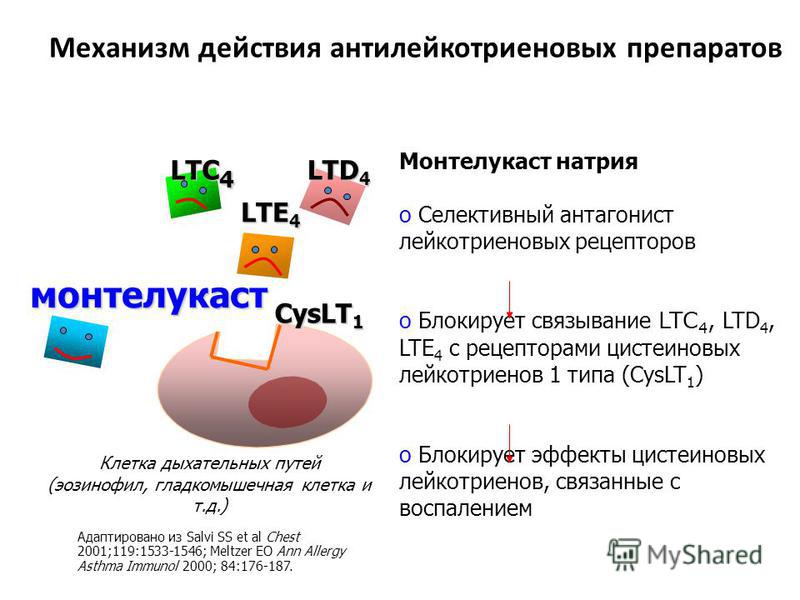
! Монтелукаст обладает высоким сродством и селективностью по отношению к цистеиниловым лейкотриеновым рецепторам CysLT1. Обратимо связываясь с ними, он ингибирует физиологическое действие лейкотриенов D4, С4 и Е4.
Обратимо связываясь с ними, он ингибирует физиологическое действие лейкотриенов D4, С4 и Е4.
Роль лейкотриенов в патогенезе БА и АР
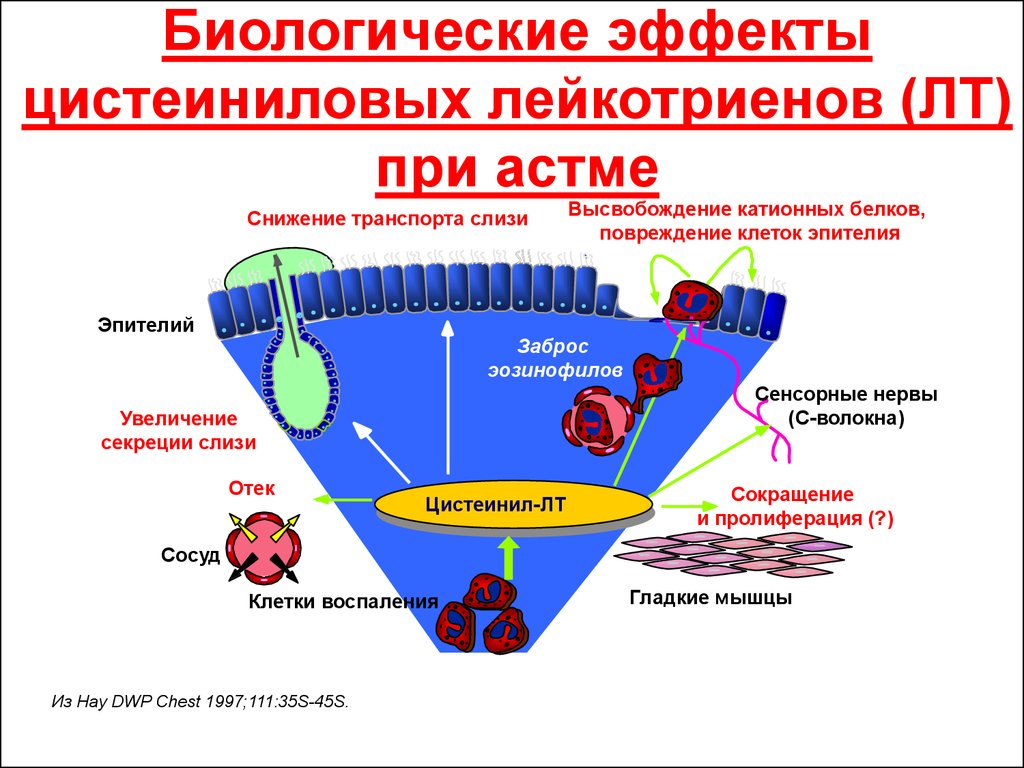
Ключевым фактором патогенеза БА и АР являются реакции воспаления в дыхательных путях, в развитии которых принимают участие многочисленные провоспалительные медиаторы. Среди них особое место занимают цистеиниловые лейкотриены (CysLTs), которые являются общими медиаторами для БА и АР.
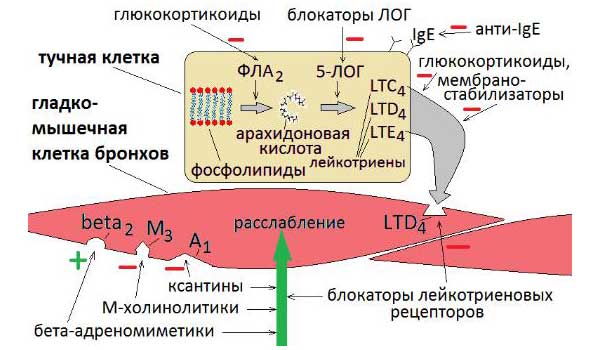
Цистеиниловые лейкотриены (C4, D4 и E4) представляют собой семейство воспалительных липидных медиаторов, синтезируемых из арахидоновой кислоты различными типами клеток, в том числе тучными клетками, эозинофилами, базофилами и макрофагами. Цистеиниловые лейкотриены образуют связь с двумя подтипами рецепторов – CysLT1 и CysLT2. Эти рецепторы присутствуют на поверхности интерстициальных и железистых клеток слизистой оболочки дыхательных путей, гладкомышечных клеток бронхов, воспалительных клеток (базофилов, нейтрофилов, эозинофилов, макрофагов, тучных клеток).
В исследовании Krell и соавт. (1990) было показано, что ингаляции лейкотриенов С4 и D4 являются в 1000 раз более мощными и более продолжительно действующими триггерами бронхообструкции по сравнению с гистамином. При этом в исследовании Davidson и соавт. (1987) установлено, что дыхательные пути пациентов с астмой во много раз чувствительнее к ингаляциям лейкотриенов, чем дыхательные пути здоровых людей. Повышенный уровень лейкотриенов был идентифицирован в плазме, моче, в мокроте и бронхоальвеолярной жидкости у пациентов с обострением БА, а также после проведения антигенной стимуляции. Другие исследования (de Graaf-in’t Veld et al.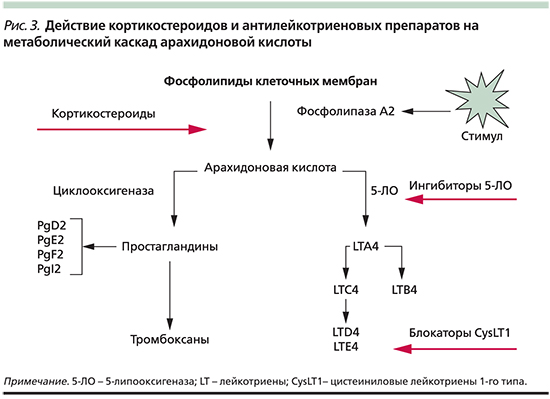
! Совокупность представленных данных подтверждает, что лейкотриены являются одними из ключевых медиаторов и модуляторов воспалительного ответа при БА и АР, что делает целесообразным включение в схемы их лечения антагонистов лейкотриеновых рецепторов.
Доказательная база эффективности монтелукаста при БА, АР и бронхоспазме, индуцированном физической нагрузкой
В ряде клинических исследований продемонстрировано, что прием монтелукаста приводит к улучшению показателей контроля БА, в том числе объема форсированного выдоха за первую секунду (ОФВ1), выраженности симптомов, потребности в бронхолитиках короткого действия. Параметры функции внешнего дыхания начинают улучшаться уже через 15 мин после перорального приема препарата, при этом эффект сохраняется не менее 24 ч.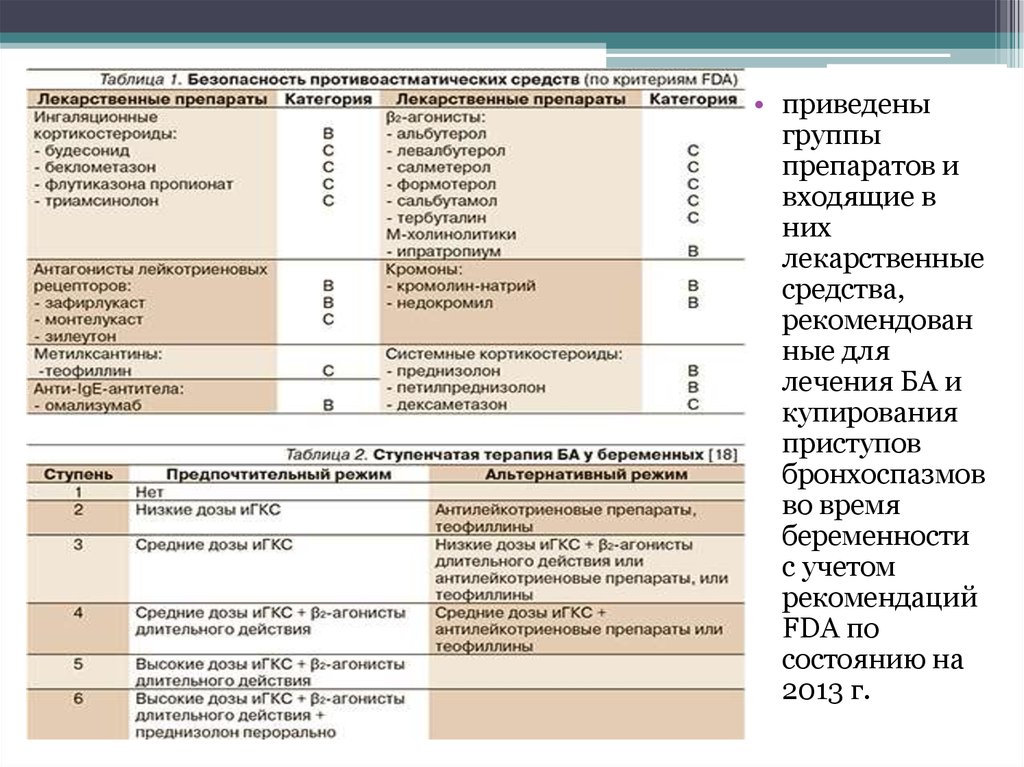
Так, D. Berube и соавт. (2014) сообщили о результатах крупного многоцентрового 12-недельного открытого наблюдательного исследования, посвященного изучению эффективности монтелукаста в виде монотерапии или в комбинации с ИКС у педиатрических больных с неконтролируемой БА (показатель опросника контроля астмы ACQ более 0,75 балла). В исследовании приняли участие 328 детей в возрасте 6,9±3,4 года. Из них 76 (23,2%) получали монтелукаст в качестве монотерапии и 252 (76,8%) в сочетании с ИКС. Через 4 нед у 61,3% пациентов в группе монотерапии и у 52,9% в группе комбинированного лечения удалось достичь контроля над астмой.
Через 12 нед число пациентов, которые достигли контроля заболевания, увеличилось до 75 и 70,9% соответственно. При этом наблюдалось клинически и статистически значимое снижение баллов по опроснику ACQ: в группе монотерапии с 1,67±0,69 до 0,71±0,70 в течение 4 нед и с 0,50±0,52 через 12 нед; в группе комбинированной терапии – с 2,02±0,83 до 0,90±0,86 через 4 нед и 0,64±0,86 через 12 нед.
Эффективность и безопасность монтелукаста в лечении АР были изучены в систематическом обзоре Nayak и соавт. (2007). В него было включено восемь крупных рандомизированных плацебо-контролируемых двойных слепых клинических исследований, посвященных оценке эффективности монтелукаста в качестве монотерапии и в комбинации с антигистаминными препаратами у пациентов с сезонным и круглогодичным АР в сочетании или без БА. Результаты анализа свидетельствуют о том, что назначение монтелукаста привело к улучшению состояния в значительно большей степени, чем в группе плацебо, а добавление антагониста лейкотриеновых рецепторов к антигистаминным препаратам обеспечивало более высокую эффективность, чем монотерапия. При этом монтелукаст хорошо переносился и продемонстрировал благоприятный профиль безопасности.
В ряде исследований изучена роль монтелукаста в предотвращении бронхоспазма, индуцированного физической нагрузкой, у детей и взрослых.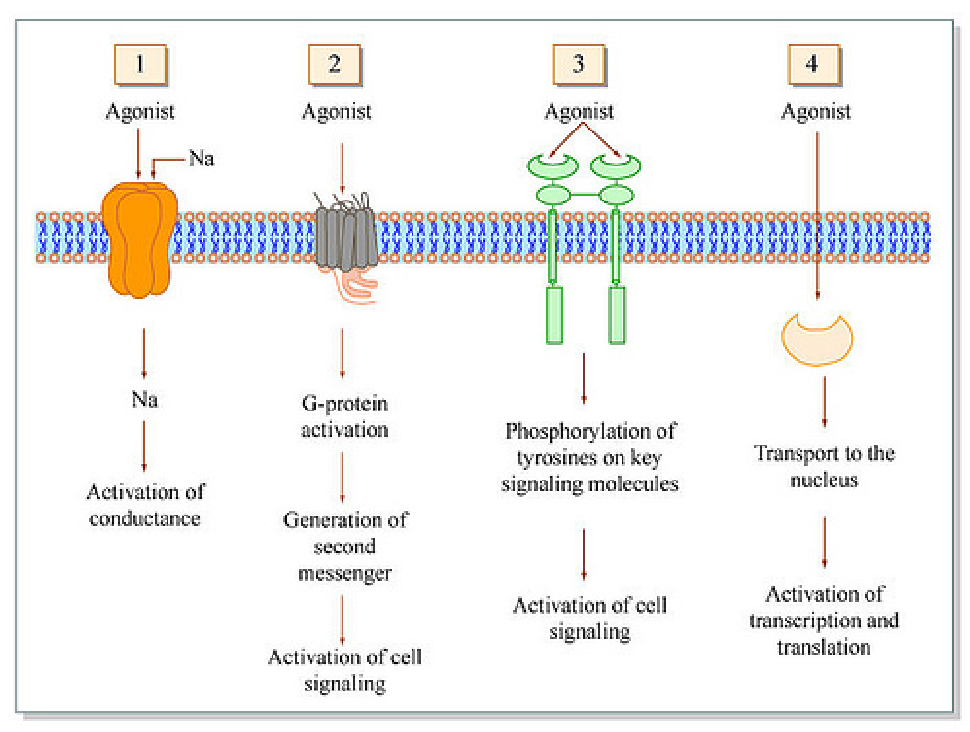 В частности, J.M. Edelman и соавт. (2000) в результате проведенного 8-недельного многоцентрового рандомизированного двойного слепого исследования пришли к выводу, что пероральный прием препарата монтелукаста один раз в день обеспечивает защиту от развития бронхоспазма, индуцированного физической нагрузкой, в течение суток. В исследовании принял участие 191 взрослый пациент с БА с документированным бронхоспазмом, индуцированным физической нагрузкой.
В частности, J.M. Edelman и соавт. (2000) в результате проведенного 8-недельного многоцентрового рандомизированного двойного слепого исследования пришли к выводу, что пероральный прием препарата монтелукаста один раз в день обеспечивает защиту от развития бронхоспазма, индуцированного физической нагрузкой, в течение суток. В исследовании принял участие 191 взрослый пациент с БА с документированным бронхоспазмом, индуцированным физической нагрузкой.
Пациенты были разделены на две группы, одна из которых получала монтелукаст (10 мг один раз вечером), вторая – сальметерол (50 мкг две ингаляции в сутки). Уже с 3-го дня исследования у пациентов обеих групп отмечалось статистически значимое улучшение функции внешнего дыхания, которую оценивали по степени снижения ОФВ1 после физической нагрузки. Однако через 4 и 8 нед протективный эффект сальметерола значительно уменьшился, в то время как в группе монтелукаста улучшение было устойчивым. Так, на 8-й неделе в группе монтелукаста снижение ОФВ
Лукаст – эффективность, безопасность и доступность
Одним из препаратов монтелукаста, представленных на украинском рынке и доступных широкому кругу пациентов, является Лукаст®. Он зарекомендовал себя как эффективный и безопасный препарат. Так, например, хорошие результаты были получены в отечественном исследовании, проведенном на базе Национального института фтизиатрии и пульмонологии им. Ф.Г. Яновского, в котором были изучены эффективность и переносимость препарата Лукаст
В этом клиническом испытании принимали участие 30 пациентов в возрасте от 25 до 75 лет, не получавшие стероиды на протяжении последних трех месяцев перед включением в исследование. В течение трех месяцев все пациенты получали препарат Лукаст® в таблетках по 10 мг один раз в сутки в качестве базисной терапии и сальбутамол по потребности. Такое лечение привело к существенному уменьшению выраженности симптомов астмы, сокращению потребности в бронхолитике короткого действия и улучшило контроль БА по результатам тестов контроля астмы АСТ и АСQ.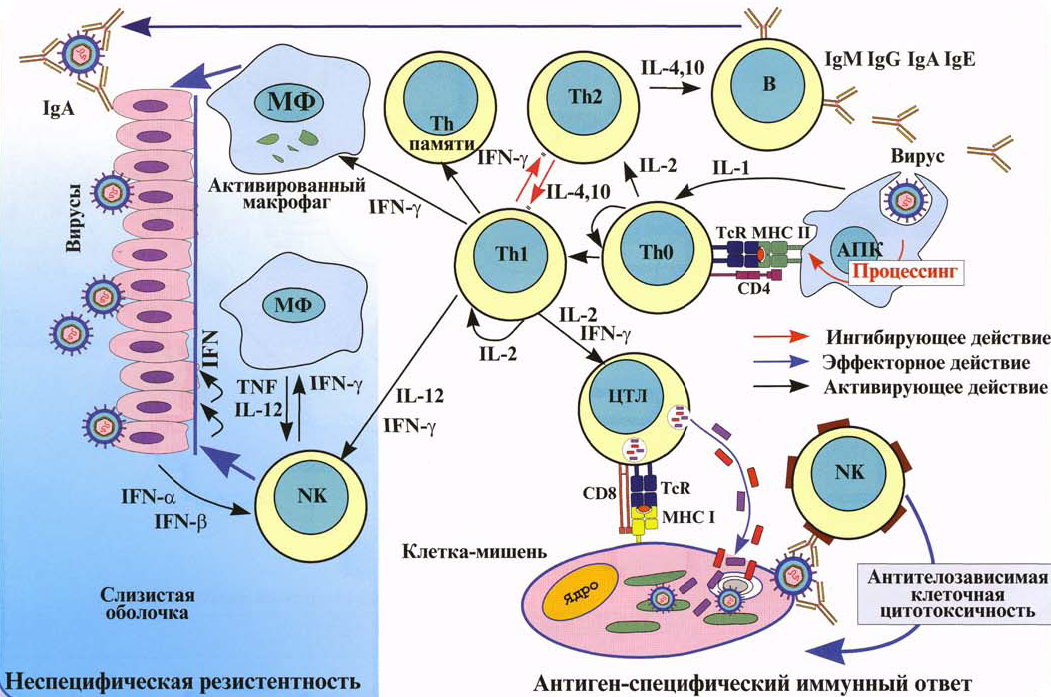 Кроме того, проведенная терапия привела к снижению гиперреактивности бронхов и уменьшению симптомов сопутствующего АР. Препарат хорошо переносился пациентами, нежелательных реакций отмечено не было.
Кроме того, проведенная терапия привела к снижению гиперреактивности бронхов и уменьшению симптомов сопутствующего АР. Препарат хорошо переносился пациентами, нежелательных реакций отмечено не было.
! Авторы этого исследования сделали вывод, что проведение противовоспалительной терапии препаратом Лукаст® эффективно и безопасно у стероид-наивных пациентов с легким течением БА.
Таким образом, имеющиеся сегодня научные данные указывают на важную роль лейкотриенов в патогенезе БА, АР и бронхоспазма, индуцированного физической нагрузкой. В свою очередь включение антагониста лейкотриеновых рецепторов монтелекаста (Лукаст) в схемы лечения этих патологических состояний значительно улучшает их контроль.
Подготовила Елена Васильева
24. 03.2023
Пульмонологія та оториноларингологіяТерапія та сімейна медицинаГоловний і лицевий біль при риносинуситі: диференційна діагностика та лікування
03.2023
Пульмонологія та оториноларингологіяТерапія та сімейна медицинаГоловний і лицевий біль при риносинуситі: диференційна діагностика та лікування
Запальні захворювання приносових пазух часто супроводжуються больовими відчуттями – головним і лицевим болем [1]. Неконтрольований гострий біль значно знижує якість життя пацієнтів із цими захворюваннями: спричиняє психоемоційні розлади, знижує працездатність і соціальну активність, сприяє хронізації больового синдрому і збільшує вартість лікування [2]. Призначаючи знеболювальний засіб пацієнту з риносинуситом (РС), варто враховувати не лише аналгетичну ефективність препарату, а й швидкість початку дії, частоту побічних ефектів, вплив на основні ланки патогенезу захворювання тощо….
20.03.2023 Пульмонологія та оториноларингологіяЕфективність назального спрея мометазону фуроату в лікуванні гострого риносинуситу
Основою лікування гострого бактеріального риносинуситу є протимікробні препарати.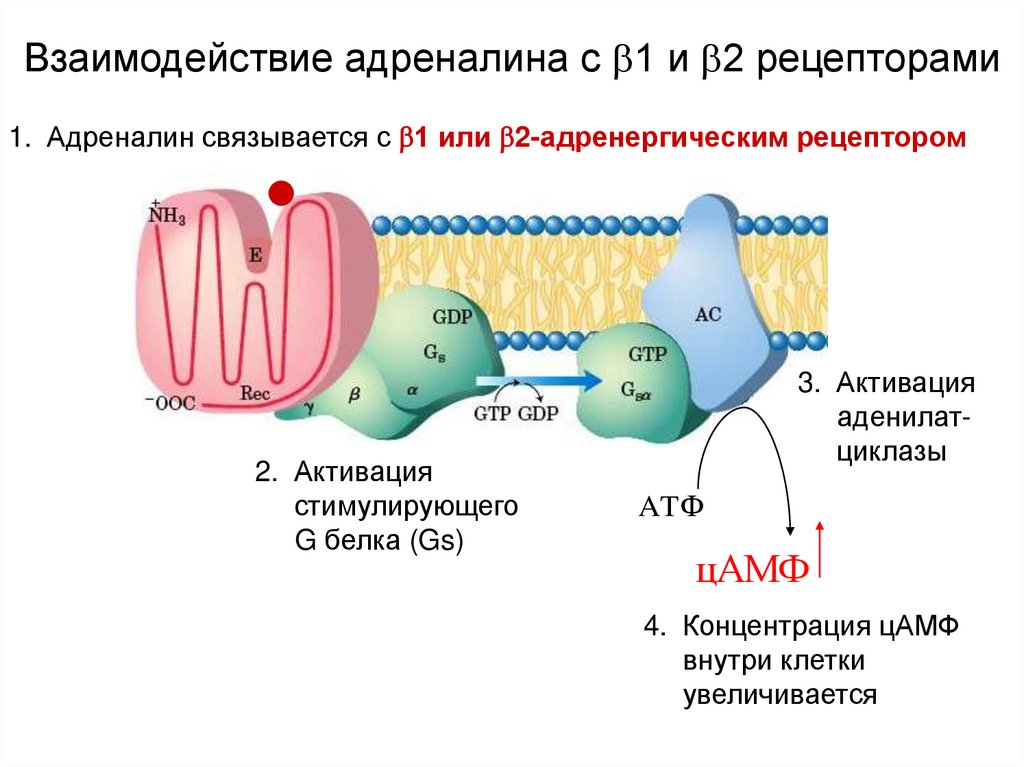 Втім, додавання до антибіотиків інтраназальних кортикостероїдів може прискорити одужання і зменшити частоту та тяжкість рецидивів. Саме тому метою цього дослідження було порівняти ефективність комбінації назального спрея мометазону фуроату з пероральним амоксициліном і амоксициліну окремо в лікуванні гострого риносинуситу….
Втім, додавання до антибіотиків інтраназальних кортикостероїдів може прискорити одужання і зменшити частоту та тяжкість рецидивів. Саме тому метою цього дослідження було порівняти ефективність комбінації назального спрея мометазону фуроату з пероральним амоксициліном і амоксициліну окремо в лікуванні гострого риносинуситу….
16.03.2023 Пульмонологія та оториноларингологіяРесперо Миртол у разі гострого вірусного риносинуситу: рандомізоване плацебо-контрольоване клінічне дослідження
Гострий вірусний риносинусит (ГВРС) клінічно проявляється запаленням слизової оболонки носа та приносових пазух. Ключовими симптомами ГВРС є ринорея (виділення з носа), постназальне затікання, закладеність носа, біль у ділянці обличчя, ускладнене носове дихання та розлади нюху [1]. ГВРС є одним із найпоширеніших розладів, які трапляються в закладах первинної медичної допомоги. Річна поширеність цього стану становить 6-15% [1], а щорічна захворюваність – від 2 до 5 епізодів на людину [2]. Незважаючи на свій самообмежувальний характер, ГВРС має високу соціально-економічну значущість із погляду втрати продуктивності, негативного впливу на якість життя та витрат для систем охорони здоров’я. Отже, сучасні варіанти лікування спрямовані на зменшення тяжкості захворювання. Зокрема, рекомендується симптоматичне лікування деконгестантами, аналгетиками, промиванням носа фізіологічним розчином і лікарськими засобами рослинного походження, які є переважною початковою стратегією лікування для дорослих із ГВРС….
ГВРС є одним із найпоширеніших розладів, які трапляються в закладах первинної медичної допомоги. Річна поширеність цього стану становить 6-15% [1], а щорічна захворюваність – від 2 до 5 епізодів на людину [2]. Незважаючи на свій самообмежувальний характер, ГВРС має високу соціально-економічну значущість із погляду втрати продуктивності, негативного впливу на якість життя та витрат для систем охорони здоров’я. Отже, сучасні варіанти лікування спрямовані на зменшення тяжкості захворювання. Зокрема, рекомендується симптоматичне лікування деконгестантами, аналгетиками, промиванням носа фізіологічним розчином і лікарськими засобами рослинного походження, які є переважною початковою стратегією лікування для дорослих із ГВРС….
10.03.2023 Пульмонологія та оториноларингологіяСольові розчини для носа при гострому риносинуситі
Риносинусит – поширене захворюванням у більшості країн світу, котре спричиняє значний суспільний тягар, зумовлений споживанням медичних послуг і зниженням продуктивності праці. Річна поширеність гострого риносинуситу (ГРС) становить 6-15%. Етіологічними агентами ГРС здебільшого є різноманітні вірусні інфекції. Гострий бактеріальний риносинусит (ГБРС) розвивається тільки у 0,5-2% пацієнтів з ознаками риносинуситу, тому рутинне призначення антибактеріальної терапії при ГРС є недоцільним….
Річна поширеність гострого риносинуситу (ГРС) становить 6-15%. Етіологічними агентами ГРС здебільшого є різноманітні вірусні інфекції. Гострий бактеріальний риносинусит (ГБРС) розвивається тільки у 0,5-2% пацієнтів з ознаками риносинуситу, тому рутинне призначення антибактеріальної терапії при ГРС є недоцільним….
Роль лейкотриенов в развитии бронхообструктивного синдрома
Двадцать первое столетие ознаменовалось значительным подъемом заболеваемости бронхиальной астмой, занимающей первое место среди хронических болезней органов дыхания: до 10 % населения страдает данной патологией. На распространенность и тяжесть течения бронхиальной астмы влияют многочисленные факторы: наследственность, микроокружение, климат, уровень развития общества, материальная обеспеченность, социальная и расовая принадлежность [1, 10, 11]. Несмотря на то, что бронхиальная астма рассматривается сегодня как заболевание, поддающееся лечению и эффективной профилактике обострений, полный контроль над ее течением не достигнут. Приступы бронхиальной астмы, протекающие с частыми обострениями, потерей трудоспособности, значительно влияют на качество жизни ребенка, вызывая ограничение физических нагрузок, частые приступы затрудненного дыхания в ночные часы, обращения за неотложной помощью, длительные госпитализации [2, 15]. Одной из причин данной ситуации является гиподиагностика заболевания и, как следствие, позднее установление диагноза.
Приступы бронхиальной астмы, протекающие с частыми обострениями, потерей трудоспособности, значительно влияют на качество жизни ребенка, вызывая ограничение физических нагрузок, частые приступы затрудненного дыхания в ночные часы, обращения за неотложной помощью, длительные госпитализации [2, 15]. Одной из причин данной ситуации является гиподиагностика заболевания и, как следствие, позднее установление диагноза.
Современная концепция рассматривает бронхиальную астму как хронический воспалительный процесс в бронхиальном дереве, характер которого регулируется различными клеточными элементами: эозинофилами, тучными клетками, Тлимфоцитами, макрофагами и каскадом медиаторов [3]. Хроническое воспаление респираторного тракта рассматривается как центральный фактор патогенеза и клинических симптомов бронхиальной астмы, приводящий к обструкции и гиперреактивности дыхательных путей, являющихся главными отличительными признаками заболевания и характеризующихся наличием дисплазии и десквамации эпителия, увеличением числа бокаловидных желез, миграцией воспалительных клеток и продукцией различных медиаторов воспаления [4]. Воспалительный процесс затрагивает все структурные элементы стенки бронхиального дерева: эпителиальный слой, базальную мембрану, бронхассоциированные лимфатические узлы, сосуды, гладкие мышцы бронхов. Патогенетические механизмы при атопической форме бронхиальной астмы опосредуются через дегрануляцию тучных клеток, эозинофилов, базофилов, вследствие IgEопосредованной аллергической реакции «антиген — антитело». Повышение уровня общего IgE и наличие IgEантител к экзогенным аллергенам в сыворотке крови являются основными маркерами сенсибилизации. Тучные клетки и базофилы занимают центральное место в развитии аллергической реакции — они имеют большое количество гранул, содержащих гистамин, а также на их мембране находятся высокоаффинные рецепторы к IgE. Большая часть общего IgE фиксирована на высокоаффинном рецепторе мембраны тучных клеток и базофилах. При распознавании поступившего аллергена антителами, фиксированными на тучных клетках, происходит агрегация IgE и реагирование высокоаффинных рецепторов, что запускает каскад активации тучных клеток и базофилов и секрецию активных медиаторов аллергии [1, 10, 11].
Воспалительный процесс затрагивает все структурные элементы стенки бронхиального дерева: эпителиальный слой, базальную мембрану, бронхассоциированные лимфатические узлы, сосуды, гладкие мышцы бронхов. Патогенетические механизмы при атопической форме бронхиальной астмы опосредуются через дегрануляцию тучных клеток, эозинофилов, базофилов, вследствие IgEопосредованной аллергической реакции «антиген — антитело». Повышение уровня общего IgE и наличие IgEантител к экзогенным аллергенам в сыворотке крови являются основными маркерами сенсибилизации. Тучные клетки и базофилы занимают центральное место в развитии аллергической реакции — они имеют большое количество гранул, содержащих гистамин, а также на их мембране находятся высокоаффинные рецепторы к IgE. Большая часть общего IgE фиксирована на высокоаффинном рецепторе мембраны тучных клеток и базофилах. При распознавании поступившего аллергена антителами, фиксированными на тучных клетках, происходит агрегация IgE и реагирование высокоаффинных рецепторов, что запускает каскад активации тучных клеток и базофилов и секрецию активных медиаторов аллергии [1, 10, 11]. В процессе активации тучных клеток и базофилов секретируются различные биологически активные вещества: преформированные (депонированные в гранулах) и синтезируемые de novo. Так, гистамин повышает сосудистую проницаемость и сокращение гладкой мускулатуры бронхов, усиливает продукцию слизи. Роль нейтральных протеаз (триптаза, химотриптаза, карбоксипротеаза), также участвующих в аллергическом воспалительном процессе, не ясна.
В процессе активации тучных клеток и базофилов секретируются различные биологически активные вещества: преформированные (депонированные в гранулах) и синтезируемые de novo. Так, гистамин повышает сосудистую проницаемость и сокращение гладкой мускулатуры бронхов, усиливает продукцию слизи. Роль нейтральных протеаз (триптаза, химотриптаза, карбоксипротеаза), также участвующих в аллергическом воспалительном процессе, не ясна.
Из других активных веществ, синтезируемых de novo, известны липидные: лейкотриены C4, D4, E4, так же, как и гистамин, повышающие сосудистую проницаемость, сокращающие гладкую мускулатуру бронхов и усиливающие продукцию слизи; лейкотриен В4, вызывающий хемотаксис нейтрофилов; простагландины D2 и F2, сокращающие гладкую мускулатуру бронхов; тромбоксан А2, вызывающий вазоконстрикцию, сокращающий гладкую мускулатуру бронхов и способствующий агрегации тромбоцитов; фактор активации тромбоцитов, повышающий сосудистую проницаемость, сокращающий гладкую мускулатуру бронхов, вызывающий хемотаксис и активацию эозинофилов и нейтрофилов; цитокины: интерлейкин4, стимулирующий гуморальный и угнетающий клеточный иммунный ответ, способствующий переключению Вклеток на синтез IgE, активирующий фибробласты, интерлейкин5, способствующий активации эозинофилов; фактор некроза опухоли , стимулирующий экспрессию молекулы адгезии эндотелиальными клетками.
Эозинофилы также играют немаловажную роль в развитии хронического воспаления в респираторном тракте при бронхиальной астме. При обострении заболевания наблюдается активация эозинофилов и синтез высокотоксичных медиаторов воспаления, таких как основной протеин и эозинофильный катионный протеин. Наличие последнего в биологических средах организма является достоверным маркером аллергического воспаления.
Факторами, которые играют немаловажную роль в развитии хронического воспаления в респираторном тракте, секретируя провоспалительные цитокины и хемокины, являются и эпителиальные клетки в активированном виде [1, 10, 11].
В настоящее время реальный интерес представляет изучение и исследование воспалительного неаллергического механизма формирования бронхиальной астмы и рекуррентных форм острого обструктивного бронхита у детей, т.е. развития неиммунного, не IgEопосредованного воспалительного процесса, в частности роли лейкотриенов в генезе бронхообструктивного процесса.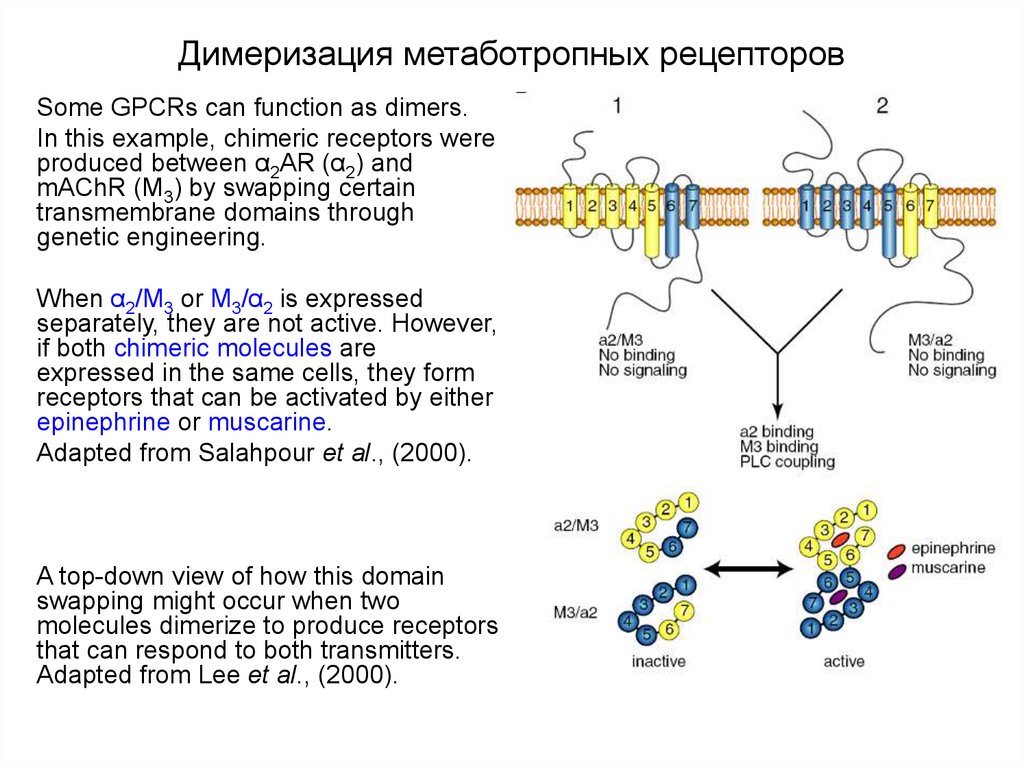 Лейкотриены являются сильными спазмогенами гладких мышц дыхательных путей и кишечника.
Лейкотриены являются сильными спазмогенами гладких мышц дыхательных путей и кишечника.
Известно, что лейкотриены продуцируются различными воспалительными клетками, участвующими в патогенезе бронхиальной астмы, включая эозинофилы, тучные клетки, макрофаги, моноциты [5]. Лейкотриены А4, В4, С4, D4, Е4 синтезируются по липоксигеназному пути из мембраносвязанной арахидоновой кислоты во время клеточной активации с участием фермента 5липоксигеназа. Арахидоновая кислота синтезируется из полиненасыщенных жирных кислот под влиянием фермента фосфолипазы А2. Промежуточными метаболитами между полиненасыщенной жирной кислотой и арахидоновой кислотой являются линолевая и линоленовая кислоты, превращающиеся в арахидоновую кислоту под действием 6 и 3 жирных кислот, которые и определяют качественный состав как арахидоновой кислоты, так и лейкотриенов. Гиперпродукция или ускоренное производство лейкотриенов начинается при взаимодействии клеток, способных синтезировать лейкотриены, а именно эозинофилы, тучные клетки, макрофаги, моноциты, с комплексом «антиген — антитело» или комплексом «IgE — антитело».
Последние исследования свидетельствуют, что преимущественная локализация фермента 5липоксигеназы, участвующего в синтезе лейкотриенов А4, В4 С4, D4, Е4, — ядерная оболочка, где и происходит синтез лейкотриенов. Расщепление арахидоновой кислоты с ферментом 5липоксигеназы приводит к образованию нестабильного промежуточного метаболита 5гидропероксиэйкозатетраеновой кислоты, а затем нестабильного и неактивного лейкотриена А4. Гидролиз лейкотриена А4 приводит к образованию лейкотриена В4 с последующей биотрансформацией в лейкотриены С4, D4 и Е4. Клетки, имеющие полный ферментативный состав (эозинофилы, тучные клетки и базофилы), способны образовывать значительное количество сульфидопептидных лейкотриенов (С4, D4, Е4), а эндотелиальные клетки и тромбоциты, не имеющие данного фермента, но имеющие фермент лейкотриен С4синтетаза, способны синтезировать лейкотриен С4 из лейкотриена А4, образованного нейтрофилами, благодаря механизму трансклеточного метаболизма. Лейкотриены опосредуют свое действие через специфический рецепторный механизм, посредством наличия в тканях лигандов для соответствующего лейкотриена.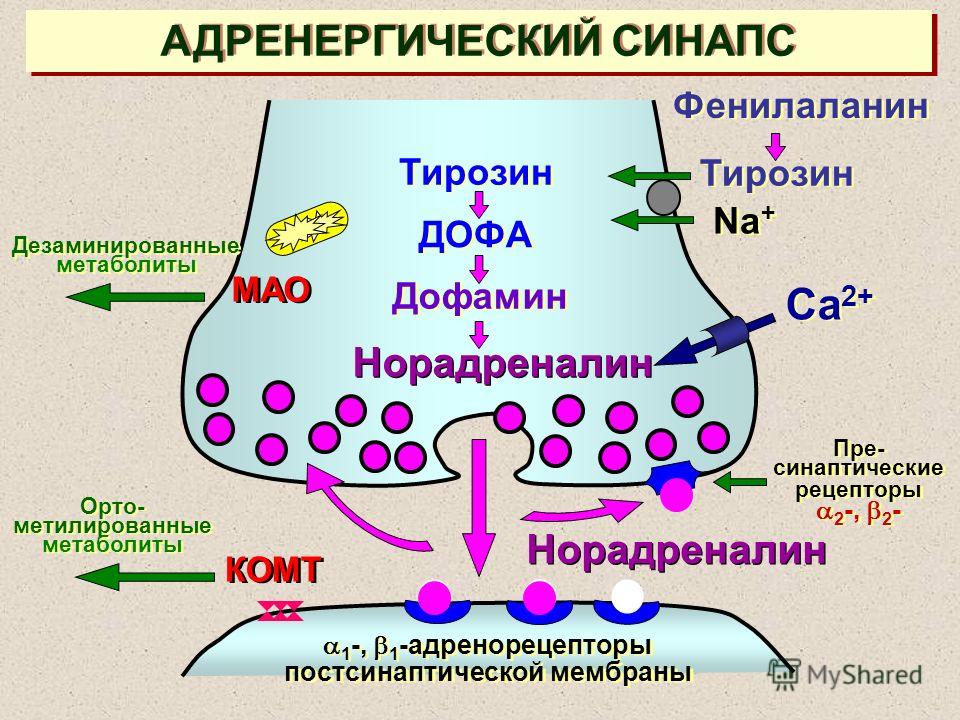
В физиологических условиях существуют системы, ингибирующие синтез лейкотриенов [6, 12–14]. Тормозное действие на синтез лейкотриенов оказывает, в частности, липокортин — высокополимерный протеин, представленный в различных клетках, включая моноциты и нейтрофилы. Образование липокортина регулируется уровнем циркулирующих в организме кортикостероидов, индуцирующих его образование. Действие липокортина связано с ингибированием активности фосфолипазы A2, в связи с чем тормозится высвобождение арахидоновой кислоты из фосфолипидов и таким образом блокируется образование лейкотриенов. Активность липоксигеназы регулируется гидроперекисями жирных кислот, которые даже в небольших количествах активируют эти ферменты. При этом патологический сигнал нарастает по механизму порочного круга. Механизм возвращения функционирования системы к физиологическому уровню, повидимому, связан с аутокатализом и аутоингибированием ферментов, для воспроизводства которых требуется определенное время [6, 12–14].
Основное место синтеза лейкотриенов — легкие, аорта и тонкий кишечник, фермент 5липоксигеназа обнаружен в эпифизе. Известно, что эпифиз является основным источником мелатонина, синтез которого в пинеалоцитах происходит в темноте и резко снижается на свету. Исследования показали, что мелатонин подавляет экспрессию гена фермента 5липоксигеназы. Данный механизм описан в Влимфоцитах человека, но, повидимому, является универсальным механизмом контроля за продукцией лейкотриенов, так как удаление эпифиза приводило к увеличению экспрессии мРНК фермента 5липоксигеназы в гиппокампе крыс [6, 12–14]. Наиболее интенсивно синтез лейкотриенов осуществляется альвеолярными макрофагами под влиянием различных вирусов, бактерий, эндотоксинов.
Лейкотриены играют важную роль в развитии бронхиальной астмы и рекуррентных форм острого обструктивного бронхита у детей, вызывая отек слизистой оболочки дыхательных путей вследствие выхода из сосудов жидкости и белка, увеличение секреции мокроты, спазм дыхательной мускулатуры. Кроме того, лейкотриены могут способствовать возникновению инфильтрации стенки бронхов клетками воспаления, особенно эозинофилами [7]. Эозинофильная инфильтрация стенки бронхов и выброс лейкотриенов формируют основу амплификационного механизма для привлечения лейкоцитов в дыхательные пути.
Кроме того, лейкотриены могут способствовать возникновению инфильтрации стенки бронхов клетками воспаления, особенно эозинофилами [7]. Эозинофильная инфильтрация стенки бронхов и выброс лейкотриенов формируют основу амплификационного механизма для привлечения лейкоцитов в дыхательные пути.
Лейкотриены обладают в 1000 раз большей бронхообструктивной активностью, чем гистамин in vitro, а его эффект в 2,5 раза продолжительнее, чем у гистамина, что и определяет не IgEзависимый путь развития бронхиальной астмы [8].
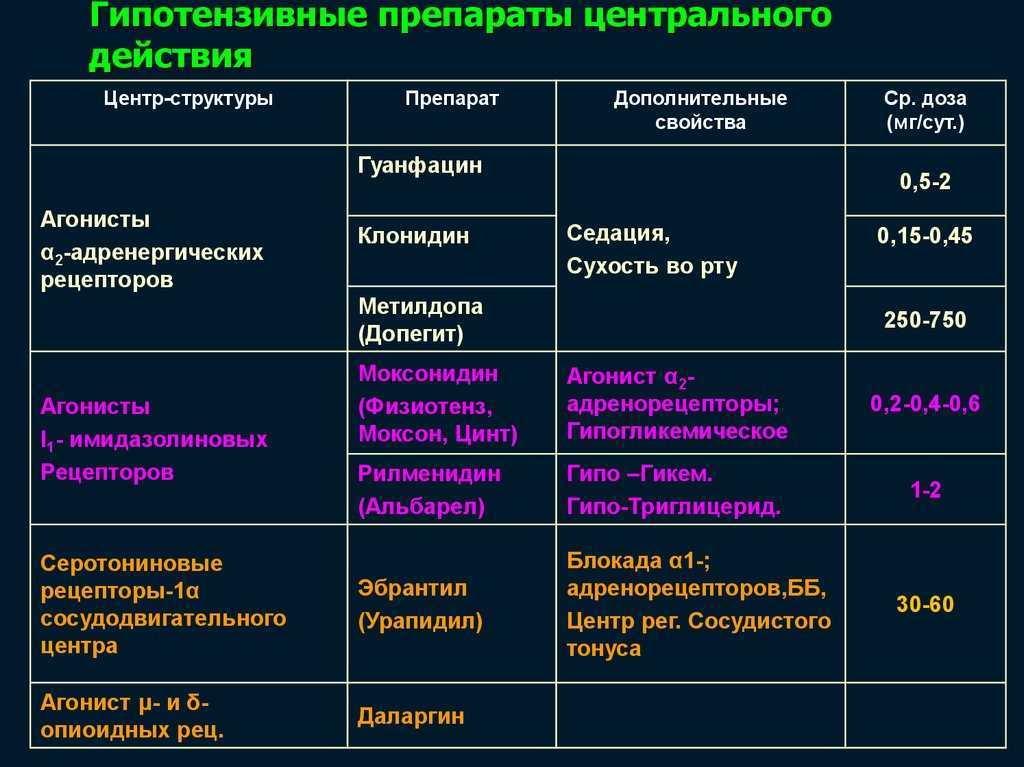
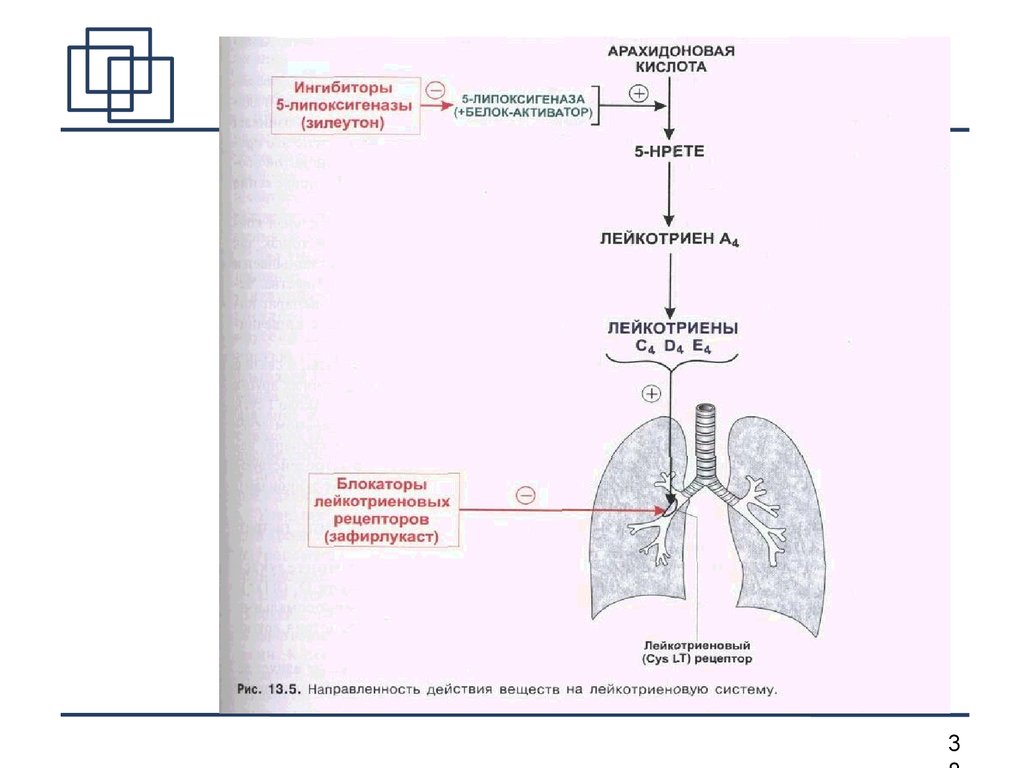
Таким образом, возникает необходимость определения новых подходов к лечению бронхиальной астмы. Одним из них подходов является угнетение или блокирование патофизиологических эффектов лейкотриенов. Существует два основных способа достижения данной цели — ингибирование образования лейкотриенов и блокирование специфических рецепторов к лейкотриенам, что снижает их влияние на воспалительный процесс. В связи с этим антилейкотриеновые препараты могут быть разделены на две группы: ингибиторы синтеза лейкотриенов и блокаторы специфических лейкотриеновых рецепторов.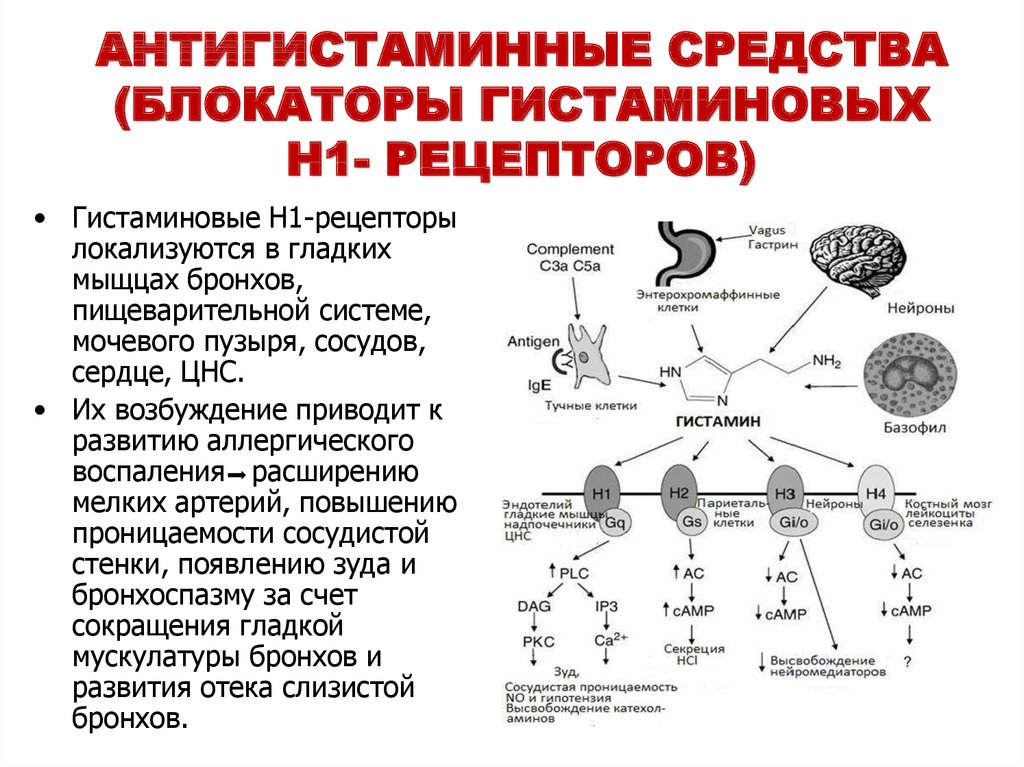 Препараты первой группы, к которым относится зилеутон, опосредуют свой эффект, блокируя фермент 5липоксигеназу, тем самым предотвращая синтез лейкотриенов из арахидоновой кислоты. Препараты второй группы, к которым относятся зафирлукаст, пранлукаст, монтелукаст, селективно блокируют лейкотриеновые рецепторы, тем самым уменьшая процесс связывания лейкотриенов с соответствующим рецептором, снижая патофизиологический эффект лейкотриенов. Антилейкотриеновые препараты приводят к уменьшению симптомов астмы, снижают частоту обострений, восстанавливают трудоспособность, улучшают качество жизни, а также количество обращений за неотложной помощью [9, 16–20].
Препараты первой группы, к которым относится зилеутон, опосредуют свой эффект, блокируя фермент 5липоксигеназу, тем самым предотвращая синтез лейкотриенов из арахидоновой кислоты. Препараты второй группы, к которым относятся зафирлукаст, пранлукаст, монтелукаст, селективно блокируют лейкотриеновые рецепторы, тем самым уменьшая процесс связывания лейкотриенов с соответствующим рецептором, снижая патофизиологический эффект лейкотриенов. Антилейкотриеновые препараты приводят к уменьшению симптомов астмы, снижают частоту обострений, восстанавливают трудоспособность, улучшают качество жизни, а также количество обращений за неотложной помощью [9, 16–20].
Таким образом, лейкотриены играют важную роль в процессе возникновения воспаления в бронхиальном дереве при бронхиальной астме и рекуррентных формах острого обструктивного бронхита у детей, что определяет изучение причин, вызывающих их гиперпродукцию и активацию лейкотриеновых рецепторов, и разработку методов их торможения и блокирования рецепторов.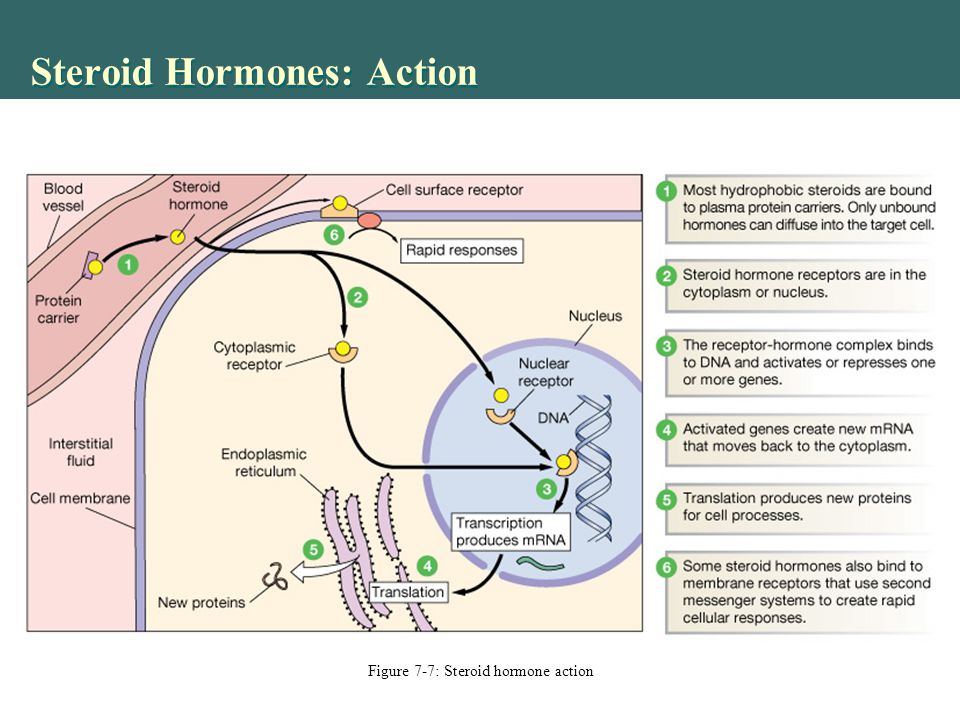
Список літератури
1. Бронхіальна астма у дітей. Лікування та профілактика: національна програма. — М., 2008. — 64 с.
2. Эффективность комплексной медикаментозной и немедикаментозной терапии у детей с бронхиальной астмой / А.В. Ростова, С.Н. Незабудкин, Д.С. Коростовцев, Т.И. Антонова, М.В. Гаврилова // Пульмонология детского возраста: проблемы и решения: Под ред. Ю.Л. Мизерницкого, А.Д. Царегородцева. — М., 2006. — С. 136140.
3. Яшина Л.О. Важливі питання діагностики і терапії бронхіальної астми / Л.О. Яшина // Нова медицина. — 2003. — № 1(6). — С. 1017.
4. Чернушенко К.Ф. Імунопатогенез бронхіальної астми / К.Ф. Чернушенко // Нова медицина. — 2003. — № 1(6). — С. 1821.
5. Busse W.W. Asthma / W.W. Busse, R.F. Lemanske // The New England journal of medicine. — 2001. — Vol. 344, № 5. — P. 350362.
6. Евсюкова Е.В. Роль метаболитов арахидоновой кислоты в развитии аллергических реакций / Е.В. Евсюкова, Г. Б. Федосеев // Аллергология. — 2000. — № 4. — С. 2126.
Б. Федосеев // Аллергология. — 2000. — № 4. — С. 2126.
7. Leukotriene E4 and granulocytic infiltration into asthmatic airways / L.A. Laitinen, A. Laitinen, T. Haahtela [et al.] // Lancet. — 1993. — Vol. 341, № 8851. — P. 989990.
8. Burne P.M. Leikotrienes in the Pathogenesis of asthma / P.M. Burne // Chest. — 1997. — Vol. 111. — P. 27s34s.
9. Руководство по фармакотерапии в педиатрии и детской хирургии / А.Д. Церогородцев, В.А. Таболин // Антилейкотриеновые препараты в терапии детей, больных бронхиальной астмой / Под ред. А.Е. Богорад, Н.Н. Помогий. — М., 2002. — С. 254266.
10. Респираторная медицина: Руководство / Под ред. Чучалина А.Г. — М.: ГЭОТАРМедиа, 2007.
11. Бронхиальная астма: новые решения / Цой А.Н., Архипов В.В. — М.: Мед. информ. агентство, 2007.
12. Пероксидна оксидація ліпідів та антиоксидантний захист при бронхіальній астмі / Герасимов С.В. // Укр. мед. часопис. — 2000. — Т. 2, № 1. — С. 8694.
13. Стан перекисного окислення ліпідів, антиоксидантної системи та особливості вищої нервової діяльності у жінок, хворих на бронхіальну астму в залежності від особливостей лікування / Зінченко Т. М. // Укр. мед. альманах. — 2000. — Т. 3, № 4. — С. 7780.
М. // Укр. мед. альманах. — 2000. — Т. 3, № 4. — С. 7780.
14. К вопросу о перспективах использования омега3 полиненасыщенных жирных кислот в лечении больных бронхиальной астмой / Победенная Г.П. // Укр. мед. альманах. — 2004. — № 2. — С. 134136.
15.Клиникофункциональные критерии оценки тяжести бронхиальной астмы у детей / Лукина О.Ф., Балаболкин И.И., Куличенко Т.В. // Пульмонология. — 2002. — № 1. — С. 6268.
16. Эффективность Сингуляра при бронхиальной астме у детей / Томилова Л.Б., Настаушева Т.Л., Жмаев А.Ф. // Фармакотерапия и фармакогенетика в педиатрии. — М., 2000. — С. 162.
17. Глобальная стратегия лечения и профилактики бронхиальной астмы / Под ред. А.Г. Чучалина.— М., 2002.— 160 с.
18. Княжеская Н.П. Бронхиальная астма: некоторые аспекты диагностики и лечения // Consilium medicum. — 2001. — Т. 3, № 12. — С. 575579.
19. Зайцева С.В., Зайцева О.В. Бронхиальная астма у детей: пути оптимизации терапии // Лечащий врач. — 2001. — № 8.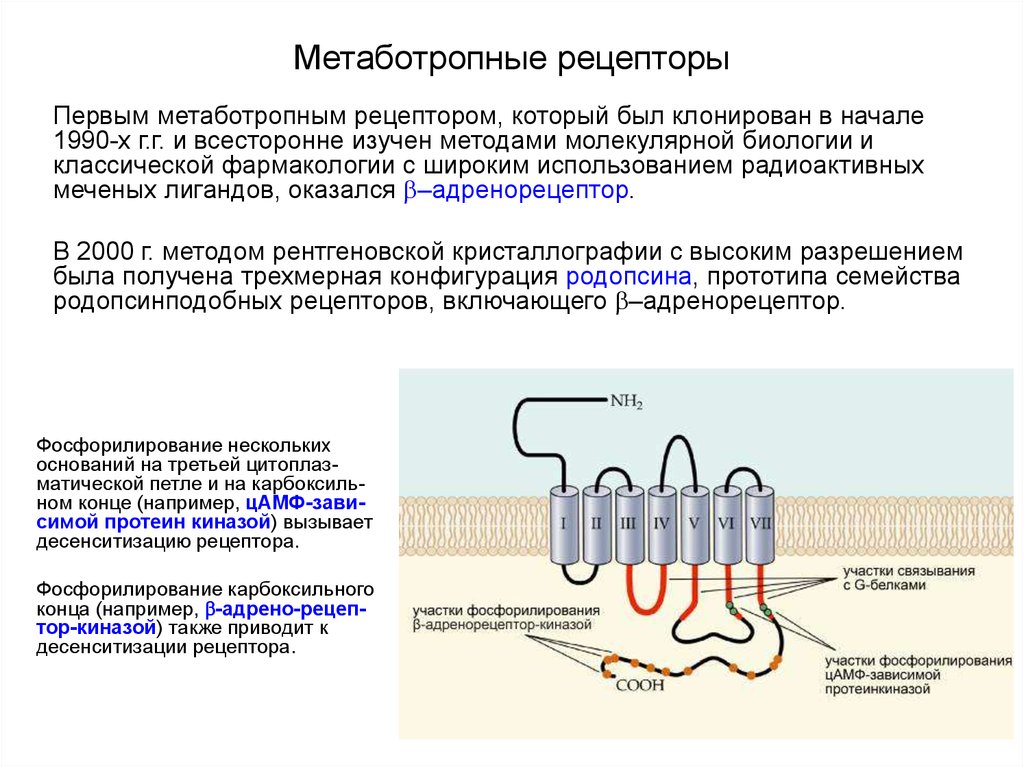 — С. 3640.
— С. 3640.
20. Фещенко Ю.И. Основные принципы современного лечения бронхиальной астмы // Укр. пульмонол. журн. — 2000. — Т. 2. — С. 1315.
Антагонисты лейкотриеновых рецепторов — StatPearls
Непрерывное обучение
Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов, показанными для профилактики и лечения хронической астмы. Лейкотриены являются эйкозаноидными медиаторами воспаления, производными арахидоновой кислоты. Ни монтелукаст, ни зафирлукаст не являются препаратами неотложной помощи во время острого астматического приступа. В этом мероприятии будут освещены механизм действия, профиль нежелательных явлений и мониторинг, актуальный для членов межпрофессиональной команды при лечении пациентов с астмой и связанными с ней состояниями с помощью антагонистов лейкотриеновых рецепторов.
Цели:
Объясните механизм действия антагонистов лейкотриеновых рецепторов.
Опишите потенциальные побочные эффекты антагонистов лейкотриеновых рецепторов.

Рассмотрите соответствующий мониторинг для пациентов, принимающих антагонисты лейкотриеновых рецепторов.
Обобщить стратегии межпрофессиональной команды по улучшению координации помощи и коммуникации для улучшения лечения астмы антагонистами лейкотриеновых рецепторов и улучшения результатов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Монтелукаст и зафирлукаст являются антагонистами цистеиниловых лейкотриеновых рецепторов.[1] Лейкотриены являются эйкозаноидными медиаторами воспаления, производными арахидоновой кислоты. Показаниями к применению монтелукаста являются профилактика и хроническое лечение астмы, предотвращение бронхоспазма, вызванного физической нагрузкой, и облегчение симптомов аллергического ринита.[2][3]
Монотерапия монтелукастом не рекомендуется в качестве терапии первой линии при аллергическом рините.[4] Вместо этого монотерапия интраназальным глюкокортикоидом является настоятельной рекомендацией при начальном лечении пациентов с умеренным/тяжелым сезонным аллергическим ринитом в возрасте 12 лет и старше, ранее не получавших лечения. [5] Роль монтелукаста в эффективном лечении экземы остается неубедительной [6].
[5] Роль монтелукаста в эффективном лечении экземы остается неубедительной [6].
Родители детей, страдающих астмой, предпочитают монтелукаст, потому что пероральная доза один раз в день более удобна, чем использование ингаляторов. Это также позволяет избежать клинических проблем, связанных с побочными эффектами длительного применения кортикостероидов, такими как задержка роста и метаболические нарушения.
Показания к применению Зафирлукаста включают профилактику и длительное лечение астмы у детей старше пяти лет и взрослых. Он используется не по прямому назначению при аллергическом рините и для профилактики бронхоспазма, вызванного физической нагрузкой.
Препаратом первой линии для профилактики бронхоспазма, вызванного физической нагрузкой, является ингаляционный бета-агонист короткого действия, такой как альбутерол. Ежедневное использование ингаляционных кортикостероидов или антагонистов лейкотриеновых рецепторов, таких как монтелукаст и зафирлукаст, рекомендуется пациентам с бронхоспазмом, вызванным физической нагрузкой, которые вдыхали бета-агонисты короткого действия для профилактики, но у них сохраняются симптомы или у которых развивается толерантность к продолжительному использованию короткодействующих агонистов.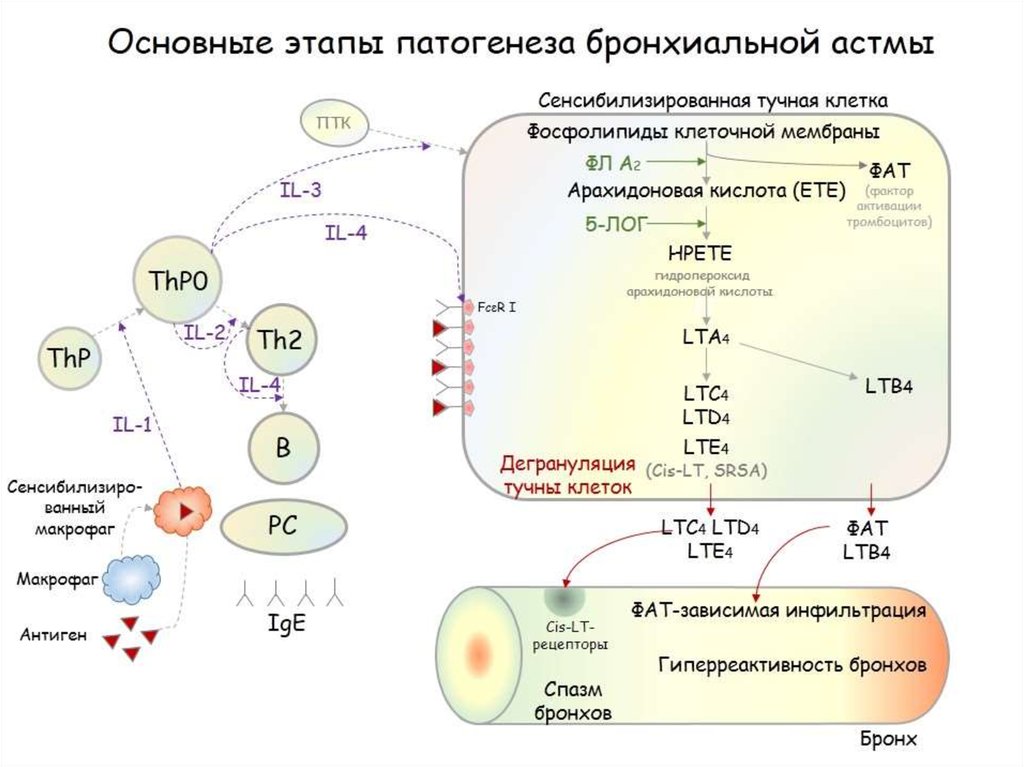 бета-агонист.[7]
бета-агонист.[7]
Как монтелукаст, так и зафирлукаст не используются в качестве средств экстренной помощи во время острого астматического приступа.[8] Вместо этого ингаляционный бета-агонист вызывает немедленную бронходилатацию.
Механизм действия
Основным показанием к применению антагонистов лейкотриеновых рецепторов является лечение хронической астмы. Лейкотриены синтезируются из арахидоновой кислоты под действием 5-липоксигеназы во многих воспалительных клетках дыхательных путей.[9] Арахидоновая кислота высвобождается из фосфолипидов клеточной мембраны в основном с помощью фосфолипазы А2.[10] Циклооксигеназный путь продуцирует тромбоксан и простагландины из арахидоновой кислоты. Кортикостероиды ингибируют фосфолипазу А2 и последующий синтез эйкозаноидных медиаторов воспаления, включая как простагландины, так и лейкотриены. Нестероидные противовоспалительные препараты, такие как аспирин, ингибируют циклооксигеназы. Зилеутон ингибирует 5-липоксигеназу.
Существует две группы лейкотриенов: одна с аминокислотными фрагментами, а другая без них. [1] Лейкотриен B4 несет только гидроксильную часть и связывается с рецепторами BLT. Сигнальный путь через активацию рецептора BLT, связанного с G-белком, вызывает мощный ответ хемотаксиса. Цистеиниллейкотриены (LTC4, LTD4 и LTE4) имеют аминокислотный фрагмент и связываются с цистеиниллейкотриеновыми рецепторами (CysLT1 и CysLT2). Бронхоконстрикция, сосудистая проницаемость, рекрутирование эозинофилов и хроническое воспаление опосредуются связанной с G-белком активацией цистеиниллейкотриеновых рецепторов. Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов CysLT1, но не рецепторов CysLT2. Исследования показали, что эозинофилы являются основным источником цистеиниллейкотриенов, а цистеиниллейкотриены очень важны для рекрутирования эозинофилов.[11] Более ранние исследования показали, что цистеиниллейкотриены также играют важную роль в ремоделировании дыхательных путей при хронической астме.[12]
[1] Лейкотриен B4 несет только гидроксильную часть и связывается с рецепторами BLT. Сигнальный путь через активацию рецептора BLT, связанного с G-белком, вызывает мощный ответ хемотаксиса. Цистеиниллейкотриены (LTC4, LTD4 и LTE4) имеют аминокислотный фрагмент и связываются с цистеиниллейкотриеновыми рецепторами (CysLT1 и CysLT2). Бронхоконстрикция, сосудистая проницаемость, рекрутирование эозинофилов и хроническое воспаление опосредуются связанной с G-белком активацией цистеиниллейкотриеновых рецепторов. Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов CysLT1, но не рецепторов CysLT2. Исследования показали, что эозинофилы являются основным источником цистеиниллейкотриенов, а цистеиниллейкотриены очень важны для рекрутирования эозинофилов.[11] Более ранние исследования показали, что цистеиниллейкотриены также играют важную роль в ремоделировании дыхательных путей при хронической астме.[12]
Астма является наиболее распространенным хроническим заболеванием легких, характеризующимся обратимой бронхоконстрикцией, воспалением и ремоделированием дыхательных путей, что приводит к гиперреактивности.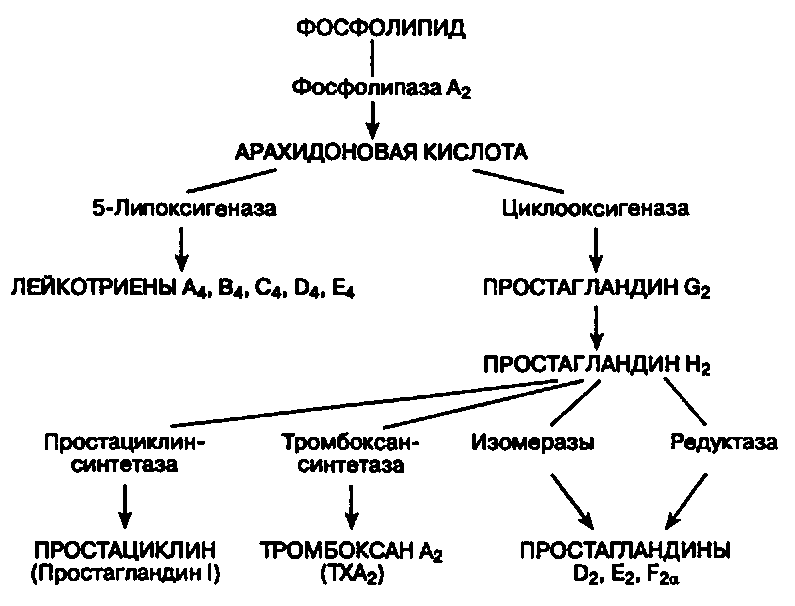 Симпатомиметические средства, такие как агонисты бета-адренергических рецепторов, являются терапевтическим выбором для лечения острой бронхоконстрикции. Они активируют бета-2 адренорецепторы и расслабляют гладкомышечные клетки дыхательных путей. К бета2-селективным агонистам короткого действия относятся альбутерол, левалбутерол, тербуталин, метапротеренол и пирбутерол. Они поддерживают бронходилатацию в течение 3-4 часов. К бета2-селективным агонистам длительного действия с 12-часовой продолжительностью действия относятся салметерол и формотерол. Пациенты, принимающие бета-агонисты сверхдлительного действия, такие как индакатерол, олодатерол и вилантерол, должны принимать бамбутерол только один раз в день. Поскольку бета-агонисты не ингибируют воспалительные реакции, они не могут использоваться в качестве монотерапии для контроля персистирующей астмы. Они часто являются вторым агентом, добавляемым к ингаляционным кортикостероидам.
Симпатомиметические средства, такие как агонисты бета-адренергических рецепторов, являются терапевтическим выбором для лечения острой бронхоконстрикции. Они активируют бета-2 адренорецепторы и расслабляют гладкомышечные клетки дыхательных путей. К бета2-селективным агонистам короткого действия относятся альбутерол, левалбутерол, тербуталин, метапротеренол и пирбутерол. Они поддерживают бронходилатацию в течение 3-4 часов. К бета2-селективным агонистам длительного действия с 12-часовой продолжительностью действия относятся салметерол и формотерол. Пациенты, принимающие бета-агонисты сверхдлительного действия, такие как индакатерол, олодатерол и вилантерол, должны принимать бамбутерол только один раз в день. Поскольку бета-агонисты не ингибируют воспалительные реакции, они не могут использоваться в качестве монотерапии для контроля персистирующей астмы. Они часто являются вторым агентом, добавляемым к ингаляционным кортикостероидам.
Основываясь на воспалительном механизме астмы, для лечения этого эндотипа астмы было разработано несколько фармакологических средств с различными механизмами действия.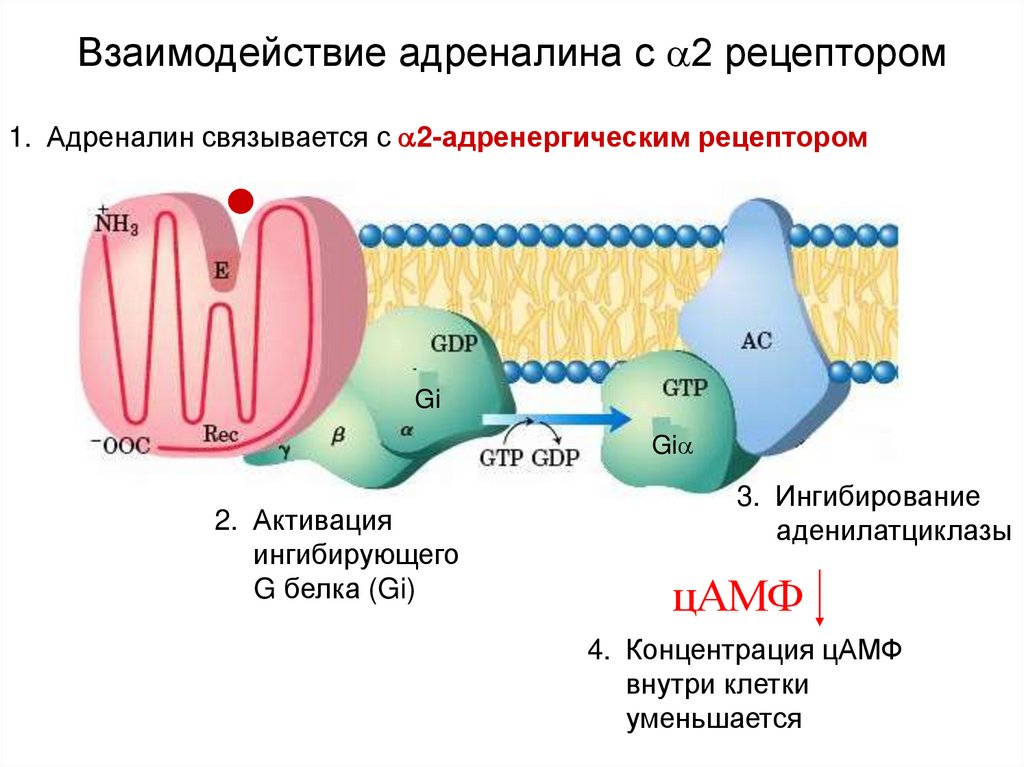 Воздействие аллергена стимулирует синтез IgE, управляемый CD4+ Т-хелперными клетками 2 типа. Антитела IgE связываются со своими рецепторами на тучных клетках ткани и базофилах крови.[14] При повторном воздействии аллергена аллерген сшивает антитела IgE на поверхности иммунных клеток. Он запускает высвобождение предварительно образованных медиаторов анафилаксии и синтез медиаторов воспаления. Кромолин или недокромил могут предотвращать дегрануляцию тучных клеток. Однако в настоящее время эти препараты обычно не используются для лечения астмы, поскольку они менее эффективны, чем ингаляционные кортикостероиды. Гистамин, триптаза и метаболиты арахидоновой кислоты, такие как лейкотриены C4 и D4 и простагландин D2, высвобождаются и вызывают острое сокращение гладких мышц и повышение проницаемости сосудов. Через три-шесть часов при поздней астматической реакции возникает более устойчивый бронхоспазм. Есть предположения, что цитокины, продуцируемые иммунным ответом 2-го типа, опосредуют поздний астматический ответ.
Воздействие аллергена стимулирует синтез IgE, управляемый CD4+ Т-хелперными клетками 2 типа. Антитела IgE связываются со своими рецепторами на тучных клетках ткани и базофилах крови.[14] При повторном воздействии аллергена аллерген сшивает антитела IgE на поверхности иммунных клеток. Он запускает высвобождение предварительно образованных медиаторов анафилаксии и синтез медиаторов воспаления. Кромолин или недокромил могут предотвращать дегрануляцию тучных клеток. Однако в настоящее время эти препараты обычно не используются для лечения астмы, поскольку они менее эффективны, чем ингаляционные кортикостероиды. Гистамин, триптаза и метаболиты арахидоновой кислоты, такие как лейкотриены C4 и D4 и простагландин D2, высвобождаются и вызывают острое сокращение гладких мышц и повышение проницаемости сосудов. Через три-шесть часов при поздней астматической реакции возникает более устойчивый бронхоспазм. Есть предположения, что цитокины, продуцируемые иммунным ответом 2-го типа, опосредуют поздний астматический ответ.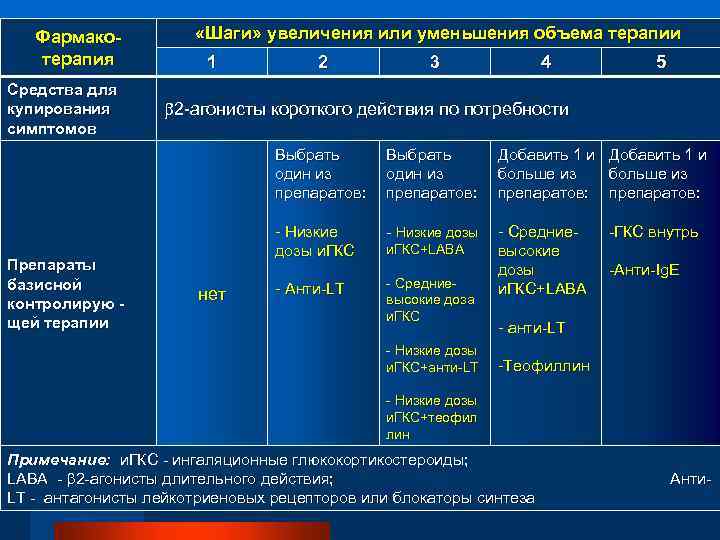 [15]
[15]
Успехи в понимании молекулярной гетерогенности астмы выявили важность иммунного ответа типа 2, опосредованного Т-хелперами типа 2, в патологии эозинофильной астмы.[16] Омализумаб представляет собой моноклональное антитело, которое может снижать количество циркулирующего IgE. ИЛ-4, ИЛ-5 и ИЛ-13 опосредуют иммунный ответ типа 2. Меполизумаб с антителами против ИЛ-5 минимизирует количество и активность эозинофилов в слизистой оболочке дыхательных путей. Дупилумаб представляет собой антитело к рецептору ИЛ-4.
Введение
Монтелукаст вводят перорально, независимо от еды или приема пищи. Пациентам с астмой, а также астмой и аллергическим ринитом следует принимать одну дозу вечером. Для лечения аллергического ринита прием может быть как утренним, так и вечерним. Его следует принимать не менее чем за два часа до тренировки, чтобы предотвратить астму, вызванную физической нагрузкой. Пациенты не должны принимать другую дозу в течение 24 часов.
Зафирлукаст принимают внутрь.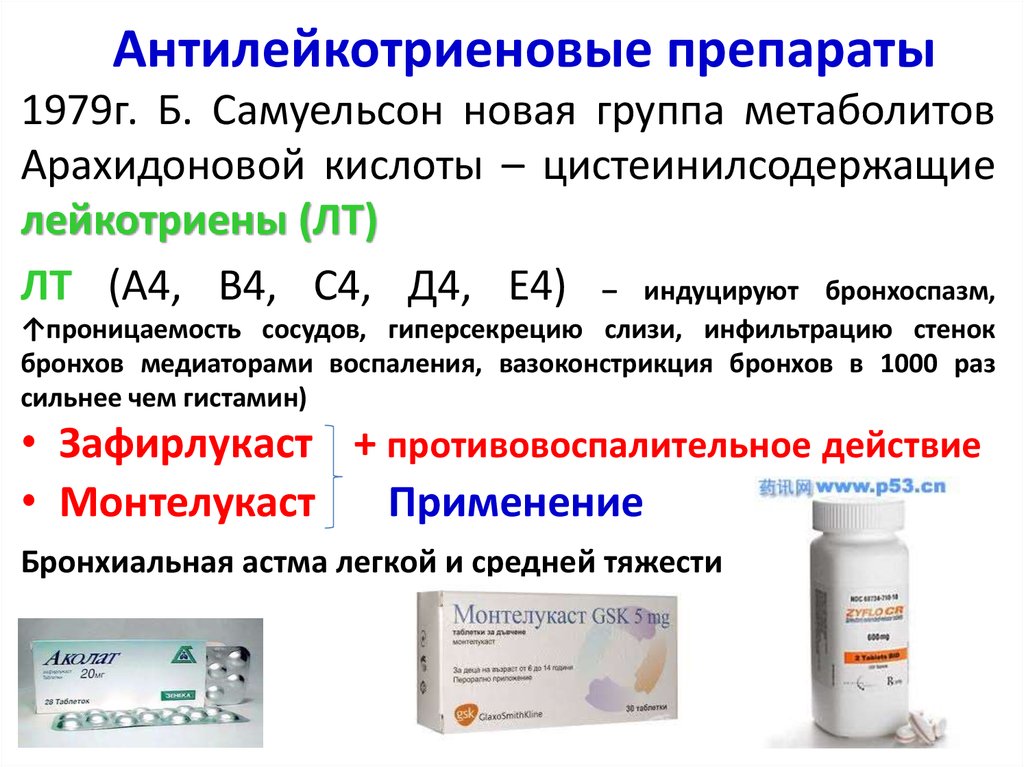 Его следует принимать через 2 часа после или за 1 час до еды, поскольку пища снижает биодоступность на 40%.
Его следует принимать через 2 часа после или за 1 час до еды, поскольку пища снижает биодоступность на 40%.
Побочные эффекты
Монтелукаст относительно хорошо переносится и в целом безопасен.[17] Наиболее часто наблюдаемыми побочными эффектами у пациентов в возрасте 15 лет и старше были головные боли, гриппозная инфекция, боль в животе, кашель и диспепсия. У детей могут возникнуть диарея, тошнота, ларингит, фарингит, синусит, отит и вирусная инфекция. Могут возникнуть нервно-психические расстройства, включая депрессию, агрессию, суицидальные мысли, бессонницу, тревогу и ночные кошмары.[18]
Аллергический гранулематозный ангиит (синдром Чарга-Стросса) также может коррелировать с применением монтелукаста, хотя причинно-следственная связь еще не установлена.[19][20] Имеются некоторые сообщения о серьезных нежелательных явлениях, связанных с ангионевротическим отеком, гиперчувствительностью, утомляемостью, спутанностью сознания, патологическими сновидениями, эпилепсией, агрессией, нарушением иммунной системы, кровоизлиянием, раздражением, увеличением количества эозинофилов, болью в конечностях и болью в животе.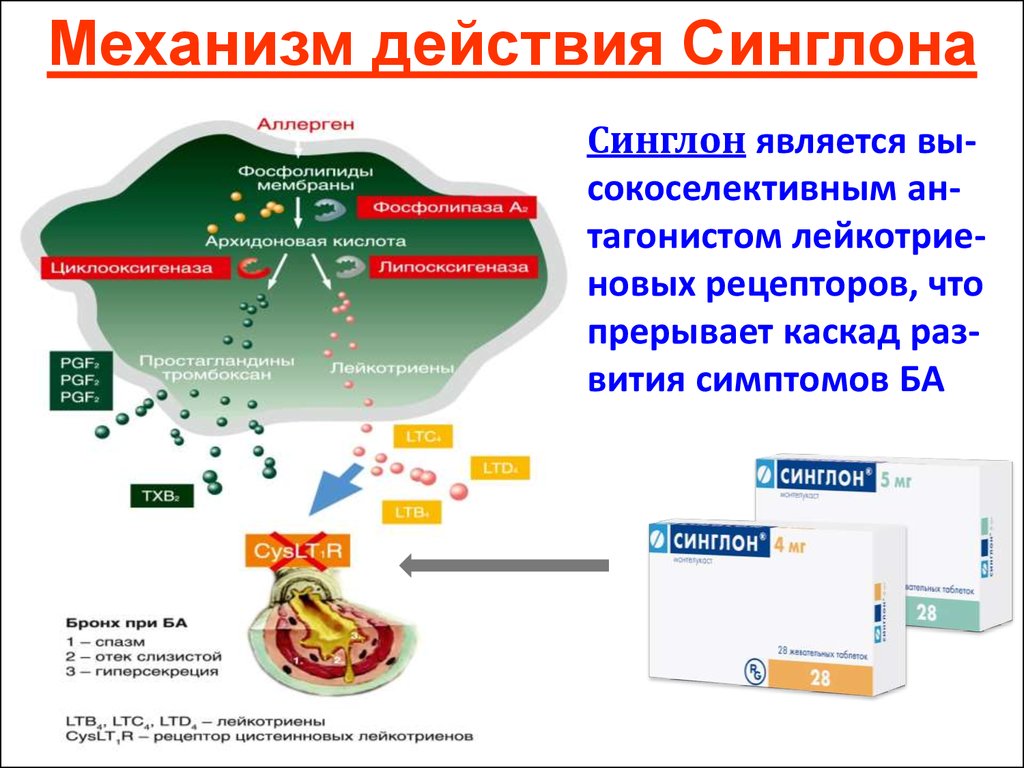 [18] В исследовании на животных он не оказывал тератогенного действия в дозах, значительно превышающих максимальную суточную дозу для человека.[17]
[18] В исследовании на животных он не оказывал тератогенного действия в дозах, значительно превышающих максимальную суточную дозу для человека.[17]
Зафирлукаст, как правило, хорошо переносится, и побочные эффекты минимальны.[21] Распространенными побочными эффектами являются головная боль, инфекция верхних дыхательных путей и желудочно-кишечные расстройства, такие как тошнота, рвота, диспепсия, боль в животе, диарея и недомогание.[21] Редко повышение активности печеночных ферментов, острый гепатит и гипербилирубинемия были связаны с зафирлукастом.[22][23]
Противопоказания
Как монтелукаст, так и зафирлукаст противопоказаны пациентам с гиперчувствительностью к препарату или любому компоненту их состава.
Противопоказания к применению зафирлукаста также включают пациентов с острой астмой или печеночной недостаточностью.
Противопоказания к применению монтелукаста включают тяжелую форму астмы. Пациентам с фенилкетонурией рекомендуется соблюдать осторожность, поскольку существует форма, содержащая фенилаланин.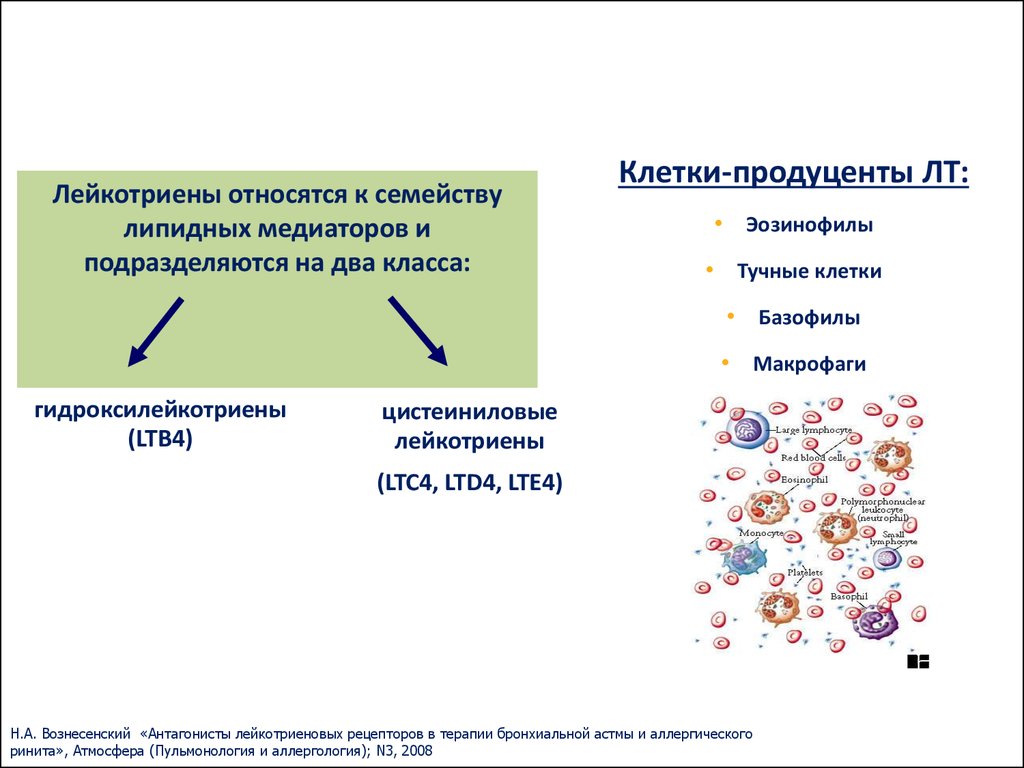
Мониторинг
Депрессия, агрессия и другие поведенческие изменения коррелируют с антагонистами лейкотриеновых рецепторов. Необходимо тщательное наблюдение за пациентами, получающими лечение антагонистами лейкотриеновых рецепторов.
Зафирлукаст может вызывать тяжелое, но редко острое поражение печени. Это основной субстрат фермента цитохрома P450 CYP2C9. Пациенты, получающие сопутствующую терапию такими препаратами, как алпелисиб, дабрафениб, энзалутамид, эритромицин, локсапин, лумакафтор, рифапентин, терфенадин и варфарин, нуждаются в наблюдении за потенциальными лекарственными взаимодействиями.
Токсичность
И монтелукаст, и зафирлукаст имеют широкий запас прочности. У пациентов, принявших передозировку, не было побочных симптомов, выздоровление проходило без осложнений, сыпи и расстройства желудка.[25][26]
При передозировке удалите неабсорбированные препараты с помощью активированного угля и при необходимости назначьте поддерживающую терапию.
Улучшение результатов бригады здравоохранения
В центр фармаконадзора Нидерландов Lareb и в глобальную базу данных отчетов ВОЗ о безопасности отдельных случаев поступили сообщения о нескольких побочных реакциях на лекарства. Наиболее частым побочным эффектом у всего населения была депрессия, а у детей в возрасте до 19 лет — агрессия.[18] Сообщалось о суицидальных мыслях, аномальном поведении, ночных кошмарах, головных болях, бессоннице и беспокойстве у пациентов, получавших монтелукаст. Кошмары могут возникать и пугать детей. Агрессивность и ненормальное поведение детей могут вызывать опасения у их родителей и учителей. Бессонница у взрослых может повлиять на безопасность пациентов и других лиц.
Астма — это хроническое заболевание легких. Даже у пациентов с хорошо налаженным режимом лечения могут возникать обострения астмы. Понимание факторов риска склонной к обострению астмы имеет решающее значение для предотвращения потенциально смертельных острых приступов астмы. [27][28]
[27][28]
Как у афроамериканцев, так и у выходцев из Латинской Америки частота обострений выше. Плохое соблюдение режима лечения из-за плохого доступа пациентов к медицинской помощи и недостаточного образования и знаний о болезни подвергает пациентов большому риску острых обострений. Другие потенциально модифицируемые факторы риска включают неконтролируемые аллергии, вирусные инфекции верхних дыхательных путей, ожирение, курение и гастроэзофагеальную рефлюксную болезнь [29].][30][31][32] Межпрофессиональный подход, включающий всех членов медицинской бригады, включая врачей (MD и DO), практикующих врачей среднего звена (NP и PA), специалистов, медсестер, фармацевтов и респираторных терапевтов, может снизить острые приступы астмы, взяв под контроль эти факторы риска. Межпрофессиональная медицинская бригада должна обучать своих пациентов или родителей и контролировать частоту побочных эффектов лекарств. Использование подхода межпрофессиональной команды к лечению пациентов в целом и использование антагонистов лейкотриеновых рецепторов у пациентов, которым будет полезна такая медикаментозная терапия. [Уровень 5]
[Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Джо-Ватанабе А., Окуно Т., Йокомизо Т. Роль лейкотриенов как потенциальных терапевтических мишеней при аллергических расстройствах. Int J Mol Sci. 22 июля 2019 г.; 20 (14) [Бесплатная статья PMC: PMC6679143] [PubMed: 31336653]
- 2.
Тамада Т, Ичиносе М. Антагонисты рецепторов лейкотриенов и противоаллергические препараты. Handb Exp Pharmacol. 2017;237:153-169. [PubMed: 27826703]
- 3.
Киттана Н., Хаттаб С., Зияде-Ислим А., Джарадат Н., Зайд А.Н. Монтелукаст, текущие показания и перспективы применения в будущем. Эксперт Respir Med. 2016 сен;10(9):943-56. [PubMed: 27485393]
- 4.
Зайдман М.Д., Гургель Р.К., Лин С.Ю., Шварц С.Р., Баруди Ф.М., Боннер Д.Р., Доусон Д.
 Е., Дайкевич М.С., Хакелл Дж.М., Хан Дж.К., Ишман С.Л., Круз Х.Дж., Малекзаде S, Mims JW, Omole FS, Reddy WD, Wallace DV, Walsh SA, Warren BE, Wilson MN, Nnacheta LC., Группа разработки рекомендаций по отоларингологии. ААО-ХНСФ. Клинические рекомендации: Аллергический ринит. Отоларингол Head Neck Surg. 2015 Февраль; 152 (1 Дополнение): S1-43. [В паблике: 25644617]
Е., Дайкевич М.С., Хакелл Дж.М., Хан Дж.К., Ишман С.Л., Круз Х.Дж., Малекзаде S, Mims JW, Omole FS, Reddy WD, Wallace DV, Walsh SA, Warren BE, Wilson MN, Nnacheta LC., Группа разработки рекомендаций по отоларингологии. ААО-ХНСФ. Клинические рекомендации: Аллергический ринит. Отоларингол Head Neck Surg. 2015 Февраль; 152 (1 Дополнение): S1-43. [В паблике: 25644617]- 5.
Эмерик А., Эмерик-Максимюк Ю., Янечек К. Новые рекомендации по лечению сезонного аллергического ринита. Постерий Дерматол Алергол. 2019 июнь;36(3):255-260. [Бесплатная статья PMC: PMC6640027] [PubMed: 31333340]
- 6.
Ferguson L, Futamura M, Vakirlis E, Kojima R, Sasaki H, Roberts A, Mori R. Антагонисты лейкотриеновых рецепторов при экземе. Cochrane Database Syst Rev. 2018 Oct 21;10(10):CD011224. [Бесплатная статья PMC: PMC6517006] [PubMed: 30343498]
- 7.
Parsons JP, Hallstrand TS, Mastronarde JG, Kaminsky DA, Rundell KW, Hull JH, Storms WW, Weiler JM, Cheek FM, Wilson KC, Anderson SD.
 , Подкомитет Американского торакального общества по упражнениям -индуцированная бронхоконстрикция. Официальное руководство по клинической практике Американского торакального общества: бронхоконстрикция, вызванная физической нагрузкой. Am J Respir Crit Care Med. 2013 01 мая; 187(9):1016-27. [PubMed: 23634861]
, Подкомитет Американского торакального общества по упражнениям -индуцированная бронхоконстрикция. Официальное руководство по клинической практике Американского торакального общества: бронхоконстрикция, вызванная физической нагрузкой. Am J Respir Crit Care Med. 2013 01 мая; 187(9):1016-27. [PubMed: 23634861]- 8.
Блейк К.В. Монтелукаст: данные клинических исследований по лечению астмы. Энн Фармакотер. 1999 декабря; 33 (12): 1299-314. [PubMed: 10630831]
- 9.
Rådmark O, Werz O, Steinhilber D, Samuelsson B. 5-липоксигеназа, ключевой фермент биосинтеза лейкотриенов в норме и при болезнях. Биохим Биофиз Акта. 2015 апрель; 1851 (4): 331-9. [PubMed: 25152163]
- 10.
Claar D, Hartert TV, Peebles RS. Роль простагландинов в аллергическом воспалении легких и бронхиальной астме. Эксперт Respir Med. 2015 Февраль;9(1):55-72. [Бесплатная статья PMC: PMC4380345] [PubMed: 25541289]
- 11.
Томпсон-Соуза Г.
 А., Гропилло И., Невес Дж.С. Цистеиниллейкотриены в биологии эозинофилов: функциональные роли и терапевтические перспективы при эозинофильных расстройствах. Front Med (Лозанна). 2017;4:106. [Бесплатная статья PMC: PMC5515036] [PubMed: 28770202]
А., Гропилло И., Невес Дж.С. Цистеиниллейкотриены в биологии эозинофилов: функциональные роли и терапевтические перспективы при эозинофильных расстройствах. Front Med (Лозанна). 2017;4:106. [Бесплатная статья PMC: PMC5515036] [PubMed: 28770202]- 12.
Hallstrand TS, Henderson WR. Новые сведения о роли лейкотриенов при астме. Курр Опин Аллергия Клин Иммунол. 2010 Февраль;10(1):60-6. [Бесплатная статья PMC: PMC2838730] [PubMed: 19915456]
- 13.
Falk NP, Hughes SW, Rogers BC. Лекарства от хронической астмы. Ам семейный врач. 2016 15 сентября; 94 (6): 454-62. [PubMed: 27637121]
- 14.
Olin JT, Wechsler ME. Бронхиальная астма: патогенез и новые препараты для лечения. БМЖ. 2014 24 ноября; 349:g5517. [PubMed: 25420994]
- 15.
Цислевич Г., Томкинсон А., Адлер А., Дуэз С., Шварце Дж., Такеда К., Ларсон К.А., Ли Дж.Дж., Ирвин К.Г., Гельфанд Э.В. Поздний, но не ранний астматический ответ зависит от ИЛ-5 и коррелирует с инфильтрацией эозинофилами.
 Джей Клин Инвест. 1999 августа; 104 (3): 301-8. [Бесплатная статья PMC: PMC408423] [PubMed: 10430611]
Джей Клин Инвест. 1999 августа; 104 (3): 301-8. [Бесплатная статья PMC: PMC408423] [PubMed: 10430611]- 16.
Fahy JV. Воспаление 2 типа при астме — присутствует у большинства, но отсутствует у многих. Нат Рев Иммунол. 2015 Янв; 15 (1): 57-65. [Бесплатная статья PMC: PMC43] [PubMed: 25534623]
- 17.
Hon KL, Leung TF, Leung AK. Клиническая эффективность и безопасность монтелукаста при бронхиальной астме. Каковы выводы клинических испытаний и метаанализов? Препарат Des Devel Ther. 2014;8:839-50. [Бесплатная статья PMC: PMC4079631] [PubMed: 25061277]
- 18.
Haarman MG, van Hunsel F, de Vries TW. Побочные реакции на монтелукаст у детей и взрослых. Фармакол Рез Перспект. 5(5) октября 2017 г. [Статья без PMC: PMC5625152] [PubMed: 28971612]
- 19.
Калапай Г., Кашаро М., Миродди М., Калапай Ф., Наварра М., Гангеми С. Побочное действие монтелукаста реакции: обзор описаний случаев в литературе.
 Фармакология. 2014;94(1-2):60-70. [PubMed: 25196099]
Фармакология. 2014;94(1-2):60-70. [PubMed: 25196099]- 20.
Гарсия-Маркос Л., Шустер А., Перес-Ярса Э.Г. Оценка пользы и риска антилейкотриенов при лечении астмы. Препарат Саф. 2003;26(7):483-518. [PubMed: 12735786]
- 21.
Twaites BR, Wilton LV, Shakir SA. Безопасность зафирлукаста: результаты постмаркетингового исследования с участием 7976 пациентов в Англии. Препарат Саф. 2007;30(5):419-29. [PubMed: 17472420]
- 22.
LiverTox: клиническая и исследовательская информация о лекарственном повреждении печени [Интернет]. Национальный институт диабета и болезней органов пищеварения и почек; Bethesda (MD): 4 июня 2019 г. Зафирлукаст. [PubMed: 31643251]
- 23.
Wooltorton E. Лекарство от астмы зафирлукаст (Accolate): серьезные нарушения со стороны печени. CMAJ. 2004 г., 25 мая; 170 (11): 1668. [Бесплатная статья PMC: PMC408503] [PubMed: 15159361]
- 24.
Adkins JC, Brogden RN.
 Зафирлукаст. Обзор его фармакологии и терапевтического потенциала в лечении астмы. Наркотики. 1998 января; 55 (1): 121-44. [PubMed: 9463793]
Зафирлукаст. Обзор его фармакологии и терапевтического потенциала в лечении астмы. Наркотики. 1998 января; 55 (1): 121-44. [PubMed: 9463793]- 25.
Cantrell FL, Farson-Collier M. Доброкачественное клиническое течение после большого приема монтелукаста у детей. J Toxicol Clin Toxicol. 2004;42(3):333-4. [PubMed: 15362605]
- 26.
Геллер М., Мело Л.Р., Коутиньо С.В. Успешный исход передозировки монтелукаста у ребенка с астмой. Энн Аллергия Астма Иммунол. 2000 март; 84 (3): 370. [PubMed: 10752926]
- 27.
Castillo JR, Peters SP, Busse WW. Обострения бронхиальной астмы: патогенез, профилактика и лечение. J Allergy Clin Immunol Pract. 2017 июль-август;5(4):918-927. [Бесплатная статья PMC: PMC5950727] [PubMed: 28689842]
- 28.
Адели М., Эль-Шарейф Т., Хендаус М.А. Обострение астмы, связанное с вирусными инфекциями: актуальное резюме. J Family Med Prim Care. 2019 сен;8(9):2753-2759. [Бесплатная статья PMC: PMC6820381] [PubMed: 31681638]
- 29.

Hammond C, Kurten M, Kennedy JL. Риновирус и астма: легендарная история несовместимости. Curr Allergy Asthma Rep. 2015 Feb;15(2):502. [Бесплатная статья PMC: PMC4327812] [PubMed: 25612798]
- 30.
Denlinger LC, Phillips BR, Ramratnam S, Ross K, Bhakta NR, Cardet JC, Castro M, Peters SP, Phipatanakul W, Aujla S, Bacharier LB, Bleecker ER, Comhair SA, Coverstone А., ДеБоер М., Эрзурум СК, Фейн С.Б., Файт М., Фитцпатрик А.М., Гаффин Дж., Гастон Б., Хасти А.Т., Хокинс Г.А., Ольгин Ф., Ирани А.М., Исраэль Э., Леви Б.Д., Ли Н., Мейерс Д.А., Мур В.К., Майерс Р., Опина М.Т., Петерс М.С., Шиблер М.Л., Соркнесс Р.Л., Тиг В.Г., Венцель С.Е., Вудрафф П.Г., Могер Д.Т., Фахи Дж.В., Джаржур Н.Н., Исследовательская программа тяжелой астмы Национального института сердца, легких и крови – 3 исследователя. Воспалительные и коморбидные особенности у пациентов с тяжелой астмой и частыми обострениями. Am J Respir Crit Care Med. 2017 01 февраля; 195(3):302-313. [Бесплатная статья PMC: PMC5328178] [PubMed: 27556234]
- 31.

Эриксон С.Е., Ирибаррен С., Толстых И.В., Блан П.Д., Эйснер М.Д. Влияние расы на лечение астмы и исходы в крупной интегрированной организации управляемой медицинской помощи. Arch Intern Med. 2007 г., 24 сентября; 167 (17): 1846-52. [PubMed: 17893305]
- 32.
Альварес Г.Г., Шульцер М., Юнг Д., Фицджеральд Дж.М. Систематический обзор факторов риска, связанных с почти фатальной и фатальной астмой. Can Respir J. 2005 г., июль-август; 12 (5): 265–70. [В паблике: 16107915]
Антагонисты лейкотриеновых рецепторов – StatPearls
Продолжение обучения
Монтелукаст и зафирлукаст являются антагонистами цистеиниловых лейкотриеновых рецепторов, показанными для профилактики и лечения хронической астмы. Лейкотриены являются эйкозаноидными медиаторами воспаления, производными арахидоновой кислоты. Ни монтелукаст, ни зафирлукаст не являются препаратами неотложной помощи во время острого астматического приступа. В этом мероприятии будут освещены механизм действия, профиль нежелательных явлений и мониторинг, актуальный для членов межпрофессиональной команды при лечении пациентов с астмой и связанными с ней состояниями с помощью антагонистов лейкотриеновых рецепторов.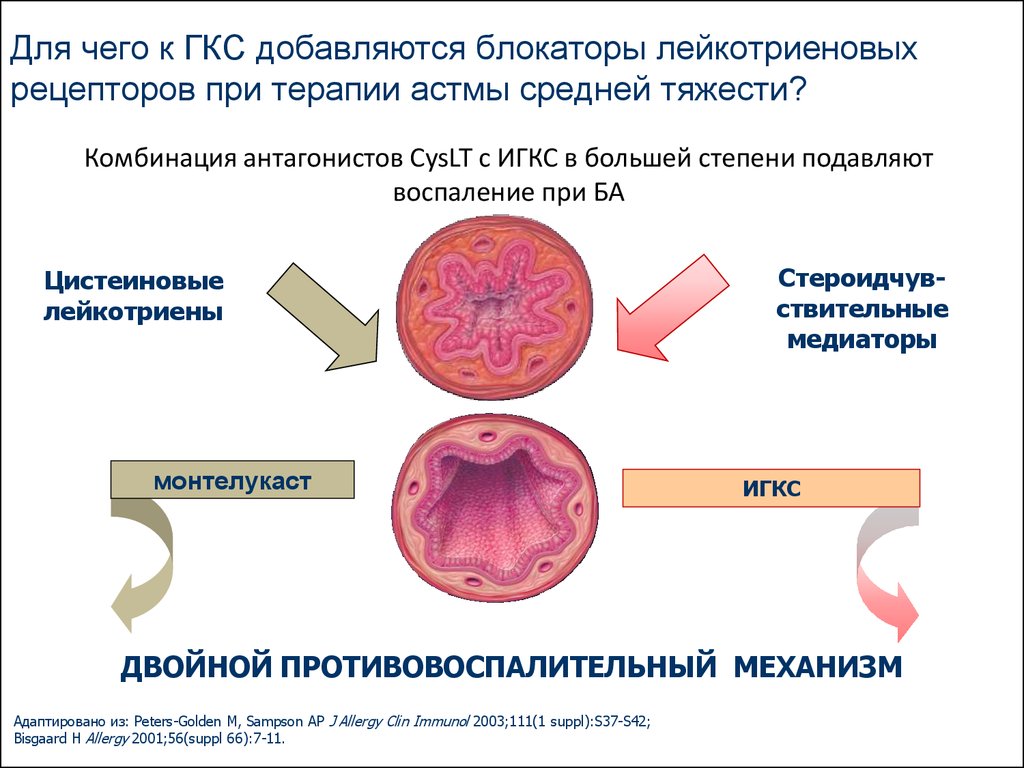
Цели:
Объясните механизм действия антагонистов лейкотриеновых рецепторов.
Опишите потенциальные побочные эффекты антагонистов лейкотриеновых рецепторов.
Рассмотрите соответствующий мониторинг для пациентов, принимающих антагонисты лейкотриеновых рецепторов.
Обобщить стратегии межпрофессиональной команды по улучшению координации помощи и коммуникации для улучшения лечения астмы антагонистами лейкотриеновых рецепторов и улучшения результатов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Монтелукаст и зафирлукаст являются антагонистами цистеиниловых лейкотриеновых рецепторов.[1] Лейкотриены являются эйкозаноидными медиаторами воспаления, производными арахидоновой кислоты. Показаниями к применению монтелукаста являются профилактика и хроническое лечение астмы, предотвращение бронхоспазма, вызванного физической нагрузкой, и облегчение симптомов аллергического ринита. [2][3]
[2][3]
Монотерапия монтелукастом не рекомендуется в качестве терапии первой линии при аллергическом рините.[4] Вместо этого монотерапия интраназальным глюкокортикоидом является настоятельной рекомендацией при начальном лечении пациентов с умеренным/тяжелым сезонным аллергическим ринитом в возрасте 12 лет и старше, ранее не получавших лечения.[5] Роль монтелукаста в эффективном лечении экземы остается неубедительной [6].
Родители детей, страдающих астмой, предпочитают монтелукаст, потому что пероральная доза один раз в день более удобна, чем использование ингаляторов. Это также позволяет избежать клинических проблем, связанных с побочными эффектами длительного применения кортикостероидов, такими как задержка роста и метаболические нарушения.
Показания к применению Зафирлукаста включают профилактику и длительное лечение астмы у детей старше пяти лет и взрослых. Он используется не по прямому назначению при аллергическом рините и для профилактики бронхоспазма, вызванного физической нагрузкой.
Препаратом первой линии для профилактики бронхоспазма, вызванного физической нагрузкой, является ингаляционный бета-агонист короткого действия, такой как альбутерол. Ежедневное использование ингаляционных кортикостероидов или антагонистов лейкотриеновых рецепторов, таких как монтелукаст и зафирлукаст, рекомендуется пациентам с бронхоспазмом, вызванным физической нагрузкой, которые вдыхали бета-агонисты короткого действия для профилактики, но у них сохраняются симптомы или у которых развивается толерантность к продолжительному использованию короткодействующих агонистов. бета-агонист.[7]
Как монтелукаст, так и зафирлукаст не используются в качестве средств экстренной помощи во время острого астматического приступа.[8] Вместо этого ингаляционный бета-агонист вызывает немедленную бронходилатацию.
Механизм действия
Основным показанием к применению антагонистов лейкотриеновых рецепторов является лечение хронической астмы. Лейкотриены синтезируются из арахидоновой кислоты под действием 5-липоксигеназы во многих воспалительных клетках дыхательных путей. [9] Арахидоновая кислота высвобождается из фосфолипидов клеточной мембраны в основном с помощью фосфолипазы А2.[10] Циклооксигеназный путь продуцирует тромбоксан и простагландины из арахидоновой кислоты. Кортикостероиды ингибируют фосфолипазу А2 и последующий синтез эйкозаноидных медиаторов воспаления, включая как простагландины, так и лейкотриены. Нестероидные противовоспалительные препараты, такие как аспирин, ингибируют циклооксигеназы. Зилеутон ингибирует 5-липоксигеназу.
[9] Арахидоновая кислота высвобождается из фосфолипидов клеточной мембраны в основном с помощью фосфолипазы А2.[10] Циклооксигеназный путь продуцирует тромбоксан и простагландины из арахидоновой кислоты. Кортикостероиды ингибируют фосфолипазу А2 и последующий синтез эйкозаноидных медиаторов воспаления, включая как простагландины, так и лейкотриены. Нестероидные противовоспалительные препараты, такие как аспирин, ингибируют циклооксигеназы. Зилеутон ингибирует 5-липоксигеназу.
Существует две группы лейкотриенов: одна с аминокислотными фрагментами, а другая без них.[1] Лейкотриен B4 несет только гидроксильную часть и связывается с рецепторами BLT. Сигнальный путь через активацию рецептора BLT, связанного с G-белком, вызывает мощный ответ хемотаксиса. Цистеиниллейкотриены (LTC4, LTD4 и LTE4) имеют аминокислотный фрагмент и связываются с цистеиниллейкотриеновыми рецепторами (CysLT1 и CysLT2). Бронхоконстрикция, сосудистая проницаемость, рекрутирование эозинофилов и хроническое воспаление опосредуются связанной с G-белком активацией цистеиниллейкотриеновых рецепторов. Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов CysLT1, но не рецепторов CysLT2. Исследования показали, что эозинофилы являются основным источником цистеиниллейкотриенов, а цистеиниллейкотриены очень важны для рекрутирования эозинофилов.[11] Более ранние исследования показали, что цистеиниллейкотриены также играют важную роль в ремоделировании дыхательных путей при хронической астме.[12]
Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов CysLT1, но не рецепторов CysLT2. Исследования показали, что эозинофилы являются основным источником цистеиниллейкотриенов, а цистеиниллейкотриены очень важны для рекрутирования эозинофилов.[11] Более ранние исследования показали, что цистеиниллейкотриены также играют важную роль в ремоделировании дыхательных путей при хронической астме.[12]
Астма является наиболее распространенным хроническим заболеванием легких, характеризующимся обратимой бронхоконстрикцией, воспалением и ремоделированием дыхательных путей, что приводит к гиперреактивности. Симпатомиметические средства, такие как агонисты бета-адренергических рецепторов, являются терапевтическим выбором для лечения острой бронхоконстрикции. Они активируют бета-2 адренорецепторы и расслабляют гладкомышечные клетки дыхательных путей. К бета2-селективным агонистам короткого действия относятся альбутерол, левалбутерол, тербуталин, метапротеренол и пирбутерол. Они поддерживают бронходилатацию в течение 3-4 часов. К бета2-селективным агонистам длительного действия с 12-часовой продолжительностью действия относятся салметерол и формотерол. Пациенты, принимающие бета-агонисты сверхдлительного действия, такие как индакатерол, олодатерол и вилантерол, должны принимать бамбутерол только один раз в день. Поскольку бета-агонисты не ингибируют воспалительные реакции, они не могут использоваться в качестве монотерапии для контроля персистирующей астмы. Они часто являются вторым агентом, добавляемым к ингаляционным кортикостероидам.
Они поддерживают бронходилатацию в течение 3-4 часов. К бета2-селективным агонистам длительного действия с 12-часовой продолжительностью действия относятся салметерол и формотерол. Пациенты, принимающие бета-агонисты сверхдлительного действия, такие как индакатерол, олодатерол и вилантерол, должны принимать бамбутерол только один раз в день. Поскольку бета-агонисты не ингибируют воспалительные реакции, они не могут использоваться в качестве монотерапии для контроля персистирующей астмы. Они часто являются вторым агентом, добавляемым к ингаляционным кортикостероидам.
Основываясь на воспалительном механизме астмы, для лечения этого эндотипа астмы было разработано несколько фармакологических средств с различными механизмами действия. Воздействие аллергена стимулирует синтез IgE, управляемый CD4+ Т-хелперными клетками 2 типа. Антитела IgE связываются со своими рецепторами на тучных клетках ткани и базофилах крови.[14] При повторном воздействии аллергена аллерген сшивает антитела IgE на поверхности иммунных клеток. Он запускает высвобождение предварительно образованных медиаторов анафилаксии и синтез медиаторов воспаления. Кромолин или недокромил могут предотвращать дегрануляцию тучных клеток. Однако в настоящее время эти препараты обычно не используются для лечения астмы, поскольку они менее эффективны, чем ингаляционные кортикостероиды. Гистамин, триптаза и метаболиты арахидоновой кислоты, такие как лейкотриены C4 и D4 и простагландин D2, высвобождаются и вызывают острое сокращение гладких мышц и повышение проницаемости сосудов. Через три-шесть часов при поздней астматической реакции возникает более устойчивый бронхоспазм. Есть предположения, что цитокины, продуцируемые иммунным ответом 2-го типа, опосредуют поздний астматический ответ.[15]
Он запускает высвобождение предварительно образованных медиаторов анафилаксии и синтез медиаторов воспаления. Кромолин или недокромил могут предотвращать дегрануляцию тучных клеток. Однако в настоящее время эти препараты обычно не используются для лечения астмы, поскольку они менее эффективны, чем ингаляционные кортикостероиды. Гистамин, триптаза и метаболиты арахидоновой кислоты, такие как лейкотриены C4 и D4 и простагландин D2, высвобождаются и вызывают острое сокращение гладких мышц и повышение проницаемости сосудов. Через три-шесть часов при поздней астматической реакции возникает более устойчивый бронхоспазм. Есть предположения, что цитокины, продуцируемые иммунным ответом 2-го типа, опосредуют поздний астматический ответ.[15]
Успехи в понимании молекулярной гетерогенности астмы выявили важность иммунного ответа типа 2, опосредованного Т-хелперами типа 2, в патологии эозинофильной астмы.[16] Омализумаб представляет собой моноклональное антитело, которое может снижать количество циркулирующего IgE. ИЛ-4, ИЛ-5 и ИЛ-13 опосредуют иммунный ответ типа 2. Меполизумаб с антителами против ИЛ-5 минимизирует количество и активность эозинофилов в слизистой оболочке дыхательных путей. Дупилумаб представляет собой антитело к рецептору ИЛ-4.
ИЛ-4, ИЛ-5 и ИЛ-13 опосредуют иммунный ответ типа 2. Меполизумаб с антителами против ИЛ-5 минимизирует количество и активность эозинофилов в слизистой оболочке дыхательных путей. Дупилумаб представляет собой антитело к рецептору ИЛ-4.
Введение
Монтелукаст вводят перорально, независимо от еды или приема пищи. Пациентам с астмой, а также астмой и аллергическим ринитом следует принимать одну дозу вечером. Для лечения аллергического ринита прием может быть как утренним, так и вечерним. Его следует принимать не менее чем за два часа до тренировки, чтобы предотвратить астму, вызванную физической нагрузкой. Пациенты не должны принимать другую дозу в течение 24 часов.
Зафирлукаст принимают внутрь. Его следует принимать через 2 часа после или за 1 час до еды, поскольку пища снижает биодоступность на 40%.
Побочные эффекты
Монтелукаст относительно хорошо переносится и в целом безопасен.[17] Наиболее часто наблюдаемыми побочными эффектами у пациентов в возрасте 15 лет и старше были головные боли, гриппозная инфекция, боль в животе, кашель и диспепсия.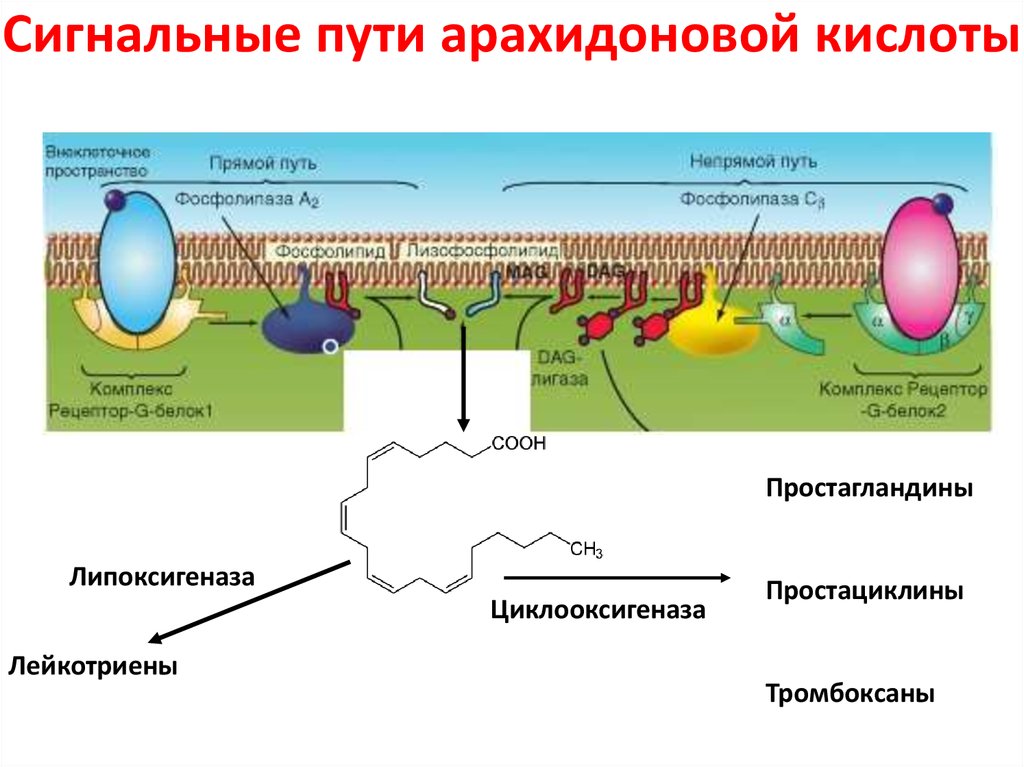 У детей могут возникнуть диарея, тошнота, ларингит, фарингит, синусит, отит и вирусная инфекция. Могут возникнуть нервно-психические расстройства, включая депрессию, агрессию, суицидальные мысли, бессонницу, тревогу и ночные кошмары.[18]
У детей могут возникнуть диарея, тошнота, ларингит, фарингит, синусит, отит и вирусная инфекция. Могут возникнуть нервно-психические расстройства, включая депрессию, агрессию, суицидальные мысли, бессонницу, тревогу и ночные кошмары.[18]
Аллергический гранулематозный ангиит (синдром Чарга-Стросса) также может коррелировать с применением монтелукаста, хотя причинно-следственная связь еще не установлена.[19][20] Имеются некоторые сообщения о серьезных нежелательных явлениях, связанных с ангионевротическим отеком, гиперчувствительностью, утомляемостью, спутанностью сознания, патологическими сновидениями, эпилепсией, агрессией, нарушением иммунной системы, кровоизлиянием, раздражением, увеличением количества эозинофилов, болью в конечностях и болью в животе.[18] В исследовании на животных он не оказывал тератогенного действия в дозах, значительно превышающих максимальную суточную дозу для человека.[17]
Зафирлукаст, как правило, хорошо переносится, и побочные эффекты минимальны. [21] Распространенными побочными эффектами являются головная боль, инфекция верхних дыхательных путей и желудочно-кишечные расстройства, такие как тошнота, рвота, диспепсия, боль в животе, диарея и недомогание.[21] Редко повышение активности печеночных ферментов, острый гепатит и гипербилирубинемия были связаны с зафирлукастом.[22][23]
[21] Распространенными побочными эффектами являются головная боль, инфекция верхних дыхательных путей и желудочно-кишечные расстройства, такие как тошнота, рвота, диспепсия, боль в животе, диарея и недомогание.[21] Редко повышение активности печеночных ферментов, острый гепатит и гипербилирубинемия были связаны с зафирлукастом.[22][23]
Противопоказания
Как монтелукаст, так и зафирлукаст противопоказаны пациентам с гиперчувствительностью к препарату или любому компоненту их состава.
Противопоказания к применению зафирлукаста также включают пациентов с острой астмой или печеночной недостаточностью.
Противопоказания к применению монтелукаста включают тяжелую форму астмы. Пациентам с фенилкетонурией рекомендуется соблюдать осторожность, поскольку существует форма, содержащая фенилаланин.
Мониторинг
Депрессия, агрессия и другие поведенческие изменения коррелируют с антагонистами лейкотриеновых рецепторов. Необходимо тщательное наблюдение за пациентами, получающими лечение антагонистами лейкотриеновых рецепторов.
Зафирлукаст может вызывать тяжелое, но редко острое поражение печени. Это основной субстрат фермента цитохрома P450 CYP2C9. Пациенты, получающие сопутствующую терапию такими препаратами, как алпелисиб, дабрафениб, энзалутамид, эритромицин, локсапин, лумакафтор, рифапентин, терфенадин и варфарин, нуждаются в наблюдении за потенциальными лекарственными взаимодействиями.
Токсичность
И монтелукаст, и зафирлукаст имеют широкий запас прочности. У пациентов, принявших передозировку, не было побочных симптомов, выздоровление проходило без осложнений, сыпи и расстройства желудка.[25][26]
При передозировке удалите неабсорбированные препараты с помощью активированного угля и при необходимости назначьте поддерживающую терапию.
Улучшение результатов бригады здравоохранения
В центр фармаконадзора Нидерландов Lareb и в глобальную базу данных отчетов ВОЗ о безопасности отдельных случаев поступили сообщения о нескольких побочных реакциях на лекарства.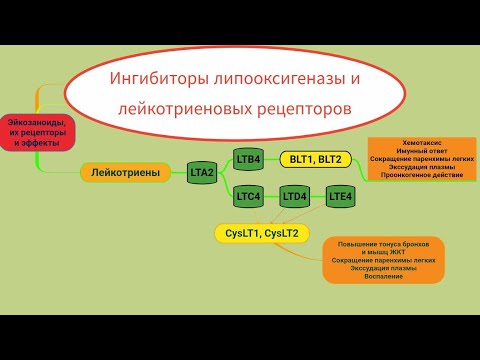 Наиболее частым побочным эффектом у всего населения была депрессия, а у детей в возрасте до 19 лет — агрессия.[18] Сообщалось о суицидальных мыслях, аномальном поведении, ночных кошмарах, головных болях, бессоннице и беспокойстве у пациентов, получавших монтелукаст. Кошмары могут возникать и пугать детей. Агрессивность и ненормальное поведение детей могут вызывать опасения у их родителей и учителей. Бессонница у взрослых может повлиять на безопасность пациентов и других лиц.
Наиболее частым побочным эффектом у всего населения была депрессия, а у детей в возрасте до 19 лет — агрессия.[18] Сообщалось о суицидальных мыслях, аномальном поведении, ночных кошмарах, головных болях, бессоннице и беспокойстве у пациентов, получавших монтелукаст. Кошмары могут возникать и пугать детей. Агрессивность и ненормальное поведение детей могут вызывать опасения у их родителей и учителей. Бессонница у взрослых может повлиять на безопасность пациентов и других лиц.
Астма — это хроническое заболевание легких. Даже у пациентов с хорошо налаженным режимом лечения могут возникать обострения астмы. Понимание факторов риска склонной к обострению астмы имеет решающее значение для предотвращения потенциально смертельных острых приступов астмы.[27][28]
Как у афроамериканцев, так и у выходцев из Латинской Америки частота обострений выше. Плохое соблюдение режима лечения из-за плохого доступа пациентов к медицинской помощи и недостаточного образования и знаний о болезни подвергает пациентов большому риску острых обострений.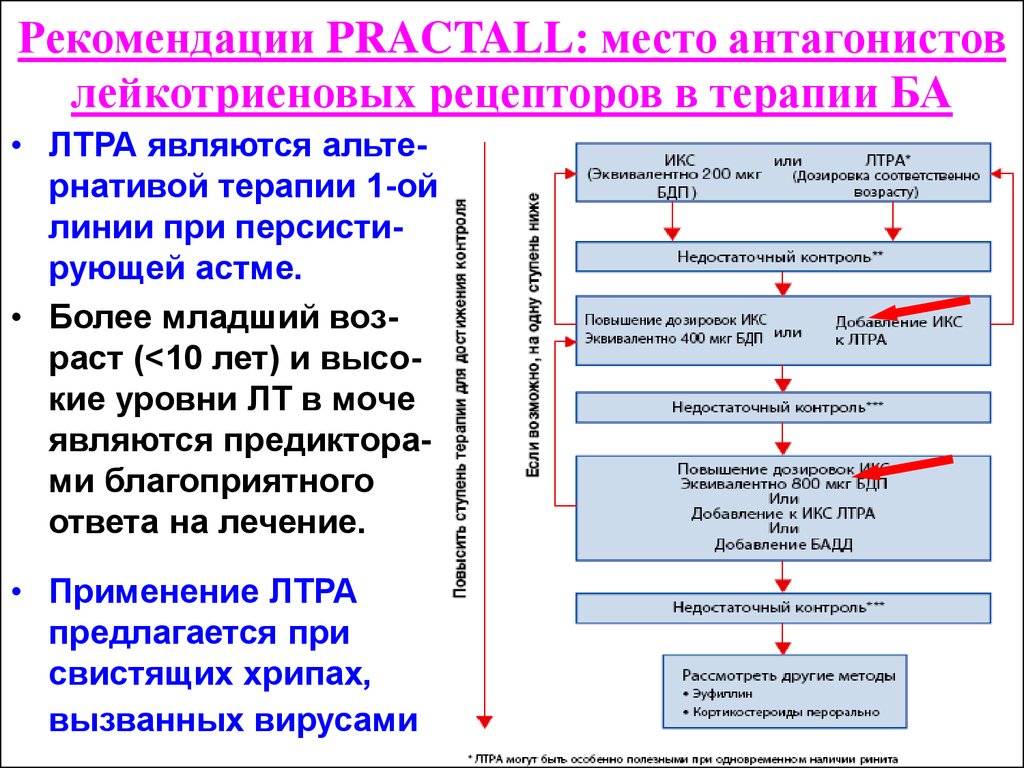 Другие потенциально модифицируемые факторы риска включают неконтролируемые аллергии, вирусные инфекции верхних дыхательных путей, ожирение, курение и гастроэзофагеальную рефлюксную болезнь [29].][30][31][32] Межпрофессиональный подход, включающий всех членов медицинской бригады, включая врачей (MD и DO), практикующих врачей среднего звена (NP и PA), специалистов, медсестер, фармацевтов и респираторных терапевтов, может снизить острые приступы астмы, взяв под контроль эти факторы риска. Межпрофессиональная медицинская бригада должна обучать своих пациентов или родителей и контролировать частоту побочных эффектов лекарств. Использование подхода межпрофессиональной команды к лечению пациентов в целом и использование антагонистов лейкотриеновых рецепторов у пациентов, которым будет полезна такая медикаментозная терапия. [Уровень 5]
Другие потенциально модифицируемые факторы риска включают неконтролируемые аллергии, вирусные инфекции верхних дыхательных путей, ожирение, курение и гастроэзофагеальную рефлюксную болезнь [29].][30][31][32] Межпрофессиональный подход, включающий всех членов медицинской бригады, включая врачей (MD и DO), практикующих врачей среднего звена (NP и PA), специалистов, медсестер, фармацевтов и респираторных терапевтов, может снизить острые приступы астмы, взяв под контроль эти факторы риска. Межпрофессиональная медицинская бригада должна обучать своих пациентов или родителей и контролировать частоту побочных эффектов лекарств. Использование подхода межпрофессиональной команды к лечению пациентов в целом и использование антагонистов лейкотриеновых рецепторов у пациентов, которым будет полезна такая медикаментозная терапия. [Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.

Ссылки
- 1.
Джо-Ватанабе А., Окуно Т., Йокомизо Т. Роль лейкотриенов как потенциальных терапевтических мишеней при аллергических расстройствах. Int J Mol Sci. 22 июля 2019 г.; 20 (14) [Бесплатная статья PMC: PMC6679143] [PubMed: 31336653]
- 2.
Тамада Т, Ичиносе М. Антагонисты рецепторов лейкотриенов и противоаллергические препараты. Handb Exp Pharmacol. 2017;237:153-169. [PubMed: 27826703]
- 3.
Киттана Н., Хаттаб С., Зияде-Ислим А., Джарадат Н., Зайд А.Н. Монтелукаст, текущие показания и перспективы применения в будущем. Эксперт Respir Med. 2016 сен;10(9):943-56. [PubMed: 27485393]
- 4.
Зайдман М.Д., Гургель Р.К., Лин С.Ю., Шварц С.Р., Баруди Ф.М., Боннер Д.Р., Доусон Д.Е., Дайкевич М.С., Хакелл Дж.М., Хан Дж.К., Ишман С.Л., Круз Х.Дж., Малекзаде S, Mims JW, Omole FS, Reddy WD, Wallace DV, Walsh SA, Warren BE, Wilson MN, Nnacheta LC., Группа разработки рекомендаций по отоларингологии.
 ААО-ХНСФ. Клинические рекомендации: Аллергический ринит. Отоларингол Head Neck Surg. 2015 Февраль; 152 (1 Дополнение): S1-43. [В паблике: 25644617]
ААО-ХНСФ. Клинические рекомендации: Аллергический ринит. Отоларингол Head Neck Surg. 2015 Февраль; 152 (1 Дополнение): S1-43. [В паблике: 25644617]- 5.
Эмерик А., Эмерик-Максимюк Ю., Янечек К. Новые рекомендации по лечению сезонного аллергического ринита. Постерий Дерматол Алергол. 2019 июнь;36(3):255-260. [Бесплатная статья PMC: PMC6640027] [PubMed: 31333340]
- 6.
Ferguson L, Futamura M, Vakirlis E, Kojima R, Sasaki H, Roberts A, Mori R. Антагонисты лейкотриеновых рецепторов при экземе. Cochrane Database Syst Rev. 2018 Oct 21;10(10):CD011224. [Бесплатная статья PMC: PMC6517006] [PubMed: 30343498]
- 7.
Parsons JP, Hallstrand TS, Mastronarde JG, Kaminsky DA, Rundell KW, Hull JH, Storms WW, Weiler JM, Cheek FM, Wilson KC, Anderson SD., Подкомитет Американского торакального общества по упражнениям -индуцированная бронхоконстрикция. Официальное руководство по клинической практике Американского торакального общества: бронхоконстрикция, вызванная физической нагрузкой.
 Am J Respir Crit Care Med. 2013 01 мая; 187(9):1016-27. [PubMed: 23634861]
Am J Respir Crit Care Med. 2013 01 мая; 187(9):1016-27. [PubMed: 23634861]- 8.
Блейк К.В. Монтелукаст: данные клинических исследований по лечению астмы. Энн Фармакотер. 1999 декабря; 33 (12): 1299-314. [PubMed: 10630831]
- 9.
Rådmark O, Werz O, Steinhilber D, Samuelsson B. 5-липоксигеназа, ключевой фермент биосинтеза лейкотриенов в норме и при болезнях. Биохим Биофиз Акта. 2015 апрель; 1851 (4): 331-9. [PubMed: 25152163]
- 10.
Claar D, Hartert TV, Peebles RS. Роль простагландинов в аллергическом воспалении легких и бронхиальной астме. Эксперт Respir Med. 2015 Февраль;9(1):55-72. [Бесплатная статья PMC: PMC4380345] [PubMed: 25541289]
- 11.
Томпсон-Соуза Г.А., Гропилло И., Невес Дж.С. Цистеиниллейкотриены в биологии эозинофилов: функциональные роли и терапевтические перспективы при эозинофильных расстройствах. Front Med (Лозанна). 2017;4:106. [Бесплатная статья PMC: PMC5515036] [PubMed: 28770202]
- 12.

Hallstrand TS, Henderson WR. Новые сведения о роли лейкотриенов при астме. Курр Опин Аллергия Клин Иммунол. 2010 Февраль;10(1):60-6. [Бесплатная статья PMC: PMC2838730] [PubMed: 19915456]
- 13.
Falk NP, Hughes SW, Rogers BC. Лекарства от хронической астмы. Ам семейный врач. 2016 15 сентября; 94 (6): 454-62. [PubMed: 27637121]
- 14.
Olin JT, Wechsler ME. Бронхиальная астма: патогенез и новые препараты для лечения. БМЖ. 2014 24 ноября; 349:g5517. [PubMed: 25420994]
- 15.
Цислевич Г., Томкинсон А., Адлер А., Дуэз С., Шварце Дж., Такеда К., Ларсон К.А., Ли Дж.Дж., Ирвин К.Г., Гельфанд Э.В. Поздний, но не ранний астматический ответ зависит от ИЛ-5 и коррелирует с инфильтрацией эозинофилами. Джей Клин Инвест. 1999 августа; 104 (3): 301-8. [Бесплатная статья PMC: PMC408423] [PubMed: 10430611]
- 16.
Fahy JV. Воспаление 2 типа при астме — присутствует у большинства, но отсутствует у многих.
 Нат Рев Иммунол. 2015 Янв; 15 (1): 57-65. [Бесплатная статья PMC: PMC43 ] [PubMed: 25534623]
Нат Рев Иммунол. 2015 Янв; 15 (1): 57-65. [Бесплатная статья PMC: PMC43 ] [PubMed: 25534623]- 17.
Hon KL, Leung TF, Leung AK. Клиническая эффективность и безопасность монтелукаста при бронхиальной астме. Каковы выводы клинических испытаний и метаанализов? Препарат Des Devel Ther. 2014;8:839-50. [Бесплатная статья PMC: PMC4079631] [PubMed: 25061277]
- 18.
Haarman MG, van Hunsel F, de Vries TW. Побочные реакции на монтелукаст у детей и взрослых. Фармакол Рез Перспект. 5(5) октября 2017 г. [Статья без PMC: PMC5625152] [PubMed: 28971612]
- 19.
Калапай Г., Кашаро М., Миродди М., Калапай Ф., Наварра М., Гангеми С. Побочное действие монтелукаста реакции: обзор описаний случаев в литературе. Фармакология. 2014;94(1-2):60-70. [PubMed: 25196099]
- 20.
Гарсия-Маркос Л., Шустер А., Перес-Ярса Э.Г. Оценка пользы и риска антилейкотриенов при лечении астмы. Препарат Саф. 2003;26(7):483-518.
 [PubMed: 12735786]
[PubMed: 12735786]- 21.
Twaites BR, Wilton LV, Shakir SA. Безопасность зафирлукаста: результаты постмаркетингового исследования с участием 7976 пациентов в Англии. Препарат Саф. 2007;30(5):419-29. [PubMed: 17472420]
- 22.
LiverTox: клиническая и исследовательская информация о лекарственном повреждении печени [Интернет]. Национальный институт диабета и болезней органов пищеварения и почек; Bethesda (MD): 4 июня 2019 г. Зафирлукаст. [PubMed: 31643251]
- 23.
Wooltorton E. Лекарство от астмы зафирлукаст (Accolate): серьезные нарушения со стороны печени. CMAJ. 2004 г., 25 мая; 170 (11): 1668. [Бесплатная статья PMC: PMC408503] [PubMed: 15159361]
- 24.
Adkins JC, Brogden RN. Зафирлукаст. Обзор его фармакологии и терапевтического потенциала в лечении астмы. Наркотики. 1998 января; 55 (1): 121-44. [PubMed: 9463793]
- 25.
Cantrell FL, Farson-Collier M.
 Доброкачественное клиническое течение после большого приема монтелукаста у детей. J Toxicol Clin Toxicol. 2004;42(3):333-4. [PubMed: 15362605]
Доброкачественное клиническое течение после большого приема монтелукаста у детей. J Toxicol Clin Toxicol. 2004;42(3):333-4. [PubMed: 15362605]- 26.
Геллер М., Мело Л.Р., Коутиньо С.В. Успешный исход передозировки монтелукаста у ребенка с астмой. Энн Аллергия Астма Иммунол. 2000 март; 84 (3): 370. [PubMed: 10752926]
- 27.
Castillo JR, Peters SP, Busse WW. Обострения бронхиальной астмы: патогенез, профилактика и лечение. J Allergy Clin Immunol Pract. 2017 июль-август;5(4):918-927. [Бесплатная статья PMC: PMC5950727] [PubMed: 28689842]
- 28.
Адели М., Эль-Шарейф Т., Хендаус М.А. Обострение астмы, связанное с вирусными инфекциями: актуальное резюме. J Family Med Prim Care. 2019 сен;8(9):2753-2759. [Бесплатная статья PMC: PMC6820381] [PubMed: 31681638]
- 29.
Hammond C, Kurten M, Kennedy JL. Риновирус и астма: легендарная история несовместимости. Curr Allergy Asthma Rep. 2015 Feb;15(2):502.
 [Бесплатная статья PMC: PMC4327812] [PubMed: 25612798]
[Бесплатная статья PMC: PMC4327812] [PubMed: 25612798]- 30.
Denlinger LC, Phillips BR, Ramratnam S, Ross K, Bhakta NR, Cardet JC, Castro M, Peters SP, Phipatanakul W, Aujla S, Bacharier LB, Bleecker ER, Comhair SA, Coverstone А., ДеБоер М., Эрзурум СК, Фейн С.Б., Файт М., Фитцпатрик А.М., Гаффин Дж., Гастон Б., Хасти А.Т., Хокинс Г.А., Ольгин Ф., Ирани А.М., Исраэль Э., Леви Б.Д., Ли Н., Мейерс Д.А., Мур В.К., Майерс Р., Опина М.Т., Петерс М.С., Шиблер М.Л., Соркнесс Р.Л., Тиг В.Г., Венцель С.Е., Вудрафф П.Г., Могер Д.Т., Фахи Дж.В., Джаржур Н.Н., Исследовательская программа тяжелой астмы Национального института сердца, легких и крови – 3 исследователя. Воспалительные и коморбидные особенности у пациентов с тяжелой астмой и частыми обострениями. Am J Respir Crit Care Med. 2017 01 февраля; 195(3):302-313. [Бесплатная статья PMC: PMC5328178] [PubMed: 27556234]
- 31.
Эриксон С.Е., Ирибаррен С., Толстых И.В., Блан П.Д., Эйснер М.Д.