Новый инструмент ВОЗ: классификация антибиотиков «AWaRe»
Главная > Новости > Новый инструмент ВОЗ: классификация антибиотиков «AWaRe»
Летом 2019 г. ВОЗ начала глобальную кампанию, призывающую правительства использовать разработанную в 2017 г. классификацию антибиотиков «Access, Watch, Reserve – AWaRe»* в мероприятиях по снижению устойчивости к противомикробным препаратам. Классификация представляет собой инструмент управления антибиотиками на местном, национальном и глобальном уровнях с целью снижения устойчивости. Классификационная база данных «AWaRe» включает 180 антибиотиков, разделенных на три группы: доступные (Access), поднадзорные (Watch) и резервные (Reserve), с указанием их фармакологических классов, кодов анатомо-терапевтическо-химической классификации (ATC) и статуса в списке основных лекарственных средств ВОЗ. В базе данных также перечислены те антибиотики, применение которых не рекомендуется ВОЗ, а именно комбинации фиксированных доз нескольких антибиотиков широкого спектра действия, относительно которых отсутствуют научно обоснованные показания к применению или рекомендации в авторитетных международных руководствах. Группа Access В эту группу входят противомикробные средства, обладающие активностью в отношении широкого спектра часто выявляемых восприимчивых патогенов и одновременно демонстрирующие более низкий потенциал резистентности, чем антибиотики других групп. Группа Access включает 48 антибиотиков, 19 из которых включены в примерный перечень основных лекарственных средств ВОЗ в качестве вариантов первого или второго эмпирического выбора для лечения определенных инфекционных синдромов (табл. 1). Группа Watch В эту группу входят антибиотики с более высоким потенциалом резистентности, а также большинство наиболее приоритетных препаратов среди критически важных противомикробных лекарственных средств для медицины человека и/или антибиотики, которые подвергаются относительно высокому риску развития бактериальной резистентности. Антибиотики в группе «Watch» должны быть приоритетными в качестве ключевых целей программ управления и мониторинга. Группа Reserve В эту группу входят антибиотики и их классы, которые следует зарезервировать для лечения подтвержденных или подозреваемых инфекций, вызванных микроорганизмами со множественной лекарственной устойчивостью. Антибиотики в резервной группе следует рассматривать как варианты «последней инстанции», которые должны быть доступны, но их применение следует адаптировать к очень специфическим пациентам и условиям, когда все альтернативы оказались неудачными или не подходят. Этим лекарственным средствам должен быть отдан приоритет в качестве основных целей национальных и международных программ управления, включающих мониторинг и отчетность об использовании для сохранения их эффективности. К группе «Reserve» отнесены 22 антибиотика, входящие в перечень основных лекарственных средств ВОЗ (табл. Почему ВОЗ разработала AWaRe Доступ к качественным, безопасным и доступным лекарственным средствам и медицинским изделиям является ключевым вкладом в обеспечение всеобщего охвата услугами здравоохранения и целью «трех миллиардов», установленной в 13-й Общей программе работы ВОЗ (General Programme of Work – GPW). Для мониторинга доступа к основным лекарственным средствам в рамках 13-й GPW существует показатель, основанный на AWaRe, предписывающий, чтобы в структуре потребления стран не менее 60% антибиотиков приходились на группу «Access». Этот инструмент также может быть принят клиницистами для мониторинга использования антибиотиков и осуществления надзорных мероприятий на местном уровне, а также для разработки рекомендаций по лечению антибиотиками. Таблица 1. Группа «Access» классификации «AWaRe»
Таблица 2.
Таблица 3.
По материалам www. Источник: apteka.ua | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ISSN 0235-2990 (Print)
Препараты макролиды – список антибиотиков, механизм действия, классификация
Препараты макролиды прочно вошли в клиническую практику. Эта группа антибактериальных средств активно используется для лечения заболеваний бактериального происхождения. Широкое распространение антибиотики получили благодаря высокой эффективности и отсутствию побочных эффектов.
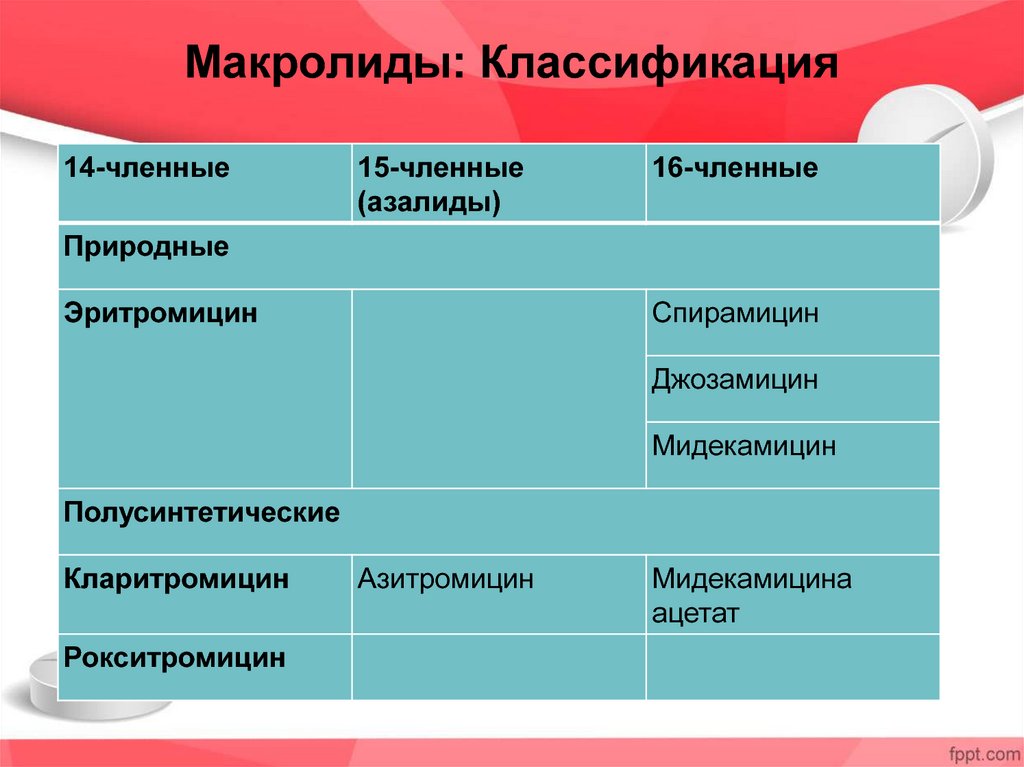
Макролиды – классификация
Данный класс антибиотиков представлен десятками препаратов. Для того чтобы их различать, врачами нередко используется классификация макролидов. Согласно ей, принято различать макролиды по:
- количеству атомов углерода в составе;
- поколениям, в зависимости от времени разработки;
- способу получения.
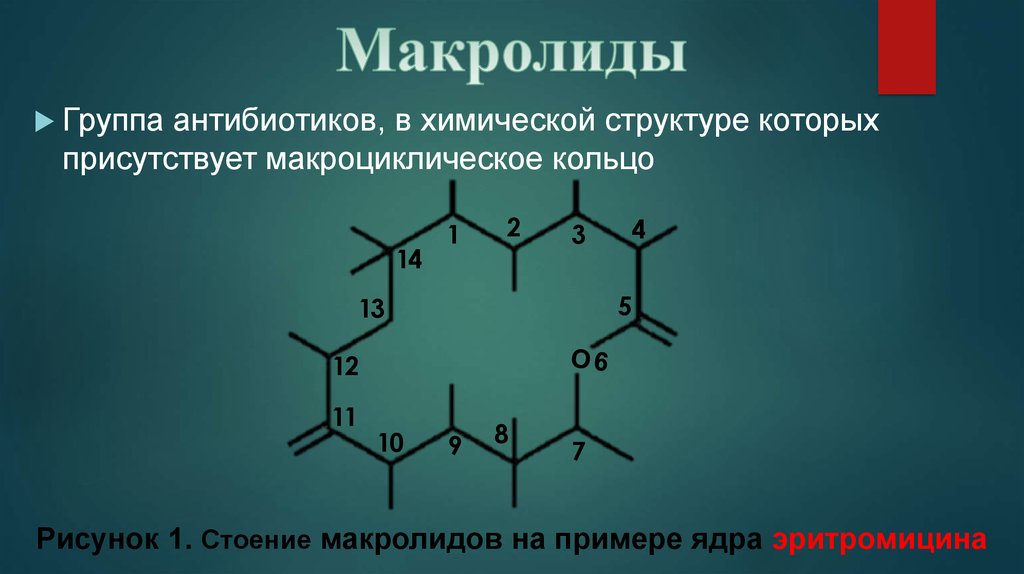
Учитывая эти особенности, медики подбирают подходящий в конкретной ситуации препарат. При этом стоит понимать, что все лекарства данной группы имеют схожую химическую структуру. В ее основе лежит макроциклическое лактонное кольцо. Непосредственно оно обеспечивает антибактериальные свойства препарата.
В ее основе лежит макроциклическое лактонное кольцо. Непосредственно оно обеспечивает антибактериальные свойства препарата.
Классификация макролидов по количеству атомов углерода
Согласно химической структуре лекарственных средств, принято выделять следующие группы препаратов макролидов:
- 14-членные – это группа лекарственных средств, действующее вещество которых состоит из 14 атомов углерода, объединенных в макроциклическое кольцо.
- 15-членные – данная группа макролидов включает лекарственные средства, в которых лактонное кольцо образованно 15-ю атомами углерода.
- 16-членные –содержат в своем составе 16 атомов углерода.
Даже учитывая такое разнообразие этой группы лекарственных средств, необходимо отметить, что все препараты макролиды имеют схожую степень активности. При этом список бактерий, в отношении которых они проявляют активность, тоже схож. В него входят как грамположительные, так и внутриклеточные микроорганизмы, что обуславливает широкий спектр активности.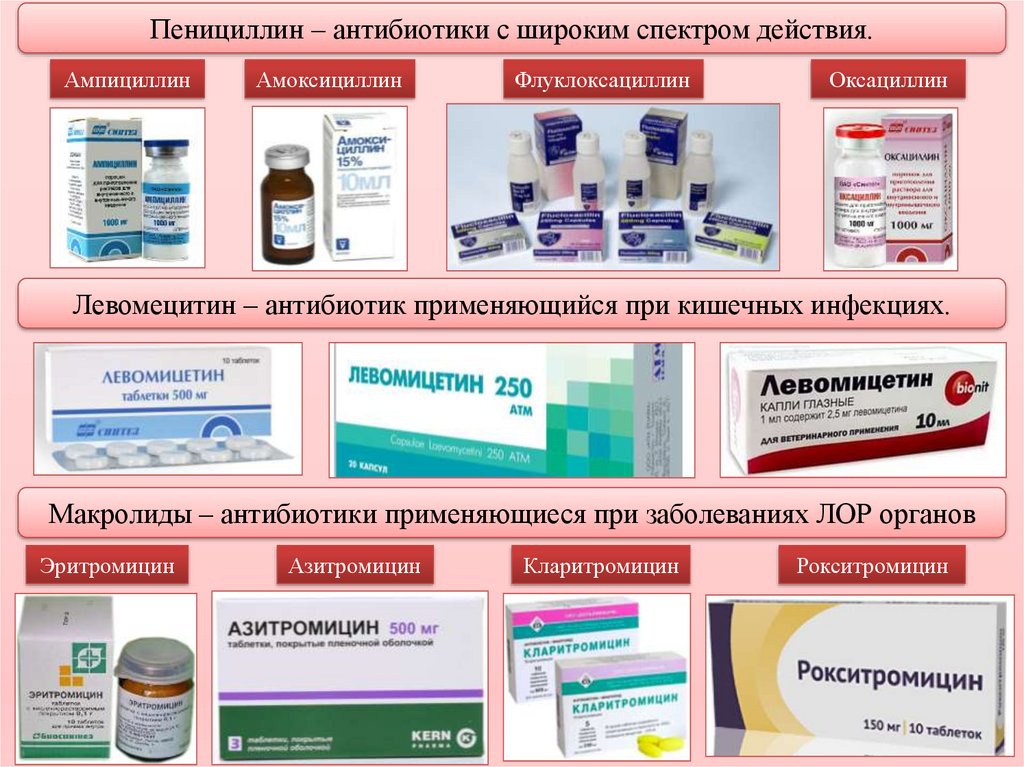
Классификация макролидов по поколениям
Фармакологи на протяжении многих лет занимаются усовершенствованием лекарственных средств, разработкой новых препаратов. Так и в случае с макролидами, список которых постоянно пополняется новыми препаратами. Если рассматривать лекарственные средства в порядке их выпуска, то можно выделить следующие поколения макролидов:
- 1 поколение (Эритромицин) – данные препараты были одной из первых альтернатив пенициллинам. Их применяли, когда патогенные микробы приобретали устойчивость к пенициллину и лечение им становилось неэффективным. Чтобы избежать разрушение эритромицина в кислой среде желудка, его выпускают в специальных капсулах и советуют принимать натощак.
- 2 поколение (Медикамицин) – обладают повышенной активностью в отношении энтеробактерий, псевдомонад и анаэробов. Проявляют улучшенные фармакокинетические свойства (лучше всасываются в желудке, обладают пролонгированным действием).
- 3 поколение (Азитромицин) – его представляют современные макролиды.
 Однако многие специалисты относят эти препараты ко второму поколению, не выделяя в отдельную группу.
Однако многие специалисты относят эти препараты ко второму поколению, не выделяя в отдельную группу.
Природные и полусинтетические макролиды
Сразу необходимо отметить, что подобное деление является условным. Обусловлено это тем, что множество природных антибиотиков получается путем синтеза. Согласно этой классификации, препараты группы «Макролиды» разделяют на:
- Природные – к ним относятся некоторые 14- и 16-членные макролиды (Эритромицин, Спирамицин, Мидекамицин).
- Полусинтетические – в качестве представителей этой группы можно выделить Кларитромицин, Мидекамицин, Рокситромицин.
Макролиды – механизм действия
Механизм действия макролидов обусловлен сбоем процесса синтеза белка, который образуется на рибосомах микробной клетки. В результате этого проявляется бактериостатический эффект – замедляется и полностью прекращается рост бактерий, останавливается процесс размножения бактериальных клеток. Однако в высоких концентрациях на отдельные группы патогенов макролиды действуют бактерицидно. Это:
Это:
- пневмококк;
- возбудители коклюша;
- возбудители дифтерии.
Стоит заметить, что макролиды, кроме бактериостатического действия, проявляют и ряд других полезных свойств. Согласно результатам проведенных клинических исследований, отдельные макролиды способны проявлять иммуномодулирующий эффект и умеренное противовоспалительное действие, что расширяет спектр применения лекарственных средств.
Спектр действия макролидов
Согласно проведенным лабораторным исследованиям, действие макролидов провоцирует гибель широкого спектра патогенных микроорганизмов. К макролидам относится с опаской и атипичный возбудитель пневмонии. Препараты быстро уничтожают грамположительных кокков, пневмококков, пиогенных стрептококков (16-членные макролиды). Кроме того, данные макролиды, группа антибиотиков, проявляет активность в отношении:
- моракселлы;
- листреи;
- спирохет;
- дифтерийной палочки;
- хламидии;
- микоплазм;
- уреаплазм;
- анаэробов;
- легионелл;
- хеликобактер;
- некоторых простейших.

Препараты макролиды – список
Представили фармацевтической промышленности постоянно ведут работу над созданием новых лекарственных средств, их совершенствованием. В связи с этим непрерывно разрабатываются новые препараты макролиды, список антибиотиков дополняется новыми названиями. Основной целью подобной работы является повышение эффективности существующих лекарственных средств, расширение спектра их действия и снижение рисков развития побочных эффектов.
Макролиды 1 поколения
Относящиеся к этой группе антибиотики макролиды, список которых будет приведен ниже, оказались высокоэффективными препаратами. Они и сегодня помогают врачам бороться с инфекцией, вызываемой грамположительными микроорганизмами. По мощности они превосходят природный пенициллин, поэтому нередко применяются в тех случаях, когда антибиотики из его группы не справляются со своей задачей.
В ходе лабораторных и клинических испытаний было установлено, что макролиды 1 поколения быстро угнетают рост бактерий, нечувствительных к тетрациклину.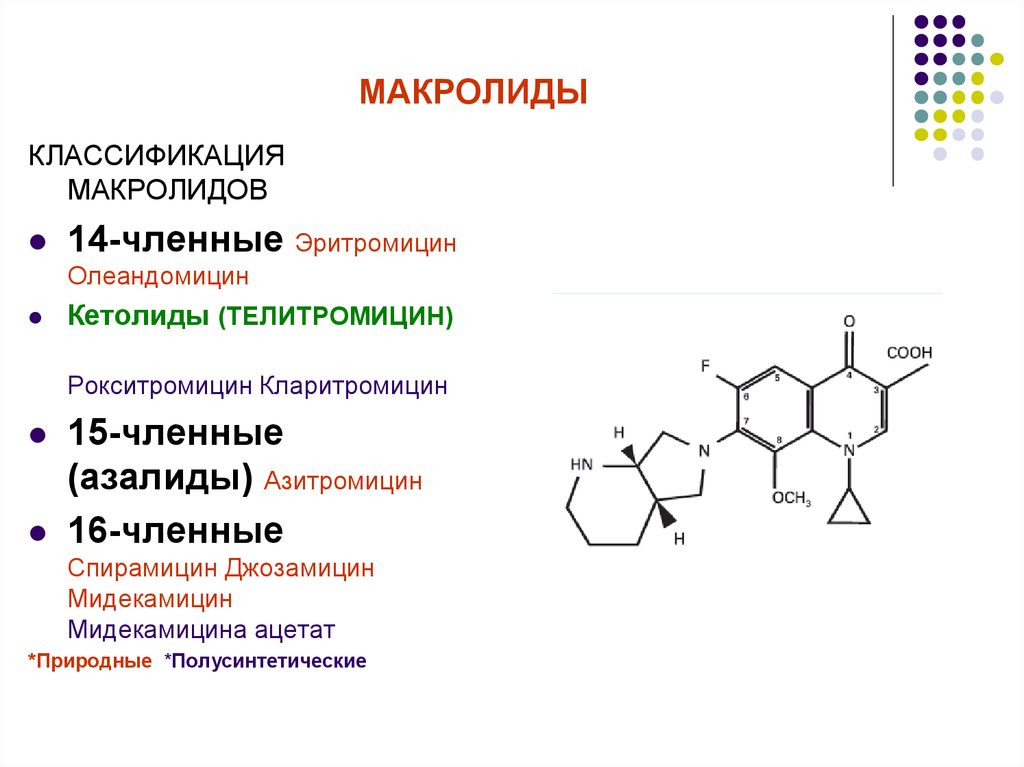 В связи с этим препараты макролиды были зачислены в ряд резервных антибиотиков. Среди представителей этой группы лекарственных средств:
В связи с этим препараты макролиды были зачислены в ряд резервных антибиотиков. Среди представителей этой группы лекарственных средств:
- Эритромицин;
- Олеандомицин;
- Илозон;
- Эридерм;
- Грюнамицин;
- Эрифлюид;
- Синэрит;
- Эритран;
- Адимицин.
Макролиды 2 поколения
Антибиотики группы макролидов, принадлежащие ко второму поколению, отличаются повышенной активностью. Эти препараты демонстрируют высокую эффективность в отношении псевдомонад, энтеробактерий, анаэробных бактерий. Средства обладают лучшей фармакокинетикой: они проявляют высокую устойчивость к кислотному гидролизу, что обуславливает высокую интенсивность их всасывания.
Кроме того, повышается и действие эффекта от применения таких антибиотиков, что ликвидирует необходимость частого их введения. Эти макролиды при пневмонии помогают быстро добиться улучшений самочувствия пациента. Среди представителей макролидов 2 поколения выделяют:
- Сумамед;
- Макропен;
- Рулид;
- Мидекамицин;
- Рокситромицин.

Макролиды 3 поколения
Необходимо отметить, что в некоторых классификациях не указывается эта группа макролидов в качестве отдельного поколения. Единственным ее представителем является азитромицин. Это антибактериальное вещество в качестве действующего компонента содержит многие макролиды, список которых следующий:
- Азитрал;
- Сумамед;
- Хемомицин;
- Азитромицин.
Макролиды – применение
Данная группа лекарственных препаратов не может использоваться без назначения врача. Применение макролидов должно быть согласовано со специалистом. Только учитывая тип заболевания, клиническую картину и вид возбудителя, можно добиться терапевтического эффекта. Макролиды быстро проникают внутрь клетки, формируя высокие внутриклеточные концентрации. Они способны проникать и через плаценту, попадать в грудное молоко, поэтому в период беременности и лактации макролиды назначают только по жизненным показаниям.
Что касается особенностей приема лекарств представителей макролидов, то здесь необходимо выделить следующее аспекты:
- Макролиды принимают за 1 час до приема пищи или спустя 2 часа после еды (Джозамицин, Кларитромицин можно применять независимо от приема пищи).

- Принимая Эритромицин, необходимо запивать его большим количеством жидкости.
- Строго соблюдать дозировку и кратность приема. В случае пропуска очередного приема препарат необходимо выпить как можно скорее. Удваивать дозу при этом нельзя.
Макролиды – побочные эффекты
Когда пациент правильно, в соответствии с назначениями и соблюдая дозировку, принимает макролиды, побочные эффекты в таких случаях встречаются редко. Согласно наблюдениям медиков, данная группа лекарственных средств не обладает нефро- и гепатотоксичностью, не вызывает хондропатию. Не отмечается и выраженного токсического влияния на центральную нервную систему (фиксируется в редких случаях), которое свойственно другим антибактериальным препаратам.
Однако высокая безопасность макролидов не означает, что побочные реакции от их приема отсутствуют. Среди возможных выделяют:
- Со стороны органов пищеварения: боли, дискомфорт в животе, диарея, возможна рвота.
- Нарушение работы сердечно-сосудистой системы: удлинение на кардиограмме интервала QT.

- Местные реакции: флебит (при внутривенном введении).
- Аллергические реакции: крапивница, сыпь (фиксируются в единичных случаях).
Макролиды — StatPearls — NCBI Bookshelf
Программа непрерывного образования
Макролиды — это класс препаратов, используемых для лечения различных бактериальных инфекций. Азитромицин, кларитромицин и эритромицин обычно используются для лечения инфекций, таких как пневмония, синусит, фарингит и тонзиллит. Они также используются при неосложненных кожных инфекциях и среднем отите у детей. Кларитромицин используется для лечения инфекций, вызванных Helicobacter pylori, в рамках стандартного протокола тройной терапии независимо от статуса резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. В этом задании рассматривается механизм действия, показания, противопоказания и другие ключевые факторы (например, использование вне зарегистрированных показаний, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), связанные с макролидами.
В этом задании рассматривается механизм действия, показания, противопоказания и другие ключевые факторы (например, использование вне зарегистрированных показаний, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), связанные с макролидами.
Цели:
Определите механизм действия антибиотиков класса макролидов.
Опишите потенциальные побочные эффекты антибиотиков класса макролидов.
Рассмотрите надлежащий мониторинг, необходимый для пациентов, принимающих препараты класса макролидов.
Опишите стратегии межпрофессиональной бригады по улучшению надлежащего назначения и лечения макролидными антибиотиками.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Макролиды представляют собой встречающиеся в природе соединения, состоящие из лактонового кольца с присоединенными дезоксисахарами.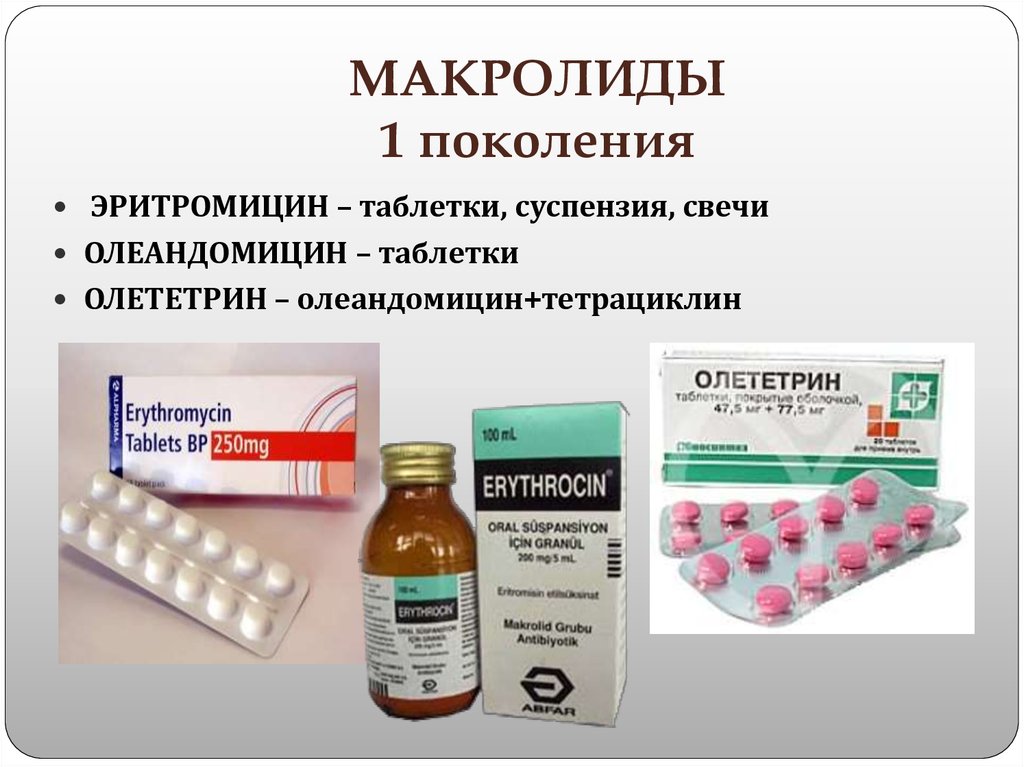 Некоторые макролиды обладают антибиотическими или противогрибковыми свойствами и используются в фармацевтической противомикробной терапии. Первым макролидом, использованным таким образом, был эритромицин в 1952 году; его часто использовали при инфекциях у пациентов с аллергией на пенициллин или у пациентов с резистентными к пенициллину инфекциями.
Некоторые макролиды обладают антибиотическими или противогрибковыми свойствами и используются в фармацевтической противомикробной терапии. Первым макролидом, использованным таким образом, был эритромицин в 1952 году; его часто использовали при инфекциях у пациентов с аллергией на пенициллин или у пациентов с резистентными к пенициллину инфекциями.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило использование макролидных антибиотиков для лечения широкого спектра бактериальных инфекций. В частности, азитромицин, кларитромицин и эритромицин обычно используются для лечения таких инфекций, как пневмония, синусит, фарингит и тонзиллит. Кроме того, FDA одобрило его использование при неосложненных кожных инфекциях и среднем отите у детей. Кроме того, кларитромицин используется для лечения инфекций, вызванных Helicobacter pylori , в рамках стандартного протокола тройной терапии, независимо от резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. Большая часть использования макролидов, как и других антибиотиков, продиктована статусом чувствительности и резистентности целевого организма. Макролиды также были одними из основных препаратов, используемых для лечения атипичной пневмонии, обычно вызываемой такими микроорганизмами, как 9.0035 Mycoplasma pneumoniae , Legionella и Chlamydia pneumoniae . [5]
Большая часть использования макролидов, как и других антибиотиков, продиктована статусом чувствительности и резистентности целевого организма. Макролиды также были одними из основных препаратов, используемых для лечения атипичной пневмонии, обычно вызываемой такими микроорганизмами, как 9.0035 Mycoplasma pneumoniae , Legionella и Chlamydia pneumoniae . [5]
В недавних исследованиях было показано, что поддерживающая терапия макролидами улучшает качество жизни и результаты спирометрии у взрослых и детей с немуковисцидозными бронхоэктазами. Кроме того, было показано, что эти агенты уменьшают количество обострений бронхоэктатической болезни. Однако эти исследования не выявили снижения числа госпитализаций по поводу обострений.[6]
Макролиды остаются неотъемлемой частью схем лечения обострений ХОБЛ. Использование этих препаратов при ХОБЛ обусловлено их противовоспалительными и иммуномодулирующими свойствами.[7]
Механизм действия
Макролы ингибируют синтез бактериального белка. Механизм действия макролидов основан на их способности связывать 50S субъединицу бактериальной рибосомы, вызывая прекращение синтеза бактериального белка. После связывания препарат предотвращает трансляцию мРНК, особенно растущей пептидной цепи, не позволяя ферменту пептидилтрансферазе добавлять последующую аминокислоту, присоединенную к тРНК. Поскольку бактериальная рибосомная структура в высокой степени консервативна у большинства, если не у всех, видов бактерий, она считается широкоспектральной.[8] Макролиды являются бактериостатическими агентами, поскольку они ингибируют только синтез белка, хотя в высоких дозах они могут оказывать бактерицидное действие.
Механизм действия макролидов основан на их способности связывать 50S субъединицу бактериальной рибосомы, вызывая прекращение синтеза бактериального белка. После связывания препарат предотвращает трансляцию мРНК, особенно растущей пептидной цепи, не позволяя ферменту пептидилтрансферазе добавлять последующую аминокислоту, присоединенную к тРНК. Поскольку бактериальная рибосомная структура в высокой степени консервативна у большинства, если не у всех, видов бактерий, она считается широкоспектральной.[8] Макролиды являются бактериостатическими агентами, поскольку они ингибируют только синтез белка, хотя в высоких дозах они могут оказывать бактерицидное действие.
Противовоспалительное и иммуномодулирующее действие макролидов, особенно азитромицина, связано с взаимодействием с фосфолипидами, а также факторами транскрипции AP-1, NF-kappaB и другими воспалительными цитокинами. Более поздние изменения, наблюдаемые в макрофагах, которые взаимодействуют с макролидами, включают ингибирование клеточной функции, клеточного транспорта и регуляцию экспрессии поверхностных рецепторов.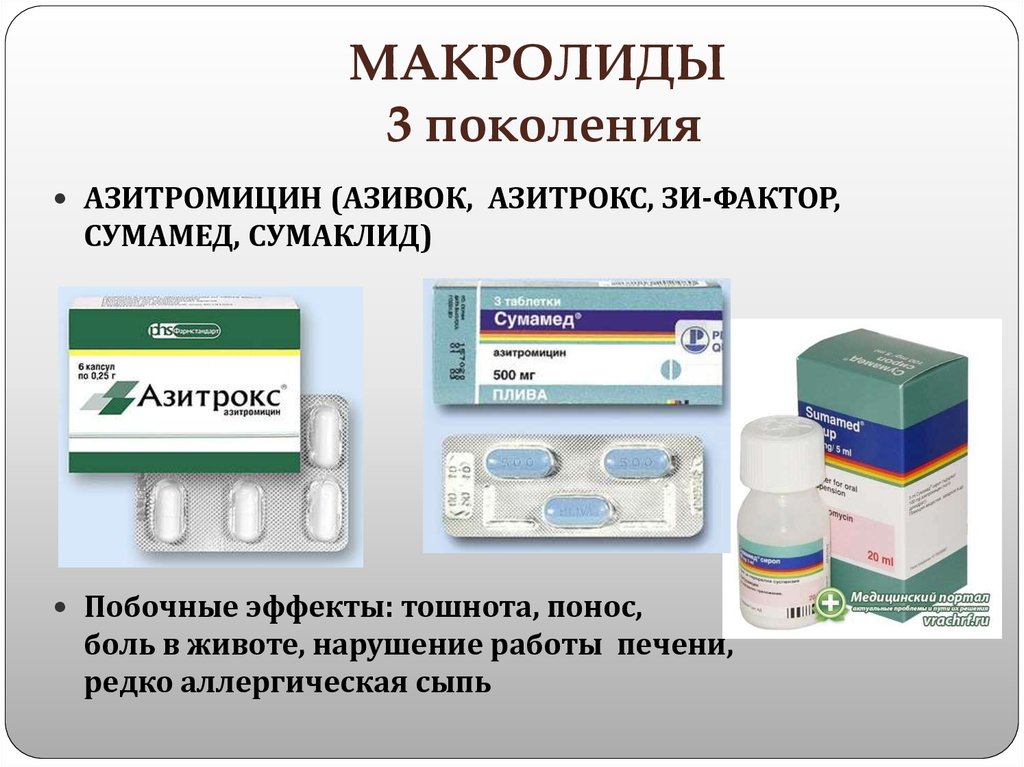 Все это завершается иммуномодулирующим действием макролидов на организм.[2]
Все это завершается иммуномодулирующим действием макролидов на организм.[2]
Из-за чрезмерного назначения антибиотиков резко возросла резистентность ко многим основным методам лечения. Макролиды не являются исключением в этой ситуации, и многие организмы обладают чрезмерной устойчивостью к ним. Основной причиной устойчивости бактерий к макролидам является посттранскрипционное метилирование бактериальной 23S рибосомной РНК. Эта приобретенная устойчивость может возникать по двум механизмам: она может быть опосредованной плазмидами, хромосомной.[9] Исследования показывают прочную связь с генетическими мутациями у бактерий и способность распространять эти гены через мобильные элементы. Рассматриваемый ген позволяет бактериям быть устойчивыми одновременно к макролидам, линкозамидам и стрептограминовым группам антибиотиков.[10]
Администрация
Состав препарата требует обсуждения с лечащим врачом. Факторами, которые необходимо учитывать, являются сила, дозировка, путь, клинические цели лечения и т.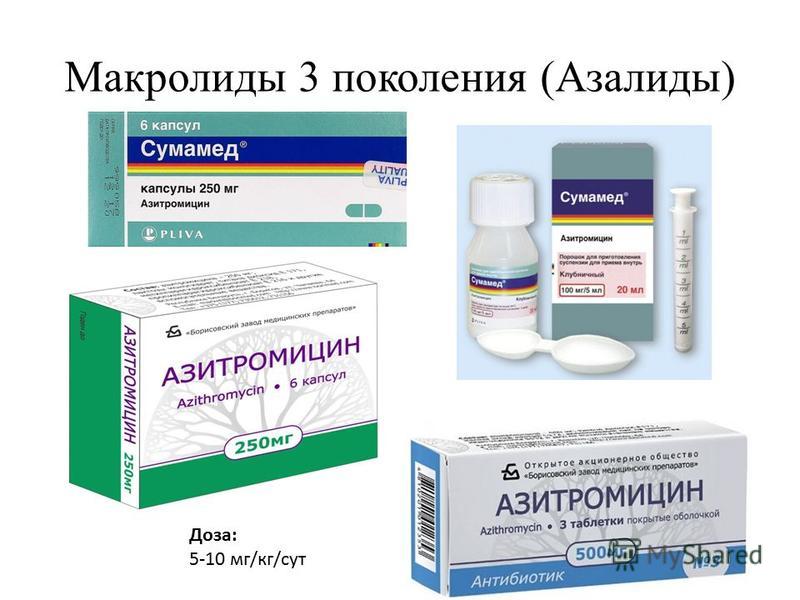 д. Макролиды выпускаются в различных формах для введения, в зависимости от желаемого лекарства и причины их использования. Чаще всего используются пероральные составы в форме таблеток, но они также бывают в виде кремов для местного применения, внутривенных составов, а также офтальмологических препаратов.[4]
д. Макролиды выпускаются в различных формах для введения, в зависимости от желаемого лекарства и причины их использования. Чаще всего используются пероральные составы в форме таблеток, но они также бывают в виде кремов для местного применения, внутривенных составов, а также офтальмологических препаратов.[4]
Следующий список включает наиболее распространенные макролиды и их наиболее распространенные составы; однако существуют другие составы и дозировки:
Эритромицин
Таблетки для приема внутрь: 250 мг / 500 мг
Офтальмологическая мазь: 0,5%
Гель или раствор для местного применения: 2%
900 0028 КларитромицинТаблетки для приема внутрь: 125 мг / 250 мг / 500 мг (пролонгированного действия) – таблетки для приема внутрь
Порошок для разведения: 125 мг/5 мл (суспензия для приема внутрь)
Азитромицин
Таблетки для приема внутрь: 100 мг/250 мг/500 мг/600 мг – таблетки для приема внутрь
Порошок для инъекций: 500 мг
Порошок для разведения: 1000 мг/0,5 мл/5 мл/5 мл Пакет с дозой г (суспензия для приема внутрь)
Фидаксомицин
Побочные эффекты
Как и любой другой антибиотик, макролиды несут определенный уровень риска из-за типичных побочных эффектов, таких как тошнота, рвота, боль в животе и диарея.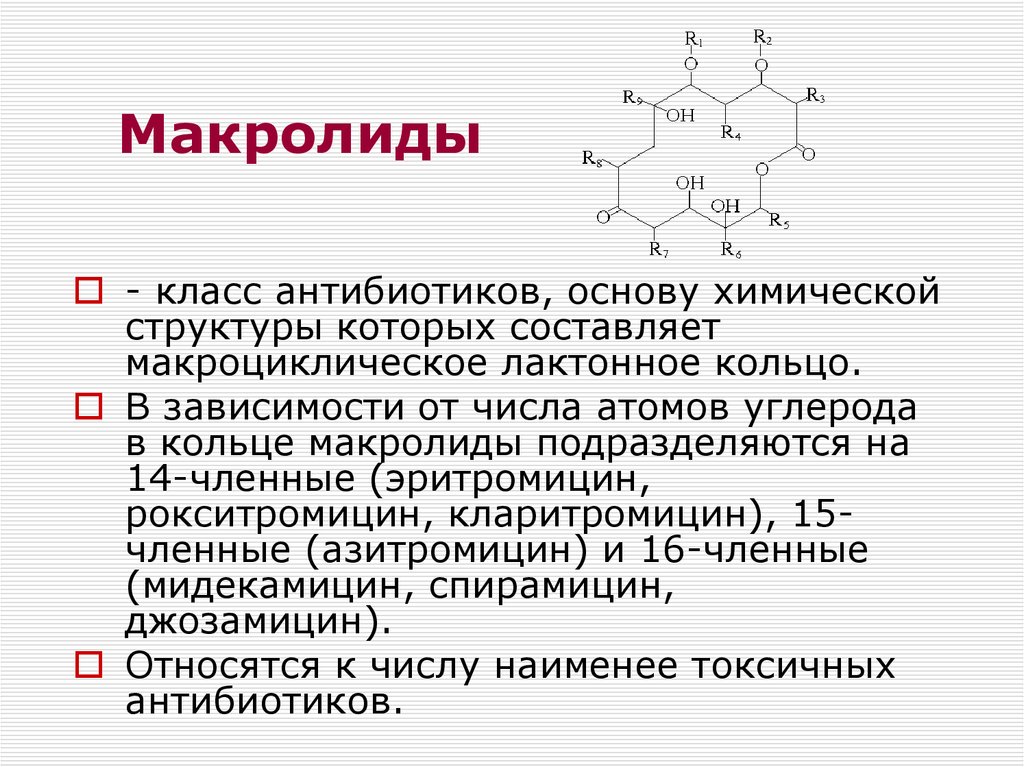 Абдоминальные симптомы в значительной степени являются результатом того, что макролиды являются агонистами мотилина, вызывая повышенный риск желудочно-кишечных расстройств и побочных эффектов.[11] Кроме того, кишечная флора чувствительна к действию макролидов; следовательно, это может вызвать дисбаланс между комменсальными бактериями, обитающими в кишечнике человека, и патогенными бактериями, которые необходимо контролировать.
Абдоминальные симптомы в значительной степени являются результатом того, что макролиды являются агонистами мотилина, вызывая повышенный риск желудочно-кишечных расстройств и побочных эффектов.[11] Кроме того, кишечная флора чувствительна к действию макролидов; следовательно, это может вызвать дисбаланс между комменсальными бактериями, обитающими в кишечнике человека, и патогенными бактериями, которые необходимо контролировать.
Другим распространенным побочным эффектом применения макролидов является их склонность к удлинению интервалов QT и QTc в сердечном цикле. Эритромицин имеет самую высокую тенденцию, а азитромицин — самую низкую. Увеличение интервалов подвергает пациентов риску сердечных аритмий, таких как пируэтная тахикардия, желудочковая тахикардия и фибрилляция желудочков. Наиболее распространенной аритмией, возникающей при использовании макролидов, будет пируэтная желудочковая тахикардия [12].
Недавние исследования макролидов также показали, что использование этих препаратов коррелирует с нейросенсорной тугоухостью. В то время как большинство случаев были обратимы при прекращении приема препарата, несколько случаев приводили к необратимой сенсоневральной тугоухости. Исследования показали, что потеря слуха может произойти как при стандартных, так и при повышенных дозах.[13]
В то время как большинство случаев были обратимы при прекращении приема препарата, несколько случаев приводили к необратимой сенсоневральной тугоухости. Исследования показали, что потеря слуха может произойти как при стандартных, так и при повышенных дозах.[13]
Серьезные побочные эффекты, такие как синдром Стивенса-Джонсона и токсический эпидермальный некролиз, хотя и редки, но возможны, и их следует учитывать при назначении этих препаратов.[14]
Эритромицин также коррелирует с гепатотоксичностью у беременных женщин. Более того, эти препараты увеличивают вероятность стеноза привратника у новорожденных.[4]
Противопоказания
В целом, макролиды представляют собой безопасную группу антибиотиков для приема, но существуют относительные противопоказания из-за профиля побочных эффектов и их способности взаимодействовать с другими препаратами. Пациентам с удлиненным интервалом QT на электрокардиограмме следует избегать макролидов из-за их аритмогенных свойств. Кроме того, пациентам с врожденными заболеваниями, такими как синдром удлиненного интервала QT 2 типа, также следует избегать этих препаратов. Пациентам, принимающим антиаритмические препараты классов Ia и III, также следует избегать макролидов, поскольку оба этих класса препаратов вызывают увеличение интервала QT и индуцируют аритмии [15].
Кроме того, пациентам с врожденными заболеваниями, такими как синдром удлиненного интервала QT 2 типа, также следует избегать этих препаратов. Пациентам, принимающим антиаритмические препараты классов Ia и III, также следует избегать макролидов, поскольку оба этих класса препаратов вызывают увеличение интервала QT и индуцируют аритмии [15].
Макролиды могут проявлять неблагоприятные взаимодействия с некоторыми широко используемыми препаратами. Взаимодействие карбамазепина, циклоспорина, терфенадина, астемизола и теофиллина наиболее часто встречается при применении макролидных антибиотиков. Как ингибитор CYP3A4 эритромицин более склонен к межлекарственным взаимодействиям, опосредованным CYP3A4; кларитромицин гораздо менее склонен к такому взаимодействию, а азитромицин не участвует в этих взаимодействиях.[16]
Беременным женщинам также следует стараться избегать использования макролидов, особенно эритромицина, из-за возможных побочных эффектов, воздействующих на мать или новорожденного. [17]
[17]
Из-за растущей устойчивости к антибиотикам макролиды следует назначать с осторожностью, и врач, назначающий препарат, должен учитывать статус местной резистентности распространенных патогенов.
Мониторинг
При назначении макролидов врач должен учитывать различные побочные эффекты со стороны желудочно-кишечного тракта и кардиальные эффекты, с которыми пациент может столкнуться при применении макролидов. У большинства пациентов побочные эффекты со стороны желудочно-кишечного тракта будут наиболее распространенными, и команда должна быть готова принять надлежащие меры для противодействия этим эффектам. Из-за риска удлинения интервала QT следует проводить тщательное наблюдение за пациентами с сердечными заболеваниями, а также за теми, кто принимает антиаритмические средства или препараты, о которых известно, что они вызывают взаимодействие. Врачи, назначающие препараты, также должны знать о возможных дерматологических побочных эффектах и, таким образом, консультировать пациентов по поводу побочных эффектов. Что касается возможных побочных эффектов у беременных женщин и новорожденных, пациенты нуждаются в консультации о побочных эффектах этих препаратов во время беременности, включая вероятное неблагоприятное воздействие на новорожденного при назначении этих препаратов.
Что касается возможных побочных эффектов у беременных женщин и новорожденных, пациенты нуждаются в консультации о побочных эффектах этих препаратов во время беременности, включая вероятное неблагоприятное воздействие на новорожденного при назначении этих препаратов.
Токсичность
Из-за серьезности побочных эффектов со стороны сердца у пациентов с высоким риском следует проводить мониторинг интервала QT на ЭКГ, чтобы избежать индукции смертельных аритмий, таких как Torsades de Pointes. У пациентов с высоким риском перед введением лекарств необходимо проверить электролиты, особенно кальций, калий и магний. [4] Прекращение приема препарата необходимо, если у пациента возникают серьезные побочные эффекты. Если возможно, у этих пациентов с высоким риском вместо макролидов следует использовать другой антибиотик, чтобы избежать вероятности индукции аритмий.
Улучшение результатов медицинского персонала
Несмотря на то, что макролиды относятся к очень безопасному классу антибиотиков, для сведения к минимуму нежелательных явлений необходимо обеспечить надлежащее медицинское обслуживание всей многопрофильной командой.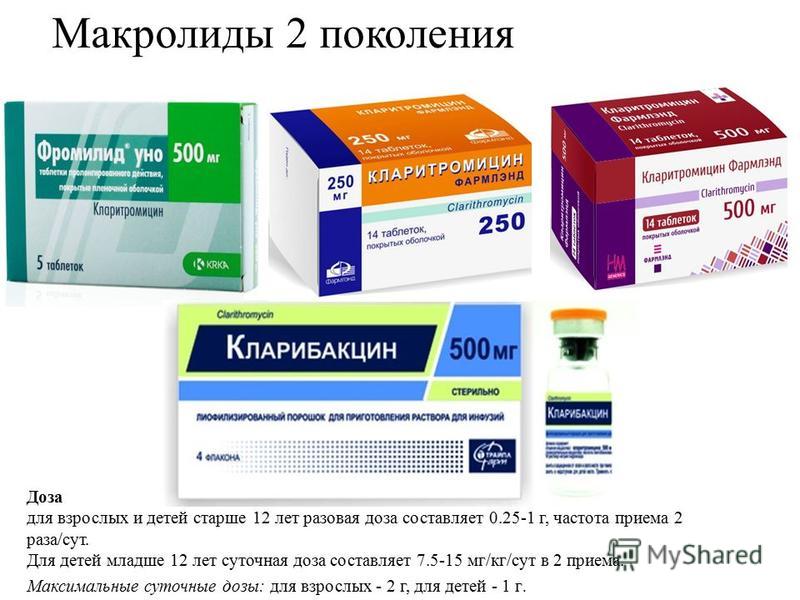 Все члены межпрофессиональной медицинской бригады должны следить за пациентами на предмет общих побочных эффектов, а также необычных. Все участники должны быть осведомлены о распространенных побочных эффектах со стороны желудочно-кишечного тракта и серьезных сердечных последствиях этого препарата. Каждый член медицинской бригады разделяет ответственность за оказание первоклассной помощи своим пациентам и всегда должен следить за возможными побочными эффектами.
Все члены межпрофессиональной медицинской бригады должны следить за пациентами на предмет общих побочных эффектов, а также необычных. Все участники должны быть осведомлены о распространенных побочных эффектах со стороны желудочно-кишечного тракта и серьезных сердечных последствиях этого препарата. Каждый член медицинской бригады разделяет ответственность за оказание первоклассной помощи своим пациентам и всегда должен следить за возможными побочными эффектами.
Принимая решение о начале терапии макролидами, клиницист (MD, DO, NP или PA) должен включить консультацию фармацевта, которая будет состоять из проверки целесообразности выбранного агента, проверки правильной дозировки и проверки наличия лекарственные взаимодействия. Фармацевты также могут помочь пациенту, отвечая на его вопросы, предупреждая о признаках нежелательных явлений, подкрепляя указания врача и сообщая врачу о любых проблемах, которые могут у них возникнуть. Сестринское дело может контролировать и отвечать на вопросы пациентов об их терапии и сообщать лечащему врачу о ходе лечения или его отсутствии или наличии побочных эффектов. Все члены межпрофессиональной команды должны знать наиболее распространенные способы применения антибиотиков класса макролидов и прилагать совместные усилия для обеспечения оптимальных результатов лечения пациентов. [Уровень 5]
Все члены межпрофессиональной команды должны знать наиболее распространенные способы применения антибиотиков класса макролидов и прилагать совместные усилия для обеспечения оптимальных результатов лечения пациентов. [Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Клейн Д.О. История применения макролидов в педиатрии. Pediatr Infect Dis J. 1997 Apr;16(4):427-31. [PubMed: 9109154]
- 2.
Parnham MJ, Erakovic Haber V, Giamarellos-Bourboulis EJ, Perletti G, Verleden GM, Vos R. Азитромицин: механизмы действия и их значение для клинического применения. Фармакол Тер. 2014 г., август; 143(2):225–45. [В паблике: 24631273]
- 3.
Yeo YH, Shiu SI, Ho HJ, Zou B, Lin JT, Wu MS, Liou JM, Wu CY., Тайваньское желудочно-кишечное заболевание и Helicobacter Consortium.
 Эрадикационная терапия первой линии Helicobacter pylori в странах с высокой и низкой устойчивостью к кларитромицину: систематический обзор и сетевой метаанализ. Кишка. 2018 Янв;67(1):20-27. [PubMed: 27670375]
Эрадикационная терапия первой линии Helicobacter pylori в странах с высокой и низкой устойчивостью к кларитромицину: систематический обзор и сетевой метаанализ. Кишка. 2018 Янв;67(1):20-27. [PubMed: 27670375]- 4.
Farzam K, Nessel TA, Quick J. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 16 июня 2022 г. Эритромицин. [В паблике: 30335282]
- 5.
Кунья Б.А. Атипичные пневмонии: клиника, диагностика и значение. Клин Микробиол Инфект. 2006 Май; 12 Дополнение 3:12-24. [Бесплатная статья PMC: PMC7128183] [PubMed: 16669925]
- 6.
Гао Ю.Х., Гуань В.Дж., Сюй Г., Тан И., Гао И., Линь З.И., Линь З.М., Чжун Н.С., Чен Р.С. Терапия макролидами у взрослых и детей с немуковисцидозными бронхоэктазами: систематический обзор и метаанализ. ПЛОС Один. 2014;9(3):e
. [Бесплатная статья PMC: PMC3946068] [PubMed: 24603554]- 7.
Qiu S, Zhong X. Macrolides: перспективная фармакологическая терапия хронической обструктивной болезни легких.
 Тер Ад Респир Дис. 2017 март; 11(3):147-155. [Бесплатная статья PMC: PMC5933650] [PubMed: 28030992]
Тер Ад Респир Дис. 2017 март; 11(3):147-155. [Бесплатная статья PMC: PMC5933650] [PubMed: 28030992]- 8.
Васкес-Ласлоп Н., Манкин А.С. Как работают макролидные антибиотики. Тенденции биохимических наук. 2018 сен; 43 (9): 668-684. [Бесплатная статья PMC: PMC6108949] [PubMed: 30054232]
- 9.
Мунита Дж. М., Ариас, Калифорния. Механизмы антибиотикорезистентности. Микробиологический спектр. 2016 Apr;4(2) [PMC free article: PMC4888801] [PubMed: 27227291]
- 10.
Marosevic D, Kaevska M, Jaglic Z. Резистентность к антибиотикам группы тетрациклинов и макролид-линкозамид-стрептограмина и его генетическая связь — обзор. Энн Агрик Энвайрон Мед. 2017 12 июня; 24 (2): 338-344. [PubMed: 28664720]
- 11.
Картер Б.Л., Вудхед Дж.С., Коул К.Дж., Милавец Г. Побочные эффекты со стороны желудочно-кишечного тракта при приеме препаратов эритромицина. Препарат Интелл Клин Фарм. 1987 Сен; 21 (9): 734-8.
 [PubMed: 3498618]
[PubMed: 3498618]- 12.
Альберт Р.К., Шуллер Дж.Л., Сеть клинических исследований ХОБЛ. Антибиотики-макролиды и риск сердечных аритмий. Am J Respir Crit Care Med. 2014 15 мая; 189(10):1173-80. [Бесплатная статья PMC: PMC4061901] [PubMed: 24707986]
- 13.
Икеда А.К., Принц А.А., Чен Д.С., Лью Д.Е.К., Шин Д.Дж. Нейросенсорная тугоухость, связанная с макролидами: систематический обзор. Ларингоскоп. 2018 Январь; 128 (1): 228-236. [В паблике: 28771738]
- 14.
Уильямс Д.А. Синдром Стивенса-Джонсона после терапии эритромицином в море. Мил Мед. 2000 г., август; 165 (8): 636-7. [PubMed: 10957862]
- 15.
Berger FA, van Weteringen W, van der Sijs H, Hunfeld NGM, Bunge JJH, de Groot NMS, van den Bemt PMLA, van Gelder T. Динамика интервала QTc в течение 24-часовой интервал между дозами после начала внутривенного введения ципрофлоксацина или низких доз эритромицина у пациентов в ОИТ. Фармакол Рез Перспект.
 2021 дек;9(6):e00865. [Бесплатная статья PMC: PMC8546217] [PubMed: 34697899]
2021 дек;9(6):e00865. [Бесплатная статья PMC: PMC8546217] [PubMed: 34697899]- 16.
фон Розенштайл Н.А., Адам Д. Антибактериальные макролиды. Лекарственные взаимодействия клинического значения. Препарат Саф. 1995 авг.; 13(2):105-22. [PubMed: 7576262]
- 17.
Андерссон Н.В., Олсен Р.Х., Андерсен Дж.Т. Связь между использованием макролидов во время беременности и риском серьезных врожденных дефектов: общенациональное когортное исследование на основе регистров. БМЖ. 2021 10 февраля; 372: n107. [Бесплатная статья PMC: PMC7873722] [PubMed: 33568349]
Макролиды — StatPearls — NCBI Bookshelf
Программа непрерывного образования
Макролиды — это класс препаратов, используемых для лечения различных бактериальных инфекций. Азитромицин, кларитромицин и эритромицин обычно используются для лечения инфекций, таких как пневмония, синусит, фарингит и тонзиллит. Они также используются при неосложненных кожных инфекциях и среднем отите у детей.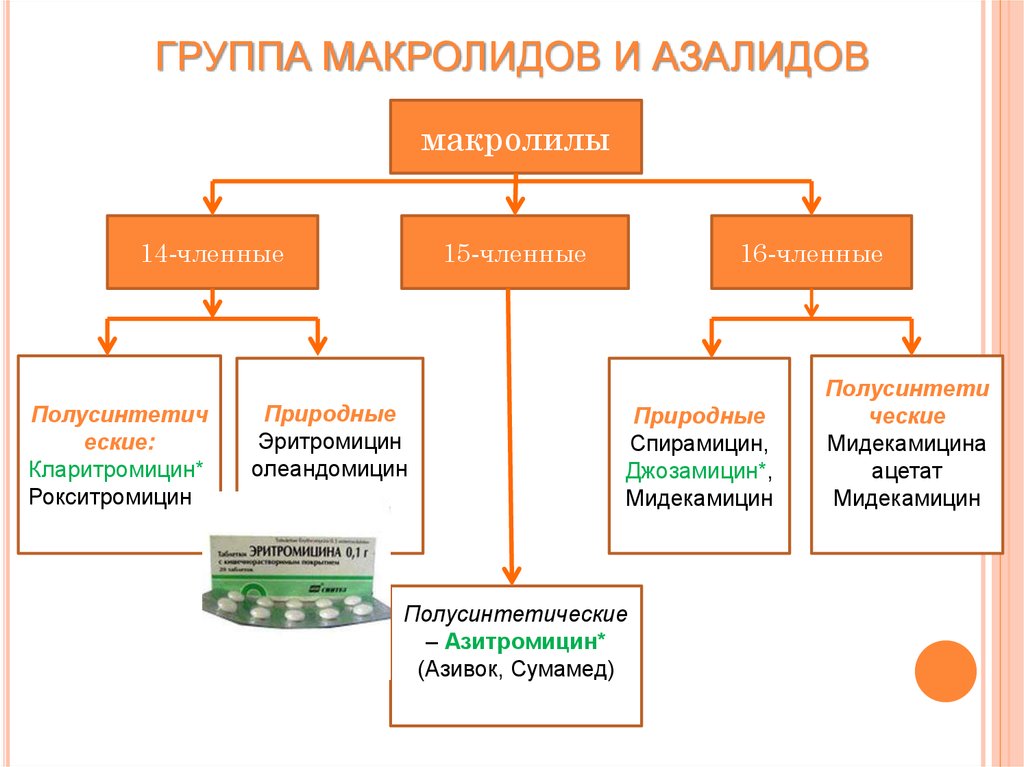 Кларитромицин используется для лечения инфекций, вызванных Helicobacter pylori, в рамках стандартного протокола тройной терапии независимо от статуса резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. В этом задании рассматривается механизм действия, показания, противопоказания и другие ключевые факторы (например, использование вне зарегистрированных показаний, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), связанные с макролидами.
Кларитромицин используется для лечения инфекций, вызванных Helicobacter pylori, в рамках стандартного протокола тройной терапии независимо от статуса резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. В этом задании рассматривается механизм действия, показания, противопоказания и другие ключевые факторы (например, использование вне зарегистрированных показаний, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), связанные с макролидами.
Цели:
Определите механизм действия антибиотиков класса макролидов.
Опишите потенциальные побочные эффекты антибиотиков класса макролидов.
Рассмотрите надлежащий мониторинг, необходимый для пациентов, принимающих препараты класса макролидов.
Опишите стратегии межпрофессиональной бригады по улучшению надлежащего назначения и лечения макролидными антибиотиками.

Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Макролиды представляют собой встречающиеся в природе соединения, состоящие из лактонового кольца с присоединенными дезоксисахарами. Некоторые макролиды обладают антибиотическими или противогрибковыми свойствами и используются в фармацевтической противомикробной терапии. Первым макролидом, использованным таким образом, был эритромицин в 1952 году; его часто использовали при инфекциях у пациентов с аллергией на пенициллин или у пациентов с резистентными к пенициллину инфекциями.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило использование макролидных антибиотиков для лечения широкого спектра бактериальных инфекций. В частности, азитромицин, кларитромицин и эритромицин обычно используются для лечения таких инфекций, как пневмония, синусит, фарингит и тонзиллит. Кроме того, FDA одобрило его использование при неосложненных кожных инфекциях и среднем отите у детей. Кроме того, кларитромицин используется для лечения инфекций, вызванных Helicobacter pylori , в рамках стандартного протокола тройной терапии, независимо от резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. Большая часть использования макролидов, как и других антибиотиков, продиктована статусом чувствительности и резистентности целевого организма. Макролиды также были одними из основных препаратов, используемых для лечения атипичной пневмонии, обычно вызываемой такими микроорганизмами, как 9.0035 Mycoplasma pneumoniae , Legionella и Chlamydia pneumoniae . [5]
Кроме того, кларитромицин используется для лечения инфекций, вызванных Helicobacter pylori , в рамках стандартного протокола тройной терапии, независимо от резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. Большая часть использования макролидов, как и других антибиотиков, продиктована статусом чувствительности и резистентности целевого организма. Макролиды также были одними из основных препаратов, используемых для лечения атипичной пневмонии, обычно вызываемой такими микроорганизмами, как 9.0035 Mycoplasma pneumoniae , Legionella и Chlamydia pneumoniae . [5]
В недавних исследованиях было показано, что поддерживающая терапия макролидами улучшает качество жизни и результаты спирометрии у взрослых и детей с немуковисцидозными бронхоэктазами. Кроме того, было показано, что эти агенты уменьшают количество обострений бронхоэктатической болезни. Однако эти исследования не выявили снижения числа госпитализаций по поводу обострений.[6]
Однако эти исследования не выявили снижения числа госпитализаций по поводу обострений.[6]
Макролиды остаются неотъемлемой частью схем лечения обострений ХОБЛ. Использование этих препаратов при ХОБЛ обусловлено их противовоспалительными и иммуномодулирующими свойствами.[7]
Механизм действия
Макролы ингибируют синтез бактериального белка. Механизм действия макролидов основан на их способности связывать 50S субъединицу бактериальной рибосомы, вызывая прекращение синтеза бактериального белка. После связывания препарат предотвращает трансляцию мРНК, особенно растущей пептидной цепи, не позволяя ферменту пептидилтрансферазе добавлять последующую аминокислоту, присоединенную к тРНК. Поскольку бактериальная рибосомная структура в высокой степени консервативна у большинства, если не у всех, видов бактерий, она считается широкоспектральной.[8] Макролиды являются бактериостатическими агентами, поскольку они ингибируют только синтез белка, хотя в высоких дозах они могут оказывать бактерицидное действие.
Противовоспалительное и иммуномодулирующее действие макролидов, особенно азитромицина, связано с взаимодействием с фосфолипидами, а также факторами транскрипции AP-1, NF-kappaB и другими воспалительными цитокинами. Более поздние изменения, наблюдаемые в макрофагах, которые взаимодействуют с макролидами, включают ингибирование клеточной функции, клеточного транспорта и регуляцию экспрессии поверхностных рецепторов. Все это завершается иммуномодулирующим действием макролидов на организм.[2]
Из-за чрезмерного назначения антибиотиков резко возросла резистентность ко многим основным методам лечения. Макролиды не являются исключением в этой ситуации, и многие организмы обладают чрезмерной устойчивостью к ним. Основной причиной устойчивости бактерий к макролидам является посттранскрипционное метилирование бактериальной 23S рибосомной РНК. Эта приобретенная устойчивость может возникать по двум механизмам: она может быть опосредованной плазмидами, хромосомной.[9] Исследования показывают прочную связь с генетическими мутациями у бактерий и способность распространять эти гены через мобильные элементы. Рассматриваемый ген позволяет бактериям быть устойчивыми одновременно к макролидам, линкозамидам и стрептограминовым группам антибиотиков.[10]
Рассматриваемый ген позволяет бактериям быть устойчивыми одновременно к макролидам, линкозамидам и стрептограминовым группам антибиотиков.[10]
Администрация
Состав препарата требует обсуждения с лечащим врачом. Факторами, которые необходимо учитывать, являются сила, дозировка, путь, клинические цели лечения и т. д. Макролиды выпускаются в различных формах для введения, в зависимости от желаемого лекарства и причины их использования. Чаще всего используются пероральные составы в форме таблеток, но они также бывают в виде кремов для местного применения, внутривенных составов, а также офтальмологических препаратов.[4]
Следующий список включает наиболее распространенные макролиды и их наиболее распространенные составы; однако существуют другие составы и дозировки:
Эритромицин
Таблетки для приема внутрь: 250 мг / 500 мг
Офтальмологическая мазь: 0,5%
Гель или раствор для местного применения: 2%
900 0028 КларитромицинТаблетки для приема внутрь: 125 мг / 250 мг / 500 мг (пролонгированного действия) – таблетки для приема внутрь
Порошок для разведения: 125 мг/5 мл (суспензия для приема внутрь)
Азитромицин
Таблетки для приема внутрь: 100 мг/250 мг/500 мг/600 мг – таблетки для приема внутрь
Порошок для инъекций: 500 мг
Порошок для разведения: 1000 мг/0,5 мл/5 мл/5 мл Пакет с дозой г (суспензия для приема внутрь)
Фидаксомицин
Побочные эффекты
Как и любой другой антибиотик, макролиды несут определенный уровень риска из-за типичных побочных эффектов, таких как тошнота, рвота, боль в животе и диарея. Абдоминальные симптомы в значительной степени являются результатом того, что макролиды являются агонистами мотилина, вызывая повышенный риск желудочно-кишечных расстройств и побочных эффектов.[11] Кроме того, кишечная флора чувствительна к действию макролидов; следовательно, это может вызвать дисбаланс между комменсальными бактериями, обитающими в кишечнике человека, и патогенными бактериями, которые необходимо контролировать.
Абдоминальные симптомы в значительной степени являются результатом того, что макролиды являются агонистами мотилина, вызывая повышенный риск желудочно-кишечных расстройств и побочных эффектов.[11] Кроме того, кишечная флора чувствительна к действию макролидов; следовательно, это может вызвать дисбаланс между комменсальными бактериями, обитающими в кишечнике человека, и патогенными бактериями, которые необходимо контролировать.
Другим распространенным побочным эффектом применения макролидов является их склонность к удлинению интервалов QT и QTc в сердечном цикле. Эритромицин имеет самую высокую тенденцию, а азитромицин — самую низкую. Увеличение интервалов подвергает пациентов риску сердечных аритмий, таких как пируэтная тахикардия, желудочковая тахикардия и фибрилляция желудочков. Наиболее распространенной аритмией, возникающей при использовании макролидов, будет пируэтная желудочковая тахикардия [12].
Недавние исследования макролидов также показали, что использование этих препаратов коррелирует с нейросенсорной тугоухостью. В то время как большинство случаев были обратимы при прекращении приема препарата, несколько случаев приводили к необратимой сенсоневральной тугоухости. Исследования показали, что потеря слуха может произойти как при стандартных, так и при повышенных дозах.[13]
В то время как большинство случаев были обратимы при прекращении приема препарата, несколько случаев приводили к необратимой сенсоневральной тугоухости. Исследования показали, что потеря слуха может произойти как при стандартных, так и при повышенных дозах.[13]
Серьезные побочные эффекты, такие как синдром Стивенса-Джонсона и токсический эпидермальный некролиз, хотя и редки, но возможны, и их следует учитывать при назначении этих препаратов.[14]
Эритромицин также коррелирует с гепатотоксичностью у беременных женщин. Более того, эти препараты увеличивают вероятность стеноза привратника у новорожденных.[4]
Противопоказания
В целом, макролиды представляют собой безопасную группу антибиотиков для приема, но существуют относительные противопоказания из-за профиля побочных эффектов и их способности взаимодействовать с другими препаратами. Пациентам с удлиненным интервалом QT на электрокардиограмме следует избегать макролидов из-за их аритмогенных свойств. Кроме того, пациентам с врожденными заболеваниями, такими как синдром удлиненного интервала QT 2 типа, также следует избегать этих препаратов. Пациентам, принимающим антиаритмические препараты классов Ia и III, также следует избегать макролидов, поскольку оба этих класса препаратов вызывают увеличение интервала QT и индуцируют аритмии [15].
Кроме того, пациентам с врожденными заболеваниями, такими как синдром удлиненного интервала QT 2 типа, также следует избегать этих препаратов. Пациентам, принимающим антиаритмические препараты классов Ia и III, также следует избегать макролидов, поскольку оба этих класса препаратов вызывают увеличение интервала QT и индуцируют аритмии [15].
Макролиды могут проявлять неблагоприятные взаимодействия с некоторыми широко используемыми препаратами. Взаимодействие карбамазепина, циклоспорина, терфенадина, астемизола и теофиллина наиболее часто встречается при применении макролидных антибиотиков. Как ингибитор CYP3A4 эритромицин более склонен к межлекарственным взаимодействиям, опосредованным CYP3A4; кларитромицин гораздо менее склонен к такому взаимодействию, а азитромицин не участвует в этих взаимодействиях.[16]
Беременным женщинам также следует стараться избегать использования макролидов, особенно эритромицина, из-за возможных побочных эффектов, воздействующих на мать или новорожденного. [17]
[17]
Из-за растущей устойчивости к антибиотикам макролиды следует назначать с осторожностью, и врач, назначающий препарат, должен учитывать статус местной резистентности распространенных патогенов.
Мониторинг
При назначении макролидов врач должен учитывать различные побочные эффекты со стороны желудочно-кишечного тракта и кардиальные эффекты, с которыми пациент может столкнуться при применении макролидов. У большинства пациентов побочные эффекты со стороны желудочно-кишечного тракта будут наиболее распространенными, и команда должна быть готова принять надлежащие меры для противодействия этим эффектам. Из-за риска удлинения интервала QT следует проводить тщательное наблюдение за пациентами с сердечными заболеваниями, а также за теми, кто принимает антиаритмические средства или препараты, о которых известно, что они вызывают взаимодействие. Врачи, назначающие препараты, также должны знать о возможных дерматологических побочных эффектах и, таким образом, консультировать пациентов по поводу побочных эффектов. Что касается возможных побочных эффектов у беременных женщин и новорожденных, пациенты нуждаются в консультации о побочных эффектах этих препаратов во время беременности, включая вероятное неблагоприятное воздействие на новорожденного при назначении этих препаратов.
Что касается возможных побочных эффектов у беременных женщин и новорожденных, пациенты нуждаются в консультации о побочных эффектах этих препаратов во время беременности, включая вероятное неблагоприятное воздействие на новорожденного при назначении этих препаратов.
Токсичность
Из-за серьезности побочных эффектов со стороны сердца у пациентов с высоким риском следует проводить мониторинг интервала QT на ЭКГ, чтобы избежать индукции смертельных аритмий, таких как Torsades de Pointes. У пациентов с высоким риском перед введением лекарств необходимо проверить электролиты, особенно кальций, калий и магний. [4] Прекращение приема препарата необходимо, если у пациента возникают серьезные побочные эффекты. Если возможно, у этих пациентов с высоким риском вместо макролидов следует использовать другой антибиотик, чтобы избежать вероятности индукции аритмий.
Улучшение результатов медицинского персонала
Несмотря на то, что макролиды относятся к очень безопасному классу антибиотиков, для сведения к минимуму нежелательных явлений необходимо обеспечить надлежащее медицинское обслуживание всей многопрофильной командой. Все члены межпрофессиональной медицинской бригады должны следить за пациентами на предмет общих побочных эффектов, а также необычных. Все участники должны быть осведомлены о распространенных побочных эффектах со стороны желудочно-кишечного тракта и серьезных сердечных последствиях этого препарата. Каждый член медицинской бригады разделяет ответственность за оказание первоклассной помощи своим пациентам и всегда должен следить за возможными побочными эффектами.
Все члены межпрофессиональной медицинской бригады должны следить за пациентами на предмет общих побочных эффектов, а также необычных. Все участники должны быть осведомлены о распространенных побочных эффектах со стороны желудочно-кишечного тракта и серьезных сердечных последствиях этого препарата. Каждый член медицинской бригады разделяет ответственность за оказание первоклассной помощи своим пациентам и всегда должен следить за возможными побочными эффектами.
Принимая решение о начале терапии макролидами, клиницист (MD, DO, NP или PA) должен включить консультацию фармацевта, которая будет состоять из проверки целесообразности выбранного агента, проверки правильной дозировки и проверки наличия лекарственные взаимодействия. Фармацевты также могут помочь пациенту, отвечая на его вопросы, предупреждая о признаках нежелательных явлений, подкрепляя указания врача и сообщая врачу о любых проблемах, которые могут у них возникнуть. Сестринское дело может контролировать и отвечать на вопросы пациентов об их терапии и сообщать лечащему врачу о ходе лечения или его отсутствии или наличии побочных эффектов.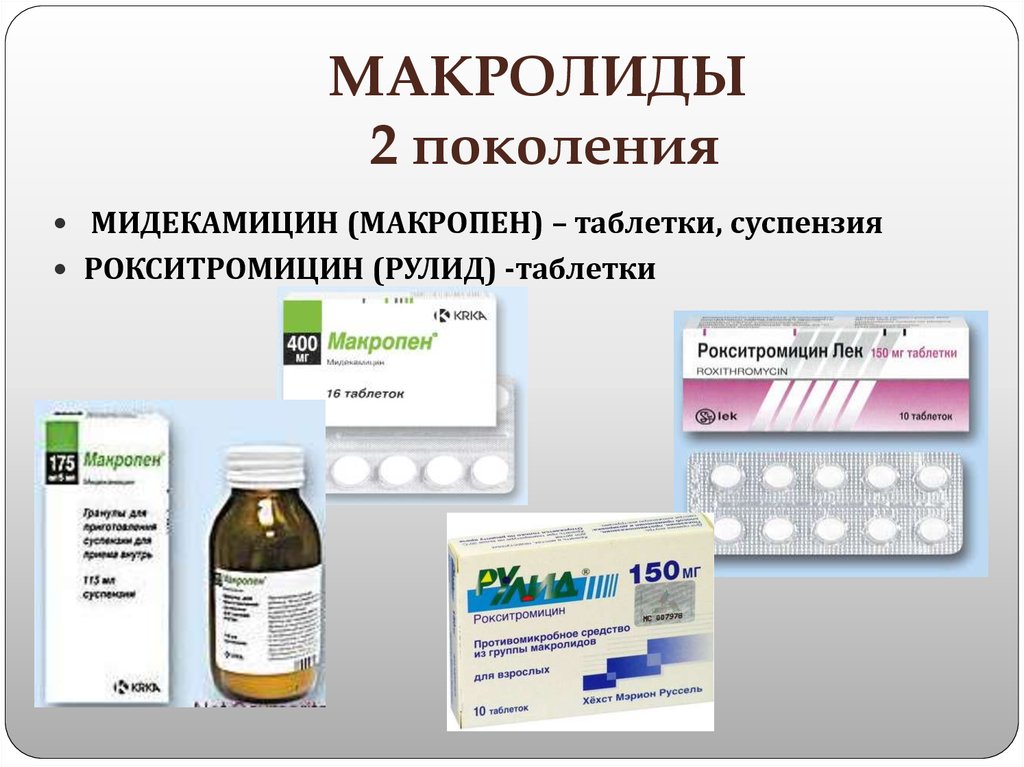 Все члены межпрофессиональной команды должны знать наиболее распространенные способы применения антибиотиков класса макролидов и прилагать совместные усилия для обеспечения оптимальных результатов лечения пациентов. [Уровень 5]
Все члены межпрофессиональной команды должны знать наиболее распространенные способы применения антибиотиков класса макролидов и прилагать совместные усилия для обеспечения оптимальных результатов лечения пациентов. [Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Клейн Д.О. История применения макролидов в педиатрии. Pediatr Infect Dis J. 1997 Apr;16(4):427-31. [PubMed: 9109154]
- 2.
Parnham MJ, Erakovic Haber V, Giamarellos-Bourboulis EJ, Perletti G, Verleden GM, Vos R. Азитромицин: механизмы действия и их значение для клинического применения. Фармакол Тер. 2014 г., август; 143(2):225–45. [В паблике: 24631273]
- 3.
Yeo YH, Shiu SI, Ho HJ, Zou B, Lin JT, Wu MS, Liou JM, Wu CY., Тайваньское желудочно-кишечное заболевание и Helicobacter Consortium.
 Эрадикационная терапия первой линии Helicobacter pylori в странах с высокой и низкой устойчивостью к кларитромицину: систематический обзор и сетевой метаанализ. Кишка. 2018 Янв;67(1):20-27. [PubMed: 27670375]
Эрадикационная терапия первой линии Helicobacter pylori в странах с высокой и низкой устойчивостью к кларитромицину: систематический обзор и сетевой метаанализ. Кишка. 2018 Янв;67(1):20-27. [PubMed: 27670375]- 4.
Farzam K, Nessel TA, Quick J. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 16 июня 2022 г. Эритромицин. [В паблике: 30335282]
- 5.
Кунья Б.А. Атипичные пневмонии: клиника, диагностика и значение. Клин Микробиол Инфект. 2006 Май; 12 Дополнение 3:12-24. [Бесплатная статья PMC: PMC7128183] [PubMed: 16669925]
- 6.
Гао Ю.Х., Гуань В.Дж., Сюй Г., Тан И., Гао И., Линь З.И., Линь З.М., Чжун Н.С., Чен Р.С. Терапия макролидами у взрослых и детей с немуковисцидозными бронхоэктазами: систематический обзор и метаанализ. ПЛОС Один. 2014;9(3):e
. [Бесплатная статья PMC: PMC3946068] [PubMed: 24603554]- 7.
Qiu S, Zhong X. Macrolides: перспективная фармакологическая терапия хронической обструктивной болезни легких.
 Тер Ад Респир Дис. 2017 март; 11(3):147-155. [Бесплатная статья PMC: PMC5933650] [PubMed: 28030992]
Тер Ад Респир Дис. 2017 март; 11(3):147-155. [Бесплатная статья PMC: PMC5933650] [PubMed: 28030992]- 8.
Васкес-Ласлоп Н., Манкин А.С. Как работают макролидные антибиотики. Тенденции биохимических наук. 2018 сен; 43 (9): 668-684. [Бесплатная статья PMC: PMC6108949] [PubMed: 30054232]
- 9.
Мунита Дж. М., Ариас, Калифорния. Механизмы антибиотикорезистентности. Микробиологический спектр. 2016 Apr;4(2) [PMC free article: PMC4888801] [PubMed: 27227291]
- 10.
Marosevic D, Kaevska M, Jaglic Z. Резистентность к антибиотикам группы тетрациклинов и макролид-линкозамид-стрептограмина и его генетическая связь — обзор. Энн Агрик Энвайрон Мед. 2017 12 июня; 24 (2): 338-344. [PubMed: 28664720]
- 11.
Картер Б.Л., Вудхед Дж.С., Коул К.Дж., Милавец Г. Побочные эффекты со стороны желудочно-кишечного тракта при приеме препаратов эритромицина. Препарат Интелл Клин Фарм. 1987 Сен; 21 (9): 734-8.
 [PubMed: 3498618]
[PubMed: 3498618]- 12.
Альберт Р.К., Шуллер Дж.Л., Сеть клинических исследований ХОБЛ. Антибиотики-макролиды и риск сердечных аритмий. Am J Respir Crit Care Med. 2014 15 мая; 189(10):1173-80. [Бесплатная статья PMC: PMC4061901] [PubMed: 24707986]
- 13.
Икеда А.К., Принц А.А., Чен Д.С., Лью Д.Е.К., Шин Д.Дж. Нейросенсорная тугоухость, связанная с макролидами: систематический обзор. Ларингоскоп. 2018 Январь; 128 (1): 228-236. [В паблике: 28771738]
- 14.
Уильямс Д.А. Синдром Стивенса-Джонсона после терапии эритромицином в море. Мил Мед. 2000 г., август; 165 (8): 636-7. [PubMed: 10957862]
- 15.
Berger FA, van Weteringen W, van der Sijs H, Hunfeld NGM, Bunge JJH, de Groot NMS, van den Bemt PMLA, van Gelder T. Динамика интервала QTc в течение 24-часовой интервал между дозами после начала внутривенного введения ципрофлоксацина или низких доз эритромицина у пациентов в ОИТ. Фармакол Рез Перспект.


 Группа Watch включает 110 антибиотиков, 11 из которых включены в Примерный перечень основных лекарственных средств ВОЗ в качестве эмпирических вариантов первого или второго выбора для лечения определенных инфекционных синдромов (табл. 2).
Группа Watch включает 110 антибиотиков, 11 из которых включены в Примерный перечень основных лекарственных средств ВОЗ в качестве эмпирических вариантов первого или второго выбора для лечения определенных инфекционных синдромов (табл. 2).
 Группа «Watch» классификации «AWaRe»
Группа «Watch» классификации «AWaRe» Группа «Reserved» классификации «AWaRe»
Группа «Reserved» классификации «AWaRe»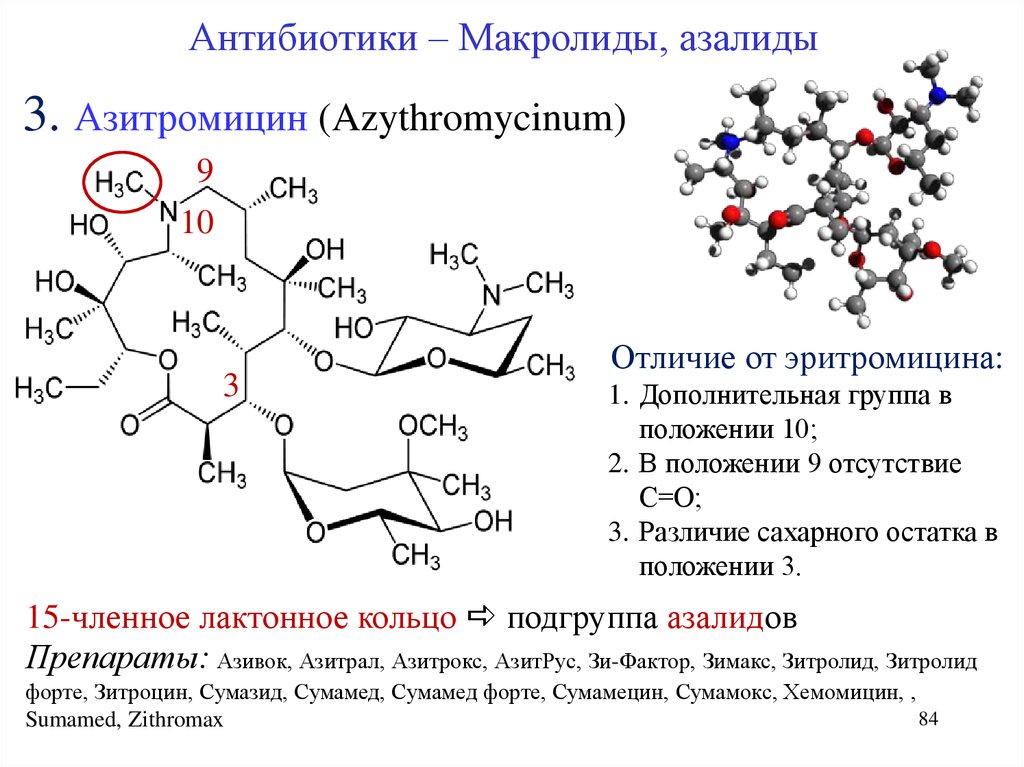 who.int
who.int