Гуморальный иммунитет
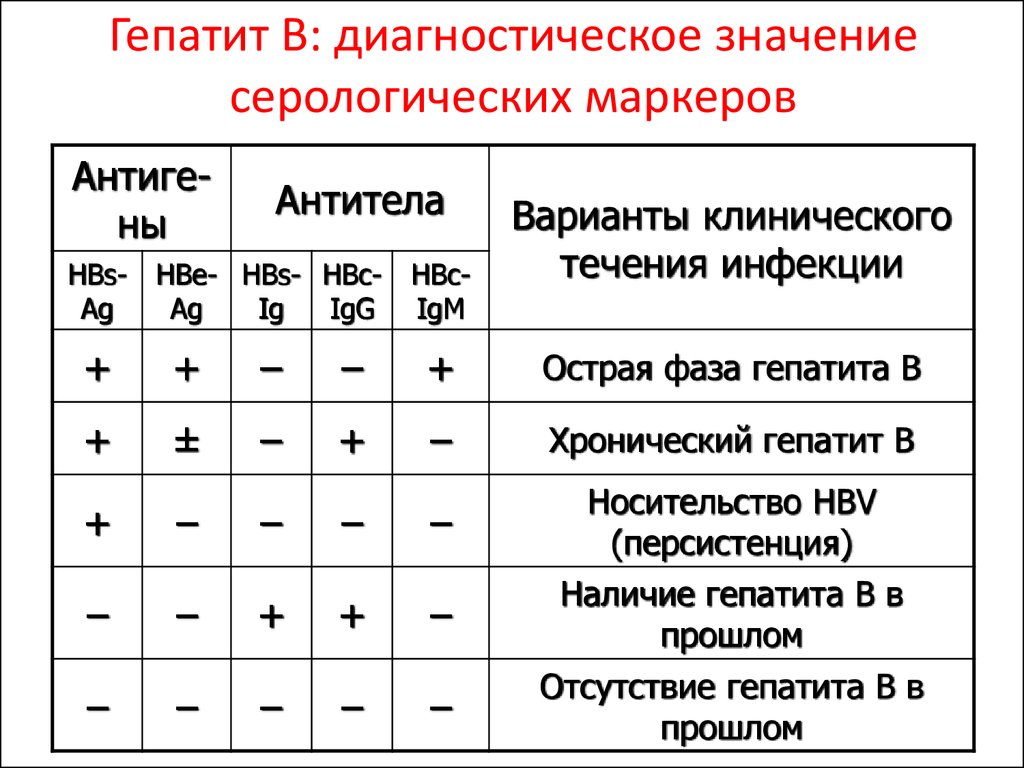
Количественное содержание иммуноглобулинов (IgА, IgМ, IgG) является основным показателем гуморального иммунного ответа и необходимо для оценки функциональной полноценности иммунной системы и диагностики патологических нарушений ее работы.
Определение уровня иммуноглобулинов является важным при диагностическом и клиническом мониторинге первичных иммунодефицитов, моноклональных гаммапатий, аутоиммунных заболеваний и других патологических состояний (Х-сцепленной агаммаглобулинемии, гипер-IgM, селективном IgА-дефиците, дефиците субклассов IgG, транзиторной гипогаммаглобулинемии новорожденных и др.). При первичных иммунодефицитах определение иммуноглобулинов имеет решающее диагностическое значение.
Снижение концентрации может свидетельствовать о различных патологиях – от генетических дефектов синтеза иммуноглобулинов до транзиторных состояний, связанных с потерей белка организмом. Причинами снижение синтеза иммуноглобулинов могут быть: моноклональные гаммапатии, термические ожоги, злокачественные лимфомы, плазмоцитомы, карциномы, болезни Ходжкина, заболеванияпочек, первичные и вторичные иммунодефициты.
При первичном контакте с антигеном сначала синтезируются IgM, затем IgG. При повторном – IgG синтезируются быстрее и в большем количестве. IgА нейтрализует вирусы и бактериальные токсины. Повышение концентраций говорит о наличии аллергических, аутоиммунных процессов, характерно для инфекционных заболеваний. Увеличение Ig разных классов отмечают при различных патологических ситуациях. Концентрация IgM возрастает в острый период и при обострении хронической инфекции, IgG – в стадии разрешения или формирования хронической инфекции, IgА – при некоторых вирусных инфекциях.
Метод исследования: >ИФА, иммунотурбидиметрия, иммунонефелометрия.
Условия взятия и хранения образца: Сыворотка крови. Хранение не более 24 ч при 4–8 °С. Допускается однократное замораживание образца.
Система комплемента
Система комплемента – комплекс белков, постоянно присутствующих в крови. Это каскадная система протеолитических ферментов, способных лизировать клетки, предназначенная для гуморальной защиты организма от действия чужеродных агентов, участвует в реализации иммунного ответа организма.
Она активизируется реакцией антиген-антитело и необходима для опосредованного антителами иммунного гемолиза и бактериолиза, играет важную роль при фагоцитозе, опсонизации, хемотаксисе и иммунном гемолизе и необходима для усиления эффекта взаимодействия между специфическими антителами и антигеном.
Одной из причин снижения факторов комплемента в сыворотке крови могут являться аутоантитела, направленные против факторов комплемента. Снижение С3 и С4 компонентов комплемента сопровождается клинической картиной рецидивирующего кожного геморрагического васкулита и артралгией.
Уровень компонентов комплемента в крови варьирует в широких пределах. Наследственный дефицит компонентов комплемента или их ингибиторов может приводить к аутоиммунным нарушениям, повторным бактериальным инфекциям, хроническим воспалительным состояниям.
С3-компонент комплемента – центральный компонент системы, белок острой фазы воспаления. Это важнейшая часть защитной системы против инфекций. Он образуется в печени, макрофагах, фибробластах, лимфоидной ткани и коже. Вследствие активации С3 выделяется гистамин из тучных клеток и тромбоцитов, хемотаксис лейкоцитов и соединение антител с антигеном, поддерживается фагоцитоз, усиливается проницаемость стенок сосудов и сокращение гладкой мускулатуры. Активация С3 играет важную роль в развитии аутоиммунных заболеваний.
Это важнейшая часть защитной системы против инфекций. Он образуется в печени, макрофагах, фибробластах, лимфоидной ткани и коже. Вследствие активации С3 выделяется гистамин из тучных клеток и тромбоцитов, хемотаксис лейкоцитов и соединение антител с антигеном, поддерживается фагоцитоз, усиливается проницаемость стенок сосудов и сокращение гладкой мускулатуры. Активация С3 играет важную роль в развитии аутоиммунных заболеваний.
С4-компонент комплемента – гликопротеин, синтезируется в легких и в костной ткани. С4 поддерживает фагоцитоз, увеличивает проницаемость стенки сосудов, участвует в нейтрализации вирусов. Он участвует только в классическом пути активации системы комплемента. Увеличение или уменьшение содержания комплемента в организме наблюдается при многих заболеваниях.
Показания к исследованию
- Подозрение на врожденный дефицит комплемента, аутоиммунные заболевания, острые и хронические бактериальные и вирусные инфекции, (особенно рецидивирующие), онкологические заболевания;
- динамическое наблюдение больных с системными аутоиммунными заболеваниями.
Условия взятия и хранения образца: Сыворотка крови. Хранение не более 24 ч при 4–8 °С. Допускается однократное замораживание образца.
Метод исследования: ИФА, иммунотурбидиметрия, иммунонефелометрия.
Повышение концентрации С3 наблюдается при некоторых острых бактериальных, паразитарных и вирусных инфекциях, аутоиммунных и воспалительных заболеваниях.
Снижение концентрации С3 -наблюдается при врожденных дефектах комплемента, различных воспалительных и инфекционных, аутоиммунных заболеваниях, длительном голодании, при лечении цитостатиками, ионизирующем излучении.
Повышение концентрации С4 характерно для реакции острой фазы, отмечается при аутоиммунных заболеваниях, назначении некоторых лекарственных препаратов.
Снижение концентрации С4 – отмечается при врожденных дефектах системы комплемента (С4 дефицит новорожденных), некоторых аутоиммунных заболеваниях, системных васкулитах, синдроме Шегрена, трансплантации почек.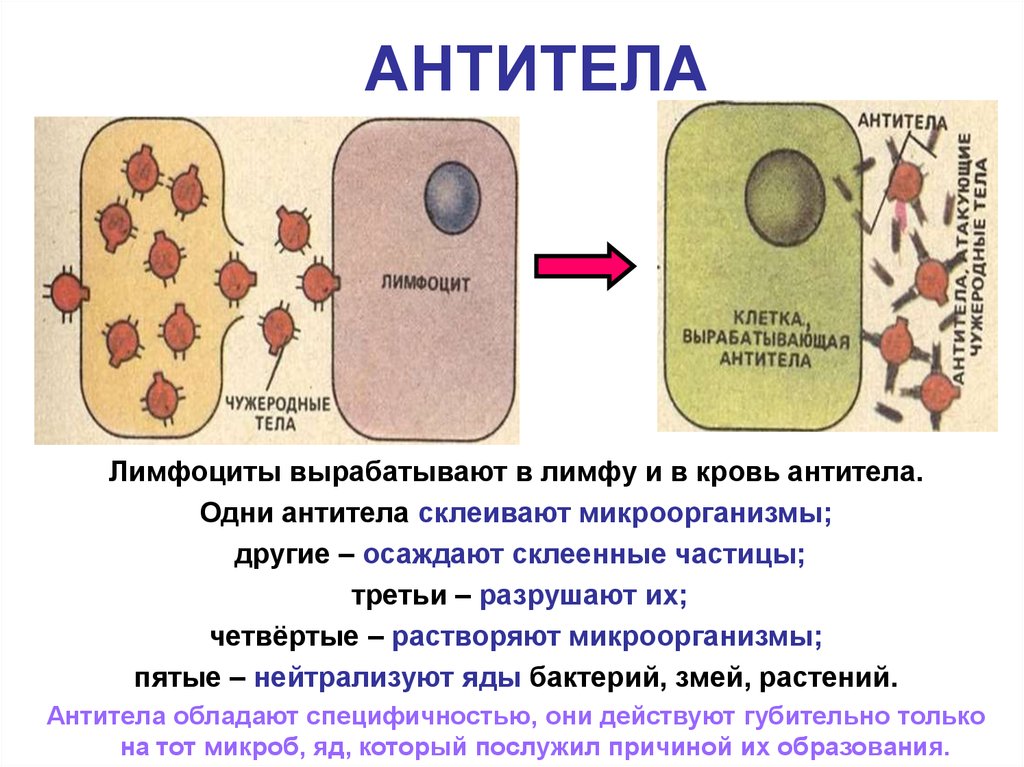
Циркулирующие иммунные комплексы
ЦИК в крови – показатель развития различных воспалительных процессов в организме и активности их течения. Повышение ЦИК наблюдается при острых и хронических инфекциях, аутоиммунных заболеваниях, вирусных гепатитах. ЦИК присутствуют у многих людей, страдающих СКВ и РА, особенно в тех случаях, когда есть осложнения в виде васкулитов. Существует положительная корреляция между активностью заболевания и уровнем ЦИК в крови. Формирование ЦИК представляет собой физиологический механизм защиты, приводящий к быстрому устранению либо эндогенных, либо экзогенных антигенов через ретикуло-эндотелиальную систему. Однако ЦИК обладают способностью связывать и активировать комплемент, что ведет к повреждению ткани. Выходя из кровотока в мелких сосудах, они могут откладываться в тканях, в гломерулах почек, в легких, коже, суставах, стенках сосудов. Клинически это часто проявляется гломерулонефритами, артритами, нейтропениями. Патологические реакции на иммунные комплексы могут быть обусловлены превышением скорости их образования над скоростью элиминации, дефицитом одного или нескольких компонентов комплемента или функциональными дефектами фагоцитарной системы.
Методы исследования: Для определения ЦИК в сыворотке крови человека используют метод иммунонефелометрии и иммунотурбодиметрии.
Условия взятия и хранения образца: Сыворотка крови. Образец стабилен, не более 24 ч при 4–8 °С. Допускается однократное замораживание образца.
Показания к исследованию: Оценка и мониторинг активности аутоиммунных, аллергических и инфекционных заболеваний.
Повышенные значения
- Аутоиммунные заболевания;
- иммунокомплексные заболевания;
- острые бактериальные, вирусные, паразитарные, грибковые заболевания;
- сывороточная болезнь;
- коллагенозы;
- ревматизм;
- аллергические альвеолиты, васкулиты, феномен Артюса;
- гломерулонефрит;
- бронхиальная астма;
- миокардит.

полезные свойства крови
ПОЛЕЗНЫЕ СВЕДЕНИЯ О КРОВИ
При переливании необходимо предварительно определить группу крови и донора и пациента.
Группы крови Существует 4 группы крови. Система ABO
В конце XIX в. Австралийский ученый Карл Ландштайнер, проводя исследование эритроцитов, обнаружил любопытную закономерность: в красных кровяных клетках (эритроцитах) некоторых людей может быть специальный маркер, который ученый обозначил буквой А, у других — маркер В, у третьих не обнаруживались ни А, ни В. Позже выяснилось, что описанные Ландштайнером маркеры — особые белки, определяющие видовую специфичность клеток, или антигены. Фактически эти исследования поделили все человечество на 3 группы крови.
Четвертая группа была описана в 1902 году учеными Декастелло и Штурли. Совместное открытие ученых получило название системы АВО.
| tildacdn.com/tild3036-6562-4632-a431-373534303630/blood-group-2781421_.jpg» bgimgfield=»img» itemscope=»» itemtype=»http://schema.org/ImageObject»> | Резус-фактор В отличие от антигенов группы крови, резус-фактор-это антиген, обнаруженный только в мембране эритроцита и не зависящий от других факторов крови. Резус-фактор передается по наследству и сохраняется в течение всей жизни человека. 85% людей, в эритроцитах которых находится резус-фактор, обладают резус-положительной кровью (Rh+), кровь остальных людей не содержит резус-фактор и называется резус-отрицательной (Rh-). |
Келл-фактор Система Kell — это система группы крови, в которую входят 25 антигенов, в том числе самый иммуногенный после А, В и D, антиген К. На основании наличия антигена K в эритроцитах или его отсутствия все люди могут быть разделены на две группы: Kell-отрицательные и Kell-положительные. В настоящее время в учреждениях службы крови определяют наличие антигена К, как наиболее опасного для возникновения иммунологических осложнений. Описаны многие случаи гемотрансфузионных осложнений и гемолитической болезни новорожденных, причиной которых была изоиммунизация антигеном К. Kell-отрицательным должна переливаться только кровь от доноров, не имеющих антиген К для предотвращения гемолиза. Лица же Kell-положительные являются универсальными реципиентами крови, так как у них не происходит отторжения её компонентов. В целях профилактики посттрансфузионных осложнений, обусловленных антигеном К системы Kell, отделения и станции переливания крови выдают для переливания в лечебные учреждения эритроцитную взвесь или массу, не содержащие этого фактора. При переливании всех видов плазмы, тромбоцитного концентрата, лейкоцитного концентрата антиген К системы Kell не учитывают. Поэтому Kell-положительным донорам рекомендуется донорство плазмы. |
Компоненты иммунной системы — Иммунобиология
Клетки иммунной системы возникают в костном мозге, где многие из них также созревают. Затем они мигрируют охранять периферических тканях, циркулирующих в крови и в специализированной системе сосуды, называемые лимфатической системой.
1-1. Белые кровяные тельца иммунной системы происходят из предшественников в костях. костный мозг
Все клеточные элементы крови, включая эритроциты, транспортирующие кислород, тромбоциты, запускающие процесс свертывания крови в поврежденных тканях, и лейкоциты иммунной системы, в конечном счете, происходят из одного и того же предшественник или клетки-предшественники — гемопоэтический ствол
 Поскольку эти стволовые клетки могут дать начало всем
различные типы клеток крови, их часто называют плюрипотентными
гемопоэтические стволовые клетки. Первоначально они дают начало стволовым клеткам более
ограниченный потенциал, которые являются непосредственными предшественниками эритроцитов,
тромбоциты и две основные категории лейкоцитов. Различные типы
клетки крови и их родословные отношения резюмируются в . Нас здесь будет интересовать
все клетки, происходящие от общего лимфоидного предшественника и миелоидного
предшественник, кроме мегакариоцитов и эритроцитов.
Поскольку эти стволовые клетки могут дать начало всем
различные типы клеток крови, их часто называют плюрипотентными
гемопоэтические стволовые клетки. Первоначально они дают начало стволовым клеткам более
ограниченный потенциал, которые являются непосредственными предшественниками эритроцитов,
тромбоциты и две основные категории лейкоцитов. Различные типы
клетки крови и их родословные отношения резюмируются в . Нас здесь будет интересовать
все клетки, происходящие от общего лимфоидного предшественника и миелоидного
предшественник, кроме мегакариоцитов и эритроцитов.Рисунок 1.3
Все клеточные элементы крови, включая лимфоциты адаптивная иммунная система, возникают из гемопоэтических стволовых клеток в костный мозг. Эти плюрипотентные клетки делятся, образуя два более специализированных типа. стволовых клеток, общий лимфоидный (подробнее…)
Миелоидный предшественник является предшественником гранулоцитов,
макрофаги, дендритные клетки и тучные клетки иммунной системы. Макрофаги
являются одним из трех типов фагоцитов в иммунной системе и распределяются
широко распространены в тканях организма, где они играют важную роль во врожденном иммунитете.
Они представляют собой зрелую форму моноцитов, которые циркулируют в крови и дифференцируются.
непрерывно в макрофаги при миграции в ткани. Дендритные клетки специализируются на
поглощают антиген и отображают его для распознавания лимфоцитами. Незрелый
дендритные клетки мигрируют из крови в ткани и одновременно
фагоцитарные и макропиноцитарные, поглощающие большое количество окружающих
внеклеточной жидкости. При встрече с возбудителем они быстро созревают и
мигрируют в лимфатические узлы.
Макрофаги
являются одним из трех типов фагоцитов в иммунной системе и распределяются
широко распространены в тканях организма, где они играют важную роль во врожденном иммунитете.
Они представляют собой зрелую форму моноцитов, которые циркулируют в крови и дифференцируются.
непрерывно в макрофаги при миграции в ткани. Дендритные клетки специализируются на
поглощают антиген и отображают его для распознавания лимфоцитами. Незрелый
дендритные клетки мигрируют из крови в ткани и одновременно
фагоцитарные и макропиноцитарные, поглощающие большое количество окружающих
внеклеточной жидкости. При встрече с возбудителем они быстро созревают и
мигрируют в лимфатические узлы.
Тучные клетки, переносимые кровью
предшественники плохо определяются, также дифференцируются в тканях. Они в основном
находятся рядом с мелкими кровеносными сосудами и при активации выделяют вещества, которые
влияют на проницаемость сосудов. Хотя наиболее известны своей ролью в
организуя аллергические реакции, считается, что они играют роль в защите
слизистых оболочек против возбудителей.
Гранулоциты так называемые
потому что они имеют густо окрашивающиеся гранулы в цитоплазме; Они также
иногда называют полиморфноядерным
лейкоциты из-за их ядер странной формы. Есть три
типы гранулоцитов, все из которых относительно недолговечны и образуются
в повышенном количестве во время иммунных реакций, когда они покидают кровь для
мигрировать к очагам инфекции или воспаления. Нейтрофилы, третьи фагоцитирующие клетки
иммунной системы, являются наиболее многочисленным и наиболее важным клеточным компонентом
врожденный иммунный ответ: наследственные нарушения функции нейтрофилов приводят
к подавляющей бактериальной инфекции, которая при отсутствии лечения приводит к летальному исходу. Считается, что эозинофилы
важное значение главным образом для защиты от паразитарных инфекций, поскольку их численность
увеличиваются при паразитарной инфекции. Функция базофилов, вероятно, аналогична и дополняет таковую.
эозинофилов и тучных клеток; мы обсудим функции этих клеток в
Глава 9и их роль в
аллергическое воспаление в главе
12. Клетки миелоидного ряда показаны на рис.
Клетки миелоидного ряда показаны на рис.
Рисунок 1.4
Миелоидные клетки врожденного и адаптивного иммунитета. Клетки миелоидного ростка выполняют различные важные функции в иммунный ответ. Ячейки схематично показаны слева. колонки в том виде, в котором они будут представлены на протяжении всей остальные (далее…)
общий лимфоидный предшественник дает начало лимфоцитам, с которым будет посвящена большая часть этой книги. Существует два основных типа лимфоцит: В-лимфоциты или В-клетки, которые при активации дифференцируются в плазматические клетки которые выделяют антитела; и Т-лимфоциты или Т-клетки, из которых есть два основных класса. Один класс при активации дифференцируется в цитотоксические Т-клетки, убивающие клетки, инфицированные вирусами, тогда как второй класс Т-клеток дифференцируется в клетки, которые активируют другие клетки, такие как В-клетки и макрофаги.
Большинство лимфоцитов представляют собой маленькие безликие клетки с небольшим количеством цитоплазматических органелл и
большая часть ядерного хроматина неактивна, о чем свидетельствует его конденсированное состояние (4). Этот вид характерен для
неактивных клеток, и неудивительно, что совсем недавно, в начале 1960-х гг.
учебники могли бы описать эти клетки, которые теперь являются центральным предметом иммунологии, как
не имеющий известной функции. Действительно, эти малые лимфоциты не имеют функциональной
активности до тех пор, пока они не столкнутся с антигеном, что необходимо для запуска их
пролиферация и дифференцировка их специализированных функциональных
характеристики.
Этот вид характерен для
неактивных клеток, и неудивительно, что совсем недавно, в начале 1960-х гг.
учебники могли бы описать эти клетки, которые теперь являются центральным предметом иммунологии, как
не имеющий известной функции. Действительно, эти малые лимфоциты не имеют функциональной
активности до тех пор, пока они не столкнутся с антигеном, что необходимо для запуска их
пролиферация и дифференцировка их специализированных функциональных
характеристики.
Рисунок 1.5
Лимфоциты в основном мелкие и неактивные клетки. На левой панели показана световая микрофотография малого лимфоцита. окружены красными кровяными тельцами. Обратите внимание на конденсированный хроматин ядра, что указывает на небольшую транскрипционную активность, относительная отсутствие (подробнее…)
Лимфоциты обладают замечательной способностью вызывать специфический иммунный ответ
практически против любого чужеродного антигена. Это возможно, потому что каждый человек
созревает лимфоцит, несущий уникальный вариант антигенного рецептора-прототипа, поэтому
что популяция Т- и В-лимфоцитов в совокупности несет огромный репертуар
рецепторов, которые сильно различаются по антигенсвязывающим сайтам. Рецептор В-клеточного антигена
( BCR ) представляет собой мембраносвязанную форму антитела, которое В-клетка
будут секретировать после активации и дифференцировки в плазматические клетки. антитело
молекулы как класс известны как иммуноглобулины, обычно сокращенно до Ig, а антигенный рецептор В-лимфоцитов представляет собой
поэтому также известен как мембранный иммуноглобулин (mIg).
Рецептор Т-клеточного антигена
( TCR ) родственен иммуноглобулину, но совершенно отличается от
это, так как он специально приспособлен для обнаружения антигенов, полученных из чужеродных белков
или патогены, проникшие в клетки-хозяева. Мы опишем структуры
этих лимфоцитарных антигенных рецепторов подробно описано в главах 3, 4 и 5, а способ в
разнообразие их сайтов связывания создается по мере развития лимфоцитов в
Глава 7.
Рецептор В-клеточного антигена
( BCR ) представляет собой мембраносвязанную форму антитела, которое В-клетка
будут секретировать после активации и дифференцировки в плазматические клетки. антитело
молекулы как класс известны как иммуноглобулины, обычно сокращенно до Ig, а антигенный рецептор В-лимфоцитов представляет собой
поэтому также известен как мембранный иммуноглобулин (mIg).
Рецептор Т-клеточного антигена
( TCR ) родственен иммуноглобулину, но совершенно отличается от
это, так как он специально приспособлен для обнаружения антигенов, полученных из чужеродных белков
или патогены, проникшие в клетки-хозяева. Мы опишем структуры
этих лимфоцитарных антигенных рецепторов подробно описано в главах 3, 4 и 5, а способ в
разнообразие их сайтов связывания создается по мере развития лимфоцитов в
Глава 7.
Третья линия лимфоидных клеток, называемая естественными клетками-киллерами, лишена антигенспецифических рецепторов и является частью
врожденная иммунная система.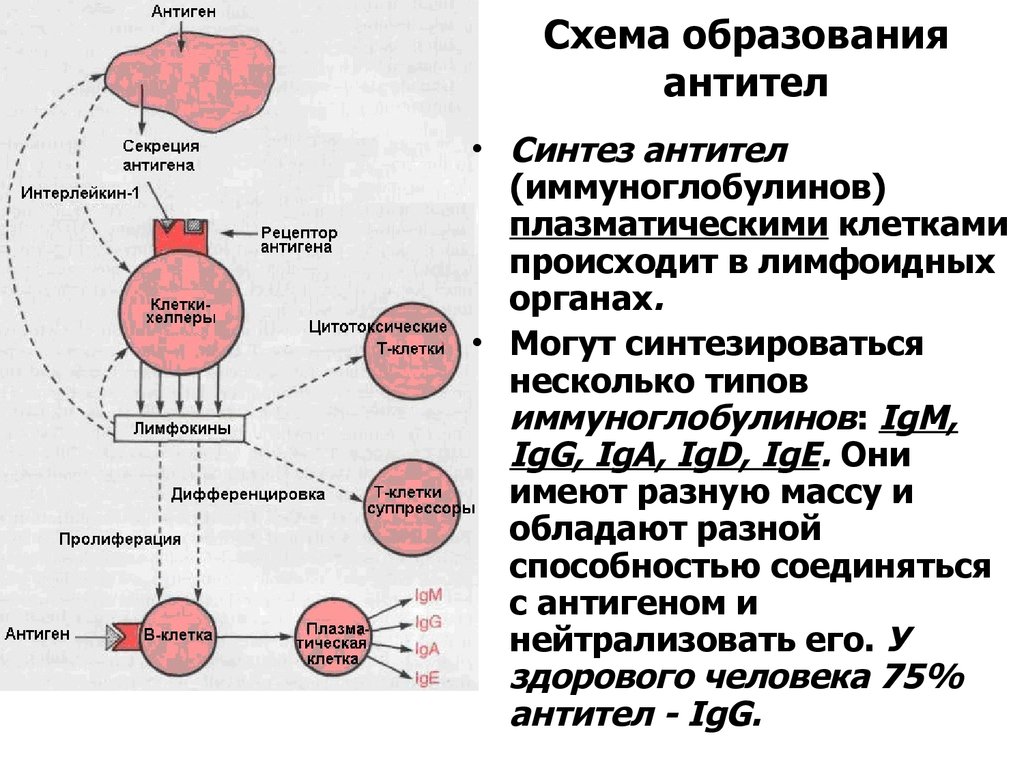 Эти клетки циркулируют в крови в виде крупных
лимфоциты с характерными цитотоксическими гранулами (). Они способны распознавать и убивать некоторые аномальные клетки,
например, некоторые опухолевые клетки и инфицированные вирусом клетки, которые считаются
играет важную роль в защите врожденного иммунитета от внутриклеточных патогенов.
Эти клетки циркулируют в крови в виде крупных
лимфоциты с характерными цитотоксическими гранулами (). Они способны распознавать и убивать некоторые аномальные клетки,
например, некоторые опухолевые клетки и инфицированные вирусом клетки, которые считаются
играет важную роль в защите врожденного иммунитета от внутриклеточных патогенов.
Рисунок 1.6
Натуральные клетки-киллеры (NK). Это крупные зернистые лимфоцитоподобные клетки с важными функции врожденного иммунитета. Несмотря на отсутствие антигенспецифического рецепторы, они могут обнаруживать и атаковать некоторые инфицированные вирусом клетки. Фотография предоставлена Н. Руни (подробнее…)
1-2. Лимфоциты созревают в костном мозге или тимусе
Лимфоидные органы организованы
тканей, содержащих большое количество лимфоцитов в составе нелимфоидного
клетки. В этих органах взаимодействия лимфоцитов с нелимфоидными клетками
важны либо для развития лимфоцитов, либо для инициации адаптивных
иммунные реакции или на поддержание лимфоцитов. Лимфоидные органы могут быть
делятся в целом на центральных или первичных лимфоидных органов, где образуются лимфоциты,
и периферийный или вторичный
лимфоидные органы , где адаптивные иммунные ответы инициируются и
где сохраняются лимфоциты. Центральными лимфоидными органами являются костный мозг и вилочковая железа, большая
орган в верхней части грудной клетки; расположение тимуса и других лимфоидных
органов, схематично показано на рис.
Лимфоидные органы могут быть
делятся в целом на центральных или первичных лимфоидных органов, где образуются лимфоциты,
и периферийный или вторичный
лимфоидные органы , где адаптивные иммунные ответы инициируются и
где сохраняются лимфоциты. Центральными лимфоидными органами являются костный мозг и вилочковая железа, большая
орган в верхней части грудной клетки; расположение тимуса и других лимфоидных
органов, схематично показано на рис.
Рисунок 1.7
Распределение лимфоидной ткани в организме. Лимфоциты возникают из стволовых клеток костного мозга и дифференцируются в центральных лимфоидных органах (желтые), В-клетках в костном мозге и Т-клетки в тимусе. Они мигрируют из этих тканей и перевозил (далее…)
И В-, и Т-лимфоциты происходят из костного мозга, но только В-лимфоциты
созреть там; Т-лимфоциты мигрируют в тимусе для созревания.
Таким образом, В-лимфоциты называются так потому, что они происходят из костного мозга, а Т-лимфоциты
лимфоциты, потому что они происходят из тимуса. Как только они завершили свои
созревания оба типа лимфоцитов попадают в кровоток, откуда они
мигрируют в периферические лимфоидные органы.
Как только они завершили свои
созревания оба типа лимфоцитов попадают в кровоток, откуда они
мигрируют в периферические лимфоидные органы.
1-3. Периферические лимфоидные органы специализируются на улавливании антигена, что позволяет инициирование адаптивных иммунных ответов и обеспечение сигналов, которые поддерживают рециркулирующие лимфоциты
Патогены могут попасть в организм многими путями и вызвать инфекцию где угодно, но антиген и лимфоциты со временем встретятся друг с другом в периферических лимфоидные органы – лимфатические узлы, селезенка и лимфоидные ткани слизистой оболочки (видеть ). Лимфоциты постоянно рециркулирует через эти ткани, к которым антиген также переносятся из очагов инфекции, в первую очередь внутри макрофагов и дендритных клетки. Внутри лимфоидных органов специализированные клетки, такие как зрелые дендритные клетки представляют антиген лимфоцитам.
Высокоорганизованные лимфатические узлы
лимфоидные образования, расположенные в местах схождения сосудов
лимфатическая система, разветвленная система сосудов, собирающая внеклеточные
жидкости из тканей и возвращает ее в кровь.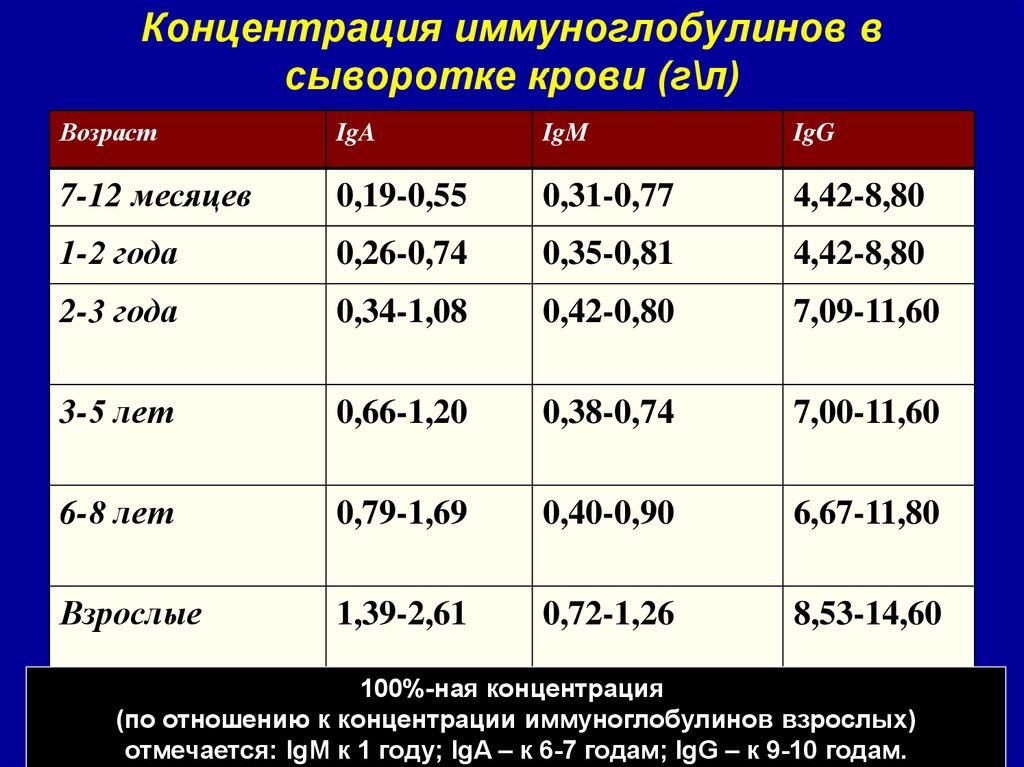 Эта внеклеточная жидкость является
вырабатывается непрерывно путем фильтрации из крови и называется лимфой. Сосуды – это лимфатические сосуды или лимфатические сосуды (см.). Афферентные лимфатические сосуды отводят жидкость от тканей, а также несут антигенсодержащие
клетки и антигены из инфицированных тканей в лимфатические узлы, где они
в ловушке. В лимфатических узлах В-лимфоциты локализованы в фолликулах, при этом Т-клетки более
диффузно распределены в окружающих паракортикальных областях, также называемых Т-клеточными зонами. Некоторые из В-клеточных фолликулов включают зародышевые центры, где В-клетки
подвергаются интенсивной пролиферации после встречи со своим специфическим антигеном и
их сотрудничающие Т-клетки (14). Б
и Т-лимфоциты сегрегируются аналогичным образом в других периферических
лимфоидные ткани, и мы увидим, что эта организация способствует решающему
взаимодействия, которые происходят между В- и Т-клетками при встрече с антигеном.
Эта внеклеточная жидкость является
вырабатывается непрерывно путем фильтрации из крови и называется лимфой. Сосуды – это лимфатические сосуды или лимфатические сосуды (см.). Афферентные лимфатические сосуды отводят жидкость от тканей, а также несут антигенсодержащие
клетки и антигены из инфицированных тканей в лимфатические узлы, где они
в ловушке. В лимфатических узлах В-лимфоциты локализованы в фолликулах, при этом Т-клетки более
диффузно распределены в окружающих паракортикальных областях, также называемых Т-клеточными зонами. Некоторые из В-клеточных фолликулов включают зародышевые центры, где В-клетки
подвергаются интенсивной пролиферации после встречи со своим специфическим антигеном и
их сотрудничающие Т-клетки (14). Б
и Т-лимфоциты сегрегируются аналогичным образом в других периферических
лимфоидные ткани, и мы увидим, что эта организация способствует решающему
взаимодействия, которые происходят между В- и Т-клетками при встрече с антигеном.
Рисунок 1.8
Организация лимфатического узла. Как показано на схеме слева, лимфатический узел состоит из
наружная кора и внутренний мозговой слой. Кора состоит из
наружная кора В-клеток, организованная в лимфоидные фолликулы, и глубокая,
или паракортикальные, области (подробнее…)
Как показано на схеме слева, лимфатический узел состоит из
наружная кора и внутренний мозговой слой. Кора состоит из
наружная кора В-клеток, организованная в лимфоидные фолликулы, и глубокая,
или паракортикальные, области (подробнее…)
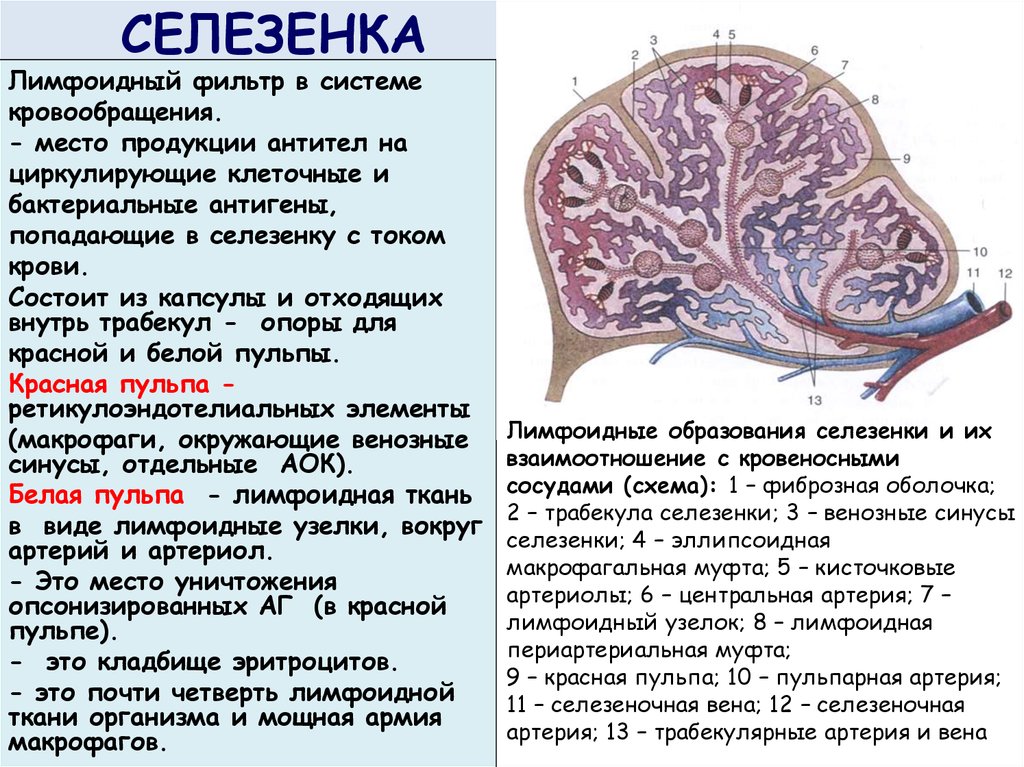
Селезенка – орган размером с кулак сразу за желудком (см. ) который собирает антиген из крови. Он также собирает и утилизирует стареющие красные кровяные клетки. Его организация схематично показана на рис. Большая часть селезенки состоит из красной пульпы, которая является местом удаление клеток крови. Артериолы, впадающие в орган, окружают лимфоциты. формирование участков белой пульпы, внутренняя область которого делится на периартериолярную лимфоидную оболочку ( PALS ), содержащий в основном Т-клетки и фланкирующая В-клеточная корона.
Рисунок 1.9
Организация лимфоидной ткани селезенки. Схема вверху справа показывает, что селезенка состоит из красной пульпы.
(розовые области на верхней панели), где находятся эритроциты.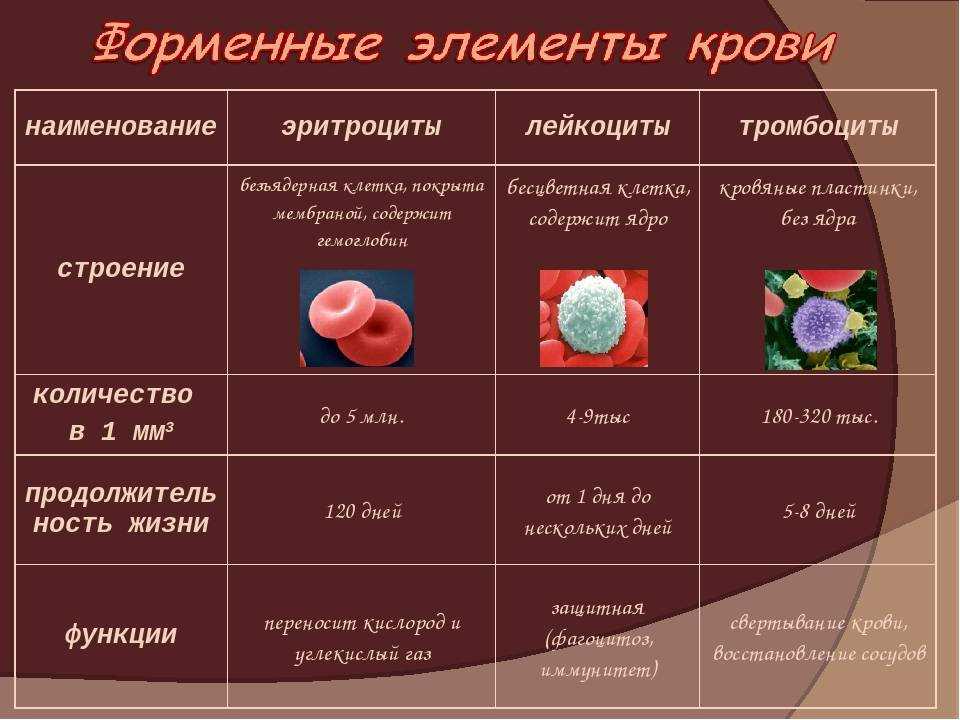 деструкция с вкраплениями лимфоидной белой пульпы. Расширение
(подробнее…)
деструкция с вкраплениями лимфоидной белой пульпы. Расширение
(подробнее…)
Лимфоидные ткани кишечника
(GALT), которые включают миндалины, аденоиды и аппендикс, а также специализированные структуры, называемые пейеровыми бляшками в малом
кишечника, собирают антиген с эпителиальных поверхностей желудочно-кишечного тракта.
тракт. В пейеровых бляшках, которые являются наиболее важными и высокоорганизованными из
В этих тканях антиген собирается специализированными эпителиальными клетками, называемыми мультифенестрированные или М-клетки. Лимфоциты образуют фолликул, состоящий из большого центрального
купол из В-лимфоцитов, окруженный меньшим количеством Т-лимфоцитов (). Аналогично, но более рассеянно
агрегаты лимфоцитов защищают респираторный эпителий, где они
известный как бронхиально-ассоциированная лимфоидная ткань (BALT), и другие слизистые оболочки, где они
известны просто как лимфоидная ткань, ассоциированная со слизистой оболочкой (MALT).
В совокупности иммунная система слизистых оболочек, по оценкам, содержит столько же
лимфоциты, как и все остальное тело, и они образуют специализированный набор
ячейки, подчиняющиеся несколько иным правилам.
Рисунок 1.10
Организация типичной кишечной лимфоидной ткани. Как показано на диаграмме слева, основную часть ткани составляют В-клетки. организованы в большой и очень активный куполообразный фолликул. Т-клетки занимают участки между фолликулами. Антиген проникает через специализированный (подробнее…)
Лимфатические узлы, селезенка и
лимфоидные ткани, ассоциированные со слизистой оболочкой, имеют одинаковую базовую архитектуру. Каждый
этих тканей действует по тому же принципу, захватывая антиген из мест
инфекцию и представить ее мигрирующим малым лимфоцитам, тем самым индуцируя
адаптивные иммунные реакции. Периферические лимфоидные ткани также обеспечивают
устойчивые сигналы к лимфоцитам, которые не сталкиваются со своими специфическими
антиген, так что они продолжают выживать и рециркулировать до тех пор, пока не встретятся
свой специфический антиген. Это важно для поддержания правильного количества
циркулирующие Т- и В-лимфоциты, и гарантирует, что только те лимфоциты с
сохраняется способность реагировать на чужеродный антиген.
1-4. Лимфоциты циркулируют между кровью и лимфой
Малые В- и Т-лимфоциты, созревшие в костном мозге и тимусе, но с еще не встретившимся антигеном, называются наивными лимфоцитами. Эти клетки постоянно циркулируют из кровь в периферические лимфоидные ткани, в которые они попадают путем сдавливания между клетками стенок капилляров. Затем они возвращаются в кровь через лимфатические сосуды () или, в случае селезенки, вернуться непосредственно в кровь. В случае инфекция, лимфоциты, распознающие инфекционный агент, задерживаются в лимфоидной ткани, где они пролиферируют и дифференцируются в эффектор клетки , способные бороться с инфекцией.
Рисунок 1.11
Циркулирующие лимфоциты сталкиваются с антигеном в периферических лимфоидных
органы. Наивные лимфоциты постоянно рециркулируют через периферические лимфоидные
ткань, показанная здесь как лимфатический узел за коленом,
подколенный лимфатический узел. Здесь они могут столкнуться со своим (подробнее. ..)
..)
Когда инфекция возникает на периферии, например, большое количество антигена поглощаются дендритными клетками, которые затем перемещаются из очага инфекции через афферентные лимфатические сосуды в дренирующие лимфатические узлы (см. ). В лимфатических узлах эти клетки представляют антиген для рециркулирующие Т-лимфоциты, которые они также помогают активировать. В-клетки, которые сталкиваются с антигеном, поскольку они мигрируют через лимфатический узел, также задерживаются и активируется с помощью некоторых активированных Т-клеток. Однажды антигенспецифические лимфоциты претерпели период пролиферации и дифференцировки они покидают лимфатические узлы в качестве эффекторных клеток через эфферентный лимфатический сосуд (см. ).
Поскольку они участвуют в инициации адаптивных иммунных реакций, периферические
лимфоидные ткани не являются статичными структурами, а довольно сильно изменяются в зависимости от
от того, есть инфекция или нет. Диффузная лимфоидная ткань слизистой оболочки
могут появляться в ответ на инфекцию, а затем исчезать, тогда как архитектура
организованных тканей изменяется более определенным образом во время инфекции. Для
например, В-клеточные фолликулы лимфатических узлов расширяются в виде В-лимфоцитов.
пролиферируют, образуя зародышевые центры (см. ), и весь лимфатический узел увеличивается, явление, знакомое
известный как опухшие железы.
Для
например, В-клеточные фолликулы лимфатических узлов расширяются в виде В-лимфоцитов.
пролиферируют, образуя зародышевые центры (см. ), и весь лимфатический узел увеличивается, явление, знакомое
известный как опухшие железы.
Резюме
Иммунные ответы опосредованы лейкоцитами, которые происходят из предшественников в
Костный мозг. Полипотентная гемопоэтическая стволовая клетка дает начало лимфоцитам.
ответственны за адаптивный иммунитет, а также за миелоидные линии, которые участвуют
как врожденного, так и адаптивного иммунитета. Нейтрофилы, эозинофилы и базофилы
все вместе известны как гранулоциты; они циркулируют в крови, если
задействованы в качестве эффекторных клеток в очагах инфекции и воспаления.
Макрофаги и тучные клетки завершают свою дифференцировку в тканях, где
они действуют как эффекторные клетки на переднем крае защиты хозяина и инициируют
воспаление. Макрофаги фагоцитируют бактерии и привлекают другие фагоцитирующие
клетки, нейтрофилы, из крови. Тучные клетки являются экзоцитарными и считаются
организовать защиту от паразитов, а также вызвать аллергические
воспаление; они рекрутируют эозинофилы и базофилы, которые также являются экзоцитами. Дендритные клетки проникают в ткани в виде незрелых фагоцитов, где они специализируются
при попадании антигенов. Эти антигенпрезентирующие клетки впоследствии мигрируют в
лимфоидная ткань. Существует два основных типа лимфоцитов: В-лимфоциты, которые
созревают в костном мозге; и Т-лимфоциты, которые созревают в тимусе.
костный мозг и вилочковая железа, таким образом, известны как центральные или первичные лимфоидные органы.
Зрелые лимфоциты непрерывно рециркулируют из кровотока через
периферические или вторичные лимфоидные органы, возвращающиеся в кровоток через
лимфатические сосуды. Большинство адаптивных иммунных реакций запускается, когда
рециркулирующие Т-клетки распознают свой специфический антиген на поверхности
дендритная клетка. Три основных типа периферической лимфоидной ткани:
селезенка, которая собирает антигены из крови; лимфатические узлы, которые собирают
антиген из очагов инфекции в тканях; и связанные со слизистой оболочкой
лимфоидные ткани (MALT), которые собирают антигены с эпителиальных поверхностей
тело.
Дендритные клетки проникают в ткани в виде незрелых фагоцитов, где они специализируются
при попадании антигенов. Эти антигенпрезентирующие клетки впоследствии мигрируют в
лимфоидная ткань. Существует два основных типа лимфоцитов: В-лимфоциты, которые
созревают в костном мозге; и Т-лимфоциты, которые созревают в тимусе.
костный мозг и вилочковая железа, таким образом, известны как центральные или первичные лимфоидные органы.
Зрелые лимфоциты непрерывно рециркулируют из кровотока через
периферические или вторичные лимфоидные органы, возвращающиеся в кровоток через
лимфатические сосуды. Большинство адаптивных иммунных реакций запускается, когда
рециркулирующие Т-клетки распознают свой специфический антиген на поверхности
дендритная клетка. Три основных типа периферической лимфоидной ткани:
селезенка, которая собирает антигены из крови; лимфатические узлы, которые собирают
антиген из очагов инфекции в тканях; и связанные со слизистой оболочкой
лимфоидные ткани (MALT), которые собирают антигены с эпителиальных поверхностей
тело. Адаптивный иммунный ответ инициируется в этих периферических лимфоидных
ткани: Т-клетки, которые сталкиваются с антигеном, пролиферируют и дифференцируются в
антиген-специфические эффекторные клетки, тогда как В-клетки пролиферируют и дифференцируются
в клетки, секретирующие антитела.
Адаптивный иммунный ответ инициируется в этих периферических лимфоидных
ткани: Т-клетки, которые сталкиваются с антигеном, пролиферируют и дифференцируются в
антиген-специфические эффекторные клетки, тогда как В-клетки пролиферируют и дифференцируются
в клетки, секретирующие антитела.
Адаптивная иммунная система — молекулярная биология клетки
Книжная полка NCBI. Служба Национальной медицинской библиотеки, Национальных институтов здоровья.
Альбертс Б., Джонсон А., Льюис Дж. и др. Молекулярная биология клетки. 4-е издание. Нью-Йорк: Гарланд Наука; 2002.
- По соглашению с издателем эта книга доступна через функцию поиска, но не может быть просмотрена.
Показать детали
Критерий поиска
Наши 9Адаптивная иммунная система 0007 спасает нас от верной смерти от инфекции. Младенец, рожденный с серьезным дефектом адаптивной иммунной системы, вскоре умрет, если не будут приняты чрезвычайные меры для его изоляции от множества инфекционных агентов, включая бактерии, вирусы, грибки и паразиты. Действительно, всем многоклеточным организмам необходимо защищаться от заражения такими потенциально опасными захватчиками, которые в совокупности называются патогенами. Беспозвоночные используют относительно простые стратегии защиты, основанные главным образом на защитных барьерах, токсичных молекулах и фагоцитирующих клетках, которые поглощают и уничтожают вторгшиеся микроорганизмы.0131 (микробы) и более крупные паразиты (например, черви). Позвоночные животные тоже зависят от таких врожденных иммунных реакций в качестве первой линии защиты (обсуждаемой в главе 25), но они также могут создавать гораздо более сложные защитные механизмы, называемые адаптивными иммунными реакциями. Врожденные реакции запускают адаптивные иммунные реакции, и обе они работают вместе, чтобы устранить патогены (14). В отличие от врожденных иммунных ответов, адаптивные реакции очень специфичны для конкретного патогена, который их вызвал. Они также могут обеспечить длительную защиту. Например, человек, выздоровевший от кори, на всю жизнь защищен от кори адаптивной иммунной системой, но не от других распространенных вирусов, таких как свинка или ветряная оспа.
Действительно, всем многоклеточным организмам необходимо защищаться от заражения такими потенциально опасными захватчиками, которые в совокупности называются патогенами. Беспозвоночные используют относительно простые стратегии защиты, основанные главным образом на защитных барьерах, токсичных молекулах и фагоцитирующих клетках, которые поглощают и уничтожают вторгшиеся микроорганизмы.0131 (микробы) и более крупные паразиты (например, черви). Позвоночные животные тоже зависят от таких врожденных иммунных реакций в качестве первой линии защиты (обсуждаемой в главе 25), но они также могут создавать гораздо более сложные защитные механизмы, называемые адаптивными иммунными реакциями. Врожденные реакции запускают адаптивные иммунные реакции, и обе они работают вместе, чтобы устранить патогены (14). В отличие от врожденных иммунных ответов, адаптивные реакции очень специфичны для конкретного патогена, который их вызвал. Они также могут обеспечить длительную защиту. Например, человек, выздоровевший от кори, на всю жизнь защищен от кори адаптивной иммунной системой, но не от других распространенных вирусов, таких как свинка или ветряная оспа. В этой главе мы сосредоточимся главным образом на адаптивных иммунных реакциях, и, если не указано иное, к ним относится термин «иммунные реакции». Мы подробно обсудим врожденные иммунные реакции в главе 25.
В этой главе мы сосредоточимся главным образом на адаптивных иммунных реакциях, и, если не указано иное, к ним относится термин «иммунные реакции». Мы подробно обсудим врожденные иммунные реакции в главе 25.
Рисунок 24-1
Врожденный и адаптивный иммунный ответ. Врожденные иммунные реакции активируются непосредственно патогенами и защищают все многоклеточные организмы от инфекций. У позвоночных патогены вместе с врожденным иммунным ответом, который они активируют, стимулируют адаптивный (подробнее…)
Функция адаптивного иммунного ответа заключается в уничтожении вторгшихся патогенов и любых продуцируемых ими токсичных молекул. Поскольку эти реакции разрушительны, крайне важно, чтобы они реагировали только на молекулы, чуждые хозяину, а не на молекулы самого хозяина. Способность различать, что такое иностранный от того, что себя таким образом, является фундаментальной особенностью адаптивной иммунной системы. Иногда система не может провести это различие и деструктивно реагирует на собственные молекулы хозяина. Такие аутоиммунные заболевания могут привести к летальному исходу.
Такие аутоиммунные заболевания могут привести к летальному исходу.
Конечно, многие чужеродные молекулы, попадающие в организм, безвредны, и было бы бессмысленно и потенциально опасно запускать против них адаптивные иммунные реакции. Аллергические состояния, такие как сенная лихорадка и астма, являются примерами пагубных адаптивных иммунных реакций против, казалось бы, безвредных чужеродных молекул. Таких неадекватных реакций обычно избегают, потому что врожденная иммунная система запускает адаптивные иммунные реакции только тогда, когда она распознает молекулы, характерные для вторгающихся патогенов, называемых 9.0007 патоген-ассоциированные иммуностимуляторы (обсуждается в главе 25). Более того, врожденная иммунная система может различать разные классы патогенов и задействовать наиболее эффективную форму адаптивного иммунного ответа для их устранения.
Любое вещество, способное вызывать адаптивный иммунный ответ, называется антигеном (анти- корпус генератор ген ).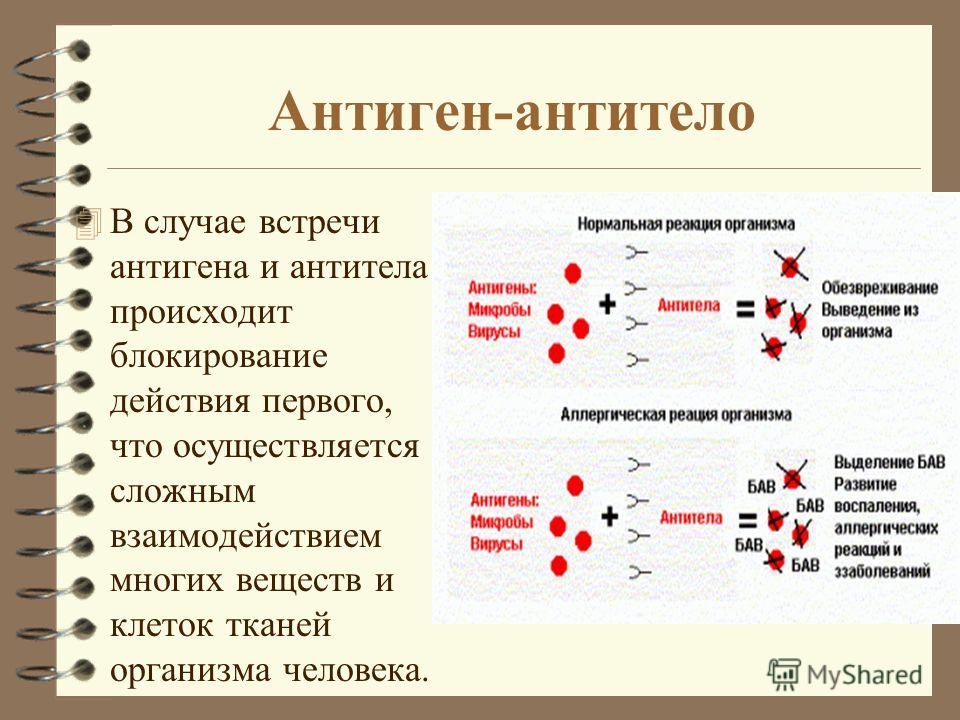 Большая часть того, что мы знаем о таких реакциях, получена из исследований, в которых экспериментатор обманом заставляет адаптивную иммунную систему лабораторного животного (обычно мыши) реагировать на безвредную чужеродную молекулу, например чужеродный белок. Хитрость заключается в том, что безвредная молекула вводится вместе с иммуностимуляторами (обычно микробного происхождения), называемыми 9.0131 адъюванты, активирующие врожденную иммунную систему. Этот процесс называется иммунизацией . При таком введении почти любая макромолекула, если она является чужеродной для реципиента, может индуцировать адаптивный иммунный ответ, специфичный для введенной макромолекулы. Примечательно, что адаптивная иммунная система может различать очень похожие антигены, например, два белка, отличающихся только одной аминокислотой, или два оптических изомера одной и той же молекулы.
Большая часть того, что мы знаем о таких реакциях, получена из исследований, в которых экспериментатор обманом заставляет адаптивную иммунную систему лабораторного животного (обычно мыши) реагировать на безвредную чужеродную молекулу, например чужеродный белок. Хитрость заключается в том, что безвредная молекула вводится вместе с иммуностимуляторами (обычно микробного происхождения), называемыми 9.0131 адъюванты, активирующие врожденную иммунную систему. Этот процесс называется иммунизацией . При таком введении почти любая макромолекула, если она является чужеродной для реципиента, может индуцировать адаптивный иммунный ответ, специфичный для введенной макромолекулы. Примечательно, что адаптивная иммунная система может различать очень похожие антигены, например, два белка, отличающихся только одной аминокислотой, или два оптических изомера одной и той же молекулы.
Адаптивный иммунный ответ осуществляется белыми кровяными тельцами, называемыми лимфоцитами. Существует два широких класса таких ответов — ответы антител и клеточно-опосредованные иммунные ответы , и они осуществляются различными классами лимфоцитов, называемых В-клетками и Т-клетками, соответственно. В ответах антител В-клетки активируются для секреции антител, которые представляют собой белки, называемые иммуноглобулинами . Антитела циркулируют в кровотоке и проникают в другие жидкости организма, где они специфически связываются с чужеродным антигеном, который стимулировал их выработку. Связывание антител инактивирует вирусы и микробные токсины (такие как столбнячный токсин или дифтерийный токсин), блокируя их способность связываться с рецепторами на клетках-хозяевах. Связывание антител также помечает вторгшиеся патогены для уничтожения, главным образом, облегчая их поглощение фагоцитарными клетками врожденной иммунной системы.
В ответах антител В-клетки активируются для секреции антител, которые представляют собой белки, называемые иммуноглобулинами . Антитела циркулируют в кровотоке и проникают в другие жидкости организма, где они специфически связываются с чужеродным антигеном, который стимулировал их выработку. Связывание антител инактивирует вирусы и микробные токсины (такие как столбнячный токсин или дифтерийный токсин), блокируя их способность связываться с рецепторами на клетках-хозяевах. Связывание антител также помечает вторгшиеся патогены для уничтожения, главным образом, облегчая их поглощение фагоцитарными клетками врожденной иммунной системы.
Рисунок 24-2
Два основных класса адаптивных иммунных реакций. Лимфоциты осуществляют оба класса ответов. Здесь лимфоциты реагируют на вирусную инфекцию. В одном классе ответа В-клетки секретируют антитела, нейтрализующие вирус. В другом, (подробнее…)
При клеточно-опосредованном иммунном ответе, втором классе адаптивного иммунного ответа, активированные Т-клетки реагируют непосредственно на чужеродный антиген, который представлен им на поверхности клетки-хозяина. Т-клетка, например, может убить инфицированную вирусом клетку-хозяина, на поверхности которой есть вирусные антигены, тем самым уничтожая инфицированную клетку до того, как вирус получит возможность реплицироваться (см. ). В других случаях Т-клетка продуцирует сигнальные молекулы, которые активируют макрофаги для уничтожения вторгшихся микробов, которые они фагоцитировали.
Т-клетка, например, может убить инфицированную вирусом клетку-хозяина, на поверхности которой есть вирусные антигены, тем самым уничтожая инфицированную клетку до того, как вирус получит возможность реплицироваться (см. ). В других случаях Т-клетка продуцирует сигнальные молекулы, которые активируют макрофаги для уничтожения вторгшихся микробов, которые они фагоцитировали.
Мы начинаем эту главу с обсуждения общих свойств лимфоцитов. Затем мы рассмотрим функциональные и структурные особенности антител, которые позволяют им распознавать и нейтрализовать внеклеточные микробы и токсины, которые они производят. Далее мы обсудим, как В-клетки могут производить практически неограниченное количество различных молекул антител. Наконец, мы рассматриваем особенности Т-клеток и клеточно-опосредованные иммунные ответы, за которые они отвечают. Примечательно, что Т-клетки могут обнаруживать микробы, скрывающиеся внутри клеток-хозяев, и либо убивать инфицированные клетки, либо помогать другим клеткам уничтожать микробы.

 Наличие антигена К (Kell-положительный) не является патологией и передается по наследству, как и другие групповые антигены человека. В России он встречается у 7-10% жителей.
Наличие антигена К (Kell-положительный) не является патологией и передается по наследству, как и другие групповые антигены человека. В России он встречается у 7-10% жителей.