Бактериальная инфекция: как распознать и предотвратить?
Время сезонных простуд, гриппа и ОРВИ не заставило себя ждать, и, к сожалению, неокрепшему организму ребёнка еще трудно противостоять этим болезням. Если у ребенка появился жар, насморк и болит горло, возникает вопрос: что является причиной заболевания – бактерия или вирус? Про признаки вирусной инфекции мы рассказывали здесь, сегодня же поговорим о бактериальных инфекциях.
Признаки бактериальной инфекции и ее лечение
В отличие от вирусов, нуждающихся в носителе, бактерии – это полноценные одноклеточные микроорганизмы, способные существовать самостоятельно. Они есть везде – в земле, воде, воздухе, на нашей коже и внутри нас, при этом большинство бактерий для человека безвредны, а некоторые даже полезны, например микрофлора кишечника.
Однако существуют и опасные для нас бактерии. Симптомы, которыми проявляется бактериальная инфекция, распространяются только на какую-то конкретную часть тела, а не на весь организм.
Общий признак бактериальных инфекций: состояние здоровья без лечения ухудшается. Вылечить бактериальную инфекцию можно только медикаментозно.
В зависимости от типа инфекции, ее локализации, иммунитета больного, состояния его здоровья, а также используемых лекарств, заболевание может длиться от 5 до 14 дней. Общим признаком бактериальных инфекций является то, что с течением времени состояние здоровья без лечения ухудшается. Вылечить бактериальную инфекцию можно только медикаментозно – антибиотиками.
Вылечить бактериальную инфекцию можно только медикаментозно – антибиотиками.
При первых симптомах подозрения на бактериальную инфекцию необходимо показать ребенка врачу.
Виды бактериальной инфекции
Среди бактериальных инфекций выделим опасные для детей пневмококковую и менингококковую. Пневмококковая инфекция – это тяжелое заболевание, в основном, у детей до двух лет, протекает в виде менингитов, пневмоний, отитов и др. Пневмококк часто присутствует на слизистых оболочках, где он может затаиться и выжидать удобного момента для атаки на организм.
Дети до пяти лет могут болеть пневмококковыми инфекциями многократно.
В настоящее время ученым известно примерно 80 разных типов пневмококковой инфекции, некоторые из которых являются представителями микрофлоры дыхательных путей человека. Основная особенность пневмококка – это специфическая оболочка, защищающая микроорганизм и препятствующая выработке иммунитета к заболеваниям, которые он вызывает. Именно поэтому дети до пяти лет могут болеть пневмококковыми инфекциями многократно.
Кроме того, бактерия передается при чихании и кашле ее носителя и может проникать в спинномозговую жидкость, кровь и другие среды, вызывая самые разные заболевания. Особенно подвержены таким недугам маленькие дети, иммунитет которых недостаточно силен для борьбы с пневмококком, а также пожилые люди старше 60 лет.
Менингококковая инфекция – это острое инфекционное заболевание, причиной которого является бактерия Neisseria meningitidis.
В настоящее время основным методом профилактики является активная иммунизация – вакцинация.
Основой эффективного лечения является ранняя диагностика заболевания, которая позволяет начать лечебные мероприятия максимально быстро, чтобы спасти жизнь и здоровье человека. Возбудитель менингококковой инфекции постоянно циркулирует среди различных возрастных групп населения, но наибольшую эпидемическую опасность для окружающих представляют бактерионосители. Считается, что на одного больного приходится 1200 бактерионосителей. Чаще носителями являются взрослые, даже не подозревая об этом, а болеют преимущественно дети..png)
Профилактика бактериальных инфекций
В настоящее время основным методом профилактики является активная иммунизация – вакцинация. Несколько лет назад пневмококковая прививка в России не была обязательной профилактической мерой и проводилась только в отдельных случаях: например, детям, страдающим различными хроническими заболеваниями (бронхитами, заболеваниями сердца и т.д.), сахарным диабетом, ВИЧ-инфицированным и т.д. Однако на фоне роста количества заболеваний, вызванных пневмококком, а также ухудшения эпидемиологической ситуации в стране, было принято решение внести пневмококковую прививку в Национальный календарь прививок, начиная с 2014 года.
Промывайте солевым раствором нос ребенку после прихода с улицы или из общественных мест, чтобы удалить вирусы и бактерии с поверхности слизистой оболочки.
Дети дошкольного возраста чаще всего заражаются бактериальной инфекцией в детских садах, торговых и развлекательных центрах, а иногда и дома от простуженных родителей.
Поэтому промывайте солевым раствором нос ребенку после прихода с улицы или из общественных мест, чтобы удалить вирусы и бактерии с поверхности слизистой оболочки. Также приучите его мыть руки после прогулки, перед едой и соблюдать правила гигиены (например, при пользовании кулером не пить из одного стаканчика воду с кем-то, даже если это лучший друг).
***
Бактериальная и вирусная инфекция. Об отличиях рассказал врач
Если обратиться к статистике, то инфекции – самая частая причина обращения за медицинской помощью. Спровоцировать их могут различные патогены: вирусы, бактерии, грибки и др. Вирусы и бактерии могут стать причиной клинически схожих инфекций, но ситуации требуют разного лечения. Чем бактериальная и вирусная инфекция отличаются?
Основы микробиологии
Бактерии – одноклеточные микроорганизмы, поражающие разнообразием.
Человеческий микробиом насчитывает сотни видов бактерий и каждый выполняет определенные функции, например, сдерживают рост патогенных микроорганизмов, поддерживают обменные процессы и многое другое. Известно, что лишь 1% бактерий вызывают болезни.
Вирусы – еще меньше чем бактерии, для нормальной жизнедеятельности нуждаются в клетках хозяина, где они могут жить и развиваться. Некоторые вирусы могут уничтожать клетки, где они развиваются.
Способы передачи
В путях передачи инфекций много общего. Основной путь передачи — от человека к человеку при близком контакте, например, при поцелуях.
Контакт с биологическими жидкостями человека, например, во время полового акта, при кашле и чихании. Так передаются не только вирусные инфекции, например, ВИЧ, ОРВИ и новая коронавирусная инфекция, но и бактериальные. Некоторые вирусы и бактерии передаются при соприкосновении с зараженными поверхностями, где вирусы и бактерии живут в биологических средах.
Клиническая картина
Вирусы и бактерии вызывают схожие болезни по симптомам: лихорадка, насморк, кашель, головная боль, слабость и снижение работоспособности. Но при детальном рассмотрении и изучении найдется и масса отличий, которые заметит только врач.
Вирусные инфекции распространены в большей степени, поэтому, при появлении симптомов, часто предполагают именно ее. Дифференцировать одно от другого помогают следующие отличия и критерии:
- Инкубационный период у вирусов более короткий, в сравнении с бактериями. Например, у бактериальных инфекций – симптомы появляются спустя 7-10-14 дней после заражения, а иногда и больше. Вирусные инфекции проявляются через 1-5 дней после заражения.
- Клиническая картина вирусных инфекций более четкая, все характерные симптомы проявляются буквально сразу или между их появлением короткий промежуток времени. Если говорить о бактериальной инфекции, то они развиваются медленнее, но с полным набором симптомов.

Вирусные инфекции могут поражать здорового человека, а вот бактериальные развиваются на фоне ослабленного иммунитета или же являются осложнением перенесенного заболевания.
Конечно, главное отличие – способы и методы специфического лечения. Антибиотики никак не действуют на вирусы, а противовирусные на бактерии.
Особенности диагностики
В медицине существует такое понятие, как дифференциальный диагноз – методы диагностики, которые помогут отличить одно заболевание от другого со схожей клинической картиной. Бактериальные и вирусные инфекции способны вызывать респираторные заболевания, и чтобы определить причину, проводят дифференциальный диагноз – анализ симптомов.
Например, выделения из носа при вирусных инфекциях жидкие, прозрачные, часто носят серозный характер. А вот при бактериальных – густые, могут иметь желтый или зеленый оттенок, что говорит о наличии гнойного процесса.
Естественной реакцией организма на проникновение вируса или бактерии является повышение температуры тела. При вирусной инфекции температура повышается резко и быстро,может держаться несколько дней. При бактериальной инфекции — постепенно и начало болезни сложно проследить.
При вирусной инфекции температура повышается резко и быстро,может держаться несколько дней. При бактериальной инфекции — постепенно и начало болезни сложно проследить.
При вирусных инфекциях сложно определить область поражения. Пациенты отмечают, что болит сразу все: горло, грудь, мышцы, голова. Однако при бактериальной инфекции легко определить область поражения: болит горло при ангине, боль в груди при бронхите, боль при мочеиспускании при циститах и др.
Длительность болезни также варьируется. Например, при вирусной инфекции улучшение наступает на 5-7 день болезни, а вот бактериальные инфекции протекают длительнее.
Особенности диагностики
В большинстве случаев, поставить предварительный диагноз удается на основе жалоб, внешнего и инструментального осмотра. Некоторые вирусные и бактериальные инфекции имеют весьма специфичные симптомы. При постановке диагноза учитывают еще и данные об эпидемиологической обстановке.
Но все же чаще при бактериальных инфекциях требуются дополнительные методы обследования, в том числе и лабораторные. В соответствии с этим, врач обязательно назначает следующие анализы:
В соответствии с этим, врач обязательно назначает следующие анализы:
- общий анализ крови;
- изучение слизи, выделяемой мокроты, других выделений и мазков;
- анализ мочи, стула;
- соскоб кожи;
- изучение спинномозговой жидкости при тяжелом течении болезни.
При бактериальных инфекциях такие исследования проводятся с целью определения вида возбудителя, а также его антибиотикочувствительности.
Особенности лечения
Вирусные и бактериальные инфекции – совершенно разные диагнозы, имеющие особенности клинического течения, а также лечения. И, в случае ошибки при назначении лечения, повышается вероятность осложнений, развития основного заболевания. Иногда это представляет угрозу для здоровья и жизни.
Лечение бактериальных инфекций
Антибиотики – группа лекарств, назначаемых исключительно при лечении бактериальных инфекций. Существует разные виды антибиотиков, которые направленно действуют на бактерии определенного класса или же широкого спектра. При формировании острых заболеваний с серьезным и быстрым течением могут назначаться антибиотики широкого спектра действия, а после, когда результаты по определению антибиотикочувствительности дадут результат, могут назначаться узкоспециализированные лекарства.
При формировании острых заболеваний с серьезным и быстрым течением могут назначаться антибиотики широкого спектра действия, а после, когда результаты по определению антибиотикочувствительности дадут результат, могут назначаться узкоспециализированные лекарства.
Неконтролируемый, необоснованный прием антибиотиков, когда пациент бросает их пить раньше срока, это может привести к формированию антибиотикоустойчивой флоры и в дальнейшем лечение окажется неэффективным.
Лечение вирусных инфекций
Для многих вирусных инфекций нет специфического лечения. Обычно разрабатывается симптоматическое, направленное на устранение симптомов, снижения температуры. Но все же лечение определяется конкретным вирусом и болезнью, которое он спровоцировал.
При вирусных инфекциях врач назначает противовирусные препараты, которые подавляют жизненный цикл некоторых вирусов.
Ну и главное, стоит помнить, что некоторые серьезные бактериальные и вирусные инфекции можно предотвратить при помощи вакцинации.
Будьте здоровы!
Автор: Алена Парецкая, врач-иммунолог
Проблема бактериальных осложнений при респираторных вирусных инфекциях
ОБЗОРКлючевые слова: вирус, грипп, инфекция, вторичная бактериальная инфекция, вторичная пневмония, интерферон
doi: 10.18527/2500-2236-2018-5-1-1-11
Получена: 2018-04-10 Принята к печати: 2018-05-20 Опубликована: 2018-06-22
А. Ю. Егоров1,2#
Принадлежность авторов1 Университет природных ресурсов и естественных наук, Вена, Австрия
2 ФГБНУ «Научно-исследовательский институт вакцин и сывороток им. И. И. Мечникова», Москва, Российская Федерация
И. И. Мечникова», Москва, Российская Федерация
# Для корреспонденции: Андрей Юрьевич Егоров, e-mail: [email protected]
Разнообразные респираторные вирусы многократно поражают каждого человека в течение жизни и являются фактором риска развития бактериальных осложнений. Наиболее опасным среди возбудителей острых респираторных вирусных заболеваний является вирус гриппа А, способный вызывать катастрофические пандемии, высокая смертность при которых в значительной степени обусловлена вторичной бактериальной пневмонией. В многочисленных исследованиях последних лет показано, что независимо от типа респираторного вируса основным механизмом провоцирования бактериальных инфекций является несбалансированный ответ системы врожденного противовирусного иммунитета – избыточный интерфероновый ответ и неконтролируемое воспаление. Вероятность тяжелых бактериальных осложнений при острых респираторных вирусных инфекциях определяется как вирулентностью самого вируса, так и составом респираторной микробиоты в момент вирусного заражения, а также генетическими особенностями организма и наличием хронических заболеваний, влияющих на регуляцию системы врожденного иммунного ответа. В данном обзоре суммированы современные представления о механизмах развития бактериальных осложнений, следующих за вирусной инфекцией, и возможностях их предотвращения.
В данном обзоре суммированы современные представления о механизмах развития бактериальных осложнений, следующих за вирусной инфекцией, и возможностях их предотвращения.
Every person in the course of lifetime is repeatedly infected by a variety of respiratory viruses that represent the risk factors for the development of bacterial complications. The most dangerous among the etiological factors of acute respiratory viral diseases is the influenza A virus. This virus is capable to cause catastrophic pandemics with high mortality mainly due to the secondary bacterial pneumonia. As it has been shown in numerous recent studies, the main mechanism of provoking bacterial infections irrespective of the type of respiratory virus is the unbalanced response of the antiviral innate immunity — excessive interferon response and uncontrolled inflammation. The probability of severe bacterial complications in the course of acute respiratory viral infections is determined by both the virulence of the virus itself and by the composition of the respiratory microbiota at the time of the viral infection, as well as by the genetic characteristics of the organism. Occurrence of severe bacterial complications is also affected by the chronic diseases that have an impact on the regulation of the innate immune response. This review summarizes the current conception of the mechanisms of development of the post viral bacterial complications as well as the possibilities of prevention of these complications.
Occurrence of severe bacterial complications is also affected by the chronic diseases that have an impact on the regulation of the innate immune response. This review summarizes the current conception of the mechanisms of development of the post viral bacterial complications as well as the possibilities of prevention of these complications.
Введение
По оценкам Всемирной организации здравоохранения (ВОЗ), от острых респираторных вирусных инфекций (ОРВИ) умирает 3,9 млн человек в год [1]. Эти инфекции затрагивают все возрастные группы, но особенно влияют на здоровье детей, а также людей пожилого возраста и имеющих хронические заболевания. Опасность ОРВИ определяется их способностью провоцировать как вирусную пневмонию, так и вторичные бактериальные осложнения, такие как пневмония, отит, менингит, а также хронические легочные заболевания. Так, именно респираторные вирусы вовлечены примерно в 50% случаев внебольничной пневмонии (ВБП) у детей и провоцируют более 90% случаев бронхиолита у младенцев и 85−95% случаев обострения астмы у детей. У взрослых, вне пандемического гриппозного периода, ОРВИ определяют 30−50% случаев ВБП, 80% обострений астмы и 20−60% обострений хронического обструктивного заболевания легких (ХОБЛ). В целом, ОРВИ являются одной из пяти главных причин смертности во всем мире, а во многих развивающихся странах − главной причиной смертности детей в возрасте до 5 лет.
У взрослых, вне пандемического гриппозного периода, ОРВИ определяют 30−50% случаев ВБП, 80% обострений астмы и 20−60% обострений хронического обструктивного заболевания легких (ХОБЛ). В целом, ОРВИ являются одной из пяти главных причин смертности во всем мире, а во многих развивающихся странах − главной причиной смертности детей в возрасте до 5 лет.
В отличие от других респираторных вирусов, вирус гриппа А представляет наибольшую опасность для человека, поскольку циркулирует среди различных видов животных и способен к реассортации геномных фрагментов, что становится причиной смены основных поверхностных антигенов вируса – гемагглютинина (НА) и нейраминидазы (NA) – и носит название антигенного шифта. Именно механизм реассортации лежит в основе появления обновленных антигенных вариантов вируса гриппа А (h2N1, h3N2, h4N2, h2N1pdm09), вызвавших 4 известные пандемии [2, 3].
В межпандемический период вирусы гриппа также претерпевают антигенные изменения, вызываемые постепенным накоплением мутаций в HA и NA (антигенный дрейф), что является причиной сезонных эпидемий.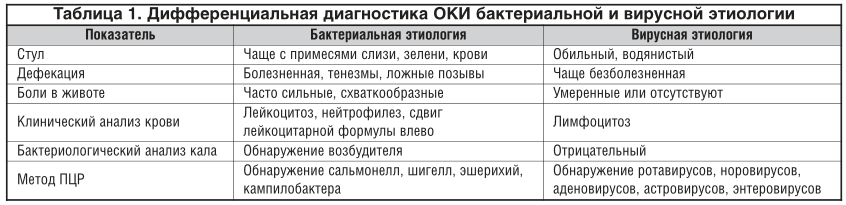
Даже в начале ХХI века, при наличии противогриппозных препаратов и антибиотиков широкого спектра действия, для людей, заболевших сезонным гриппом, существует вероятность развития вирус-индуцированного острого респираторного дистресс-синдрома (ОРДС) в течение первой недели после инфицирования или вторичной бактериальной пневмонии на 6−7 сутки после начала вирусного заболевания. По данным ВОЗ, грипп ежегодно вызывает до 650 000 смертей во всем мире. В США, с населением порядка 300 млн человек, по данным Центров по контролю и профилактике заболеваний (Centers for Disease Control and Prevention, CDC, Атланта, США), смертность от гриппа колеблется в пределах 16 000−56 000 случаев ежегодно. В Российской Федерации, с населением 146 млн человек, статистика смертности от гриппа в открытых официальных источниках отсутствует, однако, по заявлениям представителей надзорных органов, случаи смерти от гриппа исчисляются несколькими сотнями в год при сезонных вспышках заболеваемости. Различия в данных по смертности от гриппа в разных странах могут определяться методикой учета этиологического фактора как причины смерти. Например, статистика смертности от бактериальных пневмоний может не учитывать роль вирусного этиологического фактора как провокатора вторичной инфекции. Таким образом, лица, умершие от бактериальных пневмоний, могут не учитываться в статистике смертности от гриппа, даже если бактериальное осложнение было спровоцировано первичной гриппозной инфекцией.
Например, статистика смертности от бактериальных пневмоний может не учитывать роль вирусного этиологического фактора как провокатора вторичной инфекции. Таким образом, лица, умершие от бактериальных пневмоний, могут не учитываться в статистике смертности от гриппа, даже если бактериальное осложнение было спровоцировано первичной гриппозной инфекцией.
Грипп в отсутствие антибиотиков, антивирусных препаратов и вакцин
Пандемия, вызванная вирусом гриппа A(h2N1) в конце первой мировой войны (1918 г.) и получившая название «испанка», была самой масштабной из когда-либо зарегистрированных: заражению подверглось 50% населения Земли, а погибло около 50 млн человек [4]. Основной группой людей, пострадавших от этой пандемии, были лица в возрасте 20−40 лет, призванные в армию. Следует отметить, что во время «испанки», в начале XX века, этиологический агент заболевания еще не был известен: вирус гриппа открыли только в 1933 году. Микробиологи того времени пытались связать испанский грипп с различными бактериальными агентами и, в частности, с Haemophilus influenzae (H. influenzae) [5]. В настоящее время, благодаря технологии ПЦР, оказалось возможным идентифицировать гены вируса гриппа в патологоанатомических и гистологических препаратах того времени и реконструировать вирус гриппа 1918 года подтипа h2N1 с помощью методов обратной генетики. Как ни странно, не было выявлено радикальных отличий в генетической структуре вируса гриппа, вызвавшего «испанку», от вируса гриппа того же подтипа, циркулирующего в человеческой популяции в настоящее время [6]. При исследовании патологоанатомических материалов в более чем 90% образцов тканей легкого людей, умерших от гриппа в период пандемии, выявлены признаки бактериальной инфекции [7-9]. Оказалось, что 95% летальных исходов были следствием бактериальной пневмонии, а не первичной вирусной пневмонии. В частности, основным инфекционным агентом диагностированных пневмоний оказалась бактерия Streptococcus pneumoniae (S. pneumoniae) [10]. По результатам вскрытий, S. pneumoniae обнаружен в легких у 44% и в крови у 33% умерших во время «испанки» [10, 11].
influenzae) [5]. В настоящее время, благодаря технологии ПЦР, оказалось возможным идентифицировать гены вируса гриппа в патологоанатомических и гистологических препаратах того времени и реконструировать вирус гриппа 1918 года подтипа h2N1 с помощью методов обратной генетики. Как ни странно, не было выявлено радикальных отличий в генетической структуре вируса гриппа, вызвавшего «испанку», от вируса гриппа того же подтипа, циркулирующего в человеческой популяции в настоящее время [6]. При исследовании патологоанатомических материалов в более чем 90% образцов тканей легкого людей, умерших от гриппа в период пандемии, выявлены признаки бактериальной инфекции [7-9]. Оказалось, что 95% летальных исходов были следствием бактериальной пневмонии, а не первичной вирусной пневмонии. В частности, основным инфекционным агентом диагностированных пневмоний оказалась бактерия Streptococcus pneumoniae (S. pneumoniae) [10]. По результатам вскрытий, S. pneumoniae обнаружен в легких у 44% и в крови у 33% умерших во время «испанки» [10, 11].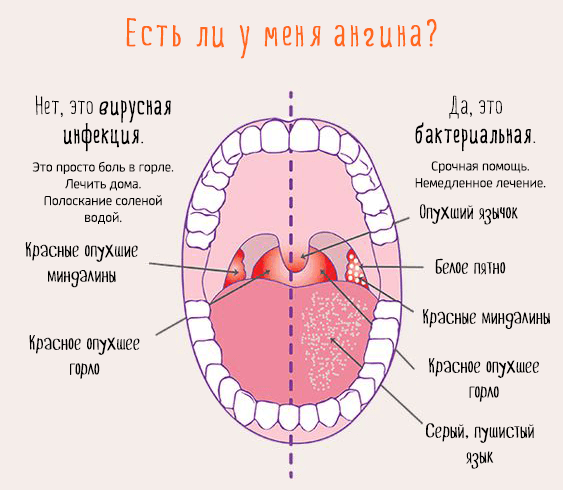 При доминировании S. pneumoniae в образцах легких идентифицированы также Staphylococcus aureus (S. aureus), H. influenzae и другие представители Streptococcus spp. [5, 7]. Таким образом, катастрофические последствия пандемии 1918 г. могли определяться отсутствием вакцины и специфических препаратов против вируса гриппа, а также антибиотиков, способных подавить вторичные бактериальные осложнения.
При доминировании S. pneumoniae в образцах легких идентифицированы также Staphylococcus aureus (S. aureus), H. influenzae и другие представители Streptococcus spp. [5, 7]. Таким образом, катастрофические последствия пандемии 1918 г. могли определяться отсутствием вакцины и специфических препаратов против вируса гриппа, а также антибиотиков, способных подавить вторичные бактериальные осложнения.
Пандемический грипп в эпоху антибиотиков при отсутствии вакцинации и противовирусных препаратов
В 1957 г. пандемия азиатского гриппа затронула 40−50% людей во всем мире. Причиной стал штамм вируса гриппа A (h3N2) [12]. Глобальные оценки смертности колеблются между 1,5 и 4 млн человек [13], число погибших в США оценивается в 69 800 [13-15]. При анализе постмортальных образцов бактериальная инфекция выявлена в 80% тяжелых случаев и летальных исходов [8, 16, 17]. Следует отметить, что в развитых странах к этому времени уже применялись такие антибиотики, как пенициллин и стрептомицин. Тем не менее, во время этой пандемии в США и многих других странах наблюдалось увеличение числа госпитализаций, связанных с пневмонией, преимущественно вызванной S. pneumoniae, H. influenzae и S. aureus [18]. Аналогичные данные представлены в отчетах из Нидерландов, где из 148 проанализированных летальных исходов, предположительно вызванных азиатским гриппом, 75% были ассоциированы с бактериальной пневмонией, вызванной в 59% случаев S. aureus и в 15% − S. pneumoniae [16]. Возможно, приведенные данные бактериологического обследования могли быть сильно искажены, поскольку многие пациенты уже принимали антибиотики [19].
Тем не менее, во время этой пандемии в США и многих других странах наблюдалось увеличение числа госпитализаций, связанных с пневмонией, преимущественно вызванной S. pneumoniae, H. influenzae и S. aureus [18]. Аналогичные данные представлены в отчетах из Нидерландов, где из 148 проанализированных летальных исходов, предположительно вызванных азиатским гриппом, 75% были ассоциированы с бактериальной пневмонией, вызванной в 59% случаев S. aureus и в 15% − S. pneumoniae [16]. Возможно, приведенные данные бактериологического обследования могли быть сильно искажены, поскольку многие пациенты уже принимали антибиотики [19].
В течение 1968−1969 гг. от пандемии гонконгского гриппа, вызванной вирусом гриппа A (h4N2), во всем мире погибло около 2 млн человек [20, 21]. В частности, в 1969 году в Великобритании был зарегистрирован 55%‑ый рост смертности от респираторных инфекций, большинство из которых ассоциировалось со вторичной бактериальной пневмонией [22]. Стафилококковая пневмония оказалась основной причиной осложненного течения гриппа, вызванного гонконгским штаммом. Например, из 129 обследованных взрослых с диагнозом «пандемический грипп» пневмония была установлена у 16%, из которых 40% случаев (6% всех 129 случаев гриппа) были смертельными. S. aureus или Pseudomonas aeruginosa (P. aeruginosa) присутствовали в 75% постмортальных образцов [23]. Интересно, что при пандемии «испанки» доминирующим патогеном, ассоциированным с пневмонией и летальными исходами, был S. pneumoniae, а при пандемиях 1957 г. и 1968 г. превалирующим этиологическим агентом вторичных бактериальных пневмоний был стафилококк. Возможной причиной этого могло быть широкое применение антибиотиков и, как следствие, развитие антибиотикорезистентности именно у S. aureus.
Стафилококковая пневмония оказалась основной причиной осложненного течения гриппа, вызванного гонконгским штаммом. Например, из 129 обследованных взрослых с диагнозом «пандемический грипп» пневмония была установлена у 16%, из которых 40% случаев (6% всех 129 случаев гриппа) были смертельными. S. aureus или Pseudomonas aeruginosa (P. aeruginosa) присутствовали в 75% постмортальных образцов [23]. Интересно, что при пандемии «испанки» доминирующим патогеном, ассоциированным с пневмонией и летальными исходами, был S. pneumoniae, а при пандемиях 1957 г. и 1968 г. превалирующим этиологическим агентом вторичных бактериальных пневмоний был стафилококк. Возможной причиной этого могло быть широкое применение антибиотиков и, как следствие, развитие антибиотикорезистентности именно у S. aureus.
Пандемия гриппа в условиях наличия противогриппозных вакцин, антивирусных препаратов и антибиотиков
В 2009 году вспышка гриппа, вызванная штаммом A(h2N1)pdm09, в течение 4 недель распространилась на 41 страну [20, 24].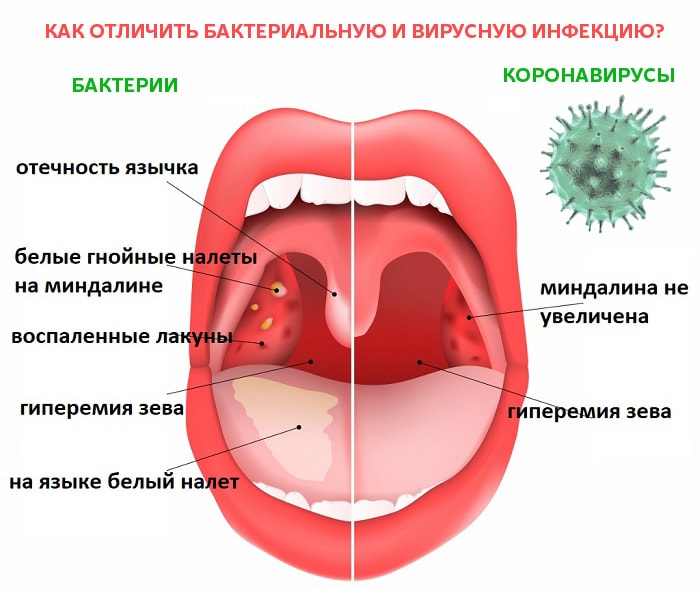 Варианты сезонных гриппозных вакцин, выпущенных в сезон 2009 года, не соответствовали по компоненту h2 антигенным свойствам вновь появившегося пандемического штамма. Считается, что во всем мире эпидемия привела к гибели 284 000 человек [25]. В США во время пандемии гриппа 2009 года частыми причинами смерти также были вторичные бактериальные инфекции, в основном S. pneumoniae и S. pyogenes [26, 27]. Американские исследователи выявили, что 77 летальных исходов в период с мая по август 2009 года были ассоциированы с бактериальными инфекциями почти в 30% случаев, 46% из которых были вызваны S. pneumoniae, 9% – S. aureus и 1% – H. influenzae. Palacios et al. исследовали образцы носоглоточных мазков почти у 200 больных пандемическим гриппом: H. influenzae обнаружена в 52%, S. pneumoniae – в 31% и S. aureus – в 18% образцов [28]. Тяжесть заболевания наиболее часто коррелировала с выделением S. pneumoniae.
Варианты сезонных гриппозных вакцин, выпущенных в сезон 2009 года, не соответствовали по компоненту h2 антигенным свойствам вновь появившегося пандемического штамма. Считается, что во всем мире эпидемия привела к гибели 284 000 человек [25]. В США во время пандемии гриппа 2009 года частыми причинами смерти также были вторичные бактериальные инфекции, в основном S. pneumoniae и S. pyogenes [26, 27]. Американские исследователи выявили, что 77 летальных исходов в период с мая по август 2009 года были ассоциированы с бактериальными инфекциями почти в 30% случаев, 46% из которых были вызваны S. pneumoniae, 9% – S. aureus и 1% – H. influenzae. Palacios et al. исследовали образцы носоглоточных мазков почти у 200 больных пандемическим гриппом: H. influenzae обнаружена в 52%, S. pneumoniae – в 31% и S. aureus – в 18% образцов [28]. Тяжесть заболевания наиболее часто коррелировала с выделением S. pneumoniae.
В исследовании 838 критически больных детей в США показано, что в течение 72 ч после госпитализации в отделение интенсивной терапии у 33% детей развивалась бактериальная суперинфекция. При этом 48% выделенных патогенов относились к метициллинрезистентным штаммам S. aureus (methicillin-resistant S. aureus, MRSA), 5,5% – к S. pneumoniae и 5% – к H. influenzae [29].
Таким образом, несмотря на широкое внедрение сезонных гриппозных вакцин, противовирусных препаратов и антибиотиков, проблема бактериальных осложнений при гриппе не потеряла актуальности. Более того, развитие резистентности бактериальной флоры к современным антибиотикам может обострить эту проблему при новой пандемии гриппа [30].
Респираторные вирусные инфекции негриппозной этиологии как триггеры вторичных бактериальных пневмоний
Современное состояние диагностики позволяет проводить анализ бактериальных осложнений при различных респираторных инфекциях негриппозной этиологии. В Таблице 1 суммированы результаты многочисленных исследований, в которых прослежена взаимосвязь возбудителей респираторных вирусных инфекций с определенными бактериальными патогенами, ассоциированными с такими осложнениями, как пневмония, отит, синусит и менингит. Несмотря на отсутствие пандемического потенциала, другие представители респираторных вирусов оказались не менее опасными триггерами вторичных бактериальных осложнений, чем вирусы гриппа. Например, представитель семейства Paramyxoviridae метапневмовирус человека (hMPV) по тяжести осложнений не уступает вирусу гриппа. Осложнения включают как вирусную пневмонию с развитием ОРДС, так и вторичную бактериальную пневмонию [31]. Другой представитель этого семейства – респираторно-синцитиальный вирус (respiratory syncytial virus, RSV) – оказался более опасным, чем возбудитель гриппа, по параметру смертности пациентов, госпитализированных с диагнозом «пневмония». Оказалось, что смертность от всех причин через 20 суток после госпитализации среди пациентов с RSV инфекцией (18,4%) выше, чем среди пациентов с гриппом (6,7%) [32].
В Таблице 1 суммированы результаты многочисленных исследований, в которых прослежена взаимосвязь возбудителей респираторных вирусных инфекций с определенными бактериальными патогенами, ассоциированными с такими осложнениями, как пневмония, отит, синусит и менингит. Несмотря на отсутствие пандемического потенциала, другие представители респираторных вирусов оказались не менее опасными триггерами вторичных бактериальных осложнений, чем вирусы гриппа. Например, представитель семейства Paramyxoviridae метапневмовирус человека (hMPV) по тяжести осложнений не уступает вирусу гриппа. Осложнения включают как вирусную пневмонию с развитием ОРДС, так и вторичную бактериальную пневмонию [31]. Другой представитель этого семейства – респираторно-синцитиальный вирус (respiratory syncytial virus, RSV) – оказался более опасным, чем возбудитель гриппа, по параметру смертности пациентов, госпитализированных с диагнозом «пневмония». Оказалось, что смертность от всех причин через 20 суток после госпитализации среди пациентов с RSV инфекцией (18,4%) выше, чем среди пациентов с гриппом (6,7%) [32]. К сожалению, для профилактики и лечения пневмовирусов отсутствуют вакцины и эффективные противовирусные препараты, как и для большинства респираторных вирусов негриппозной этиологии.
К сожалению, для профилактики и лечения пневмовирусов отсутствуют вакцины и эффективные противовирусные препараты, как и для большинства респираторных вирусов негриппозной этиологии.
Таблица 1. Респираторные вирусы и ассоциированные с ними бактериальные вторичные инфекции
|
Вирус |
Ассоциируемая вторичная инфекция* |
Ссылка |
|
Вирус гриппа |
S. pneumoniae, S. aureus, Staphylococcus pyogenes, H. influenzae, Moraxella catarrhalis, Neisseria meningitidis |
[7], [33-40] |
|
RSV |
S. pneumoniae |
[41] |
|
Аденовирус |
S. Moraxella catarrhalis |
[42] |
|
Риновирус человека |
S. pneumoniae, S. aureus, H. influenzae, Moraxella catarrhalis |
[43-45] |
|
Вирус парагриппа |
Moraxella catarrhalis, S. pneumoniae |
[46] |
|
hMPV |
S. pneumoniae |
[47] |
* Указаны патогены, которые чаще всего идентифицируют у больных с осложненным течением вирусной инфекции.
Исследования, проведенные в различных регионах мира, при общности выводов о связи вирусных и бактериальных инфекций могут различаться по выводам о роли различных патогенов в развитии ВБП, поскольку климатические условия и генетические особенности населения могут существенно влиять на распространенность того или иного вирусного и бактериального возбудителя.
В проведенном в США исследовании участвовало 1024 пациента с ВБП и 759 пациентов без выраженных симптомов [48]. Оказалось, что вирусы гриппа, RSV, hMPV, а также, в меньшей степени, вирусы парагриппа и коронавирусы существенно чаще встречались в группе больных пневмонией, независимо от возраста пациентов. В то же время риновирусы были частой причиной ВБП у взрослых, но практически не встречались при пневмонии у детей, тогда как аденовирусы ассоциировались с ВБП только у детей младше 2 лет.
В исследовании, проведенном в Японии, участвовало 2617 пациентов с пневмонией – в основном пожилые люди (старше 65 лет) с хроническими респираторными или другими сопутствующими заболеваниями. Вирусные патогены были обнаружены в 23,1% случаев [49]. Риновирусы были наиболее частой причиной развития пневмонии (9,8%), а вирусы гриппа и RSV встречались в 3,9% случаев каждый. RSV наиболее часто выявляли у лиц с хроническими заболеваниями респираторного тракта, в то время как другие вирусы ассоциировались с пневмонией независимо от наличия респираторных и других хронических заболеваний. В целом, вирусные инфекции не предопределяли повышенный риск смертности у больных пневмонией, однако в случае хронических респираторных заболеваний гриппозная инфекция ассоциировалась с увеличением смертности пациентов в 3 раза. Таким образом, вклад вирусной инфекции в смертность от пневмонии зависит от типа вирусного агента и наличия сопутствующих заболеваний.
В целом, вирусные инфекции не предопределяли повышенный риск смертности у больных пневмонией, однако в случае хронических респираторных заболеваний гриппозная инфекция ассоциировалась с увеличением смертности пациентов в 3 раза. Таким образом, вклад вирусной инфекции в смертность от пневмонии зависит от типа вирусного агента и наличия сопутствующих заболеваний.
Корейское мета-аналитическое исследование, проведенное на 5298 пациентах различных возрастных групп, показывает, что провокация бактериальной суперинфекции характерна для всех представителей вирусных респираторных инфекций [50], однако вид бактериального возбудителя вторичной инфекции может зависеть как от типа вирусной инфекции, так и от возраста пациента. Например, у взрослых инфекция вирусом гриппа А и В, риновирусом и hMPV прежде всего вызывала пневмонию, ассоциированную с S. aureus, тогда как инфекции, вызванные коронавирусом, вирусом парагриппа и RSV, осложнялись пневмонией, связанной с грамотрицательными бактериями Klebsiella spp. и Acinetobacter spp. У детей наиболее частой причиной возникновения бактериальной пневмонии независимо от типа предшествующего вируса была микоплазменная инфекция (Mycoplasma pneumonia, M. pneumonia). На основании результатов этого исследования можно судить о значимости дифференциальной вирусологической диагностики при вторичной бактериальной пневмонии с точки зрения назначения антибиотикотерапии. Например, для лечения вторичной пневмонии у младенцев и детей, скорее всего, подойдут антибиотики с активностью против M. pneumoniae (макролиды), взрослым, перенесшим грипп, hMPV или риновирусную инфекцию, − антистафилококковые препараты, а после инфекции коронавирусом и вирусом парагриппа − антибиотики против широкого спектра грамотрицательных бактерий.
и Acinetobacter spp. У детей наиболее частой причиной возникновения бактериальной пневмонии независимо от типа предшествующего вируса была микоплазменная инфекция (Mycoplasma pneumonia, M. pneumonia). На основании результатов этого исследования можно судить о значимости дифференциальной вирусологической диагностики при вторичной бактериальной пневмонии с точки зрения назначения антибиотикотерапии. Например, для лечения вторичной пневмонии у младенцев и детей, скорее всего, подойдут антибиотики с активностью против M. pneumoniae (макролиды), взрослым, перенесшим грипп, hMPV или риновирусную инфекцию, − антистафилококковые препараты, а после инфекции коронавирусом и вирусом парагриппа − антибиотики против широкого спектра грамотрицательных бактерий.
Как отмечено выше, региональные особенности генотипа населения, климата и спектра колонизующей микробной флоры диктуют необходимость проведения подобных наблюдательных исследований в различных странах мира для разработки адекватных медицинских стандартов лечения респираторных инфекций.
Патогенез вторичных бактериальных инфекций при ОРВИ
Человеческий организм является носителем разнообразных бактериальных видов, в совокупности именуемых микробиотой [51]. В норме эти бактерии считаются так называемыми комменсальными штаммами, живущими во взаимовыгодном симбиозе с хозяином и обеспечивающими разнообразные полезные функции, например, защиту организма за счет конкуренции с патогенными штаммами. Обычно небольшие количества патогенных бактерий, включая S. pneumoniae, S. aureus, H. influenzae, S. pyogenes, Moraxella catarrhalis и MRSA, присутствуют в микробиоте верхних отделов респираторного тракта человека без серьезных последствий для организма [52]. Нарушение состава микробиоты в сторону увеличения патогенной флоры может происходить при вирусных респираторных инфекциях за счет подавления факторов антибактериальной защиты. В связи с этим вторичные бактериальные инфекции респираторного тракта чаще всего не нуждаются в заражении организма патогенными бактериями извне, а являются результатом спровоцированной вирусом колонизации [53, 54].
В настоящее время известно множество патогенетических факторов, способствующих бактериальной колонизации при вирусной инфекции, которые включают следующие:
- Нарушение целостности слизистых оболочек под воздействием вирусных и бактериальных ферментов, например NA вируса гриппа [55].
- Усиление бактериальной адгезии на инфицированные вирусом клетки [54, 56, 57].
- Нарушение функции цилиарного эпителия при вирусной инфекции, снижающей способность слизистых оболочек респираторного тракта к самоочищению [58, 59].
- Индукция интерферонов I, II и III типов (IFN) и цитокинов, снижающих эффективность антибактериального иммунитета [60-64].
- Нарушение антибактериальной активности нейтрофилов и макрофагов за счет уменьшения их количества и фагоцитарной активности в очаге вирусной инфекции [65-67].
Действие большинства перечисленных факторов может зависеть не только от особенностей вирусного возбудителя, но и от колонизующей бактерии..gif) Например, известно, что S. aureus может усиливать вирусную репродукцию, негативно воздействуя на передачу сигнала IFN I типа путем препятствования образованию димера STAT-1–STAT-2 [68]. При RSV-инфекции тяжесть заболевания у детей может определяться превалированием S. pneumoniae и H. influenza в микробиоте перед началом вирусного заболевания [69].
Например, известно, что S. aureus может усиливать вирусную репродукцию, негативно воздействуя на передачу сигнала IFN I типа путем препятствования образованию димера STAT-1–STAT-2 [68]. При RSV-инфекции тяжесть заболевания у детей может определяться превалированием S. pneumoniae и H. influenza в микробиоте перед началом вирусного заболевания [69].
Тем не менее, в экспериментах на животных и в клинических исследованиях четко показано, что чаще всего триггерами колонизации респираторного тракта патогенной бактериальной флорой служат вирусные инфекции. Первичное заражение мышей сублетальными дозами бактерий с последующим заражением сублетальной дозой вируса гриппа не приводило к вторичной бактериальной пневмонии, в то время как обратная последовательность заражения вызывала пневмонию с летальным исходом [70-72]. Замечено, что как у зараженных вирусами животных, так и при ОРВИ у людей бактериальная суперинфекция чаще всего развивается на 4−7 сутки после вирусной инфекции или клинической манифестации вирусной инфекции соответственно [42, 73]. В этой закономерности, независимо от типа вирусного возбудителя, особую роль играет IFN I типа, фокусирующий систему врожденного иммунитета на борьбу с вирусной инфекцией, но при этом снижающий функцию факторов антибактериальной защиты, таких как фагоцитоз или выработка антибактериальных пептидов.
В этой закономерности, независимо от типа вирусного возбудителя, особую роль играет IFN I типа, фокусирующий систему врожденного иммунитета на борьбу с вирусной инфекцией, но при этом снижающий функцию факторов антибактериальной защиты, таких как фагоцитоз или выработка антибактериальных пептидов.
Роль интерферонового ответа в патогенезе вторичных бактериальных инфекций
Несмотря на различия в структурной и генетической организации вирусов различных семейств, их объединяет общее свойство: все они представляют собой внутриклеточные патогены и индукторы IFN ответа. Система врожденного иммунитета распознает вирусную инфекцию с помощью встроенных в цитоплазматическую мембрану клеток Toll-подобных или цитоплазматических RIG-1 и MDA5 паттерн-распознающих рецепторов (pattern recognition receptors, PRRs), ответственных за обнаружение в очаге инфекции компонентов патогенов, атипичных для нормальных клеток, таких как двуспиральные РНК (dsRNA) или липополисахариды (LPS). Распознавание вирусной инфекции приводит к индукции цитокинового ответа, и прежде всего IFN I, II и III типов. Система врожденного противовирусного иммунитета подробно описана в обзорах [74, 75]. Защитная функция IFN обусловлена двумя основными факторами: способностью индуцировать синтез множества противовирусных белков в зараженных и окружающих их клетках и иммуномодулирующими функциями, влияющими на миграцию и активацию клеток врожденного иммунитета и определяющими развитие специфического В- и Т-клеточного иммунного ответа [76-78].
Распознавание вирусной инфекции приводит к индукции цитокинового ответа, и прежде всего IFN I, II и III типов. Система врожденного противовирусного иммунитета подробно описана в обзорах [74, 75]. Защитная функция IFN обусловлена двумя основными факторами: способностью индуцировать синтез множества противовирусных белков в зараженных и окружающих их клетках и иммуномодулирующими функциями, влияющими на миграцию и активацию клеток врожденного иммунитета и определяющими развитие специфического В- и Т-клеточного иммунного ответа [76-78].
В тоже время получено множество экспериментальных и клинических данных, согласно которым IFN ответ при ОРВИ может нести повреждающую функцию. При прогрессирующем развитии инфекции продолжительная и избыточная продукция IFN может приводить к развитию воспаления в связи с гиперпродукцией хемокинов, таких как CCL2 и CXCL10, и инфильтрацией альвеол провоспалительными моноцитами/макрофагами и плазмоцитоидными дендритными клетками. При этом попадание в зону воспаления вирусных и бактериальных лигандов Toll-подобных рецепторов, например липополисахарида LPS или dsRNA, может приводить к усиленной выработке этими клетками провоспалительных цитокинов, крайним проявлением которой может явиться так называемый цитокиновый шторм [79]. При этом интенсивность повреждения легких может зависеть не столько от интенсивности вирусной репродукции, сколько от неконтролируемой выработки провоспалительных цитокинов и чрезмерной инфильтрации тканей легкого клетками врожденного иммунитета [80, 81].
При этом интенсивность повреждения легких может зависеть не столько от интенсивности вирусной репродукции, сколько от неконтролируемой выработки провоспалительных цитокинов и чрезмерной инфильтрации тканей легкого клетками врожденного иммунитета [80, 81].
Индуцируемая IFN типа I экспрессия проапоптотического лиганда TRIAL также приводит к массовому апоптозу эпителиальных клеток, способствующему развитию ОРДС [82].
Существенным фактором риска развития неконтролируемого воспаления является генетическая предрасположенность организма к регуляции IFN ответа. Например, у мышей линии DBA, продуцирующих в ответ на гриппозную инфекцию высокие уровни IFN I типа, летальная инфекция развивается при заражении дозами, безопасными для мышей линии С57BL/6 с умеренной выработкой IFN [83, 84].
У людей с синдромом Дауна выявлена повышенная чувствительность к респираторным инфекциям и высокая вероятность тяжелых осложнений, сопряжённых с генетически обусловленной гиперпродукцией IFN α/γ в ответ на вирусную инфекцию [85].
Кроме стимуляции цитокинового шторма, IFN I типа могут быть вовлечены в патогенез вторичной бактериальной инфекции [86, 87]. В частности, развитие IFN ответа при вирусной инфекции приводит к снижению миграции и фагоцитирующей функции нейтрофилов и макрофагов через проапоптотические механизмы или на уровне эпигенетической регуляции их функций [61, 88, 89].
IFN первого типа также способны подавлять антибактериальную защиту за счет ингибирования продукции Т-клетками IL-17 [63, 90]. Одним из последствий отсутствия IL-17 ответа является снижение выработки антибактериальных пептидов, таких как липокалин 2 и BPIFA1, что также приводит к усилению роста числа бактерий в очаге вирусной инфекции [87].
Существенным доказательством негативного действия избыточной экспрессии IFN является тот факт, что генетически модифицированные мыши, дефицитные по рецепторам IFN типа I (IFNAR), оказались более устойчивы к развитию ОРДС, бактериальной пневмонии или сепсиса по сравнению с мышами, имеющими нормальный IFN сигналинг [61, 62, 84, 91, 92]. Применение индуктора IFN poly (I:C) перед заражением мышей пневмококком приводило к 100-кратному усилению колонизации легких введенными бактериями [64].
Применение индуктора IFN poly (I:C) перед заражением мышей пневмококком приводило к 100-кратному усилению колонизации легких введенными бактериями [64].
Таким образом, возможность развития тяжелых осложнений при ОРВИ может зависеть не только от вирулентности самого вируса или состава респираторной микробиоты в момент вирусного заражения, но и от способности организма регулировать интенсивность реакций системы врожденного иммунитета, одним из основных звеньев которого является IFN ответ.
Роль противовирусной вакцинации и антивирусной терапии в предотвращении вторичных бактериальных осложнений
В настоящее время имеются многочисленные свидетельства того, что противовирусная вакцинация может являться мерой снижения риска бактериальных осложнений при ОРВИ. В случае гриппозной инфекции в опытах на животных было показано, что иммунизация инактивированной гриппозной вакциной, вызывающая антительный ответ к HA и NA, достоверно снижает тяжесть бактериальной суперинфекции у мышей [93]. В другом исследовании было показано, что иммунизация мышей инактивированной или живой гриппозной вакциной может в равной степени снизить летальность при вирусном и последующем бактериальном заражении, не ограничивая, однако, при этом рост S. pyogenes в легких. В этом случае было показано, что противогриппозная вакцинация позволяла, за счет снижения вирусной нагрузки, снижать индукцию провоспалительных цитокинов и IFNγ в легких при бактериальной суперинфекции [94]. К сожалению, имеется мало сведений о влиянии противогриппозной вакцинации у людей на вторичные бактериальные осложнения, что вызвано сложностью организации таких исследований, требующих параллельной оценки предшествующего противовирусного и противобактериального иммунитета к большому количеству потенциальных патогенов. Тем не менее, в ограниченном исследовании было показано, что гриппозная вакцина снижала частоту заболеваемости, связанной с S. pyogenes, у военных рекрутов в США [95]. Аналогично при вакцинации детей живой холодоадаптированной вакциной наблюдалось снижение частоты развития среднего отита [96].
В другом исследовании было показано, что иммунизация мышей инактивированной или живой гриппозной вакциной может в равной степени снизить летальность при вирусном и последующем бактериальном заражении, не ограничивая, однако, при этом рост S. pyogenes в легких. В этом случае было показано, что противогриппозная вакцинация позволяла, за счет снижения вирусной нагрузки, снижать индукцию провоспалительных цитокинов и IFNγ в легких при бактериальной суперинфекции [94]. К сожалению, имеется мало сведений о влиянии противогриппозной вакцинации у людей на вторичные бактериальные осложнения, что вызвано сложностью организации таких исследований, требующих параллельной оценки предшествующего противовирусного и противобактериального иммунитета к большому количеству потенциальных патогенов. Тем не менее, в ограниченном исследовании было показано, что гриппозная вакцина снижала частоту заболеваемости, связанной с S. pyogenes, у военных рекрутов в США [95]. Аналогично при вакцинации детей живой холодоадаптированной вакциной наблюдалось снижение частоты развития среднего отита [96].
Таким образом, вакцинация против респираторных вирусов может способствовать предотвращению вторичных бактериальных осложнений, по-видимому, за счет различных механизмов неспецифической защиты, обусловленной модуляцией системы врожденного иммунитета. Резонно предположить, что ограничение вирусной репродукции вследствие эффективной вакцинации может приводить к ограничению противовирусного IFN ответа и нивелированию негативного действия IFN на эффекторы антибактериальной защиты. Кроме того, снижение вирусной нагрузки может позитивно сказываться на сохранности респираторного эпителия и уменьшении индукции факторов адгезии для бактериальных клеток [56].
Подобные неспецифические механизмы, связанные с уменьшением вирусной нагрузки, могут лежать и в основе действия противовирусных препаратов, например ингибиторов NA вируса гриппа. Исследования, проведенные на животных моделях, свидетельствуют о том, что ингибиторы нейраминидазы способны снизить восприимчивость инфицированных вирусом гриппа животных к вторичной бактериальной пневмонии [97]. Данные о снижении частоты бронхитов и необходимости назначения антибиотиков были получены и в ходе нескольких клинических испытаний эффективности ингибиторов NA (занамивир и оселтамивир) у взрослых и детей [98-101].
Данные о снижении частоты бронхитов и необходимости назначения антибиотиков были получены и в ходе нескольких клинических испытаний эффективности ингибиторов NA (занамивир и оселтамивир) у взрослых и детей [98-101].
Заключение
Успехи медицины последних десятилетий, связанные с открытием антибиотиков и разработкой вакцин против вирусов и бактерий, заметно уменьшили вероятность повторения катастрофической пандемии испанского гриппа 1918 г., когда бактериальные суперинфекции оказались основной причиной смертности [102]. Тем не менее, вирусы гриппа и другие респираторные вирусы остаются одной из основных причин бактериальных осложнений и частой этиологической причиной ВБП. Тревожным аспектом является нарастание резистентности бактериальных патогенов к современным антибиотикам вследствие их массового применения.
К сожалению, относительные успехи в разработке гриппозных вакцин и противогриппозных препаратов практически не распространяются на другие респираторные вирусы, которые, как было показано выше, также являются инфекционными агентами, провоцирующими вторичные бактериальные осложнения. Несмотря на прогресс в разработке пневмококковых и других антибактериальных вакцин и множественные усилия в создании вакцин против респираторных вирусов, трудно предположить, что в обозримом будущем будет создана система эффективной сочетанной вакцинации против основных вирусных и бактериальных респираторных патогенов. Невелика и вероятность создания специфических противовирусных препаратов против разных групп респираторных вирусов, существенно влияющих на вирусную нагрузку, особенно при их позднем применении. Такая ситуация диктует необходимость поиска патогенетических препаратов, направленных на предотвращение реакций врожденного иммунитета при вирусных инфекциях, ведущих к ослаблению факторов антибактериальной защиты. Одним из возможных подходов может явиться поиск препаратов, предотвращающих избыточную выработку IFN на пике вирусной инфекции. Демпфирование избыточного IFN сигналинга может явиться терапевтическим подходом к предотвращению как эффектов цитокинового шторма, так и развития вторичных бактериальных осложнений в анатомических зонах, примыкающих к респираторному тракту [79, 82, 103-105].
Несмотря на прогресс в разработке пневмококковых и других антибактериальных вакцин и множественные усилия в создании вакцин против респираторных вирусов, трудно предположить, что в обозримом будущем будет создана система эффективной сочетанной вакцинации против основных вирусных и бактериальных респираторных патогенов. Невелика и вероятность создания специфических противовирусных препаратов против разных групп респираторных вирусов, существенно влияющих на вирусную нагрузку, особенно при их позднем применении. Такая ситуация диктует необходимость поиска патогенетических препаратов, направленных на предотвращение реакций врожденного иммунитета при вирусных инфекциях, ведущих к ослаблению факторов антибактериальной защиты. Одним из возможных подходов может явиться поиск препаратов, предотвращающих избыточную выработку IFN на пике вирусной инфекции. Демпфирование избыточного IFN сигналинга может явиться терапевтическим подходом к предотвращению как эффектов цитокинового шторма, так и развития вторичных бактериальных осложнений в анатомических зонах, примыкающих к респираторному тракту [79, 82, 103-105].
Благодарности
Исследования проводились при финансовой поддержке РНФ-FWF: грант № 18-45-05002 по теме «Вирусоподобные частицы для борьбы с постгриппозными бактериальными инфекциями»; получен в рамках конкурса «Проведение фундаментальных научных исследований и поисковых научных исследований международными научными коллективами».
Конфликт интересов
Автор не преследует коммерческих или финансовых интересов.
А. Егоров. Проблема бактериальных осложнений при респираторных вирусных инфекциях. MIR J, 2018; 5(1), 1-11, doi: 10.18527/2500-2236-2018-5-1-1-11.
Авторские права
© 2018 Егоров. Эта статья публикуется в свободном доступе в соответствии с лицензией Creative Commons AttributionNonCommercial-ShareAlike 4.0 International Public License (CC BY-NC-SA), которая позволяет неограниченное использование, распространение и воспроизведение на любых носителях при условии, что указываются автор и источник публикации, а материал не используется в коммерческих целях..jpg)
1. Battle against Respiratory Viruses (BRaVe) initiative. World Health Organization. Available: http://www.who.int/influenza/patient_care/clinical/brave/en/#; http://www.who.int/mediacentre/factsheets/fs211/en
2. Kilbourne ED. Influenza pandemics of the 20th century. Emerg Infect Dis 2006; 12(1), 9-14. doi: 10.3201/eid1201.051254.
3. Cheng VC, To KK, Tse H, Hung IF, Yuen KY. Two years after pandemic influenza A/2009/h2N1: what have we learned? Clin Microbiol Rev 2012; 25(2), 223-63. doi: 10.1128/CMR.05012-11.
4. Oxford JS, Sefton A, Jackson R, Innes W, Daniels RS, Johnson NP. World War I may have allowed the emergence of “Spanish” influenza. Lancet Infect Dis 2002; 2(2), 111-4. PubMed PMID: 11901642.
5. Brem WV, Bolling GE, Casper EJ. Pandemic ‘influenza’ and secondary pneumonia at Camp Fremont Calif. J Am Med Assoc 1918; 71, 2138-44. doi: 10.1001/jama.1918.26020520007010b.
6. Taubenberger JK, Baltimore D, Doherty PC, Markel H, Morens DM, Webster RG, et al. Reconstruction of the 1918 influenza virus: unexpected rewards from the past. MBio 2012; 3(5). doi: 10.1128/mBio.00201-12.
Reconstruction of the 1918 influenza virus: unexpected rewards from the past. MBio 2012; 3(5). doi: 10.1128/mBio.00201-12.
7. Morris DE, Cleary DW, Clarke SC. Secondary Bacterial Infections Associated with Influenza Pandemics. Front Microbiol 2017; 8, 1041. doi: 10.3389/fmicb.2017.01041.
8. Morens DM, Taubenberger JK, Fauci AS. Predominant role of bacterial pneumonia as a cause of death in pandemic influenza: implications for pandemic influenza preparedness. J Infect Dis 2008; 198(7), 962-70. doi: 10.1086/591708.
9. Chien YW, Klugman KP, Morens DM. Bacterial pathogens and death during the 1918 influenza pandemic. N Engl J Med 2009; 361(26), 2582-3. doi: 10.1056/NEJMc0908216.
10. Brundage JF, Shanks GD. Deaths from bacterial pneumonia during 1918-19 influenza pandemic. Emerg Infect Dis 2008; 14(8), 1193-9. doi: 10.3201/eid1408.071313.
11. Win MK, Chen MI, Barkham T, Lin C, Tan A, Lin R, et al. Influenza disease burden in adults by subtypes following the initial epidemic of pandemic h2N1 in Singapore. Influenza Other Respir Viruses 2011; 5(6), e563-7. doi: 10.1111/j.1750-2659.2011.00282.x.
Influenza Other Respir Viruses 2011; 5(6), e563-7. doi: 10.1111/j.1750-2659.2011.00282.x.
12. Potter CW. A history of influenza. J Appl Microbiol 2001; 91(4), 572-9. PubMed PMID: 11576290.
13. Viboud C, Simonsen L, Fuentes R, Flores J, Miller MA, Chowell G. Global Mortality Impact of the 1957-1959 Influenza Pandemic. J Infect Dis 2016; 213(5), 738-45. doi: 10.1093/infdis/jiv534.
14. Eickhoff TC, Sherman IL, Serfling RE. Observations on excess mortality associated with epidemic influenza. JAMA 1961; 176, 776-82. PubMed PMID: 13726091.
15. Hilleman MR. Realities and enigmas of human viral influenza: pathogenesis, epidemiology and control. Vaccine 2002; 20(25-26), 3068-87. PubMed PMID: 12163258.
16. Hers JF, Masurel N, Mulder J. Bacteriology and histopathology of the respiratory tract and lungs in fatal Asian influenza. Lancet 1958; 2(7057), 1141-3. PubMed PMID: 13612141.
17. Gill JR, Sheng ZM, Ely SF, Guinee DG, Beasley MB, Suh J, et al. Pulmonary pathologic findings of fatal 2009 pandemic influenza A/h2N1 viral infections. Arch Pathol Lab Med 2010; 134(2), 235-43. doi: 10.1043/1543-2165-134.2.235.
Pulmonary pathologic findings of fatal 2009 pandemic influenza A/h2N1 viral infections. Arch Pathol Lab Med 2010; 134(2), 235-43. doi: 10.1043/1543-2165-134.2.235.
18. Petersdorf RG, Fusco JJ, Harter DH, Albrink WS. Pulmonary infections complicating Asian influenza. AMA Arch Intern Med 1959; 103(2), 262-72. PubMed PMID: 13616762.
19. Robertson L, Caley JP, Moore J. Importance of Staphylococcus aureus in pneumonia in the 1957 epidemic of influenza A. Lancet 1958; 2(7040), 233-6. PubMed PMID: 13564806.
20. Michaelis M, Doerr HW, Cinatl J, Jr. Novel swine-origin influenza A virus in humans: another pandemic knocking at the door. Med Microbiol Immunol 2009; 198(3), 175-83. doi: 10.1007/s00430-009-0118-5.
21. Klimov A, Simonsen L, Fukuda K, Cox N. Surveillance and impact of influenza in the United States. Vaccine 1999; 17 Suppl 1, S42-6. PubMed PMID: 10471179.
22. Tillett HE, Smith JW, Gooch CD. Excess deaths attributable to influenza in England and Wales: age at death and certified cause. Int J Epidemiol 1983; 12(3), 344-52. PubMed PMID: 6629624.
Int J Epidemiol 1983; 12(3), 344-52. PubMed PMID: 6629624.
23. Lindsay MI, Jr., Herrmann EC, Jr., Morrow GW, Jr., Brown AL, Jr. Hong Kong influenza: clinical, microbiologic, and pathologic features in 127 cases. JAMA 1970; 214(10), 1825-32. PubMed PMID: 5537337.
24. Wang TT, Palese P. Unraveling the mystery of swine influenza virus. Cell 2009; 137(6), 983-5. doi: 10.1016/j.cell.2009.05.032.
25. Chertow DS, Memoli MJ. Bacterial coinfection in influenza: a grand rounds review. JAMA 2013; 309(3), 275-82. doi: 10.1001/jama.2012.194139.
26. Lee EH, Wu C, Lee EU, Stoute A, Hanson H, Cook HA, et al. Fatalities associated with the 2009 h2N1 influenza A virus in New York city. Clin Infect Dis 2010; 50(11), 1498-504. doi: 10.1086/652446.
27. Lucas S. Predictive clinicopathological features derived from systematic autopsy examination of patients who died with A/h2N1 influenza infection in the UK 2009-10 pandemic. Health Technol Assess 2010; 14(55), 83-114. doi: 10.3310/hta14550-02.
doi: 10.3310/hta14550-02.
28. Palacios G, Hornig M, Cisterna D, Savji N, Bussetti AV, Kapoor V, et al. Streptococcus pneumoniae coinfection is correlated with the severity of h2N1 pandemic influenza. PLoS One 2009; 4(12), e8540. doi: 10.1371/journal.pone.0008540.
29. Randolph AG, Vaughn F, Sullivan R, Rubinson L, Thompson BT, Yoon G, et al. Critically ill children during the 2009-2010 influenza pandemic in the United States. Pediatrics 2011; 128(6), e1450-8. doi: 10.1542/peds.2011-0774.
30. Zhivich A. Fighting bacterial resistance: approaches, challenges, and opportunities in the search for new antibiotics. Part 1. Antibiotics used in clinical practice: mechanisms of action and the development of bacterial resistance. MIR J 2017; 4(1), 31-51. doi: 10.18527/2500-2236-2017-4-1-31-51.
31. Hasvold J, Sjoding M, Pohl K, Cooke C, Hyzy RC. The role of human metapneumovirus in the critically ill adult patient. J Crit Care 2016; 31(1), 233-7. doi: 10.1016/j.jcrc. 2015.09.035.
2015.09.035.
32. Kwon YS, Park SH, Kim MA, Kim HJ, Park JS, Lee MY, et al. Risk of mortality associated with respiratory syncytial virus and influenza infection in adults. BMC Infect Dis 2017; 17(1), 785. doi: 10.1186/s12879-017-2897-4.
33. Prasso JE, Deng JC. Postviral Complications: Bacterial Pneumonia. Clin Chest Med 2017; 38(1), 127-38. doi: 10.1016/j.ccm.2016.11.006.
34. Metersky ML, Masterton RG, Lode H, File TM, Jr., Babinchak T. Epidemiology, microbiology, and treatment considerations for bacterial pneumonia complicating influenza. Int J Infect Dis 2012; 16(5), e321-31. doi: 10.1016/j.ijid.2012.01.003.
35. Mulcahy ME, McLoughlin RM. Staphylococcus aureus and Influenza A Virus: Partners in Coinfection. MBio 2016; 7(6). doi: 10.1128/mBio.02068-16.
36. Safaeyan F, Nahaei MR, Seifi SJ, Kafil HS, Sadeghi J. Quantitative detection of Staphylococcus aureus, Streptococcus pneumoniae and Haemophilus influenzae in patients with new influenza A (h2N1)/2009 and influenza A/2010 virus infection. GMS Hyg Infect Control 2015; 10, Doc06. doi: 10.3205/dgkh000249.
GMS Hyg Infect Control 2015; 10, Doc06. doi: 10.3205/dgkh000249.
37. Jennings LC, Anderson TP, Beynon KA, Chua A, Laing RT, Werno AM, et al. Incidence and characteristics of viral community-acquired pneumonia in adults. Thorax 2008; 63(1), 42-8. doi: 10.1136/thx.2006.075077.
38. Liderot K, Ahl M, Ozenci V. Secondary bacterial infections in patients with seasonal influenza A and pandemic h2N1. Biomed Res Int 2013; 2013, 376219. doi: 10.1155/2013/376219.
39. Chonmaitree T, Jennings K, Golovko G, Khanipov K, Pimenova M, Patel JA, et al. Nasopharyngeal microbiota in infants and changes during viral upper respiratory tract infection and acute otitis media. PLoS One 2017; 12(7), e0180630. doi: 10.1371/journal.pone.0180630.
40. Jacobs JH, Viboud C, Tchetgen ET, Schwartz J, Steiner C, Simonsen L, et al. The association of meningococcal disease with influenza in the United States, 1989-2009. PLoS One 2014; 9(9), e107486. doi: 10.1371/journal.pone.0107486.
41. Brealey JC, Chappell KJ, Galbraith S, Fantino E, Gaydon J, Tozer S, et al. Streptococcus pneumoniae colonization of the nasopharynx is associated with increased severity during respiratory syncytial virus infection in young children. Respirology 2018; 23(2), 220-7. doi: 10.1111/resp.13179.
Brealey JC, Chappell KJ, Galbraith S, Fantino E, Gaydon J, Tozer S, et al. Streptococcus pneumoniae colonization of the nasopharynx is associated with increased severity during respiratory syncytial virus infection in young children. Respirology 2018; 23(2), 220-7. doi: 10.1111/resp.13179.
42. Hendaus MA, Jomha FA, Alhammadi AH. Virus-induced secondary bacterial infection: a concise review. Ther Clin Risk Manag 2015; 11, 1265-71. doi: 10.2147/TCRM.S87789.
43. Louie JK, Roy-Burman A, Guardia-Labar L, Boston EJ, Kiang D, Padilla T, et al. Rhinovirus associated with severe lower respiratory tract infections in children. Pediatr Infect Dis J 2009; 28(4), 337-9. doi: 10.1097/INF.0b013e31818ffc1b.
44. Mallia P, Footitt J, Sotero R, Jepson A, Contoli M, Trujillo-Torralbo MB, et al. Rhinovirus infection induces degradation of antimicrobial peptides and secondary bacterial infection in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2012; 186(11), 1117-24. doi: 10.1164/rccm.201205-0806OC.
doi: 10.1164/rccm.201205-0806OC.
45. Kloepfer KM, Lee WM, Pappas TE, Kang TJ, Vrtis RF, Evans MD, et al. Detection of pathogenic bacteria during rhinovirus infection is associated with increased respiratory symptoms and asthma exacerbations. J Allergy Clin Immunol 2014; 133(5), 1301-7, 7 e1-3. doi: 10.1016/j.jaci.2014.02.030.
46. Korppi M, Leinonen M, Makela PH, Launiala K. Bacterial involvement in parainfluenza virus infection in children. Scand J Infect Dis 1990; 22(3), 307-12. PubMed PMID: 2164707.
47. Verkaik NJ, Nguyen DT, de Vogel CP, Moll HA, Verbrugh HA, Jaddoe VW, et al. Streptococcus pneumoniae exposure is associated with human metapneumovirus seroconversion and increased susceptibility to in vitro HMPV infection. Clin Microbiol Infect 2011; 17(12), 1840-4. doi: 10.1111/j.1469-0691.2011.03480.x.
48. Self WH, Williams DJ, Zhu Y, Ampofo K, Pavia AT, Chappell JD, et al. Respiratory Viral Detection in Children and Adults: Comparing Asymptomatic Controls and Patients With Community-Acquired Pneumonia. J Infect Dis 2016; 213(4), 584-91. doi: 10.1093/infdis/jiv323.
J Infect Dis 2016; 213(4), 584-91. doi: 10.1093/infdis/jiv323.
49. Katsurada N, Suzuki M, Aoshima M, Yaegashi M, Ishifuji T, Asoh N, et al. The impact of virus infections on pneumonia mortality is complex in adults: a prospective multicentre observational study. BMC Infect Dis 2017; 17(1), 755. doi: 10.1186/s12879-017-2858-y.
50. Jung HS, Kang BJ, Ra SW, Seo KW, Jegal Y, Jun JB, et al. Elucidation of Bacterial Pneumonia-Causing Pathogens in Patients with Respiratory Viral Infection. Tuberc Respir Dis (Seoul) 2017; 80(4), 358-67. doi: 10.4046/trd.2017.0044.
51. Hooper LV, Littman DR, Macpherson AJ. Interactions between the microbiota and the immune system. Science 2012; 336(6086), 1268-73. doi: 10.1126/science.1223490.
52. Charlson ES, Bittinger K, Haas AR, Fitzgerald AS, Frank I, Yadav A, et al. Topographical continuity of bacterial populations in the healthy human respiratory tract. Am J Respir Crit Care Med 2011; 184(8), 957-63. doi: 10.1164/rccm.201104-0655OC.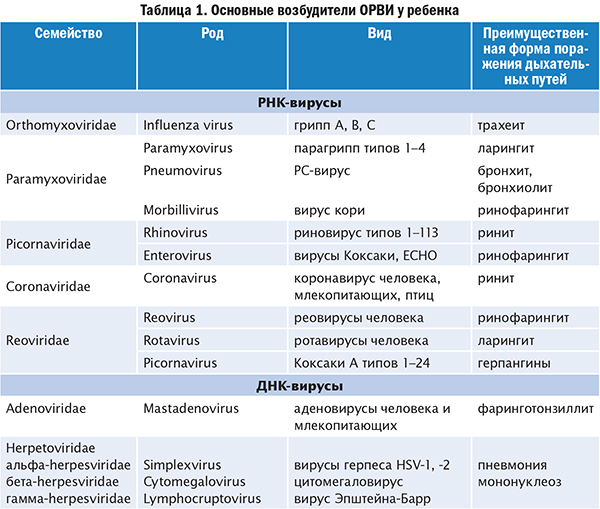
53. Bogaert D, De Groot R, Hermans PW. Streptococcus pneumoniae colonisation: the key to pneumococcal disease. Lancet Infect Dis 2004; 4(3), 144-54. doi: 10.1016/S1473-3099(04)00938-7.
54. Bosch AA, Biesbroek G, Trzcinski K, Sanders EA, Bogaert D. Viral and bacterial interactions in the upper respiratory tract. PLoS Pathog 2013; 9(1), e1003057. doi: 10.1371/journal.ppat.1003057.
55. Yang X, Steukers L, Forier K, Xiong R, Braeckmans K, Van Reeth K, et al. A beneficiary role for neuraminidase in influenza virus penetration through the respiratory mucus. PLoS One 2014; 9(10), e110026. doi: 10.1371/journal.pone.0110026.
56. Avadhanula V, Rodriguez CA, Devincenzo JP, Wang Y, Webby RJ, Ulett GC, et al. Respiratory viruses augment the adhesion of bacterial pathogens to respiratory epithelium in a viral species- and cell type-dependent manner. J Virol 2006; 80(4), 1629-36. doi: 10.1128/JVI.80.4.1629-1636.2006.
57. Li N, Ren A, Wang X, Fan X, Zhao Y, Gao GF, et al. Influenza viral neuraminidase primes bacterial coinfection through TGF-beta-mediated expression of host cell receptors. Proc Natl Acad Sci U S A 2015; 112(1), 238-43. doi: 10.1073/pnas.1414422112.
Influenza viral neuraminidase primes bacterial coinfection through TGF-beta-mediated expression of host cell receptors. Proc Natl Acad Sci U S A 2015; 112(1), 238-43. doi: 10.1073/pnas.1414422112.
58. Carson JL, Collier AM, Hu SS. Acquired ciliary defects in nasal epithelium of children with acute viral upper respiratory infections. N Engl J Med 1985; 312(8), 463-8. doi: 10.1056/NEJM198502213120802.
59. Pittet LA, Hall-Stoodley L, Rutkowski MR, Harmsen AG. Influenza virus infection decreases tracheal mucociliary velocity and clearance of Streptococcus pneumoniae. Am J Respir Cell Mol Biol 2010; 42(4), 450-60. doi: 10.1165/rcmb.2007-0417OC.
60. Sun K, Metzger DW. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection. Nat Med 2008; 14(5), 558-64. doi: 10.1038/nm1765.
61. Shahangian A, Chow EK, Tian X, Kang JR, Ghaffari A, Liu SY, et al. Type I IFNs mediate development of postinfluenza bacterial pneumonia in mice. J Clin Invest 2009; 119(7), 1910-20. doi: 10.1172/JCI35412.
J Clin Invest 2009; 119(7), 1910-20. doi: 10.1172/JCI35412.
62. Nakamura S, Davis KM, Weiser JN. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. J Clin Invest 2011; 121(9), 3657-65. doi: 10.1172/JCI57762.
63. Kudva A, Scheller EV, Robinson KM, Crowe CR, Choi SM, Slight SR, et al. Influenza A inhibits Th27-mediated host defense against bacterial pneumonia in mice. J Immunol 2011; 186(3), 1666-74. doi: 10.4049/jimmunol.1002194.
64. Tian X, Xu F, Lung WY, Meyerson C, Ghaffari AA, Cheng G, et al. Poly I:C enhances susceptibility to secondary pulmonary infections by gram-positive bacteria. PLoS One 2012; 7(9), e41879. doi: 10.1371/journal.pone.0041879.
65. Astry CL, Jakab GJ. Influenza virus-induced immune complexes suppress alveolar macrophage phagocytosis. J Virol 1984; 50(2), 287-92. PubMed PMID: 6708169.
66. Franke-Ullmann G, Pfortner C, Walter P, Steinmuller C, Lohmann-Matthes ML, Kobzik L, et al. Alteration of pulmonary macrophage function by respiratory syncytial virus infection in vitro. J Immunol 1995; 154(1), 268-80. PubMed PMID: 7995946.
Alteration of pulmonary macrophage function by respiratory syncytial virus infection in vitro. J Immunol 1995; 154(1), 268-80. PubMed PMID: 7995946.
67. Jakab GJ. Immune impairment of alveolar macrophage phagocytosis during influenza virus pneumonia. Am Rev Respir Dis 1982; 126(5), 778-82. doi: 10.1164/arrd.1982.126.5.778.
68. Warnking K, Klemm C, Loffler B, Niemann S, van Kruchten A, Peters G, et al. Super-infection with Staphylococcus aureus inhibits influenza virus-induced type I IFN signalling through impaired STAT1-STAT2 dimerization. Cell Microbiol 2015; 17(3), 303-17. doi: 10.1111/cmi.12375.
69. de Steenhuijsen Piters WA, Heinonen S, Hasrat R, Bunsow E, Smith B, Suarez-Arrabal MC, et al. Nasopharyngeal Microbiota, Host Transcriptome, and Disease Severity in Children with Respiratory Syncytial Virus Infection. Am J Respir Crit Care Med 2016; 194(9), 1104-15. doi: 10.1164/rccm.201602-0220OC.
70. Jia L, Xie J, Zhao J, Cao D, Liang Y, Hou X, et al. Mechanisms of Severe Mortality-Associated Bacterial Co-infections Following Influenza Virus Infection. Front Cell Infect Microbiol 2017; 7, 338. doi: 10.3389/fcimb.2017.00338.
Mechanisms of Severe Mortality-Associated Bacterial Co-infections Following Influenza Virus Infection. Front Cell Infect Microbiol 2017; 7, 338. doi: 10.3389/fcimb.2017.00338.
71. Jamieson AM, Pasman L, Yu S, Gamradt P, Homer RJ, Decker T, et al. Role of tissue protection in lethal respiratory viral-bacterial coinfection. Science 2013; 340(6137), 1230-4. doi: 10.1126/science.1233632.
72. Lee LN, Dias P, Han D, Yoon S, Shea A, Zakharov V, et al. A mouse model of lethal synergism between influenza virus and Haemophilus influenzae. Am J Pathol 2010; 176(2), 800-11. doi: 10.2353/ajpath.2010.090596.
73. McCullers JA. The co-pathogenesis of influenza viruses with bacteria in the lung. Nat Rev Microbiol 2014; 12(4), 252-62. doi: 10.1038/nrmicro3231.
74. Tripathi S, Garcia-Sastre A. Antiviral innate immunity through the lens of systems biology. Virus Res 2016; 218, 10-7. doi: 10.1016/j.virusres.2015.11.024.
75. Brennan K, Bowie AG. Activation of host pattern recognition receptors by viruses. Curr Opin Microbiol 2010; 13(4), 503-7. doi: 10.1016/j.mib.2010.05.007.
Curr Opin Microbiol 2010; 13(4), 503-7. doi: 10.1016/j.mib.2010.05.007.
76. Chen X, Liu S, Goraya MU, Maarouf M, Huang S, Chen JL. Host Immune Response to Influenza A Virus Infection. Front Immunol 2018; 9, 320. doi: 10.3389/fimmu.2018.00320.
77. Shim JM, Kim J, Tenson T, Min JY, Kainov DE. Influenza Virus Infection, Interferon Response, Viral Counter-Response, and Apoptosis. Viruses 2017; 9(8), 223. doi: 10.3390/v9080223.
78. Andreakos E, Salagianni M, Galani IE, Koltsida O. Interferon-lambdas: Front-Line Guardians of Immunity and Homeostasis in the Respiratory Tract. Front Immunol 2017; 8, 1232. doi: 10.3389/fimmu.2017.01232.
79. Goritzka M, Durant LR, Pereira C, Salek-Ardakani S, Openshaw PJ, Johansson C. Alpha/beta interferon receptor signaling amplifies early proinflammatory cytokine production in the lung during respiratory syncytial virus infection. J Virol 2014; 88(11), 6128-36. doi: 10.1128/JVI.00333-14.
80. Doherty PC, Turner SJ, Webby RG, Thomas PG.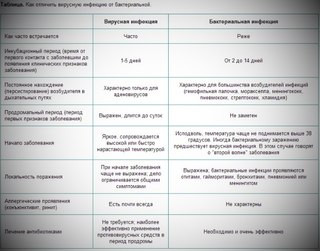 Influenza and the challenge for immunology. Nat Immunol 2006; 7(5), 449-55. doi: 10.1038/ni1343.
Influenza and the challenge for immunology. Nat Immunol 2006; 7(5), 449-55. doi: 10.1038/ni1343.
81. Peiris JS, Yu WC, Leung CW, Cheung CY, Ng WF, Nicholls JM, et al. Re-emergence of fatal human influenza A subtype H5N1 disease. Lancet 2004; 363(9409), 617-9. doi: 10.1016/S0140-6736(04)15595-5.
82. Makris S, Paulsen M, Johansson C. Type I Interferons as Regulators of Lung Inflammation. Front Immunol 2017; 8, 259. doi: 10.3389/fimmu.2017.00259.
83. Srivastava B, Blazejewska P, Hessmann M, Bruder D, Geffers R, Mauel S, et al. Host genetic background strongly influences the response to influenza a virus infections. PLoS One 2009; 4(3), e4857. doi: 10.1371/journal.pone.0004857.
84. Davidson S, Crotta S, McCabe TM, Wack A. Pathogenic potential of interferon alphabeta in acute influenza infection. Nat Commun 2014; 5, 3864. doi: 10.1038/ncomms4864.
85. Broers CJ, Gemke RJ, Weijerman ME, van der Sluijs KF, van Furth AM. Increased pro-inflammatory cytokine production in Down Syndrome children upon stimulation with live influenza A virus. J Clin Immunol 2012; 32(2), 323-9. doi: 10.1007/s10875-011-9625-4.
J Clin Immunol 2012; 32(2), 323-9. doi: 10.1007/s10875-011-9625-4.
86. Rynda-Apple A, Robinson KM, Alcorn JF. Influenza and Bacterial Superinfection: Illuminating the Immunologic Mechanisms of Disease. Infect Immun 2015; 83(10), 3764-70. doi: 10.1128/IAI.00298-15.
87. Lee B, Robinson KM, McHugh KJ, Scheller EV, Mandalapu S, Chen C, et al. Influenza-induced type I interferon enhances susceptibility to gram-negative and gram-positive bacterial pneumonia in mice. Am J Physiol Lung Cell Mol Physiol 2015; 309(2), L158-67. doi: 10.1152/ajplung.00338.2014.
88. Schliehe C, Flynn EK, Vilagos B, Richson U, Swaminanthan S, Bosnjak B, et al. The methyltransferase Setdb2 mediates virus-induced susceptibility to bacterial superinfection. Nat Immunol 2015; 16(1), 67-74. doi: 10.1038/ni.3046.
89. Kroetz DN, Allen RM, Schaller MA, Cavallaro C, Ito T, Kunkel SL. Type I Interferon Induced Epigenetic Regulation of Macrophages Suppresses Innate and Adaptive Immunity in Acute Respiratory Viral Infection. PLoS Pathog 2015; 11(12), e1005338. doi: 10.1371/journal.ppat.1005338.
PLoS Pathog 2015; 11(12), e1005338. doi: 10.1371/journal.ppat.1005338.
90. Cao J, Wang D, Xu F, Gong Y, Wang H, Song Z, et al. Activation of IL-27 signalling promotes development of postinfluenza pneumococcal pneumonia. EMBO Mol Med 2014; 6(1), 120-40. doi: 10.1002/emmm.201302890.
91. Li W, Moltedo B, Moran TM. Type I interferon induction during influenza virus infection increases susceptibility to secondary Streptococcus pneumoniae infection by negative regulation of gammadelta T cells. J Virol 2012; 86(22), 12304-12. doi: 10.1128/JVI.01269-12.
92. Dejager L, Vandevyver S, Ballegeer M, Van Wonterghem E, An LL, Riggs J, et al. Pharmacological inhibition of type I interferon signaling protects mice against lethal sepsis. J Infect Dis 2014; 209(6), 960-70. doi: 10.1093/infdis/jit600.
93. Huber VC, Peltola V, Iverson AR, McCullers JA. Contribution of vaccine-induced immunity toward either the HA or the NA component of influenza viruses limits secondary bacterial complications. J Virol 2010; 84(8), 4105-8. doi: 10.1128/JVI.02621-09.
J Virol 2010; 84(8), 4105-8. doi: 10.1128/JVI.02621-09.
94. Chaussee MS, Sandbulte HR, Schuneman MJ, Depaula FP, Addengast LA, Schlenker EH, et al. Inactivated and live, attenuated influenza vaccines protect mice against influenza: Streptococcus pyogenes super-infections. Vaccine 2011; 29(21), 3773-81. doi: 10.1016/j.vaccine.2011.03.031.
95. Lee SE, Eick A, Bloom MS, Brundage JF. Influenza immunization and subsequent diagnoses of group A streptococcus-illnesses among U.S. Army trainees, 2002-2006. Vaccine 2008; 26(27-28), 3383-6. doi: 10.1016/j.vaccine.2008.04.041.
96. Belshe RB, Gruber WC. Prevention of otitis media in children with live attenuated influenza vaccine given intranasally. Pediatr Infect Dis J 2000; 19(5 Suppl), S66-71. PubMed PMID: 10821474.
97. McCullers JA. Effect of antiviral treatment on the outcome of secondary bacterial pneumonia after influenza. J Infect Dis 2004; 190(3), 519-26. doi: 10.1086/421525.
98. Hayden FG, Osterhaus AD, Treanor JJ, Fleming DM, Aoki FY, Nicholson KG, et al. Efficacy and safety of the neuraminidase inhibitor zanamivir in the treatment of influenzavirus infections. GG167 Influenza Study Group. N Engl J Med 1997; 337(13), 874-80. doi: 10.1056/NEJM199709253371302.
Efficacy and safety of the neuraminidase inhibitor zanamivir in the treatment of influenzavirus infections. GG167 Influenza Study Group. N Engl J Med 1997; 337(13), 874-80. doi: 10.1056/NEJM199709253371302.
99. Kaiser L, Keene ON, Hammond JM, Elliott M, Hayden FG. Impact of zanamivir on antibiotic use for respiratory events following acute influenza in adolescents and adults. Arch Intern Med 2000; 160(21), 3234-40. PubMed PMID: 11088083.
100. Kaiser L, Wat C, Mills T, Mahoney P, Ward P, Hayden F. Impact of oseltamivir treatment on influenza-related lower respiratory tract complications and hospitalizations. Arch Intern Med 2003; 163(14), 1667-72. doi: 10.1001/archinte.163.14.1667.
101. Nicholson KG, Aoki FY, Osterhaus AD, Trottier S, Carewicz O, Mercier CH, et al. Efficacy and safety of oseltamivir in treatment of acute influenza: a randomised controlled trial. Neuraminidase Inhibitor Flu Treatment Investigator Group. Lancet 2000; 355(9218), 1845-50. PubMed PMID: 10866439.
102. Smith AM, Huber VC. The Unexpected Impact of Vaccines on Secondary Bacterial Infections Following Influenza. Viral Immunol 2018; 31(2), 159-73. doi: 10.1089/vim.2017.0138.
103. Zang N, Xie X, Deng Y, Wu S, Wang L, Peng C, et al. Resveratrol-mediated gamma interferon reduction prevents airway inflammation and airway hyperresponsiveness in respiratory syncytial virus-infected immunocompromised mice. J Virol 2011; 85(24), 13061-8. doi: 10.1128/JVI.05869-11.
104. Baumgarth N, Kelso A. In vivo blockade of gamma interferon affects the influenza virus-induced humoral and the local cellular immune response in lung tissue. J Virol 1996; 70(7), 4411-8. PubMed PMID: 8676464.
105. Wolf S, Johnson S, Perwitasari O, Mahalingam S, Tripp RA. Targeting the pro-inflammatory factor CCL2 (MCP-1) with Bindarit for influenza A (H7N9) treatment. Clin Transl Immunology 2017; 6(3), e135. doi: 10.1038/cti.2017.8.
Инвитро. Бактериальные инфекции, узнать цены на анализы и сдать в г.
 Бор Сифилис иммуноблот IgM (anti-Treponema pallidum IgM immunoblot)
Бор Сифилис иммуноблот IgM (anti-Treponema pallidum IgM immunoblot)Исследование IgM-антител к антигенам возбудителя сифилиса Treponema pallidum методом иммуноблота используют в качестве дополнительного специфического трепонемного теста при необходимости углубленного исследования при сомнительных результатах скрининговых и подтверждающих тестов диагностики сифилиса.
Сифилис иммуноблот IgG (anti-Treponema pallidum IgG immunoblot)Исследование IgG-антител к антигенам возбудителя сифилиса Treponema pallidum методом иммуноблота используют в качестве дополнительного специфического трепонемного теста при необходимости углубленного исследования при сомнительных результатах скрининговых и подтверждающих тестов диагностики сифилиса.
Антитела класса IgG к Borrelia burgdorferi Специфические антитела к возбудителю боррелиоза (болезни Лайма, Lyme Disease), свидетельствующие о текущей или перенесённой в прошлом инфекции.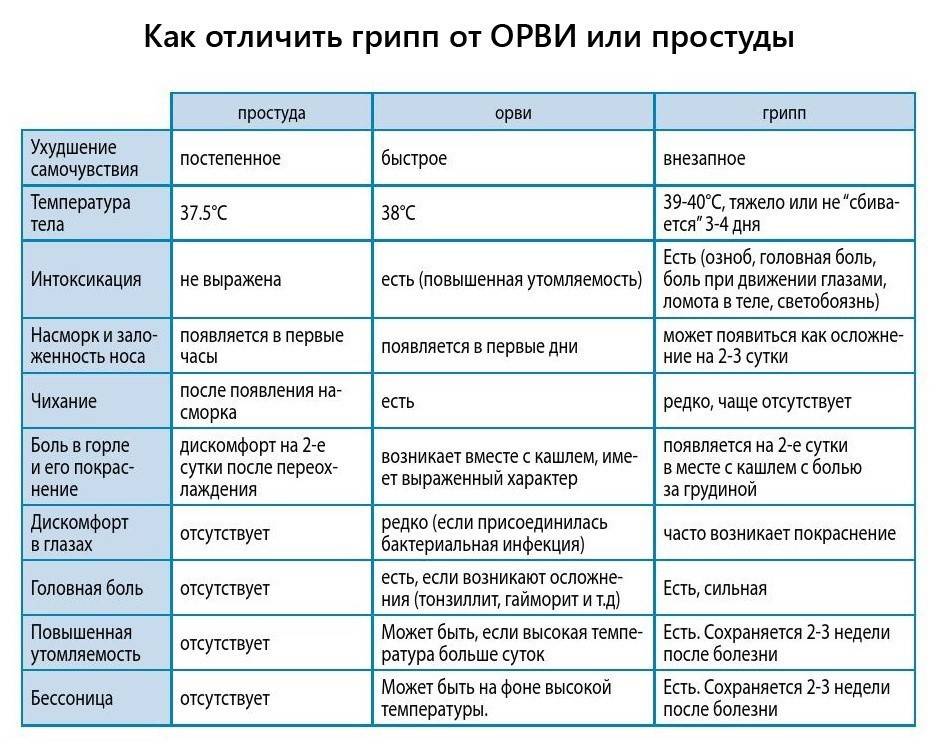
Выявление антител класса IgM к Borrelia burgdorferi, как серологического показателя ранних стадий инфекции спирохетами Borrelia, служит лабораторным подтверждением клинического диагноза Лайм-боррелиоза. Тест также можно использовать в диагностике ассоциированных с Borrelia заболеваний: хронической мигрирующей эритемы, доброкачественной лимфоцитомы кожи, атрофического акродерматита, артритов, миокардитов, перикардитов, лимфоцитарного менингорадикулоневрита, нейроборрелиоза.
Боррелии, антитела класса IgM методом Вестерн-блота (anti-Borrelia IgM, Western blot)Развернутое исследование IgM-антител к антигенам боррелий методом Вестерн-блота. Тест используют как дополнительный для подтверждения результатов ИФА методов серологической диагностики боррелиоза, при подозрении на иксодовый клещевой боррелиоз, болезнь Лайма и ассоциированные патологические состояния: хроническую мигрирующую эритему, доброкачественный кожный лимфаденоз, атрофический хронический акродерматит, артрит, кардит, нейроборрелиоз.
Выявление ДНК Neisseria gonorrhoeae в моче используется для подтверждения инфицированности при наличии клинических проявлений воспаления урогенитального тракта (в основном у мужчин), для дифференциации гоноккового и негонококкового уретрита, для контроля эффективности антибактериальной терапии.
Гонококк (Neisseria gonorrhoeae), антигенный тест, различные локализацииИммунохроматографический тест позволяет визуально и быстро определить присутствие гонорейного антигена в пробах пациента. Применяется в скрининговых исследованиях для постановки предварительного диагноза, а также для оценки эффективности ранее применяемой терапии.
Гарднерелла, определение ДНК (Gardnerella vaginalis, DNA) в мочеВыявление ДНК Gardnerella vaginalis в моче используется для подтверждения инфицированности при наличии признаков воспаления у мужчин или при проявлениях бактериального вагиноза (гарднереллеза) у женщин репродуктивного возраста.
Определение ДНК возбудителей туберкулеза методом ПЦР позволяет дифференцировать ограниченные и диссеминированные формы туберкулеза даже при отрицательных результатах микробиологических исследований. Исследование также целесообразно использовать при возникновении лихорадки, сопровождаемой ежедневным двойным повышением и понижением температуры тела, на фоне туберкулиновой гиперчувствительности или туберкулиновой анергии.
Helicobacter Pylori IgA (антитела класса IgА к Helicobacter pylori)Обнаружение IgA-антител к Helicobacter pylori указывает на местное воспаление. Анализ выполняют для диагностики хеликобактериоза у пациентов с гастритом, язвенной болезнью желудка и 12-перстной кишки, а также для мониторинга эрадикации Helicobacter pylori после проведения антибактериальной терапии.
Антитела класса IgM служат индикатором ранней инфекции Helicobacter pylori. Анализ выполняют с целью выявления причин хронического гастрита, язвенной болезни желудка и 12-перстной кишки, а также для определения степени остроты текущей инфекции.
Anti-H.pylori IgG (антитела класса IgG к Helicobacter pylori)Антитела класса IgG к Helicobacter pylori – маркер, подтверждающий инфицированность бактерией Хеликобактер пилори. Тест используют для оценки эффективности эрадикационной терапии.
Антитела к Helicobacter pyl. IgG (блот)Высокоспецифичный тест, выявляющий факт инфицирования Helicobacter pylori. Метод Вестерн-блота для определения антител к хеликобактеру пилори, в отличие от обычного ИФА, дает дифференцированные сведения о наличии антител к спектру антигенов возбудителя.
Антитела к Helicobacter pyl. IgА (блот)Высокоспецифичный тест диагностики и мониторинга инфекции Helicobacter pylori – основной причины ассоциированного гастрита и язвенной болезни желудка и 12-перстной кишки. Метод Вестерн-блота для определения антител к Helicobacter pylori, в отличие от обычного ИФА, дает дифференцированные сведения о наличии антител к спектру антигенов возбудителя.
Метод Вестерн-блота для определения антител к Helicobacter pylori, в отличие от обычного ИФА, дает дифференцированные сведения о наличии антител к спектру антигенов возбудителя.
ИНБИОФЛОР – комплексное исследование микрофлоры урогенитального тракта. Предлагаемый комплекс состоит из нескольких отдельных профилей для скрининговой оценки состава микрофлоры слизистых оболочек мочеполовой системы и мониторинга эффективности проводимой терапии. Профиль может быть использован для контроля эффективности терапии воспалительных заболеваний урогенитального тракта после установления возбудителя.
Микоплазма, определение ДНК (Mycoplasma pneumoniae, DNA) в слюнеОпределение ДНК Mycoplasma pneumoniae в биоматериале методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени» применяют для диагностики атипичной пневмонии и для оценки эффективности проводимой антибактериальной терапии.
Выявление антител класса IgM к возбудителю урогенитального микоплазмоза применяют для диагностики острой и текущей инфекции. Антитела класса IgG вырабатываются в организме человека в период выраженных клинических проявлений заболевания.
Anti-Mycoplasma pneumoniae-IgM/G (антитела класса IgM и класса IgG к Mycoplasma pneumoniae)Антитела класса IgM и класса IgG служат индикатором текущей или имевшей место в прошлом инфекции Mycoplasma pneumoniae. Антитела класса IgM, специфичные к Mycoplasma pneumonia, появляются вскоре после начала заболевания. Достоверный прирост уровня IgG антител может указывать на текущую инфекцию или реинфекцию.
Антитела класса IgA к Mycoplasma hominisТест применяют для диагностики патологических состояний, ассоциируемых с Mycoplasma hominis. Концентрация IgA в крови коррелирует с выраженностью патологического процесса на уровне слизистых оболочек.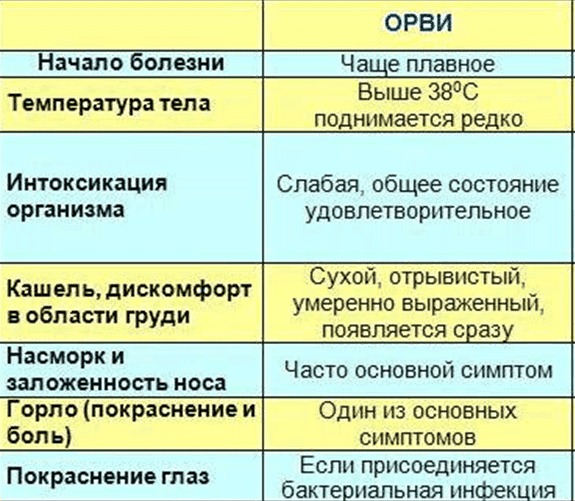
Выявление ДНК Mycoplasma hominis в моче используется для подтверждения инфицированности при наличии клинических проявлений в нижних отделах мочеполового тракта (цистит, уретрит). Может выявляться у клинически здоровых лиц.
Микоплазма, определение ДНК (Mycoplasma pneumoniae, DNA) в плазме кровиОпределение ДНК Mycoplasma pneumoniae в плазме крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени» применяют для дифференциальной диагностики микоплазменной пневмонии и других инфекционных заболеваний дыхательных путей, а также для оценки эффективности антибактериальной терапии.
Уреаплазма, определение ДНК (Ureaplasma urealyticum+parvum, DNA) в мочеВыявление ДНК Ureaplasma urealyticum + parvum в моче используется для подтверждения инфицированности при наличии характерных признаков воспаления мочеполовой системы, при стертой картине воспаления, при планировании беременности, бесплодии. Может выявляться у клинически здоровых лиц.
Может выявляться у клинически здоровых лиц.
Выявление ДНК Ureaplasma parvum в моче используется для подтверждения инфицированности при наличии характерных признаков воспаления мочеполовой системы, при стертой картине воспаления, при планировании беременности, бесплодии. Может выявляться у клинически здоровых лиц.
Уреаплазма , определение ДНК (Ureaplasma urealyticum, DNA) в мочеВыявление ДНК Ureaplasma urealyticum в моче используется для подтверждения инфицированности при наличии клинических проявлений в нижних отделах мочеполового тракта (цистит, уретрит), при стертой картине воспаления. Может выявляться у клинически здоровых лиц.
Антитела класса IgA к Ureaplasma urealyticumОбнаружение в сыворотке крови антител класса IgА к Ureaplasma urealyticum указывает на первичное инфицирование. Также их появление возможно при реинфицировании или обострении инфекции.
Антитела класса IgG – маркер текущей или перенесенной инфекции Ureaplasma urealyticum. Тест выполняют при подозрении на уреаплазмоз, в комплексе с исследованиями, направленными на выявление других патогенов при негонококковых уретритах, воспалительных заболеваниях матки и придатков, сальпингитах, бесплодии и других патологических состояниях, ассоциируемых с Ureaplasma urealyticum.
Аnti- Chlamydia tr. IgA + anti- Chlamydia tr. IgGАнтихламидийные антитела в крови – серологический маркер урогенитального хламидиоза. Антитела класса IgA к возбудителю вырабатываются в организме человека в период выраженных клинических проявлений заболевания. Антитела класса IgG являются маркером перенесенной в недавнем прошлом инфекции.
Anti-Сhlamydia tr.-IgM (Антитела класса IgМ к Chlamydia trachomatis)Антитела класса IgM появляются первыми в ходе иммунного ответа организма на проникновение инфекционного агента. Присутствие в крови IgM-антител к Chlamydia trachomatis наблюдается в раннем периоде заболевания или в начале обострения хронического процесса.
Присутствие в крови IgM-антител к Chlamydia trachomatis наблюдается в раннем периоде заболевания или в начале обострения хронического процесса.
Выявление ДНК хламидий в моче используется для подтверждения инфицированности (в основном у мужчин) при наличии клинических проявлений воспаления урогенитального тракта, для контроля эффективности антибактериальной терапии.
Anti-Chlamydophila pneumoniae IgAАнализ на выявление антител класса IgA к Chlamydophila pneumoniae выполняют при подозрении на инфекцию Chlamydia pneumoniae при длительном кашле, фарингитах, синуситах, отитах, острых и хронических бронхитах, пневмонии, поскольку данные антитела являются маркером первичной инфекции.
Anti-Chlamydophila pneumonia-IgM (антитела класса IgM к Chlamydophila pneumonia)Обнаружение IgM-антител в сыворотке крови указывает на текущую или недавнюю инфекцию Chlamydophila pneumonia. Исследование также целесообразно провести при длительном кашле, фарингитах, синуситах, отитах, острых и хронических бронхитах, пневмонии.
Исследование также целесообразно провести при длительном кашле, фарингитах, синуситах, отитах, острых и хронических бронхитах, пневмонии.
Специфичный тест, направленный на определение ДНК Chlamydоphila pneumoniae в плазме крови высокочувствительным методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени», предназначен для диагностики респираторного хламидиоза.
Хламидия, определение ДНК (Chlamydophila pneumoniae, DNA) в слюнеОпределение ДНК Chlamydophila pneumoniae методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени» используют в диагностике персистирующих (хронических) инфекций верхних дыхательных путей, атипичного воспаления легких, пневмонии, устойчивой к антибиотикотерапии.
Anti-Chlamydophila pneumonia-IgG (антитела класса IgG к Chlamydophila pneumonia)Обнаружение IgG-антител в сыворотке крови указывает на текущую или имевшую место в прошлом инфекцию Chlamydia pneumoniae. Исследование также целесообразно провести при длительном кашле, фарингитах, синуситах, отитах, острых и хронических бронхитах, пневмонии.
Исследование также целесообразно провести при длительном кашле, фарингитах, синуситах, отитах, острых и хронических бронхитах, пневмонии.
Тест предназначен для качественного выявления антигена Listeria monocytogenes в фекалиях человека с целью ранней диагностики листериозa; дифференциальной диагностики заболеваний, сопровождаемых увеличением печени и селезенки, судорогами, абдоминальными болями, лихорадкой, тошнотой, рвотой, диареей на фоне повышения температуры тела до 38-39° С с поражением лимфоидной ткани и нервной системы; для оценки эффективности терапии.
Пневмококк (Streptococcus pneumoniae), антигенный тест, мочаТест предназначен для выявления пневмонии и менингита, вызванных пневмококком (Streptococcus pneumoniae), на ранних стадиях заболевания. Особенно эффективен при невозможности собрать мокроту. Результаты теста не зависят от предыдущей антибиотикотерапии.
Посев на Staphylococcus aureus – микробиологическое исследование, позволяющее выявить инфицированность золотистым стафилококком и подобрать рациональную антибиотикотерапию. При обнаружении патогенных и/или условно-патогенных микроорганизмов определяется их чувствительность к антимикробным препаратам (антибиотикам и бактериофагам).
Посев на золотистый стафилококк (Staphylococcus aureus)Микробиологический метод с использованием специальных питательных сред позволяет выделить золотистый стафилококк, тем самым доказав его наличие в организме и возможную роль в развитии патологии либо скрытое бактерионосительство.
Антитела класса IgG Bordetella pertussisТест направлен на выявление антител класса IgG к антигенам и к токсину Bordetella pertussis – возбудителю коклюша. Положительный результат теста может определяться при текущей или имевшей место в прошлом инфекции Bordetella pertussis, а также после вакцинации против коклюша.
Положительный результат теста может определяться при текущей или имевшей место в прошлом инфекции Bordetella pertussis, а также после вакцинации против коклюша.
Антитела класса IgM являются маркером первичной инфекции Bordetella pertussis или обнаруживаются после недавней вакцинации против коклюша.
Посев на патогенную кишечную флоруПосев на патогенную кишечную флору используют для определения этиологии острого кишечного инфекционного заболевания и выбора рациональной антибиотикотерапии. Тест целесообразно проводить при заболеваниях желудочно-кишечного тракта, сопровождаемых поносами (основная цель исследования – выявление дизентерии и сальмонеллеза у детей и взрослых).
РПГА с Shigella flexneri 1-5 (Shigella flexneri 1-5, IHA)Серологическая диагностика дизентерии — исследование антител к Shigella flexneri подтипов 1-5 методом РПГА (реакция пассивной гемагглютинации).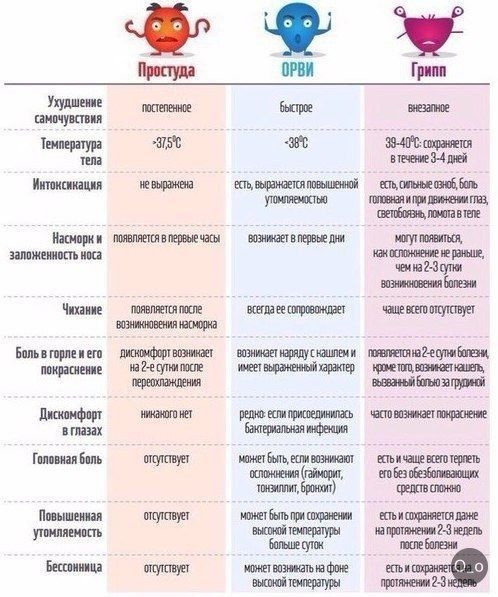
Серологическая диагностика дизентерии — исследование антител к Shigella flexneri подтипа 6 методом РПГА (реакция пассивной гемагглютинации).
РПГА с Shigella sonnei (Shigella sonnei, IHA)Серологическая диагностика дизентерии – исследование антител к Shigella sonnei методом РПГА (реакция пассивной гемагглютинации). Тест выполняют с целью диагностики острых кишечных инфекций.
РПГА с Yersinia Enterocolitica серотипа О3 (Y. enterocolitica O3, IHA)Исследование антител к Yersinia enterocolitica серотипа О:3 методом РПГА (реакция непрямой гемагглютинации) снижает потенциально возможные перекрестные реакции с другими микроорганизмами (Brucella abortus, Rickettsia spp., Salmonella spp., Morganella morganii) и используется в комплексе тестов при подозрении на иерсиниоз.
РПГА с Yersinia pseudotuberculosis (Y. pseudotuberculosis IHA)Выявление специфических антител к возбудителю псевдотуберкулеза методом РПГА (реакция пассивной, или непрямой гемагглютинации) применяется в комплексе тестов при подозрении на иерсиниоз.
Выявление в сыворотке крови антител к O-антигену сальмонелл применяют в качестве вспомогательного теста при диагностике острых кишечных инфекций (после первой недели заболевания и далее в динамике через неделю) для подтверждения клинического диагноза при получении отрицательного результата бактериологического обследования; в целях ретроспективного подтверждения диагноза; при затяжном течении заболевания.
РПГА с Salmonella gr.A (Salmonella gr.A, IHA)Выявление антител к O-антигену сальмонелл серогруппы A применяют в качестве вспомогательного теста при диагностике острых кишечных инфекций (после первой недели заболевания и далее в динамике через неделю).
РПГА с Salmonella gr.D (Salmonella gr.D, IHA)Выявление антител к O-антигену сальмонелл серогруппы D применяют в качестве вспомогательного теста при диагностике острых кишечных инфекций (после первой недели заболевания и далее в динамике через неделю).
Выявление антител к O-антигену сальмонелл серогруппы E применяют в качестве вспомогательного теста при диагностике острых кишечных инфекций (после первой недели заболевания и далее в динамике через неделю).
Кампилобактер (Campylobacter spp.), антигенный тест, калАнтигенный тест в образцах кала применяют при проведении скрининговых исследований для постановки предварительного диагноза кампилобактериоза; для дифференциальной диагностики заболеваний, сопровождаемых диареей (иногда с примесью крови), судорогами, абдоминальными болями, лихорадкой, тошнотой, рвотой, поражением лимфоидной ткани и нервной системы; для оценки эффективности ранее применяемой терапии.
Посев на клостридии диффициле (Clostridium difficile)Clostridium difficile является основной причиной антибиотико-ассоциированной диареи и псевдомембранозного колита. Посев на клостридии проводят для дифференциальной диагностики со стафилококковым энтероколитом, имеющим схожие проявления.
Посев на клостридии проводят для дифференциальной диагностики со стафилококковым энтероколитом, имеющим схожие проявления.
Антитела класса IgA к антигенам Yersinia enterocolitica служат серологическим маркером текущей инфекции. Yersinia enterocolitica может длительно персистировать в слизистой кишечника и лимфатической ткани. Персистенция возбудителя может ассоциироваться с персистенцией специфических IgA-антител.
Антитела к столбнячному анатоксину, IgG Tetanus Toxoid IgG AntibodyАнтитела класса IgG к возбудителю столбняка появляются в организме в ответ на инфицирование возбудителем столбняка или вакцинацию столбнячным анатоксином. В большинстве случаев тест используют для оценки уровня антитоксических антител после вакцинации против столбняка.
Приложение — Коммерсантъ Здравоохранение (126422)
О том, как отличить обычную пневмонию от ковидной, как правильно восстанавливаться после перенесенной коронавирусной инфекции и стоит ли игнорировать риски возникновения других вирусных заболеваний, в интервью “Ъ” рассказала доктор медицинских наук, профессор кафедры пульмонологии Российской медицинской академии непрерывного профессионального образования Оксана Фесенко.
Алгоритм лечения
— При COVID-19 у больных страдают в первую очередь легкие. Чем принципиально отличаются пневмонии — ковидная и обычная?
— Так называемые ковидная, или первично вирусная, и обычная, или бактериальная, пневмонии имеют принципиальные отличия по клиническим проявлениям, особенностям течения и, что самое главное, в подходах к лечению. Первичная вирусная пневмония всегда двусторонняя, развивается на вторые-третьи сутки заболевания и может очень быстро прогрессировать. Она проявляет себя сильной лихорадкой и нарастающей одышкой. Обычная внебольничная пневмония чаще имеет одностороннюю локализацию, начинается с повышения температуры, также могут наблюдаться боль при дыхании и кашель с выделением мокроты. Эти виды пневмонии имеют существенные отличительные рентгенологические и лабораторные признаки.
— Значит, и подходы к лечению должны различаться?
— Абсолютно верно. Очень важно подчеркнуть нецелесообразность использования антибиотиков при подозрении или подтверждении коронавирусной пневмонии. Антибиотики являются средствами выбора при бактериальных, но не вирусных инфекциях. Они не оказывают влияния на течение коронавирусной инфекции и не являются средствами профилактики бактериальных пневмоний. В то же время антибиотики могут спровоцировать тяжелые, даже угрожающие жизни осложнения. Сейчас медицинское сообщество бьет тревогу из-за необоснованного использования антибиотиков. Существует серьезная опасность, что бесконтрольное и неоправданное назначение приведет к росту устойчивых бактериальных инфекций и потере эффективности этого класса препаратов.
Комплексный подход
— Каким образом следует восстанавливаться после ковидной пневмонии. Отличается ли реабилитация после коронавируса от реабилитации после бактериальной пневмонии?
— Коронавирусное поражение легких по многим признакам отличается от обычной бронхопневмонии, и, соответственно, отличаются программы реабилитации, которые имеют несколько уровней. Реабилитация пациента начинается в отделении реанимации и должна быть продолжена на амбулаторном этапе.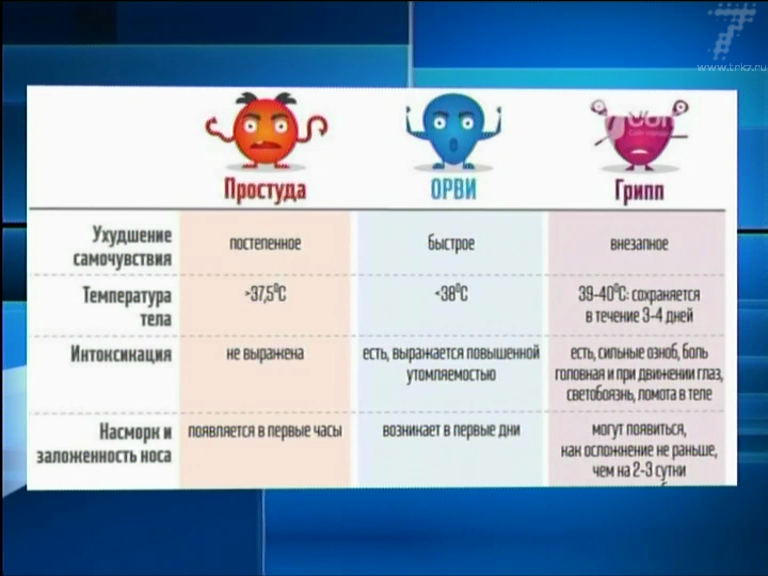 Пациентам, переболевшим вирусной пневмонией, необходимо обратить внимание на восстановление жизненной емкости легких, мышечного тонуса, повышение толерантности к физической нагрузке. Очень важным аспектом является нормализация психоэмоциональной сферы.
Пациентам, переболевшим вирусной пневмонией, необходимо обратить внимание на восстановление жизненной емкости легких, мышечного тонуса, повышение толерантности к физической нагрузке. Очень важным аспектом является нормализация психоэмоциональной сферы.
Это комплексный, длительный процесс, который в зависимости от тяжести перенесенной пневмонии и сопутствующих заболеваний может длиться от трех месяцев до года. В идеале, конечно, проводить реабилитационные мероприятия под контролем специалиста-реабилитолога или врача ЛФК. В некоторых случаях необходима консультация психолога. Ознакомиться с программами реабилитации можно и самостоятельно. Союзом реабилитологов России подготовлены клинические рекомендации по медицинской реабилитации при COVID-19. В них подробно представлены комплексы упражнений, в том числе дыхательных, принципы самоконтроля. Эти рекомендации доступны в интернете.
— Многие рекомендуют в качестве реабилитации санаторно-курортное лечение. Насколько это эффективно и безопасно ли это в условиях пандемии?
— Я уже сказала, что реабилитация пациента, перенесшего вирусную пневмонию,— это длительный процесс, эффективность которого зависит от регулярных занятий, предусматривающих повышение нагрузок, организации полноценного сна и питания. Многие ошибочно полагают, что восстановить организм можно одним рывком, приехав в санаторий на 14–21 день. Действительно, сейчас ряд санаториев разработал и предлагает программы реабилитации после перенесенной коронавирусной инфекции. Санаторно-курортное лечение можно рассматривать как этап реабилитационной программы, но не как ее полное замещение. И вы абсолютно справедливо ставите вопрос о небезопасности поездок на железнодорожном транспорте, перелетов в условиях пандемии. Вопрос в каждом случае должен решаться индивидуально на основании рекомендаций лечащего врача и пульмонолога.
В группе риска
— Правда ли, что основным осложнением после коронавируса является тромбоз?
— Да, особенностью нового коронавируса является способность повреждать сосудистую стенку как артериального, так и венозного русла, поэтому тромбозы являются не только осложнением, но и основным проявлением развернутой стадии заболевания. Накапливаются данные, подтверждающие важную роль внутрилегочных тромбов в прогрессировании дыхательной недостаточности. Поэтому всем госпитализированным пациентам как минимум до выписки назначают инъекции антикоагулянтов.
Поэтому всем госпитализированным пациентам как минимум до выписки назначают инъекции антикоагулянтов.
— Стоит ли принимать антикоагулянты в профилактических целях?
— Эффективность амбулаторного лечения антикоагулянтами в качестве первичной профилактики тромбозов у всех больных на сегодняшний день изучена недостаточно. Профилактику с использованием профилактических доз антикоагулянтов целесообразно проводить пациентам с инфекцией среднетяжелого течения, относящимся к группе высокого риска по развитию венозного тромбоэмболизма, которые не принимают эти препараты в связи с другой патологией.
Это прежде всего больные, перенесшие ранее тромбоэмболию или тромбоз глубоких вен нижних конечностей, а также лица с ограниченной подвижностью, ожирением, системным заболеванием соединительной ткани, активным злокачественным новообразованием. В группе риска по венозному тромбоэмболизму также находятся женщины, которые принимают оральные контрацептивы или получают курс гормональной заместительной терапии. Очень важно подчеркнуть, что речь идет о больных, переносящих очевидную вирусную пневмонию, подтвержденную компьютерной томографией, сопровождающуюся температурой выше 38°C, одышкой, снижением сатурации, повышением уровня С-реактивного белка. Перед назначением антикоагулянтов необходимо оценить риск возможных кровотечений, а во время приема активно его контролировать.
Очень важно подчеркнуть, что речь идет о больных, переносящих очевидную вирусную пневмонию, подтвержденную компьютерной томографией, сопровождающуюся температурой выше 38°C, одышкой, снижением сатурации, повышением уровня С-реактивного белка. Перед назначением антикоагулянтов необходимо оценить риск возможных кровотечений, а во время приема активно его контролировать.
Защитный барьер ответственности
— Все сейчас только и говорят, что о коронавирусе. А как обстоят дела с обычными сезонными ОРВИ и гриппом? Снизилась ли заболеваемость или держится на прежнем уровне?
— Как всегда в это время года, в некоторых регионах растет заболеваемость острыми респираторными вирусными инфекциями. Это вирусы не гриппозной этиологии, такие как парагрипп, аденовирус и другие. Болеют ОРВИ преимущественно взрослые. По гриппу в настоящее время ситуация спокойная. Это объясняется и активной вакцинацией, и ограничительными мерами в отношении новой коронавирусной инфекции. Но расслабляться нельзя, впереди еще зимний период.
— Как повлиял на уровень заболеваемости масочный режим? Эффективно ли это средство защиты против сезонных вирусных заболеваний?
— Уверена, что, если бы население нашей страны более ответственно относилось к масочному режиму, уровень заболеваемости и смертности от новой коронавирусной инфекции был существенно ниже. Маски обеспечивают нас важным защитным барьером. Основные источники распространения вируса — это бессимптомные носители, которые выделяет возбудитель при дыхании и разговоре. Страны со строгим масочным режимом демонстрируют существенно меньшие показатели заболеваемости и смертности от коронавирусной инфекции. Особенно важно носить маски в условиях, где концентрация вируса может быть повышенной: в медицинских учреждениях, самолетах, многолюдных помещениях с плохой вентиляцией.
— Одним из наиболее серьезных осложнений гриппа считается пневмония. Как не допустить осложнений при гриппе и какие симптомы уже должны настораживать?
— Соблюдение постельного режима, проветривание комнаты, достаточный питьевой режим и, конечно, прием препаратов с противовирусной активностью, как правило, приводят к нормализации температуры на третий-четвертый день заболевания и улучшению общего самочувствия. Сохранение высокой температуры при гриппе более пяти дней требует исключения присоединения бактериальной инфекции, прежде всего пневмонии. Насторожить должны признаки и симптомы, свидетельствующие об ухудшении снабжения организма кислородом или о сердечно-легочной недостаточности. Это одышка при движении или в состоянии покоя, кровянистая мокрота, боль в груди и пониженное артериальное давление. Крайне опасными являются признаки и симптомы, свидетельствующие об осложнениях со стороны центральной нервной системы: измененное психическое состояние, судороги, спутанность сознания.
Сохранение высокой температуры при гриппе более пяти дней требует исключения присоединения бактериальной инфекции, прежде всего пневмонии. Насторожить должны признаки и симптомы, свидетельствующие об ухудшении снабжения организма кислородом или о сердечно-легочной недостаточности. Это одышка при движении или в состоянии покоя, кровянистая мокрота, боль в груди и пониженное артериальное давление. Крайне опасными являются признаки и симптомы, свидетельствующие об осложнениях со стороны центральной нервной системы: измененное психическое состояние, судороги, спутанность сознания.
Профилактика как цель
— В каких случаях, при каких симптомах можно переносить болезнь дома, а когда необходима госпитализация?
— Важно сразу сказать, что на этот вопрос должен ответить врач, а не сам пациент (хотя его мнение, безусловно, учитывается) или его родственники. В настоящее время мы наблюдаем рост числа летальных исходов от коронавирусной инфекции, обусловленный поздним обращением за медицинской помощью. Только врач может правильно оценить степень дыхательной недостаточности, интоксикации, заподозрить осложнения или обострение сопутствующих заболеваний. Очевидно, что сохраняющаяся высокая лихорадка, нарушение сознания любой степени выраженности, одышка, тошнота, рвота, нарушение сердечного ритма, кровохарканье требуют срочной госпитализации, так как свидетельствуют о тяжелом течении заболевания.
Только врач может правильно оценить степень дыхательной недостаточности, интоксикации, заподозрить осложнения или обострение сопутствующих заболеваний. Очевидно, что сохраняющаяся высокая лихорадка, нарушение сознания любой степени выраженности, одышка, тошнота, рвота, нарушение сердечного ритма, кровохарканье требуют срочной госпитализации, так как свидетельствуют о тяжелом течении заболевания.
Особое внимание нужно уделять больным с хроническими заболеваниями, которые предрасполагают к неблагоприятному развитию болезни. Это хроническая патология легких, сердечно-сосудистой системы, почек, печени, центральной нервной системы, иммунодефицитные состояния, сахарный диабет, ожирение. К группе особого риска относятся беременные, пожилые люди старше 65 лет, дети до двухлетнего возраста.
— Лучшее лечение — это профилактика. Какие меры необходимы принимать, чтобы избежать ОРВИ и гриппа?
— Вакцинация против гриппа — это яркий пример эффективной первичной профилактики. Мероприятия, направленные на ограничение распространения коронавирусной инфекции, эффективны и в отношении ОРВИ и гриппа. Это масочный режим, социальное дистанцирование, частая обработка рук. Важное значение для иммунитета имеют полноценный сон, сбалансированное питание, физическая активность.
Мероприятия, направленные на ограничение распространения коронавирусной инфекции, эффективны и в отношении ОРВИ и гриппа. Это масочный режим, социальное дистанцирование, частая обработка рук. Важное значение для иммунитета имеют полноценный сон, сбалансированное питание, физическая активность.
— Если все же заболел, что делать, чтобы ускорить лечение: принимать лекарства?
— Мы живем в эпоху доказательной медицины. Эффективным может считаться средство, которое в сравнительном исследовании доказало свою эффективность и безопасность. В последние годы благодаря высоким технологиям разработаны препараты, содержащие антитела к молекулам-регуляторам и медиаторам, вовлеченным в противовирусный иммунный ответ и вирус-индуцированное воспаление. Примером может служить препарат «Эргоферон», который обладает противовирусным, иммуномодулирующим и антигистаминным эффектом.
Записала Мария Рыбакова
Инфекции головного мозга | Неврология
Все инфекции в разной степени опасны, а тем более – нейроинфекции. Самыми опасными из нейроинфекций считаются те, которые поражают головной мозг. Здесь не может быть «несерьезных» заболеваний. Каждый возбудитель, который может преодолеть гематоэнцефалический барьер представляет огромную опасность для здоровья и жизни человека.
Самыми опасными из нейроинфекций считаются те, которые поражают головной мозг. Здесь не может быть «несерьезных» заболеваний. Каждый возбудитель, который может преодолеть гематоэнцефалический барьер представляет огромную опасность для здоровья и жизни человека.
Виды инфекций головного мозга
Все многообразие нейроинфекций, поражающих головной мозг можно разделить на пять групп:
- бактериальные;
- паразитарные;
- вирусные;
- прионные;
- грибковые.
Бактериальные инфекции
Огромное количество возбудителей относящихся к бактериальным инфекциям могут поражать головной мозг.
Такие заболевания как менингит, энцефалит или абсцесс головного мозга вполне могут вызвать такие «обыденные» возбудители, как пневмококк, стафилококк, энтеробактерии. Но произойти это может, только при:
- повреждении костей черепа, с нарушением целостности оболочек мозга;
- заносе возбудителей во время нейрохирургической операции;
-
наличии гнойного очага в организме и ослабленный иммунитет.

Однако с другими возбудителями дело обстоит иначе.
Менингококковая инфекция – традиционная нейроинфекция, которая поражает головной мозг. Пик заболеваемости отмечается в осенне- зимний период, когда иммунная система из-за частых переохлаждений человека и нехватки витаминов снижена.
Если иммунная система в норме, то вы ограничитесь обычным назофарингитом, в обратном случае – вероятность заполучить менингит или менингоэнцефалит возрастает.
Симптомы менингококковой инфекции
- лихорадка,
- повышение температуры тела до 39-40° С.
- озноб,
- головная боль
- слабость
- напряжение мышц шеи
- тошнота,
- рвота,
специфические симптомы
- Выступающая над поверхностью кожи сыпь красно-фиолетового цвета, элементы которой напоминают по форме звезду
- Заболевание начинается очень остро (часто можно указать конкретное время (час), когда человек заболел)
-
В течение 24-х часов, пока человек в сознании должно начаться лечение, в противном случае он может впасть в кому.

Микобактерии туберкулеза кроме в всего прочего могут поражать и головной мозг.
Чаще болеют дети, пожилые люди и лица страдающие иммунодефицитом.
Симптоматика начала заболевания ярко не выражена, чаще это общая слабость, недомогание, отсутствие аппетита, головная боль и раздражительность, температура тела носит субфебрильный характер (температура повышается на протяжении длительного времени в пределах 37,1 – 38°C. ). Впоследствии присоединяются «обычные» менингеальные симптомы.
После присоединяются неврологические нарушения – парезы и параличи лицевого нерва, глазодвигательной мускулатуры, головокружения. На фоне неврологических расстройств возникают нарушения психики.
Нейросифилис, сейчас почти не встречается, но до открытия пенициллина составлял основу работы неврологов. Нейросифилис бывает нескольких видов:
-
Асимптомный, протекает без особых признаков, обнаружить заболевание можно только по анализам.

- Менингит – часто появляется в течение первого года заболевания, проявляется нарушениями работы черепно-мозговых нервов и повышенным внутричерепным давлением (ВЧД).
- Цереброваскулярный – возникает в основном на 2-5 году заболевания и может привести к инсульту или трансформироваться в спинную сухотку или прогрессивный паралич.
- Прогрессивный паралич – заболевание, которое еще называли «параличом помешанных». Возникает через 15-20 лет после инфицирования и сначала проявляется психическими симптомами, затем возникают и прогрессируют параличи мускулатуры, которые в конечном итоге приводят к смерти.
- Врожденный, который, строго говоря, поражает весь организм и характеризуется множественными дефектами развития ребенка.
- Гумма головного мозга – проявляется как объемное образование. Симптомы включают в себя повышение ВЧД и очаговую симптоматику, в зависимости от локализации гуммы.
Неприятной особенностью заболевания является его трудная диагностика.
Вирусные и прионные инфекции
Существует огромное множество вирусов –возбудителей острых энцефалитов (комариный, клещевой, эпидемический), в общем они отличаются переносчиками и географией распространения.
Очаговая симптоматика возникает на фоне «общеинфекционных проявлений», это :
- парезы
- параличи дыхательной мускулатуры
- параличи конечностей,
-
параличи лицевой мускулатуры и пр.
Огромную опасность могут составлять бешенство и медленные инфекции, в связи с чем, им уделяется особое внимание.
Бешенство.
Бешенством могут страдать практически все млекопитающие. Источником появления инфекции обычно служат собаки, волки, лисицы и именно через укус зараженных животных к человеку и передается эта опасная инфекция.
Симптомы:
- гидро и аэрофобия
- судороги
-
приступы агрессивного поведения.
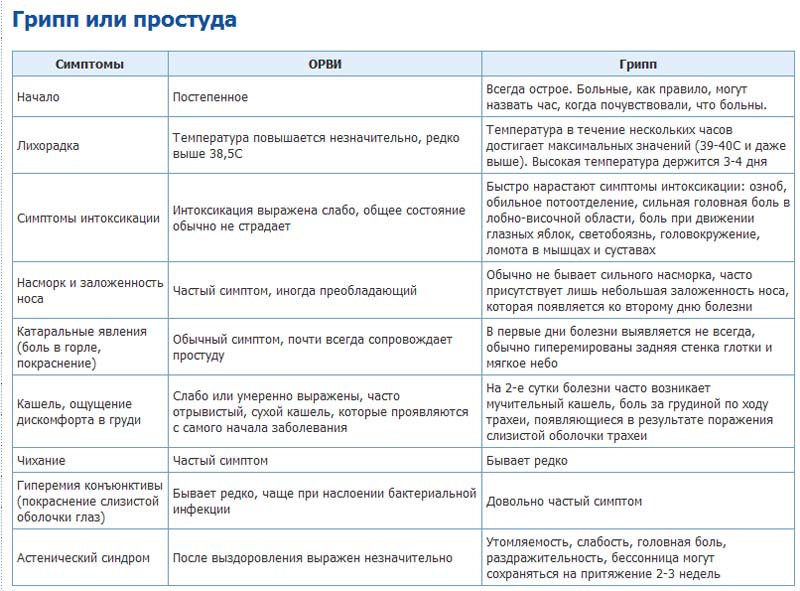
Экстренная вакцинопрофилактика после укуса – это единственный способ выздороветь, поэтому дожидаться развития первых симптомов заболевания запрещено, поскольку это может говорить только о том, что человека уже не спасти.
Медленные инфекции – вирусные нейроинфекции, которые имеют способность длительное время бессимптомно находиться в нервной ткани человека, с последующим развитием заболевания.
Учеными были выведены четыре главных признака, отличающих медленные инфекции:
- необычно продолжительный (месяцы и годы) инкубационный период;
- медленно прогрессирующий характер течения;
- необычность поражения органов и тканей;
- неизбежность смертельного исхода.
Возбудители вируса — краснуха и корь. По не до конца ясным причинам эти вирусы после перенесенного заболевания могут остаться в клетках головного мозга и через 4 и более лет вызывать заболевание. Оба вируса вызывают панэнцефалит со сходной симптоматикой:
Оба вируса вызывают панэнцефалит со сходной симптоматикой:
· изменение личности с развитием деменции
· постепенный паралич всей поперечнополосатой мускулатуры.
К огромному сожалению, даже при лечении, последствия у этих нейроинфекций всегда одинаковы – летальный исход.
Прионы
Прионы — «белковая инфекционная (частица)» (от англ. proteinaceous infectious (particles).
Прионы определяют как «малую белковую инфекционную частицу, устойчивую к инактивирующим воздействиям, которые модифицируют нуклеиновые кислоты», другими словами прионы — это обычные белки организма, которые по неким причинам (которые пока неизвестны) начинают вести себя «неправильно».
Существует четыре вида прионных нейроинфекций, и только с одной из них понятен механизм передачи. В некоторых племенах Папуа-Новая Гвинея часто отмечались случаи куру-куру из-за ранее распространенного ритуального каннибализма – поедания мозга родственников.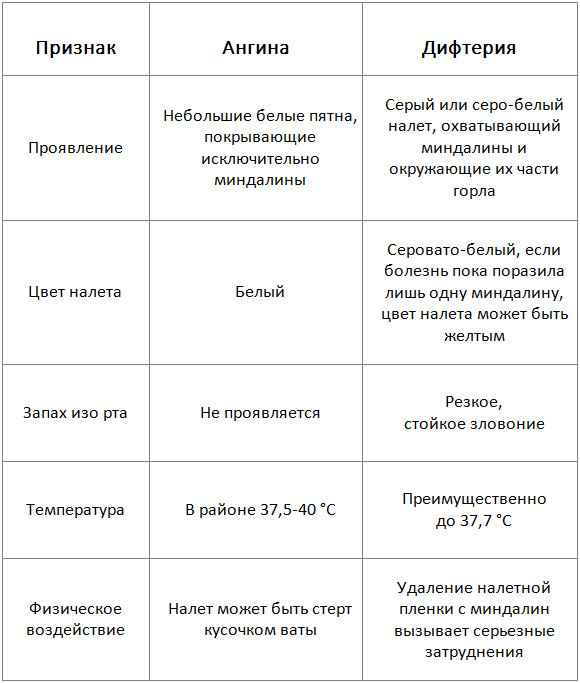 Прионы вызывают спонгиформную энцефалопатию, то есть мозг превращается в подобие губки.
Прионы вызывают спонгиформную энцефалопатию, то есть мозг превращается в подобие губки.
Паразитарные инфекции
Токсоплазмоз – паразитарное заболевание, характеризуется возможностью внутриутробного заражения, поражения нервной системы, глаз, скелетной мускулатуры и мышцы сердца, а также увеличением лимфоузлов, печени и селезенки.
Для возбудителя этого заболевания человек – промежуточный хозяин, а основной – кошки. При нормальном состоянии иммунитета заболевание никак не проявляется, но если человек страдает иммунодефицитом, то могут быть такие варианты заболевания:
- энцефалопатия, с развитием делирия, спутанности сознания вплоть до комы;
- менингоэнцефалит, со всеми своими классическими проявлениями;
-
токсоплазменный абсцесс мозга, который проявляется общеинфекционными симптомами, очаговыми нарушениями, в зависимости от расположения, судорогами, нарушением сознания.
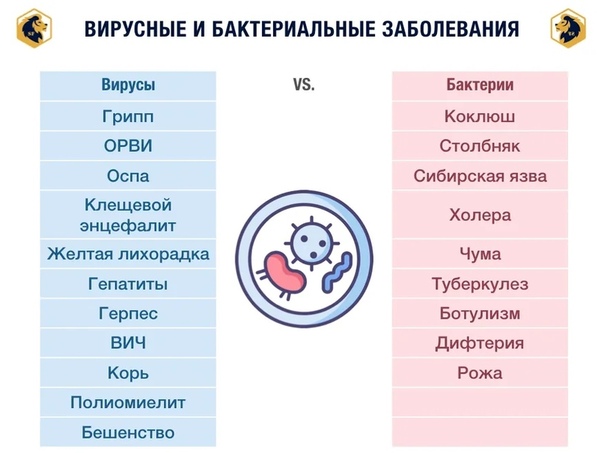
Наиболее тяжелые последствия токсоплазмоза – у беременных, так как он вызывает недоразвитие головного мозга плода.
Диагностика
Для того, чтобы диагностировать нейроинфекцию, в том числе головного мозга, используется комплекс мероприятий:
- общий анализ крови и мочи;
- биохимический анализ крови;
- анализ крови на антитела к вирусным, бактериальным и другим агентам;
- методы визуализации – МРТ;
Лечение
Несмотря на различие возбудителей, некоторые аспекты лечения совпадают во всех случаях.
Больным обязательно назначают постельный режим (при острых инфекциях), противовоспалительные препараты, детоксикационную терапию.
Когда это подострый или хронический процесс, то больным также дают «сосудистые» препараты, способствующие лучшему кровоснабжению головного мозга, ноотропные, противовоспалительные препараты.
Меры предосторожности
Не употреблять в пищу сырое или недостаточно термически обработанное мясо, тщательно мыть руки после контакта с кошками.
Чем отличается бактериальная пневмония от вирусной? | ЗДОРОВЬЕ: Медицина | ЗДОРОВЬЕ
«Бактериальная пневмония — инфицирование легких бактериями. Она сопровождается такими симптомами, как жар, сильная слабость, кашель с выделением мокроты, боль в области груди. Бактериальная пневмония может принимать легкую форму, не требующую госпитализации, и тяжелую, когда лечение нужно в стационаре», — рассказала главный внештатный пульмонолог департамента здравоохранения Тюменской области Инна Криночкина.
Диагностировать ее можно при помощи рентгеновского снимка, анализов крови и посева выделяемой мокроты. Лечат антибиотиками. В группу риска входят дети младше пяти лет и пожилые люди старше 60-ти. Для такого типа пневмонии характерно стремительное развитие осложнений, самым распространенным из которых является дыхательная недостаточность, а также высокая вероятность смертности.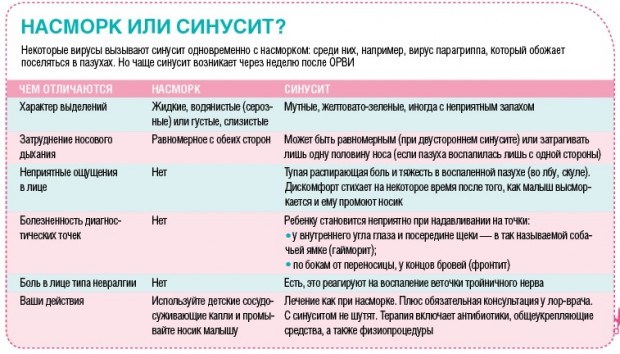
При первых же проявлениях симптомов нужно обращаться к врачу. Если лечение назначено на ранней стадии, прогноз довольно положительный.
Факторами риска возникновения бактериальной пневмонии могут быть недавно перенесенная ОРВИ, почечная недостаточность, сердечно-сосудистые заболевания, ХОБЛ, иммунодефицитные состояния, дисбактериоз, сахарный диабет.
Сейчас можно говорить о сезонности, а также, конечно, влиянии пандемии, когда пневмония стала бактериальным осложнением или присоединились вследствие перенесения ОРВИ и коронавируса, отмечает врач.
Заболевание можно предупредить, если своевременно будет сделана прививка от пневмококковой инфекции. После попадания в организм активных штаммов вакцины, начинается выработка молекул — антител, которые и призваны бороться с проникающими пневмококками.
«У большинства пациентов легкие восстанавливаются полностью спустя несколько месяцев, максимум полгода после болезни. Те же рекомендации, как и после любого ОРВИ: частые проветривания, правильное питание, постепенное возвращение к привычным физическим нагрузкам», — отметила Инна Криночкина.
бактериальных и вирусных инфекций: в чем разница?
Бактерии и вирусы могут вызывать множество распространенных инфекций. Но каковы различия между этими двумя видами инфекционных организмов?
Бактерии — это крошечные микроорганизмы, состоящие из одной клетки. Они очень разнообразны и могут иметь большое разнообразие форм и структурных особенностей.
Бактерии могут жить практически в любой мыслимой среде, в том числе внутри или на теле человека.
Лишь горстка бактерий вызывает инфекции у людей.Эти бактерии относят к патогенным бактериям.
Вирусы — это еще один тип крошечных микроорганизмов, хотя они даже меньше бактерий. Как и бактерии, они очень разнообразны и имеют самые разные формы и особенности.
Вирусы паразитируют. Это означает, что для роста им требуются живые клетки или ткань.
Вирусы могут проникать в клетки вашего тела, используя компоненты ваших клеток для роста и размножения. Некоторые вирусы даже убивают клетки-хозяева в рамках своего жизненного цикла.
Прочтите, чтобы узнать больше о различиях между этими двумя типами инфекций.
Многие бактериальные инфекции заразны, что означает, что они могут передаваться от человека к человеку. Это может происходить разными способами, в том числе:
- тесный контакт с человеком, у которого есть бактериальная инфекция, включая прикосновение и поцелуй
- контакт с жидкостями организма человека, у которого есть инфекция, особенно после полового контакта или когда человек кашляет или чихает
- передача от матери ребенку во время беременности или родов
- контакт с поверхностями, загрязненными бактериями, такими как дверные ручки или ручки крана, а затем прикосновение к своему лицу, носу или рту
Помимо того, что Передаются от человека к человеку, бактериальные инфекции также могут передаваться через укус инфицированного насекомого.Кроме того, употребление зараженной пищи или воды также может привести к инфекции.
Некоторые примеры бактериальных инфекций включают:
Как и бактериальные инфекции, многие вирусные инфекции также заразны. Они могут передаваться от человека к человеку одними и теми же способами, в том числе:
Они могут передаваться от человека к человеку одними и теми же способами, в том числе:
- при тесном контакте с человеком, у которого есть вирусная инфекция
- при контакте с жидкостями организма человека с вирусной инфекцией
- передача от от матери ребенку во время беременности или родов
- контактирует с зараженными поверхностями
Также, как и при бактериальных инфекциях, вирусные инфекции могут передаваться через укус инфицированного насекомого или через употребление пищи или воды, которые были заражены.
Вот некоторые примеры вирусных инфекций:
COVID-19 — еще одно заболевание, вызываемое вирусом. Этот вирус обычно вызывает:
- одышку
- лихорадку
- сухой кашель
Позвоните в скорую медицинскую помощь, если у вас возникнут следующие симптомы:
- затрудненное дыхание
- синеватые губы
- сильная усталость
- постоянная боль или стеснение в груди
Простуда может вызвать заложенность носа или насморк, боль в горле и низкую температуру, но является ли простуда бактериальной или вирусной?
Простуда вызывается рядом различных вирусов, хотя чаще всего виновниками являются риновирусы.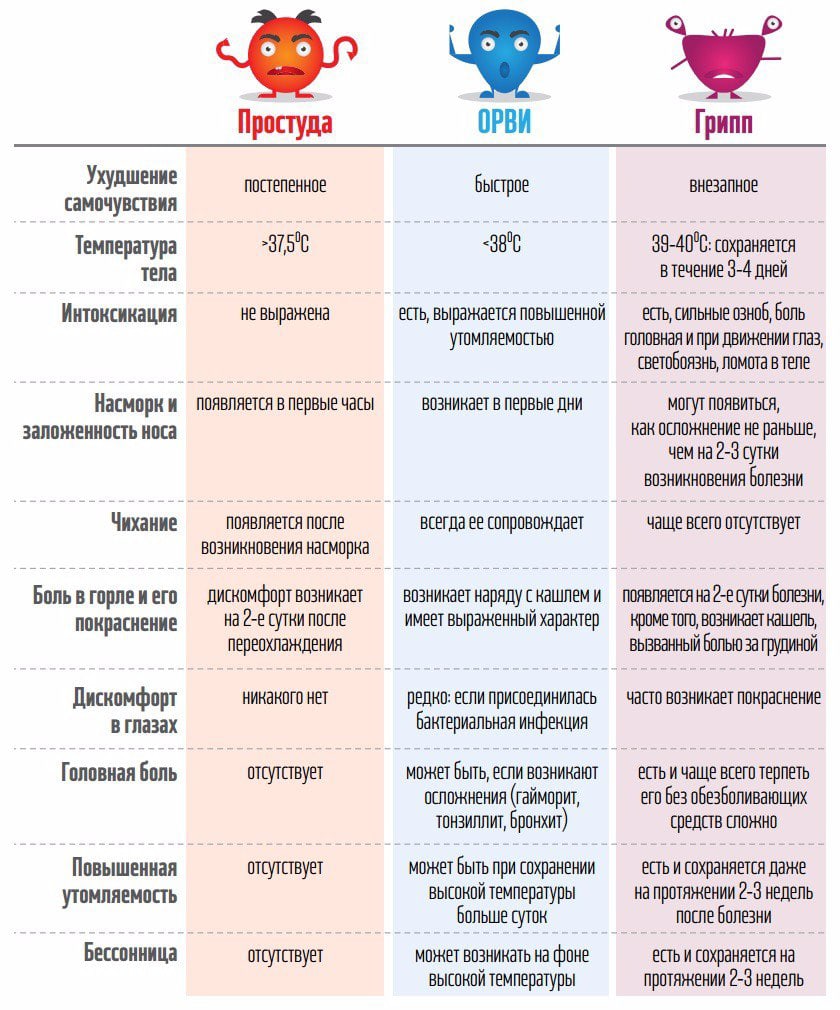
Для лечения простуды мало что можно сделать, кроме как переждать ее и использовать безрецептурные лекарства, которые помогут облегчить симптомы.
В некоторых случаях вторичная бактериальная инфекция может развиться во время или после простуды. Общие примеры вторичных бактериальных инфекций включают:
У вас может развиться бактериальная инфекция, если:
- симптомы длятся более 10-14 дней
- симптомы продолжают ухудшаться, а не улучшаться в течение нескольких дней
- у вас повышенная температура чем обычно наблюдается при простуде
Можно ли по цвету слизи определить бактериальную или вирусную инфекцию?
Вам следует избегать использования цвета слизи, чтобы определить, есть ли у вас вирусная или бактериальная инфекция.
Существует давнее мнение, что зеленая слизь указывает на бактериальную инфекцию, требующую антибиотиков. Фактически, зеленая слизь вызвана веществами, которые выделяются вашими иммунными клетками в ответ на чужеродного захватчика.
Зеленая слизь может образовываться по многим причинам, в том числе:
Когда вы испытываете такие симптомы, как тошнота, диарея или спазмы в животе, у вас, скорее всего, есть желудочная болезнь. Но это связано с вирусной или бактериальной инфекцией?
Желудочные насекомые обычно делятся на две категории в зависимости от того, как они были заражены:
- Гастроэнтерит — это инфекция пищеварительного тракта.Это вызвано контактом со стулом или рвотой инфицированного человека.
- Пищевое отравление — это инфекция пищеварительного тракта, вызванная употреблением зараженной пищи или жидкостей.
Гастроэнтерит и пищевое отравление могут быть вызваны как вирусами, так и бактериями. Независимо от причины часто симптомы проходят через день или два при хорошем домашнем уходе.
Однако симптомы, которые длятся более 3 дней, вызывают кровавую диарею или приводят к сильному обезвоживанию, могут указывать на более тяжелую инфекцию, требующую немедленного лечения.
Иногда ваш врач может диагностировать ваше состояние на основе вашей истории болезни и ваших симптомов.
Например, такие состояния, как корь или ветряная оспа, имеют очень характерные симптомы, которые можно диагностировать с помощью простого медицинского осмотра.
Кроме того, если в настоящее время наблюдается эпидемия определенного заболевания, ваш врач учтет это при постановке диагноза. Примером может служить грипп, который вызывает сезонные эпидемии в холодные месяцы каждого года.
Если ваш врач хочет знать, какой тип организма может вызывать ваше состояние, он может взять образец для посева. Образцы, которые можно использовать для посева, различаются в зависимости от предполагаемого состояния, но они могут включать:
Когда микроорганизм культивируется, это позволяет вашему врачу определить причину вашего состояния. В случае бактериальной инфекции это также может помочь им определить, какой антибиотик может быть полезен при лечении вашего состояния.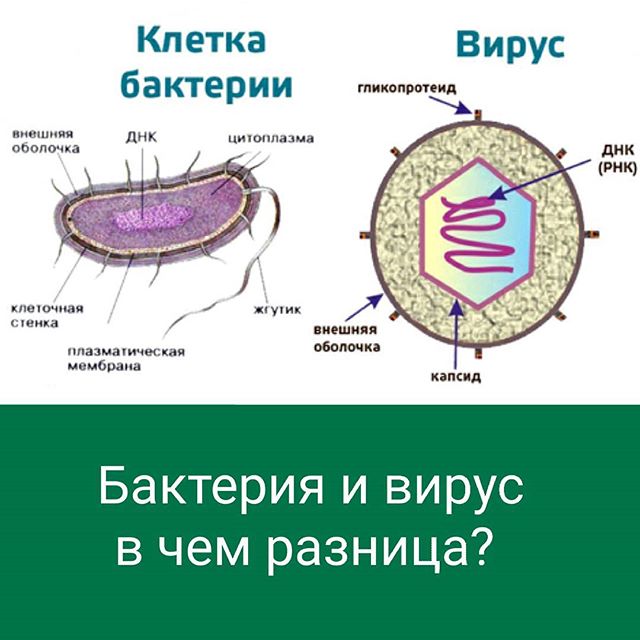
Антибиотики — это лекарства, используемые для лечения бактериальных инфекций.
Существует много типов антибиотиков, но все они препятствуют эффективному росту и делению бактерий. Они не эффективны против вирусных инфекций.
Несмотря на то, что антибиотики следует принимать только при бактериальной инфекции, антибиотики часто требуются при вирусных инфекциях. Это опасно, потому что чрезмерное назначение антибиотиков может привести к устойчивости к антибиотикам.
Устойчивость к антибиотикам возникает, когда бактерии адаптируются к определенным антибиотикам.Это может затруднить лечение многих бактериальных инфекций.
Если вам прописали антибиотики от бактериальной инфекции, пройдите весь курс антибиотиков, даже если через пару дней вы почувствуете себя лучше. Пропуск доз может предотвратить уничтожение всех патогенных бактерий.
Специального лечения многих вирусных инфекций не существует. Лечение обычно направлено на облегчение симптомов, в то время как ваш организм работает над устранением инфекции.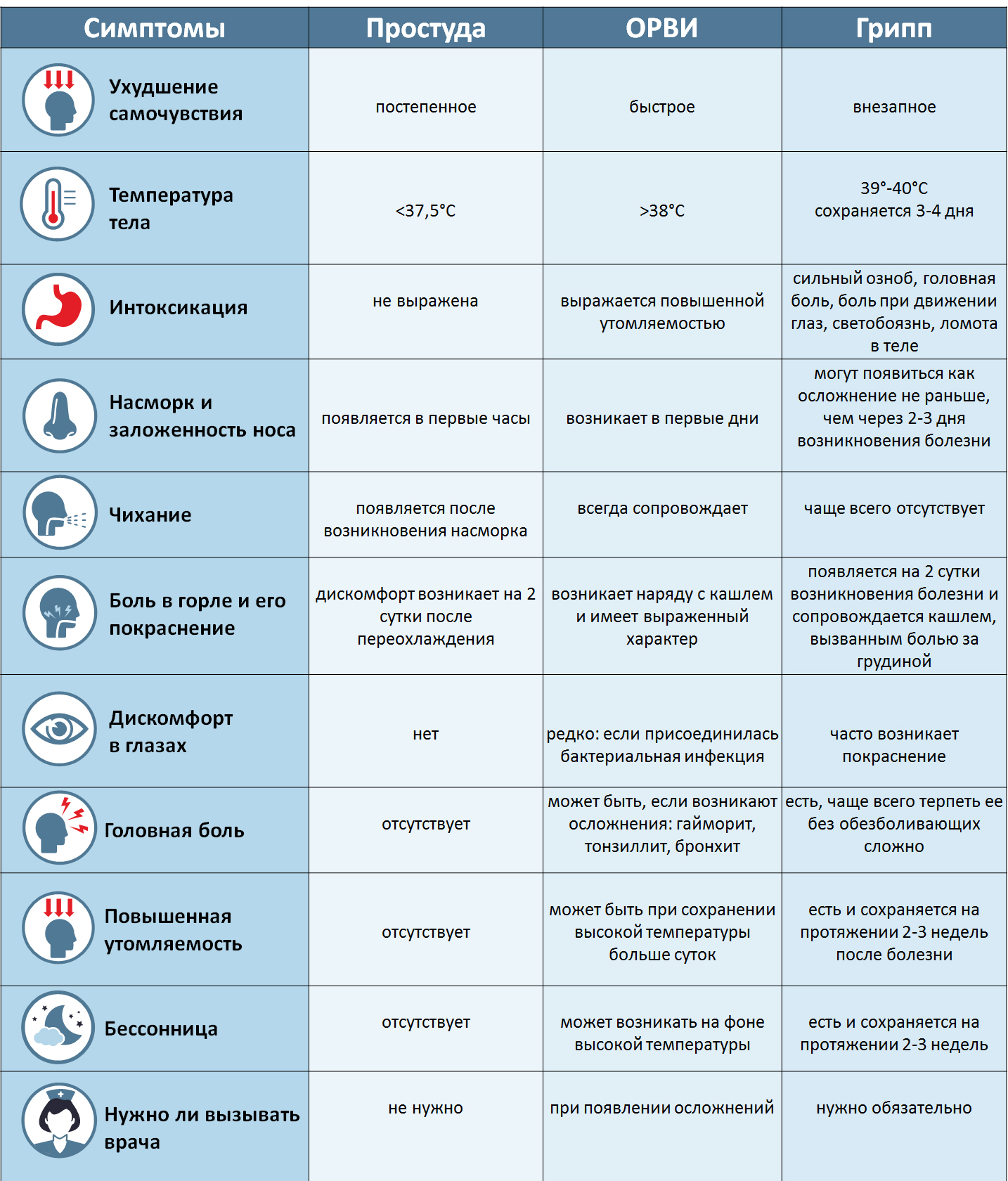 Сюда могут входить такие вещи, как:
Сюда могут входить такие вещи, как:
- питье жидкости для предотвращения обезвоживания
- много отдыхать
- использование безрецептурных обезболивающих, таких как ацетаминофен (тайленол) или ибупрофен (мотрин, адвил) для облегчения боли, боли и лихорадки
- прием безрецептурных противозастойных средств при насморке или заложенности носа
- сосание леденцов от горла для облегчения боли в горле
Противовирусные препараты
В некоторых случаях ваш врач может назначить противовирусные препараты для лечения вашего состояния.
Противовирусные препараты каким-то образом подавляют жизненный цикл вируса.
Некоторые примеры включают лекарства, такие как осельтамивир (Тамифлю) от гриппа или валацикловир (Валтрекс) от вирусных инфекций простого герпеса или опоясывающего лишая (опоясывающий лишай).
Вы можете следовать приведенным ниже советам, чтобы предотвратить заражение бактериальной или вирусной инфекцией:
Соблюдайте правила гигиены
Обязательно мойте руки перед едой, после посещения туалета, а также до и после работы с едой.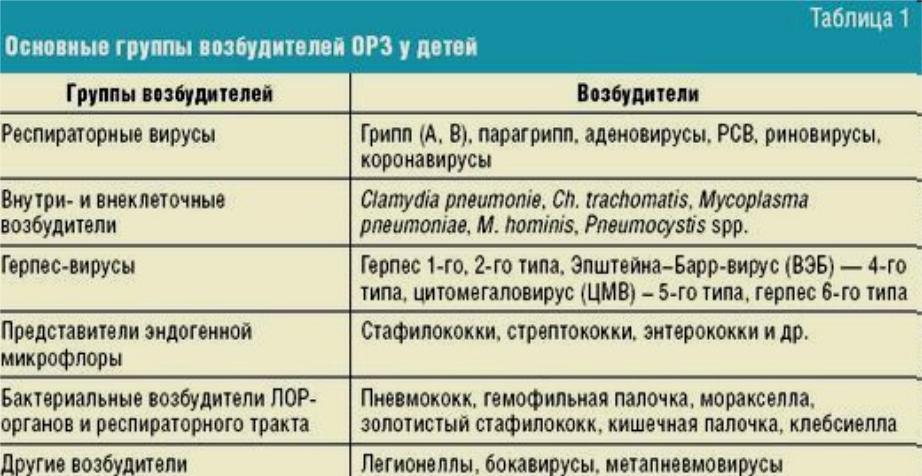
Не прикасайтесь к лицу, рту или носу, если у вас грязные руки. Не передавайте личные вещи, например:
- столовые приборы
- стаканы
- зубные щетки
Пройдите вакцинацию
Для предотвращения различных вирусных и бактериальных заболеваний существует множество вакцин. Примеры болезней, которые можно предотвратить с помощью вакцин:
Поговорите со своим врачом о доступных вам вакцинах.
Не выходите на улицу, если вы больны
Оставайтесь дома, если вы заболели, чтобы предотвратить передачу инфекции другим людям.
Если вам необходимо выйти, часто мойте руки и чихайте или кашляйте в сгиб локтя или в платок. Обязательно утилизируйте использованные салфетки надлежащим образом.
Практикуйте безопасный секс
Использование презервативов или других барьерных методов может помочь предотвратить заражение венерическими заболеваниями (ЗППП). Также было показано, что ограничение количества половых партнеров снижает риск заражения ЗППП.
Убедитесь, что еда тщательно приготовлена.
Убедитесь, что все мясо приготовлено до нужной температуры.Обязательно тщательно мойте сырые фрукты или овощи перед едой.
Не оставляйте остатки еды при комнатной температуре. Вместо этого немедленно охладите их.
Защита от укусов насекомых
Обязательно используйте средство от насекомых, содержащее такие ингредиенты, как ДЭТА или пикаридин, если вы собираетесь находиться на улице, где распространены насекомые, такие как комары и клещи.
По возможности надевайте длинные брюки и рубашки с длинными рукавами.
Бактерии и вирусы вызывают множество распространенных инфекций, и эти инфекции могут передаваться одними и теми же путями.
Иногда ваш врач может диагностировать ваше состояние с помощью простого медицинского осмотра. В других случаях им может потребоваться взять образец для посева, чтобы определить, является ли ваша болезнь бактериальной или вирусной.
Антибиотики используются для лечения бактериальных инфекций. Лечение вирусных инфекций направлено на устранение симптомов, пока инфекция протекает. Хотя в некоторых случаях могут применяться противовирусные препараты.
Лечение вирусных инфекций направлено на устранение симптомов, пока инфекция протекает. Хотя в некоторых случаях могут применяться противовирусные препараты.
Вы можете помочь предотвратить заражение или передачу бактериальных и вирусных инфекций:
- соблюдая правила гигиены
- сделав прививку
- оставаясь дома, когда вы больны
Что вызывает у моего ребенка простуду? — Основы здоровья от клиники Кливленда
Добро пожаловать в сезон простуды и гриппа.(Напоминание: еще не поздно сделать прививку от гриппа!)
Клиника Кливленда — некоммерческий академический медицинский центр. Реклама на нашем сайте помогает поддерживать нашу миссию. Мы не поддерживаем продукты или услуги, не принадлежащие Cleveland Clinic. Политика
Если ваш малыш уже всхлипывает, кашляет и чихая, вы можете задаться вопросом, заразились ли они вирусом или бактериями болен, и что вы можете сделать, чтобы помочь.
Иногда симптомы вирусных и бактериальных инфекций кажутся одинаковыми, но между ними есть большая разница, и их лечат по-разному, — объясняет Фрэнк Эспер, доктор медицины, педиатрический инфекционист.
По его словам, чаще всего причиной кашля, боли в горле или легкой температуры у ребенка является вирус. И лучшее, что можно сделать, — это позволить болезни идти своим чередом.
«По большей части вирусы исчезают сами по себе, поскольку вашей иммунной системы более чем достаточно, чтобы их уничтожить», — говорит он.
Но когда температура становится особенно высокой, подозрение может сместиться бактериальной инфекции. «Что касается бактерий, мы часто используем антибиотики для те, потому что бактериальные инфекции могут быть более серьезными », -Эспер объясняет.
Как избежать чрезмерного использования антибиотиков
Хотя родителям может быть неприятно узнать, что антибиотик не поможет их ребенку с вирусной инфекцией почувствовать себя лучше, доктор Эспер говорит, что злоупотребление антибиотиками, особенно когда они бесполезны, проблематично.
Когда мы злоупотребляем антибиотиками, бактерии, для лечения которых они предназначены, становятся более устойчивыми, и эти антибиотики больше не полезны.
Кроме того, по словам доктора Эспера, антибиотики также могут уничтожать «полезные» бактерии в кишечнике, которые могут вызывать желудочные и желудочно-кишечные расстройства.
«Ваш кишечник полон бактерий, но антибиотики не различают друга от врага», — объясняет он.
«Он убивает вредные бактерии, вызывающие инфекцию носовых пазух, но также убивает полезные бактерии в кишечнике, которые помогают пищеварению».
Если вы не уверены, вирусная или бактериальная инфекция у ребенка, доктор Эспер сказал, что лучше всего позвонить своему педиатру.
Он также напоминает родителям, что всякий раз, когда у ребенка младше 2 месяцев температура поднимается выше 100.4, их должен осмотреть врач.
От чего болеет мой ребенок? — Отдел новостей клиники Кливленда
КЛИВЛЕНД — Когда дело доходит до попытки выяснить, есть ли у вашего ребенка вирус или бактериальная инфекция, это может быть очень непросто.
По словам Фрэнка Эспера, доктора медицины детской клиники Кливленда, иногда симптомы кажутся одинаковыми, но их лечат по-разному.
«Между ними есть большая разница — по большей части вирусы исчезают сами по себе, и вашей иммунной системы более чем достаточно, чтобы их уничтожить», — сказал он.«Бактерии, часто у нас есть антибиотики для них, потому что бактериальные инфекции могут быть более серьезными».
Доктор Эспер сказал, что в большинстве случаев случайный вирус является причиной кашля, боли в горле или легкой температуры у ребенка. Но когда температура становится особенно высокой, виной всему может быть бактериальная инфекция.
Часто врачи будут пытаться победить бактериальную инфекцию, вылечив ее антибиотиками, прежде чем она станет серьезной.
Однако в случае вируса Dr.Эспер сказал, что лучше всего сделать, чтобы болезнь пошла своим чередом.
Хотя родителям может быть неприятно узнать, что антибиотик не поможет их ребенку чувствовать себя лучше, доктор Эспер сказал, что чрезмерное использование антибиотиков, особенно когда они бесполезны, проблематично.
Когда мы злоупотребляем антибиотиками, бактерии, для лечения которых они предназначены, становятся более устойчивыми, и эти антибиотики перестают быть полезными.
Плюс, доктор Эспер сказал, что антибиотики — это лекарства, которые нужно «искать и уничтожить», и они могут уничтожить «полезные» кишечные бактерии, вызывая желудочные и желудочно-кишечные расстройства.
«В конце концов, все это возвращается в ваш кишечник, и ваш кишечник полон бактерий — но антибиотики не различают друга от врага», — сказал он. «Он убивает вредные бактерии, вызывающие инфекцию носовых пазух, но также убивает полезные бактерии в кишечнике, которые помогают вам переваривать пищу».
Для родителей, которые не уверены, вирусная или бактериальная инфекция у ребенка, доктор Эспер сказал, что лучше всего позвонить педиатру.
Он также напоминает родителям всякий раз, когда у ребенка в возрасте до двух месяцев температура превышает 100.4, их должен осмотреть врач.
У детей с лихорадкой исследователи отличают бактериальные инфекции от вирусных
? ИЗОБРАЖЕНИЕ: Используя технологию микрочипов, исследователи могут различать вирусные и бактериальные инфекции у детей с лихорадкой, анализируя активность генов в образце крови. Хотя необходимы дополнительные исследования, …
посмотреть еще
Хотя необходимы дополнительные исследования, …
посмотреть еще
Кредит: Роберт Бостон, Вашингтонский университет в Сент-Луисе
У детей с лихорадкой, но без других симптомов болезни, трудно определить, есть ли у ребенка вирусная инфекция, которая разрешится сама по себе, или потенциально серьезная бактериальная инфекция, требующая антибиотиков.
Теперь исследователи из Медицинской школы Вашингтонского университета в Сент-Луисе сообщают, что они могут различать вирусные и бактериальные инфекции у детей с лихорадкой, анализируя активность генов в образце крови. В небольшом исследовании анализ генов в белых кровяных тельцах был точен более чем на 90 процентов, что намного лучше, чем стандартный диагностический тест, который является правильным только примерно в 70 процентах случаев.
Исследование опубликовано 15 июля в журнале Proceedings of the National Academy of Sciences Online Early Edition.
Хотя требуется дополнительная работа, результаты исследования подтверждают идею о том, что анализ активности генов организма в ответ на детские инфекции может помочь выявить причину болезни и обеспечить получение детьми правильного лечения.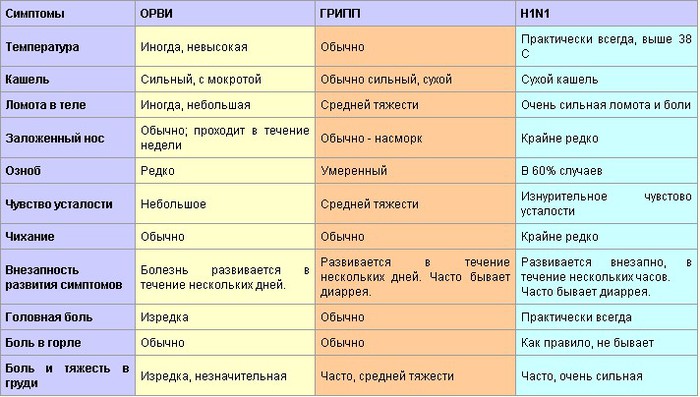
«Это обычная проблема, когда у детей развивается лихорадка без какой-либо очевидной причины», — говорит старший автор Грегори Сторч, доктор медицинских наук, профессор педиатрии Рут Л. Ситман и руководитель отделения детских инфекционных заболеваний Медицинской школы Вашингтонского университета и Св. .Детская больница Луи. «У некоторых из этих детей серьезные бактериальные инфекции, которые могут быть опасными для жизни, но у большинства из них есть вирусные инфекции. Проблема в том, что с практической точки зрения трудно понять, что есть что».
В качестве меры предосторожности многие дети, у которых лихорадка без видимой причины, получают лечение антибиотиками, даже если лекарства не действуют против вирусов, а их чрезмерное назначение способствует устойчивости к антибиотикам.
В новом исследовании приняли участие 30 детей в возрасте от двух месяцев до трех лет с лихорадкой выше 100.4 ° F, но нет явных признаков болезни, таких как кашель или диарея. На основании предыдущего обширного геномного тестирования, которое еще не практично для использования в клинических условиях, было известно, что у 22 детей есть вирусные инфекции, а у восьми других детей были бактериальные инфекции.
Но Сторч и его коллеги из Института генома университета и Центра доступа к геномным технологиям хотели знать, может ли тест, называемый микрочипом экспрессии генов, выявить закономерности активности генов в лейкоцитах, которые могут отличить детей с вирусными инфекциями от детей с бактериальными инфекциями. .Белые кровяные тельца — это первая линия защиты иммунной системы от чужеродных захватчиков, и ученые предположили, что они будут иначе реагировать на вирусы, чем на бактерии.
У исследователей также был доступ к результатам стандартного диагностического теста, проведенного, когда у детей изначально была диагностирована лихорадка в Детской больнице Сент-Луиса. Этот тест включает в себя анализ количества лейкоцитов в образце крови. Как правило, это число повышено для бактериальных инфекций и либо низкое, либо нормальное для вирусных инфекций.
«Мы знаем, что есть много исключений из этого правила, и мы определенно видели это в этом исследовании», — сказал Сторч. «У многих пациентов с вирусными инфекциями было повышенное количество лейкоцитов, поэтому врачи думали, что у них бактериальные инфекции, и прописывали антибиотики, в которых на самом деле не было необходимости».
«У многих пациентов с вирусными инфекциями было повышенное количество лейкоцитов, поэтому врачи думали, что у них бактериальные инфекции, и прописывали антибиотики, в которых на самом деле не было необходимости».
Используя технологию микрочипов, исследователи могли легко отличить бактериальные инфекции от вирусных, основываясь на характерных паттернах экспрессии генов. «Это действительно важно для врачей, потому что, если они увидят образец экспрессии генов, который указывает на вирусную инфекцию, они могут чувствовать себя комфортно, не прописывая антибиотики», — добавил Сторч.
Для сравнения, исследовательская группа выполнила микроматричный анализ образцов крови 35 детей без лихорадки в возрасте от 2 месяцев до 3 лет, перенесших амбулаторную операцию. Предыдущее геномное тестирование показало, что у восьми из этих детей были вирусы, хотя они не вызывали никаких симптомов.
«У детей с вирусом и лихорадкой многие гены были очень активными по сравнению с детьми, у которых не было вирусов и не было лихорадки, чьи гены были тихими», — объяснил Сторч. «Микроматрица в основном сообщает нам, как пациент считывает инфекцию.Очень активные гены говорят нам, что инфекция вызывает у пациента заболевание, тогда как тихие гены говорят нам, что либо нет инфекции, либо, возможно, есть бактерия или вирус, но они не вызывают лихорадку или болезнь ».
«Микроматрица в основном сообщает нам, как пациент считывает инфекцию.Очень активные гены говорят нам, что инфекция вызывает у пациента заболевание, тогда как тихие гены говорят нам, что либо нет инфекции, либо, возможно, есть бактерия или вирус, но они не вызывают лихорадку или болезнь ».
Это различие важно, потому что, когда стандартные тесты предполагают, что у ребенка есть вирус, врачи не знают, вызывает ли этот вирус болезнь ребенка или это невинный прохожий. По словам Сторча, «опасность приписать симптомы вирусу, который на самом деле является невинным свидетелем, заключается в том, что ребенок может не получить необходимые антибиотики.«
Это указывает на потенциальную пользу использования тестов, которые измеряют реакцию генов, чтобы получить более убедительные ответы на болезнь. Он добавил, что это поможет обеспечить нацеливание антибиотиков на тех детей, которые действительно в них нуждаются.
Затем Сторч надеется усовершенствовать технологию микрочипов, которая одновременно анализирует все 25 000 генов в организме. Это делает анализ слишком затратным по времени и дорогим для использования в условиях клиники. Но он и его сотрудники хотят идентифицировать меньшее количество критических генов, которые можно было бы использовать для различения вирусных и бактериальных инфекций, и оценить тест второго поколения у детей в рамках нового исследования.
Это делает анализ слишком затратным по времени и дорогим для использования в условиях клиники. Но он и его сотрудники хотят идентифицировать меньшее количество критических генов, которые можно было бы использовать для различения вирусных и бактериальных инфекций, и оценить тест второго поколения у детей в рамках нового исследования.
###
Исследование финансируется за счет грантов NIAID, UL1 RR024992 Национального центра исследовательских ресурсов NIH, Института клинических и трансляционных наук Вашингтонского университета, а также гранта на обучение T32HD049338 от NICHD. Центр доступа к геномным технологиям Медицинской школы Вашингтонского университета оказал помощь в проведении геномного анализа. Центр частично поддерживается грантом поддержки онкологического центра NCI № P30 CA91842 для онкологического центра Siteman и грантом ICTS / CTSA № UL1RR024992 Национального центра исследовательских ресурсов (NCRR), составляющим часть NIH, и дорожной карты NIH для медицинских исследований. .
.
Сторч Г.А., Кросби С.Д., Ю. Дж., Ху X. Профили экспрессии генов у детей с лихорадкой и определенной вирусной и бактериальной инфекцией. Труды Национальной академии наук . Онлайн 15 июля 2013 г.
Медицинский факультет Вашингтонского университета 2100 штатных и добровольных врачей-преподавателей также входят в медицинский персонал больниц Barnes-Jewish и St. Louis Children’s. Медицинский факультет — одно из ведущих медицинских научно-исследовательских, обучающих и лечебных учреждений в стране, которое в настоящее время занимает шестое место в стране по мнению У.S. News & World Report. Медицинский факультет связан с больницами Barnes-Jewish и St. Louis Children’s, а также с BJC HealthCare.
Заявление об отказе от ответственности: AAAS и EurekAlert! не несут ответственности за точность выпусков новостей, размещенных на EurekAlert! участвующими учреждениями или для использования любой информации через систему EurekAlert.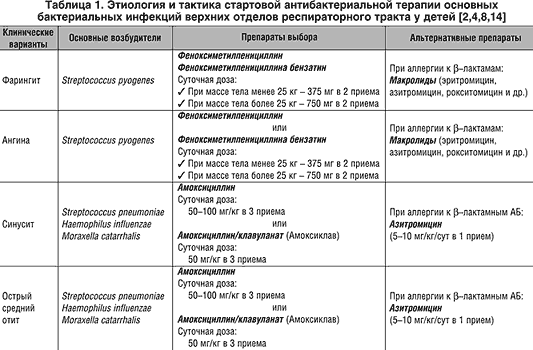
Повторные инфекции у детей — бактериальные и вирусные
Путь к улучшению здоровья
Инфекции бывают двух основных типов: бактериальные и вирусные.Бактериальные инфекции вызывают бактерий . Вирусные инфекции вызываются вирусом .
Большинство детей, перенесших повторные инфекции, не имеют серьезных проблем и вырастают здоровыми взрослыми. Убедитесь, что ваш ребенок много спит и ест здоровую пищу. Сон и правильное питание могут быть столь же важны, как и лекарства, в борьбе с инфекциями вашему ребенку..gif)
Иногда легко увидеть причину повторных инфекций. В детских садах дети передают инфекции друг другу.У них текут слюни, и из носа текут. Они касаются друг друга и трогают все игрушки. Это распространяет инфекции. Некоторые вирусы могут жить на объектах несколько часов. Как взрослые, мы гораздо реже контактируем с микробами друг друга, поэтому у нас меньше шансов заразиться таким количеством инфекций.
Воздействие сигаретного дыма (иногда называемое «пассивным курением») — еще одна причина насморка и хрипов у маленьких детей. Пассивное курение связано с астмой у детей . Это также фактор риска респираторных инфекций у детей.Поэтому важно не подпускать детей к сигаретному или сигарному дыму.
Структурные изменения пазух или евстахиевой трубы (соединительных трубок в каждом ухе) являются частой причиной повторных инфекций у детей. Термин «структурные изменения» относится к различиям в костных частях черепа , пазухах и ушах. Эти различия могут передаваться по наследству. Некоторые различия в строении тела облегчают человеку заражение инфекциями, потому что нормальный дренаж евстахиевой трубы (в ухе) или пазух (в носу) заблокирован.Когда дренаж заблокирован, количество бактерий увеличивается. Это приводит к заражению. У большинства детей по мере роста головы проблемы с дренажом улучшаются. Если у маленьких детей слишком много ушных инфекций, им могут потребоваться антибиотики или специальные ушные трубки.
Термин «структурные изменения» относится к различиям в костных частях черепа , пазухах и ушах. Эти различия могут передаваться по наследству. Некоторые различия в строении тела облегчают человеку заражение инфекциями, потому что нормальный дренаж евстахиевой трубы (в ухе) или пазух (в носу) заблокирован.Когда дренаж заблокирован, количество бактерий увеличивается. Это приводит к заражению. У большинства детей по мере роста головы проблемы с дренажом улучшаются. Если у маленьких детей слишком много ушных инфекций, им могут потребоваться антибиотики или специальные ушные трубки.
Аллергия и астма также могут вызывать повторный синусит (заложенный или мокрый нос) и хрипы. Аллергия может вызвать A body tissue’s protective response to injury.» rel=»tooltip»> воспаление внутри носа, которое длится долгое время. Из-за воспаления нормальные дренажные пути носа и пазух раздуваются и закупориваются.Бактерии разрастаются, вызывая инфекцию. Лекарство необходимо для лечения причины инфекции, которой является аллергия .
Постоянный кашель и хрипы, возникающие при легких вирусных инфекциях, могут быть признаком астмы. Иногда, когда мы думаем, что у детей пневмонии как осложнение простуды , у них действительно астма. Эти дети нуждаются в лекарствах от астмы в дополнение к другим лекарствам от инфекций.
В некоторых случаях ответ — только случай.В редких случаях у здорового ребенка может быть 2 или 3 тяжелых инфекции без очевидной причины. Однако ваш врач может попросить вашего ребенка пройти несколько простых скрининговых тестов для проверки на иммунный дефицит (слабость иммунной системы). Это основная причина повторных тяжелых инфекций.
Однако ваш врач может попросить вашего ребенка пройти несколько простых скрининговых тестов для проверки на иммунный дефицит (слабость иммунной системы). Это основная причина повторных тяжелых инфекций.
Различия между бактериальными и вирусными инфекциями
Лето в Хьюстоне подходит к концу, а впереди осень и зима. Из-за смены сезонов довольно часто можно подхватить какую-либо болезнь.Наш организм может заразиться множеством болезней, и нам нужно знать, что все они из себя представляют. Некоторые из наиболее распространенных инфекций, которые мы можем заразить, — это бактериальные и вирусные, и оба имеют разные значения. Разберитесь в различиях бактериальных и вирусных инфекций, чтобы предпринять необходимые шаги, чтобы поправиться.
Бактериальные инфекции
Бактерии — это маленькие уникальные микроорганизмы, образующие единственную клетку. Бактерии есть повсюду, но только патогенные бактерии могут вызывать инфекции.Бактериальные инфекции обычно передаются через тесный контакт с кем-то, у кого есть бактериальная инфекция. Инфекция также может передаваться через жидкости организма. Если у беременной матери бактериальная инфекция, она также может передаваться ее ребенку. Загрязненные поверхности — еще один способ проникновения бактериальных инфекций в организм. Вы можете лечить эти инфекции антибиотиками. Мы контактируем с несколькими различными заболеваниями, в том числе со следующими:
Инфекция также может передаваться через жидкости организма. Если у беременной матери бактериальная инфекция, она также может передаваться ее ребенку. Загрязненные поверхности — еще один способ проникновения бактериальных инфекций в организм. Вы можете лечить эти инфекции антибиотиками. Мы контактируем с несколькими различными заболеваниями, в том числе со следующими:
- Сальмонелла
- Туберкулез
- Гонорея
- Ангина
- Инфекция уха
- Инфекция мочевыводящих путей
Вирусные инфекции
Вирусы также являются микроорганизмами, но они намного меньше по размеру и могут быть более ужасными.Как и бактериальные инфекции, вирусы могут передаваться через контакт, жидкости организма, беременную мать ее ребенку и прикосновение к зараженной поверхности. Вирусы отличаются тем, что они могут существовать намного дольше, чем бактериальная инфекция, и могут вызывать более серьезные проблемы. Некоторые распространенные вирусные инфекции включают следующее:
- Обычный старый
- Грипп
- СПИД
- Ветряная оспа
Помните о различиях между бактериальными и вирусными инфекциями, чтобы иметь представление о том, как их лечить. Тем не менее, мы по-прежнему рекомендуем вам посетить Хьюстонскую ЛОР-клинику, чтобы вы могли пройти надлежащий осмотр у специалиста.
Тем не менее, мы по-прежнему рекомендуем вам посетить Хьюстонскую ЛОР-клинику, чтобы вы могли пройти надлежащий осмотр у специалиста.
Опубликовано в: Sinus
от А до Я: вирусная инфекция (для родителей)
Также может называться: Вирус
Вирусная инфекция — это инфекция или заболевание, вызванное вирусом (разновидностью микроба).
Дополнительная информация
Инфекции могут быть вызваны различными микробами, такими как бактерии или вирусы.Популярный
инфекции могут вызывать множество различных симптомов, таких как лихорадка,
заложенность, боль в горле, кашель, боль в ушах, рвота, диарея,
или сыпь.
Иногда ответственный вирус легко определить, а иногда нет. возможный. Хотя и вирусные, и бактериальные инфекции могут вызвать тошноту, только инфекции, вызванные бактериями, можно лечить антибиотиками.
Антибиотики не помогут вылечить вирусную инфекцию и не защитят ее от заразности, и иногда может вызывать ненужные побочные эффекты.
Помните
Вирусные инфекции могут быть неприятными и неприятными. Но с отдыхом и поддержкой уход (например, обезвоживание), большинство людей почувствуют себя лучше через несколько дней.
Все словарные статьи от А до Я регулярно проверяются организацией KidsHealth medical..jpg)

 pneumoniae, H. influenzae,
pneumoniae, H. influenzae,