ревакцинация акдс как переносится — 25 рекомендаций на Babyblog.ru
В этой передаче мы будем говорить о вакцине АКДС, которая используется во всех странах мира и которая спасла миллионы жизней.
Тема очень актуальная и очень болезненная для нашей страны. С помощью этого препарата обеспечивается профилактика сразу от нескольких болезней, и это уменьшает число хождений в поликлинику, количество уколов, риск инфицирования в поликлинике, но не увеличивает риск осложнений и не препятствует качеству вырабатываемого иммунитета. Тем не менее, слово АКДС у всех на слуху, потому что рано или поздно каждая мама слышит это от своего педиатра.
Расшифровывается АКДС:
А — означает адсорбированный. Есть такое вещество гидроокись алюминия, это особый препарат который вводится в мышцу, где он длительное время сохраняется и не всасывается в кровь, но на это вещество сорбируют дифтерийные и столбнячные анатоксины. То есть благодаря этому организм может вырабатывать иммунитет к дифтерии и столбняку и в эту же вакцину добавляют компоненты коклюшной бактерии. Таким образом, мы обеспечиваем защиту от трех болезней — коклюша, дифтерии и столбняка. По большому счету все слышат, что там или тут кто-то кашляет, потому что заболел коклюшем, но, тем не менее, услышать о том, что кто-то заболел дифтерией или столбняком в цивилизованном мире огромная редкость. Доктор Комаровский хочет напомнить всем у кого есть сомнения по поводу целесообразности вакцинации, что до появления вакцин от дифтерии, 20% детей болели этой болезнью из которых 50% погибали, а с появлением дифтерийной сыворотки умирало всего 5%.
В странах, где нет вакцинации, до сих пор люди умирают от столбняка, и за прошлый год в мире от столбняка умерло 250 тысяч человек. Доктор говорит, что столбняк очень опасная болезнь и если им заболеть то при самом лучшем лечении умирают 85%. Страшнее столбняка только бешенство, от которого умирают 100% заболевших. До того как начали делать прививки от коклюша, им болели все дети и при этом минимум один из 2 тысяч умирал.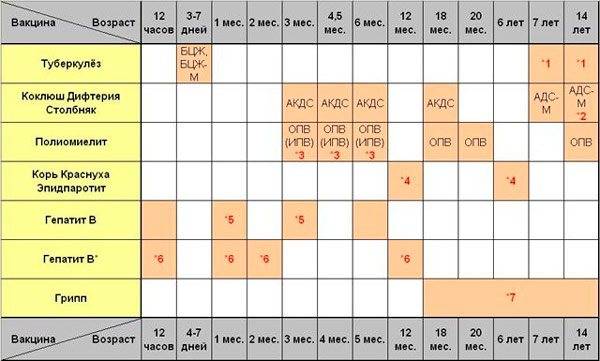
В медицине есть два термина, о которых все слышали, но мало кто понимает разницу:
1. Вакцинация;
2. Ревакцинация
Нужно чтобы в крови возник уровень антител, которые защищают организм от болезни. Оказывается, что при введении АКДС для того чтобы возник тот самый уровень, необходимо сделать 4-и укола. 3 укола делаются с интервалом 1 — 1,5 месяца, и потом через год делают еще 1 укол. Обычно АКДС вводят ребенку в 3, 4, 5 месяцев и последний в полтора года. Эти четыре введения и называются вакцинацией, и в полтора года человек получает абсолютный уровень антител к коклюшу, дифтерии и столбняку.
Вакцина Пентаксим на страже детского здоровья!
22.03.2020
Комбинированная вакцина Пентаксим предназначена для профилактики пяти наиболее опасных детских инфекций: коклюша, дифтерии, столбняка, полиомиелита, а также заболеваний, вызванных гемофильной палочкой (Haemophilus influenza типа b). Вакцина произведена компанией Sanofi Pasteur S.A. (Франция), в условиях, соответствующих требованиям Надлежащей производственной практики GMP (Good Manufacturing Practice).
Препарат уже много лет успешно используется для вакцинации детей в странах Евросоюза и США, на территории Российской Федерации вакцина Пентаксим применяется с 2008г .
На данный момент в России Пентаксим рекомендован к применению у детей, достигших трехмесячного возраста и разрешен к постановке до 5 лет 11 месяцев 29 дней, затем для дальнейшей ревакцинации применяют вакцины, содержащие уменьшенное количество антигенов (Адасель, АДС-м).
В соответствии с Национальным календарем профилактических прививок Российской Федерации, курс вакцинации для профилактики коклюша, дифтерии, столбняка, полиомиелита состоит из трех введений препарата с интервалом между прививками 45 дней, соответственно в возрасте 3, 4.5, 6 месяцев; ревакцинация проводится однократно в возрасте 18 месяцев.
Когда приходит время вакцинации ребенка, родители всегда задаются вопросами: какой вакциной лучше прививать ребенка? Велика ли разница между Пентаксимом и отечестенной вакциной АКДС, которую предлагают поставить в детской поликлинике?
Главным отличием Пентаксима от цельноклеточной вакцины АКДС является способ его получения, благодаря которому, Пентаксим характеризуется более низкой реактогенностью, в сравнении со своим аналогом. Пентаксим является бесклеточной вакциной, которая содержит в своем составе только лишь фрагменты антигенов коклюшного компонента — это делает французскую вакцину более безопасной, а сам укол менее болезненным, к тому же уменьшает нагрузку на иммунную систему ребенка. Что можно сказать о вирусе полиомиелита в составе вакцины Пентаксим? — он инактивирован, таким образом, привитой Пентаксимом ребенок не является «заразным» для окружающих непривитых лиц, поскольку даже в минимальных дозах не способен выделять в окружающую среду вирус полиомиелита. Исключается необходимость в длительной изоляции (в течение 60 дней!) непривитого человека от привитого ребенка – как в случае с живой полиомиелитной вакциной отечественного производства. После вакцинации ребенок может смело посещать организованные детские коллективы. Что касается дополнительных компонентов, встречающихся в других вакцинах, то ни ртути, ни фенолового красного в составе Пентаксима нет.
Немаловажным «плюсом» Пентаксима является еще и то, что вакцина дает возможность провести иммунизацию ребенка от пяти заболеваний (против коклюша, дифтерии, столбняка, полиомиелита, гемофильной инфекции (Haemophilus influenza типа b) с помощью всего четырех инъекций.
Пентаксим безопасен, эффективен, при этом нагрузка антигенами значительно ниже, чем если бы ребенка прививали обычными способами от тех же самых заболеваний ( АКДС + полиомиелитная вакцина+ вакцина против гемофильной инфекции).
Во всех случаях нарушения графика вакцинации врач руководствуется инструкцией по применению лекарственного препарата и рекомендациями Национального календаря профилактических прививок РФ. Но несмотря на индивидуальные смещения плана календарных прививок, интервалы между введениями вакцинирующих доз препарата не изменяются, как и интервал перед ревакцинацией (он составляет 12 месяцев).
Пентаксим является лучшей импортной вакциной, которая изготавливается в соответствии с международными нормами производства вакцин, не содержит опасных компонентов, редко вызывает побочные эффекты и обладает хорошей переносимостью.
Благодаря разработкам современной фармакологии, многие смертельно опасные заболевания взяты под контроль. К одним из средств, стоящих на страже здоровья самых маленьких пациентов относится Пентаксим .
В завершение, отвечу на наиболее часто задаваемые вопросы о вакцинации препаратом Пентаксим:
Сделали вакцину Пентаксим, когда следующая?
— Три вакцинирующие дозы вакциной Пентаксим выполняются с интервалом в 45 дней, далее следует ревакцинация — срок её выполнения наступает через 12 месяцев после последней (третьей) вакцинации.
Можно ли ревакцинацию АКДС сделать Пентаксимом?
— Безусловно можно! Срок постановки ревакцинирующей дозы Пентаксим не изменяется и в Вашем случае составляет также 12 месяцев после третьей вакцинации АКДС, но стоит помнить еще и о том, что в составе вакцины Пентаксим есть еще и полиомиелитный компонент- необходимо учесть сроки ревакцинации против полиомиелита (если вакцинации АКДС и от полиомиелита выполнялись не одновременно, как это предусмотрено календарным планом вакцинации, а в разные дни).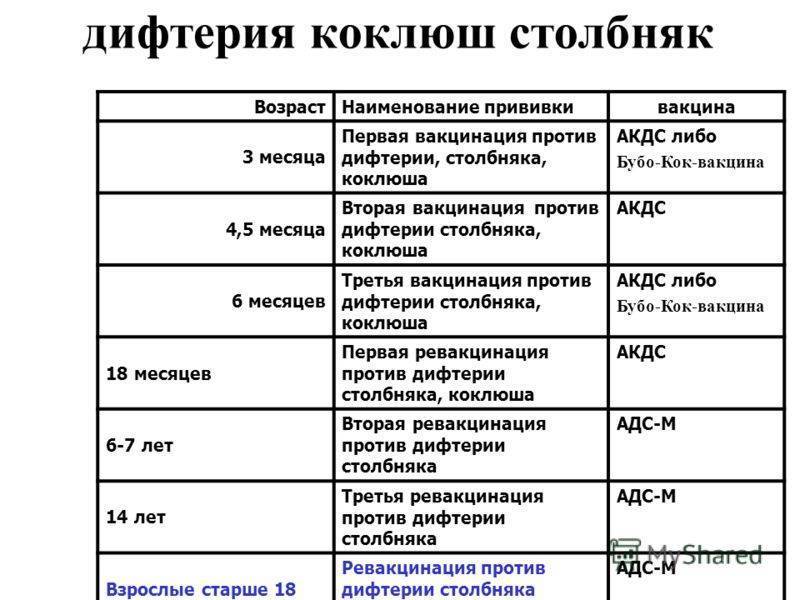
Можно ли сделать ревакцинацию Пентаксимом?
— Можно, в случае если ревакцинации АКДС и от полиомиелита совпадают по срокам.
После Пентаксима сделали АКДС, можно ли продолжить вакцинацию снова Пентаксимом?
— Продолжать вакцинацию или выполнять ревакцинация после АКДС вакциной Пентаксим возможно с учетом вакцинации против полиомиелита.
Где сделать ребенку прививку Пентаксимом?
— Будем рады предложить Вам услуги Детского диагностического центра по вакцинации детей.
В январе поставили сыну прививку Пентаксим, врач сказала что нужно ставить ещё через 45 дней. А сколько нужно сделать прививку пентаксим? Каждый раз нужен осмотр врача?
— Прививка Пентаксим ставится трижды, с минимальным перерывом в 45 дней, и четвертая, ровно через год от третьей. Осмотр педиатром перед вакцинацией не просто «нужен», а строго необходим! Ведь при осмотре доктор решает вопрос: ставить прививку сегодня или перенести вакцинацию на другую дату? т.к. у ребенка на момент осмотра могут быть отклонения в состоянии здоровья, которые вероятно понесут за собой отрицательные последствия. Например, чтобы Вам было понятно: ребенок чувствует себя на приеме хорошо, а при осмотре выявлено «красное» горло, педиатр предлагает подойти на прививку в другую дату, а вечером у ребенка появился кашель, насморк и температура. И какая уж тут прививка?! Еще, кроме осмотра педиатра, в нашем центре перед вакцинацией необходимо сдать общие анализы крови и мочи, которые детки сдают не ранее, чем за 3 дня до вакцинации, чтобы быть на 100% уверенным, что данная вакцинация не навредит малышу.
Если у Вас остались какие-либо вопросы касательно вакцинации, приглашаем Вас на бесплатную консультацию педиатра по прививкам. Прием доктора осуществляется по предварительной записи.
Записаться на консультацию Вы можете, позвонив по одному из номеров телефонов:
+7(496)797-01-70
+7(926)535-55-26
+7(925)518-83-86
Чтобы дети были здоровы — прививайте их своевременно и качественными вакцинами!
Возврат к списку
Вакцинация против дифтерии, столбняка и коклюша (АКДС) и против полиомиелита
В 3 месяца начинается вакцинация против коклюша, дифтерии, столбняка, полиомиелита. В Национальный календарь защита от данных инфекций введена в 1953 году, а против столбняка с 1966. Для вакцинации используются следующие вакцины:
В Национальный календарь защита от данных инфекций введена в 1953 году, а против столбняка с 1966. Для вакцинации используются следующие вакцины:
— АКДС – это адсорбированная комбинированная вакцина, которая содержит убитую цельную коклюшную палочку (поэтому она еще называется цельноклеточная), анатоксин (обезвреженный токсин) дифтерийный и анатоксин столбнячный. Это российская вакцина (Микроген) и ее использование практически ликвидировало дифтерию и столбняк и заметно уменьшило число случаев коклюша.
Единственное, что не нравится многим родителям – это подъем температуры в первые сутки – это вариант нормальной реакции на вакцинацию, так как клетки иммунной системы начинают активно работать в ответ на контакт с обломками коклюшной палочки.
Но вакцинопрофилактика постоянно совершенствуется, и в настоящее время выпускаются вакцины бесклеточные (или ацеллюлярные). Данные вакцины содержат только 2 или 3 коклюшных антигена, в их составе нет целой коклюшной палочки (до 3000 коклюшных антигена). Но на сегодня подобные вакцины только зарубежного производства. В России зарегистрировано несколько подобных вакцин:
— первая вакцина, зарегистрированная в России в начале 2000 годов – Инфанрикс (ГлаксоСмитКляйн, Бельгия). Вакцина содержит 3 коклюшных антигена, дифтерийный и столбнячный анатоксины.
— несколько позже зарегистрирована вакцина Инфанрикс гекса (ГлаксоСмитКляйн. Бельгия). В дополнение к составу предыдущей вакцины здесь содержится еще инактивированная вакцина против полиомиелита, гепатита В и вакцина Хиберикс (против гемофильной палочки, которая является причиной осложнений при ОРВИ у детей раннего возраста).
— Пентаксим (Санофи, Франция), зарегистрирована и с успехом применяется в России с 2008 года. В своей комбинации данная вакцина содержит еще и инактивированную (убитую) вакцину против полиомиелита, вакцину против гемофильной палочки.
В редакции основного приказа по вакцинации в рамках Национального календаря N125н от 13.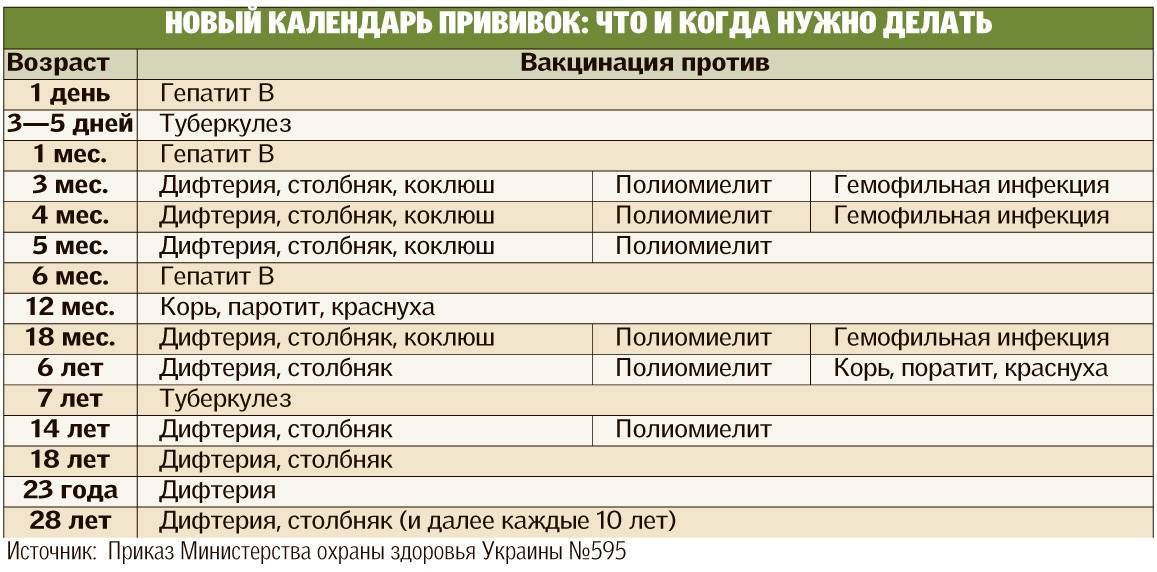 04.2017 есть следующие дополнения – определены дети из группы риска для вакцинации против гемофильной палочки и полного курса вакцинации инактивированной полиомиелитной вакциной:
04.2017 есть следующие дополнения – определены дети из группы риска для вакцинации против гемофильной палочки и полного курса вакцинации инактивированной полиомиелитной вакциной:
- С иммунодефицитными состояниями;
- С анатомическими дефектами, приводящими к резко повышенной опасности заболевания гемофильной инфекцией;
- С аномалиями развития кишечника;
- С онкологическими заболеваниями и /или длительно получающим иммуносупрессивную терапию;
- Рожденные от матерей с ВИЧ инфекцией;
- Находящиеся в домах ребенка;
- Недоношенные и маловесные дети.
Вакцинация и ревакцинация детям, относящимся к группам риска, может осуществляться иммунобиологическими лекарственными препаратами для иммунопрофилактики инфекционных болезней, содержащими комбинации вакцин (например, Пентаксим), предназначенных для применения в соответствующие возрастные периоды (редакция приказа МЗ РФ N 175н от 13.04.2017г).
Дети, не входящие в группу риска, могут по желанию родителей привиться бесклеточными препаратами для вакцинации против коклюша, дифтерии и столбняка платно. Информацию в таком случае можно получить у участкового педиатра.
Могут быть и другие варианты вакцинации детей, что зависит от возможностей регионального бюджета.
В 2016 году в России зарегистрирована вакцина Адасель (Санофи, Франция), она также не содержит целую коклюшную палочку, а содержание дифтерийного и столбнячного анатоксинов в составе меньше, чем в других препаратах. Данная вакцина, в основном, предназначена для ревакцинации детей старше 4 лет и взрослых (после 14 лет можно каждые 10 лет), так как иммунитет против коклюша недлительный.
Для детей, кто не привит вовремя и имеет возраст старше 4 лет, по Национальному календарю прививаются только против дифтерии и столбняка (вакцинация АКДС препаратом проводится до 4 лет, препаратом Инфанрикс гекса до 36 мес), но по желанию родителей может быть выполнена вакцинация и препаратами Пентаксим и Инфанрикс, так как они не имеют возрастных ограничений.
Для вакцинации против полиомиелита также существуют изменения в Национальном календаре с 2014 года.
Если раньше для массовой вакцинации с 1958-59 годов использовали живую ослабленную вакцину Сэбина (она содержала 3 вакцинных штамма полиовируса), далее для предупреждения вакциноассоциированного полиомиелита у привитых и у контактных непривитых с 2014 года схема вакцинации изменилась:
-V1 и V2 все дети получают инактивированную вакцину в 3 мес. и в 4,5 мес.,
-V3 в 6 мес. и последующие ревакцинации в 1 г 6 мес., 1 г 8 мес. и в 14 лет получают оральной полиомиелитной вакциной ОПВ, причем с весны 2017 года ОПВ содержит только 2 штамма прививочных вирусов – I и III- БиВак полио (ФНЦИРИП им Чумакова, Россия).
Инактивированные вакцины, зарегистрированные в России:
- Имовакс Полио (Санофи, Франция) – применяется на сегодня в составе комбинированной вакцины Пентаксим,
- Полиорикс (ГлаксоСмитКляйн, Бельгия) – применяется на сегодня в составе комбинированной вакцины Инфанрикс гекса,
- Полимилекс (Нанолек, Россия) – применяется для проведения V1 и V2 против полиомиелита с весны 2017 г.
Дифтерия – это серьезная инфекция, которой болеют и взрослые, и дети. Причина инфекции – дифтерийная палочка, которая передается воздушно-капельным путем, иногда через общие игрушки, предметы быта. Дифтерия поражает нос, глотку, гортань, реже – кожу, глаза. У больного образуются пленки в зеве, которые могут распространиться в нос и гортань и перекрыть дыхание. У детей до года пленки сразу переходят на гортань, голосовые связки, появляется круп (отек гортани). В этих случаях требуются неотложные мероприятия, иначе человек задохнется. Кроме того, дифтерия чревата серьезными осложнениями – поражением сердца, почек, нервной системы. Избежать заболевания можно только при своевременной вакцинации. Вакцинация защищает от токсина, вырабатываемого бактерией дифтерии, который и вызывает все жизнеугрожающие состояния.
Привитые люди не болеют тяжелой опасной формой дифтерии. У них возможно развитие ангины, но жизни это не угрожает.
Столбняк (тетанус) – острая инфекция с поражением нервной системы, вызванное токсином, который выделяет столбнячная палочка, когда попадает в рану из земли. Столбняк протекает крайне тяжело и может развиться в любом возрасте. Токсин поражает нервную систему, при этом возникают мышечные спазмы и судороги. Смертность при столбняке достигает 90%. Иммунитет при вакцинации формируется против токсина, как и при дифтерии.
Коклюш – заболевание с особым поражением дыхательной системы, характеризуется приступообразным «спазматическим» кашлем. Ребенок «заходится» в кашле до рвоты, покраснения лица и появлением мелких кровоизлияний на лице, склерах глаз. Особенно приступы кашля беспокоят ночью и под утро Коклюш опасен осложнениями- воспалением легких, а у маленьких детей – смертью из-за апноэ – остановки дыхания, судорогами и поражением мозга из-за кислородного голодания
Полиомиелит – вызывается тремя типами полиомиелитных вирусов, передаётся с водой и пищей. От полиомиелита, как правило, не умирают, но может остаться паралич или парез, чаще одной ноги, при котором конечность постепенно худеет и укорачивается, а ребенок или тяжело хромает, или совсем не может двигаться без поддержки. Иногда развивается паралич дыхательных мышц и человек не может дышать без помощи специальных аппаратов.
Вакцины АКДС и инактивированная против полиомиелита вводятся внутримышечно в переднебоковую поверхность бедра.
План вакцинации.
Вакцинация АКДС и против полиомиелита начинается в 3 мес. После проведения вакцинации и ревакцинации АКДС (см ниже), согласно календарю прививок, проводятся ревакцинации взрослых каждые 10 лет (вакциной АДС-М).
Вакцинация детей согласно календарю прививок:
|
Возраст |
|
|
Первая вакцинация АКДС и Полимилекс |
3 месяца |
|
Вторая вакцинация АКДС и Полимилекс |
4,5 месяца |
|
Третья вакцинация АКДС и БиВак полио
Ревакцинация 2 Бивак полио
Ревакцинация 2 АДС-м
Ревакцинация 3 АДС-м и БиВак полио
|
6 месяцев
20 месяцев
7 лет
14 лет |
Побочные эффекты.
Вакцина АКДС вызывает умеренные побочные эффекты: небольшая лихорадка в первые сутки; умеренная болезненность, покраснение и припухание в месте инъекции может возникнуть при V 3 или R 1. Повышение температуры тела (как правило, не выше 37,5 С) и легкое недомогание также могут наблюдаться в течение 1-2 дней после прививки, редко (до 4 % может быть подъем t выше 38). При t выше 38,5 необходимо дать в домашних условиях жаропонижающие препараты по рекомендации врача парацетамол или ибупрофен. В случае повторного подъема t или недостаточного ответа на жаропонижающие препараты нужно вызвать педиатра или скорую помощь и объем необходимой терапии назначит врач. Обтирания водкой или спиртом не рекомендуется.
У детей, склонных к аллергическим реакциям, может быть сыпь, поэтому педиатр может назначить противоаллергические препараты до и после вакцинации.
Серьезные осложнения, вызванные АКДС – иммунизацией редки; они происходят меньше чем в одном проценте случаев. Это могут быть судороги на фоне высокой температуры, поэтому детей с возможной реакцией рекомендуется прививать на фоне жаропонижающих средств (парацетамол или ибупрофен).
Для того, чтобы уменьшить число побочных эффектов на цельноклеточную АКДС вакцину, её можно заменить комбинированным аналогом (вакцина Пентаксим, Инфанрикс), в которых цельноклеточный коклюшный компонент (до 3000 антигенов) заменен на бесклеточный вариант (2-3 антигена), который практически не вызывает побочных реакций. Кроме того, комбинированные вакцины значительно снижают инъекционную нагрузку, позволяют уменьшить суммарную дозу дополнительных веществ (стабилизаторы вакцин, консерванты).
После прививки коклюша иммунитет недолгосрочный и спустя 5-7 лет можно заболеть коклюшем. Для ревакцинации в 7 лет, 14 лет и далее ч/з 10 лет можно использовать вакцину Адасель. Единственное, привитые могут заболеть в более стертой форме – в диагнозе может звучать бронхит или пневмония, может не быть характерных приступов спазматического кашля, но для непривитых такой больной является источником инфекции.
Исследования
Каково Ваше мнение о целесообразности вакцинации новорожденных в первые месяцы жизни? Справедливо ли мнение, что в возрасте до 6 месяцев иммунная память не формируется? Имеются ли современные статистические данные о том, насколько риск заразиться опасными инфекциями в этом возрасте превышает риск осложнений от прививки?
Когда ребенок появляется на свет, он обычно имеет иммунитет к некоторым болезням. Это заслуга борющихся с болезнями антител, которые передаются через плаценту от матери к будущему новорожденному. Впоследствии, кормящийся грудью младенец постоянно получает дополнительные антитела с грудным молоком. Но такой иммунитет носит временный характер.
Вакцины стимулируют ответ иммунной системы так, как будто имеет место реальная инфекция. В организме ребенка формируются собственные антитела, которые запоминают информацию о возбудителе и борются с ним при встрече.
Согласно отечественному Календарю профилактических прививок до 6 месяцев жизни ребенок вакцинируется против 8 инфекционных заболеваний. Коротко остановимся на каждом из них.
Для профилактики туберкулеза всех детей в роддоме прививают вакциной БЦЖ-М. Вакцина предотвращает у детей до 80% тяжелых форм инфекции, но не предотвращает инфицирования. Туберкулез у маленького ребенка чаще всего поражает легкие с развитием массивных поражений легочной ткани и лимфатических узлов, которые даже в случае излечения остаются потенциальным источником туберкулеза в будущем.
Почему прививку БЦЖ делают в роддоме?
Вопервых, тем самым удается создать иммунитет в самом раннем возрасте (на это уходит 8–10 недель), а во-вторых, внутрикожное введение микродозы БЦЖ-М требует высокой квалификации, и иметь в роддоме такого специалиста проще, чем в каждой поликлинике.
Гепатит B — вирусное заболевание, при котором поражается печень. Матери-носительницы вируса или больные острым гепатитом В передают вирус своему ребенку в родах, с чем и связана вакцинация против гепатита В в первые 24 часа жизни. При вакцинации в первые часы жизни ребенок никогда не инфицируется от матери и не заболеет гепатитом В. Кроме того, в отличие от взрослых, заболевший гепатитом В на первом году жизни ребенок с вероятностью 90% становится пожизненным носителем вируса.
АКДС вакцина защищает против дифтерии, столбняка и коклюша. Использование АКДС вакцины практически ликвидировало дифтерию и столбняк и заметно уменьшило число случаев коклюша.
Коклюш — поражение дыхательной системы, характеризуется длительным «спазматическим» кашлем. Осложнения могут развиться у детей первого года жизни и новорожденных, т.к. они особенно восприимчивы к этой инфекции.
Типичный коклюш проявляется характерным приступообразным кашлем, который может продолжаться до 2 месяцев, в тяжелых случаях совершенно изматывая ребенка и его родителей. Коклюш протекает особенно тяжело и нетипично у детей первого года жизни. В этот период высока частота летальных исходов — до начала массовых прививок смертность среди детей первого года жизни составляла 50–60%, детей других возрастов — 8%.
Заболеваемость дифтерией в настоящее время находится на относительно невысоком уровне. Однако многие, наверное, еще помнят эпидемию начала 90х гг., когда около 120 000 человек заболели дифтерией, а свыше 5000 погибли. С одной стороны, причиной трагедии стал массовый отказ от прививок, начиная со второй половины 80х гг. Не последнюю роль в этом сыграла антипрививочная кампания в прессе. С другой — низкий уровень иммунитета у взрослых, который не «подстегивался» своевременными ревакцинациями. Лишь массовая вакцинация взрослых наряду с ростом охвата прививками детей позволила переломить ход эпидемии дифтерии в нашей стране. Вакцинация целесообразна еще и потому, что после перенесенного заболевания иммунитет непрочен.
Не последнюю роль в этом сыграла антипрививочная кампания в прессе. С другой — низкий уровень иммунитета у взрослых, который не «подстегивался» своевременными ревакцинациями. Лишь массовая вакцинация взрослых наряду с ростом охвата прививками детей позволила переломить ход эпидемии дифтерии в нашей стране. Вакцинация целесообразна еще и потому, что после перенесенного заболевания иммунитет непрочен.
Столбняк вызывается действием токсина, выделяемого столбнячной палочкой, и характеризуется поражением нервной системы в виде судорог, приводящих в тяжелых случаях к нарушению дыхания и параличу сердца. Инфицирование связано с травматизмом и происходит при загрязнении ран почвой или занозами, зараженными спорами столбнячной бациллы. Столбняк иногда называют «болезнью босых ног». У больных нередко развиваются осложнения, и даже при своевременно начатом лечении каждый четвертый случай заканчивается смертью больного. Несмотря на широкую распространенность возбудителя, заболеваемость в нашей стране благодаря массовой вакцинации находится на очень низком уровне. Практически не регистрируется столбняк новорожденных, у которых он раньше заканчивался очень часто летальным исходом.
Благодаря массовой вакцинации в России уже несколько лет не регистрируются случаи заболевания, вызванного диким (природным) полиовирусом. Таким образом, можно признать, что в нашей стране одержана победа над второй (после оспы) страшной болезнью. Однако риск завоза вируса из-за границы по-прежнему существует, поэтому продолжать прививаться нужно.
Гемофильная инфекция— группа бактериальных заболеваний, протекающих в виде менингитов, отитов, синуситов, пневмоний, эпиглоттитов (воспаление надгортанника). По данным международных и российских исследований, примерно половина всех гнойных бактериальных менингитов у детей раннего возраста вызываются гемофильной палочкой (b типа). На Западе ежегодно регистрируются лишь единичные случаи заболевания, поскольку в развитых странах существует прививка против гемофильной инфекции, которая проводится в плановом порядке вместе с вакцинацией против дифтерии, столбняка и коклюша. Вакцинация безопасна и очень удобна, так как проводится комбинированными вакцинами.
На Западе ежегодно регистрируются лишь единичные случаи заболевания, поскольку в развитых странах существует прививка против гемофильной инфекции, которая проводится в плановом порядке вместе с вакцинацией против дифтерии, столбняка и коклюша. Вакцинация безопасна и очень удобна, так как проводится комбинированными вакцинами.
Клинические формы пневмококковой инфекции разнообразны — пневмония, отит, фарингит, менингит, сепсис и др. Известно 90 различных серотипов пневмококков, устойчивых к традиционным антибиотикам. При пневмококковом сепсисе летальность достигает 60%, при пневмококковом менингите — 20%. В России основной формой этой инфекции является ОРЗ и острая внебольничная пневмония. Именно пневмококком вызывается большинство случаев воспаления легких у детей.
Прививки, прежде всего, необходимы детям с хроническими заболеваниями легких и сердца, сахарным диабетом, инфицированным микобактериями туберкулеза, часто болеющим.
Насколько безопасна и эффективна комбинированная вакцинация?
Многолетним российским и международным опытом доказано, что вакцинация комбинированными вакцинами не приводит к «перегрузке» иммунной системы и увеличению уровня побочных реакций по сравнению с моновалентными препаратами. Наш организм постоянно (при дыхании, приеме пищи и т.д.) сталкивается с огромным количеством антигенов (чужеродных веществ), обеспечивая защиту внутренней среды. При проникновении во внутреннюю среду даже одного микроорганизма он может вырабатывать десятки видов антител к каждому из его белков. При смешанных инфекциях это число возрастает многократно, так что одновременное введение нескольких вакцин не создает чрезвычайной ситуации, поскольку иммунная система человека способна обработать до 10 тысяч таких антигенов. Кроме того, комбинированные вакцины так же эффективны, как и раздельные, моновалентные, никакой «конкуренции» между входящими в состав вакцин компонентами не происходит, как не происходит и суммирования рисков побочных реакций.
Помимо других моментов, прививка комбинированной вакциной психологически лучше переносится детьми, нежели раздельные уколы. Комбинированные вакцины также добавляют удобства, экономя время родителей и врачей.
Какие возможны реакции на прививку?
Комбинированная вакцина против дифтерии, столбняка и коклюша (в значительной степени по причине именно коклюшного компонента) более часто, чем другие, дает побочные реакции, что вызывает у некоторых родителей опасения. Препарат действительно может вызывать повышение температуры и недомогание.
Для их предупреждения врач должен назначить профилактический прием жаропонижающих и, если это требуется, антигистаминных (противоаллергических) препаратов. В очень редких случаях вакцина вызывает осложнения со стороны нервной системы, обычно без остаточных изменений. Но ведь сам коклюш намного чаще вызывает тяжелые энцефалиты, так что отказ от вакцинации не уменьшает, а намного увеличивает риск неврологических осложнений для ребенка. Поскольку прививают не живой, а убитой вакциной, заболеть коклюшем, дифтерией или столбняком в результате прививки невозможно. Иногда врач рекомендует проводить курс вакцинации без коклюшного компонента. Но важно знать, что зачастую отводы от прививок делаются необоснованно. Так, нередко обострения диатеза, наблюдаемого после прививки, на самом деле связаны с погрешностями в питании. Детей с аллергической патологией прививать можно и нужно, но важно, чтобы вакцинация проводилась не в период разгара диатеза и на фоне антигистаминной терапии.
Многие боятся ставить прививку от гриппа больше самого гриппа. Действительно ли риски настолько велики (по сравнению с вакцинами от других заболеваний)?
Среди вирусов, вызывающих острые респираторные вирусные заболевания, в первую очередь следует отметить грипп. Это одна из наиболее тяжелых и опасных ОРВИ, особенно для детей младшего возраста. Вирус гриппа крайне изменчив, практически ежегодно появляются новые его разновидности, к которым мы оказываемся восприимчивыми.
Вирус гриппа крайне изменчив, практически ежегодно появляются новые его разновидности, к которым мы оказываемся восприимчивыми.
Слышала от врачей о неэффективности прививок от гриппа. Хотя в детском саду настаивают на прививке. Хотелось бы узнать Ваше мнение. И какая вакцина наиболее эффективна?
Против гриппа есть эффективные вакцины, защищающие с 6-месячного возраста от нескольких наиболее опасных разновидностей вируса. Некоторые противогриппозные вакцины, в т.ч. отечественные, имеют специальную форму выпуска для детей до 3 лет и не содержат консервантов. На них практически не бывает побочных реакций. Прививаться следует ежегодно как по причине высокой изменчивости вируса, так и из-за непродолжительности иммунитета (9-12 мес.).
Какая вакцина от гриппа самая безопасная, если после гриппола ребенок заболел?
На острые респираторные заболевания (ОРЗ) приходится подавляющее большинство острых заболеваний у детей. ОРЗ вызываются более чем 200 разновидностями вирусов, а также другими микроорганизмами, в частности, бактериями. Прививка от гриппа защищает только от гриппа, а не от всех респираторных заболеваний вместе взятых. Привитый от гриппа ребенок может инфицироваться другими вирусами и заболеть.
В тоже время отечественная гриппозная вакцина Гриппол® плюс обладает высоким профилем безопасности, соответствующим международным требованиям, не содержит консерванта, выпускается в удобной готовой к применению упаковке – шприц-дозе и применяется для массовой иммунизации детей с 6 мес. против гриппа.
Ветряная оспа
Интересует Ваше мнение о прививке от ветрянки. Заболеет ли с ней ребенок ветрянкой? В какой форме будет протекать болезнь у привитого?
Ветряная оспа — детская инфекция, которую, в отличие от краснухи, трудно спутать с каким-либо другим заболеванием. Ветрянка очень заразное заболевание, им переболевает до половины населения страны. Обычно ветряная оспа поражает детей младше 10 лет. И хотя, ввиду относительно нетяжелого течения, ветрянка не является большой проблемой здравоохранения, может приводить к смертельно опасным и калечащим осложнениям, таким, как воспаление легких и энцефалит.
Обычно ветряная оспа поражает детей младше 10 лет. И хотя, ввиду относительно нетяжелого течения, ветрянка не является большой проблемой здравоохранения, может приводить к смертельно опасным и калечащим осложнениям, таким, как воспаление легких и энцефалит.
Хотела узнать про прививку ветрянки, если сейчас поставлю в 3 года ребенку, то он может заболеть уже будучи взрослым и в тяжелой форме? Или лучше просто ей переболеть маленьким?
Несмотря на распространенное (даже, к сожалению, среди врачей) мнение о том, что ветряная оспа является относительно доброкачественным детским заболеванием, на практике встречается осложненное течение инфекции в виде вторичных бактериальных поражений кожи, пневмонии и поражения ЦНС, которые могут регистрироваться у исходно здоровых пациентов. Отдаленным осложнением ветряной оспы, вызванным сохранением вируса в клетках нервной системы у переболевших, является опоясывающий герпес — крайне тяжелое неврологическое заболевание взрослых. Таким образом, все-таки лучше вакцинироваться против ветрянки в детском возрасте, тем более что вакцина против ветрянки зарегистрирована в России. Что касается продолжительности иммунитета, известно, что антитела у здоровых детей, привитых против ветряной оспы в раннем возрасте, сохранялись, по крайней мере, в течение 7 лет после вакцинации. Однократное введение вакцины формирует иммунитет у 78-82%, двукратное введение вакцин с интервалом 6-10 недель — у 99% привитых детей.
Другие инфекции
Расскажите, пожалуйста, про прививку от гемофильной инфекции, как после её постановки вести себя? Младшему ребенку должны в садике поставить.
Все вакцины против гемофильной инфекции слабо реактогенны. Прививочные реакции возникают относительно редко (5—30 %). Обычно они проявляются покраснением или уплотнением в месте введения, подъемом температуры тела до незначительных величин. Аллергические реакции маловероятны из-за отсутствия в вакцине примесей белковых компонентов.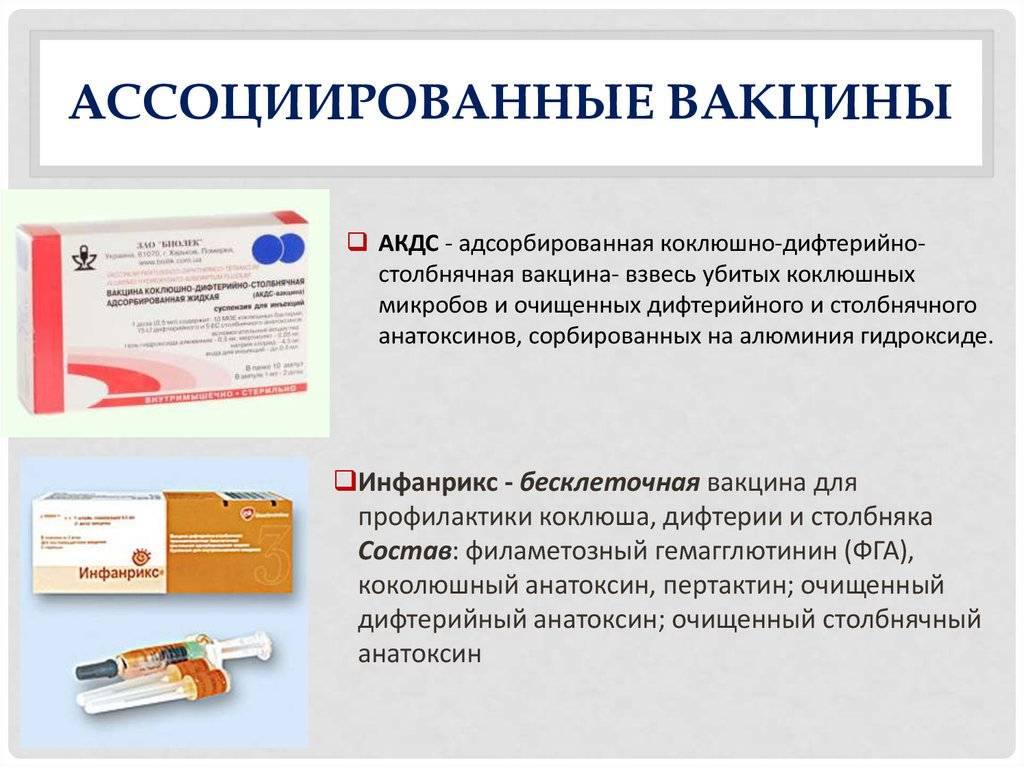 Серьезные осложнения не описаны.
Серьезные осложнения не описаны.
Как проверить эффективность прививки Пневмо-23? Как убедиться, что она привела к положительному результату?
Вакцина «Пневмо 23» используется с 2-х-летнего возраста и защищает от 23 наиболее опасных разновидностей пневмококка на срок до 5 лет. Ревакцинация обычно не рекомендуется, оправдана лишь у детей с аспленией или серповидно-клеточной анемией. Вакцинация проводится для профилактики инфекций, вызываемых пневмококками, включая сепсис, менингит, пневмонию, бактериемию и острый отит среднего уха. Проведенные многочисленные исследования по изучению титра антитела на вакцинацию показали ее высокую эффективность. Для населения снижение заболеваемости пневмониями, отитами и др., а также носительства пневмококков является по сути единственной возможностью проверить эффективность вакцинации.
Календарь прививок
Ребенку 2 года, из прививок пока поставлена только БЦЖ в роддоме. С каких прививок начинать прививаться? И нужно ли посетить сначала иммунолога, составить индивидуальный график прививок, сдать определенные анализы перед началом вакцинации, на что обращать внимание? Схемы по срокам прививок такие же как, если начать прививаться с рождения? Какие прививки после 2-х лет ставятся однократно?
Надо начинать прививаться с АКДС вакцины и полиомиелитной вакцины, сроки такие же, как и при начале вакцинации с 3-х месяцев жизни. Перед прививкой рекомендуется однократно сдать общий анализ крови и мочи, осмотр невролога, без посещения иммунолога. После 2-х лет однократно вводится вакцина против гемофильной инфекции (Акт-Хиб) и пневмококковой инфекции (Пневмо 23).
Сейчас ребенку 1 год и 3 месяца. Из прививок только БЦЖ, хотелось бы начать прививаться, но без коклюшного компонента. Какую схему порекомендуете?
Курс вакцинации АДС-анатоксином (против дифтерии и столбняка) состоит из 2 прививок с интервалом 30-45 дней. Ревакцинацию АДС-анатоксином проводят однократно через 9—12 мес. после законченного курса вакцинации. Последующие ревакцинации проводят АДС-М анатоксином в 7-8 лет, в 14-15 лет и каждые последующие 10 лет.
Ревакцинацию АДС-анатоксином проводят однократно через 9—12 мес. после законченного курса вакцинации. Последующие ревакцинации проводят АДС-М анатоксином в 7-8 лет, в 14-15 лет и каждые последующие 10 лет.
Интересует прививка от клещевого энцефалита. Ребенку 2 года, до этого не прививались. Какую вакцину и схему лучше выбрать?
Плановые прививки вакциной «ФСМЕ–ИММУН джуниор» проводятся у детей до 16 лет в сроки 0, 1—3 и 9—12 месяцев путем введения 0,5 мл вакцины внутримышечно. Ревакцинация проводится через 3 года после курса вакцинации. Вацкина «Энцепур-детский» вводится детям с 1 года до 11 лет по схеме 0, 1—3 месяца с ревакцинацией через 9—12 месяцев. Можете выбрать любую из этих вакцин.
Как правильно поступить в случае, если плановая прививка из нац.календаря была пропущена и не поставлена в срок? В поликлинике говорят, что нужно ее ставить одновременно со следующими из календаря, то есть ставить одновременно три, а то и четыре прививки?
Абсолютно верно.
Добрый день, подскажите про прививку от полиомиелита. Первые 3 мы ставили в комплексе с пентаксимом, 4-ая была живая (капли) в конце ноября 2014 года, потом получилось окно, так как то ребенок болел, то ставили другие. Сейчас надо ставить последнюю 5-ую, но в садике говорят, что в группе есть непривитые дети, и их должны будут высадить на 2 месяца из-за нас. Вопрос — имеет ли смысл сейчас ставить «убитую» вакцину или все же нужны капли?
Можно сделать «убитую» вакцину против полиомиелита.
Если будет просрочен срок второй прививки, то всё начинать заново? Перед садиком ставили от гепатита А. Вторая должна быть через 6-12 месяцев, но ребенок стал часто болеть и здорового периода хотя бы две недели для прививки не получалось.
Начинать заново не надо. Сделайте еще одну прививку против гепатита А.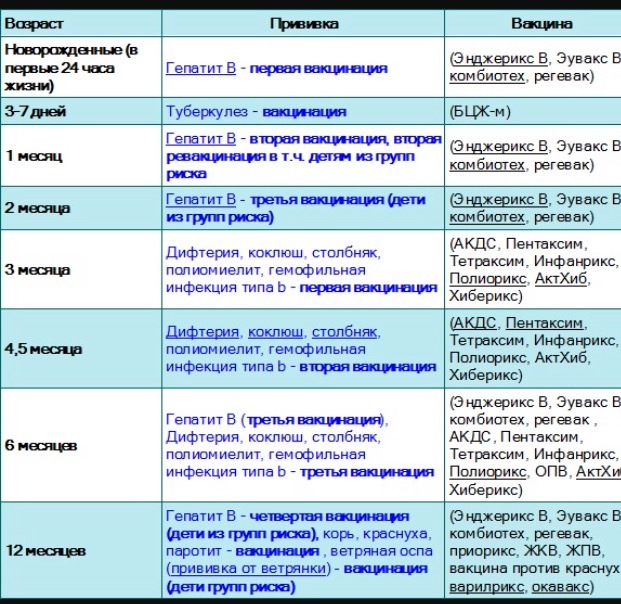
Через какой период после постановки прививка Пневмо-23 утрачивает свой эффект? Можно ли спустя 3 года с момента вакцинации вакциной Пневмо-23 повторить её, либо вакцинировать ребёнка Превенар-13?
Вакцина «Пневмо 23» используется с 2-х-летнего возраста и защищает от 23 наиболее опасных разновидностей пневмококка на срок до 5 лет. Ревакцинация обычно не рекомендуется.
Добрый день. Подскажите, пожалуйста. Ребенку 9 месяцев. На данный момент из прививок есть БЦЖ, 3 прививки от гепатита, 1 прививка от полиомиелита, 2 прививки пентаксима. Скоро будем планировать 3 прививку АКДС. Какую прививку выбрать: пентаксим или инфанрикс (надо ли ставить еще нам полиомиелит, если есть уже 3 прививки), какие прививки можно совместить с ней дополнительно из графика прививок?
Ребенок получил 3 прививки против полиомиелита, последующие ревакцинации проводят ОПВ (живая вакцина в виде капель в рот) через год после окончания курса первичной вакцинации, т.е. в 18 месяцев жизни, затем через 2 месяца (в 20 месяцев жизни) и в возрасте 14 лет. Таким образом, в настоящий момент ребенок не нуждается в прививке против полиомиелита. Рекомендую сделать отечественную вакцину АКДС, тем более, что сейчас отмечаются перебои с поставкой зарубежных вакцин Пентаксим и Инфанрикс. АКДС можно совместить с вакциной Превенар (против пневмококковой инфекции) в разные части тела.
Ребенку 5 лет. Прививки почти все по графику, но не успели поставить (медотвод по причине аллергии) первую ревакцинацию АКДС (и полиомиелит вместе с ней). Что сейчас делать — от двух врачей у меня есть два мнения — поставить АДС или поставить инфанрикс? И второй вопрос: в апреле 2014 первый раз поставили вакцину от клещевого энцефалита (Джуниор Австрия), в мае 2014 — вторая прививка. В мае 2015 не поставили. Что сейчас делать в данной ситуации?
Можно и так, и так. В случае АДС одновременно вводите живую вакцину против полиомиелита (ОПВ, капли в рот). Продолжительность иммунитета после законченного курса вакцинации ФСМЕ–ИММУН с третьей дозой составляет более 5 лет. Последние исследования, проведенные в Австрии, показывают, что у 90% привитых третья доза индуцирует иммунитет продолжительностью 8 и более лет. Таким образом, либо Вы просто вакцинируете ребенка третий раз в этом году (скорее всего антитела после предыдущих 2-х введений у него остались и после 3-его введения титр антител повысится еще больше), либо сдаете кровь на определение защитного титра антител. В России серопозитивными (иммунными) после вакцинации считаются сыворотки, титры специфических антител в которых в РТГА составляют не менее 1:10 (защитный титр).
Продолжительность иммунитета после законченного курса вакцинации ФСМЕ–ИММУН с третьей дозой составляет более 5 лет. Последние исследования, проведенные в Австрии, показывают, что у 90% привитых третья доза индуцирует иммунитет продолжительностью 8 и более лет. Таким образом, либо Вы просто вакцинируете ребенка третий раз в этом году (скорее всего антитела после предыдущих 2-х введений у него остались и после 3-его введения титр антител повысится еще больше), либо сдаете кровь на определение защитного титра антител. В России серопозитивными (иммунными) после вакцинации считаются сыворотки, титры специфических антител в которых в РТГА составляют не менее 1:10 (защитный титр).
Мы поставили Инфанрикс гекса один раз в 4 месяца, сейчас ребенку 1год 7 месяцев, ревакцинацию пропустили. После той прививки ребенку было очень плохо 4 дня. АКДС российскую ставить боимся, вакцины инфанрикс, пентаксим нет. Как дальше прививаться?
Рекомендую прививаться АКДС вакциной. В тех случаях, когда пропущен декретированный срок вакцинации, надо следовать общепринятому положению о том, что пробел в последовательности прививок не требует повторения всей серии. Вакцинацию в этих случаях надо продолжать так же, как если бы график иммунизации не нарушался, при этом для каждого ребенка следует составить индивидуальный календарь прививок.
Сколько может быть максимальный интервал по времени между 2 и 3 прививкой АКДС?
Курс вакцинации состоит из 3 прививок с интервалом 45 дней (3; 4,5 и 6 месяцев). При необходимости увеличения интервалов очередную прививку следует проводить в возможно ближайший срок, определенный состоянием здоровья детей, ревакцинацию проводят однократно в 18 месяцев, т.е. через 12 месяцев после законченного курса вакцинации. Если ребенок получил третью дозу АКДС через 12 месяцев после второй дозы или позже, то в этом случае ее можно считать ревакцинацией, а курс законченным.
Вакцины
Можно ли заменять импортные вакцины от коклюша нашими АКДС при второй и третьей прививке? Например первая и вторая были импортные, а третья отечественная. Почему после 4 лет не ставят прививку от коклюша?
Можно. Согласно нашему календарю после 4 лет от коклюша не прививают. Считается, что дети старшего возраста могут плохо перенести вакцину АКДС. Тем не менее, вопрос о дополнительной ревакцинации в 4-6 лет стоит остро и, по-видимому, будет решен в перспективе.
Многие медработники рекомендуют ставить деткам импортную вакцину АКДС вместо отечественной, с чем это связано? Первая вакцинация была сделана Инфанрикс гекса, нужно делать вторую и третью, по причине отсутствия вакцины получается очень большой перерыв между первой и второй прививкой. Педиатр настаивает на вакцинировании отечественной АКДС. Ребенку 1.3 г. Как быть? Чем может быть опасна отечественная АКДС?
Наша отечественная вакцина по безопасности и профилактической эффективности не уступает зарубежным аналогам, а по иммуногенности коклюшного компонента даже превосходит. Однако в состав зарубежных вакцин входят полиомиелитный, гепатитный и гемофильный компоненты. Кроме того, коклюшный компонент вызывает меньше реакций, чем в составе АКДС (болезненность, покраснение в месте инъекции). Рекомендую все-таки привиться АКДС.
Прививки какого производства (импортного или отечественного) Вы рекомендуете? Интересует прививка от гриппа и от клещевого энцефалита. Возраст детей (3 года и 16 лет) как-то влияет на выбор вакцины?
Противогриппозные вакцины отечественного и зарубежного производства идентичны по составу, дизайну и переносимости. Возраст не имеет значения. Главное — привиться от гриппа.
Ребёнку 1.6г. нужно ставить 3 Акссесуарз Первые две ставили импортные, которых сейчас нет в наличии Что делать, ждать когда появятся или ставить российскую?
Делать российскую, они взаимозаменяемы.
Моему ребенку нужно ставить в апреле третью прививку от клещевого энцефалита, а когда я позвонила согласовать с врачом дату ревакцинация, медсестра поликлиники сказала, что вакцины нет и, возможно, вообще не будет! Известно ли вам что- то о ситуации с этой вакциной? Как нам быть в такой ситуации?
В настоящее время перебоев с вакциной нет. Попробуйте привиться в другой поликлинике.
Вакцинация частоболеющих детей
Ребёнок часто болеет, каждый месяц на больничном, в прошлом году 2 раза лежали в больнице. Врачи рекомендуют поставить прививку Пневмо -23. Можно узнать, как к этой прививке подготовиться? Куда она ставиться, и как ребёнок её может перенести? Ребёнку 4 года.
Правильно рекомендуют. Готовиться к вакцинации не надо. Реакций вакцина не дает.
Сын часто болеет. Планирую поставить ему Превенар летом, на это время ему будет 4, 5 года. Стоит ли? И в какое время года это сделать лучше? Данная прививка ставится однократно?
Можно летом. Прививка делается однократно сроком на 5 лет.
Ребенку 7 лет, он очень часто болеет – так, что даже нет промежутка доставить прививки по календарю. Встает вопрос с прививкой от гриппа. Насколько все-таки ее актуально ставить моему ребенку? Я просто боюсь, что прививка — еще один повод поболеть и не хочется своими руками привести его в еще одну болезнь.
Еще вопрос — ребенок переболел в эту волну гриппом (судя по симптомам этот самый, свиной; диагноз мной не придуман — поставлен педиатром). Пролечились тамифлю. У ребенка сформировался какой-то иммунитет на эту разновидность гриппа или нет?
Если ребенок часто болеет ОРВИ, ему в первую очередь необходимо ежегодно вакцинироваться от гриппа. Кроме того, посоветую принимать Рибомунил (в инструкции к препарату указана схема приема) в течение всей весны, затем можно продолжить осенью. Будет меньше болеть. Если ребенок перенес грипп, то иммунитет сформируется именно против этого вируса. Но с уверенностью сказать, что Ваш ребенок перенес свиной грипп невозможно, т.к. необходимо лабораторное подтверждение.
Будет меньше болеть. Если ребенок перенес грипп, то иммунитет сформируется именно против этого вируса. Но с уверенностью сказать, что Ваш ребенок перенес свиной грипп невозможно, т.к. необходимо лабораторное подтверждение.
Ребенку 2 года 2 месяца, у него постоянно держится температура 36.9-37.4С, иногда бывает слабость. Сдали анализы на все возможные инфекции, ничего не выявлено. Переболели в 1,9 за два месяца 3 раза обструктивным бронхитом, пульмонолог посоветовал поставить вакцину Пневмо-23, но так как держится температура до сих пор 37.4С, вакцину не ставим. Посоветуйте пожалуйста, надо ли еще какие то дополнительные обследования, чтобы выявить причину температуры и слабости, и когда все-таки стоит (и стоит ли) поставить прививку?
Сдайте анализы на герпес-вирусные инфекции, в т.ч. иммуноглобулины класса IgM и IgG к вирусу Эпштейна-Барр, цитомегаловирусу и вирусу герпеса 6 типа. Затем проконсультируйтесь с врачом. Кроме того, можете на ночь ставить ребенку свечи виферона в течение 10 дней. Вакцину Пневмо 23 надо сделать, лучше летом, также давайте Рибомунил всю весну и осень.
Расскажите, пожалуйста, какие должны быть принципы вакцинации ребенка при активном герпесе 6 типа? Наблюдаемся, лечим, пока результата нет. Ребенок все время уходит в обструкции бронхов. Нужно ли при таких исходных прививаться по общему графику? Или нам должны дать медотвод?
Скорее всего обструкция связана не с вирусом герпеса 6 типа, который, кстати, лечить не надо. Ребенок с частыми обструкциями должен находиться дома, в сад не ходить. Возможно перерастет и будет меньше болеть. В противном случае может сформироваться бронхиальная астма. При обструкции делают ингаляции с беродуалом. Можно прививать ребенка согласно календарю, а также от гриппа, пневмококковой инфекции (пневмококки часто вызывают ОРВИ) вакциной Пневмо 23. Принимать Рибомунил по схеме.
Обследование перед вакцинацией
Какие анализы должны быть сданы перед прививкой, при каких отклонениях от нормальных показателей прививка ребенку не ставится?
Перед первой прививкой АКДС необходимо сделать общий анализ крови, мочи, осмотр невролога. При отклонениях от нормальных показателей (напр., нейтропения в крови, гемоглобин ниже 90 г/л в крови, белок в моче) необходимо проконсультироваться у педиатра.
При отклонениях от нормальных показателей (напр., нейтропения в крови, гемоглобин ниже 90 г/л в крови, белок в моче) необходимо проконсультироваться у педиатра.
Ребенку делали только БЦЖ в роддоме и в 1,5 месяца прививку от гепатита В. Потом кровь показала низкий гемоглобин, мнения врачей расходились, и мы решили отложить прививки до достижения 2-х летнего возраста. Ребенку сейчас 2 г. 1 мес. Хотим начать ставить прививки. Я обеспокоена возможными побочными эффектами от вакцинации. Иммунолог в нашей поликлинике сказал, что нужно сдать только общий анализ крови. Какие подробные анализы в действительности сдают перед вакцинацией — я хочу убедиться, что ребенок абсолютно здоров и прививки не принесут вреда для иммунной системы. Может ли быть такое, что на какие-то инфекции у ребенка в крови уже есть антитела и поэтому ставить такую прививку не нужно? Как это проверить и нужно ли? Нужно ли проверять наличие антител к той или иной инфекции спустя назначенный курс прививок?
Я смотрела видеозапись со встречи с разными специалистами про прививки, один из исследователей говорил, что совсем недавно в России издали постановление, что «живую» прививку от полиомиелита ставить не нужно (что он сейчас побежден). Только «убитую». Какую вакцину от полиомиелита ставить?
Необходимо сделать общий анализ крови, чтобы убедиться, что показатели, в т.ч. гемоглобина в норме. Вряд ли ребенок в 2 года переболел детскими инфекциями. Если бы он заболел корью, краснухой, дифтерией и др. Вы бы об этом точно знали. Таким образом, его необходимо прививать согласно календарю против инфекционных заболеваний. Если будете правильно прививаться, то после вакцинации кровь на антитела сдавать не надо. В настоящее время вакцины безопасны и высоко иммуногены, практически не дают побочных эффектов. Две первые вакцинации против полиомиелита проводят убитой вакциной (укол), последующие — живой вакциной (капли в рот). Полиомиелит, конечно, побежден, но существует угроза заноса инфекции из соседних стран, неблагополучных по полиомиелиту, поэтому вакцинацию надо продолжать.
Когда моей дочке было около 6 месяцев, нам дали медотвод от прививок в связи с кавернозной гемангиомой на лице. В 2 года медотвод сняли, так как гемангиому склерозировали. Сегодня нам 2года 2месяца, нужно начать прививки, но я бы хотела сначала сдать анализы. Какие анализы лучше сдать и какой график прививок в нашем случае Вы бы рекомендовали?
Начинать надо с вакцины АКДС, против полиомиелита и гепатита В. Вакцинация проводится одновременно в разные части тела. Перед началом вакцинации необходимо сделать общий анализ крови и мочи. После 2-кратной вакцинации с интервалом 45 дней через 4-5 месяцев можно привиться против кори, краснухи, паротита и гепатита В (третья вакцинация).
Противопоказания к прививкам
Как ставить прививки ребёнку с эпилепсией. Какие есть особенности? Можно ли ставить прививку против клещевого энцефалита?
Ребенок с эпилепсией прививается по общему календарю. Также его можно привить против клещевого энцефалита вакцинами ФСМЕ–ИММУН джуниор или Энцепуром детским или отечественной вакциной Клещевак (без разницы). На вакцины может наблюдаться покраснение и болезненность в месте инъекции.
Добрый день! Является ли увеличенный тимус (3 степень) противопоказанием для прививки? Ребенку 6 месяцев, ни разу ничем не болел, все анализы (общий анализ крови, инфекции, развернутая биохимия) в норме. Одни врачи отправляют лечиться, другие – говорят, что можно ставить прививки.
Ребенок может прививаться согласно календарю.
Перед каждой прививкой сдаем общий анализ крови, чаще всего нейтрофилы бывают ниже нормы (примерно 15, хотя и не было никаких простуд и т.п.), поэтому прививку не ставим. К году у ребенка половина прививок по возрасту не поставлена. Действительно ли нельзя ставить прививки с таким показателем, надо ли обследоваться выяснять причину низких нейтрофилов и лечить это, у какого врача? Тимус в порядке.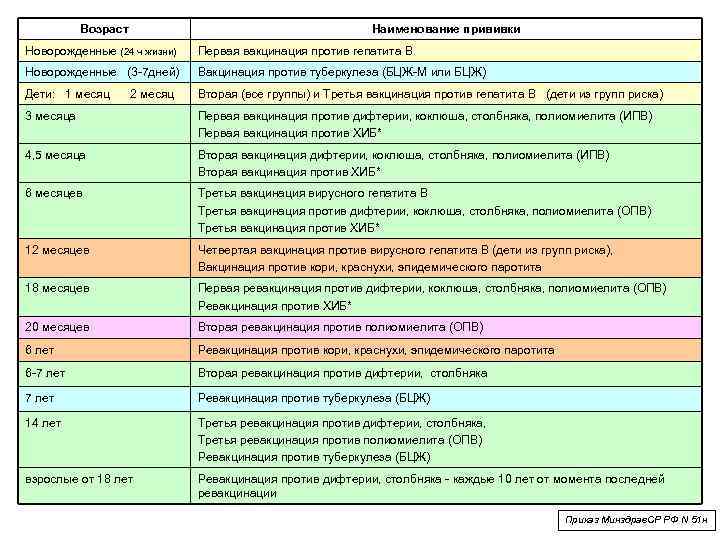
Ребенка прививать можно. Начинать надо с вакцины АКДС, полиомиелита и гепатита В. Однако если Вы хотите получить дополнительную консультацию, советую записаться на прием к гематологу в консультативную поликлинику при морозовской детской больнице (прием платный).
У ребенка (3 года) по результатам МРТ головного мозга поставлен диагноз нейрофиброматоз 1 типа. Наблюдаемся у генетика, сдавали кровь, но по крови 100% этот диагноз не подтвержден. Обследования у специалистов (невролог, окулист, гастроэнтеролог и др.) никаких серьезных заболеваний не выявили. Немного увеличена правая доля печени (98мм). Сдали биохимию, показатели в норме. Вопрос: можно ставить ребенку профилактические прививки или нет (такие как от клещевого энцефалита, от гриппа)?
Прививки против клещевого энцефалита делать можно вакцинами ФСМЕ–ИММУН джуниор или Энцепуром детским или отечественной вакциной Клещевак (без разницы). Против гриппа — вакциной Гриппол плюс.
Ребенку 4 месяца, из-за повышенного билирубина в срок не ставили прививки, потом Новый год, карантин по гриппу … И вот бы начать, но старший ребёнок заболел ветрянкой. Правильно я понимаю, что независимо от того заболеем или нет младший ребёнок ветрянкой, прививки не нужно ставить 21 день после выздоровления старшего?
Совершенно верно, т.к. ветрянка очень летучая инфекция и есть вероятность, что младший ребенок заразится от старшего. Необходимо выдержать 21 день с момента контакта между старшим (когда у него появилась сыпь) и младшим сыновьями.Здравствуйте, недавно произошла ситуация с прививкой от гриппа Ваксигрип. Ребенку 13 лет отказываются ставить прививку из-за высокого показателя лимфоцитов (50) и низкого сегментоядерных (40). Остальные показатели нормальные (лейкоциты 5,5). Объясняют тем, что боятся лейкозов. Правда ли, что после прививки в момент не очень хороших показателей крови может развиться лейкоз? От каких компонентов вакцины это зависит или это связано с каким-то другим механизмом работы организма?
Прививка не может вызвать лейкоз.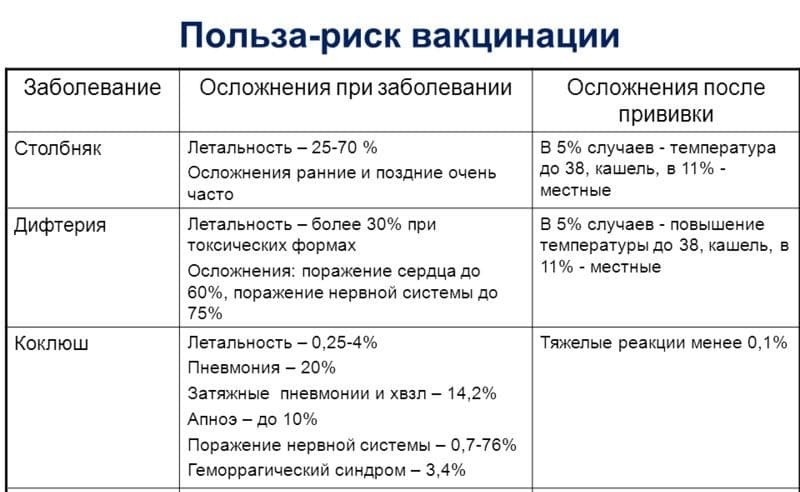 Если бы существовала такая угроза, весь мир «забил бы тревогу». Однако если Вы хотите получить дополнительную консультацию, советую записаться на прием к гематологу в консультативную поликлинику при морозовской детской больнице (прием платный).
Если бы существовала такая угроза, весь мир «забил бы тревогу». Однако если Вы хотите получить дополнительную консультацию, советую записаться на прием к гематологу в консультативную поликлинику при морозовской детской больнице (прием платный).Можно ли ставить какие-то прививки ребенку (девочка 7 лет) с шоковыми реакциями на молочный и яичный белок (есть реакция и на яйца кур (белок) и перепелов?
Лиц с анафилактическими реакциями на белок яйца нельзя вакцинировать против кори, паротита, гриппа, клещевого энцефалита, т.к. эти вакцины производятся на зародышах куриных яиц. Остальные прививки делать можно.Осложнения вакцинации/негативные реакции на введение вакцин
Вопрос про связь желтухи новорожденных и прививки от гепатита в роддоме. Сейчас детей у меня двое, ждем третью. Старшему ставили в роддоме БЦЖ только (гепатит не был обязателен еще, ставили уже в садике потом) — желтуха прошла сама, у младшего поставили в роддоме — желтуха была сильная, лежали в больнице. Сейчас думаю — ставить ли прививку против гепатита в роддоме или писать отказ, а поставить потом позднее. Есть ли, по Вашему мнению, какая-то взаимосвязь между прививкой и желтухой? И какой будет эффект, если мы ее поставим позднее?
Связи между прививкой против гепатита В и желтухой нет. Мы проводили исследование, в т.ч. у недоношенных детей и доказали отсутствие какой-либо взаимосвязи. Советую начать прививаться в роддоме. Однако, если Вы не хотите по каким-либо причинам, можно сделать прививку позднее, например, вместе с вакциной АКДС и полиомиелитной вакциной в 3 месяца жизни. Эффект будет тот же.
Какая необходимость ставить прививку против гепатита В в первый день жизни ребенка? Особенно когда ребенок находится в ПИТе, родился с гипоксией и родовой травмой. Маме ничего не объяснили про прививку, а дали кучу бланков подписать согласие. Последствия этой прививки — 4 месяца борьбы с желтухой. Куча лекарств, походы в поликлинику и платные клиники, сдача анализов — уже не говоря о здоровье ребенка. Практически все знакомые, которые родили недавно – по 3-4 месяца лечат желтуху. Создается впечатление, что какое-то намеренное вредительство детям!
Куча лекарств, походы в поликлинику и платные клиники, сдача анализов — уже не говоря о здоровье ребенка. Практически все знакомые, которые родили недавно – по 3-4 месяца лечат желтуху. Создается впечатление, что какое-то намеренное вредительство детям!
Вашего ребенка в первую очередь надо было привить против гепатита В и именно в роддоме. Это связано с тяжестью его состояния и возможностью проведения различных инвазивных вмешательств, вследствие чего существует вероятность его инфицирования вирусом гепатита В. А длительная желтуха связана с его основными заболеваниями. Связи между прививкой против гепатита В и желтухой нет. Мы проводили исследование, в т.ч. у недоношенных детей и доказали отсутствие какой-либо взаимосвязи.
У ребенка местная аллергия на все прививки, в том числе на реакцию Манту (крапивница вокруг места введения прививки). Ребенка к прививке готовим за 5 дней до прививки и после 5 дней (лактофильтрум, супрастин). Медсестра пробовала различные варианты обработки перед введением прививки, это не помогает. Если не принимать супрастин и лактофильтрум, то ребенка обсыпает полностью. Ребенку 5 лет, данная реакция на прививки началась в 3,5 года. В чём может быть причина?
Если Ваш ребенок страдает аллергией, ищите причину в себе — скорее всего либо Вы, либо Ваш муж страдаете или страдали аллергией в детстве. Думаю, надо сделать аллергопробы ребенку на различные аллергены. Можно обратиться в НЦЗД РАМН или институт иммунологии на каширском шоссе. Кроме того, проконсультироваться у фтизиатра по поводу пробы Манту.
Я сторонница прививок, все дети прививаются вовремя. Средней дочке 10 лет. Второй год подряд на прививку от гриппа у неё сильная аллергическая реакция. В этом году все плечо покраснело и было уплотнение. Пропили противоаллергические таблетки. Все прошло. В норме ли такая реакция? Какие Вы можете дать рекомендации? Участковый педиатр рекомендует ставить импортную вакцину.
Такая реакция может быть и это не зависит от страны-производителя. Однако, если это Вас волнует, вместо прививки против гриппа можно принимать противовирусные препараты в течение всей эпидемии гриппа.
Добрый день! В 1 год поставили ребенку прививку Инфанрикс — через 3 дня получили судороги с потерей сознания на фоне невысокой температуры (37.8).В 2 года поставили Пентаксим — через 1.5 месяца (в течение которых он все время недомогал) получили несколько подряд приступов судорог с потерей сознания. С тех пор (ребенку уже 6 лет) не ставили ни одной прививки, так как страшно. Обследовались у нескольких неврологов и иммунологов — они разводят руками. Признаков эпилепсии нет. Ребенок часто болел, в том числе с температурой под 40, но никогда эпизодов с потерей сознания кроме как в эти 2 раза не было. Как Вы можете объяснить наш случай, и стоит ли собраться с духом и возобновить прививки?
Скорее всего судороги были связаны с коклюшным компонентом обеих вакцин. С 6 лет жизни против коклюша уже не прививают. Поэтому надо собраться с духом и начать прививаться АДС-М, убитой вакциной против полиомиелита и вакциной против гепатита В (два раза с интервалом 45 дней с ревакцинацией через 9-12 месяцев). Перед ревакцинацией вакцинироваться против кори, краснухи и паротита.
Профилактика туберкулеза
Кто должен контролировать, ставится ли школьнику реакция Манту? В старой школе за этим всегда следила медсестра, в новой школе спохватились через год, что пробы нам не ставили. Если эта ответственность на родителе, я должна об этом знать. Если на школе — буду просить, чтобы внимательнее отнеслись к вопросу.
Просите, чтобы внимательнее относились к этому вопросу.
Сыну 8 лет, заболел гломерулонефритом, сейчас принимает гормоны. Педиатр говорит, что теперь нам нужно будет ставить манту 2 раза в год. С таким диагнозом я теперь боюсь даже слова «прививка». Стоит ли брать медотвод у нефролога, или можно обследоваться как-то иначе?
Стоит ли брать медотвод у нефролога, или можно обследоваться как-то иначе?
Проба Манту — это не прививка, а всего лишь ежегодная проба, оценивающая, инфицирован ли ребенок туберкулезом или нет. Если нет, то очень хорошо. Если да — необходима консультация фтизиатра.
Вопросы не по вакцинации
В сентябре серьёзно болела дочка, лежали в больнице, обследовались. Но причину так и не нашли. С начала заболевания и по сей день у неё в горле и в области язычка есть красные прыщики. Что это может быть? ПЦР на энтеровирус сдавали. Небольшие титры герпетической инфекции были пролечены осенью, а эти прыщики не проходят.
Если состояние ребенка удовлетворительное, думаю надо просто понаблюдать. Если Вы заметите, что прыщики изменили окраску или состояние ребенка изменилось, в этом случае обратиться к педиатру.
Ребенку 4 месяца. Живот беспокоит с первой недели жизни. На протяжении 4 месяцев даем эспумизан, сабсимплексы и прочее, чтобы хоть как-то обезболить. По рекомендации педиатра пропили хилак-форте, ацепол, результата не было. Обследовались на инфекции, ничего не выявлено. Инфекционист назначила нан кисломолочный или бифилин. Стали давать бифилин , после него ребенок начал очень много и часто срыгивать. Вопрос: стоит ли продолжать бифилин или же всё отменить? Может Вы порекомендуете какой-то другой препарат?
Сдайте анализ кала на углеводы и копрологию (можно в институте им. Габричевского). При наличии изменений необходимо обратиться к гастроэнтерологу.
| В каком возрасте ставят | От какой болезни прививка и какая вакцина | Дополнительная информация |
| Малыши в возрасте новорожденности,в течение 24 часов с момента рождения | От гепатита B. В роддоме скорей всего будет вакцина отечественного производства.
| Прививка переносится очень легко и, в большинстве своём, совсем без последствий для состоянии крохи. Такой ранний срок введения вакцины объясняется тем, что инфицирование гепатитом В именно в раннем детском возрасте крайне опасно, и может привести к инвалидности и даже смерти. А риск всегда есть, тем более, печальная статистика говорит о том, что этой болезнью инфицировано более 32% населения земного шара. Такой ранний срок введения вакцины объясняется тем, что инфицирование гепатитом В именно в раннем детском возрасте крайне опасно, и может привести к инвалидности и даже смерти. А риск всегда есть, тем более, печальная статистика говорит о том, что этой болезнью инфицировано более 32% населения земного шара. |
| Малыши в возрасте с 3 по 7 день жизни | От туберкулеза. В роддомах и поликлиниках доступна только отечественная живая вакцина. | Прививка делается внутрикожно, спустя примерно 3 недели в месте укола образуется язвочка, которую нельзя ничем обрабатывать, ковырять и трогать. После заживления остаётся рубчик. Ранний срок вакцинации объясняется высоким риском заболеть туберкулёзом сразу после выхода за стены роддома, поскольку число больных с активной формой заболевания, свободно разгуливающих по городу, действительно шокирует. |
| Малыши в 1 месяц | Вторично от гепатита B. Сейчас уже будут доступны не только отечественная, но и импортные вакцины:, Эувакс (Франция), Энджерикс В (Великобритания), Биовак В (Индия). | Перед уколом не требуются никакие анализы, достаточно того, чтобы ребенок был здоров. Вакцина лёгкая, прекрасно переносится. |
| Малыши в 2 месяца | Третья прививка от гепатита В ставится не всем, а только малышам из групп риска. | Речь идёт, например, о детках, рождённых от матерей-носительниц гепатита В. |
| Первая вакцинация от пневмококковой инфекции. Как правило, делается импортной вакциной Превенар производства США. | Её назначение: защита от микроба пневмококка, который вызывает тяжелейшие отиты, гаймориты, воспаления лёгких. | |
| Малыши в 3 месяца | Первая серьёзная комплексная прививка от коклюша, столбняка и дифтерии (АКДС). Можно поставить отечественную вакцину, или зарубежную. Платно доступны Инфанрикс Гекса (Бельгия), Пентаксим (Франция). | Сама по себе прививка крайне важная, и обеспечит крохе защиту от тяжёлых и опасных инфекций. Импортные вакцины высокоочищены и крайне редко вызывают нежелательные реакции. Импортные вакцины высокоочищены и крайне редко вызывают нежелательные реакции. |
| От полиомиелита можно поставить отечественную вакцину. Однако, вышеперечисленные Пентаксим и Инфанрикс Гекса удобны тем, что содержат в себе и компонент от полиомиелита, а значит, никаких лишних уколов! | Вакцина вводится инактивированная (с убитыми клетками вируса), обычно легко переносится. Защищает от страшной инфекции, встречающейся в России, Украине, Беларуси и др. | |
| От гемофильной инфекции деткам из групп риска. | ||
| Детки в возрасте 4,5 месяца | От коклюша, столбняка и дифтерии (вторая АКДС). | Удобно объединить три укола в один, купив платную вакцину Пентаксим или Инфанрикс Гекса. |
| От гемофильной инфекции повторно. | ||
| От полиомиелита повторно. | ||
| От пневмококковой инфекции повторно. | Теперь малыш под защитой от микроба пневмококк. | |
| Детки в возрасте 6 месяцев | От дифтерии, столбняка и коклюша в третий раз. | Если есть возможность не мучить малыша несколькими уколами, разумно приобрести платную вакцину и объединить всё в одну инъекцию. |
| От гепатита В в третий раз. | ||
| От полиомиелита в третий раз. | ||
| От гемофильной инфекции в третий раз, не всем, а только детям из группы риска. | ||
| Детки в возрасте 12 месяцев | От кори, краснухи и эпидемического паротита (ККП). Возможно вакцинация как отечественными вакцинами, так и импортной Приорикс (Бельгия). | Обязательная защита от тяжёлых бактериальных осложнений при кори (например, слепота, глухота, пневмония), краснухи. Защита от эпидемического паротита крайне важна для мальчиков, поскольку четверть всех случаев мужского бесплодия имеют причиной перенесённую в детстве «свинку» (эпидемический паротит). |
От гепатита В в четвёртый раз для малышей из групп риска. |
Ставится не всем, а по назначению педиатра. | |
| Детки в возрасте 15 месяцев | От пневмококковой инфекции – ревакцинация. | Для сохранения надёжного иммунитета к возбудителю – пневмококку. |
| Полуторагодовалые карапузы | От полиомиелита – первая ревакцинация. | Ревакцинацию от полиомиелита рекомендуется проводить не инактивированной вакциной, как ранее, а живой оральной. Это обеспечит более высокий и надёжный иммунитет от разных форм возбудителей этой опасной болезни. |
| От коклюша, столбняка и дифтерии – первая ревакцинация. | Обязательная вакцинация почти завершена, ещё немного! | |
| От гемофильной инфекции для деток из групп риска. | ||
| Малыши в 20 месяцев | От полиомиелита – вторая ревакцинация. | |
| Ребята в 6 лет | От кори, краснухи и паротита (свинки) – ревакцинация. | Чтобы сохранить иммунитет. |
| Ребята в 6-7 лет | От дифтерии и столбняка – ревакцинация. Как правило, ставится отечественная вакцина. | Возможна местная реакция – уплотнение в месте инъекции. |
| От туберкулёза — ревакцинация | Назначается врачом, не всем, а только тем, у кого отрицательная проба Манту. | |
| Подростки в 14 лет | От дифтерии и столбняка – ревакцинация в третий раз. | Укол делают в верхнюю треть плеча. |
| От полиомиелита – ревакцинация в третий раз. | Делают по назначению врача. | |
| Взрослые от 18 и старше | От дифтерии и столбняка – эта и последующие ревакцинации каждые 10 лет до конца жизни. | Иммунитет к опасным болезням не бесконечный, и его необходимо поддерживать. |
Все дети и взрослые до 55 лет, если не прививались до этого или информация об этом отсутствует |
От гепатита В. |
В будущем необходимо поддерживать иммунитет, повторяя прививку каждые 10 лет. |
| Все дети и взрослые в возрасте от 1 года до 18 лет | От краснухи | Важно ставить прививки от краснухи, сохраняя коллективный иммунитет и не допуская циркуляции вируса. Заболевание краснухой беременной женщины гарантированно вызывает выкидыш и тяжёлые пороки развития ребёнка. |
| Дети и взрослые до 35 лет | От кори | Ревакцинация от кори проводится каждые 10 лет |
| Детки старше 6 месяцев и взрослое население | От гриппа. Есть отечественные вакцины: «Совигрипп», «Гриппол», а также зарубежные «Инфлювак» (Нидерланды), «Ваксигрипп» (Франция). | В группе риска по гриппу находятся маленькие детки (старше 6 месяцев, потому что до этого ещё действуют антитела матери), школьники и студенты, пенсионеры, беременные, работники ЖКХ, транспорта, медицины, люди с хроническими болезнями. То есть все те, кому опасно болеть гриппом в тяжёлой форме и с осложнениями. |
Прививки Пентаксим
Вакцинация по схеме
Первичная вакцинация делается курсом, схема которого предполагает три введения вакцины плюс 1 ревакцинация. Иммунизация производится следующим образом: введение 1 дозы, через 45 дней введение 2 дозы, по прошествии еще 45 дней – введение 3 дозы, а через год после этого – обязательная ревакцинация.
Вакцинация показана детям, начиная с трех месяцев.
Схему вакцинации нарушать нежелательно, поскольку напряженность иммунитета ребенка к активным веществам вакцины может снизиться. Для детей от 1 года и старше введение вакцины Пентаксим с гемофильным компонентом выполняется однократно, Профилактика у ребенка от 1 года и старше полиомиелита, столбняка, коклюша и дифтерии в дальнейшем выполняется вакциной Пентаксим, но уже без применения гемофильной составляющей.
Плановая вакцинация
В России утвержден Национальный календарь профилактических прививок, согласно которому прививка Пентаксим детям ставится трижды – по 1 дозе в возрасте 3, 4, 5 и 6 месяцев, а в возрасте 18 месяцев выполняется ревакцинация. Приказом от 31 января 2011 года за № 51 в данный календарь также включена прививка против гемофильной инфекции.
Приказом от 31 января 2011 года за № 51 в данный календарь также включена прививка против гемофильной инфекции.
Одновременное введение препарата. Пентаксим с другими вакцинами
Поставить прививку Пентаксим детям допускается одновременно с любыми другими вакцинами из российского календаря профилактических прививок – в один день, но в разные части тела. Исключение составляет прививка БЦЖ.
На способность выработки иммунитета (иммуногенность) применение прививки Пентаксим вместе с другими вакцинами влияния не оказывает. Не увеличивается число побочных реакций, не становится хуже переносимость прививок.
На иммунитет введение в 1 день нескольких вакцин избыточной нагрузки не оказывает.
Использовать прививку Пентаксим можно на любом этапе курса вакцинации (завершение, продолжение), даже если он был начат другими прививками от гемофильной инфекции, столбняка, коклюша, полиомиелита, дифтерии. Причем взаимозаменяемыми являются все вакцины для профилактических прививок, указанные в российском календаре.
Побочные реакции
Прививка Пентаксим может вызывать общие и местные реакции.
Общие реакции на прививку в большинстве случаев – это лихорадка, субфебрильная (до 10% детей) или фебрильная (очень редко – до 1% детей). Еще реже осложнения более тяжелые (менее 1%), проявляющиеся уплотнением в месте укола, головной болью, раздражительностью, зудом, нарушением сна, лимфоаденопатией.
Местные реакции бывают не часто (до 10% детей), из них чаще всего проявляются болезненность, отек, покраснение в месте укола.
Противопоказания
Собираясь поставить прививку Пентаксим детям, следует учитывать некоторые противопоказания:
- гиперчувствительность (подтвержденная системная реакция) к любому из составляющих прививки;
- обострение хронических болезней, острые инфекционные заболевания, увеличение температуры тела вследствие болезни – в любом из этих случаев прививка переносится до полного выздоровления;
- аллергическая реакция, появившаяся после предшествующей прививки против полиомиелита, коклюша, столбняка, дифтерии и инфекции, возбудителем которой является Haemophilus influenzae типа b.

Дополнительная информация
Прививка Пентаксим не дает иммунитет против пневмоний и менингитов другой этиологии, как и против инфекций, возбудителями которых являются Haemophilus influenzae других типов.
Делать вакцины препаратом Пентаксим можно только полностью здоровым детям, перед прививкой в обязательном порядке нужно пройти осмотр у педиатра, чтобы оценить состояние здоровья ребенка и исключить инфекционные заболевания . Нельзя использовать прививку Пентаксим, если у ребенка имеются подтвержденные неврологом противопоказания со стороны нервной системы.
Все о вакцинации. Виды вакцин
СОДЕРЖАНИЕ
Что такое вакцинопрофилактика? Это система мероприятий, осуществляемых в целях предупреждения, ограничения распространения и ликвидации инфекционных болезней путем проведения профилактических прививок. Вакцины защищают людей от очень тяжелых инфекционных болезней.
Еще несколько десятилетий назад врачам приходилось неустанно бороться с такими инфекциями, как натуральная оспа, полиомиелит, дифтерия, коклюш, корь, эпидемический паротит, краснуха. Многих больных спасти не удавалось, многие оставались инвалидами.
Все радикально изменилось с появлением вакцин. Мир полностью избавлен от натуральной оспы, во многих странах ликвидирован полиомиелит, резко сократилось число и тяжесть течения дифтерии, коклюша, кори, краснухи, эпидемического паротита. С помощью прививок врачи научились бороться с такой инфекцией, как гепатит В, который чрезвычайно опасен возможностью формирования хронического поражения печени (цирроз, рак).
Человеку свойственно быстро забывать неприятные для него вещи: вот и вспышки инфекционных заболеваний, уносившие тысячи, а иногда и миллионы, человеческих жизней, забылись. По мнению некоторых, эпидемии инфекций – это пройденный этап в человеческой истории.
К сожалению – нет!
При снижении порога вакцинации возможна новая вспышка инфекций.
Например:
1973-1974 года – натуральная оспа в Стокгольме;
1990-1999 года – дифтерия в СССР;
Вспышка кори в г.
Екатеринбурге в 2016-17 годах у непривитых от кори лиц.
Благодаря вакцинопрофилактике появилась возможность защиты от 40 инфекционных заболеваний. Часть из этих прививок ставят всему населению, часть – по эпидемическим показаниям. Это зависит от опасности распространения инфекции на данной территории.
Обязательными на всей территории России являются прививки против туберкулеза (БЦЖ), коклюша, дифтерии, столбняка, кори, эпидемического паротита, краснухи, пневмококковой и гемофильной (ХИБ) инфекций. На территории Свердловской области в календарь прививок включены прививки против клещевого энцефалита (вся территория области является опасной по возможности инфицирования клещевым энцефалитом), ветряной оспы (велика заболеваемость этой инфекцией), гепатита А.
Дети, организм которых ослаблен в силу разных причин врожденного или приобретенного характера, особенно подвержены инфекции, болеют тяжело, часто с осложнениями и возможным неблагоприятным исходом. Такие дети нуждаются в защите от инфекционных болезней в первую очередь.
КАЛЕНДАРЬ ПРИВИВОК
|
Возраст |
Наименование прививки |
|
Новорожденные в первые 24 часа жизни |
Первая вакцинация против гепатита В |
|
Новорожденные (при выписке из родильного дома) |
Вакцинация против туберкулеза |
|
1 месяц |
Вторая вакцинация против гепатита В |
|
2 месяца |
Первая вакцинация против пневмококковой инфекции Первая вакцинация против ротавирусной инфекции |
|
3 месяца |
Первая вакцинация против дифтерии, коклюша, столбняка Первая вакцинация против полиомиелита Первая вакцинация против гемофильной инфекции Вторая вакцинация против ротавирусной инфекции |
|
4,5 месяца |
Вторая вакцинация против дифтерии, коклюша, столбняка Вторая вакцинация против полиомиелита Вторая вакцинация против гемофильной инфекции Вакцинация против пневмококковой инфекции Третья вакцинация против ротавирусной инфекции |
|
6 месяцев |
Третья вакцинация против гепатита В Третья вакцинация против дифтерии, коклюша, столбняка Третья вакцинация против полиомиелита Третья вакцинация против гемофильной инфекции |
|
9 месяцев |
Первая вакцинация против менингококковой инфекции |
|
11 месяцев |
Вторая вакцинация против менингококковой инфекции |
|
12 месяцев |
Четвертая вакцинация против гепатита В Вакцинация против кори, краснухи, эпидемического паротита Вакцинация против ветряной оспы |
|
15 месяцев |
Ревакцинация против пневмококковой инфекции Первая вакцинация против клещевого энцефалита |
|
18 месяцев |
Первая ревакцинация против дифтерии, коклюша, столбняка Первая ревакцинация против полиомиелита Ревакцинация против гемофильной инфекции |
|
20 месяцев |
Вторая ревакцинация против полиомиелита Первая вакцинация против гепатита |
|
21 месяц |
Вторая вакцинация против клещевого энцефалита |
|
26 месяцев |
Вторая вакцинация против гепатита А |
|
2 года 6 месяцев |
Первая ревакцинация против клещевого энцефалита |
|
6 лет |
Ревакцинация против кори, краснухи, эпидемического паротита Вторая вакцинация против ветряной оспы |
|
6-7 лет |
Вторая ревакцинация против дифтерии, столбняка Ревакцинация против туберкулеза |
|
13 лет (обоего пола) |
Вакцинация против папилломавирусной инфекции |
|
14 лет |
Третья ревакцинация против дифтерии, столбняка Третья ревакцинация против полиомиелита |
АКДС
– это вакцина, защищающая от трех тяжелых инфекций – от коклюша, дифтерии и столбняка.

Коклюш вызывается коклюшной палочкой. Заболевание характеризуется приступами спазматического кашля, поражением дыхательной, сердечно-сосудистой и нервной систем. Происходит скапливание густой стекловидной мокроты в бронхах, которую тяжело откашлять и взрослому человеку. Ребенок «заходится» в кашле. Опасен коклюш и своими осложнениями, которые развиваются у 30% — 50% и выше заболевших: воспалением легких (пневмонией), а у маленьких детей – поражением головного мозга (энцефалопатией) с возможными повторными судорогами. При заболевании коклюшем непривитых детей в возрасте до года умереть может каждый пятый ребенок.
Дифтерия – инфекция, которую вызывает дифтерийная палочка. Клинические проявления заболевания обусловлены действием дифтерийного токсина (продукта жизнедеятельности дифтерийной палочки). Могут поражаться миндалины, зев, гортань, нос, кожа, слизистые оболочки. У непривитых заболевание характеризуется тяжелым течением с последующим развитием осложнений со стороны сердечнососудистой и нервной системы.
От дифтерии среди непривитых умирают 10 – 20% заболевших. Антибиотики при лечении дифтерии неэффективны, лечение проводят специфической противодифтерийной сывороткой, введение которой само может вызвать тяжелые аллергические состояния.
Столбняк – инфекция, которую вызывает столбнячная палочка. Это заболевание с явлениями выраженной интоксикации нервной системы, проявляющейся в виде тонических и клонических мышечных судорог. Смерть наступает от паралича дыхательной мускулатуры. От столбняка умирают от 67 до 91% заболевших.
В состав вакцины входят: коклюшная убитая вакцина, дифтерийный и столбнячный анатоксины (иммунитет к дифтерии и столбняку вырабатывается против токсинов, обуславливающих заболевание).
Вакцинация проводится с трехмесячного возраста трехкратно с интервалом в 1,5 месяца, затем в 1 год 6 месяцев проводится первая ревакцинация. Вакцины АКДС и инфанрикс взаимозаменяемые. АКДС вводится глубоко внутримышечно в передненаружную область бедра.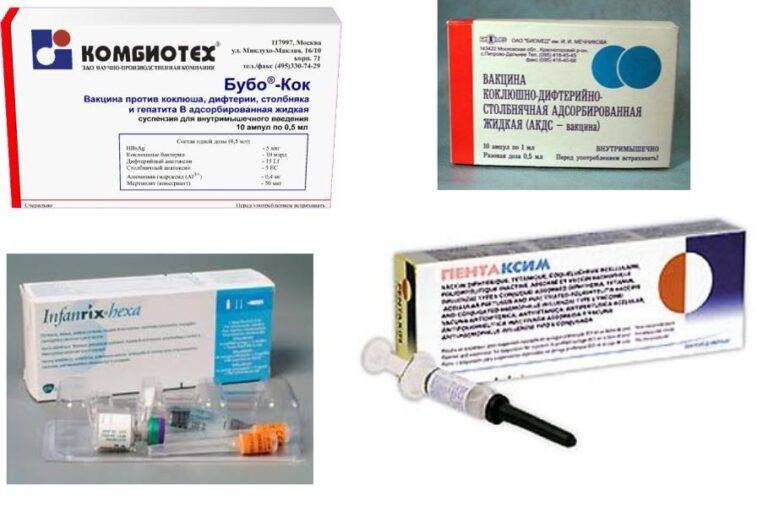
Зачем нужна ревакцинация?
С годами иммунитет к заболеванию может несколько снизиться. Для поддержания иммунитета на уровне, способном защитить организм от инфекции, проводятся ревакцинации.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Крайне редко встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
ИНФАНРИКС
– это вакцина, защищающая от трех тяжелых инфекций – от коклюша, дифтерии и столбняка.
Коклюш вызывается коклюшной палочкой. Заболевание характеризуется приступами спазматического кашля, поражением дыхательной, сердечно-сосудистой и нервной систем. Происходит скапливание густой стекловидной мокроты в бронхах, которую тяжело откашлять и взрослому человеку. Ребенок «заходится» в кашле. Опасен коклюш и своими осложнениями, которые развиваются у 30% — 50% и выше заболевших: воспалением легких (пневмонией), а у маленьких детей – поражением головного мозга (энцефалопатией) с возможными повторными судорогами. При заболевании коклюшем непривитых детей в возрасте до года умереть может каждый пятый ребенок.
При заболевании коклюшем непривитых детей в возрасте до года умереть может каждый пятый ребенок.
Дифтерия – инфекция, которую вызывает дифтерийная палочка. Клинические проявления заболевания обусловлены действием дифтерийного токсина (продукта жизнедеятельности дифтерийной палочки). Могут поражаться миндалины, зев, гортань, нос, кожа, слизистые оболочки. У непривитых заболевание характеризуется тяжелым течением с последующим развитием осложнений со стороны сердечнососудистой и нервной системы. От дифтерии среди непривитых умирают 10 – 20% заболевших. Антибиотики при лечении дифтерии неэффективны, лечение проводят специфической противодифтерийной сывороткой, введение которой само может вызвать тяжелые аллергические состояния.
Столбняк – инфекция, которую вызывает столбнячная палочка. Это заболевание с явлениями выраженной интоксикации нервной системы, проявляющейся в виде тонических и клонических мышечных судорог. Смерть наступает от паралича дыхательной мускулатуры. От столбняка умирают от 67 до 91% заболевших.
В состав вакцины входят: коклюшная бесклеточная вакцина, дифтерийный и столбнячный анатоксины (иммунитет к дифтерии и столбняку вырабатывается против токсинов, обуславливающих заболевание). За счет того, что коклюшная вакцина, входящая в состав вакцины «инфанрикс» не имеет поверхностной оболочки, тяжелые реакции и осложнения встречаются после ее введения много реже, чем после АКДС.
Вакцинация проводится с трехмесячного возраста трехкратно с интервалом в 1,5 месяца, затем в 1 год 6 месяцев проводится первая ревакцинация. Вакцины АКДС и инфанрикс взаимозаменяемые. Учитывая сложную эпид. обстановку по коклюшу на территории Свердловской области, МЗ Свердловской области рекомендована 2 ревакцинация против коклюша вакциной «инфанрикс» в возрасте 6 лет. Инфанрикс вводится глубоко внутримышечно в передненаружную область бедра.
Зачем нужна ревакцинация? С годами иммунитет к заболеванию может несколько снизиться. Для поддержания иммунитета на уровне, способном защитить организм от инфекции, проводятся ревакцинации.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Крайне редко встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом
АДС
– это вакцина, защищающая от двух тяжелых инфекций – от дифтерии и столбняка.
Дифтерия – инфекция, которую вызывает дифтерийная палочка. Клинические проявления заболевания обусловлены действием дифтерийного токсина (продукта жизнедеятельности дифтерийной палочки). Могут поражаться миндалины, зев, гортань, нос, кожа, слизистые оболочки. У непривитых заболевание характеризуется тяжелым течением с последующим развитием осложнений со стороны сердечнососудистой и нервной системы. От дифтерии среди непривитых умирают 10 – 20% заболевших. Антибиотики при лечении дифтерии неэффективны, лечение проводят специфической противодифтерийной сывороткой, введение которой само может вызвать тяжелые аллергические состояния.
Столбняк – инфекция, которую вызывает столбнячная палочка. Это заболевание с явлениями выраженной интоксикации нервной системы, проявляющейся в виде тонических и клонических мышечных судорог. Смерть наступает от паралича дыхательной мускулатуры. От столбняка умирают от 67 до 91% заболевших.
В состав вакцины входят: дифтерийный и столбнячный анатоксины, (иммунитет к дифтерии и столбняку вырабатывается против токсинов, обуславливающих заболевание).
Так как в состав вакцины не входит коклюшная вакцина, АДС применяется для вакцинации против дифтерии и столбняка у детей младше 6 лет при наличии противопоказаний к введению вакцины АКДС и Инфанрикс. Вакцина в этом случае вводится двукратно с интервалом 1,5 месяца. АДС вводится глубоко внутримышечно в передненаружную область бедра.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Крайне редко (много реже, чем при АКДС) встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
АДС-М
– это вакцина, защищающая от двух тяжелых инфекций – от дифтерии и столбняка.
Дифтерия – инфекция, которую вызывает дифтерийная палочка. Клинические проявления заболевания обусловлены действием дифтерийного токсина (продукта жизнедеятельности дифтерийной палочки). Могут поражаться миндалины, зев, гортань, нос, кожа, слизистые оболочки. У непривитых заболевание характеризуется тяжелым течением с последующим развитием осложнений со стороны сердечнососудистой и нервной системы. От дифтерии среди непривитых умирают 10 – 20% заболевших. Антибиотики при лечении дифтерии неэффективны, лечение проводят специфической противодифтерийной сывороткой, введение которой само может вызвать тяжелые аллергические состояния.
Столбняк – инфекция, которую вызывает столбнячная палочка. Это заболевание с явлениями выраженной интоксикации нервной системы, проявляющейся в виде тонических и клонических мышечных судорог. Смерть наступает от паралича дыхательной мускулатуры. От столбняка умирают от 67 до 91% заболевших.
В состав вакцины входят: дифтерийный и столбнячный анатоксины, (иммунитет к дифтерии и столбняку вырабатывается против токсинов, обуславливающих заболевание).
Так как содержание дифтерийного и столбнячного анатоксинов в вакцине АДС-М уменьшено по сравнению с вакцинами АКДС, инфанрикс, АДС, вакцина АДС-М не годится для вакцинации детей до 6 лет и применяется только для вакцинации и ревакцинации детей старше 6 лет и взрослых. Хотя в крайне редких случаях, когда все названные вакцины противопоказаны, вакцина АДС-М применяется и для вакцинации против дифтерии и столбняка детям до 6 лет, которая проводятся двукратно с интервалом в 1,5 месяца.
Ревакцинации вакциной АДС-М проводятся в 7 лет, 14 лет и далее 1 раз в 10 лет пожизненно. АДС-М детям раннего и дошкольного возраста вводится внутримышечно в передненаружную область бедра, старшим детям и взрослым ее можно вводить глубоко подкожно.
Зачем нужна ревакцинация? С годами иммунитет к заболеванию может несколько снизиться. Для поддержания иммунитета на уровне, способном защитить организм от инфекции, проводятся ревакцинации.
Для поддержания иммунитета на уровне, способном защитить организм от инфекции, проводятся ревакцинации.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Крайне редко(много реже, чем при АКДС) встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
ПОЛИОМИЕЛИТНЫЕ ВАКЦИНЫ
Полиомиелит — это острая вирусная инфекция. Вызывается вирусами полиомиелита трех типов. Поражается в основном спиной мозг, но иногда и головной. Возникают параличи (ребенок не может ходить) или парезы конечностей (хромота). Заболевание ведет к инвалидизации (пораженная конечность плохо растет, слабеет, мышцы атрофируются).
Схема вакцинации: трехкратно с интервалом в 1,5 месяца на первом году жизни, ревакцинации в 1 год 6 месяцев, 1 год 8 месяцев и в 14 лет.
Зачем нужна ревакцинация? С годами иммунитет к заболеванию может несколько снизиться. Для поддержания иммунитета на уровне, способном защитить организм от инфекции, проводятся ревакцинации.
Для поддержания иммунитета на уровне, способном защитить организм от инфекции, проводятся ревакцинации.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Крайне редко после введения инактивированной (неживой) вакцины против полиомиелита может быть местная реакция. Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей. Могут быть аллергические реакции при наличии аллергии к стрептомицину.
Введение живой полиомиелитной вакцины реакции обычно не вызывает. Очень редко, с частотой 1 на 1 000 000 доз, у детей с иммунодефицитным состоянием возможно развитие вакциноассоциированного паралитического полиомиелита.
Для профилактики этого осложнения все дети получают комбинированную схему вакцинации – первые 2 прививки проводятся инактивированной полиомиелитной вакциной, а третья вакцинация и все ревакцинации – живой. При этом инактивированная полиомиелитная вакцина создает хороший общий иммунитет к полиомиелиту, на его фоне живая полиомиелитная вакцина создает местный иммунитет, надежно защищающий от вируса полиомиелита. При такой схеме вакцинации вакциноассоциированный паралитический полиомиелит не возникает.
Вакцины для профилактики полиомиелита:
- Живая полиомиелитная вакцина – БиВак полио. Вакцину закапывают в рот.
- Имовакс – инактивированная полиомиелитная вакцина
- Полиорикс — инактивированная полиомиелитная вакцина.
- Полимилекс — инактивированная полиомиелитная вакцина
Инактивированные полиомиелитные вакцины вводятся внутримышечно в передненаружную область бедра. Живая полиомиелитная вакцина – в виде капель на корень языка ребенка.
Живая полиомиелитная вакцина – в виде капель на корень языка ребенка.
ВАКЦИНА ПРОТИВ КОРИ
Корь — острое, чрезвычайно заразное вирусное заболевание, встречающееся только у людей. При контакте с вирусом вероятность развития болезни близка к 100%. Заболевание характеризуется высокой температурой тела, общим тяжелым состоянием, кашлем, насморком, отечностью век, светобоязнью, гнойными выделения из глаз и сыпью. Корь опасна тяжелыми осложнениями: тяжелыми пневмониями с поражением плевры и образованием абсцессов в легких, язвенно-некротическими поражениями слизистых оболочек полости рта и кишечника, вплоть до распада мягких тканей, гнойным отитом, судорогами, редко – воспалением головного мозга (энцефалит), после которого наступает инвалидизация ребенка. По всему миру от кори ежегодно погибает до миллиона детей. Корью может заразиться и взрослый. Причем заболевание у него протекает тяжелее, чем у детей.
Для вакцинации против кори используется отечественная живая коревая вакцина
Вакцинация против кори проводится детям в возрасте 1 год, ревакцинация – в 6 лет. Если ребенок не был привит своевременно, то вакцинация осуществляется в любом возрасте, ревакцинация — через 6 месяцев от вакцинации. Вакцина вводится подкожно под лопатку или в наружную область плеча.
Зачем нужна ревакцинация? С годами иммунитет к заболеванию может несколько снизиться. Для поддержания иммунитета на уровне, способном защитить организм от инфекции, проводятся ревакцинации.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Вакцина против кори малореактогенна, но живой вирус у некоторых людей (редко) вызывает специфические реакции. У небольшого числа привитых, начиная с 4-5 дня после прививки может подняться температура, с 8-го по 12-й день даже до высоких цифр (выше 39,00С), появиться насморк, кашель, единичные элементы сыпи. Это является допустимой (обычной) реакцией организма на введение живой коревой вакцины, и на 13-14-й день состояние ребенка нормализуется. Реакции на вторую дозу возникают еще реже.
Крайне редко встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
ВАКЦИНА ПРОТИВ ЭПИДЕМИЧЕСКОГО ПАРОТИТА («свинки»)
Эпидемический паротит – острая вирусная инфекция, при которой в основном поражаются слюнные железы. Они распухают, ребенку больно жевать и глотать. Кроме слюнных желез вирус эпидемического паротита может вызвать поражение поджелудочной железы (панкреатит), а также головного мозга (менингит, менингоэнцефалит). У 20-30% заболевших мальчиков-подростков воспаляются яички (орхит), что может послужить причиной бесплодия. У 5% заболевших девочек могут быть воспалены яичники (оофорит).
Для вакцинации против эпидемического паротита используется отечественная живая паротитная вакцина
Вакцинация против эпидемического паротита проводится детям в возрасте 1 год, ревакцинация – в 6 лет. Если ребенок не был привит своевременно, то вакцинация осуществляется в любом возрасте, ревакцинация — через 6 месяцев от вакцинации. Вакцина вводится подкожно под лопатку или в наружную область плеча.
Зачем нужна ревакцинация? С годами иммунитет к заболеванию может несколько снизиться. Для поддержания иммунитета на уровне, способном защитить организм от инфекции, проводятся ревакцинации.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Вакцина против эпидемического паротита малореактогенна, но живой вирус у некоторых людей (редко) вызывает специфические реакции. У небольшого числа привитых возможно повышение температуры с 5 по 13-14-й день и очень редко – на один-два дня припухание слюнных желез. Это является допустимой (обычной) реакцией организма на введение живой паротитной вакцины, и на 13-14-й день состояние ребенка нормализуется.
Крайне редко встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
ВАКЦИНА ПРОТИВ КРАСНУХИ
Краснуха – острая вирусная инфекция, характеризующаяся невысоким подъемом температуры, увеличением лимфатических узлов, особенно на затылке, и мелкопятнистой сыпи. Обычно краснуха у детей протекает легко, но в редких случаях может поражаться головной мозг с развитием энцефалита.
Заболевание опасно для беременных женщин. Если беременная заболевает краснухой, особенно в первые три месяца беременности, то нередко беременность заканчивается выкидышем, рождением мертвого ребенка или ребенка с синдромом врожденной краснухи (врожденный порок сердца, слепота, глухота, в последствии – умственная отсталость), при заражении на поздних сроках беременности у ребенка может возникнуть энцефалит.
Для вакцинации против краснухи используется живая краснушная вакцина
Вакцинация против краснухи проводится детям в возрасте 1 год, ревакцинация – в 6 лет. Если ребенок не был привит своевременно, то вакцинация осуществляется в любом возрасте. Вакцина вводится подкожно под лопатку или в наружную область плеча.
Зачем нужна ревакцинация? С годами иммунитет к заболеванию может несколько снизиться. Для поддержания иммунитета на уровне, способном защитить организм от инфекции, проводятся ревакцинации.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Вакцина против краснухи малореактогенна, но живой вирус у некоторых людей (редко) вызывает специфические реакции. У небольшого числа привитых возможно повышение температуры с 5 по 13-14-й день, появление сыпи, кашля, насморка, а у взрослых – болей в суставах. Это является допустимой (обычной) реакцией организма на введение живой краснушной вакцины, и на 13-14-й день состояние ребенка нормализуется.
Крайне редко встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
ПРИОРИКС
Это вакцина, защищающая сразу от трех вирусных инфекций – кори, эпидемического паротита, краснухи.
Корь — острое, чрезвычайно заразное вирусное заболевание, встречающееся только у людей. При контакте с вирусом вероятность развития болезни близка к 100%. Заболевание характеризуется высокой температурой тела, общим тяжелым состоянием, кашлем, насморком, отечностью век, светобоязнью, гнойными выделения из глаз и сыпью. Корь опасна тяжелыми осложнениями: тяжелыми пневмониями с поражением плевры и образованием абсцессов в легких, язвенно-некротическими поражениями слизистых оболочек полости рта и кишечника, вплоть до распада мягких тканей, гнойным отитом, судорогами, редко – воспалением головного мозга (энцефалит), после которого наступает инвалидизация ребенка. По всему миру от кори ежегодно погибает до миллиона детей. Корью может заразиться и взрослый. Причем заболевание у него протекает тяжелее, чем у детей.
Эпидемический паротит – острая вирусная инфекция, при которой в основном поражаются слюнные железы. Они распухают, ребенку больно жевать и глотать. Кроме слюнных желез вирус эпидемического паротита может вызвать поражение поджелудочной железы (панкреатит), а также головного мозга (менингит, менингоэнцефалит). У 20-30% заболевших мальчиков-подростков воспаляются яички (орхит), что может послужить причиной бесплодия. У 5% заболевших девочек могут быть воспалены яичники (оофорит).
Краснуха – острая вирусная инфекция, характеризующаяся невысоким подъемом температуры, увеличением лимфатических узлов, особенно на затылке, и мелкопятнистой сыпи. Обычно краснуха у детей протекает легко, но в редких случаях может поражаться головной мозг с развитием энцефалита.
В состав вакцины «приорикс», производства ГлаксоСмитКляйн, Бельгия, входят живые вакцины против кори, эпидемического паротита и краснухи.
Вакцинация проводится детям в возрасте 1 год, ревакцинация – в 6 лет. Вакцина альтернативная, т.е. приобретается за счет средств родителей и по желанию родителей. Вакцина вводится подкожно под лопатку или в наружную область плеча.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Вакцина малореактогенна, но живой вирус у некоторых людей (редко) вызывает специфические реакции. У небольшого числа привитых возможно повышение температуры с 5 по 13-14-й день, появление сыпи, кашля, насморк, очень редко – на один-два дня припухание слюнных желез. Это является допустимой (обычной) реакцией организма на введение живой вакцины, и на 13-14-й день состояние ребенка нормализуется.
Крайне редко встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
ВАКЦИНЫ ПРОТИВ ТУБЕРКУЛЕЗА
Туберкулез – бактериальная инфекция, вызываемая микобактериями туберкулеза человека или животного. Поражаются легкие, кости, кожа, мочеполовая система, нервная система, глаза, лимфатические узлы. Туберкулез не поражает только волосы и ногти! Наиболее тяжелой формой заболевания является туберкулезный менингит (воспаление мозговых оболочек).
В наши дни в мире ежегодно заболевают туберкулезом более 9 млн. человек и 3-4 млн. умирают от него.
В России заболеваемость туберкулезом ( в том числе детей) за последние годы выросла более, чем в 2 раза и продолжает расти.
Для туберкулеза характерно постепенное, часто незаметное начало заболевания. Клинические проявления туберкулезной инфекции могут быть разные. Но всегда это сопровождается явлениями интоксикации. И всегда требует лечения.
Для вакцинации против туберкулеза существует две вакцины: БЦЖ и БЦЖ-М
Вводят вакцины внутрикожно в наружную верхнюю треть руки. Кожу после введения вакцины не обрабатывают, повязку не накладывают. В месте введения вакцины в течение 3-6 месяцев последовательно развиваются пятно, гнойничковый элемент, корочка и рубчик. Наличие рубчика свидетельствует о правильном проведении прививки. Подъема температуры, ухудшения общего состояния не бывает.
Вакцинацию против туберкулеза проводят новорожденным в роддоме на 3-7 сутки жизни вакциной БЦЖ, или при наличии при наличии временных противопоказаний – после их отмены дома вакциной БЦЖ-М. До 2-х месячного возраста прививки против туберкулеза проводятся без предварительной реакции Манту, после 2-х месяцев жизни – при отрицательном результате р. Манту. Ревакцинацию вакциной БЦЖ (повторное введение) проводят при отрицательном результате туберкулиновой пробы в 7 лет и в 14 лет.
Возможные осложнения после введения вакцины БЦЖ и БЦЖ-М: лимфаденит, инфильтрат, холодный абсцесс, язва, келоидный рубец, остеит, генерализованный БЦЖ-ит. Осложнения встречаются не часто, но при появлении у ребенка каких-либо симптомов, жалоб необходимо обратиться к врачу.
ВАКЦИНЫ ПРОТИВ ГЕПАТИТА В
Гепатит В – вирусная инфекция, широко распространенная во всем мире, вызывающая поражение печени, вплоть до цирроза (гибели клеток печени с образованием рубцовой ткани) или рака печени. Вирус содержится в крови и любых жидкостях организма зараженного человека (слюна, сперма, вагин6альный секрет). Путей заражения гепатитом В много: при инъекциях, половым путем, при тесном контакте с больным в быту через парезы, раны, при использовании общих инструментов (ножниц, бритв, игл для татуировки), мочалок, расчесок, зубных щеток и т.п. Новорожденный ребенок может заразиться от больной (инфицированной ) матери. По данным Всемирной организации здравоохранения (ВОЗ), ежегодно от гепатита В в мире погибает около 1 000 000 человек.
Вакцины против гепатита В не содержат вирус, созданы генно-инженерным путем, содержат белок пищевых дрожжей.
Первую прививку против гепатита В проводят в роддоме в первый день жизни ребенка, через 1 месяц – вторую вакцинацию, в 6 месяцев – третью. Детям, родившимся от матерей-носителей вируса гепатита В или больных гепатитом В, вакцинацию проводят 4-х кратно: в первый день жизни, в 1 месяц, в 2 месяца, в 12 месяцев. Все вакцины против гепатита В вводят внутримышечно: детям до 2 лет – в бедро, старше – в дельтовидную мышцу (высоко в руку).
На месте введения вакцины могут появиться уплотнение и краснота, которые проходят через несколько дней. Небольшое повышение температуры бывает редко и быстро проход.
Теоретически возможна аллергическая сыпь на вакцину при наличии аллергической реакции на пекарские дрожжи, но т.к. аллергическая реакция на пекарские дрожжи встречается крайне редко, аллергическая сыпь на вакцину тоже почти не регистрируется в мире.
БУБОКОКК
Это вакцина против коклюша, дифтерии, столбняка, гепатита В.
Коклюш вызывается коклюшной палочкой. Заболевание характеризуется приступами спазматического кашля, поражением дыхательной, сердечно-сосудистой и нервной систем. Происходит скапливание густой стекловидной мокроты в бронхах, которую тяжело откашлять и взрослому человеку. Ребенок «заходится» в кашле. Опасен коклюш и своими осложнениями, которые развиваются у 30% — 50% и выше заболевших: воспалением легких (пневмонией), а у маленьких детей – поражением головного мозга (энцефалопатией) с возможными повторными судорогами. При заболевании коклюшем непривитых детей в возрасте до года умереть может каждый пятый ребенок.
Дифтерия – инфекция, которую вызывает дифтерийная палочка. Клинические проявления заболевания обусловлены действием дифтерийного токсина (продукта жизнедеятельности дифтерийной палочки). Могут поражаться миндалины, зев, гортань, нос, кожа, слизистые оболочки. У непривитых заболевание характеризуется тяжелым течением с последующим развитием осложнений со стороны сердечнососудистой и нервной системы. От дифтерии среди непривитых умирают 10 – 20% заболевших. Антибиотики при лечении дифтерии неэффективны, лечение проводят специфической противодифтерийной сывороткой, введение которой само может вызвать тяжелые аллергические состояния.
Столбняк – инфекция, которую вызывает столбнячная палочка. Это заболевание с явлениями выраженной интоксикации нервной системы, проявляющейся в виде тонических и клонических мышечных судорог. Смерть наступает от паралича дыхательной мускулатуры. От столбняка умирают от 67 до 91% заболевших.
Гепатит В – вирусная инфекция, широко распространенная во всем мире, вызывающая поражение печени, вплоть до цирроза (гибели клеток печени с образованием рубцовой ткани) или рака печени. Вирус содержится в крови и любых жидкостях организма зараженного человека (слюна, сперма, вагин6альный секрет). Путей заражения гепатитом В много: при инъекциях, половым путем, при тесном контакте с больным в быту через парезы, раны, при использовании общих инструментов (ножниц, бритв, игл для татуировки), мочалок, расчесок, зубных щеток и т.п. Новорожденный ребенок может заразиться от больной (инфицированной) матери. По данным Всемирной организации здравоохранения (ВОЗ), ежегодно от гепатита В в мире погибает около 1 000 000 человек.
В состав вакцины входят: коклюшная убитая вакцина, дифтерийный и столбнячный анатоксины (иммунитет к дифтерии и столбняку вырабатывается против токсинов, обуславливающих заболевание), а также рекомбинантная вакцина против гепатита В.
Вакцина применяется в том случае, если ребенку необходимо сделать АКДС и вакцинацию против гепатита В, вводится глубоко внутримышечно в передненаружную область бедра.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Крайне редко встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
МОНОВАКЦИНЫ ПРОТИВ ГЕМОФИЛЬНОЙ ТИПА b ИНФЕКЦИИ (ХИБ-ИНФЕКЦИИ)
Гемофильная типа b (Хиб) инфекция является причиной 40% всех гнойных менингитов у маленьких детей, умирает 5 – 25% всех заболевших, 40% переболевших инвалидизируется в результате поражения нервной системы, зрения, слуха (развивается глухота). Инфекция вызывает также воспаление легких, суставов, полости рта, является причиной повторных гнойных отитов, респираторных заболеваний. Болеют в основном дети от 2 месяцев до 5 лет и дети с нарушением иммунитета в любом возрасте.
Схема вакцинации против гемофильной типа b (Хиб) инфекции:
— дети, начинающие получать прививки против Хиб-инфекции с 3 до 6 месяцев прививаются трехкратно с интервалов в 1,5 месяца с ревакцинацией в 1 год 6 месяцев;
— дети, начинающие получать прививки против Хиб-инфекции с 6 до 12 месяцев прививаются двукратно с интервалов в 1,5 месяца с ревакцинацией в 1 год 6 месяцев;
— дети старше года прививаются однократно
Для вакцинации против гемофильной типа b (Хиб) инфекции используются две вакцины: Хиберикс (ГласкоСитКляйн, Бельгия) и Акт-хиб (Санофи Пастер, Франция). Вакцины против гемофильной типа b (Хиб) инфекции вводятся внутримышечно или подкожно.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у менее 10 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С (до 1% привитых детей).
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Вакцины не имеют специальных противопоказаний, кроме гиперчувствительности к ее компонентам и сильной реакцией на предыдущую дозу. ВИЧ-инфекция не является противопоказанием.
ПЕНТАКСИМ
Это вакцина против коклюша (бесклеточная), дифтерии, столбняка, полиомиелита (инактивированная) и гемофильной инфекции типа b.
Коклюш вызывается коклюшной палочкой. Заболевание характеризуется приступами спазматического кашля, поражением дыхательной, сердечно-сосудистой и нервной систем. Происходит скапливание густой стекловидной мокроты в бронхах, которую тяжело откашлять и взрослому человеку. Ребенок «заходится» в кашле. Опасен коклюш и своими осложнениями, которые развиваются у 30% — 50% и выше заболевших: воспалением легких (пневмонией), а у маленьких детей – поражением головного мозга (энцефалопатией) с возможными повторными судорогами. При заболевании коклюшем непривитых детей в возрасте до года умереть может каждый пятый ребенок.
Дифтерия – инфекция, которую вызывает дифтерийная палочка. Клинические проявления заболевания обусловлены действием дифтерийного токсина (продукта жизнедеятельности дифтерийной палочки). Могут поражаться миндалины, зев, гортань, нос, кожа, слизистые оболочки. У непривитых заболевание характеризуется тяжелым течением с последующим развитием осложнений со стороны сердечнососудистой и нервной системы. От дифтерии среди непривитых умирают 10 – 20% заболевших. Антибиотики при лечении дифтерии неэффективны, лечение проводят специфической противодифтерийной сывороткой, введение которой само может вызвать тяжелые аллергические состояния.
Столбняк – инфекция, которую вызывает столбнячная палочка. Это заболевание с явлениями выраженной интоксикации нервной системы, проявляющейся в виде тонических и клонических мышечных судорог. Смерть наступает от паралича дыхательной мускулатуры. От столбняка умирают от 67 до 91% заболевших.
Полиомиелит — это острая вирусная инфекция. Вызывается вирусами полиомиелита трех типов. Поражается в основном спиной мозг, но иногда и головной. Возникают параличи (ребенок не может ходить) или парезы конечностей (хромота). Заболевание ведет к инвалидизации (пораженная конечность плохо растет, слабеет, мышцы атрофируются).
Гемофильная типа b (Хиб) инфекция является причиной 40% всех гнойных менингитов у маленьких детей, умирает 5 – 25% всех заболевших, 40% переболевших инвалидизируется в результате поражения нервной системы, зрения, слуха (развивается глухота). Инфекция вызывает также воспаление легких, суставов, полости рта, является причиной повторных гнойных отитов, респираторных заболеваний. Болеют в основном дети от 2 месяцев до 5 лет и дети с нарушением иммунитета в любом возрасте.
Вакцина вводится глубоко внутримышечно в передненаружную область бедра.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Крайне редко встречаются осложнения: аллергические реакции местные и общие, осложнения со стороны нервной системы (судороги, продолжительный пронзительный крик, энцефалопатия). Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
ВАКЦИНЫ ПРОТИВ ГЕПАТИТА А
Гепатит А – острое вирусное заболевание, поражающее печень. Проявляется заболевание слабостью, снижением аппетита, рвотой, желтой окраской кожи, обесцвеченным стулом, темной окраской мочи. Бывает затяжное и осложненное течение гепатита А. Наиболее тяжело болеют люди с хроническими заболеваниями печени, у них возможен смертельный исход.
Для профилактики гепатита А применяются убитые отечественные (ГЕП-А-ин-ВАК, с 3-х лет) и зарубежные (Хаврикс, с 1 года, и Аваксим, с2 лет) вакцины.
Схема вакцинации две прививки с интервалом 6 – 18 месяцев. Вакцина вводится внутримышечно (предпочтительно) или подкожно.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Крайне редко встречаются осложнения: аллергические реакции местные и общие. Эти состояния при тщательном расследовании часто оказываются заболеваниями, начало которых по времени совпадает с вакцинальным процессом.
ВЕТРЯНАЯ ОСПА
Ветряная оспа -это острое инфекционное заболевание, передающееся воздушно-капельным путем. Инфекция крайне заразна. Она характеризуется лихорадкой, умеренно выраженной интоксикацией и распространенной везикулезной сыпью. Кроме часто встречающейся легкой формы ветряная оспа может протекать в виде среднетяжелой и тяжелой форм, когда резко выражены симптомы интоксикации, может быть поражение головного мозга. А также бывают геморрагическая форма (могут быть кровоизлияния в кожу, слизистые, носовые кровотечения, кровавая рвота), гангренозная форма (некрозы и глубокие язвы на месте пузырьков). Осложнения при ветряной оспе встречаются редко. К ним относятся пневмонии, круп, энцефалиты, менингоэнцефалиты, миелиты, невриты. Возможно присоединение бактериальной инфекции.
Для вакцинации против ветряной оспы используются следующие живые вакцины:
- Варилрикс (ГласкоСмитКляйн, Бельгия)
- Окавакс ( Институт Бикен, Япония)
Схема вакцинации: вакцинация в год и ревакцинация в 6 лет, при вакцинации против ветряной оспы детей старше 6 лет – прививки проводятся двукратно с интервалом в 6 небель. Вакцины против ветряной оспы вводятся подкожно.
У детей, перенесших ветряную оспу, вакцина уменьшает частоту опоясывающего лишая.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5 – 15 % привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Вакцина малореактогенна, но живой вирус у некоторых людей (редко) вызывает специфические реакции. У небольшого числа привитых возможно повышение температуры с 5 по 13-14-й день, появление сыпи. Это является допустимой (обычной) реакцией организма на введение живой вакцины, и на 13-14-й день состояние ребенка нормализуется.
В исключительно редких случаях (частота 1:1 000 000) в период от нескольких дней до трех недель после вакцинации может развиться идеопатическая тромбоцитопеническая пурпура.
ВАКЦИНЫ ПРОТИВ ПНЕВМОКОККОВОЙ ИНФЕКЦИИ
Пневмококковая инфекция – вызывается бактериями и характеризуется тяжелыми заболеваниями ушей (отит), легких, других органов, заражением крови (сепсис), поражением мозговых оболочек (менингит). Пик заболеваемости наблюдается на 1 – 2 году жизни и у пожилых людей. Иммунизация рекомендуется детям первых лет жизни, пожилым людям, пожилым людям, пациентам в учреждениях постоянного пребывания, больным при отсутствии селезенки, онкологических заболеваниях, сахарным диабетом, хронической почечной патологией, ВИЧ. Вакцина показана часто болеющим, детям с увеличением аденоидов, с бронхолегочной патологией, инфицированным туберкулезом.
Для вакцинации против пневмококковой инфекции используется три вакцины: превенар и синфлорикс, разрешенные к применению с 2-х месячного возраста, и пневмо-23, разрешенная к применению с 2-х летнего возраста.
Схема вакцинации:
Вакцинация проводится двукратно (в 2 мес. и 4,5 мес.) с ревакцинацией в 1 год 3 месяца. Если ребенок прививается на втором году жизни – двукратно без ревакцинации. У лиц старше 2 лет – однократно.
Вакцины против пневмококковой инфекции вводятся внутримышечно, детям первых лет жизни в передненаружную поверхность бедра.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5% привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
К редко встречающимся осложнениям при использовании вакцины «превенар» относятся отек Квинке, бронхоспазм, судороги, дерматит, зуд, крапивница.
ВАКЦИНЫ ПРОТИВ КЛЕЩЕВОГО ЭНЦЕФАЛИТА
Клещевой энцефалит – природно-очаговое (характерно только для определенных территорий) вирусное заболевание с преимущественным поражением центральной нервной системы. Переносчиками и резервуарами клещевого энцефалита являются иксодовые клещи. Заражение возможно при употреблении в пищу сырого коровьего или козьего молока. Вирус сохраняется в клещах в течение всей их жизни и передается от поколения к поколению, что делает клещей природным очагом инфекции. Заражение клещевым энцефалитом может произойти и без посещения леса – клещ может быть принесен домой с ветками, цветами, на шерсти домашних животных, на одежде людей. При заболевании вирус поражает головной и спиной мозг, характерны упорные головные боли, судороги, параличи. Заболевание никогда не проходит бесследно, у переболевших на всю жизнь остаются осложнения различной степени тяжести.
Наша область является эндемичной по этому заболеванию, т.е. опасность инфицирования клещевым энцефалитом на территории Свердловской области (в т.ч. и в нашем городе) довольно велика.
Для вакцинации детского населения применяются следующие вакцины:
- «ФСМЕ-ИММУН Инжект» Австрия, разрешенная к применению с годовалого возраста;
- «ЭНЦЕПУР» Германия, разрешенная к применению с годовалого возраста;
- Вакцина против клещевого энцефалита культуральная очишенная концентрированная инактивированная сухая (г. Москва), разрешенная к применению с 4-х летнего возраста;
- КлещЭвак (г. Москва), разрешенная к применению с годовалого возраста.
- «ЭнцеВир Нео детский» (Россия)
Схема вакцинации: вакцинация двукратно с интервалом для отечественной вакцины 1-6 месяцев, для импортной 1-2 месяца; первая ревакцинация для всех вакцин через год после вакцинации, отдаленные ревакцинации 1 раз в 3 года. Вакцины вводятся внутримышечно, а отечественная для старших возрастов может быть введена подкожно в подлопаточную область.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины. Вакцинальные реакции бывают местными и общими.
Местная нормальная реакция – уплотнение тканей, краснота, не превышающая 8 см в диаметре, иногда легкая болезненность в месте введения вакцины; развивается сразу после введения препарата, проходит в течение 1-4 дней, встречается у 5% привитых детей.
Общая нормальная реакция проявляется повышением температуры до 37,50 – 38,60С, иногда появляются нарушения сна, аппетита, недомогание.
После первой дозы иногда наблюдается кратковременное повышение температуры, головная боль, боли в конечностях, тошнота и рвота. На следующие дозы эти симптомы наблюдаются еще реже.
К крайне редким тяжелым поствакцинальным реакциям относят: температуру более 400С, местную реакцию 8 см. в диаметре и более.
Крайне редки аллергические реакции.
ВАКЦИНЫ ПРОТИВ ГРИППА
Грипп – это острое инфекционное вирусное заболевание, передающееся воздушно-капельным путем, поражающее верхние дыхательные пути.
По своей социальной значимости он находится на первом месте среди всех болезней человека. Заболеваемость гриппом и ОРВИ превышает суммарную заболеваемость всеми остальными инфекциями: даже вне эпидемии грипп и ОРВИ составляют до 40% всех заболеваний взрослых и более 60% заболеваний среди детей. Ежегодно по всему земному шару фиксируется ни одна сотня тысяч смертей. Каждые 2-3 года возникают эпидемии. Во время эпидемии каждый пятый россиянин болеет гриппом.
Случаются и пандемии, когда заболевает большинство населения по всему земному шару. Такое массовое инфицирование населения происходит при возникновении нового типа вируса, имеющего незнакомые для иммунной системы человека антигены, т.е. когда у всего населения земного шара нет иммунитета к данному вирусу. Пандемии опасны из-за своего масштаба, из-за тяжести заболевания у многих. Так пандемия 1918-1919 гг. унесла 20 миллионов жизней.
Иммунитет после перенесенного гриппа кратковременный, типоспецифический (т.е. только к тому типу вируса, который вызвал заболевание). Повторные заболевания, вызванные этим же типом вируса возможны через 2-5 лет.
Наиболее частым осложнением гриппа является вторичная бактериальная пневмония. Именно от нее погибает большинство детей младшего возраста, пожилых людей и больных, страдающих хроническими заболеваниями. Пневмония развивается спустя 4-14 дней после исчезновения симптомов гриппа.
Кроме пневмонии встречаются и другие респираторные осложнения: круп (ларинготрахеит), средний отит, синусит, ринит. Грипп также может спровоцировать обострение хронических заболеваний легких (астма, бронхит), декомпенсацию сердечно-сосудистых заболеваний (миокардит, перикардит), почечной недостаточности или эндокринных расстройств (сахарный диабет).
Для профилактики гриппа используются живые, инактивированные, субъединичные и сплит-вакцины.
В Свердловской области преимущественно для вакцинации против гриппа используются субъединичные и сплит-вакцины.:
- Гриппол и Гриппол-плюс. Применяется с 6-ти месячного возраста.
- Совигрипп. Применяется с 6-ти месячного возраста.
- Ультрикс. Применяется с 6 лет.
- Флюарикс (Бельгия) Применяется с 12-ти месяцев.
- Инфлювак (Нидерланды) Применяется с 6-ти месяцев.
- Агриппал (Италия) Применяется с 6-ти месяцев.
- Бегривак (Германия) Применяется с 6-ти месяцев.
- Ваксигрип (Франция) Применяется с 12-ти месяцев.
Инактивированные вакцины вводят внутримышечно или глубоко подкожно в верхнюю треть наружной поверхности плеча.
Говоря обо всех этих вакцинах, хотелось бы отметить, что в состав данных вакцин не входит вирус ни в живом, ни в убитом виде. Все перечисленные вакцины содержат только поверхностные антигены вируса, на которые и вырабатывается иммунитет. Заболевание они вызывать не могут. Наличие же симптомов вирусной инфекции после прививки у некоторых людей связано с тем, что прививки против гриппа делаются в период роста респираторной инфекции. Это просто ОРВИ, которая была бы и без прививки. Это случайное совпадение. От гриппа же прививки эти защищают очень надежно, даже если иммунитет после прививки формируется на фоне ОРВИ. При этом не утяжеляется течение респираторной инфекции. Прививки против гриппа лучше делать до начала эпидемического сезона гриппа.
Прививочные реакции и осложнения. Живые вакцины в течение 3 суток после вакцинации у 2% привитых могут вызывать повышение температуры до 37,50С, легкое недомогание, головную боль, катаральные явления. При подкожном введении убитых вакцин допускается кратковременное повышение температуры выше 37,50С или инфильтратов до 50 мм не более, чем у 3% привитых. При впрыскивании вакцины в нос также возможно кратковременное повышение температуры. Субъединичные и сплит-вакцины дают слабые кратковременные реакции.
Возможны аллергические реакции при наличии анафилактической реакции на куриный белок. В этом случае прививки против гриппа противопоказаны.
ВАКЦИНЫ ПРОТИВ ПАПИЛЛОМАВИРУСНОЙ ИНФЕКЦИИ
В настоящее время известно более 120 типов вируса паппиломы человека, некоторые из них вызывают бородавки на коже, но более 30 типов инфицируют половой тракт. Инфицирование женщин вирусом паппиломы человека является важнейшим фактором канцерогенеза шейки матки. Этот вирус был выявлен в 99,7% биоптатов у женщин с раком шейки матки. Рак шейки матки занимает второе место среди злокачественных опухолей репродуктивных органов у женщин и уступает только раку молочной железы.
По региональному календарю прививки против папилломавирусной инфекции рекомендованы девушкам с 13 летнего возраста.
Для иммунопрофилактики используется две вакцины:
- Гардасил (Мерк Шарп и Доум) – 1 доза (0,5 мл) содержит белок L1 типов 6 и 18 (по 20 мкг), 11 и 16 (по 40 мкг), сорбент –маморфный алюминия гидроксифофатсульфат. Схема введения: 0-2-6 мес.
- Церварикс (ГласкоСмитКляйн) — 1 доза (0,5 мл) содержит белок L1 типов 6 и 18 (по 20 мкг), 50 мкг 3-О-дезацил 1-4-монофосфорил липид А, алюминия 0,5 мг, 0,624 мг дигидрофосфат-динидрата. Схема введения: 0-1-6 мес.
Вакцины вводятся внутримышечно.
Введение любой вакцины вызывает ответную реакцию организма. Это начинает работать иммунная система в ответ на введение антигенов возбудителя. Иногда эти реакции имеют клинические проявления. Это обычные, нормальные вакцинальные реакции (процессы), под которыми понимают изменения в организме, развивающиеся с определенным постоянством после введения той или иной вакцины.
Из всех реакций на вакцину чаще регистрируется боль в месте инъекции и головная боль, кратковременное повышение температуры, тошнота, рвота, боли в мышцах и суставах. Крайне редко могут быть сыпи, зуд, воспаление органов малого таза.
ВАКЦИНЫ ПРОТИВ РОТОВИРУСНОЙ ИНФЕКЦИИ
Ротовирусная инфекция – основная причина острого гастроэнтерита, к возрасту 5 лет ею переболевают практически все дети. Эпидемии наблюдаются в зимне-весенний период. В мире ротовирус уносит более 600000 детских жизней в год.
Инкубационный период составляет до пяти суток, при этом острый период начинается с третьего-седьмого дня. Для восстановления после перенесённой болезни ребёнку требуется до пяти суток.
Для данного заболевания характерно острое начало. Основными его признаками являются рвота, резкое повышение температуры тела, часто возникает понос. Стул при данном патологическом состоянии довольно характерный. В первый день он жидкий, желтый, затем приобретает глинообразную окраску. Обычно среди заболевших отмечается появление насморка, покраснение горла и болезненные ощущения при глотании. Для острого периода характерно отсутствие аппетита, а также состояние упадка сил. Ротовирусная инфекция у детей имеет следующее течение: утром отмечается вялость, капризность, тошнота, возможна рвота (иногда со слизью). Аппетит значительно снижен, после принятия пищи рвота характеризуется присутствием кусочков непереваренной еды, также она возникает при употреблении жидкости в объёме свыше пятидесяти миллилитров. В течение дня повышается температура тела, причём к вечеру она может достигать тридцати девяти градусов. Длительность состояния с повышенной температурой может составлять пять дней.
Самолечение грозит развитием осложнений и более тяжёлым течением заболевания. К таким осложнениям относят присоединение к вирусу бактериальной инфекции, отмирание клеток головного мозга (при значительном повышении температуры). В тяжёлых случаях может отмечаться летальный исход.
В Российской Федерации зарегистрировано две вакцины против ротовирусной инфекции:
- Роторикс (Англия)
- РотаТек (Швецария)
Реактогенность обеих вакцин низкая. Вакцины живые в виде капель в рот. Крайне редко в поствакцинальный период может быть повышение температуры, разжижение стула, иногда – рвота.
Первую прививку против ротовирусной инфекции необходимо поставить в возрасте с 6 до 12 недель, все три – до 32 недель. Вакцинация проводится трехкратно с интервалом между прививками в 1 месяц.
Плановая вакцинация против ветряной оспы: для медицинских работников
Консультативный комитет по практике иммунизации (ACIP) рекомендует, чтобы здоровые люди, у которых нет доказательств иммунитета к ветряной оспе, были вакцинированы против этого заболевания.
Для получения дополнительной информации см. Рекомендации ACIP по вакцинации против ветряной оспы.
Вакцинация против ветряной оспы
Плановая вакцинация двумя дозами
- Первая доза в возрасте от 12 до 15 месяцев
- Вторая доза в возрасте от 4 до 6 лет
Повторная вакцинация второй дозой
- Если вторая доза вводится после дня рождения 7 th , минимальный интервал между дозами составляет ≥3 месяцев для детей в возрасте <13 лет и 4 недели для лиц в возрасте ≥13 лет
Подростки и взрослые (≥ 13 лет) без других доказательств иммунитета
- Дайте 2 дозы с интервалом от 4 до 8 недель
- Если с момента первой дозы прошло более 8 недель, вторая доза может быть введена без перезапуска графика
Начало страницы
Противопоказания для вакцинации против ветряной оспы
Люди с противопоказаниями для вакцинации против ветряной оспы не должны получать вакцину против ветряной оспы, в том числе те, кто:
- имеет анафилактическую / анафилактоидную реакцию на желатин, неомицин или любой другой компонент вакцины в анамнезе
- имеет болезни крови, лейкоз, лимфомы или злокачественные новообразования, поражающие костный мозг или лимфатическую систему.
- имеет первичный или приобретенный иммунодефицит, в том числе у людей с иммунодефицитом, связанным с клеточным иммунодефицитом и СПИДом, или тяжелой иммуносупрессией, связанной с ВИЧ-инфекцией
- получает длительную системную иммуносупрессивную терапию высокими дозами (≥2 недель), включая большие дозы пероральных стероидов (≥2 мг / кг массы тела или в общей сложности 20 мг / день преднизона или его эквивалента для людей с массой тела> 10 кг) или другая иммуносупрессивная терапия
- имеет сопутствующее заболевание средней или тяжелой степени (см. Меры предосторожности при вакцинации против ветряной оспы)
- получал продукты крови (такие как цельная кровь, плазма или иммунный глобулин) в течение предыдущих 3-11 месяцев, в зависимости от дозировки (см. Меры предосторожности при вакцинации против ветряной оспы)
- имеет семейный анамнез (родственники первой степени родства) врожденного наследственного иммунодефицита, если у человека не установлено иммунокомпетентное состояние
- беременна или может быть беременна.Для получения дополнительной информации см. Руководство по вакцинации беременных женщин: Рекомендации по вакцинации против ветряной оспы для определенных групп
Кроме того, вакцина MMRV противопоказана людям с нарушенным гуморальным иммунитетом (гипогаммаглобулинемия, дисгаммаглобулинемия) и ВИЧ-инфекцией.
Некоторые люди с противопоказаниями для вакцинации против ветряной оспы могут получить иммуноглобулин против ветряной оспы после контакта с ветряной оспой. Для получения дополнительной информации см. Управление людьми, подверженными риску тяжелой формы ветряной оспы.
Меры предосторожности при вакцинации против ветряной оспы
Люди с острыми заболеваниями
- Людям с острым тяжелым заболеванием, включая нелеченный активный туберкулез, следует отложить вакцинацию до выздоровления. Решение отложить вакцинацию зависит от тяжести симптомов и этиологии заболевания.
Люди с тромбоцитопенией
Получатели продуктов крови
- Людям, которые недавно получали (в пределах от 3 до 11 месяцев в зависимости от дозировки) продукты крови, плазмы или иммуноглобулина, вакцинация не проводится.Кровь, включая цельную кровь, эритроциты и плазму, а также другие продукты крови, содержащие антитела, могут влиять на эффективность вакцины.
- Люди, получившие вакцину против ветряной оспы, не должны получать продукты крови в течение 14 дней после вакцинации, если польза продукта крови не перевешивает необходимость защиты от вакцинации.
Люди, получающие салицилаты
- Людям следует избегать использования салицилатов в течение 6 недель после вакцинации против ветряной оспы.Это связано с взаимосвязью между приемом аспирина и синдромом Рея после ветряной оспы, а также потенциальным риском развития синдрома Рея, если человеку вводят аспирин после вакцинации против ветряной оспы.
- Будьте осторожны при вакцинации детей, получающих салицилаты. Однако о побочных эффектах не сообщалось.
- Дети с ревматоидным артритом или другими состояниями, требующими терапевтического аспирина, должны находиться под тщательным наблюдением после вакцинации.
Для получения дополнительной информации см. Таблицу противопоказаний и мер предосторожности при вакцинации против ветряной оспы.
Начало страницы
Рекомендации по вакцинации против ветряной оспы для определенных групп
Вакцина против ветряной оспы рекомендуется для вакцинации людей в следующих группах, у которых нет доказательств иммунитета против ветряной оспы:
ВИЧ-инфицированных
- ВИЧ-инфицированные дети старше 12 месяцев с процентным содержанием CD4 + Т-лимфоцитов ≥15%
- ВИЧ-инфицированных людей старше 8 лет с количеством CD4 + Т-лимфоцитов ≥200 клеток / мкл
- Отсутствуют данные об использовании вакцины против ветряной оспы у ВИЧ-инфицированных подростков и взрослых.В этих группах иммуногенность может быть ниже, чем у детей от 1 до 8 лет. Преимущества вакцинации против ветряной оспы могут перевешивать риск тяжелого заболевания, вызванного инфекцией ветряной оспы дикого типа. Следовательно, вакцинация может рассматриваться в этих группах.
- Если вакцинация ВИЧ-инфицированного человека приводит к клиническому заболеванию, можно использовать ацикловир для предотвращения тяжелого заболевания.
ВИЧ-инфицированные люди, подходящие для вакцинации, должны получить 2 дозы одноантигенной вакцины против ветряной оспы (Варивакс®) с интервалом в 3 месяца.
ВИЧ-инфицированным детям, подросткам и взрослым не следует вводить комбинированную вакцину против кори, эпидемического паротита, краснухи и ветряной оспы (ProQuad®).
Люди с некоторой степенью иммунодефицита
- Люди с нарушением гуморального иммунитета
- Люди, получающие системные стероиды при определенных состояниях, таких как астма, и которые получают стероиды <2 мг / кг массы тела или всего <20 мг / день преднизона или его эквивалента, и не имеют иного ослабленного иммунитета
- Отсутствуют данные о том, можно ли безопасно вакцинировать людей, употребляющих ингаляционные, назальные или местные стероиды.Однако, исходя из клинического опыта, эти люди обычно хорошо переносят вакцинацию.
- Некоторые эксперты предлагают воздержаться от приема стероидов в течение 2–3 недель после вакцинации, если это можно сделать безопасно.
- Люди, получающие высокие дозы системных стероидов (≥2 мг / кг / день или ≥20 мг / день преднизона или его эквивалента в течение ≥2 недель), если стероидная терапия была прекращена на ≥1 месяц
- Люди с лейкемией, лимфомой или другими злокачественными новообразованиями, находящиеся в стадии ремиссии и не получавшие химиотерапию в течение ≥3 месяцев
- Детей с лейкемией, которые находятся в стадии ремиссии и у которых нет доказательств иммунитета к ветряной оспе, следует вакцинировать только под руководством экспертов и доступом к противовирусной терапии в случае возникновения осложнений.
Людям с некоторой степенью иммунодефицита не следует получать комбинированную вакцину против кори, эпидемического паротита, краснухи и ветряной оспы (ProQuad ® ).
Бытовые контакты людей с ослабленным иммунитетом
- Здоровые люди, прошедшие вакцинацию против ветряной оспы, могут защитить людей с ослабленным иммунитетом от заражения этой болезнью
- Если у вакцинированного человека появляется сыпь, связанная с вакцинацией, ему следует держаться подальше от людей с ослабленным иммунитетом, у которых нет доказательств иммунитета против ветряной оспы, пока все поражения не исчезнут или не перестанут появляться новые поражения в течение 24 часов
Послеродовые и кормящие матери без признаков иммунитета
Беременным или беременным женщинам не следует делать прививку от ветряной оспы.Для получения дополнительной информации см. Руководство по вакцинации беременных женщин: рекомендации по вакцинации против ветряной оспы для определенных групп
.Послеродовые матери должны получить 2 дозы вакцины против ветряной оспы после беременности
- Первую дозу следует ввести после родов и до выписки из медицинского учреждения. Вторую дозу следует ввести через 4-8 недель после первой. Эту дозу можно ввести во время послеродового визита (через 6-8 недель после родов).
- Нет необходимости откладывать послеродовую вакцинацию из-за грудного вскармливания.
- Женщины, которым сделана вакцина против ветряной оспы, могут продолжать кормить грудью.
Начало страницы
Рекомендации по вакцинации медицинского персонала от ветряной оспы
Консультативный комитет по практике иммунизации (ACIP) при поддержке Консультативного комитета по практике борьбы с инфекциями в больницах (HICPAC) рекомендует медицинским учреждениям обеспечить наличие у всего медицинского персонала доказательств иммунитета против ветряной оспы.Те, у кого нет доказательств иммунитета, должны получить 2 дозы вакцины против ветряной оспы с интервалом от 4 до 8 недель или, если ранее получили 1 дозу, вторую дозу, по крайней мере, через 4 недели после первой дозы.
Для получения дополнительной информации см .:
Тестирование на иммунитет
Медицинский персонал, не имеющий доказательств иммунитета против ветряной оспы, может пройти серологический скрининг перед вакцинацией. Это, вероятно, будет рентабельным, поскольку от 70% до 90% взрослых, которые не помнят, что у них была ветряная оспа, на самом деле имеют антитела в крови.
ACIP или HICPAC не рекомендуют медицинскому персоналу проходить тестирование на иммунитет к ветряной оспе после 2 доз вакцины. Коммерческие анализы недостаточно чувствительны, чтобы всегда обнаруживать антитела после вакцинации. Документированное получение 2 доз вакцины против ветряной оспы отменяет результаты последующих серологических тестов.
Передача вакцинного вируса
Привитые люди редко передают вирус вакцины против ветряной оспы, особенно если у них нет сыпи. В мировом масштабе, с момента запуска программ вакцинации против ветряной оспы, только 11 здоровых вакцинированных людей (6 с сыпью, похожей на ветряную оспу и 5 с поствакцинацией опоясывающего герпеса) были зарегистрированы как распространяющие вирус вакцины среди других людей.У всех этих вакцинированных людей после вакцинации появилась сыпь. В результате вакциной против ветряной оспы заразились 13 человек, включая членов семьи и людей, находящихся в учреждениях длительного ухода. Еще один случай имел механизм, отличный от прямой передачи от реципиента вакцины, возможно, воздействие аэрозоля вакцины во время подготовки вакцины к введению.
Не было документально подтвержденных случаев передачи ветряной оспы от вакцинированного медицинского персонала.
Ограничения на работу
Недавно вакцинированный медицинский персонал не требует никаких ограничений в своей работе.Однако медицинскому персоналу, у которого после вакцинации появляется сыпь, напоминающая ветряную оспу, следует держаться подальше от людей, у которых нет доказательств иммунитета и которые подвержены риску тяжелой формы ветряной оспы. Им следует подождать, пока все поражения не исчезнут (покроются коркой). Если у них появляются поражения, которые не покрываются коркой (только пятна и папулы), им следует подождать, пока новые поражения не появятся в течение 24 часов.
Постконтактная вакцинация против ветряной оспы
Консультативный комитет по практике иммунизации (ACIP) рекомендует, чтобы после контакта с ветряной оспой или опоясывающим герпесом люди, не имеющие доказательств иммунитета и подходящие для вакцинации, получили вакцину от ветряной оспы.
- В идеале вакцину следует вводить в течение 3-5 дней после заражения человека. Это может предотвратить ветряную оспу или сделать ее менее тяжелой.
- Даже если прошло более 5 дней, вакцина все равно должна быть предложена. Это обеспечит защиту от ветряной оспы, если человек снова подвергнется заражению в будущем.
Люди, которые ранее получили первую дозу, должны получить вторую дозу через соответствующий промежуток времени. Для получения дополнительной информации см. О вакцинах против ветряной оспы.
Нет данных об использовании комбинированной вакцины против кори, эпидемического паротита, краснухи и ветряной оспы (ProQuad®) для постконтактной вакцинации.
Вакцинация против ветряной оспы рекомендуется для борьбы со вспышками. Люди, у которых нет доказательств иммунитета, должны получать первую или вторую дозу по мере необходимости. Для получения информации о вспышках ветряной оспы (ветряной оспы) см. Выявление, расследование и контроль вспышек.
См. Управление людьми с риском тяжелой ветряной оспы для получения информации о вариантах профилактики и лечения людей с риском тяжелой ветряной оспы, которые не могут пройти вакцинацию.
Начало страницы
Стратегии вакцинации против копандемии Mtb / ВИЧ
Spertini, F. et al. Безопасность иммунизации человека живой аттенуированной вакциной против Mycobacterium tuberculosis: рандомизированное двойное слепое контролируемое исследование фазы I. Ланцет Респир. Med. 3 , 953–962 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Хардинг Э.Отчет ВОЗ о глобальном прогрессе в деле элиминации туберкулеза. Ланцет Респир. Med. 8 , 19 (2020).
PubMed Статья PubMed Central Google Scholar
Краситель, C. Более широкое использование наиболее широко применяемой в мире вакцины: пересмотр вакцинации против бациллы Кальметта-Герена. J. R. Soc. Интерфейс 10 , 20130365 (2013).
PubMed PubMed Central Статья Google Scholar
Black, G. F. et al. БЦЖ-индуцированное усиление интерферон-гамма-ответа на микобактериальные антигены и эффективность вакцинации БЦЖ в Малави и Великобритании: два рандомизированных контролируемых исследования. Ланцет 359 , 1393–1401 (2002).
PubMed Статья PubMed Central Google Scholar
Lalor, M. K. et al. Популяционные различия в иммунных ответах на вакцинацию бациллой Кальметта-Герена в младенчестве. J. Infect. Дис. 199 , 795–800 (2009).
CAS PubMed PubMed Central Статья Google Scholar
Lalor, M. K. et al. Вакцинация БЦЖ индуцирует различные профили цитокинов после вакцинации младенцев БЦЖ в Великобритании и Малави. J. Infect. Дис. 204 , 1075–1085 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Zhang, L. et al. Переменная вирулентность и эффективность вакцинных штаммов БЦЖ у мышей и корреляция с полиморфизмом генома. Мол. Ther. 24 , 398–405 (2016).
PubMed PubMed Central Статья CAS Google Scholar
Ким Б. Дж., Ким Б. Р., Кук Ю. Х. и Ким Б. Дж. Возможности рекомбинантных Mycobacterium paragordonae, экспрессирующих Gag ВИЧ-1, в качестве основной вакцины против инфекции ВИЧ-1. Sci. Отчетность 9 , 15515 (2019).
PubMed PubMed Central Статья CAS Google Scholar
Kilpelainen, A. et al. Рекомбинантная БЦЖ, экспрессирующая первичный HTI и рекомбинантный бустер ChAdOx1, безопасна и вызывает ВИЧ-1-специфические Т-клеточные ответы у мышей BALB / c. Vaccines 7 , https://doi.org/10.3390/vaccines7030078 (2019).
Ким, Б. Дж., Ким, Б.Р., Кук, Ю. Х. и Ким, Б. Дж. Разработка живой рекомбинантной БЦЖ, экспрессирующей Gag вируса иммунодефицита человека типа 1 (ВИЧ-1), с использованием векторной системы pMyong2: потенциальное использование в качестве новой вакцины против ВИЧ-1. Front Immunol. 9 , 643 (2018).
PubMed PubMed Central Статья CAS Google Scholar
Кориот-Шмитц, Б. и др. Резус-иммунные ответы на Gag SIV, экспрессируемые рекомбинантными векторами БЦЖ, не зависят от ранее существовавшего микобактериального иммунитета. Вакцина 33 , 5715–5722 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Sixsmith, J. D. et al. Рекомбинантные векторы бактерий Mycobacterium bovis bacillus Кальметта-Герена являются первичными для сильных клеточных реакций на рвотную реакцию вируса иммунодефицита обезьян у макак-резусов. Clin. Вакцин. Иммунол. 21 , 1385–1395 (2014).
Артикул CAS Google Scholar
Martins, M.A. et al. Вакцинация фрагментами генов Gag, Vif и Nef обеспечивает частичный контроль репликации вируса после заражения слизистой оболочкой SIVmac239. J. Virol. 88 , 7493–7516 (2014).
PubMed PubMed Central Статья CAS Google Scholar
Альдовини А. и Янг Р. А. Гуморальные и клеточно-опосредованные иммунные ответы на живые рекомбинантные вакцины БЦЖ-ВИЧ. Nature 351 , 479–482 (1991).
CAS PubMed Статья PubMed Central Google Scholar
Venkataswamy, M. M. et al. Улучшение Mycobacterium bovis bacillus Calmette-Guerin в качестве вектора доставки вакцины для вирусных антигенов путем включения гликолипидных активаторов NKT-клеток. PLoS ONE 9 , e108383 (2014).
PubMed PubMed Central Статья CAS Google Scholar
Tameris, M. et al. Живая аттенуированная противотуберкулезная вакцина MTBVAC по сравнению с БЦЖ у взрослых и новорожденных: рандомизированное контролируемое двойное слепое исследование с увеличением дозы. Ланцет Респир. Мед 7 , 757–770 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Suliman, S. et al. Ревакцинация взрослых с латентной инфекцией Mycobacterium tuberculosis Bacillus Calmette-Guerin (BCG) вызывает долгоживущие БЦЖ-реактивные ответы NK-клеток. J. Immunol. 197 , 1100–1110 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Nemes, E. et al. Профилактика инфекции M. tuberculosis с помощью вакцины h5: IC31 или ревакцинации БЦЖ. N. Engl. J. Med 379 , 138–149 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Suliman, S. et al. Оптимизация дозы вакцины H56: IC31 для эндемичных по туберкулезу групп населения. Двойное слепое плацебо-контролируемое испытание по выбору дозы. Am. J. Respir. Крит. Care Med 199 , 220–231 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Broset, E. et al. Вакцина против ТБ-ВИЧ на основе MTBVAC безопасна, вызывает реакцию Т-лимфоцитов и защищает мышей от Mycobacterium tuberculosis. Мол. Ther. 13 , 253–264 (2019).
CAS Google Scholar
Chege, G.K. et al. Устойчивый иммунитет к ауксотрофной кандидатной вакцине против ВИЧ от Mycobacterium bovis BCG-VLP на нечеловеческой модели приматов. J. Virol. 87 , 5151–5160 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Чеге, Г. К. и др. Схема первичной иммунизации с использованием рекомбинантных вакцин BCG и вирусоподобных частиц Pr55 (gag) на основе подтипа C ВИЧ 1 типа успешно вызывает Gag-специфические ответы у павианов. Вакцина 27 , 4857–4866 (2009).
CAS PubMed Статья Google Scholar
Falk, L.A. et al. Рекомбинантная палочка Кальметта-Герена как потенциальный вектор для профилактических вакцин против ВИЧ 1 типа. AIDS Res Hum. Ретровирусы 6 , 91–98 (2000).
Артикул Google Scholar
Honda, M. et al. Защитные иммунные ответы, индуцированные секрецией химерного растворимого белка из рекомбинантной вакцины-кандидата вектора Mycobacterium bovis bacillus Calmette-Guerin против вируса иммунодефицита человека типа 1 у мелких животных. Proc. Natl Acad. Sci. США 92 , 10693–10697 (1995).
CAS PubMed Статья Google Scholar
Kaushal, D. et al. Вакцинация слизистой оболочки ослабленной Mycobacterium tuberculosis вызывает сильные реакции центральной памяти и защищает от туберкулеза. Nat. Commun. 6 , 8533 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Бригадир Т.W. et al. Непатологическое инфицирование макак ослабленной микобактериальной вакциной не активируется в условиях коинфекции ВИЧ. Am. J. Pathol. 187 , 2811–2820 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Darrah, P. A. et al. Профилактика туберкулеза у макак после внутривенной иммунизации БЦЖ. Nature 577 , 95–102 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Картрайт, Э. К. и др. Начало антиретровирусной терапии восстанавливает гомеостаз CD4 + T стволовых клеток памяти у макак, инфицированных вирусом иммунодефицита обезьян. J. Virol. 90 , 6699–6708 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Nowak, P. et al. Разнообразие кишечной микробиоты позволяет прогнозировать иммунный статус при инфекции ВИЧ-1. СПИД 29 , 2409–2418 (2015).
CAS PubMed Статья Google Scholar
Singh, S.K. et al. ВИЧ препятствует представлению антигена Mycobacterium tuberculosis в дендритных клетках человека. Am. J. Pathol. 186 , 3083–3093 (2016).
CAS PubMed Статья Google Scholar
Manosuthi, W., Kiertiburanakul, S., Phoorisri, T. & Sungkanuparph, S. Воспалительный синдром восстановления иммунитета при туберкулезе у ВИЧ-инфицированных пациентов, получающих противотуберкулезную и антиретровирусную терапию. J. Infect. 53 , 357–363 (2006).
PubMed Статья Google Scholar
Лаун, С. Д., Майер, Л., Беккер, Л. Г. и Вуд, Р. Бремя туберкулеза в программе антиретровирусного лечения в странах Африки к югу от Сахары: влияние на результаты лечения и последствия для борьбы с туберкулезом. AIDS 20 , 1605–1612 (2006).
PubMed Статья Google Scholar
Уилсон, Дж. У., Нильсен, Д. М. и Маркс, С. М. Туберкулез с множественной лекарственной устойчивостью у пациентов с вирусом иммунодефицита человека. Соображения по поводу управления в условиях высоких ресурсов. Ann. Являюсь. Грудной. Soc. 17 , 16–23 (2020).
PubMed Статья Google Scholar
Ganatra, S.R. et al. Антиретровирусная терапия не снижает реактивацию туберкулеза в модели сочетанной инфекции туберкулеза и ВИЧ. J. Clin. Вкладывать деньги. , https://doi.org/10.1172/jci136502 (2020).
Bucşan, A. N. et al. Механизмы реактивации латентной туберкулезной инфекции вследствие коинфекции SIV. J. Clin. Вкладывать деньги. 129 , 5254–5260 (2019).
PubMed PubMed Central Статья Google Scholar
Nemes, E., Scriba, T. J. и Hatherill, M. Перспективы вакцины для профилактики туберкулеза, связанного с ВИЧ. Curr. Opin. ВИЧ СПИД 13 , 522–527 (2018).
CAS PubMed Статья Google Scholar
Nusbaum, R.J. et al. Туберкулез легких у гуманизированных мышей, инфицированных ВИЧ-1. Sci. Отчет 6 , 21522 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Чакраварти, С. Д. и др. Блокада фактора некроза опухоли при хроническом туберкулезе мышей усиливает гранулематозное воспаление и дезорганизует гранулемы в легких. Заражение. Иммун. 76 , 916–926 (2008).
CAS PubMed PubMed Central Статья Google Scholar
Арриага, А. К., Ороско, Э. Х., Агилар, Л. Д., Рук, Г. А. и Эрнандес Пандо, Р. Иммунологический и патологический сравнительный анализ между экспериментальной латентной туберкулезной инфекцией и прогрессирующим туберкулезом легких. Clin. Exp. Иммунол. 128 , 229–237 (2002).
CAS PubMed PubMed Central Статья Google Scholar
Dutta, N. K., Illei, P. B., Jain, S. K. & Karakousis, P. C. Характеристика новой модели некротической гранулемы латентной туберкулезной инфекции и реактивации у мышей. Am. J. Pathol. 184 , 2045–2055 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Gonzalo-Asensio, J., Marinova, D., Martin, C. & Aguilo, N. MTBVAC: ослабление возбудителя туберкулеза (ТБ) человека на пути к многообещающей вакцине против эпидемии ТБ. Front Immunol. 8 , 1803 (2017).
PubMed PubMed Central Статья CAS Google Scholar
Aguilo, N. et al. Вакцина MTBVAC безопасна, иммуногенна и обеспечивает защитную эффективность против Mycobacterium tuberculosis у новорожденных мышей. Туберкулез (ред.) 96 , 71–74 (2016).
CAS Статья Google Scholar
Kilpelainen, A. et al. Праймирование рекомбинантной БЦЖ, экспрессирующей новые консервативные мозаичные иммуногены ВИЧ-1, и усиление рекомбинантным ChAdOx1 является безопасным, стабильным и вызывает ВИЧ-1-специфические Т-клеточные ответы у мышей BALB / c. Front Immunol. 10 , 923 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Мюррей П. Дж., Альдовини А. и Янг Р. А. Манипуляции и усиление противомикобактериального иммунитета с использованием штаммов рекомбинантных бацилл Кальметта-Герена, которые секретируют цитокины. Proc. Natl Acad. Sci. США 93 , 934–939 (1996).
CAS PubMed Статья PubMed Central Google Scholar
Grode, L. et al. Повышение эффективности вакцины против туберкулеза рекомбинантной бациллы Mycobacterium bovis с мутантами Кальметта-Герена, секретирующими листериолизин. J. Clin. Вкладывать деньги. 115 , 2472–2479 (2005).
CAS PubMed PubMed Central Статья Google Scholar
Dey, R.J., Dey, B., Singh, A.K., Praharaj, M. & Bishai, W. Bacillus Calmette-Guérin, сверхэкспрессирующая эндогенный стимулятор агониста генов интерферона, обеспечивает усиленную защиту от туберкулеза легких. J. Infect. Дис. 221 , 1048–1056 (2020).
CAS PubMed PubMed Central Google Scholar
Calderon, V. E. et al. Гуманизированная модель туберкулеза на мышах. PLoS ONE 8 , e63331 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Perdomo-Celis, F. et al. Хроническая, острая и реактивированная ВИЧ-инфекция на моделях гуманизированных иммунодефицитных мышей. J. Vis. Exp. 154 , https://doi.org/10.3791/60315 (2019).
Fan, T. J. et al. Создание модели инфекции ВИЧ-1 in vivo у гуманизированных мышей B-NSG. Virol. Грех. 4 , 417–425 (2019).
Google Scholar
Ши, К., Ши, Дж. И Сюй, З. Обзор мышиных моделей латентной туберкулезной инфекции. Сканд. J. Infect. Дис. 43 , 848–856 (2011).
CAS PubMed Статья PubMed Central Google Scholar
Murawski, A. M. et al. Визуализация эволюции реактивации туберкулеза легких у мышей с использованием 18F-FDG PET. J. Nucl. Med. 55 , 1726–1729 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Клинкенберг, Л. Г., Сазерленд, Л.A., Bishai, W. R. & Karakousis, P. C. Метронидазол не обладает активностью против Mycobacterium tuberculosis в латентной модели гипоксической гранулемы in vivo. J. Infect. Дис. 198 , 275–283 (2008).
CAS PubMed PubMed Central Статья Google Scholar
Линч, Р. М., Ямамото, Т. и МакДермотт, А. Б. Исследование и открытие вакцины против ВИЧ на модели нечеловеческих приматов: единая теория профилактики заражения и борьбы с инфекцией SIV. Curr. Opin. ВИЧ СПИД 8 , 288–294 (2013).
CAS PubMed PubMed Central Google Scholar
Форман, Т. В., Мехра, С., Лакнер, А. А. и Каушал, Д. Трансляционные исследования на нечеловеческой модели туберкулеза приматов. ILAR J. 58 , 151–159 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Каушал, Д., Мехра, С., Дидье, П. Дж. И Лакнер, А. А. Модель туберкулеза приматов, не относящихся к человеку. J. Med Primatol. 41 , 191–201 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Рахман, М. А., Роберт-Гурофф, М. и Акселератинг, Х. И. В. Разработка вакцины с использованием моделей приматов, не относящихся к человеку. Expert Rev. Vaccines 18 , 61–73 (2019).
PubMed Статья CAS PubMed Central Google Scholar
Laddy, D. J. et al. К разработке вакцины против туберкулеза: рекомендации по дизайну исследования на нечеловеческих приматах. Заражение. Иммун. 86 , https://doi.org/10.1128/iai.00776-17 (2018).
Стапранс, С. И. и Файнберг, М. Б. Роли нечеловеческих приматов в доклинической оценке кандидатных вакцин против СПИДа. Expert Rev. Vaccines 3 , S5 – S32 (2004).
PubMed Статья PubMed Central Google Scholar
Rivera-Hernandez, T. et al. Вклад моделей приматов, не относящихся к человеку, в разработку вакцин для человека. Дискотека. Med. 18 , 313–322 (2014).
Google Scholar
Jensen, K. et al. Рекомбинантный аттенуированный вакцинный штамм Mycobacterium tuberculosis безопасен для детенышей макак, инфицированных вирусом обезьяньего иммунодефицита. Clin. Вакцин. Иммунол. 19 , 1170–1181 (2012).
CAS Статья Google Scholar
Larsen, M.H. et al. Эффективность и безопасность живых аттенуированных персистентных и быстро очищаемых вакцин против Mycobacterium tuberculosis для приматов, кроме человека. Вакцина 27 , 4709–4717 (2009).
CAS PubMed PubMed Central Статья Google Scholar
Jensen, K. et al. Уравновешивание тренированного иммунитета со стойкой иммунной активацией и риском заражения вирусом обезьяньего иммунодефицита у детенышей макак, вакцинированных аттенуированной вакциной Mycobacterium tuberculosis или Mycobacterium bovis BCG. Clin Vaccine Immunol 24 , https://doi.org/10.1128/cvi.00360-16 (2017).
White, A. D. et al. Оценка безопасности и иммуногенности кандидатной противотуберкулезной вакцины MVA85A, доставляемой аэрозолем в легкие макак. Clin. Вакцин. Иммунол. 20 , 663–672 (2013).
CAS Статья Google Scholar
Verreck, F. A. et al. Усиление вакцины БЦЖ MVA.85A и ослабленная вакцина против M. tuberculosis с дефицитом фосфора демонстрируют защитную эффективность против туберкулеза у макак-резусов. PLoS ONE 4 , e5264 (2009 г.).
PubMed PubMed Central Статья CAS Google Scholar
World Health, вакцина О. БЦЖ: документ с изложением позиции ВОЗ, февраль 2018 г. — Рекомендации. Вакцина 36 , 3408–3410 (2018).
Артикул Google Scholar
Dijkman, K. et al. Профилактика туберкулезной инфекции и заболевания с помощью местной вакцины БЦЖ у многократно контактировавших с макаками резус. Nat. Med. 25 , 255–262 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Биллесков Р. и др. Тестирование вакцины H56, введенной в 4 различных адъювантах в качестве бустера БЦЖ, на модели туберкулеза на нечеловеческих приматах. PLoS ONE 11 , e0161217 (2016).
PubMed PubMed Central Статья CAS Google Scholar
Lindenstrom, T. et al. Субъединичная вакцинация против туберкулеза обеспечивает долгосрочный защитный иммунитет, характеризующийся многофункциональными Т-клетками памяти CD4. J. Immunol. 182 , 8047–8055 (2009).
CAS PubMed Статья PubMed Central Google Scholar
Aagaard, C. et al. Защита и полифункциональные Т-клетки, индуцированные Ag85B-TB10.4 / IC31 против Mycobacterium tuberculosis, сильно зависят от дозы антигена. PLoS ONE 4 , e5930 (2009 г.).
PubMed PubMed Central Статья CAS Google Scholar
Седер, Р. А., Дарра, П. А. и Родерер, М. Качество Т-клеток в памяти и защите: значение для разработки вакцины. Nat. Rev. Immunol. 8 , 247–258 (2008).
CAS PubMed Статья PubMed Central Google Scholar
Coler, R. N. et al. Терапевтическая иммунизация против Mycobacterium tuberculosis является эффективным дополнением к лечению антибиотиками. J. Infect. Дис. 207 , 1242–1252 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Bertholet, S. et al. Определенный кандидат в вакцину против туберкулеза усиливает вакцину БЦЖ и защищает от микобактерий туберкулеза с множественной лекарственной устойчивостью. Sci. Пер. Med. 2 , 53ра74 (2010).
PubMed PubMed Central Статья CAS Google Scholar
Vingert, B. et al. Контроллеры ВИЧ поддерживают популяцию высокоэффективных эффекторных клеток Th2 в отличие от пациентов, получающих лечение в течение длительного времени. J. Virol. 86 , 10661–10674 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Clerici, M. & Shearer, G.M. Переключение Th2–> Th3 является критическим этапом в этиологии ВИЧ-инфекции. Immunol. Сегодня 14 , 107–111 (1993).
CAS PubMed Статья PubMed Central Google Scholar
Hoft, D. F. et al. Безопасность и иммуногенность рекомбинантной вакцины БЦЖ AERAS-422 у здоровых взрослых, не получавших БЦЖ: рандомизированное, активно контролируемое, первое исследование фазы 1 с участием людей. EBioMedicine 7 , 278–286 (2016).
PubMed PubMed Central Статья Google Scholar
Velmurugan, K. et al. Доклиническая разработка кандидатов на замену вакцины БЦЖ. Вакцины 1 , 120–138 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Jambo, K. C. et al. Бронхоальвеолярные CD4 + Т-клеточные ответы на респираторные антигены нарушены у ВИЧ-инфицированных взрослых. Грудь 66 , 375–382 (2011).
PubMed PubMed Central Статья Google Scholar
Kalsdorf, B. et al. Инфекция ВИЧ-1 нарушает ответ бронхоальвеолярных Т-клеток на микобактерии. Am. J. Respir. Крит. Care Med. 180 , 1262–1270 (2009).
CAS PubMed PubMed Central Статья Google Scholar
Murray, L. W. et al. Инфекция вируса иммунодефицита человека нарушает Th2 и Th27 Mycobacterium tuberculosis-специфические Т-клеточные ответы. J. Infect. Дис. 217 , 1782–1792 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Amelio, P. et al. ВИЧ-инфекция функционально нарушает специфические для Mycobacterium tuberculosis ответы CD4 и CD8 Т-клеток. J. Virol. 93 , https://doi.org/10.1128/jvi.01728-18 (2019).
Day, C. L. et al. Инфекция ВИЧ-1 связана с истощением и функциональным нарушением Т-лимфоцитов CD4, специфичных для Mycobacterium tuberculosis, у лиц с латентной туберкулезной инфекцией. J. Immunol. 199 , 2069–2080 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Foreman, T. W. et al. CD4 + Т-клеточные независимые механизмы подавляют реактивацию латентного туберкулеза на модели коинфекции ВИЧ на макаках. Proc. Natl Acad. Sci. США 113 , E5636 – E5644 (2016).
CAS PubMed Статья PubMed Central Google Scholar
Форд, Н., Витория, М. и Доэрти, М. Обеспечение антиретровирусной терапии для всех, кто инфицирован ВИЧ: клинические, общественные и программные преимущества лечения всех. J. Int. AIDS Soc. 21 , https://doi.org/10.1002/jia2.25078 (2018).
Джонс, Дж. Л., Хэнсон, Д. Л., Дворкин, М. С. и Декок, К. М. ВИЧ-ассоциированный туберкулез в эпоху высокоактивной антиретровирусной терапии. Группа взрослых / подростков с заболеванием ВИЧ. Внутр.J. Tuberc. Lung Dis. 4 , 1026–1031 (2000).
CAS PubMed PubMed Central Google Scholar
Golub, J. E. et al. Влияние антиретровирусной терапии и профилактической терапии изониазидом на заболеваемость туберкулезом у ВИЧ-инфицированных пациентов в Рио-де-Жанейро, Бразилия. AIDS 21 , 1441–1448 (2007).
PubMed PubMed Central Статья Google Scholar
Scriba, T. J. et al. Испытание фазы IIa новой противотуберкулезной вакцины MVA85A у взрослых, инфицированных ВИЧ и / или Mycobacterium tuberculosis. Am. J. Respir. Крит. Care Med. 185 , 769–778 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Черчъярд, Г. Дж. И др. Безопасность и иммуногенность вакцины против туберкулеза с 35 вектором аденовируса у ВИЧ-инфицированных, вакцинированных БЦЖ взрослых с количеством CD4 (+) Т-клеток> 350 клеток / мм (3). Вакцина 33 , 1890–1896 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Reither, K. et al. Безопасность и иммуногенность h2 / IC31 (R), адъювантной субъединичной вакцины против туберкулеза, у ВИЧ-инфицированных взрослых с количеством CD4 + лимфоцитов более 350 клеток / мм3: фаза II, многоцентровая, двойная слепая, рандомизированная, плацебо-контролируемая пробный. PLoS ONE 9 , e114602 (2014).
PubMed PubMed Central Статья CAS Google Scholar
Thacher, E. G. et al. Безопасность и иммуногенность кандидатной противотуберкулезной вакцины M72 / AS01 у ВИЧ-инфицированных взрослых при комбинированной антиретровирусной терапии: фаза I / II, рандомизированное испытание. AIDS 28 , 1769–1781 (2014).
CAS PubMed Статья PubMed Central Google Scholar
Hopkins, R. et al. Платформа двойной вакцины для новорожденных против ВИЧ-1 и M. tuberculosis. PLoS ONE 6 , e20067 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Im, E. J. et al. Платформа вакцин для профилактики туберкулеза и передачи вируса иммунодефицита человека 1 типа от матери ребенку при грудном вскармливании. J. Virol. 81 , 9408–9418 (2007).
CAS PubMed PubMed Central Статья Google Scholar
Ndiaye, B.P. et al. Безопасность, иммуногенность и эффективность кандидатной противотуберкулезной вакцины MVA85A у здоровых взрослых, инфицированных ВИЧ-1: рандомизированное плацебо-контролируемое исследование фазы 2. Ланцет Респир. Мед 3 , 190–200 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Nemes, E. et al. Безопасность и иммуногенность вакцинации новорожденных MVA85A и селективной отсроченной вакцинации Bacille Calmette-Guerin для младенцев от матерей, инфицированных вирусом иммунодефицита человека: рандомизированное контролируемое исследование фазы 2. Clin. Заразить. Дис. 66 , 554–563 (2018).
CAS PubMed Статья Google Scholar
Manjaly Thomas, Z. R. et al. Альтернативная аэрозольная и системная иммунизация рекомбинантным вирусным вектором против туберкулеза MVA85A: рандомизированное контролируемое исследование фазы I. PLoS Med. 16 , e1002790 (2019).
PubMed PubMed Central Статья CAS Google Scholar
Kumarasamy, N. et al. Рандомизированное контролируемое исследование безопасности и иммуногенности кандидатной противотуберкулезной вакцины M72 / AS01 на ВИЧ-инфицированных взрослых индийцах. Медицина 95 , e2459 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Hoft, D. F. et al. Рекомбинантный аденовирус, экспрессирующий иммунодоминантные антигены ТБ, может значительно усиливать индуцированный БЦЖ иммунитет человека. Вакцина 30 , 2098–2108 (2012).
CAS PubMed Статья PubMed Central Google Scholar
Abel, B. et al. Новая противотуберкулезная вакцина AERAS-402 индуцирует устойчивые и полифункциональные CD4 + и CD8 + Т-клетки у взрослых. Am. J. Respir. Крит.Care Med. 181 , 1407–1417 (2010).
CAS PubMed PubMed Central Статья Google Scholar
Penn-Nicholson, A. et al. Безопасность и иммуногенность новой противотуберкулезной вакцины ID93 + GLA-SE у здоровых взрослых, вакцинированных БЦЖ, в Южной Африке: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 1. Ланцет Респир. Med. 6 , 287–298 (2018).
CAS PubMed Статья PubMed Central Google Scholar
Aguilo, N. et al. Реактогенность по отношению к основным антигенам туберкулеза, отсутствующим в БЦЖ, связана с улучшенной защитой от Mycobacterium tuberculosis. Nat. Commun. 8 , 16085 (2017).
PubMed PubMed Central Статья Google Scholar
Covián, C. et al. Перекрестная защита, индуцированная БЦЖ, и развитие тренированного иммунитета: значение для разработки вакцины. Front Immunol. 10 , 2806 (2019).
PubMed PubMed Central Статья CAS Google Scholar
О’Нил, Л. А. Дж. И Нетеа, М. Г. Тренированный иммунитет, вызванный БЦЖ: может ли он обеспечить защиту от COVID-19? Nat. Rev. Immunol. 20 , 335–337 (2020).
PubMed Статья CAS Google Scholar
Aaby, P. et al. Рандомизированное испытание вакцинации БЦЖ детям с низкой массой тела при рождении: положительные неспецифические эффекты в неонатальном периоде? Дж.Заразить. Дис. 204 , 245–252 (2011).
CAS PubMed Статья Google Scholar
Kleinnijenhuis, J. et al. Бацилла Кальметта-Герена индуцирует NOD2-зависимую неспецифическую защиту от повторного заражения посредством эпигенетического репрограммирования моноцитов. Proc. Natl Acad. Sci. США 109 , 17537–17542 (2012).
CAS PubMed Статья Google Scholar
Jensen, K. et al. Вызванный вакциной ответ слизистой оболочки и системные антитела связаны со снижением виремии обезьяньего иммунодефицита у детенышей макак-резус. J. Virol. 90 , 7285–7302 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Разработка противотуберкулезной вакцины: от классической к клиническим кандидатам
Корреа-Маседо В. и др. (2019) Взаимодействие геномной изменчивости человека и Mycobacterium tuberculosis .Передний Genet 18 (10): 865
Google Scholar
Мустафа А.С. (2005) Клонирование и экспрессия микобактериальных генов, сравнительная геномика, биоинформатика и протеомика в связи с разработкой новых вакцин и диагностических реагентов. Med Princ Pract 14 (Suppl 1): 27–34
PubMed Google Scholar
Hershkovitz I et al (2015) Происхождение туберкулеза: сценарий неолита.Tuberculosis (Edinb) 95 (Suppl 1): S122 – S126
Google Scholar
Всемирная организация здравоохранения (2019 г.) Глобальный доклад по туберкулезу 2019 г. ВОЗ, Женева
Google Scholar
Всемирная организация здравоохранения (1994) ТБ: глобальная чрезвычайная ситуация, доклад ВОЗ об эпидемии ТБ (WHO / TB / 94.177) . ВОЗ, Женева
Google Scholar
Styblo K, Meijer J, Sutherland I (1969) Передача туберкулезных микобактерий: его тенденция в человеческой популяции. Bull World Health Organ 41 (1): 137–178
CAS PubMed PubMed Central Google Scholar
Д’Арси Харт П. (2001) Исторический спад в заболеваемости туберкулезом: природа, воспитание и биосоциальная модель. Int J Tuberc Lung Dis 5 (9): 879
CAS PubMed Google Scholar
Pai M et al (2016) Tuberculosis. Nat Rev Dis Primers 2: 16076
PubMed Google Scholar
Шори Дж. С., Шлезингер Л. С., Врожденные иммунные ответы на туберкулез. Microbiol Spectr, 2016 декабрь; 4 (6). https://doi.org/10.1128/microbiolspec.TBTB2-0010-2016
ДеВердт С. (2013) Вакцины: извечная проблема. Nature 502 (7470): S8 – S9
CAS PubMed Google Scholar
Calmette A (1931) Профилактическая вакцинация против туберкулеза с помощью БЦЖ. Proc R Soc Med 24 (11): 1481–1490
CAS PubMed PubMed Central Google Scholar
Brosch R et al (2007) Пластичность генома БЦЖ и влияние на эффективность вакцины. Proc Natl Acad Sci U S A 104 (13): 5596–5601
CAS PubMed PubMed Central Google Scholar
Фаворов М. и др. (2012) Сравнительная эффективность профилактики туберкулеза (ТБ) у детей вакцинами Bacillus Calmette-Guerin (БЦЖ) из разных источников Казахстан. PLoS One 7 (3): e32567
CAS PubMed PubMed Central Google Scholar
Mostowy S et al (2003) Эволюция вакцин БЦЖ in vitro. Вакцина 21 (27–30): 4270–4274
CAS PubMed Google Scholar
Trunz BB, Fine P, Dye C (2006) Влияние вакцинации БЦЖ на детский туберкулезный менингит и милиарный туберкулез во всем мире: метаанализ и оценка экономической эффективности. Ланцет 367 (9517): 1173–1180
Google Scholar
Блок Б.А. и др. (2015) Обученный врожденный иммунитет как основной механизм долгосрочных неспецифических эффектов вакцин. J Leukoc Biol 98 (3): 347–356
CAS PubMed Google Scholar
Рот А. и др. (2006) Вакцинация против Bacillus Calmette-Guerin и детская смертность. Expert Rev Vaccines 5 (2): 277–293
PubMed Google Scholar
Андерсен П., Кауфманн Ш., Новые стратегии вакцинации против туберкулеза.Cold Spring Harb Perspect Med. 2014 2 июня; 4 (6). pii: a018523. https://doi.org/10.1101/cshperspect.a018523
Rodrigues LC, Mangtani P, Abubakar I (2011) Как со временем снижается уровень защиты от туберкулеза вакциной БЦЖ? BMJ 343: d5974
PubMed Google Scholar
Mangtani P et al (2014) Защита вакциной БЦЖ от туберкулеза: систематический обзор рандомизированных контролируемых испытаний. Clin Infect Dis 58 (4): 470–480
PubMed Google Scholar
Abubakar I et al (2013) Систематический обзор и метаанализ текущих данных о продолжительности защиты вакцинацией против туберкулеза бациллой Кальметта-Герена. Оценка медицинских технологий 17 (37): 1–372 v-vi
CAS PubMed PubMed Central Google Scholar
Андерсен П., Доэрти TM (2005) Успех и неудача БЦЖ — последствия для новой противотуберкулезной вакцины. Nat Rev Microbiol 3 (8): 656–662
CAS PubMed Google Scholar
Colditz GA et al (1994) Эффективность вакцины БЦЖ в профилактике туберкулеза. Мета-анализ опубликованной литературы. JAMA 271 (9): 698–702
CAS PubMed Google Scholar
Fine PE (1995) Вариация защиты с помощью БЦЖ: последствия и для гетерологичного иммунитета. Ланцет 346 (8986): 1339–1345
CAS PubMed Google Scholar
Colditz GA et al (1995) Эффективность вакцинации новорожденных и младенцев бациллами Кальметта-Герена в профилактике туберкулеза: метаанализ опубликованной литературы. Педиатрия 96 (1 Pt 1): 29–35
CAS PubMed Google Scholar
Gallant CJ et al (2010) Влияние возраста и пола на микобактериальный иммунитет в районе с высокой заболеваемостью туберкулезом. Int J Tuberc Lung Dis 14 (8): 952–959
CAS PubMed Google Scholar
Испытание вакцины БЦЖ для профилактики туберкулеза на юге Индии (1979 г.) первый отчет — Испытание по профилактике туберкулеза . Bull World Health Organ 57 (5): 819–827
Google Scholar
Бюллетень Всемирной организации здравоохранения (1979) Испытание вакцины БЦЖ для профилактики туберкулеза на юге Индии: первый отчет . ВОЗ, Женева
Google Scholar
Harris DP et al (2005) Регулирование продукции IFN-гамма B-эффекторными клетками 1: важная роль T-bet и рецептора IFN-гамма. J Immunol 174 (11): 6781–6790
CAS PubMed Google Scholar
Wagner M et al. (2004) IL-12p70-зависимая индукция Th2 человеческими В-клетками требует комбинированной активации лигандом CD40 и ДНК CpG. J Immunol 172 (2): 954–963
CAS PubMed Google Scholar
Wang J et al (2004) Единичная, но не парентеральная иммунизация слизистой оболочки рекомбинантной аденовирусной вакциной обеспечивает мощную защиту от туберкулеза легких. J Immunol 173 (10): 6357–6365
CAS PubMed Google Scholar
Vordermeier HM et al (2009) Вирусные бустерные вакцины улучшают вызванную Mycobacterium bovis БЦЖ защиту от туберкулеза крупного рогатого скота. Infect Immun 77 (8): 3364–3373
CAS PubMed PubMed Central Google Scholar
Dean G et al (2014) Сравнение иммуногенности и защиты от туберкулеза крупного рогатого скота после иммунизации путем примирования БЦЖ и иммунизации аденовирусом или вакцинами на основе белка. Вакцина 32 (11): 1304–1310
CAS PubMed Google Scholar
Metcalfe HJ et al. (2018) Ag85A-специфические CD4 + Т-клеточные линии, полученные после повторной иммунизации крупного рогатого скота, вакцинированного БЦЖ, с помощью Ad5-85A, обладают как подавлением роста микобактерий, так и противовоспалительными свойствами. Вакцина 36 (20): 2850–2854
CAS PubMed PubMed Central Google Scholar
Santosuosso M et al (2006) Интраназальная стимуляция вакциной с вектором аденовируса заметно усиливает защиту от парентеральной иммунизации Mycobacterium bovis БЦЖ против туберкулеза легких.Infect Immun 74 (8): 4634–4643
CAS PubMed PubMed Central Google Scholar
Smaill F, Xing Z (2014) Вакцина против туберкулеза на основе аденовируса человека 5 типа: будущее за респираторным путем? Expert Rev Vaccines 13 (8): 927–930
CAS PubMed Google Scholar
Smaill F et al (2013) Вакцина против туберкулеза на основе аденовируса человека 5 типа индуцирует устойчивые Т-клеточные ответы у людей, несмотря на существовавший ранее антиаденовирусный иммунитет .Sci Transl Med 5 (205): 205ra134
PubMed Google Scholar
Джеанатан М. и др. (2016) Индукция иммунопротективного репертуара Т-клеток с разнообразным генетическим покрытием с помощью новой противотуберкулезной вакцины с вирусным вектором для человека. J Infect Dis 214 (12): 1996–2005
CAS PubMed PubMed Central Google Scholar
Stylianou E et al (2015) Улучшение защитной эффективности БЦЖ с помощью нового аденовируса шимпанзе и модифицированного вируса коровьей оспы Анкара, оба экспрессирующих Ag85A.Вакцина 33 (48): 6800–6808
CAS PubMed PubMed Central Google Scholar
Хокридж Т. и др. (2008) Безопасность и иммуногенность новой противотуберкулезной вакцины, MVA85A, у здоровых взрослых в Южной Африке. J Infect Dis 198 (4): 544–552
PubMed PubMed Central Google Scholar
Dockrell HM (2016) На пути к новым противотуберкулезным вакцинам: каковы проблемы? Pathog Dis 74 (4): ftw016
PubMed Google Scholar
Лу Дж. Б. и др. (2016) Анализ феномена Коха у морских свинок, инфицированных Mycobacterium tuberculosis, вакцинированных рекомбинантной противотуберкулезной вакциной AEC / BC02. Чжунхуа Цзе Хе Хе Ху Си За Чжи 39 (7): 524–528
CAS PubMed Google Scholar
Perez-Martinez AP et al (2017) Сохранение гена, кодирующего антиген Mycobacterium tuberculosis Rv2660, и высокий прогнозируемый охват населения многоступенчатой вакциной H56 в Южной Африке.Заражение Genet Evol 55: 244–250
CAS PubMed Google Scholar
Lin PL et al (2012) Многоступенчатая вакцина H56 усиливает действие БЦЖ для защиты яванских макак от активного туберкулеза и реактивации латентной инфекции Mycobacterium tuberculosis. J Clin Invest 122 (1): 303–314
CAS PubMed Google Scholar
Suliman S et al (2019) Оптимизация дозы вакцины H56: IC31 для популяций, эндемичных по туберкулезу.Двойное слепое плацебо-контролируемое испытание по выбору дозы. Am J Respir Crit Care Med 199 (2): 220–231
CAS PubMed Google Scholar
Луабея А.К. и др. (2015) Первое испытание на людях постконтактной противотуберкулезной вакцины H56: IC31 у инфицированных Mycobacterium tuberculosis и неинфицированных здоровых взрослых. Вакцина 33 (33): 4130–4140
CAS PubMed Google Scholar
Orr MT et al (2014) Адъювант с двойным агонистом TLR повышает иммуногенность и защитную эффективность антигена противотуберкулезной вакцины ID93. PLoS One 9 (1): e83884
PubMed PubMed Central Google Scholar
Duthie MS et al (2014) Защита от инфекции Mycobacterium leprae с помощью вакцин ID83 / GLA-SE и ID93 / GLA-SE, разработанных для туберкулеза. Infect Immun 82 (9): 3979–3985
PubMed PubMed Central Google Scholar
Bertholet S et al (2010) Определенная противотуберкулезная вакцина-кандидат усиливает БЦЖ и защищает от микобактерий туберкулеза с множественной лекарственной устойчивостью . Sci Transl Med 2 (53): 53ra74
PubMed PubMed Central Google Scholar
Baldwin SL et al (2012) Важность адъювантной рецептуры в разработке противотуберкулезной вакцины. J Immunol 188 (5): 2189–2197
CAS PubMed PubMed Central Google Scholar
Baldwin SL et al (2016) Защита и долгоживущий иммунитет, индуцированный вакциной-кандидатом ID93 / GLA-SE против клинического изолята Mycobacterium tuberculosis. Clin Vaccine Immunol 23 (2): 137–147
CAS PubMed PubMed Central Google Scholar
Cha SB et al (2016) Легочный иммунитет и прочная защита, индуцированные вакциной-кандидатом ID93 / GLA-SE против гипервирулентного корейского штамма Beijing Mycobacterium tuberculosis K.Вакцина 34 (19): 2179–2187
CAS PubMed Google Scholar
Coler RN et al (2013) Терапевтическая иммунизация против Mycobacterium tuberculosis является эффективным дополнением к лечению антибиотиками. J Infect Dis 207 (8): 1242–1252
CAS PubMed Google Scholar
Baldwin SL et al (2014) Противотуберкулезная вакцина-кандидат ID93 не вызывает чувствительности к очищенному производному белка.Clin Vaccine Immunol 21 (9): 1309–1313
PubMed PubMed Central Google Scholar
Coler RN et al (2018) Адъювант агониста TLR-4, GLA-SE, улучшает величину и качество иммунных ответов, вызываемых противотуберкулезной вакциной ID93: первое испытание на людях. Вакцины NPJ 3:34
PubMed PubMed Central Google Scholar
Penn-Nicholson A et al (2018) Безопасность и иммуногенность новой противотуберкулезной вакцины ID93 + GLA-SE у здоровых взрослых, вакцинированных БЦЖ, в Южной Африке: рандомизированная двойная слепая плацебо-контролируемая фаза 1 пробный.Ланцет Респир Мед 6 (4): 287–298
CAS PubMed Google Scholar
Хомолка С., Уббен Т., Ниманн С. (2016) Высокая вариабельность последовательности гена ppE18 клинических штаммов комплекса Mycobacterium tuberculosis потенциально влияет на эффективность вакцины-кандидата M72 / AS01E . PLoS One 11 (3): e0152200
PubMed PubMed Central Google Scholar
Montoya J et al (2013) Рандомизированное контролируемое исследование фазы II с подбора доз вакцины-кандидата от туберкулеза M72 / AS01 у здоровых PPD-позитивных взрослых. J Clin Immunol 33 (8): 1360–1375
CAS PubMed PubMed Central Google Scholar
Skeiky YA et al (1999) Клонирование, экспрессия и иммунологическая оценка двух предполагаемых секретируемых антигенов сериновой протеазы Mycobacterium tuberculosis. Инфекция иммунной 67 (8): 3998–4007
CAS PubMed PubMed Central Google Scholar
Dillon DC et al (1999) Молекулярная характеристика и ответы Т-клеток человека на члена нового семейства генов Mycobacterium tuberculosis mtb39. Инфекция иммунной 67 (6): 2941–2950
CAS PubMed PubMed Central Google Scholar
Аль-Аттия Р и др. (2004) Клеточные иммунные ответы in vitro на сложные и недавно определенные рекомбинантные антигены Mycobacterium tuberculosis. Clin Exp Immunol 138 (1): 139–144
CAS PubMed PubMed Central Google Scholar
Montagnani C et al (2014) Вакцина против туберкулеза: что нового? BMC Infect Dis 14 (Дополнение 1): S2
PubMed PubMed Central Google Scholar
Nabavinia MS et al (2012) Создание вектора экспрессии, содержащего Mtb72F Mycobacterium tuberculosis. Ячейка J 14 (1): 61–66
CAS PubMed PubMed Central Google Scholar
Skeiky YA et al (2004) Дифференциальные иммунные ответы и защитная эффективность, индуцированные компонентами полипротеиновой вакцины против туберкулеза, Mtb72F, доставляемой в виде голой ДНК или рекомбинантного белка. J Immunol 172 (12): 7618–7628
CAS PubMed Google Scholar
Day CL et al (2013) Индукция и регуляция Т-клеточного иммунитета с помощью новой противотуберкулезной вакцины M72 / AS01 у взрослых в Южной Африке. Am J Respir Crit Care Med 188 (4): 492–502
CAS PubMed PubMed Central Google Scholar
Gillard P et al (2016) Безопасность и иммуногенность противотуберкулезной вакцины-кандидата M72 / AS01E у взрослых с туберкулезом: рандомизированное исследование фазы II . Туберкулез (Edinb) 100: 118–127
CAS Google Scholar
Idoko OT et al (2014) Безопасность и иммуногенность кандидатной противотуберкулезной вакцины M72 / AS01 при ревакцинации БЦЖ младенцам в Гамбии: открытое рандомизированное контролируемое исследование.Tuberculosis (Edinb) 94 (6): 564–578
CAS Google Scholar
Кумарасами Н. и др. (2016) Рандомизированное контролируемое исследование безопасности и иммуногенности кандидатной противотуберкулезной вакцины M72 / AS01 у ВИЧ-инфицированных взрослых в Индии. Медицина (Балтимор) 95 (3): e2459
CAS Google Scholar
Leroux-Roels I et al (2013) Улучшение CD4 (+) Т-клеточного ответа на Mycobacterium tuberculosis у PPD-отрицательных взрослых с помощью M72 / AS01 по сравнению с композициями кандидатных вакцин против туберкулеза M72 / AS02 и Mtb72F / AS02. : рандомизированное исследование.Вакцина 31 (17): 2196–2206
CAS PubMed Google Scholar
Penn-Nicholson A et al (2015) Безопасность и иммуногенность вакцины-кандидата M72 / AS01E для подростков в условиях эндемичного туберкулеза. Вакцина 33 (32): 4025–4034
CAS PubMed PubMed Central Google Scholar
Thacher EG et al (2014) Безопасность и иммуногенность кандидатной противотуберкулезной вакцины M72 / AS01 у ВИЧ-инфицированных взрослых при комбинированной антиретровирусной терапии: фаза I / II, рандомизированное исследование.AIDS 28 (12): 1769–1781
CAS PubMed Google Scholar
Кумарасами Н. и др. (2018) Долгосрочная безопасность и иммуногенность противотуберкулезной вакцины-кандидата M72 / AS01E у ВИЧ-положительных и отрицательных взрослых индейцев: результаты рандомизированного контролируемого исследования фазы II. Медицина (Балтимор) 97 (45): S
Google Scholar
Van Der Meeren O et al (2018) Контролируемое испытание фазы 2b вакцины M72 / AS01E для профилактики туберкулеза.N Engl J Med 379 (17): 1621–1634
Google Scholar
Cardona PJ (2006) RUTI: новый шанс сократить лечение латентной туберкулезной инфекции. Туберкулез (Edinb) 86 (3–4): 273–289
Google Scholar
Vilaplana C et al (2010) Двойное слепое рандомизированное плацебо-контролируемое клиническое испытание фазы I терапевтической противотуберкулезной вакцины RUTI.Вакцина 28 (4): 1106–1116
CAS PubMed Google Scholar
Nell AS et al (2014) Безопасность, переносимость и иммуногенность новой противотуберкулезной вакцины RUTI: рандомизированное плацебо-контролируемое клиническое исследование фазы II у пациентов с латентной туберкулезной инфекцией. PLoS One 9 (2): e89612
PubMed PubMed Central Google Scholar
von Reyn CF et al (2010) Профилактика туберкулеза у взрослых ВИЧ-инфицированных, примированных бациллой Кальметта-Герена, усиленных инактивированной цельноклеточной микобактериальной вакциной.AIDS 24 (5): 675–685
Google Scholar
Lahey T. et al (2016) Иммуногенность и защитная эффективность бустерной вакцины DAR-901 на мышиной модели туберкулеза. PLoS One 11 (12): e0168521
PubMed PubMed Central Google Scholar
von Reyn CF et al (2017) Безопасность и иммуногенность бустерной инактивированной цельноклеточной вакцины против туберкулеза у взрослых, примированных БЦЖ: рандомизированное контролируемое испытание DAR-901.PLoS One 12 (5): e0175215
Google Scholar
Masonou T et al (2019) Ответы CD4 + Т-клеточных цитокинов на бустер-вакцину DAR-901 у взрослых, примированных БЦЖ: рандомизированное плацебо-контролируемое исследование. PLoS One 14 (5): e0217091
CAS PubMed PubMed Central Google Scholar
Craig SR et al (2018) Альтруизм, скептицизм и коллективное принятие решений в США иностранного происхождения.Жители S. в испытании противотуберкулезной вакцины . BMC Public Health 18 (1): 535
PubMed PubMed Central Google Scholar
Sharma P et al (1999) Инвалидность при мультибациллярной лепре после комбинированной лекарственной терапии с иммунотерапией против лепрозной вакцины против Mycobacterium w и без нее. Int J Lepr Other Mycobact Dis 67 (3): 250–258
CAS PubMed Google Scholar
Sharma P et al (2005) Иммунопрофилактические эффекты вакцины против лепры Mw у лиц, контактировавших с больными лепрой в домашних условиях: клинические полевые испытания с последующим периодом наблюдения 8-10 лет. Лепр Рев 76 (2): 127–143
PubMed Google Scholar
Sharma P et al (2000) Вакцина против Mycobacterium w, полезный адъювант для множественной лекарственной терапии при полибациллярной лепре: отчет о клинических иммунотерапевтических клинических испытаниях в больницах с последующим наблюдением в течение 1-7 лет после лечения.Лепр Рев 71 (2): 179–192
CAS PubMed Google Scholar
Guleria I, Mukherjee R, Kaufmann SH (1993) Истощение CD4 и CD8 Т-лимфоцитов in vivo нарушает индуцированную вакциной Mycobacterium w защиту против M. tuberculosis у мышей. Med Microbiol Immunol 182 (3): 129–135
CAS PubMed Google Scholar
Gupta A et al (2012) Защитная эффективность Mycobacterium indicus pranii против туберкулеза и лежащих в основе местных иммунных реакций легких на модели морской свинки.Вакцина 30 (43): 6198–6209
CAS PubMed Google Scholar
Patel N, Deshpande MM, Shah M (2002) Влияние иммуномодулятора, содержащего Mycobacterium w, на конверсию мокроты при туберкулезе легких. J Indian Med Assoc 100 (3): 191–193
PubMed Google Scholar
Patel N, Trapathi SB (2003) Повышение эффективности лечения туберкулеза легких категории II (повторное лечение) с помощью микобактерий w.J Indian Med Assoc 101 (11): 680 682
PubMed Google Scholar
Groschel MI et al (2014) Терапевтические вакцины против туберкулеза — систематический обзор. Вакцина 32 (26): 3162–3168
PubMed Google Scholar
Gonzalo-Asensio J et al (2017) MTBVAC: ослабление возбудителя туберкулеза (ТБ) человека на пути к многообещающей вакцине против эпидемии ТБ.Фронт Иммунол 8: 1803
PubMed PubMed Central Google Scholar
Aguilo N et al (2016) Вакцина MTBVAC безопасна, иммуногенна и обеспечивает защитную эффективность против Mycobacterium tuberculosis у новорожденных мышей . Туберкулез (Edinb) 96: 71–74
CAS Google Scholar
Маринова Д. и др. (2017) MTBVAC от открытия до клинических испытаний в странах, эндемичных по туберкулезу.Expert Rev Vaccines 16 (6): 565–576
CAS PubMed Google Scholar
Spertini F et al (2015) Безопасность иммунизации людей живой аттенуированной вакциной против Mycobacterium tuberculosis: рандомизированное двойное слепое контролируемое исследование фазы I. Ланцет Респир Мед 3 (12): 953–962
CAS PubMed Google Scholar
Всемирная организация здравоохранения (1995) Глобальная программа по борьбе с туберкулезом и глобальная программа по вакцинам: заявление о ревакцинации БЦЖ для профилактики туберкулеза.ВОЗ, Женева
Google Scholar
Всемирная организация здравоохранения (2004 г.) вакцина БЦЖ. Позиционный документ ВОЗ . ВОЗ, Женева
Google Scholar
Всемирная организация здравоохранения (2018 г.) Вакцины БЦЖ: документ с изложением позиции ВОЗ — февраль 2018 г. ВОЗ, Женева
Google Scholar
Всемирная организация здравоохранения (2007) Пересмотренное руководство по вакцинации БЦЖ для младенцев из группы риска заражения ВИЧ.ВОЗ, Женева
Google Scholar
Husain AA et al (2011) Влияние повторной вакцинации БЦЖ на гуморальный ответ на модели мышей. Индийский журнал J Exp Biol 49 (1): 7–10
PubMed Google Scholar
Husain AA et al (2015) Сравнительная оценка бустерной эффективности вакцин на основе пептидов БЦЖ, Ag85B и Ag85B для усиления индуцированного БЦЖ иммунитета у мышей BALB / c: пилотное исследование.Clin Exp Vaccine Res 4 (1): 83–87
CAS PubMed PubMed Central Google Scholar
Parlane NA et al (2014) Ревакцинация крупного рогатого скота бациллой Кальметта-Герена через два года после первой вакцинации, когда иммунитет ослабел, повысила защиту от заражения Mycobacterium bovis. PLoS One 9 (9): e106519
PubMed PubMed Central Google Scholar
Kashyap RS et al (2010) Оценка иммунного ответа на повторную стимуляцию вакциной БЦЖ с использованием модели PBMC in vitro. J Иммунные тервакцины 8: 3
PubMed PubMed Central Google Scholar
Nemes E et al (2018) Профилактика инфекции M. tuberculosis с помощью вакцины h5: IC31 или ревакцинации БЦЖ. N Engl J Med 379 (2): 138–149
CAS PubMed PubMed Central Google Scholar
Nieuwenhuizen NE et al (2017) Рекомбинантная вакцина Bacille Calmette-Guerin VPM1002: готова для тестирования клинической эффективности. Фронт Иммунол 8: 1147
PubMed PubMed Central Google Scholar
Hamon MA et al (2012) Listeriolysin O: швейцарский армейский нож Listeria. Trends Microbiol 20 (8): 360–368
CAS PubMed Google Scholar
Shaughnessy LM et al (2006) Перфорация мембраны ингибирует слияние лизосом за счет изменения pH и кальция в вакуолях Listeria monocytogenes.Cell Microbiol 8 (5): 781–792
CAS PubMed PubMed Central Google Scholar
Reyrat JM, Berthet FX, Gicquel B (1995) Уреазный локус Mycobacterium tuberculosis и его использование для демонстрации аллельного обмена у Mycobacterium bovis bacillus Calmette-Guerin. Proc Natl Acad Sci U S A 92 (19): 8768–8772
CAS PubMed PubMed Central Google Scholar
Гордон А.Х., Харт П.Д., Янг М.Р. (1980) Аммиак ингибирует слияние фагосома-лизосома в макрофагах. Nature 286 (5768): 79–80
CAS PubMed Google Scholar
Kaufmann SH et al (2014) Заместительная вакцина БЦЖ VPM1002: от чертежной доски до клинических испытаний. Expert Rev Vaccines 13 (5): 619–630
CAS PubMed Google Scholar
Grode L et al (2013) Безопасность и иммуногенность рекомбинантной вакцины БЦЖ VPM1002 в открытом рандомизированном клиническом исследовании фазы 1.Вакцина 31 (9): 1340–1348
CAS PubMed Google Scholar
Loxton AG, Knaul JK, Grode L, Gutschmidt A, Meller C, Eisele B, Johnstone H, van der Spuy G, Maertzdorf J, Kaufmann SHE, Hesseling AC, Walzl G, Cotton MF., Безопасность и Иммуногенность рекомбинантной вакцины БЦЖ против Mycobacterium bovis VPM1002 у новорожденных, не инфицированных ВИЧ, в Южной Африке. Clin Vaccine Immunol. 2017 6 февраля; 24 (2). pii: e00439-16. https://doi.org/10.1128/CVI.00439-16. Печать 2017 Февраль
Lindenstrom T et al (2013) Контроль хронической инфекции Mycobacterium tuberculosis с помощью клеток центральной памяти, секретирующих CD4 KLRG1-IL-2. J Immunol 190 (12): 6311–6319
CAS PubMed Google Scholar
Grode L et al (2005) Повышенная эффективность вакцины против туберкулеза рекомбинантных мутантов Mycobacterium bovis bacille Calmette-Guerin, секретирующих листериолизин. J Clin Invest 115 (9): 2472–2479
CAS PubMed PubMed Central Google Scholar
Desel C et al (2011) Рекомбинантная БЦЖ DeltaureC hly + индуцирует лучшую защиту по сравнению с исходной БЦЖ, стимулируя сбалансированную комбинацию цитокиновых ответов типа 1 и 17. J Infect Dis 204 (10): 1573–1584
CAS PubMed PubMed Central Google Scholar
Vogelzang A et al (2014) CD4 + Т-клетки центральной памяти ответственны за превосходную защиту рекомбинантной вакцины Bacillus Calmette-Guerin DeltaureC :: hly от туберкулеза.J Infect Dis 210 (12): 1928–1937
CAS PubMed PubMed Central Google Scholar
Gengenbacher M et al (2016) Постконтактная вакцинация кандидатной вакциной Bacillus Calmette-Guerin DeltaureC :: hly индуцирует превосходную защиту в мышиной модели субклинического туберкулеза. Микробы заражают 18 (5): 364–368
CAS PubMed Google Scholar
Gengenbacher M, Nieuwenhuizen N, Vogelzang A, Liu H, Kaiser P, Schuerer S, Lazar D., Wagner I, Mollenkopf HJ, Kaufmann SH., Удаление nuoG из вакцины-кандидата Mycobacterium bovis BCG DeltaureusC :: hly . mBio.2016 24 мая; 7 (3). pii: e00679-16. https://doi.org/10.1128/mBio.00679-16
Велмуруган К. и др. (2013) Доклиническая разработка кандидатов на замену вакцины БЦЖ. Вакцины (Базель) 1 (2): 120–138
CAS Google Scholar
Irwin SM et al (2005) Отслеживание антиген-специфических CD8 Т-лимфоцитов в легких мышей, вакцинированных полипротеином Mtb72F. Infect Immun 73 (9): 5809–5816
CAS PubMed PubMed Central Google Scholar
Brandt L et al (2004). Защитный эффект вакцины БЦЖ от Mycobacterium bovis усиливается при совместном введении с 72-килодальтонным гибридным полипротеином Mycobacterium tuberculosis Mtb72F у морских свинок, инфицированных M. tuberculosis.Инфекция иммунной 72 (11): 6622–6632
CAS PubMed PubMed Central Google Scholar
Ценова Л. и др. (2006) Оценка полипротеиновой вакцины Mtb72F на кроличьей модели туберкулезного менингита. Infect Immun 74 (4): 2392–2401
CAS PubMed PubMed Central Google Scholar
Reed SG et al (2009) Определенная противотуберкулезная вакцина, Mtb72F / AS02A, доказательство защиты у яванских макак.Proc Natl Acad Sci U S A 106 (7): 2301–2306
CAS PubMed PubMed Central Google Scholar
Cooper AM et al (2009) Т-клетки при микобактериальных инфекциях и болезнях. Curr Opin Immunol 21 (4): 378–384
CAS PubMed PubMed Central Google Scholar
Кальдерон В.Е. и др. (2013) Гуманизированная модель туберкулеза на мышах. PLoS One 8 (5): e63331
CAS PubMed PubMed Central Google Scholar
Commandeur S et al (2014). Экспрессируемый in vivo антиген Mycobacterium tuberculosis (IVE-TB) Rv2034 индуцирует CD4 + Т-клетки, которые защищают от легочной инфекции у трансгенных мышей HLA-DR и морских свинок. Вакцина 32 (29): 3580–3588
CAS PubMed Google Scholar
Nusbaum RJ et al (2016) Туберкулез легких у гуманизированных мышей, инфицированных ВИЧ-1. Научный представитель 6: 21522
CAS PubMed PubMed Central Google Scholar
Lanoix JP et al (2015) Стерилизующая активность пиразинамида в комбинации с препаратами первой линии в модели туберкулеза на мышах C3HeB / FeJ. Противомикробные агенты Chemother 60 (2): 1091–1096
PubMed Google Scholar
Lanoix JP et al (2015) Гетерогенное прогрессирование заболевания и ответ на лечение в модели туберкулеза у мышей C3HeB / FeJ. Dis Model Mech 8 (6): 603–610
CAS PubMed PubMed Central Google Scholar
Aagaard C et al (2011) Многоступенчатая противотуберкулезная вакцина, обеспечивающая эффективную защиту до и после заражения. Nat Med 17 (2): 189–194
CAS PubMed Google Scholar
Jacobs RE et al (2015) Реактивация туберкулеза легких во время лечения рака. Int J Mycobacteriol 4 (4): 337–340
PubMed Google Scholar
Кашино С.С. и др. (2008) Модель латентной / неактивной инфекции Mycobacterium tuberculosis на морских свинках.Microbes Infect 10 (14–15): 1469–1476
CAS PubMed PubMed Central Google Scholar
Ordway DJ et al (2010) Оценка стандартной химиотерапии на модели туберкулеза на морских свинках. Антимикробные агенты Chemother 54 (5): 1820–1833
CAS PubMed PubMed Central Google Scholar
Clark S et al (2014) Животные модели туберкулеза: морские свинки.Cold Spring Harb Perspect Med 5 (5): a018572
PubMed Google Scholar
Converse PJ et al (1996) Полостной туберкулез, вызываемый у кроликов вирулентными туберкулезными бациллами в виде аэрозоля. Infect Immun 64 (11): 4776–4787
CAS PubMed PubMed Central Google Scholar
Zhang G et al (2010) Оценка вирулентности микобактерий с использованием модели разжижения кожи кролика.Вирулентность 1 (3): 156–163
CAS PubMed PubMed Central Google Scholar
Dannenberg AM Jr (2009) Разжижение и образование полостей при легочном туберкулезе: простой метод тестирования ингибиторов на коже кролика. Tuberculosis (Edinb) 89 (4): 243–247
CAS Google Scholar
Sun H et al (2012) Влияние иммуномодуляторов на разжижение и образование язв на модели туберкулеза на коже кролика.Туберкулез (Edinb) 92 (4): 345–350
CAS Google Scholar
Peng X et al (2015) Модели кроликов для изучения инфекционных заболеваний человека. Comp Med 65 (6): 499–507
CAS PubMed PubMed Central Google Scholar
Manabe YC et al (2008) Модель латентного туберкулеза, реактивации и воспалительного синдрома восстановления иммунитета у кроликов.Туберкулез (Edinb) 88 (3): 187–196
CAS Google Scholar
Rahyussalim AJ et al (2016) Новое костное образование в туберкулезном дефекте тела позвонка после введения стромальных клеток костного мозга на модели кролика. Asian Spine J 10 (1): 1–5
PubMed PubMed Central Google Scholar
Scanga CA et al (1999) Реактивация латентного туберкулеза: вариации на мышиной модели Корнелла.Инфекция иммунной 67 (9): 4531–4538
CAS PubMed PubMed Central Google Scholar
Izzo AA et al (2015) Новая многофазная вакцина на основе MVA для профилактики или лечения туберкулеза индуцирует широкий и многофункциональный клеточный иммунитет у мышей и приматов. PLoS One 10 (11): e0143552
Google Scholar
Pena JC et al (2015) Обезьяньи модели туберкулеза: извлеченные уроки.Infect Immun 83 (3): 852–862
PubMed PubMed Central Google Scholar
Phuah J et al (2016) Влияние истощения В-клеток на раннюю инфекцию Mycobacterium tuberculosis у яванских макак. Infect Immun 84 (5): 1301–1311
CAS PubMed PubMed Central Google Scholar
Lin PL et al (2009) Количественное сравнение активного и латентного туберкулеза на модели яванского макака.Infect Immun 77 (10): 4631–4642
CAS PubMed PubMed Central Google Scholar
Diedrich CR et al (2010) Реактивация латентного туберкулеза у яванских макак, инфицированных SIV, связана с ранним истощением периферических Т-клеток, а не с вирусной нагрузкой. PLoS One 5 (3): e9611
PubMed PubMed Central Google Scholar
Kupferschmidt K (2011) Инфекционные болезни.Новый укол вакцины против туберкулеза. Наука 334 (6062): 1488–1490
PubMed Google Scholar
McShane H et al (2004) Рекомбинантный модифицированный вирус осповакцины, экспрессирующий антиген 85A Анкара, усиливает у человека примированный БЦЖ и естественным образом приобретенный антимикобактериальный иммунитет. Nat Med 10 (11): 1240–1244
CAS PubMed Google Scholar
Веррек Ф.А. и др. (2009) МВА.Усиление вакцины БЦЖ 85A и аттенуированная вакцина против M. tuberculosis с дефицитом фосфора демонстрируют защитную эффективность против туберкулеза у макак-резусов . PLoS One 4 (4): e5264
PubMed PubMed Central Google Scholar
Beveridge NE et al (2007) Иммунизация БЦЖ и рекомбинантным MVA85A индуцирует длительные, полифункциональные, специфичные для Mycobacterium tuberculosis популяции CD4 + Т-лимфоцитов памяти. Eur J Immunol 37 (11): 3089–3100
CAS PubMed PubMed Central Google Scholar
Minassian AM et al (2011) Исследование фазы I по оценке безопасности и иммуногенности MVA85A, кандидатной противотуберкулезной вакцины, у ВИЧ-инфицированных взрослых. BMJ Open 1 (2): e000223
PubMed PubMed Central Google Scholar
Odutola AA et al (2012) Новая противотуберкулезная вакцина MVA85A вызывает устойчивые антиген-специфические ответы через 14 месяцев после вакцинации у африканских младенцев. Vaccine 30 (38): 5591–5594
CAS PubMed Google Scholar
Патан А.А. и др. (2012) Влияние дозы вакцины на безопасность и иммуногенность кандидатной противотуберкулезной вакцины MVA85A у взрослых в Великобритании, вакцинированных БЦЖ. Vaccine 30 (38): 5616–5624
CAS PubMed PubMed Central Google Scholar
Sander CR et al (2009) Безопасность и иммуногенность новой противотуберкулезной вакцины MVA85A у лиц, инфицированных Mycobacterium tuberculosis. Am J Respir Crit Care Med 179 (8): 724–733
CAS PubMed PubMed Central Google Scholar
Scriba TJ et al (2010) Модифицированная вакцина, экспрессирующая Ankara Ag85A, новая противотуберкулезная вакцина, безопасна для подростков и детей и индуцирует полифункциональные CD4 + Т-клетки. Eur J Immunol 40 (1): 279–290
CAS PubMed PubMed Central Google Scholar
Scriba TJ et al (2011) Исследование по подбору дозы новой противотуберкулезной вакцины, MVA85A, у здоровых младенцев, вакцинированных БЦЖ. J Infect Dis 203 (12): 1832–1843
CAS PubMed Google Scholar
Scriba TJ et al (2012) Испытание фазы IIa новой противотуберкулезной вакцины, MVA85A, у взрослых, инфицированных ВИЧ и / или Mycobacterium tuberculosis. Am J Respir Crit Care Med 185 (7): 769–778
CAS PubMed PubMed Central Google Scholar
Tameris MD et al (2013) Безопасность и эффективность MVA85A, новой противотуберкулезной вакцины, у младенцев, ранее вакцинированных БЦЖ: рандомизированное плацебо-контролируемое исследование фазы 2b.Ланцет 381 (9871): 1021–1028
CAS PubMed PubMed Central Google Scholar
Коул С.Т. и др. (1998) Расшифровка биологии Mycobacterium tuberculosis на основе полной последовательности генома. Nature 393 (6685): 537–544
CAS PubMed Google Scholar
Кауфманн Ш.Х. (2011) Факты и вымыслы в исследованиях противотуберкулезной вакцины: 10 лет спустя.Lancet Infect Dis 11 (8): 633–640
PubMed Google Scholar
Bhatt K et al (2015) Поиск коррелятов защиты от туберкулеза. Clin Vaccine Immunol 22 (3): 258–266
CAS PubMed PubMed Central Google Scholar
Баркер Л.Ф. и др. (2009) Исследование противотуберкулезной вакцины: влияние иммунологии. Curr Opin Immunol 21 (3): 331–338
CAS PubMed Google Scholar
Cooper AM (2009) Т-клетки при микобактериальных инфекциях и болезнях. Curr Opin Immunol 21 (4): 378–384
CAS PubMed PubMed Central Google Scholar
Williams A, Hall Y, Orme IM (2009) Оценка новых вакцин против туберкулеза на модели морских свинок. Tuberculosis (Edinb) 89 (6): 389–397
CAS Google Scholar
Рид С.Г. и др. (2003) Перспективы улучшения вакцины против туберкулеза.Туберкулез (Edinb) 83 (1–3): 213–219
CAS Google Scholar
Fennelly KP et al (2012) Изменчивость инфекционных аэрозолей, образующихся во время кашля у пациентов с туберкулезом легких. Am J Respir Crit Care Med 186 (5): 450–457
PubMed PubMed Central Google Scholar
Факторы, влияющие на иммунный ответ на вакцинацию
Внутренние факторы хозяинаВозраст.Возраст — важный фактор, влияющий на реакцию на вакцины, особенно в старшем возрасте. Младенцы должны получить прививки как можно раньше, чтобы свести к минимуму время их восприимчивости к инфекциям. Однако новорожденные имеют более низкий уровень продукции антител, и, кроме того, пассивно приобретенные материнские антитела препятствуют ответу на вакцины (14; П. Циммерманн, К. Перретт, Н. Мессина, С. Донат, Н. Ритц, FRM van der Klis, и Н. Кертис, представлены для публикации). Кроме того, клеточно-опосредованные иммунные ответы менее сильны, а ответ на Т-независимые полисахаридные антигены слабый (11).Исследования 1950-х годов стремились установить оптимальный возраст для начала вакцинации (15, 16). Эти исследования показали, например, что пероральная вакцина против полиомиелита (ОПВ), вводимая в течение первой недели жизни, приводит к адекватным реакциям сывороточных антител только у 30–70% младенцев, но это при введении вакцины в возрасте от 4 до 8 недель. , это приводит к адекватным ответам почти у всех младенцев (15). Точно так же вакцина против дифтерии, столбняка и коклюша (АКДС) менее эффективна, когда первая доза вводится в течение первой недели жизни, чем когда она вводится в возрасте 6 месяцев (16) (Таблица 1).Результаты исследований иммуногенности вакцины БЦЖ, вводимой в разном возрасте, противоречат друг другу: некоторые исследования показывают лучшую иммуногенность, когда вакцина вводится в возрасте старше 2 месяцев, чем когда вакцина вводится при рождении (17), а другие сообщают о более низкой иммуногенности при введении вакцины. дается в 4 месяца, чем при рождении (18). Вакцина против гепатита В, вводимая в первый год жизни, приводит к более низким долгосрочным ответам антител, чем те, которые были получены при введении вакцины в более позднем возрасте: только 40% подростков, вакцинированных против гепатита В при рождении, имели уровни антител> 10 мМЕ / мл на момент рождения. в возрасте 15 лет (19), а после бустерной дозы антитела превышали этот защитный уровень только у половины людей (19, 20).Однако, что важно, в отличие от уровней антител, количество В-клеток памяти не уменьшается со временем (21), и, следовательно, бустерные дозы этой вакцины не требуются.
ТАБЛИЦА 1Результаты в отношении возраста исследований, посвященных внутренним факторам хозяина, которые влияют на реакцию на вакцину a
Наиболее изученной вакциной в отношении влияния возраста на реакцию на вакцину, безусловно, является противокоревая вакцина ( 10, 22–48). Метаанализ 20 исследований показывает, что доля младенцев, у которых произошла сероконверсия после одной дозы вакцинации против кори, увеличивается с 50% в возрасте 4 месяцев до 85% в возрасте 8 месяцев, и что GMTs ниже у детей, получивших первую дозу до 9 месяцев. по сравнению с теми, кто получил первую дозу в более старшем возрасте (49).Кроме того, антитела значительно быстрее ослабевают у младенцев, получивших первую дозу противокоревой вакцины в возрасте до 9 месяцев (49), и антитела имеют значительно более низкую авидность, когда первая доза противокоревой вакцины вводится в возрасте до 6 месяцев, чем когда его дают в возрасте от 9 до 12 месяцев (10). Недавнее крупное исследование, обобщающее рандомизированные контролируемые испытания (РКИ), показывает, что дети, получившие свою первую прививку от кори в возрасте до 12 месяцев, имеют более низкие SCR и средние геометрические концентрации (GMC), чем у детей, получивших свою первую прививку от кори в возрасте старше 12 месяцев. 15 месяцев (50).Более низкие концентрации антител сохраняются после второй дозы противокоревой вакцины (49, 50). Напротив, возраст первой вакцинации против кори не влияет на клеточные реакции: никаких различий в пролиферации in vitro Т-клеток в ответ на вирус кори не наблюдалось после начала вакцинации в 4, 6, 9 или 12 месяцев (30, 37, 38 , 51).
Несмотря на то, что многие вакцины имеют более низкую иммуногенность у новорожденных, было показано, что вакцины против бесклеточного коклюша (АП) (52, 53), БЦЖ (54), ГепВ (55) и ОПВ (15) могут быть эффективными в возрастной группе новорожденных, когда адъюванты и составы адаптированы к функции ранней иммунной системы (56) (таблица 1).Ранняя неонатальная иммунная система демонстрирует субоптимальное взаимодействие между антигенпрезентирующими клетками и Т-клетками, что приводит к нарушению функции Т-лимфоцитов CD4 и CD8 и поляризации в сторону Т-хелперных клеток 2 типа (Th3) (57) и скорее к индукции В-клеток памяти. чем плазматические клетки, секретирующие антитела (58, 59). Пассивно приобретенные материнские антитела не влияют на Т-клетки.
Помимо тех, кто находится в раннем возрасте, реакция на вакцины также снижается у пожилых людей, у которых также наблюдается более быстрое снижение уровня антител.У пожилых людей более низкий уровень антител к дифтерии (60), гепатиту А (HepA) (61–65), HepB (61, 62, 66–81), пневмококковой полисахаридной вакцине (PPV23) (82–84), TIV (85–81). 87), вакцинация против клещевого энцефалита (КЭ) (88) и столбняка (60, 88, 89) (Таблица 1). После вакцинации TIV у пожилых людей также наблюдается более низкий ответ на клеточную вакцину (85–87, 90). Напротив, в одном исследовании сообщается о более высоких ответах антител на вакцинацию против TIV у пожилых людей, с более высокой авидностью антител и более медленной диссоциацией антител (91).Старение сопровождается сдвигом в сторону противовоспалительного интерлейкина-10 (IL-10), что связано со снижением количества CD8 T-клеток, ответственных за очистку от вируса гриппа. Следовательно, адъюванты в TIV, которые стимулируют воспалительные цитокины и подавляют ответ IL-10, потенциально могут усилить защиту в этой возрастной группе (92).
Примечательно, что влияние возраста на реакцию на вакцины проявляется не только в крайнем возрасте. Например, ответы антител на TIV выше у детей от 2 до 4 лет, чем у детей младшего возраста (93), а GMT после вакцинации менингококковой конъюгированной вакциной (MCV-C) выше у детей старше 10 лет, чем у детей. дети младшего возраста (94).Результаты исследований, в которых изучалось влияние возраста на реакцию на вакцины, обобщены в Таблице 1.
Пол. Результаты исследований и метаанализов, изучающих влияние пола на реакцию на вакцины, в значительной степени согласуются (Таблица 2). У женщин более высокий ответ антител к денге (95), HepA (61–65, 96–104), HepB (61, 62, 66–78, 80, 100, 101, 105–117), Hib (118), IPV ( 119), вакцинации против бешенства (120–122), оспы (123) и TIV (124–134), в то время как у мужчин наблюдается более высокий ответ антител на дифтерию (135–138), MCV-A (139), PCV7 (140), Вакцинация против PPV23 (83, 122, 140–144) и столбняка (88, 89, 119).Кроме того, у женщин также наблюдается более высокий клеточный ответ на вакцину от вируса простого герпеса (ВПГ), которая в настоящее время не используется (145). Лишь в нескольких исследованиях сообщается о противоположных результатах: более высокие ответы антител на вакцинацию против дифтерии (60, 146), PCV13 (118) и столбняка (60, 147) у женщин, более высокие ответы антител на вакцинацию TIV (91) у мужчин или отсутствие различие между полами в ответах антител на вакцинацию против бешенства (148) (таблица 2).
ТАБЛИЦА 2Результаты в отношении пола исследований, посвященных изучению внутренних факторов хозяина, которые влияют на ответы на вакцины
Примечательно, что даже несмотря на общую тенденцию к более высоким ответам антител у женщин, после HepA (103) и PPV23 было показано более быстрое уменьшение количества антител. (83, 144) вакцинация.
Исследования, посвященные изучению половых различий в ответ на вакцину против кори, паротита и краснухи (КПК), дают менее согласованные результаты. В некоторых исследованиях сообщается о более высоких значениях GMT или SPR после вакцинации против кори (149), эпидемического паротита (150) и краснухи (151) и более высоких цитокиновых ответах после вакцинации против кори (152) у женщин, в то время как другие исследования сообщают о временно более высоких значениях GMT и лимфопролиферативных ответах после вакцинации краснухой ( 153) и более высокие значения SCR после вакцинации против кори (154) у мужчин или отсутствие половых различий в GMT после вакцинации против эпидемического паротита (155) и краснухи (156) или цитокиновые ответы после вакцинации против краснухи (156) (Таблица 2).
Сообщенные половые различия в ответах антител на вакцину против YF варьируются в зависимости от используемой вакцины (157–159). Интересно, что через 3–10 дней после вакцинации против YF у женщин изменяется экспрессия 660 генов, в то время как только 67 генов экспрессируются по-разному у мужчин (160). Многие из этих дифференциально экспрессируемых генов участвуют в раннем врожденном иммунном ответе (160).
Генетика. Различные этнические группы, проживающие в одном и том же месте, по-разному реагируют на вакцинацию (64, 89, 161–166) и снижение уровня антител (89), что указывает на генетическое влияние на ответы на вакцины.Исследования близнецов оценивают степень наследственности от 36 до 90% для гуморальных ответов (167–173) и от 39 до 90% для клеточных ответов, в зависимости от конкретной вакцины (167, 169) (Таблица 3).
ТАБЛИЦА 3Результаты в отношении генетики исследований по изучению внутренних факторов хозяина, которые влияют на ответы на вакцины
Одним из механизмов, идентифицированных с вариациями гуморальных (150, 174–190) и клеточных (145, 150, 186, 191) ответов на вакцины, является полиморфизм в генах главного комплекса гистосовместимости (MHC) (сведены в Таблицу 3).Другими генетическими факторами являются полиморфизм рецепторов распознавания образов (PRR), таких как гены Toll-подобных рецепторов (TLR) или RIG-подобных рецепторов (RLR) (192–195) (Таблица 3). Кроме того, многие однонуклеотидные полиморфизмы (SNP) в других генах, например, те, которые кодируют цитокины или цитокиновые, вирусные или витаминные рецепторы, также связаны с вариациями в ответах на вакцины (182, 190, 192, 193, 196– 211) (таблица 3). Кроме того, разные уровни экспрессии генов также влияют на ответы на вакцины.Например, люди с повышенной экспрессией генов, участвующих в ранней передаче сигналов интерферона, процессинге антигена и презентации антигена, имеют более высокие ответы антител на TIV (194, 212).
Антигены группы крови являются важными рецепторами или корецепторами для микроорганизмов. Кроме того, они также могут изменять врожденный иммунный ответ на инфекцию (213). Следовательно, вероятно, что антигены группы крови влияют на реакцию на вакцинацию. Было высказано предположение, что оральная вакцина с убитыми субъединицами холеры менее эффективна у лиц с группой крови O (214, 215).Напротив, оральная вакцина против холеры (OCV), как сообщается, индуцирует более высокие концентрации антител у лиц с группой крови O (216). Однако это не было однозначным выводом (217).
Сопутствующие заболевания. В ходе многочисленных исследований изучалась реакция на вакцины у детей с глютеновой болезнью (ЦБ) (218–233) (таблица 4). Большинство из них обнаружило, что у детей с CD наблюдается более низкий ответ антител на вакцинацию HepB (218–228, 231–233) с более быстрым убыванием антител (227). Метаанализ показывает, что в ретроспективных исследованиях SCR вакцинации против HepB у детей с CD составляет 54%, а в проспективных исследованиях — 66% (по сравнению с 95% у здоровых людей) (234).Было высказано предположение, что присутствие HLA-DQ2 или -DQ8, которые придают генетическую предрасположенность к CD, может быть драйвером более низких ответов на вакцинацию HepB у пациентов с CD. Однако присутствие HLA-DQ2 связано с более высокими ответами антител на вакцинацию против HepB (55). Тем не менее, HLA-DR3, -DR4 и -DR7, которые также могут быть обнаружены у пациентов с CD (229) и пациентов с сахарным диабетом (DM), связаны с более низким ответом на вакцинацию HepB (183, 184, 235). У детей с CD и DM SPR после вакцинации HepB ниже, чем у детей с DM (228), что позволяет предположить, что глютен может быть фактором снижения эффективности вакцины HepB, а некоторые исследования предполагают, что скорость ответа на вакцинацию HepB коррелирует с глютеном. прием (220, 223).Дети с CD, соблюдающие строгую безглютеновую диету, не имеют разницы в SPR вакцинации против HepB по сравнению со здоровыми детьми (222, 226). Помимо более низких ответов антител на вакцинацию HepB, одно исследование также показало, что пациенты с CD менее восприимчивы к вакцинации HepA (225). Однако другое исследование не обнаружило разницы в ответах антител на вакцинацию HepA у пациентов с CD по сравнению со здоровым контролем (229). Также нет различий в ответах антител на вакцинацию против столбняка (219), кори (236), краснухи (219), Hib (219) и TIV (230) между детьми с CD и здоровыми детьми.
ТАБЛИЦА 4Результаты исследований сопутствующих заболеваний, посвященных изучению внутренних факторов хозяина, влияющих на реакцию на вакцины
У детей с СД более низкие ответы антител на вакцинацию против HepB (232, 237–239) и, возможно, PPV23 (240), краснухи (241) и вакцинация против кори (241), но не против дифтерии (240, 241), Hib (240), PCV7 (240), коклюша (241) или столбняка (240, 241). Взрослые с СД также имеют более низкий ответ антител на вакцинацию против HepB (242–245). Добавление селена к вакцине HepB может усилить ответ антител у пациентов с СД (246).Неясно, влияет ли DM на реакцию антител на вакцинацию против TIV. В некоторых исследованиях сообщается о более низких ответах после вакцинации моновалентной противогриппозной вакциной у взрослых (90), в то время как исследования пожилых людей с СД типа II не показывают различий в ответах антител или цитокинов на вакцинацию против TIV (247, 248) (таблица 4).
Взрослые с хронической почечной недостаточностью, находящиеся на гемодиализе, имеют более низкий ответ антител на вакцинацию против дифтерии (249–251), HepB (252–255) и столбняка (249–251) с более быстрым уменьшением количества антител (252–255), особенно когда они страдают дополнительным сахарным диабетом (256–259).Дети, находящиеся на гемодиализе, имеют более низкий ответ антител к полиовирусу 2 типа (260). SPR после вакцинации HepB обратно пропорционален скорости клубочковой фильтрации (253). Факторы, ответственные за более низкий ответ на вакцину у пациентов с хронической почечной недостаточностью, включают недоедание, уремию и общее иммуносупрессивное состояние. Пациентам с хронической почечной недостаточностью может быть полезна повышенная доза вакцины (259).
Взрослые с хроническим заболеванием печени имеют более низкие GMTs после вакцинации HepA (102, 261, 262) (с аналогичными SPR [102, 262] или более низкими SPR [263, 264]) и более низкие GMT и SPR после вакцинации HepB (242), чем у здоровых взрослых.Дети с хроническим заболеванием печени также имеют более низкие значения GMT (265) и SPR (263, 265) после вакцинации HepB (265), без разницы в SCR. Однако, напротив, они имеют более высокий ответ антител на вакцинацию против ИПВ и дифтерии (260) (таблица 4).
Перинатальные факторы хозяинаГестационный возраст. Недоношенные дети подвергаются повышенному риску инфекций, в том числе инфекций, которые можно предотвратить с помощью вакцин. Различия в иммунной системе, которые делают недоношенных новорожденных менее восприимчивыми к вакцинации, включают снижение распознавания патогенов дендритными клетками и макрофагами, а также снижение активности Т-клеток (особенно активности Th2) и уменьшение взаимодействия В-клеток с Т-клетками (266).Вариации ответа на вакцину у доношенных и недоношенных детей зависят от конкретной вакцины. По сравнению с доношенными детьми, у недоношенных детей после первой дозы АКДС уровень антител значительно ниже (267). Значительно более низкие значения GMT также сохраняются после первичной иммунизации тремя дозами от дифтерии (268), HepB (268–270), Hib (269, 271–275), PCV7 (276, 277), полиовируса типа 3 (269) и коклюша ( 267, 268, 278–280) вакцины. Однако недоношенные дети достигают достаточного SPR для большинства вакцин (таблица 5), за заметным исключением ответов на вакцины против HepB (269), Hib (269, 271–275), коклюша (279) и полиовируса типа 3 (281).В дополнение к более низким GMT и SPR, у недоношенных детей также может быть более быстрое уменьшение антител, как показано для антител, продуцируемых в ответ на вакцинацию MCV-C (282).
ТАБЛИЦА 5Результаты исследований младенческих факторов, изучающих перинатальные факторы, влияющие на ответы на вакцины
У недоношенных младенцев ответы на вакцины ниже не только после первичной иммунизации, но и после бустерных доз. В возрасте от 2 до 3 лет у них более низкие ответы антител на вакцинацию против HepB (270, 283), Hib (283) и полиовируса типа 3 (283), а в возрасте 5 лет — более низкие ответы на вакцины HepB ( 283) и коклюша (284), а также снижение лимфопролиферации и цитокиновых ответов в последнем случае.
Масса тела при рождении. Через месяц после третьей дозы вакцины DTaP-Hib-IPV-HepB, введенной в 2, 4 и 6 месяцев, у младенцев с очень низкой массой тела при рождении (VLBW; менее 1,5 кг) GMTs значительно ниже. к AP и полиовирусу типа 3 и более низким SPR для Hib, чем у младенцев с низкой массой тела при рождении (LBW; 1,5–2 кг), в то время как обе группы имеют сходные GMT и SPR после вакцинации от дифтерии, столбняка и HepB (285). Однако через 1 месяц после бустерной дозы, введенной в возрасте от 18 до 24 месяцев, SPR к HepB у детей с очень низкой массой тела ниже, чем у детей с низкой массой тела, и существует тенденция к более низким GMTs для всех других компонентов вакцины (285) ( Таблица 5).Точно так же через 1 месяц после завершения схемы приема 3 доз HepB, вводимой в 0, 1 и 6 месяцев, у детей с низкой массой тела более низкие GMTs к вакцине против HepB, чем у детей с нормальной массой тела при рождении (286). Снижение массы тела при рождении связано с прогрессивным снижением ответа антител на вакцинацию против Hib (272). Однако нет никакой разницы в GMTs после 3-х дозовой схемы вакцины PCV7 между младенцами с низкой массой тела и младенцами с нормальным весом (277), а также нет корреляции между массой тела при рождении и SCR после вакцинации против кори (287).
В одном исследовании сообщалось, что реакция антител на вакцинацию против Salmonella enterica serovar Typhi (но не против бешенства) у взрослых связана с массой тела при рождении (288).
Грудное вскармливание. После плановой вакцинации по сравнению с младенцами, вскармливаемыми смесью, младенцы, находящиеся на грудном вскармливании, имеют более высокие уровни IgG в сыворотке после вакцинации против дифтерии (289), Hib (290, 291) и OPV (289, 292), более высокие уровни IgA в слюне после столбняка вакцинация против дифтерии и OPV (289), а также более высокие уровни IgM в стуле после вакцинации против столбняка и OPV (289) (таблица 5).
В то время как один метаанализ, обобщающий исследования влияния грудного вскармливания на реакцию антител на пероральную ротавирусную вакцину (ORV), сообщает о снижении SCR у младенцев, находящихся на грудном вскармливании, во всех включенных исследованиях (293), другой метаанализ сообщает о снижении ответов только в 3 из них. 16 исследований (294). Однако во всех включенных исследованиях вводилась только одна доза ORV, и младенцы со смешанным вскармливанием иногда классифицировались как находящиеся на грудном вскармливании, а иногда как на грудном вскармливании. Более поздние исследования показывают, что более высокие уровни специфического для ротавируса IgA в грудном молоке приводят к более низким SCR у младенцев после ORV (2-кратное увеличение связано со снижением SCR на 22%) (295).Уровни IgA в грудном молоке зависят от географического положения: у индийских женщин уровень выше, чем у корейских, вьетнамских и американских женщин (296). Кроме того, нейтрализующая активность IgA в грудном молоке индийских женщин выше, чем в грудном молоке американских женщин (296). Три исследования, посвященные воздержанию от грудного вскармливания в течение часа до и после ORV, не показали влияния на SCR специфичных для ротавируса IgA у младенцев (297–299).
Материнские антитела. Существующие материнские антитела подавляют ответы детских антител на вакцинацию (14) (таблица 6).После первичной иммунизации в 2 раза более высокий уровень материнских антител приводит к снижению GMT после вакцинации примерно на четверть у младенцев (28% для ИПВ, 24% для дифтерии, 22% для пертактина и 13% для столбняка). Материнские антитела также влияют на реакцию младенцев на вакцины после бустерных доз на втором году жизни (14).
ТАБЛИЦА 6Результаты исследований материнских факторов, изучающих перинатальные факторы, влияющие на ответы на вакцины
Мета-анализ, обобщающий 16 исследований, изучающих влияние материнских антител на реакцию на вакцинацию против кори, показывает, что присутствие материнских антител снижает SCR на в среднем на 33.2% (49). Однако материнские антитела к вирусу кори у младенцев быстро снижаются, и к 5-месячному возрасту только 12% младенцев имеют защитный уровень. Возраст матери — единственный фактор, связанный с уровнем материнских антител к кори (300, 301), тогда как вес матери не влияет (300). У вакцинированных против кори женщин GMTs значительно ниже, чем у женщин с естественным иммунитетом (301, 302).
Материнские антитела против HepA у младенцев остаются высокими в течение первых 6 месяцев, но затем быстро снижаются, и только приблизительно 37% младенцев имеют защитные титры к возрасту 12 месяцев (303, 304).Когда вакцина HepA вводится младенцам в течение первых 6 месяцев жизни, GMTs у детей без материнских антител значительно выше в возрасте от 12 до 15 месяцев, чем у младенцев с материнскими антителами. Однако разницы в SPR нет (305, 306). Для ORV трансплацентарный перенос материнских антител (307–309) и перенос антител через грудное молоко (295, 296, 310) приводят к снижению ответа на вакцины младенцев в зависимости от дозы.
Количество материнских антител, передаваемых младенцам, зависит от нескольких факторов, включая уровни материнских антител, подкласс IgG, гестационный возраст и характеристики плаценты (311).Передачу материнских антител можно оптимизировать путем вакцинации матери во время беременности. Эта стратегия в настоящее время рекомендуется для вакцинации от столбняка, коклюша и гриппа. Однако правильное время вакцинации во время беременности очень важно. Например, Tdap, введенный во втором триместре беременности, приводит к значительно более высоким неонатальным антителам, чем те, которые получаются при его введении в третьем триместре (312).
Материнские инфекции во время беременности.Большинство исследований не обнаруживают связи между инфицированием матери филяриями, анкилостомами, малярийными паразитами, Mansonella perstans или Schistosoma mansoni во время беременности и реакцией детских антител на дифтерию (313, 314), HepB (313–315), Hib (314), вакцинация от коклюша (314) и столбняка (313, 316). Однако одно исследование показывает, что заражение матери малярийными паразитами, филяриями или анкилостомами независимо связано с более низким ответом младенцев на вакцинацию Hib (313), в то время как другое исследование показывает, что инфицирование матери S.mansoni ассоциирован с более низкими реакциями детских антител на вакцинацию против HepB (317). Материнская малярия во время беременности связана с более низким SPR младенцев после вакцинации против кори (318). Наличие множественных материнских инфекций связано с более низкими реакциями детских антител на вакцинацию против Hib, дифтерии и столбняка (313). Напротив, инфицирование матери Strongyloides во время беременности связано с более высоким ответом антител на вакцинацию против Hib, HepB и коклюшного токсина (314).
Инфекция матери M. perstans во время беременности связана с более высокой реакцией младенцев на IL-10 после вакцинации БЦЖ и столбняка, но нет различий в гамма-интерфероне (IFN-γ), IL-5 и IL-13 (319) производство. Инфекция матери филяриями (320), Trypanosoma cruzi (321) или S. mansoni (320) во время беременности связана с более низким уровнем продукции IFN-γ у детей после вакцинации БЦЖ, в то время как другие гельминтные инфекции не влияют на реакцию младенцев на вакцинацию БЦЖ. (319, 322, 323).Эмпирическое лечение матерей альбендазолом или празиквантелом во время беременности не влияет на реакцию младенцев на вакцины БЦЖ (324), дифтерия (314), HepB (314), Hib (314), корь (324), коклюш (314) или столбняк ( 324) вакцинация (таблица 7).
ТАБЛИЦА 7Результаты исследований материнских инфекций, посвященных изучению перинатальных факторов, влияющих на ответы на вакцины
Другие материнские факторы. У младенцев цитокиновые реакции на вакцинацию БЦЖ обратно пропорциональны индексу массы тела матери (ИМТ) (325).С другой стороны, материнское недоедание связано с более низкими реакциями детских антител на вакцинацию OPV и ORV, в то время как оно не влияет на ответы на парентеральные вакцины (326).
Было высказано предположение, что низкий образовательный статус матери связан с более высоким GMT младенцев до вакцинации против столбняка (327) и более низкой продукцией младенцев IFN-γ и IL-5 после вакцинации против столбняка (319), в то время как более низкий социально-экономический статус матери связан с снижение продукции IL-10 у младенцев после вакцинации против столбняка (319) (таблица 8).Однако этому могут мешать другие факторы, такие как недоедание и несоблюдение графиков вакцинации.
ТАБЛИЦА 8Результаты в отношении других материнских факторов из исследований по изучению перинатальных факторов, которые влияют на ответы на вакцины
Иммунизация матерей против столбняка во время беременности связана с более высокими реакциями детских антител на вакцинацию от столбняка, в то время как наличие материнского рубца БЦЖ связано с более низким младенческие реакции на ИЛ-5 (319), ИЛ-10 (323) и ИЛ-13 (319) после вакцинации БЦЖ (319).
Младенцы, контактирующие с ВИЧ во время беременности, но не инфицированные, имеют более низкие ответы на IFN-γ, IL-5 и IL-13 после вакцинации против столбняка и БЦЖ (319). Антенатальные, но не послеродовые стероиды снижают продукцию антител младенцев в ответ на вакцинацию против столбняка (280) (Таблица 6).
Внешние факторыИнфекции. Большинство исследований не показывают различий в ответах антител на вакцинацию MMR у детей с диареей (287, 328), лихорадкой (287, 328) или афебрильными инфекциями верхних дыхательных путей (URTI) (329–332) и здоровыми. дети.Однако в исследованиях сообщалось о более низких значениях SCR после вакцинации против кори (330) и ветряной оспы (331) для детей с ИВДП (без различий в GMT), более низких GMT после вакцинации Hib у детей с лихорадкой (333) и более низких GMT и SCR для детей с диарея после вакцинации ОПВ (334, 335). Сопутствующая инфекция неполиовирусными энтеровирусами во время вакцинации ОПВ снижает SCR против полиовируса типа 1, но не против полиовируса типа 2 или 3 (334) (таблица 9).
ТАБЛИЦА 9Результаты в отношении симптомов или инфекций из исследований, посвященных изучению внешних факторов, влияющих на реакцию на вакцины
У детей, инфицированных вирусом Эпштейна-Барра (ВЭБ), наблюдается снижение реакции антител на менингококковый полисахарид (MPV) и вакцинацию против кори.Однако у младенцев, инфицированных как EBV, так и цитомегаловирусом (CMV), реакция аналогична реакции неинфицированных младенцев, что позволяет предположить, что эффекту EBV-инфекции может противодействовать инфекция CMV (336). Дети, инфицированные ЦМВ, также имеют более высокие значения GMT после вакцинации противокоревой вакциной (337), в то время как результаты исследований по изучению ответов на вакцины у взрослых с положительным результатом на ЦМВ противоречивы. В исследованиях сообщается о более высоких ответах антител на вакцинацию против TIV у молодых людей (GMTs) (338) и пожилых людей (SCR) (248), которые являются серопозитивными по CMV, чем у серонегативных лиц, в то время как другие исследования показывают снижение ответов антител (SCR) (339, 340). ), снижение активации B- и T-клеток (341) и переключение B-клеток памяти (339) в ответ на вакцинацию TIV у CMV-серопозитивных лиц (таблица 9).
Взрослые, инфицированные ВИЧ, имеют более низкий SPR после вакцинации вакциной HepA. Более низкая вирусная нагрузка и большее количество клеток CD4 являются предикторами более высокого ответа на вакцинацию (104). Беременные женщины, инфицированные ВИЧ, имеют более низкий цитокиновый ответ на вакцинацию БЦЖ (319, 323) и столбняк (319). Младенцы, инфицированные ВИЧ, имеют более низкие цитокиновые ответы после вакцинации вакцинами БЦЖ (319, 323), кори (337) и столбняка (319) и более низкие ответы антител после вакцинации противокоревой вакциной (318).У ВИЧ-инфицированных детей наблюдается более быстрое снижение уровня антител после вакцинации вакциной HepA (342).
Лица, хронически инфицированные вирусом гепатита B или гепатита C, имеют более низкий ответ антител на вакцинацию HepA (102, 263, 343, 344).
Паразиты. Младенцы, симптоматически инфицированные малярийными паразитами, имеют более низкий ответ антител к Hib (333), кори (318), MCV-C (345), Salmonella Typhi (внутрикожная) и вакцинации против столбняка (345–347) и ниже. цитокиновые ответы (IFN-γ, IL-5 и IL-13) после вакцинации противостолбнячной (319) и БЦЖ (319, 323) вакцинами (таблица 10).Дети с бессимптомной малярией имеют более низкие GMTs после вакцинации MCV-C (94, 348) и AP (349), но нет разницы в ответах антител на вакцинацию против столбняка (350, 351). Профилактика малярии, проводимая детям до вакцинации, не влияет на GMT или SCR после дифтерии (352–355), IPV (355), кори (352, 353, 356), OCV (357), OPV (353), коклюша (352). ), Вакцинация против Salmonella Typhi (353, 357) или столбняка (352–355, 358, 359). Профилактика малярии также не влияет на размер туберкулиновой кожной реакции после вакцинации БЦЖ (353).Однако GMT после вакцинации MCV-A и MCV-C (временно) выше у детей, получающих профилактику малярии (348, 353).
ТАБЛИЦА 10Результаты исследований паразитарных инфекций, посвященных изучению внешних факторов, влияющих на реакцию на вакцину
Лица, инфицированные Onchocerca volvulus, вырабатывают меньше антител, имеют меньшую пролиферацию мононуклеарных клеток и более низкую продукцию IFN-γ (360) после вакцинации от столбняка , и лица, инфицированные S.mansoni после вакцинации против столбняка продуцируют меньше IFN-γ (361). У детей и взрослых с инфекцией Ascaris lumbricoides ответ антител и цитокинов (IFN-γ и IL-2) на OCV снижен, но может быть частично восстановлен лечением альбендазолом до вакцинации (362, 363). Детские гельминтозы не связаны с цитокиновой реакцией после вакцинации БЦЖ. Эмпирическая ежеквартальная терапия альбендазолом в течение первых 5 лет приводит к снижению продукции IFN-γ и IL-13 после вакцинации БЦЖ (323).Напротив, лечение альбендазолом у лиц с доказанной гельминтной инфекцией приводит к большей пролиферации Т-клеток (364) и продукции IFN-γ (364, 365) и IL-12 (365) после вакцинации БЦЖ, но к меньшему количеству трансформирующего фактора роста бета (TGF- β) и продукции конканавалина А (365) (таблица 11). Младенцы, врожденно инфицированные Trypanosoma cruzi, имеют более сильные ответы in vitro IFN-γ после вакцинации вакцинами против дифтерии, гепВ и столбняка (321) (таблица 10).
ТАБЛИЦА 11Результаты в отношении противопаразитарного лечения из исследований по изучению внешних факторов, влияющих на реакцию на вакцины
Антибиотики, пробиотики и пребиотики.Нет исследований на людях, изучающих влияние антибиотиков на реакцию на вакцины. Однако исследование на мышах показало, что введение кларитромицина или доксициклина приводит к более низким ответам антител после вакцинации вакциной HepB, столбняка или PPV23, в то время как введение ампициллина приводит к более высоким ответам антител после вакцинации живой аттенуированной вакциной Salmonella Typhi (366 ). Исследование на телятах показало, что одновременное введение окситетрациклина приводит к снижению ответа антител на подкожную вакцинацию вакциной Brucella abortus (367).
Влияние пробиотиков на реакцию на вакцины подробно описано в недавнем систематическом обзоре (368). Сообщалось о положительном эффекте пробиотиков при ответе на дифтерию (369), HepA (370), Hib (371), IPV (372), OCV (373), ORV (374), OPV (375) и TIV (376). –380) вакцинация. Однако выбор штаммов и доз пробиотиков, а также продолжительность и время введения в разных исследованиях сильно различались.
Исследования по изучению воздействия пищевых добавок, содержащих смесь пробиотиков (Lactobacillus paracasei [381] или Bifidobacterium longum bv.Infantis [341, 382]) и пребиотики (фруктоолигосахариды [381] или глюкоолигосахариды [341, 382]) не показывают влияния добавок на реакцию антител на вакцинацию TIV (381–383) или PPV23 (381, 383). или на В- или Т-клеточные ответы (341) на вакцинацию против TIV.
Микробиота. Существует связь между кишечной микробиотой и реакцией на вакцины (384). У младенцев более высокая относительная численность актинобактерий (особенно видов B. longum) была связана либо с более высокими ответами антител или клеточных вакцин на БЦЖ (385), HepB (385), ИПВ (372), ОПВ (385) и вакцинация от столбняка (385).Напротив, более высокая относительная численность протеобактерий (особенно Pseudomonadales ) была связана с более низким ответом на эти вакцины (385). Кроме того, более высокая относительная численность бактерий Firmicutes (семейства Lachnospiraceae и Ruminococcacae ) была связана с более высокими гуморальными ответами на ORV (386) у младенцев и клеточными ответами на Salmonella Typhi (387) у взрослых. Кроме того, у младенцев одно исследование показало, что более высокая относительная численность организмов Bacteroidetes связана с более низкими гуморальными реакциями на ORV (386), в то время как другое исследование не обнаружило никакой связи между составом кишечной микробиоты и ответами на ORV ( 388) (таблица 12).У детей с избыточным бактериальным ростом в тонкой кишке снижен антительный ответ на OCV (389).
ТАБЛИЦА 12Результаты в отношении микробиоты исследований, посвященных изучению внешних факторов, влияющих на ответы на вакцины
Одно исследование, в котором изучалось влияние респираторной микробиоты на ответы на вакцины, показывает положительную связь между присутствием Bacteroides ovatus, Lactobacillus helveticus, Prevotella melaninogenica , Streptococcus infantis и Veillonella dispar в носоглотке и уровни IgA к вирусу гриппа в смывах из носа после вакцинации живым аттенуированным вирусом гриппа (LAIV) (390).
Предсуществующий иммунитет. Лица с более высокими титрами антител против столбняка при предвакцинации имеют более высокие SPR после повторной вакцинации (60), в то время как титры антител против дифтерии не зависят от титров предвакцинации (391). Точно так же ответ антител на TIV положительно связан с титрами предвакцинации (93). Пожилые люди, у которых до вакцинации были низкие титры антител против вируса гриппа, могут не получить сероконверсию после одной дозы TIV (392). Кроме того, примирование антигеном, отличным от того, что включено в вакцину против TIV, приводит к более низким SCR и GMT (393, 394), чем те, которые получены после примирования аналогичными антигенами.Дополнительное доказательство того, что ранее существовавший иммунитет влияет на реакцию на вакцины, поступает из исследований, показывающих, что люди, у которых есть антитела против флавивирусов, имеют более высокий ответ антител на вакцинацию против лихорадки денге (95). Предыдущее воздействие Hib-подобных бактерий окружающей среды усиливает реакцию антител на вакцинацию Hib (327). Напротив, есть свидетельства того, что более низкая продукция цитокинов после вакцинации БЦЖ может быть частично объяснена предыдущим воздействием других микобактерий (395–397). Однако так обстоит дело не во всех исследованиях (398).Доказательства ответа антител на вакцинацию против гепатита В также противоречивы: одно исследование показало более высокий ответ антител у тех, кто имеет положительный анти-HBc (242), а другое — более низкий ответ (72). Для OCV SCR были ниже у лиц с ранее существовавшим иммунитетом (399).
Поведенческие факторыКурение. Курение приводит к снижению ответа антител на вакцинацию против гепатита В в некоторых (66, 68, 69, 74, 75, 78, 80, 400), но не во всех исследованиях (81, 100, 401, 402) и к увеличению ответы антител на вакцинацию против YF (157).Курение не влияет на GMT после вакцинации против вируса папилломы человека (ВПЧ), но увеличивает риск появления антител с низкой авидностью после вакцинации (403). У курильщиков SCR выше после вакцинации с помощью LAIV, но уменьшение антител у курильщиков происходит быстрее, чем у некурящих после вакцинации с помощью LAIV и TIV (404) (Таблица 13).
ТАБЛИЦА 13Результаты исследований поведенческих факторов, влияющих на реакцию на вакцины
Употребление алкоголя. Было обнаружено, что потребление алкоголя не влияет на реакцию антител на вакцинацию HepA (405) или HepB (68, 69, 81, 402, 406), но может влияют на реакцию на вакцинацию от пневмококка (142).После вакцинации PPV23 у алкоголиков SCR ниже для серотипов 3, 4, 7F, 8 и 19F (однако это важно только для серотипов 3 и 19F) (142) (Таблица 13).
Упражнения. Небольшое исследование показало, что ответы антител на вакцинацию против столбняка были выше у бегунов, вакцинированных после того, как они завершили марафон, чем в контрольной группе, не являющейся бегуном (407). Однако более крупное исследование не обнаружило различий в ответах антител на вакцины против дифтерии, столбняка и PPV23, вводимых триатлонистам после того, как они завершили гонку, по сравнению с ответами триатлонистов, вакцинированных, когда они не занимались физическими упражнениями, или в привитой малоподвижной контрольной группе (408).Дальнейшее исследование сообщает о более высоких GMTs к TIV (только для A / Panama [h4N2]) у женщин, которые использовали эргометр за 45 минут до вакцинации (409), и одно исследование показало, что активные участники старше 62 лет (определяемые как более 20 минут энергичных упражнений три или более раз в неделю) имели более высокий ответ антител на TIV, чем у участников, ведущих сидячий образ жизни (410), в то время как другие исследования с вмешательствами для повышения физической активности у взрослых не показывают связи между увеличением физических нагрузок и антителами ответы на вакцинацию против TIV (411) или PPV23 (412) (таблица 13).
Одно исследование показало, что эксцентрическое упражнение руки перед введением TIV приводит к увеличению продукции гамма-интерферона (с увеличением продукции цитокинов, коррелирующим с увеличением окружности руки) у мужчин и выработкой антител у женщин (124). Повышение ответа антител на вакцинацию против TIV с помощью упражнений варьируется в зависимости от штамма вакцины, при этом штаммы с низкой иммуногенностью особенно чувствительны к увеличению с помощью упражнений (127). Однако последующее исследование не смогло подтвердить связь между эксцентрическими упражнениями руки и гуморальной или клеточной реакцией вакцины на TIV (413) (Таблица 13).
Острый психологический стресс. У пожилых людей позитивное настроение в день вакцинации связано с более высокой реакцией антител на TIV (414). Напротив, психический стресс перед вакцинацией приводит к более высоким GMTs после вакцинации TIV у женщин (только для A / Panama [h4N2]) (409) и к более высоким GMTs для MCV-A у мужчин (139). Лица, у которых наблюдается более выраженная реакция артериального давления (с признаками отсроченного восстановления диастолического артериального давления) к концу мысленного арифметического стрессового задания, которое вызывает отвращение, имеют более высокие значения SCR после вакцинации MPV-A (415) и TIV (в A / Panama [ h4N2] и B / Shandong) (Таблица 13).
Хронический психологический стресс. Во многих исследованиях сообщается (в основном об отрицательной) связи между хроническим психологическим стрессом и реакцией на вакцины. Например, пожилые люди, которые страдают от стресса из-за того, что ухаживают за родственниками с деменцией, имеют более низкий ответ антител (416–419), меньшую продукцию IL-1β и IL-2 (410, 416, 417) и большую продукцию IL-6 ( 419) после вакцинации TIV, а также более низкие ответы антител после вакцинации PPV23 (420). Напротив, больший оптимизм у пожилых людей связан с более высокими ответами антител (411) и большей выработкой IL-10 (410) после вакцинации TIV.Взрослые с высоким уровнем воспринимаемого стресса, стрессовых жизненных событий или одиночества также имеют более низкие антитела (410, 421–424) и клеточные (425) ответы после вакцинации TIV. Это не относится к взрослым, которые ухаживают за пациентами с рассеянным склерозом (426). Ответы на вирусы гриппа A / h2N1 и B, по-видимому, более чувствительны к влиянию психологического стресса, чем на вирусы A / h4N2 (427). Лучшая социальная поддержка или брак связаны с более высокими ответами антител на вакцинацию против гепатита В (417) и TIV (423, 428), в то время как тяжелая утрата связана с более низкими ответами антител на TIV (428) (однако в одном исследовании сообщается о более низких ответах антител на вакцину. Вакцинация против TIV у пациентов с лучшей социальной поддержкой [429]).Упражнения по снижению стресса, основанные на внимательности, не влияют на реакцию антител на вакцинацию против TIV (411).
Молодые люди со стрессовыми жизненными событиями, хроническим стрессом и низким уровнем психологического благополучия могут иметь более низкие ответы антител на вакцинацию против HepB (430–433) и MCV-C (434). Однако, напротив, одно исследование показывает более высокий ответ антител на вакцинацию против гепатита В у молодых людей с хроническим стрессом (435), а некоторые исследования не обнаруживают какой-либо связи между психологическим стрессом и реакцией антител на вакцинацию против гепатита В (436, 437).На ответы антител также могут влиять механизмы выживания. Например, люди, которые принимают реальность стрессовых ситуаций, имеют более высокий ответ антител на вакцинацию против HepB, в то время как люди, которые справляются с употреблением психоактивных веществ (430) или имеют сильный негативный аффект (436), имеют более низкие ответы. Высокое интернализирующее поведение, невротизм и низкая самооценка связаны с более низким ответом антител на вакцинацию против краснухи (438), в то время как у детей с интернализирующими симптомами настроения (депрессивными или тревожными симптомами) наблюдается более высокий ответ антител на MCV-4 (439).Одно исследование не обнаружило связи между механизмами выживания и реакцией антител на вакцинацию против гепатита В (432).
Наблюдаемое негативное / конфликтное поведение в задаче взаимодействия между родителями и детьми предсказывает более низкие ответы антител на серотип C после вакцинации MCV-4 у детей (440). У детей, у которых после поступления в детский сад повышен уровень кортизола в слюне, наблюдается более низкий ответ антител на PPV23 (441) (Таблица 13).
Сон. Короткая продолжительность сна, но не субъективное качество сна в течение недели, предшествующей вакцинации, связана с более низким ответом антител на вакцинацию против гепатита В (442).Преднамеренное лишение сна в течение ночи после вакцинации HepA связано с более низкими уровнями антител (443, 444) и специфическими ответами Th-клеток (444), в то время как высокая медленноволновая активность сна связана с более высокими ответами антител (444). Преднамеренное лишение сна через 1 неделю после вакцинации TIV также связано с более низкими реакциями антител (445), в то время как не обнаружено связи между продолжительностью сна (414) или обструктивным апноэ во сне (446) и реакциями антител на вакцинацию TIV (Таблица 13).
Nutritional FactorsИндекс массы тела. Многие исследования у взрослых показывают, что увеличение индекса массы тела (ИМТ) обратно коррелирует с реакцией антител на HepA (61, 447) и HepB (61, 66, 68, 77, 78, 80 , 100, 259, 401, 402, 448–454) вакцинация. После вакцинации TIV увеличение ИМТ изначально коррелирует с более высокими ответами антител. Однако через 12 месяцев после вакцинации более высокий ИМТ связан с большим снижением антител, а у лиц с ожирением также меньше специфических CD8 Т-клеток и меньше продукции IFN-γ (449) (Таблица 14).
ТАБЛИЦА 14Результаты исследований факторов питания, влияющих на реакцию на вакцины
Статус питания. На многие реакции на вакцины не влияет недоедание. Однако, как сообщается, у детей, страдающих от недоедания, более низкий ответ антител на HepB (455), MPVS (456), корь (318, 457–459), OPV (335), коклюш (460), Salmonella Typhi (461) и столбняк ( 462) вакцинация. Кроме того, у детей с недостаточным питанием после вакцинации БЦЖ наблюдаются меньшие кожные реакции на туберкулин (463–465) (Таблица 14).
Микроэлементы (витамины A, D, E и цинк). Витамин D играет важную роль в врожденных, гуморальных и клеточных иммунных реакциях (466). Однако его роль в влиянии на реакцию на вакцины неясна (466). В большинстве исследований, посвященных влиянию витамина D на реакцию на вакцины, изучалась реакция на TIV. Результаты этих исследований противоречивы (таблица 14). У взрослых нет связи между уровнем витамина D или введением витамина D и реакцией антител на TIV (467–469).У детей некоторые исследования не обнаруживают связи между уровнем витамина D или введением витамина D и реакцией антител на TIV (470, 471), в то время как другие показывают тенденцию к снижению SPR против TIV у детей с дефицитом витамина D (472). Напротив, после вакцинации LAIV более высокие ответы антител против двух штаммов вируса гриппа B наблюдались у детей с низким уровнем витамина D, в то время как не было никакой связи между уровнями витамина D и GMT против штамма A вакцины LAIV (471).У взрослых диализных пациентов парентеральное лечение кальцитриолом приводит к более высокому ответу антител на TIV (473). Кроме того, существует четкая связь между дефицитом витамина D у пациентов, находящихся на гемодиализе, и снижением ответа антител на вакцину HepB (474). У детей с идиопатическим нефротическим синдромом нет корреляции между уровнем витамина D и реакцией антител на PPV23 (475). У пациентов с аспеленией, вакцинированных против Hib, MCV-C и PCV7, нет корреляции между уровнями витамина D и уровнями вакцинных антител (476).Взрослые, получающие добавку витамина D перед бустерной дозой столбняка, имеют более высокие уровни антител против столбняка (477). Младенцы, получающие добавки с витаминами A и D, имеют более сильные туберкулиновые кожные реакции (478) и более низкие ответы IFN-γ после вакцинации БЦЖ.
Исследования, посвященные совместному применению витамина А и противокоревой вакцины, также показывают противоречивые результаты. Витамин А, вводимый одновременно с вакциной против кори в возрасте 6 месяцев, приводит к снижению SCR (154), но только у младенцев с материнскими антителами.Витамин А, введенный одновременно с вакцинацией от кори в возрасте 9 месяцев, не приводит к разнице в GMT и SCR в возрасте 12 месяцев (479), но приводит к более высоким GMT в возрасте 18 месяцев (35) и от 6 до 8 лет. лет (480), особенно у мальчиков. Витамин А, вводимый одновременно с вакцинацией против кори в возрасте 9 месяцев недоедающим младенцам, приводит к значительно более высоким показателям GMT (479). У детей с дефицитом витамина А и без него нет различий в ответах антител на вакцинацию против дифтерии и столбняка (481).У пожилых людей, не страдающих витаминной недостаточностью, нет связи между уровнями витамина A, витамина E или цинка и реакцией антител на TIV (482). Полиморфизмы рецепторов витаминов A и D связаны с более низкими реакциями антител на вакцинацию HepB (483) и с вариациями цитокиновых ответов после вакцинации против краснухи и кори (194, 484).
Энтеропатия. Энтеропатия определяется как воспаление кишечника, не обязательно связанное с диареей. Чаще встречается у лиц, находящихся в плохих санитарных условиях.Часто предполагается, что энтеропатия является одним из механизмов более низкой эффективности пероральных вакцин в развивающихся странах. Однако только в одном исследовании изучалось влияние энтеропатии на реакцию на вакцины. Это исследование показало, что младенцы с энтеропатией имеют более низкие SPR против OPV и ORV, но не против парентеральных вакцин (326).
Факторы окружающей средыСельская среда по сравнению с городской средой. Дети, живущие в сельской местности, имеют более высокий ответ антител на столбняк (351) и экспериментальную вакцину против малярии (485, 486).У них есть Th2-искаженный ответ (продукция IL-5) на вакцинацию против столбняка и TIV, в то время как у детей, живущих в пригородных районах, есть Th3-искаженный ответ (продукция IFN-γ) (351, 487).
Напротив, гуморальные и клеточные реакции на TIV ниже у детей, живущих в сельской местности, чем у детей, живущих в пригородных районах (487). Точно так же ответы антител на вакцинацию против гепатита В (161, 486, 488) и ответы цитокинов после вакцинации БЦЖ (323) ниже у детей и взрослых, проживающих в сельской местности.
Географическое положение. Дети, живущие в развивающихся странах, имеют более высокий ответ антител на вакцинацию против Hib (489), дифтерии (489), PCV7 (490) и коклюша (489), но более низкий ответ антител на корь (491–493), OCV ( 494), OPV (495, 496) и вакцинация против Salmonella Typhi (497). Взрослые в развивающихся странах имеют более низкий ответ антител на вакцинацию против HepB (498). У детей, живущих в развитых странах, реакция на вакцинацию БЦЖ имеет тенденцию к Th3-искажению, с повышением выработки IFN-γ (396, 398, 499, 500), в то время как у детей в развивающихся странах реакция Th2-искажена (499).
Сезон. Существует связь между месяцем введения и реакцией антител на вакцинацию против коклюша (460), PPV23 (146), бешенства (146) и Salmonella Typhi (146), но нет связи между месяцем введения вакцины и реакцией антител на вакцину. вакцинация против дифтерии (146), HepB (146) и столбняка (146) (таблица 15). Младенцы в Африке, рожденные в сезон дождей, имеют более сильную реакцию вакцины против CD154 на БЦЖ, чем у детей, рожденных в сухой сезон (325). У подростков реакция антител (GMT) на вакцинацию против гепатита В ниже у лиц, получивших первую и вторую дозы летом, чем у тех, кто получает их зимой.Однако после третьей дозы статистически значимой разницы в GMT не обнаружено. Было высказано предположение, что эти различия в ответах на вакцины могут быть объяснены различиями в воздействии УФ-излучения (501). Тем не менее, воздействие УФ-В на здоровых добровольцев за пять дней подряд до вакцинации против гепатита В не приводит к разнице в GMT или клеточных реакциях на вакцину (в тесте стимуляции лимфоцитов) между людьми, подвергающимися воздействию УФ-В и не-УФ-В (502).
ТАБЛИЦА 15Результаты исследований факторов окружающей среды, влияющих на реакцию на вакцины
Размер семьи.У большего числа людей, живущих в домашнем хозяйстве, повышенная реакция антител на вакцину против Hib (327).
Токсины. В одном исследовании сравнивали реакцию на вакцину у подвергшихся воздействию свинца детей с нарушением метаболизма и у здоровых детей и не обнаружили разницы в ответах антител на столбняк (503). Другое исследование показало, что воздействие мышьяка в раннем возрасте приводит к снижению уровня антител к вирусу паротита после вакцинации MMR (504). Было также высказано предположение, что пре- и послеродовое воздействие (грудное молоко) полихлорированных бифенилов и диоксинов приводит к снижению реакции антител на вирусы кори и эпидемического паротита (505).
Факторы вакциныТип, продукт и штамм вакцины. Иммунные ответы сильно различаются в зависимости от типа вакцины и продуктов. Например, живые вакцины обычно вызывают высокие реакции вакцины, ведущие к пожизненной защите, часто после всего лишь одной дозы, тогда как инактивированные, субъединичные или анатоксиновые вакцины обычно требуют нескольких доз, включая бустерные, для достижения аналогичной защиты. Ответы на разные субъединичные вакцины также различаются. Полисахаридные вакцины вызывают независимый от Т-клеток ответ на вакцину, который не вызывает иммунной памяти и поэтому является непродолжительным.Такие вакцины не обладают защитным действием у детей младше 2 лет и не уменьшают носоглоточное носительство. Напротив, вакцины, конъюгированные с полисахаридом и белком, обладают превосходной иммуногенностью, защищают детей в возрасте до 2 лет и снижают носоглотку. Ответы на аналогичные вакцины против одного и того же заболевания также могут варьироваться в зависимости от конкретного продукта или штамма. Это было показано, например, для вакцин БЦЖ (323, 506, 507), HepB (107, 508), TIV (86), PCV7 (490), бешенства (509) и кори (49).Однако подробное обсуждение этой темы выходит за рамки данного обзора.
Адъюванты. Адъюванты добавляются к вакцинам, чтобы вызвать более сильный иммунный ответ. Величина и качество вакцинных ответов сильно различаются в зависимости от того, какие адъюванты добавляются к вакцине (510). Например, новый адъювант MF59 увеличивает аффинность антител и перекрестную защиту против TIV (511, 512), и по сравнению с вакциной, полученной со стандартной вакциной HepB, вакцина, содержащая новый адъювант AS04, индуцирует более высокие SPR и GMT (513).
Доза вакцины. Исследование IPV показало, что существует линейная зависимость между дозой введенного антигена и реакциями антител (514). С ORV ингибирующий эффект материнских антител, передаваемых через плаценту или грудное молоко, можно преодолеть, увеличив дозу вакцины (309).
У подростков, получающих вакцинацию против HepB, для индукции серопротекции достаточно 10 мкг вместо обычно используемой дозы 20 мкг (454). Однако это приводит к более низким GMT (71, 515) и SCR (71).У пациентов с терминальной стадией заболевания почек 80 мкг вакцины HepB увеличивает вероятность стойких защитных антител (259).
Для вакцины против Hib было показано, что даже одна восьмая обычно назначаемой дозы приводит к адекватным титрам антител, связанным с долгосрочным иммунитетом (516).
В отношении TIV для пожилых людей было показано, что более высокие дозы антигенов связаны с более высокими ответами антител (130, 517), в то время как у ранее иммунизированных участников в возрасте от 18 до 49 лет половина обычной дозы вакцины приводит к сопоставимым результатам. SCR и GMT, особенно у женщин (126).
Факторы введенияГрафик вакцинации. Еще одним фактором, влияющим на реакцию на вакцину, является интервал между дозами вакцины. Графики с более длинными интервалами между дозами вакцины обычно приводят к более сильному иммунному ответу. Например, ответы антител на АР значительно выше после 2–4–6-месячного графика, чем после ускоренного 2–3–4-месячного графика (349). Точно так же ответы антител на вакцинацию АКДС выше после схемы от 3 до 5–9 месяцев, чем после ускоренной схемы от 2 до 3–4 месяцев (518).Для вакцинации против гепатита В увеличенное время между первой и второй дозами или второй и третьей дозами также коррелирует с увеличением GMT и SPR (117, 401). Однако одно исследование показало более низкие GMTs после вакцинации против HepB по графику от 0 до 12–24 месяцев, чем после графика от 0 до 1–6 месяцев (448), и, аналогичным образом, другое исследование также показало, что люди у которых интервал между первой и второй дозами превышает 1 месяц, SPR ниже (79).
Напротив, GMT после вакцинации HepA выше после графика от 0 до 1–12 месяцев, чем после графика от 0 до 6–12 месяцев (99) или от 0 до 1–12 месяцев. 2-месячный график (64).
У младенцев, получивших две дозы вакцины против кори, эпидемического паротита, краснухи и вируса ветряной оспы (MMRV), GMTs выше для всех компонентов вакцины, когда дозы вводятся с интервалом 12 месяцев вместо 4 недель (519). Когда вакцинация против гриппа проводится детям в возрасте до 24 месяцев, нет разницы в ответах антител, если одна первичная доза вводится весной, а вторая — осенью, или если обе дозы вводятся осенью (520).
Участок вакцинации.У взрослых вакцинация против гепатита В в области ягодиц приводит к более низким ответам, чем те, которые получены при вакцинации в предплечье (521–524). Однако это не относится к младенцам (525). У детей, получивших вакцинацию против Hib, также нет разницы в GMTs между детьми, получившими вакцинацию в латеральную широкую мышцу бедра, и теми, кто получил ее в дельтовидной мышце (526). Точно так же нет разницы в GMTs после вакцинации против HepB у младенцев, получивших вакцину в переднебоковой области бедра, по сравнению с теми, кто получил ее в вентроглютеальной области (8).
Путь вакцинации. Внутримышечное введение TIV приводит к более высоким ответам антител, чем при подкожном введении (125). Однако нет различий в ответах антител на вакцинацию против дифтерии (137), PPV23 (143) или столбняка (137) после внутримышечного или подкожного введения. Для вакцин против гепВ и бешенства более низкая доза, вводимая внутрикожно, вызывает ответ антител, аналогичный тому, который вызывается более высокой внутримышечной дозой (148, 527–529). Внутримышечная вакцинация основана на ответе, опосредованном Т-клетками, в то время как внутрикожная вакцинация активирует ответ, опосредованный дендритными клетками, для чего требуются более низкие дозы антигена (530).Лица, не отвечающие на внутримышечную вакцинацию против HepB, могут реагировать на внутрикожное введение (531, 532). В то время как 5 мкг, вводимые внутрикожно, приводят к более высоким SCR, чем те, которые были получены при внутримышечном введении 40 мкг (533), 2 мкг, вводимые внутрикожно, приводят к более низким SPR (74) и GMT (75), чем те, которые получены при внутримышечном введении 20 мкг (75). Нет никакой разницы во времени, необходимом для сероконверсии, или во времени до пика титра антител (75).
Размер иглы. Размер иглы, используемой для введения вакцины, не влияет на реакцию на вакцину (534, 535).
Время суток. Исследования, изучающие суточные колебания реакции антител на TIV у взрослых, показывают противоречивые результаты. Одно исследование показало, что люди, получающие вакцину утром, имеют значительно более высокие ответы антител к штамму h2N1 A и тенденцию к более высоким ответам на штамм B, в то время как время введения вакцины не влияет на ответы на штамм h4N2 A (536 ). Второе исследование показало, что суточные вариации ответа антител после TIV являются штаммоспецифическими (537).Кроме того, третье исследование показало более высокие значения GMT до TIV после утренней (по сравнению с дневной) вакцинации, но только у мужчин (538). То же самое было показано для GMT после вакцинации HepA, но снова только у мужчин (538).
Совместно вводимые вакцины. В огромном количестве исследований изучалось влияние одновременного введения живых вакцин на ответные реакции на вакцины. Два метаанализа обобщили РКИ, в которых сравнивались ответы на вакцины у младенцев, получавших либо одну дозу MMRV, либо MMR и V в виде отдельных вакцин (539, 540).Первый метаанализ, включавший 10 РКИ, не обнаружил каких-либо различий в GMT для любого из компонентов вакцины (540). Однако второй метаанализ, в который вошли 24 РКИ, показал, что после однократной вакцинации детей в возрасте от 9 до 24 месяцев GMT против вирусов паротита и ветряной оспы сопоставимы между младенцами, получавшими вакцину MMRV, и теми, кто получал вакцину MMR и V (MMR + V) или MMR. Напротив, люди, получающие вакцину MMRV, достигают значительно более высоких значений GMT к вирусу кори, чем пациенты, получающие MMR + V или MMR.GMT к вирусу краснухи снижается у тех, кто получает MMRV, по сравнению с людьми, получающими MMR + V или MMR (539). MMRV также приводит к более низким SCR, чем у MMR + V или MMR, но это, вероятно, осложняется более низкими дозами вирусного антигена в ранних вакцинах (539). При исследовании иммунных ответов после введения двух доз вакцины GMT наблюдаются сходные с большинством вакцинных вирусов (541–545). Однако в группах, получающих вакцину MMRV, наблюдается тенденция к более высокому типу GMTs при ветряной оспе (541, 542, 544, 545) и эпидемическом паротите (541, 543–545), а также более низком уровне GMT при кори (542–544) и краснухе (541, 544, 545). в качестве второй дозы, чем у тех, кто получал MMR + V.Одновременное введение LAIV с MMR + V не влияет на GMT или SPR против любого из компонентов вакцины (546). Вакцина против YF, вводимая одновременно с вакциной MMR, приводит к более низким SCR, чем те, которые были получены, когда вакцины вводились с интервалом в 1 месяц (61% против 71% для эпидемического паротита, 90% против 97% для краснухи и 70% против 87% для YF). в то время как на SCR при кори одновременная вакцинация не влияет (547). Одно исследование предполагает, что живая аттенуированная вакцина против японского энцефалита (ЯЭ), введенная за 30 дней до вакцины против YF, может мешать SCR вакцинации против YF (548).Однако последующее исследование не обнаружило разницы в SCR по сравнению с вакциной YF, независимо от того, вводили ли JE за 30 дней до вакцины, одновременно с ней или после нее. Для ЯЭ, хотя также не было значительных различий в SCR между людьми, получившими две вакцинации одновременно, и теми, кто получал их с интервалом 30 дней, GMTs были значительно выше у участников, которые получили JE за 30 дней до YF, а не наоборот. или одновременно (549).
Исследования показывают, что одновременное введение неживой вакцины с вакциной MMR или V не влияет на реакцию на какой-либо из компонентов вакцины.Сюда входят 7-валентный конъюгированный пневмококк (Pn) (550–552), 10-валентный Pn-Hib (553), менингококковый C (MenC) (554), DTaP-HBV-IPV-Hib (555) и HepA (551). , 552) вакцины.
Дополнительная доза бесклеточной коклюшной вакцины при рождении может привести к последующему снижению ГепВ (52, 53), Hib (52, 53) и дифтерии (556) GMT.
Исследования, изучающие влияние совместного введения вакцины БЦЖ, показывают, что это приводит к значительно более высоким уровням антител против HepB, OPV, PCV7 и TIV, но не против DTaP-Hib или Salmonella Typhi (557).
Существует несколько исследований, которые показывают, что одновременное введение ОПВ снижает реакцию вакцины на ОРВ (558, 559). Младенцы, которые получают две вакцины одновременно, имеют меньшую вероятность сероконверсии, чем те, кто получает обе вакцины в шахматном порядке (558). Интерференция усиливается после приема первой дозы ОПВ, предположительно потому, что первая доза связана с наибольшей репликацией штаммов вакцинного полиовируса в кишечнике (559). Однако, когда вакцины вводятся одновременно после трехмесячного возраста, ни OPV, ни ORV не влияют на реакцию на вакцину (560).
Сообщается о меньшем вмешательстве при совместном введении неживых вакцин. Совместное введение вакцины против ЦВС7 с бесклеточной коклюшной или цельноклеточной коклюшной вакциной не влияет на иммуногенность вакцины против ЦВС7, за исключением вакцины против серотипа 14, для которого специфический ответ антител ниже, когда вакцина вводится с бесклеточной коклюшной вакциной. (490). Одно рандомизированное контролируемое исследование показало, что когда DPT-IPV и Hib вводятся вместе в виде единой дозы, реакция антител на столбняк значительно ниже, чем полученный, когда DPT-IPV вводится в месте инъекции, отличном от того, которое используется для Hib, или вводится с интервалом 6 месяцев. (561).Кокрановский обзор, обобщающий исследования, в которых сравнивали иммуногенность комбинированной вакцины АКДС-ВГВ-Hib и вакцин АКДС-ВГВ и Hib, вводимых в разных центрах, не дал убедительных результатов, поскольку только в одном исследовании сообщалось о значительно более низких иммунологических ответах на Hib и столбняк, когда компоненты вакцины вводились в составе комбинированной вакцины (562).
Препараты, принимаемые одновременно. В нескольких исследованиях изучалось влияние одновременного приема парацетамола во время вакцинации.Обзор, обобщающий 13 РКИ, в которых изучалось влияние профилактического применения жаропонижающих средств после вакцинации, показывает, что младенцы, получавшие парацетамол после каждой из 3 доз плановой вакцинации, имеют более низкие GMTs для всех серотипов Pn, Hib, дифтерии, столбняка и пертактина, но не для коклюшного токсина. нитчатый гемагглютинин (FHA), HepB или IPV. После бустерной дозы более низкие GMT сохранялись в группе профилактического приема парацетамола для всех серотипов Pn, дифтерии и столбняка (563). Одно исследование, в котором изучалось влияние введения ибупрофена во время вакцинации, показывает, что GMTs к FHA и столбняку уменьшаются после первичного введения, но не после бустерной дозы, в то время как реакции на конъюгированную вакцину Pn не затрагиваются (564).Кроме того, недавнее крупное исследование с участием пожилых людей показало, что прием статинов снижает GMT до TIV (565). Точно так же у недоношенных детей, получающих дексаметазон от хронических заболеваний легких, после базовой иммунизации 3 дозами у них значительно ниже GMTs против Hib (566).
Сравнение с усилением вакцины против туберкулеза, MVA85A
Аннотация
Цели
Для исследования безопасности и иммуногенности бустерной вакцинации БЦЖ, вводимой внутрикожно у здоровых субъектов, вакцинированных БЦЖ, и для сравнения с предыдущим клиническим испытанием, в котором субъекты, вакцинированные БЦЖ, были усилены новой противотуберкулезной вакциной MVA85A.
Дизайн
Открытое наблюдательное испытание фазы I, Великобритания. Здоровые, ВИЧ-отрицательные взрослые, вакцинированные БЦЖ, были набраны и вакцинированы БЦЖ. Первичным результатом была безопасность; вторичным результатом были клеточные иммунные ответы на антиген 85, перекрывающиеся пептиды антигена 85A и производное очищенного белка туберкулина (PPD), обнаруженные с помощью анализа ex vivo интерферон-гамма (IFN-γ) ELISpot и проточной цитометрии.
Результаты и выводы
Ревакцинация БЦЖ (БЦЖ-БЦЖ) хорошо переносилась, и наблюдалось усиление ранее существовавших PPD-специфических Т-клеточных ответов.Однако, когда эти результаты сравнивались с данными предыдущего клинического испытания, в котором БЦЖ была усилена MVA85A (BCG-MVA85A), MVA85A индуцировал значительно более высокие уровни (> 2-кратные) антиген-85-специфических CD4 + Т-клеток (как антиген, так и реакции пептидного пула), чем при повторной вакцинации БЦЖ, до 52 недель после вакцинации (p = 0,009). Чтобы идентифицировать антиген 85A-специфические CD8 + Т-клетки, которые не были обнаружены с помощью ex vivo ELISpot и проточной цитометрии, дендритные клетки (DC) использовали для амплификации CD8 + T-клеток из образцов PBMC.Мы наблюдали низкие, но определяемые уровни антиген-85A-специфических CD8 + Т-клеток, продуцирующих IFNγ (1,5% от общей популяции CD8) у субъектов, примированных БЦЖ, после бустинга БЦЖ у 1 (20%) из 5 субъектов. Напротив, у субъектов, вакцинированных BCG-MVA85A, высокие уровни антиген-85A-специфических CD8 + Т-клеток (до 14% общей популяции CD8) наблюдались после бустинга MVA85A у 4 (50%) из 8 оцениваемых субъектов.
В заключение, ревакцинация БЦЖ привела к умеренному усилению ранее существовавших иммунных ответов на PPD и антиген 85, но вакцинация BCG-MVA85A вызвала значительно более высокий ответ на антиген 85 и сгенерировала более высокую частоту специфических к антигену 85A CD8 + Т-клеток. .
Образец цитирования: Whelan KT, Pathan AA, Sander CR, Fletcher HA, Poulton I, Alder NC, et al. (2009) Безопасность и иммуногенность усиленной вакцинации БЦЖ субъектов с помощью БЦЖ: сравнение с усилением новой противотуберкулезной вакциной, MVA85A. PLoS ONE 4 (6): e5934. https://doi.org/10.1371/journal.pone.0005934
Редактор: Эспер Жорж Каллас, Университет Сан-Паулу, Бразилия
Поступила: 23 декабря 2008 г .; Принята к печати: 4 апреля 2009 г .; Опубликован: 16 июня 2009 г.
Авторские права: © 2009 Whelan et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Спонсоры не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. HMcS — старший научный сотрудник Welcome Trust, а AVSH — главный научный сотрудник Wellcome Trust.Оксфордский университет был спонсором всех клинических испытаний, о которых здесь сообщается. HM и AVSH — следователи Института Дженнера.
Конкурирующие интересы: AAP, AVSH и HMcS являются соавторами патента на состав вещества для MVA85A и являются акционерами совместного предприятия, созданного для разработки этой вакцины.
Введение
По оценкам, треть населения мира инфицирована Mycobacterium tuberculosis ( M.tb. ) [1]. У большинства инфицированных людей реакция хозяина содержит эту инфекцию или может привести к исчезновению патогена. Однако глобальное бремя болезней остается серьезной проблемой. По оценкам, в 2007 г. было зарегистрировано 9,2 миллиона новых случаев туберкулеза (ТБ), а в 2006 г. — 0,5 миллиона случаев туберкулеза с множественной лекарственной устойчивостью [1]. Единственная доступная вакцина против туберкулеза, Mycobacterium bovis Bacille Calmette-Guerin (BCG), имеет переменную эффективность. Когда БЦЖ вводится при рождении, это обеспечивает последовательную и надежную защиту от диссеминированных болезней в детстве в развивающихся странах [2], [3].Однако БЦЖ не защищает от болезней легких в этих регионах [4]. Любая улучшенная схема вакцинации против туберкулеза должна включать БЦЖ, вводимую в младенчестве, чтобы сохранить защитные эффекты против тяжелых детских болезней [5], [6], [7].
Ревакцинация БЦЖ в подростковом возрасте стала рутинной практикой во многих странах по всему миру, и есть данные, свидетельствующие о том, что она обеспечивает улучшенную защиту от таких заболеваний, как туберкулезный менингит [2] и проказа [8]. В крупном клиническом испытании ревакцинации БЦЖ с участием более 200 000 детей в Бразилии не наблюдалось усиленного защитного эффекта ревакцинации БЦЖ против легочных заболеваний [9].В свете этого и других исследований ВОЗ не рекомендует ревакцинацию [10].
Иммунологические маркеры защиты от туберкулеза еще не определены. Однако иммунитет к M.tb . зависит от выработки клеточного иммунного ответа Th2-типа. Секреция IFNγ играет центральную роль в активации M.tb -инфицированных макрофагов, и измерение высвобождения IFNγ из антигенспецифических Т-клеток обеспечивает наилучший доступный иммунологический коррелят защиты от туберкулеза [11], [12], [13] .ТБ — самое распространенное заболевание, связанное с ВИЧ, и самая частая причина смертности [1]. Ежегодный риск развития туберкулеза в результате реактивации латентной инфекции M.tb у лиц, коинфицированных ВИЧ, составляет 5–15% в год по сравнению с 5–10% риском в течение жизни у лиц с иммунодефицитом [14], [15] . В дополнение к важности CD4 + Т-клеток для защитного иммунитета, CD8 + Т-клетки также важны для контроля инфекции M.tb . CD8 + Т-клетки могут иметь большее значение на латентных стадиях M.tb , путем поддержания контроля над медленно размножающимися бактериями, а не при острой инфекции [16], [17]. Улучшенная индукция, активация или функциональность ТБ-специфических CD8 + Т-клеток может повысить защитный иммунитет против ТБ [18].
Мы разработали новую вакцину, модифицированную вакцину Ankara, экспрессирующую антиген 85A (MVA85A), с использованием рекомбинантной вирусной векторной системы, которая предназначена для индукции и усиления клеточного иммунного ответа. Эта вакцина была разработана как бустерная вакцина против БЦЖ.Антиген 85A — это фермент (миколилтрансфераза), участвующий в биосинтезе клеточной стенки, он высоко консервативен у всех видов микобактерий и присутствует во всех штаммах БЦЖ [19], [20]. Антиген 85A является иммунодоминантным в исследованиях на животных и людях [21], [22], [23], а иммунизация антигеном 85A обеспечивала значительную защиту от заражения M.tb [21], [22], [23]. Усиление BCG с помощью MVA85A индуцирует высокие уровни антигенспецифического IFNγ, секретирующего клетки CD4 + и CD8 +, и усиление защиты от M.tb при интраназальном введении мышам. У более крупных животных повышенная защита наблюдалась при внутрикожном введении MVA85A для усиления БЦЖ у нечеловеческих приматов (Verreck F et al, представлено), а также у крупного рогатого скота, у которого была усилена защита от заражения M. bovis (Vordermeier M. . В серии клинических испытаний мы показали, что MVA85A эффективен в индукции высоких уровней антигенспецифических CD4 + Т-клеток при введении отдельно или в качестве усиления иммунных ответов, индуцированных БЦЖ [24].Однако обнаружение TB-специфических CD8 + Т-клеток в образцах мононуклеарных клеток периферической крови (PBMC) из этих клинических испытаний оказалось трудным. С использованием анализов ex vivo ELISpot и проточной цитометрии на основе PBMC ни до, ни после вакцинации MVA85A ни в одном из исследований, проведенных на сегодняшний день, не было обнаружено никаких антиген-специфических ответов CD8 + Т-клеток ни до, ни после вакцинации MVA85A. В другой работе дендритные клетки (ДК) использовались в качестве профессиональных антигенпредставляющих клеток для повышения чувствительности обнаружения CD8 + Т-клеток.Это связано с высокими уровнями MHC I и MHC II, костимулирующих молекул и релевантного цитокинового профиля, экспрессируемого зрелыми ДК, что способствует увеличению популяции антиген-специфических Т-клеток, которые в противном случае не могут быть обнаружены [25], [26], [27], [28].
Целью представленного здесь клинического испытания было исследование безопасности и иммуногенности повторной вакцинации БЦЖ субъектов с БЦЖ и сравнение этих результатов с данными предыдущих исследований, в которых субъекты, вакцинированные БЦЖ, были усилены с помощью MVA85A [24].Кроме того, особое внимание в иммунологии было уделено разработке методологии обнаружения антиген-специфических CD8 + Т-клеточных ответов у этих субъектов.
Методы
Блок-схемы Consort для каждого из двух обсуждаемых здесь испытаний представлены на рисунке 1. Протокол этого испытания и вспомогательный контрольный список CONSORT доступны в качестве вспомогательной информации; см. Контрольный список S1 и Протокол S1.
Участников
Субъектов были набраны для обоих клинических испытаний в соответствии с протоколами, утвержденными Комитетом по этике исследований Оксфордшира, и зачислены только после получения письменного информированного согласия.Последующее наблюдение длилось 24 недели; однако в протоколы были внесены поправки во время испытания, так что субъектов, все еще живущих в этом районе, приглашали на оценку в течение недели 52. Описанные здесь испытания были открытыми наблюдательными испытаниями.
Субъекты, включенные в клинические испытания, были здоровыми и ранее были вакцинированы БЦЖ. Визуально это подтверждалось наличием рубца от БЦЖ. Все они были серонегативными на ВИЧ, ВГВ и ВГС при скрининге, и перед вакцинацией были выполнены рутинные лабораторные гематологические и биохимические исследования.Все значения были в пределах нормы. Все испытуемые прошли тест Heaf, и те, у кого результат теста Heaf был выше 2-го класса, были исключены. Все субъекты были отрицательными в отношении M.tb -специфических антигенов ESAT6 и CFP10, как определено с помощью анализа ex vivo ELISpot.
Было 14 субъектов, подходящих для включения в исследование БЦЖ-БЦЖ со средним интервалом времени 12 лет с момента их первой вакцинации БЦЖ. Средний возраст испытуемых составлял 28 лет (от 19 до 51 года).Субъекты в испытании BCG-MVA85A были из ранее описанного исследования (n = 17) [24], с дополнительными 4 субъектами, впоследствии набранными в группу BCG-MVA85A. Все 21 субъект были использованы в анализе для этой статьи. Аналогичные критерии включения / исключения применялись к субъектам, набранным для участия в исследованиях BCG-BCG и BCG-MVA85A [24]. Средний интервал между вакцинацией БЦЖ и повторной вакцинацией MVA85A составлял 18 лет в этой группе, а средний возраст субъектов составлял 31 год (от 22 до 54 лет).Демографические данные по всем предметам обобщены в Таблице 1.
Все субъекты заполнили дневниковую карточку, в которой регистрировали местные и системные побочные эффекты и температуру тела в течение 7 дней после вакцинации. Кроме того, при каждом посещении клиники собирались запрашиваемые побочные эффекты.
Вмешательства
В исследовании BCG-BCG добровольцев вакцинировали BCG (однократная иммунизация BCG (BCG, Дания, Statens Serum Institute, Копенгаген, Дания), 100 мкл вводили внутрикожно в дельтовидную область (n = 14)).В исследовании BCG-MVA85A субъектов вакцинировали внутрикожно с помощью однократной иммунизации 5 × 10 7 БОЕ MVA85A [24].
Анализ иммуногенности
Анализ ELISpot.
Стандартизированный анализ ex vivo IFNγ ELISpot проводили на PBMC, взятых в следующие моменты времени: при скрининге (перед тестом Heaf), а затем через 1, 4, 8, 12 и 24 недели после вакцинации на свежем воздухе. PBMC от субъектов в обеих испытательных группах. Кровь также брали через 52 недели после вакцинации у тех субъектов, которые все еще проживали в этом районе [24].Вкратце, 300000 свежих PBMC на лунку высевали непосредственно на планшет ELISpot (MAIP, Millipore) в присутствии либо очищенного производного белка туберкулина (PPD) в концентрации 20 мкг / мл, либо очищенного комплекса антигена 85 (10 мкг / мл), либо антигена. Объединенные пептиды 85A (7 пулов из 9-10 15-членных пептидов, охватывающих длину антигена 85A, перекрывающихся на 10 аминокислот). Конечная концентрация каждого пептида в лунке составляла 10 мкг / мл. PBMC инкубировали с антигеном (пулы пептидов PPD, антиген 85 или антиген 85A) в течение 18 часов при 37 ° C.Стрептокиназа / стрептодорназа и PHA использовались во всех анализах в качестве положительного контроля, а только клетки и среда — в качестве отрицательного контроля. Анализы проводили в двух экземплярах, а результаты усредняли.
Данные ELISpot были проанализированы путем вычитания фоновых количеств (среднее количество пятен в среде и только клетки в контрольных лунках) из среднего числа пятен в лунках с антигеном и клетками с использованием считывающего устройства AID ELISpot 04 (AID Diagnostika GmbH, Strassberg , Германия). Количество менее 5 точек на лунку считалось отрицательным.Лунка считалась положительной, если количество было как минимум вдвое больше, чем в лунках отрицательного контроля, и как минимум на 5 точек больше, чем в лунках отрицательного контроля. Для лунок с пулами пептидов результаты суммировали по всем пулам пептидов (SPP) для каждого добровольца в каждый момент времени. Это будет дважды подсчитывать Т-клетку, которая реагирует на любую из 10-мерных перекрывающихся областей, которые встречаются в двух пулах с соседними пептидами, поскольку каждый пул содержит неперекрывающиеся пептиды.
Анализ площади под кривой (AUC) для ответов IFNγ ELISpot проводили для сравнения схем вакцинации БЦЖ — БЦЖ и БЦЖ — MVA85A с течением времени (до 52 недель).
Опосредованная дендритными клетками амплификация CD8 + Т-клеток
Анализы проточной цитометрии были выполнены на криоконсервированных PBMC, полученных от субъектов в группах BCG-BCG и BCG-MVA85A при скрининге (перед туберкулиновым кожным тестом), а затем через 1, 4, 8, 12 и 24 недели после вакцинации. обеспечение сопоставимости между группами. В этом анализе РВМС совместно культивировали с дендритными клетками (ДК), происходящими из моноцитов, для усиления обнаружения ex vivo CD8 + Т-клеточных ответов.
DC получали стандартным методом культивирования с IL-4 и GMCSF [29]. На 5 день они были активированы 10 нг / мл ЛПС. Через 16 часов после активации DC промывали, подвергали импульсному воздействию пептидов в течение 45 минут и снова промывали. Предварительные эксперименты, проведенные с импульсным постоянным током с БЦЖ, не показали детектируемого ответа CD8 + Т-лимфоцитов в режиме БЦЖ-БЦЖ, поэтому дальнейшие исследования этого не проводились. РВМС совместно культивировали в 24-луночных планшетах в соотношении 15 ± 1 (РВМС-ДК) в присутствии ИЛ-7 в концентрации 25 нг / мл в день 1, затем добавляли ИЛ-2 в количестве 0.5 нг / мл на 3-й день, а затем на 7-й и 10-й день. Культуру промывали на 13-й день и повторную стимуляцию пептидом (10 мкг / мл) проводили на 14-й день вместе с ФГА и нестимулированными клетками. Брефельдин А был добавлен через 4 часа, а еще через 12 часов было проведено внутриклеточное окрашивание цитокинов для обнаружения IFNγ с использованием набора для окрашивания внутриклеточных цитокинов Becton Dickinson с GolgiPlug ™ в соответствии с протоколом производителя.
Был выбран HLA-A2-специфический CD8 + иммунодоминантный антиген 85A пептидный пентамер, KLIANNTRV [30], поскольку ранее было показано, что он распознается у субъектов, вакцинированных БЦЖ.Был выбран предварительно определенный HLA-A2-рестриктированный CD8 + Т-клеточный эпитоп, поскольку HLA-A2 является наиболее распространенным антигеном HLA класса I, и, следовательно, это позволило нам проанализировать максимальное количество субъектов с использованием одного эпитопа, KLIANNTRV. Для оценки и количественного определения ответа CD8 + Т-клеток были проанализированы 5 субъектов в исследовании BCG-BCG и 8 субъектов в исследовании BCG-MVA85A, все из которых были HLA-A2-положительными.
Тетрамеры для EBV (EBNA 3A, YPLHEQHGM, ограниченного HLA-B35) и эпитопов ВИЧ (gag; HLA-A24-ограниченный p17 KYRLKHLVW и p46 HLA-A6802-ограниченный ETAYFILKL) использовали в качестве положительного и отрицательного контроля (для краткосрочного культивирования). условия) соответственно [27], [28], [31].Все антигены использовали в концентрации 10 мкг / мл.
Клетки инкубировали с пентамером KLIANNTRV, меченным APC, в течение 60 минут при 37 ° C. Затем клетки охлаждали до 5 ° C и инкубировали с PE-конъюгированным mAb CD8 (Becton Dickinson) в течение 30 минут, промывали и инкубировали с FITC-конъюгированным IFNγ и PerCP-конъюгированным CD3 mAb (Becton Dickinson) в течение 30 минут при 5 ° C.
Клетки получали с помощью проточной цитометрии на аппарате FACS Calibur (Becton Dickinson) и анализировали с помощью программного обеспечения FlowJo путем стробирования популяции лимфоцитов в прямом рассеянии (FSC) и боковом рассеянии (SSC), а также стробирования по популяциям живых клеток.Затем для популяции CD8 HI + выполняли стробирование, чтобы определить, являются ли они антиген-специфичными и продуцируют ли они IFNγ. Эти стробированные статистические данные использовались, и конкретные ответы (т.е. процент положительно стимулированных клеток минус процент положительных нестимулированных клеток) отображались на гистограмме. Представленные данные являются репрезентативными для трех повторных экспериментов.
Статистические методы
Тест Манна-Уитни использовался для всех сравнений между группами, площадей под кривой и сравнений между ранними и поздними временными точками (неделя 1 и неделя 52) между группами, а биномиальный метод использовался для оценки доверительных интервалов с использованием STATA 9 [32]
Результаты
Набор и демография
субъектов были набраны с февраля 2004 г. по ноябрь 2005 г. для группы BCG-BCG и с марта 2003 г. по июнь 2006 г. для группы BCG-MVA85A.За всеми субъектами наблюдали на предмет безопасности и иммуногенности в течение 24 недель после вакцинации, с дополнительным посещением через 52 недели 12 субъектов из режима BCG-BCG и 13 субъектов из режима BCG-MVA85A. 1 (7%) из 14 субъектов в группе BCG-BCG родились за пределами Великобритании, тогда как 7 (33%) из 21 субъекта в группе BCG-MVA85A родились за пределами Великобритании. Трое (21%) участников BCG-BCG имели значительную историю путешествий по сравнению с 2 (10%) субъектами BCG-MVA85A.
Безопасность вакцинации БЦЖ-БЦЖ по сравнению с вакцинацией БЦЖ-MVA85A
Схемы BCG-BCG и BCG-MVA85A хорошо переносились без серьезных или тяжелых системных нежелательных явлений, связанных с вакцинами.Не было заметных различий в местных и системных нежелательных явлениях между схемами вакцинации БЦЖ-БЦЖ (n = 14) и BCG-MVA85A (n = 21).
Все субъекты схем BCG-BCG и BCG-MVA85A испытали некоторые легкие местные побочные эффекты, связанные с вакцинацией. Это включало покраснение, боль и уплотнение, которые испытывали все субъекты в обоих режимах, при этом некоторые субъекты также испытывали зуд (Таблица 2A).
Все системные нежелательные явления были легкой степени тяжести.Наиболее частыми системными побочными эффектами были головная боль (5 (36%) из 14 субъектов, получавших БЦЖ-БЦЖ, и 8 (38%) из 21 субъекта, получавших БЦЖ-MVA85A), и миалгия (5 (36%) из 14 субъектов, получавших БЦЖ- BCG и 5 (24%) из 21 субъекта, получавшего BCG-MVA85A). Профили нежелательных явлений были сопоставимы между двумя схемами вакцинации (таблица 2A и B).
BCG-MVA85A вызывал значительно более сильные клеточные иммунные ответы на белок антиген 85 и антиген 85A SPP, чем вакцинация BCG-BCG
Иммунные ответы на PPD, антиген 85 и антиген 85A SPP сравнивали между субъектами в испытаниях BCG-BCG и BCG-MVA85A в PBMC в различные моменты времени в течение 52-недельного периода после вакцинации.У субъектов BCG-BCG сильный клеточный иммунный ответ на PPD был вызван через 1 неделю после вакцинации, что привело к увеличению IFNγ-ответа ELISpot (в среднем 824 пятнообразующих клеток (SFC) / 10 6 мононуклеарных клеток периферической крови (PBMC)) выше уровней, наблюдаемых при скрининге (медиана 205 SFC / 10 6 PBMC; Рисунок 2A). Клеточный иммунный ответ был ниже через 12 недель после вакцинации (медиана 467 SFC / 10 6 PBMC) и достиг плато на этих уровнях, которое сохранялось в течение как минимум 52 недель после вакцинации (медиана 402 SFC / 10 6 PBMC ).Точно так же у субъектов BCG-MVA85A пик ответа на PPD наблюдался через 1 неделю после вакцинации (медиана 783 SFC / 10 6 PBMC). Эти уровни снизились через 12 недель после вакцинации (медиана 223 SFC / 10 6 PBMC), незначительно увеличившись через 52 недели (медиана 347 SFC / 10 6 PBMC).
Рис. 2. Медиана IFNγ-ответа ELISpot на PPD, белок антигена 85A и SPP до 52 недель после вакцинации.
Медианные ответы IFNγ ELISpot оценивали для PBMC от субъектов в схемах вакцинации BCG-BCG и BCG-MVA85A против: (A) туберкулина PPD; (B) Очищенный белок антиген 85; (c) суммированный объединенный пептид (SPP) пептидов антигена 85A.(d) Точечный график значений AUC 0–52 недель , рассчитанных для PPD, белка антигена 85A и SPP, и статистический анализ, проведенный с использованием теста Манна-Уитни для сравнения результатов субъектов BCG-BCG и BCG-MVA85A. Результаты демонстрируют значительно более высокие ответы на белок антиген 85А (p = 0,009) и SPP (p = 0,0001) у субъектов BCG-MVA по сравнению с субъектами BCG-BCG.
https://doi.org/10.1371/journal.pone.0005934.g002
Ответ на белок антиген 85 у субъектов BCG-BCG был ниже, чем ответ PPD; достигая пика через 1 неделю после вакцинации (медиана 340 SFC / 10 6 PBMC) по результатам скрининга (медиана 105 SFC / 10 6 PBMC).Низкий уровень ответа на этот антиген продолжал наблюдаться в течение 52-недельного периода после вакцинации (рис. 2В). Напротив, наблюдалось заметное увеличение ответа на белок антиген 85 у субъектов BCG-MVA85A через 1 неделю после вакцинации (медиана 790 SFC / 10 6 PBMC) по сравнению со значениями, наблюдаемыми при скрининге (медиана 27 SFC / 10 6 PBMC; рисунок 2B). Ответ на антиген 85A снизился до 12 недель после вакцинации (медиана 113 SFC / 10 6 PBMC), а уровни ответа были незначительно выше через 52 недели (медиана 237 SFC / 10 6 PBMC).
У субъектов BCG-BCG ответ на SPP увеличивался через 1 неделю после вакцинации (медиана 236 SFC / 10 6 PBMC) по сравнению со скринингом (медиана 102 SFC / 10 6 PBMC). Ответ был снижен до исходного уровня (медиана 95 SFC / 10 6 PBMC) через 8 недель после вакцинации, где это плато продолжалось до 52 недель (медиана 34 SFC / 10 6 PBMC). У субъектов BCG-MVA85A ответ на SPP заметно увеличивался через 1 неделю после вакцинации (медиана 2147 SFC / 10 6 PBMC) по сравнению со значениями при скрининге (медиана 13 SFC / 10 6 PBMC).Ответ на SPP снизился на 12 недель (медиана 390 SFC / 10 6 PBMC), а затем незначительно увеличился через 52 недели после вакцинации (медиана 506 SFC / 10 6 PBMC).
Для анализа эффекта схем вакцинации в течение 52-недельного периода после вакцинации, анализ площади под кривой (AUC) ответов IFNγ ELISpot был выполнен для субъектов, присутствующих во всех временных точках (1, 2, 4, 8 , 12, 24 и 52 недели). Результаты показали, что усиливающий эффект MVA85A (n = 13) был значительно выше, чем усиливающий эффект BCG (n = 12) в усилении клеточного ответа на антиген 85A (p = 0.009) и SPP (p = 0,0001) за 52-недельный период (рисунок 2D и таблица 3). Ответ на PPD существенно не отличался между группами BCG – BCG и BCG – MVA85A (Таблица 3).
1 неделя после вакцинации
Для проверки значимости максимального эффекта схем вакцинации через 1 неделю после вакцинации был проведен статистический анализ клеточных иммунных ответов на PPD, белок антиген 85A и SPP (BCG∶BCG n = 21 BCG∶MVA85A n = 14). Сильный клеточный иммунный ответ наблюдался для PPD-специфических PBMC у субъектов как BCG-BCG, так и BCG-MVA85A через 1 неделю после вакцинации (медиана 707 SFC / 10 6 PBMC и 824 SFC / 10 6 PBMC, соответственно). без существенных различий в ответе на PPD между двумя группами (p = 0.95; Рисунок 3А). Напротив, через 1 неделю после вакцинации значительно более высокий ответ на PBMC от субъектов BCG-MVA85A наблюдался против белка антигена 85A (медиана 790 SFC / 10 6 PBMC) и SPP (медиана 2147 SFC / 10 6 PBMC) чем в PBMC от субъектов BCG-BCG (медиана 340 SFC / 10 6 PBMC против белка антигена 85A, p = 0,002, и медиана 236 SFC / 10 6 PBMC против SPP, p <0,0001; Таблица 4 и Рисунок 3A ).
Рисунок 3. Сравнение IFNγ-ответов ELISpot у субъектов BCG-BCG и BCG-MVA85A.
IFNγ ELISpot ответы на схемы вакцинации BCG-BCG и BCG-MVA85A через (A) через 1 неделю и (B) через 52 недели после вакцинации. Статистически значимые различия между двумя схемами вакцинации оценивали с помощью теста Манна-Уитни. Субъекты BCG-MVA85A имели значительно более выраженные ответы на белок антиген 85A и SPP по сравнению с субъектами BCG-BCG.
https://doi.org/10.1371/journal.pone.0005934.g003
52 недели после вакцинации
Для определения уровня клеточного иммунного ответа в конце периода последующего наблюдения были исследованы образцы через 52 недели после вакцинации (BCG∶BCG n = 12, BCG∶MVA85A n = 13).Статистический анализ субъектов через 52 недели после вакцинации продемонстрировал умеренный ответ на PPD в PBMC у субъектов BCG-BCG (медиана 402 SFC / 10 6 PBMC) и субъектов BCG-MVA85A (медиана 347 SFC / 10 6 PBMC ), без существенной разницы. Значительно больший антиген 85A специфический клеточный иммунный ответ был обнаружен в PBMC от субъектов BCG-MVA85A (медиана 237 SFC / 10 6 PBMC для рекомбинантного белка и медиана 506 SFC / 10 6 PBMC для SPP), чем в PBMC из BCG. — субъекты БЦЖ (медиана 83 SFC / 10 6 PBMC против антигена 85A, p = 0.0003 и 34 SFC / 10 6 PBMC против SPP, p = 0,0001; Таблица 4 и Рисунок 3B).
Опосредованная дендритными клетками амплификация секретирующего IFNγ, специфичного к пептиду антигена 85A, CD8 + Т-клеток из PBMC
Из пяти субъектов HLA-A2 + BCG-BCG, изученных в этом анализе, только один субъект имел очень низкие уровни секреции IFNγ, CD8 + Т-клетки, распознающие KLIANNTRV (1,5% от общей популяции CD8) в один момент времени (4 недели) после -вакцинация (рисунок 4). Напротив, у восьми субъектов HLA-A2 + BCG-MVA85A, секретирующие IFNγ, CD8 + Т-клетки, распознающие KLIANNTRV, были обнаружены через 2 и 4 недели после вакцинации у 4 (50%) из 8 субъектов на уровнях примерно до 10. в несколько раз выше, чем у пациентов с БЦЖ-БЦЖ (до 14% от общей популяции CD8).
Рисунок 4. Амплификация дендритными клетками Т-специфичных IFNγ-продуцирующих CD8 Т-клеток.
ТБ-специфические CD8 + Т-клетки, продуцирующие IFNγ в ответ на иммунодоминантный пептид KLIANNTRV, были идентифицированы у HLA-A2-положительных субъектов в схемах вакцинации BCG-BCG и BCG-MVA85A через 2 и 4 недели. TB-специфические CD8 + T-клетки не были обнаружены выше 0,5% TB-специфических CD8 + T-клеток в проанализированные временные точки 0, 1, 8 и 24 недели (данные не показаны). Значения представлены как среднее (+ SD) и представляют собой три образца.
https://doi.org/10.1371/journal.pone.0005934.g004
Обсуждение
В данном исследовании ревакцинация БЦЖ хорошо переносилась без каких-либо неожиданных или серьезных побочных эффектов в течение 52 недель после вакцинации. Это было похоже на профиль нежелательных явлений, наблюдаемый у субъектов в ранее описанном испытании с использованием схемы вакцинации BCG-MVA85A [24].
Вакцинация БЦЖ имеет разную эффективность, не защищает от легочных заболеваний у взрослых, но обеспечивает защиту в детстве [4].Наиболее широко распространенное объяснение переменной эффективности БЦЖ во многих глобальных испытаниях состоит в том, что предшествующее воздействие микобактерий окружающей среды либо подавляет репликацию и развитие индуцированного БЦЖ защитного иммунного ответа, либо маскирует эффект вакцинации БЦЖ, обеспечивая аналогичную степень антимикобактериального воздействия. иммунитет [11], [33]. В этом текущем исследовании различия в клеточных иммунных ответах между этими двумя схемами вакцинации нельзя объяснить возможными различиями в уровнях воздействия микобактериального антигена на исходном уровне.Чтобы подтвердить отсутствие разницы между воздействием микобактериального антигена между испытаниями, критерии включения в испытание, включая исходные ответы туберкулиновой кожной пробы, были одинаковыми для обоих испытаний.
Результаты этого исследования свидетельствуют о повышенных клеточных иммунных ответах на антигенов M.tb после схем вакцинации БЦЖ-БЦЖ и БЦЖ-MVA85A. Ответ IFNγ ELISpot на PPD у субъектов BCG-BCG был высоким и подобен субъектам BCG-MVA85A как в ранние (неделя 1), так и в поздние (неделя 52) моменты времени, а также в течение периода 52 недель (согласно значениям AUC). , без существенных различий между двумя режимами вакцинации.Усиление BCG с помощью BCG может привести к усилению многих различных секретируемых антигенов в PPD, тогда как усиление с помощью MVA85A приведет только к усилению компонента антигена 85A в BCG.
В отличие от PPD-ответов, в этом исследовании мы показали, что субъекты, вакцинированные MVA85A, имеют значительно более высокие клеточные иммунные ответы на белок антиген 85A и антиген 85A SPP в моменты времени пика (1-я неделя) и плато (52-я неделя), и в течение 52-недельного периода (согласно значениям AUC), чем у субъектов BCG-BCG.Исследования показали, что реактивность против антигена 85A [19] и белка антигена 85B [34] вызывает защитный иммунитет к туберкулезу. Иммунизация вакциной конструкцией, кодирующей антиген 85A, обеспечивает защиту от заражения живым туберкулезом у мелких животных [21], [22], [23].
Хотя значительные различия наблюдались при использовании анализов ex vivo IFNγ ELISpot, этот анализ выявлял только ответы CD4 + Т-клеток. До настоящего исследования не было выявлено никаких CD8 + Т-клеточных ответов.Поэтому мы использовали ДК для амплификации небольшого количества CD8 + Т-клеток, которые иначе не могли быть обнаружены, и сравнили между режимами бустирования. Ограниченный по HLA-A2 иммунодоминантный пептид (KLIANNTRV) из антигена 85A был выбран для идентификации CD8 + T-клеток, ограниченных классом I MHC. Было показано, что KLIANNTRV распознается PBMC, стимулированными БЦЖ, у 50% субъектов, вакцинированных БЦЖ [30]. После амплификации CD8 + Т-клеток с использованием ДК мы наблюдали, что ревакцинация с помощью БЦЖ индуцировала обнаруживаемую, но низкую частоту пентамера (KLIANNTRV) +, IFNγ +, CD8 + Т-клеток в одной временной точке только у одного из 5 субъектов HLA-A2 +.Величина (до 10 раз выше) распознавания CD8 + Т-клетками иммунодоминантного пептида KLIANNTRV была выше у субъектов BCG-MVA85A, выявлялась у 4 из 8 субъектов и определялась в 2 различных временных точках (у 50% субъектов). . Понятно, что с помощью этого высокочувствительного анализа можно выявить более высокую частоту CD8 + Т-клеток в режиме BCG-MVA85A, чем в режиме BCG-BCG. Клиническое значение этого усиленного ответа CD8 + Т-клеток можно определить только в крупномасштабных испытаниях эффективности.Возможно, что уровни антиген-специфических ответов CD8 + Т-клеток останутся ниже предела обнаружения у субъектов БЦЖ-БЦЖ, но, учитывая повышенную чувствительность метода DC-опосредованной амплификации, используемого в этом исследовании, это будет означать, что они находятся на очень высоком уровне. действительно низкая частота. Результаты этого исследования демонстрируют, что DC являются полезным и мощным инструментом в обеспечении стимуляции, необходимой для усиления низкочастотных CD8 + Т-клеток в образцах PBMC до обнаруживаемых уровней.
Было показано, чтоCD8 + Т-клеточные ответы на микобактерии вызываются вакцинацией БЦЖ у пожилых людей или после латентной инфекции или активного заболевания [30], [35], [36], [37].Однако широко распространено мнение, что вакцинация БЦЖ приводит к субоптимальному CD8 + Т-клеточному ответу. Хотя CD4 + Т-клетки являются преобладающими клетками, контролирующими ТБ-инфекцию, исследования на животных показали, что CD8 + Т-клетки участвуют в защите от ТБ [23], [38], [39]. Защита от M. tb , внутриклеточного патогена, вероятно, требует тонко сбалансированного взаимодействия между клетками врожденной и адаптивной иммунной системы. CD8 + Т-клеточные ответы могут играть роль в начальном контроле туберкулезной инфекции, и это может быть вызвано презентацией нейтрофилов во время начального врожденного иммунного ответа [40], [41] или посредством взаимодействия с нейтрофилами и DC [42].Было показано, что нейтрофилы перекрестно представляют происходящие от патогенов и растворимые антигены в CD8 + Т-клетки in vivo [42]. Это может некоторым образом объяснить различия, наблюдаемые в анализах цельной крови, где присутствуют нейтрофилы и могут инициировать пролиферацию CD8 + Т-клеток, по сравнению с препаратами PBMC, в которых нейтрофилы отсутствуют. Действительно, было показано, что CD8 + Т-клетки могут быть обнаружены с помощью проточной цитометрии в образцах цельной крови взрослых [36], [37] и младенцев [43], [44], вакцинированных БЦЖ.Хотя пентамер (KLIANNTRV) +, IFNγ +, CD8 + Т-клетки могут быть обнаружены у субъектов BCG-BCG и BCG-MVA85A в нашем исследовании, возможно, что существуют другие, функциональные, CD8 + T-клетки, как мы показали у субъектов, которые получали BCG-MVA85A [45]. Поскольку эти клетки встречаются на низкой частоте, возможно, что использование образцов цельной крови в сочетании с амплификацией постоянного тока может быть использовано в качестве мощного инструмента для усиления низкочастотных CD8 + Т-клеток для оценки их функциональности.
Таким образом, результаты этого исследования продемонстрировали, что в схеме вакцинации BCG-MVA85A можно вызвать значительно более сильные клеточные иммунные ответы на антиген 85A по сравнению с ревакцинацией BCG-BCG.IFNγ, несомненно, является важным цитокином, участвующим в защите от туберкулеза, и его использовали в качестве меры «принятия» вакцины [12] в фазе I клинических испытаний BCG-MVA85A [24], [45], [46], [47]. По мере проведения дальнейших исследований весьма вероятно, что появятся другие корреляты защиты. Доказательства концепции эффективности испытаний должны начаться в начале 2009 года и позволят нам оценить, приводят ли усиленные иммунные ответы после BCG-MVA85A к улучшению защиты.
Благодарности
Мы благодарим всех испытуемых, принявших участие в исследованиях, представленных здесь.Мы благодарим Kris Huygen за предоставление очищенного антигена 85 для использования в этих исследованиях. Оксфордский университет был спонсором всех клинических испытаний, о которых здесь сообщается.
Вклад авторов
Задумал и спроектировал эксперименты: KTW AVH HM. Проведены эксперименты: KTW AAP. Проанализированы данные: KTW AAP HF NCA HM. Предоставленные реагенты / материалы / инструменты анализа: CRS HF IP. Написал статью: KTW HM.
Ссылки
- 1. ВОЗ (2008 г.) Глобальная борьба с туберкулезом, 2008 г.http://www.who.int/research/en/ ed: ВОЗ. С. Ключевые моменты.
- 2. Родригес Л.К., Диван В.К., Уиллер Дж.Г. (1993) Защитный эффект БЦЖ против туберкулезного менингита и милиарного туберкулеза: метаанализ. Int J Epidemiol 22: 1154–1158.
- 3. Trunz BB, Fine P, Dye C (2006) Влияние вакцинации БЦЖ на детский туберкулезный менингит и милиарный туберкулез во всем мире: метаанализ и оценка экономической эффективности. Ланцет 367: 1173–1180.
- 4.Colditz GA, Brewer TF, Berkey CS, Wilson ME, Burdick E, et al. (1994) Эффективность вакцины БЦЖ в профилактике туберкулеза. Мета-анализ опубликованной литературы. Джама 271: 698–702.
- 5. Aronson NE, Santosham M, Comstock GW, Howard RS, Moulton LH и др. (2004) Долгосрочная эффективность вакцины БЦЖ у американских индейцев и коренных жителей Аляски: 60-летнее последующее исследование. JAMA 291: 2086–2091.
- 6. Баррето М.Л., Перейра С.М., Феррейра А.А. (2006) Вакцина БЦЖ: эффективность и показания для вакцинации и ревакцинации.J Pediatr (Rio J) 82: S45–54.
- 7. Sterne JA, Rodrigues LC, Guedes IN (1998) Снижается ли эффективность БЦЖ со временем после вакцинации? Int J Tuberc Lung Dis 2: 200–207.
- 8. (1996) Рандомизированное контролируемое испытание однократной вакцины БЦЖ, повторной БЦЖ или комбинированной вакцины БЦЖ и убитой Mycobacterium leprae для профилактики проказы и туберкулеза в Малави. Группа по профилактике заболеваний Каронги. Ланцет 348: 17–24.
- 9. Rodrigues LC, Pereira SM, Cunha SS, Genser B, Ichihara MY, et al.(2005) Влияние ревакцинации БЦЖ на заболеваемость туберкулезом у детей школьного возраста в Бразилии: кластерное рандомизированное исследование BCG-REVAC. Ланцет 366: 1290–1295.
- 10. (1995) Глобальная программа по борьбе с туберкулезом и Глобальная программа по вакцинам: Заявление о ревакцинации БЦЖ для профилактики туберкулеза. С. 229–236. КТО.
- 11. Black GF, Weir RE, Floyd S, Bliss L, Warndorff DK и др. (2002) БЦЖ-индуцированное усиление интерферон-гамма-ответа на микобактериальные антигены и эффективность вакцинации БЦЖ в Малави и Великобритании: два рандомизированных контролируемых исследования.Ланцет 359: 1393–1401.
- 12. Ellner JJ, Hirsch CS, Whalen CC (2000) Корреляты защитного иммунитета к Mycobacterium tuberculosis у людей. Clin Infect Dis 30: Suppl 3S279–282.
- 13. Kaufmann SH (2001) Как иммунология может способствовать борьбе с туберкулезом? Нат Рев Иммунол 1: 20–30.
- 14. Антонуччи Дж., Жирарди Э., Равильоне М.С., Ипполито Дж. (1995) Факторы риска туберкулеза у ВИЧ-инфицированных. Проспективное когортное исследование.Итальянская группа студий туберкулеза и СПИДа (GISTA). ИАМА 274: 143–148.
- 15. Selwyn PA, Hartel D, Lewis VA, Schoenbaum EE, Vermund SH и др. (1989) Проспективное исследование риска туберкулеза среди потребителей инъекционных наркотиков с инфекцией вируса иммунодефицита человека. N Engl J Med 320: 545–550.
- 16. Талли Г., Кортик С., Хон Х., Зебе И., Хитцлер В.Е. и др. (2005) Высокоточные Т-клеточные ответы при латентной инфекции легких Mycobacterium tuberculosis человека.J Immunol 174: 2174–2184.
- 17. van Pinxteren LA, Cassidy JP, Smedegaard BH, Agger EM, Andersen P (2000) Контроль латентной инфекции Mycobacterium tuberculosis зависит от CD8 T-клеток. Eur J Immunol 30: 3689–3698.
- 18. Флинн Дж. Л. (2004) Иммунология туберкулеза и значение для разработки вакцины. Туберкулез (Edinb) 84: 93–101.
- 19. Белисл Дж. Т., Висса В. Д., Зиверт Т., Такаяма К., Бреннан П. Дж. И др. (1997) Роль основного антигена Mycobacterium tuberculosis в биогенезе клеточной стенки.Наука 276: 1420–1422.
- 20. D’Souza S, Rosseels V, Romano M, Tanghe A, Denis O и др. (2003) Картирование мышиных Th2-хелперных Т-клеточных эпитопов миколилтрансфераз Ag85A, Ag85B и Ag85C из Mycobacterium tuberculosis. Infect Immun 71: 483–493.
- 21. Хюйген К., Контент Дж., Денис О., Монтгомери Д.Л., Яман А.М. и др. (1996) Иммуногенность и защитная эффективность ДНК-вакцины против туберкулеза. Nat Med 2: 893–898.
- 22. Лаунуа П., ДеЛейз Р., Нианг М.Н., Дроуарт А., Андриен М. и др.(1994) Картирование Т-клеточного эпитопа основного секретируемого микобактериального антигена Ag85A при туберкулезе и лепре. Инфекция иммунной 62: 3679–3687.
- 23. McShane H, Behboudi S, Goonetilleke N, Brookes R, Hill AV (2002) Защитный иммунитет против Mycobacterium tuberculosis, индуцированный дендритными клетками, пульсирующими CD8 (+) — и CD4 (+) — Т-клеточными эпитопами антигена 85A. Заражение иммунной 70: 1623–1626.
- 24. МакШейн Х., Патан А.А., Сандер С.Р., Китинг С.М., Гилберт С.К. и др.(2004) Рекомбинантный модифицированный вирус осповакцины Анкара, экспрессирующий антиген 85А, усиливает у людей иммунитет к антимикобактериям, примированный БЦЖ и приобретенный естественным путем. Нат Мед 10: 1240–1244.
- 25. Джин Х, Робертс К.Г., Никсон Д.Ф., Сафрит Дж.Т., Чжан Л.К. и др. (2000) Идентификация субдоминантных эпитопов цитотоксических Т-лимфоцитов, кодируемых аутологичными последовательностями ВИЧ типа 1, с использованием стимуляции дендритных клеток и компьютерного алгоритма. Ретровирусы AIDS Res Hum 16: 67–76.
- 26. Ларссон М., Мессмер Д., Сомерсан С., Фонтено Дж. Ф., Донахью С. М. и др.(2000) Необходимость зрелых дендритных клеток для эффективной активации CD8 + Т-клеток, специфичных для гриппа A. J Immunol 165: 1182–1190.
- 27. Ларссон М., Вилкенс Д. Т., Фонтено Дж. Ф., Бидл Т. Дж., Мерритт М. Дж. И др. (2002) Усиление низкочастотных ответов Т-лимфоцитов CD8 с использованием аутологичных дендритных клеток. СПИД 16: 171–180.
- 28. Shacklett BL, Means RE, Larsson M, Wilkens DT, Beadle TJ и др. (2002) Амплификация дендритными клетками ответов CD8 + Т-клеток, специфичных к ВИЧ 1-го типа, у подвергшихся воздействию серонегативных гетеросексуальных женщин.Ретровирусы AIDS Res Hum 18: 805–815.
- 29. Banchereau J, Steinman RM (1998) Дендритные клетки и контроль иммунитета. Природа 392: 245–252.
- 30. Смит С.М., Брукс Р., Кляйн М.Р., Малин А.С., Люки П.Т. и др. (2000) CD8 + CTL человека, специфичные для основного секретируемого антигена 85А микобактерий. J Immunol 165: 7088–7095.
- 31. Субклеве М., Чахруди А., Шмальджон А., Курилла М.Г., Бхардвадж Н. и др. (1999) Индукция специфических для вируса Эпштейна-Барра цитотоксических ответов Т-лимфоцитов с использованием дендритных клеток, обработанных пептидами EBNA-3A или УФ-инактивированным рекомбинантным вирусом осповакцины EBNA-3A.Кровь 94: 1372–1381.
- 32. Коновер WJ (1980) Практическая непараметрическая статистика Джон Вили и сыновья, Нью-Йорк.
- 33. Брандт Л., Фейно Кунья Дж., Вайнрайх Олсен А., Чилима Б., Хирш П. и др. (2002) Неудача вакцины БЦЖ против Mycobacterium bovis: некоторые виды микобактерий окружающей среды блокируют размножение БЦЖ и индукцию защитного иммунитета против туберкулеза. Infect Immun 70: 672–678.
- 34. Derrick SC, Yang AL, Morris SL (2005) Вакцинация ДНК-вакциной на основе вируса Синдбис, экспрессирующей антиген 85B, индуцирует защитный иммунитет против Mycobacterium tuberculosis.Заражение иммунной 73: 7727–7735.
- 35. Лалвани А., Брукс Р., Уилкинсон Р.Дж., Малин А.С., Патан А.А. и др. (1998) Цитолитические и интерферон-гамма-секретирующие CD8 + Т-лимфоциты человека, специфичные для Mycobacterium tuberculosis. Proc Natl Acad Sci U S A 95: 270–275.
- 36. Смит С.М., Малин А.С., Полин Т., Люки, Аткинсон С.Е. и др. (1999) Характеристика человеческой бациллы Mycobacterium bovis, реактивных CD8 + Т-клеток Кальметта-Герена. Инфекция иммунной 67: 5223–5230.
- 37.Turner J, Dockrell HM (1996) Стимуляция мононуклеарных клеток периферической крови человека живыми Mycobacterium bovis BCG активирует цитолитические CD8 + Т-клетки in vitro. Иммунология 87: 339–342.
- 38. Feng CG, Blanchard TJ, Smith GL, Hill AV, Britton WJ (2001) Индукция ответов CD8 + Т-лимфоцитов на секретируемый антиген Mycobacterium tuberculosis ослабленным вирусом осповакцины. Immunol Cell Biol 79: 569–575.
- 39. Serbina NV, Liu CC, Scanga CA, Flynn JL (2000) CD8 + CTL из легких мышей, инфицированных Mycobacterium tuberculosis, экспрессируют перфорин in vivo и лизируют инфицированные макрофаги.J Immunol 165: 353–363.
- 40. Фултон С.А., Мартин Т.Д., Редлайн Р.В., Генри Бум В. (2000) Легочные иммунные ответы во время первичной инфекции микобактериями bovis-Calmette-Guerin bacillus у мышей C57Bl / 6. Am J Respir Cell Mol Biol 22: 333–343.
- 41. Rhoades ER, Geisel RE, Butcher BA, McDonough S, Russell DG (2005) Липиды клеточной стенки из Mycobacterium bovis BCG являются воспалительными при инокулировании в гелевой матрице: характеристика новой модели гранулематозного ответа на микобактериальные компоненты.Туберкулез (Edinb) 85: 159–176.
- 42. Морел С., Баделл Э., Абади В., Робледо М., Сеттерблад Н. и др. (2008) Mycobacterium bovis, инфицированные BCG нейтрофилы и дендритные клетки, взаимодействуют, вызывая специфические Т-клеточные ответы у людей и мышей. Eur J Immunol 38: 437–447.
- 43. Davids V, Hanekom WA, Mansoor N, Gamieldien H, Gelderbloem SJ, et al. (2006) Влияние вакцинного штамма бациллы Кальметта-Герена и способ введения на индуцированные иммунные ответы у вакцинированных младенцев.Журнал Infect Dis 193: 531–536.
- 44. Мюррей Р.А., Мансур Н., Харбачески Р., Солер Дж., Дэвидс В. и др. (2006) Вакцинация новорожденных людей Bacillus Calmette Guerin вызывает специфический функциональный CD8 + Т-клеточный ответ. J Immunol 177: 5647–5651.
- 45. Беверидж NE, Price DA, Casazza JP, Pathan AA, Sander CR и др. (2007) Иммунизация БЦЖ и рекомбинантным MVA85A индуцирует длительные полифункциональные популяции CD4 + Т-лимфоцитов памяти, специфичные для Mycobacterium tuberculosis.



 Екатеринбурге в 2016-17 годах у непривитых от кори лиц.
Екатеринбурге в 2016-17 годах у непривитых от кори лиц.