От антибиотиков портится иммунитет? Что будет, если не закончить курс? Ответы на вопросы читателей «Медузы» об антибиотиках — Meduza
Fahroni / Shutterstock.com
В феврале мы попросили читателей задать нам вопросы об антибиотиках и всем, что с ними связано. Медицинский редактор Дарья Саркисян прочитала все три тысячи вопросов, выбрала самые популярные и интересные и ответила на них.
Антибиотики и противовирусные препараты — это разные вещи?
Коротко. Да.
Антибиотики — это препараты, которые борются с бактериями, то есть микроорганизмами, иногда вызывающими различные инфекции, например стрептококковую ангину, цистит, сифилис и многие другие. Антибиотики никак не могут повлиять на вирусы — инфекционные агенты, про которые до сих пор нет единого мнения, можно ли их назвать живыми. Вирусы становятся причиной острых респираторных вирусных инфекций (ОРВИ), ВИЧ-инфекции, кори и прочих. Для борьбы с некоторыми вирусами есть противовирусные препараты. Тех, что доказали свою эффективность, очень немного. Это, например, средства для борьбы с гепатитом C, вирусом простого герпеса и ВИЧ.
Тех, что доказали свою эффективность, очень немного. Это, например, средства для борьбы с гепатитом C, вирусом простого герпеса и ВИЧ.
Однако может быть так, что на фоне вирусной инфекции развивается бактериальная. Тогда действительно могут понадобиться антибиотики, но в качестве профилактики их назначают редко. Например, при ОРВИ такой подход не доказал свою эффективность. Однако врачи продолжают назначать антибиотики без показаний, даже при вирусных инфекциях, и на это есть несколько причин. Одна из главных — пациенты или их родственники ждут, что будет назначено какое-то лечение, хотя в действительности может не требоваться никаких препаратов. Так делают не только в России, но и в других странах. Например, в США и Великобритании.
От антибиотиков портится иммунитет?
Коротко. От обычных — нет.
Но бывают специальные препараты, которые подавляют развитие клеток. «Есть антибиотики, которые даже сначала цитостатики, а уже потом так называемые противоопухолевые антибиотики, — пишет в ответ на вопрос „Медузы“ аллерголог-иммунолог клиники „Рассвет“ (Москва) и основатель Центра доказательной медицины „Умка+“ (Ростов-на-Дону) Умар Хасанов.
Что будет если не закончить курс?
Коротко. Неизвестно.
Это сложный вопрос. До недавнего времени основные медицинские организации единодушно высказывались за то, что незаконченный курс антибиотиков ведет к появлению и распространению устойчивых к лекарствам бактерий. Потому что, если курс прервать раньше времени, только самые стойкие бактерии останутся в организме. Но в последние годы активно стали обсуждать, что, возможно, назначаемые курсы слишком длительные. С появлением новых данных рекомендации меняются, но вопрос «Можно ли не заканчивать курс антибиотиков?» все еще дискуссионный. Пока единого мнения нет, лучше следовать назначению грамотного врача.
Но проблема с нарастающей устойчивостью бактерий к антибиотикам остается. Уже есть такие микроорганизмы, которые устойчивы ко всем лекарствам. И это связывают с избыточным использованием антибиотиков и у людей, и в сельском хозяйстве. Один из способов предотвратить применение этих препаратов — вакцинация.
Какие антибиотики эффективнее — в таблетках или уколах?
Коротко. Без разницы.
Если человек может глотать и у него нет рвоты, то лучше обойтись без внутривенного или внутримышечного введения. Это справедливо и для многих других препаратов — не только антибиотиков. Дело в том, что зачастую эффект от лекарства одинаковый, а прием через рот не связан с различными неприятными последствиями вроде абсцессов, гематом и повреждения нервов. Не говоря уже о том, что внутримышечные инъекции и капельницы — это обычно больно.
Антибиотики «сажают» печень?
Коротко. Иногда.
Некоторые антибиотики действительно могут привести к повреждению печени — острому или хроническому. По разным оценкам, лекарства (все вместе, не только антибиотики) приводят к такому результату в 10–15 случаях на 10–100 тысяч человек, принимающих рецептурные препараты. Но обычно все в таких случаях заканчивается хорошо, особенно если вовремя обратить внимание на симптомы, которые могут быть неспецифичными (тошнота, сыпь, головная боль) или более характерными (темная моча, желтуха). Впрочем, их часто не бывает, поэтому врач может назначать некоторые анализы с определенной периодичностью, чтобы вовремя выявить изменения. Чаще остальных антибиотиков к такому эффекту приводит сочетание амоксициллина и клавулановой кислоты, которое используется, в частности, при среднем отите, пневмонии и риносинусите.
По разным оценкам, лекарства (все вместе, не только антибиотики) приводят к такому результату в 10–15 случаях на 10–100 тысяч человек, принимающих рецептурные препараты. Но обычно все в таких случаях заканчивается хорошо, особенно если вовремя обратить внимание на симптомы, которые могут быть неспецифичными (тошнота, сыпь, головная боль) или более характерными (темная моча, желтуха). Впрочем, их часто не бывает, поэтому врач может назначать некоторые анализы с определенной периодичностью, чтобы вовремя выявить изменения. Чаще остальных антибиотиков к такому эффекту приводит сочетание амоксициллина и клавулановой кислоты, которое используется, в частности, при среднем отите, пневмонии и риносинусите.
Нужно ли принимать пробиотики или есть йогурт, чтобы не было диареи от антибиотиков?
Коротко. Их эффективность не доказана.
Антибиотики убивают не только бактерии, вызвавшие инфекцию, но и те, что живут в организме и помогают ему функционировать. Это может привести к достаточно неприятным и даже опасным последствиям. Бывает, что все заканчивается несколькими случаями диареи во время курса антибиотиков. Но иногда у человека развивается инфекция, вызванная бактерией
Это может привести к достаточно неприятным и даже опасным последствиям. Бывает, что все заканчивается несколькими случаями диареи во время курса антибиотиков. Но иногда у человека развивается инфекция, вызванная бактерией
Главный кандидат — пробиотики, то есть микроорганизмы, которые, как предполагается, могут принести пользу здоровью. Они могут продаваться как БАДы или же в составе некоторых продуктов (например, йогуртов). Пока недостаточно данных для того, чтобы врачи могли рекомендовать их в качестве профилактики одного из самых серьезных последствий приема антибиотиков — инфекции, вызванной бактерией 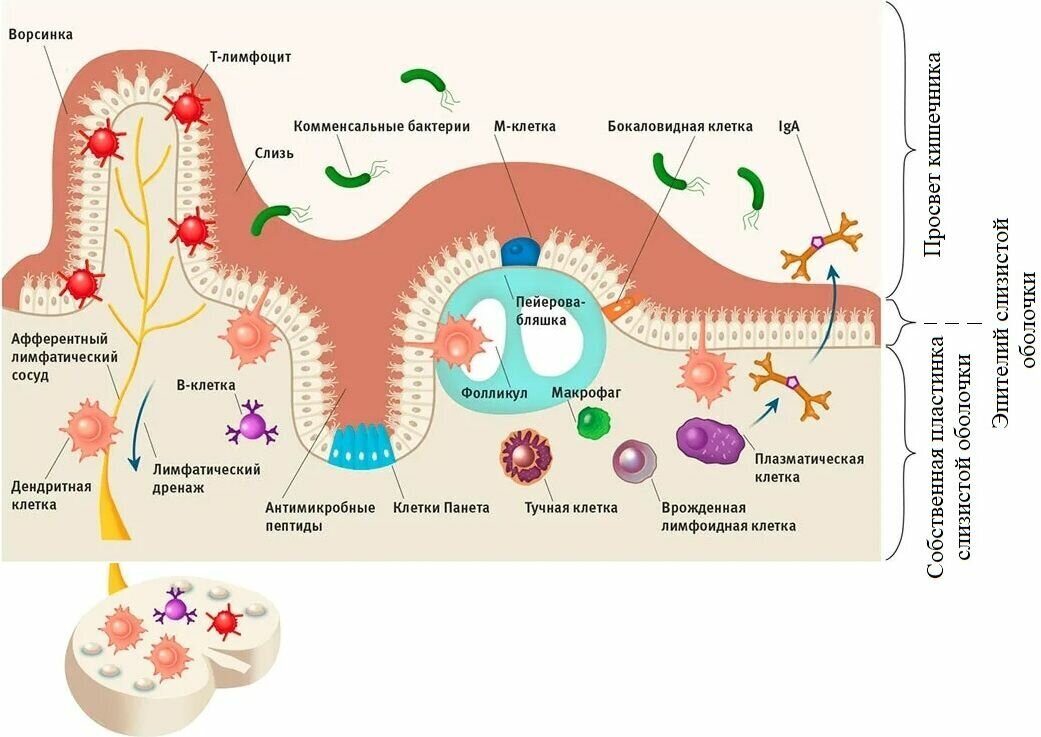 Хотя есть некоторые данные, что такой подход может сработать у определенных групп пациентов. Но результаты исследований, которые есть для одних штаммов, нельзя применять к другим. Кроме того, тяжелобольным людям пробиотики могут навредить. Эффективность пробиотиков против диареи, вызванной антибиотиками, не доказана.
Хотя есть некоторые данные, что такой подход может сработать у определенных групп пациентов. Но результаты исследований, которые есть для одних штаммов, нельзя применять к другим. Кроме того, тяжелобольным людям пробиотики могут навредить. Эффективность пробиотиков против диареи, вызванной антибиотиками, не доказана.
Бактериофаги могут заменить антибиотики?
Коротко. Пока неизвестно.
Бактериофаги — это вирусы, которые борются с бактериями. Их активно использовали в Советском Союзе; в Европе и Америке они стали популярны относительно недавно, но преимущественно среди основателей стартапов. Врачи используют бактериофаги в крайнем случае, когда бактерии устойчивы к известным антибиотикам. И результат не всегда успешный, даже несмотря на то, что бактериофаги подбираются для каждого пациента отдельно. Часть предварительных исследований с переменным успехом показывает эффективность бактериофагов, однако в рекомендации врачебных организаций их пока нет.
Почему нельзя самому подобрать антибиотик?
Коротко. Нужно учесть очень много факторов.
Подбор антибиотика зависит не только от диагноза (который еще нужно правильно поставить) — влияет и то, чем человек лечился раньше, есть ли у него противопоказания, где он живет и, в некоторых случаях, каковы лабораторные результаты чувствительности бактерий к антибиотикам. Иногда даже при подтвержденной бактериальной инфекции врач может не назначить ничего: от наблюдения будет потенциально больше пользы, чем от лекарственных средств с возможными нежелательными реакциями. Такие моменты прописаны в руководствах национальных и международных врачебных сообществ. Из-за всех этих факторов антибиотики иногда рекомендуют принимать не так, как указано в инструкции в упаковке (хотя такое решение достаточно спорно с юридической точки зрения).
Кроме того, в России в продаже есть антибиотики, которые не продемонстрировали свою эффективность и безопасность в соответсвии со стандартами доказательной медицины как минимум в той области, в которой по инструкции рекомендуются к применению. Например, грамицидин С (входит в состав «Граммидина» и «Софрадекса»). Также до 2016 года можно было купить «Биопарокс» (фузафунгин), затем его продажу запретили из-за нежелательных реакций. Некоторые антибиотики рекомендуется использовать в виде спреев при насморке, хотя в современных руководствах по лечению этого состояния ничего подобного нет.
Например, грамицидин С (входит в состав «Граммидина» и «Софрадекса»). Также до 2016 года можно было купить «Биопарокс» (фузафунгин), затем его продажу запретили из-за нежелательных реакций. Некоторые антибиотики рекомендуется использовать в виде спреев при насморке, хотя в современных руководствах по лечению этого состояния ничего подобного нет.
Как правильно утилизировать просроченные антибиотики?
Коротко. Их нельзя просто выбрасывать.
В России для пациентов нет способа правильно избавиться от лекарств, не навредив окружающей среде. Например, в США их централизованно принимают в специальных пунктах. В издании Recycle считают, что «на данный момент единственный способ правильно утилизировать лекарственные средства из домашней аптечки — это „пристроить“ их знакомым из частной клиники, которые могут оформить вашу просрочку вместе со своими отходами». В остальных случаях нужно просто сделать так, чтобы лекарства случайно не оказались доступны животным или детям.
Дарья Саркисян
Редакция благодарит за помощь в подготовке материала Тэю Розину, гепатолога Клиники нефрологии, внутренних и профессиональных болезней им. Е. М. Тареева и клиники «Рассвет».
Влияние антибиотиков на функционирование иммунной системы
Малгожата Поморска—Муль.
Государственный институт ветеринарии – Государственный исследовательский институт в Пулавах.
Антибиотики, особенно часто используются в терапии заболеваний свиней. Чаще всего При применении антибиотиков мы чаще думаем об их терапевтическом действии, связанным с бактерицидной или бактериостатической активностью. В тоже время редко обсуждаются вопросы, связанные с другими свойствами препаратов этой группы. Исследования показывают, что антибиотики, кроме очевидного действия на микробы, могут влиять на иммунную систему хозяина, как на неспецифический, так и специфический иммунитет. С учетом этого, антибиотикотерапия не может рассматриваться только как взаимодействие на уровне патоген-лекарство.
С учетом этого, антибиотикотерапия не может рассматриваться только как взаимодействие на уровне патоген-лекарство.
Вопросом влияния антибиотиков на иммунную систему занимались многие исследователи. Было установлено, что они могут оказывать на организм токсичное и иммунотоксичное действие.
Антибактериальные препараты используются в терапии из-за своих бактерицидных или бактериостатических свойств. Тип воздействия данной субстанции на микроорганизм, зависит от механизма ее действия, а также от концентрации и времени экспозиции. У разных противомикробных препаратов разный диапазон активности. К наиболее известным явлениям, связанным с действиями антибиотиков, относятся противовоспалительные и иммуномодулирующие свойства, влияющие на функционирование иммунной системы, что будет рассмотрено в этой статье.
Влияние антибиотиков на неспецифический иммунитет
Влияние на функционирование иммунной системы, а именно на неспецифический иммунитет, подтверждено в отношении нескольких антибиотиков из различных групп. Некоторые антибактериальные препараты могут модифицировать функции фагоцитов, меняяпроизводство маркеров и противовоспалительных цитокинов, а также окислительные процессы («кислородный взрыв»). Было доказано, что некоторые антибиотики могут влиять на морфологию, метаболизм и/или вирулентность патогенов, делая их более чувствительными к воздействию клеток иммунной системы. Примером может быть Полимиксин B, который оказывает антиэндотоксическое действие. Это соединение, благодаря связыванию с, так называемым, липидом А, являющимся токсичной частью ЛПС (липополисахарида), нейтрализует активность эндотоксинов. Благодаря этому можно погасить воспаления в организме. Интересно также влияние антибиотиков на активность лейкоцитов и макрофагов в процессе фагоцитоза. Одним из предложенных объяснений явлений, связанных с изменением функционирования фагоцитов конкретным антибиотиком, является влияние на кислородные процессы и нарушение функции систем, продуцирующих свободные радикалы в фагоцитах. За неспецифическое уничтожение патогенов отвечают процессы, генерирующие анионные радикалы.
Некоторые антибактериальные препараты могут модифицировать функции фагоцитов, меняяпроизводство маркеров и противовоспалительных цитокинов, а также окислительные процессы («кислородный взрыв»). Было доказано, что некоторые антибиотики могут влиять на морфологию, метаболизм и/или вирулентность патогенов, делая их более чувствительными к воздействию клеток иммунной системы. Примером может быть Полимиксин B, который оказывает антиэндотоксическое действие. Это соединение, благодаря связыванию с, так называемым, липидом А, являющимся токсичной частью ЛПС (липополисахарида), нейтрализует активность эндотоксинов. Благодаря этому можно погасить воспаления в организме. Интересно также влияние антибиотиков на активность лейкоцитов и макрофагов в процессе фагоцитоза. Одним из предложенных объяснений явлений, связанных с изменением функционирования фагоцитов конкретным антибиотиком, является влияние на кислородные процессы и нарушение функции систем, продуцирующих свободные радикалы в фагоцитах. За неспецифическое уничтожение патогенов отвечают процессы, генерирующие анионные радикалы. Они могут быть также причиной очень сильного воспалительного процесса (как местного, так и общего). Примерами антибиотиков, ингибирующих выработку свободных радикалов, являются тетрациклины, пенициллины G, аминопенициллины, цефалоспорины. Некоторые антибиотики влияют на производства отдельных свободных радикалов, другие на весь путь активации окислительных ферментов.
Они могут быть также причиной очень сильного воспалительного процесса (как местного, так и общего). Примерами антибиотиков, ингибирующих выработку свободных радикалов, являются тетрациклины, пенициллины G, аминопенициллины, цефалоспорины. Некоторые антибиотики влияют на производства отдельных свободных радикалов, другие на весь путь активации окислительных ферментов.
Последние исследования показали, что некоторые антибиотики регулируют иммунный ответ, воздействуя на рецепторы Toll-like (TLR), на экспрессию цитокинов и на фагоцитоз. Марбофлоксацин, доксициклин, и эритромицин обладают особенно сильными иммуномодулирующими свойствами и должны быть детально изучены с этой точки зрения, например, в аспекте их использования в лечении сепсиса и других состояний, протекающих с сильным воспалительным процессом.
Из множества групп факторов антибактериальных препаратов к наиболее изученным в аспекте иммуномодулирующего и/или противовоспалительного действия относят препараты группы макролидов, тетрациклинов и сульфонамид.
Остальные группы химиотерапевтических препаратов, т. е. аминогликозиды, хинолоны, бета-лактамы и др., также обладают некоторыми иммуномодулирующими свойствами, но их клиническое значение, как иммуномодуляторов, в настоящее время сравнительно мало изучено. Исследования в этой области чрезвычайно ценны и необходимы.
Макролиды — это группа, включающая в себя ряд природных и полусинтетических антибактериальных соединений. Предполагается, что в основном макролиды с 14- и 15-членным кольцом (в том числе эритромицин и его производные, азитромицин, тулатромицин) имеют значимые иммуномодулирующие и противовоспалительные свойства. Большой интерес к этой группе лекарственных средств в основном связан с их широким спектром действия и низком риске побочных эффектов, по сравнению с другими антибактериальными препаратами.
Эффект воздействия макролидов, в значительной степени зависит от дозы и времени их применения. Считает, что в краткосрочной терапии макролиды усиливают иммунный ответ, что очень важно при инфекционных заболеваниях. А в случае длительного применения, особенно в концентрациях ниже ингибирующих рост микроорганизмов, они могут вызывать иммуносупрессию, противовоспалительное и противоастматическое действие. Макролиды, как иммуностимуляторы, блокируя хемотаксис нейтрофилов к месту воспаления, изменяют их активность, облегчают протекание хронических воспалительных процессов дыхательных путей. Они также ингибируют образование свободных радикалов или вылавливают уже возникшие, что защищает органы дыхания от их воздействия.
А в случае длительного применения, особенно в концентрациях ниже ингибирующих рост микроорганизмов, они могут вызывать иммуносупрессию, противовоспалительное и противоастматическое действие. Макролиды, как иммуностимуляторы, блокируя хемотаксис нейтрофилов к месту воспаления, изменяют их активность, облегчают протекание хронических воспалительных процессов дыхательных путей. Они также ингибируют образование свободных радикалов или вылавливают уже возникшие, что защищает органы дыхания от их воздействия.
Было доказано, что макролиды могут стимулировать фагоцитоз, ускорять и облегчать дифференциацию макрофагов, а также увеличивать киллерную активность макрофагов. В зависимости от концентрации антибиотика и длительность терапии, макролиды могут вызвать существенное снижение кислородных взрывов в фагоцитах, снижать (реже повышать) производство и высвобождение провоспалительных факторов (TNF-a, TNF-γ, IL-1, IL-6, IL-8, IL-10) из лейкоцитов и клеток дыхательного эпителия. Одним из предложенных механизмов, объясняющих описанные выше действия макролидов, является их непосредственное влияние на путь протеинкиназы (PKC) или путь фосфолипазы — фосфогидролазы (PLD-PPH), являющихся частью процесса трансдукции. Это возможно благодаря тому, что макролиды биоаккумулируются в эукариотических клетках, в том числе в лейкоцитах и макрофагах, благодаря чему они могут эффективнее, чем остальные группы антибиотиков, воздействовать на функции иммунных клеток. Кроме того, допускается, что макролиды, как линкозамиды, влияют на регуляцию экспрессии генов, участвующих в синтезе цитокинов в эукариотических клетках, в частности, подавляют активность транскрипционного ядерного фактора kB (NFkB) в T-клетках, стимулированных TNF и стафилоккоковый токсин (12). Они также могут привести к повышению цикличного уровня АМР, что может в некоторой степени объяснить влияние макролидов на снижение синтеза медиаторов воспаления (12). Подтверждено также ингибирующее действие макролидных антибиотиков на пролиферацию лимфоцитов.
Это возможно благодаря тому, что макролиды биоаккумулируются в эукариотических клетках, в том числе в лейкоцитах и макрофагах, благодаря чему они могут эффективнее, чем остальные группы антибиотиков, воздействовать на функции иммунных клеток. Кроме того, допускается, что макролиды, как линкозамиды, влияют на регуляцию экспрессии генов, участвующих в синтезе цитокинов в эукариотических клетках, в частности, подавляют активность транскрипционного ядерного фактора kB (NFkB) в T-клетках, стимулированных TNF и стафилоккоковый токсин (12). Они также могут привести к повышению цикличного уровня АМР, что может в некоторой степени объяснить влияние макролидов на снижение синтеза медиаторов воспаления (12). Подтверждено также ингибирующее действие макролидных антибиотиков на пролиферацию лимфоцитов.
В исследованиях in vitro с использованием фагоцитирующих куриных клеток было доказано, что тилмикозин, благодаря своей липофильной природе, накапливается в фагоцитирующих клетках и приводит к увеличению их липосомальной активности.
Следующая группа антибиотиков, представители которой, как было доказано, влияют на иммунную систему – тетрациклины. Полезные противомикробные свойства и отсутствие серьезных побочных эффектов способствуют их широкому применению при лечении бактериальных инфекций людей и животных. Кроме того, эти антибиотики в течение длительного времени использовались в животноводстве, как стимуляторы роста (АСР) сельскохозяйственных животных. С 1 января 2006 года в Европейском Союзе действует запрет на использование АСР.
В группе тетрациклинов мы выделяем природные и синтетические антибиотики. К природным тетрациклинам относятся: хлортетрациклин, окситетрациклин, тетрациклин и демеклоциклин, а к полисинтетическим тетрациклинам относят, метациклин, доксициклин, миноциклин и ролитетрациклин. Тетрациклины можно разделить на 3 поколения: антибиотики первого поколения, открытые в 1948-1963, второго поколения – 1965-1972 г. и тетрациклины третьего поколения с 90-х годов XX века. Согласно другому разделению, можно выделить тетрациклины нового поколения (например: доксициклин, ролитетрациклин) и тетрациклины старого поколения (например: хлортетрациклин, окситетрациклин, тетрациклин). Препараты нового поколения характеризуются лучшим всасыванием после перорального применения и длительным нахождением в организме.
Препараты нового поколения характеризуются лучшим всасыванием после перорального применения и длительным нахождением в организме.
Кроме хорошо изученного антибактериального воздействия, было доказано, что препараты этой группы имеют иммуномодулирующие и противовоспалительные свойства. Побочные действия тетрациклинов лучше всего проявляются процессами ингибирования функций фагоцитов. Лекарства этой группы могут влиять на снижение активности некоторых ферментов, в частности, эластазы, коллагеназы, желатиназы, выделяемых нейтрофилами или трансформированными клетками. Они снижают также синтез оксида азота и реактивных свободных радикалов в гранулоцитах.
Было доказано, что тетрациклины в своем большинстве подавляют секрецию воспалительных цитокинов. Кажется, что это явление может быть связано с хелатированием двухвалентных ионов Ca2+ и Mg2+ или связыванием электронов и утилизацией супер активных радикалов HOCl из многоядерных лейкоцитов. Была доказана положительная корреляция между силой торможения синтеза различных провоспалительных факторов и хемокинов, и гидрофобными свойствами антибиотиков из этой группы и степенью накопления антибиотика внутри фагоцитов. В этом отношении антибиотиком с самыми выраженными свойствами считается доксициклин.
В этом отношении антибиотиком с самыми выраженными свойствами считается доксициклин.
Ряд исследований в этой области также касается сульфонамидов и триметоприма. Препараты этих групп блокируют путь синтеза фолиевой кислоты ингибируя активность дигидроксистероидной синтетазы или редуктазы дигидрофолиевой кислоты. Было доказано, что триметоприм отдельно, или в комбинации с сульфонамидами (например, сульфаметоксазолом) проявляет сильнейшее моделирующее действие на функции многоядерных лейкоцитов. Это соединение ингибирует хемотаксис нейтрофилов ингибируя пути PLD-PPH, что приводит к подавлению выработки свободных радикалов, а также влияет на функционирование цитоплазматических мембран. К сожалению, все перечисленные эффекты наблюдаются при применении доз, превышающих терапевтические концентрации, что на практике исключает применение триметоприма, в качестве иммуномодулирующего вещества. Сульфаниламиды, в том числе сульфасалазин и сульфаметоксазол, ингибируют фагоцитарные процессы в клетках.
Влияние антибиотиков на специфический иммунитет
Влияние антибиотиков на специфический иммунный ответ сравнительно мало изучено. Данные, касающиеся того, модулируют ли, антибиотики специфический иммунный ответ достаточно ограничены, но, известно, что существует зависимость между антибиотикотерапией и продукцией специфических антител, а также образованием Т-лимфоцитов.
Халифа и др. исследовали влияние антибиотикотерапии при вакцинации кур против болезни Ньюкасла (ND) на иммунный ответ к вирусу болезни Ньюкасла (NDV). Оказалось, что тилкомизин, фторфеникоа, а также энрофлоксацин снижали синтез специфических антител к NDV. Кроме того, при применении антибиотиков перорально было отмечено влияние на клеточный иммунитет. Это было связано, скорее всего, с прямым воздействием антибиотиков на физиологическую флору желудочно-кишечного тракта и изменение ее состава.
Рошковски и др, продемонстрировали, что бета-лактамные антибиотики ингибировали гуморальный и клеточный иммунный ответ. Кроме того, существенно нарушали пролиферативную активность лимфоцитов. Супрессия гуморального и клеточного ответа наблюдалась также при 7-дневном лечении цефотаксимом и амикацином, но в гораздо меньшей степени, чем это имело место при применении пиперациллина и мезоцилина. Кроме того, показатели иммунного ответа быстрее возвращались в норму.
Кроме того, существенно нарушали пролиферативную активность лимфоцитов. Супрессия гуморального и клеточного ответа наблюдалась также при 7-дневном лечении цефотаксимом и амикацином, но в гораздо меньшей степени, чем это имело место при применении пиперациллина и мезоцилина. Кроме того, показатели иммунного ответа быстрее возвращались в норму.
Исследования иммуномодулирующего влияния тетрациклинов на специфический ответ проводились несколькими научно-исследовательскими группами. Белласене и др. исследовали влияние доксициклина на специфическую реакцию клеток у мышей. У животных, которым давали доксициклин в дозе, соответствующей терапевтической дозе для человека, наблюдалось существенное снижение титров специфических антител. Исследование влияния доксициклина на поствакцинальный иммунный ответ проводили также на мышиной модели Воо и до. Кроме того, в своих исследованиях они использовали также кларитромицин и ампициллин. Результаты их исследований показали, что ранний специфический гуморальный ответ (IgM) на токсин столбняка, пневмококков и вируса гепатита B, был нарушен у мышей, получавших кларитромицин и доксициклин. Как показывают результаты ранее опубликованных исследований как кларитромицин, как и доксициклин, in vitro, могут ингибировать продукцию цитокинов T-лимфоцитами. Это явление полностью не объясняет ингибирование гуморального иммунного ответа после применения указанных антибиотиков, так как более низкие титры антител наблюдались также в отношении Т-независимого антигена. Кроме того, было доказано, что у мышей, получавших кларитромицин и вирус гепатита B, нарушилось также производство специфических антител класса IgG1 к этому вирусу. Что интересно, не наблюдалось негативного влияния после одновременного введения кларитромицина и других исследованных антигенов на производство и поддержание антител класса IgG1. Более того, после вакцинации мышей живым аттенуированным штаммом S. typhi, титр антител был выше у животных, получавших одновременно кларитромицин, ампициллин или доксициклин. Таким образом, кажется, что воздействие данного антибиотика на специфический, поствакцинальный иммунный ответ может зависеть не только от самого используемого препарата, но также и от типа антигена (вакцины).
Как показывают результаты ранее опубликованных исследований как кларитромицин, как и доксициклин, in vitro, могут ингибировать продукцию цитокинов T-лимфоцитами. Это явление полностью не объясняет ингибирование гуморального иммунного ответа после применения указанных антибиотиков, так как более низкие титры антител наблюдались также в отношении Т-независимого антигена. Кроме того, было доказано, что у мышей, получавших кларитромицин и вирус гепатита B, нарушилось также производство специфических антител класса IgG1 к этому вирусу. Что интересно, не наблюдалось негативного влияния после одновременного введения кларитромицина и других исследованных антигенов на производство и поддержание антител класса IgG1. Более того, после вакцинации мышей живым аттенуированным штаммом S. typhi, титр антител был выше у животных, получавших одновременно кларитромицин, ампициллин или доксициклин. Таким образом, кажется, что воздействие данного антибиотика на специфический, поствакцинальный иммунный ответ может зависеть не только от самого используемого препарата, но также и от типа антигена (вакцины).
Другие исследователи доказали, что фторхинолоны, моксифлоксацин и ципрофлоксацин имеют выраженное влияние на экспрессию цитокинов, вырабатываемых лимфоцитами Th2 и Th3, без влияния на отношение друг к другу обоих популяций, в то время как кларитромицин вызывает меньшую секрецию IL-4, что приводит к росту показателя Th2/Th3 (увеличение числа лимфоцитов Th2). Лимфоциты хелперы (Th) выполняют очень важные функции как в процессах гуморального, так и клеточного иммунитета. Определенный тип иммунного ответа, связан, в частности, с дифференцированием себя прекурсоров вспомогательных Т-клеток (Th0) в клетки Th2 или Th3. Этот процесс в значительной степени зависит от локальных концентраций цитокинов, типа антигена и презентации антигена. Каждая субпопуляция клеток выделяет характерный профиль цитокинов, который вызывает дальнейшую дифференциацию определенной субпопуляции клеток. Лимфоциты Th2 продуцируют, прежде всего, IFN-γ, который стимулирует развитие клеточного иммунитета, а лимфоциты Th3 секретируют преимущественно IL-4 и способствуют тем самым развитию гуморального иммунитета. Таким образом, воздействуя на профиль цитокинов, выделяемых иммунологическими клетками, мы можем в определенной степени управлять иммунным ответом, так, чтобы он развивался в интересующем нас направлении.
Таким образом, воздействуя на профиль цитокинов, выделяемых иммунологическими клетками, мы можем в определенной степени управлять иммунным ответом, так, чтобы он развивался в интересующем нас направлении.
В данном аспекте влияние антибиотиков из группы цефалоспоринов (цефотаксим, цефодизим) проанализировал также Пулверер. на мышиной модели. Антибиотики вводились в дозах, соответствующих терапевтическим дозам, применяемым в медицине человека, в течение 7 дней. В ходе антибиотикотерапии мышей вакцинировали (внутрибрюшинно) модельным антигеном (эритроциты овцы, SRBC). Как показали результаты исследований, цефодизим, в отличие от цефотаксима, не нарушал производства специфических антител класса IgM и IgG, не имел он также влияния на клеточный иммунитет, оцениваемый с помощью пролиферативного анализа лимфоцитов и гиперчувствительности позднего типа. А вот у животных, получавших цефотаксим, наблюдалось значительное, продолжительное ингибирование выработки антител класса IgM и IgG, а также ослабление пролиферации лимфоцитов в ответ на знакомый антиген.
В исследованиях по обсуждаемому вопросу, проводимых на Кафедре Болезней Свиней в ГВИ-ГИИ в Пулавах, у свиней, которых вакцинировали во время проведения антибиотикотерапии, не было замечено отрицательного влияния доксициклина, применяемого в терапевтических дозах, на специфический гуморальный ответ, а в пролиферативном анализе (оценка специфического клеточного ответа) наблюдался ослабленный специфический ответ лимфоцитов, а также существенно более низкая секреция IFN-g в ответ на знакомый антиген. Не наблюдалось также влияния 7-дневной антибиотикотерапии на концентрации иммуноглобулинов всех классов в сыворотке крови, а также на параметры лейкоцитарной системы. Кроме того, мы доказали, что у свиней, получавших доксициклин, в ходе проведения вакцинации число дважды позитивных лимфоцитов CD4+CD8+ (эффекторные лимфоциты и лимфоциты иммунологической памяти) было существенно ниже по сравнению с контрольными свиньями (не получавшими антибиотики во время вакцинации).
Подводя итог, полученные результаты показали негативное влияние доксициклина на клеточный поствакцинальный ответ после применения в качестве модели живой вакцины против болезни Ауески (бА). Результаты очередного опыта показали, что энрофлоксацин, применяемый в период вакцинации, негативно влияет как на гуморальный, так и на клеточный поствакцинальный ответ (в отношении вируса бА). В случае вакцинации против гриппа свиней нарушается гуморальный ответ, но специфической пролиферации после стимуляции SIV не было зафиксировано ни в одной из вакцинированных групп. Было обнаружено также влияние энрофлоксацина на секрецию IL-6, IL-10 и TNF-α из-за PBMC после стимуляции вирусом бА. Не было замечено влияния энрофлоксацина на параметры лейкоцитарной системы (число и процент лимфоцитов, гранулоцитов), а также на концентрацию иммуноглобулинов в сыворотке крови. Было показано также, что этот химиотерапевтический препарат влияет на численность отдельных субпопуляций лимфоцитов у свиней (снижение числа и процента лимфоцитов CD8+).
Результаты очередного опыта показали, что энрофлоксацин, применяемый в период вакцинации, негативно влияет как на гуморальный, так и на клеточный поствакцинальный ответ (в отношении вируса бА). В случае вакцинации против гриппа свиней нарушается гуморальный ответ, но специфической пролиферации после стимуляции SIV не было зафиксировано ни в одной из вакцинированных групп. Было обнаружено также влияние энрофлоксацина на секрецию IL-6, IL-10 и TNF-α из-за PBMC после стимуляции вирусом бА. Не было замечено влияния энрофлоксацина на параметры лейкоцитарной системы (число и процент лимфоцитов, гранулоцитов), а также на концентрацию иммуноглобулинов в сыворотке крови. Было показано также, что этот химиотерапевтический препарат влияет на численность отдельных субпопуляций лимфоцитов у свиней (снижение числа и процента лимфоцитов CD8+).
Результаты очередного этапа исследований показали, что сертиофур, применяемый свиньями в период проведения вакцинации, негативно влияет как на гуморальный, так и на клеточный поствакцинальный ответ (в отношении вируса бА). В случае инактивированной вакцины от гриппа нарушался только гуморальный ответ. Было выявлено также негативное влияние сертиофура на секрецию IFN-γ из-за PBMC после стимуляции вирусом бА. В тоже время не было выявлено влияния на количество и процент лимфоцитов и нейтрофилов, а также на концентрацию отдельных классов иммуноглобулинов в сыворотке крови. В цитометрическом анализе было показано существенное снижение числа и процента лимфоцитов CD8+ и CD4+CD8+ у свиней, получавших сертиофур.
В случае инактивированной вакцины от гриппа нарушался только гуморальный ответ. Было выявлено также негативное влияние сертиофура на секрецию IFN-γ из-за PBMC после стимуляции вирусом бА. В тоже время не было выявлено влияния на количество и процент лимфоцитов и нейтрофилов, а также на концентрацию отдельных классов иммуноглобулинов в сыворотке крови. В цитометрическом анализе было показано существенное снижение числа и процента лимфоцитов CD8+ и CD4+CD8+ у свиней, получавших сертиофур.
Результаты других исследований в этой области показывают, что вакцинация свиней от рожи при некоторых антибиотиках может вызвать снижение (сертиофур, доксициклин, тиамулин) или усиление (амоксициллин, тулатромицин) производства специфических антител.
Полученные результаты указывают на существенное, по большей части негативное, влияние исследуемых антибиотиков, примененных в терапевтических дозах, на развитие и/или сохранение поствакцинального гуморального и/или клеточного иммунитета. В связи с этим при планировании вакцинации свиней следует учесть возможные взаимодействия между иммунной системой и антибиотиками. Поскольку антибиотики широко применяются в лечении и метафилактике болезней животных, необходимы дальнейшие исследования, чтобы более точно оценить может ли влияние антибиотиков на иммунную систему иметь реальное клиническое значение в медицине и ветеринарии. Несмотря на то, что до сих пор данные об иммуномодулирующих свойствах антибиотиков являются неполными, однако, в большинстве опубликованных исследований было показано иммуносупрессивное воздействие антибиотиков в отношении специфического иммунного ответа in vivo, в том числе поствакцинального ответа. Кроме того, ряд антибиотиков имел противовоспалительное действие, которое может быть преимуществом в случае лечения хронических, системных или протекающих с острым воспалительным процессом инфекций. Учитывая представленные данные, при планировании рациональной химиотерапии, кроме спектра антибактериального действия, следует принимать во внимание также возможное влияние этого антибиотика на иммунную систему. В связи с тем, что точный механизм взаимодействия требует более глубокого выяснения, текущие данные должны быть толчком для дальнейших исследований, особенно в отношении практической ценности этих явлений и их клинических импликаций.
Поскольку антибиотики широко применяются в лечении и метафилактике болезней животных, необходимы дальнейшие исследования, чтобы более точно оценить может ли влияние антибиотиков на иммунную систему иметь реальное клиническое значение в медицине и ветеринарии. Несмотря на то, что до сих пор данные об иммуномодулирующих свойствах антибиотиков являются неполными, однако, в большинстве опубликованных исследований было показано иммуносупрессивное воздействие антибиотиков в отношении специфического иммунного ответа in vivo, в том числе поствакцинального ответа. Кроме того, ряд антибиотиков имел противовоспалительное действие, которое может быть преимуществом в случае лечения хронических, системных или протекающих с острым воспалительным процессом инфекций. Учитывая представленные данные, при планировании рациональной химиотерапии, кроме спектра антибактериального действия, следует принимать во внимание также возможное влияние этого антибиотика на иммунную систему. В связи с тем, что точный механизм взаимодействия требует более глубокого выяснения, текущие данные должны быть толчком для дальнейших исследований, особенно в отношении практической ценности этих явлений и их клинических импликаций.
Антибиотики снижают иммунную систему? – Healthycell
Вернуться в блог
12 июля 2022 г.
Антибиотики – это препараты, убивающие бактерии. Они десятилетиями использовались для лечения бактериальных инфекций и спасли бесчисленное количество жизней. Однако антибиотики не предназначены для лечения вирусных инфекций, таких как простуда или грипп, поскольку они не действуют против вирусов. Прием антибиотиков, когда в них нет необходимости, или их слишком частое использование может серьезно ослабить вашу иммунную систему. Давайте узнаем, почему.
Некоторые хорошие бактерии необходимы для поддержки вашей иммунной системы.
Вы, наверное, слышали, что антибиотики могут убивать плохие бактерии в вашем организме, но они также убивают некоторые хорошие бактерии в кишечнике, которые играют решающую роль в вашей иммунной системе. Ваше тело нуждается в этих хороших бактериях, чтобы иметь возможность бороться с инфекциями и другими проблемами со здоровьем.
Чтобы противостоять этому эффекту, принимайте антибиотики только по назначению и попробуйте делать уколы пробиотиков во время приема антибиотиков, чтобы стимулировать работу кишечника.
Чрезмерное использование антибиотиков может способствовать развитию устойчивости к антибиотикам.
Чрезмерное использование антибиотиков привело к растущей в мире проблеме: устойчивости к антибиотикам. Устойчивость к антибиотикам возникает, когда бактерии становятся невосприимчивыми к действию антибиотиков, что делает их неспособными бороться с инфекцией. Это растущая проблема как для людей, так и для животных с потенциально разрушительными последствиями для здоровья населения.
Устойчивость к антибиотикам также наблюдалась в окружающей среде, что способствовало ее глобальному распространению. Присутствие устойчивых бактерий на животноводческих фермах заставляет некоторых фермеров все больше полагаться на антибиотики, поскольку они ищут способы сохранить здоровье своих животных, избегая при этом вспышек заболеваний в стадах или стадах (коллекция домашних животных, содержащихся людьми). Хотя может показаться, что это поможет предотвратить распространение устойчивости к антибиотикам среди сельскохозяйственных животных, исследователи обнаружили, что использование антибиотиков в качестве универсального профилактического средства на самом деле может значительно способствовать созданию более устойчивых к лекарствам штаммов; если животные часто подвергаются воздействию низких доз этих препаратов в раннем возрасте (когда они меньше всего в них нуждаются), то у них вырабатывается больший иммунитет против них в более позднем возрасте, когда они наиболее остро нуждаются в защите, в том числе в периоды, когда вообще не существует вариантов лечения. !
Хотя может показаться, что это поможет предотвратить распространение устойчивости к антибиотикам среди сельскохозяйственных животных, исследователи обнаружили, что использование антибиотиков в качестве универсального профилактического средства на самом деле может значительно способствовать созданию более устойчивых к лекарствам штаммов; если животные часто подвергаются воздействию низких доз этих препаратов в раннем возрасте (когда они меньше всего в них нуждаются), то у них вырабатывается больший иммунитет против них в более позднем возрасте, когда они наиболее остро нуждаются в защите, в том числе в периоды, когда вообще не существует вариантов лечения. !
Ваша иммунная система зависит от вашего здоровья, поэтому прием антибиотиков без необходимости может нанести вам вред в долгосрочной перспективе.
Антибиотики используются для уничтожения бактерий, от которых люди заболевают. Антибиотики не предназначены для лечения вирусных инфекций, таких как простуда или грипп, поскольку они вызываются другим типом микроорганизмов, называемых вирусами. Когда вы принимаете антибиотик для лечения вирусного заболевания, такого как бронхит или острый фарингит, он не будет работать и может угнетать вашу иммунную систему, усугубляя вашу проблему.
Когда вы принимаете антибиотик для лечения вирусного заболевания, такого как бронхит или острый фарингит, он не будет работать и может угнетать вашу иммунную систему, усугубляя вашу проблему.
Согласно клиническим исследованиям, некоторые добавки могут повышать иммунитет, если принимать их в правильной дозе.
В случае с бузиной, витамином С, цинком и эхинацеей: если вы принимаете эти добавки в правильной дозе, чтобы они принесли пользу вашему организму (и вы следуете другим советам в этой статье) , то они могут помочь улучшить вашу иммунную систему. Однако, если вы не принимаете добавку с достаточной эффективностью или дозировкой, чтобы сделать что-то полезное для иммунитета вашего организма. Эффективные дозы научно обоснованных иммуностимулирующих ингредиентов включают:
Бузина:
Бузина содержит полифенолы, повышающие иммунитет, такие как антоцианы и флавоноиды. Он может помочь вам бороться с простудой и вирусными инфекциями, блокируя белки, необходимые вирусам для проникновения в ваши клетки. Это также может затруднить высвобождение вируса инфицированными клетками. Исследования показывают, что биофлавоноиды (например, содержащиеся в ягодах бузины) могут помочь вашему организму лучше усваивать витамин С, что также полезно для вашей иммунной системы.
Это также может затруднить высвобождение вируса инфицированными клетками. Исследования показывают, что биофлавоноиды (например, содержащиеся в ягодах бузины) могут помочь вашему организму лучше усваивать витамин С, что также полезно для вашей иммунной системы.
Я рекомендую ежедневно принимать 500 мг жидкого экстракта бузины для усиления иммунитета.
Эхинацея:
Эхинацея — это растение, обладающее лечебными свойствами. Некоторые соединения в растении могут помочь укрепить иммунную систему или обладают противовирусными свойствами.
Эхинацея не имеет официально признанной эффективной дозы, но некоторые исследования говорят, что 300-500 мг три раза в день будут работать для поддержания иммунитета. Эта доза будет такой же, как при приеме 9от 00 до 1500 мг ежедневно; однако большинство добавок предлагают только дозу 400 мг. Я рекомендую ежедневно принимать от 400 до 1200 мг высококачественного экстракта эхинацеи пурпурной, чтобы повысить иммунитет.
Витамин С:
Как и бузина и эхинацея, витамин С помогает уменьшить тяжесть и продолжительность простуды и других инфекций верхних дыхательных путей.
Витамин С является важным витамином, рекомендуемая суточная доза составляет 90 мг. Обычно вы можете найти его в добавках в более высоких дозах, например, 250–1000 мг. Он растворим в воде, поэтому ваше тело избавится от того, что ему не нужно, так что не беспокойтесь о том, что вы примете слишком много. Я рекомендую своим пациентам ежедневно принимать 1000 мг витамина С для повышения иммунитета.
Цинк:
Цинк является ключевым питательным веществом для здоровой иммунной системы. Это может помочь вам вылечиться от респираторных инфекций, таких как простуда, и может даже защитить вас от них.
Дефицит цинка довольно часто встречается у пожилых людей и связан с воспалением, проблемами с иммунитетом и повышенной восприимчивостью к инфекциям.
Я рекомендую принимать добавку цинка в составе поливитаминов или отдельно.
Бета-глюкан:
Бета-глюкан — это тип растворимой клетчатки, обнаруженной в нескольких различных вещах, таких как водоросли, дрожжи и растения.
Бета-глюкан привлек большое внимание медицинских работников за его способность изменять иммунную систему. Он известен своей способностью бороться с инфекциями, а также были проведены исследования его способности бороться с раком.
Я рекомендую придерживаться диеты с высоким содержанием бета-глюкана и принимать не менее 500 мг в день в виде добавок для поддержания иммунитета.
Использование назначенных антибиотиков вместе с определенными пищевыми добавками (включая пробиотики) может дать вам самый сильный ответ.
Попробуйте Immune Super Boost от Healthycell. Это гелеобразная добавка для приема внутрь с ультраабсорбирующим действием, содержащая эффективные дозы этих ингредиентов и многое другое. Его можно принимать прямо из гелевой упаковки, смешивать с напитком или даже добавлять в смузи. Система доставки MICROGEL™, которую она использует, становится будущим доставки пищевых добавок.
Его можно принимать прямо из гелевой упаковки, смешивать с напитком или даже добавлять в смузи. Система доставки MICROGEL™, которую она использует, становится будущим доставки пищевых добавок.
Заключение
Антибиотики важны для лечения бактериальных инфекций, но они также могут ослабить вашу иммунную систему при неправильном или слишком частом применении. Ваш врач должен назначать их только при необходимости и в умеренных количествах, что поможет защититься от любых будущих проблем с устойчивостью к антибиотикам. Попробуйте принимать пробиотики во время курса антибиотиков, чтобы поддержать кишечник, и научно обоснованные иммуностимулирующие добавки, чтобы поддержать активность лейкоцитов (иммунных клеток).
Об авторе
Доктор Джампапа — всемирно известный врач, изобретатель и хирург, специализирующийся на антивозрастной медицине. Недавно он был номинирован на Нобелевскую премию за новаторское исследование стволовых клеток, а также на премию Эдисона за пищевую добавку Healthycell для здоровья клеток. Он также был награжден премией A4M Science & Technology за разработку профиля матрицы биомаркеров — первой компьютерной программы для измерения старения. Узнайте больше о докторе Винсенте Джампапе.
Он также был награжден премией A4M Science & Technology за разработку профиля матрицы биомаркеров — первой компьютерной программы для измерения старения. Узнайте больше о докторе Винсенте Джампапе.
Теги:
- Иммунная система
Еще статьи
Вызывает ли высокое кровяное давление усталость?
В то время как высокое кровяное давление часто протекает бессимптомно, некоторые гипертензи…
ПодробнееМожет ли высокий уровень триглицеридов вызывать усталость?
Высокие уровни триглицеридов связаны со многими серьезными состояниями, которые могут вызвать утомление,…
ПодробнееДобавки, снижающие уровень триглицеридов
Добавление добавки для здоровья сердца к вашему ежедневному режиму может сыграть…
ПодробнееАнтибиотики изменяют инфекционную микросреду и могут снижать способность иммунных клеток убивать бактерии
Исследователи обнаружили, что у мышей антибиотики могут напрямую изменять биохимическую среду клеток во время инфекции, иногда пагубно.

Карен Зуси, Broad Communications
ЧТО ОНИ НАШЛИ
- Во время лечения мышей антибиотиками препараты вызывали метаболические реакции клеток-хозяев, которые действительно могли защищать бактерии
- Метаболиты, вызванные лечением антибиотиками, сделали антибиотик менее эффективным в уничтожении бактерий
- Воздействие антибиотиков снижает способность макрофагов поглощать и убивать бактерии
ПОЧЕМУ ЭТО ВАЖНО
- Взаимодействия между антибиотиками и их средой могут дать информацию для прогнозов того, как лекарство может действовать на разных людей или при различных инфекциях
- Перед лицом растущей угрозы устойчивости к антибиотикам понимание сложных событий после лечения антибиотиками имеет решающее значение для разработки более эффективных методов лечения
(Кембридж, Массачусетс) — Антибиотики обычно действуют совместно с иммунной системой организма для устранения инфекции. Однако препараты могут иметь широкий спектр побочных эффектов, включая уничтожение «хороших» бактерий в ходе борьбы с патогеном. Новое исследование, проведенное исследователями из Института Броуда Массачусетского технологического института и Гарварда, Массачусетского технологического института и Института биологической инженерии Висса, показало, что антибиотики могут также снижать способность иммунных клеток мыши убивать бактерии, и это напрямую влияет на биохимическую среду. вызванные лечением, могут защитить бактериальный патоген. Работа была опубликована сегодня в Хозяин клетки и микроб .
Однако препараты могут иметь широкий спектр побочных эффектов, включая уничтожение «хороших» бактерий в ходе борьбы с патогеном. Новое исследование, проведенное исследователями из Института Броуда Массачусетского технологического института и Гарварда, Массачусетского технологического института и Института биологической инженерии Висса, показало, что антибиотики могут также снижать способность иммунных клеток мыши убивать бактерии, и это напрямую влияет на биохимическую среду. вызванные лечением, могут защитить бактериальный патоген. Работа была опубликована сегодня в Хозяин клетки и микроб .
«Антибиотики взаимодействуют с клетками, особенно с иммунными клетками, таким образом, которого мы не ожидали», — сказал соавтор Джейсон Янг, доктор философии, научный сотрудник Института Броуда и Массачусетский технологический институт. «И биохимический контекст, измененный антибиотиками и клетками в окружающих тканях, имеет значение, когда вы пытаетесь предсказать, как лекарство может работать у разных людей или при разных инфекциях».
«И биохимический контекст, измененный антибиотиками и клетками в окружающих тканях, имеет значение, когда вы пытаетесь предсказать, как лекарство может работать у разных людей или при разных инфекциях».
Перед лицом растущей угрозы устойчивости к антибиотикам понимание множества воздействий антибиотиков также является важной задачей для исследователей и клиницистов, разрабатывающих более эффективные методы лечения. Старший автор Джеймс Коллинз, доктор философии. — член Института Броуда, профессор Массачусетского технологического института и член основного факультета Института Висса — и его лаборатория ранее показали, что несколько типов антибиотиков могут повреждать митохондрии у мышей и в эпителиальных клетках человека, и что восприимчивость бактерий к лекарствам может быть снижена. под влиянием небольших молекул, называемых метаболитами, высвобождаемых клетками в качестве промежуточных продуктов их метаболических реакций.
Ян и его коллеги подозревали, что лечение антибиотиками может еще больше изменить микроокружение инфекции таким образом, что это повлияет на бактерии и иммунные клетки. Чтобы исследовать, команда лечила мышей, инфицированных бактериями Escherichia coli , широко используемым антибиотиком под названием ципрофлоксацин, вводя его через питьевую воду животных в концентрациях, относительно тех, которые получает человек, и количественно оценивала биохимические изменения.
Чтобы исследовать, команда лечила мышей, инфицированных бактериями Escherichia coli , широко используемым антибиотиком под названием ципрофлоксацин, вводя его через питьевую воду животных в концентрациях, относительно тех, которые получает человек, и количественно оценивала биохимические изменения.
Исследователи обнаружили, что лечение антибиотиками вызывает системные изменения метаболитов — не за счет влияния на микробиом, а за счет непосредственного воздействия на ткани мыши. В ходе дальнейшего исследования команда определила, что метаболиты, выделяемые клетками мыши, составляют E. coli более устойчива к ципрофлоксацину. Воздействие антибиотиков также нарушало иммунную функцию, подавляя дыхательную активность иммунных клеток: макрофаги, обработанные ципрофлоксацином, были менее способны поглощать и убивать бактерии E. coli .
«Обычно вы предполагаете, что антибиотики будут оказывать существенное влияние на бактериальные клетки, а здесь они, кажется, вызывают реакции в клетках млекопитающих», — сказал Коллинз. «Лекарства вызывают изменения, которые на самом деле контрпродуктивны усилиям по лечению. Они снижают восприимчивость бактерий к антибиотикам, а сами лекарства снижают функциональную пользу иммунных клеток».
«Лекарства вызывают изменения, которые на самом деле контрпродуктивны усилиям по лечению. Они снижают восприимчивость бактерий к антибиотикам, а сами лекарства снижают функциональную пользу иммунных клеток».
Результаты подчеркивают способность антибиотиков модулировать иммунную систему и раскрывают важность метаболического микроокружения в борьбе с инфекцией. «Аспекты этой работы показывают, что биохимическое разнообразие может быть движущей силой различных результатов лечения наркомании», — сказал Ян. «Если мы будем лучше понимать специфические эффекты, которые антибиотики могут оказывать на разные клетки, это может помочь нам принять решение о том, как лучше лечить инфекцию».
Перенос результатов на здоровье человека потребует дополнительной работы. «Нам необходимо провести дополнительные исследования на животных в более широком диапазоне условий с более широким спектром антибиотиков и, возможно, измерить метаболиты у пациентов-людей, проходящих лечение, чтобы увидеть, что еще может происходить», — сказал Коллинз.
