Интерстициальные изменения в легких: поиск причин (клиническое наблюдение) | Владимирова
1. Raghu G., Collard H.R., Egan J.J. et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am. J. Respir. Crit. Care Med. 2011; 183 (6): 788–824. DOI: 10.1164/rccm.2009-040GL.
2. Шмелев Е.И. Дифференциальная диагностика интерстициальных болезней легких. Consilium medicum. 2003, 5 (4): 176–181.
3. Шмелев Е.И. Что должен знать врач об интерстициальных болезнях легких. Атмосфера. Пульмонология и аллергология. 2003; (3): 3–6. Доступно на: https://cyberleninka.ru/article/n/chto-dolzhen-znat-vrach-ob-interstitsialnyh-boleznyah-legkih [Дата обращения 06.03.18].
4.
5. Liebow A.A., Carrington C.B. The interstitial pneumonias. In: Simon M., Potchen E.J., LeMay M., eds. Frontiers of pulmonary radiology. New York: Grune and Stratton; 1969: 102–141.
7. Охонская Л.В., Додонов К.Н., Фомин Ю.А., Улюкин И.М. К вопросу о лимфоидной интерстициальной пневмонии на фоне перинатальной ВИЧ-инфекции. Terra Medica. 2015; 3 (81): 26–31. Доступно на http://www.terramedica.spb.ru/node/325 [Дата обращения 06.03.18].
Terra Medica. 2015; 3 (81): 26–31. Доступно на http://www.terramedica.spb.ru/node/325 [Дата обращения 06.03.18].
8. Ameratunga R., Woon S.T., Gillis D. et al. New diagnostic criteria for common variable immune deficiency (CVID), which may assist with decisions to treat with intravenous subcutaneous immunoglobulin. Clin. Exp. Immunol. 2013; 174 (2): 203–211. DOI: 10.1111/cei.12178.
9. Усенова О.П., Габдуллина Д.М., Моренко М.А., Ковзель Е.Ф. Первичный иммунодефицит: общая вариабельная иммунная недостаточность. Клиническая медицина Казахстана. 2016; 1 (39): 16–19.
ИНТЕРСТИЦИАЛЬНЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ: КЛЮЧЕВЫЕ МИШЕНИ ДЛЯ ТЕРАПИИ | Шостак
1. Клинические рекомендации. Интерстициальный легочный фиброз.
2. American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. This joint statement of the American Thoracic Society (ATS), and the European Respiratory Society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS Executive Committee, June 2001. Am J Respir Crit Care Med 2002;165(2):277–304. DOI: 10.1164/ajrccm.165.2.ats01.
3. Travis W.D., Costabel U., Hansell D.M. et al. An official American Thoracic Society/European Respiratory Society Statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2013;188(6):733–48. DOI: 10.1164/rccm.201308-1483ST.
DOI: 10.1164/rccm.201308-1483ST.
4. Петров Д.В., Овсянников Н.В., Капралов Э.А., Капустьян О.В. Интерстициальные заболевания легких: точка зрения практического врача. Практическая пульмонология 2014;(1):34–8.
5. Rockey D.C., Bell P.D., Hill J.A. Fibrosis – a common pathway to organ injury and failure. New Engl J Med 2015;372(12):1138–49. DOI: 10.1056/NEJMra1300575.
6. Maher T.M. Idiopathic pulmonary fibrosis: pathobiology of novel approaches to treatment. Clin Chest Med 2012;33(1):69–83. DOI: 10.1016/j.ccm.2011.11.002.
7. Woodcock H.V., Maher T.M. The treatment of idiopathic pulmonary fibrosis. F1000Prime Rep 2014;6:16. DOI: 10.12703/P6-16.
8. Hecker L., Vittal R., Jones T. et al. NADPH oxidase-4 mediates myofibroblast activation and fibrogenic responses to lung injury. Nat Med 2009;15(9): 1077–81. DOI: 10.1038/nm.2005.
Hecker L., Vittal R., Jones T. et al. NADPH oxidase-4 mediates myofibroblast activation and fibrogenic responses to lung injury. Nat Med 2009;15(9): 1077–81. DOI: 10.1038/nm.2005.
9. Amara N., Goven D., Prost F. et al. NOX4/NADPH oxidase expression is increased in pulmonary fibroblasts from patients with idiopathic pulmonary fibrosis and mediates TGFbeta1-induced fibroblast differentiation into myofibroblasts. Thorax 2010;65(8):733–8. DOI: 10.1136/thx.2009.113456.
10. Laleu B., Gaggini F., Orchard M. et al. First in class, potent, and orally bioavailable NADPH oxidase isoform 4 (Nox4) inhibitors for the treatment of idiopathic pulmonary fibrosis. J Med Chem 2010; 53(21):7715–30. DOI: 10.1021/jm100773e.
11. Kinder B.W., Brown K.K., McCormack F.X. et al. Serum surfactant protein A is a strong predictor of early mortality in idiopathic pulmonary fibrosis. Chest 2009;135(6):1557–63. DOI: 10.1378/ chest.08-2209.
Serum surfactant protein A is a strong predictor of early mortality in idiopathic pulmonary fibrosis. Chest 2009;135(6):1557–63. DOI: 10.1378/ chest.08-2209.
12. Ohnishi H., Yokoyama A., Kondo K. et al. Comparative study of KL6, surfactant protein A, surfactant protein D, and monocyte chemoattractant protein1 as serum markers for interstitial lung diseases. Am J Respir Crit Care Med 2002;165(3):378– 81. DOI: 10.1164/ajrccm.165.3.2107134.
13. Oldham J.M., Ma S.F., Martinez F.J. et al. IPFnet Investigators. TOLLIP, MUC5B, and the Response to N-Acetylcysteine among Individuals with Idiopathic Pulmonary Fibrosis. Am J Respir Crit Care Med 2015;192(12):1475–82. DOI: 10.1164/rccm.201505-1010OC.
14. Raghu G., Anstrom K.J., King T.E. et al. Idiopathic Pulmonary Fibrosis Clinical Research Network. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med 2012;366(21):1968–77. DOI: 10.1056/NEJMoa1113354.
Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med 2012;366(21):1968–77. DOI: 10.1056/NEJMoa1113354.
15. Noble P.W., Albera C., Bradford W.Z. et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet 2011;377(9779):1760–9. DOI: 10.1016/S0140-6736(11)60405-4.
16. Oku H., Shimizu T., Kawabata T. et al. Antifibrotic action of pirfenidone and prednisolone: different effects on pulmonary cytokines and growth factors in bleomycin-induced murine pulmonary fibrosis. Eur J Pharmacol 2008;590(1–3): 400–8. DOI: 10.1016/j.ejphar.2008.06.046.
17. King T.E. Jr., Bradford W.Z., Castro-Bernardini S. et al. ASCEND Study Group. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014;370(22):2083–92. DOI: 10.1056/NEJMoa1402582.
N Engl J Med 2014;370(22):2083–92. DOI: 10.1056/NEJMoa1402582.
18. Richeldi L., Collard H.R., Jones M.G. Idiopathic pulmonary fibrosis. Lancet 2017;389(10082):1941–52. DOI: 10.1016/S0140-6736(17)30866-8.
19. Richeldi L., du Bois R.M., Raghu G. et al. INPULSIS Trial Investigators. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med 2014;370(22):2071–82. DOI: 10.1056/NEJMoa1402584.
20. Wolters P.J., Collard H.R., Jones K.D. Pathogenesis of idiopathic pulmonary fibrosis. Annu Rev Pathol 2014;9:157–79. DOI: 10.1146/annurev-pathol-012513-104706.
21. Wolters P.J., Blackwell T.S., Eickelberg O. et al. Time for a change: is idiopathic pulmonary fibrosis still idiopathic and only fibrotic? Lancet Respir Med 2018;6(2):154–60. DOI: 10.1016/S22132600(18)30007-9.
DOI: 10.1016/S22132600(18)30007-9.
22. Svegliati S., Spadoni T., Moroncini G., Gabrielli A. NADPH oxidase, oxidative stress and fibrosis in Systemic Sclerosis. Free Radic Biol Med 2018. PII: S08915849(18)30731-7. DOI: 10.1016/j.freeradbiomed.2018.04.554.
23. Madden B.P., Allenby M., Loke T., Sheth A. A potential role for sildenafil in the management of pulmonary hypertension in patients with parenchymal lung disease. Vascul Pharmacol 2006;44(5):372–6. DOI: 10.1016/j.vph.2006.01.013.
Новые подходы к лечению фиброзирующих интерстициальных заболеваний легких. Клиническая фармакология и терапия
С.В. Моисеев. Среди хронических интерстициальных заболеваний легких (ИЗЛ)
наиболее тяжелыми являются варианты поражения легких, протекающие с формированием выраженного фиброза и,
следовательно, дыхательной недостаточности. Хотя механизмы образования соединительной ткани при этих заболеваниях
были достаточно хорошо изучены, терапевтические подходы к торможению фиброгенеза до недавнего времени оставались
мало эффективными, а широко назначавшаяся ранее при всех вариантах ИЗЛ иммуносупрессивная терапия оказалась
неоправданной при многих заболеваниях. Действительно, при хроническом гиперсенситивном пневмоните, фибротическом
варианте неспецифической интерстициальной пневмонии (в том числе в рамках системных заболеваний соединительной
ткани), продвинутых стадиях легочного саркоидоза применение преднизолона и иммуносупрессивных препаратов не приводит
к торможению фиброзного ремоделирования легочной ткани и значительно повышает риск респираторных инфекций и других
нежелательных явлений [1].
Хотя механизмы образования соединительной ткани при этих заболеваниях
были достаточно хорошо изучены, терапевтические подходы к торможению фиброгенеза до недавнего времени оставались
мало эффективными, а широко назначавшаяся ранее при всех вариантах ИЗЛ иммуносупрессивная терапия оказалась
неоправданной при многих заболеваниях. Действительно, при хроническом гиперсенситивном пневмоните, фибротическом
варианте неспецифической интерстициальной пневмонии (в том числе в рамках системных заболеваний соединительной
ткани), продвинутых стадиях легочного саркоидоза применение преднизолона и иммуносупрессивных препаратов не приводит
к торможению фиброзного ремоделирования легочной ткани и значительно повышает риск респираторных инфекций и других
нежелательных явлений [1].
М.Ю. Бровко. В начале XXI века для лечения идиопатического легочного фиброза,
характеризующегося рентгенологической и гистологической картиной обычной интерстициальной пневмонии, были
зарегистрированы два препарата с доказанным антифиброзным действием – нинтеданиб и пирфенидон [2,3]. Общность
механизмов развития легочного фиброза при обычной интерстициальной пневмонии и других вариантах фиброзирующих ИЗЛ
позволили предположить, что эти препараты могут найти применение и при других заболевания [4].
Общность
механизмов развития легочного фиброза при обычной интерстициальной пневмонии и других вариантах фиброзирующих ИЗЛ
позволили предположить, что эти препараты могут найти применение и при других заболевания [4].
Нинтеданиб является низкомолекулярным ингибитором тирозинкиназ, блокирующим важнейшие сигнальные пути фиброгенеза в
легочной ткани, в которых участвуют фактор роста тромбоцитов (PDGF), фактор роста эндотелия сосудов (VEGF) и фактор
роста фибробластов (FGF) [5]. Первоначально этот препарат изучали при онкологических заболеваниях и применяли для
лечения немелкоклеточного рака легкого, однако в 2014 году были завершены 52-недельные двойные слепые
плацебоконтролируемые исследования INPULSIS-1 и INPULSIS-2, которые доказали способность препарата замедлять
прогрессирование идиопатического легочного фиброза [2]. В целом в эти исследования были включены 1066 пациентов с
идиопатическим легочным фиброзом, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день или
плацебо. Первичной конечной точкой была ежегодная скорость снижения форсированной жизненной емкости легких (ФЖЕЛ). В
обоих исследованиях в группе нинтеданиба она была примерно в два раза ниже, чем в группе плацебо (в исследовании
INPULSIS-1 разница ежегодной скорости снижения ФЖЕЛ между группами составила 125,3 мл; p<0,001, а в исследовании
INPULSIS-2 – 93,7 мл; p<0,001) (рис. 1). Во втором исследовании лечение нинтеданибом привело также к
значительному увеличению времени до первого обострения идиопатического легочного фиброза по сравнению с плацебо
(отношение шансов 0,38; p=0,005).
Первичной конечной точкой была ежегодная скорость снижения форсированной жизненной емкости легких (ФЖЕЛ). В
обоих исследованиях в группе нинтеданиба она была примерно в два раза ниже, чем в группе плацебо (в исследовании
INPULSIS-1 разница ежегодной скорости снижения ФЖЕЛ между группами составила 125,3 мл; p<0,001, а в исследовании
INPULSIS-2 – 93,7 мл; p<0,001) (рис. 1). Во втором исследовании лечение нинтеданибом привело также к
значительному увеличению времени до первого обострения идиопатического легочного фиброза по сравнению с плацебо
(отношение шансов 0,38; p=0,005).
В 2018 г. после завершения двойного слепого, плацебо-контролируемого исследования SENCSIS была подтверждена
эффективность назначения нинтеданиба при прогрессирующем поражении легких в рамках системной склеродермии (ССД) [6]. В исследование были включены 576 больных, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в
день внутрь или плацебо. Первичная конечная точка была такой же, как в исследованиях INPULSIS. Лечение нинтеданибом
достоверно задерживало развитие фиброза у больных ССД, а разница ежегодной скорости снижения ФЖЕЛ между двумя
группами составила 41,0 мл в пользу нинтеданиба (р=0,04; рис. 2).
В исследование были включены 576 больных, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в
день внутрь или плацебо. Первичная конечная точка была такой же, как в исследованиях INPULSIS. Лечение нинтеданибом
достоверно задерживало развитие фиброза у больных ССД, а разница ежегодной скорости снижения ФЖЕЛ между двумя
группами составила 41,0 мл в пользу нинтеданиба (р=0,04; рис. 2).
П.И. Новиков. ССД – это аутоиммунное заболевание, в основе которого лежат
генерализованная микроангиопатия и активация процессов фиброгенеза. На ранних стадиях заболевание проявляется
кожными изменениями в виде плотного отека пальцев и синдромом Рейно, которые могут не сопровождаться ухудшением
общего состояния или признаками поражения внутренних органов (в том числе одышкой), поэтому пациенты зачастую не
сразу обращаются за медицинской помощью. В связи с этим ССД нередко диагностируют поздно, когда патологические
изменения в органах необратимы, а лечение менее эффективно. По данным канадского регистра, у 408 пациентов диагноз
ССД был установлен в среднем через 6,0 лет после развития феномена Рейно и через 2,7 года после появления первых
«внекожных» проявлений [7]. В России ССД диагностировали через 2,0–2,7 года после появления феномена Рейно при
диффузной форме заболевания [8]. При этом результаты крупного исследования (n=5860) показали, что смертность
пациентов с ССД достигает 68 на 1000 человек в год [9]. Таким образом, своевременная диагностика ССД представляет
собой сложную, но очень важную задачу для врача. Примерно у 75% больных уже в первые годы заболевания выяв ляют
интерстициальное поражение легких, характеризующееся медленным прогрессирующим течением с исходом в фиброз разной
степени тяжести [10]. Л.В. Теплова и соавт. с помощью компьютерной томографии высокого разрешения выявили признаки
поражения интерстиция легких у 82% из 138 пациентов с ССД [11].
В связи с этим ССД нередко диагностируют поздно, когда патологические
изменения в органах необратимы, а лечение менее эффективно. По данным канадского регистра, у 408 пациентов диагноз
ССД был установлен в среднем через 6,0 лет после развития феномена Рейно и через 2,7 года после появления первых
«внекожных» проявлений [7]. В России ССД диагностировали через 2,0–2,7 года после появления феномена Рейно при
диффузной форме заболевания [8]. При этом результаты крупного исследования (n=5860) показали, что смертность
пациентов с ССД достигает 68 на 1000 человек в год [9]. Таким образом, своевременная диагностика ССД представляет
собой сложную, но очень важную задачу для врача. Примерно у 75% больных уже в первые годы заболевания выяв ляют
интерстициальное поражение легких, характеризующееся медленным прогрессирующим течением с исходом в фиброз разной
степени тяжести [10]. Л.В. Теплова и соавт. с помощью компьютерной томографии высокого разрешения выявили признаки
поражения интерстиция легких у 82% из 138 пациентов с ССД [11].
Лечение ИЗЛ в рамках ССД обычно начинают с иммуносупрессивных препаратов, в частности циклофосфамида [12]. В многоцентровом, проспективном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании лечение цифлофосфамидом внутривенно в течение 6 мес с последующей заменой на азатиоприн привело к увеличению ФЖЕЛ на 4,2% по сравнению с контролем [13], что указывало на способность препарата замедлять прогрессирование поражения легких при этом заболевании. Тем не менее, через 2 года после начала 12-месячной иммуносупрессивной терапии было выявлено ухудшение ФЖЕЛ и рентгенологической картины [14].
В рандомизированном, двойном слепом 24-месячном исследовании микофенолат мофетил в дозе 3000 мг/сут у больных ССД с
поражением легких не отличался от циклофосфамида в дозе 2 мг/кг/сут внутрь по эффективности, но имел преимущества по
переносимости [15]. Результаты небольших неконтролируемых исследований свидетельствуют о том, что ритуксимаб может
улучшить течение ИЗЛ у больных ССД [16]. Недавно эффективность и безопасность ритуксимаба были изучены у 254 больных
ССД (у 58% из них имелось ИЗЛ), получавших лечение в центрах, которые входят в программу EUSTAR (в Российской
Федерации – НИИ ревматологии им. В.А. Насоновой и клиника им. Е.М. Тареева). Контрольную группу составили 9575
подобранных пациентов с ССД, которым проводилось лечение другими препаратами. Хотя ритуксимаб вызывал улучшение
фиброза кожи, он не оказывал существенного влияния на динамику ФЖЕЛ или диффузионной способности по оксиду углерода
(DLCO).
Недавно эффективность и безопасность ритуксимаба были изучены у 254 больных
ССД (у 58% из них имелось ИЗЛ), получавших лечение в центрах, которые входят в программу EUSTAR (в Российской
Федерации – НИИ ревматологии им. В.А. Насоновой и клиника им. Е.М. Тареева). Контрольную группу составили 9575
подобранных пациентов с ССД, которым проводилось лечение другими препаратами. Хотя ритуксимаб вызывал улучшение
фиброза кожи, он не оказывал существенного влияния на динамику ФЖЕЛ или диффузионной способности по оксиду углерода
(DLCO).
В целом приведенные данные свидетельствуют о том, что иммуносупрессивные препараты, в том числе циклофосфамид, микофенолат мофетил и ритуксимаб, позволяют стабилизировать течение ИЗЛ у части, но далеко не у всех больных ССД, что определяет необходимость применения других подходов к лечению, прежде всего с использованием препаратов, обладающих антифиброзной активностью.
С. В. Моисеев.
Особенно трудным является ведение пациентов с поражением легких в рамках ССД, у которых легочный фиброз
прогрессирует несмотря на адекватную иммуносупрессивную терапию. Приводим клиническое наблюдение:
В. Моисеев.
Особенно трудным является ведение пациентов с поражением легких в рамках ССД, у которых легочный фиброз
прогрессирует несмотря на адекватную иммуносупрессивную терапию. Приводим клиническое наблюдение:
Л.А. Акулкина. Пациентка А., 50 лет. С 35 лет отмечает онемение и
посинение пальцев рук на холоде. Диагностирован синдром Рейно. В 2010 г. в возрасте 40 лет появились
малопродуктивный кашель и одышка при физической нагрузке. По месту жительства респираторная симптоматика
трактовалась как проявление инфекционного процесса, в связи с чем периодически проводились антибактериальная
терапия, инфузии эуфиллина без существенного эффекта. В 2014 г. при мультиспиральной компьютерной томография
органов грудной клетки (МСКТ) выявлены признаки интерстициальной пневмонии, однако какая-либо терапия назначена
не была, а дыхательная недостаточность постепенно нарастала. При контрольной МСКТ через полтора года в обоих
легких, преимущественно в нижних долях, определялись участки фиброза и «сотового легкого» на фоне значительных
интерстициальных изменений по типу «матового стекла» с утолщением и уплотнением легочного интерстиция и
междольковых перегородок (более выражено в периферических отделах), а также внутригрудная лимфаденопатия верхней
паравазальной, ретрокавальной, трахеобронхиальных и бифуркационной групп до 13 мм. Обратилась к фтизиатру,
который исключил туберкулез органов дыхания. В 2016 г. в возрасте 46 лет впервые госпитализирована в клинику им.
Е.М. Тареева. При осмотре обращали на себя внимание изменения кожи с формированием «кисетного рта», плотный отек
пальцев рук, синдром Рейно с дигитальными язвами. При обследовании выявлены антинуклеарный фактор (АНФ) в титре
1:1280, положительные антитела к цитоплазматическому антигену SS-A (Ro), резкоположительные антитела к
топоизомеразе I Scl-70. ФЖЕЛ была снижена до 74%, а DLСО – до 58%. При эхокардиографии выявлены
умеренные признаки легочной гипертензии с повышением систолического давления в легочной артерии до 45 мм рт. ст.
Сочетание характерных кожных изменений, синдрома Рейно, изменений в легких по типу прогрессирующего
фиброзирующего заболевания легких (утолщение, деформация внутридолькового и междолькового легочного интерстиция,
участки кистозной трансформации легочной ткани, уменьшение нижних долей легких в размерах, наличие тракционных
бронхоэктазов, уплотнение легочной ткани по типу «матового стекла» в субплевральных и базальных отделах обоих
легких) и серологических маркеров позволило диагностировать ССД с поражением легких.
Обратилась к фтизиатру,
который исключил туберкулез органов дыхания. В 2016 г. в возрасте 46 лет впервые госпитализирована в клинику им.
Е.М. Тареева. При осмотре обращали на себя внимание изменения кожи с формированием «кисетного рта», плотный отек
пальцев рук, синдром Рейно с дигитальными язвами. При обследовании выявлены антинуклеарный фактор (АНФ) в титре
1:1280, положительные антитела к цитоплазматическому антигену SS-A (Ro), резкоположительные антитела к
топоизомеразе I Scl-70. ФЖЕЛ была снижена до 74%, а DLСО – до 58%. При эхокардиографии выявлены
умеренные признаки легочной гипертензии с повышением систолического давления в легочной артерии до 45 мм рт. ст.
Сочетание характерных кожных изменений, синдрома Рейно, изменений в легких по типу прогрессирующего
фиброзирующего заболевания легких (утолщение, деформация внутридолькового и междолькового легочного интерстиция,
участки кистозной трансформации легочной ткани, уменьшение нижних долей легких в размерах, наличие тракционных
бронхоэктазов, уплотнение легочной ткани по типу «матового стекла» в субплевральных и базальных отделах обоих
легких) и серологических маркеров позволило диагностировать ССД с поражением легких. Начата комбинированная
иммуносупрессивная терапия циклофосфамидом в дозе 800 мг внутривенно ежемесячно в течение 5 месяцев, пероральный
прием преднизолона 10 мг/сут и гидроксихлорохина 200 мг/сут. В результате терапии отмечены уменьшение одышки и
кашля, повышение толерантности к физическим нагрузкам, однако каждая инфузия циклофосфамида сопровождалась
инфекционными осложнениями. Тем не менее, при МСКТ через 6 мес наблюдалась умеренная отрицательная динамика в
виде нарастания интерстициальных фиброзных изменений в легких. Циклофосфамид был заменен на микофенолат мофетил,
а терапия преднизолоном продолжена в прежней дозе. Увеличить дозу микофенолата мофетила до целевой не удалось в
связи с развитием стойкой диареи, поэтому препарат был отменен. В декабре 2016 г. начаты инфузии ритуксимаба. В
результате лечения наблюдался некоторый положительный клинический эффект в виде уменьшения одышки и выраженности
синдрома Рейно, повышения толерантности к физическим нагрузкам.
Начата комбинированная
иммуносупрессивная терапия циклофосфамидом в дозе 800 мг внутривенно ежемесячно в течение 5 месяцев, пероральный
прием преднизолона 10 мг/сут и гидроксихлорохина 200 мг/сут. В результате терапии отмечены уменьшение одышки и
кашля, повышение толерантности к физическим нагрузкам, однако каждая инфузия циклофосфамида сопровождалась
инфекционными осложнениями. Тем не менее, при МСКТ через 6 мес наблюдалась умеренная отрицательная динамика в
виде нарастания интерстициальных фиброзных изменений в легких. Циклофосфамид был заменен на микофенолат мофетил,
а терапия преднизолоном продолжена в прежней дозе. Увеличить дозу микофенолата мофетила до целевой не удалось в
связи с развитием стойкой диареи, поэтому препарат был отменен. В декабре 2016 г. начаты инфузии ритуксимаба. В
результате лечения наблюдался некоторый положительный клинический эффект в виде уменьшения одышки и выраженности
синдрома Рейно, повышения толерантности к физическим нагрузкам. В мае 2017 г. лабораторные признаки активности
заболевания отсутствовали, а при МСКТ выявлено уменьшение выраженности изменений по типу «матового стекла» в
обоих легких, однако площадь фиброзных изменений несколько увеличилась. С учетом полной деплеции CD19+
B-лимфоцитов в периферической крови повторное введение ритуксимаба было решено отложить. В апреле 2018 г.
рентгенологическая картина и функциональные легочные показатели без динамики. Отмечено нарастание числа CD19+
В-лимфоцитов до 0,8%, в связи с чем проведена очередная инфузия ритуксимаба 1 г. В мае 2019 года функция легких
оставалась относительной стабильной (ФЖЕЛ 67%, DLCO 46%), однако при МСКТ отмечено нарастание
уплотнения легочной ткани по типу «матового стекла». Выполнено очередное введение ритуксимаба 1 г. При
обследовании в декабре того же года клиническое состояние пациентки стабильно, признаков активности ССД нет,
однако выявлено нарастание фиброзных изменений легочной ткани при отсутствии существенной динамики ФЖЕЛ и
DLCO.
В мае 2017 г. лабораторные признаки активности
заболевания отсутствовали, а при МСКТ выявлено уменьшение выраженности изменений по типу «матового стекла» в
обоих легких, однако площадь фиброзных изменений несколько увеличилась. С учетом полной деплеции CD19+
B-лимфоцитов в периферической крови повторное введение ритуксимаба было решено отложить. В апреле 2018 г.
рентгенологическая картина и функциональные легочные показатели без динамики. Отмечено нарастание числа CD19+
В-лимфоцитов до 0,8%, в связи с чем проведена очередная инфузия ритуксимаба 1 г. В мае 2019 года функция легких
оставалась относительной стабильной (ФЖЕЛ 67%, DLCO 46%), однако при МСКТ отмечено нарастание
уплотнения легочной ткани по типу «матового стекла». Выполнено очередное введение ритуксимаба 1 г. При
обследовании в декабре того же года клиническое состояние пациентки стабильно, признаков активности ССД нет,
однако выявлено нарастание фиброзных изменений легочной ткани при отсутствии существенной динамики ФЖЕЛ и
DLCO. В настоящее время обсуждается возможность назначения нинтеданиба.
В настоящее время обсуждается возможность назначения нинтеданиба.
М.Ю. Бровко. История заболевания пациентки де монстрирует недостаточную эффективность применявшихся иммуносупрессивных лекарственных препаратов – несмотря на лечение в течение 3 лет отмечено снижение показателей легочной вентиляции, в том числе ФЖЕЛ на 10% и DLCO на 12%. В этом случае оправдано применение антифибротической терапии, так как в исследовании SENCSIS лечение нинтеданибом у таких больных позволило замедлить нарастание респираторного дефицита у пациентов с ССД практически вдвое [6].
В.И. Шоломова. Опубликованные в 2019 г. результаты 52-недельного двойного
слепого, плацебо-контролируемого исследования INBUILD подтвердили эффективность терапии нинтеданибом при
практически полном спектре фиброзирующих ИЗЛ, не относящихся к ИЛФ. В исследовании приняли участие 663 пациента
из 15 стран, включая Российскую Федерацию. Критериями включения были признаки интерстициального фиброза с
вовлечением более 10% легочной паренхимы по данным МСКТ органов грудной клетки в сочетании с признаками
прогрессирования заболевания за предыдущие 24 мес (нарастание рентгенологических изменений, снижение ФЖЕЛ,
усугубление респираторной симптоматики) несмотря на иммуносупрессивную терапию. Лечение нинтеданибом 150 мг два
раза в сутки и плацебо получали пациенты с гиперсенситивным пневмонитом, идиопатической неспецифической
интерстициальной пневмонией, неклассифицируемой интерстициальной пневмонией, поражениями легких,
ассоциированными с различными системными заболеваниями соединительной ткани (в том числе ССД, ревматоидным
артритом), профессиональными заболеваниями и саркоидозом. У большей части пациентов (62,1%) имелись
рентгенологические изменения, соответствующие паттерну обычной интерстициальной пнев монии.
Критериями включения были признаки интерстициального фиброза с
вовлечением более 10% легочной паренхимы по данным МСКТ органов грудной клетки в сочетании с признаками
прогрессирования заболевания за предыдущие 24 мес (нарастание рентгенологических изменений, снижение ФЖЕЛ,
усугубление респираторной симптоматики) несмотря на иммуносупрессивную терапию. Лечение нинтеданибом 150 мг два
раза в сутки и плацебо получали пациенты с гиперсенситивным пневмонитом, идиопатической неспецифической
интерстициальной пневмонией, неклассифицируемой интерстициальной пневмонией, поражениями легких,
ассоциированными с различными системными заболеваниями соединительной ткани (в том числе ССД, ревматоидным
артритом), профессиональными заболеваниями и саркоидозом. У большей части пациентов (62,1%) имелись
рентгенологические изменения, соответствующие паттерну обычной интерстициальной пнев монии.
В группе нинтеданиба отмечено значительное снижение ежегодной скорости падения ФЖЕЛ – 80,8 мл/год против 187,8
мл/год в группе плацебо (различие между группами составило 107 мл/год, р<0,001). В когорте пациентов с
паттерном обычной интерстициальной пневмонии эта разница оказалась еще более значительной и достигла 128,2
мл/год (р<0,001) (рис. 3). Переносимость терапии исследуемым препаратом была удовлетворительной. Среди
нежелательных явлений чаще всего встречались диарея (66,9% пациентов) и изменение лабораторных показателей со
стороны печени. Примером эффективного применения антифиброзного препарата при прогрессирующем легочном
интерстициальном поражении может служить представленный ниже клинический случай.
В когорте пациентов с
паттерном обычной интерстициальной пневмонии эта разница оказалась еще более значительной и достигла 128,2
мл/год (р<0,001) (рис. 3). Переносимость терапии исследуемым препаратом была удовлетворительной. Среди
нежелательных явлений чаще всего встречались диарея (66,9% пациентов) и изменение лабораторных показателей со
стороны печени. Примером эффективного применения антифиброзного препарата при прогрессирующем легочном
интерстициальном поражении может служить представленный ниже клинический случай.
А.Ш. Янакаева. Больная К., 65 лет. В 2014 г. в возрасте 60 лет появился
постоянный сухой кашель, однако к врачу не обращалась. В январе 2016 г. при диспансеризации впервые выявлены
патологические признаки на рентгенограммах легких. При МСКТ обнаружены изменения по типу «матового стекла» в
базальных отделах обоих легких, увеличение внутригрудных лимфатических узлов до 14 мм. Признаков дыхательной
недостаточности не выявлено. ФЖЕЛ составила 110%, однако исследование диффузионной способности не проводилось.
При эхокардиографии без существенных отклонений. Диагностирована идиопатическая интерстициальная пневмония.
Проводилась терапия преднизолоном 25 мг/сут и ацетилцистеином 600 мг/сут. При контрольной МСКТ через 6 мес
положительной динамики не наблюдалось, сохранялся сухой кашель. Рекомендовано продолжить прием преднизолона в
дозе 15 мг/сут.
При МСКТ обнаружены изменения по типу «матового стекла» в
базальных отделах обоих легких, увеличение внутригрудных лимфатических узлов до 14 мм. Признаков дыхательной
недостаточности не выявлено. ФЖЕЛ составила 110%, однако исследование диффузионной способности не проводилось.
При эхокардиографии без существенных отклонений. Диагностирована идиопатическая интерстициальная пневмония.
Проводилась терапия преднизолоном 25 мг/сут и ацетилцистеином 600 мг/сут. При контрольной МСКТ через 6 мес
положительной динамики не наблюдалось, сохранялся сухой кашель. Рекомендовано продолжить прием преднизолона в
дозе 15 мг/сут.
В апреле 2017 г. госпитализирована в Клинику им. Е.М. Тареева с жалобами на мучительный сухой кашель, слабость,
умеренную одышку. В базальных отделах обоих легких выслушивалась крепитация. ФЖЕЛ – 91%, DLСО – 67%.
Рентгенологически определялась картина неспецифической интерстициальной пневмонии. По сравнению с предыдущим
исследованием отмечено нарастание фиброзных изменений, в то время как выраженность зон «матового стекла»
существенно не изменилась (рис. 4). При иммунологическом исследовании обнаружено повышение титра АНФ до 1:320,
слабоположительный титр SS-A. Неоднократно осматривалась ревматологом, данных за какое-либо системное
заболевание соединительной ткани не было. Диагностирована интерстициальная пневмония с аутоиммунными признаками
[18]. Продолжена терапия преднизолоном в дозе 20 мг/сут, к которому был добавлен микофенолат мофетил в дозе 2000
мг/сут. В ноябре 2017 г. отмечено уменьшение площади интерстициальных изменений по типу «матового стекла» при
усилении выраженности тракционных бронхоэктазов. Несмотря на проводимую иммуносупресивную терапию вентиляционная
функция продолжала снижаться, в том числе ФЖЕЛ до 82% и DLСО до 61%. С учетом неэффективности
иммуносупрессивной терапии и соответствия пациенки критериям отбора в исследование INBUILD в декабре 2017 г.
По сравнению с предыдущим
исследованием отмечено нарастание фиброзных изменений, в то время как выраженность зон «матового стекла»
существенно не изменилась (рис. 4). При иммунологическом исследовании обнаружено повышение титра АНФ до 1:320,
слабоположительный титр SS-A. Неоднократно осматривалась ревматологом, данных за какое-либо системное
заболевание соединительной ткани не было. Диагностирована интерстициальная пневмония с аутоиммунными признаками
[18]. Продолжена терапия преднизолоном в дозе 20 мг/сут, к которому был добавлен микофенолат мофетил в дозе 2000
мг/сут. В ноябре 2017 г. отмечено уменьшение площади интерстициальных изменений по типу «матового стекла» при
усилении выраженности тракционных бронхоэктазов. Несмотря на проводимую иммуносупресивную терапию вентиляционная
функция продолжала снижаться, в том числе ФЖЕЛ до 82% и DLСО до 61%. С учетом неэффективности
иммуносупрессивной терапии и соответствия пациенки критериям отбора в исследование INBUILD в декабре 2017 г. начато лечение нинтеданибом в дозе 150 мг два раза в сутки в сочетании с преднизолоном в дозе 10 мг/сут. На фоне
2-летней терапии нинтеданибом впервые отмечена стабилизация показателей функции внешнего дыхания: в сентябре
2019 г. ФЖЕЛ составила 81%, а DLСО – 59%. При МСКТ выраженность фиброзных изменений не изменилась, в связи
с чем терапию антифиброзным препаратом решено продолжить.
начато лечение нинтеданибом в дозе 150 мг два раза в сутки в сочетании с преднизолоном в дозе 10 мг/сут. На фоне
2-летней терапии нинтеданибом впервые отмечена стабилизация показателей функции внешнего дыхания: в сентябре
2019 г. ФЖЕЛ составила 81%, а DLСО – 59%. При МСКТ выраженность фиброзных изменений не изменилась, в связи
с чем терапию антифиброзным препаратом решено продолжить.
С.В. Моисеев. Представленные истории болезни демонстрируют варианты
неблагоприятного фиброзирующего течения ИЗЛ, отличных от идиопатического легочного фиброза. Обеим пациенткам
показана длительная терапия антифиброзным лекарственным препаратом – нинтеданибом в дозе 150 мг два раза в
сутки. Результаты плацебо-контролируемых клинических исследований свидетельствуют о том, что лечение этим
препаратом оказывает благоприятное влияние на различные фиброзирующие заболевания легких. Очевидно, что лучших
результаты терапии можно ожидать у второй пациентки, учитывая отсутствие системного заболевания. Однако и первой
больной назначение нинтеданиба также показано, так как неблагоприятный прогноз в первую очередь определяется
поражением легких и прогрессирующей дыхательной недостаточности.
Очевидно, что лучших
результаты терапии можно ожидать у второй пациентки, учитывая отсутствие системного заболевания. Однако и первой
больной назначение нинтеданиба также показано, так как неблагоприятный прогноз в первую очередь определяется
поражением легких и прогрессирующей дыхательной недостаточности.
Необходимость лечения нинтеданибом должна быть подтверждена в лечебном учреждении, занимающемся изучением ИЗЛ и имеющем опыт ведения таких пациентов. Нинтеданиб переносится удовлетворительно и обычно не вызывает тяжелые нежелательные реакции, поэтому препарат может применяться под наблюдением врача поликлиники. Био химические показатели целесообразно контролировать ежемесячно в течение первых трех месяцев после начала лечения, а затем ежеквартально.
Drug-induced interstitial lung disease: approaches to diagnostics and treatment | Anaev
БАЛ – бронхоальвеолярный лаваж
БМАРП – болезнь-модифицирующие антиревматические препараты
ГК – глюкокортикоиды
ГП – гиперчувствительный пневмонит
ДАП – диффузное альвеолярное повреждение
ДСЛ – диффузионная способность легких
ИЗЛ – интерстициальное заболевание легких
КОП – криптогенная организующаяся пневмония
Л-ИЗЛ – лекарственно-индуцированное ИЗЛ
МСКТ – мультиспиральная компьютерная томография
НМРЛ – немелкоклеточный рак легких
НСИП – неспецифическая интерстициальная пневмония
ФЖЕЛ – форсированная жизненная емкость легких
ФНО – фактор некроза опухоли
KL-6 – гликопротеин Krebs von den Lungen-6
Распространенность интерстициального заболевания легких (ИЗЛ), связанного с медикаментозной терапией, растет. Прежде всего это связано с прогрессом в разработке новых лекарственных средств. Наиболее частыми причинами лекарственно-индуцированного ИЗЛ (Л-ИЗЛ) являются противоопухолевые препараты, амиодарон и антибиотики. В настоящее время более 450 препаратов связаны с паренхиматозными заболеваниями легких [1, 2].
Прежде всего это связано с прогрессом в разработке новых лекарственных средств. Наиболее частыми причинами лекарственно-индуцированного ИЗЛ (Л-ИЗЛ) являются противоопухолевые препараты, амиодарон и антибиотики. В настоящее время более 450 препаратов связаны с паренхиматозными заболеваниями легких [1, 2].
Л-ИЗЛ характеризуется развитием лекарственно-индуцированного воспаления (альвеолита/пневмонита) и в конечном итоге фиброза легкого. Лекарственные препараты могут поражать все отделы легких, но чаще всего в патологический процесс вовлекается паренхима. Согласно классификации Американского торакального общества/ Европейского респираторного общества (ATS/ERS) Л-ИЗЛ является признанным подтипом диффузных заболеваний паренхимы легких [3], но клинические, рентгеноморфологические признаки заболевания редко патогномоничны, и его трудно отличить от других интерстициальных пневмоний. Кроме того, клинический фенотип, МСКТ- и гистопатологический паттерн значительно различаются между лекарственными средствами и между пациентами, принимающими один и тот же препарат. Следовательно, Л-ИЗЛ – диагноз исключения, что создает определенные сложности для клиницистов.
Следовательно, Л-ИЗЛ – диагноз исключения, что создает определенные сложности для клиницистов.
Цель статьи – обобщение текущих знаний о паренхиматозных заболеваниях легких, вызванных лекарственными средствами, подходы к их диагностике и лечению.
Несмотря на то, что Л-ИЗЛ различаются по своей патофизиологии, клиническим проявлениям и прогнозу, подходы к диагностике и лечению одинаковы. Диагностика Л-ИЗЛ осуществляется на основании характерных клинических, физиологических и рентгенологических данных. Важно выявить связь между появлением симптомов и воздействием лекарств, отсутствие другой более вероятной причины, например инфекции, острого респираторного дистресс-синдрома, радиационного поражения легких, прогрессирования основного заболевания. У пациента с Л-ИЗЛ наблюдаются улучшение клинического состояния после отмены подозреваемого лекарственного средства с терапией глюкокортикоидами (ГК) или без нее и, в некоторых случаях, ухудшение состояния при повторном назначении причинного препарата.
Новые препараты, индуцирующие Л-ИЗЛ, регулярно выявляются, лекарственные средства и паттерны заболеваний занесены в Международную базу данных Pneumotox (www.pneumotox.com), в которой сообщается более чем о 1400 лекарственных препаратах, процедурах или веществах, вызывающих респираторные проблемы. Тем не менее нет детальной общей картины заболеваемости, фенотипа и клинического течения Л-ИЗЛ.
Эпидемиология Л-ИЗЛ
Частота возникновения Л-ИЗЛ для отдельных препаратов варьировала от менее 1 до 60%. Согласно имеющимся данным заболеваемость Л-ИЗЛ в Великобритании в период с 1997 по 2008 г. составила 4,1 случая на 1 млн в год [4]. После этой публикации произошло значительное расширение спектра новых онкологических препаратов, используемых в практике, что привело к увеличению частоты Л-ИЗЛ (www.pneumotox.com). По данным недавно проведенного исследования, частота ИЗЛ составила 19,4 случая на 100 тыс. в год [5]. На долю Л-ИЗЛ приходилось 6,4% случаев, что предполагает 12,4 случая на 1 млн в год. В других исследованиях распространенность Л-ИЗЛ в популяциях диагностированных случаев ИЗЛ составила 2,6–5% [5–7].
В других исследованиях распространенность Л-ИЗЛ в популяциях диагностированных случаев ИЗЛ составила 2,6–5% [5–7].
Основные причинно-значимые лекарственные средства
Анализ ретроспективных исследований, в которых подробно изучалась частота ИЗЛ, ассоциированных с медикаментами, показал, что в большинстве исследований основной причиной Л-ИЗЛ были противоопухолевые лекарственные средства (23–51% случаев), болезнь-модифицирующие антиревматические препараты – БМАРП (6–72%), антибиотики (6–26%), нестероидные противовоспалительные средства (0–23%), психотропные препараты (0–9%) и антиаритмические средства (0–9%) [8–11]. В регистре ИЗЛ Франции наиболее частыми причинами Л-ИЗЛ значились амиодарон и нитрофурантоин [6].
Противоопухолевая терапия
Выявление причин Л-ИЗЛ в онкологии является сложной задачей, тем более при назначении препаратов в комбинированных схемах или в сочетании с лучевой терапией, которая может приводить к фиброзу легких. К наиболее частым противоопухолевым лекарственным средствам, вызывающим Л-ИЗЛ, относятся блеомицин, препараты, направленные на рецептор эпидермального фактора роста (EGFR), гемцитабин, ингибиторы белка рапамицина в клетках (mTOR – Mechanistic Target of Rapamycin Protein Inhibitors) и ингибиторы контрольных точек иммунного ответа. Метотрексат, используемый при лечении опухолевых и ревматологических заболеваний, также вызывает Л-ИЗЛ.
Метотрексат, используемый при лечении опухолевых и ревматологических заболеваний, также вызывает Л-ИЗЛ.
Блеомицин (Bleomycin)
Блеомицин, используемый в основном для лечения лимфомы Ходжкина и герминогенных опухолей, вызывает повреждение легких посредством иммуноопосредованного и прямого токсического действия [12]. Риск ИЗЛ составляет 6,8–21%, а уровень смертности достигает 48% [12–14]. Клинические проявления блеомицин-индуцированного повреждения легких сильно варьируют, причем болезнь может протекать бессимптомно. До 39% случаев выявляются только на рентгенограмме или МСКТ грудной клетки [13, 14]. Нарушения легочной функции встречаются часто и включают раннее снижение диффузионной способности легких (ДСЛ) по монооксиду углерода (DLCO) с последующим уменьшением форсированной жизненной емкости легких (ФЖЕЛ), что коррелирует с ухудшением симптомов заболевания [12, 13].
Л-ИЗЛ может возникнуть в любой период лечения. У пациентов с герминогенными опухолями, получавшими высокие дозы блеомицина, среднее время развития Л-ИЗЛ составило 4,2 мес от начала лечения. Кумулятивные дозы более 300 000 МЕ связаны с 3,5-кратным увеличением риска Л-ИЗЛ [14]. Также описаны редкие реакции по типу идиосинкразии на прием низких доз в начале курса лечения [12, 14].
Кумулятивные дозы более 300 000 МЕ связаны с 3,5-кратным увеличением риска Л-ИЗЛ [14]. Также описаны редкие реакции по типу идиосинкразии на прием низких доз в начале курса лечения [12, 14].
Гемцитабин (Gemcitabine)
Гемцитабин используется для лечения опухолевых заболеваний, включая немелкоклеточный рак легких (НМРЛ), рак поджелудочной железы и рак молочной железы [8, 15]. Риск развития Л-ИЗЛ возрастает при комбинации его с другими препаратами, особенно блеомицином, эрлотинибом и таксанами [15–17], при этом заболеваемость составляет 1–20%. Смертность, как правило, низкая [15], за исключением тяжелых случаев, когда требуется госпитализация [18]. В отличие от блеомицина не было взаимосвязи между дозой и началом развития заболевания [15, 16].
В ретроспективном исследовании 25 924 пациентов, получавших гемцитабин, Л-ИЗЛ выявлено в 0,6% случаев. Медиана времени начала болезни составила 65 дней, а кумулятивная заболеваемость – 1,1, 1,5 и 1,9% через 3, 6 и 12 мес соответственно. Общие показатели заболеваемости были одинаковыми при монотерапии (1,7%) и комбинированной терапии (1,6%) [17].
Общие показатели заболеваемости были одинаковыми при монотерапии (1,7%) и комбинированной терапии (1,6%) [17].
Препараты, направленные на рецептор эпидермального фактора роста
EGFR-таргетные препараты включают низкомолекулярные ингибиторы тирозинкиназного рецептора (RTKI) и моноклональные антитела, используемые для лечения НМРЛ, рака молочной железы и колоректального рака [18, 19]. Заболеваемость Л-ИЗЛ при лечении гефитинибом и эрлотинибом составляет 1,2–1,6%, смертность достигает 22,8%. Л-ИЗЛ развивается в течение 4 нед от начала лечения [8, 19].
В недавнем постмаркетинговом исследовании частота Л-ИЗЛ при EGFR-таргетной терапии моноклональными антителами панитумумаб и цетуксимаб составила 1,3 и 1,2% соответственно с началом заболевания в среднем на 101 день [18]. В другом исследовании показано, что заболевание начиналось в среднем через 113 дней после введения первой дозы панитумумаба, причем в 28% случаев возникло после 6 мес терапии [20]. Примечательно, что многие пациенты также получали и другие препараты, имеющие риск развития Л-ИЗЛ. Смертность при Л-ИЗЛ, связанных с цетуксимабом и панитумумабом, составила 42 и 51% соответственно [8].
Смертность при Л-ИЗЛ, связанных с цетуксимабом и панитумумабом, составила 42 и 51% соответственно [8].
Ингибиторы mTOR (мишени рапамицина в клетках)
Ингибиторы mTOR используются преимущественно для лечения почечно-клеточного рака и нейроэндокринных опухолей, а также в качестве средств, подавляющих отторжение трансплантата [21, 22]. Сиролимус, темсиролимус и эверолимус ассоциированы с легочной токсичностью [22, 23]. Метаанализ 5 клинических исследований, включавших 2233 больных злокачественными опухолевыми заболеваниями, которые получали эверолимус, показал, что заболеваемость Л-ИЗЛ составляет 10,4%, не выявлено связи с продолжительностью лечения и видом опухоли [23].
Анализ МСКТ-данных после клинических исследований темсиролимуса и эверолимуса продемонстрировал, что частота рентгенологических изменений, характерных для Л-ИЗЛ, значительно выше, чем клинических (в группе эверолимус – 54% против 13,5%; в группе темсиролимус – 29% против 6%) [22]. Заболеваемость Л-ИЗЛ у реципиентов с трансплантацией органов варьировала от 2,8 до 12,7% [21].
Ингибиторы контрольных точек иммунного ответа (Immune Checkpoint Inhibitors)
Ингибиторы контрольных точек запрограммированной гибели клеток 1 (PD-1) и его лигандов (PD-L1 и PD-L2), а также антиген 4 цитотоксических Т-лимфоцитов (CTLA-4) относятся к новым классам препаратов, используемых при лечении метастатической меланомы, НМРЛ и лимфомы Ходжкина [24, 25]. Метаанализ клинических испытаний ингибиторов PD-1 и PD-L1 выявил частоту заболеваемости Л-ИЗЛ 3,6% для ингибиторов PD-1 (ниволумаб, пембролизумаб) и 1,1% для ингибиторов PD-L1 (авелумаб и дурвалумаб). Заболеваемость, степень тяжести и смертность от Л-ИЗЛ были выше у ингибиторов PD-1 по сравнению с PD-L1, при этом смертность составила 8%. Не выявлена связь с дозой препаратов или продолжительностью лечения [25].
В наблюдательном исследовании с участием 1826 больных опухолевыми заболеваниями, получавших ингибиторы контрольных точек, частота заболеваемости Л-ИЗЛ составила 3,5%, смертность – 9,4%. Время начала заболевания варьировало от 0,2 до 27,4 мес, причем 42% приходилось на первые 2 мес лечения [24]. При комбинированной терапии заболеваемость Л-ИЗЛ была выше по сравнению с монотерапией [26].
При комбинированной терапии заболеваемость Л-ИЗЛ была выше по сравнению с монотерапией [26].
Препараты, применяемые в ревматологии
В ревматологии анализ Л-ИЗЛ затруднен из-за фоновой распространенности ИЗЛ, особенно ревматоидного артрита. Кроме того, многие БМАРП являются иммунодепрессантами и связаны с повышенным риском развития оппортунистической инфекции, что затрудняет дифференциальную диагностику обострения респираторных симптомов.
Метотрексат (Methotrexate)
Mетотрексат является одним из наиболее часто используемых препаратов в ревматологии, а также при лечении опухолевых заболеваний. Показано, что частота Л-ИЗЛ у пациентов с ревматоидным артритом, получавших низкие дозы метотрексата, составила 0,3–2,1% [27]. Два метаанализа сравнивали показатели Л-ИЗЛ при лечении комбинацией метотрексата с другими БМАРП больных ревматоидным артритом и воспалительными заболеваниями без ревматоидного артрита [27, 28]. При ревматоидном артрите частота метотрексат-индуцированного ИЗЛ составила 0,28%, а в группе больных, получающих БМАРП, не выявлено ни одного случая [27]. У пациентов с другими воспалительными заболеваниями, получавшими метотрексат, не отмечен риск развития Л-ИЗЛ [28].
У пациентов с другими воспалительными заболеваниями, получавшими метотрексат, не отмечен риск развития Л-ИЗЛ [28].
Mетотрексат-индуцированное ИЗЛ имеет разное время и частоту возникновения, не зависит от дозы препарата [29]. В одном исследовании 48% случаев развились в течение 32 нед после начала лечения, а в другом – среднее время начала Л-ИЗЛ составило 23 дня. Описаны случаи Л-ИЗЛ, возникшие в период до 4 лет после начала лечения или после прекращения лечения. Л-ИЗЛ рецидивирует примерно в 1/3 случаев и имеет высокую смертность (10–30%) [30].
Лефлуномид (Leflunomide)
В наблюдательном исследовании с участием 5045 пациентов, получавших лефлуномид, новое ИЗЛ выявлено в 1,2%, а ранее имевшееся ИЗЛ ухудшилось в 5,7% случаев. В другом исследовании большинство пациентов оценены через 20 нед лечения. В этих исследованиях смертность составила 19 и 41%. В исследовании «случай–контроль» продемонстрировано значимое увеличение заболеваемости на лефлуномид. Тем не менее использование высокой дозы и низкая масса тела были в значительной степени связаны с Л-ИЗЛ, что указывает на токсичность лефлуномида [31]. Ранее сообщалось, что наличие ИЗЛ в анамнезе, курение и предшествующий прием метотрексата увеличивали частоту Л-ИЗЛ на лефлуномид. После рекомендаций не принимать лефлуномид и проявлять осторожность у пациентов с низкой массой тела или ИЗЛ в анамнезе частота ИЗЛ снизилась в 2,3 раза [8]. Метаанализ клинических исследований не обнаружил увеличения частоты побочных реакций со стороны легких при лечении лефлуномидом [31, 32].
Ранее сообщалось, что наличие ИЗЛ в анамнезе, курение и предшествующий прием метотрексата увеличивали частоту Л-ИЗЛ на лефлуномид. После рекомендаций не принимать лефлуномид и проявлять осторожность у пациентов с низкой массой тела или ИЗЛ в анамнезе частота ИЗЛ снизилась в 2,3 раза [8]. Метаанализ клинических исследований не обнаружил увеличения частоты побочных реакций со стороны легких при лечении лефлуномидом [31, 32].
Биологические БМАРП
Опубликованы многочисленные случаи подозрения на Л-ИЗЛ, связанные с препаратами фактора некроза опухолей (ФНО), хотя убедительных доказательств причинно-следственной связи не получено. Данные постмаркетингового наблюдения свидетельствуют о частоте заболеваемости 0,6% для новых или прогрессирующих ИЗЛ у пациентов, получавших моноклональные антитела к ФНО [33]. В когортных исследованиях не выявлено различий в частоте развития ИЗЛ между пациентами, получавшими анти-ФНО-терапию и другие виды БМАРП, однако сравнительные исследования не проводились [34].
В обзоре опубликован отчет о 29% смертельных случаев в группе пациентов с Л-ИЗЛ, получавших анти-ФНО-препараты, причем 70% смертей произошло в течение 5 нед после появления симптомов. Самая высокая смертность была у пожилых пациентов с ИЗЛ в анамнезе и больных, получающих иммуносупрессивную терапию. В систематических обзорах выявлены случаи Л-ИЗЛ, связанного с другими биологическими БМАРП, включая тоцилизумаб (ингибитор интерлейкина-6) и ритуксимаб [33, 35]. Другие обзоры опубликовали единичные случаи ритуксимаб-индуцированного ИЗЛ. В большинстве случаев это были пациенты с онкологическими заболеваниями с острой или подострой формой ИЗЛ во время 4-го цикла лечения. Летальность составила 18–37,5% [35, 36].
Антибактериальная терапия
Нитрофурантоин обычно используется для лечения и профилактики инфекций мочевыводящих путей. На Л-ИЗЛ приходится 16–48% побочных эффектов, связанных с нитрофурантоином. Также в исследованиях регистра сообщалось о 447 случаях Л-ИЗЛ, связанных с данным препаратом, у 90% пациентов были острые реакции со стороны легких. Частота госпитализации составила 75%, а смертность пациентов с острыми реакциями и хронической интерстициальной пневмонией – 0,5 и 8% соответственно [37].
Частота госпитализации составила 75%, а смертность пациентов с острыми реакциями и хронической интерстициальной пневмонией – 0,5 и 8% соответственно [37].
Реакция гиперчувствительности может возникнуть в первые дни лечения или в течение нескольких часов, если ранее имел место прием нитрофурантоина. Хроническая интерстициальная пневмония является более редким проявлением, имитирующим легочный фиброз, и в основном встречается у пациентов, длительно получающих препарат с профилактической целью [37]. В исследовании «случай–контроль» сравнивалась частота возникновения ИЗЛ на нитрофурантоин и другие антибактериальные препараты [38]. В целом отношение риска Л-ИЗЛ не было увеличено для нитрофурантоина. Абсолютный риск был выше при длительном приеме препарата по сравнению с кратковременной терапией, а также у пожилых пациентов.
Даптомицин, применяемый при лечении тяжелых инфекций, связан с риском развития эозинофильного Л-ИЗЛ. В ретроспективном исследовании 102 пациентов, получавших даптомицин, Л-ИЗЛ с эозинофилией развилось в 2,9% случаев [38].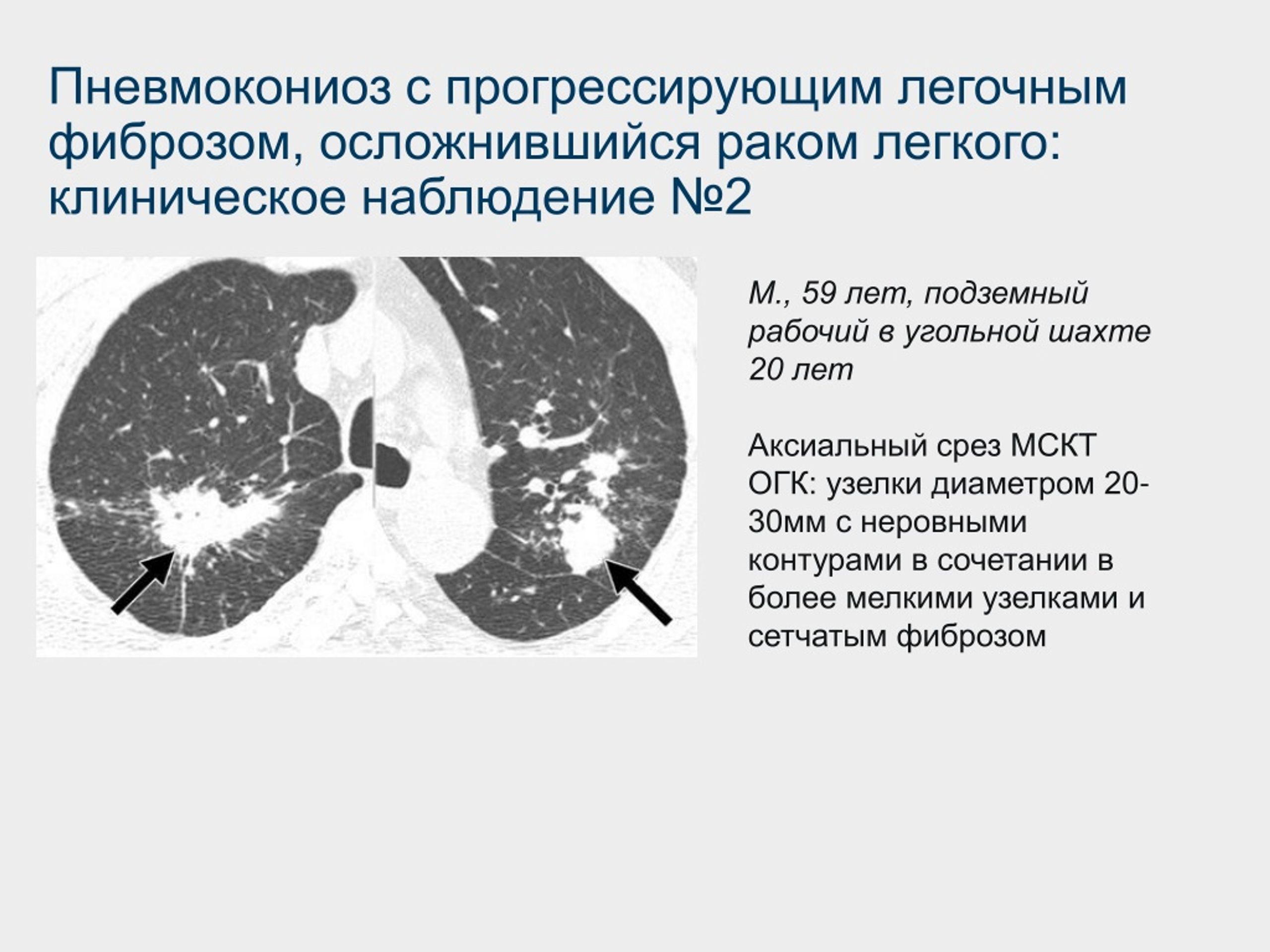 Обзор базы данных FDA (Управление по контролю пищевых продуктов и лекарств в США) выявил 7 подтвержденных, 23 вероятных и 38 возможных случаев даптомицин-индуцированной эозинофильной пневмонии в период между 2004 и 2010 гг. Следует отметить, что в этом наблюдении все пациенты выздоровели [39].
Обзор базы данных FDA (Управление по контролю пищевых продуктов и лекарств в США) выявил 7 подтвержденных, 23 вероятных и 38 возможных случаев даптомицин-индуцированной эозинофильной пневмонии в период между 2004 и 2010 гг. Следует отметить, что в этом наблюдении все пациенты выздоровели [39].
Амиодарон
Амиодарон является одной из наиболее частых причин Л-ИЗЛ в регистрах [6] с зарегистрированной заболеваемостью 1,2–8,8% и смертностью 3–37% [40, 41]. В ретроспективном исследовании 500 пациентов, получавших амиодарон, у 8% выявлено Л-ИЗЛ, больные наблюдались в среднем 4 года. Кумулятивная заболеваемость через 1, 3 и 5 лет составила 4,2, 7,8 и 10,6% соответственно, с предполагаемой годичной заболеваемостью 2,1%. Чаще всего диагностирована подострая форма Л-ИЗЛ [42]. В другом исследовании, в котором оценивались 90-дневные результаты у пациентов, госпитализированных с амиодарон-ассоциированным ИЗЛ, сообщалось о смертности 37% с пребыванием в стационаре в среднем 17 дней. Клиническое выздоровление наступало в среднем через 36 мес, однако в 66% случаев развивался фиброз [40].
Кумулятивная доза является важным фактором риска для амиодарон-ассоциированного ИЗЛ, и комбинация высоких доз в течение длительного периода более тесно связана с Л-ИЗЛ, чем оба фактора по отдельности [8].
Факторы риска Л-ИЗЛ
Факторы риска развития Л-ИЗЛ варьируют в зависимости от формы заболевания, дозы препарата и популяции больных. Определенные факторы риска характерны для разных лекарственных средств.
Возраст. Пожилой возраст определен как наиболее значимый фактор риска развития Л-ИЗЛ при лечении блеомицином, гемцитабином, EGFR-таргетными препаратами, лефлуномидом, метотрексатом, амиодароном и нитрофурантоином [14, 17, 18, 29, 31, 37]. Для мониторинга Л-ИЗЛ у пациентов старше 60 лет при лечении блеомицином рекомендуется снижение дозы вместе с еженедельной рентгенографией грудной клетки и тщательным наблюдением после завершения терапии. Не обнаружено связи с возрастом при лечении ингибиторами mTOR [25].
Заболевание легких в анамнезе. Наличие ИЗЛ или идиопатического легочного фиброза у пациента является независимым фактором риска развития Л-ИЗЛ на прием различных препаратов [22, 33, 43, 44]. Например, ИЗЛ в анамнезе у пациентов с НМРЛ было связано с повышением риска развития Л-ИЗЛ в 3,2 раза [19]. Повышенный риск Л-ИЗЛ наблюдается у пациентов с хронической обструктивной болезнью легких, бронхоэктазией и асбестозом [43, 45].
Наличие ИЗЛ или идиопатического легочного фиброза у пациента является независимым фактором риска развития Л-ИЗЛ на прием различных препаратов [22, 33, 43, 44]. Например, ИЗЛ в анамнезе у пациентов с НМРЛ было связано с повышением риска развития Л-ИЗЛ в 3,2 раза [19]. Повышенный риск Л-ИЗЛ наблюдается у пациентов с хронической обструктивной болезнью легких, бронхоэктазией и асбестозом [43, 45].
Курение. Курильщики имеют риск развития Л-ИЗЛ при лечении гемцитабином, EGFR-препаратами и метотрексатом [18, 29, 45].
Доза препарата. Связь между дозой препарата и заболеваемостью Л-ИЗЛ выявлена при лечении блеомицином, амиодароном и нитрофурантоином. Хотя в других исследованиях получены противоречивые результаты [21, 22].
Основные характеристики заболевания. Тяжелое состояние и прогрессирующие или метастатические стадии опухолевых заболеваний являются независимыми факторами риска развития Л-ИЗЛ [17, 18, 44]. В постмаркетинговом исследовании показан более высокий риск развития Л-ИЗЛ у пациентов с НМРЛ, получавших гемцитабин, по сравнению с больными, которые получали этот препарат от других видов рака [18]. При ревматоидном артрите риск метотрексат-индуцированного ИЗЛ был повышен у пациентов с высокими концентрациями маркеров воспаления, низким альбумином и внесуставными проявлениями [33].
В постмаркетинговом исследовании показан более высокий риск развития Л-ИЗЛ у пациентов с НМРЛ, получавших гемцитабин, по сравнению с больными, которые получали этот препарат от других видов рака [18]. При ревматоидном артрите риск метотрексат-индуцированного ИЗЛ был повышен у пациентов с высокими концентрациями маркеров воспаления, низким альбумином и внесуставными проявлениями [33].
Пол. Мужской пол отмечен как фактор риска Л-ИЗЛ при лечении ингибиторами EFGR, пеметрекседом, метотрексатом и амиодароном [18, 29, 43].
Другие методы лечения. В 2 исследованиях (в одном пациенты получали эрлотиниб, в другом – ингибиторы контрольных точек иммунного ответа) обнаружено, что повторное лечение одним или другим препаратом из этого класса несет меньший риск развития Л-ИЗЛ [19, 25]. Риск развития лекарственно-ассоциированного ИЗЛ повышен у пациентов с раком легкого после лучевой терапии [19]. При ревматоидном артрите предшествующее лечение метотрексатом увеличивало риск развития лефлуномид-индуцированного ИЗЛ, а предшествующая БМАРП-терапия имела высокий риск развития ИЗЛ на метотрексат [29].
Другие факторы риска. Другие потенциальные факторы риска Л-ИЗЛ включают генетическую предрасположенность, злоупотребление алкоголем, почечную недостаточность и сахарный диабет [15, 19, 29]. Показано, что некоторые аллельные варианты HLA связаны с Л-ИЗЛ после комбинированной терапии эрлотинибом и гемцитабином [46]. Л-ИЗЛ развивалось чаще при назначении сиролимуса на более поздней стадии отторжения трансплантата или нарушении функции почек [47].
Диагностика Л-ИЗЛ
Рентгенологическое исследование
Односторонние или, чаще, двусторонние легочные инфильтраты на рентгенограмме грудной клетки могут быть первым признаком Л-ИЗЛ. Однако в 25–75% случаев при клиническом подозрении на Л-ИЗЛ рентгенограммы грудной клетки были в норме [8].
МСКТ обладает высокой чувствительностью при выявлении особенностей ИЗЛ и является предпочтительным методом визуализации [22]. Основными ограничениями считаются воздействие ионизирующей радиации (проблема сводится к минимуму современными сканерами) и использование итеративной реконструкции. До настоящего времени оценка МСКТ не была специфичной для Л-ИЗЛ, так как многочисленные паттерны интерстициальных изменений обычно наблюдаются при других ИЗЛ.
До настоящего времени оценка МСКТ не была специфичной для Л-ИЗЛ, так как многочисленные паттерны интерстициальных изменений обычно наблюдаются при других ИЗЛ.
Исследования, посвященные оценке МСКТ при Л-ИЗЛ, ограничены противоречивой терминологией, существовавшей до 2013 г. [3]. Термин «хроническая интерстициальная пневмония» был общим в более ранних исследованиях [10, 11], затем использовался с ограничением из-за плохого соответствия между рентгенологическими и патологическими данными [11, 48]. В нескольких исследованиях сравнивались гистопатологические и МСКТ-данные при Л-ИЗЛ [11, 36, 48]. Проспективное исследование 42 пациентов с Л-ИЗЛ, которым брали трансбронхиальную биопсию или бронхоальвеолярный лаваж (БАЛ), показало диагностическое совпадение в 67% случаев [11]. МСКТ-картина диффузного альвеолярного повреждения (ДАП) в высокой степени согласуется с его гистопатологическими признаками [3] и сопровождается высокой смертностью [18, 20, 43, 49, 50].
Л-ИЗЛ чаще всего проявляется как затемнения по типу «матового стекла» с консолидацией или без нее [8, 40, 51] и имеет базальное, периферическое и билатеральное распределение, часто затрагивая много долей [52]. Гетерогенность описания затрудняет установление истинной частоты каждого паттерна. Чаще всего встречаются изменения, напоминающие криптогенную организующуюся пневмонию (КОП) и неспецифическую интерстициальную пневмонию – НСИП (рис. 1), реже – гиперчувствительный пневмонит (ГП)-подобные изменения [11, 20, 50, 52].
Гетерогенность описания затрудняет установление истинной частоты каждого паттерна. Чаще всего встречаются изменения, напоминающие криптогенную организующуюся пневмонию (КОП) и неспецифическую интерстициальную пневмонию – НСИП (рис. 1), реже – гиперчувствительный пневмонит (ГП)-подобные изменения [11, 20, 50, 52].
Рис. 1. МСКТ-паттерны Л-ИЗЛ: а – КОП; б – НСИП.
Паттерн НСИП чаще встречается у пациентов с Л-ИЗЛ, вызванным химиотерапией [9]. Ретикулярные изменения и уменьшение объема легких выявляются реже [36]. В современной классификации это соответствует фиброзирующей НСИП или обычной интерстициальной пневмонии [3]. Реже обнаруживаются внутригрудная лимфаденопатия и плевральный выпот [53]. Проявления, напоминающие саркоидоз, описаны при лечении интерфероном α [11]. Также при Л-ИЗЛ может встречаться другой паттерн затемнения по типу «матового стекла» с утолщением междольковых перегородок (симптом «сумасшедшей исчерченности»), имеющий низкие чувствительность и специфичность [53].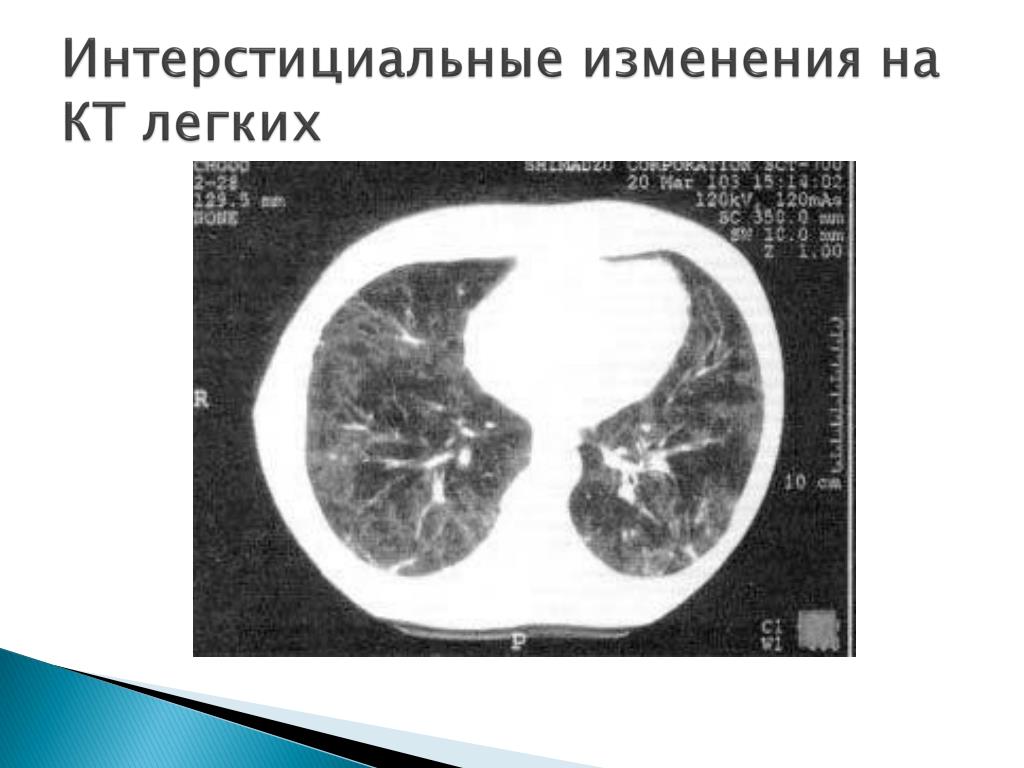
Качественные характеристики МСКТ не являются специфичными для Л-ИЗЛ, так как другие причины подобных рентгенологических паттернов, такие как атипичные инфекции (особенно у пациентов с ослабленным иммунитетом) или ИЗЛ, связанные с заболеваниями соединительной ткани, могут затруднять интерпретацию [22]. Кроме того, рентгенологические паттерны ИЗЛ, вызванного одним препаратом, сильно варьируют (например, паттерны НСИП, ДАП и КОП наблюдаются при ИЗЛ, индуцированной амиодароном) [17], и, наоборот, один и тот же паттерн может быть характерным для других препаратов (например, КОП-подобный паттерн выявляется у пациентов, получающих амиодарон, RTKI и ингибиторы иммунных контрольных точек) [20, 24, 41].
Легочная функция
Оценка функции легких важна при подозрении на Л-ИЗЛ, но, как и МСКТ, она не обладает высокой специфичностью. Нарушения легочной функции могут варьировать от обструктивных нарушений, вызванных бронхоспазмом или облитерирующим бронхиолитом, до тяжелых нарушений ДСЛ вследствие легочного фиброза. Большинство препаратов вызывает рестриктивные нарушения легочной вентиляции с уменьшением легочных объемов и снижением DLCO [54].
Большинство препаратов вызывает рестриктивные нарушения легочной вентиляции с уменьшением легочных объемов и снижением DLCO [54].
Снижение ДСЛ является предсимптомной находкой при Л-ИЗЛ, а изменения ФЖЕЛ коррелируют с клиническим прогрессированием у пациентов, получающих блеомицин. При обследовании пациентов с подозрением на блеомицин-индуцированное ИЗЛ изменения легочной функции выявлены только в 22% случаев [12]. В другом исследовании оценивалась диагностическая значимость изменения DLCO у пациентов, получавших амиодарон. Чувствительность составила 76, 68 и 59% при снижении DLCO на 10, 15 и 20% соответственно [8]. В исследовании нитрофурантоин-индуцированного Л-ИЗЛ все пациенты имели нарушения DLCO, однако снижение ФЖЕЛ выявлено лишь в 12% случаев [54].
Бронхоальвеолярный лаваж
Бронхоскопия с БАЛ – инвазивный метод, который может помочь в диагностике и дифференциальной диагностике инфильтративных заболеваний легких. Анализ БАЛ в сочетании с клиническими и рентгенологическими данными позволяет установить диагноз [51]. Результаты дифференцировки клеток БАЛ с лимфоцитарным (>15%), нейтрофильным (>3%), эозинофильным (>2%) или смешанным клеточным паттерном также могут использоваться в диагностике [50, 55], хотя не являются специфическими для Л-ИЗЛ, так как подобная картина может наблюдаться при воспалительных или инфекционных заболеваниях легких [51].
Результаты дифференцировки клеток БАЛ с лимфоцитарным (>15%), нейтрофильным (>3%), эозинофильным (>2%) или смешанным клеточным паттерном также могут использоваться в диагностике [50, 55], хотя не являются специфическими для Л-ИЗЛ, так как подобная картина может наблюдаться при воспалительных или инфекционных заболеваниях легких [51].
Клеточный состав БАЛ при различных ИЗЛ [51] | |
Нейтрофильный | Идиопатический легочный фиброз, острый респираторный дистресс-синдром, коллагенозы, асбестоз, гранулематоз с полиангиитом |
Эозинофильный | Аллергический бронхолегочный аспергиллез, эозинофильный гранулематоз с полиангиитом, эозинофильные пневмонии, идиопатический гиперэозинофильный синдром |
Лимфоцитарный | Саркоидоз, бериллиоз, ГП, силикоз, болезнь Крона |
Смешанно-клеточный | КОП, коллагенозы, НСИП |
В таблице приведены типичные результаты БАЛ при Л-ИЗЛ, вызванных лекарственными препаратами..gif) Например, при ГП анализ БАЛ характеризуется лимфоцитозом, низким соотношением CD4 к CD8, иногда увеличением нейтрофилов, хотя это неспецифично для Л-ИЗЛ [55, 56]. Другие данные включают такие клеточные нарушения, как увеличение ядер и гиперхромазия, липидные включения и гемосидериннагруженные макрофаги [11]. Наличие реактивных пневмоцитов II типа также описано в тяжелых случаях Л-ИЗЛ [8].
Например, при ГП анализ БАЛ характеризуется лимфоцитозом, низким соотношением CD4 к CD8, иногда увеличением нейтрофилов, хотя это неспецифично для Л-ИЗЛ [55, 56]. Другие данные включают такие клеточные нарушения, как увеличение ядер и гиперхромазия, липидные включения и гемосидериннагруженные макрофаги [11]. Наличие реактивных пневмоцитов II типа также описано в тяжелых случаях Л-ИЗЛ [8].
Обнаружение оппортунистической инфекции в БАЛ помогает при дифференциальной диагностике большинства Л-ИЗЛ. В некоторых исследованиях это привело к пересмотру диагноза в случаях с подозрением на Л-ИЗЛ. В исследовании, включавшем 26 пациентов, которые получали эверолимус, впоследствии диагностирован Pneumocystis jiroveci в 46% случаев [21]. В настоящее время основная роль БАЛ состоит в исключении других причин ИЗЛ, особенно инфекции.
Биопсия легких
Лекарственные препараты могут вызывать практически все гистопатологические паттерны интерстициальной пневмонии, включая ГП, КОП, НСИП (см. рис. 2 на цветной вклейке), ДАП, эозинофильную пневмонию, облитерирующий бронхиолит, кровоизлияние и гранулематозный пневмонит [11, 20, 36, 50, 51]. Большинство препаратов сопоставимого класса может сопровождаться одинаковым гистопатологическим поражением легких, что указывает на общий механизм. Однако некоторые лекарства способны вызывать более одного паттерна гистопатологического поражения у одного и того же пациента. Эти реакции могут проявляться остро, подостро или хронически.
рис. 2 на цветной вклейке), ДАП, эозинофильную пневмонию, облитерирующий бронхиолит, кровоизлияние и гранулематозный пневмонит [11, 20, 36, 50, 51]. Большинство препаратов сопоставимого класса может сопровождаться одинаковым гистопатологическим поражением легких, что указывает на общий механизм. Однако некоторые лекарства способны вызывать более одного паттерна гистопатологического поражения у одного и того же пациента. Эти реакции могут проявляться остро, подостро или хронически.
Рис. 2 Характерные гистологические паттерны Л-ИЗЛ: а-ГП; б-КОП; в-НСИП
Роль биопсии легкого ограничена небольшими исследованиями. Опубликованы все гистопатологические паттерны, но ни один из них не является патогномоничным для Л-ИЗЛ [11]. Поэтому существует ограниченное количество доказательств для рутинного использования биопсии в диагностике Л-ИЗЛ. Как и БАЛ, она может быть проведена в диагностически сложных случаях и для исключения других причин ИЗЛ.
Биомаркеры
Krebs von den Lungen-6 (KL-6) представляет собой муциноподобный гликопротеин, секретируемый альвеолярными пневмоцитами II типа и эпителиальными клетками бронхов в ответ на повреждение и регенерацию при ИЗЛ. В проспективном исследовании у 53% пациентов с Л-ИЗЛ наблюдалось повышение уровня KL-6, что коррелировало с паттерном ДАП и более обширным поражением легких [10]. Динамическое изменение уровня KL-6 коррелировало с клиническим течением заболевания. Во втором исследовании сообщалось о прогностической связи между отношением KL-6 к сиалилу стадиеспецифического эмбрионального антигена-1 (SSEA-1) и последующим Л-ИЗЛ у пациентов с раком легкого, получающих химиотерапию [49]. Однако специфичность KL-6 при Л-ИЗЛ не установлена. Другие биомаркеры, включая эозинофилию периферической крови и высокие уровни маркеров воспаления, неспецифичны и не имеют диагностической ценности при Л-ИЗЛ.
В проспективном исследовании у 53% пациентов с Л-ИЗЛ наблюдалось повышение уровня KL-6, что коррелировало с паттерном ДАП и более обширным поражением легких [10]. Динамическое изменение уровня KL-6 коррелировало с клиническим течением заболевания. Во втором исследовании сообщалось о прогностической связи между отношением KL-6 к сиалилу стадиеспецифического эмбрионального антигена-1 (SSEA-1) и последующим Л-ИЗЛ у пациентов с раком легкого, получающих химиотерапию [49]. Однако специфичность KL-6 при Л-ИЗЛ не установлена. Другие биомаркеры, включая эозинофилию периферической крови и высокие уровни маркеров воспаления, неспецифичны и не имеют диагностической ценности при Л-ИЗЛ.
Лечение Л-ИЗЛ
Данные об эффективности ГК при лечении Л-ИЗЛ различаются. Из 75 пациентов с опухолевыми заболеваниями и иринотекан-индуцированным ИЗЛ, получавших ГК, выздоровление зафиксировано в 61% случаев. Из 10 пациентов с Л-ИЗЛ на пеметрексед, получавших ГК, 5 человек ответили на лечение, 4 – не ответили, 1 – умер [43]. В другом исследовании сообщили о 100% выздоровлении после прекращения приема препаратов и терапии ГК 6 пациентов с Л-ИЗЛ, получавших комбинированную терапию гемцитабином и доцетакселом [8]. При анализе Л-ИЗЛ вследствие разных причин 62% пациентов получали ГК, а остальные 38% выздоровели без поддерживающей терапии ГК [9]. Ретроспективный характер этих исследований и отсутствие четких критериев для назначения ГК означают, что данные препараты в основном используются у пациентов с тяжелыми заболеваниями и паттерном ДАП.
В другом исследовании сообщили о 100% выздоровлении после прекращения приема препаратов и терапии ГК 6 пациентов с Л-ИЗЛ, получавших комбинированную терапию гемцитабином и доцетакселом [8]. При анализе Л-ИЗЛ вследствие разных причин 62% пациентов получали ГК, а остальные 38% выздоровели без поддерживающей терапии ГК [9]. Ретроспективный характер этих исследований и отсутствие четких критериев для назначения ГК означают, что данные препараты в основном используются у пациентов с тяжелыми заболеваниями и паттерном ДАП.
Дозы ГК варьировали в широких пределах и включали высокие дозы перорального и внутривенного метилпреднизолона, при этом дозировка и длительность отчасти определялись рентгенологической картиной [57]. K. Takatani и соавт. сообщили о средней кумулятивной дозе 5240 мг преднизолона для ДАП по сравнению с 2722 мг для КОП, 415 мг для ГП и 264 мг для НСИП [50]. Слабые подтверждающие данные о роли ГК предполагаются повышенным риском рецидива Л-ИЗЛ после прекращения приема или ранней отмены ГК (в течение 3 мес после начала заболевания) [40]. Преимущества высоких дозировок ГК не установлены.
Преимущества высоких дозировок ГК не установлены.
Паттерн ДАП имеет худший прогноз. В одном исследовании ни один из пациентов с ДАП не ответил на лечение ГК, и общая смертность составила 37,5%. Однако есть данные об улучшении МСКТ-паттерна на фоне ГК-терапии: 75% при КОП, 45,8% – НСИП и 36,4% – ГП [9].
Несмотря на то, что ГК-терапия использовалась во многих исследованиях, в настоящее время нет доказательств, на основании которых можно рекомендовать использование ГК при Л-ИЗЛ. Следует отметить, что терапия ГК рекомендуется у пациентов с тяжелым поражением, с режимами дозирования по усмотрению лечащего врача. Для разработки рекомендаций по лечению необходимы дальнейшие исследования.
Прогноз
Прогноз Л-ИЗЛ варьирует между препаратами и исследованиями. Полное выздоровление возможно после снижения дозы, отмены препарата и/или одновременном использовании ГК [19, 22, 36]. Тем не менее у большей части пациентов с Л-ИЗЛ не бывает улучшения или наблюдается прогрессирующее течение заболевания [16, 19].
Смертность от Л-ИЗЛ часто обусловлена дыхательной недостаточностью, полиорганной недостаточностью, прогрессированием основного заболевания или неблагоприятными эффектами терапии ГК. У пациентов с онкологическими заболеваниями смертность колеблется от 14 до 51% [13, 18, 19, 40, 45], в то время как у неонкологических больных она варьирует от 0 до 41% [15, 30, 58].
Острые и тяжелые проявления являются предикторами смертности. В частности, потребность в искусственной вентиляции легких связана со смертностью более 60% [59]. Быстрое развитие симптомов, начальная тяжесть заболевания и гипоксемия в момент выявления болезни также предсказывают высокую смертность [40]. Большая степень повреждения легких и гомогенный паттерн при МСКТ связаны с более высокой смертностью у пациентов, получавших амиодарон [58]. При ДАП-паттерне смертность составляет 40–83% [18, 19, 48]. Следует отметить, что при диффузных затемнениях по типу «матового стекла» часто наблюдается полное восстановление МСКТ-картины [43].
Заключение
В настоящее время известно более 450 лекарственных препаратов, которые вызывают ИЗЛ. Однако нет единого диагностического подхода к обследованию пациентов с подозрением на Л-ИЗЛ. Клинические и рентгенологические особенности Л-ИЗЛ часто трудно отличить от других причин ИЗЛ (например, инфекции, повреждения легких при злокачественных новообразованиях и заболеваниях соединительной ткани), и нет характерных клинико-рентгенологических показателей. Важное значение имеет оценка корреляций клинических и лабораторных данных и рентгенологической картины. МСКТ-визуализация играет важную роль в выявлении изменений в легких, однако не существует рентгенологических паттернов, специфичных для Л-ИЗЛ. Несмотря на то, что БАЛ и биопсия легких не считаются патогномоничными методами выявления лекарственной токсичности, они позволяют исключить ИЗЛ и инфекцию, выявить характер повреждения паренхимы легкого. Необходимы дальнейшие клинические и наблюдательные исследования, поиск и валидация биомаркеров для раннего выявления Л-ИЗЛ и дифференциации от других причин. Для оптимального ведения пациентов в будущем необходима разработка доказательной базы лечения Л-ИЗЛ, в том числе клинические испытания эффективности и оптимального дозирования ГК.
Для оптимального ведения пациентов в будущем необходима разработка доказательной базы лечения Л-ИЗЛ, в том числе клинические испытания эффективности и оптимального дозирования ГК.
Компьютерная томография в оценке формирования различных типов пневмофиброза у больных интерстициальными заболеваниями легких | Сперанская
1. Nishino M., Lee K.S., Itoh H. The spectrum of pulmonary sarcoidosis: variations of high-resolution CT findings and clues for specific diagnosis. Eur. J. Radiol. 2010; 73: 66–73.
2. Franquet T. Interstitial lung diseases. Торакальная радиология: Сб. трудов конгресса. СПб; 2012: 32–9.
3. Pellegrino R., Viegi G., Brusasco V., Crapo R.O., Burgos F., Casaburi R. et al. Interpretative strategies for lung function tests. Eur. Respir. J. 2005; 26: 948–68.
Eur. Respir. J. 2005; 26: 948–68.
4. Abehsera M., Valeyre D., Grenier P. Sarcoidosis with pulmonary fibrosis: CT patterns and correlation with pulmonary function. Am. J. Roentgenol. 2000; 174: 1751–7.
5. Flaherty K.R., Thwaite E.L., Kazerooni E.A. Radiological versus histological diagnosis in UIP and NSIP: survival implications. Thorax. 2003; 58: 143–8.
6. Kligerman S.J., Groshong S., Brown K.K. Nonspecific interstitial pneumonia: radiologic, clinical, and pathologic considerations. Radiographics. 2009; 29: 73–87.
7. Schmidt S.L., Sundaram B., Flaherty K.R. Diagnosing fibrotic lung disease: when is high-resolution computed tomography sufficient to make a diagnosis of idiopathic pulmonary fibrosis? Respirology. 2009; 14: 934–9.
2009; 14: 934–9.
8. Sumikawa H., Johkoh T., Ichikado K. Nonspecific interstitial pneumonia: histologic correlation with highresolution CT in 29 patients. Eur. J. Radiol. 2009; 70: 35–40.
9. Sverzellati N., De Filippo M., Bartalena T. High-resolution computed tomography in the diagnosis and follow-up of idiopathic pulmonary fibrosis. Evr. Radiol. 2010; 20: 88.
10. Tzilas V., Koti A., Papandrinopoulou D. Prognostic factors in idiopathic pulmonary fibrosis. Am. J. Med. Sci. 2009; 338: 481–5.
11. Verschakelen J.A. The role of highresolution computed tomography in the work-up of interstitial lung disease. Pulmonary Medicine. 2010; 16: 503–10.
Интерстициальная болезнь легких (часть 1)
Стенограмма клинического разбора, представленного доктором Рощиной Т.В. на II Международном Интернет Конгрессе специалистов по внутренним болезням.
Профессор Драпкина О.М.: – Клинико-анатомическую конференцию проведет академик Ивашкин Владимир Трофимович, она будет посвящена интерстициальной болезни легких. Случай доложит лечащий доктор той пациентки, Рощина Татьяна Викторовна.
(00:20) Заставка: Интерстициальная болезнь легких
Академик Ивашкин В.Т.: — Прежде, чем Татьяна Викторовна начнет, я хочу сделать небольшое предварительное введение, потому что случай, который мы с вами будем анализировать, довольно непростой. Хотя наша клинико-анатомическая конференция имеет тривиальное название «Интерстициальная болезнь легких», я очень сжато расскажу интригу для того, чтобы вам легче было следить, уважаемые коллеги, за тем, как развертывались события. А интрига очень простая, на самом деле довольно сложная.
Пациентка, которая довольно длительное время наблюдалась с диагнозом «интерстициальная болезнь легких», в очередной раз поступила в клинику, у нее развивается острая дыхательная недостаточность. Эта острая дыхательная недостаточность расценивается как результат пневмонии, пациентка умирает, а на секции, на аутопсии обнаруживают злокачественную опухоль легких и все признаки острого респираторного дистресс-синдрома. Поэтому этот треугольник – интерстициальная болезнь легких, злокачественное образование легких и острый респираторный дистресс-синдром – и составит основу, вокруг которой и будет раскручиваться вся клиническая интрига. Пожалуйста, Татьяна Викторовна.
Доктор Рощина Т.В.: — Спасибо, Владимир Трофимович. Моя миссия грустная, потому что я должна доложить этот трагичный случай, который произошел у нас в клинике. Это больная К., ей было всего 45 лет. Пациентка госпитализирована к нам в отделение 28 августа 2012 года. При поступлении пациентка предъявляла жалобы на одышку при выполнении умеренной физической нагрузки, сухой кашель, сердцебиение и общую слабость. Из анамнеза известно, что в 2008 году пациентка перенесла двустороннюю пневмонию. Проводилось лечение таваником с положительным эффектом, на фоне которого изменения разрешились, однако лечение пневмонии было очень упорным, и изменения в нижней доле справа сохранялись достаточно длительный период времени.
Начиная с 2011 года, у пациентки появляется одышка при выполнении ранее привычных физических нагрузок, и появление одышки заставляет пациентку обратиться за медицинской помощью амбулаторно. Ей выполняется флюорография и в дальнейшем проводится обследование в Городской клинической больнице №83. В клинической больнице пациентке проводится спирометрия, бодиплетизмография, ей выполняется исследование лабораторных анализов, в том числе фибробронхоскопия, которая выявила двусторонний атрофический бронхит и при цитологическом исследовании пролиферацию бронхиального эпителия.
На основании проведенного обследования был установлен диагноз – интерстициальное заболевание легких: идиопатический легочный фиброз, дыхательная недостаточность 1 степени. На данном слайде представлены те критерии Американского торакального общества, Европейского респираторного общества, которые необходимы для постановки диагноза интерстициальной болезни легких при отсутствии хирургической биопсии легкого.
У нашей пациентки были набраны все критерии, за исключением возраста, пациентка была младше 50 лет. Таким образом, этот диагноз можно считать достоверным для этой пациентки, и он был установлен в 83-й больнице, и с ним она была выписана. Однако в момент проведения бронхоскопии у пациентки внезапно возникла остановка дыхания и потеря сознания, в связи с чем для дальнейшего лечения она была переведена в отделение интенсивной терапии, где наблюдалась уже неврологами по поводу острой гипоксической энцефалопатии. Спустя месяц неврологическая симптоматика регрессировала, и пациентка в удовлетворительном состоянии была выписана из 83-й больницы, однако сохраняющаяся одышка послужила поводом для обращения за медицинской помощью и госпитализации в декабре 2011 года в нашу клинику.
Какова тактика, современное лечение интерстициальных заболеваний легких, в соответствии с рекомендациями Американского торакального общества и Европейского респираторного общества? Существуют несколько подходов. Это либо пробная терапия высокими дозами стероидами, либо комбинированная терапия – это преднизолон в сочетании с цитостатиками, пульс-терапия преднизолоном и препарат ацетилцистеин в высоких дозах.
Когда нужно начинать лечение? Лечение должно начинаться при постановке диагноза или получении объективных доказательств прогрессирования заболевания, или при среднетяжелом или тяжелом течении процесса. Поскольку у нашей пациентки было прогрессирование заболевания, среднетяжелое течение процесса, мы выбрали тактику и назначили препарат метипред. Метипред был назначен в дозе 20 мг/сутки. Пациентка принимала этот препарат всего на протяжении месяца, у нее начала изменяться внешность, и она самостоятельно препарат отменила.
В марте 2012 года пациентка вновь госпитализирована к нам в отделение для того, чтобы мы провели повторное обследование и определили дальнейшую тактику ведения этой больной. Учитывая прогрессирование заболевания, прогрессирование одышки, ухудшение по компьютерной томографии, была изменена лечебная тактика и уже назначено два препарата: к системным глюкокортикостероидам был добавлен препарат азатиоприн. Пациентка была выписана из отделения с рекомендациями обратиться к нам в клинику через месяц после того, как она была выписана, то есть в апреле 2012 года.
Пациентка же обратилась к нам только в августе 2012 года. За это время у нее резко усилилась одышка, усилился кашель, она практически перестала выходить из дома, перестала обслуживать себя и отметила изменение концевых фаланг пальцев: у нее появились «барабанные пальцы» и изменение ногтей в виде часовых стеклышек. И 28 августа 2012 года пациентка госпитализирована к нам в отделение.
Пациентка родилась в Москве, по профессии она администратор, в 1997 году пациентка перенесла холецистэктомию, из аллергологического анамнеза на виферон у пациентки наблюдалась крапивница. Пациентка не курит, вредных привычек не имеет. При поступлении состояние пациентки средней тяжести. Обращал на себя внимание диффузный цианоз, частота дыхательных движений 22/мин, сатурация по пульсоксиметру 92%. Обращала на себя внимание деформация фаланг пальцев в виде барабанных палочек и ногтей в виде часовых стеклышек. Перкуторно-коробочный звук, дыхание жесткое, выслушивалась крепитация по всем легочным полям. Тоны сердца были ясные, ритмичные, частота сердечных сокращений – 120/мин, артериальное давление – 120/70. Живот был мягкий, безболезненный, периферических отеков не было, печень не увеличена.
На данном слайде представлены причины быстропрогрессирующей одышки у больных с интерстициальными заболеваниями легких. Это возможно присоединение гнойного воспалительного процесса, развитие опухоли, пневмоторакса, тромбоэмболии мелких ветвей легочной артерии. Все эти возможные причины мы имели в виду, когда проводили обследование, когда встретились с этой пациенткой вновь, однако провести компьютерную томографию мы не успели, поскольку пациентка провела в нашей клинике всего 17 часов. На данном слайде мы видим, что в клиническом анализе крови обращал на себя внимание лейкоцитоз – 17,7*109/л, повышение уровня калия, аланиновой и аспарагиновой трансаминаз, креатинина и глюкозы.
Академик Ивашкин В.Т.: — Татьяна Викторовна, я бы хотел нотировать внимание, действительно, реакция со стороны лейкоцитов, а вот биохимические данные можно было бы сгруппировать. У пациентки повышен уровень калия и креатинина.
Доктор Рощина Т.В.: — То есть, у нее была почечная недостаточность.
Академик Ивашкин В.Т.: — Предполагается наличие почечной недостаточности. Почечная недостаточность развилась в последнюю госпитализацию, по-моему. До этого не было.
Доктор Рощина Т.В.: — В последнюю госпитализацию, это данные за полтора часа.
Академик Ивашкин В.Т.: — Далее, у пациентки повышена активность аланиновой и аспарагиновой трансаминазы, чего также не было. Следовательно, можно предполагать повреждение не только почек, но и печени. Наконец, у пациентки повысился уровень глюкозы, что также раньше не отмечалось. Следовательно, можно предполагать какое-то влияние негативное на поджелудочную железу. Следовательно, речь идет о полиорганной реакции у нашей пациентки, которая развилась на фоне быстропрогрессирующей одышки, тяжелой, нарастающей одышки, диффузного цианоза и тахипноэ. Присоединение такой полиорганной реакции.
Профессор Драпкина О.М.: — Владимир Трофимович, с точки зрения пропедевтики, крепитация у больных с интерстициальными заболеваниями легких, если по механизму, она чем…
Академик Ивашкин В.Т.: — Это признак бронхиоло-альвеолита.
Профессор Драпкина О.М.: — То есть, потеря эластичности?
Академик Ивашкин В.Т.: — Это может быть за счет сдавления периальвеолярным и перибронхиальным отеком, небольшого выхода отечной жидкости в просвет альвеол, бронхиолы, и это разлипание бронхиол и альвеол, это картина такой взрывной крепитации, «целлофановой».
Доктор Рощина Т.В.: — Представлена электрокардиограмма накануне гибели пациентки. Здесь мы видим, что ритм синусовый, горизонтальное положение электрической оси сердца, диффузные изменения миокарда.
Академик Ивашкин В.Т.: — У вас вторая будет электрокардиограмма?
Доктор Рощина Т.В.: — Будет.
Академик Ивашкин В.Т.: — Я прошу нотировать внимание. Здесь доминируют признаки преобладания электрической активности левых отделов сердца: электрическая ось сдвинута влево и отчетливая если не горизонтальная, то полугоризонтальная электрическая позиция сердца по Вильсону. С учетом довольно высоких зубцов R влево в грудных отведениях и глубоких S вправо в грудных отведениях, все-таки отчетливо можно говорить о преобладании электрической активности левых отделов сердца. И через короткое время снимается вторая электрокардиограмма. Дальше будет.
Доктор Рощина Т.В.: — Немножко позже будет, я хочу пока продемонстрировать данные компьютерной томографии этой пациентки. Это исследования в динамике, которые проведены в декабре 2011 года и в марте 2012 года. В августе мы не успели провести это исследование для пациентки. Уже здесь видно, что резко утолщен интерстиций, ретикулярная исчерченность, причем все эти изменения наблюдаются от верхушек до нижних отделов, заинтересованы во всех отделах легкие, а в некоторых отделах – например, шестые сегменты справа и слева – видны кистозные трансформации легочной ткани с образованием таких просветлений, как буллезные вздутия.
Академик Ивашкин В.Т.: — Я бы сказал, так называемые кистозные трансформации. Так можно предположить. Я нотирую внимание наших уважаемых участников на эти компьютерные снимки.
Доктор Рощина Т.В.: — Нижние самые срезы и отдельно выведены шестые сегменты справа и слева, которые нам описывали лучевые диагносты как своеобразную кистозную трансформацию.
Академик Ивашкин В.Т.: — Смотрите, во-первых, воздушная бронхограмма, во-вторых, эта разряженность оценивалась по-разному рентгенологами, оценивалась как кисты?
Доктор Рощина Т.В.: — Как кистозная трансформация.
Академик Ивашкин В.Т.: — Как кистозная трансформация. Мы вернемся к этой компьютерной томографической картинке несколько позже и посмотрим ее под другим углом зрения. Пожалуйста.
Доктор Рощина Т.В.: — Здесь представлены надпочечники, показано, что изменений никаких со стороны надпочечников не было. И макрокартина печени, тоже никаких образований в структуре паренхимы печени.
Академик Ивашкин В.Т.: — Образований нет, но все-таки паренхима печени плотная, она очень яркая, что предполагает наличие стеатоза. Очень яркая картина печени.
Доктор Рощина Т.В.: — Гиперэхогенная. Проводилось лечение системными глюкокортикостероидами, метилпреднизолоном, цитостатиками, внутривенно вводился препарат эуфиллин, подкожно фраксипарин. Предполагая, что возможной причиной могла послужить все-таки присоединившаяся пневмония, мы подключили антибиотики и кислородотерапию. 29 августа в 6:00 пациентка обратилась к дежурному врачу в связи с появлением тошноты, усилением слабости и одышки. При осмотре состояние было тяжелое, она заторможена, ортопноэ, сознание ясное, в легких дыхание жесткое, по всем легочным полям выслушивалась крепитация, частота дыхательных движений составляла уже 35/мин.
Академик Ивашкин В.Т.: — 35 в минуту, с большей частотой она уже и не могла дышать, это максимальная частота, которую эта пациентка в принципе могла развить.
Доктор Рощина Т.В.: — Отмечалась тахикардия до 120/мин, артериальное давление не определялось. Вот электрокардиограмма, которая выполнена в тот момент времени.
Академик Ивашкин В.Т.: — Смотрите, конечно, электрокардиограмма претерпела эволюцию. Электрическая ось девиировала в «стандартное» положение, появился синдром S1Q3, и в стандартных отведениях, и в усиленных однополисных S1Q3, появились отрицательная ТЭ в третьем отведении, в АВФ, в правогрудных отведениях.
Доктор Рощина Т.В.: — И двуфазный Р еще.
Академик Ивашкин В.Т.: — Да, и двуфазный Р. То есть, отчетливое указание на острую перегрузку правых отделов сердца. Острая перегрузка на фоне тахипноэ 35/мин, тахикардии 120/мин, диффузный цианоз.
Профессор Драпкина О.М.: — И S до V5.
Академик Ивашкин В.Т.: — Совершенно верно. Отчетливые изменения, это острая картина, отражающая развитие острого легочного сердца. Поэтому предположение врачей о возможной тромбоэмболии мелких ветвей было вполне разумным.
Доктор Рощина Т.В.: — В 7:00 отмечено угнетение сознания, остановка сердечной деятельности. В это время начинаются реанимационные мероприятия, которые проводятся совместно с реаниматологами. Однако, несмотря на проводимые мероприятия, через 30 минут, в 7:30, была констатирована биологическая смерть. На данном слайде представлен тот клинический диагноз, с которым пациентка была направлена на вскрытие.
Основное заболевание – интерстициальное заболевание легких: идиопатический легочный фиброз в стадии формирования «сотового легкого», длительно леченный глюкокортикостероидами и цитостатиками. Эмфизема легких, пневмосклероз, легочное сердце. Внебольничная двусторонняя полисегментарная пневмония.
Осложнения: хроническая дыхательная недостаточность, острая дыхательная недостаточность от 29 августа 2012 года, тромбоэмболия мелких ветвей легочной артерии, терминальный отек легких, терминальный отек головного мозга, реанимационные мероприятия. Сопутствующие заболевания: желчно-каменная болезнь, холецистоэктомия в 1997 году и хронический билиарный панкреатит вне обострения.
Академик Ивашкин В.Т.: — Естественно, после этого пациентка была направлена на аутопсию. Давайте посмотрим некоторые результаты аутопсии. Клинический диагноз – интерстициальное заболевание, острая дыхательная недостаточность и острое легочное сердце на фоне интерстициальной болезни легких. Вот что оказалось на секции. Мы видим здесь папиллярную аденокарциному легких, совершенно отчетливая картина папиллярной аденокарциномы, на фоне диффузной воспалительной реакции легких.
Здесь показана периневральная инвазия клеток аденокарциномы, опять-таки на фоне диффузной воспалительной реакции. То есть, в процесс вовлечены нервы, нервная система. Далее, сосудистая инвазия, поражение стенки сосудов клетками злокачественной опухоли. Видите, метастаз аденокарциномы в лимфатический узел, отчетливо совершенно прослеживаются атипичные клетки, которые как бы врываются в этот воспалительный инфильтрат. А это метастаз аденокарциномы в надпочечнике. То есть, неврологически ничего в надпоечниках не было, но при секции мы видим метастаз аденокарциномы в надпочечнике.
Что привлекает особое внимание и что, по всей вероятности, объясняет это острейшее развитие финальной стадии болезни у нашей пациентки с нарастанием тяжелой одышки, цианоза, тахипноэ и так далее, и так далее, и с полиорганными изменениями – это обнаружение гиалиновых мембран. Гиалиновые мембраны покрывают значительные площади альвеол, видны также участки слущенного эпителия в альвеолах, и гиалиновые мембраны служат как бы замещающим фактором. Это говорит о том, что пациентка умирала в статусе острого респираторного дистресс-синдрома. Вот гиалиновые мембраны, они здесь хорошо показаны. Гиалиновые мембраны патогномоничный морфологический признак острого респираторного дистресс-синдрома.
Это крупнокапельная жировая дистрофия печени – вы помните значительное повышение аланиновой и аспарониновой трансаминазы. По всей вероятности, это исходное состояние печени, жировая дистрофия, и острая реакция с повышением активности ферментов была усугублена развившейся на фоне острого респираторного дистресс-синдрома гипоксемии, то есть гипоксическим повреждением печени. Вы помните также подъем глюкозы у нашей пациентки, и вы видите на этой картинке мелкий жировой некроз поджелудочной железы, следовательно, поджелудочная железа тоже отреагировала на этот респираторный дистресс-синдром.
Далее почка. Если клубочки находятся в относительно сохранном состоянии, то в правом верхнем углу наверху вы видите канальцы в состоянии некротических изменений. То есть, речь идет о некротическом поражении канальцев почек. Таким образом, патологоанатомический диагноз после гистологического исследования звучал так. Основное комбинированное заболевание включало два конкурирующих заболевания.
Во-первых, множественный периферический рак нижних долей обоих легких (гистологически – очаги инвазивной и минимально инвазивной смешанной аденокарциномы – участки муцинозной, микропапиллярной и немуцинозной аденокарциномы с бронхиоло-альвеолярным характером роста) с прорастанием париетальной плевры и распространенной – я нотирую внимание, уважаемые коллеги, с прорастанием париетальной плевры, это важно нам для дальнейших рассуждений – и распространенной периневральной и васкулярной инвазии. Метастазы рака в перибронхиальный лимфатический узел и левый надпочечник.
Второе конкурирующее заболевание – это идиопатический легочный фиброз (гистологически – обычная интерстициальная пневмония). Может возникнуть вопрос, почему наряду с периферическим раком легкого в качестве конкурирующего заболевания поставлен идиопатический легочный фиброз, который по своим первоначальным проявлениям, конечно, не мог вызвать такую картину. Я думаю, из наших дальнейших рассуждений станет понятным.
Осложнения – это жировая дистрофия миокарда, диффузный жировой гепатоз, некротический нефроз, который обусловил развитие острой почечной недостаточности, и острый респираторный дистресс-синдром, отек легких и реанимационные мероприятия. В связи с этим возник вопрос: можно ли раньше было, на более раннем этапе, догадываться о возможности этой бронхиоло-альвеолярной карциномы легких? Речь идет о бронхиоло-альвеолярной карциноме легких, можно ли было догадываться на основании клинических или рентгенологических данных? И второй вопрос, очень важный: осложнением чего явился острый респираторный дистресс-синдром? Осложнением легочного фиброза, обычной интерстициальной пневмонии – или он явился осложнением бронхиолоальвеолярноклеточной карциномы?
Это очень важные вопросы для нас. Как вы помните, у пациентки «барабанные пальцы» и «часовые стекла» образовались за три месяца до ее смерти. Обычно в учебниках пишут: «барабанные пальцы», «часовые стекла» у пациентов с легочным заболеванием, основные причины – это или хроническая инфекция, или рак легкого. Но никогда ни в одном учебнике не нотируется внимание, сколько требуется времени для того, чтобы развились «барабанные пальцы» и «часовые стекла». И как учитывать?
И на примере этой пациентки мы видим, что наличие злокачественной опухоли может вызывать развитие изменений концевых фаланг пальцев и ногтевого ложа по типу «часовых стекол» быстро, в течение трех месяцев. Следовательно, будущим клиницистам и молодым клиницистам, и не очень молодым клиницистам следует обращать внимание на этот, казалось бы, классический симптом, которым пользовались наши великие предшественники, а мы начинаем об этом забывать.
Вторая часть. Выступление академика РАМН Ивашкина В.Т.
Клинические формы интерстициальных болезней лёгких у детей, принципы диагностики :: ТРУДНЫЙ ПАЦИЕНТ
Н.С. Лев, Е.А. Ружицкая
ФГУ МНИИ педиатрии и детской хирургии Росмедтехнологий
Понятие интерстициальных болезней лёгких объединяет гетерогенную группу заболеваний, при которых первично поражается интерстиций, альвеолы и периальвеолярные ткани. Заболевания характеризуются двусторонней диссеминацией, прогрессирующей дыхательной недостаточностью, рестриктивным характером вентиляционных нарушений [1, 2].
Единая классификация интерстициальных болезней лёгких отсутствует. Их условно разделяют на болезни с известной этиологий (к ним относится экзогенный аллергический альвеолит, токсический альвеолит) и заболевания с неустановленным этиологическим фактором (фиброзирующие альвеолиты, саркоидоз, различные васкулиты). Кроме этого выделяют, так называемые, вторичные интерстициальные болезни лёгких, развивающиеся при системных поражениях соединительной ткани [3].
Несмотря на полиморфизм клинических и морфологических вариантов и проявлений интерстициальных болезней лёгких, большинство из них начинается с достаточно стереотипных изменений лёгочного интерстиция в виде воспалительной инфильтрации различной степени выраженности, продуктивного альвеолита, в последующем формируется фиброз, темпы прогрессирования которого могут быть различными, и развивается картина «сотового лёгкого».
Эти последовательные процессы являются единым патофизиологическим механизмом, вовлекающим различные типы клеток и широкий спектр растворимых клеточных медиаторов. Течение интерстициальных заболеваний лёгких у детей осложнено тем, что патофизиологические процессы протекают в развивающемся органе [4, 5].
В настоящее время уже стало очевидным, что имеется генетическая предрасположенность к развитию диффузных заболеваний лёгких вследствие избыточного фиброзообразования в ответ на неспецифическое повреждение лёгочного эпителия.
Генетические исследования при интерстициальных болезнях лёгких сосредоточены на поиске врождённых мутаций, доказательстве усиления экспрессии генов, определяющих интенсивность фибропролиферативных процессов, и напротив, супрессии или удаления генов, сдерживающих эти процессы [6].
Несмотря на большое разнообразие клинических форм ИБЛ, для них характерны общие клинические симптомы, при появлении которых у врача должно появиться подозрение на интерстициальную болезнь лёгких.
Вместе с тем, нередко от начала заболевания до постановки окончательного диагноза проходят месяцы, и даже годы. Мы убедились, что у детей респираторные симптомы могут быть нечёткими и длительное время расцениваться как проявления других заболеваний. Болезнь часто начинается исподволь. Порой клинические симптомы вовсе отсутствуют при наличии рентгенологической симптоматики.
Среди клинических проявлений заболевания определяющая роль принадлежит дыхательной недостаточности. Одышка – главный симптом практически всех ИБЛ, имеет место у большинства пациентов, особенно у детей младшего возраста, и является наиболее ранним признаком заболевания. Дыхательная недостаточность вначале возникает или усиливается при физической нагрузке, имеет неуклонно прогрессирующий характер. У некоторых больных одышка сопровождается свистящим дыханием. Эти проявления заболевания ошибочно могут быть приняты за бронхиальную астму.
У больных с интерстициальными болезнями лёгких, как правило, отмечается кашель. Кашель, непродуктивный или со скудной слизистой мокротой.
Цианоз менее постоянный и более поздний признак болезни, возникает или усиливается при физической нагрузке, у маленьких детей при кормлении.
Как правило, в процессе болезни отмечается значительное похудание детей, отставание в росте.
Частым и прогностически неблагоприятным признаком интерстициальных болезней лёгких, как у взрослых больных, так и у детей, является утолщение концевых фаланг пальцев по типу «барабанных палочек», ногти в форме «часовых стекол» («пальцы Гиппократа»). С большим постоянством наблюдаются различные деформации грудной клетки.
Физикальные изменения со стороны лёгких при интерстициальных болезнях достаточно специфичны. У больных на вдохе прослушиваются нежные крепитирующие «целлофановые» хрипы. Они могут быть непостоянными по своей выраженности и локализации. Характерным, по наблюдениям ведущих детских пульмонологов, является несоответствие выраженной одышки относительно небольшим физикальным изменениям в лёгких. Это один из важнейших дифференциально-диагностических признаков, позволяющих клинически отличить интерстициальные заболевания лёгких от других хронических заболеваний бронхолёгочной системы [7-9].
Клиническая картина заболевания во многом определяется присоединением инфекционно-воспалительного процесса в лёгких. Рецидивирующие воспалительные заболевания бронхолёгочной системы нередко предшествуют и сопровождают течение интерстициальных болезней лёгких у детей.
В поздние стадии заболевания, как правило, отмечаются прогрессирование одышки, формирование лёгочно-сердечной недостаточности за счёт гемодинамических нарушений в малом круге кровообращения.
С большим постоянством у больных определяется артериальная гипоксемия, выявляемая на ранних этапах заболевания лишь при физической нагрузке, а по мере прогрессирования процесса гипоксемия регистрируется и в покое, сопровождается гипокапнией, отражающей особенности дыхательного паттерна больных – частого поверхностного дыхания (rapid shallow breating), гиперкапния появляется в далеко зашедших стадиях болезни. Основным механизмом гипоксемии является вентиляционно-перфузионный дисбаланс, снижение диффузионной способности лёгких.
Важное диагностическое значение при интерстициальных болезнях лёгких у детей отводится функциональным исследованиям внешнего дыхания.
Функциональное исследование лёгких обнаруживает преимущественно рестриктивный тип нарушения вентиляции: снижение основных лёгочных объёмов.
Вместе с тем, рестриктивные нарушения нередко сочетаются с обструктивными, особенно у детей, что, в частности, наблюдается у значительного числа больных с экзогенным аллергическим альвеолитом.
Рентгенологические методы обследования грудной клетки являются важнейшими диагностическими методами при интерстициальных болезнях лёгких. Следует подчеркнуть, что различные нозологические формы ИБЛ имеют свои отличительные особенности рентгенологической картины. Всё большее значение приобретает компьютерная томография высокого разрешения КТВР (high-resolution computed tomography) [10-12].
На ранних стадиях болезни рентгенологическими и томографическими признаками ИБЛ являются преимущественно усиление и деформация лёгочного рисунка, понижение прозрачности лёгочных полей по типу «матового стекла», мелкоочаговые тени. По мере прогрессирования процесса деформация лёгочного рисунка становится более выраженной, выявляются признаки интерстициального фиброза, полостные образования, формируется картина «сотового лёгкого».
Наиболее точная диагностика большинства ИБЛ возможна при помощи оценки биопсийного материала лёгких. Биопсия лёгких считается в настоящее время «золотым» стандартом в диагностике ИБЛ, позволяющим не только установить диагноз, но и предсказать прогноз заболевания, возможный ответ на терапию [13, 14].
Несмотря на неоспоримую ценность исследования, биопсия показана и возможна далеко не во всех случаях ИБЛ. По данным крупных медицинских центров, биопсия лёгких проводится только у 11-12 % больных с интерстициальными болезнями лёгких [15].
Для косвенной оценки процессов, происходящих в лёгочной ткани, нами использовался метод оценки заживления асептического воспаления кожи («кожное окно») (G. Rebuch, J. Crowley, 1955, в модификации М.А. Капелько, Е.И. Цветковой, 1982).
Исследование «кожного окна» даёт возможность оценить фазы воспалительного процесса (экссудативной, клеточно-пролиферативной, активности фибробластов), выявить особенности миграции в очаг воспаления различных видов фагоцитирующих клеток (нейтрофилов, моноцитов), оценить полноценность межклеточных взаимодействий в ходе воспалительного процесса, зафиксировать наличие аллергии и активность фибропролиферативных реакций.
Следует подчеркнуть, что среди интерстициальных болезней лёгких у детей наибольшее клиническое значение имеет экзогенный аллергический альвеолит. Сведения о распространённости экзогенного аллергического альвеолита в детском возрасте отсутствуют.
В клинике пульмонологии нашего института В.Н. Нестеренко (1995 г.) наблюдала 240 детей с экзогенным аллергическим альвеолитом [16]. В последующем работа в этом направлении продолжилась [17]. В последние годы мы видим значительное увеличение тяжёлых хронических форм этого заболевания.
Экзогенный аллергический альвеолит (ЭАА) представляет собой иммунологически индуцированное воспаление лёгочной паренхимы, при котором в процесс вовлекаются стенки альвеол и верхние дыхательные пути вследствие неоднократного вдыхания разнообразной органической пыли и других веществ [18].
В литературе встречаются и другие названия этой патологии: «гиперчувствительный пневмонит», «ингаляционные пневмопатии», «диффузная интерстициальная пневмония», «интерстициальный гранулематозный пневмонит» и др. В 1932 г. симптоматика аллергического пневмонита была описана J.M. Campbell у 5 фермеров, работавших с заплесневевшим хлебом. Термин «экзогенный аллергический альвеолит» был предложен J. Pepys в 1967 г.
В МКБ-10 под кодами J.67-J.67.9 представлены различные формы ЭАА – гиперсенситивного пневмонита в зависимости от этиологического фактора.
Большинство форм ЭАА рассматриваются как профессиональная патология. Вместе с тем, формирование ЭАА возможно у детей самого разного возраста, контактирующих с различными аллергенами из-за особенностей домашнего микроокружения. Имеются наблюдения развития болезни в первые месяцы жизни ребёнка.
Формирование ЭАА у детей связывается с проживанием в сырых помещениях, тесным контактом с домашними животными и птицами. Наиболее важными из неблагоприятных факторов домашней экологии считаются термофильные актиномицеты и антигены птиц.
ЭАА справедливо рассматривается как иммунопатологические заболевание, в развитии которого ведущая роль принадлежит аллергическим реакциям 3- и 4-го типов (по классификации P.E. Gell, R.R. Coomb, 1968).
Особое значение в диагностике ЭАА придаётся обнаружению специфических преципитирующих антител к «виновному» антигену. У большинства больных с ЭАА определяются преципитирующие IgG к причиннозначимым аллергенам (чаще всего к грибковым, эпидермальным и бытовым аллергенам) в различных титрах. По нашим наблюдениям, обнаружение даже незначительного достоверного уровня преципитирующих антител у детей в сочетании с характерными данными анамнеза и клинической картиной считается достоверным маркером заболевания.
Следует заметить, что при ЭАА, особенно – у детей, могут отмечаться сопутствующие IgE-опосредованные реакции гиперчувствительности немедленного типа, что объясняет нередкое сочетание заболевания с бронхиальной астмой (до 25 % случаев) [16].
ЭАА может иметь различные варианты течения и прогноз: возможно клиническое выздоровление, но вместе с тем, заболевание может приводить к необратимым повреждениям лёгочной архитектоники. Это зависит от многих факторов, включая характер и длительность экспозиции антигена, иммунный ответ пациента, а также своевременность постановки диагноза и адекватное лечение.
Хроническую форму экзогенного аллергического альвеолита, при которой развиваются необратимые фиброзные изменения, необходимо дифференцировать от идиопатического фиброзирующего альвеолита и других интерстициальных болезней лёгких.
В литературе последних лет развернулась широкая дискуссия в отношении различных форм идиопатических интерстициальных пневмоний (ИИП), к которым в настоящее время относят идиопатический фиброзирующий альвеолит (ИФА).
Первые упоминания о заболевании имели место в 1935 г., когда L. Hamman и A. Rich описали несколько больных с быстропрогрессирующей дыхательной недостаточностью и гибелью в течение нескольких месяцев. Термин «фиброзирующий альвеолит», предложенный J. Scadding в 1964 г., отражает основные ключевые признаки заболевания: воспаление и фиброз. В нашей стране наиболее употребителен термин «идиопатический фиброзирующий альвеолит», также отражающий первичность и неясную природу заболевания. Синонимами ИФА являются «идиопатический лёгочный фиброз» – термин, чаще всего используемый в американской литературе, и «криптогенный фиброзирующий альвеолит» (cryptogenic fibrosing alveolitis), получивший большее распространение в Европе, особенно в Великобритании. В 1999 году, а затем в 2002 году были приняты совместные соглашения Американского торакального общества и Европейского респираторного общества по интерстициальным заболеваниям лёгких, сущность которых заключается в том, что были выделены и дифференцированы различные формы идиопатических интерстициальных пневмоний преимущественно по морфологическим признакам. Собственно идиопатический фиброзирующий альвеолит (ИФА) в настоящее время рассматривается как заболевание с морфологической картиной обычной интерстициальной пневмонии [19, 20].
Другие формы интерстициальных пневмоний и в их числе острая интерстициальная пневмония, неспецифическая интерстициальная пневмония, десквамативная интерстициальная пневмония, интерстициальная болезнь с респираторным бронхиолитом и другие типы идиопатических интерстициальных пневмоний являются самостоятельными заболеваниями.
Следует подчеркнуть, что заболевания, относящиеся к группе идиопатических интерстициальных пневмоний, у детей встречаются крайне редко. Это касается и наших наблюдений. Доминирующими в клинической картине являются симптомы тяжёлой дыхательной недостаточности. Болезнь имеет неуклонно прогрессирующее течение, терапия кортикостероидами при этом малоэффективна, что может служить дополнительным критерием при проведении дифференциального диагноза. Средняя продолжительность жизни детей после установления диагноза, по данным американских клиницистов, составляет в среднем 47 месяцев [14].
В педиатрической практике встречаются и другие интерстициальные болезни лёгких – это васкулиты с поражением лёгочной ткани, заболевания, отнесённые к разряду редких, а также системные болезни, в симптомокомплекс которых входит поражение лёгочной ткани [21].
У пациентов с коллагенозами, наряду с интерстициальным поражением лёгких, как правило, удаётся выявить сопутствующее поражение сердца, суставов, кожи, почек, а также специфические иммунологические маркеры, характерные для этой группы заболеваний.
В клиническом симптомокомплексе, наблюдаемом при идиопатическом лёгочном гемосидерозе, выделяется ведущая триада признаков: кровохарканье, железодефицитная анемия, наличие инфильтративных теней на рентгенограммах лёгких. При этом в мокроте, бронхиальных смывах удаётся обнаружить гемосидерофаги – макрофаги, содержащие включения гемосидерина. В случае тяжёлого обострения на рентгенограммах выявляются массивные инфильтративные тени с обеих сторон. При повторных кризах формируется лёгочный фиброз [22, 23].
Аутоиммунные васкулиты (синдром Гудпасчера, гранулематоз Вегенера, синдром Черджа-Стросса и др.), характеризующиеся поражением мелких сосудов, в т. ч. капилляров, могут иметь симптомы, присущие интерстициальным болезням лёгких, сопровождаться диффузными рентгенологическими изменениями в лёгких, наличием крепитирующих хрипов [1, 2].
В заключении следует сказать, что интерстициальные болезни легких характеризуются многообразием нозологических форм у детей и представляют в настоящее время важнейшую проблему. Особенно актуальными является диагностика различных интерстициальных болезней лёгких на ранних, ещё обратимых стадиях заболевания, поиск новых современных подходов к терапии этих угрожающих жизни ребёнка заболеваний.
Литература
1. Илькович М.М. Интерстициальные болезни лёгких. В кн. Заболевания органов дыхания. С. Петербург. 1998; 109-318.
2. Интерстициальные болезни лёгких: Практическое руководство. Е.А. Коган, Б.М. Корнев, Е.Н. Попова, В.В. Фомин и др. / Под ред. Н.А.Мухина. М.: Литерра, 2007; 432. (Серия «Практическое руководство»).
3. Шмелев Е.И. Дифференциальная диагностика интерстициальных болезней лёгких // Consilium medicum. 2003; 5: 4: 176-181.
4. Clement А., Eber Е. Interstitial lung diseases in infants and children // Eur Respir J. 2008; 31: 658-666.
5. Corrin B. Pathology of interstitial lung disease // Semin Resp Crit Care Med. 1994; 15: 61-76.
6. Du Bois R.M., Kangesan I., Veeraraghavan S Genetics of pulmonary fibrosis // Semin. Respir. Crit. Care Med. 2003; 24: 2: 205-212.
7. Каганов С.Ю., Розинова Н.Н., Ардашникова С.Н., Барг В.А.. Любченко Л.Н., Костюченко М.В. Диагностические критерии диффузного интерстициального фиброза лёгких у детей // Вопросы охраны материнства и детства. 1981; 5: 11-16.
8. Hilman B.C., Amaro-Galvez R. Diagnosis of and treatment of Interstitial lung disease in children // Pediatr Resir. Rev. 2004; Jun; 5: 2: 101-7.
9. Bartato A., Panizzonlo C. Chronic interstitial lung disease in children // Pediatr Resir. Rev. 2000; Jun; 1: 2: 172-8.
10. Tung K.T., Wells A.U., Rubens M.B., Kirk J.M., du Bois R.M., Hansell D.M. Accuracy of the typical computed tomographic appearances of fibrosing alveolitis // Thorax. 1993; 48: 334-8.
11. Raghu G. Interstitial lung disease: A diagnostic approach. Are CT scan and lung biopsy indicated in every patient? // Am.J.Respir.Crit.Care Med. 1995; 151: 909-914.
12. Костюченко М.В. Современные методы рентгенодиагностики хронических неспецифических заболеваний лёгких у детей // Росс Вестник перинатологии и педиатрии. 2002; 2: 33-38.
13. Travis W.D. Handling and analysis of bronchoalveolar lavage and lung biopsy specimens with approach to pattens of lung injiry. ARP atlases. 2007; 1: 17-47.
14. Fan L.L., Kozinetz C.A., Wojtczak H.A. Diagnostic value of transbronchial, thoracoscopic, and open lung biopsy in immunocompetent children with chronic interstitial lung disease // J Pediatr. 1997; Oct; 131: 4: 565-9.
15. Авдеева О.Е., Авдеев С.Н. Идиопатический фиброзирующий альвеолит : современные подходы к диагностике и терапии // Соnsilium medicum. 2002; 4: 4.
16. Нестеренко В.Н. Клинические варианты экзогенного аллергического альвеолита у детей // Рос. Вест. Перинатологии и педиатр. 1995; 1: 29-34.
17. Богорад А.Е., Костюченко М.В., Сорокина Е.В., Шахназарова М.Д., Невструева В.В., Розинова Н.Н., Каганов С.Ю. Острый гипресенситивный пневмонит (аллергический альвеолит) у детей // Рос. Вест. Перинатологии и педиатр. 2002; 6: 27-33.
18. Хайннинкен Г.У., Ричерсон Г.В. Аллергический альвеолит. В кн. Внутренние болезни / Под ред. Т.Р. Харрисона (пер. с англ.). М.: Медицина. 1995; 45-48.
19. American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias // Am J Respir Crit Care Med. 2002; 165: 277-304.
20. Travis W.D., King T.E.Jr., Bateman E.D. et al. Americam Thoracic Society/European Respiratory Society international multidisciplinary consensus classification of the Idiopathic interstinal pneumonias // Am. J. Resp. Crit. Care Med. 2002; 165: 277-304.
21. Schwarz M.I., Cherniack R.M., King J.R. Diffuse alveolar hemorrage and other rare infiltrative disorders. In: Murray&Nadel: Textbook of Respiratory Medicine, 3rd ed. Philadelphia: W.B. Saunders, 2000: 1733-1755.
22. Богорад А.Е., Розинова Н.Н.. Сухоруков В.С., Ружицкая Е.А., Костюченко М.В., Соколова Л.В., Комарова О.Н., Успенская Е.В., Каганов С.Ю. Идиопатический гемосидероз лёгких у детей // Российский вестник перинатологии и педиатрии. 2003; 4: 29-35.
23. Cohen S. Idiopathic pulmonary hemosiderosis // Am J Med Sci. 1999; 317: 67-74.
Симптомы, причины, тесты и лечение
Обзор
Что такое интерстициальная болезнь легких?
Интерстициальное заболевание легких (ILD) — это еще один термин для обозначения фиброза легких, который означает «рубцевание» и «воспаление» интерстиция (ткани, окружающей воздушные мешочки, кровеносные сосуды и дыхательные пути легких).Это рубцевание делает легочную ткань жесткой, что может затруднить дыхание. ILD может быть ограничен легкими, или это может быть связано с состоянием, которое может повлиять на другие части тела, таким как ревматоидный артрит или саркоидоз.
Эти болезни имеют схожие черты, включая непродуктивный (сухой) кашель и одышку. Хотя они могут выглядеть одинаково радиографически (на рентгенограмме грудной клетки или компьютерной томографии грудной клетки), ILD, вызванные разными причинами и состояниями, имеют разные методы лечения и перспективы.ИЛБ чаще встречается у взрослых, но редко встречается у детей.
Симптомы и причины
Что вызывает интерстициальную болезнь легких?
Существует более 200 причин возникновения международных заболеваний. Поскольку ILD включает в себя множество расстройств, их классифицируют в зависимости от причины.К этим типам международных подключений относятся:
- ILD, связанная с другим заболеванием: У некоторых людей ILD развивается в результате аутоиммунного заболевания (иммунная система вредит организму). Примеры аутоиммунных заболеваний включают ревматоидный артрит, склеродермию, полимиозит / дерматомиозит, волчанку и саркоидоз.
- ILD, вызванные вдыханием вредных веществ: Люди, которые вдыхают вредные частицы, такие как угольная пыль, асбест, табачный дым или парикмахерские химикаты, могут заболеть ILD.
- Генетическая ILD: Генетическая ILD возникает, когда болезнь передается среди членов семьи. Эти состояния включают нейрофиброматоз (заболевание, при котором опухоли растут на нервах) и болезнь Гоше (отмеченную увеличением внутренних органов, включая селезенку и печень, а также поражениями костей).
- Идиопатический ILD: Идиопатический означает, что причина неизвестна. Идиопатические ILD обычно поражают людей старше 60 лет.
Каковы симптомы интерстициальной болезни легких?
У большинства людей, больных ИЛЗ, есть симптомы, затрудняющие дыхание, в том числе:
- Одышка
- Кашель, обычно непродуктивный
- Пониженная толерантность к физической нагрузке
- Усталость
- Похудание
Диагностика и тесты
Как диагностируется интерстициальное заболевание легких?
Поскольку существует много типов ВЗЛ, врачи используют множество методов для их диагностики, в том числе следующие:
- Медицинский осмотр.Врач также спросит, есть ли у вас какие-либо системные заболевания (расстройства, влияющие на весь организм) или подвергались ли вы воздействию вредных веществ.
- Функциональный тест легких, чтобы проверить, насколько хорошо ваши легкие работают
- Визуальные тесты, такие как рентген и компьютерная томография высокого разрешения (КТ)
- Бронхоскопия, тест, при котором врач вводит через нос или рот в легкие устройство, называемое бронхоскопом, чтобы заглянуть внутрь дыхательных путей.
- В некоторых случаях врач берет образец легочной ткани.Исследование этой ткани, называемое биопсией, может дополнительно определить тип ILD. Во время биопсии ваш врач берет небольшой образец ткани из легкого и изучает его под микроскопом, чтобы определить тип ILD.
Ведение и лечение
Как лечится интерстициальное заболевание легких?
Лечение ILD предназначено для сохранения способности легких функционировать и предотвращения обострения болезни.Лечение зависит от многих факторов, в том числе от типа ВЗЛ и степени его тяжести, и включает:
- Лекарства могут помочь улучшить функцию легких за счет уменьшения воспаления и / или фиброза. Лекарства для уменьшения воспаления включают стероиды (преднизон) и другие ревматологические препараты, включая микофенолат (CellCept), азатиоприн (Imuran), лефлуномид (Arava), ритуксимаб (Rituxan), циклофосфамид (Cytoxan), такролимус (Prograf) и другие. Лекарства для остановки дальнейшего фиброза включают пирфенидон (Esbriet) и нинтеданиб (Ofev).
- Кислородная терапия: Дополнительный кислород, подаваемый через носовую трубку, может облегчить дыхание. Эта терапия повышает уровень кислорода в крови, поэтому каждый вдох становится более продуктивным.
- Легочная терапия и лечебная физкультура: Дыхательные упражнения и повышенная физическая активность могут улучшить состояние легких.
- Пересадка легких: Некоторым людям с тяжелыми случаями ILD проводят трансплантацию легких, чтобы продлить им жизнь.
Каковы осложнения интерстициальной болезни легких?
У многих людей с интернационалом есть затрудненное дыхание и непрекращающийся кашель.В более тяжелых случаях осложнения могут быть опасными для жизни и включать высокое кровяное давление в легких, правожелудочковую недостаточность и дыхательную недостаточность (легкие не доставляют в организм достаточно кислорода).
Профилактика
Можно ли предотвратить интерстициальное заболевание легких?
Невозможно предотвратить идиопатические или генетические ILD, но можно предотвратить некоторые типы с известными причинами.Вы можете снизить риск:
- Ношение респиратора (маски, фильтрующей частицы из воздуха) вокруг вредных веществ, таких как асбест, металлическая пыль или химические вещества.
- Бросить курить.
- Получение прививок от гриппа и пневмонии для защиты легких.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с интерстициальным заболеванием легких?
Лекарства от международной болезни нет.Как только рубцевание возникает в легких, его обычно нельзя исправить. Лечение может помочь замедлить развитие болезни, чтобы максимально сохранить качество жизни.
Прогноз для пациентов зависит от тяжести состояния и причины ILD. Многие люди с легкой степенью интерстициальной болезни могут нормально функционировать на протяжении всей жизни без лечения. Их состояние может быть стабильным (хуже не становится).
У людей с более тяжелыми случаями ILD заболевание может прогрессировать (со временем ухудшаться).Этим людям может потребоваться регулярное лечение и терапия до конца жизни, чтобы справиться с симптомами.
Симптомы, причины, тесты и лечение
Обзор
Что такое интерстициальная болезнь легких?
Интерстициальное заболевание легких (ILD) — это еще один термин для обозначения фиброза легких, который означает «рубцевание» и «воспаление» интерстиция (ткани, окружающей воздушные мешочки, кровеносные сосуды и дыхательные пути легких).Это рубцевание делает легочную ткань жесткой, что может затруднить дыхание. ILD может быть ограничен легкими, или это может быть связано с состоянием, которое может повлиять на другие части тела, таким как ревматоидный артрит или саркоидоз.
Эти болезни имеют схожие черты, включая непродуктивный (сухой) кашель и одышку. Хотя они могут выглядеть одинаково радиографически (на рентгенограмме грудной клетки или компьютерной томографии грудной клетки), ILD, вызванные разными причинами и состояниями, имеют разные методы лечения и перспективы.ИЛБ чаще встречается у взрослых, но редко встречается у детей.
Симптомы и причины
Что вызывает интерстициальную болезнь легких?
Существует более 200 причин возникновения международных заболеваний. Поскольку ILD включает в себя множество расстройств, их классифицируют в зависимости от причины.К этим типам международных подключений относятся:
- ILD, связанная с другим заболеванием: У некоторых людей ILD развивается в результате аутоиммунного заболевания (иммунная система вредит организму). Примеры аутоиммунных заболеваний включают ревматоидный артрит, склеродермию, полимиозит / дерматомиозит, волчанку и саркоидоз.
- ILD, вызванные вдыханием вредных веществ: Люди, которые вдыхают вредные частицы, такие как угольная пыль, асбест, табачный дым или парикмахерские химикаты, могут заболеть ILD.
- Генетическая ILD: Генетическая ILD возникает, когда болезнь передается среди членов семьи. Эти состояния включают нейрофиброматоз (заболевание, при котором опухоли растут на нервах) и болезнь Гоше (отмеченную увеличением внутренних органов, включая селезенку и печень, а также поражениями костей).
- Идиопатический ILD: Идиопатический означает, что причина неизвестна. Идиопатические ILD обычно поражают людей старше 60 лет.
Каковы симптомы интерстициальной болезни легких?
У большинства людей, больных ИЛЗ, есть симптомы, затрудняющие дыхание, в том числе:
- Одышка
- Кашель, обычно непродуктивный
- Пониженная толерантность к физической нагрузке
- Усталость
- Похудание
Диагностика и тесты
Как диагностируется интерстициальное заболевание легких?
Поскольку существует много типов ВЗЛ, врачи используют множество методов для их диагностики, в том числе следующие:
- Медицинский осмотр.Врач также спросит, есть ли у вас какие-либо системные заболевания (расстройства, влияющие на весь организм) или подвергались ли вы воздействию вредных веществ.
- Функциональный тест легких, чтобы проверить, насколько хорошо ваши легкие работают
- Визуальные тесты, такие как рентген и компьютерная томография высокого разрешения (КТ)
- Бронхоскопия, тест, при котором врач вводит через нос или рот в легкие устройство, называемое бронхоскопом, чтобы заглянуть внутрь дыхательных путей.
- В некоторых случаях врач берет образец легочной ткани.Исследование этой ткани, называемое биопсией, может дополнительно определить тип ILD. Во время биопсии ваш врач берет небольшой образец ткани из легкого и изучает его под микроскопом, чтобы определить тип ILD.
Ведение и лечение
Как лечится интерстициальное заболевание легких?
Лечение ILD предназначено для сохранения способности легких функционировать и предотвращения обострения болезни.Лечение зависит от многих факторов, в том числе от типа ВЗЛ и степени его тяжести, и включает:
- Лекарства могут помочь улучшить функцию легких за счет уменьшения воспаления и / или фиброза. Лекарства для уменьшения воспаления включают стероиды (преднизон) и другие ревматологические препараты, включая микофенолат (CellCept), азатиоприн (Imuran), лефлуномид (Arava), ритуксимаб (Rituxan), циклофосфамид (Cytoxan), такролимус (Prograf) и другие. Лекарства для остановки дальнейшего фиброза включают пирфенидон (Esbriet) и нинтеданиб (Ofev).
- Кислородная терапия: Дополнительный кислород, подаваемый через носовую трубку, может облегчить дыхание. Эта терапия повышает уровень кислорода в крови, поэтому каждый вдох становится более продуктивным.
- Легочная терапия и лечебная физкультура: Дыхательные упражнения и повышенная физическая активность могут улучшить состояние легких.
- Пересадка легких: Некоторым людям с тяжелыми случаями ILD проводят трансплантацию легких, чтобы продлить им жизнь.
Каковы осложнения интерстициальной болезни легких?
У многих людей с интернационалом есть затрудненное дыхание и непрекращающийся кашель.В более тяжелых случаях осложнения могут быть опасными для жизни и включать высокое кровяное давление в легких, правожелудочковую недостаточность и дыхательную недостаточность (легкие не доставляют в организм достаточно кислорода).
Профилактика
Можно ли предотвратить интерстициальное заболевание легких?
Невозможно предотвратить идиопатические или генетические ILD, но можно предотвратить некоторые типы с известными причинами.Вы можете снизить риск:
- Ношение респиратора (маски, фильтрующей частицы из воздуха) вокруг вредных веществ, таких как асбест, металлическая пыль или химические вещества.
- Бросить курить.
- Получение прививок от гриппа и пневмонии для защиты легких.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с интерстициальным заболеванием легких?
Лекарства от международной болезни нет.Как только рубцевание возникает в легких, его обычно нельзя исправить. Лечение может помочь замедлить развитие болезни, чтобы максимально сохранить качество жизни.
Прогноз для пациентов зависит от тяжести состояния и причины ILD. Многие люди с легкой степенью интерстициальной болезни могут нормально функционировать на протяжении всей жизни без лечения. Их состояние может быть стабильным (хуже не становится).
У людей с более тяжелыми случаями ILD заболевание может прогрессировать (со временем ухудшаться).Этим людям может потребоваться регулярное лечение и терапия до конца жизни, чтобы справиться с симптомами.
Симптомы, причины, тесты и лечение
Обзор
Что такое интерстициальная болезнь легких?
Интерстициальное заболевание легких (ILD) — это еще один термин для обозначения фиброза легких, который означает «рубцевание» и «воспаление» интерстиция (ткани, окружающей воздушные мешочки, кровеносные сосуды и дыхательные пути легких).Это рубцевание делает легочную ткань жесткой, что может затруднить дыхание. ILD может быть ограничен легкими, или это может быть связано с состоянием, которое может повлиять на другие части тела, таким как ревматоидный артрит или саркоидоз.
Эти болезни имеют схожие черты, включая непродуктивный (сухой) кашель и одышку. Хотя они могут выглядеть одинаково радиографически (на рентгенограмме грудной клетки или компьютерной томографии грудной клетки), ILD, вызванные разными причинами и состояниями, имеют разные методы лечения и перспективы.ИЛБ чаще встречается у взрослых, но редко встречается у детей.
Симптомы и причины
Что вызывает интерстициальную болезнь легких?
Существует более 200 причин возникновения международных заболеваний. Поскольку ILD включает в себя множество расстройств, их классифицируют в зависимости от причины.К этим типам международных подключений относятся:
- ILD, связанная с другим заболеванием: У некоторых людей ILD развивается в результате аутоиммунного заболевания (иммунная система вредит организму). Примеры аутоиммунных заболеваний включают ревматоидный артрит, склеродермию, полимиозит / дерматомиозит, волчанку и саркоидоз.
- ILD, вызванные вдыханием вредных веществ: Люди, которые вдыхают вредные частицы, такие как угольная пыль, асбест, табачный дым или парикмахерские химикаты, могут заболеть ILD.
- Генетическая ILD: Генетическая ILD возникает, когда болезнь передается среди членов семьи. Эти состояния включают нейрофиброматоз (заболевание, при котором опухоли растут на нервах) и болезнь Гоше (отмеченную увеличением внутренних органов, включая селезенку и печень, а также поражениями костей).
- Идиопатический ILD: Идиопатический означает, что причина неизвестна. Идиопатические ILD обычно поражают людей старше 60 лет.
Каковы симптомы интерстициальной болезни легких?
У большинства людей, больных ИЛЗ, есть симптомы, затрудняющие дыхание, в том числе:
- Одышка
- Кашель, обычно непродуктивный
- Пониженная толерантность к физической нагрузке
- Усталость
- Похудание
Диагностика и тесты
Как диагностируется интерстициальное заболевание легких?
Поскольку существует много типов ВЗЛ, врачи используют множество методов для их диагностики, в том числе следующие:
- Медицинский осмотр.Врач также спросит, есть ли у вас какие-либо системные заболевания (расстройства, влияющие на весь организм) или подвергались ли вы воздействию вредных веществ.
- Функциональный тест легких, чтобы проверить, насколько хорошо ваши легкие работают
- Визуальные тесты, такие как рентген и компьютерная томография высокого разрешения (КТ)
- Бронхоскопия, тест, при котором врач вводит через нос или рот в легкие устройство, называемое бронхоскопом, чтобы заглянуть внутрь дыхательных путей.
- В некоторых случаях врач берет образец легочной ткани.Исследование этой ткани, называемое биопсией, может дополнительно определить тип ILD. Во время биопсии ваш врач берет небольшой образец ткани из легкого и изучает его под микроскопом, чтобы определить тип ILD.
Ведение и лечение
Как лечится интерстициальное заболевание легких?
Лечение ILD предназначено для сохранения способности легких функционировать и предотвращения обострения болезни.Лечение зависит от многих факторов, в том числе от типа ВЗЛ и степени его тяжести, и включает:
- Лекарства могут помочь улучшить функцию легких за счет уменьшения воспаления и / или фиброза. Лекарства для уменьшения воспаления включают стероиды (преднизон) и другие ревматологические препараты, включая микофенолат (CellCept), азатиоприн (Imuran), лефлуномид (Arava), ритуксимаб (Rituxan), циклофосфамид (Cytoxan), такролимус (Prograf) и другие. Лекарства для остановки дальнейшего фиброза включают пирфенидон (Esbriet) и нинтеданиб (Ofev).
- Кислородная терапия: Дополнительный кислород, подаваемый через носовую трубку, может облегчить дыхание. Эта терапия повышает уровень кислорода в крови, поэтому каждый вдох становится более продуктивным.
- Легочная терапия и лечебная физкультура: Дыхательные упражнения и повышенная физическая активность могут улучшить состояние легких.
- Пересадка легких: Некоторым людям с тяжелыми случаями ILD проводят трансплантацию легких, чтобы продлить им жизнь.
Каковы осложнения интерстициальной болезни легких?
У многих людей с интернационалом есть затрудненное дыхание и непрекращающийся кашель.В более тяжелых случаях осложнения могут быть опасными для жизни и включать высокое кровяное давление в легких, правожелудочковую недостаточность и дыхательную недостаточность (легкие не доставляют в организм достаточно кислорода).
Профилактика
Можно ли предотвратить интерстициальное заболевание легких?
Невозможно предотвратить идиопатические или генетические ILD, но можно предотвратить некоторые типы с известными причинами.Вы можете снизить риск:
- Ношение респиратора (маски, фильтрующей частицы из воздуха) вокруг вредных веществ, таких как асбест, металлическая пыль или химические вещества.
- Бросить курить.
- Получение прививок от гриппа и пневмонии для защиты легких.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с интерстициальным заболеванием легких?
Лекарства от международной болезни нет.Как только рубцевание возникает в легких, его обычно нельзя исправить. Лечение может помочь замедлить развитие болезни, чтобы максимально сохранить качество жизни.
Прогноз для пациентов зависит от тяжести состояния и причины ILD. Многие люди с легкой степенью интерстициальной болезни могут нормально функционировать на протяжении всей жизни без лечения. Их состояние может быть стабильным (хуже не становится).
У людей с более тяжелыми случаями ILD заболевание может прогрессировать (со временем ухудшаться).Этим людям может потребоваться регулярное лечение и терапия до конца жизни, чтобы справиться с симптомами.
Симптомы, причины, тесты и лечение
Обзор
Что такое интерстициальная болезнь легких?
Интерстициальное заболевание легких (ILD) — это еще один термин для обозначения фиброза легких, который означает «рубцевание» и «воспаление» интерстиция (ткани, окружающей воздушные мешочки, кровеносные сосуды и дыхательные пути легких).Это рубцевание делает легочную ткань жесткой, что может затруднить дыхание. ILD может быть ограничен легкими, или это может быть связано с состоянием, которое может повлиять на другие части тела, таким как ревматоидный артрит или саркоидоз.
Эти болезни имеют схожие черты, включая непродуктивный (сухой) кашель и одышку. Хотя они могут выглядеть одинаково радиографически (на рентгенограмме грудной клетки или компьютерной томографии грудной клетки), ILD, вызванные разными причинами и состояниями, имеют разные методы лечения и перспективы.ИЛБ чаще встречается у взрослых, но редко встречается у детей.
Симптомы и причины
Что вызывает интерстициальную болезнь легких?
Существует более 200 причин возникновения международных заболеваний. Поскольку ILD включает в себя множество расстройств, их классифицируют в зависимости от причины.К этим типам международных подключений относятся:
- ILD, связанная с другим заболеванием: У некоторых людей ILD развивается в результате аутоиммунного заболевания (иммунная система вредит организму). Примеры аутоиммунных заболеваний включают ревматоидный артрит, склеродермию, полимиозит / дерматомиозит, волчанку и саркоидоз.
- ILD, вызванные вдыханием вредных веществ: Люди, которые вдыхают вредные частицы, такие как угольная пыль, асбест, табачный дым или парикмахерские химикаты, могут заболеть ILD.
- Генетическая ILD: Генетическая ILD возникает, когда болезнь передается среди членов семьи. Эти состояния включают нейрофиброматоз (заболевание, при котором опухоли растут на нервах) и болезнь Гоше (отмеченную увеличением внутренних органов, включая селезенку и печень, а также поражениями костей).
- Идиопатический ILD: Идиопатический означает, что причина неизвестна. Идиопатические ILD обычно поражают людей старше 60 лет.
Каковы симптомы интерстициальной болезни легких?
У большинства людей, больных ИЛЗ, есть симптомы, затрудняющие дыхание, в том числе:
- Одышка
- Кашель, обычно непродуктивный
- Пониженная толерантность к физической нагрузке
- Усталость
- Похудание
Диагностика и тесты
Как диагностируется интерстициальное заболевание легких?
Поскольку существует много типов ВЗЛ, врачи используют множество методов для их диагностики, в том числе следующие:
- Медицинский осмотр.Врач также спросит, есть ли у вас какие-либо системные заболевания (расстройства, влияющие на весь организм) или подвергались ли вы воздействию вредных веществ.
- Функциональный тест легких, чтобы проверить, насколько хорошо ваши легкие работают
- Визуальные тесты, такие как рентген и компьютерная томография высокого разрешения (КТ)
- Бронхоскопия, тест, при котором врач вводит через нос или рот в легкие устройство, называемое бронхоскопом, чтобы заглянуть внутрь дыхательных путей.
- В некоторых случаях врач берет образец легочной ткани.Исследование этой ткани, называемое биопсией, может дополнительно определить тип ILD. Во время биопсии ваш врач берет небольшой образец ткани из легкого и изучает его под микроскопом, чтобы определить тип ILD.
Ведение и лечение
Как лечится интерстициальное заболевание легких?
Лечение ILD предназначено для сохранения способности легких функционировать и предотвращения обострения болезни.Лечение зависит от многих факторов, в том числе от типа ВЗЛ и степени его тяжести, и включает:
- Лекарства могут помочь улучшить функцию легких за счет уменьшения воспаления и / или фиброза. Лекарства для уменьшения воспаления включают стероиды (преднизон) и другие ревматологические препараты, включая микофенолат (CellCept), азатиоприн (Imuran), лефлуномид (Arava), ритуксимаб (Rituxan), циклофосфамид (Cytoxan), такролимус (Prograf) и другие. Лекарства для остановки дальнейшего фиброза включают пирфенидон (Esbriet) и нинтеданиб (Ofev).
- Кислородная терапия: Дополнительный кислород, подаваемый через носовую трубку, может облегчить дыхание. Эта терапия повышает уровень кислорода в крови, поэтому каждый вдох становится более продуктивным.
- Легочная терапия и лечебная физкультура: Дыхательные упражнения и повышенная физическая активность могут улучшить состояние легких.
- Пересадка легких: Некоторым людям с тяжелыми случаями ILD проводят трансплантацию легких, чтобы продлить им жизнь.
Каковы осложнения интерстициальной болезни легких?
У многих людей с интернационалом есть затрудненное дыхание и непрекращающийся кашель.В более тяжелых случаях осложнения могут быть опасными для жизни и включать высокое кровяное давление в легких, правожелудочковую недостаточность и дыхательную недостаточность (легкие не доставляют в организм достаточно кислорода).
Профилактика
Можно ли предотвратить интерстициальное заболевание легких?
Невозможно предотвратить идиопатические или генетические ILD, но можно предотвратить некоторые типы с известными причинами.Вы можете снизить риск:
- Ношение респиратора (маски, фильтрующей частицы из воздуха) вокруг вредных веществ, таких как асбест, металлическая пыль или химические вещества.
- Бросить курить.
- Получение прививок от гриппа и пневмонии для защиты легких.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с интерстициальным заболеванием легких?
Лекарства от международной болезни нет.Как только рубцевание возникает в легких, его обычно нельзя исправить. Лечение может помочь замедлить развитие болезни, чтобы максимально сохранить качество жизни.
Прогноз для пациентов зависит от тяжести состояния и причины ILD. Многие люди с легкой степенью интерстициальной болезни могут нормально функционировать на протяжении всей жизни без лечения. Их состояние может быть стабильным (хуже не становится).
У людей с более тяжелыми случаями ILD заболевание может прогрессировать (со временем ухудшаться).Этим людям может потребоваться регулярное лечение и терапия до конца жизни, чтобы справиться с симптомами.
Интерстициальная болезнь легких | Сидарс-Синай
Не то, что вы ищете?Что такое интерстициальные заболевания легких?
Интерстициальная болезнь легких — это название для группы из более чем 200 заболеваний легких. Большинство из них долговечные, или хронический.Эти заболевания вызывают воспаление или рубцевание легких. Воспаление и рубцы делают Это трудно получить достаточно кислорода. Рубцевание называется легочным фиброзом.
Фиброз приводит к долговременной (необратимой) потере легочной ткани. способность переносить кислород. Когда образуется рубцовая ткань, она разрушает воздушные мешочки. Это также разрушает легочную ткань вокруг воздушных мешков и легочных капилляров.
Симптомы и течение этих заболевания могут варьироваться от человека к человеку.Общая связь между многими формами в Заболевание заключается в том, что все они часто начинаются с воспаления в интерстиции. В интерстиций — это опорная структура легких. Это почти как строительные леса. Это воспаление затем вызывает воспаление в других частях легкого, что приводит к такие условия как:
- Бронхиолит. Это воспаление мелких дыхательных путей (бронхиолы).
- Альвеолит. Это воспаление воздушные мешочки, в которых происходит обмен кислорода и углекислого газа в крови (альвеолы).
- Васкулит. Это воспаление, которое влияет на мелкие кровеносные сосуды (капилляры).
Что вызывает интерстициальные заболевания легких?
Интерстициальная болезнь легких связаны с определенными заболеваниями, такими как саркоидоз или ревматоидный артрит.Он также может быть вызвано факторами окружающей среды. Часто его причина неизвестна.
Основными способствующими факторами являются: курение и вдыхание загрязняющих веществ в окружающей среде или на производстве, таких как неорганические или органическая пыль.
Другие факторы включают:
- Некоторые запрещенные наркотики или лекарства
- Определенная соединительная ткань или коллаген болезни
- Семейная история
- Лучевая терапия
Каковы симптомы интерстициальных заболеваний легких?
Симптомы у разных людей разные.Заболевание может протекать медленный или быстрый курс. У людей с этим заболеванием могут быть симптомы от очень от легкой до умеренной до очень тяжелой. Состояние может оставаться неизменным долгое время. Или это может быстро измениться. Течение болезни непредсказуемо. Если это будет прогрессировать, в легочная ткань утолщается и становится жесткой. Дыхание затрудняется.
Вот наиболее частые симптомы:
- Одышка, особенно при Мероприятия
- Сухой отрывистый кашель, который не проходит. производить мокроту
- Сильная усталость и слабость
- Нет аппетита
- Необъяснимая потеря веса
- Слабая боль в груди
- Затрудненное дыхание, которое может быть учащенным и неглубоко
- Легкое кровотечение
Эти симптомы могут выглядеть как другие заболевания легких или проблемы со здоровьем.Поговорите со своим врачом о диагноз.
Как диагностируются интерстициальные заболевания легких?
Медицинский работник спросит об истории вашего здоровья и проведите медицинский осмотр. Вам также может потребоваться легочная функция. тесты. Эти тесты помогают измерить способность легких перемещать воздух внутрь и наружу. в легкие. Тесты часто проводятся на машинах, которыми вы дышите.Они могут включать следующие:
Спирометрия
Спирометр — это устройство, используемое для проверки функции легких. Спирометрия — одна из самых простых, самые распространенные тесты. Его можно использовать для:
- Определите, насколько хорошо легкие получают, удерживают и перемещают воздух
- Ищите болезнь легких
- Посмотрите, как хорошо работает лечение
- Определить степень тяжести заболевания легких
- Выясните, есть ли заболевание легких ограничительный.Это когда легкие становятся жесткими и не могут удерживать столько воздуха. Или если заболевание легких обструктивное. Это когда поток воздуха прерывается в дыхательные пути.
Контроль пикового расхода
Это устройство используется для измерения как быстро вы можете выдувать воздух из легких. Изменения, связанные с заболеванием, могут вызвать большие дыхательные пути в легких медленно сужаются.Это замедлит скорость выхода воздуха. легкие. Это измерение очень важно для оценки того, насколько хорошо или плохо болезнь находится под контролем.
Рентген грудной клетки
Этот тест позволяет сфотографировать внутренние ткани, кости и органы.
Анализы крови
Анализ газов артериальной крови может быть выполнен чтобы проверить количество углекислого газа и кислорода в крови.Другие анализы крови могут использоваться для поиска возможных инфекций или других заболеваний, которые могут вызывать интерстициальные заболевание легких.
КТ
В этом тесте используется комбинация Рентген и компьютер, чтобы сделать снимки тела. КТ-сканирование более детализировано, чем обычный рентген.
Бронхоскопия
Этот тест является прямым экзаменом основные дыхательные пути легких (бронхи).В нем используется гибкая трубка, называемая бронхоскоп. Бронхоскопия помогает оценить и диагностировать проблемы с легкими, проверить закупорки, возьмите образцы ткани или жидкости и помогите удалить инородное тело. Это может включать биопсию или бронхоальвеолярный лаваж.
Бронхоальвеолярный лаваж
Этот тест удаляет ячейки из нижние дыхательные пути, чтобы помочь найти воспаление и исключить определенные причины.
Биопсия легкого
В ходе этого теста удаляется небольшой кусочек ткани из легкого, чтобы ее можно было проверить под микроскопом.
Как лечат интерстициальные заболевания легких?
Поскольку причин так много, лечение будет отличаться.Некоторые интерстициальные заболевания легких неизлечимы. Уход является направлена на предотвращение дальнейшего рубцевания легких, устранение симптомов и помощь в поддержании активности и здоровый. Лечение не может исправить уже возникшее рубцевание легких.
Процедуры могут включать:
- Пересадка легкого
- Лекарство, принимаемое внутрь (перорально), включая кортикостероиды для уменьшения воспаления и циклофосфамид для подавления в иммунная система.Некоторые лекарства защищают легкие от большего повреждения и рубцевания. Эти называются антифибротическими средствами и включают нинтеданиб и пирфенидон.
- Кислородная терапия с портативного устройства контейнеры
- Легочная реабилитация
Если вы курите или используете устройства для вейпинга, попросите вашего врача помочь вам остановиться. Также проконсультируйтесь с вашим лечащим врачом о прививках от гриппа и пневмококка.Ежегодная прививка от гриппа может помочь предотвратить грипп и пневмонию. Кроме того, пневмококковые бактерии могут вызывать незначительные такие проблемы, как ушные инфекции. Но они также могут стать опасными для жизни. болезни легких (пневмония), оболочки головного и спинного мозга (менингит) и кровь (бактериемия). Заболеть пневмококком может любой человек. Но те к группе повышенного риска относятся дети младше 2 лет, взрослые 65 лет и старше, люди с определенными проблемами со здоровьем и курильщиками.
Поговорите со своим лечащим врачом о пневмококковой вакцине. CDC рекомендует его всем детям младше 2 лет и всем взрослым. 65 или старшая.
Основные сведения об интерстициальных заболеваниях легких
- Интерстициальная болезнь легких — это название для группы из более чем 200 заболеваний легких, вызывающих воспаление или рубцевание легких.
- Причина часто неизвестна. Главный способствующими факторами являются курение и вдыхание окружающей среды или производственной деятельности. загрязняющие вещества.
- Наиболее частые симптомы — одышка. дыхание, особенно при активности, и сухой отрывистый кашель.
- Рентгеновские снимки и другие методы визуализации используется для диагностики состояния.Как и тесты, которые помогают измерить способность легких к обмен кислорода и углекислого газа.
- Цель лечения — предотвратить больше рубцов, справиться с симптомами и помочь вам оставаться активным и здоровым.
- Если вы курите, отказ от курения имеет решающее значение, чтобы сохранить как можно больше легких. здоровье по возможности.
- Спросите своего врача о заболевании гриппом и пневмококковые вакцины.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от визита к врачу:
- Знайте причину вашего визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и вспомнить, что вы лечите. провайдер вам говорит.
- При посещении запишите имя новый диагноз и любые новые лекарства, методы лечения или тесты. Также запишите любые новые инструкции, которые дает вам ваш лечащий врач.
- Знайте, почему новое лекарство или лечение прописан и как он вам поможет. Также знайте, каковы побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство, не пройдете тест или процедуру.
- Если у вас назначена повторная встреча, запишите дату, время и цель для этого посещение.
- Узнайте, как вы можете связаться с вашим лечащим врачом, если у вас возникнут вопросы.
Интерстициальное заболевание легких: причины, перспективы и диагностика
Интерстициальное заболевание легких — это название, данное группе состояний, которые вызывают воспаление и рубцевание ткани в легких, что затрудняет их работу.Также могут быть затронуты дыхательные пути, воздушные мешочки, внешняя часть легких и кровеносные сосуды.
Состояние вызывает у людей одышку и часто сопровождается сухим кашлем. Диагностика может быть сложной задачей, и в настоящее время нет лекарства от этого расстройства.
Однако существуют варианты лечения, которые могут помочь справиться с симптомами. Лечение также включает изменение образа жизни для замедления прогрессирования, насколько это возможно.
Краткие сведения об интерстициальном заболевании легких:
- Причины варьируются от воздействия окружающей среды до долгосрочных заболеваний и генетических факторов.
- Точная причина большинства интерстициальных заболеваний легких неизвестна.
- По мере развития болезни это может привести к серьезным, потенциально опасным для жизни осложнениям.
Существует много типов интерстициальных заболеваний легких, все из которых поражают интерстиций, представляющий собой сеть тканей, проходящих через оба легких.
Интерстиций поддерживает альвеолы или крошечные воздушные мешочки в легких.Кровеносные сосуды проходят через интерстиций, позволяя крови получать кислород и избавляться от избытка углекислого газа.
Заболевания, поражающие интерстиций, приводят к утолщению его тканей за счет рубцевания, воспаления и задержки жидкости. Это утолщение затрудняет поглощение кислорода кровью, что может привести к появлению симптомов интерстициального заболевания легких, таких как одышка.
По данным Американского торакального общества, существует более 200 различных заболеваний легких, поражающих интерстиций.Некоторые из этих заболеваний включают:
- Хронический силикоз : заболевание легких, обычно связанное с работой человека и вызванное вдыханием слишком большого количества кремнеземной пыли.
- Интерстициальная пневмония : инфекция легких, возникающая в интерстиции.
- Пневмокониоз угольных рабочих : это заболевание легких, также называемое черным легким, вызвано вдыханием угольной пыли.
- Идиопатический фиброз легких : Хроническое рубцевание в интерстиции без известной причины.
- Сидероз : Воспаление или рубцевание ткани в результате вдыхания железа в результате сварки или добычи полезных ископаемых.
- Неспецифический интерстициальный пневмонит : Повреждение интерстиция, которое часто возникает при аутоиммунных заболеваниях, таких как склеродермия или ревматоидный артрит.
- Гиперчувствительный пневмонит : Воспаление из-за вдыхания аллергенов или раздражающих веществ, таких как плесень, детрит растений и животных или химические вещества.
- Легочный фиброз, связанный с соединительной тканью : заболевание, которое поражает некоторых людей с другими заболеваниями соединительной ткани, такими как склеродермия или ревматоидный артрит.
- Криптогенная организующая пневмония : интерстициальное заболевание легких, которое может напоминать пневмонию без наличия инфекции.
- Острый интерстициальный пневмонит : Внезапное повреждение интерстициальной ткани, которое является серьезным и часто требует неотложной медицинской помощи и жизнеобеспечения.
- Десквамативный интерстициальный пневмонит : значительное воспаление легких, часто связанное с тяжелым курением.
- Саркоидоз : Воспалительное состояние, которое влияет на интерстиций, саркоидоз также может вызывать увеличение лимфатических узлов и проблемы с сердцем, глазами, суставами, кожей и нервами.
- Семейный фиброз легких : скопление рубцовой ткани в легких, которое поражает двух или более человек в одной семье.
- Асбестоз : Рубцовая ткань или воспаление в легких, вызванное вдыханием волокон асбеста.
Симптомы интерстициального заболевания легких различаются и зависят от первопричины. Однако некоторые симптомы обычно являются общими для всех различных форм заболевания. Самый частый симптом — это чувство одышки или невозможность отдышаться.
Большинство людей с интерстициальным заболеванием легких испытывают этот симптом, и со временем он может ухудшиться. В конце концов, человек с интерстициальным заболеванием легких может почувствовать одышку даже в состоянии покоя.
Эта характерная одышка часто сопровождается сухим непродуктивным кашлем. У некоторых людей также может наблюдаться необъяснимая потеря веса.
Всем, у кого проблемы с дыханием, следует обратиться к врачу для постановки диагноза.
Интерстициальное заболевание легких может развиться у любого человека, хотя оно может чаще встречаться у людей с определенными заболеваниями, употреблением определенных наркотиков или опасностями окружающей среды.Эти факторы риска могут включать:
Аутоиммунные заболевания
Некоторые аутоиммунные заболевания вызывают атаку и повреждение легких и других органов.
Аутоиммунные заболевания, которые могут повлиять на легкие, включают:
- склеродермия
- ревматоидный артрит
- волчанка
- дерматомиозит
- полимиозит
- синдром Шегрена
- некоторые васкулиты
- 933 9 9000 смешанные заболевания соединительной ткани 9 работы также может подвергнуть человека риску повреждения интерстициальной ткани.Воздействие различных токсинов или загрязнителей может со временем повредить легкие. Эти вещества могут включать:
- пыль, например зерновую пыль
- кремнеземную пыль
- асбест
- уголь
- сварку железа
- плесень
- некоторые животные белки, например, содержащиеся в птичьем помете
- глинистые минералы, например , тальк
- лучевая терапия
- сердечные лекарства, используемые для лечения нерегулярного сердечного ритма
- определенные антибиотики
- противовоспалительные препараты
- химиотерапевтические препараты
- наркотики, включая героин и лечебный метадон
- Интерстициальное заболевание легких — заболевание легких, сопровождающееся хроническим воспалением легких
- Хроническое воспаление легких вызывает прогрессирующее рубцевание или фиброз легких
- Рубцы влияют на способность дышать и могут вызвать одышку.В течение длительного времени заболевание может вызывать дыхательную и сердечную недостаточность.
Лекарства
Некоторые лекарства могут также повредить легкие, в том числе:
Осложнения могут включать:
Дыхательная недостаточность
Дыхательная недостаточность возникает при поздней стадии интерстициального заболевания легких, когда чрезвычайно низкий уровень кислорода в крови может способствовать отказу других органов.
Легочная гипертензия
Рубцовая ткань, воспаление или низкий уровень кислорода, ограничивающие кровоток, являются причинами высокого кровяного давления в артериях легких.
Правожелудочковая сердечная недостаточность
Интерстициальное заболевание легких может привести к легочному сердцу , когда правому желудочку приходится сильнее качать кровь для перемещения крови через легкие. Эта дополнительная работа может вызвать отказ сердца из-за перенапряжения.
Поделиться на PinterestВрач может порекомендовать компьютерную томографию для диагностики интерстициального заболевания легких.Если врачи считают, что у человека интерстициальное заболевание легких, простой визуализирующий тест, такой как рентген или компьютерная томография, может помочь им оценить степень повреждения. Они также могут попросить провести другие тесты, чтобы подтвердить свой диагноз.
Стресс-тест может помочь врачам определить, связаны ли симптомы дыхания человека с проблемами с сердцем или с легкими.
Стресс-тесты увеличивают работу сердца, заставляя человека тренироваться на беговой дорожке или принимать лекарства, которые заставляют сердце биться быстрее.
Функциональные легочные пробы проверяют снижение емкости легких, если кто-то подует в аппарат, называемый спирометром. Тесты помогают определить, какой тип проблемы с легкими они могут испытывать. Они также дают информацию о том, как легкие вводят и выводят воздух и насколько хорошо они используют кислород.
Бронхоскопия — это еще один тест, который помогает врачам проверить ткань легких. Врач вводит пациенту легкое успокоительное и вводит трубку в горло и в легкие. Затем они удаляют небольшой кусочек легочной ткани для исследования.
Тест бронхоальвеолярного лаважа может дать дополнительную информацию с помощью промывания солевым раствором для сбора клеток для тестирования.
Однако в некоторых случаях может потребоваться хирургическая биопсия.
В настоящее время не существует методов лечения, которые могут полностью обратить вспять повреждение легких. Но некоторые методы лечения, доступные в настоящее время, могут замедлить развитие рубцов и позволить человеку дышать более свободно.
Врачи могут назначить несколько различных методов лечения чьих-либо симптомов.
Многие врачи рекомендуют пройти легочную реабилитацию, так как это поможет укрепить легкие. В легочной реабилитации используются различные упражнения, которые помогают человеку увеличить объем легких и лучше дышать.
В недавнем небольшом исследовании изучалась полезность легочной реабилитации у людей с интерстициальным заболеванием легких по разным причинам. Исследование пришло к выводу, что легочная реабилитация благоприятна для толерантности к физической нагрузке, симптомов интерстициального заболевания легких и качества жизни.
Кислородная терапия может быть назначена, чтобы помочь уменьшить одышку у человека и улучшить его способность быть активным. Однако недавний обзор исследований ставит под сомнение полезность оксигенотерапии в долгосрочной перспективе у пациентов с интерстициальным заболеванием легких.
Противовоспалительные препараты
Хотя некоторые противовоспалительные препараты могут повредить легкие, другие могут помочь облегчить симптомы. Примером может служить кортикостероид преднизон.
Лечение кортикостероидами может быть полезно при различных интерстициальных заболеваниях легких, но оно не лишено побочных эффектов.
Иммуноподавляющие препараты
Если симптомы аутоиммунного заболевания вызывают, врачи могут порекомендовать иммунодепрессанты, чтобы уменьшить повреждение легких.
Антифиброзные препараты
Более новый класс лекарств, известных как антифиброзные или препараты против рубцевания, похоже, работает, блокируя пути в организме, необходимые для образования рубцовой ткани.
Эти препараты были одобрены для лечения идиопатического легочного фиброза, типа интерстициального заболевания легких без известной причины.
Примеры этих лекарств включают Офев (нинтеданиб) и Эсбриет (пирфенидон), которые в настоящее время изучаются на предмет их эффективности при других типах интерстициальных заболеваний легких.
Трансплантация
При тяжелых или быстро прогрессирующих состояниях может потребоваться пересадка легкого. Прежде чем рекомендовать пересадку легких, врачи захотят убедиться, что у человека достаточно хорошее здоровье и нет других проблем со здоровьем.
Перспективы интерстициальной болезни легких у всех разные.Это прогрессирующее заболевание, и в настоящее время нет лекарства от повреждений, вызванных рубцами и воспалением. Симптомы могут непредсказуемо прогрессировать и усложнять чью-то жизнь.
Люди с интерстициальным заболеванием легких могут хорошо реагировать на изменения образа жизни, такие как кислородная терапия, легочная реабилитация и здоровое и разнообразное питание. Медицинское лечение может помочь замедлить повреждение легких и помочь кому-то дышать, а в некоторых случаях потребуется пересадка легких.
Посещение врача для диагностики интерстициального заболевания легких и обсуждения идеального варианта лечения — лучший способ действий для любого, кто подозревает, что у него может быть интерстициальное заболевание легких.
Интерстициальная болезнь легких и фиброз легких
Интерстициальная болезнь легких и фиброз легких — общие термины, используемые для описания воспалительных и фиброзных заболеваний легочной ткани (интерстиция).
Ключевая информация
Существует более 100 известных причин интерстициального заболевания легких и фиброза легких, включая семейные и генетические нарушения, вдыхаемые вещества, инфекции, лекарства и заболевания соединительной ткани.
Идиопатический фиброз легких (IPF) — интерстициальное заболевание легких, характеризующееся хроническим воспалением, сопровождающимся неконтролируемой реакцией заживления, которое вызывает прогрессирующее рубцевание или утолщение (фиброз) тканей между альвеолами легких или воздушными мешочками.Причина IPF неизвестна, хотя, по-видимому, главную роль играет собственный иммунный ответ организма. Согласно последним данным, на 100 000 населения приходится от 14 до 63 случаев ИЛФ. Обычный возраст при постановке диагноза составляет от 40 до 70 лет, но часто за два-пять лет до постановки диагноза есть рентгенологические доказательства заболевания. Заболевание чаще поражает мужчин, чем женщин.
Заболевание обычно проявляется легкой одышкой при физической нагрузке. Со временем одышка усиливается, так как перенос кислорода в кровь уменьшается.По мере того, как перенос кислорода уменьшается, сердце должно работать больше, чтобы перекачивать насыщенную кислородом кровь в организм. Это приводит к проблемам с сердцем, и часто развивается сердечная недостаточность. Средняя выживаемость людей с ИЛФ составляет пять лет.
Диагностика интерстициальной болезни легких
Диагностика интерстициального заболевания легких стала значительно более точной в результате торакоскопии, процедуры с минимальным доступом, при которой для осмотра грудной клетки используются небольшие разрезы и видеоэндоскопические инструменты. Можно провести биопсию и сканирование нескольких участков легкого, чтобы определить наличие этого заболевания без необходимости делать большой разрез.
Лечение
Стандартное лечение IPF предназначено для улучшения симптомов и замедления прогрессирования заболевания. Кортикостероиды и цитотоксические препараты уменьшают воспалительную реакцию и предотвращают рубцевание и утолщение тканей легких. Трансплантация легких оказалась успешной в качестве последнего средства лечения.
Следующие шаги
Если вам нужна помощь с легкими или грудной клеткой, мы готовы помочь. Позвоните по телефону (212) 305-3408 для существующих пациентов, (212) 304-7535 для новых пациентов или запросите онлайн-запись, чтобы начать работу сегодня.
