Дисбактериоз у новорожденных и грудных детей | Bifiform ru
В норме микрофлора кишечника состоит в среднем из 1 млн микробов на 1 мл содержимого. Нормальную микрофлору составляют 15-20 представителей анаэробных (бактерии, которые не могут жить в присутствии кислорода) и аэробных (способных существовать в присутствии кислорода) бактерий основных родов: бактероиды, бифидобактерии, лактобактерии и другие. Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Здоровая микрофлора участвует в пищеварительных процессах организма, усиливает активность пищеварительных ферментов, действует на моторику желудочно-кишечного тракта, способствует выработке витаминов, гормонов, аминокислот и повышает иммунитет.
Также микрофлора выполняет детоксикационную и антиаллергенную функции. Защитные функции кишечника сводятся к созданию барьера для размножения болезнетворных бактерий и разрушения аллергенов. Нормальная микрофлора также обладает антиоксидантными, антимутагенными и противораковыми функциями1,2
Формирование микрофлоры
Формирование и функционирование иммунной системы происходит в 2 этапа. Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Второй этап — начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
В становлении нормальной микрофлоры ребенка особенно важную роль играют бифидобактерии. Количество бифидобактерий в кишечнике ребенка, находящегося на грудном вскармливании, быстро нарастает в первые недели его жизни. В течение первого года жизни меняется видовой состав кишечной микрофлоры, что связано с различными периодами в жизни ребенка: периодом грудного вскармливания до введения прикорма, после введения прикорма, после появления в рационе твердой пищи, после прекращения грудного вскармливания.
Нормальная микрофлора ребенка
Микрофлора обусловливает защиту слизистой кишечника от внедрения патогенных микроорганизмов, поддерживает и активирует иммунную систему, участвует в обмене белков, липидов, углеводов, выполняет антиаллергическую функцию, участвует в синтезе аминокислот, витаминов, гормонов, влияет на пищеварительные функции желудочно-кишечного тракта 1.
Пробиотический комплекс Бифиформ Бэби можно давать даже новорожденным с первых дней жизни. Его основное назначение – формирование сбалансированной микрофлоры кишечника, в том числе, при различных проблемах, связанных с кормлением. Особый комплекс бактерий может способствовать профилактикекишечных расстройств различного характера, включая колики 4.
Нормальную микрофлору кишечника составляют множество видов микроорганизмов. Одни из значимых и изученных на сегодняшний день:
Бифидобактерии
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта человека. Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин. Способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D 6.
Лактобактерии
Уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие 6
Нарушения микрофлоры
Дисбактериоз является нарушением качественного и количественного состава микрофлоры кишечника. Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Дисбактериоз у грудных детей может проявляться в виде изменения частоты, состава и цвета стула, нарушения процессов переваривания пищи, повышенного газообразования, беспокойного поведения ребенка, плача, повышенной раздражительности, плохого аппетита и сна, ухудшение состояния кожного покрова и даже аллергических реакций 3.
Причины возникновения дисбактериоза у новорожденных и грудничков
В группе риска по нарушению баланса микрофлоры находятся дети, мамы которых имели различные осложнения в период беременности и родах, а также дети, находящиеся на искусственном вскармливании, недоношенные. Простудные заболевания, прием некоторых лекарственных препаратов (лечение антибиотиками) могут приводить к нарушениям баланса микрофлоры кишечника.
Сдача анализов
При возникновении симптомов недомогания у Вашего ребенка, обязательно проконсультируйтесь с врачом. Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Как правильно собрать кал для анализа на дисбактериоз:
Кал собирается в стерильную баночку, предварительно прокипяченную вместе с крышкой в течение 20 минут. Посуда для анализа, на основании результатов которого будет проводиться лечение дисбактериоза у грудных детей, должна храниться в холодильнике не более суток. Собранный в стерильную емкость анализ доставляется в лабораторию в течение 2 часов (не позднее). Результаты подготавливаются через 7-10 дней.
Для получения информации о том, где можно приобрести Бифиформ Бэби , посетите раздел «Где купить».
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
- Донских Е.Е. Микрофлора — Дисбактериоз у детей http://lekmed.ru/info/literatyra/disbakterioz-y-detei.html
- Корниенко Е.А., Мазанкова Л.Н., Горелов А.В. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины. Лечащий врач 2015.
- И.А. Беляева. Пробиотические добавки для коррекции младенческих колик: перспективы использоавния.
- Беляева И.А., Митиш М.Д., Катосова Л.К. Эффективность использования пробиотиков у недоношенных детей. РМЖ 2009.
- Рыбальченко О.В., Бондаренко В.М. Оценка микробиоты и пробиотических штаммов с позиций новых научных технологий. Фарматека №11, 2016
- Бельмер С.В., Малкоч А.В. Кишечная микрофлора и значение пребиотиков для ее функционирования. Лечащий врач 2006, 4
PP-BIB-RUS-0082
Как победить состояние дисбактериоза у детей?
Дисбактериоз в последнее время — весьма распространённое состояние у детей, особенно у грудничков.

— Вадим Леонидович, дисбактериоз некоторые врачи считают болезнью. Каково Ваше мнение по этому поводу?
— Дисбактериоз – это состояние, которое может развиваться при различных заболеваниях или неблагоприятных окружающих условиях человека. Приведу простой пример: вы сидите на лекции или в кино, в зале душно нарастает количество углекислого газа в воздухе. В этой ситуации постепенно начинает развиваться состояние дисбактериоза. На работе отругал начальник, человек получил новую порцию стресса, усилилась моторика кишечника, положено начало к развитию состояния дисбактериоза. На нормальную кишечную флору, и не только кишечную, но и на флору всех полостных органов влияет: неправильное питание, плохая экология, изменение климата, различные ионизирующие излучения, которые окружают человека в повседневной жизни, воспалительные заболевания, прием лекарственных средств. Но это не болезнь – это изменение флоры (состояние временное) в зависимости от внешних условий воздействия.
— Дисбактериоз может быть только в кишечнике или этому подвержены все слизистые оболочки организма?
— Нарушенная кишечная флора будет отрицательно действовать на слизистую всех полостных органов в которых она имеется (полость рта, пищевод, желудок, кишечник, влагалище и др.). Здесь появляется цепочка взаимосвязей: болезнь слизистой кишки влияет на состояние микрофлоры, нарушенная микрофлора – на слизистую.
— По каким признакам родители могут определить, что у ребенка имеется состояние дисбактериоза?
— Родителям стоит задуматься, если у ребенка снижается аппетит, ребенок бледный с синюшными кругами под глазами и под носом. Если у ребенка периодически отмечается подташнивание, бурчание и боли в животе, меняется стул, в кале присутствует зелень или кусочки непереваренной пищи. Ребенок плохо прибавляет в весе, срыгивает, начинает часто болеть простудными заболеваниями. Возможно, вечером, а именно в семь часов, отмечается субфебрильная температура — 37,1-37,2.
— Насколько состояние кишечной флоры влияет на иммунитет ребенка?
— При изменении кишечной микрофлоры ребенка в худшую сторону происходит снижение иммунитета. Когда у ребенка появляются частые простудные заболевания, это тоже говорит о том, что органы пищеварения не позволяют иметь 100%-ный иммунитет. Ведь у человека иммунитет на 98% зависит от состояния микрофлоры толстой кишки. И когда она нарушается, иммунитет падает, а, значит, появляются частые простуды.
— То есть, если у родителей часто болеет ребенок, они должны задуматься о посещении гастроэнтеролога?
— Как один из моментов. Мы знаем, что многие болезни: кожи, зубов, слизистых, вплоть до бронхиальной астмы, – это порой осложнение болезней органов пищеварения. Когда мне задают подобные вопросы, я сразу вспоминаю один случай: выходит конферансье на сцену и говорит: «У меня сегодня что-то болит голова».
 Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.
Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.— Как врач определяет наличие у ребенка состояния дисбактериоза?
— Существуют различные методы исследования микробной флоры у человека. Очень важно при оценке анализа кала на дисбактериоз учитывать возраст пациента, принципы его питания, период посева: как его собирали, и когда был сдан кал. И без учета данных факторов нельзя правильно оценить полученный результат. Потому что цифры в конечном итоге будут разные. Приведу простой пример: если пациент употребляет больше кисломолочных продуктов, то у него бактерий coli будет значительно меньше, но это не значит, что это болезнь. Если он ест больше мяса, у него бактерий coliбудет больше, а бифидум меньше и так далее. Поэтому сам анализ нужно интерпретировать с учетом этих всех моментов.
— Когда ребенок сдает анализ, все эти факторы обследуются досконально?
— Нет, конечно.
— Тогда получается нельзя с точностью определить у ребенка наличие дисбактериоза?
— Без учета данных факторов нельзя. Поэтому многие родители, когда обращаются к нам за помощью, часто удивляются, почему мы спрашиваем все тонкости и подробности питания, которые в принципе никто никогда не спрашивает. Поэтому мы положительно отличаемся и в плане лечения, и в плане диагностики, и в плане результата. И поэтому к нам всегда огромная очередь.
— Какие методы лечения состояния дисбактериоза существуют и надо ли его вообще лечить?
— Лечить обязательно надо! Начинать лечение необходимо с основного заболевания, приведшего к этому состоянию или с той причины, которая привела к нему. Естественно, первично назначаются лекарственные препараты, которые воздействуют непосредственно на устранение основной причины. Предположим, у ребенка имеется гастрит, проводится его лечение и плюс назначаются препараты улучшающие микрофлору кишечника ребенка. Если ребенок находится в помещениях, где имеются различные домашние «приборы-излучатели» (телевизор, компьютер, микроволновая печь, радиотелефон, и другие, то, соответственно, их необходимо использовать, как можно реже.
 Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.
Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.— Врач сможет точно определить, отчего именно развился дисбактериоз?
— Чаще всего, мы видим причину.
— Существует ли профилактика дисбактериоза?
— В первую очередь необходимо следить за состоянием здоровья ребенка. Обязательно нужно придерживаться принципов здорового питания. В ежедневном рационе ребенка должна содержаться растительная клетчатка (овощи, фрукты, зерновые каши), которая способствует восстановлению кишечной микрофлоры. Естественно, набор должен быть полный: микроэлементы, витамины, ферменты. В рационе должна преобладать растительная пища, обязательно ребенку необходимо употреблять кисломолочные продукты и белки, в виде яиц, мяса, курицы, рыбы.
 Это будет способствовать восстановлению нормальной кишечной флоры.
Это будет способствовать восстановлению нормальной кишечной флоры.— Можно вести здоровый образ жизни, но ведь от стрессов и излучений уберечься гораздо сложнее. Какой выход в этом случае?
— Единственный – избавиться от источника негатива. Если, допустим, у вас стресс на работе, то нужно заменить место работы. И это абсолютно серьезно, ведь мы живем один раз. Быть в постоянном стрессе и лечиться от болезней – это не лучшее решение проблемы. Это просто бессмысленно. Не зря считают японцы, что место работы надо менять один раз в пять лет. И на каждом предприятии у них имеется комната разгрузки, в которой стоят муляжи начальников. Если начальник тебя обидел, заходишь в эту комнату и имеющейся там палкой лупишь по данному муляжу. Начальника, чей муляж разрушается быстрее остальных, увольняют с предприятия. Это и есть профилактика болезней у сотрудников и борьба за более высокую производительность на предприятии.
— Получается, что также не рационально жить в Челябинской области, где экология не самая лучшая?
— Безусловно, проживать у Средиземного моря или в горах Грузии гораздо полезнее, чем в Челябинской области.
 Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.
Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.— А какова роль наследственности в развитии болезней ЖКТ?
— Безусловно, большую роль в здоровье ребенка играет здоровье его родителей. Они передают ему предрасположенность к заболеваниям органов пищеварения. Если мама нездорова, то качество ее грудного молока будет низким, что является следующим фактором не в пользу ребенка.
— Во время грудного вскармливания мама должна соблюдать особый режим питания или диету?
— Питание должно быть полноценным и разнообразным.
 При наличии заболеваний ЖКТ у матери с профилактической целью могут быть назначены лекарства, улучшающие ее состояние. На это мама сама должна обратить внимание врача-гинеколога, потому что ее состояние здоровья на момент рождения ребенка играет большую роль в формировании здоровья малыша. В частности, насколько полноценным будет состав его микрофлоры кишечника. Ведь заселение нормальных микробов в кишечник ребенка происходит в утробе матери, начиная 26-28 недели.
При наличии заболеваний ЖКТ у матери с профилактической целью могут быть назначены лекарства, улучшающие ее состояние. На это мама сама должна обратить внимание врача-гинеколога, потому что ее состояние здоровья на момент рождения ребенка играет большую роль в формировании здоровья малыша. В частности, насколько полноценным будет состав его микрофлоры кишечника. Ведь заселение нормальных микробов в кишечник ребенка происходит в утробе матери, начиная 26-28 недели.— Какие продукты детям не рекомендуется употреблять в пищу?
— Существует пять основных вредных продуктов – это газированные напитки, майонез, кетчуп, чипсы и жевательная резинка. Это все продукты генной инженерии. Например, длительное использование жевательной резинки приводит к слабоумию (наличие в ней фенолов). Более того, она покрыта вредным вкусообразующим веществом. А частое ее использование ведет к нарушению пищевого рефлекса. И в следующий раз при глотании пищи желудок не будет готов к ее перевариванию.

— А какие продукты лучше не давать до трех лет?
— Все продукты до трех лет должны быть натуральными, не консервированными! Использовать их можно в сыром или вареном виде. Жареное и копченое, маринованное, шоколадное, естественно, нельзя. Хотя в последнее время надо уже говорить и о вредных привычках у детей раннего возраста, когда малышам матери начинают давать по чайной ложке водки на ночь, чтобы они лучше спали. А для аппетита детям стали давать пиво. Это встречается достаточно часто в последнее время. К нам поступают дети раннего возраста с циррозом печени, потому что мама, вскармливая ребенка грудью, употребляла алкогольные напитки и курила.
— Как вы относитесь к употреблению молока в питании детей?
— Учитывая тот факт, что идеально здоровых детей нет, употребление молока многим из них может быть не на пользу. Молоко может способствовать излишнему росту микрофлоры, а порой, организм ребенка не способен его переварить (лактазная недостаточность).
 Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.
Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.— Если ребенок вынужден принимать антибиотики, что нужно делать в профилактических целях, чтобы не развился дисбактериоз?
— Лучше всего прием антибиотиков сочетать с отваром трав, например, тысячелистника, подорожника, ромашки или душицы. Они на 80% снижают отрицательное воздействие антибиотиков на слизистую кишечника и его микрофлору.
— Как часто встречаются заболевания органов пищеварения?
— Заболевания желудочно-кишечного тракта у детей находятся на втором месте после респираторных инфекций. И это если учесть, что ребенок болеет ОРВИ 2-3 раза за год, а диагноз заболевания ЖКТ ставится однократно.
— Вы лечите детей только с области или из Челябинска тоже?
— ЧОДКБ обслуживает жителей Челябинской области вне зависимости от ее территорий, то есть сюда входит и Челябинск. Но учитывая тот факт, что в Челябинске имеются в достаточном количестве гастроэнтерологические койки и специалисты, диагностика тоже на высоком уровне, мы стараемся брать из Челябинска только самые тяжелые и сложные случаи.
 И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.
И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.— Каким образом дети попадают к вам?
— Они приезжают по направлению врачей из территорий области на консультативный прием в детскую областную поликлинику к специалисту-гастроэнтерологу. Осмотрев ребенка, и проведя необходимые исследования, врач решает необходимость его госпитализации или лечения в амбулаторных условиях. Вторым вариантом прибытия пациента в областную детскую поликлинику или на госпитализацию в отделение является осмотр врача-гастроэнтеролога «выездной поликлиники». Это когда наши специалисты консультируют детей по месту их проживания.
Ольга Мельчакова, информационное агентство «Уралпресс»
Дисбактериоз у детей
Дисбактериоз у детей – явление очень частое. К счастью, диагнозом дисбактериоз кишечника не является, то есть не входит в международную классификацию болезней. Тем не менее, дисбактериоз существует, и в особенности часто у детей.
Что же такое дисбактериоз?
Ребенок, как мы с Вами знаем уже из предыдущих статей, рождается в этом мире абсолютно стерильным. Важным моментом в формировании на коже новорожденного малыша и его слизистых оболочках поверхностной микрофлоры является прохождение ребенка по родовым путям матери и первый контакт с ее кожей, когда младенца акушеры должны выложить на мать. В первые часы жизни новорожденного начинается самое активное заселение поверхностей его тела множеством бактерий, которые в дальнейшем должны сформировать защитный слой везде, где возможен контакт наших с вами оболочек (кожи, слизистого эпителия) с возбудителями опасных инфекций.
Если в эти первые часы жизни в организм ребенка попадут помимо условно хороших бактерий еще и не очень хорошие, или патогенные бактерии, то у ребенка с самого момента его появления на свет будет нарушено состояние поверхностной защиты, иными словами, пленка может оказаться с дырками. Через эти слабые места в дальнейшем возможно попадание в организм различных аллергенов, вирусов и бактерий.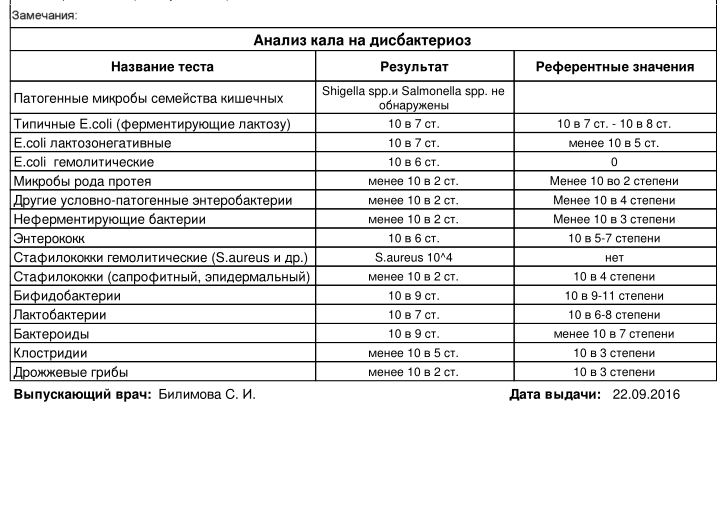
Точно также «дырки в защитной пленке» образуются в результате применения различных химиотерапевтических препаратов, прежде всего, антибиотиков.
Отсюда вывод: если мама ребенка во время беременности или во время лактации (кормления грудью), или же сам ребенок сразу после рождения получали антибиотики, дисбактериоз обеспечен.
А как следствие дисбактериоза возникают проблемы с аллергией, вплоть до непереносимости белка материнского молока. В настоящее время уже появились анализы на антитела IgE и IgG грудного ребенка к белку не только коровьего, но даже грудного материнского молока.
Как мы можем вылечить дисбактериоз?
Справедливости ради надо сказать, что вылечить дисбактериоз нельзя, поскольку это не болезнь, как уже написано выше. Но если в микробиологическом анализе кала на дисбактериоз высеиваются патогенные бактерии, то это – не дисбактериоз, а кишечная инфекция, которая лечится, увы, антибиотиками.
Во всех остальных случаях нарушения нормальной микрофлоры кишечника, запомните, дисбактериоз Не лечится антибиотиками!
В настоящее время принято очень много схем лечения дисбактериоза, которые включают различные бактериофаги – специальные вирусы, которые паразитируют на плохих микробах, во все схемы лечения дисбактериоза обязательно входят сорбенты – препараты, связывающие и выводящие из организма токсины патогенных бактерий, а также пищевые аллергены.
Но основным методом лечения дисбактериоза кишечника по-прежнему остается длительный прием пробиотиков, то есть колоний хороших, полезных бактерий, которые очень нужны для правильного пищеварения и профилактики аллергии у детей, кто бы и что Вам не говорил.
Лечение дисбактериоза – это длительный и сложный процесс, но стоит того, чтобы предотвратить у ребенка развитие хронического запора или остановить развитие атопического дерматита.
Самостоятельно нельзя начинать прием никаких препаратов для лечения дисбактериоза, так как любые препараты имеют и плюсы, и минусы, то есть возможные побочные эффекты, и только грамотный врач педиатр, аллерголог илигастроэнтеролог должны подобрать и контролировать необходимый курс лечения.
Диагностика и коррекция дисбактериоза у детей | Мухина Ю.Г.
Значение микробиоценоза кишечника Наиболее сложным биотопом микробиоценоза является кишечная кооперация, представленная различными популяциями микроорганизмов. Микробиоценоз кишечника — очень важная система организма, выполняющая или регулирующая многочисленные его функции по поддержанию гомеостаза.
| ФУНКЦИИ НОРМАЛЬНОЙ МИКРОФЛОРЫ КИШЕЧНИКА:
o обеспечение колонизационной резистентности |
Одной из важнейших функций нормальной микрофлоры является обеспечение колонизационной резистентности, которая предотвращает заселение организма посторонними микробами.
 При снижении колонизационной резистентности происходит увеличение числа и спектра патогенных бактерий, возникает возможность развития инфекционного процесса. Интересно, что колонизационная способность микроорганизмов, (в частности, лактобактерий) строго специфична в отношении конкретного индивидуума. Исследования на добровольцах показывают, что аутомикроорганизмы обеспечивают очень быстрое восстановление нормального состояния микрофлоры кишечника.
При снижении колонизационной резистентности происходит увеличение числа и спектра патогенных бактерий, возникает возможность развития инфекционного процесса. Интересно, что колонизационная способность микроорганизмов, (в частности, лактобактерий) строго специфична в отношении конкретного индивидуума. Исследования на добровольцах показывают, что аутомикроорганизмы обеспечивают очень быстрое восстановление нормального состояния микрофлоры кишечника.Слизистая кишечника покрыта биопленкой, внутри которой устойчивость бактерий к неблагоприятным воздействиям обеспечивают клеточный муцин и бактериальный полисахарид, заключающие матрикс микроколонии бактерий и простейших. Неиммобилизованные бактерии имеют устойчивость во много раз ниже, чем при колонизационной резистентности.
| У детей, находившихся на искусственном вскармливании, аутофлора кишечника чаще вызывает эндогенные инфекционные процессы |
Хорошо известна иммуномодулирующая функция микрофлоры кишечника.
 Становление иммунного ответа формируется в первые часы неонатального периода под влиянием микрофлоры. При отсутствии микроорганизмов происходит уменьшение глубины крипт слизистой кишки, снижение высоты ворсин, истончение собственной пластины, уменьшение пейеровых бляшек. При их участии выделяются лизоцим и другие адъювантно-активные соединения, которые стимулируют иммунную систему организма.
Становление иммунного ответа формируется в первые часы неонатального периода под влиянием микрофлоры. При отсутствии микроорганизмов происходит уменьшение глубины крипт слизистой кишки, снижение высоты ворсин, истончение собственной пластины, уменьшение пейеровых бляшек. При их участии выделяются лизоцим и другие адъювантно-активные соединения, которые стимулируют иммунную систему организма.Микроорганизмами осуществляются физиологические, биохимические процессы в желудочно-кишечном тракте (ЖКТ) по перевариванию и всасыванию пищи. Метаболизм белков, углеводов, жиров, продукция витаминов, гормонов, ряда биологических аминов поддерживают функциональные возможности всего организма и, в частности, ЖКТ. Моторная функция кишечника регулируется также микробной флорой, которая осуществляется через ряд механизмов: образование и ингибирование субстанций типа брадикинина; продукция простагландинов бактериального происхождения; изменение метаболизма желчных кислот с образованием метаболитов, ускоряющих моторику. Образующиеся в процессе жизнедеятельности микроорганизмов амины — гистамин, брадикинин — регулируют сфинктерную деятельность ЖКТ.
Образующиеся в процессе жизнедеятельности микроорганизмов амины — гистамин, брадикинин — регулируют сфинктерную деятельность ЖКТ.
| Разнообразные неблагоприятные воздействия вызывают изменения иммунного ответа и поэтому могут влиять на качественные и количественные характеристики нормальной флоры кишечника |
Детоксикационная деятельность кишечной микробной флоры осуществляет защиту от ксенобиотиков: пестицидов, аминов, солей тяжелых металлов, многих лекарственных средств, нитратов и пр. Известен ряд бактерий, имеющих высокую активность нитратредуктазы (пропионибактерии, пептококки, вейлонеллы, грамотрицательные энтеробактерии и другие), которые предотвращают развитие метгемоглобинемии при высоком содержании нитратов. Особенно это важно у детей раннего детского возраста, имеющих высокую долю фетального гемоглобина.

Метаболические детоксикационные процессы протекают с участием преимущественно реакций гидролиза и восстановления, с биотрансформацией, приводящей к образованию нетоксических продуктов и ускорению элиминации.
Формирование микробиоценоза у детей
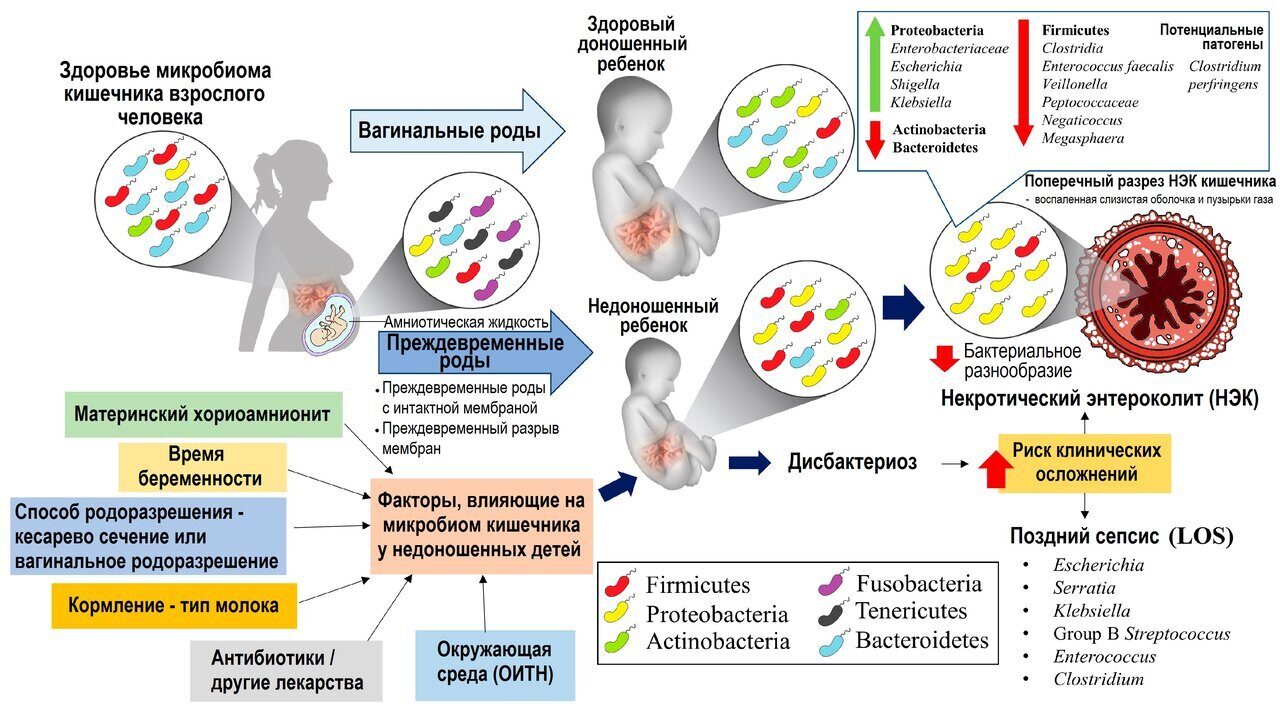
Становление микробного биоценоза ребенка начинается с первых этапов жизни. Во время родов при заглатывании происходит поступление микрофлоры родовых путей матери и колонизация вагинальной флоры в пищеварительной системе ребенка. В настоящее время отработаны рекомендации по коррекции вагинальной флоры беременной женщины в последнем триместре беременности с помощью бактерийного препарата желемик, представляющего собой лиофилизированные живые лактобактерии, выделенные из влагалища здоровых женщин. Колонизация кишечника ребенка микрофлорой матери обеспечивает предупреждение развития дисбактериозов у новорожденного.
| Приизмене ияхмикрофлор кишечни анеобхо им коррекцияпита иясучетоммотори и,секре орныхизме ений,фермент ойактивности пищева ительного трактаидоп л ительн мвведениемвитаминн -минераль ы комплексов |
После рождения происходит колонизация кишечника микробами матери, а также персонала и окружающей среды, которые в основном представлены аэробами и факультативно — анаэробами.
Флора ребенка первого года жизни находится в прямой зависимости от характера вскармливания. Дети, получающие естественное вскармливание, имеют виды бифидумбактерий: B. bifidum и B. breve, а на искусственном — биовар в B. longum. После одного года жизни доминирующими становятся B. breve, B. adolscentis, B. longum, B. infantis. У взрослых чаще присутствует B.bifidum серовар а, B. adolscentis, B. longum. Лактобактерии определяют в более высоком титре при искусственном вскармливании. Клостридии превышают уровень 106 КОЕ/г исследуемого материала при использовании искусственных смесей. Нередко можно обнаружить у этих детей C. dificile и C. perfringens, способных вырабатывать энтеротоксины. Повышение уровня клостридий может происходить у более старших детей при использовании несбалансированной диеты со значительным увеличением содержания мясных продуктов.
У взрослых чаще присутствует B.bifidum серовар а, B. adolscentis, B. longum. Лактобактерии определяют в более высоком титре при искусственном вскармливании. Клостридии превышают уровень 106 КОЕ/г исследуемого материала при использовании искусственных смесей. Нередко можно обнаружить у этих детей C. dificile и C. perfringens, способных вырабатывать энтеротоксины. Повышение уровня клостридий может происходить у более старших детей при использовании несбалансированной диеты со значительным увеличением содержания мясных продуктов.
Просмотреть [ _Т а б л и ц у_ ]
У детей, получающих искусственное вскармливание, чаще и в более высоких титрах появляются бактероиды и вейлонеллы. При избыточном количестве последних может отмечаться повышенное газообразование, развитие диспепсических проявлений. В зависимости от характера питания находится и факультативно-анаэробная флора. Пациенты, находящиеся на искусственном вскармливании чаще заболевают энтеритами, которые обусловлены эндогенными эшерихиями, или кишечными палочками с измененными свойствами (лактозонегативные и гемолизинпродуцирующие). Другие бактерии: клебсиеллы, протеи, морганеллы, энтеробактер, цитробактер, серрации являются условно-патогенными; при снижении резистентности организма они могут приобретать патогенные свойства, вызывать воспалительный процесс и диарею.
Пациенты, находящиеся на искусственном вскармливании чаще заболевают энтеритами, которые обусловлены эндогенными эшерихиями, или кишечными палочками с измененными свойствами (лактозонегативные и гемолизинпродуцирующие). Другие бактерии: клебсиеллы, протеи, морганеллы, энтеробактер, цитробактер, серрации являются условно-патогенными; при снижении резистентности организма они могут приобретать патогенные свойства, вызывать воспалительный процесс и диарею.Непатогенные стафилококки (S. epidermidis) колонизируют кишечник детей с первых дней жизни. Иногда присутствуют в небольших концентрациях стафилококки с патогенными свойствами. Однако возможно развитие инфекционного процесса при передаче от носителей к ребенку нозокомиальных штаммов. Эти штаммы отличаются устойчивостью к антибактериальным препаратам и могут вызывать тяжелые воспалительные поражения кишечника и даже септический процесс.
| Результат комплексного лечения зависит от эффективности терапевтической тактики основного заболевания, адекватности выбора комплекса препаратов с учетом микробиологических изменений и особенностей организма ребенка |
Роль стрептококков в формировании оптимального уровня колонизационной резистентности достаточно велика.
 При естественном вскармливании уровень стрептококков сохраняется постоянным, а при искусственном вскармливании может значительно превышать норму. Однако при сниженном количестве облигатной микрофлоры у детей усиленный рост энтерококков способствует формированию эндогенного инфекционного процесса.
При естественном вскармливании уровень стрептококков сохраняется постоянным, а при искусственном вскармливании может значительно превышать норму. Однако при сниженном количестве облигатной микрофлоры у детей усиленный рост энтерококков способствует формированию эндогенного инфекционного процесса.Таким образом, естественное вскармливание ребенка, начатое сразу после его рождения, формирует более благоприятную флору пищеварительного тракта, которая способна к колонизационной резистентности и обеспечивает адекватные процессы пищеварения. Искусственное вскармливание может являться одной из причин изменений микроэкологии ребенка с последующим участием эндогенной флоры в формировании инфекционных, аллергических, иммунопатологических процессов.
Микроорганизмы колонизируют просвет пищеварительного тракта, а также поверхность слизистых оболочек. В связи с этим разделяют мукозную микрофлору и полостную микрофлору. При ряде патологических состояний очень важно учитывать состав каждого пула. В настоящее время разрабатываются и внедряются методы раздельной оценки флоры пищеварительного тракта.
В настоящее время разрабатываются и внедряются методы раздельной оценки флоры пищеварительного тракта.
Клинические проявления дисбиоза появляются значительно позже, чем микробиологические изменения. Они очень неспецифичны, однако возможен ряд симптомов, которые формируются из-за нарушения процессов, происходящих при участии определенных бактерий.
Состав кишечной микрофлоры
Бифидобактерии — грамположительные палочки, строгие анаэробы — в толстой кишке детей составляют около 95% популяции бактерий. Являясь сахаролитическими микробами, выделяют большое количество кислых продуктов. Образующаяся молочная, уксусная кислоты способствуют усилению всасывания ионов кальция, железа, витамина D. Продукция ими лизоцима, бактериоцинов, спиртов и высокая антагонистическая активность по отношению к патогенным бактериям препятствуют проникновению микробов в верхние отделы ЖКТ и другие органы. Отмечена высокая способность у бифидобактерий к синтезу аминокислот, белков, многих витаминов группы В, которые затем всасываются в кишечнике. Поэтому при стойких, тяжелых нарушениях функций бифидобактерий может развиваться комплекс белково-витаминно-минеральной недостаточности. При снижении уровня бифидобактерий транслокация условно-патогенных микробов в верхние отделы кишечника может вызывать их избыточный рост с более тяжелыми проявлениями синдрома нарушенного всасывания.
Поэтому при стойких, тяжелых нарушениях функций бифидобактерий может развиваться комплекс белково-витаминно-минеральной недостаточности. При снижении уровня бифидобактерий транслокация условно-патогенных микробов в верхние отделы кишечника может вызывать их избыточный рост с более тяжелыми проявлениями синдрома нарушенного всасывания.
Лактобактерии включают 44 вида, но основными являются L. acidophilus, L. casei, L. plantarum, L. fermentum. Подавление гнилостных и гноеродных микробов и антибактериальная активность лактобактерий связаны с выработкой молочной кислоты, спирта и лизоцима, продуктов с высокой антибиотической активностью, интерферонов, интерлейкина 1, ряда других. Исчезновение лактобактерий приводит к сдвигу реакции среды в щелочную сторону, резко снижая утилизацию кишечником биологически активных соединений. Интересен факт, что люди, использующие строгую вегетарианскую диету, имеют очень высокое содержание лактобактерий.
Доказана важная роль эубактерий, которые представляют собой анаэробные грамположительные неспорообразующие палочки, в трансформации холестерола в копростанол. В связи с этим положением требует внимания педиатров ряд работ зарубежных исследователей по использованию функционального питания, обогащенного соответствующими микроорганизмами для снижения уровня холестерола у пациентов. Однако следует помнить, что эубактерии могут участвовать в развитии воспаления ротовой полости, формировании гнойных процессов в плевре и легких и инфекционного эндокардита.
В связи с этим положением требует внимания педиатров ряд работ зарубежных исследователей по использованию функционального питания, обогащенного соответствующими микроорганизмами для снижения уровня холестерола у пациентов. Однако следует помнить, что эубактерии могут участвовать в развитии воспаления ротовой полости, формировании гнойных процессов в плевре и легких и инфекционного эндокардита.
Клостридии также принимают участие в деконъюгации желчных кислот, многие поддерживают колонизационную резистентность, подавляют рост патогенных клостридий. Clostridium difficile и C. perfrigens способны вырабатывать энтеротоксины. Микробные пептидные токсины оказывают провоспалительный эффект, вызывают хемотаксис нейтрофилов, выделяют сериновые протеазы, окислители, формируют хроническое воспаление. При их участии происходит местная и системная сенсибилизация антигенами энтеральной системы, пищевая сенсибилизация. Так, развитие псевдомембранозного колита, обусловленного C. difficile (Рис. 1), связано с применением ряда антибиотиков, подавляющих нормальную микрофлору и резким снижением количества нетоксигенных клостридий.
difficile (Рис. 1), связано с применением ряда антибиотиков, подавляющих нормальную микрофлору и резким снижением количества нетоксигенных клостридий.
Бактероиды являются еще недостаточно изученными представителями микрофлоры, известна их определенная роль в расщеплении желчных кислот. Среди них B. fragilis обладает рядом факторов, обусловливающих патогенность: способность секретировать лактамазу, энтеротоксин, гиалуронидазу, гепариназу, фибролизин, нейраминидазу. Имеются указания, что 10% случаев диарей вызываются энтеротоксигенными штаммами B. fragilis, особенно часто диарея, обусловленная бактероидами, наблюдается у детей дошкольного возраста.
Целый ряд видов фузобактерий способны секретировать гемолизины, гемагглютинины и факторы агрегации тромбоцитов. Поэтому при тяжелых септицемиях, связанных с ростом фузобактерий, могут возникать тромбоэмболии, имеющие соответствующую клиническую характеристику.
Вейлонеллы способны к восстановлению нитратов. При избыточном размножении в кишечнике вейлонелл отмечается повышенное газообразование, могут возникать выраженные диспепсические расстройства.
При избыточном размножении в кишечнике вейлонелл отмечается повышенное газообразование, могут возникать выраженные диспепсические расстройства.
Некоторые штаммы эшерихий продуцируют колицины, которые тормозят рост энтеропатогенных штаммов кишечной палочки. Эти свойства обусловлены в первую очередь механизмом синтеза секреторных иммуноглобулинов в кишечнике. Эшерихии принимают участие в синтезе витамина К, обеспечивая гемостатические процессы. Однако следует указать на способность формирования госпитальных штаммов эшерихий с множественной резистентностью к антибактериальным средствам, что является причиной развития госпитальной инфекции.
Цитробактер, энтеробактер, протеи, клебсиеллы и другие при снижении иммунологической резистентности организма также могут приводить к изменению функции кишечника, формированию воспалительных процессов в различных органах в результате воздействия микробных пептидных токсинов.
Иммунная реактивность организма
Самые разнообразные неблагоприятные воздействия на ребенка: стрессы, физические и психоэмоциональные нагрузки, несбалансированное питание, экологическое неблагополучие и многие патологические состояния вызывают изменения иммунного ответа и поэтому могут влиять на качественные и количественные характеристики нормальной флоры кишечника. В случае развития дисбактериоза кишечника у больного ребенка могут выявляться клинические состояния, которые связаны со снижением колонизационной резистентности, расстройствами пищеварения и трофическими нарушениями, нарушением детоксицирующей функции кишечной микрофлоры и изменениями иммунного ответа.
В случае развития дисбактериоза кишечника у больного ребенка могут выявляться клинические состояния, которые связаны со снижением колонизационной резистентности, расстройствами пищеварения и трофическими нарушениями, нарушением детоксицирующей функции кишечной микрофлоры и изменениями иммунного ответа.
Диагностика и оценка тяжести кишечного дисбактериоза
В зависимости от степени выраженности клинических проявлений и особенностей микробиологических изменений выделяют 3 степени дисбактериоза: компенсированная, субкомпенсированная и декомпенсированная. Однако в оценке степеней дисбактериоза нет единой точки зрения, так как часто используются разные клинико-лабораторные критерии. Клинические проявления дисбактериоза кишечника в значительной степени определяются локализацией изменений. Дисбактериоз тонкой кишки — синдром избыточного бактериального роста (обсеменения), чаще характеризуется диареей и формированием синдрома нарушенного кишечного всасывания с самыми разнообразными отклонениями в гомеостазе. Дисбактериоз толстой кишки может не иметь клинических проявлений. В ряде случаев описывают связь запоров с нарушениями микрофлоры. Может формироваться тяжелое заболевание — псевдомембранозный колит.
Лабораторная диагностика дисбактериоза чаще всего базируется на микробиологическом анализе фекалий. Микробиологическими критериями служат снижение бифидолактобактерий, снижение или увеличение эшерихий, появление штаммов с измененными свойствами, повышение количества кокков, обнаружение условно-патогенных грамотрицательных палочек, а также грибов и клостридий более 103 КОЕ/л. В анализах возможны различные сочетания указанных сдвигов.
В настоящее время применяется также газожидкостная хроматография. Хроматографический метод позволяет оценить химические соединения, связанные с жизнедеятельностью нормальной микрофлоры.
Оценка копрологии выявляет бродильную и гнилостную диспепсию, нарушения расщепления и всасывания пищевых ингредиентов.
В ряде случаев целесообразно определение ЛПС-О-антигена, уровня энтеротоксинов.
Коррекция микрофлоры
Лечебные программы по восстановлению нарушенной микрофлоры должны строиться с учетом возможных факторов, приводящих к ее изменению. Имея в своем арсенале широкий спектр различных препаратов, для выбора конкретных лекарств врач должен проанализировать индивидуальные изменения в организме ребенка с учетом преморбидного фона, возраста, характера вскармливания, аллергических реакций, перенесенных кишечных инфекций, а также препаратов, используемых для терапии основного заболевания.
Питание
Адекватное, соответствующее возрасту ребенка, сбалансированное питание при нормальном функционировании органов и систем предотвращает развитие дисбиозов. При изменениях микрофлоры необходима коррекция питания с учетом моторики, секреторных изменений ЖКТ, ферментативной активности пищеварительного тракта и дополнительным введением витаминно-минеральных комплексов. В настоящее время широкое распространение получает так называемое функциональное питание. При функциональном питании употребляются готовые пищевые продукты, в которые добавляют биопрепараты, антиоксиданты, каротиноиды, ферменты и другие субстраты. Для детей раннего возраста широко применяются адаптированные смеси, обогащенные представителями микрофлоры, — (Малютка), (Биолакт адаптированный), (Бифидок), (Бифилин), (Бифидолакт), (Бифилайф), (Виталакт) и ряд других. Во многих случаях оправдывает себя применение сухой смеси (Лактофидус), содержащий бифидобактерии и стрептококки, (НАН) с бифидобактериями. Для выхаживания детей в неонатальном периоде разработано функциональное питание в виде лиофилизированного грудного молока, обогащенного Bifidobacterium bifidum.
Большое значение для коррекции микрофлоры кишечника имеют пищевые волокна. Они являются естественными энтеросорбентами и влияют на состав микробоценоза. Микробная флора использует пищевые волокна в качестве субстрата для жизнедеятельности, однако следует помнить, что продукты их метаболизма могут оказывать как физиологическое, так и токсическое действие.
Пищевые волокна (пектины, лигнины, целлюлоза, гемицеллюлоза) содержатся в большом количестве в отрубях, морской капусте, яблоках, моркови, красной рябине и других овощах и фруктах; поступая в толстую кишку, они подвергаются воздействию глюкозидаз. Глюкоза является субстратом для многих анаэробных бактерий. Велика роль и других образующихся метаболитов, среди них молочная кислота, другие короткоцепочечные монокарбоновые кислоты, которые ингибируют патогенную флору и являются субстратом для восстановления кишечного эпителия. Пропионовая кислота регулирует микроциркуляцию толстой кишки через сосудистые сфинктеры, бутират участвует в пролиферации и дифференцировке эпителия кишечника. Пищевые волокна существенно снижают уровень эндогенного гистамина и других биологических аминов, которые реализуют аллергические проявления при болезнях пищеварительной системы. Хорошо зарекомендовали себя препараты лактулозы. Для лечения дисбиозов широко используется нормазе. Препарат высоко эффективен при наличии запоров и аллергического компонента.
Ферментные препараты
Для улучшения расщепления и всасывания пищевых ингредиентов могут использоваться ферментные препараты на основе панкреатина, а в сложных случаях — микротаблетированные ферменты, которые могут предотвращать гнилостные процессы. В последнее время с хорошим эффектом применяются комбинированные препараты вобензим, флагензим. Они особенно эффективны в комплексной терапии дисбиозов кишечника, сопровождающихся нарушениями кишечного всасывания и аллергическими проявлениями у детей.
Энтеросорбенты
Применение энтеросорбентов особенно важно в условиях возрастания полирезистентности микробов к антибактериальным средствам. Сорбенты обладают высокой сорбирующей активностью по отношению к экзо- и эндотоксинам, метаболитам бактерий, желчным кислотам, а также самим бактериям и вирусам. Применяются сорбенты на основе гранулированных активированных углей: карболен, микросорб П, активированный уголь СКН, энтеросорбент СКН, карболонг и ряд других. Энтеросорбент смекта, представляющий собой микропластины диоктаэдра кремния и алюминия также нашел свое применение в педиатрической практике. Этот препарат способствует улучшению свойств слизи ЖКТ, повышению резистентности слизистой оболочки , имеет цитопротективное действие. С хорошим терапевтическим эффектом применяются новые сорбенты — СУМС1 и альгисорб (альгинат кальция), они быстро выводят различные метаболиты, нормализуют показатели микрофлоры. СУМС1 представляет собой углеродоминеральный сорбент в виде гранул и порошка. Альгисорб изготавливается из морских водорослей — ламинарий, не влияет на обмен кальция, калия, железа, микроэлементов, поэтому может применяться в течении длительного времени. Он хорошо восстанавливает многие адаптационные механизмы.
Бактерийные препараты
Широкое распространение получили бактерийные препараты на основе живых микроорганизмов, представителей нормальной микрофлоры — пробиотики (см. таблицу). В настоящее время появилось новое понятие — биотерапевтические агенты (БТА), представляющие собой препараты микроорганизмов, на основе штаммов лактобифидобактерий. Бифидумбактерин, лактобактерин, кисломолочный бифидумбактерин относятся к категории БТА. Для этих препаратов характерна способность выживать в кислой среде, эффективно прикрепляться к эпителиоцитам, осуществлять колонизацию слизистой, продуцировать антимикробные субстанции, стимулировать иммунную систему, предупреждать избыточный рост и размножение патогенных микроорганизмов, восстанавливать нормальную микрофлору.
В ряде препаратов имеется сочетание микроорганизмов: бификол (бифидо-колибактерии), бифиформ (бифидум-энтерококк), бифоцит (бифидум-лактобактерии), линекс (три штамма лактобактерий), кисломолочный бифилакт. Имеются также комплексные препараты: бифидумбактерин-форте (с косточковым сорбентом), бифилиз (с лизоцимом), нутролин В (с витаминами группы В), кипацид (с иммуноглобулином). В настоящее время появляются рекомбинантные препараты (субалин).
Имеются разные точки зрения на применение бактерийных препаратов, содержащих аэробные спорообразующие бактерии — бактисубтил, споробактерин и др. Существуют указания, что искусственное введение в кишечник этих бактерий в больших количествах и излишнее размножение бацилл в нехарактерной для них экологической нише, сопровождающееся распространением бацилл за пределы кишечника, на фоне снижения количества облигатной флоры может увеличивать степень дисбиотических нарушений, ухудшать состояние пациента. B. cereus синтезируют гемолизины, способные разрушать эритроциты. Препарат споробактерин содержит бациллы, продуцирующие протеолитические ферменты, фибринолизины. Штаммы, содержащиеся в споробактерине, из-за высокой протеолитической активности проникают через слизистую оболочку в кровь, лимфу, достигают лимфатических узлов, селезенки, печени. По сути эти штаммы обладают свойствами, характерными для патогенных микроорганизмов. Можно согласиться с мнением ряда авторов, что широкое применение указанных препаратов мало обосновано и должны быть строгие показания для их использования.
В настоящее время при неэффективности коммерческих бактерийных препаратов в силу слабой их приживляемости в кишечнике больного могут использоваться аутоштаммы бифидо- и лактобактерий. Они могут длительно сохранять свою активность в лиофилизированном состоянии или в холодильнике при температуре -20оС. Особенно рекомендуется коррекция микрофлоры с помощью аутоштаммов у больных, требующих применения цитостатиков, глюкокортикоидов, антибиотиков, лучевой терапии.
Отработано применение донорских штаммов бифидо- и лактобактерий матери для ребенка через 2 ч после кесарева сечения с целью предотвращения патологической колонизации кишечника и формирования нормальной микрофлоры.
Также используются препараты пробиотики, состоящие из пищевых добавок, селективно стимулирующих рост нормальной флоры. Достаточно широко используются лизоцим, лактулоза, хилак-форте.
В случаях дисбактериоза 2-3-й степени необходимо назначать средства, обладающие селективной антибактериальной активностью. Различные фаги часто бывают эффективны в лечении дисбактериозов. В настоящее время используют стафилококковый, клебсиеллезный, пиобактериофаг, интестибактериофаг, синегнойный и другие фаги.
В некоторых случаях, при низкой чувствительности к фагам могут использоваться антибактериальные препараты: фуразолидон, хлорофилипт, метронидазол, нифуроксазид, интетрикс, а также антибиотики и группа антигрибковые средства, среди последних следует указать кетоконазол, флюконазол, натамицин.
Комплексная терапия может включать иммуномодулирующие средства, в том числе витамины, стабилизаторы клеточных мембран, микроэлементы.
Результат лечения зависит от эффективности терапии основного заболевания, адекватности выбора комплекса препаратов с учетом не только микробиологических изменений, но и особенностей организма ребенка.
Литература
1. Бабушкин Н.В. Применение препарата (Хилак-форте) в комплексном лечении дисбактериоза кишечника. Рос. журн. гастроэнтерол., гепатол., колопроктол. 1997; 5: 96-7.
2. Запруднов А.М., Мазанкова Л.Н. Микробная флора кишечника и пробиотики. М. 1999.
3. Куваева И.Б., Ладодо К.С. Микроэкологические и иммунные нарушения у детей. М. 1991.
4. Коровина Н.А., Вихерева В.Н., Захарова И.Н. и др. Профилактика и коррекция нарушений микробиоциноза кишечника у детей раннего возраста. М. 1996.
5. Коршунов В.М., Смеянов В.В., Ефимов Б.А. Рациональные подходы к проблеме коррекции микрофлоры кишечника. Вестн. РАМН. 1996; 2: 60-5.
6. Коршунов В.М., Володин Н.Н., Ефимов Б.А. и др. Микроэкология желудочно-кишечного тракта. Коррекция микрофлоры при дисбактериозах кишечника. М. 1999.
8. Парфенов А.И. Микробная флора кишечника и дисбактериоз. Рус. мед. журн. 1998; 6 (18): 1170-3.
9. Шендеров Б.А., Манвелова М.А. Функциональное питание и пробиотики: микроэкологические аспекты. М. 1997.
10. Щеплягина Л.А., Римарчук Г.В., Борисова О.И. и др. Организация медицинского наблюдения за детьми в районах экологического неблагополучия. (Лекция). М. 1998; 25-35.
.
Дисбактериоз у грудничка: симптомы и лечение
Как известно помимо стерильных областей нашего организма (такой как, например, кровь), у нас есть органы, в которых живут различные бактерии. Среди них различают «дружественные», «враждебные» и «нейтральные». Набор бактерий у каждого человека свой, именно его и называют микрофлорой. Как только состояние микрофлоры отклоняется от нормы (индивидуальной для каждого организма), диагностируется дисбактериоз. Причиной изменений во флоре ребенка всегда является стресс — смена климата, режима, нарушение биоритмов, болезнь, введение в рацион новых продуктов и пр. Самый верный сценарий поведения родителей в сложившейся ситуации — подождать.
Симптомы дисбактериоза у грудничка исчезнут при одном из условий:
1. Организм адаптируется к новым условиям
2. Причина, вызвавшая сбой (простуда или стресс), будет устранена.
Многие педиатры убеждены, что дисбактериоз нужно лечить и рекомендуют принимать препараты для восстановления микрофлоры. Зачастую они неэффективны, однако, мама принимает естественное возвращение здоровья малыша в норму за результат от лечения.
Какие симптомы указывают на дисбактериоз у грудничка:
- Плохой аппетит
- Метеоризм, вздутие живота
- Боли в животе
- Молочница, стоматит
- Расстройство стула — запоры, понос
- Отрыжка, рвота
- Неприятный запах изо рта
Безусловно, эти симптомы могут сигнализировать о действительно серьезных заболеваниях ЖКТ. Поэтому для определения причин недомогания делают анализ кала. Дисбактериоз по нему определить невозможно, а вот выявить опасные кишечные инфекции (дизентерию, сальмонеллез и др.) — да.
Рекомендаций для лечения синдрома не существует, однако для профилактики дисбактериоза у младенцев стоит выполнять следующие советы педиатров:
- Кормите ребенка грудью (как минимум полгода после рождения, в идеале —до 1–1,5 года). Мамино молоко — залог здоровья малыша. Грудничкам, страдающим от дисбактериоза, оно нужно особенно.
- Смесь для искусственников подбирайте вместе с наблюдающим ребенка педиатром. Хорошо, если в ней будет содержаться пребиотик ГОС (такой есть в каждой смеси Valio Baby®). Он похож на естественные пищевые волокна, которые содержатся в грудном молоке и способствуют формированию здоровой микрофлоры младенца.
#PROMO_BLOCK#
- Не увлекайтесь стерильностью. Разумеется, это не значит, что ребенок должен жить в грязи, однако полностью ограждать детский организм от внешних бактерий не стоит. У малыша должен сформироваться иммунитет.
- Чаще и дольше гуляйте на свежем воздухе.
- Не кормите ребенка насильно, если у него нет аппетита или он перенес какой-либо стресс (смену режима, нововведения в меню, переезд). Доказано, что микрофлора быстрее приходит в норму, если кишечник не перегружен. Некоторые родители практикуют намеренное ограничение в питании малыша, чтобы он быстрее почувствовал себя лучше.
Дисбактериоз кишечника у младенца — симптомы и лечение. Нарушение пищеварительной системы у детей первого года жизни
Почему у младенцев часто бывают функциональные нарушения пищеварительной системы: колики, срыгивания, запор или понос? Какая в этом роль микробиоценоза кишечника? Как формируется микробный мир ребенка и влияет ли он на здоровье малыша, можно и нужно ли принимать в раннем возрасте биодобавки, которые содержат живые бактерии.
Посмотреть видео: Дисбактериоз у младенца
Попробуем разобраться что такое микробиоценоз, как формируется микробное содружество у ребенка, когда он нарушается и чем это грозит малышу, нужно ли давать пробиотики и если да, то в каких случаях и какие именно.
Что бы понять роль микроорганизмов в нашем организме вы должны знать, что в человеке общее количество соматических клеток приблизительно 1013 степени, а вот общее количество микроорганизмов, которое находится в организме – 1015, то есть на каждую клетку нашего организма приходится около 100 микроорганизмов!!!
И возникает вопрос, так кто в доме хозяин? В совокупном геноме человека и микроорганизмов, которые его населяют, геном человека занимает не более 1%.
За счет микробов мы дополнительно имеем к своей наследственной программе около 40 генов, которые продуктивно работают на наш организм.
Получается, что дисбиозы приводят к сокращению дополнительной наследственной программы, которую получает малыш от микробов. На сегодняшний день кишечник, с наполняющими его бактериями, называют вторым мозгом человека, настолько велико его влияние на все процессы в организме.
Главное, что организм человека и его микрофлора создают уникальную экосистему. Ее нормальное состояние — эубиоз, то есть равновесие между микробиоценозом и хозяином.
При этом микробы не просто живут, а выполняют различные функции и поддерживают состояние, которое все привыкли называть здоровьем. При нарушении баланса, то есть, при дисбиозе, полезные функции нормофлоры превращаются в соответствующие «антифункции» … К слову, нарушить этот баланс очень легко, а восстановить бывает очень непросто!
Как формируется микробиоценоз у малыша?
Ребенок в утробе матери находится в стерильных условиях. При рождении, природа позаботилась о том, чтобы в родовых путях значительно увеличивалось количество лактобактерий и другой полезной флоры. Рождаясь, ребенок как-бы вылизывает родовые пути мамы и получает первую флору, нужную для заселения кишечника. Дальше следующий этап – после родов ребенку еще не отсекли пуповину, а сразу же выкладывают на живот и мамину грудь. Этот момент называют контактом «кожа к коже». При этом он опять получает хорошие и полезные микроорганизмы от матери. Затем его прикладывают к груди, и он получает молозиво, которое содержит — лакто и бифидобактерии, и, кроме того, еще и пребиотики олигосахариды, т.е вещества, которые способствуют росту и размножению
бифидофлоры в кишечнике.
А дальше мама начинает кормить грудным молоком, с которым малыш получает и полезные бактерии и вещества, которые способствуют их росту и размножению. В результате формируется индивидуальная кишечная микробиота, которую можно рассматривать как «отпечаток пальца» организма-хозяина. А теперь представьте ситуацию: роды с помощью кесарева сечения, позднее прикладывание к груди, искусственное вскармливание, назначение антибиотиков при определенных состояниях — все это существенно нарушает нормальное формирование и функционирование этого очень сложного микробиоценоза кишечника.
Результатом такого дисбаланса могут быть кишечные колики и другие неприятности у малыша.
Что мы часто наблюдаем, при нарушениях микобиоценоза кишечника у маленьких детей.
В первую очередь это функциональные нарушения кишечника: колики, срыгивания, запор или понос. Кроме того, дисбактериоз нарушает нормальное развитие иммунной системы малыша и формирование иммунологической толерантности, что проявляется увеличением риска пищевой аллергии, в первую очередь на белок коровьего молока, что клинически проявляется теми же коликами, срыгиванием, поносом или запором, кожной сыпью. Дисбактериоз способствует уменьшению синтеза фермента лактазы в кишечнике, при этом могут возникать симптомы непереносимости лактозы, что проявляется криком и беспокойством ребенка после кормления, коликами, пенистым стулом с кислым запахом, срыгиванием. Дисбактериоз сопровождается нарушением моторики кишечника, что способствует поносам или запорам. При дисбактериозах нарушается синтез и всасывание витаминов и микроэлементов и у ребенка легко развиваются дефицитные состояния. Таким образом довольно часто родители или педиатр, учитывая определенные клинические симптомы может заподозрить нарушение баланса микрофлоры, как иногда говорят дисбактериоз. Хотя официально такого диагноза и нет, в вот состояние – реально есть.
Нужно ли делать анализ кала на дисбактериоз в микробиологической лаборатории?
Дело в том, что рутинные анализы на дисбактериоз или микробный пейзаж малоинформативны. Делать такой анализ, чтобы получить реальный результат это и дорого, и сложно, нужна очень хорошо оснащенная лаборатория, которая может делать генетическое типирование бактериальных штаммов. Для большинства центров это нереально. Такое исследование стоит сделать при значительной или длительной диарее, для исключения кишечной инфекции или диагностики избыточного роста грибов, в первую очередь кандиды. Поэтому врачи довольно часто используют назначение пробиотиков при определённых клинических состояниях, у маленьких деток это младенческие кишечные колики, понос, запор, срыгивания, пищевая аллергия, лактазная недостаточность.
Что такое пробиотики?
Пробиотики — это живые, специально отобранные микроорганизмы, которые выделены из организма здоровых людей, при применении которых получают полезный эффект для здоровья хозяина и для которых существуют научные доказательства безопасности и эффективности. Сейчас на фармацевтическом рынке огромное количество предложений различных живых бактерий и их комбинаций. Но далеко не все штаммы бактерий подтвердили свою эффективность, полезность и безопасность. Реально использовать можно только бактерии, которые были выделены из организма здорового человека, они не должны иметь побочных эффектов, переносить возможную антибиотикорезистентность на другую микрофлору кишечника, обязательно должны иметь свой генетический паспорт, стабильные характеристики и главное, что их эффективность и безопасность была доказана в клинических исследованиях самого высокого уровня. Штампы, которые применяются у детей должны иметь статус GRAS (Generally Recognized As Safe) которое присваивает Управление по контролю качества пищевых продуктов и лекарственных средств США или QPS (Qualified Presumption (priˈzəmpSHən) of Safety) Европейского агентства по безопасности продуктов питания ЕС. Это крайне важно!
Давайте рассмотрим некоторые штампы пробиотиков, которые широко используются в педиатрии раннего возраста.
Пробиотики, которые были в значительной степени изучены на людях, включают виды Lactobacillus и Род Bifidobacterium.
Бифидобактерии и лактобактерии – это крайне важные штаммы бактерий детей первого года жизни. В Украине такой состав представлен в капельках Према Дуо, который очень удобный для приема маленьким деткам. Этот Итальянский производитель известен тем, что выпускает качественные медицинские продукты по самым современным технологиям. Например этот прробиотик приготовлен по технологии микроэнкапсуляции, они как бы спрятаны в микрокапсулках, что гарантирует, то кишечник получит 100% живых бактерий, которые сразу начнут там работать на благо малыша. Если бактериии лиофилизируются, т.е. высушиваются, то для того чтобы они ожили во первых нужно время, во вторых часть из них имеет шанс погибнуть. У детей играет значение даже форма выпуска. Для раннего возраста это должны бы ть капли или саше, т е. порошок, который нужно растворить в какой-то жидкости. Если пробиотик в капсуле, то логично предположить, что он предназначен для более старшего возраста, когда ребенок сможет ее проглотить. Вы представляете, грудное молоко не стерильно, и оно содержит бактерии.
Зачем нужны в материнском молоке бактерии?
Бифидобактерии — создают барьер, чтобы патогенные микробы и их токсины не проникали через стенку кишечника; они угнетают патогенную и условно патогенную флору за счет выработки органических жирных кислот; активно участвуют в пищеварении; синтезируют аминокислоты, белки и витамины; способствуют усилению процессов всасывания кальция, железа и витамина Д, способны расщеплять молочный сахар грудного молока, имеет решающее значение для сбалансированного развития иммунной системы.
Лактобактерии — превращают лактозу, а это основной углевод женского и любого другого молока, в молочную кислоту, что препятствует росту многих патогенных бактерий и грибков; стимулируют нормальное развитие иммунитета; обладают противоопухолевой защитой; подавляют синтез иммуноглобулина Е, избыток которого сопровождается аллергическими реакциями, участвуют в пищеварении и важны для роста и размножения бифидобактерий.
Bifidobacterium breve
Среди бифидобактерий штаммы вида Bifidobacterium breve широко используются в педиатрии, учитывая их способность достигать и колонизировать желудочно-кишечный тракт и их документированную историю безопасности. Bifidobacterium breve является доминирующим видом в кишечнике детей при грудном вскармливании, и она была выделена как из грудного молока, так и из фекалий здоровых детей. Штамм обладает значительной антимикробной активностью в отношении патогенов, не обладает трансмиссивными признаками устойчивости к антибиотикам, не цито токсичен и имеет иммуностимулирующие свойства.
Посмотрите на иллюстацию, которая приведена в, пожалуй, самом полном обзоре, в толстенной книге Probiotics and Prebiotics in Pediatrics которая издана в 2019 году.
Видите, в ней перечислены детские заболевания, при которых наблюдались симптомы улучшения после введения штаммов Bifidobacterium breve. Это:
- Младенческие колики
- Целиакия
- Ожирение
- Химиотерапия
- Хирургические вмешательства
- Запоры
- Аллергия
- Недоношенные дети
- Наркотизирующий энтероколит
Как видите спектр применения достаточно большой. Геном Bifidobacterium brevе полностью расшифрован, то есть штамм имеет свой генетический паспорт, имеет статус GRAS в США и QPS в Европейском союзе, что делает ее безопасной и рекомендованной для применения в педиатрической практике. Эффективность ее применения подтверждена во многочисленных клинических исследованиях. При этом ее использовали как в виде одного штамма, так и в сочетании с другими штаммами, отмечая при этом синергетический эффект, то есть повышение эффективности каждого отдельного штамма.
Lactobacillus rhamnosus GG
Другим штампом пробиотических бактерий, которые широко используются в педиатрии является Lactobacillus rhamnosus GG или как ее часто называют сокращенно – LGG. Эту бактерию часто называют золотым стандартом пробиотиков. Lactobacillus rhamnosus LGG® — является лучшим в мире документированным пробиотическим штаммом. Он использовался в пищевых продуктах и диетических добавках с 1990 года, был изучен в более чем 3001 клинических исследованиях, документирующих как его эффективность, так и безопасность. Безопасность LGG продемонстрирована американским статусом GRAS и европейским дипломом QPS. Естественно, что ее геном также полностью расшифрован и остается стабильным более 30 лет. Этот штамм показал свою эффективность при аллергических состояниях у детей, в том числе пищевой аллергии на белок коровьего молока, экземы, диареи, младенческих коликах, запорах. Я думаю, что это один из наиболее изученных пробиотических штаммов в медицине.
Всем ли можно назначать пробиотики?
Пробиотики противопоказаны:
- Детям с сепсисом,
- Тяжелыми иммунодефицитами
- Центральным венозными катетерами
- Некоторыми онкологическими заболеваниями
Однако при выборе конкретного пробиотика для применения у ребенка врачу необходимо учитывать наличие доказательной базы в отношении его эффективности и безопасности. Результаты многочисленных исследований убедительно свидетельствуют, что пробиотики Lactobacillus rhamnosus GG и Bifidobacterium breve BR03 оказывают положительное влияние на развитие и течение многих патологических процессов в детском возрасте и их применение является весьма перспективным для профилактики развития нарушений микробиоценоза кишечника и их коррекции. На сегодняшний день пробиотики очень широко используются в педиатрической практике.
Лечение дисбактериоза у грудничковЕсли у вашего ребенка раннего возраста имеются функциональные нарушения пищеварительной системы в виде колик, поносов или запоров, срыгиваний, симптомы пищевой аллергии и ваш педиатр подозревает у ребенка сопутствующее нарушение микробиоценоза, может быть назначен, после обязательной консультации с вашим педиатром, современный проверенный европейский пробиотический препарат, например Према Дуо, содержащие микроэнкапсулированные жизнеспособные бактерии Lactobacillus rhamnosus GG и Bifidobacterium breve BR03. В данном случае это будет обоснованный выбор.
Пусть Ваши дети будут здоровы и успешны!
Видео: Дисбактериоз кишечника у грудничка
Дисбактериоз у детей, симптомы и лечение
Каждая вторая мама знакома с таким недугом, как дисбактериоз кишечника у детей. Особенно активно он прогрессирует при ослаблении иммунной системы малыша.
Дисбактериоз представляет собой сбой в работе кишечника из-за нарушения баланса полезных и «вредных» бактерий в желудочно-кишечном тракте. Устранение дисбактериоза кишечника у детей значительно повышает качество жизни как малыша, так и мамы.
Дисбактериоз – нарушение соотношения нормальной микрофлоры кишечника. Состояние редко имеет идиопатический характер, не является самостоятельным заболеванием. Развивается в любом возрасте, более уязвимы грудные дети. Чтобы противостоять дисбактериозу, стоит ознакомиться с провоцирующими его факторами и знать, что делать при дисбактериозе кишечника у ребенка
Причины дисбактериоза и кишечный иммунитет
Перед рождением ребенок находится в стерильных условиях, его кишечник также стерилен. После первого сосания груди и приема молозива поступают питательные вещества, иммунные комплексы, гормоны, полезные бактерии. В течение последующих 5–7 дней бактериальные клетки колонизируются, подавляется рост патогенных микроорганизмов. У ослабленных и недоношенных малышей дисбаланс кишечной микрофлоры может развиваться самостоятельно, без фонового заболевания
Причины дисбактериоза у детей до года:
- неправильное питание кормящей женщины,
- резкая отмена грудного вскармливания,
- снижение иммунного ответа,
- кормление искусственными смесями,
- заражение золотистым стафилококком,
- прием антибактериальных средств.
Этиология дисбактериоза у детей после 1 года связана с глистной инвазией, частыми простудными болезнями, ослаблением моторики и ферментативной недостаточностью кишечника, подверженностью стрессовому воздействию. Все перечисленные состояния ведут к снижению иммунной реакции.
Местный иммунитет в кишечнике играет колоссальную роль в борьбе с патогенной микрофлорой, вирусными и бактериальными агентами. Клеточные макрофаги расщепляют и поглощают поступившие антигены.
Последствия ослабления иммунитета и возникновения дисбактериоза
Первым признаком дисбактериоза кишечника у детей является нарушение отхождения кашицеобразного стула. Он становится жидким, с резким кислым запахом, цвет от бледно-желтого до болотно-зеленого или отмечаются стойкие запоры с болезненным актом дефекации.
Другие последствия:
- урчание в животике;
- повышенное газообразование;
- появление колик у малыша, сопровождающееся болями;
- аллергические высыпания на фоне интоксикации;
- отставание в физическом развитии – недостаток витаминов группы В, витаминов Е, Д.
При выявлении подобных признаков рекомендовано обращение в клинику к педиатру. Только специалист сможет объективно оценить состояние здоровья малыша.
Первый сигнал о дисбактериозе – появление сыпи разной локализации на теле, которая чешется и для которой характерен полиморфизм высыпания. Так проявляются аллергические реакции на коже.
Что делать при дисбактериозе у малышей?
Коррекция дисбактериоза кишечника у детей направлена на устранение причины и симптомов нарушения. Женщинам, желающим узнать, как помочь малышу при коликах и газах, желательно ознакомиться с советами доктора. Зачастую специалист назначает:
- бактериофаги;
- пероральные сорбенты;
- ферментативные средства;
- ветрогонные препараты;
- назначают пробиотики для малышей, чтобы заселить микрофлору, или пребиотики для стимуляции роста собственных колоний;
- иногда антибиотик;
- прием интерферонов.
Для коррекции дисбиоза также показаны прогулки на свежем воздухе, дополнение рациона питания пробиотическими продуктами и нормализация режима сна и отдыха детей
Как поддержать естественную микрофлору
Поддерживать естественную микрофлору кишечника могут помочь капли для приема внутрь – Аципол® Малыш, капли. Они относятся к биологически активным добавкам, в состав которых входит необходимое количество колониеобразующих организмов – лактобактерии, бифидобактерии.
Способ дозирования средства очень прост – есть насадка-дозатор. Разводить вещество не нужно, оно выпускается в суспензии. Согласно инструкции по применению, Аципол® Малыш, капли дают ребенку 1 раз в день по 5 капель, допускается добавление в смесь, воду.
Действие компонентов Аципол® Малыш, капли
Действие Аципол® Малыш, капли сходно с аналогичными средствами, относящимися к группе пробиотиков. Лактобактерии и бифидобактерии заселяют желудочно-кишечный тракт и оказывают благотворное влияние на организм.
Образующиеся колонии полезных бактерий вытесняет патогенную микрофлору. Результатом использования такого средства служит нормализация стула малыша, уменьшение болей в животике, снижение интоксикации.
Стоит отметить, что применение только Аципол® Малыш, капли при дисбактериозе кишечника у детей нецелесообразно, обязательна комплексная терапия с применением лекарственных препаратов, которые вам назначит специалист вместе с Аципол® Малыш, капли
При выявлении первых признаков дисбактериоза у ребенка следует обратиться за медицинской помощью к профилирующему специалисту. Причин развития патологического состояния много, только специалист может определить этиологию недуга и назначить адекватное лечение с учетом возраста ребенка и степени тяжести патологии.
Дисбактериоз кишечника новорожденных | Журнал перинатологии
Домингес-Белло М.Г., Годой-Виторино Ф., Найт Р., Блазер М.Дж. Роль микробиома в развитии человека. Кишечник. 2019; 68: 1108–14.
CAS PubMed PubMed Central Google Scholar
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352: 539–44.
CAS PubMed PubMed Central Google Scholar
Ayres JS. Совместное поведение микробной толерантности в мутуализме микробиоты хозяина. Клетка. 2016; 165: 1323–31.
CAS PubMed PubMed Central Google Scholar
Санчес К.К., Чен Г.Й., Шибер АМП, Редфорд С.Е., Шохирев М.Н., Леблан М. и др. Совместная метаболическая адаптация хозяина может способствовать бессимптомной инфекции и способствовать снижению вирулентности кишечного патогена. Клетка. 2018; 175: 146–58.e15.
CAS PubMed PubMed Central Google Scholar
Сорбара МТ, Памер Э.Г. Межбактериальные механизмы устойчивости к колонизации и стратегии, используемые патогенами для их преодоления. Mucosal Immunol. 2019; 12: 1–9.
CAS PubMed PubMed Central Google Scholar
Ко А., Бэкхед Ф. От ассоциации к причинно-следственной связи: роль кишечной микробиоты и ее функциональных продуктов в метаболизме хозяина. Mol Cell. 2020; 78: 584–96.
CAS PubMed PubMed Central Google Scholar
Геверс Д., Кугатасан С., Денсон Л.А., Васкес-Баеза И., Ван Треурен В., Рен Б. и др. Микробиом, ранее не получавший лечения, при впервые возникшей болезни Крона. Клетка. Хост-микроб. 2014; 15: 382–92.
CAS PubMed PubMed Central Google Scholar
Клингберг Э., Магнуссон М.К., Стрид Х., Демингер А., Шталь А., Сундин Дж. И др. Различный состав микробиоты кишечника у пациентов с анкилозирующим спондилитом связан с повышенным уровнем калпротектина в кале.Arthritis Res Ther. 2019; 21: 248.
CAS PubMed PubMed Central Google Scholar
Фалони Дж., Джоосенс М., Виейра-Силва С., Ван Дж., Дарзи Й., Фауст К. и др. Популяционный анализ изменчивости микробиома кишечника. Наука. 2016; 352: 560–4.
CAS PubMed PubMed Central Google Scholar
Яцуненко Т.Р., Манари М.Дж., Трехан И., Домингес-Белло М.Г., Контрерас М., Магрис М. и др.Микробиом кишечника человека в зависимости от возраста и географии. Природа 2012; 486: 222–7.
CAS PubMed PubMed Central Google Scholar
Биттингер К., Чжао С., Ли И, Форд Э., Фридман Э.С., Ни Дж. И др. Бактериальная колонизация перепрограммирует метаболом кишечника новорожденных. Nat Microbiol. 2020; 5: 838–47.
CAS PubMed PubMed Central Google Scholar
Vangay P, Ward T, Gerber JS, Knights D. Антибиотики, детский дисбактериоз и болезни. Клетка. Хост-микроб. 2015; 17: 553–64.
CAS PubMed PubMed Central Google Scholar
Deshmukh HS, Liu Y, Menkiti OR, Mei J, Dai N, O’Leary CE, et al. Микробиота регулирует гомеостаз нейтрофилов и устойчивость хозяина к сепсису Escherichia coli K1 у новорожденных мышей. Nat Med. 2014; 20: 524–30.
CAS PubMed PubMed Central Google Scholar
Грачи MG, Гарретт WS. Кишечник. микробиота, метаболиты и иммунитет хозяина. Nat Rev Immunol. 2016; 16: 341–52.
CAS PubMed PubMed Central Google Scholar
Ольшак Т., Ан Д., Цейссиг С., Вера М.П., Рихтер Дж., Франке А. и др. Воздействие микробов в молодом возрасте оказывает стойкое влияние на функцию естественных Т-клеток-киллеров. Наука. 2012; 336: 489–93.
CAS PubMed PubMed Central Google Scholar
Cox LM, Yamanishi S, Sohn J, Alekseyenko AV, Leung JM, Cho I, et al. Изменение кишечной микробиоты во время критического периода развития имеет долгосрочные метаболические последствия. Клетка. 2014; 158: 705–21.
CAS PubMed PubMed Central Google Scholar
Кимура И., Миямото Дж., Оуэ-Китано Р., Ватанабе К., Ямада Т., Онуки М. и др. Микробиота кишечника матери во время беременности влияет на метаболический фенотип потомства у мышей.Наука. 2020; 367: eaaw8429.
CAS PubMed PubMed Central Google Scholar
Гордон Х.А., Пести Л. Животные-гнотобиоты как инструмент в изучении микробных взаимоотношений хозяина. Бактериол. Ред. 1971; 35: 390–429.
CAS PubMed PubMed Central Google Scholar
Лучински П., Маквей Нойфельд К.А., Ориач К.С., Кларк Дж., Динан Т.Г., Крайан Дж. Ф.Выращивание в пузыре: использование стерильных животных для оценки влияния микробиоты кишечника на мозг и поведение. Int J Neuropsychopharmacol. 2016; 19: pyw020.
PubMed PubMed Central Google Scholar
Уилкс М. Бактерии и раннее развитие человека. Early Hum Dev. 2007; 83: 165–70.
PubMed PubMed Central Google Scholar
Гериг Дж. Л., Венкатеш С., Чанг Х. В., Хибберд М. С., Кунг В. Л., Ченг Дж. И др.Влияние продуктов, направленных на микробиоту, на животных-гнотобиотов и детей с недостаточным питанием. Наука. 2019; 365: eaau4732.
PubMed PubMed Central Google Scholar
Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–31.
PubMed PubMed Central Google Scholar
Safari Z, Джерард П. Связь между микробиомом кишечника и неалкогольной жировой болезнью печени (НАЖБП). Клетка. Mol Life Sci. 2019; 76: 1541–58.
CAS PubMed PubMed Central Google Scholar
Цзян Ц., Ли Дж., Хуанг П., Лю З., Чжао Б. Микробиота кишечника и болезнь Альцгеймера. J. Alzheimers Dis. 2017; 58: 1–15.
PubMed PubMed Central Google Scholar
Lee YP, Chiu CC, Lin TJ, Hung SW, Huang WC, Chiu CF, et al. Моноколонизация мышей без микробов с помощью Bacteroides fragilis улучшает индуцированный азоксиметаном / декстрансульфатом натрия колоректальный рак, вызванный колитом. Immunopharmacol Immunotoxicol. 2019; 41: 207–13.
CAS PubMed PubMed Central Google Scholar
Tissier H. Recherches sur la flore кишечника дез nourrissons. C R Mem Soc Biol. 1899; 51: 943.
Google Scholar
Logan WR. Кишечная флора младенцев и детей раннего возраста. J Pathol. 1913; 18: 527–51.
Google Scholar
Гарридо Д., Бариле Д., Миллс Д.А. Молекулярная основа обогащения бифидобактерий в желудочно-кишечном тракте младенцев. Adv Nutr. 2012; 3: 415С – 21С.
CAS PubMed PubMed Central Google Scholar
Ruiz-Moyano S, Totten SM, Garrido DA, Smilowitz JT, German JB, Lebrilla CB, et al.Различия в потреблении олигосахаридов грудного молока младенческими кишечными штаммами Bifidobacterium breve. Appl Environ Microbiol. 2013; 79: 6040–9.
CAS PubMed PubMed Central Google Scholar
Живкович AM, German JB, Lebrilla CB, Mills DA. Гликобиом грудного молока и его влияние на микробиоту желудочно-кишечного тракта младенцев. Proc Natl Acad Sci USA. 2011; 108 (Приложение 1): 4653–8.
CAS Google Scholar
Хенрик Б.М., Хаттон А.А., Палумбо М.С., Касабури Дж., Митчелл Р.Д., Андервуд М.А. и др. Повышенный pH кала указывает на глубокое изменение микробиома кишечника грудного ребенка из-за сокращения бифидобактерий за последнее столетие. мСфера. 2018; 3: e00041–18.
PubMed PubMed Central Google Scholar
Litvak Y, Byndloss MX, Tsolis RM, Baumler AJ. Распространение дисбиотических протеобактерий: микробный признак дисфункции эпителия.Curr Opin Microbiol. 2017; 39: 1–6.
CAS Google Scholar
Милани С., Дуранти С., Боттачини Ф., Кейси Е., Туррони Ф., Махони Дж. И др. Первые микробные колонизаторы кишечника человека: состав, деятельность и последствия для здоровья микробиоты кишечника младенца. Microbiol Mol Biol Rev.2017; 81: e00036-17.
PubMed PubMed Central Google Scholar
La Rosa PS, Warner BB, Zhou Y, Weinstock GM, Sodergren E, Hall-Moore CM и др. Структурированное развитие бактериальных популяций в кишечнике недоношенных детей. Proc Natl Acad Sci USA. 2014; 111: 12522–7.
Google Scholar
Korpela K, Blakstad EW, Moltu SJ, Strommen K, Nakstad B, Ronnestad AE, et al. Развитие кишечной микробиоты и гестационный возраст у недоношенных новорожденных. Научный отчет 2018; 8: 2453.
PubMed PubMed Central Google Scholar
Ватанен Т., Плихта Д.Р., Сомани Дж., Мунк П.С., Артур Т.Д., Холл А.Б. и др. Геномная изменчивость и штамм-специфическая функциональная адаптация микробиома кишечника человека в раннем возрасте. Nat Microbiol. 2019; 4: 470–9.
CAS Google Scholar
Raman AS, Gehrig JL, Venkatesh S, Chang HW, Hibberd MC, Subramanian S, et al. Единица разреженного коваринга, которая описывает развитие здоровой и нарушенной микробиоты кишечника человека. Наука. 2019; 365: eaau4735.
PubMed PubMed Central Google Scholar
Younge NE, Newgard CB, Cotten CM, Goldberg RN, Muehlbauer MJ, Bain JR, et al. Нарушение созревания микробиоты и метаболома у крайне недоношенных детей с послеродовой задержкой роста. Научный доклад 2019; 9: 8167.
PubMed PubMed Central Google Scholar
Лю Дж, Ли Й, Фэн Й, Пан Л, Се З, Ян З и др.Структурное прогрессирование микробиоты кишечника, связанное с некротическим энтероколитом и поздним сепсисом у недоношенных детей: проспективное исследование в отделении интенсивной терапии новорожденных в Китае. PeerJ. 2019; 7: e7310.
PubMed PubMed Central Google Scholar
Галаццо Дж., Ван Бест Н., Бервоетс Л., Дапаа И.О., Савелкул PH, Хорнеф М.В. и др. Развитие микробиоты и ассоциации с режимом рождения, диетой и атопическими расстройствами в продольном анализе образцов стула, собранных с младенчества до раннего детства.Гастроэнтерология. 2020; 158: 1584–96.
CAS Google Scholar
Madan JC, Hoen AG, Lundgren SN, Farzan SF, Cottingham KL, Morrison HG, et al. Связь кесарева сечения и добавления смеси с кишечным микробиомом 6-недельных младенцев. JAMA Pediatr. 2016; 170: 212–9.
PubMed PubMed Central Google Scholar
Стюарт С.Дж., Аджами, штат Нью-Джерси, О’Брайен Д.Л., Хатчинсон Д.С., Смит Д.П., Вонг М.С. и др.Временное развитие микробиома кишечника в раннем детстве по данным исследования TEDDY. Природа. 2018; 562: 583–8.
CAS PubMed PubMed Central Google Scholar
Combellick JL, Shin H, Shin D, Cai Y, Hagan H, Lacher C, et al. Различия в фекальной микробиоте новорожденных, рожденных дома или в больнице. Научный доклад 2018; 8: 15660.
PubMed PubMed Central Google Scholar
Savage JH, Lee-Sarwar KA, Sordillo JE, Lange NE, Zhou Y, O’Connor GT и др. Диета во время беременности и младенчества и микробиом кишечника младенца. J Pediatr. 2018; 203: 47–54.e4.
PubMed PubMed Central Google Scholar
Лундгрен С.Н., Мадан Дж. К., Эмонд Дж. А., Моррисон Х. Г., Кристенсен BC, Карагас М. Р. и др. Диета матери во время беременности связана с микробиомом детского стула в зависимости от способа родов.Микробиом. 2018; 6: 109.
PubMed PubMed Central Google Scholar
Williams JE, Carrothers JM, Lackey KA, Beatty NF, Brooker SL, Peterson HK, et al. Между молочным, оральным и фекальным микробиомами в диадах мать-младенец существуют сильные многомерные отношения в течение первых шести месяцев после родов. J Nutr. 2019; 149: 902–14.
PubMed PubMed Central Google Scholar
Азад М.Б., Конья Т., Персо Р.Р., Гутман Д.С., Чари Р.С., Филд С.Дж. и др. Влияние антибиотиков во время родов, методов родов и грудного вскармливания на микробиоту кишечника в течение первого года жизни: проспективное когортное исследование. Int J Obstet Gynaecol. 2016; 123: 983–93.
CAS Google Scholar
Coker MO, Hoen AG, Dade E, Lundgren S, Li Z, Wong AD, et al. Конкретный класс антибиотиков во время родов связан с созреванием микробиоты кишечника младенца: проспективное когортное исследование.Int J Obstet Gynaecol. 2020; 127: 217–27.
CAS Google Scholar
Eck A, Rutten N, Singendonk MMJ, Rijkers GT, Savelkoul PHM, Meijssen CB, et al. Развитие микробиоты новорожденных и действие антибиотиков в раннем возрасте определяется двумя разными типами поселенцев. PloS ONE. 2020; 15: e0228133.
CAS PubMed PubMed Central Google Scholar
Гупта Р.В., Тран Л., Норори Дж., Феррис М.Дж., Эрен А.М., Тейлор С.М. и др. Блокаторы рецепторов гистамина-2 изменяют фекальную микробиоту у недоношенных детей. J Педиатр Гастроэнтерол Нутр. 2013; 56: 397–400.
CAS Google Scholar
Леви Э.И., Хоанг Д.М., Ванденплас Й. Влияние ингибиторов протонной помпы на микробиом у маленьких детей. Acta Paediatr. 2020; 109: 1531–8.
CAS Google Scholar
Vich Vila A, Collij V, Sanna S, Sinha T, Imhann F, Bourgonje AR, et al. Влияние часто используемых лекарств на состав и метаболическую функцию микробиоты кишечника. Nat Commun. 2020; 11: 362.
CAS PubMed PubMed Central Google Scholar
Джексон М.А., Верди С., Максан М.Э., Шин С.М., Зирер Дж., Бойер Р.Ц.и др. Связь кишечной микробиоты с распространенными заболеваниями и лекарствами, отпускаемыми по рецепту, в популяционной когорте.Nat Commun. 2018; 9: 2655.
PubMed PubMed Central Google Scholar
Iszatt N, Janssen S, Lenters V, Dahl C, Stigum H, Knight R, et al. Экологические токсиканты в грудном молоке норвежских матерей, а также состав и метаболиты кишечных бактерий у их младенцев в возрасте 1 месяца. Микробиом 2019; 7: 34.
PubMed PubMed Central Google Scholar
Лауэ Х.Э., Мороиши Ю., Джексон Б.П., Палис Т.Дж., Мадан Дж.К., Карагас МР.Смеси питательных и токсичных элементов и микробиом кишечника в раннем постнатальном периоде в когорте продольных рождений в США. Environ Int. 2020; 138: 105613.
CAS Google Scholar
Маклин К., Джун С., Козырский А. Влияние курения матери на микробиоту кишечника младенца и его связь с избыточным весом ребенка: обзорный обзор. Мир J Pediatr. 2019; 15: 341–9.
Google Scholar
Tun HM, Konya T, Takaro TK, Brook JR, Chari R, Field CJ и др. Контакт с домашними пушистыми домашними животными влияет на микробиоту кишечника младенца в возрасте 3-4 месяцев после различных сценариев рождения. Микробиом. 2017; 5: 40.
PubMed PubMed Central Google Scholar
D’Agata AL, Wu J, Welandawe MKV, Dutra SVO, Kane B, Groer MW. Влияние стресса ОИТН в раннем возрасте на развивающийся микробиом кишечника. Dev Psychobiol. 2019; 61: 650–60.
PubMed PubMed Central Google Scholar
Ho TTB, Groer MW, Kane B., Yee AL, Torres BA, Gilbert JA, et al. Дихотомическое развитие микробиома кишечника у недоношенных детей. Микробиом. 2018; 6: 157.
PubMed PubMed Central Google Scholar
Parra-Llorca A, Gormaz M, Alcantara C, Cernada M, Nunez-Ramiro A, Vento M и др. Микробиом кишечника недоношенных в зависимости от типа кормления: значение донорского грудного молока.Front Microbiol. 2018; 9: 1376.
PubMed PubMed Central Google Scholar
Taft DH, Salinero LK, Vongbhavit K, Kalanetra KM, Masarweh C, Yu A, et al. Бактериальная колонизация и гены устойчивости к противомикробным препаратам в трубках для энтерального питания новорожденных. FEMS Microbiol Ecol. 2019; 95: физ039.
CAS PubMed PubMed Central Google Scholar
Ногачка А., Салазар Н., Суарес М., Милани С., Арболея С., Солис Г. и др.Влияние антимикробной профилактики во время родов на микробиоту кишечника и распространенность генов устойчивости к антибиотикам у доношенных новорожденных, родившихся через естественные родовые пути. Микробиом. 2017; 5: 93.
PubMed PubMed Central Google Scholar
Гаспаррини А.Дж., Крофтс Т.С., Гибсон М.К., Тарр П.И., Уорнер Б.Б., Дантас Г. Нарушение антибиотиками микробиома кишечника недоношенных детей и резистома. Кишечные микробы. 2016; 7: 443–9.
CAS PubMed PubMed Central Google Scholar
Гибсон М.К., Ван Б., Ахмади С., Бернхэм Калифорния, Тарр П.И., Уорнер Б.Б. и др. Динамика развития микробиоты кишечника недоношенных детей и резистома к антибиотикам. Nat Microbiol. 2016; 1: 16024.
CAS PubMed PubMed Central Google Scholar
Rutayisire E, Huang K, Liu Y, Tao F. Способ родов влияет на разнообразие и характер колонизации кишечной микробиоты в течение первого года жизни младенцев: систематический обзор.BMC Gastroenterol. 2016; 16:86.
PubMed PubMed Central Google Scholar
Dahl C, Stigum H, Valeur J, Iszatt N, Lenters V, Peddada S, et al. У недоношенных новорожденных есть различные микробиомы, которые не объясняются способом родов, продолжительностью грудного вскармливания или воздействием антибиотиков. Int J Epidemiol. 2018; 47: 1658–69.
PubMed PubMed Central Google Scholar
Tun MH, Tun HM, Mahoney JJ, Konya TB, Guttman DS, Becker AB. и другие. Послеродовое воздействие бытовых дезинфицирующих средств, микробиоты кишечника младенцев и последующий риск избыточного веса у детей. Can Med Assoc J. 2018; 190: E1097 – e107.
Google Scholar
Шоу К.А., Берта М., Хофмеклер Т., Чопра П., Ватанен Т., Шриватса А. и др. Дисбактериоз, воспаление и реакция на лечение: продольное исследование педиатрических субъектов с недавно диагностированным воспалительным заболеванием кишечника.Genome Med. 2016; 8: 75.
PubMed PubMed Central Google Scholar
Xia GH, You C, Gao XX, Zeng XL, Zhu JJ, Xu KY, et al. Индекс дисбактериоза инсульта (SDI) в микробиоме кишечника связан с травмой головного мозга и прогнозом инсульта. Фронт Neurol. 2019; 10: 397.
PubMed PubMed Central Google Scholar
Го Й, Чжан И, Герхард М., Гао Дж. Дж., Мехиас-Луке Р., Чжан Л. и др.Влияние Helicobacter pylori на микробиоту желудочно-кишечного тракта: популяционное исследование в Linqu, зоне высокого риска рака желудка. Кишечник. 2019. https://doi.org/10.1136/gutjnl-2019-319696.
Casen C, Vebo HC, Sekelja M, Hegge FT, Karlsson MK, Ciemniejewska E, et al. Отклонения в микробиоте кишечника человека: новый диагностический тест для определения дисбактериоза у пациентов с СРК или ВЗК. Пищевая Pharmacol Therap. 2015; 42: 71–83.
CAS Google Scholar
Мандл Т., Марсал Дж., Олссон П., Олссон Б., Андреассон К. Тяжелый кишечный дисбактериоз распространен при первичном синдроме Шегрена и связан с системной активностью заболевания. Arthritis Res Ther. 2017; 19: 237.
PubMed PubMed Central Google Scholar
Ватанен Т., Костич А.Д., д’Хеннезель Э., Сильяндер Х., Франзоса Э.А., Яссур М. и др. Вариабельность иммуногенности LPS микробиома способствует развитию аутоиммунитета у людей.Клетка. 2016; 165: 842–53.
CAS PubMed PubMed Central Google Scholar
Ватанен Т., Франзоза Э.А., Швагер Р., Трипати С., Артур Т.Д., Вехик К. и др. Микробиом кишечника человека при диабете типа 1 с ранним началом из исследования TEDDY. Природа. 2018; 562: 589–94.
CAS PubMed PubMed Central Google Scholar
Chua HH, Chou HC, Tung YL, Chiang BL, Liao CC, Liu HH, et al.Дисбактериоз кишечника с обилием ruminococcus gnavus ассоциируется с аллергическими заболеваниями у младенцев. Гастроэнтерология. 2018; 154: 154–67.
PubMed PubMed Central Google Scholar
Lee MJ, Kang MJ, Lee SY, Lee E, Kim K, Won S, et al. Нарушения генов микробиома кишечника у младенцев с атопическим дерматитом в зависимости от типа вскармливания. J Allergy Clin Immunol. 2018; 141: 1310–9.
CAS PubMed PubMed Central Google Scholar
Ламонт Р.Ф., Моллер Люф Б., Стенер Йоргенсен Дж. Воспалительные заболевания и нарушение обмена веществ у детей после воздействия антибиотиков во время беременности, антенатально, во время родов и новорожденных. F1000Res. 2020; 9: 144.
Google Scholar
Доухауэр Карпа К., Пол И.М., Леки Дж. А., Шунг С., Каркачи-Салли Н., Врана К. Е. и др. Обзор ретроспективной карты для выявления перинатальных факторов, связанных с пищевой аллергией. Нутр Дж. 2012; 11: 87.
PubMed PubMed Central Google Scholar
Metz TD, McKinney J, Allshouse AA, Knierim SD, Carey JC, Heyborne KD. Воздействие стрептококковой антибиотикопрофилактики группы B и индекс массы тела в раннем детстве в когорте вагинальных родов. J Matern Fetal Neonatal Med. 2020; 33: 3318–3323.
PubMed PubMed Central Google Scholar
Wohl DL, Curry WJ, Mauger D, Miller J, Tyrie K. Антибиотики во время родов и детский атопический дерматит. J Am Board Fam Med. 2015; 28: 82–9.
PubMed PubMed Central Google Scholar
Памми М., Коуп Дж., Тарр П.И., Уорнер Б.Б., Морроу А.Л., Май В. и др. Дисбактериоз кишечника у недоношенных детей, предшествующий некротическому энтероколиту: систематический обзор и метаанализ. Микробиом. 2017; 5:31.
PubMed PubMed Central Google Scholar
Olm MR, Bhattacharya N, Crits-Christoph A, Firek BA, Baker R, Song YS, et al.Некротическому энтероколиту предшествует усиленная репликация кишечных бактерий, клебсиелл и бактерий, кодирующих фимбрии. Sci Adv. 2019; 5: eaax5727.
CAS PubMed PubMed Central Google Scholar
Esmaeilizand R, Shah PS, Seshia M, Yee W., Yoon EW, Dow K. Воздействие антибиотиков и развитие некротического энтероколита у очень недоношенных новорожденных. Педиатр детского здоровья. 2018; 23: e56 – e61.
PubMed PubMed Central Google Scholar
Esaiassen E, Fjalstad JW, Juvet LK, van den Anker JN, Klingenberg C. Воздействие антибиотиков у новорожденных и ранние неблагоприятные исходы: систематический обзор и метаанализ. J Antimicrob. Chemother. 2017; 72: 1858–70.
CAS PubMed PubMed Central Google Scholar
Guillet R, Stoll BJ, Cotten CM, Gantz M, McDonald S, Poole WK, et al. Связь терапии блокаторами h3 и более высокой частоты некротического энтероколита у младенцев с очень низкой массой тела при рождении.Педиатрия. 2006; 117: e137–42.
PubMed Google Scholar
Hewitt KM, Mannino FL, Gonzalez A, Chase JH, Caporaso JG, Knight R, et al. Бактериальное разнообразие в двух отделениях интенсивной терапии новорожденных (ОИТН). PloS ONE. 2013; 8: e54703.
CAS PubMed PubMed Central Google Scholar
Бокулич Н.А., Миллс Д.А., Андервуд М.А. Поверхностные микробы в отделении интенсивной терапии новорожденных: изменения в процессе регулярной очистки и со временем.J Clin Microbiol. 2013; 51: 2617–24.
PubMed PubMed Central Google Scholar
Брукс Б., Олм М.Р., Файрек Б.А., Бейкер Р., Геллер-МакГрат Д., Реймер С.Р. и др. Развитие кишечного микробиома недоношенных детей является основным фактором, формирующим микробиом отделений интенсивной терапии новорожденных. Микробиом. 2018; 6: 112.
PubMed PubMed Central Google Scholar
Стюарт С.Дж., Эмблтон Н.Д., Маррс Э.Л., Смит Д.П., Фофанова Т., Нельсон А. и др. Продольное развитие кишечного микробиома и метаболома у недоношенных новорожденных с поздним началом сепсиса и у здоровых людей. Микробиом. 2017; 5: 75.
PubMed PubMed Central Google Scholar
Сингер JR, Blosser EG, Zindl CL, Silberger DJ, Conlan S, Laufer VA и др. Предотвращение дисбактериоза кишечного микробиома новорожденных мышей защищает от позднего сепсиса.Nat Med. 2019; 25: 1772–82.
CAS PubMed PubMed Central Google Scholar
Masi AC, Stewart CJ. Роль кишечного микробиома недоношенных при сепсисе и некротизирующем энтероколите. Early Hum Dev. 2019; 138: 104854.
PubMed PubMed Central Google Scholar
Хемми М.Х., Вольке Д., Шнайдер С. Связь между проблемами с плачем, сном и / или кормлением в младенчестве и долгосрочными поведенческими результатами в детстве: метаанализ.Arch Dis Child. 2011; 96: 622–9.
PubMed PubMed Central Google Scholar
Loughman A, Quinn T, Nation ML, Reichelt A, Moore RJ, Van TTH, et al. Детская микробиота при коликах: предиктивные ассоциации с проблемным плачем и последующим поведением ребенка. J Dev Orig Health Dis. 2020: 1–11. https://doi.org/10.1017/S2040174420000227.
Huttenhower C, Kostic AD, Xavier RJ. Воспалительное заболевание кишечника как модель трансляции микробиома.Иммунитет. 2014; 40: 843–54.
CAS PubMed PubMed Central Google Scholar
Mayer EA, Tillisch K, Gupta A. Ось кишечника / мозга и микробиота. J Clin исследования. 2015; 125: 926–38.
PubMed PubMed Central Google Scholar
Honda K, Littman DR. Микробиота в адаптивном иммунном гомеостазе и болезнях. Природа. 2016; 535: 75–84.
CAS PubMed PubMed Central Google Scholar
Schroeder BO, Bäckhed F. Сигналы от микробиоты кишечника к отдаленным органам в физиологии и болезнях. Nat Med. 2016; 22: 1079–89.
CAS PubMed PubMed Central Google Scholar
Леви М., Колодзейчик А.А., Тайс К.А., Элинав Э. Дисбактериоз и иммунная система. Nat Rev Immunol. 2017; 17: 219–32.
CAS PubMed PubMed Central Google Scholar
Марувада П., Леоне В., Каплан Л. М., Чанг Е.Б. Микробиом человека и ожирение: выход за рамки ассоциаций. Клетка. Хост-микроб. 2017; 22: 589–99.
CAS PubMed PubMed Central Google Scholar
Бах Дж.Ф. Гипотеза гигиены при аутоиммунных заболеваниях: роль патогенов и комменсалов. Nat Rev Immunol. 2018; 18: 105–20.
CAS PubMed PubMed Central Google Scholar
Браун JM, Хазен SL. Микробная модуляция сердечно-сосудистых заболеваний. Nat Rev.2018; 16: 171–81.
CAS Google Scholar
Тилг Х., Змора Н., Адольф Т.Э., Элинав Э. Микробиота кишечника, питающая метаболическое воспаление. Nat Rev Immunol. 2020; 20: 40–54.
CAS PubMed PubMed Central Google Scholar
Якоб С., Якоб Д.Г. Инфекционные угрозы, кишечный барьер и его троянский конь: дисбактериоз.Front Microbiol. 2019; 10: 1676.
PubMed PubMed Central Google Scholar
Fouhse JM, Yang K, More-Bayona J, Gao Y, Goruk S, Plastow G, et al. Воздействие амоксициллина у новорожденных изменяет долгосрочный иммунный ответ, несмотря на временное воздействие на кишечную микробиоту у поросят. Фронт Иммунол. 2019; 10: 2059.
CAS PubMed PubMed Central Google Scholar
Бомонт М., Паес С., Муссар Э., Кнудсен С., Каукиль Л., Эймард П. и др. Метаболиты кишечной микробиоты способствуют созреванию кишечного барьера при переходе от сосания к отъему. Кишечные микробы. 2020; 11: 1268–86.
PubMed PubMed Central Google Scholar
Suh SH, Choe K, Hong SP, Jeong SH, Mäkinen T., Kim KS, et al. Микробиота кишечника регулирует целостность молочных желез, индуцируя VEGF-C в макрофагах ворсинок кишечника.EMBO Rep.2019; 20: e46927.
PubMed PubMed Central Google Scholar
Kulkarni DH, McDonald KG, Knoop KA, Gustafsson JK, Kozlowski KM, Hunstad DA, et al. Пассажи антигена, связанные с бокаловидными клетками, ингибируются во время инфекции Salmonella typhimurium, чтобы предотвратить распространение патогена и ограничить реакцию на пищевые антигены. Mucosal Immunol. 2018; 11: 1103–13.
CAS PubMed PubMed Central Google Scholar
Abo H, Chassaing B, Harusato A, Quiros M, Brazil JC, Ngo VL, et al. Регулятор-1 дифференцировки эритроидов, индуцированный микробиотой в раннем возрасте, управляет пролиферацией и регенерацией стволовых клеток кишечника. Nat Commun. 2020; 11: 513.
CAS PubMed PubMed Central Google Scholar
Fung TC, Vuong HE, Luna CDG, Проновост Г.Н., Александрова А.А., Райли Н.Г. и др. Воздействие кишечного серотонина и флуоксетина модулирует бактериальную колонизацию кишечника.Nat Microbiol. 2019; 4: 2064–73.
PubMed PubMed Central Google Scholar
Canfora EE, Meex RCR, Venema K, Blaak EE. Метаболиты кишечных микробов при ожирении, НАЖБП и СД2. Обзоры природы. Эндокринология. 2019; 15: 261–73.
CAS PubMed PubMed Central Google Scholar
Lau WL, Vaziri ND. Микробные короткоцепочечные жирные кислоты кишечника и риск диабета.Нат Рев Нефрол. 2019; 15: 389–90.
PubMed PubMed Central Google Scholar
Санна С., ван Зуйдам Н.Р., Махаджан А., Курильщиков А., Вич Вила А., Воса У и др. Причинно-следственные связи между микробиомом кишечника, короткоцепочечными жирными кислотами и метаболическими заболеваниями. Нат Жене. 2019; 51: 600–5.
CAS PubMed PubMed Central Google Scholar
Де Ваддер Ф, Ковачева-Датчари П., Гонсалвес Д., Винера Дж., Зитоун С., Дюшампт А. и др.Метаболиты, вырабатываемые микробиотой, улучшают метаболизм через нервные цепи кишечника и мозга. Клетка. 2014; 156: 84–96.
PubMed PubMed Central Google Scholar
Далиле Б., Ван Ауденхове Л., Вервлиет Б., Вербеке К. Роль короткоцепочечных жирных кислот в коммуникации между микробиотой, кишечником и мозгом. Нат Рев Гастроэнтерол Гепатол. 2019; 16: 461–78.
PubMed PubMed Central Google Scholar
Parada Venegas D, De la Fuente MK, Landskron G, Gonzalez MJ, Quera R, Dijkstra G и др. Короткоцепочечные жирные кислоты (SCFA), опосредуемые эпителиальной и иммунной регуляцией кишечника, и ее значение при воспалительных заболеваниях кишечника. Фронт Иммунол. 2019; 10: 277.
PubMed PubMed Central Google Scholar
Frese SA, Hutton AA, Contreras LN, Shaw CA, Palumbo MC, Casaburi G, et al. Стойкость добавок Bifidobacterium longum subsp.Infantis EVC001 у младенцев на грудном вскармливании. мСфера. 2017; 2: e00501–17.
PubMed PubMed Central Google Scholar
Zheng N, Gao Y, Zhu W., Meng D, Walker WA. Короткоцепочечные жирные кислоты, образующиеся при взаимодействии кишечных комменсальных бактерий с сцеженным грудным молоком, обладают противовоспалительным действием в незрелых энтероцитах человека. PloS ONE. 2020; 15: e0229283.
CAS PubMed PubMed Central Google Scholar
Waligora-Dupriet AJ, Dugay A, Auzeil N, Nicolis I, Rabot S, Huerre MR, et al. Короткоцепочечные жирные кислоты и полиамины в патогенезе некротического энтероколита: аспекты кинетики у гнотобиотических перепелов. Анаэроб. 2009; 15: 138–44.
CAS PubMed PubMed Central Google Scholar
Рой С.К., Менг К., Садовиц Б.Д., Коллиш-Сингул М., Епури Н., Саталин Дж. И др. Энтеральное введение смеси, ферментированной бактериями, новорожденным поросятам: высокоточная модель некротического энтероколита (NEC).PloS ONE. 2018; 13: e0201172.
PubMed PubMed Central Google Scholar
Meng D, Sommella E, Salviati E, Campiglia P, Ganguli K, Djebali K, et al. Индол-3-молочная кислота, метаболит триптофана, секретируемый Bifidobacterium longum подвид Infantis, оказывает противовоспалительное действие в незрелом кишечнике. Pediatr Res. 2020. https://doi.org/10.1038/s41390-019-0740-x.
Mukhopadhyay S, Wade KC, Puopolo KM.Препараты для профилактики и лечения сепсиса у новорожденных. Clin Perinatol. 2019; 46: 327–47.
PubMed PubMed Central Google Scholar
Кабальеро-Флорес Г., Сакамото К., Зенг М.И., Ван Й., Хаким Дж., Матус-Акуна В. и др. Иммунизация матери обеспечивает защиту потомства от прикрепляющегося и удаляющегося патогена за счет доставки IgG с грудным молоком. Клетка. Хост-микроб. 2019; 25: 313–23.e4.
CAS PubMed PubMed Central Google Scholar
Mukhopadhyay S, Sengupta S, Puopolo KM. Проблемы и возможности рационального использования антибиотиков среди недоношенных детей. Arch Dis Child. 2019; 104: F327 – f32.
Google Scholar
Шульман Дж., Диманд Р. Дж., Ли ХК, Дуэнас Г. В., Беннетт М. В., Гулд Дж. Б.. Использование антибиотиков в отделении интенсивной терапии новорожденных. Педиатрия. 2015; 135: 826–33.
PubMed PubMed Central Google Scholar
Шульман Дж., Профит Дж., Ли ХК, Дуэнас Дж., Беннетт М.В., Паруча Дж. И др. Варианты использования антибиотиков в неонатальном периоде. Педиатрия. 2018; 142: e20180115.
PubMed PubMed Central Google Scholar
Chi C, Buys N, Li C, Sun J, Yin C. Влияние пребиотиков на сепсис, некротический энтероколит, смертность, непереносимость кормления, время до полного энтерального питания, продолжительность пребывания в больнице и частоту стула в недоношенные дети: метаанализ.Eur J Clin Nutr. 2019; 73: 657–70.
CAS PubMed PubMed Central Google Scholar
Sun J, Marwah G, Westgarth M, Buys N, Ellwood D, Gray PH. Влияние пробиотиков на некротический энтероколит, сепсис, внутрижелудочковое кровотечение, смертность, продолжительность пребывания в больнице и прибавку в весе у очень недоношенных детей: метаанализ. Adv Nutr. 2017; 8: 749–63.
PubMed PubMed Central Google Scholar
Deshpande G, Jape G, Rao S, Patole S. Преимущества пробиотиков у недоношенных новорожденных в странах с низким и средним доходом: систематический обзор рандомизированных контролируемых испытаний. BMJ Open. 2017; 7: e017638.
PubMed PubMed Central Google Scholar
Dermyshi E, Wang Y, Yan C, Hong W, Qiu G, Gong X и др. «Золотой век» пробиотиков: систематический обзор и метаанализ рандомизированных и наблюдательных исследований у недоношенных детей.Неонатология. 2017; 112: 9–23.
CAS PubMed PubMed Central Google Scholar
Olsen R, Greisen G, Schroder M, Brok J. Профилактические пробиотики для недоношенных детей: систематический обзор и метаанализ обсервационных исследований. Неонатология. 2016; 109: 105–12.
PubMed PubMed Central Google Scholar
Куанг Л., Цзян Ю. Эффект пробиотических добавок у беременных женщин: метаанализ рандомизированных контролируемых исследований.Br J Nutr. 2020; 123: 870–80.
CAS Google Scholar
Skonieczna-Zydecka K, Janda K, Kaczmarczyk M, Marlicz W., Loniewski I, Loniewska B. Влияние пробиотиков на симптомы, кишечную микробиоту и маркеры воспаления при детской колике: систематический обзор, метаанализ и мета-регрессия рандомизированных контролируемых исследований. J Clin Med. 2020; 9: 999.
CAS Google Scholar
van den Akker CHP, van Goudoever JB, Shamir R, Domellof M, Embleton ND, Hojsak I, et al. Пробиотики и недоношенные дети: позиционный документ Европейского общества педиатрической гастроэнтерологии, гепатологии и комитета по питанию по вопросам питания и рабочей группы Европейского общества детской гастроэнтерологии, гепатологии и питания по пробиотикам и пребиотикам. J Педиатр Гастроэнтерол Нутр. 2020; 70: 664–80.
Google Scholar
van den Akker CHP, van Goudoever JB, Szajewska H, Embleton ND, Hojsak I., Reid D., et al. Пробиотики для недоношенных детей: систематический обзор штаммов и сетевой метаанализ. J Педиатр Гастроэнтерол Нутр. 2018; 67: 103–22.
Google Scholar
Su GL, Ko CW, Bercik P, Falck-Ytter Y, Sultan S, Weizman AV, et al. Руководство AGA по клинической практике о роли пробиотиков в лечении желудочно-кишечных расстройств.Гастроэнтерология. 2020. https://doi.org/10.1053/j.gastro.2020.05.059.
Льюис З.Т., Шани Г., Масарве К.Ф., Попович М., Фрезе С.А., Села Д.А. и др. Подтверждение идентичности видов и подвидов бифидобактерий в коммерческих пробиотических продуктах. Pediatr Res. 2016; 79: 445–52.
CAS Google Scholar
Chiang MC, Chen CL, Feng Y, Chen CC, Lien R, Chiu CH. Lactobacillus rhamnosus сепсис, связанный с терапией пробиотиками у крайне недоношенных новорожденных: патогенез и обзор для клиницистов.J Microbiol Immunol Infect. 2020. https://doi.org/10.1016/j.jmii.2020.03.029
Pell LG, Loutet MG, Roth DE, Sherman PM. Аргументы против рутинного приема пробиотиков для профилактики НЭК. Curr Opin Pediatrics. 2019; 31: 195–201.
Google Scholar
Новые направления в профилактике неонатального дисбактериоза
Proteus mirabilis, часть микробиома человека.
Некротический энтероколит, сокращенно НЭК, является одной из основных причин смерти младенцев.Врачи знают, что недоношенные дети более уязвимы для НЭК, чем доношенные, но причины не совсем ясны. Предотвратить и лечить это состояние особенно сложно.
NEC и другие серьезные состояния в младенчестве, такие как сепсис и даже задержка развития, связаны с нездоровым дисбалансом бактерий в пищеварительном тракте младенцев, состоянием, известным как дисбактериоз.
«Все начинается в кишечнике, когда вредные бактерии берут на себя контроль», — говорит Ахил Махешвари, директор неонатологии Детского центра Джонса Хопкинса.
Преобладает мнение, что недоношенные младенцы более склонны к дисбактериозу, потому что после рождения они проводят много времени в больнице, где заражаются вредными бактериями от других младенцев — траектория неонатологи и микробиологи называют горизонтальным приобретением .
«Колонизация у матерей происходит задолго до рождения, и матери передают ее. Мы можем использовать эти знания для предотвращения дисбактериоза ». — Ахил Махешвари
Новое исследование Махешвари перевернуло это понимание с ног на голову.Противоречивые результаты исследования открыли новое понимание того, как младенцы становятся колонизированными нездоровыми бактериями, и предлагают новые интригующие направления в борьбе с дисбактериозом. Исследование было опубликовано в выпуске Microbiome от 12 сентября.
Дисбиоз вызывает беспокойство, поскольку микробный дисбаланс склоняется в пользу класса микробов, известных как гаммапротеобактерии, который включает патогены, вызывающие брюшной тиф, гонорею, чуму, холеру и другие известные инфекционные заболевания, а также E.coli , который может вызвать смертельное пищевое отравление у детей.
Махешвари намеревался определить, как эти нежелательные бактерии начинают процветать у недоношенных детей, у которых чаще развивается полноценный дисбактериоз. Его исследование показывает, что недоношенные дети, у которых развивается дисбактериоз, делятся на две категории: полужизни начинают с низким уровнем гаммапротеобактерий в кишечнике и колонизируются в первые несколько недель после рождения; у другой половины младенцев очень высокий уровень этих бактерий, как только они родились.Исследование Махешвари — первое, демонстрирующее эту двойную дихотомию в прогрессировании дисбактериоза.
Однако более критично то, что исследование говорит о том, как младенцы приобрели бактерии. Обе группы рождаются с гаммапротеобактериями и изначально не приобрели их от других младенцев, как предполагают преобладающие гипотезы. Должен быть другой источник.
«Это предполагает, что вредные бактерии поступают напрямую от матери к ребенку, а не от других младенцев — так называемая вертикальная траектория », — говорит Махешвари.
В то же время врачи также знают, что у доношенных матерей в крови, молоке, кале или других жидкостях организма отсутствуют гаммапротеобактерии. «Если у доношенных мам их нет, а у недоношенных — откуда они?» — риторически спрашивает Махешвари.
Ответ в данных. Теперь он считает, что вредные бактерии приобретаются не младенцами от других младенцев, а матерями во время длительного, а иногда и многократного пребывания в больнице, предназначенного для предотвращения преждевременных родов.По его словам, шестьдесят процентов матерей с преждевременными родами попадают в больницу три или четыре раза, и многие другие женщины поступают как минимум два раза.
Передача от матери к ребенку также объясняет еще один факт о дисбактериозе: вагинальные роды, при которых младенцы чаще контактируют с кровью, фекалиями и другими биологическими жидкостями от матери, приводят к большей вероятности развития этого состояния у недоношенных детей. матери которых были госпитализированы до их рождения.
«Колонизация у матерей происходит задолго до рождения, и матери передают ее», — говорит Махешвари.«Мы можем использовать эти знания для предотвращения дисбактериоза».
Основываясь на результатах своего собственного исследования, Махешвари начал широкое сотрудничество со своими коллегами-акушерами по внедрению новой политики и процедур приема в Детский центр Джона Хопкинса для противодействия дисбактериозу.
Вместо того, чтобы бороться с микробным дисбалансом постфактум — у уже колонизированных новорожденных, дезинфицируя отделения интенсивной терапии или назначая антибиотики, — борьба должна начаться гораздо раньше, в идеале, с момента, когда у матери начнутся преждевременные роды.Махешвари считает, что следует более тщательно рассмотреть потенциальные риски пребывания в больнице по поводу преждевременных родов, и следует избегать или ограничивать такое пребывание в максимально возможной степени.
«Врачам необходимо начать профилактику до родов», — говорит он. «Если мы дождемся родов, будет уже слишком поздно».
«Колонизация у матерей происходит задолго до рождения, и матери передают ее», — говорит Махешвари. «Мы можем использовать эти знания для предотвращения дисбактериоза».
Новая парадигма детского питания
6 -я Международная конференция и выставка пробиотиков, функционального и детского питания
02-03 октября 2017 г. Лондон, Великобритания
Дэвид Дж. Кайл
Evolve Biosystems, США
Основной доклад : J Prob Health
Аннотация :Постановка проблемы: грудное молоко было единственным источником питания для младенцев на протяжении миллионов лет и богато специфические олигосахариды (HMO).В естественном микробиоме кишечника младенцев преобладает один вид бифидобактерий, а именно: исключительно конкурентоспособны при потреблении ОПЗ. Из-за непредвиденных последствий кормления смесью, использования антибиотиков и Кесарево сечение, этот естественный микробиом был радикально изменен, так что сегодня более 90% новорожденных в США дисбактериоз. Цель этой работы — разработать решение, которое поможет спасти естественный микробиом от дисбактериоза. раннее ремоделирование, которое возвращает микросреду толстой кишки в ее естественное состояние.Методология: рандомизированное параллельное контролируемое проспективное клиническое исследование (n = 68) было проведено в пяти исследованиях в Дэвисе, Калифорния, США. США со здоровыми доношенными детьми, находящимися на грудном вскармливании, зарегистрированными на четвертый день жизни. Половина когорты получала добавки ежедневно в течение 21 дня. с активированными Bifidobacteria infantis, и половина из них обеспечивала стандартный уход. Результаты: у всех младенцев, получавших добавки, независимо от способа родов, в микробиоме преобладали более 80% бактерий B. infantis. тогда как младенцы без добавок были лишены B.Infantis и 21 из 34 младенцев вообще не имели бифидобактерий. Различия в Также были отмечены зрелость стула, pH, микробиологические и химические различия. Заключение и значение: естественный микробиом hi-bif был утрачен за последние 50-80 лет в развитых странах. В возникающий в результате дисбактериоз может иметь значительное влияние на запрограммированное развитие иммунной системы и ее становление. метаболических уставок. Мы показали, что этот дисбактериоз можно исправить и восстановить микросреду с помощью добавление активированного B.Infantis.
Биография :Дэвид Дж. Кайл — генеральный директор Evolve Biosystems Inc., дочернего предприятия Института продуктов питания для здоровья Калифорнийского университета в Дэвисе. За свою карьеру он основал несколько компаний, в том числе Martek Biosciences Corp, где он руководил исследованиями и разработками и коммерческим развитием более 15 лет. Его продукты DHA и ARA теперь присутствуют практически во всех детских смесях по всему миру. В 2011 году он был приобретен DSM за 1,2 миллиарда долларов. Он получил степень доктора биохимии в Университете Альберты, Канада.За свою выдающуюся карьеру он опубликовал более 80 научных статей и отредактировал две книги. В 2009 году он был занесен в Зал славы космических технологий США за его вклад в науку и промышленность.
лучших медицинских специалистов собираются для решения проблем с дисбактериозом кишечника младенцев
ДЭВИС, Калифорния, 4 июня 2019 г. / PRNewswire / — Evolve BioSystems, производитель детского пробиотика Evivo® , объявила сегодня о созыве Консультативного совета по здоровью детей с участием ведущих экспертов в области медицины и научных исследований в области младенцев. здоровье.Консультативный совет провел свое первое заседание 29 мая, на котором обсуждались способы восстановления полезных бактерий, необходимых для создания функционального микробиома младенца, и снижения риска краткосрочных и долгосрочных проблем со здоровьем.
Во время этого первоначального и последующих заседаний Консультативный совет по здоровью младенцев изучит, как безопасно и эффективно вернуть жизненно важные бактерии в микробиомы младенцев. В состав Консультативного совета по здоровью младенцев входят :
- Др.Крис Дамман, доктор медицины, старший сотрудник по программам, Глобальное здравоохранение, Фонд Билла и Мелинды Гейтс; Доцент кафедры гастроэнтерологии Вашингтонского университета
- Д-р Бенджамин Голд, доктор медицины, детский гастроэнтеролог, Детский центр здоровья пищеварительной системы, Атланта
- Д-р Джэ Ким, доктор медицинских наук, неонатолог и детский гастроэнтеролог, Детская больница Рэди, Сан-Диего; Клинический профессор педиатрии, Калифорнийский университет, Сан-Диего
- Д-р Брайан Скоттолайн, доктор медицинских наук, неонатолог, доцент педиатрии, Орегонский университет медицинских наук
- Доктор.Эрин Гамильтон Спенс, доктор медицины, неонатолог, Детская больница Кука, Форт-Уэрт; Медицинский директор, Банк материнского молока Северного Техаса
- Д-р Карл Сильвестр, доктор медицины, профессор хирургии и педиатрии, заместитель декана по исследованию здоровья матери и ребенка, Стэнфордский университет
«Проблема дисбактериоза проявляется по-разному. Жизненно важно объединить исследователей и клиницистов из разных дисциплин», — сказала д-р Эрин Гамильтон Спенс, доктор медицины, неонатолог Детской больницы Кука, Форт-Уэрт, и медицинский директор. Банк материнского молока в Северном Техасе.«Каждый из нас видит проблемы через свой объектив. Консультативный совет Evolve BioSystems Infant Health предоставляет форум для обмена данными и генерации идей. Исходя из нашей первоначальной встречи, я очень воодушевлен нашим потенциалом пролить свет на очень запутанные и все более сложные вопросы. распространенные проблемы со здоровьем младенцев в США и за их пределами ».
Клинически доказано, что ключевые полезные бактерии B. infantis, снижают количество кишечных патогенов, таких как Clostridium и E.coli , которые связаны со все более распространенными аутоиммунными заболеваниями, такими как астма, аллергия, экзема и диабет 1 типа. Хотя B. infantis исторически присутствовал в кишечнике младенцев, важные современные медицинские методы, такие как антибиотики, кормление смесью и кесарево сечение, предотвратили естественный перенос полезных бактерий от матери к младенцу при рождении. Действительно, недавних исследований показали, что до девяти из 10 младенцев, родившихся в США, не хватало B.Infantis в их кишечном микробиоме в молодом возрасте.
«Ведущие практики в области неонатальной и педиатрической науки и медицины начинают понимать, что дисбактериоз, характеризующийся нарушением нормального кишечного микробиома и нарушением симбиотических отношений между хозяином и связанными с ним микробами, становится все более распространенным среди детей в США», сказал доктор Бенджамин Голд, доктор медицины, педиатрический гастроэнтеролог, Детский центр здоровья пищеварительной системы, Атланта.»Это нарушение нормальной микрофлоры может затем привести к развитию заболеваний, в частности аутоиммунных, воспалительных и аллергических заболеваний, которые становятся настоящим кризисом для общественного здравоохранения. К счастью, мы добились больших успехов в поиске методов восстановления кишечник младенца до нормального здорового состояния. Мы должны использовать эти мощные открытия и начать применять эту технологию к ряду различных парадигм болезней, чтобы определить, можно ли успешно снизить риск развития болезни путем восстановления нормального микробиома младенца.«
О компании Evolve BioSystems
Evolve BioSystems, Inc. — это частная микробиомная компания, занимающаяся разработкой следующего поколения продуктов для создания, восстановления и поддержания здорового микробиома кишечника. Evolve недавно завершила раунд финансирования серии C на сумму 40 миллионов долларов, совместно возглавляемый Фондом Билла и Мелинды Гейтс и Horizons Ventures, венчурным подразделением Фонда Ли Ка Шинга. Evolve — это ответвление Института продуктов питания для здоровья (FFHI) Калифорнийского университета в Дэвисе, основанное на более чем десятилетних исследованиях, направленных на понимание уникального партнерства микробиома кишечника младенца и компонентов грудного молока.Благодаря разработке и коммерческому запуску продуктов для лечения дисбактериоза кишечника новорожденных, в том числе Evivo® EVC001 для младенцев, открытая платформа Evolve теперь применяется для решения проблемы дисбактериоза кишечника на протяжении всего жизненного цикла человека и животных. В дополнение к знаменательному испытанию, подтверждающему концепцию, Evolve проводит дальнейшие клинические исследования для создания своего набора решений на основе микробиома.
Контактное лицо: Crisel Ortiz, 1-415-989-9000, [адрес электронной почты защищен]
ИСТОЧНИК Evolve BioSystems, Inc.
Ссылки по теме
https://www.evolvebiosystems.com/
Дисбактериоз микробиоты жидкости бронхоальвеолярного лаважа у младенцев с затяжным бактериальным бронхитом — Bao
Введение
Затяжной бактериальный бронхит (ПББ), который проявляется влажным кашлем, стойкой инфекцией слизистой оболочки бронхов и слизисто-гнойным воспалением, является одной из основных причин повторяющегося кашля и хрипов у младенцев и детей ясельного возраста (1,2).ПБД считается предшественником других хронических респираторных заболеваний, таких как бронхоэктазы и хроническая гнойная пневмония (3,4). Бактериальная культура показала, что основными патогенами являются Haemophilus influenza , Streptococcus pneumonia и Moraxella catarrhalis (1,2). Однако низкий уровень обнаружения традиционного метода ограничивает обнаружение патогенов, присутствующих в небольшом количестве. Обнаружение микробиоты 16S рДНК с помощью секвенирования следующего поколения дает более полную информацию о флоре дыхательных путей у младенцев с ПБД (3-5).
Жидкость бронхоальвеолярного лаважа (ЖБАЛ) обычно используется для диагностики и характеристики заболеваний нижних дыхательных путей (6-8). Используя обнаружение 16S рДНК на ЖБАЛ, можно точно описать бактериальный состав и разнообразие микробиоты в нижних дыхательных путях младенцев с ПБД (7-9). В исследовании, опубликованном van der Gast et al. , обнаружение микробиоты BALF показало, что у младенцев PBB общие основные бактерии с младенцами с бронхоэктазами и младенцами с кистозным фиброзом (10), и инфицированные патогены будут постоянно повреждать слизистую оболочку бронхов.В то время как Wang et al. предположил, что состав микробиоты BALF различается у младенцев с пневмонией, инфицированных разными патогенами, и подробно описаны взаимодействия между бактериями (11). Было немного сообщений о микробном сравнении BALF между младенцами с ПБД и трахеомаляцией (ТМ), а влияние сети совместной встречаемости на младенцев с ПБД еще не оценивалось.
В этом исследовании BALF, который был собран у 24 младенцев, использовался для обнаружения микробиоты и построения сети совместного возникновения у детей с ПБД и ТМ.И необходимо решить две проблемы: (I) различия в бактериальном составе детей с ПБД и ТМ; (II) микробные взаимодействия у младенцев с ПБД и их вклад в общее состояние здоровья. Это углубит наше понимание бактериальной сети и ее участия в патогенезе ПБД.
Методы
Заявление об этике и клинический диагноз
Все родители младенцев предоставили письменное информированное согласие, и исследование было одобрено этическим комитетом детской больницы Шэньчжэня под номером одобрения 2016 (005).ПБД был определен как стойкая бактериальная инфекция бронхиального эпителия, которая вызывает такие клинические признаки, как хроническое гнойное воспаление. Младенцы с ПБД должны соответствовать следующим условиям: (I) пациенты должны иметь хронический влажный кашель продолжительностью не менее 4 недель; (II) симптомы кашля должны исчезнуть после 2 недель лечения антибиотиками; (III) нейтрофилов было больше у пациентов с положительными бактериальными культурами; (IV) другие причины хронического кашля были исключены (12). В это исследование были включены младенцы с ТМ, которые соответствовали следующим критериям: (I) пациенты имеют коллапс просвета трахеи более чем на 50%; (II) клинические симптомы, которые включают шумное дыхание, хрипы в трахее, резкий лающий кашель или экспираторную одышку; (III) следует исключить проблемы сердечных заболеваний, неврологических расстройств и аномалий пищевода (13).Клинические данные и истории приема всех пациентов были сведены в Таблицу 1 и Таблицу S1 .
Таблица 1 Характеристики младенцев с PBB или TMПолный стол Таблица S1 Подробная информация о младенцах
Полная таблица
BALF коллекция
После поступления в нашу больницу ЖБАЛ был взят у новорожденных за 2 дня.Для отбора проб использовался электронный бронхоскоп (EB-270P или EB-270S, Fujitsu Electronics, Inc., Токио, Япония). За 6 ч до операции младенцам запрещалось есть. За 30 мин до операции больным внутримышечно вводили атропин (0,01–0,02 мг / кг), затем внутривенно вводили мидазолам (0,1–0,3 мг / кг). После индукции электронных бронхоскопов лидокаин (1-2 мл) с концентрацией 1% распыляли на главные бронхи. Затем электронные бронхоскопы фиксировали в средней доле, нижнем бронхе верхней доли и воспаленных частях правого легкого пациента.Для бронхоальвеолярного лаважа использовали физиологический раствор (1 мл / кг). БАЛ был регенерирован и хранился при -80 ° C для дальнейшего использования.
Построение библиотеки и секвенирование ДНК
Микробную ДНК экстрагировали из ЖБАЛ с использованием E.Z.N.A. ® Soil DNA Kit (Omega Bio-tek, Inc., Norcross, GA, USA) в соответствии с протоколами производителя. С помощью набора для ПЦР (AP221-02, Beijing TransGen Biotech Co., Ltd., Пекин, Китай), участки V3 – V4 16S рДНК амплифицировали с использованием праймеров 341F и 517R. Электрофорез в агарозном геле с концентрацией 2% использовали для подтверждения длины продуктов полимеразной цепной реакции (ПЦР), а качество продуктов ПЦР определяли с помощью QuantiFluor ™ -ST [Promega (Beijing) Biotech Co., Ltd., Пекин, Китай ]. Затем квалифицированную ДНК использовали для секвенирования MiSeq со стратегиями 300 парных концов. Необработанные чтения были загружены в базу данных NCBI Sequence Read Archive (SRA) (номер доступа: SRP067201, SRR3951741, SRR3951743 и SRR3951754).
Обработка данных и таксономическая аннотация
Необработанные данные, полученные с помощью секвенирования MiSeq, сначала использовались для фильтрации данных. Любые чтения, которые содержали более 10 низкокачественных оснований или адаптерных последовательностей из 15 п.н., были отфильтрованы. Дубликаты также были удалены, чтобы оставить чистые высококачественные данные. Затем парные чтения были объединены в теги на основе перекрытия. Теги были сгруппированы в операционные таксономические единицы (OTU) с 97% сходством, как показывает USEARCH (v7.0.1090) (14), и каждая OTU содержала одну необработанную репрезентативную последовательность (15). Химеры, созданные во время ПЦР, удаляли из OTU с помощью UCHIIME (16). Наконец, все теги были сопоставлены с OTU с помощью глобального поиска, и 466 окончательных OTU были получены в общей сложности онлайн: http://jtd.amegroups.com/public/addition/jtd/supp-jtd.2017.12.59-2.pdf (15). Значение Шеннона и Симпсона рассчитывали с помощью MOTHUR (v1.31.2) (17).
Статистический анализ
Разнообразие микробиоты дыхательных путей между группами ПБД и ТМ сравнивалось с использованием критерия суммы рангов Вилкоксона.Значительно обогащенные микробные резиденты в группе PBB и TM были идентифицированы с помощью анализа LEfSe [размер эффекта линейного дискриминантного анализа (LDA)] в соответствии со следующими параметрами: значения P теста Краскела-Уоллиса и критерия Вилкоксона были меньше 0,01 и пороговое значение оценки LDA было установлено как 3 (18). Используя пакет «psy» в R, корреляции Пирсона среди родов на основе их относительной численности были получены в когортах PBB и TM. Затем сеть совместного изобилия была визуализирована с помощью программного обеспечения Cytoscape (v2.2.0) (19), если коэффициенты корреляции Пирсона> 0,9 или <−0,5. Используя расстояние Брея-Кертиса между младенцами PBB и TM, влияние клинических симптомов на микробный состав BALF было обнаружено с помощью пермутационного дисперсионного анализа (PERMANOVA, 9 999 перестановок) с пакетом «веганский» в R (, таблица S2 ).
Таблица S2 Ранжирование ассоциаций PERMANOVA между клиническими симптомами и микробиотой BALF у младенцевПолная таблица
Результаты
Когорты исследования и выходные данные
В общей сложности 12 младенцев с ПБД и 12 младенцев с ТМ в возрасте до 3 лет были включены в исследование для выявления микробиоты ЖБАЛ.И их клиническая информация была представлена в Таблице 1 . Используя платформу MiSeq, нацеленную на вариабельную область V3 – V4 рДНК 16S, были получены метки образцов BALF, которые варьировались от 9,992 до 29,165. Количество OTU варьировалось от 75 до 117 в группе PBB и от 79 до 245 в группе TM.
Разнообразие микробиоты ЖБАЛ было значительно ниже в когорте
ПБД.Анализ главных компонентов (PCA) на основе распределения OTU был проведен для оценки сходства микробиоты среди 24 образцов в Интернете: http: // jtd.amegroups.com/public/addition/jtd/supp-jtd.2017.12.59-4.pdf. Результаты показали, что образцы из группы PBB сгруппированы вместе, как и те явления из группы TM (, рис. 1A, ). Затем индексы Шеннона и Симпсона были использованы для оценки микробного разнообразия ЖБАЛ. Среднее значение индекса Шеннона составило 1,683 ± 0,703 (среднее ± стандартное отклонение) для группы ПБД и 2,324 ± 0,142 для группы ТМ (P <0,001) ( Рисунок 1B ). На значительную разницу указал также индекс Симпсона, который в среднем составил 0.416 ± 0,216 для группы PBB и 0,191 ± 0,025 для группы TM (P <0,001) (, рисунок 1B, ).
Рис. 1 ПХА и микробное разнообразие младенцев с ПБД и младенцев с ТМ. (A) PCA был выполнен на основе взвешенных расстояний UniFrac, и образцы из группы PBB сгруппированы отдельно от группы TM; (B) распределение индексов Шеннона и Симпсона в группе PBB и группе TM. Разнообразие микробов у младенцев с ПБД было значительно выше, чем у младенцев ТМ (P = 0.006 и P = 1 × 10 −5 для индексов Шеннона и Симпсона соответственно). **, значение P меньше 0,01. PCA, анализ главных компонент; ПБД, затяжной бактериальный бронхит; ТМ, трахеомаляция.
Таксономические компоненты у младенцев с ПБД и ТМ различались
Используя анализ LEfSe, был сравнен состав микробиоты BALF, и было обнаружено 54 дифференциально обогащенных таксона между группой PBB и TM ( Рисунок S1A ).Среди 25 таксонов, обогащенных группой ПБД, Bacillus (40,770% ± 22,218%, LDA = 5,632), Haemophilus (14,319% ± 29,532%, LDA = 5,161), Pseudomonas (10,406% ± 25,439%, LDA = 5,042) и Enterococcus (0,959% ± 0,631%, LDA = 3,980) присутствовали в более высоких относительных количествах. Относительная численность Lactobacillales, которая включает Lactococcus (13,463% ± 7,319%, LDA = 5,661) и Lactobacillus (0,153% ± 0,076%, LDA = 3,508), была значительно ниже у младенцев с ПБД.Для дальнейшей характеристики таксономических различий микробиота ЖБАЛ была проанализирована на уровне классов. В соответствии с результатами для родов, таксоны, обогащенные ПБД, были сгруппированы по Bacteroidia и Clostridia , тогда как Actinobacteria и Flavobacteria были более обогащены в группе TM ( Рисунок S1B ). Влияние потенциальных искажающих факторов, включая пол, возраст и клинические симптомы, на изменения микробиоты ЖБАЛ у младенцев с ПБД оценивали с помощью PERMANOVA (, таблица S2, ).И была выявлена корреляция между кашлем и изменениями микробиоты (P <0,05).
Рисунок S1 Дифференциально обогащенные таксоны у младенцев с ПБД и младенцев с ТМ. (A) В общей сложности 25 таксонов, включая Bacillus , Haemophilus , Pseudomonas и Enterococcus , были обнаружены значительно обогащенными в группе PBB, в то время как уровни Lactococcus и Lactobacillus были ниже, чем в TM. группа; (B) биомаркеры на уровнях типа, класса, порядка, семейства и рода проявлялись от внутреннего к внешнему.Группы PBB и TM были показаны зеленым и красным цветом соответственно. ПБД, затяжной бактериальный бронхит; ТМ, трахеомаляция.
Отличительная сеть совместного микробного заражения ЖБАЛ у детей с ПББ и НМ
Для младенцев TM, Pseudomonas и Arthrobacter были ключевыми узлами сети совместного возникновения и положительно коррелировали с другими родами ( Рисунок 2 ).Между тем, было высказано предположение, что значительно обогащенный Lactococcus положительно коррелировал с Bacillus (r = 0,920, P <0,001). В группе PBB вышеупомянутая сеть была разрушена, и была обнаружена более сложная сеть совместного возникновения микробиоты (, рис. 2, ). Было показано четыре основных узла, включая Haemophilus , Peptoclostridium , Porphyromonas и Cronobacter . Haemophilus , который был основным возбудителем PBB, отрицательно коррелировал с другими родами, включая Bacillus (r = -0.533), Clostridium (r = -0,541) и Lactococcus (r = -0,539). Положительная корреляция между Lactococcus и Bacillus (r = 0,940, P <0,001) в группе PBB, как правило, аналогична таковой в группе TM.
Рисунок 2 Сеть микробной совместимости у младенцев с ПБД и ТМ. Зеленый и красный края обозначают положительную и отрицательную корреляцию между легочными бактериями, а значения P обозначены звездочками (одна, две и три звездочки обозначают значение P меньше 0.05, 0,01 и 0,001 соответственно). Зеленые или красные пятна указывают на то, что роды значительно обогащены когортами ПБД или ТМ, а диаметр соответствует их относительному содержанию. Бактериальная сеть в группе ПБД была более сложной, чем в группе ТМ, и большинство бактериальных взаимоотношений в группе ТМ было нарушено. Между тем прямая отрицательная корреляция между Haemophilus и другими родами, включая Bacillus , Lactococcus , Clostridium и Acinetobacter , была определена для группы PBB.ПБД, затяжной бактериальный бронхит; ТМ, трахеомаляция.
Обсуждение
В ходе исследования сравнивался состав микробных сообществ ЖБАЛ у пациентов с ПБД и ТМ. Результаты PCA показали, что состав микробиоты у младенцев с ПБД отличался от такового у младенцев TM. У младенцев с ПБД легкие были заражены патогенами, которые могли разрушить неповрежденную слизистую дыхательных путей и усугубить дисбактериоз микробиоты (20).Более того, корреляция между клиническими симптомами и изменениями микробного сообщества доказала, что кашель, вызванный инфекцией патогена, может быть оценен как особенность пациентов с ПБД. А у младенцев с ПБД было заметно меньшее микробное разнообразие. Все пациенты в исследовании подвергались лечению антибиотиками в течение последних 3 месяцев, и более низкое микробное разнообразие у младенцев с ПБД, вероятно, было связано с длительным применением антибиотиков, хотя некоторые клинические записи недоступны ( Таблица S1 ).
Помимо патогена Haemophilus , относительная численность Pseudomonas , Escherichia и Bacteroides была выше у младенцев с ПБД. Эти бактерии трудно культивировать, особенно после лечения антибиотиками (20). Предыдущие отчеты продемонстрировали, что Haemophilus тесно коррелировал с интерлейкином-1α (IL-1α) и интерлейкином-1β (IL-1β) (21). Они могут вызывать гибель клеток и воспаление, что является причиной влажного кашля у младенцев с ПБД (12,21).В то же время некоторые исследования показали, что Bacteroides может способствовать дифференцировке Т-хелперных клеток 17 (Th27), а секретируемый Th27 интерлейкин-17 (IL-17) может запускать воспалительную реакцию и аутоиммунные заболевания (22,23). Как и в случае с ПБД, были доказательства того, что колонизация патогенных бактерий, таких как Haemophilus , в дыхательных путях была связана с тяжелой обструкцией дыхательных путей и нейтрофильным воспалением дыхательных путей у взрослых с астмой (24). ПБД у детей и астма у взрослых, которые имеют общие клинические проявления и патогены, дали нам представление о том, что в этих двух состояниях может существовать сходный патогенез.С другой стороны, количество Lactococcus и Lactobacillus было значительно ниже у младенцев с ПБД. Lactococcus может секретировать бутират и подавлять рост патогенов (25), тогда как было обнаружено, что Lactobacillus влияет на развитие флоры нижних дыхательных путей у младенцев (26). Таким образом, нарушение микробиоты легких у младенцев с ПБД может не только нанести прямой вред здоровью детей, но также может повлиять на колонизацию бактерий в нижних дыхательных путях и увеличить риск аллергических заболеваний дыхательных путей.
Общая микробная сеть совместного возникновения была разрушена у младенцев с ПБД, но не в когортах НМ. Значительное обогащение основного узла Haemophilus наблюдалось у младенцев с PBB, и оно отрицательно коррелировало с другими микробными колонизаторами, включая Lactococcus , Bacillus и Clostridium . Предыдущие отчеты показали, что Bacillus косвенно влияет на секрецию IL-17 (27), а Clostridium может способствовать дифференцировке Т-регуляторных (Treg) клеток, которые имеют решающее значение для воспалительных реакций (22,28).У младенцев с ПБД относительная численность вышеупомянутых родов снизилась по мере увеличения Haemophilus , и было обнаружено, что это усугубляет микробный дисбаланс и усиливает иммунный ответ в слизистой оболочке дыхательных путей.
Это исследование улучшило понимание различий в микробиоте и сетях совместного присутствия бактерий у детей грудного возраста с ПБД и ТМ, но отсутствие убедительных доказательств взаимосвязи между микробиотой легких и патогенезом ПБД было основным недостатком исследования.Необходима дополнительная работа: (I) необходимо провести исследование большой когорты для проверки этих результатов; (II) у младенцев с ПБД необходимо выявлять изменения микробиома и метаболитов; (III) изменения иммунного фактора должны быть проверены экспериментально.
Выводы
Таким образом, в исследовании описаны изменения микробиоты нижних дыхательных путей у младенцев с ПБД. Результаты пролили предварительный свет на то, как реагируют патогены, вызывающие ПБД, и стали основой для дополнительной бактериальной терапии ПБД у младенцев в соответствии с лечением антибиотиками.
Благодарности
Мы хотели бы поблагодарить сотрудников WeHealthGene, чьи имена не включены в список авторов, но, тем не менее, внесли свой вклад в работу этой команды. Мы также хотели бы поблагодарить медсестер, которые помогали собирать образцы в детской больнице Шэньчжэня.
Финансирование : Эта работа финансируется Проектом создания ключевых медицинских дисциплин в Шэньчжэне, который был предоставлен Комиссией по здравоохранению и планированию семьи Шэньчжэня (201606033).
Конфликт интересов : Авторы не заявляют о конфликте интересов.
Этическое заявление : Все родители младенцев предоставили письменное информированное согласие, и это исследование было одобрено этическим комитетом детской больницы Шэньчжэня под номером утверждения 2016 (005).
Список литературы
- Ван И, Хао Ц., Чи Ф и др.Клиническая характеристика затяжного бактериального бронхита у китайских младенцев. Научный журнал 2015; 5: 13731. [Crossref] [PubMed]
- Чиппс БЭ. Обследование младенцев и детей с рефрактерными симптомами нижних дыхательных путей. Ann Allergy Asthma Immunol 2010; 104: 279-83; викторина 283-5, 298.
- de Steenhuijsen Piters WA, Sanders EA, Bogaert D. Роль местной микробной экосистемы в респираторном здоровье и болезнях. Филос Транс Р Соц Лондон Биол Наука 2015; 370: 20140294.[Crossref] [PubMed]
- Durack J, Boushey HA, Lynch SV. Микробиота дыхательных путей и последствия дисбактериоза при астме. Curr Allergy Asthma Rep 2016; 16: 52. [Crossref] [PubMed]
- Brown PS, Pope CE, Marsh RL, et al. Непосредственный забор легкого у маленького ребенка с муковисцидозом выявляет разнообразную микробиоту. Энн Ам Торак Соц 2014; 11: 1049-55. [Crossref] [PubMed]
- Buzan MT, Pop CM. Современное состояние диагностики и лечения интерстициальных заболеваний легких.Clujul Med 2015; 88: 116-23. [Crossref] [PubMed]
- Хаффнэгл, Великобритания, Диксон, РП. Бактериальная микробиота при воспалительных заболеваниях легких. Clin Immunol 2015; 159: 177-82. [Crossref] [PubMed]
- Чен А.С., Мартин М.Л., Лурье Р. и др. Бронхоэктазы без кистозного фиброза у взрослых характеризуются активацией пути Th27 просвета дыхательных путей. PLoS One 2015; 10: e0119325. [Crossref] [PubMed]
- Ян XJ, Ван YB, Zhou ZW, и др.Высокопроизводительное секвенирование ампликонов 16S рДНК характеризует бактериальный состав жидкости бронхоальвеолярного лаважа у пациентов с вентилятор-ассоциированной пневмонией. Drug Des Devel Ther 2015; 9: 4883-96. [PubMed]
- van der Gast CJ, Cuthbertson L, Rogers GB, et al. Три клинически различных хронических инфекции дыхательных путей у детей имеют общую основную микробиоту. Энн Ам Торак Соц 2014; 11: 1039-48. [Crossref] [PubMed]
- Ван Х., Дай В., Цю С. и др.Mycoplasma pneumoniae и Streptococcus pneumoniae вызвали различную микробную структуру и корреляционную сеть в микробиоте легких. J Thorac Dis 2016; 8: 1316-22. [Crossref] [PubMed]
- Бейнс К.Дж., Апхэм Дж.В., Еркович С.Т. и др. Медиаторы функции нейтрофилов у детей с затяжным бактериальным бронхитом. Сундук 2014; 146: 1013-20. [Crossref] [PubMed]
- Фрага Дж.С., Дженнингс Р.В., Ким П.С. Детская трахеомаляция. Семин Педиатр Хирургия 2016; 25: 156-64.[Crossref] [PubMed]
- Эдгар RC. UPARSE: высокоточные последовательности OTU, полученные при считывании микробного ампликона. Нат Методы 2013; 10: 996-8. [Crossref] [PubMed]
- Ван К., Гаррити ГМ, Тидже Дж. М. и др. Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой бактериальной таксономии. Appl Environ Microbiol 2007; 73: 5261-7. [Crossref] [PubMed]
- Эдгар Р.С., Хаас Б.Дж., Клементе Дж.С. и др. UCHIME улучшает чувствительность и скорость обнаружения химер.Биоинформатика 2011; 27: 2194-200. [Crossref] [PubMed]
- Schloss PD, Westcott SL, Рябин Т. и др. Представляем mothur: программное обеспечение с открытым исходным кодом, независимое от платформы, поддерживаемое сообществом, для описания и сравнения сообществ микробов. Appl Environ Microbiol 2009; 75: 7537-41. [Crossref] [PubMed]
- Сегата Н., Изард Дж., Уолдрон Л. и др. Открытие и объяснение метагеномных биомаркеров. Genome Biol 2011; 12: R60. [Crossref] [PubMed]
- Шеннон П., Маркиел А., Озьер О. и др.Cytoscape: программная среда для интегрированных моделей сетей биомолекулярного взаимодействия. Genome Res 2003; 13: 2498-504. [Crossref] [PubMed]
- Сигал Л.Н., Блазер М.Дж. Дивный новый мир: микробиота легких в эпоху перемен. Ann Am Thorac Soc 2014; 11 Дополнение 1: S21-7. [Crossref] [PubMed]
- Мартин SJ. Гибель клеток и воспаление: случай цитокинов семейства IL-1 как канонических DAMP иммунной системы. FEBS J 2016; 283: 2599-615.[Crossref] [PubMed]
- Камада Н., Сео СУ, Чен Г.Й. и др. Роль микробиоты кишечника в иммунитете и воспалительных заболеваниях. Нат Рев Иммунол 2013; 13: 321-35. [Crossref] [PubMed]
- Юрковецкий Л.А., Пикард Ю.М., Червонский А.В. Микробиота и аутоиммунитет: поиск новых возможностей. Клеточный микроб-хозяин 2015; 17: 548-52. [Crossref] [PubMed]
- Green BJ, Wiriyachaiporn S, Grainge C и др. Потенциально патогенные бактерии дыхательных путей и нейтрофильное воспаление при устойчивой к лечению тяжелой астме.PLoS One 2014; 9: e100645. [Crossref] [PubMed]
- Рамакришна Б.С. Роль микробиоты кишечника в питании и метаболизме человека. J Gastroenterol Hepatol 2013; 28 Suppl 4: 9-17. [Crossref] [PubMed]
- Hansel TT, Johnston SL, Openshaw PJ. Микробы и иммунные реакции слизистых оболочек при астме. Ланцет 2013; 381: 861-73. [Crossref] [PubMed]
- Гонг Й., Ли Х., Ли Й. Влияние Bacillus subtilis на плотные эпителиальные соединения мышей с воспалительным заболеванием кишечника.J. Interferon Cytokine Res 2016; 36: 75-85. [Crossref] [PubMed]
- Ирландия SJ, Монсон Н.Л., Дэвис Л.С. В поисках баланса: усиление и ингибирование аутоиммунных реакций рассеянного склероза с помощью ИЛ-6 и ИЛ-10. Цитокин 2015; 73: 236-44. [Crossref] [PubMed]
Цитируйте эту статью как: Bao Y, Li Y, Qiu C, Wang W, Yang Z, Huang L, Feng X, Liu Y, Li J, Zhou Q, Wang H, Li Д., Ван Х., Дай В., Чжэн Ю. Дисбиоз микробиоты жидкости бронхоальвеолярного лаважа у младенцев с затяжным бактериальным бронхитом.J Thorac Dis 2018; 10 (1): 168-174. doi: 10.21037 / jtd.2017.12.59
Положительное влияние лечения пробиотиками на кишечную микробиоту у младенцев с очень низкой массой тела при рождении
Младенцы с очень низкой массой тела при рождении (ОНМТ) подвергаются высокому риску выраженного дисбиоза микробиоты кишечника. В настоящем исследовании 36 младенцев с ОНМТ были случайным образом разделены на две группы, которые лечились комбинированными пробиотиками и плацебо, и у них было собрано 72 образца кала на 14-й и 28-й дни жизни. Наконец, 32 образца фекалий, взятых у 16 недоношенных новорожденных с ОНМТ, были квалифицированы и проанализированы с использованием секвенирования гена 16S рРНК.Первичный результат заключался в оценке изменения микробиоты кишечника у младенцев с очень низкой массой тела после комбинированного приема пробиотиков. Вторичным результатом был анализ корреляции микробного состава кишечника и уровней цитокинов. Мы обнаружили, что лечение пробиотиками, но не плацебо, уменьшило разнообразие α кишечной микробиоты у детей с очень низкой массой тела. На уровне филума обработка пробиотиками сильно увеличивала численность Firmicutes , тогда как численность Proteobacteria значительно снижалась.На уровне семейства Streptococcaceae и Lactobacillaceae стали преобладающими после лечения пробиотиками, в то время как относительная численность Enterobacteriaceae за это время снизилась. В частности, значимые корреляции наблюдались между численностью Lactobacillaceae и уровнями цитокинов в сыворотке крови. Необходимы дальнейшие исследования, чтобы пролить больше света на характеристики кишечной микробиоты новорожденных с очень низкой массой тела. И следует учитывать модуляцию микробиоты, чтобы улучшить выживаемость младенцев с очень низкой массой тела.
1. Введение
Благодаря последним достижениям в области интенсивной терапии новорожденных, выживаемость крайне недоношенных новорожденных значительно увеличилась за последние 20 лет [1]. Однако в многоцентровом исследовании в Китае по-прежнему наблюдались высокие показатели смертности и заболеваемости среди младенцев, рожденных> 26 недель [2]. Таким образом, улучшение выживаемости не сопровождалось пропорциональным сокращением случаев инвалидности в этой популяции. Некротический энтероколит (НЭК) является частым заболеванием желудочно-кишечного тракта и ведущей причиной заболеваемости и смертности у крайне недоношенных детей.Многие метаанализы РКИ показали, что пероральные пробиотики эффективно снижают НЭК и смертность [3, 4]. Кроме того, обновленное исследование метаанализа показало, что пробиотики с множественными штаммами могут быть более эффективными в предотвращении НЭК и смерти у крайне недоношенных детей [5], но все еще неясно, какие комбинации пробиотиков наиболее эффективны [6].
Как мы знаем, колонизация пробиотиками, которая увеличивает барьерную функцию слизистых оболочек, может изменить ключевые компоненты воспаления кишечника и активизировать иммунную систему [7].Однако в настоящее время исследования о корреляции кишечного микробиома и воспалительных факторов все еще отсутствуют, особенно о влиянии пробиотической добавки на микробиом кишечника и воспалительные факторы. Мы предположили, что кишечные микробы могут участвовать в патогенезе не только кишечных заболеваний, таких как NEC, но и системных воспалительных процессов.
В этом исследовании мы провели рандомизированное двойное слепое контролируемое исследование детей с ОНМТ с пробиотической добавкой, чтобы выяснить влияние комбинированных пробиотиков на микробное сообщество кишечника и воспалительные факторы.
2. Материалы и методы
2.1. Заявление об этике
Все процедуры исследования были рассмотрены и одобрены этическим комитетом больницы по охране здоровья матери и ребенка Шэньчжэнь Баоань. Информированное согласие было подписано родителями каждого младенца в соответствии с протоколом, утвержденным Контрольным советом учреждения (регистрационный номер: LL2014006).
2.2. Дизайн исследования и сбор выборки
Это рандомизированное двойное слепое контролируемое исследование. Недоношенные дети госпитализированы в Шэньчжэньский Баоаньский госпиталь по охране здоровья матери и ребенка с сентября.С 1 января 2014 г. по 31 декабря 2015 г., выжившие в отделении интенсивной терапии были зачислены в группу после получения информированного согласия родителей. Недоношенные дети с тяжелой асфиксией (стадия III), хромосомными аномалиями плода, синюшным врожденным пороком сердца, врожденной атрезией кишечника, гастрошизисом, омфалоцеле, активным кровотечением из верхних отделов желудка, без согласия родителей или без согласия родителей, или те, кто голодал более 3 недель в течение Период исследования после рождения был исключен.
2.3. Рандомизация, сокрытие распределения, ослепление и последующее наблюдение
Зарегистрированные младенцы с ОНМТ были рандомизированы на две группы: группу пробиотиков (PB), которую лечили комбинированными пробиотиками, и группу плацебо (PL), которую лечили плацебо.Рандомизация проводилась с использованием последовательно пронумерованного компьютеризированного алгоритма рандомизации. Назначение лечения было скрыто главным исследователем в соответствии с порядковыми номерами перед началом. Препараты поставлялись Glac Biotech Co. Ltd. и были идентичны по упаковке, размеру и форме. Кроме того, перед отправкой лекарства были помечены буквами B и C. Лекарства добавлялись в грудное молоко или смесь перед кормлением старшими медсестрами, которые не принимали участия в уходе за этими младенцами.Медсестры и врачи, ведущие наблюдение за младенцами, не знали о составе препарата до конца исследования. За всеми включенными в исследование младенцами наблюдали и наблюдали лечащий врач до 36 недель после наступления менструального цикла или выделений.
2.4. Руководство по кормлению и вмешательство
Все включенные в исследование младенцы рассматривались для первоначального кормления в течение 24 часов после рождения в зависимости от гестационного возраста и массы тела при рождении. Предпочтение отдавалось материнскому молоку, за ним следовало донорское молоко, а затем смеси для недоношенных детей.В первый день минимальное количество грудного молока или смеси давали каждые 2-4 часа в зависимости от переносимости кормления. При переносимости количество кормления увеличивалось медленно, с шагом не более 20 мл / кг в день за одно кормление. Пероральный прием 100 мл / кг в день был определен как полное энтеральное питание. Кормление прекращали при появлении каких-либо признаков непереносимости пищи, включая наличие желудочного аспирата в количестве, превышающем половину от предыдущего кормления, дважды или вздутие живота.
Тем временем зарегистрированные младенцы получали лечение как часть пробиотической группы: грудное молоко или смесь с комбинированным пробиотиком (содержащая L. plantarum LK006 20%, B. longum LK014 40% и B. bifidum. LK012 40%; каждая пробиотическая капсула содержит 500 мг 5 10 колониеобразующих единиц (КОЕ), поставляемых Glac Biotech Co. Ltd.), или группа плацебо: получает 1 мл 5% раствора глюкозы. Всего 500 мг пробиотиков (содержит 5 10 КОЕ) в день или глюкозу вводили через назогастральный зонд в течение 4 часов после рождения.250 мг на дозу добавляли два раза в день к грудному молоку или смеси до 36 недель после менструального возраста.
Характеристики, клиническая информация и лабораторные данные были взяты из наших медицинских записей.
Образцы фекалий собирали в количестве 30–50 г на 14 и 28 дней жизни, а затем немедленно транспортировали в лабораторию на льду и хранили при -80 ° C для дальнейших исследований.
Первичным результатом была оценка изменения микробиоты кишечника у детей с очень низкой массой тела после комбинированной добавки с пробиотиками.Вторичным результатом был анализ корреляции микробного состава кишечника и уровней цитокинов для выяснения положительных эффектов после приема пробиотических добавок.
2,5. Экстракция ДНК
Геномную ДНК экстрагировали из каждого образца фекалий с использованием мини-набора QIAamp Fast DNA Stool Mini (QIAGEN, Германия) в соответствии с инструкциями производителя. Количество ДНК определяли на спектрофотометре NanoDrop 2000 UV-Vis (Thermo Scientific, США). Целостность и размер ДНК проверяли на 0.Электрофорез в 8% () агарозном геле в бромистом этидии 0,5 мг / мл. Все образцы ДНК хранили при -20 ° C перед дальнейшей обработкой.
2.6. Секвенирование гена 16S рРНК
Бактериальный прямой праймер 5-CCTACGGGRSGCAGCAG-3 и обратный праймер 5-GGACTACVVGGGTATCTAATC-3 использовали для амплификации гипервариабельных областей V3-V4 гена 16S рРНК в каждом образце. Концентрацию библиотек ДНК определяли количественно с помощью анализа ДНК PicoGreen (Invitrogen, США). Объединенную библиотеку ДНК разводили до 10 пМ и денатурировали в 0.2 н. NaOH и смешивают с контрольной библиотекой PhiX (Illumina Inc., США). Библиотеку ДНК секвенировали с помощью секвенатора Illumina MiSeq (Illumina Inc., США).
2.7. Биоинформатика и статистический анализ
Для обработки данных секвенирования использовался конвейер Quantitative Insights Into Microbial Ecology (QIIME ver. 1.9.0, http://www.qiime.org/). Считывания с парных концов были объединены с использованием PANDAseq, последовательности были удалены с помощью USEARCH (версия 8.0.1623), а химера была проверена с помощью UCHIME26.Оперативные таксономические единицы (OTU) были отобраны с использованием UCLUST при 97% сходстве, и были созданы репрезентативные последовательности. Последовательности были выровнены с PyNAST с использованием базы данных Greengenes и таксономии, отнесенной к самому низкому возможному таксономическому уровню с использованием классификатора проекта базы данных рибосом при пороговом значении начальной загрузки 80%. OTU, обнаруженные более чем в 50% образцов, были сохранены. Количество последовательностей нормализовали для дальнейшего анализа.
Внутригрупповое бактериальное разнообразие (т. Е. α -разнообразие) оценивали с помощью индексов ACE, Chao, Shannon и Simpson.Взвешенный анализ основных координат (PCoA) Fast UniFrac на основе OTU был проведен для обеспечения обзора микробной динамики кишечника в ответ на лечение пробиотиками и плацебо. Межгрупповые бактериальные различия (то есть β -разнообразие) исследовали с помощью стандартного теста. Коэффициент корреляции Пирсона был рассчитан для оценки связи между численностью бактерий и уровнями цитокинов. Статистический анализ и визуализация данных выполнялись с помощью программного пакета R (версия 3.4.2).
3. Результаты
3.1. Характеристики участников исследования
В период исследования было собрано 72 образца фекалий, собранных у 36 детей с очень низкой массой тела на 14 и 28 дни жизни. Из всех этих образцов 20 образцов фекалий были полностью исключены из-за недостаточного количества после амплификации мета рДНК, а 2 образца были дополнительно исключены из-за более низкого содержания, несмотря на оптимизацию второй амплификации мета рДНК. Наконец, 50 образцов кала, взятых у 30 недоношенных новорожденных с ОНМТ, были квалифицированы и подверглись секвенированию гена 16S рРНК.В течение последующих периодов наблюдения 18 образцов кала были исключены из-за отсутствия образцов на 14-й или 28-й день жизни и дублировании. Наконец, были проанализированы 32 образца кала, взятых у 16 недоношенных новорожденных с ОНМТ. Блок-схема этого исследования показана на рисунке 1.
Все шестнадцать недоношенных новорожденных с ОНМТ были случайным образом разделены на две группы, получавшие лечение пробиотиками и плацебо (далее обозначаемые как PB и PL, соответственно). Подробные демографические, клинические характеристики, типы кормления и воздействие антибиотиков в двух группах обобщены в таблице 1.Между этими двумя группами нет различий с точки зрения демографических данных, клинических характеристик, типов кормления и воздействия антибиотиков ().
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ХЗЛ: хроническое заболевание легких; ВЖК: внутрижелудочковое кровоизлияние; ROP: ретинопатия. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Лечение пробиотиками влияет на микробиоту кишечника у младенцев с VLBW
На основе высококачественных считываний, полученных при секвенировании, мы идентифицировали в общей сложности 597 операционных таксономических единиц (OTU) во всех образцах с уровнем сходства 97%.Индексы ACE, Chao, Shannon и Simpson были применены для анализа α -разнообразия (рис. 2). В группе PB сниженные индексы ACE, Chao и Shannon и увеличенный индекс Симпсона на 14 и 28 дни жизни в совокупности продемонстрировали снижение α -разнообразия после лечения пробиотиками. Напротив, на 14 и 28 день после лечения плацебо в группе PL не было обнаружено никаких существенных различий.
Анализ β -разнообразия также был выполнен путем расчета невзвешенных расстояний UniFrac между отдельными образцами.Графики анализа главных координат (PCoA) продемонстрировали, что образцы агрегировались в кластер на 14-й день жизни, который рассредоточился на 28-й день в группе PB (рис. 3 (а)). Однако на 14 и 28 дни жизни в группе PL не наблюдалось явных изменений (рис. 3 (б)).
3.3. Корреляция между микробным составом кишечника и уровнями цитокинов
На различных таксономических уровнях состав кишечной микробиоты сравнивали между 14- и 28-дневными образцами фекалий в группе PB. Кладограмма, представляющая структуру микробиоты и преобладающих бактерий, была создана методом линейного дискриминантного анализа размера эффекта (LEfSe) (рис. 4).На уровне филума Firmicutes было значительно больше в кишечной микробиоте в 28-дневных образцах, чем в 14-дневных. А относительная численность Proteobacteria снизилась на 28 дней жизни. На уровне семейства Streptococcaceae и Lactobacillaceae стали преобладать на 28-й день жизни, в то время как относительная численность Enterobacteriaceae за это время снизилась.
Чтобы определить, облегчило ли лечение пробиотиками симптомы у детей с очень низкой массой тела, мы также оценили уровни цитокинов в образцах сыворотки из группы PB.На 28-й день жизни в группе PB наблюдалось снижение IL-6 (значение парного критерия Стьюдента = 0,026) и повышение TGF- β 2 (значение парного критерия Стьюдента = 0,011) (Рисунок 5). . С другой стороны, в группе PL не было обнаружено значительного изменения уровней цитокинов (данные не показаны).
Наконец, мы оценили корреляции между относительной численностью различных бактерий, IL-6 и TGF- β 2. Среди дифференциальных бактерий между 14- и 28-дневными образцами разница между численностью Lactobacillaceae значительно коррелировала. с изменениями IL-6 (рис. 6 (а)) и TGF- β 2 (рис. 6 (б)).Увеличение численности Lactobacillaceae сопровождалось снижением уровня IL-6 и повышением TGF- β 2.
4. Обсуждение
Накопленные данные показывают, что микробиота кишечника человека оказывает сильное влияние на метаболизм хозяина. расстройства [8]. Сравнение и исследование бактериального разнообразия кишечной микробиоты имеют важное значение для понимания этиологии недоношенных детей с низкой массой тела при рождении и для разработки потенциальных стратегий лечения.В этом исследовании мы изучили эффективность комбинированных пробиотиков на бактериальное разнообразие, структуру сообщества и иммунную систему у детей с очень низкой массой тела. Насколько нам известно, это первый случай одновременного изучения изменений и корреляции микробиоты кишечника и воспалительных факторов у младенцев с ОНМТ с пероральной комбинированной пробиотической добавкой.
LEfSe идентифицировал серию дифференциально обильных таксонов между 14-дневными и 28-дневными образцами из группы PB. Наши результаты были в основном разумными и соответствовали плану эксперимента или опубликованным результатам.Во-первых, комбинированные пробиотики, протестированные в этом исследовании, содержат L. plantarum . В результате доля семейства Lactobacillaceae неожиданно увеличилась в группе PB [9]. Во-вторых, на уровне филума увеличение Firmicutes и уменьшение Proteobacteria после лечения пробиотиками имеет тенденцию быть полезным, поскольку сообщалось, что в фекальном микробиоме недоношенных новорожденных с некротическим энтероколитом было увеличено относительное количество Proteobacteria . и уменьшилась относительная численность Firmicutes [10, 11].Такой бактериальный дисбаланс можно было бы обратить вспять с помощью пробиотиков в настоящем исследовании. В-третьих, на уровне семьи увеличение количества Streptococcaceae и Lactobacillaceae и уменьшение Enterobacteriaceae можно легко объяснить предыдущими выводами о том, что Enterobacteriaceae преобладают у недоношенных младенцев с VLBW, а Streptococcaceae 900obacillaceae и преобладают у доношенных детей [12]. По этой причине уменьшение α -разнообразия после обработки пробиотиками произошло из-за уменьшения относительной численности вредных бактерий, доля которых в микробиоме перешла к видам пробиотиков.
В группе PB лечение пробиотиками сопровождалось снижением уровня IL-6 и увеличением TGF- β 2 в сыворотке. В соответствии с предыдущими данными [13], такие изменения цитокинов подразумевают этот защитный эффект TGF- β , особенно изоформы TGF- β 2 , посредством подавления воспалительных реакций макрофагов в развивающемся кишечнике [14]. В микробиологических исследованиях младенцев с ОНМТ, которые проводились до сих пор, мало внимания уделялось корреляции между изменениями микробиоты и уровнями цитокинов.Таким образом, подробный механизм применения пробиотиков у недоношенных новорожденных с ОНМТ оставался в значительной степени неясным. В настоящем исследовании мы обнаружили, что Lactobacillaceae достоверно коррелировали с уровнями в сыворотке IL-6 и TGF- β 2 . Это предполагает, что это семейство бактерий тесно связано с патологией младенцев с очень низкой массой тела. В связи с этим обилие Lactobacillaceae и других хорошо известных родов пробиотиков (например, Bifidobacteria ) может служить биомаркером эффективности лечения пробиотиками.
Несмотря на новые открытия, наше исследование имеет определенные ограничения. Во-первых, размер выборки был относительно небольшим. Тем не менее, наше исследование уникально тем, что содержит серийную оценку лечения пробиотиками и микробиоты кишечника. Кроме того, изменения в основных типах бактерий, наблюдаемые в этом исследовании, соответствовали текущему пониманию воздействия этих микробов. Во-вторых, все испытуемые были этническими китайцами, и результаты нельзя напрямую экстраполировать на другие группы населения. Приветствуются дальнейшие подтверждающие исследования других этнических групп, чтобы понять межпопуляционные вариации микробиоты кишечника.
Таким образом, мы идентифицировали ряд бактерий с различной численностью при лечении пробиотиками, которые не были обнаружены в группе плацебо. Основываясь на этом, будущие метагеномные исследования с участием более крупных когорт недоношенных VLBW могут улучшить пробиотическую терапию и выяснить причинно-следственные связи между кишечной микробиотой и недоношенными новорожденными с VLBW.
Доступность данных
Данные, использованные для подтверждения выводов этого исследования, в настоящее время находятся под запретом, а результаты исследований коммерциализируются.Запросы данных (6/12 месяцев) после публикации статьи будут рассмотрены соответствующим автором.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Два автора Юэ-фэн Ли и Чуан-жуй Чжу внесли равный вклад в рукопись.
Дополнительные материалы
Дополнительные 1. CONSORT 2010 контрольный список информации для включения в отчет о рандомизированном исследовании.
Дополнительный 2. Рисунок S1: изменения α -разнообразия (индекс Шеннона) в группе пробиотиков и группе плацебо.
Дополнительный 3. Рисунок S2: значительное снижение процента нейтрофилов на 28 день в группе PB.
Связь между грибковым и бактериальным дисбиозом у младенцев и детским атопическим хрипом в непромышленных условиях
Общие сведения
Астма является наиболее распространенным хроническим заболеванием детского возраста.Недавно мы определили критическое окно в начале жизни мышей и младенцев из Канады, в течение которого микробные изменения кишечника (дисбактериоз) влияют на развитие астмы. Учитывая географические различия в микробиоте кишечника человека во всем мире, мы изучили влияние микробного дисбиоза кишечника на атопическое дыхание у населения, живущего в разных условиях развивающегося мира.
Цель
Мы стремились определить, связаны ли микробные изменения в раннем младенчестве с развитием атопического хрипа в непромышленных условиях.
Методы
Мы провели исследование случай-контроль, вложенное в когорту новорожденных из сельских районов Эквадора, в котором мы идентифицировали 27 детей с атопическим хрипом и 70 здоровых контрольных субъектов в возрасте 5 лет. Мы проанализировали микробиоту кишечника бактерий и эукариот в образцах стула, собранных в возрасте 3 месяцев, с использованием секвенирования 16S и 18S. Бактериальные метагеномы были предсказаны на основе данных 16S рРНК с использованием филогенетического исследования сообществ путем реконструкции ненаблюдаемых состояний и классифицированы по функциям с помощью Киотской энциклопедии генов и онтологии геномов.Концентрации фекальных короткоцепочечных жирных кислот определяли с помощью газовой хроматографии.
Результаты
Как ранее наблюдалось у канадских младенцев, микробный дисбиоз в возрасте 3 месяцев был связан с более поздним развитием атопического хрипа. Однако дисбактериоз у эквадорских младенцев затрагивал разные бактериальные таксоны, был более выраженным, а также затрагивал несколько грибковых таксонов. Прогнозируемый метагеномный анализ подчеркнул значительные связанные с дисбиозом различия в генах, участвующих в метаболизме углеводов и таурина.Уровни ацетата и капроата короткоцепочечных жирных кислот в кале были снижены и увеличены, соответственно, в 3-месячных образцах стула детей, у которых развились атопические хрипы.
Выводы
Наши результаты подтверждают важность грибковой и бактериальной микробиоты в течение первых 100 дней жизни в развитии атопического хрипа и обеспечивают дополнительную поддержку для рассмотрения модуляции микробиома кишечника в качестве стратегии первичной профилактики астмы.
