MEDISON.RU — Пренатальная вирусная инфекция
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Различают внутриутробную инфекцию и внутриутробное инфицирование плода и новорожденного. При этих состояниях заражение происходит во время беременности или в родах, и его источником является мать. Внутриутробное инфицирование плода характеризуется только тем, что в организм плода проникает возбудитель инфекции, но плод при этом не заболевает, что, вероятно, связано с активацией защитных механизмов в системе мать-плацента-плод.
При внутриутробном инфицировании, которое происходит в первые 3 месяца беременности, возникают истинные пороки развития, формируется первичная фетоплацентарная недостаточность, неразвивающаяся беременность, происходят самопроизвольные выкидыши. При развитии внутриутробной инфекции после 3 месяцев беременности формируется внутриутробная задержка развития, вторичная фетоплацентарная недостаточность, отмечаются признаки инфекционного поражения плода.
В диагностике внутриутробного инфицирования используют иммунологические тесты для выявления специфических антител к возбудителям, культуральный метод (посев), а также метод полимеразной цепной реакции (ПЦР). Для исследования используют кровь и материал, взятый из влагалища и из канала шейки матки. В ряде случаев для исследования используют околоплодные воды, полученные путем амниоцентеза. Для диагностики широко используется также и ультразвуковое исследование. Остановимся на наиболее типичных вирусных заболеваниях эмбриона и плода.
Краснуха
Вирус краснухи представляет, пожалуй, наибольшую опасность для эмбриона и плода с точки зрения возникновения аномалий развития и существенного повреждения плода.
Принимая во внимание высокий риск возникновения аномалий развития при заболевании в первые 2-3 месяца беременности, ее необходимо прерывать. Ребенок, который родился у женщины, перенесшей во время беременности краснуху, сам является носителем вируса, и поэтому необходима его изоляция. В случае контакта беременной с больным краснухой, если она не болела ею ранее, необходима вакцинация, но не ранее 8-10 недели беременности, так как с этой целью используют живую ослабленную вакцину, и возможно негативное влияние на эмбрион.
Цитомегаловирус (ЦМВ)
Цитомегаловирус (ЦМВ) является одним из наиболее распространенных вирусов, передающихся плоду. При заражении ЦМВ велика вероятность неразвивающейся беременности, самопроизвольного ее прерывания, преждевременных родов, гибели плода, аномалий его развития. Выявление ЦМВ в организме беременной еще не означает наличия у нее острого заболевания, так как в большинстве случаев имеет место только бессимптомное вирусоносительство или субклиническая хроническая инфекция. У 10-20 %, у которых выявляются в крови специфические антитела к ЦМВ, может возникать обострение заболевания, а развитие внутриутробной инфекции только у 1-2 % среди этих беременных. Заражение ЦМВ впервые происходит у 1-4% беременных, и соответственно у 40-50% из них возникает риск развития внутриутробной инфекции.
Летальность при врожденной ЦМВ-инфекции достигает 20-30 %. У 90 % выживших детей отмечаются такие поздние осложнения, как потеря слуха, задержка умственного и физического развития, атрофия зрительного нерва, дефекты роста зубов и т. д. При ведении беременных с ЦМВ специфический противовирусный препарат ацикловир применяют только по строгим жизненным показаниям, обусловленным состоянием матери и новорожденного. Возможно также применение иммуномодуляторов на основе рекомбинантного альфа-2 интерферона, который вводят в виде свечей в прямую кишку в течение 10 дней.
д. При ведении беременных с ЦМВ специфический противовирусный препарат ацикловир применяют только по строгим жизненным показаниям, обусловленным состоянием матери и новорожденного. Возможно также применение иммуномодуляторов на основе рекомбинантного альфа-2 интерферона, который вводят в виде свечей в прямую кишку в течение 10 дней.
Вирус простого герпеса (ВПГ)
Возбудителем генитального герпеса чаще всего служит ВПГ 2-го типа. В 15 % случаев заболевание обусловлено ВПГ 1-го типа. В 90 % наблюдений инфицирование детей происходит во время родов вследствие непосредственного контакта с инфицированными тканями родовых путей. Около 5% детей инфицируются еще во время беременности. В остальных 5 % наблюдений инфицирование происходит уже после родов в результате контактов с окружающими и в основном с больной матерью. Риск инфицирования во время беременности зависит от характера проявления инфекции. Так, риск передачи вируса к ребенку при впервые возникшей инфекции с клиническими проявлениями к моменту родов составляет до 50%.
При заражении ребенка после 32 недель у новорожденного отмечаются кожные проявления в виде герпетических высыпаний или изъязвлений, поражение глаз — катаракта, микрофтальмия, выраженные нарушения со стороны центральной нервной системы — гидроцефалия, микроцефалия, некроз тканей, известковые включения. У детей могут иметь место такие тяжелые проявления инфекции, как менингоэнцефалит и сепсис. В последующем у детей нередко возникают тяжелые неврологические расстройства, нарушения зрения, отставание в развитии. Беременную с генитальным герпесом следует информировать о возможном риске передачи герпетической инфекции к плоду и о возможности кесарева сечения.
Метод родоразрешения зависит от наличия или отсутствия поражения половых органов в конце беременности, выделения вируса герпеса и времени, прошедшего с момента разрыва плодных оболочек. При выявлении признаков свежего герпетического поражения половых органов незадолго до родов целесообразно провести родоразрешение путем кесарева сечения. В послеродовом периоде рекомендуется обязательное грудное вскармливание новорожденных вне зависимости от вида герпетической инфекции у матери, так как грудное молоко является источником противогерпетических антител, даже при выявлении в нем антигена ВПГ.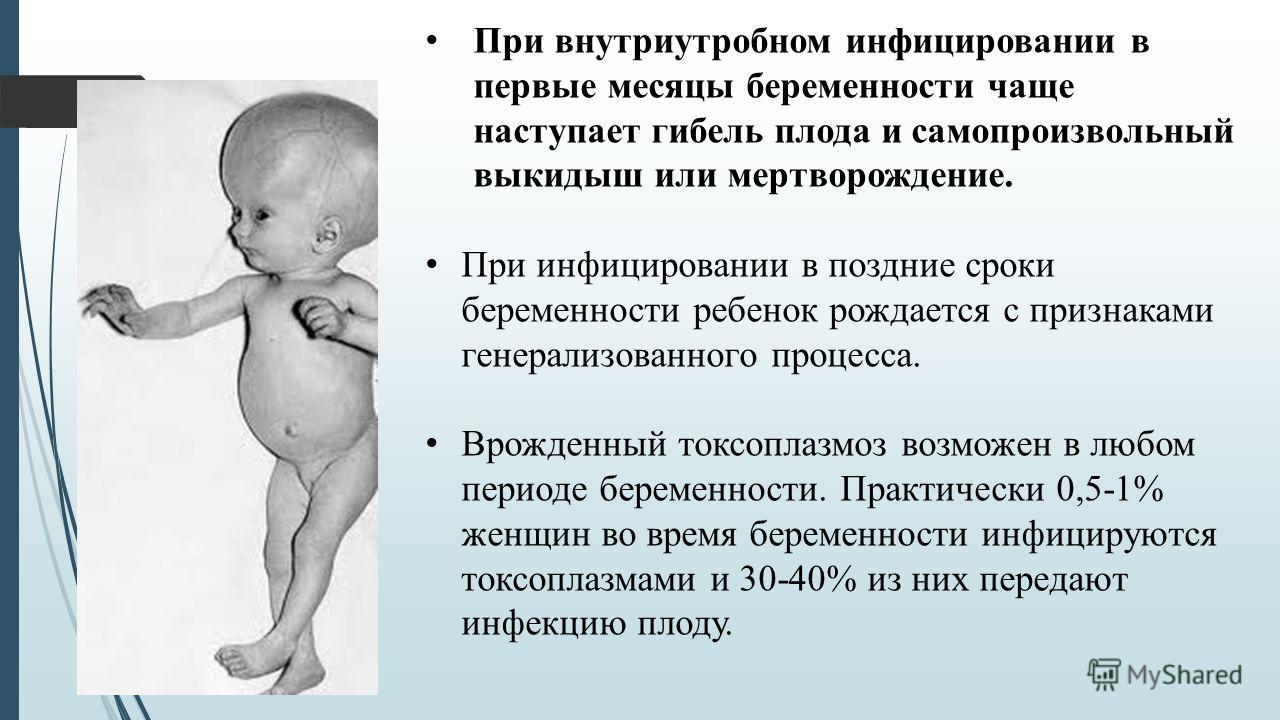
Вирусный гепатит
Вирусный гепатит представляет собой тяжелое заболевание печени. В зависимости от разновидности вируса вызывающего гепатит, различают следующие их типы: гепатит А, гепатит В, гепатит С, гепатит D, гепатит Е, гепатит F и гепатит G.
Гепатит А. Заболевание вызывается РНК-содержащим вирусом. Инфекция к матери передается фекально-оральным путем. Заражение плода происходит редко. Заражение новорожденного происходит при кормлении грудью в период нахождения вируса в крови у пациентки. Инкубационный период составляет 15-45 дней. У беременной заболевание протекает обычно в легкой или в среднетяжелой форме. Отмечается тошнота, рвота, увеличение печени, желтуха, боль в правом подреберье. В связи с тем, что вирус гепатита А не проникает через плаценту, он не приводит к возникновению пороков развития у плода. Острый вирусный гепатит А излечивается после короткой вирусемической фазы, не переходит в хроническую форму и не вызывает цирроз печени. Диагностику острого гепатита А проводят путем определения специфических антител в крови, которые выявляются уже через 2 недели после инфицирования. Лечение гепатита А проводят по общетерапевтическим, симптоматическим критериям. В случае контакта беременной с больным гепатитом А с профилактической целью вводят g-глобулин.
Диагностику острого гепатита А проводят путем определения специфических антител в крови, которые выявляются уже через 2 недели после инфицирования. Лечение гепатита А проводят по общетерапевтическим, симптоматическим критериям. В случае контакта беременной с больным гепатитом А с профилактической целью вводят g-глобулин.
Гепатит В в настоящее время представляет одну из важных проблем здравоохранения, что связано с увеличением частоты заболевания и с развитием неблагоприятных исходов в виде формирования хронического гепатита, цирроза печени и гепатоцеллюлярной карциномы. Возбудителем гепатита В является ДНК-содержащий вирус. Предполагается, что этот вирус является онкогенным. У беременных регистрируется 1-2 случая острого гепатита В на 1000 беременностей и 5-15 случаев хронического гепатита В. Источником инфекции являются больные с острым и хроническим гепатитом и вирусоносители. Передается вирус при переливании крови и препаратов крови, при половых контактах. Также возможно заражение при тесных бытовых контактах (использование общих зубных щеток, расчесок, носовых платков) и при использовании плохо обработанных медицинских инструментов.
Также возможно заражение при тесных бытовых контактах (использование общих зубных щеток, расчесок, носовых платков) и при использовании плохо обработанных медицинских инструментов.
В 85-95 % случаев инфицирование плода происходит во время родов вследствие контакта с кровью, инфицированными выделениями родовых путей или путем заглатывания инфицированных выделений. В 2-10 % случаев инфицирование происходит во время беременности путем проникновения вируса через плаценту, особенно при нарушении функции плаценты при фетоплацентарной недостаточности или при отслойке плаценты. В остальных случаях инфицирование происходит через зараженное материнское молоко. После родов возможно также заражение ребенка контактно-бытовым путем от матери. Тяжесть заболевания у новорожденных зависит от срока беременности, когда произошло инфицирование. Если инфицирование произошло в I или II триместре беременности, вероятность инфицирования составляет до 10 %. Если инфицирование имело место в III триместре, то риск передачи инфекции составляет 70 %. Если у матери в крови определяется антиген НВsAg, то риск заражения плода равен 20-40 . При дополнительном наличии антигена НBеАg, риск возрастает до 70-90 %.
Если у матери в крови определяется антиген НВsAg, то риск заражения плода равен 20-40 . При дополнительном наличии антигена НBеАg, риск возрастает до 70-90 %.
При гепатите В отмечается повышенная частота преждевременных родов и самопроизвольных абортов, число преждевременных родов возрастает втрое. У большинства инфицированных детей острый гепатит В протекает в легкой форме. В подавляющем большинстве случаев (90 %) у детей в последующем развивается состояние хронического носительства вируса с риском последующей передачи инфекции. Имеет место также и риск последующего возникновения первичной карциномы или цирроза печени.
Диагностика гепатита В основана на выявлении в крови пациентки различных антигенов и антител к вирусу. При развитии острого гепатита В во время беременности терапия состоит из поддерживающего лечения (диета, коррекция водно-электролитного баланса, постельный режим). При развитии коагулопатии переливается свежезамороженная плазма, криопреципитат. Беременным с различными формами гепатита В следует избегать проведения различных инвазивных процедур во время беременности и в родах. Следует также стремиться к уменьшению продолжительности безводного промежутка и родов в целом.
Беременным с различными формами гепатита В следует избегать проведения различных инвазивных процедур во время беременности и в родах. Следует также стремиться к уменьшению продолжительности безводного промежутка и родов в целом.
Наличие гепатита В не является показанием к родоразрешению путем кесарева сечения, так как оно также не исключает вероятности инфицирования (контакт с инфицированной кровью). В послеродовом периоде вакцинации подлежат все новорожденные, родившиеся от матерей — носительниц вируса гепатита В. Новорожденным также показано введение протективного иммуноглобулина «Гепатотект» в первые 12 ч жизни. В случае вакцинации сразу после родов не следует избегать грудного вскармливания. Основным методом профилактики заражения ребенка вирусным гепатитом В является 3-кратное обследование беременных на наличие НВsAg. При риске инфицирования вирусом гепатита В беременной целесообразна 3-кратная вакцинация пациентки рекомбинантной вакциной без риска для ребенка и матери.
Гепатит С характеризуется тенденцией к развитию хронического процесса, ограниченными клиническими симптомами и плохой реакцией на противовирусную терапию. В последствии высока вероятность развития гепатоцеллюлярной карциномы.
Возбудителем гепатита С является РНК-содержащий вирус. Источниками инфекции являются больные с хронической и острой формами гепатита С, а также латентные носители вируса. Вирус передается при трансфузии зараженной крови или ее компонентов. Контактно-бытовой и половой пути заражения являются довольно редкими. Основным путем инфицирования детей является вертикальный путь передачи инфекции от матери. Инкубационный период составляет в среднем 7- 8 нед. Заболевание делится на три фазы: острую, латентную и фазу реактивации. Острая фаза в большинстве наблюдений протекает без клинических проявлений и приблизительно в 60-85 % случаев переходит в хроническую форму гепатита с риском развития цирроза печени и гепатоцеллюлярной карциномы.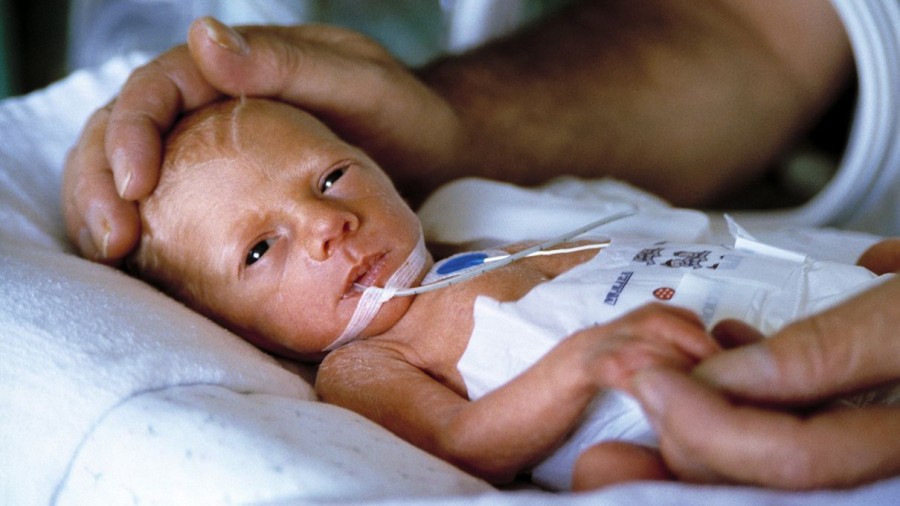
Острый гепатит С как латентный, так и клинически проявляющийся в 30-50 % случаев может закончиться выздоровлением с полной элиминацией НСV. Однако в большинстве случаев он сменяется латентной фазой В период латентной фазы инфицированные лица считают себя здоровыми и никаких жалоб не предъявляют. Фаза реактивации соответствует началу новых клинических проявлений гепатита С с последующим развитием хронического гепатита, цирроза печени и гепатоцеллюлярной карциномы.
Вакцины от гепатита С на сегодняшний день не существует. Всем беременным проводится обязательное скрининговое обследование на гепатит С трижды за беременность. Несмотря на то, что возможна вертикальная передача вируса плоду, гепатит С не является противопоказанием к беременности. Риск заражения плода гепатитом С не зависит от времени заражения матери и составляет около 6%. Передача вируса возможна как во время беременности, так и во время родов.
Нет единого мнения об оптимальном способе родоразрешения беременных с гепатитом С. Некоторые специалисты считают, что кесарево сечение снижает риск инфицирования плода, тогда как другие отрицают это. Преждевременный разрыв плодного пузыря и длительный безводный промежуток увеличивает риск передачи инфекции.
Вирус гепатита С обнаруживается и в грудном материнском молоке, и в этой связи нет также единого мнения о безопасности грудного вскармливания. У всех детей, рожденных от матерей с гепатитом С, в крови также будут отмечаться антитела к вирусу в течение первых 12 мес жизни. Если антитела сохраняются более чем через 18 мес после рождения, то это является подтверждением инфицированности ребенка гепатитом С.
Гепатит D. Возбудителем заболевания является вирус гепатита D, который представляет собой дефектный РНК-содержащий вирус, который способен производить репликацию только с помощью HBsAg-антигена вируса гепатита В. Инфекция передается при трансфузии крови или ее компонентов, а также половым путем. Инфицирование плода происходит вертикальным путем. Диагностика вирусного гепатита D основывается на выявлении антител в сыворотке крови. При инфицировании у новорожденного развивается хронический гепатит D с высоким риском цирроза печени. При гепатите D беременную следует иммунизировать по схеме вакцинации как при гепатите В. Лечение заболевания проводится в рамках общетерапевтических мероприятий.
Гепатит Е. Возбудителем инфекции является РНК-содержащий вирус, который распространяется фекально-оральным путем и вызывает острый гепатит. К плоду вирус попадает путем вертикальной передачи. При гепатите Е повышена частота самопроизвольных выкидышей. Диагноз заболевания основан на прямом выявлении вируса и определении специфических антител. Лечение острого гепатита Е проводят по общим принципам симптоматической терапии.
Гепатит G. Отмечается высокий инфекционный риск для новорожденного при данном заболевании. При наличии гепатита G у беременных в 33 % имеется вертикальная передача плоду и новорожденному. Однако у новорожденных до настоящего времени пока ни в одном случае не было выявлено клинических симптомов гепатита. НЕ обнаружено также наличие вируса в молоке, однако по аналогии с гепатитом С целесообразно воздержаться от кормления ребенка грудью. Диагноз устанавливают путем выявления вируса методом ПЦР. Лечение и профилактика острой и хронической форм вирусного гепатита G до сих пор окончательно не разработаны.
Грипп
Грипп, который может протекать у беременных в тяжелой форме, способен приводить к поражению эмбриона и плода. При данном заболевании может происходить самопроизвольное прерывание беременности, гибель плода, аномалии его развития. В результате инфекции возможно рождение недоношенных и функционально незрелых детей, а также детей с недостаточной массой тела.
Влияние вируса гриппа при внутриутробной инфекции обусловлено воздействием возбудителей на плаценту и плод, а также выраженной интоксикацией, повышенной температурой тела, нарушением маточно-плацентарного кровообращения с развитием в последующем гипоксии плода. Во время вспышек гриппа беременных следует иммунизировать поливалентной убитой вакциной.
Парвовирусная инфекция
Возбудителем инфекции является парвовирус В19 (ДНК-содержащий вирус, семейство парвовирусов, род эритровирусов), который вызывает системное заболевание — инфекционную эритему. Инфекция чаще передается воздушно-капельным путем. Особой опасности инфицирования подвержены лица, работающие в детских коллективах, а также имеющие детей в возрасте до 10 лет. Возможна также парентеральная передача при переливании крови или ее компонентов. При инфекции во время беременности вирус может передаваться трансплацентарно.
Во время беременности для клинической картины характерны кожная сыпь, боли в горле, артралгия, артрозы, транзиторная апластическая анемия, субфебрилитет. Беременность не влияет на течение заболевания. Однако при инфицировании во время беременности повышается вероятность преждевременного прерывания беременности и внутриутробного инфицирования плода. Частота передачи вируса плоду при острой инфекции — 33 %. Под влиянием вируса, воздействующего на эритроциты плода, у него снижается уровень гемоглобина. Развивающаяся при этом тяжелая анемия является причиной водянки, сердечно-сосудистой декомпенсации и смерти плода. Риск внутриутробной инфекции в III триместре уменьшается, что связано с формированием защитных сил организма плода. Возможно, что существует взаимосвязь между заболеванием инфекционной эритемой в I триместре и с различными аномалиями глаз плода.
Диагностика осуществляется путем использования ПЦР. Обнаружение специфических антител к вирусу в крови подтверждает диагноз. Обнаружение и IgG, и IgМ свидетельствует об острой инфекции, обнаружение только IgG подтверждает перенесенную в прошлом парвовирусную инфекцию. Специфического лечения заболевания не существует. Внутриматочную терапию концентратом эритроцитов проводят при уровне гемоглобина меньше 80 г/л. Перед лечением берут пробы крови с целью выявления ДНК парвовируса.
Коксаки-вирусная инфекция
При коксаки-вирусной инфекции внутриутробное инфицирование в I триместре беременности происходит редко. Однако, если это происходит, то могут сформироваться пороки развития желудочно-кишечного тракта, мочеполовой системы и центральной нервной системы. При инфицировании в поздние сроки беременности у новорожденного возможны такие проявления, как: лихорадка, отказ от еды, рвота, кожные высыпания, судороги. У некоторых новорожденных может отмечаться отит, назофарингит, пневмония.
ВИЧ-инфекция
Возбудителем является вирус иммунодефицита человека (ВИЧ) — РНК-содержащий вирус. Различают два типа ВИЧ — ВИЧ-1 и ВИЧ-2, которые приводят к развитию синдрома приобретенного иммунодефицита (СПИД). При ВИЧ-1-инфекции — у 20-40 %, а при ВИЧ-2-инфекции заболевание развивается у 4-10 % инфицированных. Это заболевание, связанное с выраженным нарушением Т-клеточного иммунитета у взрослых и Т- и В-клеточного иммунитета у детей. Источником инфекции являются больные СПИД-ом и вирусоносители. При этом срок вирусоносительства может быть очень длительным (годы). Вирус в основном распространяется половым путем, а также при трансфузии крови и ее компонентов. Плод может инфицироваться вследствие проникновения вируса через плаценту, а также во время родов и после родов через инфицированное молоко и при тесных бытовых контактах между матерью и новорожденным.
Течение ВИЧ-инфекции во время беременности может усугубляться в связи с естественным ослаблением иммунной защиты организма беременной. Наиболее частыми и выраженными осложнениями при ВИЧ-инфекции во время беременности являются: генитальный кандидоз; цервикальная неоплазия; преждевременные роды; преждевременный разрыв плодного пузыря; задержка развития плода; хориоамнионит. Наиболее опасным осложнением беременности является инфицирование плода ВИЧ-инфекцией, которое наблюдается в 30-60 % случаев независимо от наличия симптомов заболевания у матери. Заражение ВИЧ может происходить во время беременности, в родах и в послеродовом периоде. При этом возможны 3 пути переноса вируса к плоду.
Инфекция к плоду может передаваться через плаценту при ее повреждении вследствие фетоплацентарной недостаточности или при отслойке плаценты. Инфицирование возможно также при первичном заражении плаценты и накоплении вируса в клетках Гофбауэра с последующим размножением вируса и переходом его к плоду. Инфицирование плода может происходить и в родах при контакте слизистых оболочек плода с инфицированной кровью или выделениями родового канала. После родов инфицируется от 15 до 45 % детей от ВИЧ-инфицированных матерей. Большинство из этих женщин не знают о наличии у себя инфекции и в основном инфицируют детей при грудном вскармливании.
Заражение ВИЧ-инфекцией плода или новорожденного приводит к развитию у него иммунодефицита, который отличается от такового у взрослых. До 5 лет жизни СПИД развивается у 80 % детей, инфицированных ВИЧ во время беременности. Первыми признаками внутриутробной ВИЧ-инфекции являются недостаточная масса тела, гипотрофия и различная неврологическая симптоматика. Вскоре после рождения присоединяются: упорный понос, лимфаденопатия, увеличение печени и селезенки, грибковое поражение ротовой полости, задержка развития. Часто отмечаются пневмонии и рецидивирующие инфекции. Симптомы поражения центральной нервной системы связаны с диффузной энцефалопатией, атрофией мозжечка, микроцефалией, отложением внутричерепных кальцификатов.
Диагностика ВИЧ-инфекции основана на выявления факторов риска или клинических симптомов заболевания с подтверждением диагноза с помощью серологических тестов. Серологические исследования проводят с использованием твердофазного иммуноферментного анализа в сочетании с подтверждающими тестами. В настоящее время назначение беременным специфических противовирусных препаратов позволяет снизить риск внутриутробного инфицирования до 5-10 %. Таким противовирусным препаратом у беременных является зидовудин — аналог нуклеозидов ВИЧ.
ВИЧ-инфекция у пациентки, получающей противовирусные препараты, не является показанием для кесарева сечения у женщин, так как риск инфицирования плода при кесаревом сечении и естественных родах примерно одинаков. У ВИЧ-инфицированных женщин, не получавших терапии во время беременности, в настоящее время методом выбора является кесарево сечение. В случае ведения родов через естественные пути следует придерживаться правил ведения родов при любых вирусных инфекциях. Для предотвращения постнатального инфицирования естественное вскармливание при ВИЧ-инфекции противопоказано.
С целью сокращения случаев внутриутробного инфицирования проводят обязательное обследование всех беременных женщин на ВИЧ-инфекцию трижды за беременность: при постановке на учет, при сроке 24-28 недель и перед родами. Также рекомендуется обследование на ВИЧ половых партнеров беременных пациенток.
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Внутриутробная инфекция | Детская городская больница №17
Внутриутробная инфекция — болезнь плода или новорождённого, возникшая вследствие его антенатального или интранатального заражения возбудителем какого-либо инфекционного заболевания.
В настоящее время адекватные статистические данные по внутриутробным инфекциям отсутствуют. Однако существуют отдельные исследования, косвенно свидетельствующие о значительной распространённости внутриутробных инфекций. Та
к, в среднем у 33% женщин детородного возраста и у 60-80% пациенток, относимых к группе высокого риска, в слизи из цервикального канала обнаруживают цитомегаловирус и вирус простого герпеса. Нормальную влагалищную микрофлору выявляют менее чем у 50% беременных. В последнее десятилетие прослеживается отчётливая тенденция к увеличению доли внутриутробны
х инфекций в структуре перинатальной смертности (главным образом за счёт улучшения диагностики). Частота инфицирования в определённой степени зависит от эпидемиологической ситуации и особенно высока среди групп населения с низким социальным статусом.
При генерализованной внутриутробной инфекции прогноз неблагоприятен: летальность достигает 80%. У детей, выживших после тяжёлых форм менингоэнцефалита или фетального гепатита, формируется грубая задержка психомоторного развития или хронический гепатит соответственно. При локализованных формах внутриутробных инфекций прогноз главным образом зависит от нали
чия сопутствующих патологических состояний, своевременности и адекватности лечения. К наиболее тяжёлым последствиям приводит поражение ЦНС. Однако и при иной локализации процесса не исключено серьёзное поражение многих органов (кардиомиопатия, фиброэластоз эндокарда, интерстициальный нефрит, бронхо-лёгочная дисплазия с формированием хронической патологии органов дыхания, хронический гепатит с исходом в цирроз и т.п.). Мало- или бессимптомное течение внутриутробных инфекций в дальнейшем приводит к развитию отсроченной патологии.
Источник: Детские болезни. Баранов А.А. // 2002.
Внутриутробные инфекции. Причины возникновения и профилактика. | Наталья Порядина
В медицинской практике, под внутриутробной инфекцией понимается целая группа болезней плода и новорожденного, которые развиваются вследствие инфицирования в дородовом периоде или непосредственно в родах.
Подобные инфекции могут спровоцировать гибель плода, самопроизвольный аборт, задержку в росте и развитии плода, поражение его центральной нервной системы.
В акушерской практике, проблема внутриутробных инфекций до сих пор актуальна и является сложной, требующей использования многих методов исследования на разных сроках беременности, и сложного лечения.
Что такое внутриутробные инфекции и основные причины их возникновения
Статистика показывает, что около 10% новорожденных подвержены внутриутробному инфицированию, и должна быть выяснена основная причина их возникновения. Как правило, основной источник инфекции – сама мать, а инфекция может передаваться через околоплодные воды, через плаценту, аспирационным или контактным путями. Как правило, основной причиной инфицирования будут именно вирусные агенты, например, вирусы краснухи, герпеса, цитомегаловирус, гепатит В и С, ВИЧ и др.
В периоде от начала родов до их логического завершения, причиной инфицирования будут микробы родовых путей, а степень и характер последующих проявлений, будет зависеть от состава микрофлоры родовых путей матери. Среди наиболее вероятных инфекций, будут стрептококки, энтеробактерии, синегнойные палочки, протей.
Есть женщины из группы риска, у которых вероятность развития внутриутробных инфекций будет выше. Это женщины с отягощенным акушерско-гинекологическим анамнезом, с осложнениями беременности, с угрозой ее прерывания и инфекциями у матери. Риск инфицирования уже после рождения повышен у недоношенных малышей.
На степень тяжести клинических симптомов будут влиять срок инфицирования и конкретный вид возбудителя. В случае, если инфицирование происходит на сроке 8 – 10 недель внутриутробного развития, беременность чаще заканчивается самопроизвольным абортом.
Внутриутробное инфицирование на сроке до 12 недель гестации, может стать причиной мертворождения или формирования сложных пороков развития. Внутриутробное инфицирование плода во втором и третьем триместре, заканчивается поражением отдельных органов либо развитием генерализованной инфекции.
Виды внутриутробной инфекции
Все виды инфекций, принято классифицировать на три типа:
• Вирусные, например, гепатиты, герпес, краснуха, ОРВИ, энтеровирус и др.;
• Бактериальные, например, туберкулез, сифилис, сепсис и др.;
• Паразитарные или грибковые – микоплазма, токсоплазма, молочница и др.
Для диагностики конкретной инфекции, в клинической практике используются различные виды лабораторной диагностики, например, ПЦР – и TORCH –анализ, позволяющий выявить ряд наиболее опасных и типичных инфекций, угрожающих беременности.
Как проявляется внутриутробная инфекция?
Наличие внутриутробной инфекции может быть заподозрено уже во время родов, когда начинают изливаться мутные околоплодные воды, загрязненные меконием и с неприятным запахом. Сказать о наличии инфицирования может и состояние плаценты.
У рожденных детей часто диагностируется гипоксия, вплоть до асфиксии, увеличенная печень, пороки развития, микро- и гидроцефалия. Практически с самого рождения у ребенка отмечается желтуха, появляется красная сыпь, похожая на розеолезную, отмечается судорожный синдром, респираторные расстройства. В первые дни после рождения нередко диагностируется пневмония, миокардиты, анемии, геморрагический синдром.
При инструментальном исследовании у новорожденного обнаруживается катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты в головном мозге. В дальнейшем, новорожденные часто и обильно срыгивают, характерна мышечная слабость, угнетенное состояние центральной нервной системы. В последующем этапе, после длительного инкубационного периода, могут развиваться поздние менингиты, энцефалиты и остеомиелит (микробно-гнойное воспаление костей). Кроме общих симптомов, для каждой инфекции будут характерны конкретные симптомы и последствия.
Врожденный токсоплазмоз
Внутриутробное поражение плода токсоплазмой становится причиной тяжелых последствий – задержка развития, врожденные пороки развития головного мозга, глаз, сердца. После рождения ребенка, в остром периоде инфекции, основные симптомы – лихорадка, желтуха, отечный синдром, геморрагия, судороги, нефриты и пневмония. К поздним осложнениям врожденного токсоплазмоза относят олигофрению, эпилепсию или слепоту.
Врожденная краснуха
Внутриутробное поражение вирусом плода может возникнуть, только если женщина перенесла краснуху в это время. Риск заражения и его последствия будут напрямую зависеть от срока беременности. До 8 недель беременности, риск инфицирования составляет 80% и заканчивается (чаще) самопроизвольным абортом. Во втором и третьем триместре вероятность инфицирования существенно ниже от 10 – 3%. Но детки рождаются раньше положенного срока, с низким весом, геморрагической сыпью и длительной желтухой. Классическими проявлениями краснухи будет триада симптомов:
• Поражение глаз;
• Открытый артериальный проток;
• Поражение слухового нерва.
Врожденная герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в разных формах:
• Генерализованная – с выраженным токсикозом, респираторными синдромами, желтухой, пневмонией и геморрагическим синдромом.
• Неврологическая форма характеризуется проявлениями энцефалита и менингоэнцефалитом.
• слизисто-кожная – везикулярная сыпь на коже, слизистых оболочках.
Внутриутробная герпес-инфекция приводит к формированию пороков развития – микроцефалия, ретинопатия, гипоплазия конечностей. К числу поздних осложнений врожденного герпеса относят глухоту, слепоту, задержку психомоторного развития.
Опасной, герпетическая инфекция для течения беременности и плода, может быть только в случае, если инфицирование матери произошло именно в этот период, что к счастью, бывает крайне редко. Как правило, к моменту беременности, в крови матери уже есть антитела, которые защищают плод от инфицирования.
Лечение и профилактика внутриутробной инфекции
Основные принципы лечения сводятся к назначению иммуно-, противовирусной и антибактериальной терапии. Но всегда легче предупреждать внутриутробную инфекцию, чем заниматься ее лечением. Главное правило профилактики – подготовка к беременности, лечение и профилактика заболеваний, передающихся половым путем, исключение контакта беременной с потенциальными больными. Женщины из групп риска заслуживают особого и пристального внимания.
Все женщины, которые ранее не болели краснухой, должны пройти курс вакцинопрофилактики, не позднее, чем за 3 месяца до момента оплодотворения. Иногда, наличие внутриутробных инфекций может стать показанием для прерывания беременности.
Внутриутробные инфекции — причины, симптомы, диагностика и лечение
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.
Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.
Внутриутробные инфекции
Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном — аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
На тяжесть клинических проявлений внутриутробной инфекции влияют сроки инфицирования и вид возбудителя. Так, если инфицирование происходит в первые 8-10 недель эмбриогенеза, беременность обычно заканчивается самопроизвольным выкидышем. Внутриутробные инфекции, возникшие в раннем фетальном периоде (до 12 недели гестации), могут приводить к мертворождению или формированию грубых пороков развития. Внутриутробное инфицирование плода во II и III триместре беременности проявляется поражением отдельных органов (миокардитом, гепатитом, менингитом, менингоэнцефалитом) либо генерализованной инфекцией.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых — вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития — микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса — энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Советы для пациентов
Права граждан Республики Беларусь в области охраны здоровья по профилактике инфекционных заболеваний.
Право на охрану здоровья регламентируется Конституцией Республики Беларусь, ст. 45 «Гражданам Республики Беларусь гарантируется право на охрану здоровья, включая бесплатное лечение в государственных учреждениях здравоохранения. Государство создает условия доступного для всех граждан медицинского обслуживания».
Каждый гражданин Республики Беларусь обязан беспокоиться о сохранении своего здоровья. Государство предоставляет каждому возможность защитить себя от заражения инфекционными заболеваниями.
Вакцины – имеют в нашей стране статус лекарственных средств (Закон «О Лекарственных средствах»), предназначенных для профилактики инфекционных заболеваний и относятся к группе иммунобиологических лекарственных средств (далее – ИЛС). Каждая партия вакцины, поступающая в страну, проходит тщательную проверку качества.
Вакцины – это ИЛС, предназначенные для проведения профилактики инфекционных заболеваний у здоровых людей, поэтому и требования к их качеству жесткие, соответствующие международным стандартам безопасности.
В стране функционирует система надзора за регистрацией побочных реакций после применения вакцин, предусматривающая учет и расследование серьёзных побочных реакций.
Для предотвращения возникновения побочных реакций проводится комплекс мероприятий, направленных на исключение вероятности ненадлежащего использования вакцин. Эта система включает следующие компонеты:
1. Вакцины, применяемые для иммунизации населения – на территории Республики Беларусь используются только зарегистрированные и/или разрешенные к применению в установленном порядке ИЛС.
2. Порядок назначения ИЛС, проведения профилактических прививок и наблюдения за пациентом после их проведения.
Профилактические прививки – введение в организм пациента ИЛС для создания специфической невосприимчивости к инфекционным заболеваниям.
Профилактические прививки назначает врач-специалист: врач-терапевт, врач общей практики, врач-педиатр при обращении пациентов за оказанием медицинской помощи с учетом показаний и противопоказаний к их проведению, в строгом соответствии с инструкцией, прилагаемой к ИЛС. В детском возрасте проводятся прививки против: гепатита В, туберкулёза, дифтерии, столбняка, коклюша, полиомиелита, пневмококковой и гемофильной инфекций, кори, краснухи, эпидемического паротита. Взрослым в обязательном порядке необходимо повторное введение вакцин против дифтерии и столбняка. Кроме того некоторые категории граждан имеют право на бесплатную вакцинацию против вирусного гепатита В, гриппа.
Сведения о профилактических прививках вносятся в медицинскую документацию. Уточнить сведения о прививочном статусе можно в территориальной организации здравоохранения по месту жительства.
При обращении за медицинской помощью в территориальную организацию здравоохранения пациент имеет право уточнить свой прививочный статус и уточнить необходимость проведения профилактических прививок в соответствии с возрастом.
Вакцинация населения Республики Беларусь осуществляется в рамках оказания медицинской помощи гражданам. Услуга «вакцинация» входит в стандарт оказания медицинской амбулаторно-поликлинической помощи населению и осуществляется бесплатно в соответствии с Национальным календарем профилактических прививок (далее – Национальный календарь).
3. Календарь профилактических прививок. В 1974 году Всемирная организация здравоохранения (далее – ВОЗ) начала осуществлять крупную международную акцию, которая получила название Расширенная Программа Иммунизации (РПИ), с целью обеспечения своевременной и полной вакцинации детей против наиболее важных инфекционных болезней. В 2012 году 194-ми государствами-членами Всемирной ассамблеи здравоохранения был утвержден Глобальный план действий в отношении вакцин (ГПДВ), целью которого является претворение в жизнь концепции Десятилетия вакцин за счет обеспечения всеобщего доступа к иммунизации.
ГПДВ направлен на укрепление плановой иммунизации для достижения следующих целей:
- достижение целевых показателей по охвату вакцинацией;
- наращивание темпов борьбы с болезнями, предотвратимыми с помощью вакцин, и первым рубежом этой борьбы является ликвидация полиомиелита;
- внедрение новых и улучшенных вакцин;
- внедрение разработок для получения вакцин и технологий следующего поколения.
Национальный календарь профилактических прививок (далее – Национальный календарь) включает 12 инфекций: гемофильная инфекция, гепатит В, дифтерия, коклюш, корь, краснуха, полиомиелит, столбняк, туберкулез, эпидемический паротит – всем лицам в указанном возрасте, а также грипп, пневмококковая инфекция – контингентам риска. В Республике Беларусь регламентировано проведение профилактических прививок по эпидемическим показаниям против 18 инфекций.
4. Финансирование. В Республике Беларусь проведение иммунизации в рамках Национального календаря полностью финансируется государством. Кроме того, бесплатно проводятся профилактические прививки по эпидемическим показаниям для «групп риска» (против бешенства, против кори в очагах инфекции, против желтой лихорадки, против гепатита В для медработников, против гриппа и пр.). По желанию граждан вакцинацию против инфекций, не входящих в Национальный календарь, можно провести за счет собственных средств граждан в организациях здравоохранения.
5. Согласие и отказ от профилактических прививок.
В соответствии со ст. 44 Закона РБ «О здравоохранении» согласие на иммунизацию (как простое медицинское вмешательство) дается пациентом или в отношении несовершеннолетних – одним из родителей, усыновителей, опекунов, попечителей (далее – законные представители) устно, а медицинским работником делается отметка в медицинской документации пациента.
Вместе с тем, в соответствии со ст. 45 Закона РБ «О здравоохранении» пациент или его законный представитель имеет право отказаться от проведения прививки. В этом случае лечащим врачом в доступной форме разъясняются возможные последствия отказа, отказ оформляется записью в медицинской документации пациента, подписывается лечащим врачом и пациентом, которому должны быть разъяснены возможные последствия отказа.
Если все же у Вас возникают сомнения в необходимости проведения профилактических прививок, не спешите оформлять отказ. Не забывайте, что именно Вы несете ответственность за свое здоровье и здоровье Вашего ребенка.
По данным ВОЗ:
- в 2017 году было вакцинировано 116,2 миллиона детей, что стало беспрецедентным показателем за всю историю;
- с 2010 года новые вакцины были внедрены в 113 странах, при этом число вакцинированных детей увеличилось на 20 миллионов;
- с 2002 года Европейский регион ВОЗ сертифицирован как свободный от полиомиелита, а число случаев кори снизилось на 90%;
- по различным причинам 19,9 миллионов детей в возрасте до одного года не были охвачены вакциной КДС-3.
Основные факты об иммунизации.
- Иммунизация спасает жизни людей.
Плановая иммунизация против таких болезней, как полиомиелит, столбняк, дифтерия, коклюш, корь ежегодно спасает жизни от 2 до 3 миллионов человек во всем мире. Кроме того, она предотвращает миллионы людей от тяжелых страданий, связанных с изнурительными болезнями и пожизненной инвалидностью.
Вакцины способны не только спасать, но и преобразовывать жизнь людей, предоставляя детям возможности для здорового развития, посещения школ и улучшения их жизненных перспектив.
С помощью вакцин можно ограничить распространение устойчивости к антибиотикам. Глобальный рост заболеваемости, вызванный бактериями с устойчивостью к лекарственным средствам в результате чрезмерного использования антибиотиков и злоупотребления ими, является серьезной проблемой здравоохранения. Иммунизация является очень действенным способом остановить инфицирование населения и, тем самым, исключить потребность в антибиотиках. Повышение эффективности вакцинации и разработка новых вакцин являются неотъемлемой частью борьбы с устойчивостью к антибиотикам и сокращения числа предотвратимых заболеваний и случаев смерти.
2. Вспышки инфекционных заболеваний создают постоянную серьезную угрозу, продолжают уносить жизни людей, многих оставляют инвалидами.
Вакцинация позволяет предотвращать страдания, инвалидность и смерть от болезней, предотвратимых с помощью вакцин. Вместе с тем, как это ни парадоксально, но тот факт, что благодаря эффективным программам вакцинации многие инфекционные болезни стали редкими или практически совсем исчезли, может способствовать распространению среди родителей мнения о том, что иммунизация больше не является необходимой, что она более опасна, чем сама болезнь. Эти ошибочные представления привели к значительному снижению уровней охвата и возвращению таких болезней, как дифтерия, корь, коклюш, полиомиелит. Вспышки болезней затрагивают каждого человека.
Корь
Число таких заболеваний, как корь, статистически значительно снизилось, но даже в странах с высоким уровнем охвата профилактическими прививками вспышки поражают группы непривитых лиц. В 2016 г. Американский регион ВОЗ стал первым в мире регионом, в котором была элиминирована корь. Это достижение – результат 22-х лет работы и массовой вакцинации населения стран Америки против кори, краснухи и эпидемического паротита.
По данным ВОЗ в странах Европейского региона (53 страны) в
2018 г. зарегистрировано более 80-ти тысяч случаев заболевания корью, из них более 70 закончились летальным исходом. Основная доля заболеваний корью принадлежит Украине, где в 2018 г. корью переболело более 53 тысяч человек, в том числе 16 с летальным исходом. Напряженная ситуация отмечалась в Сербии (4 175 случаев, включая 15 летальных), Израиле (3 119 случаев, включая 2 летальных), Франции (2 913 случаев, включая 3 летальных), Италии (2 517 случаев, включая 8 летальных), Грузии (2 203 случая), Греции (2 193 случая, включая 2 летальных), Российской Федерации (2 256 случаев), Албании (1 466 случаев), Румынии (1 087 случаев).
По результатам заключения Европейской региональной комиссии по верификации элиминации кори с 2012 г. Республика Беларусь отнесена к группе стран, где данная инфекция элиминирована.
В 2018 г. в 7-ми регионах Республики Беларусь было зарегистрировано 259 случаев кори, из них 74% у взрослых. В подавляющем большинстве – это завозные случаи (большинство из Украины) и случаи у контактных с заболевшими лицами. Более 73 % заболевших корью лиц были не привиты (в том числе по причине отказа от вакцинации) или не полностью привиты против кори. Распространение заболевания было предотвращено благодаря поддержанию высокого уровня охвата профилактическими прививками против кори населения, а также своевременно и в полном объеме проведенным санитарно-противоэпидемическим мероприятиям.
Полиомиелит
Ситуация по полиомиелиту в мире в 2018 г. оставалась достаточно стабильной. За последние пять лет в мире уменьшилось количество зарегистрированных случаев паралитического полиомиелита: с 359 случаев в 2014 г. до 33 случаев в 2018 г. Имеются основания говорить о том, что из трех штаммов дикого полиовируса уже элиминировано два. Индия и весь Регион стран Юго-Восточной Азии ВОЗ были объявлены свободными от полиомиелита, а вспышки, начавшиеся в 2013-2014 гг. на Ближнем Востоке и в районе Африканского Рога, были остановлены.
За 2018 г. все случаи паралитического полиомиелита были зарегистрированы в двух эндемичных странах: Афганистан (21 случай) и Пакистан (12 случаев). Также эндемичной по полиомиелиту остается Нигерия, где случаев паралитического полиомиелита в 2017-2018 гг. не зарегистрировано.
С 2002 года Республика Беларусь входит в список стран свободных от полиомиелита.
В 2018 г. рекомендованный показатель регистрации случаев неполиомиелитных ОВП (не менее 1 на 100 тысяч детей до 15 лет) достигнут во всех регионах республики и составил от 1,6 до 3,3 на 100 тысяч возрастного контингента.
Острые респираторные инфекции, грипп
Острые респираторные инфекции (далее – ОРИ) и грипп, остаются одной из самых актуальных медицинских и социально-экономических проблем. В структуре ежегодно регистрируемых в Республике Беларусь инфекционных заболеваний (3,3-3,5 миллионов случаев) на долю ОРИ и гриппа приходится около 97%.
Прошедший сезон заболеваемости гриппом 2017-2018 гг. характеризовался умеренным эпидемическим подъемом заболеваемости.
Для обеспечения эпидемиологического благополучия в сентябре-ноябре 2017 г. проведена кампания вакцинации населения против гриппа, по результатам которой специфическую защиту от гриппа получило 40,5% населения Республики Беларусь (более 3,7 миллионов человек), в том числе:
- за счет средств республиканского и местных бюджетов вакцинировано 32,4% населения;
- за счет средств предприятий, организаций и личных средств граждан 8,1% населения.
Охват профилактическими прививками населения из групп повышенного риска неблагоприятных последствий заболевания гриппом достиг регламентируемого уровня (не менее 75%) и составил 75,3% от численности данного контингента.
Выполнена задача по вакцинации не менее 75% от численности медицинских работников (привито 84,3% от численности контингента), лиц из учреждений с круглосуточным пребыванием детей и взрослых (привито 82,9%), работников служб по обеспечению жизнедеятельности и безопасности государства (привито 78,5%).
Анализ данных о заболеваемости гриппом среди привитого и непривитого населения в эпидемический период активности респираторных вирусов в 2018 г. показал высокую эффективность мероприятий, направленных на профилактику и снижение заболеваемости среди населения.
Забота о здоровье граждан – это не только обязанность государства, но и в первую очередь руководителей предприятий и самих граждан, которые также должны быть заинтересованы в предотвращении гриппа методами, подтвердившими свою эффективность и безопасность.
3. Болезни, предупреждаемые вакцинацией, можно победить и ликвидировать.
При стабильном и высоком уровне охвата вакцинацией показатели заболеваемости снижаются, и болезни могут быть даже полностью ликвидированы. Натуральная оспа, от которой ежегодно погибало 5 миллионов человек во всем мире. Последний случай оспы был зарегистрирован 25 октября в 1977 г. в Сомали, а в 1980 г. на XXXIII сессии Ассамблеи ВОЗ было официально объявлено о ликвидации натуральной оспы во всем мире. И сегодня об этой болезни уже почти все забыли.
В XIX веке и первой половине ХХ века эпидемии полиомиелита свирепствовали в Европе и США. За один только 1916 год полиомиелитом в США заразились 27 тысяч человек. После широкого применения полиомиелитной вакцины во многих промышленно развитых странах заболеваемость резко сократилась. В 2002 г. ВОЗ провозгласила Европейский регион свободным от полиомиелита, и задача полной ликвидации полиомиелита во всем мире в настоящее время близка к достижению.
Благодаря иммунизации почти ликвидированы эпидемии менингита А в Африке. Менингит А – инфекция, которая может вызывать тяжелое поражение мозга и нередко заканчивается смертельным исходом. С тех пор, как в декабре 2010 г. в Африке начала применяться вакцина против менингита А, массовые кампании вакцинации позволили поставить под контроль и практически элиминировать заболеваемость смертельно опасным менингитом А в 26 африканских странах так называемого «менингитного пояса». В настоящее время вакцина внедряется в национальные программы плановой иммунизации.
4. Иммунизация является эффективной мерой с точки зрения затрат.
Иммунизация, несомненно, является одной из наиболее эффективных и экономически целесообразных мер медицинского вмешательства, существующих в настоящее время. Она является одной из немногих мер, требующих небольших затрат, но обеспечивающих получение значительных положительных результатов для здоровья и благополучия всего населения. Ежегодно иммунизация спасает миллионы жизней, предотвращая случаи смерти и инвалидности, связанные с инфекционными заболеваниями, хотя затраты на нее намного ниже, чем стоимость лечения.
За последние годы финансовое бремя, связанное с заболеваемостью, значительно снизилось в большинстве государств-членов. Каждый доллар США, израсходованный на вакцину против кори-паротита-краснухи, экономит более 21 долларов США в качестве прямых затрат на оказание медицинской помощи. Согласно оценкам, проведенным в ходе анализа затрат, связанных со вспышкой кори в Западной Европе в 2002-2003 гг., прямые издержки составили 9,9-12,4 миллионов евро, что равно сумме, необходимой для вакцинации 1 358 100 детей двумя дозами вакцины при уровне охвата 95%.
По данным экономистов, на 1 доллар, потраченный на вакцинацию против краснухи, приходится 7,7 долларов, которые надо было бы потратить на борьбу с самим заболеванием. Расходы на ребенка с синдромом врожденной краснухи (СВК) в течение его жизни в среднем составляют более 200 тысяч долларов США. В эту сумму входят расходы на содержание детей с тяжелыми патологиями (врожденная глухота, катаракта, психическая неполноценность, физические уродства), а также на обучение детей и подростков с нарушениями зрения и слуха.
Поскольку иммунизация способствует предупреждению заболеваний, она обеспечивает значительную, хотя и не поддающуюся оценке, экономию средств в отношении производительности труда, трудоспособности и доступа к образованию, а также снижения расходов на лечение болезней, поддающихся предупреждению.
5. Успехи и достижения иммунопрофилактики в ХХ-XXI вв.
Благодаря успешно проводимым программам иммунизации, в нашей стране сохраняется стабильная ситуация по ряду инфекций, управляемых средствами вакцинопрофилактики:
|
Инфекция |
Год начала проведения массовой иммунизации |
Число заболеваний в довакцинальном периоде |
Число случаев за 2018 год в Республике Беларусь |
|---|---|---|---|
|
Натуральная оспа |
1798/1918 |
102 000 |
ликвидирована |
|
Полиомиелит |
1959 |
1 000 |
элиминирован |
|
Корь |
1967 |
58 620 (1966 г.) |
259 |
|
Дифтерия |
1957 |
11 367 (1956 г.) |
0 |
|
Столбняк |
1957 |
67 (1955 г.) |
0 |
|
Краснуха |
1967/1995 |
65 562 (1994 г.) |
0 |
|
Туберкулёз |
1963 |
11 187 |
1 855 |
|
Коклюш |
1957 |
17 880 |
648 |
|
Эпидемический паротит |
1963/1974 |
32 526 (1973 г.) |
1 |
|
Вирусный гепатит В (острая форма) |
1996 |
1 687 |
66 |
В ближайшем будущем, несмотря на развитие систем здравоохранения, появление новейших средств и способов диагностики, лечения и профилактики, инфекционные заболевания будут существовать. Их распространению будут способствовать вооруженные конфликты, экономические кризисы, глобальные миграционные процессы, изменения климата и т.д.
Поэтому создание и совершенствование вакцин против инфекционных заболеваний – одно из главных направлений развития медицины.
Сейчас разрабатываются вакцины против возбудителя язвенной болезни (Helicobacter pylori), грибковых заболеваний (грибы рода Candida), вирусов герпеса и папилломы человека, ВИЧ-инфекции.
В нескольких странах была лицензирована новая вакцина против лихорадки Денге, а в 3-х африканских странах началась апробация первой вакцины для защиты детей от малярии. Также увеличилось число вакцин, находящихся в разработке на стадии клинических испытаний.
Информация для населения, которая может быть использована при подготовке информационно-образовательных материалов (брошюры, памятки, буклеты) к Европейской неделе иммунизации
Корь
Корь – это крайне заразная болезнь, которую вызывает вирус, распространяющийся посредством кашля и чихания при тесном или непосредственном контакте с инфицированными выделениями из носоглотки больного. Заболевший может распространять вирус, начиная с четвертого дня до появления сыпи и в течение четырех дней с момента ее появления.
Признаки и симптомы:
Ранние признаки включают:
высокую температуру, насморк, кашель, воспаленные глаза, слезотечение, мелкие белые пятнышки, которые развиваются на первичной стадии на внутренней стороне щек.
Через несколько дней появляется сыть обычно на лице и верхней части шеи. Сыпь распространяется, в конце концов, достигая рук и ног, держится пять-шесть дней, затем подсыхает.
Самыми серьезными осложнениями являются:
- слепота,
- энцефалит (инфекция, которая вызывает отёчность мозга),
- острая диарея и последующее обезвоживание,
- ушные инфекции,
- серьезные респираторные инфекции, такие как пневмония.
В большинстве тяжелых случаев кори, осложнения могут привести к летальному исходу.
Краснуха
Краснуха – это вирусное заболевание, которое передается при контакте с заболевшим посредством кашля и чихания. Болезнь особенно заразна в период наличия сыпи, но может передаваться и в течение 7 дней до момента появления сыпи. Лица при отсутствии симптомов, все равно могут распространять краснуху.
Признаки и симптомы:
Краснуха может начинаться с легкой лихорадки в течение 1-2 дней, болезненности и увеличения лимфатических узлов обычно с задней стороны шеи и за ушами. Далее на лице появляется сыпь, которая распространяется ниже. Однако некоторые заболевшие краснухой не имеют никаких симптомов.
У детей краснуха обычно проходит в легкой форме, хотя в редких случаях могут возникнуть серьезные проблемы. Сюда входят менингит и кровотечения. Краснуха особенно опасна для плода, если заболевает женщина в период беременности. Синдром врожденной краснухи может стать причиной выкидыша или врожденных дефектов развития, таких как глухота, отставание в психическом развитии и развитии таких органов, как сердце.
Эпидемический паротит
Эпидемический паротит (свинка) передается при вдыхании вируса, выделяемого в воздух при кашле или чихании заболевшим. Вирус может передаваться также через слюну. Паротит может распространяться до появления клинических симптомов и в течение пяти дней после.
Признаки и симптомы:
Обычные симптомы паротита включают: температуру, потерю аппетита, утомляемость, мышечные боли, головную боль, за которыми следует увеличение околоушной слюнной железы или подчелюстных желез. У некоторых болезнь, протекает бессимптомно.
У большинства детей паротит протекает в легкой форме, однако заболевание может стать причиной серьезных проблем, таких как менингит и глухота. В редких случаях паротит может привести к летальному исходу.
Полиомиелит
Причиной полиомиелита является вирус, который поражает нервную систему. Вирус попадает в организм через рот и размножается в кишечнике. Передается фекально-оральным путем. Источником инфекции чаще всего становится пища или питьевая вода. Способствующие факторы: несоблюдение правил личной гигиены, плохие санитарные условия или недостаточный контроль за сточными водами. Вирус полиомиелита также распространяется при кашле и чихании.
Признаки и симптомы:
Симптомы на начальной стадии включают:
- температуру,
- утомляемость,
- головную боль,
- рвоту,
- ригидность шеи и боль в конечностях.
Полиомиелит, в основном, поражает детей, но может также привести к параличу у подростков и взрослых, не обладающих иммунитетом.
Полиомиелит может вызвать полный паралич в течение нескольких часов, так как болезнь поражает спинной и/или головной мозг. Такой паралич может быть необратимым. В случае паралича может возникнуть неподвижность дыхательных мышц, что приводит к смерти. Специфического лечения против полиомиелита не существует.
Дифтерия
Дифтерия – острая инфекционная болезнь, возникающая в результате попадания в организм Corynebacterium diphtheria и выделения дифтерийного токсина, характеризующаяся острым воспалением верхних дыхательных путей, преимущественно ротоглотки (примерно 90% случаев), носа. Возможно поражение кожи в местах ее повреждения, глаз или половых органов.
Характерной особенностью заболевания является возможность формирования так называемого носительства возбудителя дифтерии, когда симптоматика отсутствует или минимальна и практически не доставляет проблем человеку.
Передаётся возбудитель инфекции от человека к человеку воздушно-капельным путём при чихании, кашле, разговоре. Возможна передача возбудителя контактно-бытовым путем через предметы обихода и возникновение кожных форм дифтерии, что чаще отмечается в странах с жарким климатом. Инкубационный период дифтерии длится от 2 до 10 дней.
Признаки и симптомы:
высокая температура, слабость, боли в горле при глотании.
Дифтерийный токсин вызывает образование болезненных плотных пленок (скопление некротизированных тканей) на задней стенке горла и на миндалинах, затрудняя глотание и дыхание, приводя к развитию так называемого дифтерийного крупа, кроме того, поражает нервную, сердечно-сосудистую и выделительную системы, тем самым представляя опасность для здоровья и жизни.
Единственным способом лечения дифтерии, позволяющим добиться выздоровления и избежать необратимых последствий вплоть до летального исхода, является безотлагательное введение противодифтерийной сыворотки. Вакцинация против дифтерии и даже перенесенное заболевание не приводит к формированию стойкого пожизненного иммунитета, со временем происходит его угасание. Поэтому вакцинация против дифтерии проводится на протяжении всей жизни человека.
Столбняк
Инфекционное заболевание, вызываемое токсигенными бактериями Clostridium tetani, не передается от человека к человеку.
Важной особенностью возбудителя является его способность образовывать споры, которые могут сохранять жизнеспособность годами. Споры бактерии обнаруживаются в окружающей среде – в почве, на поверхности ржавых инструментов, в фекалиях животных, человека.
Споры возбудителя столбняка могут попасть в организм человека через повреждения на коже: ссадины, царапины, раны или укусы животных, при ожогах, обморожениях, через пупочную ранку у новорожденных.
Инкубационный период столбняка длится от 3 до 21 дня после инфицирования (в среднем, 14 дней).
Признаки и симптомы:
Болезнь начинается с общей слабости, раздражительности, головной боли, тянущие боли вокруг раны, ригидность затылочных мышц.
Первым и наиболее часто встречающимся симптомом является тоническое напряжение (тризм) жевательных мышц с затруднением открывания рта. Следом за тризмом появляются другие признаки столбняка, образующие классическую триаду: «сардоническая улыбка» вследствие спазма мимической мускулатуры и дисфагия (нарушение глотания) в результате сокращения мышц глотки.
Поражение мускулатуры идет по нисходящему типу. Впоследствии судороги охватывают все мышцы туловища, от чего больной выгибается дугой.
При заболевании столбняком требуется неотложная медицинская помощь в условиях больничных организаций здравоохранения.
От 1 до 8 человек из 10 заболевших столбняком умирает от остановки дыхания, а в случае выздоровления длительное время сохраняются нарушения речи и памяти;
После перенесенного заболевания иммунитет против столбняка нестойкий и непродолжительный, возможно повторное инфицирование.
Способ специфической профилактики столбняка только один – вакцинация столбнячным анатоксином.
Заболевания, вызываемые гемофильной инфекцией типа b (Hib)
Гемофильная инфекция типа b вызывается бактерией. Обычно бактерии находятся в носоглотке человека и не вызывают заболевание. Но, при определенных условиях, если бактерии попадают в легкие или в кровь, человек может заболеть. Болезнь распространяется при кашле и чихании от заболевшего.
Признаки и симптомы:
Симптомы заболевания зависят от того, какая часть тела поражена. Температура характерна для всех форм заболевания:
- менингит (воспаление оболочек головного и спинного мозга),
- эпиглоттит (отек надгортанника на задней стенке глотки),
- пневмония (воспаление легких),
- остеомиелит (воспаление костей и суставов),
- целлюлит (воспаление подкожной клетчатки, обычно на лице).
Заболевание может развиваться быстро, а менингит и эпиглоттит могут привести к летальному исходу. Большинство детей с этим заболеванием нуждаются в госпитализации. Даже при условии лечения остается риск летального исхода или инвалидизации.
Пневмококковая инфекция
Бактерия Streptococcus pneumoniae вызывает пневмококковое заболевание. Заболевание распространяется воздушно-капельным путем при кашле или чихании от заболевшего человека или человека, который является носителем бактерии.
Признаки и симптомы:
Существует много видов пневмококковой инфекции, и симптомы зависят от того, какая система организма поражена. Пневмония является наиболее распространенной и тяжелой формой заболевания. Для нее характерны следующие признаки: температура, озноб, кашель, учащенное или затрудненное дыхание, боль в грудной клетке.
Еще одной серьезной формой заболевания является вызванный пневмококковой инфекцией менингит, который представляет собой поражение оболочек головного и спинною мозга. Симптомами менингита являются: ригидность затылочных мышц, температура, головная боль и резь в глазах от яркого света. Менингит, вызванный пневмококком, приводит к длительной потере трудоспособности или смерти. Пневмококковые инфекции иногда трудно поддаются лечению, особенно из-за того, что некоторые бактерии устойчивы к антибиотикам.
Внутриутробная инфекция у новорожденных: причины и последствия
По статистическим данным приблизительно 10-15% новорожденных подвержены внутриутробному инфицированию. Актуальность данной проблемы обусловлена высокой частотой репродуктивных потерь, ранней неонатальной заболеваемостью, нередко приводящей к инвалидности и смертности.
Внутриутробная инфекция (ВУИ) – это заражение плода или новорожденного патогенными микроорганизмами (вирусами, бактериями, грибами, простейшими) в результате передачи их ребенку от больной матери, но при этом у него отсутствуют какие-либо симптомы заболевания.
ВУИ является достаточно тяжелой патологией, что в большинстве случаев определяет уровень смертности новорожденных. Согласно научным данным, этиологическим фактором внезапной смерти только что родившихся детей, является именно инфекция, которая протекает, как правило, без явной симптоматики.
Пути передачи инфекции:
- Гематогенный, то есть через кровь.
- Восходящий, то есть от области наружных половых органов и уретры в полость матки.
- Нисходящий, то есть из воспаленных придатков в маточную полость.
- Интранатальный, то есть в процессе прохождения плода по родовым путям.
- Смешанный.
Данный диагноз устанавливается на основании лабораторного исследования крови, спинномозговой жидкости и выявления в них иммуноглобулинов класса М и низкоавидных иммуноглобулинов класса G в крови, взятой из пуповины.
Причины ВУИ
- Воспалительные и инфекционные заболевания органов мочеполовой системы беременной женщины: уретрит, цистит, оофорит, аднексит, пиелонефрит, сальпингит, сифилис, гонорея, ВИЧ.
- Перенесенные заболевания органов дыхательной системы женщины: ОРВИ, ОРЗ, ангина, фарингит, тонзиллит, грипп, пневмония, герпес.
- Преэклампсия, эклампсия во время беременности.
- Угроза самопроизвольного прерывания беременности.
- Нарушение функции маточно-плацентарного барьера.
- Рождение ребенка на сроке до 37 недель.
- Врожденная патология центральной нервной системы у плода.
- Осложненное течение интранатального периода.
- Ятрогенное инфицирование плода во время проведения инвазивных процедур: биопсия ворсин хориона, амниоцентез, кордоцентез.
Внутриутробная инфекция новорожденного довольно тяжелое патологическое состояние, которое способно вызвать самые негативные последствия и опасные осложнения.
Последствия
- Преждевременные роды, раннее излитие околоплодных вод.
- Выкидыши, замершая беременность. Они обусловлены тератогенным и эмбриотоксическим эффектами. На УЗИ при этом можно увидеть деформацию плодного яйца, отслойку и гипоплазию хориона, укорочение шейки матки.
- Задержка роста плода.
- Фетоплацентарная недостаточность.
- Многоводие, маловодие.
- Рождение ребенка с низкой массой тела.
- Аномалии развития плода.
- Фиброзно-склеротические деформации органов.
- Со стороны печени: гепатит, гепатомегалия, цирроз.
- Со стороны сердца: кардит, стойкая тахикардия, сердечно-сосудистая недостаточность, фиброэластоз эндокарда.
- Со стороны нервной системы: менингит, энцефалит, менингоэнцефалит, судорожный синдром, эпилепсия, детский церебральный паралич, микроцефалия, мышечная слабость, кистозные образования и кальцификаты в головном мозге, пирамидный и экстрапирамидный синдромы, хроническая головная боль.
- Повреждение слухового нерва, тугоухость.
- Врожденные иммунодефицитные состояния.
- Со стороны дыхательной системы: пневмония, пневмосклероз, плеврит, дыхательная недостаточность, поликистоз легких.
- Со стороны органов зрения: косоглазие, катаракта, микроофтальмия, миопия, хориоретинит, конъюнктивит, атрофия зрительного нерва, дакриоцистит, слепота.
- Инфекционные повреждения кожных покровов: желтуха, экзантемы, пиодермия, розеола.
- Инфекционный мастит.
- Водянка или отечный синдром у плода: асцит, гидроторакс.
- Повреждение кроветворных органов с развитием анемии, тромбоцитопении, геморрагического синдрома.
- Со стороны желудка и кишечника: гастрит, колит, энтероколит.
- Умственная отсталость, расстройство речи и психомоторного развития в будущем.
- Со стороны почек: поликистоз, нефрит.
- Патология плаценты: плацентит, хориоамнионит.
- Сепсис, септический шок.
- Со стороны психики: психические и неврологические расстройства, астения,
- Хроническая гипоксия плода, вплоть до асфиксии.
- Пожизненная инвалидность.
- Рождение мертвого плода.
- Гибель новорожденного.
Рекомендации
- Беременность должна быть запланированной.
- Все инфекции, существовавшие у женщины до беременности должны быть пролечены своевременно, в том числе инфекции, передающиеся половым путем.
- Во время беременности ни в коем случае не контактировать с заболевшими людьми, ограничить общение с домашними животными.
- Питаться правильно, не употреблять в пищу сырую рыбу. Перед употреблением мяса и рыбы, их необходимо тщательно прожаривать.
- Следует регулярно посещать своего лечащего врача, не пропускать назначенные приемы.
- Своевременная постановка на учет способствует раннему выявлению различных отклонений как у женщины, так и у плода.
- Все женщины, раньше не болеющие краснухой, за 3 месяца до предполагаемого зачатия должны привиться.
Выводы
Появление новых методов диагностики и лечения данной патологии никак не меняют ситуацию с ВУИ, являясь по-прежнему актуальной проблемой как в акушерстве, так и в педиатрии и неонатологии. Как итог, все это, несомненно, влияет на неуклонный рост ВУИ, высокий рост реинфекции.
Проблема осложняется тем, что на сегодняшний день недостаточно изучена роль смешанной инфекции в возникновении и течении, не учитываются гормональный и иммунный статус пациента, не до конца сформированы критерии выявления лиц с излечимыми ВУИ. По-прежнему актуальной остается проблема лабораторного выявления возбудителей заболевания.
Похожие записи
В Новосибирске мать обвиняет врачей в гибели новорожденного сына — Российская газета
Мать ищет виновных в гибели новорожденного сына. 33-летняя Виктория Аратова подала в суд на Государственную Новосибирскую областную клиническую больницу — она утверждает, что ее мальчик, проживший девять дней, умер в роддоме из-за недобросовестности медперсонала.
Коротенькую «биографию» умершего ребенка Виктория изложила на нескольких бумажных страничках. Судя по этим записям, молодой женщине не в чем упрекнуть себя — она тщательно готовилась к беременности, обратившись к врачам еще до ее наступления. Забеременев, наблюдалась с первых дней. Неоднократно проходила ПЦР-диагностику на все инфекции («плод не страдает, лечения не требуется» — цитирует она заключения инфекциониста). Неукоснительно выполняла рекомендации врачей. В общем, делала все, чтобы родить здорового ребенка. Почему ее старания оказались напрасными, Виктория не понимает до сих пор.
— За день до родов мне сделали УЗИ, все было в норме, — рассказывает она. — Десятого октября я родила мальчика весом четыре с половиной килограмма. Мне сказали, что с сыном все хорошо, и приложили к груди. Но уже через час, судя по той же истории болезни, ему был выставлен диагноз — внутриутробная инфекция неуточненной этиологии, двухсторонний конъюнктивит.
Три следующих дня мальчик провел в боксе детской комнаты — через капельницу ему вводили антибиотик. Кроме того, новорожденному был сделан рентген грудной клетки, не выявивший пневмонии. Наконец, вечером 13 октября ребенка отдали матери — дежурный врач нашел, что его состояние удовлетворительное. «В дальнейшем ни врач, ни медсестра ни разу не приходили к нам в палату, и я не была предупреждена о том, что лечение продолжается, — говорит Виктория. — Хотя в истории болезни написано, что антибактериальная терапия продолжалась даже ночью».
Утром сын затемпературил, и его снова забрали в бокс. Виктория утверждает — крохе пытались сбить температуру, оставляя раздетым на пеленальном столе. По ее словам, в боксе малыш провел почти двое суток, и только в час ночи 15 октября к нему вызвали врача отделения патологии новорожденных и реаниматолога. «После осмотра сына забрали в отделение патологии, заявив, что это нужно было сделать давно, — говорит Виктория Аратова. — На следующие сутки у него обнаружили пневмонию, перевели в реанимацию, а утром 19 октября он умер».
По мнению специалистов облбольницы, они сделали все возможное для спасения малыша. А причина его смерти — сепсис, возникший из-за глубокого поражения органов внутриутробной инфекцией, передавшейся ребенку от матери.
— Я считаю, что шанс у новорожденного был, — возражает представитель Виктории Аратовой, врач и юрист медико-страхового права Валерий Иевлев. — Даже если допустить, что он действительно был инфицирован внутриутробно, ребенок мог бы выжить при условии своевременной диагностики и правильного выбора лечения.
Кто прав, будут решать эксперты, — Виктория и ее представители настаивают, чтобы экспертизу проводили в Томске или Тюмени. Мать уверена, что ни о какой внутриутробной инфекции речи и быть не может — в первые минуты после родов у нее брали пуповинную кровь специалисты Института клинической иммунологии СО РАН. По их заключениям, кровь была стерильна.
Комментарий
Александр Шаклеин, главный акушер-гинеколог департамента здравоохранения Новосибирской области:
— Смерть ребенка — всегда трагедия, и для врачей в не меньшей степени, чем для родителей. Ведь мы стараемся спасти каждого пациента, использовав для этого все имеющиеся возможности.
Мама утверждает, что она была здорова, а ребенок погибает от внутриутробной инфекции. Возможно ли такое? Возможно, но только в одном случае: если беременная женщина не знает о том, что у нее есть некая инфекция, представляющая угрозу для будущего ребенка. В данном же случае, как свидетельствует медицинская документация, будущая мама трижды в течение срока беременности проходила стационарное лечение. И по данным представленной документации есть подтверждения того, что у пациентки имелись признаки урогенитальной инфекции, угрожающего самопроизвольного выкидыша и родов, по поводу которых она проводила соответствующее лечение.
Когда у новорожденного в течение первых двух часов жизни проявляется конъюнктивит (воспаление слизистой оболочки глаз), это признак реализации внутриутробной инфекции. Наиболее точно диагноз «внутриутробная инфекция» можно подтвердить или опровергнуть только после морфологического изучения различных тканей, а исследование крови является вспомогательным и не абсолютно достоверным методом диагностики. В частности, исследуются ткани плаценты — «детского места», органа, осуществляющего связь между организмом матери и плода в период внутриутробного развития. Серьезные изменения в плаценте, обнаруженные патологоанатомами в данном случае, могут быть вызваны именно инфекционным агентом.
Говорить о том, что диагноз поставлен не вовремя и лечение начато с опозданием, некорректно. Лечить малыша в Областном перинатальном центре начали сразу же, как только у него были обнаружены признаки инфекции, то есть с первых суток жизни. Терапия продолжалась постоянно, врачи применяли разные методы с учетом состояния ребенка, которое то нормализовалось, то ухудшалось.
Вообще, давая оценку работе врачей, следует учитывать, что все люди имеют одинаковую анатомию и физиологию, но каждый человеческий организм уникален. И предсказать течение болезни у конкретного пациента не всегда представляется возможным. В этом — сложность медицины и ее принципиальное отличие от работы с механизмами, где все действия четко укладываются в определенную схему.
Беременность у женщин часто наступает на фоне хронической инфекции, причем носителями ее бывают как мать, так и отец. Коварство инфекции в том, что она может никак себя не проявлять, не вызывать беспокойства до тех пор, пока ее что-то не спровоцирует на активность. У людей с сильным иммунитетом и людей с иммунитетом ослабленным изначально может быть один и тот же инфекционный фон, но один болеет, а другой — нет. Сегодня ваши анализы хорошие, а завтра болезнь вдруг себя проявит.
К сожалению, детей с внутриутробной инфекцией рождается много, и часть из них погибает. Организм малыша еще настолько слаб, что не в силах справиться с такой агрессией. И даже сильные лекарства не всегда помогают в этом.
Справка «РГ»
В Новосибирской области за девять месяцев текущего года мертвыми родилось 44 ребенка, в прошлом году 43, в 2006 году — 46 детей. У 55 процентов из них обнаружены признаки внутриутробной инфекции. Еще один печальный показатель — ранняя неонатальная смертность, то есть гибель ребенка в течение первых семи суток после рождения. В 2006 году умерло 42 ребенка, в 2007 году — 35 детей, с начала этого года уже 43. У каждого пятого из них причиной смерти стала внутриутробная пневмония, причем, у двух процентов — генерализованная внутриутробная инфекция, то есть тотальное поражение всех органов.
Внутриутробная инфекция (хориоамнионит) | Tommy’s
Внутриутробная инфекция — это инфекция в утробе матери , что в контексте беременности обычно означает инфицирование:
- оболочки, которые окружают ребенка
- пуповина
- и / или околоплодные воды.
Исследования показывают, что внутриутробная инфекция может быть причиной до 40 процентов преждевременных родов, с более высокими показателями на более ранних сроках беременности (очень недоношенные дети).
Что такое внутриутробная инфекция?
Матка, околоплодные воды и окружающая среда, в которой развивается ребенок, могут быть инфицированы бактериями. Обычно это естественные бактерии, которые многие женщины переносят во влагалище или на коже, которые обычно безвредны, но мигрировали в те части тела, где их быть не должно. Наиболее частая причина внутриутробной инфекции — через влагалище и шейку матки, но она также может передаваться через плаценту, маточные трубы или через инвазивные процедуры, такие как амниоцентез.
Инфекции, которые могут проникнуть в матку, включают E-Coli и стрептококк группы B (GBS), бактериальный вагиноз, хламидиоз, трихомону, гонорею, сифилис и ВИЧ.
Если инфекция достигает матки, это может вызвать воспаление и инфицирование плодных оболочек (оболочки мешочка, окружающего ребенка в утробе матери, также называемого амнионом или хорионом). Это называется хориоамнионитом. Если поражена пуповина, это называется фунизитом.
Каковы последствия хориоамнионита?
Это инфекция оболочек мешочка, в котором находится ребенок, и воды, и обычно возникает, когда нераспознанная инфекция проникает в матку из влагалища.Инфекция вызывает воспаление плодных оболочек, что само по себе может вызвать преждевременные схватки. Это также может привести к преждевременному отрыву воды (также известному как преждевременный преждевременный разрыв плодных оболочек, или сокращенно PPROM). Ребенку, возможно, придется скоро родиться, чтобы предотвратить более серьезную инфекцию.
Обратите внимание на следующие симптомы хориоамнионита:
- высокая температура
- выделения из влагалища с неприятным запахом
- высокая частота пульса
- боль в животе.
Если у вас есть какие-либо из этих симптомов, как можно скорее обратитесь за советом к своему лечащему врачу, поскольку вам может потребоваться лечение.
Инфекции мочевыводящих путей (ИМП)
ИМП, часто вызываемые вирусом E-Coli, поражают около пяти процентов беременных женщин. Примерно от одной трети до половины этих женщин ИМП попадают в почки, вызывая острый пиелонефрит, инфекцию почек, которая может вызвать преждевременные роды и низкий вес при рождении. Следите за этими симптомами ИМП:
- высокая температура
- тошнота
- рвота
- Боль в боках или пояснице
- дискомфорт или боль при мочеиспускании
- кровь в моче
Если у вас есть какие-либо из этих симптомов, как можно скорее свяжитесь со своим лечащим врачом, так как вам могут потребоваться антибиотики.
Лечение инфекций
Не всегда легко обнаружить инфекцию; на ранних стадиях явных симптомов может не быть. Если есть какие-либо признаки инфекции, например, если у вас высокая температура, ваша медицинская бригада проверит вас либо с помощью анализа крови, либо с помощью простого мазка.
Если у вас преждевременный отток воды (PPROM), вам, конечно же, могут дать таблетки антибиотика, чтобы снизить риск хориоамнионита.
Если инфекция прогрессировала за определенное время или если вы очень плохо себя чувствуете, вам может потребоваться госпитализация для внутривенного введения антибиотиков, а в некоторых случаях может потребоваться роды.В большинстве случаев PPROM прием антибиотиков помогает снизить вероятность хориоамнионита, снижает количество родов, происходящих в течение 48 часов после выхода воды, и снижает вероятность развития инфекции у ребенка.
Подробнее о водах, разрушающих ранний / преждевременный разрыв плодных оболочек (PPROM)
Влияние материнской инфекции на новорожденного
2. Хориоамнионит / внутриамниотическая инфекция (IAI)
Хориоамнионит — это термин, который десятилетиями использовался для описания инфекции и / или воспаления хориона, амниона или того и другого.Далее этот диагноз был разделен на «клинический» диагноз, основанный на материнских симптомах, и «гистологический» диагноз, основанный на патологии плаценты после родов. Клинические признаки и симптомы используются для диагностики клинического хориоамнионита и включают лихорадку у матери, болезненность дна матки, тахикардию у матери и / или плода и гнойные околоплодные воды [5]. Наиболее частыми бактериальными микроорганизмами, вызывающими хориоамнионит, являются Ureaplasma urealyticum и Mycoplasma hominis .Гистологический хориоамнионит диагностируется путем наблюдения за инфильтрацией нейтрофилов в хорион и амнион [6]. Различия в определении хориоамнионита привели к путанице в ведении новорожденных, а также к затруднениям в оценке долгосрочного воздействия хориоамнионита на развитие. Таким образом, внутриамниотическая инфекция (IAI) была разработана, чтобы заменить предыдущий диагноз хориоамнионита [7].
IAI был обновлен в 2017 году Американским колледжем акушеров и гинекологов на три категории, которые легко диагностируются.Изолированная материнская лихорадка (IMF) — это первая категория, при которой у матери одна температура во время родов ≥39,0 ° C или температура 38,0–38,9 ° C, которая сохраняется в течение 30 минут, с рекомендациями по лечению, включая рассмотрение широкого спектра антибиотики [7, 8]. Учитывая многочисленные потенциальные причины материнской лихорадки, использование антибиотиков остается на усмотрение врача. Подозрение на ИАИ диагностируется, когда у матери повышенная температура (≥39,0 ° C) или немного повышенная температура (38.0–38,9 ° C) наряду с одним из следующих факторов риска: лейкоцитоз матери, гнойный дренаж шейки матки или тахикардия плода [7, 8]. Подтвержденный ИАИ диагностируется на основании положительного результата анализа околоплодных вод или патологии плаценты, демонстрирующей гистологические доказательства инфекции [7]. Подобно ранее использовавшемуся гистологическому хориоамниониту, этот диагноз подвергается критике за то, что он ставится после разрешения клинической ситуации и, таким образом, не помогает в неотложном лечении матери или ребенка.Как подозреваемый, так и подтвержденный диагноз ИАИ должен привести к лечению антибиотиками и жаропонижающими средствами во время родов [7].
IAI присутствует почти в 50% случаев очень ранних преждевременных родов [9], после которых могут возникнуть множественные осложнения и наблюдается широкий спектр неонатальных заболеваемости и смертности. Это привело к предположению, что IAI напрямую влияет на развитие и исходы плода и новорожденного, а также потенциально может привести к преждевременным родам, что затем влияет на развитие и исходы.В большинстве исследований, посвященных этому вопросу, использовались диагнозы хориоамнионита, которые включали как клинические, так и гистологические случаи. Учитывая разнообразие диагнозов, включенных в эти исследования, неудивительно, что результаты также были разными. Крупное исследование 2390 крайне недоношенных детей (родившихся с гестационным возрастом <27 недель) из шестнадцати центров США показало, что у младенцев, подвергшихся гистологическому и клиническому хориоамниониту, повышенный риск когнитивных нарушений в скорректированном возрасте 18–22 месяцев [10] .Отдельное исследование 350 младенцев показало, что, хотя гестационный возраст был значительно ниже среди тех, кто был подвержен гистологическому хориоамниониту, не было никакой связи с внутрижелудочковым кровоизлиянием, повреждением белого вещества при рождении или различиями в когнитивных или моторных результатах в возрасте 18–24 месяцев с поправкой возраст [11]. Дополнительные исследования выявили слабую причинную или ассоциативную роль хориоамнионита с риском церебрального паралича [12] и отсутствие повышенного риска повреждения белого вещества на магнитно-резонансной томографии (МРТ) после гистологического хориоамнионита у недоношенных детей [13].Требуется дополнительное исследование с новыми определениями IAI, чтобы определить, согласуются ли результаты с исходами развития у лиц с диагнозом IAI.
3. TORCH-инфекции
TORCH-инфекция — это мнемоника, которая классически использовалась для описания врожденных инфекций, которые могут повлиять на развитие плода. В прошлом TORCH представлял токсоплазмоз, другие заболевания (сифилис, ветряная оспа, парвовирус B19 и более новые патогены, такие как вирус Зика), краснуху, цитомегаловирус и вирус простого герпеса.Однако по мере того, как обнаруживается все больше патогенов и расширяется категория «других», некоторые эксперты считают, что мнемоника сегодня не так актуальна.
3.1 Токсоплазмоз
Toxoplasma gondii — облигатное внутриклеточное простейшее, которое обычно вызывает легкое заболевание у большинства иммунокомпетентных людей [14, 15]. В то время как большая часть инфицированных детей и взрослых протекает бессимптомно, токсоплазмоз считается одной из основных причин смерти, связанной с болезнями пищевого происхождения в Соединенных Штатах.Если человек с ослабленным иммунитетом, беременная женщина или плод / младенец заразятся инфекцией, это может иметь серьезные, даже фатальные, последствия [14, 15]. Заболевание может варьироваться от неспецифических системных симптомов, таких как лихорадка, лимфаденопатия и гепатоспленомегалия, до врожденного токсоплазмоза (КТ), который классически описывается как триада хориоретинита, внутричерепных кальцификатов и гидроцефалии. Без лечения КТ может привести к потере зрения и слуха, снижению когнитивных функций и задержке нервного развития [14, 16–18].
T. gondii существует в трех формах: тахизоит, брадизоит и спорозоит. Окончательные хозяева являются членами семейства Felidae , но теплокровные млекопитающие также могут служить промежуточными хозяевами [17]. Животные из семейства кошачьих могут заразиться T. gondii при попадании в организм инфицированных жертв тканевых цист, содержащих брадизоиты, или при попадании в организм ооцист, содержащих спорозоиты, в чем-либо, загрязненном фекалиями инфицированной кошки. Они могут выделять неспорообразующие ооцисты со стулом через 3–30 дней после заражения и могут выделяться в течение 7–14 дней.При правильном климате (например, теплом и влажном) ооцисты могут образовывать споры в течение 1–5 дней, после чего могут оставаться заразными в течение многих лет. Если тканевые цисты промежуточных хозяев или спорулированные ооцисты попадают в организм человека, они превращаются в активные тахизоиты. В первую очередь тахизоиты затем инфицируют центральную нервную систему, глаза, опорно-двигательного аппарата, а также плаценту путем заражения ядросодержащие клеток-хозяев, чтобы обойти гематоэнцефалический барьер и плацентарный баррикад. Инкубация длится 7 дней с диапазоном 4–21 дней [14, 15, 18].
Для беременных женщин с острой инфекцией, вызванной T. gondii , время может иметь решающее значение и определять курс лечения. Как правило, чем раньше во время беременности возникает острая инфекция, тем ниже вероятность передачи плоду. К сожалению, серьезность заболевания увеличивается, если передача происходит на более ранних сроках беременности [14, 15]. Обратное верно для инфекции на более поздних сроках беременности (например, в третьем триместре), во время которой высок уровень передачи, но менее тяжелое заболевание у плода.
Диагноз первичной или скрытой инфекции ставится в первую очередь с помощью серологических тестов. Токсоплазмоспецифический иммуноглобулин G (IgG) и иммуноглобулин M (IgM) можно проводить в стандартных лабораториях. Затем любые положительные результаты на IgM отправляются в справочные лаборатории, которые могут провести дополнительное тестирование для подтверждения [18]. Если у беременной обнаруживается острая инфекция, можно провести амниоцентез, а жидкость отправить на тестирование полимеразной цепной реакции (ПЦР).Если ПЦР отрицательный и считается, что плод не заразился инфекцией, следующим лучшим шагом является лечение матери спирамицином в попытке предотвратить передачу [14, 15, 17, 18]. Однако если предполагается, что плод инфицирован, матери назначают комбинацию пириметамина, сульфадиазина и фолиевой кислоты. Спирамицин, в первую очередь бактериостатический макролид, который проявляет активность против некоторых грамотрицательных и грамположительных организмов, а также некоторых спирохет, не может проникать через плаценту, тогда как комбинация противопаразитарных препаратов может проникать через плаценту и, таким образом, может помочь в лечении плод [18, 19].Комбинация также используется при инфицировании плода, подтвержденном на 18 неделе беременности или после нее, или при инфицировании матери, приобретенном в третьем триместре [14, 17, 18]. Поскольку невылеченная КТ может привести к гибели или гибели плода в течение первых нескольких дней жизни, а хориоретинит может развиться у значительной части младенцев, матери которых не получали лечения, крайне важно своевременно диагностировать и начать лечение [18].
После рождения ребенка с подозрением на КТ его или ее следует тщательно обследовать и обследовать.Необходимо присылать серологические исследования, полный анализ крови (CBC), тесты функции печени, ПЦР крови, ПЦР мочи, ПЦР спинномозговой жидкости (ЦСЖ) и исследования ЦСЖ, включая уровень глюкозы, белок и количество клеток [18]. Новорожденный также должен пройти офтальмологическое, слуховое и неврологическое обследование, включая визуализацию головного мозга [18]. Инфицированные младенцы должны получать лечение независимо от каких-либо клинически очевидных симптомов, поскольку у значительной части младенцев с бессимптомной КТ при рождении развиваются нарушения зрения / слуха, нарушения обучаемости и задержка психомоторного развития [15, 16, 18, 20].Лечение состоит из такой же антипаразитарной комбинации пириметамина, сульфадиазина и фолиновой кислоты [18, 19]. Если исследования в спинномозговой жидкости показывают повышенную концентрацию белка (более 1 г / дл) или есть признаки тяжелого хориоретинита, то добавляют кортикостероид, такой как преднизон, до тех пор, пока не произойдет снижение концентрации белка в спинномозговой жидкости или разрешение тяжелого хориоретинита [15 , 18, 19]. Лечение продолжают, по крайней мере, до достижения 12-месячного возраста, с учетом более короткой продолжительности лечения для младенцев, у которых отсутствуют симптомы в течение первых трех месяцев жизни [18, 19].Для тех младенцев, у которых отсутствуют симптомы заболевания с положительным токсо-специфическим IgG, но отрицательным IgM и иммуноглобулином A (IgA), следует повторять тестирование на IgG каждые четыре-шесть недель до исчезновения IgG. Нет четкого консенсуса относительно лечения этих младенцев [18, 19].
Исследования, изучающие исходы у младенцев с КТ, показали значительно лучшие неврологические исходы и исходы развития у тех, кого лечили, чем у тех, кто не лечился [21]. Важно отметить, что по сравнению со своими неинфицированными братьями и сестрами у детей, получавших лечение, был более низкий уровень когнитивных функций, хотя со временем ухудшения не наблюдалось.Что касается офтальмологических результатов, было обнаружено, что при наблюдении до 22 лет новые глазные поражения могут быть обнаружены в подростковом возрасте, что указывает на важность продолжения офтальмологического обследования.
3.2 Другое: сифилис, ветряная оспа, парвовирус B19, Зика
3.2.1 Сифилис
Treponema pallidum , тонкая подвижная спирохета, вызывает сифилис [18], инфекцию, передаваемую половым путем, которая может также приводят к врожденному инфицированию плода.Хотя первоначально в США в 2000–2001 гг. Наблюдалось снижение заболеваемости сифилисом, недавно было отмечено тревожное возрождение. В период с 2013 по 2017 год число зарегистрированных первичных и вторичных случаев в Соединенных Штатах увеличилось на 72%, а число случаев врожденного сифилиса увеличилось более чем на 150% с 2013 по 2018 год [22–24]. Считается, что рост употребления метамфетамина, половые контакты с людьми, употребляющими инъекционные наркотики, употребление инъекционных наркотиков и героин являются основными факторами, ведущими к такому резкому увеличению случаев сифилиса [22, 25].
Приобретенный сифилис обычно делится на три стадии: первичный, вторичный и латентный. На начальной стадии на коже или слизистых оболочках открытых участков образуются безболезненные затвердевшие язвы, которые самопроизвольно заживают в течение нескольких недель. Вторичная стадия, обычно через 1-2 месяца после первичной, характеризуется пятнисто-папулезной сыпью, которая обычно включает ладони и подошвы, лимфаденопатией и кожно-слизистыми поражениями, включая большие кондиломы [18]. Наконец, латентная стадия наступает, когда нет клинических признаков или симптомов инфекции, но человек остается серореактивным [18]. T. pallidum может инфицировать центральную нервную систему (ЦНС) на любой стадии, приводя к нейросифилису. Передача плоду во время беременности может произойти в любой момент, причем первичный и вторичный сифилис имеют самые высокие показатели передачи — 60–100% [18].
Всем женщинам рекомендуется пройти скрининг на сифилис на ранних сроках беременности с помощью нетрепонемного теста, с повторным тестированием на более поздних сроках беременности для лиц с высоким риском. Эти тесты включают слайд-тест Лаборатории исследования венерических заболеваний (VDRL) и экспресс-тест на плазменный реагин (RPR) [18].В этих нетрепонемных тестах используется антиген, который реагирует в присутствии антител (к сифилису). Однако, учитывая, что антиген не специфичен для сифилиса и является компонентом клеточных мембран, ложноположительные результаты могут быть результатом других инфекций, включая ветряную оспу и корь, или повреждения тканей, наблюдаемого при заболевании соединительной ткани и даже самой беременности [26]. Следовательно, за положительным нетрепонемным тестом должен следовать подтверждающий тест, такой как абсорбция флуоресцентных трепонемных антител (FTA-ABS) или T.pallidum тесты агглютинации частиц (TP-PA). Кроме того, любой человек, у которого на основе скрининга и подтверждающего тестирования будет обнаружен положительный результат на сифилис, также должен пройти скрининг на вирус иммунодефицита человека (ВИЧ), учитывая высокий уровень коинфекции.
Лечение сифилиса — парентеральное введение пенициллина G; если у человека аллергия на пенициллин G, ему следует пройти десенсибилизацию из-за отсутствия доказанной эффективности альтернативных агентов в этой ситуации. Отсутствие лечения во время беременности может привести к мертворождению и неонатальной смерти почти у 40% женщин с первичной и вторичной стадиями заболевания, 40% младенцев инфицированы и только 20% младенцев являются здоровыми и неинфицированными [27].Кроме того, инфекция плода может привести к анемии, гепатомегалии и водянке [24]. Не следует откладывать лечение младенца, поскольку раннее лечение может предотвратить неврологические последствия [24].
Серологический диагноз ставится младенцу, если титр нетрепонема (VDRL или RPR) в четыре раза выше, чем у матери (оба образца должны быть получены примерно в одно и то же время), если титр нетрепонема сохраняется или увеличивается после рождения, или если титр трепонемных антител (FTA-ABS или TP-PA) остается положительным в возрасте 12–18 месяцев.Выбор теста для младенца зависит от теста, который прошла мать, так как титры необходимо будет сравнить [18]. Затем требуется полная оценка, включая общий анализ крови (CBC), функциональные тесты печени, получение спинномозговой жидкости (CSF) для проверки реактивности VDRL, офтальмологическое обследование и рентгенограммы длинных костей для оценки аномального окостенения, просветления или смещения эпифизов [ 28]. Если есть какие-либо опасения по поводу поражения центральной нервной системы, следует рассмотреть возможность нейровизуализации [18].У инфицированных младенцев обычно назначают десять дней парентерального лечения пенициллином G, при этом требуется тщательное наблюдение. Титры следует повторить к 3-месячному возрасту, при этом следует отметить их снижение, а отсутствие реакции — к 6-месячному возрасту [28]. Если мать получила соответствующее лечение, которое проводилось за более чем 4 недели до родов, и ребенок прошел обычное физикальное обследование с титром, равным или меньшим четырехкратного материнского титра, то оценка не рекомендуется. Однако неадекватное лечение матери должно привести к обследованию ребенка и лечению пенициллином G в течение 10 дней [28].
Клинически почти половина младенцев не имеет каких-либо явных признаков инфекции, хотя могут присутствовать поражения костей, гематологические и гепатобилиарные аномалии, причем гепатомегалия является одним из наиболее частых проявлений [24, 29]. У младенцев, у которых развиваются симптомы, может быть ринит в течение первой недели жизни, при котором возникают стойкие белые выделения («сопение»), содержащие спирохеты [29]. Дополнительные симптомы могут включать генерализованную лимфаденопатию и пятнисто-папулезную сыпь [29]. Долгосрочные исходы у младенцев, не получавших надлежащего лечения, могут включать нейросенсорную тугоухость, интерстициальный кератит, вторичную глаукому, рубцевание роговицы, ухудшение зрения, зубы Хатчинсона (меньшие зубы, на которых расположены зазубрины), саблевидные голени (резкое переднее изгибание большеберцовой кости), лобные выступы, седловидный нос, гуммы (мягкие, незлокачественные образования) и рубцы [29].Пожизненная инвалидность может возникать при врожденном сифилисе, если младенцы не проходят надлежащее обследование и лечение [28].
3.2.2 Ветряная оспа
Вирус ветряной оспы (VZV) — это вирус герпеса, который передается воздушно-капельным путем, при прямом контакте с кожными поражениями и трансплацентарно во время беременности [30]. У младенцев, подвергшихся воздействию VZV в течение последних нескольких недель беременности, может развиться неонатальная ветряная оспа, которая может быть довольно тяжелой; Синдром врожденной ветряной оспы (СВХ) развивается у младенцев, подвергшихся воздействию во время беременности, причем риск наиболее высок, если воздействие происходит в первом триместре [30].У младенцев, подвергшихся воздействию после 20 недель беременности, вероятность развития сердечно-сосудистой системы составляет около 2% [31]. Младенцы с сердечно-сосудистыми заболеваниями чаще всего имеют поражения кожи в дерматомном распределении, за которыми следуют неврологические дефекты, заболевания глаз и аномалии скелета [31]. Неврологические дефекты могут включать атрофию коры головного мозга и вентрикуломегалию. К сожалению, примерно в 30% случаев сердечно-сосудистые заболевания приводят к летальному исходу в течение первого месяца жизни [32].
Моновалентная вакцина, одобренная в 1995 г., и четырехвалентная вакцина, представленная в 2005 г., повлияли на распространенность врожденной инфекции, поскольку серопротекция составляет почти 100% после 2 доз вакцины [18].Таким образом, в настоящее время ССС считается крайне редким заболеванием.
3.2.3 Парвовирус B19
Парвовирус человека B19 представляет собой одноцепочечный вирус дезоксирибонуклеиновой кислоты (ДНК) без оболочки, единственным хозяином которого является человек [18]. Вирус реплицируется в предшественниках эритроцитов и передается через секреты дыхательных путей, контакт с кровью или продуктами крови и вертикально [18]. Хотя он часто вызывает легкую инфекцию дыхательных путей с сыпью «пощечину», он может быть смертельным для плода, при этом риск смерти достигает 10% [33].Частота инфицирования парвовирусом B19 во время беременности составляет 3–4%, а частота трансплацентарной передачи приближается к 30% [34]. К счастью, примерно 50–75% женщин репродуктивного возраста имеют иммунитет к парвовирусу B19 [35]. Время инфицирования во время беременности действительно влияет на риск внутриутробной смерти плода, при этом инфекции в первом триместре беременности приводят к 71% риску потери плода [34]. Сложность диагностики вируса во время беременности возникает из-за отсутствия симптомов, которые испытывает большинство взрослых, и у 70% женщин не было бы никаких симптомов, если бы они были инфицированы во время беременности [34].Артропатии являются одним из наиболее частых симптомов и должны вызывать подозрение на возможную инфекцию [34]. Кроме того, наличие асцита у плода или перикардиального выпота при ультразвуковом исследовании также должно вызывать серьезные подозрения [33].
Водянка плода или аномальное накопление жидкости / отека в двух или более отделах является обычным явлением при инфекции Parvovirus B19, при этом метаанализ показал совокупную заболеваемость 9,3%, а также повышенный риск потери плода. самопроизвольный аборт и мертворождение [36].Парвовирус B19 является одной из наиболее частых причин неиммунной водянки плода, и хотя может произойти спонтанное разрешение инфекции, только около 5% случаев водянки покажут спонтанное разрешение инфекции с исчезновением водянки при последующем ультразвуковом исследовании [37]. .
Тяжелая анемия и тромбоцитопения возникают в утробе матери после инфицирования парвовирусом B19 наряду с дисфункцией миокарда [38]. Эти факторы вместе, вероятно, являются этиологией отека плода. Внутриутробное переливание крови (ВМС) часто необходимо и снижает уровень смертности по сравнению с выжидательной тактикой. Метаанализ показал, что ВМИ была проведена у 78% отечных плодов по сравнению с 29% негидропных плодов, причем разница, вероятно, связана с отечными плодами с более высоким риском гибели [37]. Осложнения могут возникать до 5% случаев, особенно если плод, вероятно, более чувствителен к перегрузке сосудов [38]. Таким образом, внутриматочные обменные трансфузии (IUET) также были предприняты в случаях отека плода на фоне инфекции парвовируса B19.К сожалению, до сих пор он приводит к таким же показателям выживаемости, что и IUT, и не кажется клинически более эффективным в качестве метода лечения [38].
Долгосрочное тестирование выявляет аномалии развития нервной системы после внутриутробной инфекции парвовируса B19 у тех, у кого также диагностирована водянка. При врожденных парвовирусных инфекциях были описаны аномалии головного мозга, включая кальцификаты паренхимы, венозный инфаркт, артериальный инфаркт, мозжечковое кровоизлияние и корковые мальформации, включая диффузную корковую дисплазию и полимикрогирию [39].Если на визуализации нет отклонений и водянка исчезла до родов, одно исследование показало нормальное развитие нервной системы у выживших через 1 и 5 лет [40]. Хотя общий риск смертности и заболеваемости высок, в отдельных случаях врожденных парвовирусных инфекций существует вероятность нормального исхода.
3.2.4 Зика
Вирус Зика, ZIKV, представляет собой развивающийся флавивирус, который впервые стал очевидным на международном уровне после того, как Бразилия объявила чрезвычайную ситуацию в области общественного здравоохранения в 2016 году, после чего Всемирная организация здравоохранения объявила вспышку событием в области общественного здравоохранения, имеющим международное значение [41 ].Впервые вирус был идентифицирован в 1947 году в Уганде, после чего случаи заражения человека стали нечастыми и достаточно локализованными [41]. ZIKV передается инфицированными Aedes spp. комары, половой контакт и переливание крови [42]. Около 80% ZIKV, встречающихся у взрослых, протекает бессимптомно, а в других случаях наблюдается легкое лихорадочное заболевание, головная боль, сыпь, лихорадка и конъюнктивит [42]. Однако тяжелые неврологические осложнения также могут возникать у взрослых.
Синдром врожденного вируса Зика (CZS) отличается по клинической картине и степени тяжести, и только у подгруппы новорожденных, подвергшихся воздействию, наблюдаются явные признаки и симптомы при рождении [41].Ожидается, что младенцы, подвергшиеся воздействию ZIKV in utero , выживут, однако может возникнуть тяжелый фенотип, особенно когда воздействие происходит в первом триместре [43]. Репликация ZIKV в ткани мозга может продолжаться после рождения, и, таким образом, у младенцев, у которых изначально не было симптомов, симптомы могут развиться в течение первого года жизни [41]. Фенотип CZS, по-видимому, состоит из тяжелой микроцефалии и, возможно, частично разрушенного черепа, тонкой коры головного мозга с подкорковыми кальцификациями, рубцеванием желтого пятна, врожденными контрактурами и выраженным ранним гипертонусом [41].Микроцефалия — наиболее частый симптом, встречающийся до 91% CZS, и часто бывает тяжелым, при этом средняя окружность затылочно-лобной части головы на 3–4 стандартных отклонения ниже нормы [43]. Оба центральной и периферической нервной системы, подвергаются воздействию, с результирующих воздействий на опорно-двигательного аппарата, слуховых и офтальмологических систем и симптомов, в том числе токопроводящей дисплазии тазобедренного сустава, нарушение позы конечностей, проводящего потери слуха и нарушений сетчатки и зрительного нерва [43]. До 55% младенцев с CZS имеют структурные глазные аномалии, поэтому визуальный скрининг и вмешательство критически важно проводить в раннем возрасте, чтобы обеспечить нейропластичность и оптимизировать результаты [44].Это привело к тому, что любому младенцу с подозрением на CZS или контактом с ZIKV рекомендуется пройти обследование глаз перед выпиской из больницы и еще раз в возрасте 3 месяцев [44].
Мета-анализ 42 статей выявил наиболее распространенные аномалии головного мозга после воздействия ZIKV в утробе матери , включая уменьшение объема мозга, увеличение экстрааксиального пространства спинномозговой жидкости, подкорковые кальцификаты, микроцефалию, вентрикуломегалию, пороки развития коры головного мозга, базальные ганглии кальцификаты и большая цистерна [45].Эти данные подтверждают концепцию, что ZIKV препятствует нормальной миграции нейронов во время развития, что затем влияет на развитие мозга. Основная миграция нейронов происходит до 25-й недели беременности, что делает воздействие вируса в первом и втором триместрах наиболее разрушительным. Младенцы с воздействием ZIKV и без явного врожденного синдрома также подвержены риску аномальных исходов развития нервной системы, о чем свидетельствует недавнее исследование 70 детей в возрасте до 18 месяцев [46].У этих младенцев подтверждено воздействие ZIKV, но нет данных, подтверждающих CZS, и, несмотря на нормальную окружность головы, в течение первого года жизни развились последующие нарушения развития нервной системы [46]. Поскольку исследования продолжаются и становятся известны более долгосрочные результаты, критически важно внимательно следить за любым младенцем, подвергшимся воздействию ZIKV.
3.3 Краснуха
Краснуха вызывается одноцепочечным вирусом рибонуклеиновой кислоты (РНК), который очень заразен и передается только от человека [18, 47].Обычно он передается воздушно-капельным путем и в большинстве случаев приводит к легкому вирусному заболеванию. Симптомы могут включать жар, сыпь, недомогание и аденопатию. Вирус способен инфицировать клетки дыхательных путей, а затем распространяться через системный кровоток во многие системы органов, включая плаценту [48]. Когда инфекция происходит во время беременности, вирус может передаваться плоду и приводить к смерти плода или к ряду врожденных аномалий, известных под общим названием «Синдром врожденной краснухи» (СВК) [18].Время, когда беременная женщина заражается вирусом, по-видимому, связано с риском врожденной инфекции и пороков развития плода. По оценкам исследований, материнская инфекция, происходящая в течение первых 12 недель беременности, имеет примерно 90% -ную вероятность врожденной инфекции с риском дефектов почти 85% [49]. Когда врожденная инфекция возникает в течение первого триместра, чаще возникают дефекты слуха, пороки сердца, неврологические нарушения и дефекты глаз. ХРС представляет собой комбинацию этих дефектов, но наиболее классически описывается как триада из катаракты, врожденного порока сердца и нейросенсорной глухоты [49, 50].Другие проявления включают задержку внутриутробного развития (ЗВУР), гепатомегалию, спленомегалию, тромбоцитопению и кожный эритропоэз (широко известный как «черничная кексовая сыпь») [18].
Беременные женщины в США проходят серологический скрининг на иммунитет к краснухе. Люди, перенесшие естественную инфекцию или получившие хотя бы одну дозу вакцины против краснухи, обычно имеют пожизненный иммунитет [18]. Те женщины, у которых обнаружено отсутствие иммунитета, должны получить одну дозу вакцины после родов, поскольку вакцинация во время беременности имеет теоретический тератогенный риск из-за того, что вакцина живая [18].Если беременная женщина заразилась вирусом краснухи, ей следует пройти серологическое тестирование на специфические для краснухи IgM и IgG. Если у нее обнаруживается специфический IgG к краснухе, она считается иммунной. Однако, если IgG не обнаруживается во время воздействия, тогда через 3 и 6 недель после воздействия получают серологические исследования выздоравливающих, при этом реактивность IgG в эти моменты времени указывает на недавнюю инфекцию [18]. К сожалению, помимо поддерживающих мер лечения краснухи не существует.
При подозрении на врожденную инфекцию диагноз может быть поставлен путем анализа на специфические IgM к краснухе в крови плода или обнаружения вируса в околоплодных водах [49].Постнатально можно также провести иммуноферментный иммуноферментный анализ (ИФА) для выявления специфичных для краснухи IgM. В случае положительного результата подтверждающее тестирование проводится с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) мазков из носоглотки, мочи или ротовой жидкости [47, 49]. У некоторых младенцев вирус может обнаруживаться в выделениях из носоглотки и моче более года [18, 49]. Хотя лечения СВК не существует, диагноз важен с точки зрения последующего наблюдения. Из-за риска катаракты среди других глазных аномалий (включая микрофтальмию, глаукому, хориоретинит), потери слуха, неврологических проявлений (таких как задержка развития, аутизм) и эндокринных нарушений (включая диабет, заболевания щитовидной железы) дети с СВК должны периодически обследоваться. для лечения этих потенциальных осложнений [48–50].Внедрение вакцины привело к значительному сокращению случаев заражения краснухой и СВК в Соединенных Штатах, при этом с 2001 по 2004 год в среднем регистрировалось 14 случаев краснухи в год и 4 случая СВК в год [51].
3.4 Цитомегаловирус
Цитомегаловирус (ЦМВ) представляет собой двухцепочечный вирус дезоксирибонуклеиновой кислоты (ДНК), который встречается повсеместно и обычно вызывает легкие или субклинические симптомы у большинства детей и взрослых [18, 52]. Он может передаваться через контакт с инфицированными выделениями, при переливании продуктов крови от инфицированных доноров, при трансплантации органов от инфицированных людей или вертикально [18].При вертикальной передаче ЦМВ может вызвать серьезные и необратимые последствия [18, 52, 53]. ЦМВ известен как одна из наиболее распространенных врожденных вирусных инфекций и является ведущей негенетической причиной нейросенсорной тугоухости у детей в США [18]. Он может передаваться плоду через плаценту, при контакте с инфицированными выделениями шейки матки во время родов или перинатально при проглатывании грудного молока, содержащего вирус [18]. Когда ЦМВ передается внутриутробно (, ), это может быть связано с первичной материнской инфекцией во время беременности, реактивацией предшествующей инфекции или повторным заражением другим штаммом, несмотря на присутствие материнских антител [54, 55].Реактивация и повторное заражение встречаются чаще, чем первичная инфекция; однако последнее имеет тенденцию вызывать более серьезные последствия, особенно если инфекция возникает на ранних сроках беременности.
Из тех младенцев, у матери которых во время беременности была острая инфекция, 30–40% будут иметь врожденный ЦМВ (cCMV) [18, 55]. Младенцы с cCMV имеют симптомы в 10–15% случаев, при этом у половины или двух третей этих детей в более позднем возрасте развивается нейросенсорная тугоухость (SNHL) [55]. Симптомы при рождении могут включать тромбоцитопению, гепатомегалию, спленомегалию, микроцефалию, перивентрикулярные кальцификации головного мозга, хориоретинит, гепатит и SNHL.Долгосрочные результаты включают прогрессирующую SNHL и задержку нервного развития [18, 53, 55]. Из младенцев, у которых при рождении не было симптомов, около 15% позже разовьются SNHL [18]. Визуализация головного мозга плода может быть завершена in utero с помощью трансвагинального ультразвука или магнитно-резонансной томографии (МРТ). cCMV может приводить к герминолитическим кистам, лентикулостриатной васкулопатии, кистам височной доли и затылочной части, а также к гипоплазии мозжечка и миграционным нарушениям, включая полимикрогирию [52].Перивентрикулярные кальцификации — наиболее часто встречающаяся находка при визуализации головного мозга случаев cCMV, затрагивающая 34–70% диагностированных пациентов [56].
Тестирование во время беременности обычно не проводится, но серологическое тестирование может быть выполнено, если беременная женщина подверглась заражению или подозревается на инфекцию ЦМВ. ЦМВ-специфический IgM имеет низкую специфичность, так как он может сохраняться в течение 6–9 месяцев после первичной инфекции, а также может быть обнаружен во время реактивации [54]. Однако индекс авидности CMV IgG может использоваться для подтверждения первичной инфекции; Тестирование авидности — это метод измерения силы связи между антителами и вирусом.Низкая авидность указывает на недавнюю инфекцию, в то время как высокая авидность требует времени и указывает на перенесенную инфекцию. В настоящее время не существует рекомендованного лечения острой ЦМВ-инфекции во время беременности [18, 54].
В настоящее время также нет рутинных тестов на ЦМВ у младенцев. В некоторых штатах в обязательном порядке проводится таргетный скрининг на ЦМВ для тех, кто не проходит стандартную проверку слуха новорожденных, однако важно отметить, что при целевом скрининге не будут проходить те новорожденные, у которых нет симптомов при рождении, но все еще подвержены риску развития SNHL в дальнейшей жизни [18].У детей с симптомами заболевания диагноз cCMV может быть поставлен постнатально, если тестирование проводится в течение 3 недель после рождения, чтобы избежать трудностей при различении внутриутробной и перинатальной инфекции [18, 54, 57]. ЦМВ можно выделить из мочи, слюны, респираторного секрета, крови или спинномозговой жидкости [18]. Могут быть выполнены вирусные культуры, культуры из флаконов с быстрой оболочкой и ПЦР [54]. Лечение младенцев с симптомами, независимо от поражения ЦНС, включает внутривенное введение ганцикловира или валганцикловира перорально [18, 54, 58].Последнее предпочтительнее из-за простоты введения, поскольку продолжительность лечения составляет шесть месяцев. Если есть опасения по поводу нарушения всасывания в желудочно-кишечном тракте из-за других факторов, лечение можно начать с внутривенного введения ганцикловира [54]. Исследования показали, что у тех, кто начал противовирусное лечение в течение первого месяца жизни, значительно улучшились аудиологические результаты и исходы нервного развития в возрасте 12 и 24 месяцев по сравнению с теми, кто этого не делал [53]. Лечение валганцикловиром или ганцикловиром может вызвать значительную нейтропению; Абсолютное количество нейтрофилов следует контролировать еженедельно в течение первых шести недель лечения с последующим скринингом через восемь недель лечения, а затем ежемесячно в течение всего периода лечения [54].Младенцам с легкими симптомами или изолированным SNHL не рекомендуется получать противовирусное лечение в настоящее время из-за отсутствия данных в этой популяции [54].
Долгосрочные результаты, которые следует учитывать у детей с cCMV, включают SNHL и задержку нервного развития. Этим детям следует часто проходить аудиологическое обследование, поскольку SNHL может развиваться и / или прогрессировать после периода новорожденности [54]. Хотя не существует установленных универсальных руководящих принципов для оценки слуха, исследования показывают, что скрининг должен продолжаться как минимум в течение первых четырех лет жизни, после чего позднее начало SNHL выявляется редко.
3.5 Вирус простого герпеса
Вирусы простого герпеса представляют собой большие двухцепочечные ДНК-вирусы двух типов: ВПГ-1 и ВПГ-2 [18]. Традиционно ВПГ-1 может вызывать везикулярные поражения в областях выше талии, в то время как ВПГ-2 поражает области ниже талии. Однако все чаще встречаются поражения половых органов, вызванные ВПГ-1. Оба типа могут вызывать герпетическое заболевание у новорожденных, если они приобретены от матери. Передача может происходить во время родов через контакт с поражениями половых органов, восходящей инфекцией, внутриутробно или постнатально при контакте с поражениями [18, 52].Первичная генитальная инфекция ВПГ у матери перед родами имеет в 10–30 раз больше риска передачи по сравнению с рецидивирующей инфекцией. Считается, что это связано с более низкими концентрациями трансплацентарных антител к ВПГ у новорожденных [18, 59]. К сожалению, определить инфекцию как первичную по сравнению с рецидивирующей может быть непросто, поскольку женщины могут протекать бессимптомно и могут не знать, что у них ранее была инфекция ВПГ. Кроме того, распространение вируса может происходить при отсутствии клинических симптомов [59].
Если у беременной женщины действительно есть генитальные поражения, характерные для ВПГ, близкие к родам, мазки с поражений могут быть отправлены на вирусный посев и ПЦР с серологическим тестированием для определения типа. На основании этих результатов женщин можно разделить на четыре разные категории: задокументированная первая первичная инфекция, задокументированный первый эпизод не первичной инфекции, предполагаемый первый эпизод (первичный или не первичный) или рецидивирующая инфекция (см. Таблицу 1, адаптированную из Kimberlin et al. ).
Таблица 1.
Диагностические тесты на антитела к вирусу простого герпеса (ВПГ) и посевы / ПЦР. В этой таблице описывается классификация инфекции HSV на основе результатов посева или ПЦР, а также результатов тестов на антитела к HSV-1 и HSV-2.
Женщин с первичной инфекцией или первым эпизодом можно лечить пероральным ацикловиром в течение 7–10 дней [18]. Пациентов с рецидивирующим эпизодом можно лечить той же или более высокой дозой в течение 5 дней [18]. Если у женщины в анамнезе был ВПГ, то супрессивная терапия должна быть начата на 36 неделе беременности, чтобы снизить риск рецидива при родах, хотя это не полностью подавит выделение [60].Другие профилактические методы включают в себя отказ от инвазивного мониторинга плода, такого как использование электродов на черепе плода, и выбор планового кесарева сечения при наличии поражений во время родов [52, 60].
ВПГ новорожденных может иметь разные проявления. Заболевание SEM включает заболевание кожи, глаз и / или рта; 45% младенцев с HSV будут иметь SEM. Еще 30% младенцев с ВПГ будут иметь локализованное заболевание центральной нервной системы (ЦНС) с поражением кожи или без него. Остальные 25% младенцев с ВПГ будут иметь диссеминированное заболевание, которое может поражать несколько органов, чаще всего печень и легкие [18].Начало болезни варьирует в зависимости от различных проявлений: болезнь SEM проявляется на 5–11 днях жизни, заболевание ЦНС — на 8–17 днях жизни, а диссеминированное заболевание — на 10–12 днях жизни [61]. Начальные симптомы могут быть неспецифическими и включать трудности с кормлением, вялость, судороги, подозрение на сепсис, везикулярную сыпь или тяжелую дисфункцию печени, при этом до 30% инфицированных новорожденных не имеют кожных повреждений [52, 60]. Поскольку у новорожденных с ВПГ могут быть высокие показатели заболеваемости и смертности, крайне важно диагностировать и начать лечение при появлении подозрения на него [18].
Опубликованы рекомендации по ведению бессимптомных новорожденных, рожденных от женщин с активными поражениями половых органов [59]. У новорожденных, матери которых до беременности болели генитальным ВПГ и имели активные поражения во время родов, риск передачи низкий. Однако у младенца должны быть мазки с поверхности рта, носоглотки, конъюнктивы и ануса, полученные для посева и ПЦР, а также ПЦР сыворотки на ВПГ, отправленные через 24 часа жизни. Ожидание отправки образцов до 24 часов жизни гарантирует, что любые положительные результаты будут отражать активную репликацию вируса у младенца, а не заражение матери [59].В этой ситуации не следует начинать внутривенное введение ацикловира, если у ребенка не проявляются симптомы или если мазки с поверхности и / или сыворотка не дают положительных результатов. Это подтвердит инфекцию и потребует люмбальной пункции для получения спинномозговой жидкости (CSF) для ПЦР-тестирования. Результат ПЦР ЦСЖ является ключевым при определении продолжительности лечения. Если ЦСЖ и сывороточная ПЦР на ВПГ отрицательны, то эмпирический внутривенный ацикловир вводится в течение 10 дней для предотвращения перехода от инфекции к заболеванию. Если ПЦР ЦСЖ положительный, лечение следует проводить в течение 21 дня [59].По окончании курса лечения при заболевании ЦНС необходима повторная люмбальная пункция для подтверждения разрешения. Если повторная ПЦР CSF HSV все еще положительна, то ацикловир продолжают еще 7 дней. Для подтверждения просвета проводится повторная люмбальная пункция. Этот процесс повторяется до тех пор, пока CSF не станет отрицательным. Любой младенец, который проходит курс лечения от ВПГ, должен получать супрессивную терапию пероральным ацикловиром в течение 6 месяцев после завершения парентерального лечения (см. Рисунки 1 и 2) [59, 62].
Рис. 1.
Обследование новорожденных при подозрении на заражение вирусом простого герпеса (ВПГ). Эта блок-схема, адаптированная из Ref. [59] описывает оценку (я) младенца, которую необходимо завершить, если во время родов возникла проблема материнской инфекции HSV из-за наличия поражений.
Рисунок 2.
Рекомендации по лечению младенцев при подозрении на врожденную инфекцию, вызванную вирусом простого герпеса (ВПГ). Это блок-схема, адаптированная из Ref. [59] описывает схемы лечения, основанные на детских симптомах.
В случае, если бессимптомный новорожденный родился от матери с активным поражением половых органов, но не имел в анамнезе генитального ВПГ до беременности, важно различать, является ли это первичной, непервичной или рецидивирующей инфекцией [ 59]. Мать должна не только отправить мазки на ПЦР и посев, но и провести серологические тесты сыворотки на антитела к ВПГ-1 и ВПГ-2. Младенца необходимо обследовать через 24 часа жизни с помощью поверхностных культур ВПГ и ПЦР-тестирования сыворотки и спинномозговой жидкости.Образцы спинномозговой жидкости также должны быть отправлены для подсчета клеток и химического анализа с получением скрининга сывороточной аланинаминотрансферазы. Внутривенное введение ацикловира будет начато эмпирически после получения образцов в возрасте 24 часов в ожидании результатов. По результатам тестирования матери можно определить классификацию матери, как показано в Таблице 1. Если предполагается, что у матери есть первый эпизод первичной или непервичной инфекции, то лечение младенца будет включать 10 дней внутривенного введения ацикловира для нормальная оценка (ребенок остается бессимптомным, отрицательная ПЦР CSF и сыворотки на ВПГ, нормальные показатели CSF и нормальная сывороточная АЛТ), 14 дней для аномальной оценки (положительная сывороточная ПЦР на ВПГ, у ребенка с симптомами или аномальная АЛТ) и 21 день для инфекции ЦНС ( положительный результат ПЦР ЦСЖ или аномальные показатели) [59].Новорожденного с положительным результатом ПЦР на ВПГ в спинномозговой жидкости, независимо от классификации матери, следует лечить, как описано выше для заболевания ВПГ. Важно отметить, что если у ребенка проявляются симптомы в какой-либо момент, даже до исследования, проведенного через 24 часа жизни, следует немедленно начать обследование и лечение [59]. Другие факторы риска, которые могут побудить к тестированию и лечению до 24 часов, включают: длительный разрыв плодных оболочек (> 4-6 часов) и недоношенность (<37 недель беременности) на фоне поражений материнских половых органов, характерных для ВПГ [59].
Только 10% младенцев выживают при нелеченом диссеминированном заболевании HSV, а 50% младенцев выживают при нелеченом HSV-заболевании ЦНС [61]. Недолеченное или нелеченное заболевание HSV SEM может прогрессировать до диссеминированного заболевания или заболевания ЦНС; у тех, кто выжил, есть значительная часть с некоторыми неврологическими последствиями, а именно в виде задержки моторики, речи и развития [61]. Результаты, особенно смертность, улучшаются, чем раньше начато лечение, что делает обязательным оценку и начало эмпирического лечения при подозрении на инфекцию ВПГ [61].Также было показано, что оральная супрессивная терапия улучшает исходы развития нервной системы в возрасте 12 месяцев по сравнению с теми, кто не получал длительные противовирусные препараты, что позволяет предположить, что у младенцев, пораженных ВПГ, может наблюдаться продолжающееся неврологическое повреждение [62].
4. Дополнительные вирусы
Ниже приводится обзор дополнительных вирусов, которые могут поражать младенцев, подвергшихся воздействию во время беременности. Эти вирусы были связаны с рядом неблагоприятных исходов у младенцев с пренатальным / перинатальным воздействием, однако они по-прежнему редко диагностируются или влияние на плод остается чрезвычайно разнообразным.Однако, учитывая повышенный риск потенциальных неблагоприятных исходов, они кратко обсуждаются.
4.1 Гепатит E
Вирус гепатита E (HEV) представляет собой вирус с одноцепочечной РНК, который известен как основная причина острого вирусного гепатита, особенно в развивающихся странах, в результате попадания внутрь загрязненных источников воды [18, 63]. В то время как у большинства взрослых он обычно вызывает легкое заболевание, беременные женщины, как правило, имеют более тяжелое заболевание. Смертность наблюдается у беременных, особенно при инфицировании генотипом 1 [18, 63].По оценкам, HEV является причиной до 3000 мертворождений в год в развивающихся странах и обычно может вызывать преждевременные роды у инфицированных матерей, что приводит к неблагоприятным неонатальным исходам [63, 64]. Когда HEV передается вертикально, гепатит может присутствовать с рождения и сохраняться на протяжении всей жизни младенца, но, как известно, не связан с врожденными аномалиями.
4.2 Энтеровирус
Энтеровирусы представляют собой группу РНК-вирусов, которые могут передаваться от человека через дыхательные пути, вертикально и фекально-оральным путем [18].Симптомы у взрослых и детей могут быть разными и могут включать респираторные, дерматологические, неврологические, глазные, сердечные, мышечные и желудочно-кишечные проявления [18]. Когда энтеровирус передается вертикально или чаще в послеродовой период, новорожденный может оставаться бессимптомным без последствий или иметь серьезные симптомы, включая септический шок с полиорганной дисфункцией [65]. Имеются ограниченные данные, позволяющие предположить, что инфицирование энтеровирусом во время беременности связано с врожденными аномалиями или гибелью плода [65].
4.3 Синдром вируса врожденного лимфоцитарного хориоменингита
Вирус лимфоцитарного хориоменингита (LCMV) представляет собой вирус с одноцепочечной РНК, распространяемый грызунами и проникающий через плаценту; в редких случаях он может передаваться во время родов через материнские выделения или кровь и вызывать врожденную вирусную инфекцию [66–68]. У инфицированных беременных женщин могут быть неспецифические вирусные симптомы, и они могут сообщать о прямом контакте или присутствии грызунов в своих домах [66, 68]. Обычными находками у младенцев, пораженных LCMV, являются макроцефалия или микроцефалия и глазные аномалии; кроме того, могут присутствовать неврологические аномалии, включая гидроцефалию, перивентрикулярные кальцификации, судороги, последствия развития нервной системы, включая умственную отсталость или даже смерть [67, 68].Эти симптомы предполагают сходство с другими ранее обсуждавшимися врожденными инфекциями, такими как ЦМВ или токсоплазмоз, что может способствовать недооценке распространенности ВЦМВ при подозрении на врожденную инфекцию [66, 68].
4.4 Вирус Западного Нила
Вирус Западного Нила (ВЗН) — это флавивирус, который был первоначально выделен в 1937 году и не достиг США до вспышки в 1999 году [69–71]. Первичный путь передачи — через укус инфицированного комара вида Culex , при этом индивидуумы могут передаваться от бессимптомных до нулевых.У 7% инфицированных людей развивается нейроинвазивное заболевание с энцефалитом, менингитом или острым вялым параличом [69]. В настоящее время нет специального лечения или вакцины [70]. Отчеты о случаях новорожденных, рожденных от матерей с ВЗН, показали ряд результатов, при этом последующее наблюдение в возрасте 2–3 лет неизменно не показывало каких-либо задержек в развитии [69]. Были обнаружены хориоретинит, потеря белого вещества и кистозные изменения, а также врожденные дефекты, такие как лиссэнцефалия, полидактилия, коарктация аорты и волчья пасть [69].Чтобы точно определить, приводит ли ЛЗН к врожденным аномалиям, необходимы дополнительные исследования воздействия облучения младенцев во время вынашивания плода и долгосрочных результатов.
4.5 Аденовирус
Аденовирусы человека (HAdV) — это ДНК-вирусы семейства Adenoviridae с 7 подгруппами и 52 серотипами [72]. Хотя обычно это причина «простуды», тяжесть заболевания может варьироваться от легкой до тяжелой с возможным гастроэнтеритом, пневмонией и неврологическими заболеваниями [73]. В сообщениях не было отмечено каких-либо специфических пороков развития плода, хотя у младенцев с положительной полимеразной цепной реакцией (ПЦР) была более высокая частота дефектов нервной трубки и эхогенных поражений печени с водянкой и без нее [74].
Компания была основана в Вене в 2004 году Алексом Лазиницей и Ведраном Кордичем, двумя аспирантами, изучающими робототехнику. Когда мы получали степень доктора философии, нам было трудно получить доступ к нужным нам исследованиям. Итак, мы решили создать нового издателя открытого доступа. Лучше, чтобы исследователи, подобные нам, могли легко найти нужную информацию. Результатом является IntechOpen, издатель с открытым доступом, который ставит академические потребности исследователей выше деловых интересов издателей.
Мы начали с публикации журналов и книг из наиболее знакомых нам областей науки — искусственного интеллекта, робототехники, производственных и операционных исследований.Благодаря нашей растущей сети институтов и авторов, мы вскоре расширились в смежные области, такие как экологическая инженерия, нанотехнологии, информатика, возобновляемые источники энергии и электротехника. Сегодня мы являемся крупнейшим в мире издателем научных исследований с открытым доступом, выпустившим более 4200 книг и 54000 книг. научные работы, в том числе рецензируемые материалы более 116 000 ученых из 161 страны. Наши авторы варьируются от всемирно известных лауреатов Нобелевской премии до многообещающих исследователей, ведущих научные открытия.
В том же году, когда была основана IntechOpen, мы запустили первый в истории рецензируемый журнал открытого доступа в своей области: Международный журнал передовых роботизированных систем (IJARS).
Мы начали с публикации журналов и книг из наиболее знакомых нам областей науки — искусственного интеллекта, робототехники, производственных и операционных исследований. Благодаря нашей растущей сети институтов и авторов, мы вскоре расширились в смежные области, такие как экологическая инженерия, нанотехнологии, информатика, возобновляемые источники энергии и электротехника. Сегодня мы являемся крупнейшим в мире издателем научных исследований с открытым доступом, выпустившим более 4200 книг и 54000 книг. научные работы, в том числе рецензируемые материалы более 116 000 ученых из 161 страны.Наши авторы варьируются от всемирно известных лауреатов Нобелевской премии до многообещающих исследователей, ведущих научные открытия.
В том же году, когда была основана IntechOpen, мы запустили первый в истории рецензируемый журнал открытого доступа в своей области: Международный журнал передовых роботизированных систем (IJARS).
Внутриутробные инфекции плода: практические подходы
Осведомленность о влиянии инфекций плода растет, и это вызвало необходимость в обновлении методов диагностики внутриутробных инфекций.Результаты сонографии плода и серология для идентификации конкретного инфекционного агента обычно используются для пренатальной диагностики проявлений инфекций у плода. Традиционно основой диагностики инфекций плода является обнаружение микроорганизмов с помощью посевов, иммунологических методов и специальных методов молекулярной биологии. Проявления инфекции плода могут быть прямыми, такими как порок развития плода и / или смерть плода, которые могли бы произойти к тому времени, когда инфекция будет подтверждена посевом или другими гистопатологическими методами, или косвенными, такими как ограничение внутриутробного развития или кальцификация органов плода.
Ультразвук — это полезный метод обнаружения почти всех аномалий плода, типичных для внутриутробной инфекции, и считается самым безопасным, наименее инвазивным и эффективным способом обнаружения и мониторинга дородовых инфекций. Ультразвук может показать некоторые неспецифические признаки, указывающие на врожденные инфекции, такие как ограничение роста плода, вентрикуломегалия или внутричерепные кальцификаты, которые требуют дальнейшего исследования для подтверждения. Кроме того, ответ на терапию оценивается с помощью ультразвука при инфекциях, таких как парвовирус, для оценки разрешения водянки.3D-УЗИ улучшает обнаружение аномалий плода, таких как заячья губа, поражения головного мозга, пороки развития конечностей и структурные пороки сердца, связанные с инфекциями плода. Таким образом, использование ультразвука для обнаружения маркеров инфекции поможет клиницистам точно идентифицировать возбудителя, коррелировать с дородовым и послеродовым синдромом, связанным с ним, и помочь в уменьшении проблемы неблагоприятного исхода, который может произойти при неожиданной или недиагностированной инфекции плода. .
Важным общим шагом является подтверждение материнской инфекции, чаще всего серологически, путем тестирования на патоген-специфические IgG и IgM.Интерпретация результатов может быть трудной, особенно в отсутствие преморбидного образца, так что сероконверсию с отрицательного IgG на положительный IgG невозможно. Здесь возникает роль поиска четырехкратного увеличения титра IgG и тестирования авидности, где низкая авидность указывает на недавнюю инфекцию, а высокая авидность дает уверенность в старой инфекции. Риск передачи плоду и вероятность повреждения плода напрямую связаны с возбудителем и беременностью на момент инфицирования.Амниоцентез для проверки наличия РНК или ДНК с помощью ПЦР в большинстве случаев является основой диагностики инфекции плода, но время проведения теста по отношению к вероятной точке, в которой произошла передача, имеет решающее значение. Инфекция плода подтверждается посевом околоплодных вод или ПЦР, а чувствительность ПЦР приближается к 100% при сроках беременности> 21 недели.
Обнаружение вируса само по себе не является синонимом повреждения плода, и отрицательный результат не исключает полностью возможность инфицирования плода.Ультразвуковое наблюдение является основным инструментом для определения степени повреждения, но оно также имеет ограничения в точном прогнозировании результата. Существует несколько терапевтических возможностей для инфицированного плода, и в настоящее время они ограничиваются внутриутробным переливанием крови в случаях анемии, вызванной парвовирусной инфекцией. В настоящее время практикуются трансплацентарная терапия сифилиса, АРВ для профилактики передачи ВИЧ от матери ребенку.
Скрининг в дородовой период
Скрининг является обязательным при определенных инфекциях, поскольку передачу от матери ребенку можно предотвратить и эффективно лечить.
Скрининг на сифилис во время беременности является обязательным для выявления женщин с активным сифилисом и предложения лечения их собственной инфекции. Скрининг на краснуху на IgG должен быть частью дородового протокола. В случае подозрения на краснуху следует измерить титры IgG и IgM, даже если у пациента ранее был положительный результат на IgG к краснухе.
Универсальное бесплатное серологическое тестирование на вирус гепатита B должно быть предложено всем беременным женщинам на основе отказа, чтобы инфицированным женщинам было предложено эффективное послеродовое вмешательство для снижения риска MCT.
Американский колледж акушеров и гинекологов (ACOG) и CDC рекомендуют подход «отказа от участия», чтобы обеспечить рутинный скрининг на ВИЧ для всех беременных женщин, в идеале проводимый при первом дородовом посещении. CDC также рекомендует повторное тестирование в третьем триместре, указывая на его экономическую эффективность даже в регионах с низкой распространенностью.
Скрининг на другие инфекции должен проводиться только на основании клинического подозрения и контакта.
Хориоамнионит | Сидарс-Синай
Не то, что вы ищете?Что такое хориоамнионит?
Хориоамнионит (chor-y-oh-am-nee-oh-NY-tis) — это инфекция плаценты и околоплодных вод.Лишь немногие женщины заболевают им, но это частая причина преждевременных родов.
Что вызывает хориоамнионит?
Хориоамнионит чаще всего вызывается бактериями, обычно обнаруживаемыми во влагалище. Чаще бывает, когда водяной мешок (амниотический мешок) разрывается задолго до родов. Это позволяет бактериям из влагалища подниматься в матку.
Кто подвержен риску хориоамнионита?
Вероятность заражения этой инфекцией выше, если:
- Ваш мешок с водой (амниотический мешок) разрывается задолго до того, как вы действительно доставите
- У вас долгая работа
- У вас частые вагинальные осмотры во время родов
- Это ваша первая беременность
- У вас инфекция, передающаяся половым путем или другая вагинальная инфекция
- Вы употребляете алкоголь или табак
- У вас есть внутренний мониторинг плода
- Вам сделали эпидуральную анестезию во время родов
- У вас стрептококковая инфекция группы В
Каковы симптомы хориоамнионита?
Симптомы могут немного отличаться у каждого человека.Они могут включать:
- Лихорадка
- Учащенное сердцебиение у матери и ребенка
- Боль в матке
- Неприятный запах околоплодных вод
Симптомы хориоамнионита могут походить на другие проблемы со здоровьем. Всегда обращайтесь к своему врачу за диагнозом.
Как диагностируется хориоамнионит?
Ваш врач спросит о вашем прошлом здоровье.Он или она проведет вам медицинский осмотр. Он или она может диагностировать хориоамнионит только по вашим симптомам. Вам также может потребоваться лабораторный анализ, чтобы проверить наличие инфекции.
Ваш лечащий врач может предложить тест, называемый амниоцентез, хотя этот тест обычно не проводится при хориоамнионите. Во время этого теста ваш лечащий врач использует иглу, чтобы взять небольшое количество околоплодных вод для анализа.
Как лечится хориоамнионит?
Лечение будет зависеть от ваших симптомов, возраста и общего состояния здоровья.Это также будет зависеть от насколько тяжелое состояние.
Антибиотики используются для лечения хориоамнионит сразу после обнаружения инфекции. Ваш лечащий врач может побуждают вас родить ребенка пораньше. Это может предотвратить осложнения для вас и Ваш ребенок. Возможно, вам придется продолжать принимать антибиотики после рождения ребенка.
Какие возможные осложнения хориоамнионита?
Хориоамнионит может вызвать у матери опасную инфекцию крови, называемую бактериемией.Это может привести к преждевременному рождению ребенка. Это также может вызвать серьезные осложнения у новорожденного. Это включает инфекцию (например, пневмонию или менингит), повреждение мозга или смерть.
Что я могу сделать, чтобы предотвратить хориоамнионит?
Если ваш мешок воды сломается рано (преждевременный разрыв плодных оболочек), антибиотики снижают вероятность развития хориоамнионита. Это Это также помогает ограничить количество вагинальных осмотров до и во время родов.
Когда мне следует позвонить своему врачу?
Если у вас разрыв плодных оболочек, немедленно сообщите об этом своему врачу. Другие симптомы, требующие неотложной помощи, включают:
- Лихорадка
- Быстрый пульс
- Боль в матке
- Амниотическая жидкость с неприятным запахом
Основные сведения о хориоамнионите
- Хориоамнионит — это инфекция плаценты и околоплодных вод.
- Чаще бывает, когда амниотический мешок разрывается задолго до родов.
- Главный симптом — лихорадка. Другой Симптомы включают учащенное сердцебиение, болезненные ощущения в матке и неприятный запах амниотическая жидкость.
- Хориоамнионит может вызвать осложнения для матери и ребенка.
- Вам могут назначить антибиотики, если у вас преждевременный разрыв плодных оболочек.Это может снизить риск хориоамнионита.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от визита к врачу:
- Знайте причину вашего визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и запомнить, что вам говорит поставщик.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые дает вам ваш провайдер.
- Узнайте, почему прописано новое лекарство или лечение и как они вам помогут. Также знайте, каковы побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство, не пройдете тест или процедуру.
- Если вам назначена повторная встреча, запишите дату, время и цель этого визита.
- Узнайте, как можно связаться со своим поставщиком услуг, если у вас возникнут вопросы.
Хориамнионит (внутриутробная инфекция): признаки и симптомы
Материнские инфекции
Хориоамнионит — это инфекция при беременности , поражающая плаценту и оболочки, окружающие растущего ребенка.Беременная женщина может заболеть хориоамнионитом, когда бактерии перемещаются вверх через влагалище в матку. Хориоамнионит может вызвать преждевременные роды и нарушить обмен питательными веществами и газами между матерью и ребенком. Он также может передаваться ребенку через пуповину или во время родов через естественные родовые пути. В большинстве случаев хориоамнионит протекает доброкачественно и не причиняет вреда. В некоторых случаях, когда хориоамнионит плохо лечится, он может привести к развитию у ребенка пожизненной инвалидности, такой как гипоксически-ишемическая энцефалопатия (ГИЭ), церебральный паралич (ЦП) и перивентрикулярная лейкомаляция (ПВЛ).Врачи могут предотвратить необратимый вред, приняв меры предосторожности, такие как предоставление матери антибиотиками и своевременные роды через кесарево сечение (1).
Перейти к:
Причины и факторы риска хориоамнионита
Хориоамнионит или интраамниотическая инфекция обычно вызывается бактериями, попадающими в матку из влагалища или иногда из толстой кишки. Это более вероятно после преждевременного разрыва плодных оболочек (PROM), то есть разрыва амниотического мешка и хориона (также известного как «разрыв воды») до начала родов.Другие факторы риска хориоамнионита включают (1):
Признаки и симптомы хориоамнионита
Признаки и симптомы хориоамнионита могут включать следующие (1):
- Материнская лихорадка (это наиболее важный клинический признак инфекции)
- Потоотделение (повышенное потоотделение)
- Гипотония (пониженное артериальное давление)
- Болезненность матки
- Значительная материнская тахикардия (частота сердечных сокращений> 120 уд / мин.)
- Тахикардия плода (ЧСС> 160 — 180 уд / мин)
- Гнойные околоплодные воды или выделения из влагалища с неприятным запахом
- Материнский лейкоцитоз (высокое количество лейкоцитов)
Важно отметить, что некоторые женщины могут не проявлять явных признаков или симптомов инфекции.
Диагностика хориоамнионита
Хориоамнионит может быть диагностирован на основании таких признаков, как лихорадка матери, микробиологические показания в культуре околоплодных вод или микроскопические аномалии пуповины и плаценты.
Диагноз хориоамнионита обычно основывается исключительно на клинических признаках, поскольку доступ к незагрязненным околоплодным водам или плаценте для посева является инвазивным и обычно избегается. Для диагностики обычно требуется наличие лихорадки (температура> 100,4) плюс два других признака (болезненность матки, тахикардия у матери или плода и гнойные / гнойные околоплодные воды). Кроме того, наличие факторов риска хориоамнионита, особенно разрыва мембраны, еще больше укрепляет диагноз (1).
Другие методы диагностики перечислены ниже:
Лабораторные тесты для матери без симптомов, у которой преждевременные роды или PROM, включают:
- Исследование околоплодных вод
- Скрининговый тест на GBS матери
- Исследования материнской крови
- Исследования мочи матери
Обследование матери с лихорадкой (лихорадкой) с подозрением на хориоамнионит включает:
- Количество лейкоцитов
- Уровни С-реактивного белка
- Измерение комплекса ингибиторов альфа-1-протеиназы
- Уровни интерлейкина-6 или ферритина в сыворотке
Исследования по оценке околоплодных вод и урогенитального секрета включают:
- Бактериальные культуры
- Количество лейкоцитов
- Окрашивание по Граму
- pH
- Концентрация глюкозы
Ультрасонография может использоваться для определения благополучия ребенка в утробе матери.
Профилактика хориоамнионита
Профилактика хориоамнионита имеет решающее значение. Преждевременный разрыв плодных оболочек (PROM) и преждевременный преждевременный разрыв плодных оболочек (PPROM) являются основными причинами хориоамнионита; до 70% женщин, у которых PROM развивается во время схваток или родов, страдают хориоамнионитом. Хотя PROM может вызвать хориоамнионит , необходимо отметить, что вместе с преждевременными родами PROM может быть также вызван хориоамнионитом.
Стандарт лечения хориоамнионита включает назначение антибиотиков широкого спектра действия, обычно включающих эритромицин или азитромицин, и ампициллин в течение 7–10 дней внутривенно (2 дня) с последующим пероральным путем (1).Кроме того, индукция родов и роды связаны со снижением материнской инфекции и уменьшением потребности в неонатальной интенсивной терапии. При длительном разрыве мембраны (> 18 часов) во время родов профилактические антибиотики не показаны, если у матери нет колонии GBS. Однако Центры по контролю за заболеваниями (CDC) рекомендуют начать профилактику GBS, если статус GBS неизвестен (2).
Действительно, профилактические антибиотики оказались очень полезными в снижении частоты неонатальной смерти, хронических заболеваний легких или серьезных аномалий головного мозга у ребенка.Также было показано, что антибиотики снижают частоту хориоамнионита и неонатального сепсиса (инфицирование кровотока) и продлевают время до родов у матерей с преждевременным разрывом мембран, которым назначают выжидательную тактику (ожидание самопроизвольных родов).
Лечение хориоамнионита
Лечение матери и ребенка с хориоамнионитом включает ранние роды, поддерживающую терапию и прием антибиотиков.
Своевременное назначение антибиотиков необходимо для предотвращения осложнений как у матери, так и у плода.Было показано, что время до родов после проведения антибактериальной терапии в некоторых случаях не влияет на заболеваемость. Таким образом, кесарево сечение для ускорения родов не показано при хориоамнионите, если нет других акушерских показаний. Внутривенное (IV) введение ампициллина каждые 6 часов и гентамицина каждые 8-24 часа до родов является стандартной схемой (1). Если выполняется кесарево сечение, для анаэробного покрытия обычно добавляют клиндамицин каждые 8 часов (или метронидазол). Лечение также должно включать введение дополнительной внутривенной дозы антибиотиков после родов (1).
Поддерживающие меры включают использование парацетамола (тайленола), что особенно важно во время родов для предотвращения неонатальной энцефалопатии (повреждения головного мозга) (1).
Исходы хориоамнионита
Хориоамнионит очень распространен и обычно не причиняет вреда маме или ребенку. Иногда это может повредить мембраны, а также вызвать выброс гормона простагландина и созревание шейки матки, что может привести к преждевременным родам. Кроме того, воспаление может распространяться на ворсинки хориона, которые покрывают плаценту и способствуют обмену питательных веществ и газов между матерью и ребенком.Это состояние, называемое виллитом, обычно доброкачественное, но может увеличить риск внутриутробной гибели плода.
Если хориоамнионит и / или виллит не лечить должным образом, это нечасто может привести к серьезным последствиям для ребенка, в том числе:
Что такое фунизит?
Фунисит — это воспаление пуповины в результате инфицирования пуповины. Фунисит часто возникает в результате хориоамнионита, когда инфекция распространяется от плацентарной мембраны на пуповину, вызывая синдром воспалительной реакции плода (FIRS).Фунисит обычно протекает доброкачественно, но иногда может нарушить приток кислорода и питательных веществ к ребенку, если роды не своевременны.
Юридическая помощь при хориоамнионите
Если у вашего ребенка был хориоамнионит и в настоящее время он страдает серьезным заболеванием, например, гипоксически-ишемической энцефалопатией или церебральным параличом, существует вероятность того, что ему была оказана неправильная медицинская помощь. Возможно, вы захотите подать иск о врачебной халатности.
В юридических центрах ABC (Reiter & Walsh, P.C.), мы занимаемся случаями родовых травм (включая инфекции и кислородное голодание). Наши отмеченные наградами поверенные разбираются в сложных юридических вопросах, связанных с инфекцией беременности, и помогут вам получить компенсацию, на которую вы имеете право. Чтобы начать бесплатное рассмотрение дела, обратитесь в юридические центры ABC любым из следующих способов:
Бесплатный обзор корпуса | Доступно 24/7 | Никаких комиссий, пока мы не выиграем
Телефон (бесплатный): 888-419-2229
Нажмите кнопку Live Chat в своем браузере
Заполните нашу онлайн-форму для связи
Как вы произносите хориоамнионит?
Подробнее о нашей фирме
Подробнее о ведении дела о родовой травме
Источники:
- Тита, А.Т. (2018, август). Внутриамниотическая инфекция (клинический хориоамнионит или тройной I). Получено с https://www.uptodate.com/contents/intra-amniotic-infection-clinical-chorioamnionitis-or-triple-i?search=chorioamnionitis treatment & source = search_result & selectedTitle = 1 ~ 150 & usage_type = default & display_rank = 1 # h28.
- Хорсли, Э. (1 мая 2011 г.). CDC обновляет руководство по профилактике перинатального заболевания GBS. Получено с https://www.aafp.org/afp/2011/0501/p1106.html.
Врожденные инфекции | Медицинская школа Эмори
Что такое врожденная инфекция?
Врожденные инфекции поражают будущего плода или новорожденного ребенка.Как правило, они вызываются вирусами, которые ребенок может заразить в любое время беременности и во время родов. Первоначально вирусы заражают мать, которая впоследствии может передать их ребенку либо непосредственно через плаценту, либо во время родов, когда ребенок проходит через родовые пути. Матери обычно не заболевают вирусами. Иногда у них наблюдаются симптомы гриппа. Даже если известно, что мать больна вирусным заболеванием во время беременности, ее иммунная система может предотвратить заражение вирусом плода или новорожденного ребенка.Наиболее распространенные вирусы, связанные с врожденными инфекциями, включают цитомегаловирус (CMV), герпес, краснуху (немецкая корь), парвовирус, ветряная оспа (ветряная оспа) и энтеровирусы.
Как узнать, есть ли у моего ребенка врожденная инфекция?
Сначала это может быть очень сложно. Большинство врожденных инфекций у плода и новорожденного протекает бессимптомно и протекает бессимптомно. Однако некоторые из них могут быть серьезными и вызывать серьезные повреждения организма, приводящие к врожденным дефектам или даже к смерти.Даже если инфекция изначально скрыта, она может незаметно и медленно повредить организм, вызывая медицинские проблемы и проблемы развития, которые проявляются только через месяцы или даже годы. Иногда акушер или педиатр может поставить диагноз врожденной инфекции, основываясь на симптомах матери, физическом состоянии ребенка до (с помощью ультразвука) или после рождения, а также на основе анализов крови матери и ребенка. Иногда, несмотря на сложное медицинское обследование, врожденная инфекция не может быть доказана.
Какие медицинские осложнения связаны с врожденной инфекцией?
Кальцификации мозга, связанные с повреждением головного мозга, могут наблюдаться при ЦМВ-инфекциях. Мозг плохо растет, и впоследствии голова кажется маленькой (микроцефалия). Также могут возникать гидроцефалия («вода в мозгу») и паховые грыжи. Сахарный диабет и проблемы с сердцем могут наблюдаться при врожденной инфекции краснухи. Рецидивирующие инфекции глаз и кожи типичны для герпеса.
Какие осложнения развития связаны с врожденными инфекциями?
Младенцы с врожденными инфекциями могут особенно сильно повредить развивающийся мозг и органы чувств.Последующие эффекты инфекции весьма разнообразны, что приводит к широкому диапазону результатов развития. Потеря слуха является наиболее частым нарушением развития, особенно в результате инфекций CMV и краснухи. Он может присутствовать при рождении или развиваться позже в детстве и быть прогрессирующим. В младенчестве трудно обнаружить потерю слуха. Часто наблюдаются нарушения зрения, особенно при инфекциях, вызванных герпесом и краснухой. Нарушения возникают в результате развития катаракты или фактического разрушения тканей глаза.Может произойти легкое или тяжелое повреждение головного мозга, что приведет к умственной отсталости различной степени, расстройствам обучения и поведения, а также аутизму. Часто требуется специальное образование.
Что я могу делать после того, как мой ребенок вернется домой?
Младенцы, рожденные с явной врожденной инфекцией, часто в раннем возрасте часто демонстрируют серьезные нарушения развития. Младенцы, рожденные с тихими врожденными инфекциями, могут не проявлять инвалидности в течение месяцев или лет. По этой причине важно, чтобы за всеми детьми, рожденными с известными или предполагаемыми врожденными инфекциями, внимательно следили, чтобы выявлять признаки проблем с развитием в самом раннем возрасте.Экраны раннего зрения и слуха особенно важны. Тщательное и раннее наблюдение позволит в кратчайшие сроки ввести необходимые интервенционные методы лечения. Электронная почта Контакт
Внутриутробная инфекция / воспаление во время беременности и повреждения головного мозга у потомства: возможные механизмы | Репродуктивная биология и эндокринология
Volpe JJ: Перинатальное повреждение головного мозга: от патогенеза к нейропротекции. Ment Retard Devel Disab Res Rev.2001, 7: 56-64.10.1002 / 1098-2779 (200102) 7: 1 <56 :: AID-MRDD1008> 3.0.CO; 2-A.
CAS Статья Google Scholar
Berger R, Garnier Y, Jensen A: Перинатальное повреждение головного мозга: основные механизмы и нейрозащитные стратегии. J Soc Gynecol Investig. 2002, 9: 319-328. 10.1016 / S1071-5576 (02) 00164-8.
CAS Статья PubMed Google Scholar
Wu YW, Colford JM: Хориоамнионит как фактор риска церебрального паралича: метаанализ.ДЖАМА. 2000, 284: 1417-1424. 10.1001 / jama.284.11.1417.
CAS Статья PubMed Google Scholar
Pang Y, Cai Z, Rhodes PG: Действие липополисахарида на клетки-предшественники олигодендроцитов опосредуется астроцитами и микроглией. J Neurosci Res. 2000, 62: 510-520. 10.1002 / 1097-4547 (20001115) 62: 4 <510 :: AID-JNR5> 3.3.CO; 2-6.
CAS Статья PubMed Google Scholar
Гарнье Y, Coumans ABC, Jensen A, Hassart THM, Berger R: Перинатальное повреждение головного мозга, связанное с инфекцией: патогенная роль нарушения контроля сердечно-сосудистой системы плода. J Soc Gynecol Investing. 2003, 10: 450-459. 10.1016 / S1071-5576 (03) 00150-3.
CAS Статья Google Scholar
Шендель Д., Шухат А., Торсен П. Проблемы общественного здравоохранения, связанные с инфекциями, беременностью и церебральным параличом. Ment Retard Dev Disabil Res Rev.2002, 8: 39-45. 10.1002 / mrdd.10011.
Артикул PubMed Google Scholar
Ньякас К., Бувальда Б., Луитен PGM: Гипоксия и развитие мозга. Prog Neurobiol. 1996, 49: 1-51.
CAS Статья PubMed Google Scholar
Рикманн М., Вольф JR: Пренатальный олигенез в неопаллии крысы. Adv Anat Embryol Cell Biol. 1985, 93: 1-10.
CAS Статья PubMed Google Scholar
Санчо-Телло М., Валлес С., Монтолиу С., Ренау-Пикерас Дж., Герри С. Паттерн развития экспрессии генов GFAP и виментина в мозге крыс и культурах радиальной глии. Глия. 1995, 15: 157-166.
CAS Статья PubMed Google Scholar
Чамак Б., Доббертин А., Маллат М.: Иммуногистохимическое определение тромбоспондина в микроглии в развивающемся мозге крысы. Неврология. 1995, 69: 177-187. 10.1016 / 0306-4522 (95) 00236-С.
CAS Статья PubMed Google Scholar
Мерфи Д.Дж., Селлерс С., Маккензи И.З., Юдкин П.Л., Джонсон А.М.: Исследование факторов риска дородового и внутриродового риска церебрального паралича у очень недоношенных детей-одиночек. Ланцет. 1995, 346: 1449-1454. 10.1016 / S0140-6736 (95) 92471-Х.
CAS Статья PubMed Google Scholar
Zupan V, Gonzales P, Lacaze-Masmonteil T, Boithias C, d’Allest AM, Dehan M, Gabilan JC: Перивентрикулярная лейкомаляция: еще раз о факторах риска.Dev Med Child Neurol. 1996, 38: 1061-1067.
CAS Статья PubMed Google Scholar
Verma U, Tejani N, Klein S, Reale MR, Beneck D, Figueroa R, Visintainer P: Акушерские предшественники внутрижелудочкового кровоизлияния и перивентрикулярной лейкомаляции у новорожденных с низкой массой тела при рождении. Am J Obstet Gynecol. 1997, 176: 275-281.
CAS Статья PubMed Google Scholar
Berger R, Bender S, Sefkow S, Klingmüller V, Künzel W, Jensen A: Пери / внутрижелудочковое кровоизлияние: краниальное ультразвуковое исследование 5286 новорожденных. Eur J Obstet Gynecol Reprod Biol. 1997, 75: 191-203. 10.1016 / S0301-2115 (97) 00135-8.
CAS Статья PubMed Google Scholar
Дамманн О., Левитон А. Материнская внутриутробная инфекция, цитокины и повреждение головного мозга у недоношенных новорожденных. Pediatr Res. 1997, 42: 1-8.
CAS Статья PubMed Google Scholar
Юн Б.Х., Ромеро Р., Пак Дж. С., Ким С.Дж., Ким С.Х., Чой Дж. Х., Хан Т.Р.: Воздействие внутриамниотического воспаления плода и развитие церебрального паралича в возрасте трех лет. Am J Obstet Gynecol. 2000, 182: 675-681.
CAS Статья PubMed Google Scholar
Жиль Ф. Х., Левитон А., Керр С. С.: Эндотоксиновая лейкоэнцефалопатия в конечном мозге новорожденного котенка.J Neurol Sci. 1976, 27: 183-191. 10.1016 / 0022-510X (76)
-5.
CAS Статья PubMed Google Scholar
Янг Р.С., Ягель С.К., Товфиги Дж .: Системные и невропатологические эффекты эндотоксина E. coli у новорожденных собак. Pediatr Res. 1983, 17: 349-353.
CAS Статья PubMed Google Scholar
Debillon T, Gras-Leguen C, Verielle V, Winer N, Caillon J, Roze J-C, Gressens P: Межутробная инфекция вызывает запрограммированную гибель клеток в перивентрикулярном белом веществе кролика.Pediatr Res. 2000, 47: 736-742.
CAS Статья PubMed Google Scholar
Юн Б.Х., Ким С.Дж., Ромеро Р., Джун Дж.К., Пак К.Х., Чой С.Т., Чи Дж.Г .: Экспериментально индуцированная внутриутробная инфекция вызывает поражения белого вещества мозга плода у кроликов. Am J Obstet Gynecol. 1997, 177: 797-802.
CAS Статья PubMed Google Scholar
Bunge RP: Глиальные клетки и центральная миелиновая оболочка.Physiol Rev.1968, 48: 197-251.
CAS PubMed Google Scholar
Jacobson L, Ek U, Fernell E, Flodmark O, Broberger U: Нарушение зрения у недоношенных детей с перивентрикулярной лейкомаляцией — визуальные, когнитивные и нейропедиатрические характеристики, связанные с церебральной визуализацией. Dev Med Child Neurol. 1996, 38: 724-735.
CAS Статья PubMed Google Scholar
Бервальд К.Д., Попко Б. Развивающиеся и зрелые олигодендроциты по-разному реагируют на иммунный цитокин интерферон-γ. J Neurosci Res. 1998, 52: 230-239. 10.1002 / (SICI) 1097-4547 (19980415) 52: 2 <230 :: AID-JNR11> 3.3.CO; 2-P.
CAS Статья PubMed Google Scholar
Хельфаер М.А., Кирш Дж. Р., Трайстман Р. Дж.: Поглотители радикалов: проникновение в мозг после ишемии и реперфузии. В кн .: Фармакология церебральной ишемии.Под редакцией: Krieglstein J, Oberpichler-Schwenk H. 1994, Medpharm Scientific, Штутгарт, 297-309.
Google Scholar
Палмер К., Товфиги Дж., Робертс Р.Л., Хейтджан Д.Ф.: Аллопуринол, вводимый после индукции гипоксии / ишемии, снижает повреждение головного мозга у 7-дневных крыс. Pediatr Res. 1993, 33: 405-411.
CAS PubMed Google Scholar
Сайто К., Пакианатан С., Лонго Л.Д. Повышение активности орнитиндекарбоксилазы, вызванное свободными радикалами, в развивающихся срезах головного мозга крысы.Brain Res. 1997, 763: 232-238. 10.1016 / S0006-8993 (97) 00414-9.
CAS Статья PubMed Google Scholar
Banker BQ, Larroche JC: Перивентрикулярная лейкомаляция младенчества. Форма неонатальной аноксической энцефалопатии. Arch Neurol. 1962, 7: 386-610.
CAS Статья PubMed Google Scholar
Максвелл WL, Follows R, Ashhurst DE, Berry M: Реакция полушария головного мозга крысы на травму: I.Зрелая крыса. Philos Trans R Soc Lond Biol Sci. 1990, 328: 479-500.
CAS Статья Google Scholar
Balasingam V, Tejada-Berges T, Wright E, Bouchova R, Yong VW: Реактивный астроглиоз в головном мозге новорожденных мышей и его модуляция цитокинами. J Neurosci. 1994, 14: 846-856.
CAS PubMed Google Scholar
Дегучи К., Огучи К., Такашима С. Характерная невропатология лейкомаляции у младенцев с крайне низкой массой тела при рождении.Pediatr Neurol. 1997, 16: 296-300. 10.1016 / S0887-8994 (97) 00041-6.
CAS Статья PubMed Google Scholar
Feldhaus B, Dietzel ID, Berger R: TNF-a индуцирует гибель клеток в первичных культурах предшественников олигодендроцитов. J Soc Gynecol Investig. 2001, 8: 248A-
Google Scholar
Cai Z, Pan ZO, Pang Y, Evans OB, Rhodes PG: Индукция цитокинов в мозге плода крысы и повреждение головного мозга у новорожденных крыс после введения материнскому липопоисахариду.Pediatr Res. 2000, 47: 64-72.
CAS Статья PubMed Google Scholar
Merrill JE: Фактор некроза опухоли альфа, интерлейкин 1 и родственные цитокины в развитии мозга: нормальные и патологические. Dev Neurosci. 1992, 14: 1-10.
CAS Статья PubMed Google Scholar
Merrill JE: Эффекты IL-1 и TNF альфа на астроциты, микроглию, олигодендроциты и глиальные предшественники in vitro.Dev Neurosci. 1991, 13: 130-137.
CAS Статья PubMed Google Scholar
Джулиан Д., Янг Д.Г., Вудворд Дж., Браун Д.К., Лахман Л.Б. Интерлейкин-1 является фактором роста астроглии в развивающейся нервной системе. J Neurosci. 1988, 8: 709-714.
CAS PubMed Google Scholar
Юн Б.Х., Ромеро Р., Ким С.Дж., Ку Дж.Н., Чхве Г., Син ХК, Чи Дж. Г.: Высокая экспрессия фактора некроза опухоли-а и интерлейкина-6 при перивентрикулярной лейкомаляции.Am J Obstet Gynocol. 1997, 177: 406-411.
CAS Статья Google Scholar
Юн Б.Х., Джун Дж.К., Ромеро Р., Парк К.Х., Гомес Р., Чой Дж. Х., Ким И.О .: Воспалительные цитокины околоплодных вод (интерлейкин-6, интерлейкин-1β и фактор некроза опухоли-а), мозг новорожденного поражения белого вещества и церебральный паралич. Am J Obstet Gynecol. 1997, 177: 19-26.
CAS Статья PubMed Google Scholar
Megyeri P, Abraham CS, Temesvari P, Kovacs J, Vas T, Speer CP: Рекомбинантный фактор некроза опухоли человека альфа сужает пиальные артериолы и увеличивает проницаемость гематоэнцефалического барьера у новорожденных поросят. Neurosci Lett. 1992, 148: 137-140. 10.1016 / 0304-3940 (92)
CAS Статья PubMed Google Scholar
Уно Х, Мацуяма Т., Акита Х, Нишимура Х, Сугита М: Индукция фактора некроза опухоли альфа в гиппокампе мыши после временной ишемии переднего мозга.J Cereb Blood Flow Metab. 1997, 17: 491-499. 10.1097 / 00004647-199705000-00002.
CAS Статья PubMed Google Scholar
Tureen J: Влияние рекомбинантного фактора некроза опухоли альфа человека на церебральное потребление кислорода, лактат спинномозговой жидкости и церебральный кровоток у кроликов: роль оксида азота. J Clin Invest. 1995, 95: 1086-1091.
PubMed Central CAS Статья PubMed Google Scholar
Duchini A, Govindarajan S, Santucci M, Zampi G, Hofman FM: Влияние фактора некроза опухоли альфа и интерлейкина-6 на проницаемость жидкой фазы и диффузию аммиака в эндотелиальных клетках, происходящих из ЦНС. J Investig Med. 1996, 44: 474-482.
CAS PubMed Google Scholar
Ботчкина Г.И., Геймонен Э., Биллоф М.Л., Вильярреал О., Трейси К.Дж.: Потеря активности NF-kappaB во время церебральной ишемии и цитотоксичность TNF. Mol Med.1999, 5: 372-381.
PubMed Central CAS PubMed Google Scholar
Белл MJ, Hallenbeck JM: Влияние внутриутробного воспаления на развивающийся мозг крысы. J Neurosci Res. 2002, 70: 570-579. 10.1002 / jnr.10423.
CAS Статья PubMed Google Scholar
Cammer W. Влияние TNF-α на незрелые и зрелые олигодендроциты и их предшественники in vitro.Brain Res. 2000, 864: 213-219. 10.1016 / S0006-8993 (00) 02178-8.
CAS Статья PubMed Google Scholar
Ladiwala U, Hewei L, Antel J, Nalbantoglu J: индукция p53 фактором некроза опухоли -a и участие p53 в гибели клеток олигодендроцитов человека. J Neurochem. 1999, 73: 605-611. 10.1046 / j.1471-4159.1999.0730605.x.
CAS Статья PubMed Google Scholar
Berger R, Garnier Y, Pfeiffer D, Jensen A: Липополисахариды не изменяют метаболические нарушения в срезах гиппокампа плодных морских свинок после кислородно-глюкозной депривации. Pediatr Res. 2000, 48: 531-535.
CAS Статья PubMed Google Scholar
Kaukola T, Satyaraj E, Patel DD, Tchernev VT, Grimwade BG, Kingsmore SF, Koskela P, Vainionpaa L, Pihko H, Aarimaa T, Hallman M: Церебральный паралич характеризуется белковыми посредниками в пуповинной сыворотке.Энн Нейрол. 2004, 55: 186-194. 10.1002 / ana.10809.
CAS Статья PubMed Google Scholar
Oppenheim RW, Prevette D, Yin QW: Контроль выживания эмбриональных мотонейронов in vivo с помощью цилиарного нейротрофического фактора. Наука. 1991, 251: 1616-1618.
CAS Статья PubMed Google Scholar
Knusel B, Rabin SJ, Hefti F: Регулируемая реакция рецептора нейротрофина во время миграции нейронов и ранней дифференцировки.J Neurosci. 1994, 14: 1542-1554.
CAS PubMed Google Scholar
Han BH, Holtzman DM: BDNF защищает мозг новорожденного от гипоксически-ишемического повреждения in vivo через путь ERK. J Neurosci. 2000, 20: 5775-5781.
CAS PubMed Google Scholar
Киршнер П.Б., Дженкинс Б.Г., Шульц Дж.Б.: NGF, BDNF и NT-5, но не NT-3, защищают новорожденных животных от токсичности MPP + и окислительного стресса.Brain Res. 1996, 713: 178-185. 10.1016 / 0006-8993 (95) 01513-2.
CAS Статья PubMed Google Scholar
Уолтон М., Коннор Б., Лоулор П., Янг Д., Сириманн Е., Глюкман П., Коул Г., Драгунов М.: Смерть и выживаемость нейронов в двух моделях гипоксически-ишемического повреждения мозга. Brain Res Brain Res Rev.1999, 29: 137-168. 10.1016 / S0165-0173 (98) 00053-8.
CAS Статья PubMed Google Scholar
Schwartz JP, Nishiyama N: Экспрессия гена нейротрофического фактора в астроцитах во время развития и после травмы. Brain Res Bull. 1994, 35: 403-407. 10.1016 / 0361-9230 (94) -1.
CAS Статья PubMed Google Scholar
Камигучи Х., Йошида К., Сагох М., Сасаки Х., Инаба М., Вакамото Х., Отани М., Тоя С. Высвобождение цилиарного нейротрофического фактора из культивируемых астроцитов и его модуляция цитокинами. Neurochem Res.1995, 20: 1187-1193.
CAS Статья PubMed Google Scholar
Кан М.А., де Веллис Дж .: Факторы роста в ЦНС и их влияние на олигодендроглии. Prog Brain Res. 1995, 105: 145-169.
CAS Статья PubMed Google Scholar
Генрих М., Горат М., Ландсберг CR: Нейротрофин-3 (NT-3) модулирует раннюю дифференцировку олигодендроцитов в кортикальной культуре головного мозга крысы.Глия. 1999, 28: 244-255. 10.1002 / (SICI) 1098-1136 (199912) 28: 3 <244 :: AID-GLIA8> 3.3.CO; 2-N.
CAS Статья PubMed Google Scholar
Патан С: Васкулогенез и ангиогенез как механизмы формирования, роста и ремоделирования сосудистой сети. J Neurooncol. 2000, 50: 1-15. 10.1023 / А: 1006493130855.
CAS Статья PubMed Google Scholar
Miquerol L, Langille BL, Nagy A: Эмбриональное развитие нарушается умеренным увеличением экспрессии гена фактора роста эндотелия сосудов. Разработка. 2000, 127: 3941-3946.
CAS PubMed Google Scholar
Янкопулос Г.Д., Дэвис С., Гейл Н.В., Радж Дж. С., Виганд С.Дж., Холаш Дж. Сосудистые факторы роста и формирование кровеносных сосудов. Природа. 2000, 407: 242-248. 10.1038 / 35025215.
CAS Статья PubMed Google Scholar
Taylor CM, Stevens H, Anthony FW, Wheeler T: Влияние гипоксии на клеточные линии, производные от фактора роста эндотелия сосудов: JEG, Jar и BeWo. Плацента. 1997, 18: 451-458.
CAS Статья PubMed Google Scholar
Yanagisawa M, Kurihara H, Kimura S, Tomobe Y, Kobayashi M, Mitsui Y, Yazaki Y, Goto K, Masaki T: новый мощный сосудосуживающий пептид, продуцируемый эндотелиальными клетками сосудов. Природа. 1988, 332: 411-415.10.1038 / 332411a0.
CAS Статья PubMed Google Scholar
Hirata Y, Takagi Y, Fukuda Y, Marumo F: Эндотелин является мощным митогеном для гладкомышечных клеток сосудов крыс. Атеросклероз. 1989, 78: 225-228.
CAS Статья PubMed Google Scholar
Шичири М., Марумо Ф, Хирата Y: Подавление эндотелиального апоптоза, опосредованное рецептором эндотелина-B.J Cardiovasc Pharmacol. 1998, 31: S138-S141. 10.1097 / 00005344-199800001-00041.
CAS Статья PubMed Google Scholar
Lee ME, de la Monte SM, Ng SC, Bloch KD, Quertermous T: Экспрессия сильнодействующего вазоконстриктора эндотелина в центральной нервной системе человека. J Clin Invest. 1990, 86: 141-147.
PubMed Central CAS Статья PubMed Google Scholar
Накамура С., Нарус М., Нарус К., Шиода С., Накай Ю., Уэмура Х: Совместная локализация иммунореактивного эндотелина-1 и нейрогипофизарных гормонов в аксонах нервной доли гипофиза крысы. Эндокринология. 1993, 132: 530-533. 10.1210 / en.132.2.530.
CAS PubMed Google Scholar
Kuwaki T, Kurihara H, Cao WH, Kurihara Y, Unekawa M, Yazaki Y, Kumada M: физиологическая роль эндотелина мозга в центральном вегетативном контроле: от нейрона до нокаутированной мыши.Prog Neurobiol. 1997, 51: 545-579. 10.1016 / S0301-0082 (96) 00063-9.
CAS Статья PubMed Google Scholar
Ямасита К., Катаока Ю., Ямасита Ю.С., Химено А., Цуцуми К., Нива М., Танияма К.: Система глиального эндотелина / оксида азота участвует в гибели нейронов SHRSP в гиппокампе CA1 после временной ишемии переднего мозга. Clin Exp Pharmacol Physiol. 1995, 22: S277-S278.
CAS Статья Google Scholar
Zhang WW, Badonic T, Hoog A, Jiang MH, Ma KC, Nie XJ, Olsson Y: Астроциты при болезни Альцгеймера проявляют иммунореактивность к вазоконстриктору эндотелину-1. J Neurol Sci. 1994, 122: 90-96. 10.1016 / 0022-510X (94)
CAS Статья PubMed Google Scholar
Josko J: Церебральный ангиогенез и экспрессия VEGF после субарахноидального кровоизлияния (SAH) у крыс. Brain Res. 2003, 981: 58-69. 10.1016 / S0006-8993 (03) 02920-2.
CAS Статья PubMed Google Scholar
Dirnagl D, Iadecola C, Moskowitz MA: Патобиология ишемического инсульта: комплексный взгляд. Trends Neurosci. 1999, 22: 391-397. 10.1016 / S0166-2236 (99) 01401-0.
CAS Статья PubMed Google Scholar
Векслер З.С., Ферриеро Д.М.: Молекулярные и биохимические механизмы перинатального повреждения головного мозга.Semin Neonatol. 2001, 6: 99-108. 10.1053 / siny.2001.0041.
CAS Статья PubMed Google Scholar
Marks N, Berg MJ: Последние достижения в области развития нейрональных каспаз и нейродегенерации. Neurochem Int. 1999, 35: 195-220. 10.1016 / S0197-0186 (99) 00061-3.
CAS Статья PubMed Google Scholar
Han BH, D’Costa A, Back SA, Parsadanian M, Shah AR, Gidday JM, Srinivasan A, Deshmukh M, Holtzman DM: BDNF блокирует активацию каспазы-3 при неонатальной гипоксии-ишемии.Neurobiol Dis. 2000, 7: 38-53. 10.1006 / nbdi.1999.0275.
CAS Статья PubMed Google Scholar
Felderhoff-Mueser U, Taylor DL, Greenwood K, Kozma M, Stibenz D, Joashi UC, Edwards AD, Mehmet H: Fas / CD95 / APO-1 может действовать как рецептор смерти для нейрональных клеток in vitro и in vivo и активируется после церебрального гипоксически-ишемического повреждения развивающегося мозга крысы. Brain Pathol. 2000, 10: 17-29.
CAS Статья PubMed Google Scholar
Lipton JM, Катания A: Противовоспалительное действие нейроиммуномодулятора альфа-МСГ. Иммунол сегодня. 1997, 18: 140-145. 10.1016 / S0167-5699 (97) 01009-8.
CAS Статья PubMed Google Scholar
Oktar BK, Ercan F, Yegen BC, Alican I. Влияние гормона, стимулирующего альфа-меланоциты, на воспаление толстой кишки у крыс. Пептиды. 2000, 21: 1271-1277. 10.1016 / S0196-9781 (00) 00269-2.
CAS Статья PubMed Google Scholar
Rajora N, Boccoli G, Catania A, Lipton JM: альфа-МСГ модулирует экспериментальное воспалительное заболевание кишечника. Пептиды. 1997, 18: 381-385. 10.1016 / S0196-9781 (96) 00345-2.
CAS Статья PubMed Google Scholar
Taherzadeh S, Sharma S, Chhajlani V, Gantz I, Rajora N, Demitri MT, Kelly L, Zhao H, Ichiyama T, Catania A, Lipton JM: альфа-МСГ и его рецепторы в регуляции некроза опухолей производство фактора альфа моноцитами / макрофагами человека.Am J Physiol. 1999, 276: R1289-1294.
CAS PubMed Google Scholar
Редондо П., Гарсия-Фонсиллас Дж., Окружнов И., Бандрес Е: Альфа-МСГ регулирует экспрессию интерлейкина-10 кератиноцитами человека. Arch Dermatol Res. 1998, 290: 425-428. 10.1007 / s004030050330.
CAS Статья PubMed Google Scholar
Magnoni S, Stocchetti N, Colombo G, Carlin A, Colombo A, Lopton JM, Catania A: уровень альфа-меланоцит-стимулирующего гормона снижается в плазме у пациентов с острым повреждением головного мозга.J Neurotrauma. 2003, 20: 251-260. 10.1089 / 089771503321532833.
Артикул PubMed Google Scholar
Lipton JM, Catania A, Delgado R: Пептидная модуляция воспалительных процессов Пептидная модуляция воспалительных процессов в головном мозге. Нейроиммуномодуляция. 1998, 5: 178-83. 10.1159 / 000026335.
CAS Статья PubMed Google Scholar
Катания А., Липтон Дж. М.: Пептидная модуляция лихорадки и воспаления в головном мозге. Ann N Y Acad Sci. 1998, 856: 62-68.
CAS Статья PubMed Google Scholar
Lipton JM, Катания A: Механизмы противовоспалительного действия нейроиммуномодулирующего пептида альфа-MSH. Ann N Y Acad Sci. 1998, 1: 373-380.
Артикул Google Scholar
Wong KY, Rajora N, Boccoli G, Catania A, Lipton JM: Потенциальный механизм местного противовоспалительного действия альфа-меланоцит-стимулирующего гормона в головном мозге: модуляция производства фактора некроза опухоли-альфа астроцитарными клетками человека. Нейроиммуномодуляция. 1997, 4: 37-41.
CAS PubMed Google Scholar
