Внутриутробные инфекции как фактор риска развития сенсоневральной тугоухости
Принятые сокращения:
ВИЧ — вирус иммунодефицита человека
ВУИ — внутриутробные (врожденные) инфекции
ДНК — дезоксирибонуклеиновая кислота
ИФА — иммуноферментный анализ
ПЦР — полимеразно-цепная реакция
РНК — рибонуклеиновая кислота
СНТ — сенсоневральная тугоухость
ЦМВ — цитомегаловирус
ЦМВИ — цитомегаловирусная инфекция
ЦНС — центральная нервная система
Ig — иммуноглобулин
Внутриутробные (врожденные) инфекции (ВУИ) — это группа инфекционных заболеваний эмбриона, плода или новорожденного, вызываемых вирусами, бактериями, простейшими. Инфекции новорожденному могут передаваться in utero (антенатальное заражение) или в процессе родов (интранатальное инфицирование). В антенатальном периоде плод может быть инфицирован трансплацентарно (гематогенно, вертикально), посредством нисходящей (через маточные трубы) или восходящей (трансамниональной) инфекции, при этом нарушение целостности оболочек плодного пузыря и длительный безводный период значительно повышают вероятность заражения.
В группу ВУИ объединены заболевания, влияние которых на заболеваемость и смертность новорожденных доказано. Она включает такие инфекции, как токсоплазмоз, сифилис, гепатит В, краснуха; инфекции, вызываемые вирусом иммунодефицита человека (ВИЧ), парвовирусом В19, энтеровирусом, вирусом хориоменингита, герпесвирусами. В англоязычной литературе для обозначения наиболее опасных для плода инфекций используется термин ToRCH (Toxoplasmosis, Rubella, CMV, HSV — токсоплазмоз, краснуха, цитомегаловирус, вирус простого герпеса) [1, 2].
Токсоплазмоз является самой распространенной ВУИ, вызываемой простейшими. Возбудителем инфекции является Toxoplasma gondii, облигатный внутриклеточный паразит. Различают врожденный и приобретенный токсоплазмоз. В последнем случае инфицирование, как правило, протекает бессимптомно, хотя у незначительного числа людей наблюдается лихорадка, недомогание и лимфаденопатия [2]. Внутриутробное инфицирование возможно при первичной (или активизации латентной) инфекции у матери, причем вероятность заражения повышается с увеличением срока гестации — от 15% в первом триместре до более чем 60% в третьем [3].
При заражении плода на более ранних сроках гестации последствия оказываются более серьезными, вплоть до развития самопроизвольного аборта. В том случае, если гибели плода не произошло, у такого новорожденного проявляются серьезные осложнения со стороны центральной нервной системы (ЦНС), зрительного анализатора. При инфицировании во втором триместре, как правило, формируется классическая триада: гидроцефалия, внутримозговые кальцинаты, хориоретинит. Также может развиваться желтуха, гепатоспленомегалия, анемия, лимфаденопатия, микроцефалия, нарушения зрения, тугоухость, эпилептические приступы. В случае, если заражение происходит в третьем триместре, дети рождаются без каких-либо пороков развития [1].
Также может развиваться желтуха, гепатоспленомегалия, анемия, лимфаденопатия, микроцефалия, нарушения зрения, тугоухость, эпилептические приступы. В случае, если заражение происходит в третьем триместре, дети рождаются без каких-либо пороков развития [1].
Патогенез формирования тугоухости заключается в поражении возбудителем волосковых клеток, сосудистой полоски, спирального ганглия, а также внутреннего слухового прохода [2].
Ультразвуковая и инвазивная (амниоцентез, хорион- или плацентобиопсия) пренатальная диагностика при токсоплазмозе у матери служит не только для диагностики фетальной инфекции, но и для контроля за эффективностью специфической терапии, которую получает беременная. Значимым сонографическим параметром для оценки состояния плода служит диагностика внутриматочной гидроцефалии в рамках текущего энцефалита [3].
Отмечено, что результатом адекватной терапии токсоплазмоза во время беременности может быть улучшение изначально нарушенной слуховой функции у ребенка [1].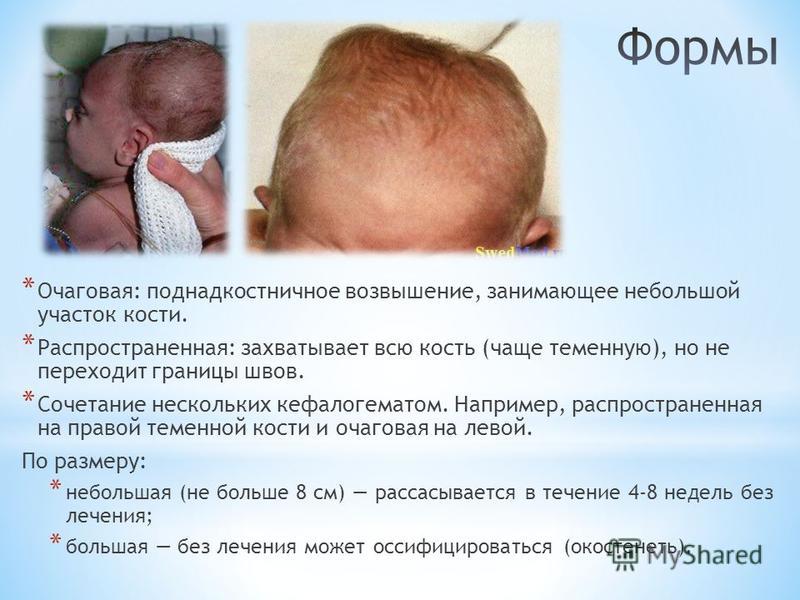
Сифилис вызывается грамотрицательной бактерией Treponema pallidum. Распространенность врожденного сифилиса точно не установлена [4]. Возбудитель сифилиса может трансплацентарно передаваться плоду, начиная с 16-й недели беременности.
По времени возникновения клинических проявлений выделяют ранний и поздний врожденный сифилис. Симптомы раннего врожденного сифилиса проявляются сразу после рождения. К ним относятся: макулопапулезная сыпь, генерализованная лимфаденопатия, гепатомегалия, анемия, тромбоцитопения, менингит, хориоретинит, белая пневмония, остеохондрит, нефротический синдром или острый гломерулонефрит. Для позднего врожденного сифилиса характерна триада Гетчинсона (пороки развития зубов, специфический лабиринтит, паренхиматозный кератит), а также гидроцефалия, деформации скелета, церебральный паралич и другие нарушения [2—4].
При врожденном сифилисе зачастую поражается слуховой анализатор и, в отсутствие немедленного лечения, развивается СНТ.
Вирус иммунодефицита человека (ВИЧ)

Для верификации ВИЧ у беременных женщин применяются методы серологической диагностики, позволяющие обнаруживать ВИЧ-специфические антитела класса IgG, в частности тесты иммуноферментного анализа (ИФА) и простые экспресс-тесты. Диагностика ВИЧ-инфекции у детей затруднена из-за присутствия в их организме пассивно приобретенных антител матери, которые могут персистировать до 18-го месяца жизни. Ранняя диагностика заключается в определении антигена р24, антител класса IgM, анализе полимеразной цепной реакции (ПЦР) [2].
У новорожденных, инфицированных ВИЧ при рождении, клинические проявления заболевания отсутствуют — они развиваются позже, по мере поражения Т-лимфоцитов и присоединения оппортунистических инфекций [2].
В случае ВИЧ-ассоциированной тугоухости необходимо иметь в виду следующие повреждающие факторы: собственно вирусное поражение плода, токсическое воздействие на него противовирусных препаратов и влияние оппортунистических инфекций (бактериальной, грибковой, протозойной), в результате чего развивается как сенсоневральная, так и кондуктивная тугоухость [6, 7].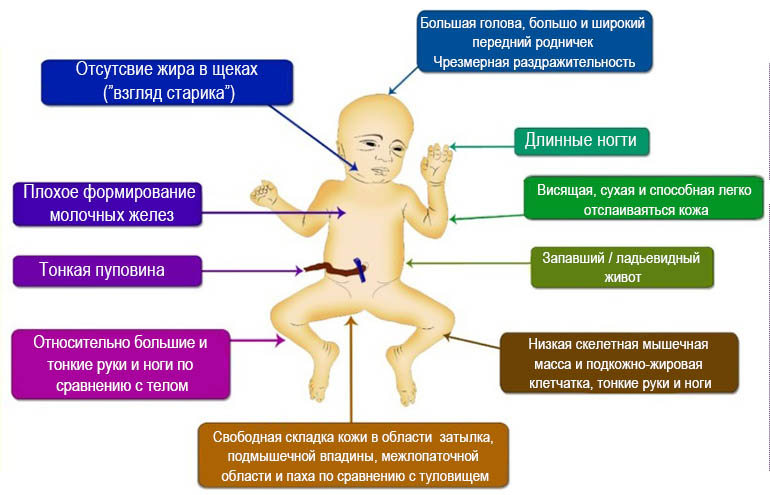
Краснуха на сегодняшний день, в силу распространения цитомегаловирусной инфекции, уже не занимает лидирующую позицию в структуре причин врожденной СНТ, однако является верифицированным тератогенным фактором, поражающим в том числе и слуховой анализатор плода [8].
Частота инфицирования плода и риск развития эмбриопатии зависят от срока гестации на момент заражения матери. Если на ранних сроках беременности плод инфицируется приблизительно в 70—90% случаев и в 50% случаев развивается эмбриопатия, то в последующем частота эмбриопатий падает до 25%. При заболевании матери краснухой непосредственно перед зачатием случаев инфицирования плода не выявлено. Заражение матери с 1-й по 11-ю неделю беременности вызывает множественные пороки развития органов. При инфицировании с 12-й по 17-ю неделю беременности возможно развитие одно- или двусторонней тугоухости, связанной с поражением внутреннего уха разной степени тяжести. При краснухе у матери в сроки гестации более 18 недель пороков развития у новорожденных не отмечено [2, 3].
После того, как поставлен диагноз первичной инфекции у матери, с помощью инвазивной пренатальной диагностики оценивают состояние плода: выявление вируса посредством ПЦР возможно в конце первого триместра (в ворсинах хориона) и во втором триместре (в околоплодных водах). При отрицательном результате, как правило, считается возможным сохранение беременности. Для обнаружения антител класса IgM и IgG к вирусу краснухи в крови беременных используется ИФА, при этом определение индекса авидности (степень прочности связывания молекулы антитела с молекулой антигена) IgG-антител к возбудителю помогает отличить первичную инфекцию от вторичной (реинфекция), что позволяет определить риск трансмиссии вируса плоду [2].
Клиника врожденной краснухи включает в себя триаду Грегга: пороки сердца, внутреннего уха и органа зрения. Вирус, проникая в ductusendolymphaticus через сосудистую полоску, поражает кортиев орган и способствует развитию лабиринтита, что приводит к формированию СНТ [1, 2].
Семейство герпесвирусов включает большое число ДНК-содержащих вирусов, вносящих значительный вклад в структуру заболеваемости ВУИ. Ведущая роль в возникновении СНТ отводится цитомегаловирусу, который, наряду с мутацией в гене коннексина, является основной причиной развития прелингвальной тугоухости, проявляющейся отсрочено, через несколько месяцев после рождения [9, 10]. Частота встречаемости СНТ у детей, внутриутробно инфицированных вирусом простого герпеса, крайне мала, а потому проведение скрининга на наличие Herpes Simplex у новорожденных с впервые выявленной СНТ не является оправданным [7].
Трансплацентарное заражение плода вирусом ветряной оспы (Varicellazoster virus) до срока 20 нед влечет за собой либо внутриутробную гибель плода, либо возникновение аномалий развития, в том числе патологию органа слуха, зрения, повреждения ЦНС, гипоплазию лимба. При инфицировании плода на более поздних сроках гестации клинические проявления ветряной оспы могут развиваться после рождения или не возникать вовсе [3].
Вирусный геном цитомегаловируса (ЦМВ) разделен на UL- и US-области, ответственные за синтез белка UL54 (ДНК-полимераза). Он заключен в капсид, покрытый, в свою очередь, оболочкой, в составе которой содержится фосфопротеин 65 (pp65), являющийся самым иммуногенным белком вируса и, соответственно, мишенью для Т-лимфоцитов при иммунном ответе. Наружная оболочка вируса включает в себя gB-комплекс, gM/gN-комплекс и gH/gL/gO-комплекс. У сероположительных людей образуются тропные к этим гликопротеинам противовирусные антитела, которые потенциально могут быть использованы при изготовлении вакцины [2, 11].
Распространенность ЦМВ-инфекции (ЦМВИ) среди новорожденных составляет, по разным данным, от 0,18 до 2,5%. Выделены следующие факторы риска возникновения врожденной ЦМВИ: совместное проживание более трех человек, наличие в окружении беременной детей дошкольного возраста, небелая раса, низкий социальный уровень и возраст матери менее 25 лет [12]. Значимым фактором в распространении врожденной ЦМВИ является ее латентное течение у большинства взрослых людей и малая их осведомленность об опасности, которую влечет за собой заражение плода. У взрослых ЦМВИ может протекать бессимптомно или проявляться неспецифическими симптомами (общая слабость, боль в горле, увеличение небных миндалин), реже — сиалоаденитом, и, несмотря на свою широкую распространенность, редко диагностируется, за исключением случаев заболевания у больных с различными формами иммунодефицита [13].
У взрослых ЦМВИ может протекать бессимптомно или проявляться неспецифическими симптомами (общая слабость, боль в горле, увеличение небных миндалин), реже — сиалоаденитом, и, несмотря на свою широкую распространенность, редко диагностируется, за исключением случаев заболевания у больных с различными формами иммунодефицита [13].
Базисными тестами для диагностики ЦМВИ, помимо реакции связывания комплемента и иммунофлюоресценции для определения IgG-, IgM-, IgA-антител к ЦМВ, являются, в основном, непрямые иммуноферментные тесты. В качестве антигена обычно используют экстракты лизированных инфицированных вирусом клеток или очищенные вирусные частицы. Для определения IgM- и IgA-антител также существует метод «захвата». Для дифференцирования первичной, возвратной или более ранней инфекции в качестве дополнительных тестов применяют качественное определение IgM/IgG-антител методом иммуноблоттинга, оценивают индекс авидности IgG-антител и выявляют антитела класса IgM и IgG к рекомбинантному основному предраннему неструктурному белку ЦМВ посредством ИФА [3].
Имеющаяся иногда несогласованность между параметрами иммунного ответа и клиническими проявлениями накладывает дополнительные ограничения на серологический анализ в диагностике ЦМВИ. Это обусловлено особенностями иммунного ответа при данном заболевании, часто возникающем на фоне иммунодефицитного состояния пациента. Поэтому важную роль в постановке диагноза ЦМВИ играет определение вирусных антигенов и вирусной ДНК [14].
Основным путем передачи ЦМВИ от матери плоду является трансплацентарный. ВУИ может быть вызвана реактивацией вируса у сероположительных матерей, инфицированием сероположительной женщины новым штаммом ЦМВ или же первичным заражением женщин, не инфицированных ранее [15]. Первичная ЦМВИ во время беременности встречается у 1—4% ранее серонегативных женщин, при этом риск передачи вируса плоду составляет 30—40%. Реактивация вируса отмечается у 10—30% сероположительных женщин на всех сроках гестации. В данном случае риск инфицирования плода составляет 1—3%. При первичном инфицировании беременной женщины риск развития ВУИ в первом, втором и третьем триместрах составляет 25, 50 и 75% соответственно, тогда как при реинфекции вероятность инфицирования плода составляет от 0,15 до 2% [3].
При первичном инфицировании беременной женщины риск развития ВУИ в первом, втором и третьем триместрах составляет 25, 50 и 75% соответственно, тогда как при реинфекции вероятность инфицирования плода составляет от 0,15 до 2% [3].
Диагностика врожденной ЦМВИ может быть осуществлена уже в антенатальном периоде. При первичной материнской инфекции можно выявить вирусную ДНК в плацентарной ткани (производится биопсия хориона или плаценты) или амниотической жидкости с помощью ПЦР. По данным некоторых исследований, предиктором развития внутриутробной инфекции плода при заражении матери является высокий титр ЦМВ в околоплодных водах. Титр вируса в амниотической жидкости также является показателем, позволяющим предсказать развитие острой или латентной формы врожденной инфекции у ребенка. ПЦР-диагностика выполняется при необычных результатах ультразвукового обследования в конце второго триместра беременности. При этом наряду с биопсией плаценты также целесообразно проводить кордоцентез (забор пуповинной крови). Поскольку при отрицательной ПЦР нельзя уверенно исключить инфекцию плода к более позднему моменту времени, необходимы дальнейшие серологический и сонографический контроль [3, 16, 17].
Поскольку при отрицательной ПЦР нельзя уверенно исключить инфекцию плода к более позднему моменту времени, необходимы дальнейшие серологический и сонографический контроль [3, 16, 17].
Подтвердить наличие вируса у новорожденного можно путем его выделения методом ПЦР при исследовании пуповинной крови, ткани плаценты, мочи или слюны ребенка, спинномозговой жидкости или посредством обнаружения антител к ЦМВ класса IgM в крови. Основными материнскими антителами, циркулирующими в крови новорожденного, являются IgG, а потому наличие в крови IgM является показательным для врожденной инфекции, так как данный вид антител не проникает через плаценту. Доказано, что в моче и крови детей с острой формой инфекции выделяется больше ЦМВ, чем у детей с латентной формой инфекции [3, 14, 18].
К наиболее распространенным клиническим проявлениям врожденной ЦМВИ относятся: желтуха (развивается в 62% случаев), петехии (58%) и гепатоспленомегалия (50%), представляющие классическую триаду острой ЦМВИ. Также вирус может вызывать недоношенность плода, отставание внутриутробного развития, асцит, неиммунный гидропс, гипотонию, церебральную вентрикуломегалию, внутримозговые кальцинаты, микроцефалию, поражения органа слуха, реже — гепатит, пневмонию, остеит, внутримозговые кровоизлияния. В других случаях инфекция может протекать в виде латентной формы, которая диагностируется, как правило, отсроченно, при развитии осложнений [3, 19].
Также вирус может вызывать недоношенность плода, отставание внутриутробного развития, асцит, неиммунный гидропс, гипотонию, церебральную вентрикуломегалию, внутримозговые кальцинаты, микроцефалию, поражения органа слуха, реже — гепатит, пневмонию, остеит, внутримозговые кровоизлияния. В других случаях инфекция может протекать в виде латентной формы, которая диагностируется, как правило, отсроченно, при развитии осложнений [3, 19].
Одним из осложнений врожденной ЦМВИ у детей является СНТ [10, 16, 19—22]. По данным ретроспективного исследования, у 10% детей с врожденной СНТ и 35% с возникшими впоследствии нарушениями слуха ЦМВИ была верифицирована при рождении [8]. Частота встречаемости СНТ составляет 10—15% среди всех инфицированных детей: 30—40% среди детей, перенесших острую форму ЦМВИ, и 5—10% — латентную форму. ЦМВИ вносит существенный вклад в структуру общей заболеваемости СНТ, составляя от 15 до 21% от всех регистрируемых случаев снижения слуха у детей [12].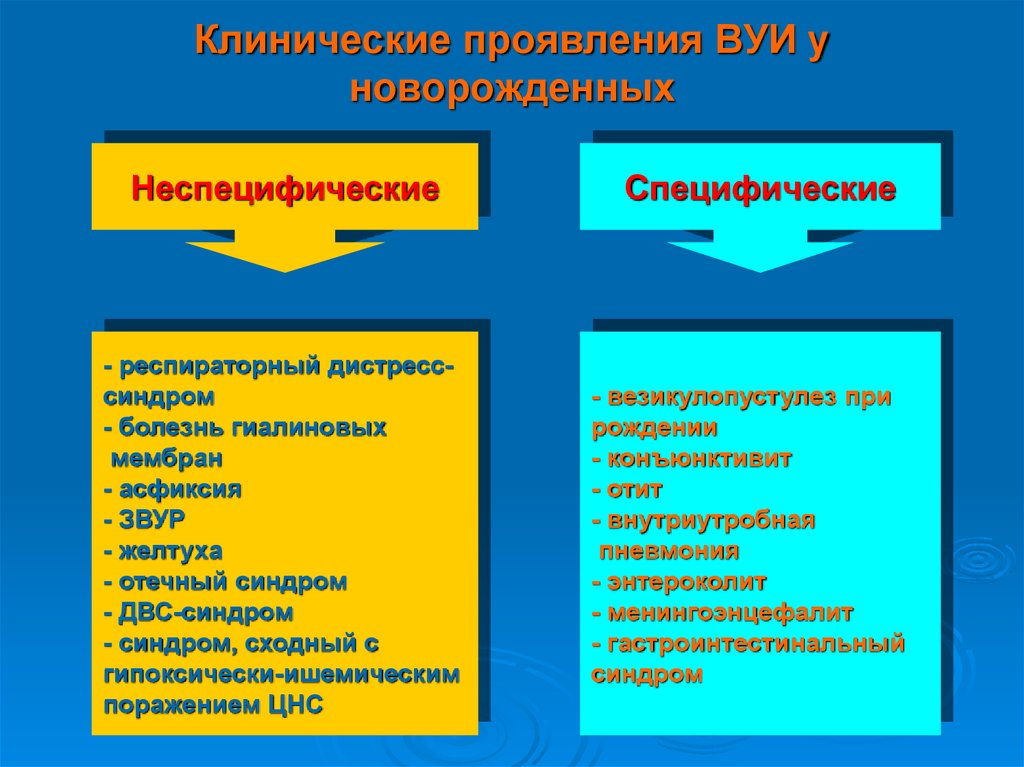 СНТ развивается у каждого пятого внутриутробно инфицированного ЦМВ новорожденного. Это делает внутриутробную ЦМВИ одной из основных причин развития генетически недетерминированной тугоухости. В то же время у 84% зараженных ЦМВ новорожденных вирусная инфекция протекает латентно, без развития СНТ и какой-либо другой симптоматики [8]. Тугоухость может проявляться сразу после рождения, в течение первого года жизни или манифестировать отсрочено вплоть до 5—6-летнего возраста. Она может иметь различную степень тяжести и носить одно- или двусторонний характер в зависимости от уровня поражения слухового анализатора, может быть флюктуирующей или прогрессирующей [8, 22].
СНТ развивается у каждого пятого внутриутробно инфицированного ЦМВ новорожденного. Это делает внутриутробную ЦМВИ одной из основных причин развития генетически недетерминированной тугоухости. В то же время у 84% зараженных ЦМВ новорожденных вирусная инфекция протекает латентно, без развития СНТ и какой-либо другой симптоматики [8]. Тугоухость может проявляться сразу после рождения, в течение первого года жизни или манифестировать отсрочено вплоть до 5—6-летнего возраста. Она может иметь различную степень тяжести и носить одно- или двусторонний характер в зависимости от уровня поражения слухового анализатора, может быть флюктуирующей или прогрессирующей [8, 22].
Патогенез развития СНТ при врожденной ЦМВИ изучен недостаточно детально, обусловлен цитопатическим действием вируса и развитием местного иммунного ответа [19]. ЦМВ и фрагменты вирусной ДНК были обнаружены в перилимфе пациентов с врожденной ЦМВИ [15]. ЦМВИ, развивающаяся в первые 7—8 нед беременности, вызывает развитие мальформации улитки, расширение водопровода и деформацию Мондини.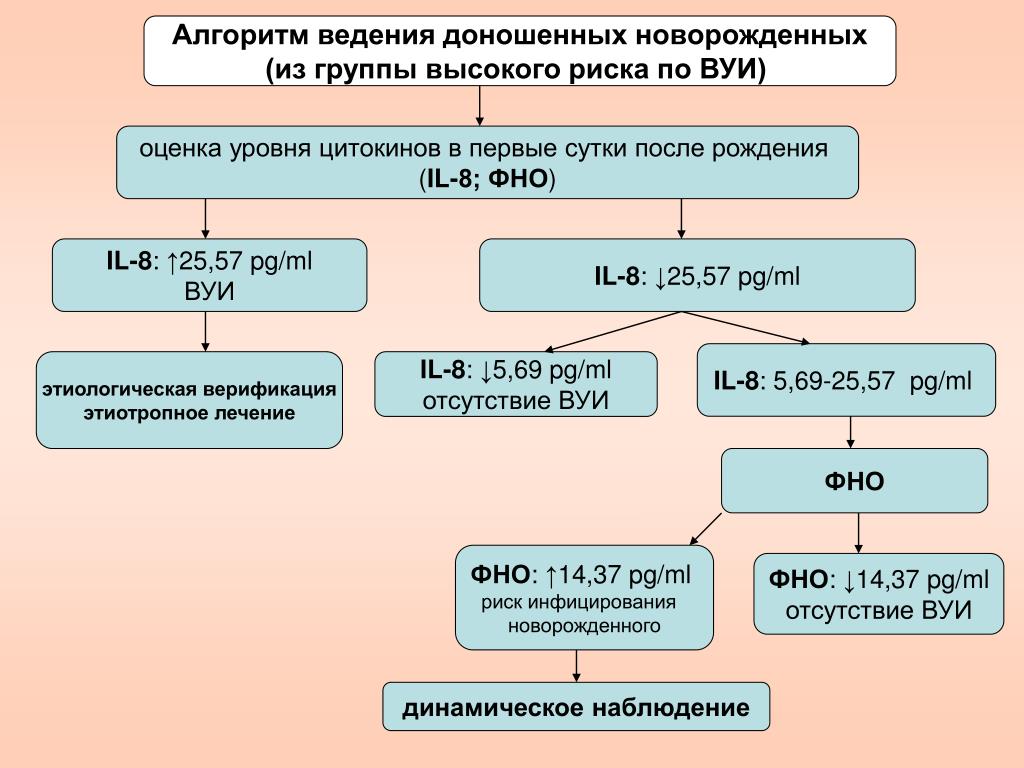 Доказано, что ЦМВ проникает в эндолимфу через сосудистую полоску, что подтверждено путем выделения вируса из перилимфы методом ПЦР. По данным некоторых исследований, белок UL76, специфический для всего семейства герпесвирусов, индуцирует мутацию клеточной ДНК [15]. Именно эти специфические поломки генома могут быть причиной морфологических изменений и, как следствие, развития СНТ [23]. Ген USH2A, ближайший к месту поломки, индуцированной ЦМВ, ответственен за синтез белка, значимого в патогенезе синдрома Ушера 2-го типа. Кроме того, в патогенезе СНТ при врожденной ЦМВИ не исключается роль плацентарной гипоксии вследствие поражения вирусом ткани плаценты, которое последовательно носит характер воспаления, фиброза и некроза [15].
Доказано, что ЦМВ проникает в эндолимфу через сосудистую полоску, что подтверждено путем выделения вируса из перилимфы методом ПЦР. По данным некоторых исследований, белок UL76, специфический для всего семейства герпесвирусов, индуцирует мутацию клеточной ДНК [15]. Именно эти специфические поломки генома могут быть причиной морфологических изменений и, как следствие, развития СНТ [23]. Ген USH2A, ближайший к месту поломки, индуцированной ЦМВ, ответственен за синтез белка, значимого в патогенезе синдрома Ушера 2-го типа. Кроме того, в патогенезе СНТ при врожденной ЦМВИ не исключается роль плацентарной гипоксии вследствие поражения вирусом ткани плаценты, которое последовательно носит характер воспаления, фиброза и некроза [15].
Во время проведения аудиологического скрининга новорожденных с бессимптомной формой врожденной ЦМВИ в раннем послеродовом периоде методом отоакустической эмиссии и регистрации слуховых вызванных потенциалов такие дети, как правило, показывают нормальные результаты. Развитие прогрессирующей СНТ часто является первым симптомом наличия ЦМВИ [24]. Средний возраст выявления тугоухости на первом году жизни составляет 7,4±3,7 мес [24]. Однако нарушение слуха может обнаруживаться и в более поздние сроки, при этом средний возраст манифестации СНТ при инаппарантной форме ЦМВИ составляет 44, а при клинической — 33 мес [25].
Развитие прогрессирующей СНТ часто является первым симптомом наличия ЦМВИ [24]. Средний возраст выявления тугоухости на первом году жизни составляет 7,4±3,7 мес [24]. Однако нарушение слуха может обнаруживаться и в более поздние сроки, при этом средний возраст манифестации СНТ при инаппарантной форме ЦМВИ составляет 44, а при клинической — 33 мес [25].
ЦМВ может поражать ЦНС, при этом могут наблюдаться общая вялость, задержка психомоторного развития, микроцефалия, параличи, парезы, умственная отсталость [26]. По данным некоторых авторов, о возможности развития осложнений со стороны ЦНС можно судить, исходя из неврологической картины в раннем послеродовом периоде: при нормальной картине прогноз хороший, при наличии каких-либо аномалий вероятность развития отдаленных осложнений составляет более 80%. Также прогноз заболевания коррелирует с вирусной нагрузкой в крови, оцениваемой посредством ПЦР. Отмечено, что у детей с подтвержденной ЦМВИ сочетание диагностированных при рождении микроцефалии, расширения желудочков головного мозга, ретинита является достоверным предиктором отставания в развитии в последующем. В целом, риск возникновения осложнений у плода значительно выше при инфицировании в первой половине беременности. Показатели смертности составляют, по разным данным, от 5—10 до 30% при симптоматической форме инфекции. Как правило, причиной гибели является не поражение ЦНС, а дисфункция печени, которая влечет за собой развитие кровотечений [2, 3].
В целом, риск возникновения осложнений у плода значительно выше при инфицировании в первой половине беременности. Показатели смертности составляют, по разным данным, от 5—10 до 30% при симптоматической форме инфекции. Как правило, причиной гибели является не поражение ЦНС, а дисфункция печени, которая влечет за собой развитие кровотечений [2, 3].
Лечение симптоматической врожденной ЦМВИ складывается из этиотропной и синдромальной терапии. Последняя зависит от клинических проявлений заболевания. Так, при нарушении функции печени проводят терапию как при вирусном гепатите. При пневмонии дополнительно назначают антибиотики. Рекомендуется использовать общеукрепляющие, гипосенсибилизирующие, седативные и другие симптоматические средства. Собственно противовирусная терапия неонатальной ЦМВИ заключается в назначении, главным образом, антицитомегаловирусного иммуноглобулина, препаратов рекомбинантного интерферона альфа-2b, а также ганцикловира, валганцикловира, которые используются реже вследствие их токсичности [27, 28]. После проведения противовирусной терапии у пациентов, инфицированных ЦМВ, зачастую наблюдается остановка прогрессирования или даже регресс СНТ. При поражении ЦНС неврологическая симптоматика также может подвергаться обратному развитию [26].
После проведения противовирусной терапии у пациентов, инфицированных ЦМВ, зачастую наблюдается остановка прогрессирования или даже регресс СНТ. При поражении ЦНС неврологическая симптоматика также может подвергаться обратному развитию [26].
Профилактика врожденной ЦМВИ заключается в раннем выявлении беременных, серонегативных в отношении ЦМВ, а также гигиенической профилактике заражения беременной женщины и, соответственно, новорожденного. В наши дни ведутся исследования по разработке вакцины от ЦМВ (CMV glycoprotein B vaccine), получены обнадеживающие результаты, однако остается еще много неразрешенных вопросов относительно ее практического внедрения [2, 3].
Так как инфицирование плода возможно на любом сроке гестации, а обследовать беременных женщин на ЦМВ в течение всей беременности не представляется возможным, нельзя полностью исключить наличие инфекции у новорожденного даже при отрицательном результате анализа у матери. Следовательно, необходимо проводить обязательный скрининг на ЦМВ в роддомах [18]. Что касается аудиологического скрининга, то необходимо учитывать возможность развития отсроченной тугоухости. Потому все дети, инфицированные ЦМВ, должны оставаться под динамическим наблюдением врачей сурдологов, по крайней мере, до 5—6-летнего возраста [22, 25].
Что касается аудиологического скрининга, то необходимо учитывать возможность развития отсроченной тугоухости. Потому все дети, инфицированные ЦМВ, должны оставаться под динамическим наблюдением врачей сурдологов, по крайней мере, до 5—6-летнего возраста [22, 25].
Конфликт интересов отсутствует .
Диагностика внутриутробных инфекций у новорожденных в раннем неонатальном периоде | Аксенов А.Н., Бочарова И.И., Башакин Н.Ф., Троицкая М.В., Якубина А.А., Букина М.Ю., Будыкина Т.С.
Внутриутробная инфекция (ВУИ) занимает одно из ведущих мест в структуре неонатальной смертности, являясь основной причиной смерти или осложняя течение основного заболевания у 37,5% умерших новорожденных.
Достоверных данных об истинной распространенности ВУИ нет. Однако, согласно данным ряда исследований, инфекционные заболевания выявляют у 50–60% госпитализированных доношенных и 70% недоношенных новорожденных [1]. Основной причиной ВУИ являются инфекционные урогенитальные заболевания матери, частота которых в структуре заболеваемости беременных сохраняется высокой в течение последних 10 лет и составляет 88–100 на 1000 беременных. К сожалению, в настоящее время мы не имеем достоверных сведений о вероятности заражения плода от инфицированной матери, но риск инфицирования плода различными микроорганизмами, выделенными у матери, колеблется от 5 до 70%, а данные о частоте реализации инфекции у новорожденного недостаточны и крайне противоречивы [2, 3].
Основной причиной ВУИ являются инфекционные урогенитальные заболевания матери, частота которых в структуре заболеваемости беременных сохраняется высокой в течение последних 10 лет и составляет 88–100 на 1000 беременных. К сожалению, в настоящее время мы не имеем достоверных сведений о вероятности заражения плода от инфицированной матери, но риск инфицирования плода различными микроорганизмами, выделенными у матери, колеблется от 5 до 70%, а данные о частоте реализации инфекции у новорожденного недостаточны и крайне противоречивы [2, 3].
Ранняя диагностика инфекционно-воспалительных заболеваний у новорожденных остается актуальной до настоящего времени, в связи с чем в последние годы применяются новые информативные диагностические методики. К ним относятся исследование цитокинового статуса [4, 5], определение белков острой фазы (С-реактивный белок) [6, 7] и прокальцитонина (ПКТ) [8, 9], а также другие диагностические тесты, характеризующиеся выявлением того или иного достоверно отличающегося параметра [10–14].
Большой интерес представляет исследование роли про- и противовоспалительных цитокинов в патогенезе инфекционных заболеваний у новорожденных [15–17]. Во многих работах [18–20] сообщается о высокой диагностической и прогностической ценности определения уровней ФНО и ИЛ-8 при неонатальном сепсисе. Некоторые авторы [21, 22] для повышения информативности теста на С-реактивный белок предлагают использовать его комбинацию с определением уровня ИЛ-6, который играет важную роль в запуске синтеза С-реактивного белка гепатоцитами, при диагностике неонатальных бактериальных инфекций.
Доказано, что ПКТ является чувствительным маркером системной воспалительной реакции у новорожденных на 3-7-е сут жизни, а после 14-го дня жизни отмечается увеличение диагностической значимости провоспалительных цитокинов. Однако ПКТ может превосходить C-реактивный белок в определении и оценке тяжести инфекции, о чем свидетельствует опыт многих исследований. Несмотря на большое число публикаций, посвященных диагностической значимости ПКТ при системных инфекциях, в т. ч. и у новорожденных, нет однозначного мнения о возможности использования этого показателя при диагностике инфекционно-воспалительных заболеваний в первые 2 сут жизни в связи с большим разбросом его контрольных диапазонов в данный возрастной период [8, 23, 24].
ч. и у новорожденных, нет однозначного мнения о возможности использования этого показателя при диагностике инфекционно-воспалительных заболеваний в первые 2 сут жизни в связи с большим разбросом его контрольных диапазонов в данный возрастной период [8, 23, 24].
Цель настоящего исследования: повысить качество диагностики ВУИ и оптимизировать тактику ведения новорожденных высокого инфекционного риска в раннем неонатальном периоде путем применения алгоритма обследования с использованием доступных и информативных тестов.
Материалы и методы
Было проведено обследование 240 доношенных и 10 недоношенных новорожденных, родившихся у матерей с инфекционно-воспалительными заболеваниями урогенитального тракта. Среди беременных преимущественно вирусные инфекции отмечались в 35 (14%) наблюдениях, бактериальные — в 30 (12%), а в 185 (74%) — встречались смешанные вирусно-бактериальные инфекции. Урогенитальный хламидиоз диагностирован у 85 (34%) пациенток, уреаплазма выявлялась в 75 (30%) наблюдениях, микоплазмы — в 30 (12%) случаях. ВПГ-2 инфекция обнаружена у 135 (54%) матерей, цитомегаловирусная инфекция (ЦМВИ) — у 180 (72%). Хронические заболевания почек и мочевыводящих путей имели 45 (18%) женщин, у каждой пятой пациентки (20%) к моменту родоразрешения сохранялись проявления кольпита, у 40 (16%) — цервицита.
ВПГ-2 инфекция обнаружена у 135 (54%) матерей, цитомегаловирусная инфекция (ЦМВИ) — у 180 (72%). Хронические заболевания почек и мочевыводящих путей имели 45 (18%) женщин, у каждой пятой пациентки (20%) к моменту родоразрешения сохранялись проявления кольпита, у 40 (16%) — цервицита.
Течение настоящей беременности осложнилось присоединением преэклампсии у 50 (20%) матерей, с такой же частотой была диагностирована анемия беременных, угроза прерывания беременности имела место примерно у половины (46%) пациенток. По результатам комплексной оценки нарушения функции фетоплацентарного комплекса были диагностированы у 100 (40%) беременных, многоводие — в 30 (12%) наблюдениях.
Роды были самопроизвольными в 160 (64%) наблюдениях, путем операции кесарева сечения родоразрешение было выполнено 86 (34,4%) беременным, у 4 (1,6%) рожениц была применена вакуум-экстракция плода. Продолжительность родов колебалась от 2,75 до 18 ч, длительность безводного промежутка — от 2,5 до 24 ч. Роды осложнились слабостью родовой деятельности в 40 (16%) наблюдениях, дородовое излитие околоплодных вод отмечалось у 30 (12%) рожениц. У 20 (8%) пациенток в родах развился хориоамнионит.
Роды осложнились слабостью родовой деятельности в 40 (16%) наблюдениях, дородовое излитие околоплодных вод отмечалось у 30 (12%) рожениц. У 20 (8%) пациенток в родах развился хориоамнионит.
Для выявления клинико-лабораторных корреляций новорожденные были разделены на 6 групп в зависимости от основного клинического диагноза.
1-ю группу составили 45 (18%) новорожденных с генерализованными и тяжелыми локализованными формами ВУИ, которые включали сепсис, менингоэнцефалит, пневмонию, гастроэнтероколит.
2-я группа состояла из 30 (12%) новорожденных с локализованными инфекционными процессами средней степени тяжести, а именно: везикулопустулез, конъюнктивит, ринит, омфалит, вульвовагинит, локальные формы кандидоза.
3-я группа объединила 25 (10%) новорожденных с выявленными при ультразвуковых исследованиях морфологическими изменениями в центральной нервной системе (ЦНС) и внутренних органах, что позволило предположить перенесенную ВУИ.
4-ю группу составили 30 (12%) новорожденных с гипоксическими повреждениями ЦНС разной степени тяжести.
5-я группа включала 28 (11,2%) новорожденных с задержкой внутриутробного развития (ЗВУР).
6-я группа состояла из 92 (36,8%) клинически здоровых новорожденных.
Наряду со стандартным клинико-лабораторным обследованием, которое проводилось всем новорожденным, 158 детям было проведено ультразвуковое исследование вилочковой железы (ВЖ) — ультразвуковая тимометрия, у 90 новорожденных в рамках иммунологического обследования было проведено исследование интерферонового статуса (ИФС) и концентрации цитокинов (ФНО-α, ИЛ-1, ИЛ-4, ИЛ-6, ИЛ-8, α- и γ-ИФН) в сыворотке крови, спонтанных и стимулированных культурах клеток крови, у 50 детей определялся уровень ПКТ экспресс-методом.
Частота выделения представителей аэробной микрофлоры в мазках со слизистой носоглотки, из ануса у новорожденных высокого инфекционного риска в момент рождения составила от 40,2% (у клинически здоровых новорожденных) до 62,2% (у детей с тяжелыми формами ВУИ). Для тяжелых форм ВУИ была характерна высокая частота контаминации новорожденных представителями инфекций, передающихся половым путем: ВПГ-2 — 43,6%, ЦМВИ — 58,2%, хламидии — 41,8%, уреаплазма — 52,7%, микоплазма — 32,7%.
Для тяжелых форм ВУИ была характерна высокая частота контаминации новорожденных представителями инфекций, передающихся половым путем: ВПГ-2 — 43,6%, ЦМВИ — 58,2%, хламидии — 41,8%, уреаплазма — 52,7%, микоплазма — 32,7%.
Результаты исследования
На основании оценки клинических данных и показателей иммунитета с использованием перцентильной шкалы основных иммунологических показателей у обследованных новорожденных были выделены следующие варианты иммунного реагирования и состояния цитокинового статуса в раннем неонатальном периоде.
У новорожденных с тяжелыми формами ВУИ (обследовано 14 детей) были выявлены два варианта иммунного реагирования. Первый вариант (8 новорожденных) характеризовался активацией клеток врожденного и адаптивного иммунитета в сочетании с их незрелостью, повышением ИФН в сыворотке крови и способности лейкоцитов к продукции α-ИФН при низкой способности лимфоцитов к выработке γ-ИФН. У 2-х новорожденных, умерших в раннем неонатальном периоде, выявлялось наиболее выраженное угнетение как α-(4–8 МЕ/мл), так и γ-(<4 МЕ/мл) интерфероногенеза при низкой концентрации ИФН в сыворотке крови (<4 МЕ/мл), что позволяет рассматривать эти показатели в качестве прогноза неблагоприятного исхода (р=0,03) у новорожденных с ВУИ. В сыворотке крови у всех детей определялся ИЛ-8 (в 75% наблюдений его количество превышало 50 пкг/мл), имело место снижение продукции ИЛ-6, ИЛ-1, ФНО-α.
В сыворотке крови у всех детей определялся ИЛ-8 (в 75% наблюдений его количество превышало 50 пкг/мл), имело место снижение продукции ИЛ-6, ИЛ-1, ФНО-α.
Второй вариант (6 новорожденных) отличался отсутствием активации иммунитета и повышения ИФН, дефицитом фагоцитов, зрелых Т- и В-лимфоцитов. Способность лейкоцитов к продукции α-ИФН была в пределах нормативных значений, а способность лимфоцитов к продукции γ-ИФН — несколько выше, чем при первом варианте. ИЛ-8 в сыворотке крови определялся в 30% наблюдений (уровень не превышал 50 пкг/мл). Данный вариант иммунного реагирования был характерен для таких форм течения заболевания, которые возникали в результате аспирации и заглатывания околоплодных вод с развитием аспирационных пневмоний, что больше свидетельствовало об интранатальном инфицировании и подтверждалось высокой частотой осложнений в родах, более поздними сроками манифестации ВУИ в раннем неонатальном периоде, отсутствием генерализованных форм инфекции и летальных исходов.
Отличительными чертами иммунного ответа у новорожденных с локализованными инфекционно-воспалительными заболеваниями средней степени тяжести (обследовано 10 новорожденных) являлись: отсутствие изменений количества и зрелости клеток врожденного и адаптивного иммунитета с преобладанием провоспалительного иммунного ответа в виде повышения уровня IgM и сывороточного ИФН, высокой способности к продукции α-ИФН, преобладанием продукции γ-ИФН над продукцией ИЛ-4 (<10 пкг/мл) без иммунологических критериев системной инфекции (отсутствие ИЛ-8 и провоспалительных цитокинов в сыворотке крови, неизмененная продукция лимфокинов и монокинов).
Состояние иммунитета у новорожденных с выявленными при ультразвуковых исследованиях морфологическими изменениями в ЦНС и внутренних органах (обследовано 8 детей) характеризовало законченный к моменту рождения инфекционный процесс. Иммунный ответ характеризовался повышением числа зрелых иммунокомпетентных клеток и уровня IgG, показатели ИФС не отличались от нормативных значений. Была снижена индуцированная продукция ИЛ-1 и ФНО-α, повышена продукция α-ИФН и ИЛ-4, преобладала противовоспалительная направленность иммунного ответа.
Была снижена индуцированная продукция ИЛ-1 и ФНО-α, повышена продукция α-ИФН и ИЛ-4, преобладала противовоспалительная направленность иммунного ответа.
Результаты микробиологического исследования у матерей (герпес-вирусная этиология инфекции в 90,9% случаев) и их новорожденных (выделение ВПГ-2 в 43,6%, ЦМВИ — в 58,2%) в сочетании с нарушениями в цитокиновом статусе в виде усиления продукции α-ИФН, снижения продукции ИЛ-1 и ФНО-α подтверждали вирусную этиологию заболевания. Изменения со стороны ЦНС и внутренних органов, выявленные при рождении, в сочетании с показателями иммунитета позволяют предположить раннее внутриутробное инфицирование, преимущественно вирусной этиологии, с благоприятным исходом для жизнеспособности плода на фоне проводимой этиотропной терапии в антенатальном периоде, но с формированием стойких структурных изменений, преимущественно ЦНС, к моменту рождения.
У новорожденных с гипоксическими повреждениями ЦНС (обследовано 15 новорожденных) гипоксия являлась дополнительным повреждающим фактором, способствующим увеличению антигенной нагрузки, и в условиях низкого риска внутриутробного инфицирования (у 8 детей) приводила к активации клеток врожденного иммунитета без изменений в цитокиновом статусе. При сочетании гипоксии с микробной контаминацией у 7 новорожденных иммунный ответ характеризовался повышенным потреблением макрофагов из кровеносного русла, увеличением уровня IgM в сыворотке крови, усилением продукции провоспалительных цитокинов, снижением способности лимфоцитов к продукции γ-ИФН, что не исключало манифестацию ВУИ, клинические проявления которой на фоне симптомов повреждения ЦНС и проводимой противоинфекционной терапии могли быть стертыми.
При сочетании гипоксии с микробной контаминацией у 7 новорожденных иммунный ответ характеризовался повышенным потреблением макрофагов из кровеносного русла, увеличением уровня IgM в сыворотке крови, усилением продукции провоспалительных цитокинов, снижением способности лимфоцитов к продукции γ-ИФН, что не исключало манифестацию ВУИ, клинические проявления которой на фоне симптомов повреждения ЦНС и проводимой противоинфекционной терапии могли быть стертыми.
Иммунный ответ у новорожденных со ЗВУР (обследовано 14 детей) характеризовался снижением количества клеток врожденного и адаптивного иммунитета (CD3+, CD20+, CD8+, CD16+, моноцитов). Были установлены два типа ИФС. Отличительными особенностями первого типа ИФС были отсутствие ИФН в сыворотке крови и высокая способность лимфоцитов к продукции γ-ИФ. Второй тип ИФС был сопряжен с повышением сывороточного ИФН (16 МЕ/мл) и низкой способностью лимфоцитов к продукции γ-ИФН (<4 МЕ/мл). Имелась статистически значимая зависимость (р=0,004) между вторым типом ИФС и частотой постнатальной инфекции у новорожденных со ЗВУР, которая составила 64,3% (заболели 9 новорожденных).
Показатели иммунитета и цитокинового статуса у клинически здоровых новорожденных без микробной контаминации (обследовано 17 детей) не отличались от нормативных значений. Микробная контаминация у клинически здоровых новорожденных (12 детей) иммунологически характеризовалась увеличением числа зрелых клеток адаптивного иммунитета (CD3+, CD20+, CD4+, CD8+, CD16+), уровня IgG, уменьшением числа клеток врожденного иммунитета (нейтрофилов и моноцитов), повышением способности лейкоцитов к продукции α-ИФН (128 МЕ/мл и 545,3 пкг/мл), ИЛ-1 (329,6 пкг/мл) и ФНО-α (748,6 пкг/мл) в 1,5–2 раза. Продукция γ-ИФН, ИЛ-6 и ИЛ-4 не отличалась от нормативных значений, сохранялся баланс продукции γ-ИФН (22,5 пкг/мл) и ИЛ-4 (23,5 пкг/мл). Изменения показателей иммунитета у здоровых новорожденных от матерей с урогенитальными инфекциями зависели от наличия микробной контаминации, которая характеризовалась повышением числа зрелых иммунокомпетентных клеток, способных к выработке про- и противовоспалительных цитокинов, поддержание баланса которых препятствовало манифестации ВУИ.
Иммунологическими критериями ранней диагностики тяжелых форм ВУИ у новорожденных являются: повышение уровня IgM более 1,0 г/л и снижение уровня IgG менее 6,6 г/л в сыворотке крови; повышение в периферическом кровотоке ранних предшественников Т- и В-лимфоцитов — более 70,4%, незрелых Т-лимфоцитов — более 19,4%; повышение ИФН в сыворотке крови до 16 МЕ/мл и более в сочетании со снижением способности лимфоцитов к продукции γ-ИФН менее 4 МЕ/мл или менее 3,0 пкг/мл; увеличение содержания ИЛ-8 в сыворотке крови более 50 пкг/мл и (или) снижение продукции γ-ИФН менее 3,0 пкг/мл в сочетании с низкой продукцией ИЛ-4 (менее 10 пкг/мл).
Поскольку основным органом иммунной системы у плода и новорожденного является тимус, были сопоставлены морфологические особенности ВЖ и иммунного статуса новорожденных группы высокого инфекционного риска для выявления информативных и доступных критериев ранней диагностики ВУИ и иммунной недостаточности. Проведенные исследования показали четкую взаимосвязь между объемом ВЖ, наличием и тяжестью клинических проявлений ВУИ и дефектами иммунитета у новорожденных в раннем неонатальном периоде (табл. 1).
1).
Выявленная эхоскопически тимомегалия с объемом ВЖ более 2,5 мл/кг была статистически значимой для тяжелых форм ВУИ с нарушениями иммунного ответа в виде незрелости и активации клеток врожденного и адаптивного иммунитета с глубоким нарушением их эффекторных функций. Уменьшение объема ВЖ менее 1 мл/кг коррелировало с дисфункцией иммунитета в виде дефицита зрелых иммунокомпетентных клеток и недостаточности провоспалительного иммунного ответа, что клинически характеризовалось затяжным течением ВУИ и высокой частотой постнатальных инфекционно-воспалительных заболеваний у новорожденных.
Учитывая диагностическую значимость ПКТ при системных инфекциях, в т. ч. и у новорожденных, а также большой разброс контрольных диапазонов этого показателя в первые 2 сут жизни, было проведено исследование уровня ПКТ экспресс-методом у 40 доношенных и 10 недоношенных новорожденных.
Новорожденные были разделены на 4 группы с учетом характера патологии.
1-я группа состояла из 21 новорожденного с внутриутробной пневмонией.
2-я группа включала 6 новорожденных, у которых по сумме данных анамнеза, клинических симптомов и результатов лабораторного обследования была диагностирована ВУИ без четко установленного очага.
3-я группа объединила 13 новорожденных с патологией неинфекционного характера.
В 4-ю группу были включены 10 клинически здоровых новорожденных.
Исследование ПКТ у новорожденных проводилось на 1-е, 2-е и 3-и сут жизни (табл. 2).
Повышение уровня ПКТ более 2 нг/мл в первые сутки жизни было статистически значимым для тяжелых форм ВУИ, сопровождающихся системной воспалительной реакцией и симптомами органной недостаточности. В то же время у новорожденных без симптомов инфекционно-воспалительных заболеваний не отмечалось повышения уровня ПКТ в сыворотке крови в первые 48 ч жизни. Полученные результаты исследования позволяют использовать повышение уровня ПКТ более 2 нг/мл в качестве раннего диагностического критерия тяжелых форм ВУИ у новорожденных, начиная с первых суток жизни.
Заключение
Таким образом, в нашем исследовании показана четкая взаимосвязь между наличием и тяжестью клинических проявлений ВУИ, дефектами иммунитета, состоянием ВЖ и результатами полуколичественного экспресс-теста на определение ПКТ. Предложенные иммунологические показатели нарушений цитокинового статуса и ультразвуковые критерии патологии ВЖ, повышение ПКТ более 2 нг/мл с первых суток жизни могут быть использованы в качестве критериев ранней диагностики и тяжести ВУИ.
Литература
- Сидорова И.С., Макаров И.О., Матвиенко Н.А. Внутриутробные инфекции. М.: МИА, 2006. 176 с.
- Фризе К., Кахель В. Инфекционные заболевания беременных и новорожденных. Пер. с нем. М.: Медицина, 2003. 424 с.
- Неонатология – национальное руководство / Под ред. Н.Н. Володина. М.: ГЭОТАР-Медиа, 2008. 749 с.
- Ахматова Н.К., Киселевский М.В. Врожденный иммунитет: противоопухолевый и противоинфекционный.
 М.: Практическая медицина, 2008. 256 с.
М.: Практическая медицина, 2008. 256 с. - Akira S., Uematsu S., Takeuchi O. Pathogen recognition and innate immunity // Cell. 2006. Vol. 124 (4). P. 783–801.
- Липагина А.А. Диагностическое и прогностическое значение исследования белков острой фазы и иммуноглобулинов у новорожденных детей из группы риска по развитию гнойно-септических заболеваний: автореф. дис. на соиск. учен. степ. к.м.н. М., 2000.19 с.
- Hofer N., Zacharias E., Müller W., Resch B. An update on the use of C-reactive protein in early-onset neonatal sepsis: current insights and new tasks // Neonatol. 2012. Vol. 102(1). P. 25–36.
- Бирюкова Т.В., Солдатова И.Г., Милева О.И. и др. Диагностическая информативность уровня прокальцитонина в сыворотке крови новорожденных при раннем неонатальном сепсисе // Вопросы практической педиатрии. 2007. № 3. С. 5–11.
- Casado-Flores J., Blanco-Quirós A., Asensio J. et al. Serum procalcitonin in children with suspected sepsis: a comparison with C-reactive protein and neutrophil count // Pediatr.
 Crit. Care Med. 2003. P.190–195.
Crit. Care Med. 2003. P.190–195. - Дегтярева М.В. Современные возможности иммунокорригирующей терапии тяжелых инфекционно-воспалительных и иммунопатологических состояний у новорожденных // Иммунокоррекция в педиатрии / Под ред. М.П. Костинова, М.: Медицина для всех, 2001. С.182–194.
- Ганковская Л.В., Макаров О.В., Ковальчук Л.В. и др. Система цитокинов амниотической жидкости при внутриутробной инфекции // Новые технологии в перинатологии: материалы ежегодного конгресса специалистов перинатальной медицины. М., 2008. С. 19.
- Shozushima T., Takahashi G., Matsumoto N. et al. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diag¬nostic criteria of systemic inflammatory response syndrome // J. Infect. Chemother. 2011. Vol.17(6). P. 764–769.
- Adly A.A., Ismail E.A., Andrawes N.G., El-Saadany M.A. Circulating soluble triggering receptor expressed on myeloid cells-1 (sTREM-1) as diagnostic and prognostic marker in neonatal sepsis // Cytokine.
 2014. Vol. 65(2). P.184–191.
2014. Vol. 65(2). P.184–191. - Fanos V., Caboni P., Corsello G. et al. Urinary (1)H-NMR and GC-MS metabolomics predicts early and late onset neonatal sepsis // Early Hum. Dev. 2014. Vol. 90 (Suppl. 1). S78–S83.
- Дегтярева М.В. Современные возможности иммунокорригирующей терапии тяжелых инфекционно-воспалительных и иммунопатологических состояний у новорожденных // Иммунокоррекция в педиатрии / Под ред. М.П. Костинова. М.: Медицина для всех, 2001. С.182–194.
- Hoebe K., Janssen E., Beutler B. The interface between innate and adaptive immunity // Nat. Immunol. 2004. Vol. 5. P. 971–974.
- Ng P.C., Li K., Wong R.P. Proinflammatory and anti-inflammatory cytokine responses in preterm infants with systemic infections // Arch. Dis. Child. Fetal. Neonatal. Ed. 2003. P. 209–213.
- Володин Н.Н., Дегтярева М.В., Симбирцев А.С. и др. Роль про- и противовоспалительных цитокинов в иммунной адаптации новорожденных детей // Intern.
 J. Immunorehabilit. 2000. Vol. 2, № 1. P.175–185.
J. Immunorehabilit. 2000. Vol. 2, № 1. P.175–185. - Santana C., Guindeo M.C., Gonzakz G. Cord blood levels of cytokines as predictors of early neonatal sepsis // Acta Paediatr. 2001. Vol. 90. P.1176–1181.
- Witt A., Berger A., Gruber C.J., Petricevic L. et al. IL-8 concentrations in maternal serum, amniotic fluid and cord blood in relation to different within the amniotic cavity // J. Perinatal. Med. 2005. Vol. 33 (1). P. 22–26.
- Mehr S., Doyle L.W. Cytokines as markers of bacterial sepsis in newborn infants: a review // Pediatr. Infect. Dis. J. 2000. Vol. 19. P. 879–887.
- Pavcnik-Arnol M., Hojker S., Derganc M. Lipopolysaccharide-binding protein in critically ill neonates and children with suspected infection: comparison with procalcitonin, interleukin-6, and C-reactive protein // Intens. Care Med. 2004. Vol. 30(7). P.1454–1460.
- Черняховский О.Б., Абрамова И.В., Полянчикова О.Л. Внутриутробные инфекции у новорожденных, факторы риска // Российский вестник перинатологии и педиатрии.
 2009. № 1. С. 80–88.
2009. № 1. С. 80–88. - McGuire W., Clerihew L., Fowlie P.W. Infection in the preterm infant // BMJ. 2004. Vol. 2. P. 329–341.
Интерпретация общего анализа крови вскоре после рождения у новорожденных с риском развития сепсиса
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Электронная почта: (изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
. 2010 ноябрь; 126(5):903-9.
doi: 10.1542/пед.2010-0935. Epub 2010 25 октября.
Томас Б. Ньюман 1 , Карен М. Пуополо, Сура Ви, Дэвид Дрейпер, Габриэль Дж. Эскобар
принадлежность
- 1 Департамент эпидемиологии и биостатистики, Калифорнийский университет, Сан-Франциско, Box 0560, Сан-Франциско, Калифорния 94143, США. [email protected]
- PMID: 20974782
- PMCID: PMC3197862
- DOI:
10.
 1542/пед.2010-0935
1542/пед.2010-0935
Бесплатная статья ЧВК
Томас Б. Ньюман и соавт. Педиатрия. 2010 ноябрь
Бесплатная статья ЧВК
. 2010 ноябрь; 126(5):903-9.
doi: 10.1542/пед.2010-0935. Epub 2010 25 октября.
Авторы
Томас Б. Ньюман 1 , Карен М. Пуополо, Сура Ви, Дэвид Дрейпер, Габриэль Дж. Эскобар
принадлежность
- 1 Департамент эпидемиологии и биостатистики, Калифорнийский университет, Сан-Франциско, Box 0560, Сан-Франциско, Калифорния 94143, США.
 [email protected]
[email protected]
- PMID: 20974782
- PMCID: PMC3197862
- DOI: 10.1542/пед.2010-0935
Абстрактный
Фон: Полный анализ крови (CBC) с дифференциацией лейкоцитов обычно назначают для оценки новорожденных с риском сепсиса.
Цели: Для количественной оценки того, насколько хорошо компоненты общего анализа крови предсказывают сепсис в первые 72 часа после рождения.
Методы: Для этого ретроспективного кросс-секционного исследования мы выявили 67 623 доношенных и поздних недоношенных (≥ 34 недель гестации) новорожденных из 12 больниц Kaiser в северной Калифорнии и 1 больницы в Бостоне, штат Массачусетс, у которых общий анализ крови и посев крови были проведены в пределах 1 часа друг от друга при < возраст 72 часа. Мы сравнили результаты общего анализа крови у новорожденных, чьи культуры крови были и не были положительными, и количественно оценили дискриминацию, используя кривые рабочих характеристик приемника и отношения правдоподобия.
Мы сравнили результаты общего анализа крови у новорожденных, чьи культуры крови были и не были положительными, и количественно оценили дискриминацию, используя кривые рабочих характеристик приемника и отношения правдоподобия.
Полученные результаты: Культуры крови 245 детей (3,6 из 1000 протестированных новорожденных) были положительными. Среднее количество лейкоцитов (WBC) и среднее абсолютное количество нейтрофилов (ANC) были ниже, а средняя доля незрелых нейтрофилов была выше у новорожденных с инфекцией; количество тромбоцитов не отличалось. Дискриминация улучшалась с возрастом в первые несколько часов, особенно для подсчета лейкоцитов и ANC (например, площадь под кривой рабочей характеристики приемника для подсчета лейкоцитов составляла 0,52 при <1 часе и 0,87 при ≥ 4 часа). Как количество лейкоцитов, так и АЧН были наиболее информативными при очень низком уровне (например, отношение правдоподобия для АЧН < 1000 составляло 115 через ≥ 4 часов). Ни один тест не был очень чувствительным; самое низкое отношение правдоподобия (для количества лейкоцитов ≥ 20 000 через ≥ 4 часа) составило 0,16.
Ни один тест не был очень чувствительным; самое низкое отношение правдоподобия (для количества лейкоцитов ≥ 20 000 через ≥ 4 часа) составило 0,16.
Заключение: Оптимальная интерпретация CBC требует использования интервальных отношений правдоподобия для возраста новорожденного в часах.
Цифры
РИСУНОК 1
Результаты тестирования по возрасту…
РИСУНОК 1
Результаты анализов по возрасту для общего анализа крови, выполненного в
РИСУНОК 1Результаты анализов по возрасту для общего анализа крови, выполненного в
РИСУНОК 2
ROC-кривые для количества лейкоцитов…
РИСУНОК 2
ROC-кривые для количества лейкоцитов (A), ANC (B), отношения I/T (C) и тромбоцитов…
ФИГУРА 2 Кривые ROCдля количества лейкоцитов (A), ANC (B), соотношения I/T (C) и количества тромбоцитов (D), выполненные на
См. это изображение и информацию об авторских правах в PMC
это изображение и информацию об авторских правах в PMC
Похожие статьи
Объединение количества незрелых и общих нейтрофилов для прогнозирования раннего начала сепсиса у доношенных и поздних недоношенных новорожденных: использование I/T2.
Ньюман Т.Б., Дрейпер Д., Пуополо К.М., Ви С., Эскобар Г.Дж. Ньюман Т.Б. и др. Pediatr Infect Dis J. 2014 Aug;33(8):798-802. doi: 10.1097/INF.0000000000000297. Pediatr Infect Dis J. 2014. PMID: 24503598 Бесплатная статья ЧВК.
Использование полного подсчета клеток крови при позднем неонатальном сепсисе.
Хорник С.П., Бенджамин Д.К., Беккер К.С., Бенджамин Д.К. младший, Ли Дж., Кларк Р.Х., Коэн-Волковиз М., Смит П.Б. Хорник С.
 П. и соавт.
Pediatr Infect Dis J. 31 августа 2012 г. (8): 803-7. дои: 10.1097/INF.0b013e31825691e4.
Pediatr Infect Dis J. 2012.
PMID: 22531232
Бесплатная статья ЧВК.
П. и соавт.
Pediatr Infect Dis J. 31 августа 2012 г. (8): 803-7. дои: 10.1097/INF.0b013e31825691e4.
Pediatr Infect Dis J. 2012.
PMID: 22531232
Бесплатная статья ЧВК.Использование подсчета лейкоцитов в оценке сепсиса новорожденных с ранним началом.
Мерфи К., Вайнер Дж. Мерфи К. и др. Pediatr Infect Dis J. 2012 Jan; 31(1):16-9. doi: 10.1097/INF.0b013e31822ffc17. Pediatr Infect Dis J. 2012. PMID: 21860335
СВС или не СВС? Вот в чем вопрос.
Молодой врач общей практики. Молодой ГП. Энн Эмерг Мед. 1986 март; 15(3):367-71. doi: 10.1016/s0196-0644(86)80587-x. Энн Эмерг Мед. 1986 год. PMID: 3511801 Обзор.
Корреляция профиля CBC и инфекционного исхода.
 Исследование детей с лихорадкой, оцененных на предмет сепсиса.
Исследование детей с лихорадкой, оцененных на предмет сепсиса.Бонадио В.А., Смит Д., Кармоди Дж. Бонадио В.А. и соавт. Клин Педиатр (Фила). 1992 октября; 31 (10): 578-82. дои: 10.1177/000992289203101001. Клин Педиатр (Фила). 1992. PMID: 1395363 Обзор.
Посмотреть все похожие статьи
Цитируется
Экономические и диагностические тесты биомаркеров неонатального сепсиса: проспективное исследование в больнице третичного уровня в стране с низким уровнем дохода.
Хадка П., Махарджан Г., Чапагейн Г., Джанука Тапалия, Паудьял П. Хадка П. и др. Биомед Рез Инт. 2022 25 ноября; 2022:5166380. дои: 10.1155/2022/5166380. Электронная коллекция 2022. Биомед Рез Инт. 2022. PMID: 36467887 Бесплатная статья ЧВК.
Консервативное ведение новорожденных с гестационным возрастом 35 недель и более с риском развития раннего сепсиса: бразильское когортное исследование.

Камарго Дж.Ф., Алмейда Дж.Л., Фернандес Л.Ф., Марба СТМ, Калдас Дж.П.С. Камарго Дж.Ф. и др. Джей Педиатр (Рио Джей). 2023 март-апрель;99(2):181-186. doi: 10.1016/j.jped.2022.08.002. Epub 2022 30 сентября. Джей Педиатр (Рио Джей). 2023. PMID: 36183743 Бесплатная статья ЧВК.
Взаимосвязь между материнской лихорадкой и неонатальным сепсисом: ретроспективное исследование в медицинском центре.
Хуан С.Х., Чан Ю.Дж., Чен Л.Дж., Ли Ч., Чен Х.Н., Чен Д.И., Сяо К.С. Хуан С.Х. и др. Биомедицины. 2022 7 сентября; 10 (9): 2222. doi: 10.3390/биомедицины10092222. Биомедицины. 2022. PMID: 36140323 Бесплатная статья ЧВК.
Краткое изложение практики антимикробной терапии часто встречающихся состояний в отделении интенсивной терапии новорожденных: канадская точка зрения.

Тинг Дж.Й., Аутмизгин Дж., Данн М.С., Чоудхури Дж., Блэкберн Дж., Гупта-Бхатнагар С., Ассен К., Эмберли Дж., Хан С., Леунг Дж., Лин Г.Дж., Лю-Клири Д., Морин Ф., Рихтер Л.Л., Виел- Терио И., Робертс А., Ли К.С., Скарсгард Э.Д., Робинсон Дж., Шах П.С. Тинг Дж.И. и др. Фронт Педиатр. 2022 8 июл;10:894005. doi: 10.3389/fped.2022.894005. Электронная коллекция 2022. Фронт Педиатр. 2022. PMID: 35874568 Бесплатная статья ЧВК. Обзор.
Роль параметров полного анализа крови в диагностике неонатального сепсиса.
Ворку М., Айналем М., Бисет С., Волду Б., Адане Т., Тигабу А. Ворку М. и соавт. БМС Педиатр. 2022 13 июля; 22 (1): 411. doi: 10.1186/s12887-022-03471-3. БМС Педиатр. 2022. PMID: 35831816 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
- 66161
Грантовая поддержка
- R01 GM080180/GM/NIGMS NIH HHS/США
- R01-GM-80180-3/GM/NIGMS NIH HHS/США
Полнотекстовые ссылки
Информационные системы Silverchair Бесплатная статья ЧВК
Процитируйте
Формат: ААД АПА МДА НЛМ
Отправить на
CDC – Скрининг новорожденных – Тяжелый комбинированный иммунодефицит (SCID)
Важность скрининга новорожденных на SCID
Дети, рожденные с тяжелым комбинированным иммунодефицитом (ТКИД), при рождении выглядят нормальными, но не могут бороться с инфекцией. Они могут умереть в возрасте до 1 года без лечения1. Если SCID диагностируется в раннем возрасте, до начала инфекции, трансплантация костного мозга может успешно вылечить заболевание.
Они могут умереть в возрасте до 1 года без лечения1. Если SCID диагностируется в раннем возрасте, до начала инфекции, трансплантация костного мозга может успешно вылечить заболевание.
Скрининг новорожденных выявляет детей с врожденными нарушениями, такими как SCID. Ежегодно в США обследуют около 4 миллионов новорожденных на наличие многочисленных заболеваний, а 32 штата и округ Колумбия в настоящее время проводят скрининг на SCID. Отдел лабораторных наук CDC разработал лабораторные тесты и справочные материалы для SCID с использованием высушенных пятен крови и работает над продвижением скрининга по всей стране.
Проверка состояния
Вскоре после рождения ребенка медицинский работник берет несколько капель крови из пятки ребенка. Образец крови отправляется в государственную лабораторию для проверки на несколько тяжелых заболеваний. Хотя каждый штат решает, какие расстройства включать в скрининг, Консультативный комитет госсекретаря по наследственным расстройствам у новорожденных и детей (SACHDNC) рекомендует штатам тестировать основную группу из 31 врожденного расстройства2. SCID был добавлен в основную группу рекомендуемых унифицированных скринингов (RUSP) в 2010 году.
SCID был добавлен в основную группу рекомендуемых унифицированных скринингов (RUSP) в 2010 году.
Деятельность по программе лабораторий CDC
С 2008 года CDC работает над увеличением числа штатов и территорий США, которые включают точное тестирование на SCID в рамках своих программ скрининга новорожденных. Стремясь расширить и улучшить скрининг, Отдел лабораторных наук CDC:
- Финансирует разработку теста SCID и ранний скрининг в сотрудничестве со штатами,
- Обеспечивает обучение и техническую помощь государственным лабораториям, проводящим скрининг на SCID,
- Разрабатывает новые лабораторные методы выявления детей с ТКИН,
- Предоставляет лабораториям материалы для тестирования, чтобы помочь обеспечить точный скрининг SCID, и
- Спонсирует конференции и встречи для обучения ученых методам и справочным материалам для тестирования SCID.
Отдел лабораторных наук CDC финансирует скрининг SCID государственными лабораториями общественного здравоохранения в рамках соглашений о сотрудничестве с программами скрининга новорожденных. Приемлемые государственные или территориальные программы — это те, которые ранее не проводили скрининг новорожденных на SCID в масштабах штата и демонстрируют достаточный лабораторный опыт, оборудование и юридические полномочия для проведения скрининга. Среди награжденных:
Приемлемые государственные или территориальные программы — это те, которые ранее не проводили скрининг новорожденных на SCID в масштабах штата и демонстрируют достаточный лабораторный опыт, оборудование и юридические полномочия для проведения скрининга. Среди награжденных:
- Луизиана, Невада и Северная Каролина (2015)
- Джорджия, Вирджиния и Оклахома (2013)
- Мичиган и Миннесота (2011)
- Висконсин и Массачусетс (2008)
Успешные пилотные исследования по скринингу новорожденных в этих штатах показали:
- Обеспечение готовности скрининговых тестов на SCID для общенационального использования,
- Послужили образцом для других штатов по внедрению скрининга населения, и
- Предоставлены доказательства в поддержку добавления SCID в RUSP.
В 2015 году CDC профинансировал Нью-Йорк для разработки передовых методов лабораторного скрининга и материалов для обеспечения качества, которые улучшат обнаружение SCID.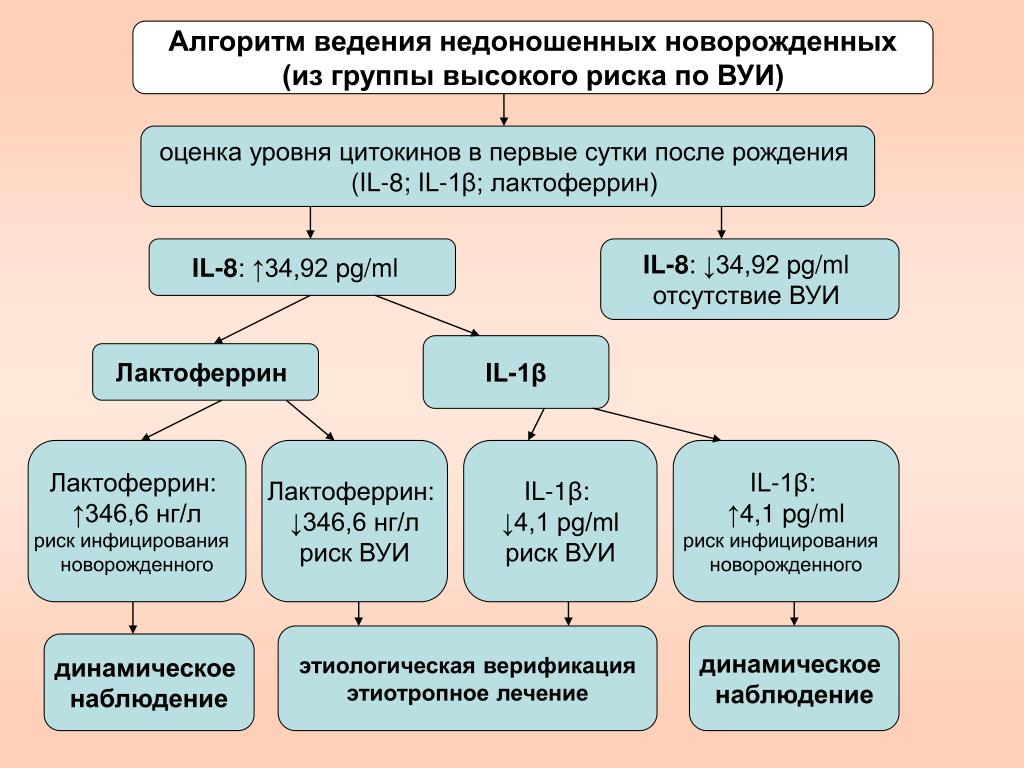
Результаты программы SCID
Основной целью программы скрининга новорожденных CDC является улучшение здоровья и жизни новорожденных. Программа скрининга новорожденных на SCID продолжает:
- Увеличить количество лабораторий, проводящих скрининг на SCID
- Увеличить количество младенцев, обследованных на SCID
- Улучшить возможности государственной лаборатории
- Повышение производительности государственной лаборатории
Финансирование CDC помогло штатам провести скрининг более миллиона детей на SCID. Отдел лабораторных наук продолжает проводить программы проверки квалификации с ежеквартальной рассылкой во все лаборатории США, которые в настоящее время проводят скрининг на SCID.
Ссылки
- Институт клинических и лабораторных стандартов (CLSI). Скрининг пятен крови новорожденных на наличие тяжелого комбинированного иммунодефицита путем измерения кругов эксцизии Т-клеточных рецепторов ; Утвержденное руководство.

