Сингуляр, Аколат инструкция, применение, цены, аналоги
Содержание страницы:
Таблица аналогов и цен
Сингуляр (Монтелукаст) таблетки 5 и 10мг — инструкция по применению
Сингуляр (Монтелукаст) таблетки 4мг (для детей с 2 лет) — показания и дозировка
Препараты, содержащие блокаторы лейкотриеновых рецепторов (АТC R03DC):
| Частые формы выпуска Монтелукаста (Montelukast, код АТХ (ATC) R03DC03) | |||
|---|---|---|---|
| Название, производитель | Форма выпуска | Упак., шт | Цена, р |
| Сингуляр (Singulair), Нидерланды, Мерк Шарп Доум | табл. жеват. 4мг | 14 | 680-1860 |
| 28 | 1.300- 2.200 | ||
| табл. жеват. 5мг | 7 | 1070-1370 | |
| 14 | 870-1.940 | ||
| 28 | 1.290-2.300 | ||
| 14 | 950-1.800 | ||
| 28 | 1.490-2.380 | ||
| Алмонт, Мальта, Актавис | табл. жеват. 4мг | 28 | 600-1.310 |
| 98 | 1.820-2.950 | ||
| табл. жеват. 5мг | 28 | 760-1.480 | |
| 98 | 1.820-3.370 | ||
| табл. 10мг | 28 | 840-1.650 | |
| 98 | 1.820-3.800 | ||
| Монтелар (Montelar), Турция, Сандоз | табл. жеват. 4мг | 14 | 420-1.080 |
| 28 | 680-1.380 | ||
| табл. жеват. 5мг | 14 | 380-950 | |
| 28 | 720-1.500 | ||
| табл. 10мг | 14 | 380-980 | |
| 28 | 680-1.500 | ||
| Синглон (Singlon), Польша, Гедеон Рихтер | табл. 4мг | 28 | 730-1.600 |
| табл. 5мг | 14 | 400-540 | |
| 28 | 670-1.400 | ||
| табл. 10мг | 28 | 750-1.520 | |
| Монтелукаст (Montelukast, Россия, Вертекс) | табл. жеват. 5мг | 10 | 420-530 |
| 28 | 580-1.000 | ||
| табл 10мг | 30 | 505-930 | |
| Редкие формы выпуска Монтелукаста (Montelukast, код АТХ (ATC) R03DC03) | |||
| Название, производитель | Форма выпуска | Упак., шт | Цена, р |
| Глемонт (Glemont), Индия, Гленмарк | табл. жеват. 4мг | 28 | 580-800 |
| табл. жеват. 5мг | 28 | 550-770 | |
| Экталуст, Россия, Канонфарма | табл. жеват. 4мг | 14 | нет |
| табл. жеват. 5мг | 14 | 440-550 | |
| табл. 10мг | 14 | 490-680 | |
| Снятые с продаж формы выпуска Зафирлукаста (Zafirlukast, код АТХ (ATC) R03DC01) | |||
| Аколат (Accolate), Англия, Астра Зенека | табл. 20мг | 28 | нет |
Коммерческие названия за границей (за рубежом) — для Монтелукаста — Airlukast, Asthator, Asthmatin, Emlucast, Lukotas, Monkasta, Montair, Montecad, Montek, Montelo-10, Monteflo, Monti, Odimont, Singulair; для Зафирлукаста — Accolate, Accoleit, Aeronix, Azimax, Olmoran, Resma, Vanticon, Zuvair.
Задать вопрос или опубликовать отзыв о лекарстве (пожалуйста, не забудьте указать название препарата в тексте сообщения) можно здесь .
Все препараты, применяемые в пульмонологии
Какой дженерик лучше?
Где купить?
Сингуляр (Монтелукаст) в таблетках 5 и 10мг — инструкция по применению.
Клинико-фармакологическая группа:
Антагонист лейкотриеновых рецепторов. Препарат для лечения бронхиальной астмы и аллергического ринита.
Фармакологическое действие
Антагонист лейкотриеновых рецепторов. Монтелукаст селективно ингибирует CysLT1-рецепторы цистеиниловых лейкотриенов (LTC4, LTD4, LTE4) эпителия дыхательных путей, а также предотвращает у больных бронхиальной астмой бронхоспазм, обусловленный вдыханием цистеинилового лейкотриена LTD4. Дозы 5 мг достаточно для купирования бронхоспазма, индуцированного LTD4. Применение монтелукаста в дозах, превышающих 10 мг 1 раз в сутки, не повышает эффективность препарата.
Монтелукаст вызывает бронходилатацию в течение 2 ч после приема внутрь и может дополнять бронходилатацию, вызванную бета2-адреномиметиками.
Фармакокинетика
Всасывание
После приема внутрь монтелукаст быстро и практически полностью всасывается из ЖКТ. Прием обычной пищи не влияет на Cmax в плазме крови и биодоступность таблеток, покрытых оболочкой, и жевательных таблеток. У взрослых при приеме натощак таблеток, покрытых оболочкой, в дозе 10 мг Cmax в плазме крови достигается через 3 ч. Биодоступность при приеме внутрь составляет 64%.
После приема внутрь натощак препарата в форме жевательных таблеток в дозе 5 мг Cmax у взрослых достигается через 2 ч. Биодоступность составляет 73%.
Распределение
Связывание монтелукаста с белками плазмы крови составляет более 99%. Vd в среднем составляет 8-11 л.
При однократном приеме препарата в форме таблеток, покрытых оболочкой, в дозе 10 мг 1 раз в сутки наблюдается умеренная (около 14%) кумуляция активного вещества в плазме.
Метаболизм
Монтелукаст активно метаболизируется в печени. При применении в терапевтических дозах концентрация метаболитов монтелукаста в плазме в равновесном состоянии у взрослых и детей не определяется.
Предполагается, что в процесс метаболизма монтелукаста вовлечены изоферменты цитохрома Р450 (3А4 и 2С9), при этом в терапевтических концентрациях монтелукаст не ингибирует изоферменты цитохрома Р450: 3А4, 2С9, 1А2, 2А6, 2С19 и 2D6.
Выведение
T1/2 монтелукаста у молодых здоровых взрослых составляет от 2.7 до 5.5 ч. Клиренс монтелукаста составляет у здоровых взрослых в среднем 45 мл/мин. После перорального приема монтелукаста 86% выводится с калом в течение 5 дней и менее 0.2% — с мочой, что подтверждает то, что монтелукаст и его метаболиты выводятся почти исключительно с желчью.
Показания к применению препарата СИНГУЛЯР®
Профилактика и длительное лечение бронхиальной астмы у взрослых и детей в возрасте 6 лет и старше, включая:
- предупреждение дневных и ночных симптомов заболевания;
- лечение бронхиальной астмы у пациентов с повышенной чувствительностью к ацетилсалициловой кислоте;
- предупреждение бронхоспазма, вызванного физической нагрузкой.
Купирование дневных и ночных симптомов сезонных аллергических ринитов (у взрослых и детей в возрасте 6 лет и старше) и постоянных аллергических ринитов (у взрослых и детей в возрасте 6 лет и старше).
Способ применения и дозировка
Препарат принимают внутрь 1 раз в сутки независимо от приема пищи. Для лечения бронхиальной астмы Сингуляр® следует принимать вечером. При лечении аллергических ринитов препарат можно принимать в любое время суток. При сочетанной патологии (бронхиальная астма и аллергический ринит) препарат следует принимать вечером.
Взрослым и подросткам в возрасте 15 лет и старше препарат назначают в дозе 10 мг (1 таблетка, покрытая оболочкой) в сутки.
Детям в возрасте от 6 до 14 лет назначают в дозе 5 мг (1 таблетка жевательная) в сутки. Подбора дозы для этой возрастной группы не требуется.
Терапевтическое действие препарата Сингуляр® на показатели, отражающие течение бронхиальной астмы, развивается в течение первого дня. Пациенту следует продолжать принимать Сингуляр® как в период достижения контроля симптомов бронхиальной астмы, так и в период обострения заболевания.
Для пожилых пациентов, пациентов с почечной недостаточностью, пациентов с легкими или среднетяжелыми нарушениями функции печени, а также в зависимости от пола специального подбора дозы не требуется.
Сингуляр® можно добавлять к лечению бронходилататорами и ингаляционными ГКС.
Побочное действие
В целом, препарат Сингуляр® хорошо переносится. Побочные эффекты обычно бывают легкими и, как правило, не требуют отмены препарата. Общая частота побочных эффектов при лечении препаратом Сингуляр® сопоставима с их частотой при приеме плацебо.
Взрослые и дети в возрасте 15 пет и старше с бронхиальной астмой
В двух 12-недельных плацебо-контролируемых клинических исследованиях с аналогичным дизайном единственными побочными эффектами, оцененными как связанные с приемом препарата, наблюдавшиеся у >1% пациентов, принимавших Сингуляр®, и чаще, чем в группе пациентов, принимавших плацебо, были боль в животе и головная боль. Различия по частоте данных побочных эффектов между двумя группами лечения были статистически незначимыми.
При более длительном лечении (в течение 2 лет) профиль побочных эффектов не изменился.
Дети в возрасте от 6 до 14 лет с бронхиальной астмой
Профиль безопасности препарата у детей был целом, схожим с профилем безопасности у взрослых и сопоставим с профилем безопасности плацебо.
В 8-недельном плацебо-контролируемом клиническом исследовании единственным побочным эффектом, оцененным как связанный с приемом препарата, наблюдавшимся у >1% пациентов, получавшим Сингуляр®, и чаще, чем в группе пациентов, получавших плацебо, была головная боль. Различие по частоте между двумя группами лечения было статистически незначимым.
В исследованиях по оценке темпа роста профиль безопасности у пациентов данной возрастной группы соответствовал ранее описанному профилю безопасности препарата Сингуляр®.
При более длительном лечении (более 6 мес) профиль побочных эффектов не изменился.
Взрослые и дети в возрасте 15 лет и старше с сезонным аллергическим ринитом
Пациенты принимали Сингуляр® 1 раз в сутки утром или вечером, в целом препарат хорошо переносился. Профиль безопасности препарата был схожим с профилем безопасности плацебо. В плацебо-контролируемых клинических исследованиях не были зарегистрированы побочные реакции, которые бы расценивались как связанные с приемом препарата, наблюдались бы у >1% пациентов, получавших Сингуляр®, и чаще, чем в группе пациентов, принимавших плацебо. В 4-недельном плацебо-контролируемом клиническом исследовании профиль безопасности препарата был схожим с таковым в 2-недельных исследованиях. Частота возникновения сонливости при приеме препарата во всех исследованиях была такой же, как при приеме плацебо.
Дети в возрасте от 2 до 14 лет с сезонным аллергическим ринитом
Пациенты принимали Сингуляр® 1 раз в сутки вечером, в целом препарат хорошо переносился. Профиль безопасности препарата был схожим с профилем безопасности плацебо. В данном клиническом исследовании не были зарегистрированы побочные реакции, которые бы расценивались как связанные с приемом препарата, наблюдались бы у >1% пациентов, получавших Сингуляр®, и чаще, чем в группе пациентов, получавших плацебо.
Взрослые и дети в возрасте 15 лет и старше с круглогодичным аллергическим ринитом
Пациенты принимали Сингуляр® 1 раз в сутки вечером, в целом препарат хорошо переносился. Профиль безопасности препарата был схожим с профилем безопасности, наблюдавшимся при лечении пациентов с сезонным аллергическим ринитом и при приеме плацебо. В данных клинических исследованиях не были зарегистрированы побочные эффекты, которые бы расценивались как связанные с приемом препарата, наблюдались бы у >1% пациентов, получавших Сингуляр®, и чаще, чем в группе пациентов, получавших плацебо. Частота возникновения сонливости при приеме препарата была такой же, как при приеме плацебо.
Обобщенный анализ результатов клинических исследований
Был проведен обобщенный анализ 41 плацебо-контролируемого клинического исследования (35 исследований с участием пациентов в возрасте 15 лет и старше, 6 исследований с участием пациентов в возрасте от 6 до 14 лет) с использованием утвержденных методов оценки суицидальности. Среди 9929 пациентов, получавших Сингуляр®, и 7780 пациентов, получавших в данных исследованиях плацебо, был выявлен 1 пациент с суицидальной настроенностью в группе пациентов, получавших Сингуляр®. Ни в одной из групп лечения не было совершено ни одного самоубийства, суицидальной попытки или других подготовительных действий, указывавших на суицидальное поведение.
Отдельно был проведен обобщенный анализ 46 плацебо-контролируемых клинических исследований (35 исследований с участием пациентов в возрасте 15 лет и старше; 11 исследований с участием пациентов в возрасте от 3 месяцев до 14 лет) для оценки неблагоприятных поведенческих эффектов. Среди 11673 пациентов, принимавших в этих исследованиях препарат Сингуляр®, и 8827 пациентов, принимавших плацебо, процент больных, имеющих как минимум один неблагоприятный поведенческий эффект, составил 2.73% среди пациентов, получавших Сингуляр®, и 2.27% среди пациентов, получавших плацебо; отношение шансов составило 1.12 (95%-доверительный интервал [0.93; 1.36]).
Побочные эффекты, зарегистрированные во время постмаркетингового применения препарата
Инфекционные и паразитарные заболевания: инфекции верхних дыхательных путей.
Cо стороны свертывающей системы крови: повышение склонности к кровотечениям.
Со стороны иммунной системы: реакции гиперчувствительности, в т.ч. анафилаксия; очень редко (<1/10 000) — эозинофильная инфильтрация печени.
Со стороны психики: ажитация (в т.ч. агрессивное поведение или враждебность), тревожность, депрессия, дезориентация, патологические сновидения, галлюцинации, бессонница, раздражительность, беспокойство, сомнамбулизм, суицидальные мысли и поведение (суицидальность), тремор.
Со стороны нервной системы: головокружение, сонливость, парестезия/гипестезия; очень редко (<1/10 000) — судороги.
Со стороны сердечно-сосудистой системы: учащенное сердцебиение.
Со стороны дыхательной системы, органов грудной клетки и средостения: носовые кровотечения.
Со стороны пищеварительной системы: диарея, диспепсия, тошнота, рвота, панкреатит.
Со стороны печени и желчевыводящих путей: увеличение активности АЛТ и ACT в крови; очень редко (<1/10 000) — гепатит (включая холестатические, гепатоцеллюлярные и смешанные поражения печени).
Со стороны кожи и подкожных тканей: склонность к формированию гематом, узловатая эритема, многоформная эритема, зуд, сыпь.
Аллергические реакции: ангионевротический отек, крапивница.
Со стороны костно-мышечной системы: артралгия, миалгия, включая мышечные судороги.
Общие реакции: астения (слабость)/усталость, отеки, пирексия.
В целом, препарат Сингуляр® хорошо переносится больными. Побочные эффекты обычно бывают легкими и, как правило, не требуют отмены препарата. Общая частота побочных эффектов при лечении препаратом Сингуляр® сопоставима с их частотой при приеме плацебо.
Противопоказания к применению препарата СИНГУЛЯР®
- детский возраст до 6 лет;
- повышенная чувствительность к компонентам препарата.
Применение препарата СИНГУЛЯР® при беременности и кормлении грудью
Клинических исследований препарата Сингуляр® с участием беременных женщин не проводилось. Сингуляр® следует применять при беременности и в период грудного вскармливания только в тех случаях, когда ожидаемая польза для матери превышает потенциальный риск для плода или ребенка.
В ходе пострегистрационного применения препарата Сингуляр® сообщалось о развитии врожденных дефектов конечностей у новорожденных, матери которых принимали Сингуляр® при беременности. Большинство этих женщин также принимали другие препараты для лечения бронхиальной астмы при беременности. Причинно-следственная связь межд приемом препарата Сингуляр® и развитием врожденных дефектов конечностей не установлена.
Неизвестно, выделяется ли монтелукаст с грудным молоком. Поскольку многие лекарственные препараты выделяются с грудным молоком, необходимо учитывать это при назначении препарата Сингуляр® кормящим грудью матерям.
Применение при нарушениях функции печени
Для пациентов с легкими или среднетяжелыми нарушениями функции печени специального подбора дозы не требуется.
Данных о характере фармакокинетики монтелукаста у пациентов с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью) нет.
Применение при нарушениях функции почек
Для пациентов с почечной недостаточностью специального подбора дозы не требуется.
Применение у пожилых пациентов
Для пожилых пациентов специального подбора дозы не требуется.
Применение у детей
Противопоказание: детский возраст до 6 лет. Детям в возрасте от 6 до 14 лет назначают в дозе 5 мг (1 таблетки жевательная) в сутки. Подбора дозы для этой возрастной группы не требуется.
Особые указания
Эффективность препарата Сингуляр® для перорального приема в отношении лечения острых приступов бронхиальной астмы не установлена. Поэтому Сингуляр® в таблетках не рекомендуется назначать для лечения острых приступов бронхиальной астмы. Пациентам должны быть даны инструкции всегда иметь при себе препараты экстренной помощи для купирования приступов бронхиальной астмы (ингаляционные бета2-агонисты короткого действия).
Не следует прекращать прием препарата Сингуляр® в период обострения астмы и необходимости применения для купирования приступов препаратов экстренной помощи (ингаляционных бета2-агонистов короткого действия).
Пациенты с подтвержденной аллергией к ацетилсалициловой кислоте и другим НПВС не должны принимать эти препараты в период лечения препаратом Сингуляр®, поскольку Сингуляр®, улучшая дыхательную функцию у больных аллергической бронхиальной астмой, тем не менее, не может полностью предотвратить вызванную у них НПВС бронхоконстрикцию.
Дозу ингаляционных ГКС, применяемых одновременно с препаратом Сингуляр®, можно постепенно снижать под наблюдением врача, однако резкой замены ингаляционных или пероральных ГКС препаратом Сингуляр® проводить нельзя.
У пациентов, принимавших Сингуляр®, были описаны психоневрологические нарушения. Учитывая, что эти симптомы могли быть вызваны другими факторами, неизвестно, связаны ли они с приемом препарата Сингуляр®. Врачу необходимо обсудить данные побочные эффекты с пациентами и/или их родителями/опекунами. Пациентам и/или их опекунам необходимо объяснить, что в случае появления подобных симптомов необходимо сообщить об этом лечащему врачу.
Уменьшение дозы системных ГКС у больных, получающих противоастматические средства, включая блокаторы лейкотриеновых рецепторов, сопровождалось в редких случаях появлением одной или нескольких следующих реакций: эозинофилия, сыпи, ухудшение легочных симптомов, кардиологические осложнения и/или невропатия, иногда диагностируемая как синдром Чарджа-Стросс, системный эозинофильный васкулит. Хотя причинно-следственной связи этих побочных реакций с терапией антагонистами лейкотриеновых рецепторов не было установлено, при снижении дозы системных ГКС у больных, получающих Сингуляр®, необходимо соблюдать осторожность и проводить со ответствующее клиническое наблюдение.
Таблетки, покрытые оболочкой, 10 мг содержат лактозы моногидрат. Пациентам с редкой формой наследственной непереносимости галактозы, врожденной недостаточностью лактазы или глюкозо-галактозной мальабсорбцией не следует назначать Сингуляр® в данной лекарственной форме.
Сингуляр® таблетки жевательные 5 мг содержит аспартам — источник фенилаланина. Пациенты с фенилкетонурией должны быть проинформированы, что каждая жевательная таблетка 5 мг содержит аспартам в количестве, эквивалентном 0.842 мг фенилаланина. Сингуляр® таблетки жевательные 5 мг не рекомендуется назначать пациентам с фенилкетонурией.
Влияние на способность к управлению автотранспортом и работе с механизмами
Данных, свидетельствующих о том, что прием препарата Сингуляр® влияет на способность управлять автомобилем или движущимися механизмами не выявлено.
Передозировка
Симптомы передозировки не выявлены в ходе клинических исследований длительного (22 недели) лечения препаратом Сингуляр® взрослых пациентов с бронхиальной астмой в дозах до 200 мг в сутки, либо в ходе коротких (около 1 недели) клинических исследований при приеме препарата в дозах до 900 мг в сутки.
Имели место случаи острой передозировки препарата Сингуляр® (прием не менее 1000 мг в сутки) в пострегистрационном периоде и во время клинических исследований у взрослых и детей. Клинические и лабораторные данные свидетельствовали о сопоставимости профилей безопасности препарата Сингуляр® у детей, взрослых и пациентов пожилого возраста. Наиболее частыми симптомами были чувство жажды, сонливость, рвота, психомоторное возбуждение, головная боль и боль в животе. Данные побочные эфекты согласутся с профилем безопасности препарата Сингуляр®.
Лечение: проведение симптоматической терапии. Специальной информации о лечении передозировки препарата Сингуляр® нет. Данных об эффективности перитонеального диализа или гемодиализа монтелукаста не имеется.
Лекарственное взаимодействие
Сингуляр® можно назначать вместе с другими лекарственными средствами, которые обчычно применяют для профилактики и длительного лечения бронхиальной астмы и/или лечения аллергического ринита. Монтелукаст в рекомендуемой терапевтической дозе не оказывал клинически значимого эффекта на фармакокинетику следующих препаратов: теофиллин, преднизон, преднизолон, пероральные контрацептивы (этинилэстрадиол/норэтиндрон 35/1), терфенадин, дигоксин и варфарин.
При одновременном применении с фенобарбиталом AUC монтелукаста уменьшалась примерно на 40%, при этом коррекция режима дозирования препарата Сингуляр® не требуется.
В исследованиях in vitro установлено, что монтелукаст ингибирует изофермент CYP2C8, однако при исследовании лекарственного взаимодействия in vivo монтелукаста и роcиглитазона (метаболизируется с участием изофермента CYP2C8 ) не получено подтверждения ингибирования монтелукастом изофермента CYP2C8. Поэтому в клинической практике не предполагается влияние монтелукаста на CYP2С8-опосредованный метаболизм ряда лекарственных препаратов, в т.ч. паклитаксела, росиглитазона, репаглинида.
Комбинированное лечение с бронходилататорами: Сингуляр® является обоснованным дополнением к монотерапии бронходилататорами, если последние не обеспечивают адекватного контроля бронхиальной астмы. По достижении терапевтического эффекта от лечения препаратом Сингуляр®, можно начать постепенное снижение дозы бронходилататоров.
Комбинированное лечение с ингаляционными ГКС: лечение препаратом Сингуляр® обеспечивает дополнительный терапевтический эффект у пациентов, получающих ингаляционные ГКС. По достижении стабилизации состояния, можно начать постепенное снижение дозы ГКС под наблюдением врача. В некоторых случаях допустима полная отмена ингаляционных ГКС, однако резкая замена ингаляционных кортикостероидов на Сингуляр® не рекомендуется.
Условия отпуска из аптек
Препарат отпускается по рецепту.
Условия и сроки хранения
Список Б. Препарат следует хранить в недоступном для детей, защищенном от влаги и света месте при температуре не выше 30°С. Срок годности таблеток жевательных 5 мг — 2 года; таблеток, покрытых оболочкой, 10 мг — 3 года.
Инструкция цитируется по материалам фармацевтического сайта Видаль .
Сингуляр (Монтелукаст) в таблетках жевательных 4мг — показания и дозировка
Показания к применению препарата СИНГУЛЯР® таблетки жевательные 4 мг
- профилактика и длительное лечение бронхиальной астмы у детей в возрасте 2 лет и старше: с целью контроля дневных и ночных симптомов заболевания;
- облегчение симптомов аллергического ринита у детей в возрасте 2 лет и старше.
Дозировка
Препарат принимают внутрь 1 раз в сутки независимо от приема пищи.
При бронхиальной астме назначают по 4 мг (1 таблетка) на ночь.
При бронхиальной астме и аллергическом рините назначают по 4 мг (1 таблетка) на ночь.
При аллергическом рините назначают по 4 мг (1 таблетка) в сутки в индивидуальном режиме, в зависимости от времени наибольшего обострения симптомов.
Для детей в возрасте от 2 до 5 лет с бронхиальной астмой и/или аллергическим ринитом доза составляет 4 мг (1 таблетка) в сутки.
Для детей, пациентов пожилого возраста, пациентам с почечной недостаточностью и пациентов с легким/умеренным нарушением функции печени специального подбора дозы не требуется.
Вернуться к началу страницы
xn—-7sbabkdpwufdsp9apq.xn--p1ai
Роль и место антилейкотриеновых препаратов в лечении аллергических заболеваний | #03/14
Сегодня аллергические болезни входят в число самых распространенных хронических заболеваний. По данным Всемирной организации здравоохранения (ВОЗ) в мире насчитывается около 1 млрд людей, страдающих хроническими неинфекционными заболеваниями органов дыхания, из которых 300 млн больных бронхиальной астмой (БА), 400 млн больных аллергическим ринитом. В 2008 г. под эгидой ВОЗ Глобальный альянс по борьбе с хроническими респираторными заболеваниями (Global Alliance Against Chronic Respiratory Diseases, GARD) определил приоритетные направления, включающие сердечно-сосудистые заболевания, хронические респираторные заболевания, онкологию и сахарный диабет. Были сформулированы 6 задач, одной из которых является повышение значения и создание интегрированной профилактики и контроля заболеваний. Отдельно было подчеркнуто, что аллергия — один из известных факторов риска формирования хронических респираторных заболеваний [1].
«…Астма является хроническим воспалительным заболеванием, связанным с приходящей и изменяющейся по своей выраженности обструкцией дыхательных путей и гиперреактивностью бронхов, проявляющимся повторяющимися эпизодами хрипов, кашля, одышки и чувством стеснения в груди…» [2].
Создание и широкое использование в первую очередь ингаляционных глюкокортикостероидов (ИГКС) существенно повлияло на возможности достижения контроля течения заболевания. ИГКС, обладая мощным противовоспалительным действием, воздействуют на основные механизмы формирования БА.
В связи с высокой эффективностью ИГКС вполне правомочен вопрос, нужны ли другие препараты, способные подавить хроническое аллергическое воспаление у больных БА?
Несмотря на широкое использование ИГКС, у части больных не удается достигнуть контроля течения заболевания. В большинстве стран Европы больше половины пациентов с БА имеют неконтролируемое течение заболевания (рис. 1).
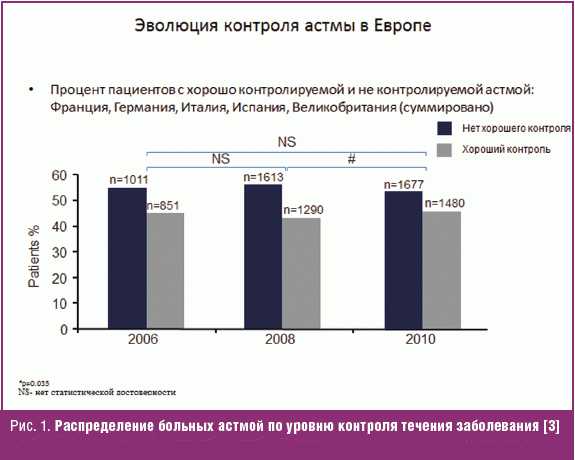
Причинами неконтролируемого течения БА являются отсутствие приверженности пациентов к проводимой базисной терапии, нежелание выполнить все предписания врача, отсутствие элиминации из окружения больного всех причинных аллергенов, поздняя диагностика и неадекватная терапия на ранних этапах заболевания, наличие различных фенотипов и эндотипов астмы, избирательная чувствительность к различным средствам базисной терапии астмы.
Согласно основным международным документам, регламентирующим тактику лечения детей с БА, к средствам базисной терапии, влияющим на хроническое воспаление дыхательных путей, относятся: глюкокортикостероиды, антагонисты лейкотриеновых рецепторов, пролонгированные ß2-агонисты в комбинации с ингаляционными глюкокортикостероидами, кромоны (кромоглициевая кислота, недокромил натрия), пролонгированные теофиллины и антитела к IgE. Пролонгированные ß2-агонисты могут лишь усиливать противовоспалительный эффект ИГКС и никогда не используются в качестве монотерапии астмы, кромоны по данным ряда исследований оказывают эффект, близкий к плацебо, а пролонгированные теофиллины редко используются у детей в связи с выраженными побочными действиями (Международный консенсус по астме у детей (ICON, International Consensus on Pediatric Asthma), 2012).
В области лечения БА в последнем десятилетии успешно прошли испытания две группы препаратов: это антилейкотриеновые препараты (АЛТП) и анти-IgE-препараты.
К АЛТП относятся:
1) ингибиторы 5-липооксигеназы (5-LO, биосинтез лейкотриенов): зилейтон (Зифло)*, используется главным образом в США;
2) цистеиниловые лейкотриеновые (CysLT1) антагонисты: монтелукаст (Сингуляр), зафирлукаст (Аколат) и пранлукаст (Онон)**.
Проводятся клинические исследования (еще нет в клинической практике) так называемых ингибиторов FLAP, которые препятствуют 5-LO-активации белков.
АЛТП классифицируются как препараты, контролирующие течение БА, и характеризуются высокой эффективностью контроля течения БА у детей [1, 36].
Показания к назначению антагонистов лейкотриеновых рецепторов:
- профилактика и длительное лечение БА, включая предупреждение дневных и ночных симптомов заболевания у взрослых и детей с 2 лет;
- лечение аспиринчувствительных пациентов с БА;
- предупреждение бронхоспазма, вызванного физической нагрузкой;
- возможность использования препаратов из группы ингибиторов лейкотриеновых рецепторов в комбинации с любым базисным препаратом, а также возможность использования их как монотерапии при легкой персистирующей форме БА у детей;
- купирование дневных и ночных симптомов сезонных аллергических ринитов (у взрослых и детей с 2-летнего возраста) и постоянных аллергических ринитов (у взрослых и детей с 2-летнего возраста).
Согласно международным согласительным документам антагонисты лейкотриеновых рецепторов используются начиная с 1-й ступени терапии в качестве монотерапии или со 2-й ступени терапии в комбинации с ИГКС (рис. 2).

Лейкотриены являются одними из основных медиаторов формирования хронического воспаления дыхательных путей у больных БА. Бронхоспазм, который вызывают лейкотриены, в 1000 раз более мощный, чем гистамин. Лейкотриены вызывают повышение проницаемости сосудов, увеличение продукции и секреции слизистыми железами дыхательных путей, увеличение клеточной инфильтрации слизистой оболочки дыхательных путей, ремоделирование бронхов. Ремоделирование бронхов характеризуется массовой гибелью эпителиальных клеток, большим количеством слизистых пробок в бронхах, утолщением базальной мембраны, гипертрофией и гиперплазией бокаловидных клеток и серозных желез, гипертрофией гладких мышц стенки бронхов (более чем на 200%), активным ангионеогенезом [4, 5].
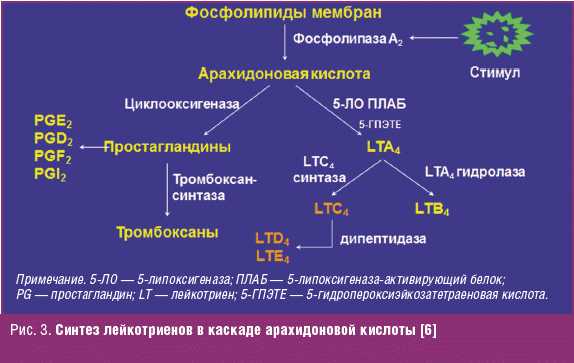
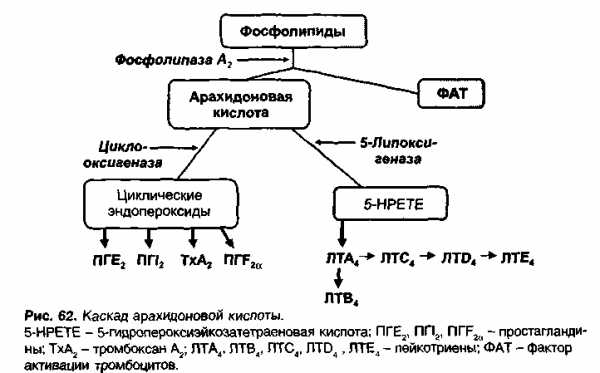
Лейкотриены образуются при взаимодействии фермента 5-липоксигеназы (5-ЛО) и 5-липоксигеназа-активирующего белка (ПЛАБ) (рис. 3). В результате этого взаимодействия арахидоновая кислота (высвобождающаяся в ответ на различные стимулы) превращается в 5-гидропероксиэйкозатетраеновую кислоту (5-ГПЭТЕ), затем в лейкотриен A4 (LTA4), отличающийся крайней нестабильностью. В дальнейшем под действием LTA4 гидролазы нейтрофилов, моноцитов периферической крови и альвеолярных макрофагов он превращается в лейкотриен B4 (LTB4) или происходит его конъюгация с образованием лейкотриена C4 (LTC4). Дальнейшее превращение LTC4 в лейкотриен D4 (LTD4), а затем LTD4 в лейкотриен E4 (LTE4) катализируется широко распространенными в тканях и циркулирующими в крови ферментами — соответственно гамма-глутамилтранспептидазой и дипептидазой. LTC4, LTD4 и LTE4 называют цистеиниловыми лейкотриенами (старое название этой группы лейкотриенов — медленно реагирующая субстанция анафилаксии), так как в их состав входит цистеин. Цистеиниловые лейкотриены, являясь ключевыми медиаторами в патогенезе БА, повышают продукцию слизи, вызывают развитие отека, эозинофилию и бронхоспазм. LTB4 играет менее важную роль в патогенезе БА. К основным биологическим эффектам LTB4 относятся влияние на хемотаксис и иммуномодуляция. Лейкотриены синтезируются в активированных эозинофилах, нейтрофилах, тучных клетках, моноцитах и макрофагах. В активированных эозинофилах и тучных клетках преимущественно образуется LTC4, в то время как моноциты и макрофаги синтезируют как LTB4, так и LTC4. Цистеиниловые лейкотриены LTC4, LTD4 и LTE4 вырабатываются у чувствительных лиц в ответ на различные стимулы, в том числе аллергены, физическую нагрузку и Аспирин. LTA4 образуется и высвобождается многими клетками, и в дальнейшем он превращается при участии других клеток в LTB4 и/или цистеиниловые лейкотриены. Как для ранней, так и для поздней фазы аллергического ответа характерно индуцированное аллергеном высвобождение цистеиниловых лейкотриенов из клеток воспаления, в том числе тучных клеток, эозинофилов, базофилов, макрофагов и моноцитов [6].
Цистеиниловые лейкотриены (LTC4, LTD4, LTE4) участвуют в развитии бронхиальной обструкции, гиперреактивности и образовании воспалительного экссудата в дыхательных путях при БА благодаря четырем основным механизмам:
- привлечение эозинофилов в дыхательные пути — важный этап патогенеза БА, сопровождающийся повреждением эпителия и повышением бронхиальной реактивности;
- повышение проницаемости микрососудов, приводящее к экссудации плазмы в бронхиальную стенку и просвет и формированию отека;
- увеличение секреции слизи, которая вместе с белками плазмы и распадающимися клетками образует слизистые пробки;
- выраженный бронхоспазм, обусловленный констрикторным действием лейкотриенов на гладкомышечные клетки дыхательных путей. Кроме того, цистеиниловые лейкотриены могут способствовать гипертрофии и ремоделированию гладкой мускулатуры бронхов [6, 15].
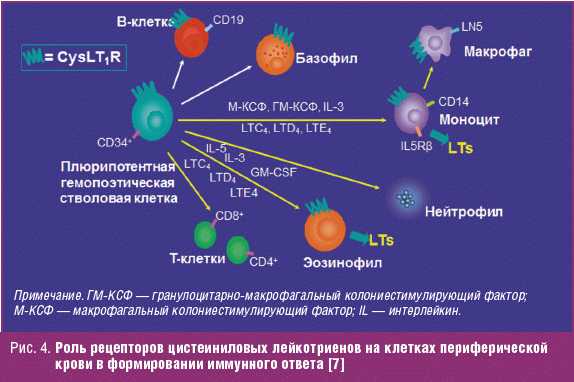
Эффекты цистеиниловых лейкотриенов опосредуются рецепторами. У человека найдены, по меньшей мере, два вида таких рецепторов (подтипы 1 и 2). Рецептор к цистеиниловым лейкотриенам 1-го подтипа (CysLT1) — это основной рецептор, опосредующий эффекты цистеиниловых лейкотриенов при БА. Рецепторы CysLT1 были обнаружены в перибронхиальных гладкомышечных клетках и ключевых клетках воспаления: эозинофилах, моноцитах и макрофагах, B-клетках, а также клетках-предшественниках CD34+ (плюрипотентные гемопоэтические стволовые клетки).
У пациентов с атопической БА обнаружены повышенные уровни CD34+ клеток в слизистой бронхов. Экспрессия на этих клетках рецептора CysLT1 позволяет предположить, что при определенных условиях лейкотриены могут воздействовать на пути дифференцировки CD34+ клеток в различные виды клеток воспаления. Цистеиниловые лейкотриены могут подготавливать клетки-предшественники CD34+ к созреванию с образованием эозинофилов, моноцитов, макрофагов и определенных лимфоцитарных клеток периферической крови. При обострении БА лейкотриены, образованные в легких при участии эозинофилов и макрофагов, могут активировать рецепторы CysLT1 гладкой мускулатуры бронхов, вызывая бронхоспазм. Кроме того, цистеиниловые лейкотриены могут усиливать непосредственное повреждение легочной ткани и расширять популяции клеток воспаления в легких вследствие аутокринного и паракринного воздействия на рецепторы CysLT1, расположенные на интерстициальных предшественниках гранулоцитов, эозинофилов и/или макрофагов. Такой механизм положительной обратной связи может объяснять наблюдаемые в клинических условиях прогрессирующие бронхоспазм и воспаление, характерные для БА [7, 14].
Согласно современным представлениям БА рассматривают как гетерогенное заболевание, имеющее множество фенотипов. Выделяют эозинофильный, нейтрофильный и пауцигранулоцитарный (обедненный по клеточным элементам) фенотипы.
При эозинофильном фенотипе БА ключевой клеткой воспаления является эозинофил, активация которой происходит под влиянием интерлейкина 5 (ИЛ-5), образующегося после взаимодействия аллергена и Т-хелперов 2 (Th3) клеток. Активированный эозинофил высвобождает эозинофильный катионный белок (ECP), основной белок эозинофилов (MBP) и матриксную металлопротеиназу-9 (MMP9) с формированием аллергического воспаления дыхательных путей у больных БА. При нейтрофильном воспалении ключевыми клетками являются макрофаги и эпителиальные клетки. Высвобождающийся из этих клеток интерлейкин 8 (ИЛ-8) приводит к привлечению к месту воспаления нейтрофилов с высвобождением нейтрофильных факторов, приводящих и поддерживающих воспаление бронхов у больных БА. Использование ИГКС приводит у больных БА к подавлению в первую очередь эозинофильного воспаления. Нейтрофильное воспаление у больных БА значительно хуже реагирует на использование данной группы базисных препаратов. В ряде исследований было показано, что монтелукаст в терапевтической дозе подавляет воспаление в дыхательных путях у больных БА, вызванное не только эозинофилами и моноцитами, но и кортикостероид-нечувствительными нейтрофилами [8].
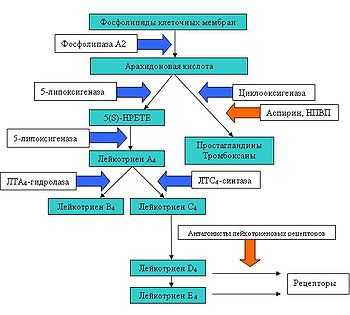
Для воздействия на разные звенья каскада арахидоновой кислоты были разработаны различные классы лекарственных препаратов. К ингибиторам синтеза лейкотриенов относятся ингибиторы 5-ЛО, которые напрямую блокируют каталитическую активность 5-ЛО, а также ингибиторы ПЛАБ, которые вытесняют арахидонат из места связывания с молекулой ПЛАБ и препятствуют поступлению арахидоната — субстрата для синтеза лейкотриенов — к 5-ЛО. Антагонисты рецепторов цистеиниловых лейкотриенов селективно угнетают активность цистеиниловых лейкотриенов на рецепторе LTD4 [9–11]. К этому классу относятся монтелукаст, пранлукаст и зафирлукаст [12].
Хотя считается, что кортикостероиды угнетают образование фосфолипазы A2, тем самым предотвращая формирование всех продуктов арахидонового каскада, исследования показали, что они не оказывают влияния на стимулированное аллергеном высвобождение цистеиниловых лейкотриенов в жидкость бронхоальвеолярного лаважа у пациентов с БА [14].
Z. Csoma с соавт. (2002) исследовали воспаление в дыхательных путях у детей с БА с помощью измерения уровней цистеиниловых лейкотриенов в конденсате выдыхаемого воздуха. В исследование включали детей в возрасте 7–14 лет, в том числе детей без БА и атопии (контрольная группа), детей с легкой интермиттирующей БА, детей с легкой, среднетяжелой и тяжелой персистирующей БА, получавших ИГКС. Исследование конденсата выдыхаемого воздуха показало, что у детей с персистирующей БА уровни цистеиниловых лейкотриенов были статистически значимо выше, чем у здоровых детей. У детей с легкой интермиттирующей БА уровни цистеиниловых лейкотриенов статистически значимо не отличались от уровней у здоровых детей. На фоне терапии ИГКС уровни цистеиниловых лейкотриенов в конденсате выдыхаемого воздуха были повышены у детей с легкой, среднетяжелой и тяжелой БА. Таким образом, дозы ИГКС, обеспечивающие контроль клинических проявлений БА у детей, могут не полностью угнетать воспалительный процесс. Длительное лечение астмы ИГКС, не обеспечивая явного угнетения синтеза лейкотриенов, может приводить к дальнейшему высвобождению медиаторов воспаления, участвующих в привлечении клеток воспаления и, тем самым, поддержании хронического воспаления в дыхательных путях [16].
В другом открытом перекрестном исследовании с двумя периодами участвовали 23 ребенка в возрасте 6–11 лет, страдавших среднетяжелой БА, имевших значение объема форсированного выдоха за первую секунду (ОФВ1) 60–85% от должного. При этом прирост ОФВ1 после ингаляции ß-агониста у включенных в это исследование больных составил ≥ 12%. После двухнедельного вводного периода детям назначали терапию монтелукастом (таблетка 5 мг один раз в сутки) или кромолином (2 ингаляции по 1 мг 4 раза в сутки) в течение 4 недель с последующим периодом «отмывки» между разными видами терапии продолжительностью 2 недели. По потребности применялись ß2-агонисты. До и после лечения каждого вида измеряли концентрации LTC4 в смывах со слизистой полости носа. Терапия монтелукастом в течение 4 недель приводила к статистически значимому снижению концентраций LTC4 (p < 0,005), а применение кромолина сопровождалось статистически не значимым увеличением концентраций. На следующем этапе исследования дети, получавшие ранее монтелукаст, стали ингалировать кромоны, а дети, получавшие кромоны, стали получать монтелукаст. У детей, которые сначала получали монтелукаст, уровни LTC4 не вернулись к исходным в течение периода «отмывки» и оставались низкими на протяжении периода лечения кромолином. У детей, которые сначала получали кромолин, уровни LTC4 вернулись к исходным в период «отмывки», затем произошло их дальнейшее уменьшение на фоне терапии монтелукастом. Во время лечения монтелукастом 75% детей использовали ß2-агонист < 2 ингаляций в сутки. На фоне лечения кромолином такая потребность в ß2-агонистах отмечалась только у 27% детей (p < 0,04). Ни у одного ребенка не развилось обострения БА во время приема монтелукаста, а на фоне терапии кромолином у двух детей отмечены обострения, приведшие к исключению их из исследования. В данном исследовании было показано, что монтелукаст угнетал высвобождение лейкотриенов в дыхательных путях детей с персистирующей БА, а прием кромонов не приводил к снижению образования лейкотриенов и контролю течения заболевания [17].
С. Lex с соавт. (2006) измеряли уровни цистеиниловых лейкотриенов в конденсате выдыхаемого воздуха у детей 4–15 лет, страдавших среднетяжелой и тяжелой персистирующей БА. Помимо оценки функции внешнего дыхания у больных определяли концентрацию цистеиниловых лейкотриенов в выдыхаемом воздухе, проводилась бронхоскопия и биопсия слизистой бронхов. Все обследуемые (24 ребенка) получали ИГКС в дозе > 400 мкг. Часть детей получала дополнительную терапию системными кортикостероидами перед бронхоскопией. Монтелукаст получали 10 из 24 больных, включенных в данное исследование. Результаты исследования конденсата выдыхаемого воздуха показали, что концентрации цистеиниловых лейкотриенов у детей, получавших монтелукаст, были значительно ниже, чем у тех детей, которые получали только ИГКС (p = 0,004). Кроме того, в группе терапии ИГКС отмечена статистически значимая корреляция концентраций цистеиниловых лейкотриенов со степенью утолщения ретикулярной базальной мембраны, отражающая степень ремоделирования бронхов (p = 0,003) [18].
Хорошо известен факт нарастания частоты обращений для оказания экстренной помощи детей с БА в осенне-зимний период в связи с увеличением частоты острых респираторных инфекций в этот сезон. Изучение эффективности монтелукаста для профилактики обострений БА, индуцированной вирусной инфекцией (исследование PREVIA), было проведено, чтобы оценить влияние терапии монтелукастом в течение 12 месяцев по сравнению с плацебо на симптомы БА, связанные с простудными заболеваниями, у детей в возрасте 2–5 лет, страдающих БА.
PREVIA — это многоцентровое рандомизированное двойное слепое плацебо-контролированное исследование в параллельных группах продолжительностью 12 месяцев. После двухнедельного вводного периода (пациенты принимали плацебо, не зная, какой препарат принимают) соответствующие критериям включения пациенты были рандомизированы двойным слепым методом в группы терапии монтелукастом или плацебо на протяжении 12 месяцев. Монтелукаст назначали в виде жевательной таблетки 4 мг один раз в сутки перед сном. Критерием включения в исследование был возраст (от 2 до 5 лет), в анамнезе наличие не менее трех обструкций на фоне ОРИ, требовавших применения ß-агониста, длительностью ≥ 3 дней, развившихся за последние 12 месяцев, и если хотя бы один из этих эпизодов развился в течение 6 месяцев перед включением. Кроме того, пациенты должны были страдать легкой БА. По сравнению с плацебо монтелукаст статистически значимо снижал частоту обострений (32%, p ≤ 0,001). Рассчитанная частота обострений составила 1,60 эпизода в год в группе монтелукаста по сравнению с 2,34 эпизода в год в группе плацебо. В результате исследования был сделан вывод, что у детей с БА в возрасте 2–5 лет монтелукаст в дозе 4 мг является эффективным, удобным и хорошо переносимым средством достижения контроля над БА, обеспечивая уменьшение выраженности дневных и ночных симптомов БА и уменьшение частоты обострений [19].
Продукты метаболизма арахидоновой кислоты имеют существенное значение в развитии астмы, индуцированной физической нагрузкой. Использование антилейкотриеновых препаратов предупреждает развитие бронхоспазма, вызванного физической нагрузкой [20]. В исследовании, проведенном J. P. Kemp и соавт. (1998), монтелукаст предупреждал бронхоконстрикцию, вызванную физической нагрузкой, у детей 6–14 лет. Целью этого двойного слепого рандомизированного плацебо-контролируемого перекрестного исследования с двумя периодами, включавшего 27 детей с астмой 6–14 лет, являлась оценка влияния монтелукаста по сравнению с плацебо на бронхоконстрикцию, обусловленную физической нагрузкой. Дети, включенные в исследование, имели снижение ОФВ1 ≥ 20% после стандартизованной нагрузки на тредмиле до начала терапии. Во время каждого периода исследования дети получали монтелукаст 5 мг или плацебо 1 раз в сутки вечером в течение 2 дней. Провокационный тест со стандартизованной нагрузкой проводили вечером примерно через 20–24 ч после приема второй дозы исследуемого препарата. Длительность периода вымывания между периодами исследования составляла ≤ 4 дней. По сравнению с плацебо монтелукаст обусловливал статистически значимое уменьшение выраженности падения ОФВ1 (–18%) по сравнению с –26% (p = 0,009). Кроме того, время восстановления ОФВ1 к значению до нагрузки на фоне терапии монтелукастом было меньше, чем на фоне плацебо (соответственно 18 минут и 28 минут) [21].
Аллергический ринит — частое сопутствующее заболевание у больных БА. Изолированный аллергический ринит увеличивает риск развития астмы. Клинические исследования монтелукаста показали его эффективность при монотерапии сезонного аллергического ринита, сопоставимую с эффективностью антигистаминных препаратов нового поколения. В случае комбинации препаратов этих групп эффективность терапии сопоставима с эффективностью лечения интраназальными стероидами. В случае легкого течения аллергического ринита монтелукаст может быть препаратом выбора. Отмечается улучшение качества жизни и у больных с симптомами риноконъюнктивита [31, 32]. Также обосновано применение данной группы препаратов при бронхиальной астме, сопровождающейся аллергическим ринитом.
Аспириновая астма диагностируется у детей очень редко. Это связано с тем, что классическая триада симптомов (астма, полипозные образования в придаточных пазухах носа и непереносимость нестероидных противовоспалительных препаратов) появляется в более старшем возрасте и редко симптомы появляются одновременно. Однако у детей с неатопической астмой следует всегда исключать аспириновую астму, даже если нет всей классической симптоматики, характеризующей данную форму у взрослых. Кроме того, не следует забывать, что возможно сочетание как аллергической, так и аспириновой астмы у одного больного. У больных с аспириновой астмой отмечается повышенный синтез цистеиниловых лейкотриенов. В качестве базисной терапии следует использовать ИГКС в сочетании с АЛТП. Назначение АЛТП уменьшает рост назальных полипов. К лучшему ответу на АЛТП предрасположены больные с БА, имеющие «мутации» в промоторной зоне гена, кодирующего LTC4 синтазу [22].
Другой редко диагностируемой формой астмы является «кашлевая» астма (CVA). Длительно кашляющие дети представляют собой достаточно большую группу больных, имеющих различные заболевания. Диагностировать данную форму астмы следует согласно имеющимся критериям, опубликованным в международных согласительных документах Всемирной инициативы по борьбе с бронхиальной астмой (Global Initiative for Asthma, GINA). Подбор терапии таким детям не всегда прост, и к диагнозу аллергического поражения бронхов врач подходит, как правило, исключив другие заболевания.
По данным Т. Kita с соавт. (2010), обследовавшего 75 больных с «кашлевым» вариантом астмы, монтелукаст может эффективно использоваться для лечения в качестве монотерапии [23]. У больных CVA 2-недельное лечение монтелукастом, кленбутеролом и монтелукастом плюс кленбутерол оказалось эффективным. В группе больных, получающих монтелукаст в комбинации с кленбутеролом, значение пиковой скорости выдоха (ПСВ) в утренние и в вечерние часы значительно увеличились после 2 недель лечения по сравнению со значениями ПСВ до лечения. У пациентов с аллергическим трахеобронхитом 2-недельное лечение монтелукастом, кленбутеролом и комбинацией «монтелукаст плюс кленбутерол» оказалось неэффективным и достоверных различий получено не было.
У больных с легкой персистирующей астмой или на 1-й ступени в качестве базисного препарата можно использовать либо низкие дозы ИГКС, либо АЛТП [2]. Исследование MOSAIC ставило перед собой цель сравнить уровень контроля астмы, достигнутый на фоне терапии пероральным монтелукастом и низкими дозами ингаляционного флутиказона по проценту дней без применения препаратов по экстренным показаниям через 1 год лечения у детей в возрасте 6–14 лет при легкой персистирующей БА. Исследование MOSAIC являлось рандомизированным одногодичным двойным слепым исследованием в двух параллельных группах. После 4 недель простого слепого вводного периода, в течение которого пациенты получали плацебо, пациентов рандомизировали в соотношении 1:1 в группы терапии: либо монтелукаст 5 мг в виде жевательной таблетки один раз в сутки перед сном или флутиказон 2 ингаляции 50 мкг 2 раза в сутки. Длительность лечения составляла 1 год. Все пациенты могли использовать ß2-агонисты короткого действия по требованию или пероральные стероиды. Интервалы между визитами в клинику составляли 4 месяца. Оценка контроля астмы проводилась с помощью раздела «контроль» Педиатрического опросника для оценки терапии астмы — PATAQ (Control domain of the Paediatric Asthma Therapy Assessment Questionnaire). Доля пациентов без приступов астмы составила 67,8% в группе монтелукаста и 74,4% в группе флутиказона. Отношение рисков составило 1,38 в пользу флутиказона (95% ДИ: 1,04, 1,84). В двух группах отмечены сходные изменения ОФВ1 по сравнению с исходным уровнем: ОФВ1 увеличился после лечения как в группе монтелукаста, так и в группе флутиказона. В среднем использование ß2-агониста снизилось с 7,0 (исходно) до 2,6 ингаляции в неделю после терапии монтелукастом и с 7,2 до 2,3 ингаляции в группе флутиказона (статистически достоверной разницы нет). Средняя доля дней использования ß2-агониста уменьшилась с 38,0% (исходно) до 15,4% (после лечения) в группе монтелукаста и с 38,5% до 12,8% в группе флутиказона. После терапии монтелукастом количество эозинофилов периферической крови снизилось как в группе монтелукаста, так и в группе флутиказона (без статистически достоверной разницы).
Результаты исследования MOSAIC показали, что у детей в возрасте 6–14 лет с легкой персистирующей астмой монтелукаст был сопоставим с флутиказоном по увеличению доли дней без терапии астмы по экстренным показаниям. Оба препарата в целом хорошо переносились [24].
Для оценки приверженности к терапии в современной медицинской литературе используются ряд терминов: «сompliance», «adherence», «concordance».
Комплаенс («сompliance» — «приверженность») описывает степень, в которой пациент следует назначениям при приеме лекарств. Есть еще термин «соблюдение» («adherence»), который обладает меньшим количеством негативных смысловых связей («отцовская» модель отношений вместо партнерской). Альтернативный термин «concordance» («соответствие», «идентичность»), предложенный с целью отразить суть лечения как достижение общей цели врача и пациента, не получил широкого распространения. По мнению большинства исследователей, недостаточная приверженность к терапии БА ухудшает контроль над болезнью [25], увеличивает риск госпитализации [26], а также смертность, связанную с астмой [27], приводит к необоснованному увеличению дозировки лекарства или назначению дополнительного лечения, усложняя режим приема лекарств и увеличивая стоимость лечения [28]. Несоблюдение больными предписанного режима обходится американской системе здравоохранения в $300 млрд/год [29].
Достаточно интересные результаты были получены при сравнении использования таблетированного препарата (монтелукаст) и ИГКС (беклометазон) в виде дозированного ингалятора. Цель исследования была оценить предпочтения/приверженность терапии при сравнении монтелукаста и ИГКС. Было обследовано 124 ребенка с астмой в возрасте 6–14 лет. Фаза наблюдения составила 6 месяцев [30]. Дети, участвовавшие в исследовании, чаще выполняли назначения по применению монтелукаста, чем беклометазона. Средняя доля дней, в течение которых пациенты полностью выполняли назначения, составила 98% в группе монтелукаста и 83% в группе беклометазона. Различия между группами достигали 15% и были статистически значимыми (p < 0,001).
Выводы
- Антилейкотриеновые препараты облегчают симптомы БА и являются препаратами для базисной терапии этого заболевания.
- Монтелукаст рекомендован пациентам, страдающим астмой с сопутствующим аллергическим ринитом.
- С позиции доказательной медицины антагонисты лейкотриеновых рецепторов включаются в качестве монотерапии детей с легкой персистирующей БА.
- Монтелукаст приводит к значительному улучшению контроля БА у детей (в том числе и у детей 2–5 лет).
- Монтелукаст снижает частоту обострений БА, обусловленных вирусной инфекцией, у детей в возрасте 2–5 лет с интермиттирующей БА.
- Монтелукаст предупреждает бронхоспазм, вызванный физической нагрузкой или холодным воздухом.
- Обладает противовоспалительным эффектом, комплементарным действию глюкокортикостероидов.
Литература
- 2008–2012 Action Plan for the Global Strategy for the Prevention and Control of Noncommunicable Diseases. WHO. 2008.
- International consensus on (ICON) pediatric asthma. John Wiley & Sons A/S. 2012.
- Demoly P., Annunziata K., Gubba E., Adamek L. Repeated cross-sectional survey of patient-reported asthma control in Europe in the past 5 years // Eur Respir Rev. 2012; 21: 66–74.
- Ghosh G., Manglik A. K., Roy S. Efficacy and Safety of Montelukast as Monotherapy in Children with Mild Persistent Asthma // Indian Pediatrics. 2006; v. 43: 780–785.
- Pelkonen A. S., Malmstrom K., Sarna S., Kajosaari M., Klemola T., Malmberg L. P., Makkela M. J. The effect of montelukast on respiratory symptoms and lung function in wheezy infants // Eur Respir J. 2013; 41: 664–670.
- Holgate S. T., Bradding P., Sampson A. P. Leukotriene antagonists and synthesis inhibitors: new directions in asthma therapy // J Allergy Clin Immunol. 1996; 98: 1–13.
- Figueroa D. J., Breyer R. M., Defoe S. K. Expression of the cysteinyl leukotriene 1 receptor in normal human lung and peripheral blood leukocytes // Am J Respir Crit Care Med. 2001; 163 (1): 226–233.
- Tintinger G. R., Feldman C., Theron A. J., Anderson R. Montelukast: More than a Cysteinyl Leukotriene Receptor Antagonist? // The Scientific World Journal. 2010, v. 10, 2403–2413.
- Holgate S. T., Peters-Golden M. Introduction: the antiinflammatory role of cysteinyl leukotriene receptor antagonists in asthma // J Allergy Clin Immunol. 2003; 111 (suppl 1): S1–4.
- Krawiec M. E., Wenzel S. E. Leukotriene inhibitors and nonsteroidaltherapies in the treatment of asthma // Expert Opin Pharmacother. 2001; 2 (1): 47–65.
- Drazen J. M. Anti-leukotrienes as novel anti-infl amatory treatments in asthma // Adv Exp Med Biol. 2002; 507: 217–221.
- Parameswaran K., Liang H., Fanat A., Watson R., Snider D. P., O’Byrne P. M. Role for cysteinyl leukotrienes in allergeninduced change in circulating dendritic cell number in asthma // J Allergy Clin Immunol. 2004; 114 (1): 73–79.
- Jeffery P. K. The roles of leukotrienes and the effects of leukotriene receptor antagonists in the infl ammatory response and remodelling of allergic asthma // Clin Exp Allergy Rev. 2001; 1 (2): 148–153.
- Wenzel S. E. The role of leukotrienes in asthma // Prostaglandins Leukot Essent Fatty Acids. 2003; 69 (2–3): 145–155.
- Shibata A., Katsunuma N., Tomikawa M., Tan A., Yuki K., Akashi K., Eto Y. Increased Leukotriene E4 in the Exhaled Breath Condensate of Children With Mild Asthma // Chest. 2006; 130: 1718–1722.
- Increased Leukotriene E4 in the Exhaled Breath Condensate of Children With Mild Asthma. CHEST 2006; 130: 1718–1722.
- Csoma Z., Kharitonov S. A., Barnes P. J. et al. Increased leukotrienes in exhaled breath condensate in childhood asthma // Am J Respir Crit Care Med. 2002; 166: 1345–1349.
- Volovitz B., Tabachnik E., Nussinovitch M., Shtaif B., Blau H., Gil-Ad I., Weizman A., Varsano I. Montelukast, a leukotriene receptor antagonist, reduces the concentration of leukotrienes in the respiratory tract of children with persistent asthma // J Allergy Clin Immunol. 1999, 104: 1162–1167.
- Lex C., Zacharasiewicz A., Payne D., Wilson N. M., Nicholson A, Kharitonov S. A., Barnes P. J., Bush A. Exhaled breath condensate cysteinyl leukotrienes and airway remodeling in childhood asthma: a pilot study // Respiratory Research. 2006, 7: 63–69.
- Bisgaard H., Zielen S., Garcia M., Johnston S. L., Gilles L., Menten J., Tozzi C. A., Polos P. Montelukast Reduces Asthma Exacerbations in 2-to 5-Year-Old Children with Intermittent Asthma // Am J Respir Crit Care Med. 2005, v. 171, p. 315–322.
- Small I., Moreira A., Couto M. Practical approach to managing exercise-induced asthma in children and adults // Prim Care Respir J. 2013; 22 (1): 126–129.
- Kemp J. P., Dockhorn R. J., Shapiro G. G. Montelukast once daily inhibits exercise-induced bronchoconstriction in 6-to 14-year-old children with asthma // J. Pediatr. 1998; 133: 424–428.
- Mastalerz L., Ni?ankowska E., Sanak M. et al. Clinical and genetic features underlying the response of patients with bronchial asthma to treatment with a leukotriene receptor antagonist // Eur J Clin Inves. 2002; 32: 949–955.
- Kita T., Fujimura M., Ogawa H., Nakatsumi Y., Nomura S. Antitussive effects of the leukotriene receptor antagonist montelukast in patients with cough variant asthma and atopic cough // Allergology Internetional. 2010; 59 (2): 185–192.
- Garcia M. L., Wahn U., Gilles L., Swern A., Tozzi C. A., Polos P. Montelukast, Compared With Fluticasone, for Control of Asthma Among 6-to 14-Year-Old Patients With Mild Asthma: The MOSAIC Study // Pediatrics. 2005, v. 116, № 2, 360–369.
- Bender B., Zhang L. Negative affect, medication adherence, and asthma control in children // Journal of Allergy and Clinical Immunology. 2008, v. 122, № 3, p. 490–495.
- Bender B., Milgrom H., Rand C., Ackerson L. Psychological factors associated with medication nonadherence inasthmatic children // Journal of Asthma. 1998, v. 35, № 4, p. 347–353.
- Robertson C. F., Rubinfeld A. R., Bowes G. Pediatric asthma deaths in Victoria: the mild are at risk // Pediatric pulmonology. 1992, v. 13, № 2, p. 95–100.
- Cramer J. A. Feedback on medication dosing enhances patient compliance // Chest. 1993, v. 104, № 2, p. 333–334.
- Bender B. G., Rand C. Medication non-adherence and asthma treatment cost // Current Opinion in Allergy and Clinical Immunology. 2004, v. 4, № 3, p. 191–195.
- Lagos J. A, Marshall G. D. Montelukast in the management of allergic rhinitis / Therapeutics and Clinical Risk Management 2007:3 (2), p. 327–332
- Chowdhury M. A. N., Uddin M. S., Das S., Hoque M. Montelukast in Allergic Rhinitis: A Review / Medicine tiday 2012 Volume 24 Number 02, p. 75–78
- Brozek J. L., Bousquet J., Baena-Cagnani C. E., Bonini S., Canonica G. W., Casale T. B., van Wijk R. G., Ohta K., Zuberbier T., Scheunemann H. J. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 Revision // J Allergy Clin Immunol. 2010; 126: 466–476.
- Pedinoff A. P. G, Vandormael K., Ty mofyeyev Y., Smugar S. S., Reiss T. F., Korenblat P. E. A phase I randomized, placebo-controlled, dose-exploration study of single-dose inhaled montelukast in patients with chronic asthma // J Asthma. 2010, 47 (10): 1078–1084. Epub 2010 Nov 3.
- Majak P. Montelukast treatment may alter the early efficacy of immunotherapy in children with asthma // J Allergy Clin Immunol. 2010; 125: 1220–1227.
- Sicherer S. H. Clinical aspects of gastrointestinal allergy in childhood // Pediatrics. 2003; 111: 1609–1616.
- Capsomidis A., Tighe M. Is oral montelucast beneficial in treating acute asthma exacerbations in children? // Arch Dis Child. 2010, 95: 948–950.
* Зилейтон в РФ не зарегистрирован.
** Пранлукаст в РФ не зарегистрирован.
Г. А. Новик, доктор медицинских наук, профессор
ГБОУ ВПО СПбГПМУ МЗ РФ, Санкт-Петербург
Контактная информация: [email protected]
Abstract. Treatment of allergic inflammation with bronchial asthma patients has been analyzed. Indications to prescription of leukotriene receptor blocking agents are discussed, effectiveness of application of anti-leukotriene preparations with bronchial asthma including its application for children has been shown.
Купить номер с этой статьей в pdf
www.lvrach.ru
Антилейкотриеновые препараты нового поколения: перечень лучших
Антилейкотриеновые препараты представляют собой новый класс средств, уменьшающих воспалительные процессы, которые имеют инфекционную или аллергическую этиологию.
Для того чтобы понимать принцип действия подобных препаратов, стоит разобраться в том, что представляют собой лейкотриены.
Лейкотриены
Являются медиаторами воспалительных процессов. По своей химической структуре они являются жирными кислотами, которые образованы арахидоновой кислотой.
Лейкотриены принимают участие в процессе развития бронхиальной астмы. Так же как и гистамин, они являются медиатором аллергических реакций немедленного типа. Гистамин способен вызвать стремительный, но кратковременный спазм бронхов, а лейкотриены вызывают отсроченный и более продолжительный спазм.
Как классифицируются антилейкотриеновые препараты?
В настоящее время классифицированы следующие лейкотриены: A4, B4, C4, D4, E4.
Синтез лейкотриенов происходит из арахидоновой кислоты. Она под воздействием 5-липоксигеназы переходит в лейкотриен A4. После этого происходит каскадная реакция, в результате которой образуются следующие лейкотриены B4-C4-D4-E4. Конечный продукт такой реакции – ЛТЕ4.
Установлено, что ЛТЕ4, D4, E4 способны вызывать бронхоконстрикторный эффект, повышать секрецию слизи, могут способствовать развитию отечности, тормозить мукоцилиарный клиренс.
B4, D4, E4 имеют хемотаксическую активность, то есть могут привлекать нейтрофилы и эозинофилы в зону воспалительного процесса.
Ученые доказали, что лейкотриены продуцированы макрофагами, тучными клетками, эозинофилами, нейтрофилами, Т-лимфоцитами, которые принимают непосредственное участие в реакции воспалительного характера. Антилейкотриеновые препараты при бронхиальной астме часто применяют.
После того как клетки вступили в контакт с аллергеном и произошло охлаждение дыхательных путей либо после физической нагрузки, активируется синтез ЛТ. То есть синтез начинается, когда увеличивается осмолярность бронхиального содержимого.
Четыре группы препаратов
В настоящее время известно всего четыре группы антилейкотриеновых препаратов:
- «Зилеутон», являющийся прямым ингибитором 5-липооксигеназы.
- Препараты, являющиеся ингибиторами ФЛАП, предупреждающими процесс связывания данного белка с арахидоновой кислотой.
- «Зафирлукаст», «Побилукаст», «Монтелукаст», «Пранлукаст», «Верлукаст», являющиеся антагонистами рецепторов сульфидопептидных лейкотриенов.
- Препараты, являющиеся антагонистами рецепторов лейкотриена В4.
Наиболее исследованными являются антилейкотриеновые препараты первой группы и средства третьей группы. Рассмотрим представителей этих групп немного подробнее.
«Зилеутон»
«Зилеутон» является обратимым ингибитором 5-липооксигеназы. Он способен угнетать процесс образования сульфидопептидных ЛТ и ЛТ В4. Препарат может оказывать бронхорасширяющее воздействие длительностью до пяти часов. Также он способен предупредить возникновение бронхиального спазма, который является следствием воздействия холодного воздуха или «Аспирина».
Многочисленные исследования доказывают, что «Зилеутон», назначенный пациентам, страдающим от бронхиальной астмы в течение от одного до шести месяцев, способен снизить потребность больного в ингаляции β2-адреномиметиков и глюкокортикоидов. Однократный прием «Зилеутона» предупреждает возникновение чихания и затрудненное носовое дыхание у тех пациентов, которые страдают аллергическим ринитом после введения аллергена назально.

Шестинедельная терапия с применением «Зилеутона» больных атопической астмой показывала значительный результат. Медики отмечают качественное понижение уровня эозинофилов и нейтрофилов. Также снижался фактор некроза опухоли в жидкости лаважа бронхоальвеолярного типа после теста аллергеном. Вот чем уникальны антилейкотриеновые препараты, механизм действия именно на этом основан.
«Зилеутон» характеризуется достаточно коротким сроком, в течение которого происходит его полувыведение. Это предполагает, что препарат следует принимать достаточно часто, до четырех раз в сутки. Помимо этого, «Зилеутон» способен понижать клиренс теофиллина. Это обязательно нужно учитывать, если предполагается параллельный прием теофиллина и «Зилеутона». То есть дозу первого следует снизить. Если «Зилеутон» назначается на длительный срок, то следует осуществлять контроль уровня печеночных ферментов.
Но есть антилейкотриеновые препараты нового поколения, перечень их представлен ниже.
Средства, которые являются антагонистами сульфидопептидных лейкотриенов, представляют собой высокоселективные конкуренты и обратимые блокаторы рецепторов ЛТ D4. К таким препаратам относятся «Пранлукаст», «Зафирлукаст», «Монтелукаст».
«Аколат» («Зафирлукаст»)
«Зафирлукаст», он же «Аколат», является наиболее изученным препаратом данной группы антилейкотриеновых веществ. Он также обладает активностью бронхорасширяющей направленности. Эффект держится довольно продолжительное время, до пяти часов. «Зафирлукаст» способен предупреждать процесс развития астматической реакции в случае ингаляции аллергеном. Его эффективность доказана и при профилактике спазма бронхов, который провоцируется холодным воздухом, аспирином, физической нагрузкой, поллютантами. Данный лекарственный препарат, а также препарат «Монтелукаст» способны усиливать бронхолитическую активность β2-адреномиметиков.
«Аколат» («Зафирлукаст») обладает хорошей всасываемостью, пик его концентрации в крови достигается по истечении трех часов после его приема. Период его полувыведения немного продолжительней, чем у «Зилеутона», и составляет 10 часов. Помимо этого, он не оказывает влияния на клиренс теофиллина. Принимать данный препарат следует либо за час до приема пищи, либо по истечении двух часов после него, так как еда значительно уменьшает его способность всасывания. Средство переносится пациентами довольно хорошо.
Заключение
Антилейкотриеновые препараты при аллергии можно использовать для детей, однако не ранее, чем они достигнут двухлетнего возраста. При помощи этих медикаментов у детей лечат рецидивирующий бронхит, аллергический ринит, легкую бронхиальную астму.
fb.ru
Вариант 14
Классификация лекарственных средств, влияющих на моторику желудка: группы, названия препаратов.
Прокинетические (стим. эвакуацию): метоклопрамид, цизаприд
Ослабляющие моторику: м-холиноблокаторы, атропин; спазмолитики миотропного действия: папаверин, дротаверин
Монтелукаст: механизм действия, показания к применению.
Антагонисты лейкотриеновых рецепторов – это препараты, которые блокируют рецепторы к лейкотриенам (зафирлукаст и монтелукаст) и угнетают активность фермента 5-липооксигеназы (зилейтон), катализирующего процесс образования лейкотриенов из арахидоновой кислоты.
Препараты этой группы оказывают противовоспалительное действие, подавляя клеточные и неклеточные компоненты воспаления в бронхах, вызываемого воздействием антигенов.
В связи с этим антагонисты лейкотриеновых рецепторов применяются для лечения бронхиальной астмы.
В эту группу входят препараты зафирлукаст (Аколат), зилейтон и монтелукаст (Сингуляр).
Механизм действия
Лейкотриены – это биологически активные вещества, относящиеся к числу медиаторов аллергического воспаления, которые представляют собой жирные кислоты, образующиеся из арахидоновой кислоты при участии фермента 5-липооксигеназы.
В настоящее время идентифицированы лейкотриены ЛТА 4 , ЛТВ 4 , ЛТС 4 , ЛТД 4 и ЛТЕ 4 ..
Являясь медиаторами аллергии и воспаления, лейкотриены оказывают различные отрицательные эффекты на дыхательную систему и приводят к нарушению бронхиальной проводимости.
Лейкотриены индуцируют бронхоспазм, повышают проницаемость мелких сосудов, вызывают гиперсекрецию слизи, инфильтрацию стенок бронхов клетками воспаления, пролиферацию волокон гладкой мускулатуры бронхов. Действие лейкотриенов на бронхи опосредовано цистеинил лейкотриеновыми рецепторами эпителия дыхательных путей.
Антагонисты лейкотриеновых рецепторов блокируют цистеинил лейкотриеновые рецепторы (зафирлукаст и монтелукаст) и угнетают активность фермента 5-липооксигеназы (зилейтон), катализирующего процесс образования лейкотриенов из арахидоновой кислоты.
В результате снижается реактивность бронхов при вдыхании аллергенов, уменьшается бронхоспазм, улучшается функция легких.
Антагонисты лейкотриеновых рецепторов оказывают противовоспалительное действие, подавляя клеточные и неклеточные компоненты воспаления в бронхах, вызываемого воздействием антигенов.
У пациентов, получающих антагонисты лейкотриеновых рецепторов, уменьшается выраженность симптомов бронхиальной астмы в дневное время и ночью. Прием препаратов этой группы позволяет предупреждать приступы бронхиальной астмы, вызванные антигенами, аспирином, физической нагрузкой и холодным воздухом.
Фенотерол: механизм токолитического действия, показания к применению, побочные эффекты.
К средствам, ослабляющим сократительную активность миометрия (так называемые токолитические средства1), относятся препараты, стимулирующие B2-адренорецепторы матки, — фенотерол , сальбутамол. Их назначают главным образом для задержки преждевременно наступающих родов. Эффективность их достаточно высока. Однако они не обладают избирательностью действия в отношении миометрия. Одновременно с расслаблением мускулатуры матки наблюдаются побочные эффекты, связанные с возбуждением р-адренорецепторов разной локализации, и некоторая стимуляция р-адренорецепторов (правда, значительно менее выраженная, чем для изадрина).
Фенотерол при энтеральном введении действует быстрее, но кратковремен-нее, чем сальбутамол. Снижение содержания фенотерола в плазме на 50% происходит примерно через 7 ч. Основное его количество выделяется почками (в виде конъюгатов с сульфатами), около 15% — пищеварительным трактом.
Оба препарата вызывают некоторую тахикардию как у матери, так и у плода, а также гипергликемию у плода.
Низкомолекулярные гепарины: препараты, механизм антикоагулянтного действия, показания к применению, сравнительная характеристика стандартного гепарина и низкомолекулярных гепаринов.
Низкомолекулярные гепарины (низкомолекулярные фрагмен-тыгепарина) — надропарин (фраксипарин), дальтепарин, эноксапа-рин (клексан) снижают активность фактора Ха (нарушают превращение протромбина в тромбин) и мало влияют на активность тромбина. По сравнению с гепарином действуют более продолжительно и в меньшей степени вызывают тромбоцитопению и геморрагии.
Препараты вводят под кожу 1—2 раза в сутки при нестабильной стенокардии, инфаркте миокарда, ишемическом инсульте, тромбозах вен, для профилактики тромбоэмболии после хирургических операций.
При передозировке гепарина и низкомолекулярных гепаринов в качестве их антагониста внутривенно вводят протамина сульфат (1мг протамина сульфата нейтрализует 80—100 ЕД гепарина).
Ибупрофен: механизм действия, фармакологические эффекты, показания к применению, побочные эффекты.
Ибупрофен (бруфен, нуро-фен) — одно из наименее токсичных НПВС. Применяется при головной и зубной боли, высокой температуре у детей, приступах мигрени, невралгиях, миалгиях, артритах, спондилитах, а также при альгодисменорее. Назначают внутрь 3—4 раза в день.
обладают в основном тремя свойствами: противовоспалительным, анальгетическим и жаропонижающим. Механизм противовоспалительного действия этих веществ связан с угнетением циклооксигеназы (рис. 62). При этом нарушается образование провоспалительных простагландинов Е и I.
Анальгетический эффект НПВС также связан с нарушением образования простагландинов Е2 и 12, которые повышают чувствительность болевых рецепторов к брадикинину. НПВС эффективны в основном при болях, связанных с воспалением (зубная боль, боль при артритах, миозитах, невралгиях), а также при головной боли, послеоперационных болях, болях при метастазах опухолей в костной ткани. При альгодисменорее НПВС уменьшают боль 1) за счет анальгетических свойств, 2) в связи с ослаблением сокращений миометрия (ослабление утеротонического действия простагланди-на F2a).
Жаропонижающий эффект НПВС связан с уменьшением продукции простагландина Е2 (при инфекциях интерлейкин-1, выделяемый макрофагами, стимулирует образование простагландина Е2, который активирует центры терморегуляции в гипоталамусе). Нормальную температуру НПВС не снижают и действуют как жаропонижающие средства только при лихорадке.
studfile.net
Лейкотриены — это… Что такое Лейкотриены?
Лейкотриен E4Лейкотрие́ны — группа липидных высокоактивных веществ, образующаяся в организме из арахидоновой кислоты, содержащей 20-членную углеродную цепь. Подкласс лейкотриенов, вместе с простаноидами, входит в класс эйкозаноидов. Один из основных эффектов лейкотриенов — бронхоспазм — лежит в основе патогенеза бронхиальной астмы.
История
В 1938 году Киллвэй и Фелдберг, при исследовании воздействия яда кобры на лёгкие морских свинок, случайно обнаружили в лёгочном перфузате неизвестное ранее вещество, обладающее бронхоконстрикторным действием. Бронхоспазм, развивавшийся под воздействием этого неизвестного вещества, отличался от вызванной гистамином бронхоспастической реакции медленным развитием и большей продолжительностью. В связи с этим учёные назвали это вещество медленнореагирующей субстанцией анафилаксии (сокращенно МРСА, англ. slow reacting substance).
В 1960 году Броклхёрст выделил МРС-А из лёгочной ткани больного бронхиальной астмой после проведения ингаляционной провокации с аллергеном. Этим исследованием он подтвердил, что МРСА обладает выраженным бронхоконстрикторным действием и является важным медиатором в развитии аллергического воспаления у больных БА.
В конце 1970-х годов была расшифрована структура молекулы МРСА. В исследованиях Бенгта Самуэльсона и его сотрудников было показано, что МРСА представляет собой неоднородную химическую структуру, относящуюся к семейству липидных медиаторов. Впервые эти медиаторы были выделены из лейкоцитов и характеризовались наличием конъюгированной триеновой структуры. В связи с этим выделенные вещества были названы «лейкотриенами» (ЛТ).
В настоящее время идентифицированы ЛТА4, ЛТВ4, ЛТС4, ЛТD4, ЛТE4, ЛТF4. Среди них выделяют 2 подгруппы лейкотриенов: к первой относят ЛТC4, ЛТD4, ЛТE4 и ЛТF4, они содержат в боковой цепи пептидные остатки, ко второй относят ЛТВ4, имеющий другое строение.
Синтез
 Метаболизм арахидоновой кислоты. Синие стрелки — участие фермента, красные стрелки — блокирование
Метаболизм арахидоновой кислоты. Синие стрелки — участие фермента, красные стрелки — блокированиеКак было сказано выше, лейкотриены образуются из арахидоновой кислоты, которая, в свою очередь, отщепляется от фосфолипидов цитоплазматической мембраны, с помощью фермента фосфолипаза A2.
Далее арахидоновая кислота может трансформироваться двумя путями: под влиянием ЦОГ она превращается в простаноиды, а под влиянием липоксигеназной ферментной системы в лейкотриены.
Липоксигеназная ферментная система относится к растворимым цитозольным ферментам, они обнаружены в цитоплазме альвеолярных макрофагах, тромбоцитах, тучных клетках и лейкоцитах. Наиболее важным среди ферментов этой системы является 5-липоксигеназа (5-ЛОГ). Активация перечисленных клеток приводит к перемещению 5-ЛОГ к мембране ядерного аппарата и связыванию со специфическим белком — 5-ЛОГ-активирующим протеином (5-ЛОГ-АП). 5-ЛОГ-АП является кофактором при взаимодействии арахидоновой кислоты и 5-ЛОГ. Таким образом, арахидоновая кислота под воздействием комплекса 5-ЛОГ + 5-ЛОГ-АП превращается в нестабильное соединение 5-гидроксипероксиэйкозатетраеновую кислоту (5-HPETE), из которой в свою очередь образуется ЛТА4. Обе эти реакции катализируются активированной 5-ЛОГ, расположенной на перинуклеарной мембране.
Далее ЛТА4 может превращаться двумя путями: либо при участии цитозольного фермента ЛТА4-гидролазы в ЛТВ4, либо под воздействием ЛТС4-синтетазы с образованием цисЛТС4. ЛТС4 выходит во внеклеточное пространство и далее с помощью g-глутамилтрансептидазы превращается в ЛТD4, который затем под влиянием дипептидазы образует ЛТЕ4. ЛТЕ4 является субстратом для образования ЛТF4.
Химическое строение
Лейкотриен А4 Лейкотриен В4 Лейкотриен С4 Лейкотриен D4Лейкотриены являются производными арахидоновой кислоты. Последняя является полиненасыщенной кислотой, содержащей 20 атомов углерода, из которых 1-й входит в состав карбоксильной группы (-COOH). Молекула арахидоновой кислоты также содержит 4 двойные связи: первая расположена между 5 и 6 атомом углерода (счет их ведется от -COOH), вторая — между 8 и 9, третья — между 11 и 12, четвёртая — между 14 и 15.
Известно 6 типов лейкотриенов — А, В, С, D, Е и F. Их объединяет — с точки зрения химического строения — наличие карбоксильной группы, общее число атомов углерода в основной цепочке (20) и наличие 4 двойных связей (поэтому после написания названия лейкотриена, указывают индекс 4). Тем не менее, каждая молекула лейкотриенов имеет свои особенности:
- ЛТА4 — его 4 двойные связи расположены следующим образом: первая — между 7 и 8 атомом углерода, вторая — между 9 и 10, третья — между 11 и 12, четвёртая — между 14 и 15. Кроме того, к 5 и 6 атомам углерода присоединяется одна эпоксидная группа.
- ЛТВ4 — его 4 двойные связи расположены иначе: первая — между 6 и 7 атомом углерода, вторая — между 8 и 9, третья — между 10 и 11, четвёртая — между 14 и 15. Кроме того, к 5 и 13 атомам углерода присоединяются гидроксильные группы.
- ЛТС4 — также отличается расположением 4 двойных связей: первая — между 7 и 8 атомом углерода, вторая — между 9 и 10, третья — между 11 и 12, четвёртая — между 13 и 14. Кроме того, к 5-му атому углерода присоединяются гидроксильная группа, а к шестому глутатион, через сульфидную группу цистеина.
- ЛТD4 — очень похож на лейкотриен С4, но он образуется при отщеплении от глутатиона одной аминокислоты — глутамата. Поэтому его боковая пептидная цепочка именуется цистеинилглицином.
- ЛТE4 — образутся из ЛТD4, после того как его пептидная цепь лишается ещё одной аминокислоты — глицина.
- ЛТF4 — очень похож на лейкотриен С4, но он образуется при отщеплении от глутатиона глицина. Поэтому его боковая пептидная цепочка именуется γ-глутамилцистеином).[1]
Таким образом, по химическому строению, можно выделить две группы лейкотриенов:
- 1 группа — «пептидные (цистеиновые) лейкотриены», к ним относят ЛТС4, ЛТD4, ЛТЕ4, ЛТF4.
- 2 группа — лейкотриены, без пептидов: ЛТА4, ЛТВ4.
Роль в организме
Лейкотриеновые рецепторы
Выделяют три основных типа рецепторов лейкотриенов.[2] Причём два из них модулируются «пептидными лейкотриенами»:
- «Пептидные лейкотриены» модулируют специфические рецепторы, сопряженные с G-белком. Их обозначают CysLT-R. В настоящее время выделяют 2 типа CysLT. Взаимодействие лейкотриенов с рецепторами 1 типа (CysLT1) определяет спектр их основных эффектов (бронхоспазм). Связывание ЛТ с рецепторами 2 типа (CysLT2) изменяет тонус и проницаемость сосудов.
- Лейкотриен B4 модулирует другой тип рецепторов — BLT1- и BLT2-рецепторы (другое название LTB4-рецепторы).
Основные эффекты
- ЛТB4 — опосредует хемотаксис, экссудацию плазмы, сокращение паренхимы лёгких, участие в иммунных ответах.
- ЛТC4, ЛТD4, ЛТE4 являются основными компонентами МРСА, поэтому в первую очередь эта группа лейкотриенов относится к мощным бронхоконстрикторам. Также эти лейкотриены способны повышать тонус гладких мышц ЖКТ, опосредовать экссудацию плазмы и сокращение паренхимы лёгких.
Роль в патологии
- Лейкотриены участвуют в патогенезе бронхиальной астмы. Вместе с гистамином лейкотриены относятся к медиаторам ранней фазы аллергической реакции немедленного типа. В результате действия гистамина возникает мгновенный и кратковременный бронхоспазм, лейкотриены же вызывают отсроченный и более длительный бронхоспазм.
- Лейкотриены вызывают очень неприятный аспириновый бронхоспазм, возникающий при приёме неселективных НПВС: аспирин и др.[3] Аспириновый бронхоспазм порождается следующим образом: ЦОГ, которую ингибируют НПВС, катализирует реакцию превращения арахидоновой кислоты в циклический эндопероксид ПГ h3. Это ведёт к тому, что синтез ПГ резко уменьшается, а на этом фоне преобладающими станут лейкотриены. Однако, активность фосфолипазы A2 остаётся неизменной, соответственно арахидоновой кислоты отщепляется от фосфолипидов цитоплазматической мембраны столько же, сколько и в норме. Если в физиологических условиях арахидоновая кислота равномерно распределялась, поступая на синтез и ПГ и ЛТ, то при ингибировании ЦОГ, она целиком и поностью будет поступать на синтез лейкотриенов. Таким образом, при использовании неселективных НПВС, в тканях человека будет не просто вакатное (лат. vacuus — пустой) преобладание ЛТ, но они будут синтезироваться интенсивнее, чем в норме. ЛТC4, ЛТD4, ЛТE4 входят в комплекс МРСА, которая порождает бронхоспазм.
Возможности фармакологической коррекции эффектов
- В настоящее время разработаны и успешно используются антагонисты CysL-R1: монтелукаст, зафирлукаст и пранлукаст (последний не зарегистрирован в РФ). Препараты могут использоваться в виде монотерапии у больных лёгкой персистирующей бронхиальной астмой. У больных со среднетяжёлым и тяжёлым течением заболевания антагонисты CysLT-R1 используют в качестве дополнительной терапии в комбинации с ингаляционными глюкокортикоидами (ИГКС) с целью уменьшения дозы ИГКС и достижения полного контроля астмы. Отмечено также их положительное влияние на течение аспириновой БА у больных с непереносимостью нестероидных противовоспалительных препаратов.
- Созданы ингибиторы биосинтеза лейкотриенов, подавляющие активность фермента 5-ЛОГ: зилеутон. Установлено, что этот препарат оказывает бронхорасширяющее действие (его начало в течение 2-х часов, продолжительность — 5 часов после приема) и предупреждает развитие бронхоспазма, вызываемого аспирином и холодным воздухом.
- В экспериментах созданы блокаторы 5-ЛОГ-активирующего протеина и рецепторов ЛТB4.
Таким образом, можно выделить 4 точки приложения препаратов:
- Прямые ингибиторы 5-ЛОГ (зилеутон, Z-D2138, АВТ-761),
- Ингибиторы 5-ЛОГ-АП предупреждающие связывание этого мембраносвязанного белка с арахидоновой кислотой (МК-0591, МК-886, BAYxl005 и др.),
- Антагонисты CysLT-R (зафирлукаст, монтелукаст, пранлукаст и др.),
- Антагонисты рецепторов лейкотриенов В4 (U-75, 302).[4]
Примечания
Ссылки
dic.academic.ru
Антагонисты лейкотриеновых рецепторов в терапии бронхиальной астмы и аллергического ринита Текст научной статьи по специальности «Клиническая медицина»
Антагонисты лейкотриеновых рецепторов в терапии бронхиальной астмы и аллергического ринита
Н.А. Вознесенский
Цистеиниловые лейкотриены (ЦЛТ) С4, Э4 и Е4 синтезируются клетками воспаления (эозинофилами, базофи-лами и тучными клетками, макрофагами) при метаболизме арахидоновой кислоты по липоксигеназному пути [1]. Повышенные уровни ЦЛТ были обнаружены при бронхиальной астме (БА) и аллергическом рините (АР) [2, 3]. Исследования в этой области привели к созданию антагонистов лейкотриеновых рецепторов (АЛР), среди которых зафирлукаст (аколат), монтелукаст (Сингуляр) и пран-лукаст (в РФ не зарегистрирован) [4].
Механизм действия АЛР заключается в блокировании ЦЛТ-рецепторов подтипа 1, благодаря чему АЛР:
• тормозят хемотаксис и активацию эозинофилов;
• уменьшают проницаемость сосудов и отек;
• снижают секрецию слизи;
• стимулируют мукоцилиарный клиренс;
• расслабляют гладкомышечные клетки бронхов [5, 6].
Противодействуя эффектам ЦЛТ в дыхательных путях, АЛР обладают противовоспалительной и бронхолити-ческой активностью при БА [4, 7]. Бронходилатация при приеме АЛР относительно слабая и развивается вследствие их противовоспалительных свойств. Как бронхолити-ческий, так и противовоспалительный эффекты АЛР усиливаются при сочетанном применении с другими противо-астматическими препаратами — р2-агонистами и ингаляционными глюкокортикостероидами (ИГКС) [8]. Важно отметить, что глюкокортикостероиды (ГКС) полностью не блокируют провоспалительные эффекты, обусловленные ЦЛТ [9].
ЦЛТ являются мощными хемоаттрактантами для эозинофилов, поэтому один из ключевых эффектов АЛР при БА связан с редукцией эозинофильного воспаления. Способность АЛР уменьшать эозинофилию в дыхательных путях продемонстрирована в ряде экспериментальных и клинических исследований. Так, монтелукаст при 4-недельной терапии у больных БА привел к уменьшению числа эозинофилов в мокроте на 48% [10]. Поскольку АЛР применяются перорально, они способны уменьшать эози-
Николай Арнольдович Вознесенский — канд. мед. наук, зав. лабораторией НИИ пульмонологии ФМБА России.
нофилию не только в дыхательных путях, но и в крови. У больных среднетяжелой БА, часть из которых исходно получали ИГКС, лечение монтелукастом в течение 12 нед сопровождалось достоверным уменьшением числа эозинофилов в крови [11]. Таким образом, АЛР в отличие от ИГКС оказывают системное влияние на процессы аллергического воспаления, что особенно важно для больных с сочетанием БА и АР [12].
Клиническая эффективность АЛР при БА
Монотерапия АЛР
Согласно современным руководствам АЛР в качестве монотерапии могут применяться при легкой персистирую-щей БА как один из альтернативных вариантов лечения [13]. Сравнение эффективности монотерапии АЛР и ИГКС было проведено в ряде исследований.
В многоцентровом рандомизированном двойном слепом плацебоконтролируемом исследовании MOSAIC, проведенном у детей в возрасте 6-14 лет с легкой персисти-рующей БА (n = 994), сравнивалась эффективность монотерапии монтелукастом (5 мг перорально 1 раз в сутки) и флутиказона пропионатом (ФП, 100 мкг 2 раза в сутки) на протяжении 12 мес [14]. Основной конечной точкой было число дней, “свободных от лечения” (ДСЛ) — без потребности в препаратах для купирования симптомов и обращений за медицинской помощью. Исходно у пациентов доля ДСЛ составляла 64%. В группе монтелукаста за время терапии наблюдалось 84,0% ДСЛ, а в группе ФП — 86,7%. Различие между группами по доле ДСЛ оказалось равным 2,7%, т.е. менее 1 дня за месяц. По другим параметрам также была достигнута положительная динамика в обеих группах, более выраженная в группе ФП. Переносимость обоих режимов терапии была хорошей. Несмотря на некоторые преимущества ФП, авторы делают заключение о сопоставимом эффекте монтелукаста и ФП при монотерапии легкой БА у детей.
В сходном по дизайну исследовании у взрослых пациентов (n = 400) с легкой персистирующей БА были получены аналогичные результаты [15]. Число ДСЛ во время первой двойной слепой фазы (12 нед) в группе ФП составило 74,9%, в группе монтелукаста — 73,1% (различие недостоверно — 1,8%), а во время открытой фазы (36 нед) — 77,3 и
С
71,1% (различие достоверно — 6,2%). При анализе выяснилось, что преимущества ФП обусловлены его большим эффектом у пациентов с исходно более выраженными функциональными нарушениями, а у остальных больных препараты оказались эквивалентными по достигаемому уровню контроля БА.
Очевидно, что при сравнении АЛР с ИГКС необходимо учитывать и риск нежелательных явлений. Потенциальное влияние ИГКС на линейный рост тела у детей — один из наиболее острых вопросов по безопасности этих препаратов. В исследовании MOSAIC [14] было показано, что прибавка роста за год у детей, получавших ФП, была на 0,4 см меньше, чем при приеме монтелукаста. В другом рандомизированном двойном слепом исследовании оценивалась скорость роста тела у детей (n = 360) при терапии беклометазона дипропионатом (БДП) или монтелукас-том в сравнении с плацебо [16]. Дети в возрасте 6,4-9,4 года получали в течение 56 нед БДП (200 мкг 2 раза в сутки), монтелукаст (5 мг/сут) или только плацебо. Доля дней с потребностью в р2-агонистах была больше в группе монтелукаста (10,6%), чем в группе БДП (6,7%), по потребности в пероральных ГКС эти группы не различались. Скорость линейного роста тела при терапии монте-лукастом и приеме плацебо была одинаковой, а при лечении БДП — на 0,8 см в год меньше (р < 0,001), что сопровождалось нарушениями со стороны маркеров костеобразования.
Важный фактор, особенно у больных легкой БА, — простота терапии монтелукастом (пероральный прием 1 раз в сутки) и связанный с ней уровень комплайнса. В открытом рандомизированном исследовании у детей с легкой персистирующей БА в возрасте 6-11 лет (n = 124) сравнивали эффективность, безопасность и комплайнс при терапии монтелукастом (5 мг на ночь) или БДП (по 100 мкг 3 раза в сутки) на протяжении 6 мес [17]. При равной эффективности (по частоте обострений, требующих приема пероральных ГКС, динамике функциональных показателей, числу пропущенных из-за БА учебных дней) комплайнс и субъективная удовлетворенность лечением (как у детей, так и у их родителей) в группе АЛР оказались значительно выше.
АЛР в комбинации с ИГКС
АЛР могут быть добавлены к терапии ИГКС при среднетяжелом и тяжелом течении БА в случае недостаточного контроля заболевания [13]. Такая рекомендация основана на доказанном аддитивном эффекте АЛР у больных БА, получающих ИГКС.
В рандомизированном двойном слепом исследовании [18] оценивали эффект от добавления к лечению монтелукаста (10 мг/сут) при БА, не полностью контролируемой терапией БДП (200 мкг 2 раза в сутки). Пациенты с объемом форсированного выдоха за 1-ю секунду (ОФВ1) 50-85% от должного и наличием симптомов, несмотря на прием БДП, после 4 нед вводного периода были разделе-
ны на 4 группы: монтелукаст + БДП; таблетки плацебо + БДП; монтелукаст + ингалятор плацебо; 2 препарата плацебо. Добавление монтелукаста к терапии БДП привело к достоверному увеличению ОФВ1, уменьшению дневных и ночных симптомов. При терапии только монтелукас-том контроль БА несколько ухудшился, но не до такой степени, как при приеме только плацебо. Таким образом, при сочетанном лечении ИГКС и АЛР их эффекты суммируются, позволяя достичь лучшего контроля БА.
Аддитивный эффект АЛР показан и при добавлении их к терапии будесонидом (многоцентровое рандомизированное двойное слепое исследование CASIOPEA) [19]. В исследование включались взрослые больные БА с ОФВ1 >55% от должного и сохраняющимися симптомами на фоне лечения будесонидом в дозе 400-1600 мкг/сут. После вводного периода пациенты в течение 16 нед получали прежнюю дозу будесонида в сочетании с монтелукастом либо с плацебо. В группе монтелукаста наблюдалось на 35% меньше дней “с ухудшением” (хотя бы один из признаков: усиление симптомов более чем на 50%, неоднократные пробуждения ночью от БА, увеличение потребности в р2-агонистах более чем на 70%, снижение пиковой скорости выдоха (ПСВ) на 20% и более, внеплановое обращение за медицинской помощью), чем в группе плацебо. Также при лечении монтелукастом было в 1,5 раза больше дней, “свободных от астмы” (использование не более
2 доз р2-агониста и отсутствие ночных симптомов) -66% (в группе плацебо — 42%, р = 0,001). Добавление к лечению монтелукаста сопровождалось улучшением и по другим показателям: частоте ночных пробуждений от симптомов БА, потребности в р2-агонистах и ПСВ.
Важные результаты получены в масштабном исследовании COMPACT [20]. Взрослые пациенты (n = 889) с неадекватным контролем БА при лечении будесонидом в дозе 800 мкг/сут были разделены на 2 группы, получавшие в течение 12 нед будесонид в дозе 1600 мкг/сут или будесо-нид 800 мкг/сут в сочетании с монтелукастом 10 мг/сут. Средняя ПСВ за последние 10 нед лечебного периода увеличилась в группах в равной степени, однако в первые
3 дня терапии прирост ПСВ происходил быстрее в группе комбинированной терапии (20,1 и 9,6 л/мин, р < 0,001). По улучшению остальных параметров контроля БА (потребность в р2-агонистах, дневные и ночные симптомы, обострения БА, “свободные от астмы” дни, качество жизни), а также по переносимости лечения группы не различались. Таким образом, у больных с недостаточным контролем БА добавление монтелукаста к терапии ИГКС обеспечивает такое же улучшение контроля, как удвоение дозы ИГКС.
АЛР при среднетяжелой/тяжелой БА в качестве терапии, дополнительной к ИГКС, служат определенной альтернативой Р2-агонистам длительного действия (ДД), а также могут применяться совместно с ними. Эти два класса препаратов сравнивались между собой при добавлении к терапии ИГКС в ряде исследований. По сравнению
с АЛР р2-агонисты ДД приводили к большему приросту функциональных показателей, особенно у больных с выраженной обратимой обструкцией [21]. Однако в двух других исследованиях [22, 23] эффективность салметеро-ла и монтелукаста при добавлении к терапии ИГКС оказалась равной. Улучшение симптомов и функциональных показателей у больных с легкой/среднетяжелой БА было одинаковым при сочетании ИГКС с салметеролом или монтелукастом, однако воспаление в дыхательных путях уменьшилось сильнее при использовании монтелукас-та [22]. В масштабном (n = 1490) 48-недельном исследовании салметерол и монтелукаст в качестве препаратов второй линии обладали равной эффективностью в предотвращении обострений БА, но это достигалось за счет разных механизмов: салметерол в большей степени улучшал симптомы и функцию легких, а монтелукаст уменьшал активность воспаления [23].
При выборе между АЛР и р2-агонистами ДД предлагается ориентироваться на те параметры, которые необходимо улучшить у конкретного больного [8]. Если при терапии ИГКС сохраняются нарушения функции дыхания, то более показано присоединение р2-агонистов ДД, а при выраженной активности воспаления в бронхах (о чем свидетельствуют высокая степень бронхиальной гиперреактивности, эозинофилия мокроты или крови, повышение уровня оксида азота в выдыхаемом воздухе) и при сочетании БА с АР препаратами выбора могут служить АЛР О высокой бронхиальной гиперреактивности можно судить не только по результатам инструментального обследования (тест с метахолином), но также по данным анамнеза (приступы при контакте с холодным воздухом, при физической нагрузке и т.д.) и пикфлоуметрии (выраженная вариабельность ПСВ).
Применение АЛР при аллергическом рините
Под эгидой Всемирной организации здравоохранения были разработаны рекомендации по диагностике и лечению АР в контексте его взаимосвязей с БА — “Аллергический ринит и его влияние на бронхиальную астму” (“Allergic Rhinitis and its Impact on Asthma” (ARIA)). Впервые программа ARIA, построенная на принципах доказательной медицины, опубликована в 2001 г., а в последующем она была кардинально переработана и дополнена в 2007 г. [24]. В этом документе нашли отражение многосторонние и тесные взаимовлияния АР и БА, которые описываются концепцией “единая дыхательная система, единое заболевание”.
АЛР занимают одну из ключевых позиций в ряду лекарственных препаратов, используемых для лечения АР у детей и взрослых (таблица). Монтелукаст доказал свою эффективность при сезонном АР, причем она оказалась эквивалентной Н1-блокатору лоратадину [25, 26]. Монтелукаст способен уменьшать и предупреждать симптомы со стороны носа и глаз, в том числе положительно влиять на зало-
Уровень доказательности рекомендаций по применению лекарственных препаратов при АР [24]
Класс препаратов Сезонный АР Круглогодичный АР
взрослые дети взрослые дети
Пероральные Н1-блокаторы A A A A
Интраназальные Н1-блокаторы A A A A
Интраназальные ГКС A A A A
Антагонисты лейкотриенов A А В —
Интраназальные кромоны A* A* A* A*
Моноклональные антитела к IgE A A A A
Примечания. Уровень доказательности А — рекомендации основаны на данных нескольких рандомизированных контролируемых исследований и/или метаанализов. Уровень доказательности В — рекомендации основаны на данных 1 рандомизированного контролируемого исследования или 1 метаанализа.
* Большинство исследований включали небольшое число пациентов.
женность носа. При профилактическом применении до начала сезона поллинации монтелукаст в сочетании с цети-ризином предупреждал симптомы АР и уменьшал аллергическое воспаление в слизистой оболочке носа [27]. При круглогодичном АР данные исследований по монтелукасту оказались противоречивыми [24].
При сочетании сезонного АР с БА антагонисты лейко-триеновых рецепторов могут быть препаратами выбора, так как они положительно влияют на симптомы обоих заболеваний (в отличие от Н1-блокаторов, которые не показаны для лечения БА) [28, 29]. Как было показано в исследовании COMPACT, у больных БА с сопутствующим АР добавление монтелукаста к терапии будесонидом эффективнее купировало бронхиальную обструкцию, чем удвоение дозы будесонида [20]. Это особенно важно, поскольку наличие АР утяжеляет течение БА, приводя к большей частоте приступов и обращений за неотложной помощью [30].
Заключение
Применение антагонистов лейкотриеновых рецепторов, обладающих системным противовоспалительным эффектом, обосновано при бронхиальной астме и аллергическом рините. На основании доказательств, полученных в крупных рандомизированных клинических исследованиях, АЛР рекомендованы международными согласительными документами в качестве монотерапии при легкой пер-систирующей БА и в комбинации с ИГКС при более тяжелых формах заболевания. Монтелукаст (Сингуляр) доказал свою эффективность и при сезонном АР. Особенно показан прием монтелукаста больным, у которых БА сочетается с сезонным АР. К достоинствам Сингуляра относятся его высокая безопасность и простота применения, обеспечивающая высокий комплайнс.
Список литературы 15. Zeiger R.S. et al. // Amer. J. Med. 2005. V. 118. P 649.
1. Samuelsson B. // Science. 1983. V. 220. P 568. 16. Becker A.B. et al. // Ann. Allergy Asthma Immunol. 2006. V 96. P 1.
2. Wenzel S.E. et al. // Amer. Rev. Respir. Dis. 1990. V 142. P. 112. 17. Maspero J.F. et al. // Curr. Med. Res. Opin. 2001. V. 17. P. 96.
3. Howarth PH. // Amer. J. Respir. Crit. Care Med. 2000. V. 161. 18. Laviolette M. et al. // Amer. J. Respir. Crit. Care Med. 1999. V. 160.
P 133. P. 1862.
4. Diamant Z., Sampson A.P // Clin. Exp. Allergy. 1999. V. 29. P 1449. 19. Vaquerizo M.J. et al. // Thorax. 2003. V. 58. P 204.
5. Ravasi S. et al. // Biochem. Pharmacol. 2002. V. 63. P 1537. 20. Price D.B. et al. // Thorax. 2003. V. 58. P 211.
6. Hay D.W. // Chest. 1997. V. 111. P 35. 21. Fish J.E. et al. // Chest. 2001. V. 120. P 423.
7. Sampson A.P et al. // J. Allergy Clin. Immunol. 2003. V. 111. P 49. 22. Wilson AM. et al. // Chest. 2001. V. 119. P 1021.
8. Diamant Z., Molen T.V.D. // Respir. Med. 2005. V. 99. P 655. 23. Bjermer L. et al. // Thorax. 2003. V. 327. P 891.
9. Dworski R. et al. // Amer. J. Respir. Crit. Care Med. 1994. V. 149. 24. ARIA (Allergic Rhinitis and its Impact on Asthma) Report 2007 //
P 953. www.whiar.org
10. Leff J.A. et al. // Amer. J. Respir. Crit. Care Med. 1997. V. 155. 25. van Adelsberg J. et al. // Ann. Allergy Asthma Immunol. 2003.
A. 977. V. 90. P 214.
11. Reiss T.F. et al. // Arch. Intern. Med. 1998. V. 158. P 1213. 26. Meltzer E.O. et al. // J. Allergy Clin. Immunol. 2000. V. 105. P 917.
12. Bousquet J. et al. // J. Allergy Clin. Immunol. 2001. V. 108. № 5. 27. Kurowski M. et al. // Allergy. 2004. V. 59. P 280.
Pt. 2. P. 147. 28. Busse W.W. et al. // Ann. Allergy Asthma Immunol. 2006. V. 96.
13. Global Strategy for Asthma Management and Prevention. Revised P 60.
2006 // www.ginasthma.com 29. Philip G. et al. // Curr. Med. Res. Opin. 2004. V. 20. P 1549.
14. Garcia M.L.G. et al. // Pediatrics. 2005. V. 116. P 360. 30. Bousquet J. et al. // Clin. Exp. Allergy. 2005. V. 35. P. 723. v
■ Клинические исследования. 2-е изд., испр. и доп.
(автор О.Г. Мелихов)
В монографии достаточно полно и вместе с тем популярно изложены основные теоретические и практические аспекты клинических исследований. Клиническое исследование — это изучение безопасности и эффективности исследуемого препарата у человека для выявления или подтверждения его клинических, фармакологических, фармакодинамических свойств, побочных эффектов и других особенностей действия на организм. Задача всех имеющих отношение к этому процессу специалистов — минимизировать риск, которому подвергаются участвующие в исследованиях пациенты, и получить безупречные научные данные о свойствах нового лекарственного средства. Рассмотрены история, фазы и виды клинических исследований, вопросы планирования, проведения и контроля качества. Особое внимание уделено этическим вопросам.
Второе издание (первое издание выпущено в 2003 г.) дополнено сведениями о нормативных документах Российской Федерации и международных организаций, вышедших в свет в период с 2004 по 2007 г. 200 с.
Для специалистов в области клинических исследований, врачей-исследователей и всех тех, кто интересуется процессом разработки новых лекарственных средств.
www.atmosphere-ph.ru
Всю дополнительную информацию можно получить на сайте
Книги Издательского дома “АТМОС
cyberleninka.ru
кому, когда, как долго* uMEDp
Как известно, цель терапии бронхиальной астмы – достижение и поддержание контроля. Между тем в половине клинических случаев наблюдается неконтролируемое течение заболевания. К основным препаратам для длительного контроля астмы относятся ингаляционные глюкокортикостероиды (ИГКС). Однако доказано, что некоторые фенотипы астмы наиболее чувствительны к антилейкотриеновым препаратам, применяемым в виде монотерапии или в составе комбинированного лечения с добавлением ИГКС. Монтелукаст – основной представитель данного класса препаратов. В статье проанализированы вопросы практического использования монтелукаста у больных астмой и/или аллергическим ринитом: когда польза от его назначения максимальна, как долго следует применять препарат.Рис. 1. Метаболизм арахидоновой кислоты
Рис. 2. Ступенчатая терапия бронхиальной астмы (проект федеральных клинических рекомендаций по диагностике и лечению бронхиальной астмы, 2017 г.)
Рис. 3. Эффективность монтелукаста в редуцировании вирус-индуцированного обострения у детей 2–5 лет с интермиттирующей БА (А – частота обострений, Б – количество курсов ГКС в год)
Рис. 4. Эффективность монтелукаста при аспириновой БА (А – ОФВ1, Б – утренняя ПСВ, В – дневные симптомы, Г – потребность в ингаляциях, Д – ночные симптомы)
Рис. 5. Сравнительная эффективность комбинации «монтелукаст + ИГКС» и двойной дозы ИГКС у пациентов с БА и АР
Рис. 6. Эффективность монтелукаста в контроле над симптомами сезонного АР через две недели терапии (А) и уменьшении числа эозинофилов периферической крови (Б) у детей и подростков
Рис. 7. Ступенчатая терапия аллергического ринита на основе контроля симптомов
Важными медиаторами, участвующими в патогенезе бронхиальной астмы (БА), являются цистеиниловые лейкотриены (цис-ЛТ) ЛТC4, ЛTD4, ЛTE4, обладающие выраженными провоспалительными и бронхоконстрикторными свойствами и образующиеся в результате обмена арахидоновой кислоты по 5-липоксигеназному (5-ЛО) пути из фосфолипидов клеточной мембраны под действием фосфолипазы А2 (рис. 1). Цис-ЛТ генерируются эозинофилами, базофилами, тучными клетками, макрофагами и миелоидными дендритными клетками. Ацетилсалициловая кислота (АЦСК) и нестероидные противовоспалительные препараты (НПВП) являются ингибиторами циклооксигеназы 1 – фермента, наряду с 5-ЛО участвующего в обмене арахидоновой кислоты и контролирующего образование простагландинов и тромбоксанов (рис. 1). Не случайно при аспириновой БА, сопровождающейся непереносимостью АЦСК и НПВП, особенно значим уровень цис-ЛТ. Цис-ЛТ активируют по крайней мере два типа рецепторов на гладкомышечных клетках, индуцируя их сокращение, и на эндотелиальных клетках, увеличивая проницаемость сосудов. При этом в отношении влияния на сосудистую проницаемость они в 100 раз эффективнее гистамина. Кроме того, указанные медиаторы усиливают приток эозинофилов и других воспалительных клеток, стимулируют пролиферацию и дифференцировку миофибробластов, способствуя тем самым развитию субэпителиального фиброза. Подавляющее большинство фармакологических эффектов цис-ЛТ, относящихся к патофизиологии БА и аллергического ринита (АР), осуществляются через активацию специфических цис-ЛТ1-рецепторов, расположенных на тучных клетках, моноцитах и макрофагах, эозинофилах, базофилах, нейтрофилах, Т- и В-лимфоцитах, гладкомышечных клетках, бронхиальных фибробластах и эндотелиальных клетках. Поэтому фармакологические препараты – антагонисты цис-ЛТ1-рецепторов (монтелукаст, зафирлукаст и пранлукаст), применение которых давно одобрено во многих странах мира, хорошо зарекомендовали себя в качестве фармакотерапии БА и АР у взрослых и детей.
Монтелукаст – наиболее часто применяемый в Европе и Северной Америке препарат из названной группы. Пранлукаст используется преимущественно в Японии и других странах Азии. Зафирлукаст – первый зарегистрированный в европейских странах, в том числе в России, препарат – антагонист цис-ЛТ. Двукратный прием (для сравнения: монтелукаст применяется один раз в день) и возможное взаимодействие с пищей и другими лекарственными препаратами делают зафирлукаст менее востребованным. Препарат зилеутон – ингибитор 5-ЛО в нашей стране не зарегистрирован.
Солидная доказательная база, основанная на результатах рандомизированных клинических исследований и исследований в реальной практике, свидетельствует об эффективности монтелукаста и других препаратов – антагонистов лейкотриеновых рецепторов в улучшении симптомов и легочной функции при БА, уменьшении частоты обострений и потребности в бета-2-агонистах короткого действия (КДБА), редукции эозинофилии крови и мокроты у взрослых и детей с БА различной степени тяжести. У пациентов с персистирующими симптомами БА, получающих только симптоматическую терапию КДБА, монтелукаст улучшает контроль БА. Результаты нашего исследования, проведенного несколько лет назад, убедительно показали клинико-функциональную эффективность монотерапии монтелукастом у взрослых пациентов с легкой персистирующей БА в отношении достижения контроля заболевания. После 12-недельной монотерапии монтелукастом отмечалась достоверная положительная динамика дневных симптомов БА, снижалась потребность в КДБА, улучшалась функция легких [1].
Каким пациентам с астмой целесообразно назначать монтелукаст
Монотерапия антагонистами лейкотриеновых рецепторов, в частности монтелукастом, может быть альтернативой ингаляционным глюкокортикостероидам (ИГКС) у пациентов с легкой персистирующей БА, не желающих или по каким-либо причинам не могущих принимать ИГКС. На это указано в федеральных и основных международных руководствах по БА (рис. 2) [2] и АР GINA и ARIA. Более того, у детей младшего возраста с непродолжительным стажем болезни и высоким уровнем ЛТЕ4 в моче монотерапия монтелукастом эффективнее, чем терапия флутиказона фуроатом [3].
Для многих пациентов с БА характерны вирус-индуцированные обострения или ухудшения заболевания, развивающиеся несмотря на базисную терапию ИГКС. Как показали результаты исследований, уровень цис-ЛТ повышается при вирус-индуцированном обострении БА. ГКС практически не влияют на их продукцию, что делает обоснованным назначение монтелукаста пациентам с частыми вирус-индуцированными обострениями или ухудшением течения БА. Убедительные доказательства эффективности монтелукаста в отношении вирус-индуцированных обострений БА у детей в возрасте от двух до пяти лет получены в исследовании H. Bisgaard и соавт. [4]. В 12-месячном двойном слепом плацебоконтролируемом исследовании на фоне терапии монтелукастом отмечалось значимое (на 31,9% по сравнению с плацебо) редуцирование числа обострений БА. Средняя частота обострений БА на одного пациента составила 1,60 эпизода в группе монтелукаста и 2,34 эпизода в группе плацебо. Терапия монтелукастом способствовала увеличению периода до первого обострения БА в среднем на два месяца (р = 0,024) и снижению потребности в ингаляционных и системных ГКС (р = 0,027) по сравнению с плацебо (рис. 3) [4]. Результаты этого исследования приобретают особую актуальность в сезон вирусных инфекций, поскольку 85% обострений БА у детей и 60% обострений БА у взрослых индуцированы респираторными вирусными инфекциями, вызванными преимущественно риновирусом. Как известно, из-за большого числа серологических вариантов вакцин против данного возбудителя не существует.
Метаанализ клинических исследований влияния монтелукаста на бронхообструктивный синдром, развивающийся в результате РС-вирусного бронхиолита у маленьких детей, показал, что препарат способен снижать частоту этого синдрома в отсутствие значимых побочных эффектов [5].
Распространенность курения среди лиц, страдающих БА, не отличается от распространенности курения в популяции в целом. Считается, что по крайней мере треть пациентов с БА курильщики. Курение отрицательно влияет на течение БА. В отличие от некурящих у курящих больных значительно чаще имеют место неконтролируемая БА, обострения, нарушение и потеря функции легких. Причем на течение БА влияет не только активное, но и пассивное курение. Курение родителей приводит к более частым обострениям БА у детей, потребности в неотложной помощи и интубации [6, 7].
Цис-ЛТ участвуют в формировании воспаления у курящих больных БА. В исследовании K. Kontogianni и соавт. [8] показано, что в идуцированной мокроте курильщиков, страдающих астмой, уровень цис-ЛТ значительно выше, чем у некурящих, и коррелирует с уровнем эозинофилов. У некурящих такой взаимосвязи не зафиксировано. По сравнению с некурящими у курящих больных БА повышенный уровень цис-ЛТ может быть следствием дополнительной активации 5-ЛО никотином, что косвенно подтверждают данные о повышенном уровне цис-ЛТ в моче у активных или пассивных курильщиков независимо от наличия БА [9]. Монтелукаст может быть вариантом лечения у курящих больных БА, особенно при сниженном ответе на ИГКС.
В восьминедельном двойном слепом исследовании с перекрестным дизайном (все участники получали оба вида терапии) [10] оценивали влияние низкой дозы ИГКС (160 мкг беклометазона дипропионата (БДП) дважды в день) или монтелукаста (10 мг однократно вечером) на клинико-функциональные параметры (объем форсированного выдоха за первую секунду (ОФВ1) и пиковая скорость выдоха (ПСВ)) и маркеры воспаления (бронхиальная гиперреактивность и эозинофилы индуцированной мокроты) у курящих и некурящих пациентов с легкой персистирующей БА. У курящих больных зафиксирован лучший функциональный ответ на терапию монтелукастом. Увеличение утренней ПСВ у них существенно превышало таковое в ответ на БДП. Прирост ОФВ1 был одинаков, хотя противовоспалительный эффект, оцениваемый по редукции эозинофилов и эозинофильного катионного протеина в мокроте, был сильнее выражен на фоне применения БДП как у некурящих, так и курящих пациентов. Тем не менее приоритетный функциональный ответ курящих пациентов на монтелукаст свидетельствует об участии цис-ЛТ в воспалении и последующих функциональных нарушениях при БА у этой категории пациентов.
В более обширном двойном слепом рандомизированном клиническом исследовании сравнивали эффективность монтелукаста (10 мг однократно вечером), флутиказона пропионата (ФП) 250 мкг в день и плацебо у курящих пациентов (18–55 лет) с персистирующей БА [11]. Первичным критерием эффективности служил процент дней контролируемой БА на протяжении шестимесячного исследования. 347, 336 и 336 курящих пациентов с БА получали монтелукаст, ФП и плацебо соответственно. Разница в проценте дней контролируемой БА при использовании монтелукаста или ФП оказалась незначимой (р = 5,14). Это говорит об отсутствии существенной разницы в отношении контроля БА на фоне терапии монтелукастом и ФП у курящих больных БА. В ходе исследования отмечалась важная тенденция: больные с индексом курения ≤ 11 пачко-лет демонстрировали лучший ответ на ФП, пациенты с индексом курения > 11 пачко-лет – на монтелукаст. Сказанное позволяет предположить, что более длительное и интенсивное курение приводит к преимущественно нейтрофильному воспалению в слизистой оболочке бронхов и снижению ответа на ИГКС. В связи с этим терапия антагонистами лейкотриеновых рецепторов может иметь определенные преимущества у данной группы больных.
Таким образом, в отношении улучшения функции легких и достижения контроля терапия монтелукастом приоритетна у курящих больных астмой. Препарат может применяться в качестве монотерапии при легкой персистирующей БА у курящих подростков, отличающихся особенно низкой приверженностью ИГКС, и дополнительной терапии, усиливающей влияние ИГКС у курящих пациентов со среднетяжелой персистирующей бронхиальной астмой.
Аспириновая БА относится к группе респираторных заболеваний, обостряющихся после приема аспирина и других НПВП. Этот фенотип астмы встречается у взрослых, чаще у женщин, и связан с хроническим гиперпластическим риносинуситом, назальными полипами и приступами БА после приема аспирина и других неселективных ингибиторов циклооксигеназы, блокирующих циклооксигеназу 1. Распространенность данного фенотипа среди взрослых пациентов с БА около 10–25% [12]. В большинстве случаев данный фенотип характеризуется тяжелым течением. Респираторное заболевание (Aspirin Еxacerbated Respiratory Disease, AERD), вызванное аспирином, частично объясняется повышенной экспрессией 5-ЛО и ЛТC4-синтазы, что приводит к конститутивному гиперсинтезу цис-ЛТ, особенно усиливающемуся после приема аспирина и НПВП. Кроме того, AERD характеризуются избыточной экспрессией рецепторов цис-ЛT. У пациентов с аспириновой БА более высокий базовый уровень цис-ЛТ в слюне, мокроте, крови и моче, чем у пациентов с обычной неаспириновой БА [13]. Это подтверждает роль цис-ЛТ в патогенезе аспириновой БА. Больные с указанным фенотипом БА, как правило, недостаточно эффективно реагируют на ИГКС и имеют ощутимую пользу от дополнительного назначения антилейкотриеновых препаратов.
В плацебоконтролируемом исследовании у 80 взрослых пациентов с аспириновой БА изучали эффективность монтелукаста, добавленного к ИГКС (средние и высокие дозы), которые назначались ранее [14]. В группе монтелукаста наблюдалось значительное улучшение симптомов БА, тогда как в группе плацебо изменения отсутствовали (рис. 4) [14]. Улучшенная легочная функция на фоне применения монтелукаста была связана с меньшим количеством симптомов и обострений БА.
L. Mastalerz и соавт. [15] сравнили клинический ответ на монтелукаст у больных с аспириновой БА и аспирин-толерантных пациентов с БА. После трехнедельного приема монтелукаста 10 мг в день обе группы пациентов продемонстрировали аналогичное значительное улучшение контроля БА, утренней и вечерней ПСВ и качества жизни по сравнению с принимавшими плацебо.
Недавно были проанализированы восприятие и качество жизни пациентов с AERD, а также их оценка эффективности лечения [16]. Результаты показали неудовлетворенность пациентов текущими вариантами лечения, о чем свидетельствовали стойкие симптомы, неблагоприятное воздействие на качество жизни и стремление к различным альтернативным способам терапии. Из всех методов лечения наиболее эффективна десенситизация аспирином, за ней следует терапия антилейкотриеновыми препаратами и комбинация разных лекарств. Половина респондентов отметила эффективность антилейкотриеновых препаратов.
Таким образом, избыточное образование и патогенетическая роль цис-ЛТ при аспириновой БА, а также результаты клинических исследований свидетельствуют, что лечение монтелукастом, как правило в качестве дополнительной терапии к ИГКС, может улучшить контроль БА и назальные симптомы у пациентов с AERD.
Избыточный вес и ожирение, имеющие те же тенденции эпидемического распространения, что и БА, нередко у одного и того же пациента, в основном женского пола, формируют особый фенотип БА, характеризующийся поздним дебютом, среднетяжелым или тяжелым течением БА, умеренным снижением функции легких с некоторой обратимостью, зачастую неэозинофильным воспалением слизистой оболочки бронхов и менее частой атопией. Уровень цис-ЛТЕ4 в моче положительно коррелирует с индексом массы тела (ИМТ) пациентов с БА, что, вероятно, является результатом действия лептина. Как показали результаты исследования M. Peters-Golden и соавт. [17], фенотипу «БА у больных с ожирением» присуща неоднозначность ответа на контролирующую фармакотерапию. Ученые провели ретроспективный анализ четырех двойных слепых плацебоконтролируемых рандомизированных исследований с участием 3073 взрослых пациентов с персистирующей среднетяжелой БА, получавших монтелукаст (n = 1439), БДП (n = 894) и плацебо (n = 740). Первичной оценкой эффективности служил процент дней контролируемой БА. 52% больных, включенных в анализ, имели нормальный вес, 32% – повышенный ИМТ и 16% – ожирение. Согласно полученным результатам, повышенный ИМТ и ожирение влияют на возможность достижения контроля БА, приводя к снижению процента дней контролируемой БА. Ответ на ИГКС (БДП) также снижался с увеличением ИМТ, но не на монтелукаст. Различий в проценте дней контролируемой БА в ответ на терапию монтелукастом между пациентами с нормальным, повышенным ИМТ или пациентов с ожирением не установлено.
В двух других ретроспективных анализах сравнивали ИГКС или ИГКС/ДДБА (бета-2-агонисты длительного действия) с монтелукастом у пациентов с БА и избыточным весом и ожирением. ИГКС и ИГКС/ДДБА оказались последовательно более эффективны, чем монтелукаст, у больных всех категорий ИМТ [18]. Тем не менее, учитывая особенности фенотипа «БА у больных с ожирением», связанные с высокой коморбидностью (гипертензия, снижение толерантности к глюкозе, сердечно-сосудистые заболевания) и зачастую препятствующие назначению высоких доз ИГКС или комбинации ИГКС/ДДБА, а также нейтрофильный или смешанный профиль воспаления и вовлечение цис-ЛТ в его формирование, целесообразно рассматривать вопрос о назначении монтелукаста пациентам, не достигающим контроля на терапии ИГКС или ИГКС/ДДБА.
Еще одно важное свойство этой группы препаратов – выраженный бронхопротективный эффект в отношении бронхоспазма, вызванного физической нагрузкой (БВФН) у больных БА. БВФН отмечается у 70–80% больных с неконтролируемой астмой и персистирующими симптомами. Особенно БВФН характерен для детей и подростков, у которых он может быть единственным проявлением БА. Первые доказательства эффективности монтелукаста при БВФН появились еще в середине 1990-х гг., когда были опубликованы результаты исследований защитного действия препарата в отношении бронхоконстрикции, вызванной физической нагрузкой. В отличие от бета-2-агонистов эффективность монтелукаста при продолжительном лечении не уменьшается. Бронхопротективный эффект монтелукаста в отношении снижения ОФВ1 после физической нагрузки значительно превышает таковой плацебо. Кроме того, на фоне применения препарата не развивается тахифилаксия. Защитный эффект проявляется быстро – после приема первой дозы. Следовательно, у детей и подростков, страдающих БА с доминированием БВФН, а также у взрослых монтелукаст в качестве монотерапии при легкой БА или в комбинации с ИГКС при среднетяжелой БА может быть оптимальным выбором в целях достижения контроля и профилактики БВФН.
Как известно, для любой БА характерно поражение не только крупных и средних, но также мелких, дистальных бронхов. Постоянное неконтролируемое воспаление в периферических дыхательных путях может препятствовать достижению контроля и, напротив, способствовать увеличению бронхиальной гиперреактивности и числа обострений. Дистальные дыхательные пути служат важной мишенью при любой терапевтической стратегии БА. Монтелукаст назначают перорально. Препарат обладает системным эффектом, а значит, способен достигать как крупных, так и мелких бронхов. Лейкотриеновые рецепторы по-разному экспрессируются в фибробластах периферических дыхательных путей по сравнению с центральными [19], что может объяснить ремоделирование, вызванное цис-ЛТ, главным образом в периферических дыхательных путях, и, возможно, преобладающий эффект монтелукаста в дистальных отделах бронхов.
H. Nakaji и соавт. показали, что цис-ЛТ в мелких бронхах в 30 раз мощнее, чем в крупных бронхах. Кроме того, монтелукаст проявляет сильную антагонистическую активность против бронхоконстрикторного действия цис-ЛТ в изолированных мелких бронхиолах человека [20].
В нескольких исследованиях терапия монтелукастом способствовала небольшому, но значимому повышению плотности легочной ткани (уменьшение выраженности воздушных ловушек) по сравнению с плацебо и увеличению ряда функциональных показателей, в частности остаточного объема легких. Это косвенно подтверждает потенциальное влияние монтелукаста на воспаление в мелких бронхах у больных БА [21–23].
Таким образом, пациенты с неконтролируемой БА и признаками нарушения функции мелких бронхов (снижение форсированной жизненной емкости легких (ФЖЕЛ), уменьшение среднего экспираторного потока на уровне 25–75% ФЖЕЛ (МОС25–75), увеличение общей емкости легких и остаточного объема легких, увеличение сопротивления дыхательных путей) могут получить дополнительную пользу от приема монтелукаста в отношении функции легких и контроля заболевания.
Пероральные антагонисты ЛТ-рецепторов, обладающие системным эффектом на аллергическое воспаление, целесообразно назначать при сочетании БА и АР. Результаты множества исследований подтверждают эффективность этой терапии у больных изолированным АР и АР с сопутствующей БА, у которых эффективность антилейкотриеновых препаратов даже выше, чем у пациентов с изолированной БА.
В систематическом обзоре исследований эффективности монтелукаста при сезонном и круглогодичном АР с сопутствующей БА и в отсутствие таковой показано, что у пациентов с АР и БА на фоне приема монтелукаста по сравнению с плацебо значительно уменьшаются симптомы обоих заболеваний и снижается потребность в противоастматических лекарственных препаратах [24].
В клиническом исследовании монтелукаста в качестве дополнительной терапии к ИГКС больные БА с сопутствующим АР в отличие от пациентов без сопутствующего АР по-разному реагировали на комбинацию будесонида и монтелукаста с точки зрения контроля астмы (функция легких). В подгруппе пациентов с БА и АР комбинированный подход обеспечивал более высокую эффективность в улучшении функции легких по сравнению с удвоенной дозой будесонида (рис. 5) [25].
В ряде обсервационных исследований оценивали эффективность и безопасность монтелукаста у пациентов с БА и АР в реальной клинической практике. В 12-месячном исследовании участвовал 1681 пациент с легкой и среднетяжелой БА, недостаточно контролируемой ИГКС или ИГКС + ДДБА [26]. Пациентам назначали монтелукаст 10 мг/сут в качестве дополнительной терапии. Оценка контроля выполнялась через 3, 6, 9 и 12 месяцев. Показатель ACT (Asthma Control Test – тест по контролю над астмой) в общей популяции был основной конечной точкой исследования. Дополнительная терапия монтелукастом продемонстрировала значительное улучшение симптомов БА в течение 12 месяцев у всех пациентов. Однако у пациентов с АР уровень контроля по АСТ превышал таковой у пациентов без АР. Авторы пришли к выводу, что сопутствующий АР – значимый предиктор лучшего контроля БА в результате дополнительной терапии монтелукастом [26].
Монтелукаст эффективен и в терапии изолированного АР: на фоне его применения отмечается редукция всех симптомов заболевания, включая заложенность носа (рис. 6) [27]. Важный момент: препарат влияет на эозинофильное воспаление, что проявляется уменьшением эозинофилии крови и слизистой оболочки дыхательных путей (рис. 6) [27].
В ряде исследований монтелукаст продемонстрировал особенно высокую эффективность в комбинации с антигистаминными препаратами (АГП) второго поколения [28–30].
Назначение монтелукаста пациентам с астмой и/или аллергическим ринитом
Антагонисты лейкотриеновых рецепторов относятся к группе базисных противовоспалительных препаратов и применяются для достижения и поддержания контроля БА и АР. При легких симптомах сезонного и круглогодичного АР монтелукаст может служить альтернативой АГП второго поколения. При среднетяжелом/тяжелом АР монтелукаст может применяться в комбинации с АГП второго поколения или ИГКС (рис. 7) [31]. Безусловный приоритет в назначении монтелукаста имеют пациенты с АР и сопутствующей БА.
При БА монтелукаст можно использовать в монотерапии или комбинированной терапии у пациентов с неконтролируемыми симптомами. Результаты исследований, проведенных в реальной клинической практике, показали практически одинаковую эффективность монтелукаста и низких доз ИГКС у больных легкой персистирующей БА, монтелукаста и ДДБА в качестве дополнительной терапии к ИГКС у больных среднетяжелой неконтролируемой БА.
D. Price и соавт. [32] провели два двухлетних исследования в условиях реальной клинической практики. В первом сравнили эффективность антагонистов ЛТ-рецепторов (монтелукаст, зафирлукаст) и ИГКС в качестве начальной терапии БА у 326 пациентов, ранее не получавших лечения для контроля симптомов. Во втором сравнили антагонисты ЛТ-рецепторов (монтелукаст, зафирлукаст) и ДДБА в качестве дополнительной терапии у 361 пациента с БА, не контролируемой на монотерапии ИГКС. Основным критерием оценки служил мини-вопросник по качеству жизни с БА (Mini AQLQ), дополнительным – вопросник по контролю БА ACQ. Кроме того, оценивали частоту обострений БА (назначение пероральных ГКС или госпитализация). Использовали также мини-вопросник по качеству жизни с риноконъюнктивитом (Mini RQLQ). Эффективность антагонистов ЛТ-рецепторов оказалась эквивалентной эффективности ИГКС в качестве базисной терапии первой линии БА и ДДБА в качестве дополнительной терапии у пациентов, уже получавших ИГКС.
По крайней мере подобная эквивалентность была достоверно показана через два месяца терапии. Эквивалентность, оцененная через два года терапии, была недостоверной по главному критерию Mini AQLQ, но динамика второстепенных критериев (ACQ и ПСВ) была сопоставимой в группах сравнения. Поскольку исследования продолжались два года, их результаты отражают реальную клиническую практику со всеми ее преимуществами (разнообразие пациентов) и недостатками (отсутствие объективного плацебо-контроля). В исследованиях зафиксирована высокая приверженность больных лечению антилейкотриеновыми препаратами: в первом исследовании – 65%, по сравнению с ИГКС – 41%, во втором в качестве дополнительной терапии к ИГКС – 74%, к ДДБА – 46%.
Таким образом, неконтролируемые симптомы служат показанием для назначения монтелукаста в виде моно- или комбинированной терапии больным бронхиальной астмой и/или аллергическим ринитом.
Как долго пациенты с астмой и/или аллергическим ринитом могут применять монтелукаст
Монтелукаст считается безопасным лекарственным препаратом. Как правило, возникающие на фоне его применения незначительные побочные реакции по виду и частоте не отличаются от реакций, развивающихся при использовании плацебо. Общая распространенность нежелательных побочных реакций при использовании монтелукаста, согласно результатам клинических исследований, сопоставима с таковой на фоне приема плацебо. Монтелукаст в качестве дополнительной терапии не увеличивает частоту этих реакций по сравнению с терапией ИГКС и ДДБА.
В систематическом обзоре и метаанализе сравнивали эффективность и безопасность антагонистов лейкотриеновых рецепторов и плацебо у взрослых и подростков [33]. Пропорция пациентов с неблагоприятными событиями была одинакова среди больных, получавших монтелукаст и плацебо. Во всех клинических исследованиях, включенных в метаанализ, серьезных побочных эффектов при использовании монтелукаста не зарегистрировано. Авторы пришли к выводу, что частота нежелательных явлений, прекращения терапии из-за нежелательных явлений и ухудшений астмы схожи для антилейкотриеновых препаратов и плацебо, что отражает благоприятный профиль безопасности и переносимости антагонистов лейкотриеновых рецепторов.
Другой обзор клинических исследований обобщил информацию о безопасности и переносимости монтелукаста у детей и подростков – дошкольников и школьников (2751 пациент). Лечение монтелукастом в целом хорошо переносится. Наиболее частые нежелательные побочные реакции, отмеченные во всех клинических исследованиях, были связаны с инфекцией верхних дыхательных путей, ухудшением течения астмы, фарингитом и лихорадкой [34]. Исходя из результатов постмаркетинговых наблюдений было высказано предположение о возможном изменении поведения у лиц, принимающих монтелукаст. Речь, в частности, идет об увеличении беспокойства и агрессии, появлении бессонницы и суицидальных мыслей. Однако пересмотр и анализ 116 клинических исследований показал, что частота побочных эффектов, связанных с поведением, у пациентов, получающих монтелукаст, ничем не отличается от аналогичного показателя у пациентов контрольных групп [35, 36]. Важно, что хорошая переносимость и безопасный профиль монтелукаста сохраняются на протяжении его длительного (свыше 12 месяцев) применения [37]. В реальной клинической практике пациенты с БА принимают монтелукаст на протяжении многих лет с неизменным клиническим эффектом, хорошей переносимостью и безопасностью. Помимо этого монтелукаст является препаратом, на фоне применения которого при достижении и поддержании стойкого контроля БА можно снизить поддерживающую дозу ИГКС (step-down) [38].
Длительность применения монтелукаста при АР определяется продолжительностью симптомов: при сезонном АР препарат применяют в течение всего периода пыления и отменяют через две – четыре недели после его окончания. При круглогодичном АР препарат используют постоянно в течение всего года, длительность лечения зависит от эффективности элиминационных мероприятий или аллергенспецифической иммунотерапии.
Таким образом, у больных астмой и/или аллергическим ринитом монтелукаст, характеризующийся хорошей переносимостью и безопасностью и не вызывающий развития тахифилаксии, можно применять длительно, на протяжении месяцев и лет.
Известно множество дженерических форм монтелукаста. Монтелукаст компании «Сандоз» под торговым наименованием Монтелар® полностью соответствует требованиям, предъявляемым к качественным дженерикам. При более доступной цене препарат имеет высокий профиль эффективности и безопасности и обладает доказанной биологической и терапевтической эквивалентностью оригинальному препарату.
Заключение
Антагонисты лейкотриеновых рецепторов, в частности монтелукаст, имеют доказанную эффективность в отношении клинических и функциональных проявлений БА и АР и достижения контроля заболеваний.
Монтелукаст в качестве монотерапии может быть альтернативой низким дозам ИГКС, особенно у детей и подростков с легкой БА и АР, вирус-индуцированными обострениями БА, астмой, сопровождающейся сниженной толерантностью к физической нагрузке, а также в качестве step-down-терапии.
В качестве дополнительной терапии к ИГКС монтелукаст является альтернативой ДДБА. Этот вариант комбинированной терапии эффективен при аспириновой БА, БА с сопутствующим АР, БА у пациентов с ожирением, курящих больных БА, а также у больных астмой, имеющих противопоказания к назначению ДДБА.
Монтелукаст имеет хороший профиль безопасности. Частота побочных эффектов при его применении не отличается от таковой при использовании плацебо.
umedp.ru