Коронавирус повреждает реснитчатые клетки дыхательных путей
Исследователи из Института Пастера в Париже проверили, как влияет коронавирусная инфекция на структуру и функцию бронхиального эпителия человека. Эпителий, выстилающий дыхательные пути, играет ключевую роль в защите от инфекций. Его бокаловидные клетки выделяют защитную слизь, которая улавливает вдыхаемые частицы, в том числе патогены. Ресничные клетки, составляющие более половины всех эпителиальных клеток, несут примерно по 200 ресничек, которые ритмично бьются, перемещая слой слизи в направлении гортани, где она в итоге проглатывается. Базальные клетки дыхательных путей при повреждениях пролиферируют и дифференцируются в другие типы клеток.
Исследования образцов аутопсии от пациентов с COVID-19 и экспериментальное инфицирование тканевых эксплантатов подтвердили репликацию SARS-CoV-2 преимущественно в эпителии верхних и нижних дыхательных путей и в альвеолах легких. В предыдущих опытах по инфицированию моделей эпителия дыхательных путей было показано, что вирус преимущественно воздействует на реснитчатые клетки, а в некоторых работах — также на бокаловидные клетки.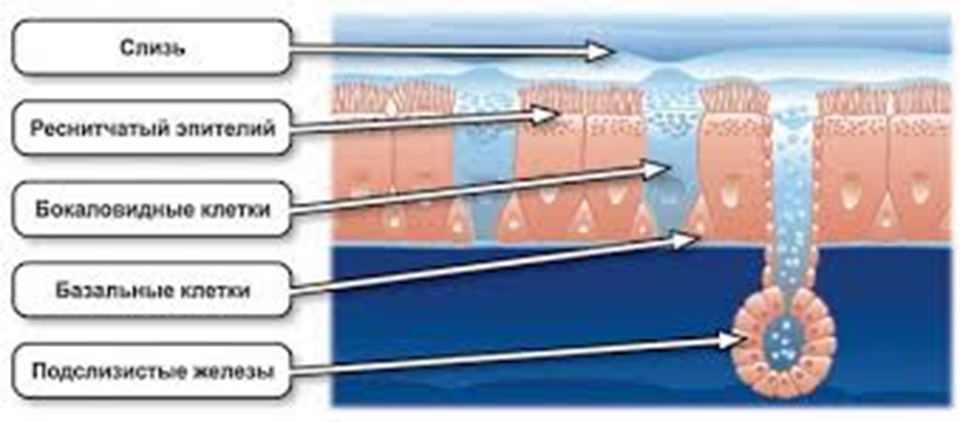
Модель эпителия дыхательных путей представляла собой первичные эпителиальные клеток бронхов человека, выращенные на пористой мембране и дифференцированные на границе раздела «воздух/жидкость» на протяжении 4 недель. С помощью сканирующей электронной микроскопии подтвердили, что клетки дифференцировались в три основных типа клеток бронхиального эпителия: реснитчатые, бокаловидные и базальные. Модельный эпителий инфицировали суспензией вируса.
Репликация SARS-CoV-2 в клетках вызвала временное снижение барьерной функции эпителия и нарушение плотных контактов, хотя пересечение эпителия вирусными частицами оставалось ограниченным. В то же время репликация вируса приводит к быстрой потере ресничного слоя. Функция ресничек была нарушена, что проявилось в нарушении транспорта слизи.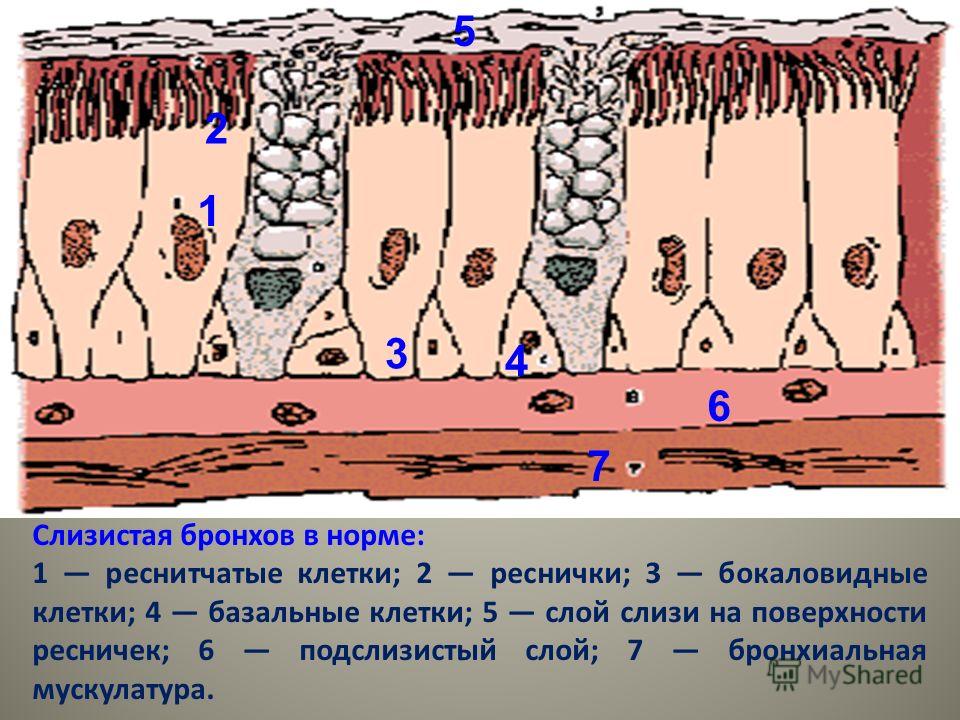 Эпителиальные защитные механизмы, такие как мобилизация базальных клеток и индукция интерферона-лямбда, активизировались только после повреждения ресничек (на 7-й день), при этом начиналась регенерация эпителия, компенсирующая функциональные нарушения. Потеря подвижных ресничек также наблюдалась в дыхательных путях хомячков, зараженных SARS-CoV-2.
Эпителиальные защитные механизмы, такие как мобилизация базальных клеток и индукция интерферона-лямбда, активизировались только после повреждения ресничек (на 7-й день), при этом начиналась регенерация эпителия, компенсирующая функциональные нарушения. Потеря подвижных ресничек также наблюдалась в дыхательных путях хомячков, зараженных SARS-CoV-2.
Авторы отмечают, что вирус гриппа А гораздо сильнее нарушает целостность эпителиального барьера. Это говорит о том, что различные вирусы респираторных заболеваний используют разные стратегии.
Таким образом, повреждение ресничек — важный механизм, который может способствовать распространению SARS-CoV-2 по дыхательным путям, в их более глубокие участки, пока вирус не достигнет альвеол легких. Кроме того, нарушение функции ресничек повышает вероятность вторичных инфекций. Процент пациентов с COVID-19 с сопутствующей бактериальной или грибковой респираторной инфекцией при поступлении в больницу остается невысоким, однако среди пациентов с тяжелыми формами болезни от четверти до трети имеют бактериальные или грибковые суперинфекции, что ассоциировано с худшими исходами.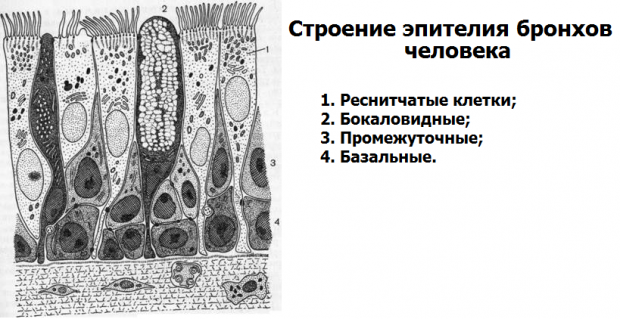
Бокаловидная клетка | АЙК Обнинск
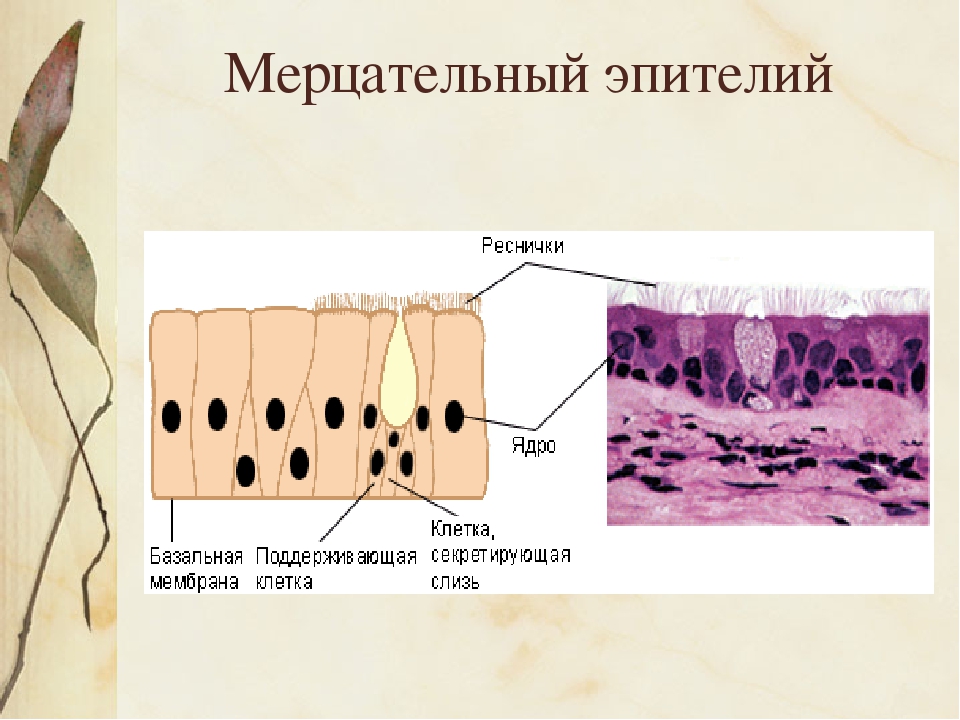
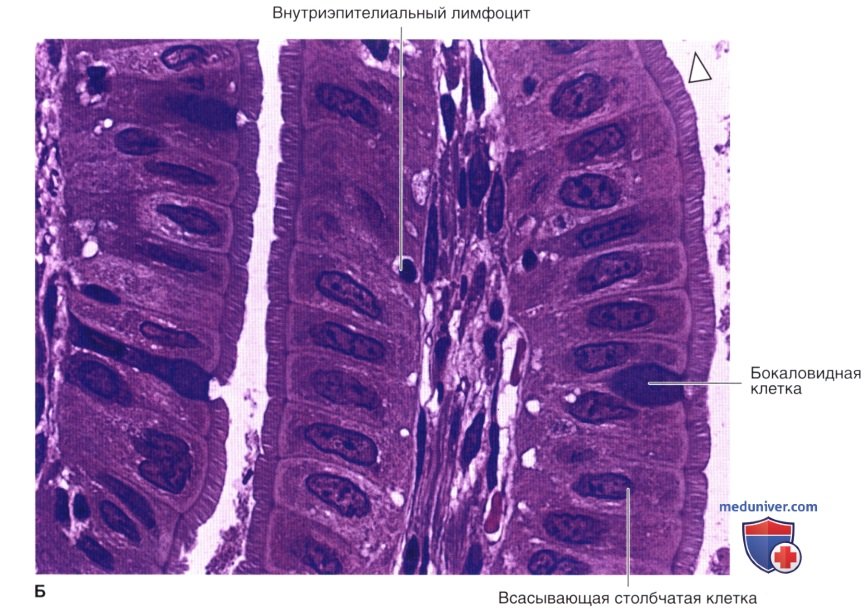
Бокаловидная клетка (синонимы: энтероциты бокаловидные, бокаловидные экзокриноциты; лат. enterocytus caliciformis) — продуцирующие слизь клетки эпителия слизистой оболочки кишечника и других органов позвоночных животных и человека. Бокаловидные клетки часто называют одноклеточными железами.
Локализация:
Бокаловидные клетки — один из энтероцитов эпителия кишечника. Располагаются на кишечных ворсинках поодиночке среди каёмчатых энтероцитов. Обычно отсутствуют на самой вершине ворсинки, а также на дне крипты. В тонкой кишке человека составляют 9.5% от всех клеток эпителиального пласта. Число бокаловидных клеток увеличивается в дистальном направлении кишки.
Кроме кишечника, бокаловидные клетки имеются в слизистой оболочке дыхательных путей, в конъюнктиве глаз, протоках поджелудочной и околоушных слюнных желёз. В дыхательных путях больше всего бокаловидных клеток находится в экстраторакальной части трахеи, с уменьшением диаметра бронхов их количество существенно сокращается, а в бронхиолах менее 1 мм их нет совсем.
Структура и функции:
Бокаловидные клетки накапливают гранулы муциногена, которые, абсорбируя воду, набухают и превращаются в муцин (основной компонент слизи). При этом клетки обретают форму бокала, суженного у основания (где находится ядро) и округлой широкой в апикальной, верхней части. Затем набухшая верхняя часть бокаловидной клетки разрушается, слизь переходит в просвет органа, клетка приобретает призматическую форму и снова начинает накапливать муциноген. Слизь, выделяемая бокаловидными клетками, служит для увлажнения поверхности слизистой оболочки кишечника и этим способствует продвижению химуса, а также участвует в процессах пристеночного пищеварения.
Апикальная часть бокаловидных клеток имеет исчерченную каёмку, подобно каёмчатым энтероцитам. Однако, в отличие от каёмчатых энтероцитов, микроворсинки каёмки у бокаловидных клеток расположены реже и неодинаковы по высоте.
Метаплазия бокаловидных клеток:
При некоторых патологиях бокаловидные клетки могут встречаться в тканях и органах, в которых в норме они или отсутствуют, или присутствуют в значительно меньшем количестве. Часто такая метаплазия является предраковым состоянием. Так, при пищеводе Барретта, осложнении гастроэзофагеальной рефлюксной болезни, рассматриваемом как предраковое состояние пищевода, бокаловидные клетки обнаруживаются в пищеводе.
Часто такая метаплазия является предраковым состоянием. Так, при пищеводе Барретта, осложнении гастроэзофагеальной рефлюксной болезни, рассматриваемом как предраковое состояние пищевода, бокаловидные клетки обнаруживаются в пищеводе.
Наличие бокаловидных клеток в слизистой оболочке желудка считается важнейшим диагностическим признаком кишечной метаплазии (состояние предрака желудка).
Гиперплазия бокаловидных клеток дыхательных путей с переходом в метаплазию и дисплазию или без является патологическим состоянием — предшественником рака лёгких.
Анатомия лёгких, строение, функции на ONKO.LV
Лёгкие – это мягкий, губчатый, конусообразный парный орган. Лёгкие обеспечивают дыхание — обмен углекислого газа и кислорода. Так как лёгкие являются внутренней средой организма, которая постоянно соприкасается с внешней средой, они имеют хорошо приспособленное и специализированное строение не только для газообмена, но и для защиты – в дыхательных путях задерживаются и выводятся наружу различные вдыхаемые инфекционные возбудители, пыль и дым.
Чтобы облегчить движения лёгких, их окружает плевра – оболочка, которая состоит из двух листков – висцеральной и париетальной плевры.
Париетальная плевра присоединяется к стенке грудной клетки. Висцеральная плевра присоединяется к наружней поверхности каждого лёгкого. Между двумя плевральными листками образуется небольшое пространство, которое называется плевральной полостью. В плевральной полости находится небольшое количество водянистой жидкости, которая называется плевральной жидкостью. Она предотвращает трение и держит вместе плевральные поверхности во время вдоха и выдоха.
В плевральной полости находится небольшое количество водянистой жидкости, которая называется плевральной жидкостью. Она предотвращает трение и держит вместе плевральные поверхности во время вдоха и выдоха.
Строение клеток глубоких дыхательных путей достаточно специализировано и хорошо приспособлено для дыхания. Все дыхательные пути выстланы эпителием, который является специально приспособленными клетками, чтобы выполнять много важных функций:
- защитную;
- секрецию слизи;
- выведение раздражающих веществ;
- начало иммунных реакций.
Вид эпителия отличается в разных частях дыхательных путей. Большую часть слизистой дыхательных путей образует реснитчатый эпителий. Эти клетки – расположены вертикально в один слой с ресничками, направленными в сторону дыхательных путей. Реснички всегда движутся в направлении наружу. Слизистую более мелких дыхательных путей образует эпителий без ресничек.
В эпителии дыхательных путей находятся железы – бокаловидные клетки. Это специализированные клетки, которые производят и выделяют слизь. Слизь, продуцируемая этими клетками необходима, чтобы увлажнять поверхность эпителия и механически защищать слизистую.
Это специализированные клетки, которые производят и выделяют слизь. Слизь, продуцируемая этими клетками необходима, чтобы увлажнять поверхность эпителия и механически защищать слизистую.
Слизь является липкой, поэтому к ней прилипают вдыхаемые микроскопические инородные тела, и потом они выводятся наружу при помощи реснитчатого эпителия.
Кашель как междисциплинарная проблема в практике врача первичного звена. XII Национальный конгресс терапевтов. Сателлитный симпозиум компании «Санофи»
Кашель – защитный рефлекс, направленный на удаление чужеродных веществ и патологического секрета из дыхательных путей. Кашель может быть проявлением различных заболеваний, поэтому его лечение представляет междисциплинарную проблему современной медицины. Российские специалисты – пульмонологи, оториноларингологи, терапевты в рамках XII Национального конгресса терапевтов обсудили методы лечения и диагностики кашля, проанализировали распространенные причины его возникновения и алгоритм лечения. По мнению экспертов, одним из эффективных методов лечения кашля является применение муколитических препаратов, в частности амброксола (Лазолван). Амброксол оказывает секретолитическое и мукокинетическое действие, восстанавливает мукоцилиарный клиренс. Важной составляющей в терапии кашля признано восстановление носового дыхания и дренажа соустий пазух с использованием современных деконгестантов (назальный спрей Лазолван Рино).
Российские специалисты – пульмонологи, оториноларингологи, терапевты в рамках XII Национального конгресса терапевтов обсудили методы лечения и диагностики кашля, проанализировали распространенные причины его возникновения и алгоритм лечения. По мнению экспертов, одним из эффективных методов лечения кашля является применение муколитических препаратов, в частности амброксола (Лазолван). Амброксол оказывает секретолитическое и мукокинетическое действие, восстанавливает мукоцилиарный клиренс. Важной составляющей в терапии кашля признано восстановление носового дыхания и дренажа соустий пазух с использованием современных деконгестантов (назальный спрей Лазолван Рино).
Профессор, д.м.н. А.И. Синопальников
Профессор, д.м.н. А.Ю. Овчинников
Профессор, д.м.н. А.А. Зайцев
Взгляд пульмонолога
Cимпозиум открыл д. м.н., профессор, заведующий кафедрой пульмонологии Российской медицинской академии непрерывного профессионального образования Александр Игоревич СИНОПАЛЬНИКОВ. Он рассмотрел кашель не только как распространенный симптом заболеваний респираторного тракта, но и как физиологический феномен, направленный на самоочищение или поддержание постоянства внутренней среды дыхательной системы.
м.н., профессор, заведующий кафедрой пульмонологии Российской медицинской академии непрерывного профессионального образования Александр Игоревич СИНОПАЛЬНИКОВ. Он рассмотрел кашель не только как распространенный симптом заболеваний респираторного тракта, но и как физиологический феномен, направленный на самоочищение или поддержание постоянства внутренней среды дыхательной системы.
Мукоцилиарный клиренс считается основным неспецифическим механизмом защиты и очищения дыхательных путей, базирующимся на двух составляющих – реснитчатом аппарате слизистой оболочки и секреторной системе дыхательных путей. Барьером на пути проникновения патогенных веществ в организм служит слизистая оболочка дыхательных путей – многорядный эпителий бронхов, представленный реснитчатыми эпителиоцитами, между которыми расположены секретообразующие бокаловидные клетки. Кроме того, к секреторному аппарату бронхов относят серозные железы, расположенные в подслизистой оболочке. При нормальной реологии бронхиальной слизи реснитчатый эпителий обеспечивает мукоцилиарный клиренс – удаление избытка слизи, инородных частиц и микробных агентов. На страже постоянства внутренней среды дыхательных путей помимо клеток реснитчатого эпителия стоят базальные, бокаловидные и слизистые серозные клетки. Продукт деятельности бронхиальных желез и бокаловидных клеток бронхиальный секрет, или слизь, представляет собой инертную гомогенную массу. В равной степени в ней присутствуют элементы тканевого транссудата и секрет слизистых клеток. Результатом продукции слизистых клеток являются муцины. Избыточное образование кислых муцинов (сиаломуцин, сульфомуцин) закономерно усугубляет текучие реологические свойства бронхиального секрета. В случае образования нейтральных муцинов, или фукомуцинов, секрет становится более подвижным и легко экспекторируется мокротой.
На страже постоянства внутренней среды дыхательных путей помимо клеток реснитчатого эпителия стоят базальные, бокаловидные и слизистые серозные клетки. Продукт деятельности бронхиальных желез и бокаловидных клеток бронхиальный секрет, или слизь, представляет собой инертную гомогенную массу. В равной степени в ней присутствуют элементы тканевого транссудата и секрет слизистых клеток. Результатом продукции слизистых клеток являются муцины. Избыточное образование кислых муцинов (сиаломуцин, сульфомуцин) закономерно усугубляет текучие реологические свойства бронхиального секрета. В случае образования нейтральных муцинов, или фукомуцинов, секрет становится более подвижным и легко экспекторируется мокротой.
Бронхиальный секрет представлен двумя слоями – плотным (гель) и жидким (золь). Поверхностный слой в виде геля достаточно вязок. На нем происходит адгезия всех инородных частиц, попадающих с воздухом в просвет дыхательных путей. Нижний слой – золь более водянистый, с высоким содержанием нейтральных, но не кислых муцинов.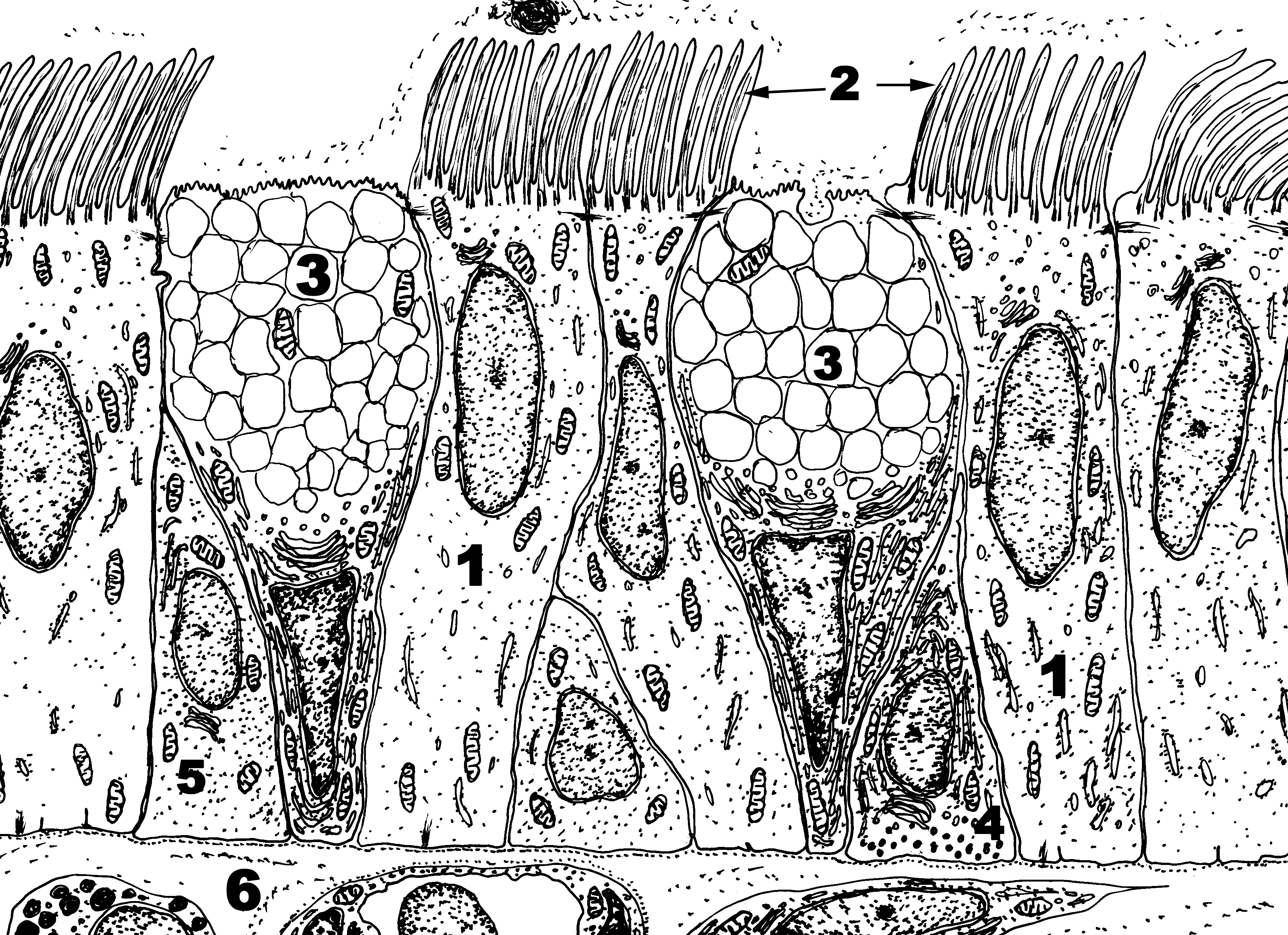 Именно в этом слое осуществляют колебательные движения реснички мерцательного эпителия. Как только слой геля загустевает или истончается, реснички начинают испытывать затруднения при совершении колебательных движений и отхождение мокроты нарушается. Таким образом, один из механизмов медикаментозного воздействия на кашель и экспекторацию сопровождающей его мокроты, очевидно, связан с увеличением слоя золя и частоты биения ресничек мерцательного эпителия1.
Именно в этом слое осуществляют колебательные движения реснички мерцательного эпителия. Как только слой геля загустевает или истончается, реснички начинают испытывать затруднения при совершении колебательных движений и отхождение мокроты нарушается. Таким образом, один из механизмов медикаментозного воздействия на кашель и экспекторацию сопровождающей его мокроты, очевидно, связан с увеличением слоя золя и частоты биения ресничек мерцательного эпителия1.
Секрет, производимый бокаловидными клетками и бронхиальными железами, не является нейтральной субстанцией. В нем содержится большое количество активных веществ, включая гликопротеины, лизоцимы, иммуноглобулины и другие неспецифические гуморальные факторы противоинфекционной защиты, что в совокупности определяет эффективное противодействие дыхательных путей бактериальной или вирусной агрессии.
Подавлению мукоцилиарного клиренса способствуют токсины микроорганизмов, образующих в дыхательных путях колонии. Например, наиболее распространенный возбудитель инфекции нижних и верхних дыхательных путей пневмококк (Streptococcus pneumoniae) продуцирует такой фактор вирулентности, как пневмолизин. Итогом подобного воздействия на дыхательные пути становится застой слизи, а также повреждение клеток эпителия дыхательных путей. При проникновении в организм гемофильной палочки (Haemophilus influenzae), возбудителя респираторных инфекций, особенно у курящих, страдающих хроническим бронхитом и хронической обструктивной болезнью легких (ХОБЛ), и синегнойной палочки (Pseudomonas aeruginosa) реснички мерцательного эпителия повреждаются (цилиостаз), их двигательная активность нарушается, что приводит к гиперсекреции и застою бронхиального секрета.
Например, наиболее распространенный возбудитель инфекции нижних и верхних дыхательных путей пневмококк (Streptococcus pneumoniae) продуцирует такой фактор вирулентности, как пневмолизин. Итогом подобного воздействия на дыхательные пути становится застой слизи, а также повреждение клеток эпителия дыхательных путей. При проникновении в организм гемофильной палочки (Haemophilus influenzae), возбудителя респираторных инфекций, особенно у курящих, страдающих хроническим бронхитом и хронической обструктивной болезнью легких (ХОБЛ), и синегнойной палочки (Pseudomonas aeruginosa) реснички мерцательного эпителия повреждаются (цилиостаз), их двигательная активность нарушается, что приводит к гиперсекреции и застою бронхиального секрета.
В настоящее время кашель считается одним из наиболее распространенных симптомов. На его долю приходится почти четверть всех обращений к врачам первичного медицинского звена в мире. Различают острый кашель с продолжительностью повторных кашлевых пароксизмов не более трех недель, подострый – более трех, но не более восьми недель и хронический – более восьми недель. Важно определить вид кашля – продуктивный или непродуктивный, поскольку от этого зависит выбор лекарственных средств.
Важно определить вид кашля – продуктивный или непродуктивный, поскольку от этого зависит выбор лекарственных средств.
В целях симптоматического улучшения и минимизации риска обострений и осложнений заболеваний дыхательных путей, сопровождающихся выделением вязкой, трудноотделяемой мокроты, применяют мукоактивные лекарственные средства – муколитики, мукорегуляторы, экспекторанты и препараты с мукокинетической активностью. В клинической практике чаще применяют муколитик N-ацетилцистеин, экспекторанты гипертонический раствор и гвайфенезин, мукорегулятор карбоцистеин, мукокинетик амброксол.
Самыми распространенными среди мукоактивных лекарственных средств признаны муколитики, в частности N-ацетилцистеин. Ключевой механизм действия N-ацетилцистеина – разрыв дисульфидных мостиков, связывающих полимеры муцина. N-ацетилцистеин характеризуется антиоксидантным и противовоспалительным эффектами. На фоне его применения как при остром, так и при хроническом кашле улучшаются реологические свойства бронхиального секрета и облегчается экспекторация мокроты.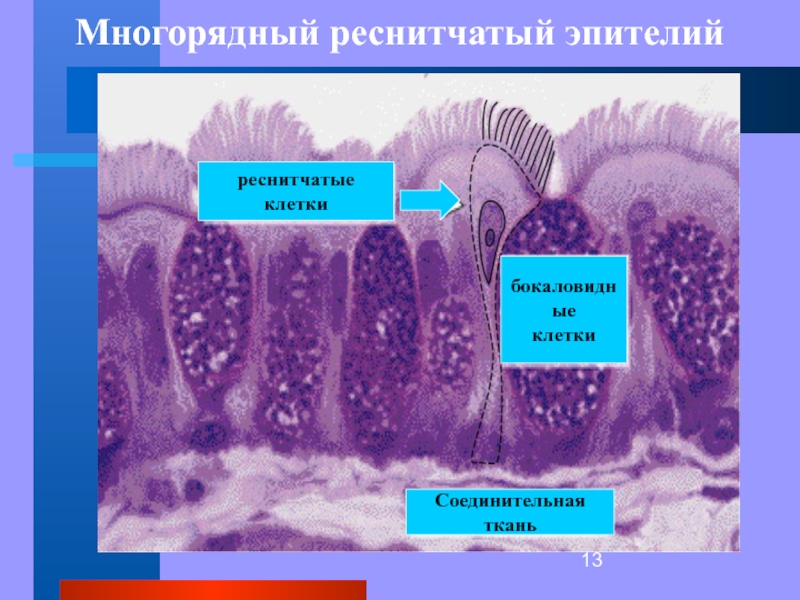
Экспекторанты увеличивают объем бронхиального секрета, стимулируют секрецию и уменьшают вязкость мокроты.
Мукорегуляторы в отличие от N-ацетилцистеина не влияют непосредственно на реологические свойства мокроты, но воздействуют на метаболизм бокаловидных клеток и бронхиальных желез, переключают продукцию с кислых на нейтральные муцины, улучшают вязкость бронхиального секрета, облегчая эвакуацию образующейся мокроты.
Карбоцистеин обладает клинически значимым самостоятельным антиоксидантным и противовоспалительным действием.
К мукорегуляторам относятся и другие препараты, в частности холинолитики, глюкокортикостероиды (ГКС).
Мукокинетические препараты представлены бронхолитиками, сурфактантами, а также амброксолом2.
Амброксол оказывает секретолитическое и мукокинетическое действие, восстанавливает мукоцилиарный клиренс. Отличительной особенностью амброксола и его производных является способность увеличивать продукцию сурфактанта за счет повышения его синтеза, секреции и торможения его распада.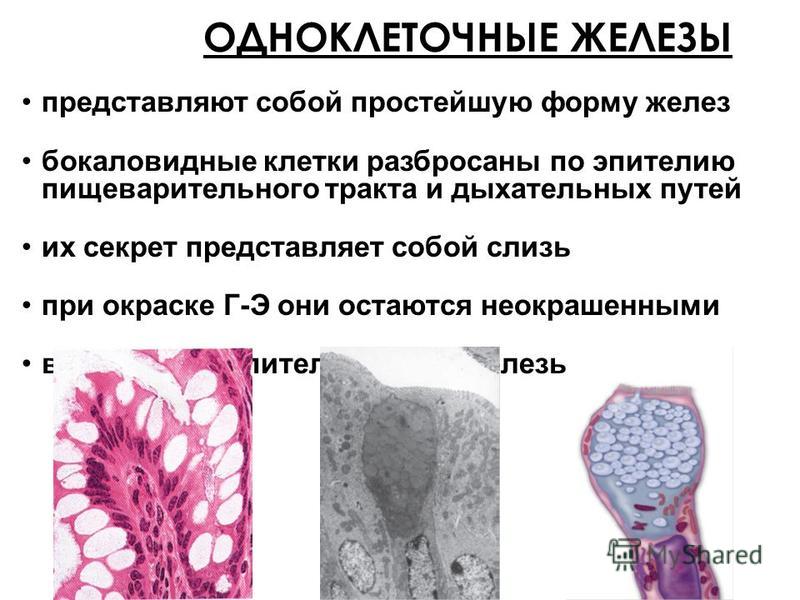 Амброксол характеризуется противовоспалительной активностью, а также местным анестезирующим эффектом, связанным с блокадой нейрональных Na+-каналов3, 4.
Амброксол характеризуется противовоспалительной активностью, а также местным анестезирующим эффектом, связанным с блокадой нейрональных Na+-каналов3, 4.
Местноанестезирующее действие амброксола при остром кашле изучали в ряде исследований. Как показал опрос в рамках постмаркетингового исследования в реальной клинической практике, амброксол (Лазолван) снижает раздражение гортани, уменьшая кашель5.
Течение хронических заболеваний дыхательных путей характеризуется периодическими обострениями, которые снижают качество жизни больного и ухудшают прогноз заболевания. Результаты ряда рандомизированных плацебоконтролируемых исследований продемонстрировали клиническую эффективность мукоактивных препаратов в предотвращении обострений хронического бронхита и ХОБЛ6.
Эффективность амброксола в предотвращении обострений хронического бронхита изучали в 13 клинических центрах на протяжении шести месяцев. В исследование были включены 240 больных, разделенных на две группы. Пациенты первой группы получали амброксол 75 мг в виде капсул с медленным высвобождением один раз в сутки в течение шести месяцев, пациенты второй – плацебо. К концу наблюдения в группе активной терапии число пациентов без признаков обострения достигло 45,5%, в группе плацебо – 14,4%. Кроме того, в исследовании зарегистрированы улучшение клинической симптоматики, уменьшение выраженности кашля в группе пациентов, получавших амброксол7.
В исследование были включены 240 больных, разделенных на две группы. Пациенты первой группы получали амброксол 75 мг в виде капсул с медленным высвобождением один раз в сутки в течение шести месяцев, пациенты второй – плацебо. К концу наблюдения в группе активной терапии число пациентов без признаков обострения достигло 45,5%, в группе плацебо – 14,4%. Кроме того, в исследовании зарегистрированы улучшение клинической симптоматики, уменьшение выраженности кашля в группе пациентов, получавших амброксол7.
В двойном слепом рандомизированном многоцентровом исследовании, посвященном оценке профилактического использования амброксола (Лазолвана) при обострении хронического бронхита, критерием эффективности служило суммарное количество дней нетрудоспособности в связи с обострениями основного заболевания бронхолегочной системы на протяжении 24 месяцев. Между группами пациентов, получавших амброксол и плацебо, зафиксирована значительная разница. Так, в группе амброксола суммарное количество дней нетрудоспособности из-за обострения хронического бронхита составило 1216, в группе плацебо – 1789, количество дней применения антибактериальных препаратов – 75 и 103 соответственно8.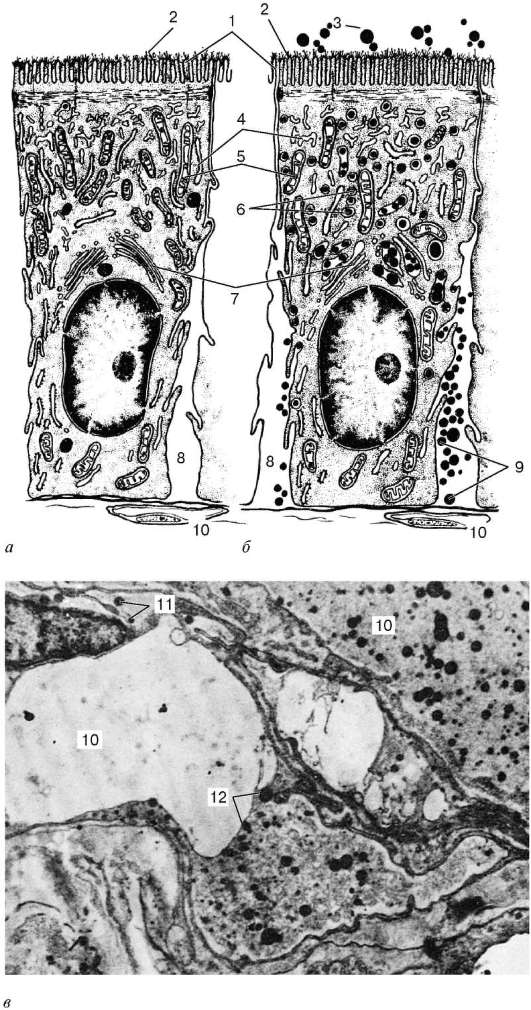
Аналогичные результаты получены и в многоцентровом открытом исследовании, в котором участвовали 5635 амбулаторных пациентов. В отличие от группы плацебо в группе больных, получавших амброксол в капсулах 75 мг один раз в день в течение шести месяцев, отмечалась отчетливая положительная динамика в отношении выраженности кашля, одышки и патологических аускультативных признаков, выделения и отхождения мокроты9.
Кроме того, в ряде исследований показано, что сочетание препарата с антибиотиками имеет преимущество перед использованием только антибиотика. Амброксол способствует повышению концентрации антибиотика в бронхиальном секрете, что улучшает течение заболевания при бактериальных инфекциях легких.
При одновременном применении амброксола и антибиотика, назначаемого перорально или парентерально, потенциально увеличивается тканевая концентрация антибиотика в дыхательных путях.
В заключение профессор А.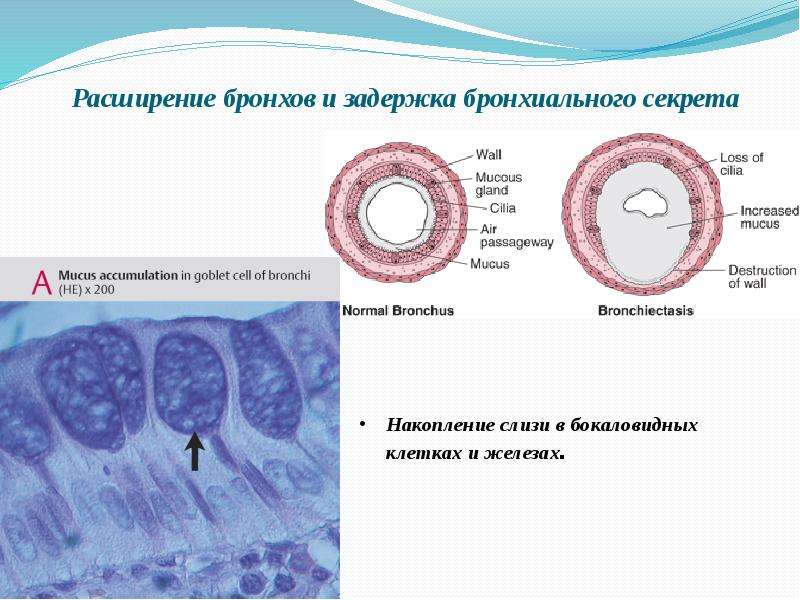 И. Синопальников отметил, что оценка эффективности и безопасности амброксола, появившегося на фармацевтическом рынке в 1973 г., базируется на результатах более 100 исследований с участием свыше 15 000 пациентов и данных постмаркетингового мониторинга. Амброксол (Лазолван) – эффективный и безопасный муколитический препарат с выраженным отхаркивающим действием и рядом других важных свойств, позволяющих использовать его при воспалительных процессах бронхолегочной системы у детей и взрослых.
И. Синопальников отметил, что оценка эффективности и безопасности амброксола, появившегося на фармацевтическом рынке в 1973 г., базируется на результатах более 100 исследований с участием свыше 15 000 пациентов и данных постмаркетингового мониторинга. Амброксол (Лазолван) – эффективный и безопасный муколитический препарат с выраженным отхаркивающим действием и рядом других важных свойств, позволяющих использовать его при воспалительных процессах бронхолегочной системы у детей и взрослых.
Взгляд оториноларинголога
По словам профессора, д.м.н., заведующего кафедрой оториноларингологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова Андрея Юрьевича ОВЧИННИКОВА, кашель является одним из наиболее распространенных симптомов и представляет мультидисциплинарную проблему.
Острый, подострый и хронический кашель может быть обусловлен патологией верхних дыхательных путей, гипертрофией небной или язычной миндалины, постназальным затеканием, постинфекционным кашлем после острой респираторной инфекции в результате гиперреактивности бронхов, хроническим тонзиллитом, ларингитом и др.
Острый кашель может быть спровоцирован заболеваниями верхних дыхательных путей. Одной из распространенных причин кашля являются острые респираторные вирусные инфекции (ОРВИ). На их долю приходится 90% всех заболеваний респираторного тракта. Каждый взрослый переносит ОРВИ два-три раза в год. Чаще (от четырех до восьми раз в год) болеют дети в возрасте от шести месяцев до шести лет. В 4% случаев заболевание осложняется бактериальной инфекцией, в том числе бактериальным риносинуситом.
Среди основных симптомов ОРВИ лидируют клинические признаки, связанные с носовой обструкцией и выделениями из полости носа. Заложенность носа встречается в 23,7% случаев, ринорея – в 16,2%, кашель – в 14,3% случаев.
К причинам развития острых ринитов относят рефлекторный механизм при переохлаждении и респираторные вирусы при ОРВИ. В случае переохлаждения всего организма или дистальных отделов конечностей нарушается мукоцилиарный клиренс полости носа.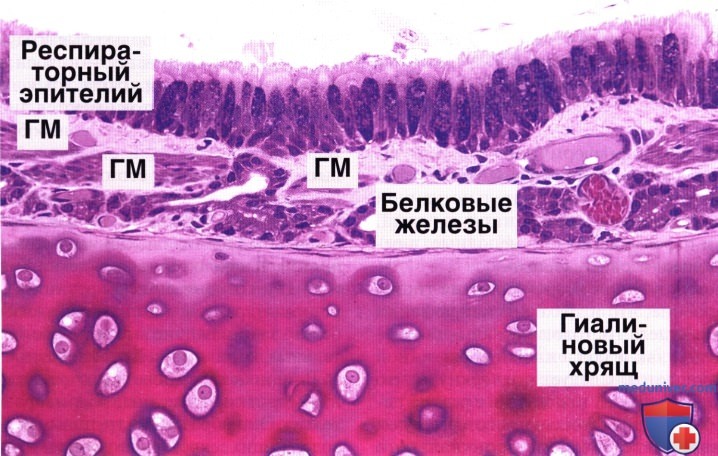 Вирусы, вызывающие острые респираторные инфекции, как правило, тропны к слизистой оболочке верхних дыхательных путей. При этом поражается слизистая оболочка не только полости носа, но и околоносовых пазух, иногда затрагивается область слуховой трубы. В этом контексте правильно говорить о развитии при ОРВИ не острого ринита, а острого риносинусита.
Вирусы, вызывающие острые респираторные инфекции, как правило, тропны к слизистой оболочке верхних дыхательных путей. При этом поражается слизистая оболочка не только полости носа, но и околоносовых пазух, иногда затрагивается область слуховой трубы. В этом контексте правильно говорить о развитии при ОРВИ не острого ринита, а острого риносинусита.
Воспаление слизистых оболочек респираторного тракта при ОРВИ приводит к поражению мерцательного эпителия, нарушению слизеобразования, а также изменению качественного состава слизи.
Основные механизмы патогенеза острого ринита, или риносинусита, – вазодилатация, увеличение проницаемости клеточной стенки. Кроме того, изменение мукоцилиарной функции характеризуется гиперреакцией с преобладанием активности серозных желез, транссудацией секрета с низким содержанием всех муцинов, отеком соустьев, слуховых труб, пролиферацией и перестройкой эпителия, изменением соотношения реснитчатых и бокаловидных клеток. Иными словами, происходит активация слизистых желез, увеличивается вязкость секрета, нарушается вентиляционная функция соустьев, возникает застой слизи, а затем изменяются ее реологические свойства в околоносовых пазухах.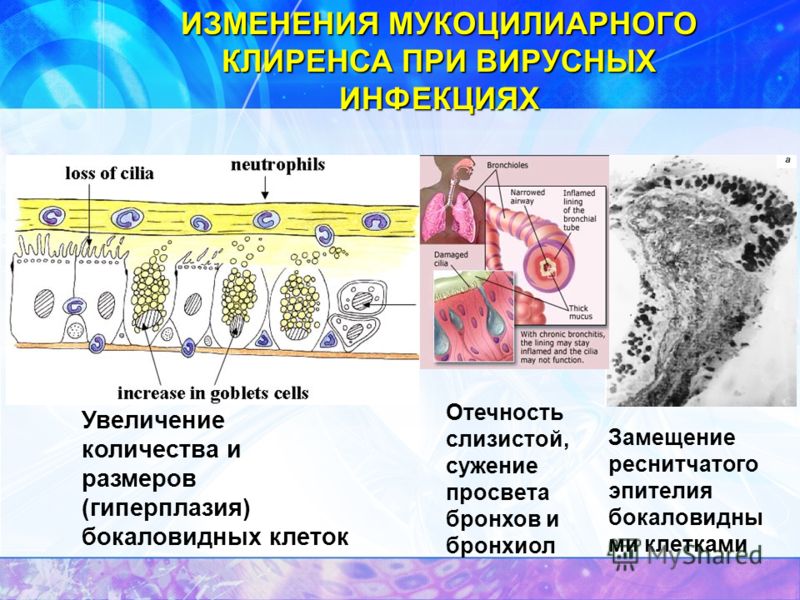 В результате снижается эффективность защитной функции слизистой оболочки носа, создаются условия для формирования в околоносовых пазухах бактериальной колонизации. Начинается стадия бактериального риносинусита.
В результате снижается эффективность защитной функции слизистой оболочки носа, создаются условия для формирования в околоносовых пазухах бактериальной колонизации. Начинается стадия бактериального риносинусита.
Следствием назальной обструкции при риносинусите становится кислородное голодание, которое иногда приводит к гипоксии центральной нервной системы, внутренних органов, повышению уровня кровяного, внутриглазного и внутричерепного давления. Кроме того, у пациентов с ринитом нарушается качество сна, снижаются аппетит и концентрация внимания. Повышается риск развития инфекционных осложнений, таких как отит, синусит, трахеобронхит, бронхопневмония, конъюнктивит.
Выделяют несколько стадий острого катарального ринита, или риносинусита. На сухую стадию, или стадию раздражения, приходится несколько часов. Стадия серозных выделений продолжается два-три дня и сопровождается выраженным отеком, гиперемией слизистой оболочки. На этой стадии цитопатический эффект начинают оказывать вирусы, которые активизируются при ОРВИ.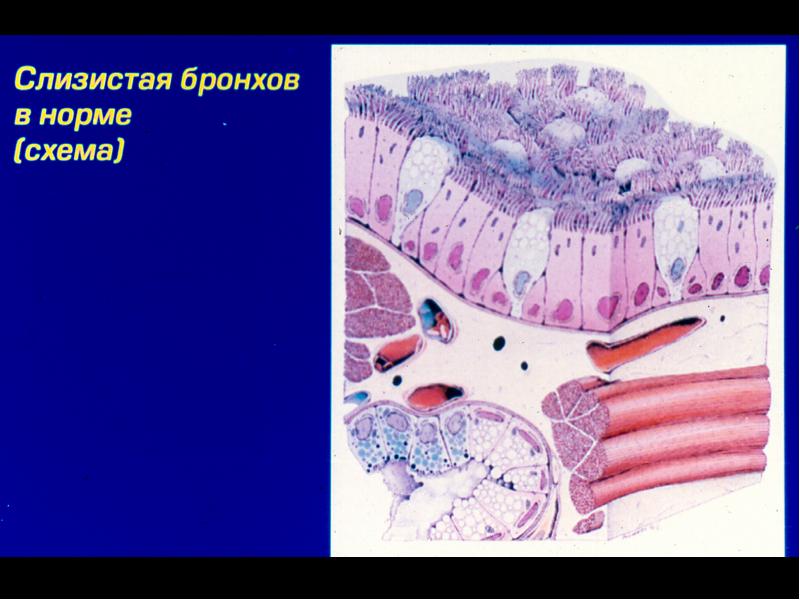 На четвертый-пятый день от начала заболевания меняется характер выделений: они становятся слизисто-гнойными. На этой стадии заболевание либо завершается, либо переходит в стадию бактериального риносинусита.
На четвертый-пятый день от начала заболевания меняется характер выделений: они становятся слизисто-гнойными. На этой стадии заболевание либо завершается, либо переходит в стадию бактериального риносинусита.
Бактериальный риносинусит возникает у 1–3% больных ОРВИ. В эпидсезоне число пациентов, госпитализированных по поводу среднетяжелого и тяжелого риносинусита, достигает 40–50%. При неадекватном лечении или воздействии других факторов, провоцирующих острые риносинуситы, в 10–15% случаев заболевание переходит в рецидивирующую или хроническую форму.
Риносинусит, особенно перешедший в затянувшуюся или хроническую форму с поражением задних околоносовых пазух, часто сопровождается постназальным затеканием. Среди причин формирования затянувшегося или хронического кашля на долю синдрома постназального затекания приходится 41,5%10.
Синдром постназального затекания объединяет клинические ситуации, характеризующиеся воспалительным процессом верхних дыхательных путей (носоглотка, полость носа, околоносовые пазухи), при которых отделяемое из носа стекает по задней стенке глотки, раздражая кашлевые рецепторы.
Следует подчеркнуть, что осведомленность врачей в отношении данного синдрома важна, поскольку такой кашель нередко ошибочно трактуют как хронический бронхит.
Докладчик отметил, что многообразие оториноларингологических причин кашля воспалительного и невоспалительного генеза определяет широкий спектр препаратов для его купирования.
Выбор конкретных лекарственных средств от кашля основан на детальном анализе его клинических особенностей. Особое место в терапии кашля отводится мукоактивным препаратам, стимулирующим выведение и разжижение слизи, уменьшение ее внутриклеточного образования. При заболеваниях респираторного тракта, когда изменяются реологические свойства секрета, применяют муколитические отхаркивающие средства, в частности амброксол, известный под торговым наименованием Лазолван. Амброксол оказывает комплексное действие. Лазолван эффективно разжижает мокроту и уменьшает ее вязкость, оказывает мукорегулирующий эффект, увеличивая секрецию в дыхательных путях. Мукокинетическое действие Лазолвана заключается в усилении тока и транспорта слизи, восстановлении активности ресничек мерцательного эпителия бронхов.
Мукокинетическое действие Лазолвана заключается в усилении тока и транспорта слизи, восстановлении активности ресничек мерцательного эпителия бронхов.
При риносинусите применяют антибактериальную и противовоспалительную терапию, секретолитики, пункционное лечение, физиотерапию. Пациентам со средним отитом показаны антибактериальные и противовоспалительные препараты, десенсибилизирующая терапия и различные физиотерапевтические процедуры. Ринит служит показанием к назначению тепловых процедур, фито- и физиотерапии11.
Местная терапия при заболеваниях ЛОР-органов характеризуется доказанными преимуществами – простотой и доступностью введения препарата (непосредственно на слизистую оболочку), его высокой концентрацией при низкой общей дозе, отсутствием или уменьшением системного воздействия.
К преимуществам местных антибиотиков относятся широкий спектр активности, отсутствие резистентности основных видов возбудителей и системного действия и связанных с ним побочных эффектов.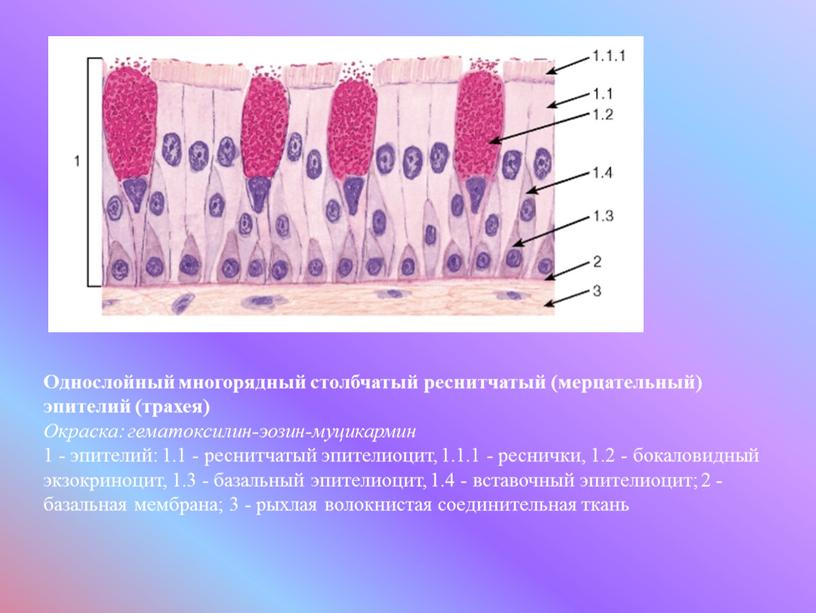 Однако надо помнить, что местные антибиотики не применяются в качестве монотерапии риносинусита средней и тяжелой степени.
Однако надо помнить, что местные антибиотики не применяются в качестве монотерапии риносинусита средней и тяжелой степени.
Местная противовоспалительная терапия – важная составляющая лечения ЛОР-патологии. На сегодняшний день доказана противовоспалительная эффективность топических ГКС при риносинуситах и других заболеваниях верхних дыхательных путей. Эти препараты не оказывают системного действия и не вызывают связанных с ним побочных эффектов, устраняют отек в кратчайшие сроки. В комплексном лечении риносинусита часто используют безопасные бактериальные лизаты с иммуномодулирующим и профилактическим эффектами. Однако в качестве монотерапии риносинусита их применять не следует.
Особое место в медикаментозной терапии всех видов ринита занимают деконгестанты. Они быстро устраняют заложенность носа. Эффективность и удобство применения в сочетании с экономической доступностью сделали деконгестанты невероятно популярными среди пациентов. Не случайно в рейтинге аптечных продаж эти препараты лидируют.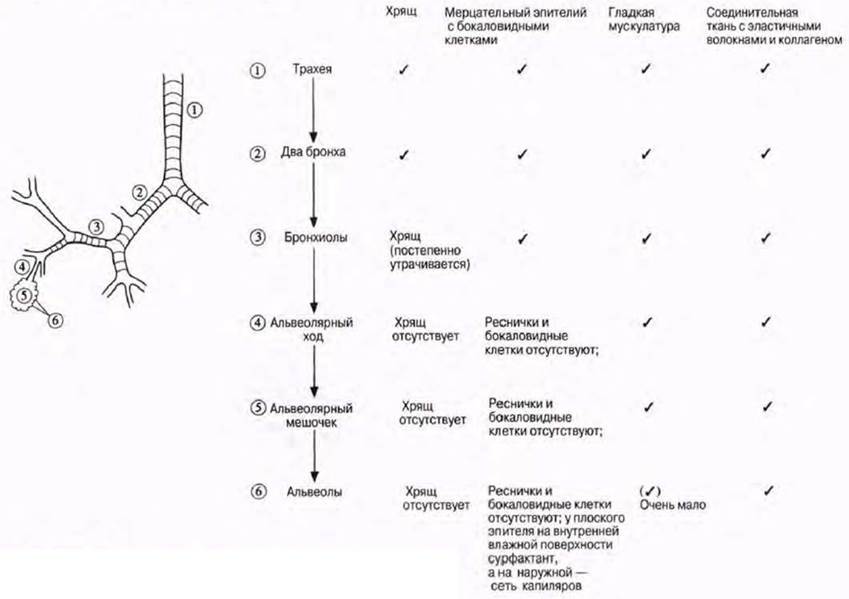 Уменьшение отека слизистой оболочки под воздействием сосудосуживающих препаратов значительно облегчает состояние больного и ускоряет процесс выздоровления. Тем не менее необходимо помнить, что из-за риска развития медикаментозного ринита использование деконгестантов должно быть ограничено пятью – семью днями. Длительный курс исключен.
Уменьшение отека слизистой оболочки под воздействием сосудосуживающих препаратов значительно облегчает состояние больного и ускоряет процесс выздоровления. Тем не менее необходимо помнить, что из-за риска развития медикаментозного ринита использование деконгестантов должно быть ограничено пятью – семью днями. Длительный курс исключен.
По фармакологическим свойствам назальные деконгестанты являются альфа-адреномиметиками, воздействующими на альфа-адренорецепторы гладкой мускулатуры сосудов слизистой оболочки носа. Последние на основании сравнительной избирательности подразделяют на альфа-1- и альфа-2-рецепторы. Механизм действия деконгестантов заключается в стимулировании адренергических рецепторов, вследствие чего уменьшаются отек и гиперемия слизистой оболочки. Носовое дыхание улучшается за счет расширения носовых ходов, снижения уровня назальной секреции. Проходимость естественных отверстий – околоносовых пазух и слуховой трубы восстанавливается.
В современной клинической практике широко применяют альфа-2-адреномиметики с выраженным сосудосуживающим эффектом.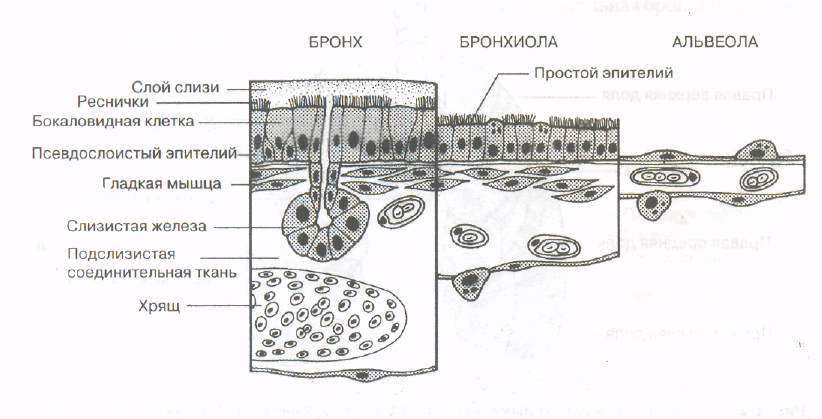 Современный препарат, относящийся к этой группе, – трамазолина гидрохлорид (Лазолван Рино). Согласно данным исследований, трамазолин оказывает быстрый сосудосуживающий эффект, который сохраняется в течение длительного периода времени. Терапевтическое воздействие препарата проявляется примерно через пять минут после приема. В одном из исследований максимальное уменьшение отечности слизистой оболочки носа было достигнуто за 30 минут, после чего в течение пяти часов сохранялся нормальный уровень сопротивления носовой полости воздушному потоку. Даже спустя шесть часов эффект препарата оставался значительным. Доказано, что терапевтическое действие препарата Лазолван Рино в форме назального спрея может сохраняться 8–10 часов12.
Современный препарат, относящийся к этой группе, – трамазолина гидрохлорид (Лазолван Рино). Согласно данным исследований, трамазолин оказывает быстрый сосудосуживающий эффект, который сохраняется в течение длительного периода времени. Терапевтическое воздействие препарата проявляется примерно через пять минут после приема. В одном из исследований максимальное уменьшение отечности слизистой оболочки носа было достигнуто за 30 минут, после чего в течение пяти часов сохранялся нормальный уровень сопротивления носовой полости воздушному потоку. Даже спустя шесть часов эффект препарата оставался значительным. Доказано, что терапевтическое действие препарата Лазолван Рино в форме назального спрея может сохраняться 8–10 часов12.
Анализ данных литературы подтверждает эффективность и быстрое начало действия трамазолина гидрохлорида в отношении основных симптомов ринита. Так, в 70% случаев отмечается начало действия препарата в течение первых трех минут. После нанесения на слизистые оболочки носа из-за сосудосуживающего воздействия препарат заметно уменьшает отечность. В итоге проходимость носовых ходов быстро восстанавливается, дыхание облегчается.
В итоге проходимость носовых ходов быстро восстанавливается, дыхание облегчается.
Лазолван Рино, выпускаемый в виде спрея с дозирующим устройством, применяют до четырех раз в сутки. Продолжительность лечения препаратом Лазолван Рино при рините не должна превышать пяти – семи дней. Помимо трамазолина в состав препарата Лазолван Рино входят компоненты, увлажняющие и защищающие слизистую оболочку носа. Эвкалиптол, камфора и ментол увлажняют слизистую оболочку и защищают ее от высыхания.
Кроме того, трамазолина гидрохлорид является дериватом имидазолина. В отличие от дериватов адреналина препараты имидазолиновой группы обеспечивают пролонгированную вазоконстрикцию, не вызывают гиперемии при длительном применении, гипертрофии носовой раковины и атрофии слизистой оболочки носа, безопасны для реснитчатого эпителия и не приводят к сердечно-сосудистым нарушениям даже у детей. По сравнению с другими препаратами имидазолиновой группы трамазолин действует быстрее и характеризуется пролонгированным эффектом.
Подводя итог, профессор А.Ю. Овчинников подчеркнул, что только разумное применение медикаментозных средств при ОРВИ, в том числе ограничение их бесконтрольного и необоснованного использования врачами и пациентами, способствует повышению качества лечения, уменьшению побочных эффектов и аллергизации организма.
Взгляд клинического фармаколога
Профессор, д.м.н., главный специалист-пульмонолог Министерства обороны РФ Главного военного клинического госпиталя им. академика Н.Н. Бурденко Андрей Алексеевич ЗАЙЦЕВ представил участникам симпозиума фармакологическую характеристику мукоактивных средств.
Кашель – наиболее частая причина обращения за медицинской помощью на амбулаторном этапе. По данным зарубежных эпидемиологических исследований, в Великобритании острый кашель, сопровождающий ОРВИ, наблюдается у 45–48 млн больных ежегодно. 60% населения этой страны переносит острый кашель ежегодно, но из них только треть обращается за медицинской помощью13.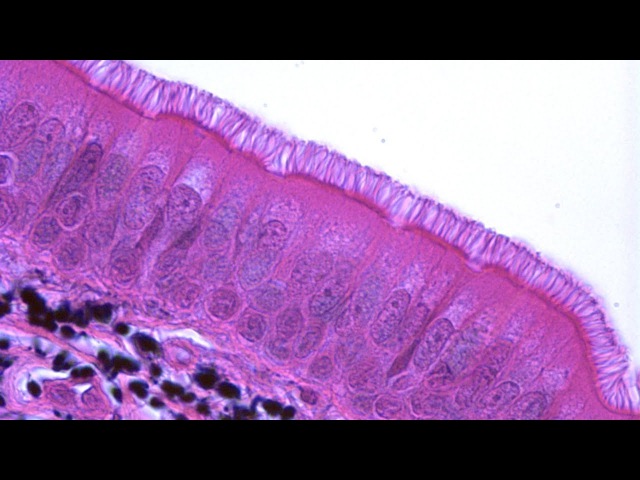
Рациональная фармакотерапия кашля предполагает прежде всего установление диагноза заболевания и анализ особенностей кашля. С точки зрения фармакологии существует два направления противокашлевой терапии – применение супрессантов кашля и проведение мукоактивного лечения.
Супрессанты – это препараты, подавляющие кашель в центральном или периферическом звене. Соответственно среди супрессантов различают препараты центрального и периферического действия. Препараты центрального действия подразделяют на опиоидные и неопиоидные. К наиболее известным противокашлевым опиоидным средствам относят кодеин. Действие препарата основано на взаимодействии с мю-опиоидными рецепторами и подавлении функции кашлевого центра продолговатого мозга. Препарат обладает противокашлевым, обезболивающим и успокаивающим эффектами. Его побочное действие обусловлено «высушиванием» дыхательных путей. При регулярном применении кодеина наблюдается явление привыкания.
Неопиоидные противокашлевые препараты центрального действия (бутамират, глауцин) также подавляют кашлевой рефлекс за счет угнетения кашлевого центра, но не влияют на дыхательный центр, оказывают противокашлевое, отхаркивающее, умеренное бронходилатирующее, противовоспалительное действие.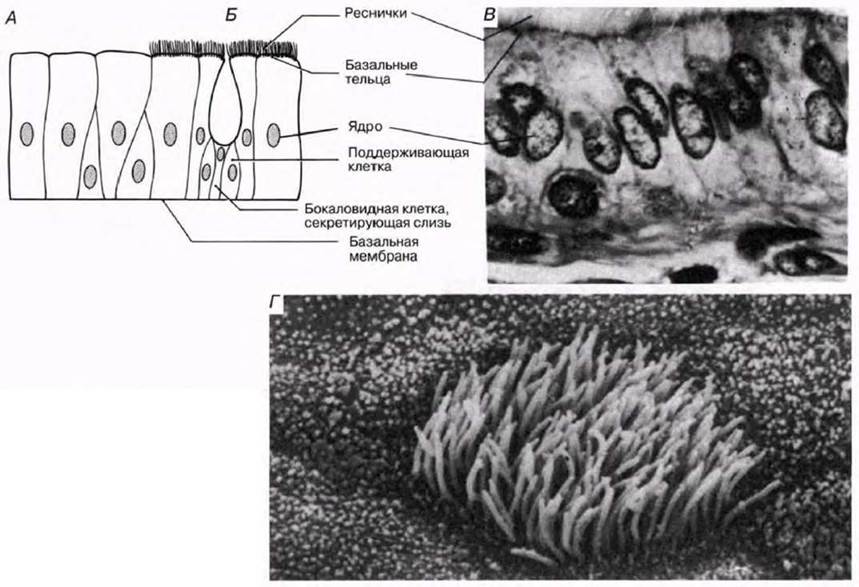 В реальной клинической практике чаще используется бутамират. По сравнению с кодеинсодержащими препаратами его противокашлевое действие несколько слабее, вместе с тем он лишен ряда нежелательных эффектов.
В реальной клинической практике чаще используется бутамират. По сравнению с кодеинсодержащими препаратами его противокашлевое действие несколько слабее, вместе с тем он лишен ряда нежелательных эффектов.
Противокашлевые препараты периферического действия (преноксдиазин (Либексин), леводропропизин) блокируют периферические звенья кашлевого рефлекса за счет снижения чувствительности рецепторов нервных окончаний блуждающего нерва, расположенных в органах дыхания. Их противокашлевое действие существенно ниже, чем у препаратов центрального действия, поэтому для достижения оптимального противокашлевого эффекта требуются достаточно высокие дозы.
Как отметил докладчик, противокашлевые препараты не рекомендуются при остром кашле, для подавления продуктивного кашля, поскольку способны нарушать мукоцилиарный клиренс и ухудшать состояние больного. Препараты, подавляющие кашлевой рефлекс, назначают только в том случае, если кашель значительно снижает качество жизни пациента, нарушает сон, дневную активность, а также при наличии выраженного болевого синдрома. Чаще эти средства применяются для подавления кашля у пациентов с неопластическими процессами и в ряде других подобных клинических ситуаций14.
Чаще эти средства применяются для подавления кашля у пациентов с неопластическими процессами и в ряде других подобных клинических ситуаций14.
При продуктивном кашле рекомендовано применение мукоактивных препаратов. Это лекарственные средства, позволяющие управлять кашлем через изменение количества и свойств бронхиального секрета. Мукоактивная терапия предусматривает применение препаратов трех основных групп – муколитиков, мукокинетиков и мукорегуляторов.
По действию на бронхиальный секрет и мукоцилиарный клиренс принято выделять две группы мукокинетиков – прямого и рефлекторного действия. К наиболее эффективным мукокинетикам прямого действия можно в полной мере отнести только два препарата – гипертонический раствор NaCl и гвайфенезин. Наиболее широкое клиническое распространение среди препаратов данной группы получил гвайфенезин, оказывающий как муколитический, так и мукокинетический эффект. Однако препарат входит в состав комбинированных средств и на отечественном фармацевтическом рынке в монокомпонетном составе не представлен. Все остальные препараты рефлекторного действия, как правило, растительного происхождения (корень солодки, алтея, листья плюща и т.д.). Следует отметить, что в дозах, обеспечивающих высокий мукокинетический эффект, данные средства способны вызывать ряд нежелательных явлений (тошнота, рвота), что ограничивает их применение.
Все остальные препараты рефлекторного действия, как правило, растительного происхождения (корень солодки, алтея, листья плюща и т.д.). Следует отметить, что в дозах, обеспечивающих высокий мукокинетический эффект, данные средства способны вызывать ряд нежелательных явлений (тошнота, рвота), что ограничивает их применение.
С точки зрения фармакологии муколитики и мукорегуляторы подразделяют на две основные группы в зависимости от механизма действия. К первой группе относят препараты, нормализующие внутриклеточное образование бронхиального секрета, такие как вазициноиды (бромгексин, амброксол), карбоцистеин. Вторую группу составляют препараты, действующие в просвете бронхов. Среди них выделяют препараты, разрушающие пептидные связи молекул белка и нуклеиновой кислоты. В их числе протеолитические ферменты трипсин, химотрипсин, рибонуклеаза, дорназа альфа. Препараты, действующие в просвете бронхов, также оказывают влияние на дисульфидные связи мукополисахаридов и гликопротеидов.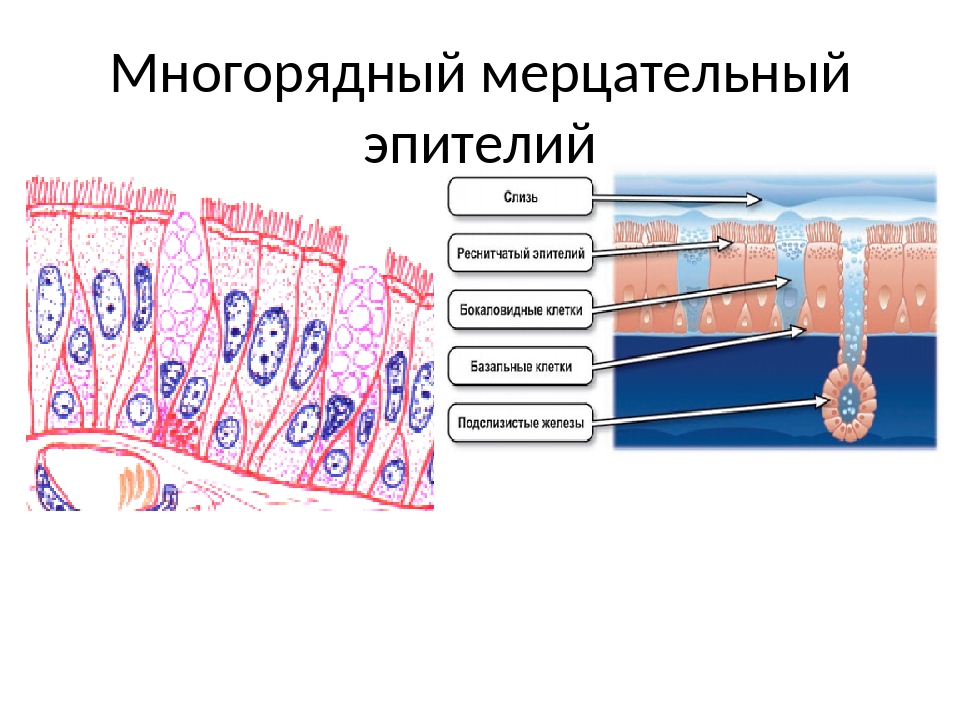 В отечественной клинической практике используются два основных препарата этой группы – ацетилцистеин и эрдостеин.
В отечественной клинической практике используются два основных препарата этой группы – ацетилцистеин и эрдостеин.
Широкое распространение получили комбинированные препараты, сочетающие в себе муколитический и мукорегулирующий эффекты, в частности препараты, содержащие бромгексин, гвайфенезин, сальбутамол.
Профессор А.А. Зайцев рассмотрел различные фармакологические подходы к противокашлевой терапии в определенных клинических ситуациях.
Механизм действия протеолитических ферментов реализуется за счет расщепления комплекса мукопротеинов или нуклеиновых кислот, что улучшает вязкость мокроты и ее отхождение. В настоящее время клинические возможности ферментных средств ограничиваются использованием препарата дорназа альфа. Он способен расщеплять внеклеточную ДНК вязкого бронхиального секрета больных муковисцидозом. Применение препарата у данной категории пациентов сопровождается уменьшением вязкости мокроты, снижением риска развития инфекционных осложнений.
Муколитическое действие ацетилцистеина обусловлено наличием в его молекуле сульфгидрильных SH-групп, которые разрывают дисульфидные связи мукополисахаридов мокроты, делая ее менее вязкой. К препаратам той же группы относится эрдостеин. Препарат обладает хорошим антиоксидантным эффектом. В ряде исследований, например с участием пациентов с ХОБЛ, с частыми обострениями, жалобами на постоянный продуктивный кашель с образованием вязкой мокроты, длительное применение эрдостеина обеспечивало очевидный клинический эффект в виде снижения частоты обострения, в том числе за счет антиоксидантных свойств. Перспективы применения этого препарата связаны с долгосрочной фармакотерапией у больных с частыми обострениями ХОБЛ. Кроме того, эрдостеин показан пациентам с острым и хроническим бронхитом, пневмонией, бронхиальной астмой с затрудненным отхождением мокроты, бронхоэктатической болезнью. Препарат применяется также в целях профилактики пневмонии и ателектаза легких после хирургических вмешательств.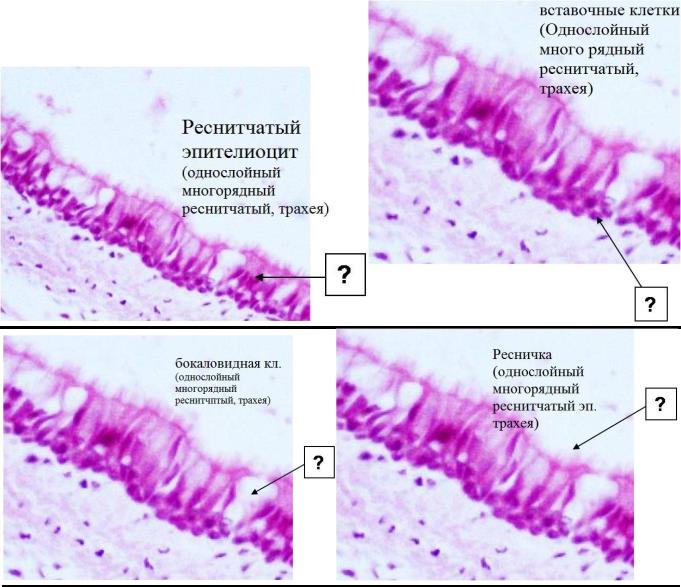
Бромгексин метаболизируется в печени с образованием активного метаболита – амброксола, который способен оказывать муколитическое и отхаркивающее действие. Препарат повышает активность лизосом бокаловидных клеток эпителия дыхательных путей, вследствие чего высвобождаются лизосомальные ферменты, гидролизующие мукопротеиды и мукополисахариды. Бромгексин восстанавливает мукоцилиарный клиренс за счет стимуляции выработки нейтральных полисахаридов и сурфактанта. Отличительной особенностью бромгексина является его небольшое самостоятельное противокашлевое действие. Режим дозирования – три раза в сутки.
Амброксола гидрохлорид – активный метаболит бромгексина, обеспечивающий более выраженный муколитический эффект в отсутствие противокашлевого действия. Препарат стимулирует образование трахеобронхиального секрета пониженной вязкости, улучшает мукоцилиарный транспорт. Способность повышать синтез, секрецию сурфактанта и блокировать его распад у амброксола выше, чем у бромгексина.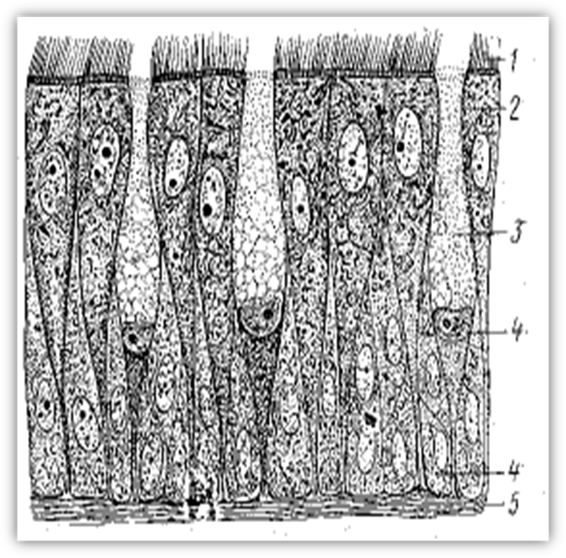 Применение амброксола в реальной клинической практике обусловлено не только расширенными показаниями из-за смешанного механизма действия, но и разнообразием лекарственных форм. На российском фармацевтическом рынке представлены формы, позволяющие принимать амброксол один раз в сутки.
Применение амброксола в реальной клинической практике обусловлено не только расширенными показаниями из-за смешанного механизма действия, но и разнообразием лекарственных форм. На российском фармацевтическом рынке представлены формы, позволяющие принимать амброксол один раз в сутки.
Ученые изучали эффективность амброксола при хроническом бронхите. На фоне применения препарата отмечалось статистически значимое симптоматическое улучшение в отношении качества и количества мокроты (отхаркивающий эффект). По сравнению с плацебо при использовании амброксола значительно сокращались длительность периода обострения и продолжительность антибиотикотерапии, наблюдалось статистически значимое симптоматическое улучшение: уменьшение кашля и отсутствие одышки. Амброксол значительно снижал количество обострений хронического бронхита7.
Особый интерес представляют результаты оценки длительного применения амброксола. При использовании амброксола у пациентов с хроническим бронхитом фиксировалось меньшее количество дней нетрудоспособности.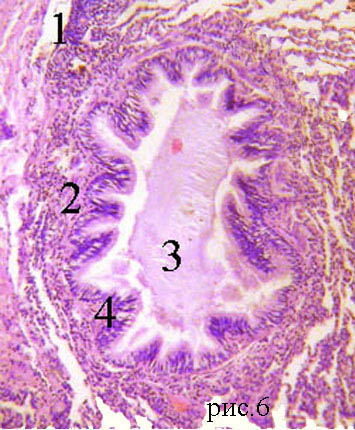 Кроме того, улучшалась вентиляционная функция легких, отмечался существенный регресс одышки и кашля, повышалось качество жизни. Этим пациентам реже, чем пациентам из группы плацебо, требовалась антибиотикотерапия8.
Кроме того, улучшалась вентиляционная функция легких, отмечался существенный регресс одышки и кашля, повышалось качество жизни. Этим пациентам реже, чем пациентам из группы плацебо, требовалась антибиотикотерапия8.
Среди муколитических препаратов непрямого действия следует отметить карбоцистеин, обладающий одновременно мукорегулирующим и муколитическим эффектами. Он способствует восстановлению слизистой оболочки, регулирует активность бокаловидных клеток (предотвращает гиперпродукцию секрета), ингибирует медиаторы воспаления, оказывая противовоспалительное действие. На фоне применения карбоцистеина у пациентов с хроническим бронхитом, сопровождающимся гиперпродукцией секрета, снижается частота обострений. Карбоцистеин действует на всем протяжении респираторного тракта (полость носа, придаточные пазухи носа, верхние и нижние дыхательные пути), в полости среднего уха. Карбоцистеин целесообразно применять при сочетанном поражении нескольких отделов респираторного тракта.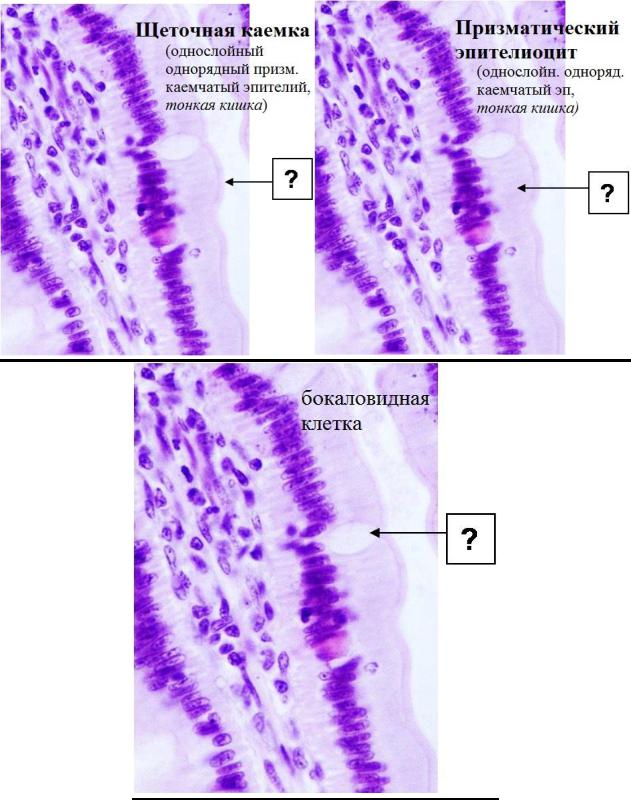
Стимуляторы мукоцилиарного клиренса – бета-2-симпатомиметики (фенотерол, сальбутамол и др.) увеличивают мукоцилиарный клиренс, повышают секрецию слизистых желез и продукцию сурфактанта, облегчают отхождение мокроты, оказывают дозозависимое бронхолитическое действие. В связи с этим в определенных клинических ситуациях (например, при остром бронхите, обострении ХОБЛ) оправданна терапия бета-2-агонистами в комбинации с основным мукоактивным препаратом.
Заключение
Успех терапии кашля зависит от правильной диагностики основного заболевания и назначения адекватной терапии. Муколитическая терапия является важной составляющей комплексного лечения бронхолегочных заболеваний, как острых, так и хронических.
Лазолван (компания «Санофи») представляет собой активный метаболит бромгексина – синтетического производного алкалоида вазицина. Основное вещество амброксола гидрохлорид разжижает мокроту, стимулирует выработку ферментов, расщепляющих связи между мукополисахаридами мокроты, и сурфактанта, что также нормализует реологические параметры мокроты, уменьшая ее вязкость и адгезивные свойства. Препарат непосредственно стимулирует движение ресничек эпителия бронхов, способствуя эвакуации мокроты. Данные литературы свидетельствуют о противовоспалительном и иммуномодулирующем эффектах Лазолвана.
Препарат непосредственно стимулирует движение ресничек эпителия бронхов, способствуя эвакуации мокроты. Данные литературы свидетельствуют о противовоспалительном и иммуномодулирующем эффектах Лазолвана.
Амброксол не обладает тератогенным действием, поэтому может применяться у беременных. При использовании препарата побочные явления наблюдаются редко. Лазолван выпускается в различных лекарственных формах: таблетки, раствор для приема внутрь и ингаляций, сироп в двух концентрациях для разных возрастных категорий.
Важным компонентом алгоритма лечения заболеваний дыхательных путей является восстановление нормальной деятельности дыхания, в том числе проходимости носовой полости. Лазолван Рино – антиконгестивное средство для местного применения в ЛОР-практике. Лазолван Рино спрей назальный содержит действующий элемент – трамазолина гидрохлорид. В состав входят элементы, оказывающие дополнительное действие. После введения препарата интраназальным способом происходит сужение сосудов, признаки отека слизистой оболочки носа уменьшаются, проходимость носовой полости улучшается.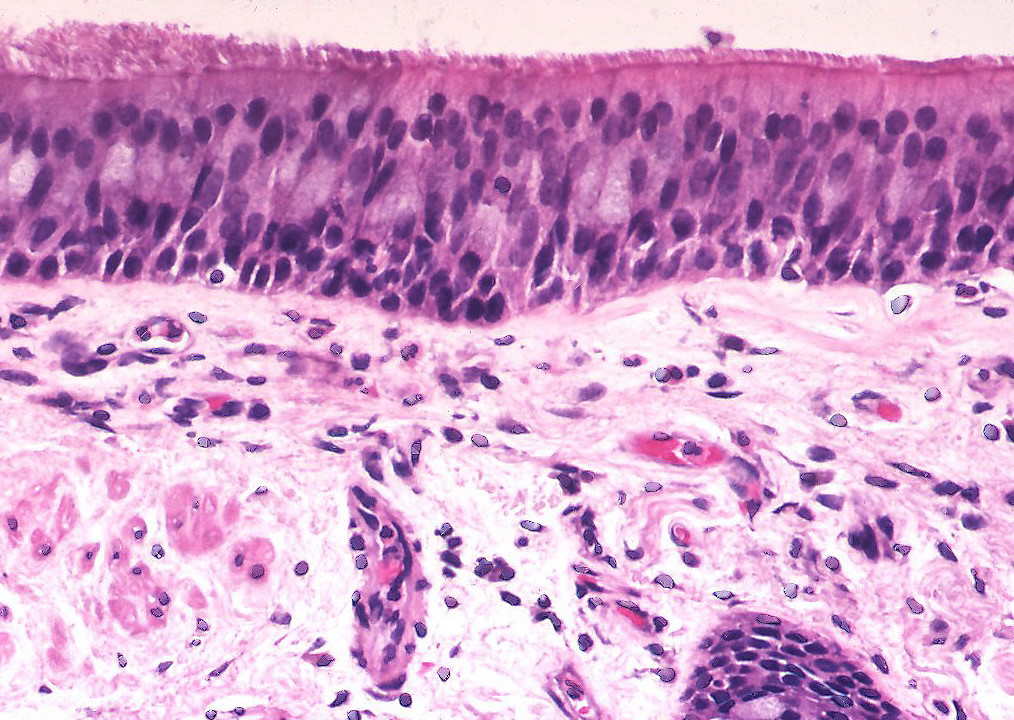 Лазолван Рино нормализует деятельность дыхания. Терапевтическое воздействие препарата проявляется примерно через пять – десять минут после приема и может сохраняться восемь – десять часов. Лазолван Рино используют при отеке слизистых оболочек носа, а также заложенности носа, вызванной поллинозом или острыми респираторными заболеваниями. Показаниями к назначению препарата служат ринит, сенная лихорадка, средний отит (евстахиит), синусит.
Лазолван Рино нормализует деятельность дыхания. Терапевтическое воздействие препарата проявляется примерно через пять – десять минут после приема и может сохраняться восемь – десять часов. Лазолван Рино используют при отеке слизистых оболочек носа, а также заложенности носа, вызванной поллинозом или острыми респираторными заболеваниями. Показаниями к назначению препарата служат ринит, сенная лихорадка, средний отит (евстахиит), синусит.
Медицинская академия имени С.И. Георгиевского ФГАОУ ВО «КФУ им. В.И. Вернадского». Дыхательная система.
ДЫХАТЕЛЬНАЯ СИСТЕМА.
А) ВОЗДУХОНОСНЫЕ ПУТИ.
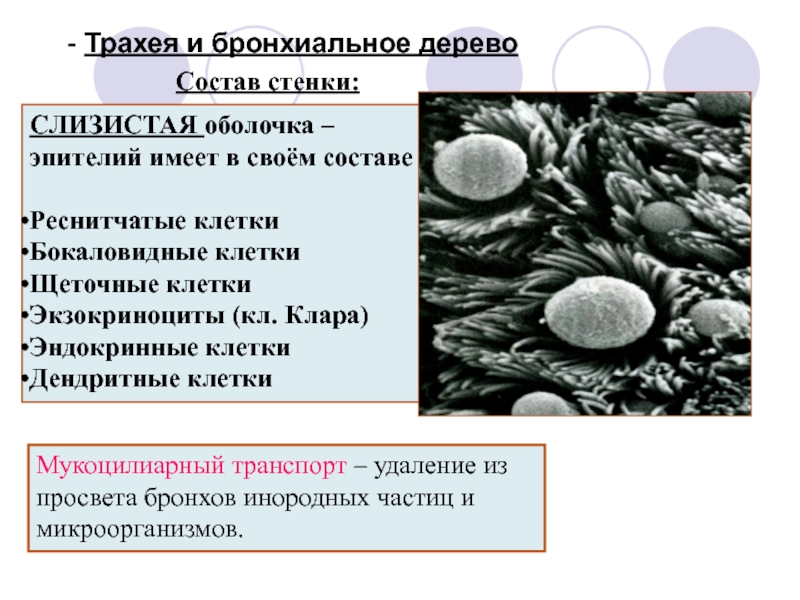
Слизистая оболочка носовой полости, трахеи, главных, крупних и средних бронхов выстлана ОДНОСЛОЙНЫМ ПРИЗМАТИЧЕСКИМ МНОГОРЯДНЫМ РЕСНИТЧАТЫМ эпителием = ОПМР Эп. Он содержит виды клеток: 1)РЕСНИТЧАТЫЕ эпителиоциты — высокие призматич. кл., на апикальной пов-сти имеют 250 РЕСНИЧЕК. Функ.:удаление пылевых частиц. 2)БОКАЛОВИДНЫЕ экзокриноциты-
Он содержит виды клеток: 1)РЕСНИТЧАТЫЕ эпителиоциты — высокие призматич. кл., на апикальной пов-сти имеют 250 РЕСНИЧЕК. Функ.:удаление пылевых частиц. 2)БОКАЛОВИДНЫЕ экзокриноциты-высок. призматич. кл., в апикальной части есть секреторн.гранулы. Функ.: секреция муциногена(слизи).3)БАЗАЛЬНЫЕ эпителиоциты —низкие, малодифф-ные кл. Функ.: это источние РЕГЕНЕРАЦИИ для остальных кл.4)ЩЕТОЧНЫЕ (БЕЗРЕСНИТЧАТЫЕ) эпителиоциты- призматич. кл., на апикальной пов-сти есть МИКРОВОРСИНКИ. Функ.: зто клетки- хеморецепторы. 5)ЭНДОКРИНОЦИТЫ(нейроэндокрин. кл)- содержат гранулы в базальной части. Функ.: секреция гормонов.6)Клетки КЛАРА=бронхиолярные экзокриноциты. (лежат только в БРОНХИОЛАХ). Имеют ГРУШЕВИДНО расширенную апик. часть, в ней есть секреторн.гранулы. Функ.:секреция СУРФАКТАНТА.
ТРАХЕЯ.
Ее стенка состоит из 4-х оболочек: 1) СЛИЗИСТАЯ об-ка, 2) ПОДСЛИЗИСТАЯ основа,3) ВОЛОКНИСТО-ХРЯЩЕВАЯ об-ка, 4) АДВЕНТИЦИАЛЬНАЯ об-ка.
Слизистая об-ка состоит из 2-х слоев: а) ОПМР эпителий, б)собственная пластинка- рыхлая неоформленная соединит. тк. =РНСТ. Подслизистая основа –плотн. неоформл. соед. тк.+ слизистые ЖЕЛЕЗЫ.Волокнисто-хрящевая об-ка сост. из 16-20 ХРЯЩЕВЫХ ПОЛУколец. Тип ткани— ГИАЛИНОВЫЙ хрящ. Адвентициальная об-ка – РНСТ.
СЛИЗИСТАЯ об-ка всех БРОНХОВ состоит НЕ из 2-х, а из 3-х слоїв:
а) ОПМР эпителий, б)собственная пластинка- РНСТ, в) МЫШЕЧНАЯ пластинка слизистой об-ки- гладкая МЫШЕЧНАЯ. тк.
ГЛАВНЫЙ бронх. Его стенка состоит из 4-х оболочек (см. “ Трахея “). НО: волокнисто-хрящевая об-ка состоит из ЗАМКНУТЫХ хрящевых КОЛЕЦ. Тип ткани— гиалиновый хрящ.
 КРУПНЫЙ бронх. Его стенка состоит из 4-х оболочек (см.“Трахея “). НО: волокнисто-хрящевая об-ка состоит из ПЛАСТИН гиалинового хряща. СРЕДНИЙ бронх. Его стенка состоит из 4-х оболочек (см. “ Трахея “). НО: волокнисто-хрящевая об-ка состоит из ОСТРОВКОВ и ЗЕРЕН ЭЛАСТИЧЕСКОГО хряща.
КРУПНЫЙ бронх. Его стенка состоит из 4-х оболочек (см.“Трахея “). НО: волокнисто-хрящевая об-ка состоит из ПЛАСТИН гиалинового хряща. СРЕДНИЙ бронх. Его стенка состоит из 4-х оболочек (см. “ Трахея “). НО: волокнисто-хрящевая об-ка состоит из ОСТРОВКОВ и ЗЕРЕН ЭЛАСТИЧЕСКОГО хряща.МЕЛКИЙ (или внутридольковый) бронх имеет 4 ОСОБЕННОСТИ:
1.—ЭПИТЕЛИЙ в слизистой об-ке НЕ многорядный, а низкий призматическ. ДВУХрядный.
2.—ХРЯЩ полностью ОТСУТСТВУЕТ, значит отсутствует волокнисто-хрящевая об-ка.
3.—очень ТОЛСТЫЙ слой гладкой МЫШЕЧНОЙ ткани (мышечная пластинка).
4.—В подслизистой основе ЖЕЛЕЗЫ ОТСУТСТВУЮТ
ТОЛЬКО МЕЛКИЕ бронхи участвуют в развитии приступа бронхиальной астмы, т.к. они способны СУЖИВАТЬСЯ (бронхоспазм) под влиянием гистамина.
Б) РЕСПИРАТОРНЫЙ отдел легкого.
Он представлен ЛЕГОЧНЫМ АЦИНУСОМ—это СТРУКТ.-ФУНКЦИОН. единица респират. отдела. Он состоит из респираторных бронхиол, в стенке к-рых есть АЛЬВЕОЛЫ.Стенка АЛЬВЕОЛЫ состоит из 3-х типов клеток:
1)АЛЬВЕОЛОЦИТ 1-го типа=РЕСПИРАТОРНЫЙ эпителиоцит. Это однослойный ПЛОСКИЙ эпителий. Функция: через его цитоплазму происходит ГАЗООБМЕН.
2)АЛЬВЕОЛОЦИТ 2-го типа=БОЛЬШОЙ эпителиоцит. Это однослойный КУБИЧЕСКИЙ эпителий. В его цитоплазме есть ПЛАСТИНЧАТЫЕ (или, ЛАМЕЛЛЯРНЫЕ) тельца.
Функция: секреция СУРФАКТАНТА в полость альвеолы. Сурфактант предотвращает: а)спадение альвеол на выдохе, б)развитие отека легкого
3)АЛЬВЕОЛЯРНЫЙ МАКРОФАГ. Клетка звездчатой формы, в цитоплазме много ЛИЗОСОМ.
 Функция: фагоцитоз пылевых частиц и бактерий.
Функция: фагоцитоз пылевых частиц и бактерий.Эмбриональный источник для эпителия воздухоносных путей и альвеолоцитов- ЭНТОдерма передней кишки. Для макрофагов –это моноциты. Для хряща, мышечной и соединительной ткани- это мезенхима.
Составитель – доцент В.В. Бондаренко.
Бокаловидная клетка — это… Что такое Бокаловидная клетка?
Бокаловидные клетки на разрезе ворсинки эпителия кишечника человека (помечены литерой e). Увеличение в 350 раз.Бокаловидные клетки (синонимы: энтероциты бокаловидные, бокаловидные экзокриноциты; лат. enterocytus caliciformis) — продуцирующие слизь клетки эпителия слизистой оболочки кишечника и других органов позвоночных животных и человека. Бокаловидные клетки часто называют одноклеточными железами.[1]
Локализация
Бокаловидные клетки — один из энтероцитов эпителия кишечника.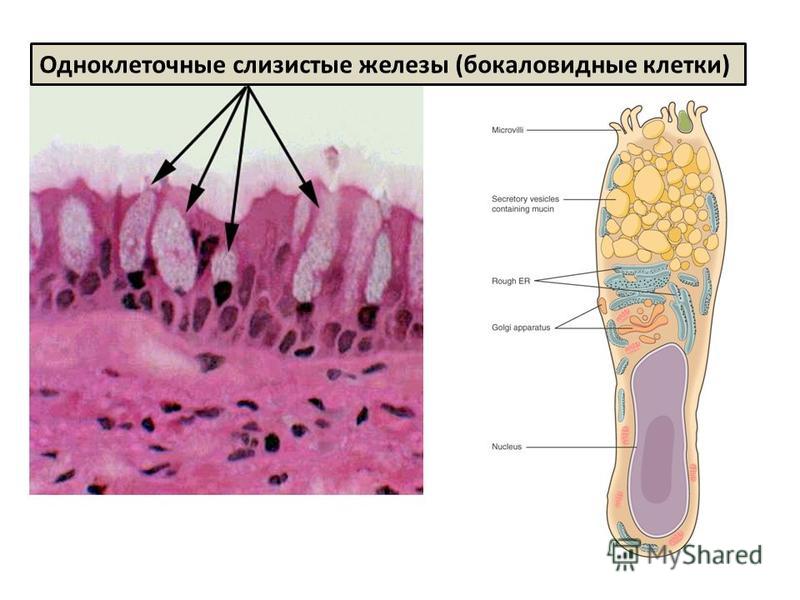 Располагаются на кишечных ворсинках поодиночке среди каёмчатых энтероцитов. Обычно отсутствуют на самой вершине ворсинки, а также на дне крипты. В тонкой кишке человека составляют 9,5 % от всех клеток эпителиального пласта. Число бокаловидных клеток увеличивается в дистальном направлении кишки.[2]
Располагаются на кишечных ворсинках поодиночке среди каёмчатых энтероцитов. Обычно отсутствуют на самой вершине ворсинки, а также на дне крипты. В тонкой кишке человека составляют 9,5 % от всех клеток эпителиального пласта. Число бокаловидных клеток увеличивается в дистальном направлении кишки.[2]
Кроме кишечника, бокаловидные клетки имеются в слизистой оболочке дыхательных путей, в конъюнктиве глаз, протоках поджелудочной и околоушных слюнных желёз.[3] В дыхательных путях больше всего бокаловидных клеток находится в экстраторакальной части трахеи, с уменьшением диаметра бронхов их количество существенно сокращается, а в бронхиолах менее 1 мм их нет совсем.[4]
Структура и функции
Бокаловидные клетки накапливают гранулы муциногена, которые, абсорбируя воду, набухают и превращаются в муцин (основной компонент слизи). При этом клетки обретают форму бокала, суженного у основания (где находится ядро) и округлой широкой в апикальной, верхней части. Затем набухшая верхняя часть бокаловидной клетки разрушается, слизь переходит в просвет органа, клетка приобретает призматическую форму и снова начинает накапливать муциноген. Слизь, выделяемая бокаловидными клетками, служит для увлажнения поверхности слизистой оболочки кишечника и этим способствует продвижению химуса, а также участвует в процессах пристеночного пищеварения.
Затем набухшая верхняя часть бокаловидной клетки разрушается, слизь переходит в просвет органа, клетка приобретает призматическую форму и снова начинает накапливать муциноген. Слизь, выделяемая бокаловидными клетками, служит для увлажнения поверхности слизистой оболочки кишечника и этим способствует продвижению химуса, а также участвует в процессах пристеночного пищеварения.
Апикальная часть бокаловидных клеток имеет исчерченную каёмку, подобно каёмчатым энтероцитам. Однако, в отличие от каёмчатых энтероцитов, микроворсинки каёмки у бокаловидных клеток расположены реже и неодинаковы по высоте.[2]
Метаплазия бокаловидных клеток
При некоторых патологиях бокаловидные клетки могут встречаться в тканях и органах, в которых в норме они или отсутствуют, или присутствуют в значительно меньшем количестве. Часто такая метаплазия является предраковым состоянием. Так, при пищеводе Барретта, осложнении гастроэзофагеальной рефлюксной болезни, рассматриваемом как предраковое состояние пищевода, бокаловидные клетки обнаруживаются в пищеводе. [5]
[5]
Наличие бокаловидных клеток в слизистой оболочке желудка считается важнейшим диагностическим признаком кишечной метаплазии (состояние предрака желудка).[6]
Гиперплазия бокаловидных клеток дыхательных путей с переходом в метаплазию и дисплазию или без является патологическим состоянием — предшественником рака лёгких.[7]
Источники
- ↑ Большой медицинский словарь. Клетка бокаловидная.
- ↑ 1 2 Маев И. В., Самсонов А. А. Болезни двенадцатиперстной кишки. М., МЕДпресс-информ, 2005, — 512 с. ISBN 5-98322-092-6.
- ↑ Большая советская энциклопедия. Бокаловидные клетки.
- ↑ Маев И. В., Бусарова Г. А. Муколитические средства в терапии хронической обструктивной болезни легких. Лечащий врач. № 1. 2003.
- ↑ Васильев Ю. В. Пищевод Барретта: этиопатогенез, диагностика, лечение больных. Трудный пациент. № 7.
 — 2006.
— 2006. - ↑ Маев И. В., Зайратьянц О. В., Кучерявый Ю. А. Кишечная метаплазия слизистой оболочки желудка в практике гастроэнтеролога: современный взгляд на проблему. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2006, № 4, с. 38-48.
- ↑ Кузьмин И. В. Онкология легких.
Взаимосвязь курения с холодовой гиперреактивностью дыхательных путей и течением деструктивно-цитолитических процессов в бокаловидном эпителии бронхов больных бронхиальной астмой | Пирогов
1. Гамбарян М.Г. Хронические респираторные заболевания и потребление табака (обзор). Медицинский совет. 2016; 17: 144–152. DОI: 10.21518/2079-701X2016-17-144-152.
2. Краснова Ю.Н. Влияние табачного дыма на органы дыхания. Сибирский медицинский журнал. 2015; 137 (6): 11–16.
3. Backman H., Hedman L., Jansson S., Lindberg А., Lundbück В., Rönmark Е. Prevalence trends in respiratory symptoms and asthma in relation to smoking – two cross-sectional studies ten years apart among adults in northern Sweden. World Allergy Organ. J. 2014; 7 (1): 1–7. DОI: 10.1186/1939-4551-7-1.
Backman H., Hedman L., Jansson S., Lindberg А., Lundbück В., Rönmark Е. Prevalence trends in respiratory symptoms and asthma in relation to smoking – two cross-sectional studies ten years apart among adults in northern Sweden. World Allergy Organ. J. 2014; 7 (1): 1–7. DОI: 10.1186/1939-4551-7-1.
4. Polosa R., Russo C., Caponnetto P., Bertino G., Sarvа М., Antic Т., Mancuso S., Al-Delaimy W. Greater severity of new onset asthma in allergic subjects who smoke: a 10- year longitudinal study. Respiratory Research. 2011; 12 (1): 16. DОI: 10.1186/1465-9921-12-16.
5. Chalmers G.W., Macleod K.J., Little S.A., Thomson L.J., McSharry C.P., Thomson N.C. Influence of cigarette smoking on inhaled corticosteroid treatment in mild asthma. Thorax. 2002; 57 (3): 226–230. DОI: 10.1136/thorax.57.3.226.
6. Thomson N.C., Spears M. The influence of smoking on the treatment response in patients with asthma. Curr. Opin. Allergy Clin. Immunol. 2005; 5 (1): 57–63. DОI: 10.1097/00130832-200502000-00011.
Thomson N.C., Spears M. The influence of smoking on the treatment response in patients with asthma. Curr. Opin. Allergy Clin. Immunol. 2005; 5 (1): 57–63. DОI: 10.1097/00130832-200502000-00011.
7. Boulet L.P., FitzGerald J.M., McIvor R.A., Zimmerman S., Chapman K.R. Influence of current or former smoking on asthma management and control. Can. Respir. J. 2008; 15 (5): 275–279. DОI: 10.1155/2008/725074.
8. Перельман Н.Л. Влияние табакокурения на связанное со здоровьем качество жизни у больных бронхиальной астмой. Бюллетень физиологии и патологии дыхания. 2014; 53: 30–35.
9. Juusela M., Pallasaho P., Rönmark E., Sarna S., Sovijürvi A., Lundbück B. Dose-dependent association of smoking and bronchial hyperresponsiveness. Eur. Respir. J. 2013; 42: 1503–1512. DОI: 10.1183/09031936.00073712.
DОI: 10.1183/09031936.00073712.
10. Пирогов А.Б., Приходько А.Г., Перельман Ю.М., Çиновьев С.В. Влияние нейтрофильного компонента бронхиального воспаления на уровень контроля болезни и функцию внешнего дыхания у больных бронхиальной астмой. Бюллетень физиологии и патологии дыхания. 2016; 61: 16–24. DOI: 10.12737/21434.
11. Пирогов А.Б., Колосов В.П., Перельман Ю.М., Приходько А.Г., Çиновьев С.В., Гассан Д.А., Мальцева Т.А. Особенности воспалительных паттернов бронхов и клинико-функциональная характеристика тяжелой неконтролируемой астмы у больных с холодовой гиперреактивностью дыхательных путей. Пульмонология. 2016; 26 (6): 701–707. DОI: 0.18093/086901892016266701707.
12. Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention (Updated 2016).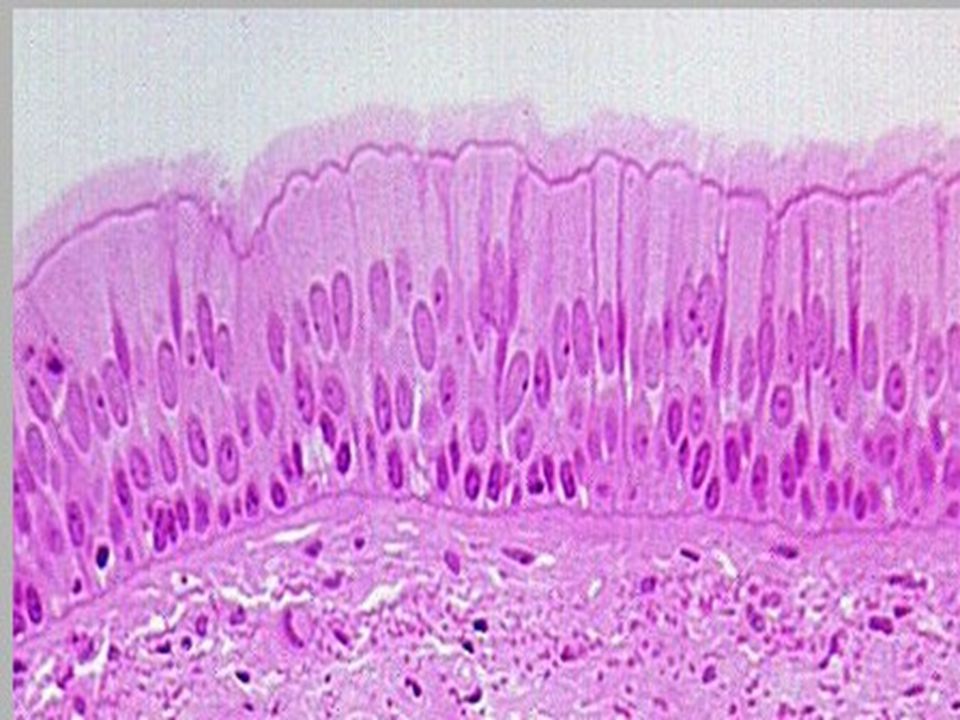 URL: http://www.ginasthma.com.
URL: http://www.ginasthma.com.
13. Приходько А.Г., Перельман Ю.М., Колосов В.П. Гиперреактивность дыхательных путей. Владивосток: Дальнаука, 2011: 204.
14. Bakakos P., Schleich F., Alchanatis M., Louis R. Induced sputum in asthma: From bench to bedside. Curr. Med. Chem. 2011; 18 (10): 1415–1422. DOI: 10.2174/092986711795328337.
15. Матвеева Л.А. Местная защита респираторного тракта у детей. Томск: Издательство Томского унта, 1993: 276.
16. Хейхоу Ф.Г.Дж., Кваглино Д. Гематологическая цито-химия; пер. с англ.; под ред. Н.С. Кисляк. М.: Медицина, 1983: 319.
17. Медицинские лабораторные технологии: руководство по клинической лабораторной диагностике в 2 т.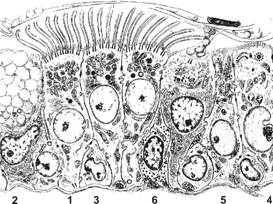 ; под ред. А.И. Карпищенко; 3-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2012: 472.
; под ред. А.И. Карпищенко; 3-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2012: 472.
18. Соодаева С.К., Климанов И.А. Нарушения окислительного метаболизма при заболеваниях респираторного тракта и современные подходы к антиоксидантной терапии. Атмосфера. Пульмонология и аллергология. 2009; 1: 34–38.
19. Соодаева С.К. Свободнорадикальные механизмы повреждения при болезнях органов дыхания. Пульмонология. 2012; 1: 5–10. DOI: 10.18093/0869-0189-2012-0-1-5-10.
20. Jin Y.S., Park K.K., Park J.Y., Kim M.J., Lee W.L., im H.Y., Lee H. J., Park E.K. Effects of exercise induced oxidative stress and antioxidant supplementation on NF-kB activation in peripheral mononuclear cells. Korean J. Sports Med. 2000; 18 (2): 261–270.
21. Васильева Г.И., Иванова И.А., Тюкавкина С.Ю. Кооперативное взаимодействие моно- и полинуклеарных фагоцитов, опосредованное моно- и нейтрофилокинами. Иммунология. 2000; 5: 11–17.
Васильева Г.И., Иванова И.А., Тюкавкина С.Ю. Кооперативное взаимодействие моно- и полинуклеарных фагоцитов, опосредованное моно- и нейтрофилокинами. Иммунология. 2000; 5: 11–17.
22. Kuwano K. Epithelial cell apoptosis and lung remodeling. Cell. Mol. Immunol. 2007; 4 (6): 419–429.
23. Конищева А.Ю., Гервазиева В.Б., Лаврентьева Е.Е. Особенности структуры и функции респираторного эпителия при бронхиальной астме. Пульмонология. 2012; 5: 85–91. DOI: 10.18093/0869-0189-2012-0-5-85-91.
24. Панасенко О.М., Сергиенко В.И. Галогенирующий стресс и его биомаркеры. Вестник Российской АМН. 2010; 1: 27–39.
25. Wood L.G., Baines K.I., Fu J. Scott H.A., Gibson P.G. The neutrophilic inflammatory phenotype is associated with systemic inflammation in asthma.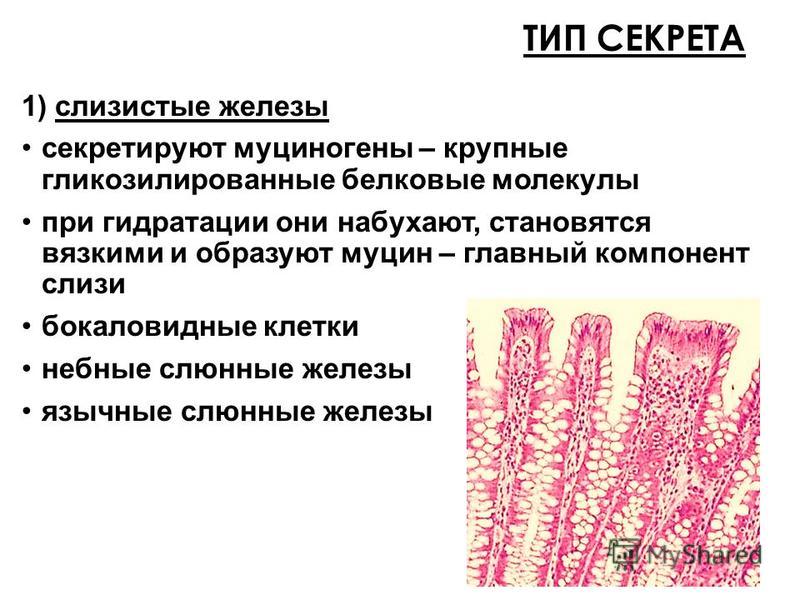 Chest. 2012; 142 (1): 86–93. DOI: 10.1378/chest.11-1838.
Chest. 2012; 142 (1): 86–93. DOI: 10.1378/chest.11-1838.
26. Pirogov A.B., Zinov’ev S.V., Perelman J.M., Prikhodko A.G., Kolosov V.P. Destructive-cytolytic activity of bronchial epithelium and its influence on the development of cold airway hyperresponsiveness in patients with asthma. Respirology. 2017; 22 (3): 172.
27. Нolgate S.T. Epithelium dysfunction in asthma. J. Allergy Clin. Immunol. 2007; 120 (6): 1233–1244. DOI: 10.1016/j.jaci.2007.10.025.
бокаловидных клеток
Кубковидные клетки
Талант бокаловидных клеток заключается в выделении слизи, вязкой жидкости, состоящей в основном из сильно гликозилированных белков, называемых муцинами, взвешенными в растворе электролитов. Слизь выполняет множество функций, включая защиту от напряжения сдвига и химического повреждения, и, особенно в респираторном дереве, улавливание и удаление твердых частиц и микроорганизмов.
Распространение и морфология
Бокаловидные клетки разбросаны среди других клеток в эпителии многих органов, особенно в кишечнике и дыхательных путях.В некоторых областях их количество относительно невелико по сравнению с другими типами клеток, тогда как в тканях, таких как толстая кишка, их гораздо больше.
На изображении ниже изображена ворсинка в тонком кишечнике мыши. Срез окрашивали методом периодической кислоты-Шиффа, при котором гликопротеины, в том числе муцины, окрашиваются в ярко-фиолетовый цвет.
Подавляющее большинство клеток, покрывающих ворсинки, представляют собой абсорбирующие эпителиальные клетки, но несколько бокаловидных клеток отчетливо видны. Похожая ситуация наблюдается в эпителии бронхов и трахеи.
Название бокаловидная клетка происходит от характерной формы этих клеток в традиционно фиксированных тканях: узкое основание и расширенная апикальная часть, которая иногда простирается в просвет. Эта морфология, как видно справа на срезе тонкого кишечника кошки (окрашивание гематоксилином и эозином), как известно, является артефактом фиксации, при котором слизистые гранулы в апикальной части клетки расширяются, вызывая раздувание клетки.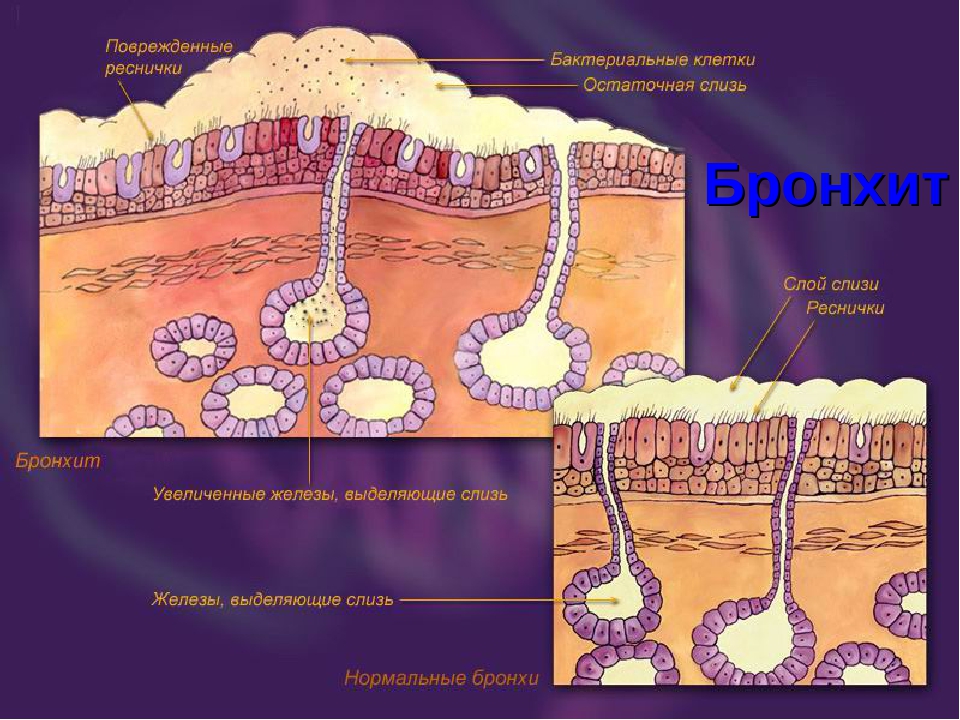 Если при фиксации приняты особые меры предосторожности, бокаловидные клетки выглядят как цилиндрические.
Если при фиксации приняты особые меры предосторожности, бокаловидные клетки выглядят как цилиндрические.
Независимо от фиксации бокаловидные клетки имеют отчетливо поляризованную морфологию.Их ядро находится в основании клетки вместе с такими органеллами, как митохондрии, эндоплазматический ретикулум и Гольджи. Остальная часть клетки заполнена мембраносвязанными секреторными гранулами, наполненными слизью.
Выделение слизи
Секреция слизи бокаловидными клетками вызывается в первую очередь раздражающими раздражителями, а не реакцией на гормоны. Просвет кишечного тракта неизбежно содержит многочисленные раздражители, а в легких такие вещества, как пыль и дым, являются мощными индукторами секреции бокаловидных клеток.
Выделение слизи путем экзоцитоза секреторных гранул. Интересно, что у бокаловидных клеток есть два пути секреции:
- Конститутивная или базальная секреция : низкий уровень, нерегулируемая и по существу непрерывная секреция.
 Этот путь зависит от цитоскелетного движения секреторных гранул.
Этот путь зависит от цитоскелетного движения секреторных гранул. - Стимулированная секреция : регулируемый экзоцитоз гранул в ответ на внеклеточные стимулы. Этот путь обеспечивает способность резко увеличивать секрецию слизи
Слизь в гранулах бокаловидных клеток конденсируется, но при секреции резко и почти мгновенно увеличивается в объеме (представьте баллончик с пеной для бритья или взбитыми сливками под давлением). В некоторых исследованных системах объем муцинового геля увеличивается в 500 раз за период всего 20 миллисекунд!
Механизм, предлагаемый для такого быстрого увеличения объема, заключается в следующем. Муцины покрыты обильными отрицательными (полианионными) зарядами, которые в секреторных гранулах маскируются или «нейтрализуются» ионами кальция. Во время экзоцитоза поры мембраны открываются за пределы клетки, позволяя кальцию диффундировать. Это приводит к чрезвычайно быстрому фазовому изменению, основанному на отталкивании полианионных зарядов и гидратации, что приводит к расширению муцинового геля.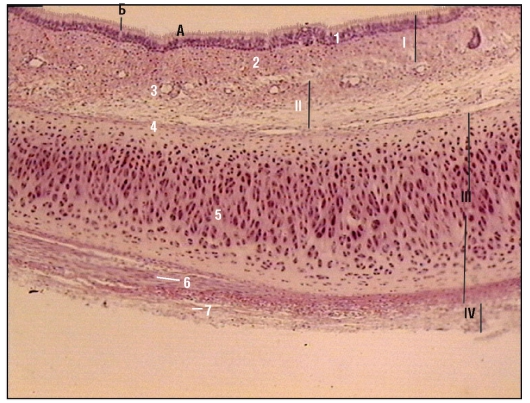
Патофизиология
Бокаловидные клетки обладают способностью дифференцироваться в клетки других типов. Хорошо изученный пример этого находится в дыхательных путях, где бокаловидные клетки, по-видимому, являются предшественниками мерцательных эпителиальных клеток.
Повышенное количество бокаловидных клеток наблюдается при нескольких болезненных состояниях. Хронический брохит и кистозный фиброз являются примерами заболеваний, при которых возникает гиперплазия бокаловидных клеток или метаплазия.
Ссылки и обзоры
- Rogers DF: бокаловидные клетки дыхательных путей: отзывчивые и адаптируемые передовые защитники.Europ Respiratory J 7: 1690, 1997. .
- Specian RD, Оливер MG: Функциональная биология бокаловидных клеток кишечника. Am J Physiol 260: C183, 1991.
- Verdugo P: Секреция и мукогенез бокаловидных клеток. Энн Рев Физиол 52: 157, 1990.
Отправляйте комментарии [email protected]
Бронхиальный эпителий — обзор
AIRWAY EPITHELIUM
Бронхиальный эпителий представляет собой сложную структуру, состоящую из бокаловидных, реснитчатых и базальных клеток (рис.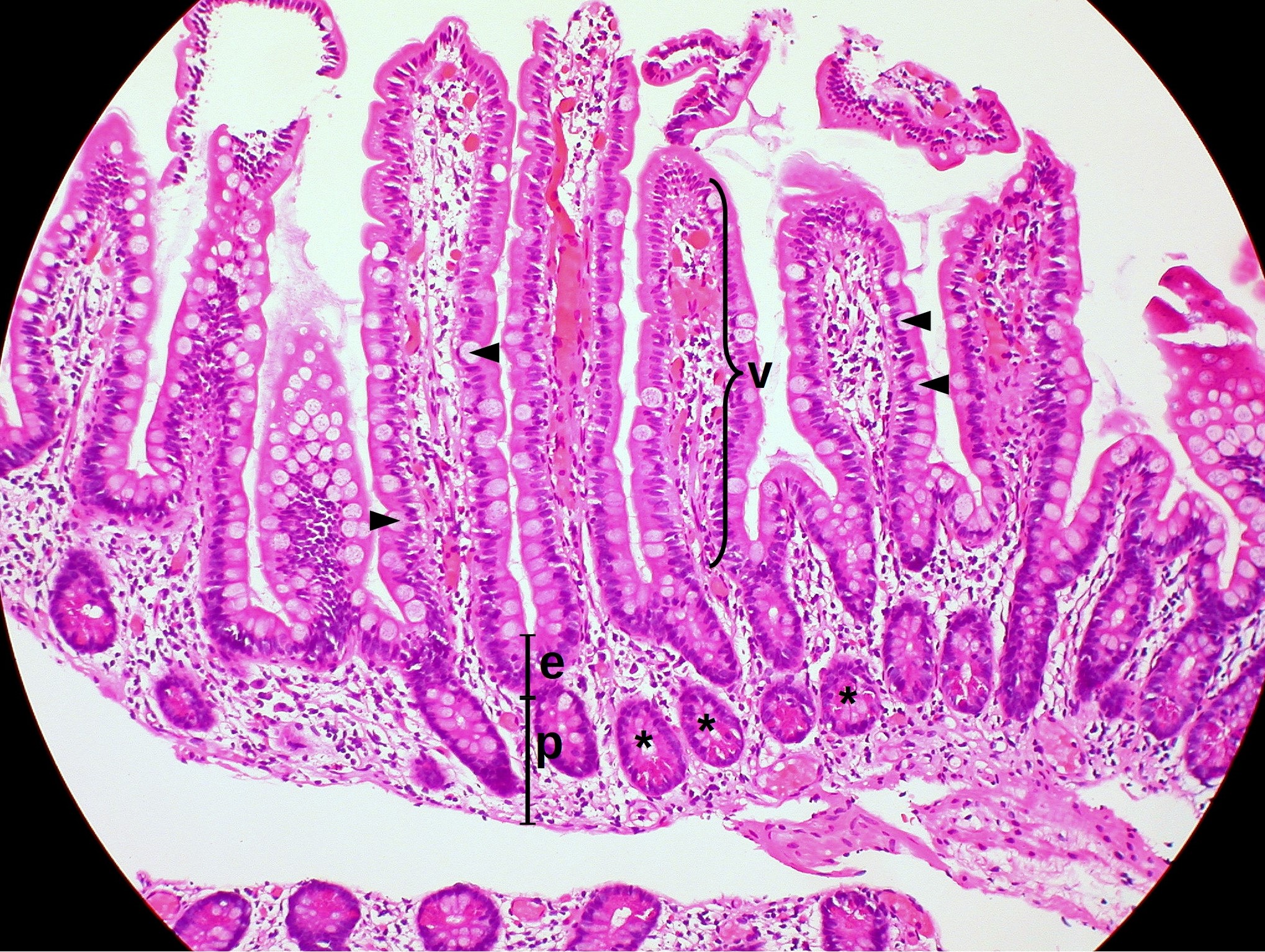 3-4). При эндобронхиальной биопсии эпителий дыхательных путей кажется хрупким, что подтверждается частично или полностью обнаженными участками. В бронхоальвеолярном лаваже астматиков увеличивается количество эпителиальных клеток, что отражает возможность десквамации эпителия в просвете дыхательных путей. Некоторые авторы предположили, что это нарушение эпителия может быть связано с артефактом отбора проб, но текущие данные предполагают, что имеется повышенная хрупкость эпителия. Эта потеря механического и биохимического динамического барьера может привести к последующей активации подслизистых клеток, называемой аномальной эпителиальной мезенхимальной единицей.
3-4). При эндобронхиальной биопсии эпителий дыхательных путей кажется хрупким, что подтверждается частично или полностью обнаженными участками. В бронхоальвеолярном лаваже астматиков увеличивается количество эпителиальных клеток, что отражает возможность десквамации эпителия в просвете дыхательных путей. Некоторые авторы предположили, что это нарушение эпителия может быть связано с артефактом отбора проб, но текущие данные предполагают, что имеется повышенная хрупкость эпителия. Эта потеря механического и биохимического динамического барьера может привести к последующей активации подслизистых клеток, называемой аномальной эпителиальной мезенхимальной единицей.
Механизмы, лежащие в основе хрупкости эпителия при астме, все еще остаются предметом дискуссий. Экссудация плазмы может способствовать отслоению эпителия от подслизистой оболочки. Прямое действие провоспалительных медиаторов, таких как металлопротеиназы (MMP) или фактор некроза опухоли (TNF) -α, может вызывать гибель клеток в результате некроза. Повреждение эпителия может привести к повышенной чувствительности дыхательных путей из-за истощения релаксантных факторов и потери ферментов, разрушающих провоспалительные нейропептиды (например, вещества P).Целостность эпителия дыхательных путей может влиять на чувствительность дыхательных путей к провокационным стимулам за счет высвобождения различных бронхоактивных медиаторов, таких как продукты, производные от липоксигеназы и циклооксигеназы.
Повреждение эпителия может привести к повышенной чувствительности дыхательных путей из-за истощения релаксантных факторов и потери ферментов, разрушающих провоспалительные нейропептиды (например, вещества P).Целостность эпителия дыхательных путей может влиять на чувствительность дыхательных путей к провокационным стимулам за счет высвобождения различных бронхоактивных медиаторов, таких как продукты, производные от липоксигеназы и циклооксигеназы.
Эпителиальные клетки признаны ключевыми участниками воспалительного процесса, вырабатывая провоспалительные продукты, включая цитокины и протеазы, и экспрессируя различные молекулы адгезии. Различные триггеры, включая аллергены, загрязнители и микроорганизмы, могут активировать эпителиальные клетки.Эпителиальные клетки могут генерировать воспалительные сигналы, которые способны активировать различные структурные и воспалительные клетки. Эти сигналы могут затем увеличить рекрутирование лейкоцитов из крови и обеспечить более длительное выживание воспалительных клеток в бронхах за счет изменения апоптоза клеток. Эпителиальные клетки бронхов могут поддерживать активацию, о чем свидетельствует избыточная экспрессия факторов транскрипции, таких как ядерный фактор каппа B (NFκB), что приводит к постоянному состоянию воспаления в структурах бронхов.
Эпителиальные клетки бронхов могут поддерживать активацию, о чем свидетельствует избыточная экспрессия факторов транскрипции, таких как ядерный фактор каппа B (NFκB), что приводит к постоянному состоянию воспаления в структурах бронхов.
В астматическом бронхиальном эпителии присутствуют как восстановительные, так и воспалительные процессы. Количество бокаловидных клеток в эпителии дыхательных путей увеличивается при астме. Гиперсекреция — частая эндоскопическая находка в дыхательных путях при астме, связанная с избыточным выделением слизи. С другой стороны, клиренс слизи изменяется, что способствует чрезмерному накоплению слизи, что приводит к обструкции дыхательных путей. Частично это может быть связано с уменьшением количества ресничек или другим секреторным фенотипом с увеличением бокаловидных клеток и / или снижением жизнеспособности ресничек.Муцины и многие другие продукты не регулируются и вносят свой вклад в фенотипические модификации бронхов при астме. Фактически, гиперплазия бокаловидных клеток может быть следствием активации эпителиальных клеток посредством активации генов муцина (MUC5AC).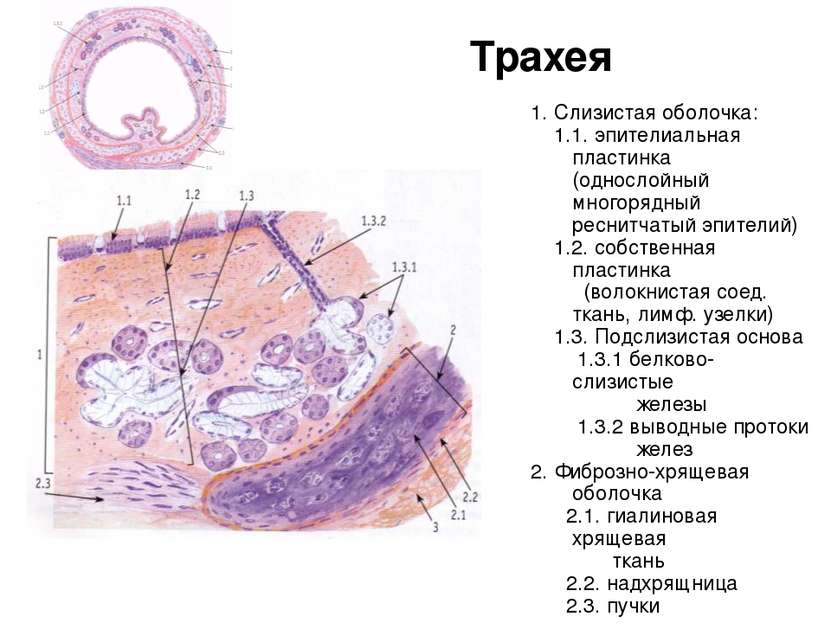 Различные цитокины, происходящие из эпителия, такие как IL-4 и IL-13, могут способствовать гиперплазии бокаловидных клеток, как показано на животных (in vivo) и клеточных (ex vivo) моделях.
Различные цитокины, происходящие из эпителия, такие как IL-4 и IL-13, могут способствовать гиперплазии бокаловидных клеток, как показано на животных (in vivo) и клеточных (ex vivo) моделях.
Эпителиальные клетки высвобождают различные медиаторы, участвующие в регенерации, пролиферации и дифференцировке.Активированные эпителиальные клетки участвуют в каждой стадии воспалительной реакции посредством высвобождения медиаторов, включая липидные провоспалительные молекулы, такие как лейкотриены, простагландины и цитокины. Эпителиальные клетки также участвуют в рекрутинге и активации лейкоцитов, высвобождении компонентов внеклеточного матрикса и факторов роста и экспрессии молекул адгезии, способствующих межклеточным взаимодействиям.
Эпителиальные клетки находятся на границе между воздушным пространством и внутренней средой.Они действуют как физический и биохимический барьер, чтобы обеспечить лучший переход между компартментами. Многие стимулы активируют эпителиальные клетки, включая вредные агенты, инфекции (вирусы, бактерии или грибки), аллергены у пациентов с атопией, загрязнители воздуха, такие как частицы дизельного топлива или озон, и сигаретный дым.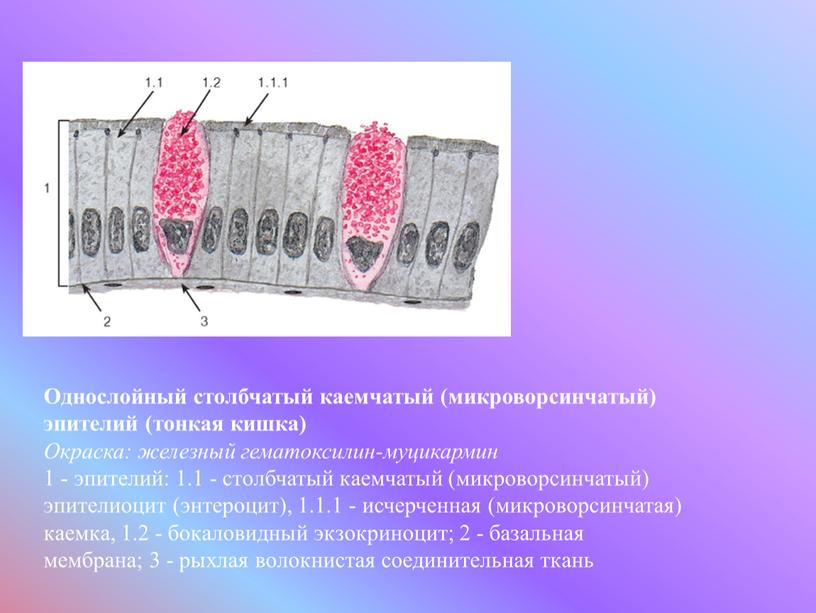 После активации эти эпителиальные клетки производят множество медиаторов, таких как цитокины, факторы роста, воспалительные и противовоспалительные продукты, хемокины и другие. Посредством этих медиаторов эпителиальные клетки обеспечивают адаптивный ответ, который важен для нейтрализации, удаления антигена и заживления ран в случае повреждения.В некоторых случаях стимулы могут давать достаточно интенсивный сигнал, чтобы вызвать системный ответ.
После активации эти эпителиальные клетки производят множество медиаторов, таких как цитокины, факторы роста, воспалительные и противовоспалительные продукты, хемокины и другие. Посредством этих медиаторов эпителиальные клетки обеспечивают адаптивный ответ, который важен для нейтрализации, удаления антигена и заживления ран в случае повреждения.В некоторых случаях стимулы могут давать достаточно интенсивный сигнал, чтобы вызвать системный ответ.
Когда хроническая стимуляция эпителиальных клеток сохраняется и местный ответ недостаточен, эти клетки могут вызывать провоспалительный ответ, рекрутируя лейкоциты и способствуя взаимодействию со структурными клетками, а также профибротический ответ, ведущий к ремоделированию дыхательных путей. Подслизистые фибробласты и миофибробласты способны синтезировать большое количество компонентов внеклеточного матрикса. Отслаивание эпителия можно рассматривать как проявление неудачного ускоренного процесса восстановления.Активированные эпителиальные клетки могут нести ответственность за собственное шелушение, индуцируя металлопротеазы и разрушая мосты между клеткой и матрицей. Индукция активации эпителиальных клеток через специфические или неспецифические рецепторы обычно сигнализирует о последующих событиях, таких как NFκB, AP1, а также сигнальный преобразователь и активатор транскрипционных путей (STAT). Таким образом, активация этой эпителиально-мезенхимальной трофической единицы была предложена в качестве потенциального механизма чрезмерной физиологической реакции, характерной для астмы.
Индукция активации эпителиальных клеток через специфические или неспецифические рецепторы обычно сигнализирует о последующих событиях, таких как NFκB, AP1, а также сигнальный преобразователь и активатор транскрипционных путей (STAT). Таким образом, активация этой эпителиально-мезенхимальной трофической единицы была предложена в качестве потенциального механизма чрезмерной физиологической реакции, характерной для астмы.
Гиперплазия бокаловидных клеток требует высокого транспорта бикарбоната для поддержки высвобождения муцина
Модуляция ионного транспорта с помощью IL-4
Для нашего исследования мы использовали клетки бронхиального эпителия от двух человек, BE37 и BE63, которым потребовалась трансплантация легких из-за легочной гипертензии и идиопатический фиброз легких, соответственно. Мы выбрали эти клетки как наиболее близкие к здоровым контрольным клеткам. Действительно, эти два заболевания поражают дистальную часть легких и не повреждают эпителий главных бронхов. Мы измерили трансэпителиальные свойства переноса ионов в клетках, обработанных IL-4 (10 нг / мл) в течение 24 и 72 часов. На рис. 1 показаны данные, полученные в результате экспериментов с током короткого замыкания на хорошо дифференцированном бронхиальном эпителии (клетки, нанесенные на пористую мембрану и выдержанные в условиях воздух-жидкость в течение трех недель). После блокирования абсорбции Na + амилоридом (не показано) клетки стимулировали CPT-cAMP для индукции фосфорилирования и, следовательно, активации CFTR (фиг. 1A). Результирующий ток был сильно чувствителен к CFTR inh -172, сильному и селективному ингибитору CFTR.В присутствии этого ингибитора апикальное приложение UTP генерировало очень быстрое увеличение тока, которое достигало максимума за несколько секунд, а затем снижалось до уровней до стимуляции через 10-20 минут (рис. 1B). Действие UTP опосредуется внутриклеточной мобилизацией Ca 2+ , что приводит к временной активации TMEM16A Cl — каналы ( 15 ).
Мы измерили трансэпителиальные свойства переноса ионов в клетках, обработанных IL-4 (10 нг / мл) в течение 24 и 72 часов. На рис. 1 показаны данные, полученные в результате экспериментов с током короткого замыкания на хорошо дифференцированном бронхиальном эпителии (клетки, нанесенные на пористую мембрану и выдержанные в условиях воздух-жидкость в течение трех недель). После блокирования абсорбции Na + амилоридом (не показано) клетки стимулировали CPT-cAMP для индукции фосфорилирования и, следовательно, активации CFTR (фиг. 1A). Результирующий ток был сильно чувствителен к CFTR inh -172, сильному и селективному ингибитору CFTR.В присутствии этого ингибитора апикальное приложение UTP генерировало очень быстрое увеличение тока, которое достигало максимума за несколько секунд, а затем снижалось до уровней до стимуляции через 10-20 минут (рис. 1B). Действие UTP опосредуется внутриклеточной мобилизацией Ca 2+ , что приводит к временной активации TMEM16A Cl — каналы ( 15 ).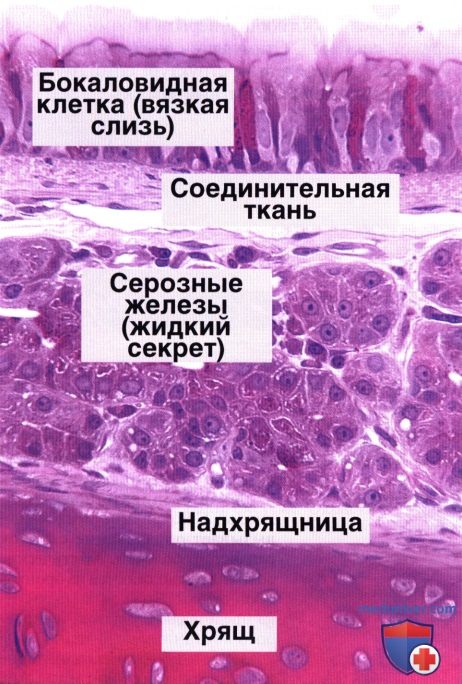
Повышающая регуляция функции CFTR и TMEM16A с помощью IL-4.
( A, B ) Репрезентативные кривые (слева) и гистограммы (справа), показывающие CFTR- и TMEM16A / CaCC-зависимые токи, измеренные методом тока короткого замыкания в эпителиальных клетках бронхов человека, находящихся в контрольных условиях или инкубированных в течение 24 или 72 часа с IL-4 (10 нг / мл).Токи CFTR сначала активировали CPT-cAMP (100 мкМ), а затем блокировали CFTR inh -172 (10 мкМ). Вместо этого токи TMEM16A / CaCC активировали 100 мкМ UTP (в присутствии ингибитора CFTR). Гистограммы показывают величину падения тока, вызванного CFTR inh -172 ( A ), или максимальную амплитуду тока, вызванного UTP ( B ). Данные представляют собой среднее ± среднеквадратическое значение 13–21 экспериментов (клетки BE37 и BE63). *** p <0,001 по сравнению с контролем. # р <0.05 против Ил-4 в течение 24 часов. ( C ) Обнаружение белков TMEM16A и CFTR иммунофлуоресценцией (слева) и вестерн-блоттингом (справа)./90-2.jpg) Клетки обрабатывали IL-4 и без него в течение 72 часов. Иммунофлуоресцентные изображения показывают срезы xy (вверху; масштабная линейка 20 мкм) или xz (внизу; масштабная шкала 10 мкм). При вестерн-блоттинге Na + / K + -АТФаза β1 и GAPDH также были выявлены в качестве контроля. Как и ожидалось, антитело C464.8 против Na + / K + -АТФаза β1 выявило две полосы.Результаты вестерн-блоттинга для CFTR и TMEM16A представлены в виде обрезанных изображений. Полноразмерные изображения показаны на дополнительном рисунке 1. ( D ) Записи короткого замыкания (слева) и иммунофлуоресценции (справа) от бронхиальных эпителиальных клеток, полученных от пациентов с МВ F508del / F508del. Токи CFTR значительно увеличиваются при лечении IL-4 (n = 15–16; p <0,001; клетки BE43, BE49 и BE91). Экспрессия TMEM16A и CFTR, обнаруженная с помощью иммунофлуоресценции (шкала 30 мкм), увеличивается под действием IL-4 также в клетках CF.Небольшое изображение представляет собой увеличение клеток, обработанных IL-4, чтобы более подробно показать локализацию CFTR.
Клетки обрабатывали IL-4 и без него в течение 72 часов. Иммунофлуоресцентные изображения показывают срезы xy (вверху; масштабная линейка 20 мкм) или xz (внизу; масштабная шкала 10 мкм). При вестерн-блоттинге Na + / K + -АТФаза β1 и GAPDH также были выявлены в качестве контроля. Как и ожидалось, антитело C464.8 против Na + / K + -АТФаза β1 выявило две полосы.Результаты вестерн-блоттинга для CFTR и TMEM16A представлены в виде обрезанных изображений. Полноразмерные изображения показаны на дополнительном рисунке 1. ( D ) Записи короткого замыкания (слева) и иммунофлуоресценции (справа) от бронхиальных эпителиальных клеток, полученных от пациентов с МВ F508del / F508del. Токи CFTR значительно увеличиваются при лечении IL-4 (n = 15–16; p <0,001; клетки BE43, BE49 и BE91). Экспрессия TMEM16A и CFTR, обнаруженная с помощью иммунофлуоресценции (шкала 30 мкм), увеличивается под действием IL-4 также в клетках CF.Небольшое изображение представляет собой увеличение клеток, обработанных IL-4, чтобы более подробно показать локализацию CFTR.
Обработка IL-4 способствовала заметному увеличению секреции cAMP- и Ca 2+ -активированного Cl —, на что указывает амплитуда токов, блокированных CFTR inh -172 (рис. 1A) или активируется UTP (рис. 1B) соответственно. Ток, зависящий от CFTR, увеличился в 2,6 раза через 24 часа и в 3,5 раза через 72 часа, причем эти два значения значительно различались (рис.1А). Вместо этого увеличение UTP-зависимого тока было по существу таким же (почти в 10 раз) при двухкратной обработке IL-4 (рис. 1B). Интересно отметить, что в клетках, получавших IL-4 в течение 72 часов, токи CFTR первоначально демонстрировали колебания, которые постепенно исчезали (рис. 1A).
Мы изучили уровень экспрессии белков CFTR и TMEM16A с помощью методов иммунофлуоресценции и вестерн-блоттинга (рис. 1С). С помощью конфокальной микроскопии мы обнаружили, что обработка IL-4 вызывает сильную активацию TMEM16A.Иммунофлуоресцентное обнаружение CFTR также выявило усиление сигнала, хотя и менее резкое, чем TMEM16A.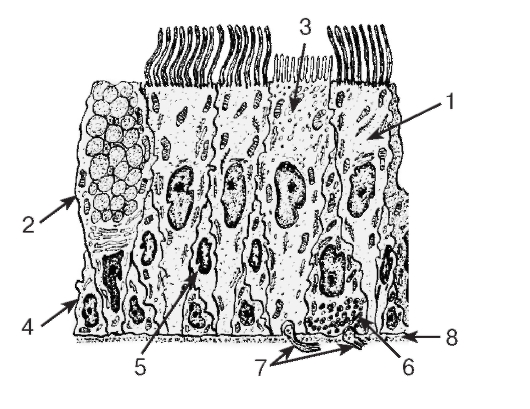 Оба белка, по-видимому, локализованы на апикальной стороне клеток, но, что важно, никогда в одной и той же клетке (Рис. 1C, слева). В соответствии с данными иммунофлуоресценции и функциональными данными, эксперименты вестерн-блоттинга показали, что белок TMEM16A сильно активируется IL-4 (рис. 1С, справа и дополнительный рис. 1). Напротив, степень экспрессии белка CFTR по данным вестерн-блоттинга, по-видимому, не была изменена цитокином.Мы отметили только небольшое изменение подвижности, которое могло отражать модификацию паттерна гликозилирования (рис. 1С, справа). Мы количественно определили уровни мРНК с помощью ОТ-ПЦР в реальном времени. МРНК CFTR не изменялась IL-4, тогда как мРНК TMEM16A повышалась в 7 раз.
Оба белка, по-видимому, локализованы на апикальной стороне клеток, но, что важно, никогда в одной и той же клетке (Рис. 1C, слева). В соответствии с данными иммунофлуоресценции и функциональными данными, эксперименты вестерн-блоттинга показали, что белок TMEM16A сильно активируется IL-4 (рис. 1С, справа и дополнительный рис. 1). Напротив, степень экспрессии белка CFTR по данным вестерн-блоттинга, по-видимому, не была изменена цитокином.Мы отметили только небольшое изменение подвижности, которое могло отражать модификацию паттерна гликозилирования (рис. 1С, справа). Мы количественно определили уровни мРНК с помощью ОТ-ПЦР в реальном времени. МРНК CFTR не изменялась IL-4, тогда как мРНК TMEM16A повышалась в 7 раз.
Для дальнейшего подтверждения вывода о том, что цАМФ-зависимый ток обусловлен CFTR, мы использовали клетки от пациентов с CF. В частности, мы использовали клетки пациентов, гомозиготных по мутации F508del, которая вызывает серьезный дефект в транспортировке белка CFTR и более чем 90% снижение функции CFTR.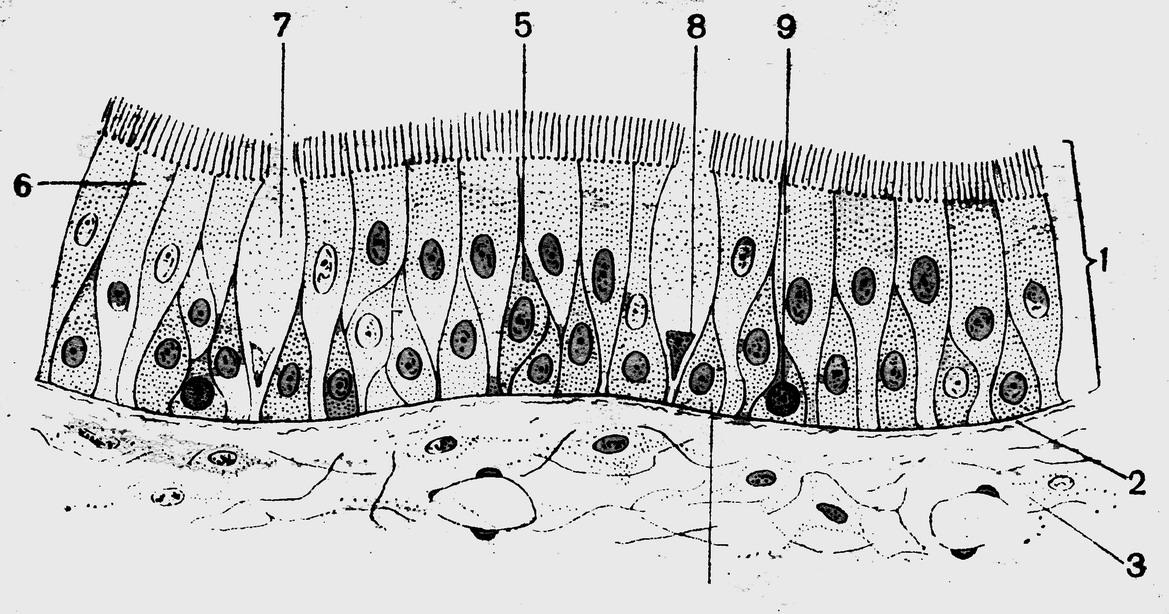 Как и ожидалось, цАМФ-зависимый ток был заметно снижен в клетках CF, в том числе обработанных IL-4 (рис. 1D). Однако мы отметили, что обработка IL-4 в течение 72 часов индуцировала почти трехкратное увеличение функции CFTR, эффект, пропорциональный эффекту IL-4 в клетках, не являющихся CF. Путем иммунофлуоресценции мы обнаружили, что IL-4 увеличивает экспрессию белка CFTR также в клетках CF (рис. 1D). Внимательное изучение микроскопических изображений показывает, что большая часть сигнала CFTR является внутриклеточной, учитывая перинуклеарный паттерн окрашивания (рис.1D, увеличенное изображение).
Как и ожидалось, цАМФ-зависимый ток был заметно снижен в клетках CF, в том числе обработанных IL-4 (рис. 1D). Однако мы отметили, что обработка IL-4 в течение 72 часов индуцировала почти трехкратное увеличение функции CFTR, эффект, пропорциональный эффекту IL-4 в клетках, не являющихся CF. Путем иммунофлуоресценции мы обнаружили, что IL-4 увеличивает экспрессию белка CFTR также в клетках CF (рис. 1D). Внимательное изучение микроскопических изображений показывает, что большая часть сигнала CFTR является внутриклеточной, учитывая перинуклеарный паттерн окрашивания (рис.1D, увеличенное изображение).
Повышающая регуляция ионных каналов и транспортеров с помощью IL-4
Для определения степени и динамики изменений экспрессии генов, вызванных IL-4, мы экстрагировали РНК из клеток, обработанных в различные моменты времени, от 6 до 72 часов. Учитывая сложность исследования, включающего четыре различных момента времени и три отдельных клеточных препарата, мы решили использовать клетки от одного человека, BE 37. Образцы РНК были проанализированы с помощью гибридизации микрочипов (рис.2; Номер доступа GEO: GSE78914). Нас особенно интересовала экспрессия генов, участвующих в трансэпителиальном переносе ионов. Как было показано нами ранее, IL-4 заметно увеличивает экспрессию хлоридного канала TMEM16A 15 и SLC26A4 (он же пендрин), электронейтрального анионита 16 . Новые данные показывают, что активация TMEM16A и пендрина уже выявляется через 6 часов и что экспрессия продолжает увеличиваться, хотя и с другим течением времени (рис.2). Пендрин имеет самую сильную экспрессию через 72 часа с 37-кратным увеличением (FDR <10 -6 ) по сравнению с необработанными клетками. Вместо этого экспрессия TMEM16A показывает пик через 24 часа (18-кратный, FDR <10 -4 ), за которым следует небольшое снижение через 72 часа. Важно отметить, что анализ микроматрицы выявил активацию других систем ионного транспорта. Некоторые гены показали относительно отсроченный ответ на IL-4 с особой гиперэкспрессией через 72 часа.
Образцы РНК были проанализированы с помощью гибридизации микрочипов (рис.2; Номер доступа GEO: GSE78914). Нас особенно интересовала экспрессия генов, участвующих в трансэпителиальном переносе ионов. Как было показано нами ранее, IL-4 заметно увеличивает экспрессию хлоридного канала TMEM16A 15 и SLC26A4 (он же пендрин), электронейтрального анионита 16 . Новые данные показывают, что активация TMEM16A и пендрина уже выявляется через 6 часов и что экспрессия продолжает увеличиваться, хотя и с другим течением времени (рис.2). Пендрин имеет самую сильную экспрессию через 72 часа с 37-кратным увеличением (FDR <10 -6 ) по сравнению с необработанными клетками. Вместо этого экспрессия TMEM16A показывает пик через 24 часа (18-кратный, FDR <10 -4 ), за которым следует небольшое снижение через 72 часа. Важно отметить, что анализ микроматрицы выявил активацию других систем ионного транспорта. Некоторые гены показали относительно отсроченный ответ на IL-4 с особой гиперэкспрессией через 72 часа.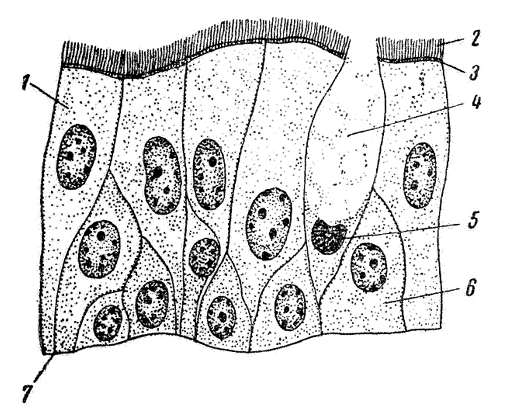 Это случай генов, кодирующих ATP12A, SLC31A1, KCNMB4 и SLC7A1 (рис.2). ATP12A — это внегастральная форма H + / K + -ATPase, ответственная за секрецию H + на апикальной мембране эпителиальных клеток 17 . SLC31A1 — это высокоаффинный переносчик меди. KCNMB4 служит β-субъединицей канала K + , активированного Ca 2+ с большой проводимостью. SLC7A1 является переносчиком катионных аминокислот с высоким сродством. Другие гены показали более быструю индукцию IL-4. Этот список включает гены, кодирующие: KCNJ16, pH-чувствительный канал K + 18 ; SLC39A8, бикарбонат-зависимый транспортер цинка и железа 19 ; SLC24A3, K + -зависимый обменник Na + / Ca 2+ 20 ; KCNK3, двухпоровый канал K + TASK-1, ингибируемый внеклеточной кислотой 21 ; SLC12A2, переносчик NKCC1 22 ; SLC6A14, ATB 0, + переносчик аминокислот 23 ; SLCO1B3, переносчик органических анионов.
Это случай генов, кодирующих ATP12A, SLC31A1, KCNMB4 и SLC7A1 (рис.2). ATP12A — это внегастральная форма H + / K + -ATPase, ответственная за секрецию H + на апикальной мембране эпителиальных клеток 17 . SLC31A1 — это высокоаффинный переносчик меди. KCNMB4 служит β-субъединицей канала K + , активированного Ca 2+ с большой проводимостью. SLC7A1 является переносчиком катионных аминокислот с высоким сродством. Другие гены показали более быструю индукцию IL-4. Этот список включает гены, кодирующие: KCNJ16, pH-чувствительный канал K + 18 ; SLC39A8, бикарбонат-зависимый транспортер цинка и железа 19 ; SLC24A3, K + -зависимый обменник Na + / Ca 2+ 20 ; KCNK3, двухпоровый канал K + TASK-1, ингибируемый внеклеточной кислотой 21 ; SLC12A2, переносчик NKCC1 22 ; SLC6A14, ATB 0, + переносчик аминокислот 23 ; SLCO1B3, переносчик органических анионов.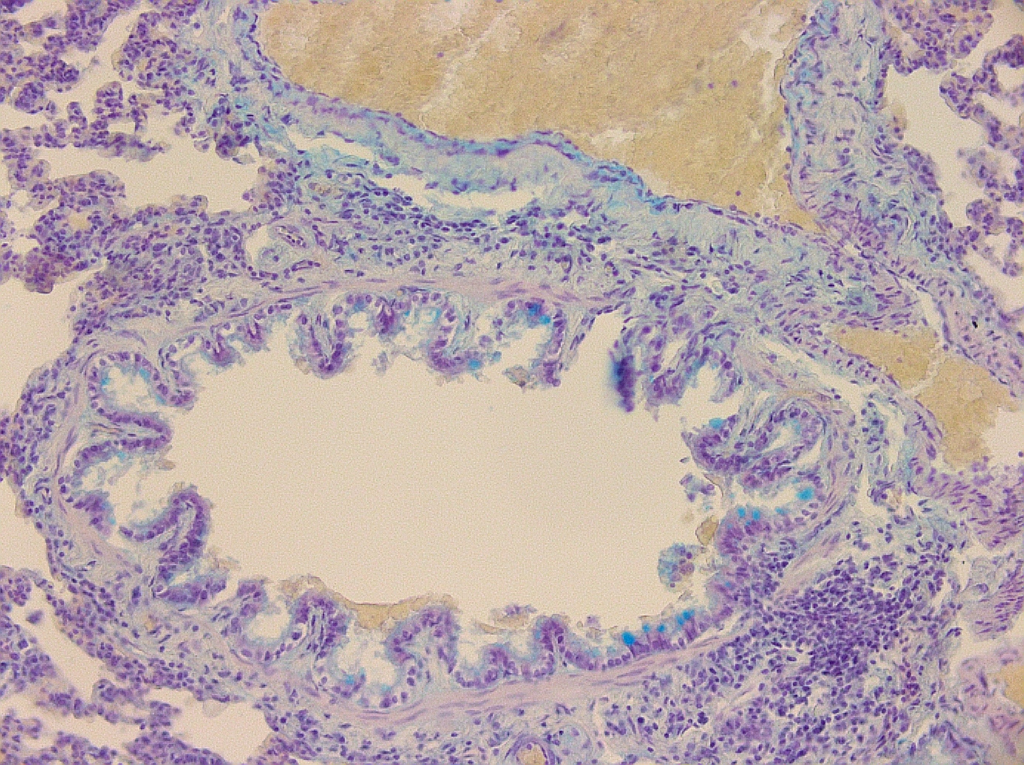 Важно отметить, что мы также отметили, что IL-4 сильно индуцировал экспрессию цитозольной карбоангидразы 2 (CA2) с более чем 20-кратной (FDR <10 -5 ) активацией уже через 6 часов (рис. 2). . Напротив, другая карбоангидраза, мембраносвязанная СА12, подавлялась. Более общий список из 200 основных генов, активируемых IL-4, доступен в дополнительных таблицах 1–4. Следует отметить, что в соответствии с данными ОТ-ПЦР в реальном времени, обработка IL-4 не влияла на экспрессию CFTR.
Важно отметить, что мы также отметили, что IL-4 сильно индуцировал экспрессию цитозольной карбоангидразы 2 (CA2) с более чем 20-кратной (FDR <10 -5 ) активацией уже через 6 часов (рис. 2). . Напротив, другая карбоангидраза, мембраносвязанная СА12, подавлялась. Более общий список из 200 основных генов, активируемых IL-4, доступен в дополнительных таблицах 1–4. Следует отметить, что в соответствии с данными ОТ-ПЦР в реальном времени, обработка IL-4 не влияла на экспрессию CFTR.
Повышающая регуляция экспрессии каналов и транспортеров с помощью IL-4.
Столбчатые диаграммы показывают относительное изменение экспрессии (ось y: отношение знаков, SR) указанных генов после обработки бронхиальных эпителиальных клеток IL-4 (10 нг / мл) в течение 6, 12, 24 и 72 часов. Данные были получены с помощью микроматричного анализа трех отдельных препаратов бронхиальных клеток (клетки BE37). Звездочки указывают на значительное увеличение экспрессии по сравнению с контрольными клетками (FDR <0.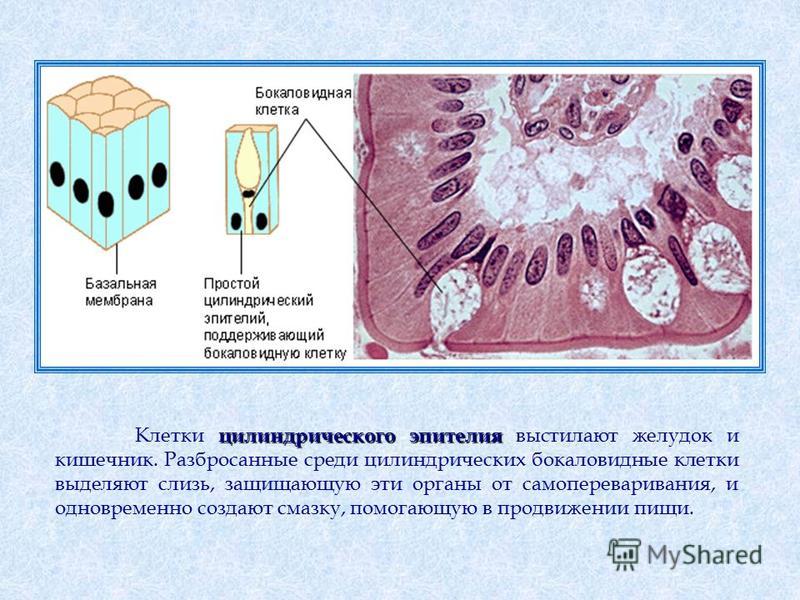 05; данные, включая соотношение со знаком и FDR, также представлены в дополнительных таблицах 1–4 для 200 наиболее активных генов).
05; данные, включая соотношение со знаком и FDR, также представлены в дополнительных таблицах 1–4 для 200 наиболее активных генов).
Путем иммунофлуоресценции мы исследовали экспрессию выбранных белков, положительная регуляция которых была подтверждена данными микроматрицы. Если позволяет совместимость первичных антител, мы также окрашивали клетки на ацетилированный тубулин или MUC5AC, маркеры мерцательных и бокаловидных клеток, соответственно. Подобно TMEM16A, белок SLC26A4 заметно активизировался IL-4 с локализацией в апикальной мембране (рис.3). Эти два белка показали совместную локализацию в некоторых клетках, но раздельную экспрессию во многих других. Иммунодетекция CA2 выявила сильную экспрессию, индуцированную IL-4, с преимущественной локализацией в MUC5AC-положительных клетках (фиг. 3). Интересно, что SLC12A2 и ATP12A показали более равномерное распределение: они сильно активировались IL-4 в большинстве клеток, хотя и с разной субклеточной локализацией (рис. 3). Как и ожидалось, SLC12A2 находился в базолатеральной мембране.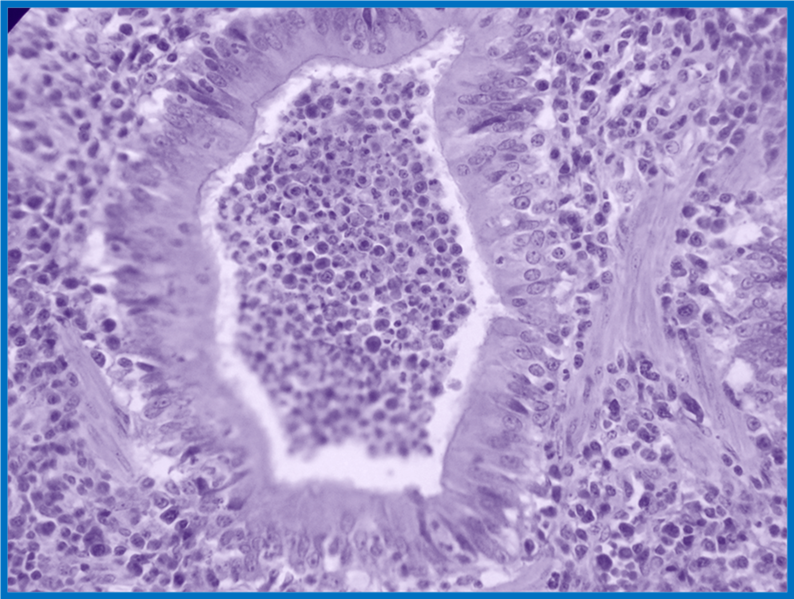 ATP12A появился в апикальной области, с более выраженной экспрессией в нереснитчатых клетках.Экспрессия TMEM16A, SLC26A4, CA2, SLC12A2 и ATP12A также показана на дополнительном рис. 2 в другом масштабе. Повышающая регуляция CA2 и SLC26A4 была также подтверждена вестерн-блоттингом (дополнительный рисунок 3).
ATP12A появился в апикальной области, с более выраженной экспрессией в нереснитчатых клетках.Экспрессия TMEM16A, SLC26A4, CA2, SLC12A2 и ATP12A также показана на дополнительном рис. 2 в другом масштабе. Повышающая регуляция CA2 и SLC26A4 была также подтверждена вестерн-блоттингом (дополнительный рисунок 3).
Иммунофлуоресцентное обнаружение белков, модулируемых IL-4.
Репрезентативные изображения с конфокальной микроскопии показывают степень экспрессии и субклеточную локализацию TMEM16A, SLC26A4, карбоангидразы 2 (CA2), SLC12A2 и ATP12A (изображения, полученные из клеток BE37; аналогичные результаты были получены для клеток BE63).Если позволяла комбинация первичных антител, ацетилированный тубулин и MUC5AC также окрашивались как маркеры мерцательных и бокаловидных клеток соответственно. Бронхиальный эпителий содержали в контрольных условиях или обрабатывали IL-4 в течение 72 часов. Увеличенные изображения: xy срезов (масштабная линейка: 20 мкм).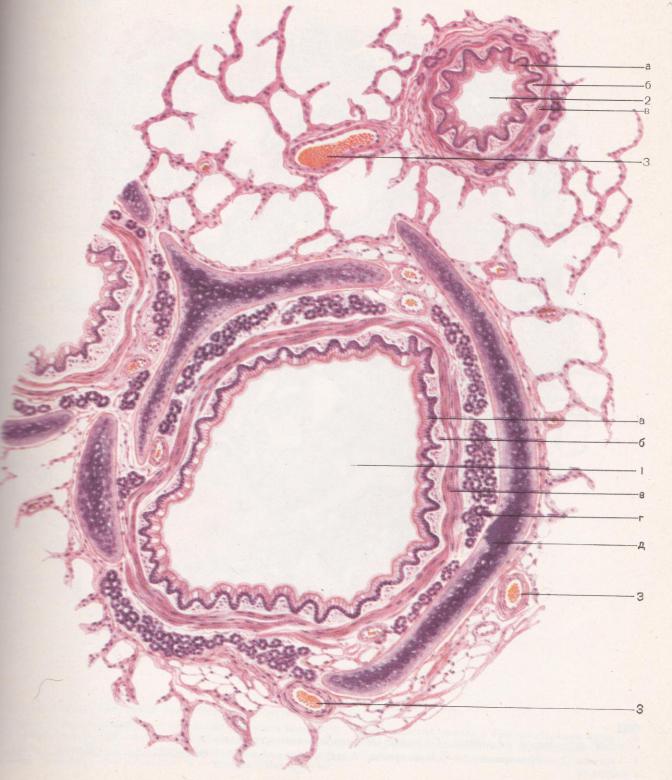 Вставка: xz секций (шкала: 10 мкм). Изображения с другим масштабом обзора показаны на дополнительном рисунке 2.
Вставка: xz секций (шкала: 10 мкм). Изображения с другим масштабом обзора показаны на дополнительном рисунке 2.
Транспорт бикарбоната в обработанном IL-4 эпителии
Как показал анализ микроматрицы, IL-4 стимулирует экспрессию нескольких белков, участвующих в транспорте анионов, что может приводить к усиленная секреция бикарбоната.Поэтому нас особенно интересовал вклад бикарбоната в токи, активируемые цАМФ и Ca 2+ . Соответственно, мы провели эксперименты в растворе, не содержащем Cl — , условие, которое использовалось для оценки чистого переноса бикарбоната 24 . В необработанных клетках отсутствие внеклеточного Cl — уменьшало цАМФ- и Ca 2+ -зависимые токи до 11% и 5%, соответственно (рис. 4A, C). Обработка клеток в течение 72 часов IL-4 изменила процент тока, остающегося после удаления Cl —, до 20% и 41% соответственно, что представляет собой почти двукратное и восьмикратное пропорциональное увеличение по сравнению с необработанными клетками (рис. 4Б, В). Учитывая переходное поведение тока, зависящего от Ca 2+ , мы также оценили его величину не как размер пика, а как площадь под кривой, AUC (рис. 4D). Используя этот параметр, UTP-активированный Cl —-независимый компонент оказался даже больше в обработанных интерлейкином клетках по сравнению с контрольными клетками (13% против 1% значений, измеренных в присутствии Cl —).
Эффект удаления внеклеточного Cl — .
( A, B ) Типичные записи тока короткого замыкания, показывающие токи CFTR и CaCC в клетках, находящихся в контрольных условиях ( A, ) или обработанных IL-4 в течение 72 часов ( B ).Обратите внимание на разные масштабные линейки. Эксперименты проводились в физиологическом растворе (вверху) или в отсутствие Cl — (внизу). ( C ) Гистограммы, отображающие данные CFTR (слева) и TMEM16A (справа) при различных условиях. Значения CFTR взяты из размера эффекта CFTR inh -172.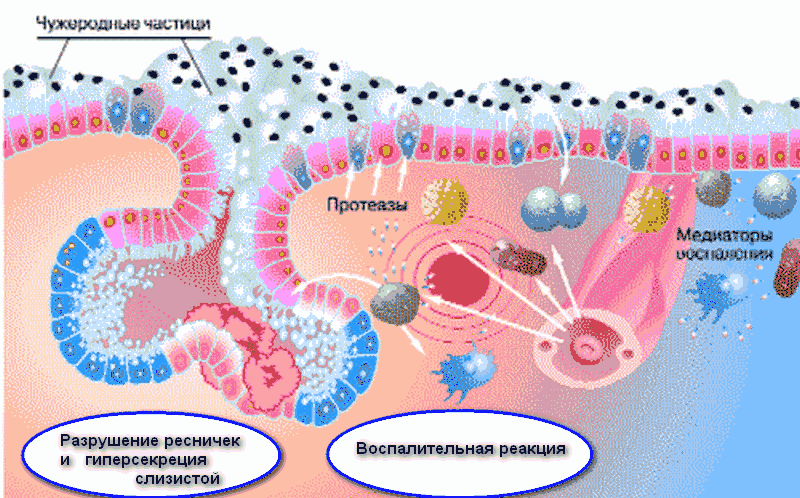 Значения CaCC представляют собой максимальный ток, индуцированный UTP. ( D ) Токи CaCC также количественно определяли как площадь под кривой (AUC) UTP-индуцированных ответов. ** p <0,01; *** р <0.001 в зависимости от токов с Cl — . ## p <0,01 по сравнению с клетками, не обработанными IL-4 (n = 6 на состояние; клетки BE37).
Значения CaCC представляют собой максимальный ток, индуцированный UTP. ( D ) Токи CaCC также количественно определяли как площадь под кривой (AUC) UTP-индуцированных ответов. ** p <0,01; *** р <0.001 в зависимости от токов с Cl — . ## p <0,01 по сравнению с клетками, не обработанными IL-4 (n = 6 на состояние; клетки BE37).
Для дальнейшего исследования изменений, вызываемых IL-4, мы использовали буметанид в качестве блокатора ко-транспортера NKCC1 и S0859 в качестве общего ингибитора базолатеральных транспортеров бикарбоната 25 . Сначала мы изучили ток, активируемый цАМФ. Как и ожидалось, учитывая роль NKCC1 в поддержании секреции Cl —, буметанид заметно снижает ток, активируемый цАМФ, в необработанных клетках (рис.5А). Последующее добавление CFTR inh -172 позволило оценить остаточный CFTR-зависимый компонент, остающийся после буметанида. Рассматривая относительные эффекты буметанида и CFTR inh -172, мы подсчитали, что ингибирование NKCC1 устраняет ~ 60% общей секреции, опосредованной CFTR (фиг.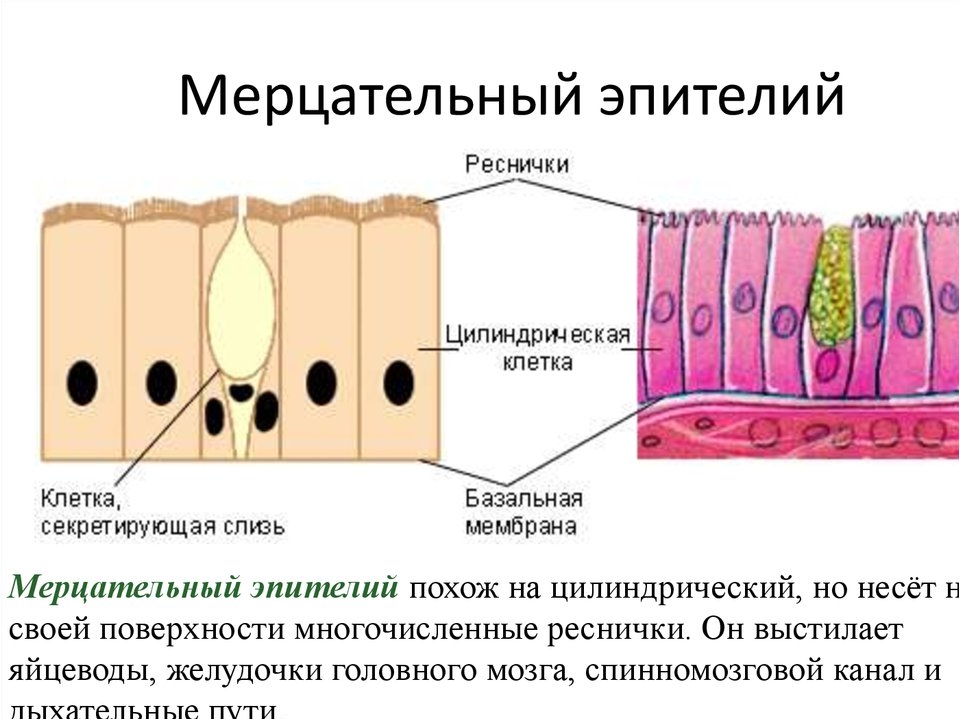 5A). В другой серии экспериментов мы добавляли S0859 после буметанида. Характерная кривая на рис. 5A показывает, что эффект S0859 состоял из небольшого переходного пика, за которым следовало умеренное уменьшение тока.Общее ингибирование, полученное с помощью S0859 плюс буметанид, было лишь немного выше, чем у одного буметанида (фиг. 5A). В клетках, обработанных IL-4 в течение 72 часов, относительные эффекты буметанида и S0859 были изменены. Ток, подавляемый буметанидом, был больше в абсолютном выражении, но процент подавления общего тока был значительно меньше (<40%) по сравнению с измеренным в необработанных клетках (фиг. 5A, B). Этот результат предполагает более высокий вклад других типов базолатеральных переносчиков анионов.В соответствии с этой интерпретацией, S0859, по-видимому, вызывает более выраженное ингибирование в клетках, обработанных IL-4 (фиг. 5B).
5A). В другой серии экспериментов мы добавляли S0859 после буметанида. Характерная кривая на рис. 5A показывает, что эффект S0859 состоял из небольшого переходного пика, за которым следовало умеренное уменьшение тока.Общее ингибирование, полученное с помощью S0859 плюс буметанид, было лишь немного выше, чем у одного буметанида (фиг. 5A). В клетках, обработанных IL-4 в течение 72 часов, относительные эффекты буметанида и S0859 были изменены. Ток, подавляемый буметанидом, был больше в абсолютном выражении, но процент подавления общего тока был значительно меньше (<40%) по сравнению с измеренным в необработанных клетках (фиг. 5A, B). Этот результат предполагает более высокий вклад других типов базолатеральных переносчиков анионов.В соответствии с этой интерпретацией, S0859, по-видимому, вызывает более выраженное ингибирование в клетках, обработанных IL-4 (фиг. 5B).
Влияние ингибиторов транспорта анионов.
( A, B ) Типичные записи тока короткого замыкания и столбчатые диаграммы, показывающие влияние буметанида и S0859 на CFTR-зависимые токи в клетках в контрольных условиях ( A, ) или обработанных IL-4 в течение 72 часов ( В ).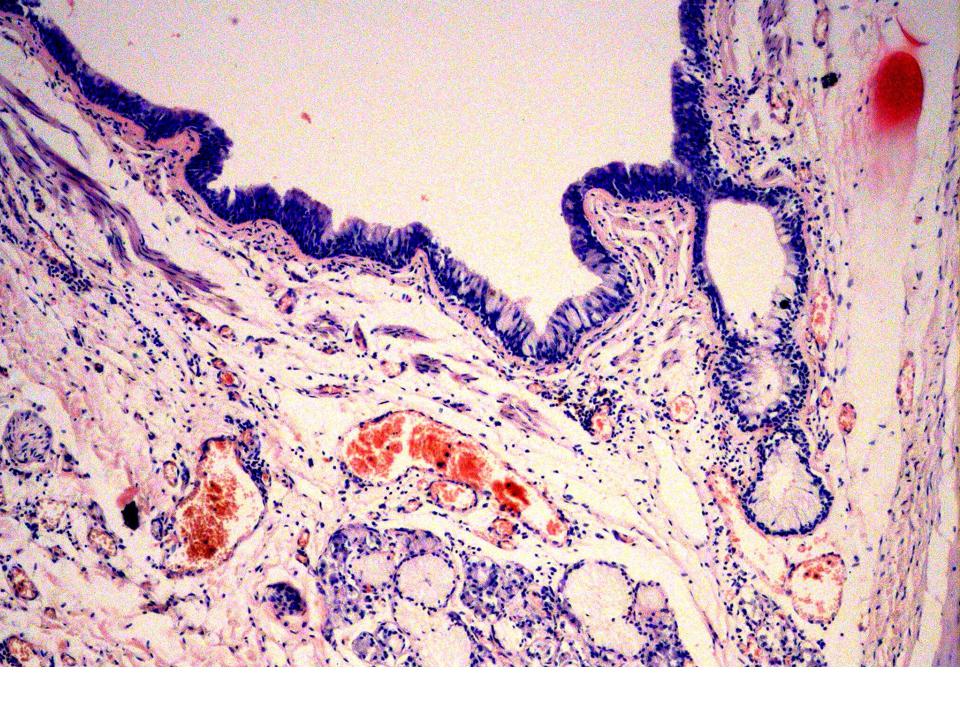 Величина ингибирования, представленная на гистограммах, рассчитывается из общего тока CFTR (ток, активированный CPT-cAMP, минус ток, остающийся после CFTR inh -172).B: буметанид. B + S: буметанид + S0859. * р <0,05; *** p <0,001 по сравнению с одним буметанидом (n = 8 на условие; клетки BE37). ( C, D ) Типичные записи тока короткого замыкания и гистограммы, показывающие влияние буметанида и S0859 на токи, индуцированные UTP в клетках в контрольных условиях ( C, ) или обработанных IL-4 в течение 72 часов ( D ). Активность TMEM16A / CaCC количественно определяли как текущий пик или как AUC. * р <0,05; ** p <0,01; *** p <0,001 по сравнению с токами без ингибиторов. # p <0,05; ## p <0,01; ### p <0,001 по сравнению с токами с одним буметанидом (n = 8 на условие).
Величина ингибирования, представленная на гистограммах, рассчитывается из общего тока CFTR (ток, активированный CPT-cAMP, минус ток, остающийся после CFTR inh -172).B: буметанид. B + S: буметанид + S0859. * р <0,05; *** p <0,001 по сравнению с одним буметанидом (n = 8 на условие; клетки BE37). ( C, D ) Типичные записи тока короткого замыкания и гистограммы, показывающие влияние буметанида и S0859 на токи, индуцированные UTP в клетках в контрольных условиях ( C, ) или обработанных IL-4 в течение 72 часов ( D ). Активность TMEM16A / CaCC количественно определяли как текущий пик или как AUC. * р <0,05; ** p <0,01; *** p <0,001 по сравнению с токами без ингибиторов. # p <0,05; ## p <0,01; ### p <0,001 по сравнению с токами с одним буметанидом (n = 8 на условие).
Мы также изучили влияние ингибиторов базолатерального транспортера на ток, активированный Ca 2+ . Апикальный UTP вводился в присутствии и в отсутствие буметанида отдельно или в комбинации с S0859.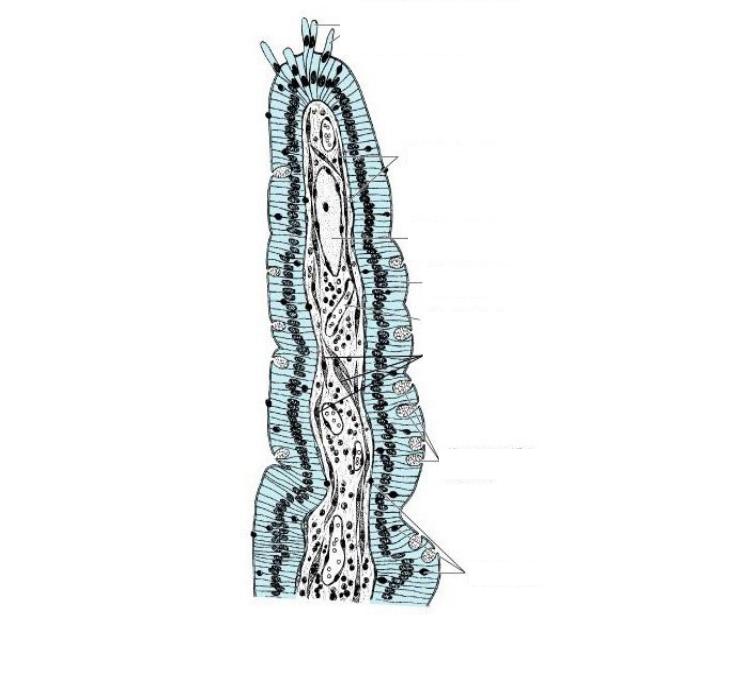 В необработанных клетках ток, активированный UTP, особенно если измерять как AUC, частично ингибировался буметанидом и почти полностью блокировался буметанидом плюс S0859 (рис.5С). Подобное поведение (аддитивный эффект буметанида и S0859) также наблюдалось в клетках, обработанных IL-4. Однако в обработанных клетках остаточный ответ на UTP в присутствии двух ингибиторов был заметно выше (фиг. 5D).
В необработанных клетках ток, активированный UTP, особенно если измерять как AUC, частично ингибировался буметанидом и почти полностью блокировался буметанидом плюс S0859 (рис.5С). Подобное поведение (аддитивный эффект буметанида и S0859) также наблюдалось в клетках, обработанных IL-4. Однако в обработанных клетках остаточный ответ на UTP в присутствии двух ингибиторов был заметно выше (фиг. 5D).
Мы отметили, что даже в присутствии буметанида плюс S0859 все еще оставались остаточные цАМФ- и Ca 2+ -зависимые токи, особенно в клетках, обработанных IL-4. Для дальнейшего подавления трансэпителиального транспорта анионов мы протестировали ацетазоламид как ингибитор карбоангидразы.При введении после буметанида и S0859 ацетазоламид дополнительно уменьшал CFTR-зависимый ток (дополнительный рисунок 4). Общее ингибирование, полученное с тремя соединениями вместе, составило ~ 85%. Ток, активированный UTP, также был чувствителен к ацетазоламиду. Пик, индуцированный UTP в присутствии тройной комбинации ингибиторов, был меньше, чем пик, измеренный с буметанидом плюс S0859 (27,8 ± 2,2 против 47,9 ± 3,1 мкА / см 2 ; дополнительный рис. 4). В качестве контрольного эксперимента мы сначала добавили CFTR inh -172, а затем CPT-cAMP.Важно отметить, что после полного блокирования CFTR его селективным ингибитором не наблюдалось дальнейшего снижения с буметанидом, S0859 и ацетазоламидом (дополнительный рисунок 4). Единственным видимым откликом, оставшимся в присутствии CFTR inh -172, был небольшой переходный ток, вызванный S0859. Этот ответ может быть следствием активации Ca 2+ -активированных каналов Cl —, поскольку он ингибируется CaCC inh -A01 (дополнительный рисунок 4).
4). В качестве контрольного эксперимента мы сначала добавили CFTR inh -172, а затем CPT-cAMP.Важно отметить, что после полного блокирования CFTR его селективным ингибитором не наблюдалось дальнейшего снижения с буметанидом, S0859 и ацетазоламидом (дополнительный рисунок 4). Единственным видимым откликом, оставшимся в присутствии CFTR inh -172, был небольшой переходный ток, вызванный S0859. Этот ответ может быть следствием активации Ca 2+ -активированных каналов Cl —, поскольку он ингибируется CaCC inh -A01 (дополнительный рисунок 4).
Как показали наши исследования, пендрин / SLC26A4 является одним из генов, наиболее активно регулируемых IL-4.Однако активность пендрина не может быть обнаружена при записи тока короткого замыкания, поскольку его механизм переноса ионов электронейтральный 16 . Таким образом, мы искали доказательства транспорта бикарбоната, измеряя внутриклеточный pH с помощью флуоресцентного зонда BCECF, как это было сделано ранее в клетках Calu-3 26 . С этой целью монослои поляризованных клеток, загруженные BCECF, помещали в специально разработанную кювету, которая обеспечивала независимую перфузию апикальной и базолатеральной сторон.Чтобы оценить присутствие пендрин-опосредованного обмена Cl — / HCO 3 — , мы перфузировали апикальную сторону раствором, не содержащим Cl — . Чтобы исключить вклад CFTR, который также проницаем для бикарбоната, мы использовали клетки CF без стимуляции цАМФ. Как показано на рис. 1D, в этих условиях вклад CFTR незначителен. В необработанных клетках в условиях покоя удаление апикального Cl — не вызывало изменения внутриклеточного pH (фиг. 6A).Напротив, значительное ощелачивание наблюдалось в клетках, обработанных IL-4, что указывает на усиленную экспрессию апикального бикарбонатного обменника (фиг. 6B). Действительно, в отсутствие внеклеточного Cl — (замененного глюконатом) выход бикарбоната через механизм обмена затруднен. В тех же экспериментах мы впоследствии стимулировали клетки апикальным UTP.
С этой целью монослои поляризованных клеток, загруженные BCECF, помещали в специально разработанную кювету, которая обеспечивала независимую перфузию апикальной и базолатеральной сторон.Чтобы оценить присутствие пендрин-опосредованного обмена Cl — / HCO 3 — , мы перфузировали апикальную сторону раствором, не содержащим Cl — . Чтобы исключить вклад CFTR, который также проницаем для бикарбоната, мы использовали клетки CF без стимуляции цАМФ. Как показано на рис. 1D, в этих условиях вклад CFTR незначителен. В необработанных клетках в условиях покоя удаление апикального Cl — не вызывало изменения внутриклеточного pH (фиг. 6A).Напротив, значительное ощелачивание наблюдалось в клетках, обработанных IL-4, что указывает на усиленную экспрессию апикального бикарбонатного обменника (фиг. 6B). Действительно, в отсутствие внеклеточного Cl — (замененного глюконатом) выход бикарбоната через механизм обмена затруднен. В тех же экспериментах мы впоследствии стимулировали клетки апикальным UTP.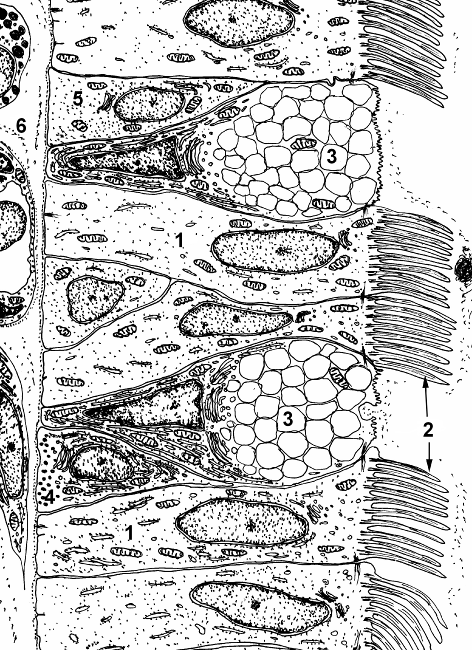 В этих условиях замена Cl — вызвала внутриклеточное ощелачивание, которое было больше в клетках, обработанных IL-4 (рис.6А, Б). Этот эффект может быть результатом поступления бикарбоната через каналы Cl —, активированные Ca 2+ . Чтобы объяснить этот эффект, мы должны учитывать, что электрогенный выход Cl — через каналы увеличивается после удаления внеклеточного Cl — . Это вызывает деполяризацию мембранного потенциала (внутренняя сторона более положительная), что вызывает усиленное проникновение бикарбоната. Важно отметить, что в присутствии ингибитора CaCC inh -A01, который блокирует Ca 2+ -активированные каналы Cl —, UTP-зависимое подщелачивание не отличается от такового, вызванного только удалением Cl — (рис.6C), предполагая, что TMEM16A работает синергетически с пендрином, секретируя HCO 3 —.
В этих условиях замена Cl — вызвала внутриклеточное ощелачивание, которое было больше в клетках, обработанных IL-4 (рис.6А, Б). Этот эффект может быть результатом поступления бикарбоната через каналы Cl —, активированные Ca 2+ . Чтобы объяснить этот эффект, мы должны учитывать, что электрогенный выход Cl — через каналы увеличивается после удаления внеклеточного Cl — . Это вызывает деполяризацию мембранного потенциала (внутренняя сторона более положительная), что вызывает усиленное проникновение бикарбоната. Важно отметить, что в присутствии ингибитора CaCC inh -A01, который блокирует Ca 2+ -активированные каналы Cl —, UTP-зависимое подщелачивание не отличается от такового, вызванного только удалением Cl — (рис.6C), предполагая, что TMEM16A работает синергетически с пендрином, секретируя HCO 3 —.
Измерения внутриклеточного pH в эпителии бронхов.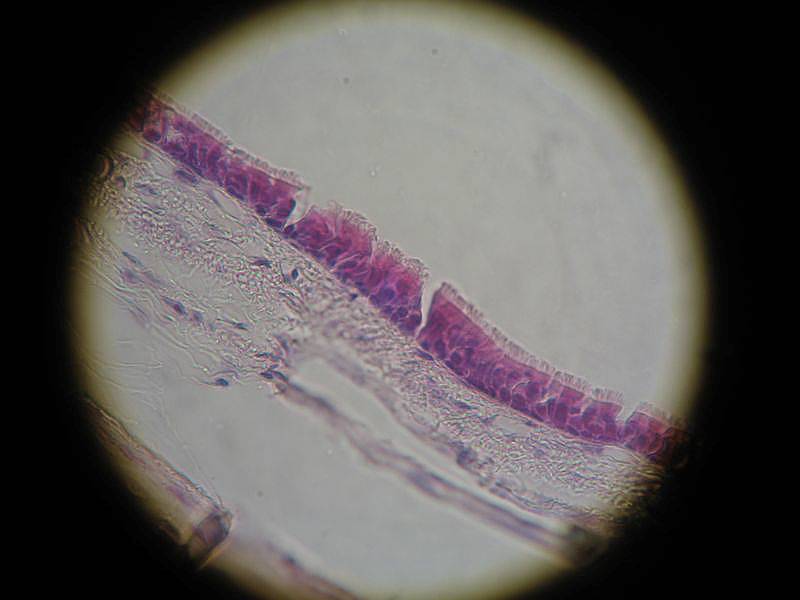
Репрезентативные кривые показывают значения внутриклеточного pH, измеренные с помощью зонда BCECF с апикальным Cl — и без него. Гистограммы показывают изменения pH после удаления апикального Cl — в отсутствие и в присутствии апикального UTP. ( A ) Клетки бронхиального эпителия без обработки ИЛ-4 (n = 7).( B ) Клетки, обработанные IL-4 в течение 72 часов (n = 7). ( C ) Клетки, обработанные IL-4 и UTP, наносили в присутствии CaCC inh -A01 (n = 5). ** p <0,01; *** p <0,001 (клетки BE43).
Чтобы более точно проверить способность клеток бронхиального эпителия секретировать бикарбонат, мы провели эксперименты, в которых апикальная сторона эпителия была покрыта 150 мкл раствора Кребса, содержащего 128 мМ Cl — и 24 мМ HCO 3 — .После 48 часов инкубации при 37 ° C в увлажненной атмосфере с 5% CO 2 апикальную жидкость собирали для измерения ионного состава (рис. 7). Мы отметили заметную разницу между клетками, обработанными IL-4 и без него. В необработанных клетках Cl — увеличился до 143 мМ, а HCO 3 — снизился до 16 мМ по отношению к начальной концентрации каждого иона в исходном растворе. С IL-4 концентрация Cl — снизилась до 107 мМ, тогда как HCO 3 — накапливалась до 42 мМ (рис.7). В соответствии с высокой концентрацией HCO 3 — апикальная жидкость клеток, обработанных IL-4, была более щелочной, на что указывают два разных типа измерений pH (рис. 7). Другое существенное изменение касалось K + : по сравнению с исходным значением 4,6 мМ, концентрация K + была умеренно изменена в контрольных клетках (3,2 мМ), но заметно снизилась (0,3 мМ) в клетках, обработанных IL-4 (рис. 7). . Напротив, концентрация Na + и Ca 2+ существенно не изменилась.Мы были обеспокоены тем, что добавление жидкости на апикальной стороне в течение 48 часов могло нарушить поведение эпителия с точки зрения ответа на IL-4.
В необработанных клетках Cl — увеличился до 143 мМ, а HCO 3 — снизился до 16 мМ по отношению к начальной концентрации каждого иона в исходном растворе. С IL-4 концентрация Cl — снизилась до 107 мМ, тогда как HCO 3 — накапливалась до 42 мМ (рис.7). В соответствии с высокой концентрацией HCO 3 — апикальная жидкость клеток, обработанных IL-4, была более щелочной, на что указывают два разных типа измерений pH (рис. 7). Другое существенное изменение касалось K + : по сравнению с исходным значением 4,6 мМ, концентрация K + была умеренно изменена в контрольных клетках (3,2 мМ), но заметно снизилась (0,3 мМ) в клетках, обработанных IL-4 (рис. 7). . Напротив, концентрация Na + и Ca 2+ существенно не изменилась.Мы были обеспокоены тем, что добавление жидкости на апикальной стороне в течение 48 часов могло нарушить поведение эпителия с точки зрения ответа на IL-4. Дополнительный рис. 5 показывает, что погруженные клетки все еще отвечают на IL-4 заметной гиперплазией бокаловидных клеток. Контрольные записи тока короткого замыкания, выполненные после удаления апикальной жидкости, также подтвердили активацию токов CFTR и TMEM16A с помощью IL-4.
Дополнительный рис. 5 показывает, что погруженные клетки все еще отвечают на IL-4 заметной гиперплазией бокаловидных клеток. Контрольные записи тока короткого замыкания, выполненные после удаления апикальной жидкости, также подтвердили активацию токов CFTR и TMEM16A с помощью IL-4.
Изменение апикальной жидкости IL-4.
Ионный состав и pH апикальной жидкости из клеток, содержащихся в контрольных условиях или обработанных IL-4.Фиксированный объем (150 мкл) физиологического раствора наносили на апикальную сторону эпителия и восстанавливали через 48 часов. Пунктирная линия показывает начальную концентрацию каждого иона в исходном растворе. Значения pH определяли с помощью лакмусовых полосок (кружки) или pH-чувствительных электродов (квадраты). * р <0,05; ** p <0,01 по сравнению с контролем (n = 3–4; клетки BE37).
Мы спросили, играет ли повышенная регуляция транспорта анионов в клетках, обработанных ИЛ-4, роль в выделении слизи.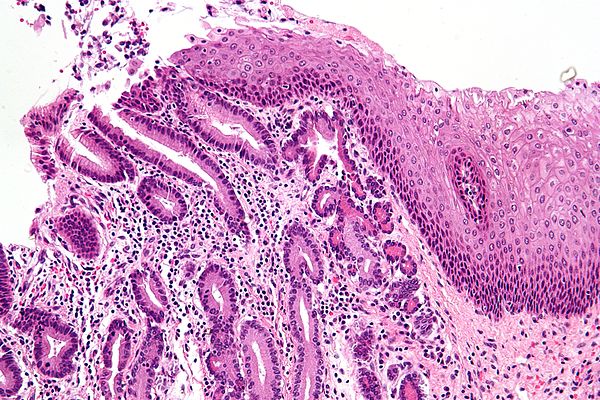 Для этой цели мы разработали анализ, в котором АТФ плюс флуоресцентные наносферы (в 50 мкл физиологического раствора) были добавлены к апикальной стороне эпителия.Во время добавления жидкости эпителии сохраняли под наклоном, чтобы обеспечить однонаправленный поток раствора под действием силы тяжести. После удаления лишней жидкости слизь, окрашенная наносферами, визуализировалась с помощью флуоресцентной микроскопии. В контрольных экспериментах, проведенных в отсутствие АТФ, очень слабая флуоресценция была видна в клетках, обработанных или обработанных IL-4, или без него (фиг. 8A, B). Это открытие указывает на то, что наносферы не связываются с эпителиальной поверхностью, если выделение слизи не стимулируется. Когда АТФ был включен в раствор, в эпителии, не обработанном ИЛ-4, появлялись флуоресцентные волокна, указывающие на выделение слизи (рис.8С). Число нитей и их интенсивность сильно увеличивались в клетках, обработанных IL-4 в течение 72 часов (фиг. 8D). Этот паттерн предполагал образование сложной сети нитей слизи при стимуляции АТФ.
Для этой цели мы разработали анализ, в котором АТФ плюс флуоресцентные наносферы (в 50 мкл физиологического раствора) были добавлены к апикальной стороне эпителия.Во время добавления жидкости эпителии сохраняли под наклоном, чтобы обеспечить однонаправленный поток раствора под действием силы тяжести. После удаления лишней жидкости слизь, окрашенная наносферами, визуализировалась с помощью флуоресцентной микроскопии. В контрольных экспериментах, проведенных в отсутствие АТФ, очень слабая флуоресценция была видна в клетках, обработанных или обработанных IL-4, или без него (фиг. 8A, B). Это открытие указывает на то, что наносферы не связываются с эпителиальной поверхностью, если выделение слизи не стимулируется. Когда АТФ был включен в раствор, в эпителии, не обработанном ИЛ-4, появлялись флуоресцентные волокна, указывающие на выделение слизи (рис.8С). Число нитей и их интенсивность сильно увеличивались в клетках, обработанных IL-4 в течение 72 часов (фиг. 8D). Этот паттерн предполагал образование сложной сети нитей слизи при стимуляции АТФ.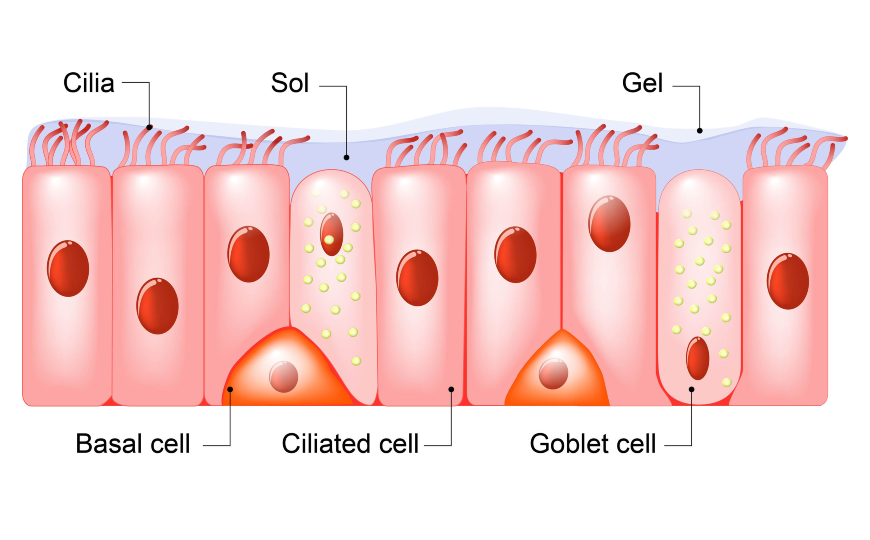 Важно отметить, что заметное уменьшение количества нитей слизи было обнаружено, когда эпителий, обработанный IL-4, предварительно подвергался в течение трех часов воздействию базолатерального раствора без бикарбоната (рис. 8E) или когда эксперименты проводились на эпителии CF, обработанном IL-4 ( Рис. 8F). Сводка данных представлена на рис.8G.
Важно отметить, что заметное уменьшение количества нитей слизи было обнаружено, когда эпителий, обработанный IL-4, предварительно подвергался в течение трех часов воздействию базолатерального раствора без бикарбоната (рис. 8E) или когда эксперименты проводились на эпителии CF, обработанном IL-4 ( Рис. 8F). Сводка данных представлена на рис.8G.
Выделение слизи эпителием бронхов.
( A – F ) Типичные изображения, показывающие окрашивание слизи с добавлением флуоресцентных наносфер (50 мкл физиологического раствора) на апикальной стороне наклонного эпителия. Там, где указано ( C – F ), добавленный раствор содержал АТФ (100 мкМ) для стимуляции выделения слизи. Эксперименты проводились на эпителии, обработанном IL-4 и без него (10 нг / мл) в течение 72 часов, как указано. Размер масштабной линейки 500 мкм. ( G ) Количественная оценка нитей слизи для различных состояний (n = 3–6 на одно состояние; клетки BE37 и BE43).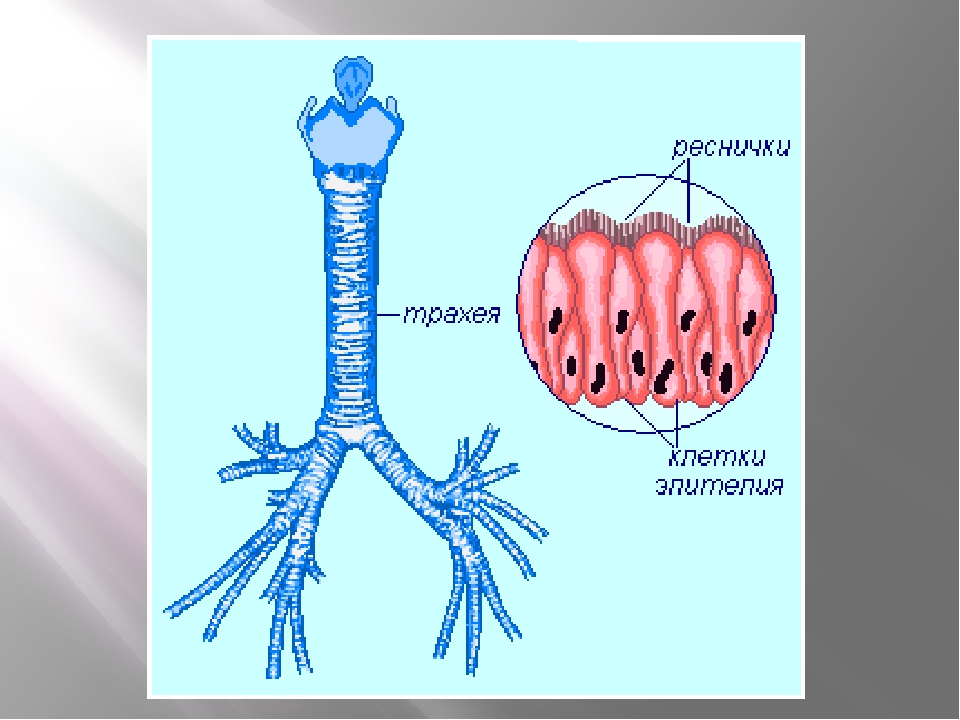 Эффект ИЛ-4 был статистически значимым (р <0,01).
Эффект ИЛ-4 был статистически значимым (р <0,01).
Повышение регуляции SLC6A14
Хотя это и не связано напрямую с транспортом бикарбоната, мы были заинтригованы усилением регуляции SLC6A14 с помощью IL-4 (Рис. 2). SLC6A14 отвечает за Na + -зависимый захват основных и нейтральных аминокислот апикальной мембраной 23,27 и недавно был идентифицирован как модификатор заболевания легких в CF 28 . Мы провели эксперименты по току короткого замыкания, в которых апикальная сторона эпителия подвергалась воздействию лизина или аргинина (дополнительный рис.6). Аминокислоты вызывали очень слабый ответ в необработанных клетках. Напротив, эпителий, обработанный ИЛ-4, показал токи, которые быстро появлялись после добавления аминокислоты.
Муциновые гранулы-ассоциированные белки в эпителиальных клетках бронхов человека: бокаловидная клетка дыхательных путей «гранулом» | Респираторные исследования
Культура клеток
Первичная культура клеток NHBE на границе раздела воздух / жидкость, метод, который позволяет этим клеткам поддерживать хорошо дифференцированный фенотип, был описан ранее [10].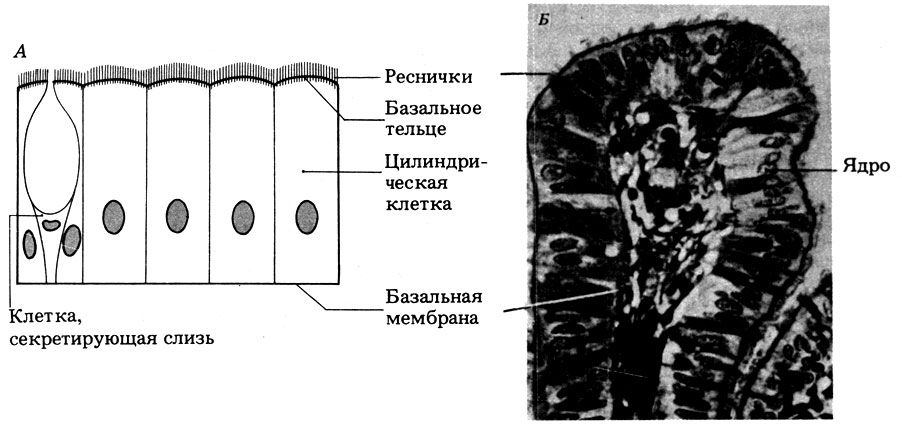 Вкратце, коммерчески доступные клетки NHBE от одного донора (Lonza, Cambridge, MA) засевали в вентилируемые колбы для тканевых культур Т75 с плотностью 500 клеток / см 2 . Клетки размножали в среде роста при 5% CO 2 при 37 ° C до конфлюэнтности 85-90%, диссоциировали из колб с использованием 0,25% трипсина / ЭДТА и замораживали в жидком азоте в качестве клеток пассажа 2 (2 × 10 6 клеток / мл).
Вкратце, коммерчески доступные клетки NHBE от одного донора (Lonza, Cambridge, MA) засевали в вентилируемые колбы для тканевых культур Т75 с плотностью 500 клеток / см 2 . Клетки размножали в среде роста при 5% CO 2 при 37 ° C до конфлюэнтности 85-90%, диссоциировали из колб с использованием 0,25% трипсина / ЭДТА и замораживали в жидком азоте в качестве клеток пассажа 2 (2 × 10 6 клеток / мл).
Интерфейсные культуры клеток NHBE воздух / жидкость были созданы на Transwell ® -Clear culture 0.Вставки из полиэстера с порами 4 мкм (Costar, Cambridge, MA), тонко покрытые коллагеном типа I из крысиного хвоста (Collaborative Biomedical, Bedford, MA). Замороженные клетки NHBE извлекали и высевали с плотностью 2 × 10 4 клеток / см 2 на апикальную поверхность вставок со средой, добавленной в базолатеральный компартмент. Полная среда состояла из смеси 50:50 ростовой среды бронхиального эпителия и среды Игла, модифицированной Дульбекко, с высоким содержанием глюкозы (4,5 г / л) и конечной концентрацией 50 мкг / мл гентамицина, 5 мкг / мл инсулина, 10 мкг / л.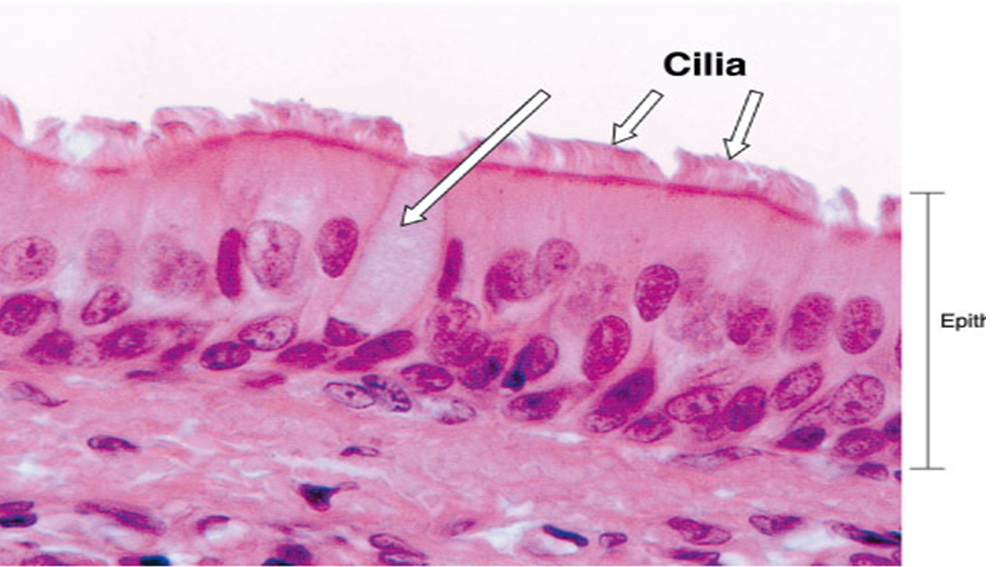 мл трансферрина, 0.5 мкг / мл адреналина, 6,5 нг / мл трийодтиронина, 0,5 нг / мл человеческого рекомбинантного эпидермального фактора роста, 0,5 мкг / мл гидрокортизона, 50 нг / мл амфотерицина-B (Lonza), 0,13 мг / мл экстракта гипофиза крупного рогатого скота, 5 × 10 -8 моль / л полностью транс-ретиноевой кислоты, 1,5 мкг / мл бычьего сывороточного альбумина (Sigma, Сент-Луис, Миссури) и 20 Ед / мл нистатина (Ameresco, Solon, OH). Клетки выращивали в атмосфере 5% CO 2 при 37 ° C, и среду меняли на следующий день, затем через день, пока клетки не достигли 90% слияния.На этом этапе была установлена граница раздела воздух / жидкость (ALI) путем удаления апикальной среды, таким образом поддерживая клетки со средой внизу и без среды наверху. Среду, указанную ниже, меняли ежедневно в течение 14 дней. Муцин наблюдали через 14 дней культивирования, а реснички стали очевидными через 18 дней. Эксперименты проводились на клетках через 21 день культивирования, чтобы гарантировать, что культуры были хорошо дифференцированы.
мл трансферрина, 0.5 мкг / мл адреналина, 6,5 нг / мл трийодтиронина, 0,5 нг / мл человеческого рекомбинантного эпидермального фактора роста, 0,5 мкг / мл гидрокортизона, 50 нг / мл амфотерицина-B (Lonza), 0,13 мг / мл экстракта гипофиза крупного рогатого скота, 5 × 10 -8 моль / л полностью транс-ретиноевой кислоты, 1,5 мкг / мл бычьего сывороточного альбумина (Sigma, Сент-Луис, Миссури) и 20 Ед / мл нистатина (Ameresco, Solon, OH). Клетки выращивали в атмосфере 5% CO 2 при 37 ° C, и среду меняли на следующий день, затем через день, пока клетки не достигли 90% слияния.На этом этапе была установлена граница раздела воздух / жидкость (ALI) путем удаления апикальной среды, таким образом поддерживая клетки со средой внизу и без среды наверху. Среду, указанную ниже, меняли ежедневно в течение 14 дней. Муцин наблюдали через 14 дней культивирования, а реснички стали очевидными через 18 дней. Эксперименты проводились на клетках через 21 день культивирования, чтобы гарантировать, что культуры были хорошо дифференцированы.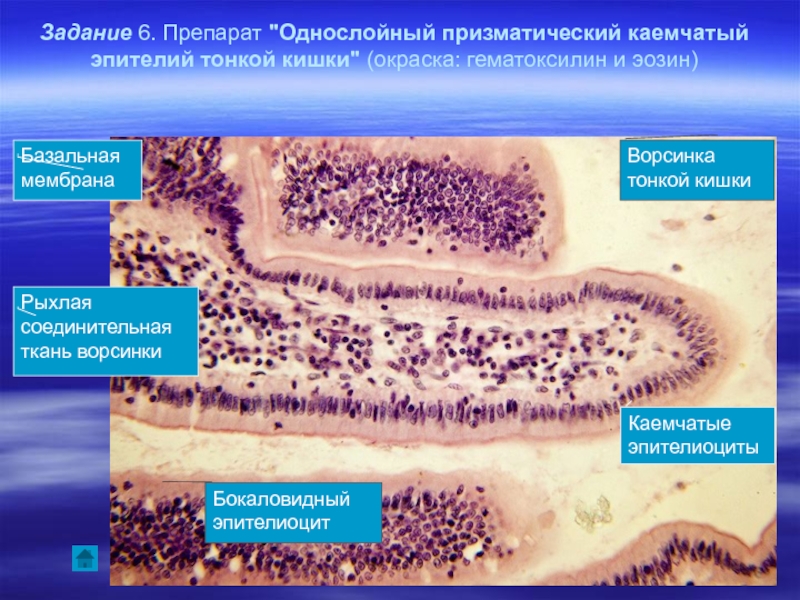 При обработке клеток NHBE апикальную поверхность клеток промывали фосфатно-солевым буфером (PBS), pH 7, осторожно перемешивая в течение 5 минут перед обработкой для удаления скопившейся слизи.
При обработке клеток NHBE апикальную поверхность клеток промывали фосфатно-солевым буфером (PBS), pH 7, осторожно перемешивая в течение 5 минут перед обработкой для удаления скопившейся слизи.
Иммуно-изоляция гранул муцина
Иммуно-изоляция гранул выполнялась с использованием модифицированной версии протокола, описанного Wu et al. [11]. После обработки клетки промывали PBS, а затем собирали в буфере для изоляции (PBS, 1 мМ фенилметилсульфонилфторид, коктейль ингибиторов протеазы 1, коктейль ингибиторов фосфатазы (Sigma, Сент-Луис, Миссури)) с использованием резиновых полицейских. Собранные клетки лизировали кратковременной обработкой ультразвуком и лизаты центрифугировали при 600 × g в течение 10 мин.Супернатанты добавляли к 1,9 объемам 86% перколла, 0,3 М сахарозы, 5 мМ MOPS (4-морфолинпропансульфоновая кислота), 1 мМ EDTA и 0,2 мкг / мл DPPD (N, N’-дифенил-4-фенилендиамина) (Sigma ), pH 6,8, и центрифугировали в течение 30 мин при 17000 × g в ультрацентрифуге Sorvall Discovery 100S (Sorvall, Inc. , Ньютаун, Коннектикут). Неочищенные гранулы переносили со дна самообразовавшегося градиента в новую пробирку, разбавляли 3 объемами 0,3 М сахарозы, содержащей 2 мМ MOPS, 1 мМ EDTA и 0,2 мкг / мл DPPD, и центрифугировали в течение 15 минут при 2000 × г.Осадок восстанавливали в PBS, инкубировали с антителом к gob-5 / mclca3 (ортологом CLCA1 человека), полученным в нашей лаборатории в течение ночи при 4 ° C на нутаторе. Используемые кроличьи поликлональные антитела gob-5 генерировали против пептидного эпитопа mclca3 ESWKAKPEYTRPKLE (Covance, Денвер, Пенсильвания). После инкубации комплекс антитело-гранула наносили на шарики Dynal, покрытые протеином G. Гранулы тщательно промывали, и комплекс элюировали Na-цитратом pH 2,5 или загрузочным красителем.
, Ньютаун, Коннектикут). Неочищенные гранулы переносили со дна самообразовавшегося градиента в новую пробирку, разбавляли 3 объемами 0,3 М сахарозы, содержащей 2 мМ MOPS, 1 мМ EDTA и 0,2 мкг / мл DPPD, и центрифугировали в течение 15 минут при 2000 × г.Осадок восстанавливали в PBS, инкубировали с антителом к gob-5 / mclca3 (ортологом CLCA1 человека), полученным в нашей лаборатории в течение ночи при 4 ° C на нутаторе. Используемые кроличьи поликлональные антитела gob-5 генерировали против пептидного эпитопа mclca3 ESWKAKPEYTRPKLE (Covance, Денвер, Пенсильвания). После инкубации комплекс антитело-гранула наносили на шарики Dynal, покрытые протеином G. Гранулы тщательно промывали, и комплекс элюировали Na-цитратом pH 2,5 или загрузочным красителем.
Субклеточное фракционирование белка
После обработки клетки промывали ледяным PBS, содержащим ингибитор фосфатазы (Active Motif Inc, Карлсбад, Калифорния), а затем соскребали в буфер для лизиса (50 мМ Трис, pH 7.5, 1 мМ этилендиаминтетрауксусная кислота, 100 мМ NaCl, 1 мМ фенилметилсульфонилфторид) с использованием резинового полицейского. Собранную клеточную смесь лизировали кратковременной обработкой ультразвуком. Лизаты центрифугировали при 14000 × g при 4 ° C в центрифуге Eppendorf 5417R (Eppendorf Corp., Гамбург, Германия) в течение 30 минут для разделения цитозольной и мембранной фракций. Супернатант сохраняли как цитозольный образец, в то время как осадок ресуспендировали в буфере для лизиса, содержащем 0,01% Тритон-100, растворяли обработкой ультразвуком и инкубировали на льду в течение 30 мин.После инкубации образцы снова центрифугировали при 14000 × g при 4 ° C в течение 30 минут, и супернатант, отделенный от смеси осадка, сохраняли как мембранную фракцию.
Собранную клеточную смесь лизировали кратковременной обработкой ультразвуком. Лизаты центрифугировали при 14000 × g при 4 ° C в центрифуге Eppendorf 5417R (Eppendorf Corp., Гамбург, Германия) в течение 30 минут для разделения цитозольной и мембранной фракций. Супернатант сохраняли как цитозольный образец, в то время как осадок ресуспендировали в буфере для лизиса, содержащем 0,01% Тритон-100, растворяли обработкой ультразвуком и инкубировали на льду в течение 30 мин.После инкубации образцы снова центрифугировали при 14000 × g при 4 ° C в течение 30 минут, и супернатант, отделенный от смеси осадка, сохраняли как мембранную фракцию.
Для приготовления сырых лизатов целых клеток разрушенную клеточную смесь центрифугировали при 15000 об / мин на центрифуге Eppendorf 5417R (Eppendorf Corp., Гамбург, Германия) в течение 15 минут при 4 ° C. Супернатант собирали как цельный неочищенный клеточный лизат. Концентрации белка во всех образцах клеточного лизата определяли количественно с помощью анализа Брэдфорда (BioRad Laboratories, Геркулес, Калифорния).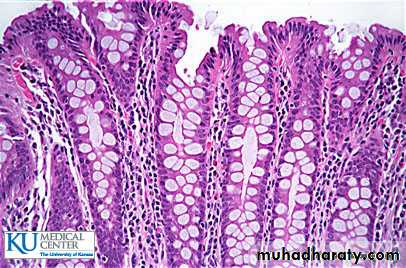 В качестве стандарта использовали бычий сывороточный альбумин (BSA; Sigma), и производили серийные разведения из исходной исходной концентрации 400 нг / мл. Величины поглощения определяли с помощью системы считывания микропланшетов, а линейную регрессию и концентрации белка рассчитывали с помощью программного обеспечения для анализа данных SoftMax Pro (Molecular Devices, Саннивейл, Калифорния).
В качестве стандарта использовали бычий сывороточный альбумин (BSA; Sigma), и производили серийные разведения из исходной исходной концентрации 400 нг / мл. Величины поглощения определяли с помощью системы считывания микропланшетов, а линейную регрессию и концентрации белка рассчитывали с помощью программного обеспечения для анализа данных SoftMax Pro (Molecular Devices, Саннивейл, Калифорния).
Совместная иммунопреципитация белковых комплексов и вестерн-анализ
Лизаты целых клеток или гранул муцина, содержащие 500-1000 мкг / мл общего белка, инкубировали в течение ночи при 4 ° C с 3-10 мкл (20-30 мкг) с указанным антителом .Двадцать пять мкл динальных гранул с протеином G (Invitrogen, Carlsbad, CA) добавляли для связывания комплекса антитело-белок в течение 3 часов. Гранулы трижды промывали холодным PBS, и белки элюировали с помощью буфера для образцов для электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и кипятили за 10 мин до разделения белков на геле SDS-PAGE. Разрешенные белки переносили на нитроцеллюлозную мембрану 0,45 мкМ (BioRad, Hercules, CA), блокировали 5% обезжиренным молоком и либо мышиными антителами против MARCKS (Millipore, Bedford, MA), либо кроличьими антителами против CSP, либо мышиными антителами против HSP70 (Abcam. , Кембридж, Великобритания), козье антитело против hCLCA1 (Imgenex, Сан-Диего, Калифорния) или кроличье антитело против mclca3 использовали в качестве первичного антитела для исследования мембран.
Разрешенные белки переносили на нитроцеллюлозную мембрану 0,45 мкМ (BioRad, Hercules, CA), блокировали 5% обезжиренным молоком и либо мышиными антителами против MARCKS (Millipore, Bedford, MA), либо кроличьими антителами против CSP, либо мышиными антителами против HSP70 (Abcam. , Кембридж, Великобритания), козье антитело против hCLCA1 (Imgenex, Сан-Диего, Калифорния) или кроличье антитело против mclca3 использовали в качестве первичного антитела для исследования мембран.
Визуализация белков происходила после зондирования вторичными антителами, конъюгированными с пероксидазой хрена, с использованием набора для усиленной хемилюминесценции (Chemicon, Бакингемшир, Великобритания) с последующим экспонированием на пленку. Денситометрию анализировали с помощью программного обеспечения для получения и анализа изображений Labworks (UVP Inc, Upland, CA).
Ультраструктурная иммуногистохимия
Хорошо дифференцированные культуры клеток фиксировали на вставке Transwell смесью 4% формальдегид: 1% глутальдегид в фосфатном буфере.В препаратах мембран гранул муцина мембраны гранул фиксировали в суспензии магнитных шариков. Образцы ткани заливали смолой Spurr, разрезали на ультратонкие срезы и помещали на сетки из нержавеющей стали. Сетки блокировали в 10% фетальной бычьей сыворотке (FBS) в PBS в течение 15 минут при комнатной температуре с последующей 5-минутной промывкой в 0,5% BSA в PBS. Первичную обработку сеток антителами проводили в течение ночи при 4 ° C на нутаторе, после чего сетки многократно промывали в течение одного часа в 0,5% BSA в PBS и зондировали вторичным антителом, меченным золотом, в течение 2 часов при комнатной температуре.Соответствующую цельную молекулу IgG использовали в качестве первичного отрицательного контроля на антитела. Сетки промывали в PBS несколько раз в течение 1 часа, быстро сушили, затем окрашивали уранилацетатом и исследовали с помощью просвечивающего электронного микроскопа FEI / Philips EM 208S. Антитело панмуцина 17Q2 [12] использовали в качестве положительного контроля для идентификации интактных гранул муцина.
Жидкостная хроматография тандемная масс-спектрометрия (ЖХ-МС / МС)
Полосы белка, разделенные на одномерном (SDS-PAGE), вырезали, сушили растворителем, экстрагировали и обрабатывали гидроксиэтилдисульфидом в качестве реагента, блокирующего тиол, в щелочной среде. условия при 60 ° C.Экстрагированные пептиды восстанавливали почти досуха в потоке воздуха перед расщеплением трипсином в 50 мМ бикарбонате аммония, pH ~ 7,8. Затем образцы инкубировали в течение ночи при 37 ° C перед анализом с помощью ЖХ / МС.
Пептиды анализировали обращенно-фазовой ВЭЖХ с масс-спектрометрией с ионизацией электрораспылением. Разделение достигалось с помощью колонки C18 HPLC (Phenomenex Jupiter Proteo: внутренний диаметр 150 мм × 0,50 мм, размер частиц 4 мкм, размер пор 90A) и подвижной фазы, работающей с запрограммированным градиентом с 50 мМ уксусной кислоты и ацетонитрила.Для анализа использовали прибор для ВЭЖХ Thermo Surveyor, соединенный с масс-спектрометром с ионной ловушкой Thermo LTQ. Масс-спектрометр работал в режиме положительных ионов с источником ионизации электрораспылением (ESI). Масс-спектрометр работал в зависимом от данных режиме сканирования MS / MS, сканирование от m / z 420-2000 и сбор спектров MS / MS для четырех наиболее распространенных ионов в каждом сканировании.
Поиск в базе данных белков
Поиск полученных МС / МС спектров для каждого образца проводился с помощью BioWorks 3.1 Алгоритм SR1 SEQUEST (Thermo Electron, Сан-Хосе, Калифорния) против человеческой неизбыточной базы данных. Неизбыточная база данных была загружена с веб-сайта Национального центра биотехнологической информации (NCBI). Неизбыточная база данных использовалась для первоначальной идентификации белков для тандемных масс-спектральных данных, полученных в ячейке ICR, а также в линейной ловушке. Оценка общего белкового покрытия была выполнена путем создания базы данных подмножества белков, состоящей только из белков Homo sapiens, белков.Параметры поиска в базе данных предполагали, что протеолиз был выполнен с использованием трипсина с возможностью одного внутреннего остатка расщепления. Поиск проводился с использованием трипсина, указанного в качестве фермента, с учетом до двух пропущенных сайтов расщепления. Поисковые запросы из повторений в рамках эксперимента были объединены для создания исчерпывающего списка пептидов и белков, идентифицированных в конкретном эксперименте. Уровни приемлемости для положительной идентификации пептидов определяли с использованием оценок взаимной корреляции (Xcorr).Эти баллы помогают в определении истинно положительных результатов, при этом более высокие баллы повышают уверенность в правильной идентификации. Минимально допустимый Xcorr для идентифицированных пептидов составил 3,0 [13, 14].
Статистический анализ
Повторные эксперименты были выполнены для каждой анализируемой концентрации реагентов. Все реагенты, использованные для обработки клеток, исследовали на цитотоксичность путем измерения общего высвобождения лактатдегидрогеназы из клеток, и эксперименты проводили при нецитотоксических концентрациях.
Измененное поколение мерцательных клеток при хронической обструктивной болезни легких
Глобальная инициатива по хронической обструктивной болезни легких. Глобальная стратегия диагностики, M., and Prevention of COPD, обновленная версия, http://www.goldcopd.org (2018).
Брюссель, Г. Г., Джоос, Г. Ф. и Брак, К. Р. Новые взгляды на иммунологию хронической обструктивной болезни легких. The Lancet 378 , 1015–1026, https://doi.org/10.1016/s0140-6736(11)60988-4 (2011).
CAS Статья Google ученый
Джеффри П. К. Сравнение структурных и воспалительных особенностей ХОБЛ и астмы. Лекция Джайлза Ф. Филли. Комод 117 , 251С – 260С (2000 г.).
CAS Статья Google ученый
Гра, Д., Чанез, П., Вашье, И., Пети, А. и Бурден, А. Бронхиальный эпителий как мишень для инновационных методов лечения астмы. Фармакология и терапия 140 , 290–305, https://doi.org/10.1016/j.pharmthera.2013.07.008 (2013).
CAS Статья Google ученый
Найт, Д. А. и Холгейт, С. Т. Эпителий дыхательных путей: структурные и функциональные свойства при здоровье и болезнях. Respirology 8 , 432–446 (2003).
Артикул Google ученый
Кристал, Р. Г., Рэнделл, С. Х., Энгельгардт, Дж. Ф., Войнов, Дж. И Сандей, М. Е. Эпителиальные клетки дыхательных путей: современные концепции и проблемы. Proceedings of the American Thoracic Society 5 , 772–777, https://doi.org/10.1513/pats.200805-041HR (2008).
Артикул PubMed PubMed Central Google ученый
Мукерджи, И., Рой, С. и Чакрабарти, С. Идентификация важных эффекторных белков в транскрипционной сети FOXJ1, связанной с цилиогенезом и функцией ресничек. Front Genet 10 , 23, https://doi.org/10.3389/fgene.2019.00023 (2019).
CAS Статья PubMed PubMed Central Google ученый
Митчисон, Х. М. и Валенте, Э. М. Подвижные и неподвижные реснички в патологии человека: от функции к фенотипу. Журнал патологии 241 , 294–309, https://doi.org/10.1002/path.4843 (2017).
Артикул PubMed Google ученый
Перотин, Дж. М. и др. . Изменение первичных ресничек при ХОБЛ. Европейский респираторный журнал 52 , https://doi.org/10.1183/13993003.00122-2018 (2018).
Артикул Google ученый
Хильдебрандт, Ф., Бенцинг, Т. и Катсанис, Н. Цилиопатии. Медицинский журнал Новой Англии 364 , 1533–1543, https://doi.org/10.1056/NEJMra1010172 (2011).
CAS Статья PubMed PubMed Central Google ученый
Браун, Дж. М. и Уитман, Г. Б. Реснички и болезни. Bioscience 64 , 1126–1137, https://doi.org/10.1093/biosci/biu174 (2014).
Артикул PubMed PubMed Central Google ученый
Crystal, R.G. Базальные клетки дыхательных путей. «Дымящийся пистолет» хронической обструктивной болезни легких. Американский журнал респираторной медицины и реанимации 190 , 1355–1362, https: // doi.org / 10.1164 / rccm.201408-1492PP (2014 г.).
Артикул PubMed PubMed Central Google ученый
Saetta, M. et al. . Гиперплазия бокаловидных клеток и воспаление эпителия в периферических дыхательных путях у курильщиков как с симптомами хронического бронхита, так и с хроническим ограничением воздушного потока. Американский журнал респираторной медицины и реанимации 161 , 1016–1021, https://doi.org/10.1164/ajrccm.161.3.90 (2000).
CAS Статья PubMed Google ученый
Рид Л. М. Патология хронического бронхита. Ланцет 266 , 274–278 (1954).
CAS PubMed Google ученый
Haswell, LE, Hewitt, K., Thorne, D., Richter, A. & Gaca, MD Общее количество твердых частиц сигаретного дыма увеличивает количество секретирующих слизистых клеток. in vitro : потенциальная модель гиперплазии бокаловидных клеток . Toxicology in vitro: международный журнал, опубликованный совместно с BIBRA 24 , 981–987, https://doi.org/10.1016/j.tiv.2009.12.019 (2010).
CAS Статья Google ученый
Zuyderduyn, S. et al . Воздействие IL-4 и IL-13 во время мукоцилиарной дифференцировки эпителиальных клеток бронхов увеличивает антимикробную активность и экспрессию антимикробных пептидов. Респираторные исследования 12 , 59, https: // doi.org / 10.1186 / 1465-9921-12-59 (2011).
CAS Статья PubMed PubMed Central Google ученый
Чен, Ю. и др. . Стимуляция экспрессии гена муцина дыхательных путей интерлейкином (IL) -17 через паракринную / аутокринную петлю IL-6. Журнал биологической химии 278 , 17036–17043, https://doi.org/10.1074/jbc.M210429200 (2003).
CAS Статья PubMed Google ученый
Shao, M. X. & Nadel, J. A. Двойная оксидаза-1-зависимая экспрессия муцина MUC5AC в культивируемых эпителиальных клетках дыхательных путей человека. Proceedings of the National Academy of Sciences of the United States of America 102 , 767–772, https://doi.org/10.1073/pnas.0408932102 (2005).
ADS CAS Статья PubMed PubMed Central Google ученый
Кан, Дж. Х., Хван, С. М. и Чунг, И.Y. S100A8, S100A9 и S100A12 активируют эпителиальные клетки дыхательных путей, чтобы продуцировать MUC5AC через пути ERK и NF-kappaB. Иммунология, https://doi.org/10.1111/imm.12352 (2014).
Артикул Google ученый
Яги, А., Заман, А., Кокс, Г. и Долович, М. Б. Цилиарное биение подавляется в носовых ресничках у субъектов с хронической обструктивной болезнью легких. Респираторная медицина 106 , 1139–1147, https: // doi.org / 10.1016 / j.rmed.2012.04.001 (2012).
Артикул PubMed Google ученый
Вашье И. и др. . Воспалительные особенности слизистой оболочки носа у курильщиков с и без ХОБЛ. Грудь 59 , 303–307 (2004).
CAS Статья Google ученый
Сиссон, Дж. Х. и др. . Дым и вирусная инфекция вызывают потерю ресничек, обнаруживаемую цитологическим исследованием бронхоальвеолярного лаважа и динеиновым ELISA. Американский журнал респираторной медицины и реанимации 149 , 205–213, https://doi.org/10.1164/ajrccm.149.1.8111584 (1994).
CAS Статья PubMed Google ученый
Леопольд П. Л. и др. . Курение связано с укорочением ресничек дыхательных путей. PloS one 4 , e8157, https://doi.org/10.1371/journal.pone.0008157 (2009).
ADS CAS Статья PubMed PubMed Central Google ученый
Балленджер, Дж. Дж. Экспериментальное воздействие сигаретного дыма на респираторные реснички человека. Медицинский журнал Новой Англии 263 , 832–835, https://doi.org/10.1056/NEJM196010272631704 (1960).
CAS Статья PubMed Google ученый
Gomperts, B.N., Kim, L.J., Flaherty, S.A. & Hackett, B.P. IL-13 регулирует потерю ресничек и экспрессию foxj1 в эпителии дыхательных путей человека. Американский журнал респираторных клеток и молекулярной биологии 37 , 339–346, https: // doi.org / 10.1165 / rcmb.2006-0400OC (2007).
CAS Статья PubMed PubMed Central Google ученый
Gohy, S. T. et al. . Снижение регуляции полимерных иммуноглобулиновых рецепторов при хронической обструктивной болезни легких. Стойкость в культивируемом эпителии и роль трансформирующего фактора роста бета. Американский журнал респираторной медицины и реанимации 190 , 509–521, https: // doi.org / 10.1164 / rccm.201311-1971OC (2014).
CAS Статья PubMed Google ученый
Gohy, S. T. et al. . Импринтинг эпителия дыхательных путей ХОБЛ для дедифференцировки и мезенхимального перехода. Европейский респираторный журнал 45 , 1258–1272, https://doi.org/10.1183/036.00135814 (2015).
Артикул PubMed Google ученый
Ауэрбах, О. и др. . Изменения бронхиального эпителия в связи с курением и раком легкого; отчет о проделанной работе. Медицинский журнал Новой Англии 256 , 97–104, https://doi.org/10.1056/NEJM195701172560301 (1957).
CAS Статья PubMed Google ученый
Ридер, Дж. Р. и др. . Патогенез метаплазии слизистых клеток на модели мышиной астмы. Американский журнал патологии 162 , 2069–2078, https://doi.org/10.1016/S0002-9440(10)64338-6 (2003).
Артикул PubMed PubMed Central Google ученый
Бедроссиан, К. В., Гринберг, С. Д., Сингер, Д. Б., Хансен, Дж. Дж. И Розенберг, Х. С. Легкие при муковисцидозе. Количественное исследование, включающее распространенность патологических данных среди разных возрастных групп. Хум Патол 7 , 195–204 (1976).
CAS Статья Google ученый
Ghosh, M. et al. . Истощение базальных клеток-предшественников дыхательных путей при ранней и установленной хронической обструктивной болезни легких. Американский журнал респираторной медицины и реанимации 197 , 885–896, https://doi.org/10.1164/rccm.201704-0667OC (2018).
CAS Статья PubMed PubMed Central Google ученый
Штаудт, М. Р. и др. . Дыхательные пути Базальные стволовые клетки / клетки-предшественники обладают пониженной способностью регенерировать эпителий дыхательных путей при хронической обструктивной болезни легких. Американский журнал респираторной медицины и реанимации 190 , 955–958, https://doi.org/10.1164/rccm.201406-1167LE (2014).
Артикул PubMed PubMed Central Google ученый
Gras, D. et al. . Эпителиальные мерцательные бьющиеся клетки необходимы для роста культуры ex vivo ALI. BMC, легочная медицина 17 , 80, https://doi.org/10.1186/s12890-017-0423-5 (2017).
Артикул PubMed PubMed Central Google ученый
Gras, D. et al. . Модель ex vivo тяжелой астмы с использованием восстановленного бронхиального эпителия человека. Журнал аллергии и клинической иммунологии 129 , 1259–1266 e1251, https://doi.org/10.1016/j.jaci.2012.01.073 (2012).
Артикул PubMed Google ученый
Lam, H.C. et al. . Селективная аутофагия, опосредованная гистон-деацетилазой 6, регулирует ассоциированную с ХОБЛ дисфункцию ресничек. Журнал клинических исследований 123 , 5212–5230, https://doi.org/10.1172/JCI69636 (2013).
CAS Статья PubMed PubMed Central Google ученый
Zuo, W. L. и др. . Взаимодействие EGF-амфирегулина в стволовых / прогениторных клетках дыхательных путей связывает патогенез вызванных курением повреждений эпителия дыхательных путей человека. Стволовые клетки , https://doi.org/10.1002/stem.2512 (2016).
Артикул Google ученый
Schamberger, A.C., Staab-Weijnitz, C.A., Mise-Racek, N. & Eickelberg, O. Сигаретный дым изменяет первичную дифференцировку эпителиальных клеток бронхов человека на границе раздела воздух-жидкость. Научные отчеты 5 , 8163, https://doi.org/10.1038/srep08163 (2015).
ADS CAS Статья PubMed PubMed Central Google ученый
Шайхиев Р. и др. . EGF сдвигает судьбу базальных клеток дыхательных путей человека в сторону эпителиального фенотипа дыхательных путей, связанного с курением. Труды Национальной академии наук Соединенных Штатов Америки 110 , 12102–12107, https: // doi.org / 10.1073 / pnas.1303058110 (2013).
ADS Статья PubMed PubMed Central Google ученый
Тайнер Дж. У. и др. . Блокирование метаплазии слизистых клеток дыхательных путей путем ингибирования антиапоптоза EGFR и сигналов трансдифференцировки IL-13. Журнал клинических исследований 116 , 309–321, https://doi.org/10.1172/JCI25167 (2006).
CAS Статья PubMed PubMed Central Google ученый
Морти, Р. Э., Конигшофф, М. и Эйкельберг, О. Преобразование передачи сигналов бета-фактора роста через возраст: от нарушения развития легких до хронической обструктивной болезни легких. Труды Американского торакального общества 6 , 607–613, https://doi.org/10.1513/pats.200908-087RM (2009).
CAS Статья PubMed Google ученый
Soler Artigas, M. et al. . Полногеномная ассоциация и широкомасштабное наблюдение выявили 16 новых локусов, влияющих на функцию легких. Природная генетика 43 , 1082–1090, https://doi.org/10.1038/ng.941 (2011).
CAS Статья PubMed Google ученый
Smolonska, J., Wijmenga, C., Postma, D. S. & Boezen, H. M. Мета-анализ генов с подозрением на хроническую обструктивную болезнь легких: резюме 20-летних исследований. Американский журнал респираторной медицины и реанимации 180 , 618–631, https: // doi.org / 10.1164 / rccm.200905-0722OC (2009 г.).
CAS Статья PubMed Google ученый
Takizawa, H. et al. . Повышенная экспрессия трансформирующего фактора роста-бета1 в эпителии мелких дыхательных путей курильщиков табака и пациентов с хронической обструктивной болезнью легких (ХОБЛ). Американский журнал респираторной медицины и реанимации 163 , 1476–1483, https://doi.org/10.1164/ajrccm.163.6.95 (2001).
CAS Статья PubMed Google ученый
Konigshoff, M., Kneidinger, N. & Eickelberg, O. Передача сигналов TGF-бета при ХОБЛ: расшифровка генетической и клеточной восприимчивости для будущей терапевтической схемы. Швейцарский медицинский еженедельник 139 , 554–563, DOI: smw-12528 (2009).
Tanabe, T., Kanoh, S., Moskowitz, W. B. & Rubin, B.K. Сердечная астма: трансформация фактора роста-бета из больного сердца приводит к плоской метаплазии в клетках дыхательных путей человека и в легких мыши. Сундук 142 , 1274–1283, https://doi.org/10.1378/chest.11-1710 (2012).
CAS Статья PubMed Google ученый
Джеттен А. М., Ширли Дж. Э. и Стоунер Дж. Регулирование пролиферации и дифференцировки эпителиальных клеток дыхательных путей с помощью TGF бета. Экспериментальные исследования клеток 167 , 539–549 (1986).
CAS Статья Google ученый
Чу, Х. В. и др. . Трансформирующий фактор роста бета2 индуцирует экспрессию муцина в эпителиальном эпителии бронхов при астме. Американский журнал патологии 165 , 1097–1106 (2004).
CAS Статья Google ученый
Harrop, C. A., Gore, R. B., Evans, C. M., Thornton, D. J. & Herrick, S. E. TGF-бета (2) снижает исходную и стимулированную IL-13 продукцию муцина первичными эпителиальными клетками бронхов человека. Экспериментальное исследование легких 39 , 39–47, https://doi.org/10.3109/018.2012.748854 (2013).
CAS Статья PubMed Google ученый
Lazard, D. S. et al. . Слизисто-цилиарная дифференцировка эпителиальных клеток носа снижается после заживления ран in vitro . Аллергия 64 , 1136–1143, https://doi.org/10.1111/j.1398-9995.2009.02003.x (2009).
CAS Статья PubMed PubMed Central Google ученый
Макмиллан, С. Дж., Ксанту, Г. и Ллойд, К. М. Манипуляции с индуцированным аллергеном ремоделированием дыхательных путей путем лечения анти-TGF-антителами: влияние на сигнальный путь Smad. Журнал иммунологии 174 , 5774–5780, https://doi.org/10.4049/jimmunol.174.9.5774 (2005).
CAS Статья PubMed Google ученый
Брекман А., Уолтерс М. С., Тилли А. Э. и Кристал Р. Г. FOXJ1 предотвращает ингибирование роста ресничек сигаретным дымом в эпителии дыхательных путей человека in vitro . Американский журнал респираторных клеток и молекулярной биологии 51 , 688–700, https://doi.org/10.1165/rcmb.2013-0363OC (2014).
CAS Статья PubMed PubMed Central Google ученый
Simet, S. M. et al. .Длительное воздействие сигаретного дыма на мышиной модели функции мерцательных эпителиальных клеток. Американский журнал респираторных клеток и молекулярной биологии 43 , 635–640, https://doi.org/10.1165/rcmb.2009-0297OC (2010).
CAS Статья PubMed PubMed Central Google ученый
Puchelle, E., Zahm, J. M., Tournier, J. M. & Coraux, C. Ремонт, регенерация и ремоделирование эпителия дыхательных путей после травмы при хронической обструктивной болезни легких. Труды Американского торакального общества 3 , 726–733, https://doi.org/10.1513/pats.200605-126SF (2006).
CAS Статья PubMed Google ученый
Bouzin, C. et al. . Цифровая патология: элементарный, быстрый и надежный автоматизированный анализ изображений. Гистопатология 68 , 888–896, https://doi.org/10.1111/his.12867 (2016).
Артикул PubMed Google ученый
Vandesompele, J. et al. . Точная нормализация количественных данных ОТ-ПЦР в реальном времени путем геометрического усреднения нескольких генов внутреннего контроля. Биология генома 3 , Исследование 0034 (2002).
Артикул Google ученый
SIU SOM Гистология CRR
SIU SOM Гистология CRRРуководство по гистологическому исследованию
Дыхательные пути
Эти примечания являются вспомогательным ресурсом, НЕ заменяют запланированный ресурсные сессии или учебники. Если вы используете это онлайн учебное пособие, пожалуйста, обратитесь к своим учебникам и атласы для более богатой и подробной информации.
SAQ — S elf A оценка Q опыты
т ОП ЭТОЙ СТРАНИЦЫ / СОДЕРЖАНИЕ ДЛЯ ЭТОЙ СТРАНИЦЫ / УКАЗАТЕЛЬ ДЫХАТЕЛЬНОГО ИЗОБРАЖЕНИЯ .Препарат
Прежде чем изучать гистологию какой-либо конкретной системы или органа, следует: оценить основные концепции и инструменты гистологии, представленные в Введение в гистологию в этом интернет сайт.В частности, следует знать четыре основные типы тканей, особенно эпителий и соединительной ткани и с основными инструментами гистологии.
Обзор гистологии дыхательных путей
Легкое — один из нескольких органов, покрытых большой эпителиальной поверхностью. площадь в компактный объем. Основная организационная модель такова: железы, в которой ветвится дерево трубки обеспечивают непрерывность от внешней поверхности тела к большому количеству эпителиальных клеток.Действительно, дыхательные пути начинают жизнь как инвагинация эпителиальной (энтодермальной) ткани, и эмбриональные легкие даже имеют гистологический вид соединения, экзокринный железы. Лишь довольно поздно в развитии кубовидный эпителиальный клетки концевых альвеол принимают тонкую плоскую форму, характерную для выстилка зрелых газообменных воздушных мешков. И некоторые важные секреторные функция сохраняется в виде кубовидной формы, выделяющей большое количество поверхностно-активных веществ. альвеолярные клетки.
- Как в крупных железах, так и в дыхательной системе система проводящих переходов образуют разветвленное «дерево», с функциональные единицы на конце каждой веточки.
- В дыхательной системе «ствол» дерева. это трахея, более крупные ветви называются бронхами (единственное число «бронх»), а более мелкие ветви называются бронхиолами. (В железе проводящие ходы называются «протоками».)
- В легких эпителиальные клетки на концах всех веточек образуют «дыхательные единицы», также называется альвеолами (единственное число, «альвеолой»). (В железе секреторные единицы на концах веточек еще иногда называют «альвеолами», что означает небольшую полость или полость.)
Плевральная полость выстлана мезотелием .Это включает в себя как внешняя поверхность легкого и прилегающая внутренняя поверхность грудной стенки. (Простая плоская мезотелиальная ткань также выстилает другие основные полости тела, перикард и брюшина.)
В проводящие проходы дыхательной системы (носовая полость, трахея, бронхи и бронхиолы) выстланы псевдостратифицированными столбчатыми эпителиальная ткань, которая состоит из ресничек и включает секретирующие слизь бокалов .Поступающие частицы (пыль, бактерии) прилипают к слизь, которая затем уносится ресничками вверх и прочь.
Потому что прохождение воздуха зависит от широко открытых проходов, более крупных респираторных проходы (трахея и бронхи) поддерживаются скелетными элементами в виде хрящевых колец. Обширное сосудистое сплетение позволяет теплообмену кондиционировать воздух до он достигает нежных альвеол.
The дыхательная или газообменная поверхность состоит из миллионов небольших мешочков, или альвеолы, выстланные простой чешуйчатой эпителий. Этот эпителий очень тонкий, чтобы облегчить распространение кислорода и CO 2 . Альвеолярные стенки также содержат кубовидную форму. клетки, секретирующие сурфактант. Поверхностно-активное вещество преодолевает тенденцию альвеолярные стенки должны слипаться друг с другом (что приведет к стиранию воздушного пространства).Как и в любой железе, каждая альвеола окружена капиллярами. В легких газообменная функция этого легочного сосудистая сеть имеет решающее значение для функционирования органов и самой жизни.
т ОП ЭТОЙ СТРАНИЦЫ / СОДЕРЖАНИЕ ДЛЯ ЭТОЙ СТРАНИЦЫ / УКАЗАТЕЛЬ ДЫХАТЕЛЬНОГО ИЗОБРАЖЕНИЯ .Проводка система.
Большинство дыхательных путей, идущих из носовой полости через бронхи, выстланы ресничным, псевдостратифицированным столбчатый эпителий с бокаловидными клетками.Бронхиолы выстланы простой кубовидный эпителий. (Альвеолы легких, в контрастные, на подкладке очень тонкие простые плоский эпителий.)
Псевдостратифицированный респираторный эпителий состоит в основном из столбчатых реснитчатых клеток . Биение ресничек сметает слизь и пыль, которые она уносит по бронхам и трахею к глотке, где ее можно проглотить.
За недавние исследования функции ресничек в отношении свойства слизистой дыхательных путей, см. Б.Ф. Дики (2012) Идя дальше Твердая земля, Наука 24 августа 2012: 924-925. [DOI: 10.1126 / science.1227091]
Электронные микрофотографии ресничек можно увидеть на WebPath и в Elektronenmikroskopischer Атлас в Интернете.
Проконсультируйтесь с вашим учебником по гистологии и / или атласом (например, Rhodin, рисунок 31-22 ) для дополнительных деталей и электронных микрофотографий этих ячеек.(Мерцательный эпителий также характерен для женский репродуктивный тракт.)
рассеянный среди ресничных клеток иногда встречаются бокаловидных клеток . Эти клетки выделяют слизь, которая увлажняет эпителиальную поверхность (поэтому реснитчатые клетки может функционировать) и прилипает к вдыхаемым частицам (так что пыль и бактерии улавливаются прежде, чем они попадут в альвеолы).
Для недавних исследований свойств слизистых дыхательных путей. относительно функции ресничек см. B.Ф. Дики (2012) Идущий по твердому телу Земля, Наука 24 августа 2012: 924-925. [DOI: 10.1126 / science.1227091]
Название «кубок» относится к форме ячейки, узкие у основания и выпуклые на вершине. Апикальный конец каждой чашки ячейка занята большой массой слизи, которая сжимает соседние ячейки (тем самым придавая характерную форму кубка) и смещает ядро к базальному концу клетки.Как и в других слизистые клетки, ядро компактное и интенсивно окрашенный (базофильный) H&E.
Проконсультируйтесь с вашим учебником по гистологии и / или атласом (например, Rhodin, рисунок 31-22 ) для дополнительных деталей и электронных микрофотографий этих ячеек. Подобные клетки также могут быть обнаружены в желудочно-кишечном тракте. тракт.
Базальные клетки (те, ядра которых лежат низко в эпителии, около базальная мембрана) считаются источником замены реснитчатых и бокаловидные клетки.
Проконсультируйтесь с вашим учебником по гистологии и / или атласом (например, Rhodin, рисунок 31-22 ) для дополнительных деталей и электронных микрофотографий этих ячеек.
дюйм наш набор слайдов, мерцательный респираторный эпителий лучше всего представлен слайдами трахеи (или «трахеи и пищевода»).
т OP ЭТОЙ СТРАНИЦЫ / СОДЕРЖАНИЕ ДЛЯ ЭТОЙ СТРАНИЦЫ / УКАЗАТЕЛЬ ДЫХАТЕЛЬНОГО ИЗОБРАЖЕНИЯ .
Носоглотка
Псевдостратифицированный респираторный эпителий начинается в полости носа и продолжается с небольшими вариациями через носоглотку , и ниже трахею, бронхи и бронхиолы.
Слизистые поверхности носовых ходов важны для кондиционирования воздух прежде, чем он достигнет более нежной альвеолярной ткани. Многие маленькие железы обеспечивают влагу для увлажнения, а также слизь для прилипания к входящим пыль.Обширное сосудистое сплетение обеспечивает теплообмен, так что воздух достигая альвеол, не слишком холодно и не слишком жарко.
Вы когда-нибудь замечали, какой большой нос у верблюда? В Функция кондиционирования носа особенно эффективна у этого животного. Когда существо вдыхает, горячий сухой воздух пустыни увлажняется испарением. выделений из носа, а сами носовые ходы охлаждаются охлаждение испарением.Во время выдоха охлаждаемые каналы конденсируются. и восстанавливают влагу, обеспечивая важный вклад в сохранение воды.
В наших собственных телах кондиционирование воздуха не так эффективно как у верблюда. Но испарительное охлаждение дыхательных путей вносит значительный вклад в терморегуляцию во время интенсивных тренировок. упражнение. (Другими словами, многие калории, потраченные во время тренировки не выполняем никакой полезной работы, а только испаряем выдыхаемую нами воду.)
В контраст между респираторным эпителием носоглотки и многослойный плоский эпителий полости рта можно увидеть в поперечном сечении неба (или, аналогично, поперечный разрез надгортанника).
Один небольшая область носовой полости, обонятельной слизистой оболочки , имеет очень модифицированный эпителий, содержащий специализированные сенсорные рецепторные клетки.Несмотря на то что обонятельные рецепторы имеют вид столбчатых эпителиальных клеток, по сути, это нервные клетки. Каждая обонятельная рецепторная клетка несет на его апикальном конце своеобразный выступ или «обонятельный пузырек», от которого прорастают несколько длинных, но неподвижных ресничек (см. Электронный микроскоп). Atlas im Internet, reichkolben , для ЭМ изображений этой структуры). Каждая обонятельная клетка также имеет аксон, который идет от базального конца клетка к обонятельной луковице головного мозга.Множество аксонов обонятельных рецепторы проходят через медиальную часть решетчатой кости, которая называется решетчатая пластина («решетчатая форма» означает «как решето», т.е. дырявый).
Клетки обонятельного эпителия прекрасны, причудливой формы, отображающей элементы как эпителиальной, так и нервной формы. Известный врач-эссеист Льюис Томас выбрал эти клетки как одно из «семи чудес современности». Мир »:
«Мое пятое чудо — обонятельная рецепторная клетка, расположен в эпителиальной ткани высоко в носу, нюхает воздух в поисках подсказки к окружающей среде, аромат друзей, запах листьев дым, завтрак, ночь и перед сном, и даже роза, как говорят, запах святости.Ячейка, которая делает все это, стреляет отключение срочных сообщений в самых глубоких частях мозга, включение одно странное необъяснимое воспоминание за другим, само по себе является правильным мозгом клетка, сертифицированный нейрон, принадлежащий мозгу, но далеко в под открытым небом, носясь по всему миру. Как ему удается понять что он чувствует, различая жасмин и все остальное, кроме жасина безошибочность — это один из глубоких секретов нейробиологии. Это было бы достаточно удивительно, но это еще не все. Это население клеток мозга, в отличие от других нейронов центральной нервной системы позвоночных. система обновляется каждые несколько недель; клетки изнашиваются, умирают и заменены совершенно новыми ячейками, подключенными к тем же самым глубоким центрам много миль назад в мозгу, ощущая и запоминая одни и те же чудесные запахи. Если и когда мы достигнем понимания этих клеток и их функций, включая настроения и прихоти под их управлением, мы будем знать много больше о разуме, чем сейчас, в другом мире.»[Льюис Томас (1983) Семь чудес, стр. 55-63, в Late Night Мысли о слушании к Девятой симфонии Малера .]
Проконсультируйтесь с вашим учебником по гистологии и / или атласом (например, Rhodin, цифры 31-5 — 31-8 ) для получения дополнительных деталей и электронных микрофотографий обонятельных клеток.
Миндалины являются локализованными лимфоидными узлами. находится в слизистой оболочке глотки (а также язык и нёбо).Каждая миндалина состоит из эпителия. крипта (инвагинированный карман), окруженная плотными скоплениями лимфы узелки.
Лимфатические узелки (также называемые лимфоидными фолликулами) — это участки где собираются лимфоциты. В центре каждого лимфатического узла находится «зародышевый центр», где лимфоциты размножаться.
Глоточные миндалины (также называемые «аденоиды») предоставляют участки, где клетки иммунного надзора (лимфоциты) может столкнуться с чужеродными антигенами, которые попадают в организм через воздуха.
Подробнее о лимфоидных тканях, связанных со слизистой оболочкой (MALT), обратитесь к тексту по гистологии (например, стр. 134-5 в Stevens & Lowe).
глотка миндалины напоминают таковые из неба (небные миндалины, проиллюстрированные здесь), но с реснитчатыми, псевдостратифицированными эпителий, а не стратифицированный плоский эпителий, выстилающий поверхность и крипты.
т OP ЭТОЙ СТРАНИЦЫ / СОДЕРЖАНИЕ ДЛЯ ЭТОЙ СТРАНИЦЫ / УКАЗАТЕЛЬ ДЫХАТЕЛЬНОГО ИЗОБРАЖЕНИЯ .
трахеи, бронхов и бронхиолы
Трахея является «стволом» ветвящегося дерева проходы, ведущие в легкие. Его основные гистологические специализации включать скелетное армирование в виде неполной (т.е. C -образной) кольца хряща и сосудистое (венозное) сплетение, которое способствует теплообмену с состоянием воздух, прежде чем он достигнет нежных альвеол.
Подробная информация о мерцательном псевдостратифицированном эпителии. трахеи, см. выше.
Трахея делится на два основных бронха (единичный, бронх), по одному в каждое легкое. В затем первичные бронхи многократно делятся на более мелкие и еще более мелкие бронхиол .Таким образом, бронхов и бронхиол , соответственно, большая и меньшая ветви воздуховодное дерево, простирающееся в легкие. Количество хрящей, толщина дыхательных путей. эпителий, и степень псевдостратификации уменьшаются как единое целое. спускается по воздуховодным путям к альвеолам. Различие между бронхами и бронхиолами несколько условно, а вообще бронхи имеют хрящевое укрепление и столбчатый эпителиальный слой, в то время как отсутствие бронхиол хрящ и простой кубическая облицовка. Помимо реснитчатые и секретирующие слизь клетки, бронхиолярный эпителий май включают клубных клеток (экзокринные клетки бронхиол), роль которых неясна, но которые кажутся обладают некоторой специализированной синтетической и секреторной функцией.
(В старых учебниках экзокринные клетки бронхиол именуются «клетками Клары», в названии исследователь Макс Клара, работавший над телами заключенных, казненных нацистским режимом ранее до ВМВ. Из-за этой запятнанной истории [см. Science 329: 275, 16 июля 2010 г.], альтернативный термин «клубные ячейки» был принят рядом журналов и обществ.)
Маленькие слизистые железы разбросаны по большей части дыхательных путей. дерево и иногда может быть замечено в стенке бронхов или бронхиол.
Стенки дыхательных путей также имеют гладкую мускулатуру, что позволяет регулирование распределения воздуха по объему легких.
т ОП ЭТОЙ СТРАНИЦЫ / СОДЕРЖАНИЕ ДЛЯ ЭТОЙ СТРАНИЦЫ / УКАЗАТЕЛЬ ДЫХАТЕЛЬНОГО ИЗОБРАЖЕНИЯ .Респираторный (газообменная) область легкого
Легкое состоит из функциональных дыхательных единиц, называемых «воздушными мешками». или альвеол (единичных, альвеол ), каждая связаны через бронхиолы и бронхи к трахее.В легкое иногда ошибочно изображается как воздушный шарик на конце большого бронх. Воздушного шара нет . Один можно представить, что каждая альвеола представляет собой крошечный шарик, но даже это не точный. Легкое больше похоже на хорошо организованную губку. Каждая альвеола разделяет свою стенку (межальвеолярную перегородку) с прилегающими альвеолами. Альвеолы не может рухнуть по отдельности, только все вместе.
Справка по клинической гистологии : Нормальный объем легких — это в основном пространство, заполненное воздухом.В идеале гистологические образцы, это пространство сохраняется, сохраняя легкое раздутым во время приготовления. Но для удобства клинические образцы часто готовятся в несколько свернутом состоянии. Не удивляйся по образцам легких, в которых альвеолы кажутся уплощенными, с альвеолярными стенками морщинистые и спрессованные, с уменьшением воздушного пространства. За пример см. WebPath.
Альвеолы отделены друг от друга тонкими стенками альвеол ( межальвеолярных перегородок, ).Каждая альвеола выстлана простыми плоский эпителий, чрезвычайно тонкий для облегчения диффузии кислорода при этом все еще образуя эпителиальный барьер между наружным воздухом и внутренние жидкости организма. В между двумя эпителиальными поверхностями лежит сеть капилляров, через которые протекают красные кровяные тельца, гемоглобин которых поглощает кислород для транспорт к остальной части тела.
Другими словами, каждая межальвеолярная перегородка состоит из простых плоский эпителий с обеих сторон с капиллярами зажатый между ними.
До поглощения гемоглобином молекула кислорода должен сначала достичь альвеолы, а затем диффундировать через плазматическую мембрану плоскоклеточная эпителиальная клетка через очень тонкую цитоплазму эпителиальных клеток, через плазматическую мембрану на другой стороне эпителиальной клетки, через базальная мембрана, отделяющая эпителий от подлежащего ткань через базальную мембрану, которая окружает каждый капилляр (эти две базальные мембраны могут быть слиты вместе) через плазму мембрана эндотелиальной клетки капилляров, через очень тонкую цитоплазму этой клетки, через плазматическую мембрану на стороне просвета капилляров эндотелия клетки, через немного плазмы крови и, наконец, через мембрану эритроцита.Ух!
Электронная микрофотография ресничек гемато-воздушного барьера. можно увидеть на Elektronenmikroskopischer Атлас в Интернете.
Клиническое примечание: Альвеолы могут обеспечить уютное рай для роста бактерий, ведущих к пневмонии и воспалениям. За изображение альвеол, заполненных воспалительными клетками, см. WebPath. (Дополнительную патологию легких см. Ниже.)
В клетки плоского эпителия альвеолярных стенок иногда называют типом . Пневмоциты I . Как отмечалось выше, эти плоскоклеточные Клетки типа I способствуют газообмену.
Среди плоских клеток иногда встречаются более крупные кубовидные клетки, иногда называют больших альвеолярных клеток и иногда называют Тип Пневмоциты II . Эти клетки секретируют сурфактант, который служит критическая функция предотвращения прилипания альвеолярных стенок друг к другу.
Проконсультируйтесь с вашим учебником по гистологии и / или атласом (например, Rhodin, цифры с 31-45 до 31-54 ) для дополнительных деталей и электроники микрофотографии клеток, связанных с альвеолами легких.
См. Электронный микроскоп Атлас в Интернете для (в основном немаркированных) ЭМ изображений легких.
Потому что реальная форма газообменных пространств несколько сложна, есть некоторая дополнительная терминология, используемая для описания.Терминальные бронхиолы, те, которые открываются непосредственно в газообменные пространства, иногда называют респираторными. Ашхабад . Обычно они открываются в проходы, называемые дыхательных путей. протоки , которые открываются непосредственно в альвеолы, а также в другие проходы, называется дыхательных мешков , которые также открываются в альвеолы. Края альвеолярных стенок, которые образуют входы в дыхательные мешки и альвеолы содержат небольшие пучки гладких мышц, которые позволяют контролировать распределение воздуха между различными областями легких.
Кому держать альвеолы в чистоте, амебоидные фагоцитарные клетки ползают по поверхности стенки альвеол и заглатывают любой инородный материал, с которым они сталкиваются. Эти ячейки иногда называют «пылевыми ячейками», но в основном они вышедшие макрофаги соединительной ткани и на эпителиальную поверхность альвеол.
Возможно, забавно отметить, что эти клетки ведут себя скорее как независимые агенты, покинув собственно тело, пересекая альвеолярный эпителий.Хотя они могут снова пересекают эпителий и повторно попадают в организм, эти клетки также могут быть захватил дыхательные пути ресничками и проглотил, фактически становясь пищей.
т ОП ЭТОЙ СТРАНИЦЫ / СОДЕРЖАНИЕ ДЛЯ ЭТОЙ СТРАНИЦЫ / УКАЗАТЕЛЬ ДЫХАТЕЛЬНОГО ИЗОБРАЖЕНИЯ .Сосудистая сеть легких
Больше сосуды, как вены, так и артерии, имеют тенденцию следовать тому же ветвлению, что и дыхательные пути, поэтому соединительная ткань вокруг каждого бронха и бронхиолы обычно содержится артерия и вена.Поскольку малое кровообращение имеет более низкое давление чем большой круг кровообращения, легочные артерии и вены, как правило, имеют больше тонкие стены, чем те, что видны в других частях тела.
В существенная газообменная функция легких может осуществляться только потому, что альвеолярный стены обильно снабжены капиллярами. Действительно, большая часть «основной массы» альвеолярных стенок состоит из клеток крови, проходящих через эти капилляры.
Проконсультируйтесь с вашим учебником по гистологии и / или атласом (например, Rhodin, цифры от 31-55 до 31-67 ) для дополнительных деталей и электроники микрофотографии легочных сосудов.
т ОП ЭТОЙ СТРАНИЦЫ / СОДЕРЖАНИЕ ДЛЯ ЭТОЙ СТРАНИЦЫ .Примеры патологии легких ,
Следующие ссылки иллюстрируют некоторые отклонения от нормального внешнего вида легочной ткани. представлен на WebPath интернет сайт.На этих изображениях попытайтесь распознать основные черты легкого. ткани, а также конкретной патологии. Пневмония . Альвеолы заполняются воспалительными клетками
Индекс изображений
Комментарии
и вопросы: [email protected]
SIUC / Школа of Medicine / Anatomy / David King
http: // www.siumed.edu/~dking2/crr/rsguide.htm
Последнее обновление: 20 мая 2016 г. / dgk
Бокаловидные клетки — Окончательное руководство
Определение
Бокаловидные клетки — это особый тип эпителиальных клеток, которые секретируют муцины, которые являются важными компонентами слизи. Чаще всего они обнаруживаются в дыхательных путях и желудочно-кишечном тракте, где составляют часть поверхностного эпителия. Секреция слизи в этих путях смазывает и защищает слизистую оболочку органов.Повышенная активность или количество бокаловидных клеток связывают с некоторыми заболеваниями.
Гистологическое окрашивание бокаловидных клеток. Клетки окрашивают методом Периодовой кислоты – Шиффа, который окрашивает гликопротеины, присутствующие в слизи, в темно-фиолетовый цвет.Структура бокаловидных клеток
Бокаловидные клетки получили свое название от их чашеобразного вида. Их ширина составляет примерно четверть своего роста, и они поляризованы, то есть их внутренняя организация асимметрична.
Их цитоплазматическое содержимое (особенно секреторные пузырьки) локализовано на апикальном конце клетки, который является узкой стороной, ближайшей к краю ткани.Ядро и другие органеллы, такие как митохондрии, расположены на базальном конце, более широкой стороной к основанию ткани.
Бокаловидные клетки содержат специализированные структуры, которые позволяют им выполнять свою функцию по производству и секреции компонентов слизи. Эти особенности включают обширный и широко распространенный эндоплазматический ретикулум и аппарат Гольджи по всей цитоплазме. Эти структуры представляют собой органеллы, которые имеют решающее значение для производства и сворачивания белка, а также для модификации и транспорта, соответственно.
Кроме того, на апикальной стороне клетки обнаружено множество секреторных гранул. Это позволяет ему производить и доставлять большое количество секрета во внеклеточное пространство.
Наконец, на апикальном конце бокаловидной клетки часто есть небольшие выступы, называемые микроворсинками, которые увеличивают площадь поверхности клетки. Они увеличивают пространство клетки, чтобы секретировать свое содержимое в просвет.
Эти адаптации имеют решающее значение для того, чтобы бокаловидные клетки могли выполнять свою функцию по эффективному производству и секреции муцинов.
Структура бокаловидных клетокРасположение бокаловидных клеток
Бокаловидные клетки обычно находятся разбросанными среди клеток простых эпителиальных тканей, секретирующих слизь. В некоторых областях имеется небольшое количество клеток, но в других очень много бокаловидных клеток.
Некоторые регионы, где вы можете ожидать найти бокаловидные клетки, — это респираторный (трахея, бронхи и бронхиолы) и желудочно-кишечный тракт (тонкий кишечник и толстый кишечник). Они также находятся в конъюнктиве (оболочке глаза и века), где они расположены в многослойном эпителии.Это контрастирует с их появлением в простой эпителиальной ткани дыхательной и желудочно-кишечной систем.
Функция бокаловидных клеток
Роль бокаловидных клеток заключается в выработке секрета, образующего слизь, выстилающую поверхность некоторых эпителиальных тканей
Секреция муцинов
Бокаловидные клетки синтезируют и секретируют белки, называемые муцинами, которые являются основными часть слизи — гелеобразный секрет.
Муцины — это белки с высокой степенью гликозилирования, что означает, что они имеют много углеводных остатков, прикрепленных к их структуре.Эти углеводы придают слизи слизистую гелеобразную консистенцию. Присоединение этих углеводных групп происходит в аппарате Гольджи под действием ферментов, называемых гликозилтрансферазами.
Отсюда муцины образуют гранулы секрета, которые транспортируются к мембране на апикальной стороне клетки. При необходимости эти гранулы сливаются с мембраной посредством экзоцитоза, высвобождая муцины за пределы клетки в просвет органа.
Основные белки муцина, секретируемые бокаловидными клетками дыхательных путей, называются MUC5AC и MUC5B.В дыхательных путях они чаще секретируют другой белок муцин, MUC2.
Бокаловидные клетки производят и секретируют муцины, входящие в состав слизи. Слизь выстилает эпителий респираторных и желудочно-кишечных тканейСлизь
Муцины являются компонентом слизи, которая представляет собой вязкую жидкость, которая в основном состоит из муцинов, воды и неорганических солей. Он смазывает подкладки ткани, из которой высвобождается, и защищает поверхность от вредных частиц и внешней среды.
- Дыхательная система — бокаловидные клетки особенно важны в дыхательных путях. Они часто обнаруживаются в трахее, бронхах и бронхиолах, где слизь необходима для улавливания и защиты нежной альвеолярной ткани легких от посторонних частиц, которые могут их повредить. Эти частицы включают пыль и аллергены, а также потенциальные патогены, такие как бактерии.
- Пищеварительная система — слизь важна по всему желудочно-кишечному тракту для смазывания поверхностей тканей, по которым материалы должны скользить вниз.Например, пища скользит по пищеводу и защищает слизистую оболочку желудка от кислой среды. Бокаловидные клетки в первую очередь участвуют в производстве слизи в нижнем отделе кишечника, а не в желудке.
- Репродуктивная система — цервикальная слизь также вырабатывается в репродуктивных путях, но обычно это не касается бокаловидных клеток. Вместо этого другие типы клеток выделяют цервикальную слизь.
Клиническая значимость
Бокаловидные клетки участвуют в некоторых заболеваниях либо из-за их повышенной активности (гиперпродукция слизи), либо из-за увеличения количества, либо из-за аномального присутствия в новых участках.
Повышенная секреция муцина
Повышенная выработка слизи связана с астмой и хроническим бронхитом. Астма — это аллергическое состояние, связанное с воспалением дыхательных путей. Часть патофизиологии астмы включает увеличение количества бокаловидных клеток в дыхательных путях, называемое гиперплазией. Гиперплазия приводит к увеличению выработки слизи и ухудшению симптомов астмы.
Хронический бронхит — еще одно заболевание, связанное с гиперплазией бокаловидных клеток и повышенным образованием слизи.Это связано с раздражением бронхиол, вызывающим скопление слизи в легких. Это раздражение эпителия обычно вызывается курением, которое стимулирует выработку муцина.
Гиперпродукция слизи бокаловидными клетками может вызвать хронический бронхит.Метаплазия бокаловидных клеток.
Метаплазия бокаловидных клеток — это случаи, когда бокаловидные клетки обнаруживаются в местах, которых обычно не ожидается. Это часто называют кишечной метаплазией, потому что бокаловидные клетки часто считаются клетками кишечника (так как это одно из мест, где они в первую очередь обнаруживаются).Такие аберрантные клетки идентифицируются с помощью процесса, называемого гистологией, когда структура ткани и состав клеток исследуются под микроскопом.
Эта метаплазия может возникать при заболевании, называемом пищеводом Баррета, которое характеризуется наличием бокаловидных клеток в пищеводе. Пищевод Баррета — это воспалительное заболевание, вызванное длительным кислотным рефлюксом. Этот постоянный рефлюкс повреждает пищевод, заставляя ткань содержать аномальные типы клеток, такие как бокаловидные клетки.
Метаплазия бокаловидных клеток может также возникать при различных формах рака женских половых путей, включая эндоцервикальные аденокарциномы, а также при доброкачественных поражениях шейки матки.
Карциноид бокаловидных клеток
Карциноид бокаловидных клеток — это редкий вид рака, который почти всегда обнаруживается в аппендиксе, а иногда и в желудочно-кишечном тракте. Эти опухоли представляют собой тип нейроэндокринной опухоли, которая является опухолью, возникающей из клеток, вырабатывающих гормоны, а также проявляет черты более агрессивного типа опухоли, называемой аденокарциномой. Чаще всего они встречаются у людей старше пятидесяти лет и обычно имеют хороший прогноз: более 75% людей выживают через пять лет после постановки диагноза.
Викторина
Библиография
Показать / скрыть
- Дао, Д.-П. Д., & Ле, П. Х. (2020). Гистология, бокаловидные клетки. В StatPearls . Получено с http://www.ncbi.nlm.nih.gov/pubmed/31985989
- Johansson, M. E. V., & Hansson, G. C. (2013). Слизь и бокаловидная клетка. Заболевания органов пищеварения , 31 (3–4), 305–309. https://doi.org/10.1159/000354683
- Ким, Ю.С., и Хо, С.Б. (2010, октябрь). Кишечные бокаловидные клетки и муцины в здоровье и болезни: последние выводы и прогресс. Текущие отчеты гастроэнтерологии , Vol. 12. С. 319–330. https://doi.org/10.1007/s11894-010-0131-2
- Ма, Дж., Рубин, Б. К., и Войнов, Дж. А. (1 июля 2018 г.). Муцины, слизь и бокаловидные клетки. Сундук , Vol. 154. С. 169–176. https://doi.
