Лечение тяжелой бронхиальной астмы: рекомендации Европейского респираторного общества и Американского торакального общества | Holguin
1. Chung K.F., Wenzel S.E., Brozek J.L. et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur. Respir. J. 2014; 43 (2): 343–373. DOI: 10.1183/09031936.00202013.
2. Guyatt G.H., Oxman A.D., Vist G.E. et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008; 336: 924–926. DOI: 10.1136/bmj.39489.470347.AD.
3. Wedzicha J., Miravitlles M., Hurst J.R. et al. Management of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur. Respir. J. 2017; 49 (3): 1600791. DOI: 10.1183/13993003.00791-2016.
4. Wedzicha J.A., Calverley P.M.A., Albert R.K. et al. Prevention of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur. Respir. J. 2017; 50 (3): 1602265. DOI: 10.1183/13993003. 02265-2016.
02265-2016.
5. Santanello N.C., Zhang J., Seidenberg B. et al. What are minimal important changes for asthma measures in a clinical trial? Eur. Respir. J. 1999; 14 (1): 23–27. DOI: 10.1034/j.1399-3003.1999.14a06.x.
6. Juniper E.F., Svensson K., Mork A.C. et al. Measurement properties and interpretation of three shortened versions of the asthma control questionnaire. Respir. Med. 2005; 99 (5): 553–558. DOI: 10.1016/j.rmed.2004.10.008.
7. Juniper E.F., Guyatt G.H., Willan A., Griffith L.E. Determining a minimal important change in a disease-specific quality of life questionnaire. J. Clin. Epidemiol. 1994; 47 (1): 81–87. DOI: 10.1016/0895-4356(94)90036-1.
8. Bel E.H., Wenzel S.E., Thompson P.J. et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N. Engl. J. Med. 2014; 371 (13): 1189–1197. DOI: 10.1056/NEJMoa1403291.
9. Ortega H.G., Liu M.C., Pavord I.D. et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N. Engl. J. Med. 2014; 371 (13): 1198–1207. DOI: 10.1056/NEJMoa1403290.
J. Med. 2014; 371 (13): 1198–1207. DOI: 10.1056/NEJMoa1403290.
10. Chupp G.L., Bradford E.S., Albers F.C. et al. Efficacy of mepolizumab add-on therapy on health-related quality of life and markers of asthma control in severe eosinophilic asthma (MUSCA): a randomised, double-blind, placebo-controlled, parallel-group, multicentre, phase 3b trial. Lancet Respir. Med. 2017; 5 (5): 390–400. DOI: 10.1016/S2213-2600(17)30125-X.
11. Bjermer L., Lemiere C., Maspero J. et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil levels: a randomized phase 3 study. Chest. 2016; 150 (4): 789–798. DOI: 10.1016/j.chest.2016.03.032.
12. Castro M., Mathur S., Hargreave F. et al. Reslizumab for poorly controlled, eosinophilic asthma: a randomized, placebo-controlled study. Am. J. Respir. Crit. Care Med. 2011; 184 (10): 1125–1132. DOI: 10.1164/rccm.201103-0396OC.
13. Castro M., Zangrilli J., Wechsler M.E. et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet Respir. Med. 2015; 3 (5): 355–366. DOI: 10.1016/S2213-2600(15)00042-9.
Lancet Respir. Med. 2015; 3 (5): 355–366. DOI: 10.1016/S2213-2600(15)00042-9.
14. Corren J., Weinstein S., Janka L. et al. Phase 3 study of reslizumab in patients with poorly controlled asthma: effects across a broad range of eosinophil counts. Chest. 2016; 150 (4): 799–810. DOI: 10.1016/j.chest.2016.03.018.
15. Bleecker E.R., FitzGerald J.M., Chanez P. et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. Lancet. 2016; 388 (10056): 2115–2127. DOI: 10.1016/S0140-6736(16)31324-1.
16. Castro M., Wenzel S.E., Bleecker E.R. et al. Benralizumab, an anti-interleukin 5 receptor α monoclonal antibody, versus placebo for uncontrolled eosinophilic asthma: a phase 2b randomised dose-ranging study. Lancet Respir. Med. 2014; 2 (11): 879–890. DOI: 10.1016/S2213-2600(14)70201-2.
17. FitzGerald J.M., Bleecker E. R., Nair P. et al. Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2016; 388 (10056): 2128–2141. DOI: 10.1016/S0140-6736(16)31322-8.
R., Nair P. et al. Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2016; 388 (10056): 2128–2141. DOI: 10.1016/S0140-6736(16)31322-8.
18. Nair P., Wenzel S., Rabe K.F. et al. Oral glucocorticoid-sparing effect of benralizumab in severe asthma. N. Engl. J. Med. 2017; 376 (25): 2448–2458. DOI: 10.1056/NEJMoa1703501.
19. Park H.S., Kim M.K., Imai N. et al. A phase 2a study of benralizumab for patients with eosinophilic asthma in South Korea and Japan. Int. Arch. Allergy Immunol. 2016; 169: 135–145. DOI: 10.1159/000444799.
20. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. 2019. Available at: http://ginasthma.org/2019-gina-report-global-strategy-for-asthma-management-and-prevention [Accessed: October 28, 2019].
21. National Institute for Health and Care Excellence. Mepolizumab for treating severe refractory eosinophilic asthma. TA431. 2017. Available at: www.nice.org.uk/guidance/ta431 [Accessed: October 1, 2019].
Mepolizumab for treating severe refractory eosinophilic asthma. TA431. 2017. Available at: www.nice.org.uk/guidance/ta431 [Accessed: October 1, 2019].
22. National Institute for Health and Care Excellence. Reslizumab for treating severe eosinophilic asthma. TA479. 2017. Available at: www.nice.org.uk/guidance/ta479 [Accessed: October 01, 2019].
23. National Institute for Health and Care Excellence. Benralizumab for treating severe eosinophilic asthma. TA565. 2019. Available at: www.nice.org.uk/guidance/ta565 [Accessed: October 01, 2019].
24. Institute for Clinical and Economic Review. Biologic therapies for treatment of asthma associated with type 2 inflammation: effectiveness, value, and value-based price benchmarks. 2018. Available at: https://icer-review.org/wp-content/uploads/2018/04/ICER_Asthma_Draft_Report_092418v1.pdf [Accessed: October 01, 2019].
25. Nair P., Pizzichini M.M., Kjarsgaard M. et al. Mepolizumab for prednisone-dependent asthma with sputum eosinophilia. N. Engl. J. Med. 2009; 360 (10): 985–993. DOI: 10.1056/NEJMoa0805435.
N. Engl. J. Med. 2009; 360 (10): 985–993. DOI: 10.1056/NEJMoa0805435.
26. Ortega H.G., Yancey S.W., Mayer B. et al. Severe eosinophilic asthma treated with mepolizumab stratified by baseline eosinophil thresholds: a secondary analysis of the DREAM and MENSA studies. Lancet Respir. Med. 2016; 4 (7): 549–556. DOI: 10.1016/S2213-2600(16)30031-5.
27. Mukherjee M., Aleman Paramo F., Kjarsgaard M. et al. Weight-adjusted intravenous reslizumab in severe asthma with inadequate response to fixed-dose subcutaneous mepolizumab. Am. J. Respir. Crit. Care Med. 2018; 197 (1): 38–46. DOI: 10.1164/rccm.201707-1323OC.
28. Khatri S., Moore W., Gibson P.G. et al. Assessment of the long-term safety of mepolizumab and durability of clinical response in patients with severe eosinophilic asthma. J. Allergy Clin. Immunol. 2019; 143 (5): 1742–1751. DOI: 10.1016/j.jaci.2018.09.033.
29. Busse W.W., Bleecker E.R., FitzGerald J.M. et al. Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. Lancet Respir. Med. 2019; 7 (1): 46–59. DOI: 10.1016/S2213-2600(18)30406-5.
Lancet Respir. Med. 2019; 7 (1): 46–59. DOI: 10.1016/S2213-2600(18)30406-5.
30. National Institute for Health and Care Excellence. Asthma: diagnosis, monitoring and chronic asthma management. 2017. Available at: www.nice.org.uk/guidance/ng80 [Accessed: October 28, 2019].
31. Ledford D., Busse W., Trzaskoma B. et al. A randomized multicenter study evaluating Xolair persistence of response after long-term therapy. J. Allergy Clin. Immunol. 2017; 140 (1): 162–169. DOI: 10.1016/j.jaci.2016.08.054.
32. Hanania N.A., Wenzel S., Rosen K. et al. Exploring the effects of omalizumab in allergic asthma: an analysis of biomarkers in the EXTRA study. Am. J. Respir. Crit. Care Med. 2013; 187 (8): 804–811. DOI: 10.1164/rccm.201208-1414OC.
33. Busse W., Spector S., Rosen K. et al. High eosinophil count: a potential biomarker for assessing successful omalizumab treatment effects. J. Allergy Clin. Immunol. 2013; 132 (2): 485–486. DOI: 10.1016/j.jaci.2013.02.032.
34. Izuhara K. , Ohta S., Ono J. Using periostin as a biomarker in the treatment of asthma. Allergy Asthma Immunol. Res. 2016; 8 (6): 491–498. DOI: 10.4168/aair.2016.8.6.491.
, Ohta S., Ono J. Using periostin as a biomarker in the treatment of asthma. Allergy Asthma Immunol. Res. 2016; 8 (6): 491–498. DOI: 10.4168/aair.2016.8.6.491.
35. Casale T.B., Chipps B.E., Rosen K. et al. Response to omalizumab using patient enrichment criteria from trials of novel biologics in asthma. Allergy. 2018; 73 (2): 490–497. DOI: 10.1111/all.13302.
36. Busse W., Corren J., Lanier B.Q. et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J. Allergy Clin. Immunol. 2001; 108 (2): 184–190. DOI: 10.1067/mai.2001.117880.
37. Soler M., Matz J., Townley R. et al. The anti-IgE antibody omalizumab reduces exacerbations and steroid requirement in allergic asthmatics. Eur. Respir. J. 2001; 18 (2): 254–261. DOI: 10.1183/09031936.01.00092101.
38. Humbert M., Taille C., Mala L. et al. Omalizumab effectiveness in patients with severe allergic asthma according to blood eosinophil count: the STELLAIR study. Eur. Respir. J. 2018; 51 (5): 1702523. DOI: 10.1183/13993003.02523-2017.
Respir. J. 2018; 51 (5): 1702523. DOI: 10.1183/13993003.02523-2017.
39. British Thoracic Society, Scottish Intercollegiate Guidelines Network. British Guideline on the Management of Asthma. SIGN 158. 2019. Available at: www.sign.ac.uk [Accessed: October 28, 2019].
40. Kerstjens H.A.M., Disse B., Schroder-Babo W. et al. Tiotropium improves lung function in patients with severe uncontrolled asthma: a randomized controlled trial. J. Allergy Clin. Immunol. 2011; 128 (2): 308–314. DOI: 10.1016/j.jaci.2011.04.039.
41. Kerstjens H.A.M., Engel M., Dahl R. et al. Tiotropium in asthma poorly controlled with standard combination therapy. N. Engl. J. Med. 2012; 367 (13): 1198–1207. DOI: 10.1056/NEJMoa1208606.
42. Hamelmann E., Bernstein J.A., Vandewalker M. et al. A randomised controlled trial of tiotropium in adolescents with severe symptomatic asthma. Eur. Respir. J. 2017; 49 (1): 1601100. DOI: 10.1183/13993003.01100-2016.
43. Kerwin E., Wachtel A., Sher L. et al. Efficacy, safety, and dose response of glycopyrronium administered by metered dose inhaler using co-suspension delivery technology in subjects with intermittent or mild-to-moderate persistent asthma: a randomized controlled trial. Respir. Med. 2018; 139: 39–47. DOI: 10.1016/j.rmed.2018.04.013.
Respir. Med. 2018; 139: 39–47. DOI: 10.1016/j.rmed.2018.04.013.
44. Lee L.A., Briggs A., Edwards L.D. et al. A randomized, three-period crossover study of umeclidinium as monotherapy in adult patients with asthma. Respir. Med. 2015; 109 (1): 63–73. DOI: 10.1016/j.rmed.2014.10.009.
45. Lee L.A., Yang S., Kerwin E. et al. The effect of fluticasone furoate/umeclidinium in adult patients with asthma: a randomized, dose-ranging study. Respir. Med. 2015; 109 (1): 54–62. DOI: 10.1016/j.rmed.2014.09.012.
46. Peters S.P., Bleecker E.R., Kunselman S.J. et al. Predictors of response to tiotropium versus salmeterol in asthmatic adults. J. Allergy Clin. Immunol. 2013; 132 (5): 1068–1074. DOI: 10.1016/j.jaci.2013.08.003.
47. Kerstjens H.A., Moroni-Zentgraf P., Tashkin D.P. et al. Tiotropium improves lung function, exacerbation rate, and asthma control, independent of baseline characteristics including age, degree of airway obstruction, and allergic status. Respir. Med. 2016; 117: 198–206. DOI: 10.1016/j.rmed.2016.06.013.
DOI: 10.1016/j.rmed.2016.06.013.
48. Szefler S.J., Murphy K., Harper T. 3 rd et al. A phase III randomized controlled trial of tiotropium add-on therapy in children with severe symptomatic asthma. J. Allergy Clin. Immunol. 2017; 140 (5): 1277–1287. DOI: 10.1016/j.jaci.2017.01.014.
49. National asthma education and prevention program. Guidelines for the diagnosis and management of asthma 2007 (EPR-3). Available at: www.nhlbi.nih.gov/health-topics/guidelines-for-diagnosis-management-of-asthma [Accessed: October 28, 2019].
50. Brusselle G.G., VanderStichele C., Jordens P. et al. Azithromycin for prevention of exacerbations in severe asthma (AZISAST): a multicentre randomised double-blind placebo-controlled trial. Thorax. 2013; 68 (4): 322–329. DOI: 10.1136/thoraxjnl-2012-202698.
51. Gibson P.G., Yang I.A., Upham J.W. et al. Effect of azithromycin on asthma exacerbations and quality of life in adults with persistent uncontrolled asthma (AMAZES): a randomised, double-blind, placebo-controlled trial. Lancet. 2017; 390 (10095): 659–668. DOI: 10.1016/S0140-6736(17)31281-3.
Lancet. 2017; 390 (10095): 659–668. DOI: 10.1016/S0140-6736(17)31281-3.
52. Strunk R.C., Bacharier L.B., Phillips B.R. et al. Azithromycin or montelukast as inhaled corticosteroid-sparing agents in moderate-to-severe childhood asthma study. J. Allergy Clin. Immunol. 2008; 122 (6): 1138–1144. DOI: 10.1016/j.jaci.2008.09.028.
53. Hahn D.L., Grasmick M., Hetzel S., Yale S. Azithromycin for bronchial asthma in adults: an effectiveness trial. J. Am. Board Fam. Med. 2012; 25 (4): 442–459. DOI: 10.3122/jabfm.2012.04.110309.
54. Sutherland E.R., King T.S., Icitovic N. et al. A trial of clarithromycin for the treatment of suboptimally controlled asthma. J. Allergy Clin. Immunol. 2010; 126 (4): 747–753. DOI: 10.1016/j.jaci.2010.07.024.
55. Simpson J.L., Powell H., Boyle M.J. et al. Clarithromycin targets neutrophilic airway inflammation in refractory asthma. Am. J. Respir. Crit. Care Med. 2008; 177 (2): 148–155. DOI: 10.1164/rccm.200707-1134OC.
56. Taylor S.L., Leong L. E.X., Mobegi F.M. et al. Long-term azithromycin reduces Haemophilus influenzae and increases antibiotic resistance in severe asthma. Am. J. Respir. Crit. Care Med. 2019; 200 (3): 309–317. DOI: 10.1164/rccm.201809-1739OC.
E.X., Mobegi F.M. et al. Long-term azithromycin reduces Haemophilus influenzae and increases antibiotic resistance in severe asthma. Am. J. Respir. Crit. Care Med. 2019; 200 (3): 309–317. DOI: 10.1164/rccm.201809-1739OC.
57. British Thoracic Society, Scottish Intercollegiate Guidelines Network. British guideline on the management of asthma. 2016. SIGN 153. Available at: www.brit-thoracic.org.uk/quality-improvement/guidelines/asthma [Accessed: October 28, 2019].
58. Wenzel S., Castro M., Corren J. et al. Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of mediumto-high-dose inhaled corticosteroids plus a long-acting β2 agonist: a randomized double-blind placebo-controlled pivotal phase 2b dose-ranging trial. Lancet. 2016; 388 (10039): 31–44. DOI: 10.1016/S0140-6736(16)30307-5.
59. Castro M., Corren J., Pavord I.D. et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N. Engl. J. Med. 2018; 378 (26): 2486–2496. DOI: 10.1056/NEJMoa1804092.
DOI: 10.1056/NEJMoa1804092.
60. Rabe K.F., Nair P., Brusselle G. et al. Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. N. Engl. J. Med. 2018; 378 (26): 2475–2485. DOI: 10.1056/NEJMoa1804093.
61. B rown T., Jones T., Gove K. et al. Randomised controlled trials in severe asthma: selection by phenotype or stereotype. Eur. Respir. J. 2018; 52 (6): 1801444. DOI: 10.1183/13993003.01444-2018.
62. Agusti A., Bel E., Thomas M. et al. Treatable traits: toward precision medicine of chronic airway diseases. Eur. Respir. J. 2016; 47 (2): 410–419. DOI: 10.1183/13993003.01359-2015.
63. Pavord I.D., Beasley R., Agusti A. et al. After asthma: redefining airways diseases. Lancet. 2018; 391 (10118): 350–400. DOI: 10.1016/S0140-6736(17)30879-6.
64. Shrimanker R., Beasley R., Kearns C. Letting the right one in: evaluating the generalisability of clinical trials. Eur. Respir. J. 2018; 52 (6): 1802218. DOI: 10.1183/13993003.02218-2018.
65. Pavord I.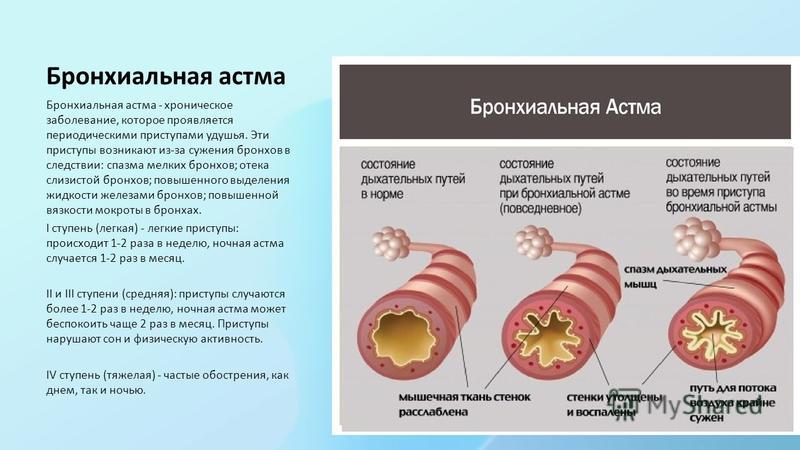 D., Chanez P., Criner G.J. et al. Mepolizumab for eosinophilic chronic obstructive pulmonary disease. N. Engl. J. Med. 2017; 377 (17): 1613–1629. DOI: 10.1056/NEJMoa1708208.
D., Chanez P., Criner G.J. et al. Mepolizumab for eosinophilic chronic obstructive pulmonary disease. N. Engl. J. Med. 2017; 377 (17): 1613–1629. DOI: 10.1056/NEJMoa1708208.
66. Kerkhof M., Sonnappa S., Postma D.S. et al. Blood eosinophil count and exacerbation risk in patients with COPD. Eur. Respir. J. 2017; 50 (1): 1700761. DOI: 10.1183/13993003.00761-2017.
67. Levy M.L., Winter R. Asthma deaths: what now? Thorax. 2015; 70 (3): 209–210. DOI: 10.1136/thoraxjnl-2015-206800.
68. Royal College of Physicians. National Review of Asthma Deaths 2012–2013. 2015. Available at: www.rcplondon.ac.uk/projects/national-review-asthma-deaths [Accessed: October 01, 2019].
69. Bush A., Saglani S., Fleming L. Severe asthma: looking beyond the amount of medication. Lancet Respir. Med. 2017; 5 (11): 844–846. DOI: 10.1016/S2213-2600(17)30379-X.
70. Green R.H., Shaw D. Strict adherence rules to obtain monoclonal therapy might cost lives. Lancet Respir. Med. 2017; 5 (9): 678–679. DOI: 10.1016/S2213-2600(17)30238-2.
DOI: 10.1016/S2213-2600(17)30238-2.
71. Andersson C.K., Adams A., Nagakumar P. et al. Intraepithelial neutrophils in pediatric severe asthma are associated with better lung function. J. Allergy Clin. Immunol. 2017; 139 (6): 1819–1829. DOI: 10.1016/j.jaci.2016.09.022.
72. Bossley C.J., Fleming L., Gupta A. et al. Pediatric severe asthma is characterized by eosinophilia and remodeling without TH 2 cytokines. J. Allergy Clin. Immunol. 2012; 129 (4): 974–982. DOI: 10.1016/j.jaci.2012.01.059.
73. Kuo C.S., Pavlidis S., Loza M. et al. T-helper cell type 2 (Th3) and non-Th3 molecular phenotypes of asthma using sputum transcriptomics in U-BIOPRED. Eur. Respir. J. 2017; 49 (2): 1602135. DOI: 10.1183/13993003.02135-2016.
74. Travers J., Rothenberg M.E. Eosinophils in mucosal immune responses. Mucosal. Immunol. 2015; 8 (3): 464–475. DOI: 10.1038/mi.2015.2.
75. Normansell R., Walker S., Milan S.J. et al. Omalizumab for asthma in adults and children. Cochrane Database Syst.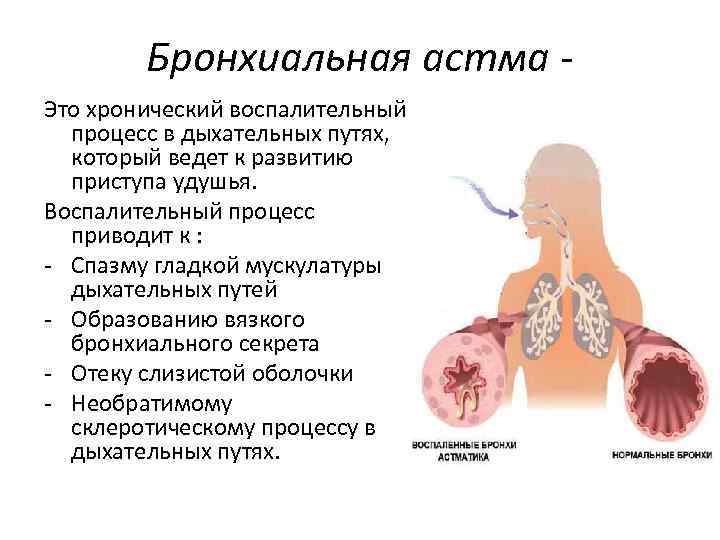 Rev. 2014; (1): CD003559. DOI: 10.1002/14651858.CD003559.pub4.
Rev. 2014; (1): CD003559. DOI: 10.1002/14651858.CD003559.pub4.
76. Corren J., Kavati A., Ortiz B. et al. Efficacy and safety of omalizumab in children and adolescents with moderate-to-severe asthma: a systematic literature review. Allergy Asthma Proc. 2017; 38 (4): 250–263. DOI: 10.2500/aap.2017.38.4067.
77. Odajima H., Ebisawa M., Nagakura T. et al. Long-term safety, efficacy, pharmacokinetics and pharmacodynamics of omalizumab in children with severe uncontrolled asthma. Allergol. Int. 2017; 66 (1): 106–115. DOI: 10.1016/j.alit.2016.06.004.
78. Saglani S., Bush A., Carroll W. et al. Biologics for paediatric severe asthma: trick or TREAT? Lancet Respir. Med. 2019; 7 (4): 294–296. DOI: 10.1016/S2213-2600(19)30045-1.
79. Nair P., O’Byrne P.M. The interleukin-13 paradox in asthma: effective biology, ineffective biologicals. Eur. Respir. J. 2019; 53 (2): 1802250. DOI: 10.1183/13993003.02250-2018.
80. Chung K.F. Tralokinumab unsuccessful for management of severe, uncontrolled asthma. Lancet Respir. Med. 2018; 6 (7): 480–481. DOI: 10.1016/S2213-2600(18)30194-2.
Lancet Respir. Med. 2018; 6 (7): 480–481. DOI: 10.1016/S2213-2600(18)30194-2.
81. Busse W.W., Brusselle G.G., Korn S. et al. Tralokinumab did not demonstrate oral corticosteroid-sparing effects in severe asthma. Eur. Respir. J. 2019; 53 (2): 1800948. DOI: 10.1183/13993003.00948-2018.
82. Russell R.J., Chachi L., FitzGerald J.M. et al. Effect of tralokinumab, an interleukin-13 neutralising monoclonal antibody, on eosinophilic airway inflammation in uncontrolled moderate-to-severe asthma (MESOS): a multicentre, double-blind, randomised, placebo-controlled phase 2 trial. Lancet Respir. Med. 2018; 6 (7): 499–510. DOI: 10.1016/S2213-2600(18)30201-7.
83. Panettieri R.A. Jr, Sjobring U., Peterffy A. et al. Tralokinumab for severe, uncontrolled asthma (STRATOS 1 and STRATOS 2): two randomised, double-blind, placebo-controlled, phase 3 clinical trials. Lancet Respir. Med. 2018; 6 (7): 511–525. DOI: 10.1016/S2213-2600(18)30184-X.
84. Pilette C., Brightling C., Lacombe D., Brusselle G. Urgent need for pragmatic trial platforms in severe asthma. Lancet Respir. Med. 2018; 6 (8): 581–583. DOI: 10.1016/S2213-2600(18)30291-1.
Urgent need for pragmatic trial platforms in severe asthma. Lancet Respir. Med. 2018; 6 (8): 581–583. DOI: 10.1016/S2213-2600(18)30291-1.
85. Bousquet J., Mantzouranis E., Cruz A.A. et al. Uniform definition of asthma severity, control, and exacerbations: document presented for the World Health Organization Consultation on Severe Asthma. J. Allergy Clin. Immunol. 2010; 126 (5): 926–938. DOI: 10.1016/j.jaci.2010.07.019.
ЛРЦ. Лечебно-реабилитационный центр Минэкономразвития России
Что такое пикфлоуметр?
Это небольшого размера трубочка с градуированной шкалой, измеряющая максимальную скорость воздушного потока при выдохе.
Сама манипуляция получила название пикфлоуметрия.
Что такое пикфлоуметрия и для чего она нужна?
У многих пациентов, страдающих хроническими не легочными заболеваниями есть аппаратура, которая помогает им контролировать определенные показатели (частоту пульса, давление, уровень сахара крови), В зависимости от их значений человек может контролировать свое лечение. Люди, у которых повышается давление, всегда имеют дома тонометр, болеющие сахарным диабетом — глюкометр. А что делать человеку, страдающему бронхиальной астмой? Как он может контролировать свое состояние. Можно, конечно, опираться на собственные ощущения, но это не надежно. Учащение приступов затрудненного дыхание, усиление кашля, нарастание одышки. Все эти признаки обострения бронхиальной астмы человек начинает отмечать, когда обострение в полном разгаре и его лечение требует больших усилий и значительного увеличения доз препаратов.
Люди, у которых повышается давление, всегда имеют дома тонометр, болеющие сахарным диабетом — глюкометр. А что делать человеку, страдающему бронхиальной астмой? Как он может контролировать свое состояние. Можно, конечно, опираться на собственные ощущения, но это не надежно. Учащение приступов затрудненного дыхание, усиление кашля, нарастание одышки. Все эти признаки обострения бронхиальной астмы человек начинает отмечать, когда обострение в полном разгаре и его лечение требует больших усилий и значительного увеличения доз препаратов.
Выход есть. Для людей страдающих бронхиальной астмой изобретен простейший прибор, помогающий контролировать состояние бронхов и вовремя принять необходимые меры. Это значит — раньше начать лечение с меньшими дозами лекарственных препаратов, и предотвратить развитие тяжелого обострения. Это и есть, та самая градуированная трубочка, о которой мы говорили, и которая называется пикфлоуметр.
Пикфлоуметр показывает наибольшую скорость, с которой воздух может проходить через дыхательные пути при максимально резком выдохе. Значит, он позволяет оценить степень сужения бронхов и степень их расширения при приеме лекарственных препаратов.
Значит, он позволяет оценить степень сужения бронхов и степень их расширения при приеме лекарственных препаратов.
Пикфлоуметрия-это метод самоконтроля за течением бронхиальной астмы.
Как правильно проводится пикфлоуметрия?
Проводится пикфлоуметриядва раза в день: утром сразу после подъёма с постели до приема препаратов и вечером пред сном.
- Установите бегунок шкалы пикфлоуметра на нулевое значение.
- Обхватите плотно губами мундштук
- Не закрывайте рукой вентиляционные отверстия в задней части прибора
- Сделайте спокойный вдох и максимально сильный и резкий, быстрый выдох
- Переместите бегунок обратно и повторите эти действия еще два раза
- Запишите лучшее из трех значений в Вашем дневнике
Как следует оценивать результаты пикфлоуметрии?
Норма показателей выдоха расчитывается индивидуально с учетом пола, возраста и роста.
Для простоты оценки пиковой скорости выдоха (ПСВ) используется принцип «Светофора», когда значения показаний делятся на зоны, которые соответствуют цветам светофора: зеленая, желтая и красная.
Зеленая зона. Показатель нормы. Она сигнализирует, что астма находится под контролем. Нет выраженных симптомов астмы, больной физически активен, не имеет проблем со сном и может принимать лекарства, как обычно. Показатели ПВС в зеленой зоне составляют от 80% до 100% от Ваших лучших значений.
Желтая зона. Показатель начинающегося обострения. При этом данные пикфлоуметрии находятся в интервале от 50% до 80% от Ваших лучших значений ПСВ. Скорее всего, у Вас могут наблюдаться приступы затрудненного дыхания, кашель, свистящие хрипы, требующие дополнительно приема ингаляторов или назначения иных препаратов. Обязательно обратитесь к Вашему врачу.
Красная зона. Это — сигнал тревоги. В красной зоне показатели ПСВ находятся в интервале ниже 50% от Ваших лучших значений. Вероятнее всего начинается тяжелое обострение заболевания. Немедленно обратитесь к врачу.
Если Вы постоянно наблюдаетесь у пульмонолога, то чаще всего врач заранее объясняет, что надо сделать при переходе показателей пикфлоуметрии в желтую или красную зону, говорит дозу каких ингаляторов надо увеличить или что прибавить к проводимой терапии.
Как рассчитать нормальные показатели скорости выдоха?
Лучшие значения показателей скорости выдоха рассчитываются при отсутствии симптомов астмы на том же пикфлоумерте, которым Вы постоянно пользуетесь. Самый лучший показатель пикфлоуметрии нужно умножить на 0,8. Например, если у Вас лучшее значение пикфлоуметрии — 400, Вам необходимо 400 умножить на 0,8, результат 320. Любое значение выше 320 будет относиться к зеленой зоне, что означает — нормальный уровень проходимости бронхов. Для определения границ желтой зоны Вам необходимо умножить Ваш лучший показатель (например 400) на 0,5, полученный результат (200) будет нижней границей желтой зоны, а верхнюю границу мы уже знаем (ранее подсчитанное значение), т. е. желтая зона в нашем примере будет находится между 200 и 320 л/мин. Все показатели ниже 200 будут относиться к красной зоне.
Астма | Британское торакальное общество
Улучшение качества
Опубликован окончательный объем совместного руководства NICE/BTS/SIGN по диагностике, мониторингу и лечению хронической астмы.
Декабрь 2021
NICE, BTS и SIGN рады сообщить о прогрессе в разработке Совместного руководства по диагностике, мониторингу и лечению хронической астмы. Читать далее.
Март 2021
BTS, SIGN и NICE должны выпустить совместное руководство по хронической астме — как часть более широкого «пути астмы» — подробнее.
апрель 2020 г.
Текущий
ИСПОЛЬЗУЙТЕ СТРЕЛКИ НИЖЕ ДЛЯ СОРТИРОВКИ ПО КОЛОННЕ| Заголовок | Дата публикации | Описание | Положение дел |
|---|---|---|---|
00
Руководство BTS/SIGN по лечению астмы 2019 г.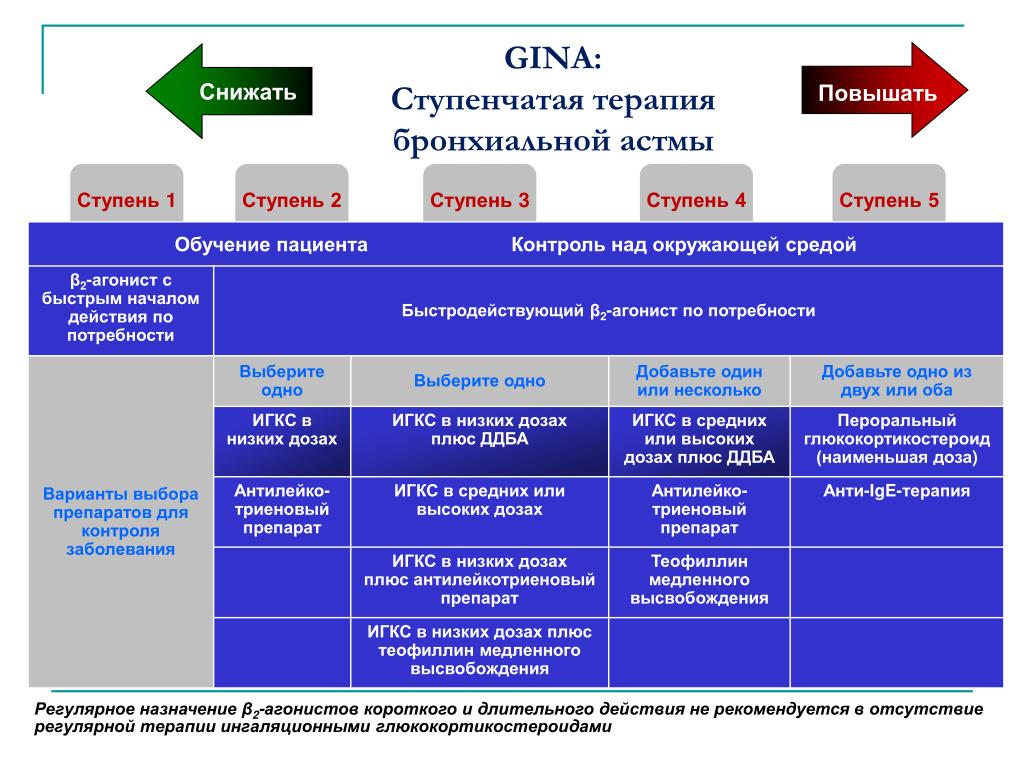 | 20190701июль 2019 | Руководство BTS/SIGN по астме от 2019 года. | |
| 01 Руководство NICE Астма: диагностика, мониторинг и лечение хронической астмы | 20200201Февраль 2020 | Содержит обновленное руководство по увеличению дозы ингаляционных кортикостероидов в рамках программы самоконтроля у детей и молодых людей с астмой. | Действительный |
02
Руководство BTS/SIGN по борьбе с астмой Краткое справочное руководство 2019 г.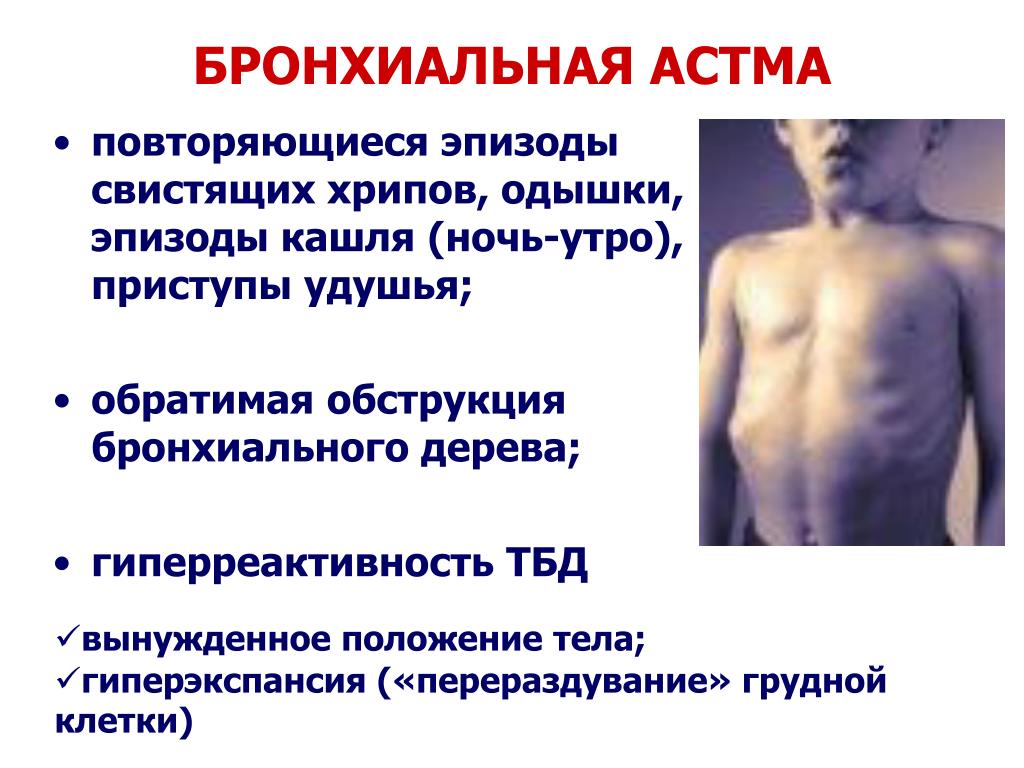 | 20190701июль 2019 | Краткое справочное руководство к руководству BTS/SIGN по астме 2019 года. | Действительный |
Предыдущий
ИСПОЛЬЗУЙТЕ СТРЕЛКИ НИЖЕ ДЛЯ СОРТИРОВКИ ПО КОЛОННЕ| Заголовок | Дата публикации | Описание | Положение дел |
|---|---|---|---|
00
Руководство BTS/SIGN по борьбе с астмой 2014 г. | Британские рекомендации BTS/SIGN по лечению астмы | Заменено | |
| 01 Руководство BTS/SIGN по борьбе с астмой 2016 г. | 20160901Сентябрь 2016 | Опубликовано в сентябре 2016 г. | Заменено |
| 02 Руководство BTS/SIGN по борьбе с астмой Краткое справочное руководство 2014 г. | 20141001Октябрь 2014 | Заменено | |
03
Краткое руководство BTS/SIGN по лечению астмы, 2016 г. | Заменено |
Астма
Астма
Руководящие принципы/стратегии
Глобальная стратегия лечения и профилактики астмы (обновление 2022 г.). Всеобъемлющий обновленный ресурс. В самом последнем обновлении представлены обновленные определения легкой и тяжелой астмы, а также рекомендации по использованию LAMA, азитромицина и абсолютных пороговых значений эозинофилов для определения кандидатов на биопрепараты.
Бесплатный полный текст
Целенаправленные обновления 2020 г. Руководства по лечению астмы: отчет рабочей группы Координационного комитета Национальной программы обучения и профилактики астмы.
 посвящено использованию FeNO, смягчению воздействия аллергенов, использованию непрерывных ИГКС по сравнению с первичными, LAMA, иммунотерапии и бронхиальной термопластике.
посвящено использованию FeNO, смягчению воздействия аллергенов, использованию непрерывных ИГКС по сравнению с первичными, LAMA, иммунотерапии и бронхиальной термопластике.Бесплатный полный текст
Ольгин Ф., Карде Дж. К., Кунг Дж. Ф. и др. Лечение тяжелой астмы: руководство Европейского респираторного общества/Американского торакального общества.
PMID: 31558662
Бесплатный полный текст
Применение ИКС/ДДБА по мере необходимости при легкой астме на основе prn привело к частоте обострений, аналогичной поддерживающей терапии ICS два раза в день, но со значительно более низким общим воздействием стероидов.
O’Byrne PM, FitzGerald JM, Bateman ED et al. Ингаляционный комбинированный будесонид-формотерол по мере необходимости при легкой форме астмы . N Engl J Med. 2018; 378:1865-1876.
PMID: 29768149
Бесплатный полный текст
Bateman ED, Reddel HK, O’Byrne PM et al. Будесонид-формотерол по мере необходимости в сравнении с поддерживающей терапией будесонидом при легкой астме . N Engl J Med. 2018; 378:1877-1887.
PMID: 29768147
Полный текст бесплатно
Комбинированная терапия
Бейтман Э.Д., Боуши Х.А., Буске Дж. и др. Группа исследователей GOAL. Можно ли достичь контроля над астмой в соответствии с рекомендациями? Исследование «Получение оптимального контроля над астмой». Am J Respir Crit Care Med. 2004; 170:836-44. В этом годичном рандомизированном исследовании (n = 3421) пациентов с неконтролируемой астмой сравнивали добавление ДДБА и увеличение дозировки стероидов для достижения двух строгих, составных, основанных на рекомендациях мер контроля: полностью и хорошо контролируемой астмы.
PMID: 15256389
Peters SP, Kunselman SJ, Icitovic N, et al. для Сети клинических исследований астмы Национального института сердца, легких и крови. Пошаговая терапия тиотропия бромидом у взрослых с неконтролируемой астмой. N Engl J Med 2010; 363:1715-26. Исследование TALC показало, что у пациентов с астмой, неадекватно контролируемой низко-умеренными дозами ингаляционных кортикостероидов, добавление антихолинергической терапии длительного действия было лучше, чем повышение дозы кортикостероидов, и не уступало добавлению терапии бета-агонистами длительного действия. Однако в исследовании не было возможности сравнить влияние на обострения.
PMID: 20979471
Бесплатный полный текст
Kerstjens HA, Engel M, Dahl R, et al. Тиотропий при астме, плохо контролируемой стандартной комбинированной терапией. N Engl J Med. 2012 г.; 367:1198-207. 48-недельное рандомизированное исследование с участием 912 пациентов с персистирующей астмой показало, что добавление тиотропия (ингалятор Респимат, а не сухой порошок) продемонстрировало статистически значимое улучшение ОФВ1 (230 мл), которое было меньше минимального клинически значимого различия, но также 21% снижение тяжелых обострений.
N Engl J Med. 2012 г.; 367:1198-207. 48-недельное рандомизированное исследование с участием 912 пациентов с персистирующей астмой показало, что добавление тиотропия (ингалятор Респимат, а не сухой порошок) продемонстрировало статистически значимое улучшение ОФВ1 (230 мл), которое было меньше минимального клинически значимого различия, но также 21% снижение тяжелых обострений.
PMID:22938706
Полный свободный текст
Азитромицин для уменьшения обострений астмы
Gibson PG, Jang IA, Uphamal Влияние азитромицина на обострения астмы и качество жизни у взрослых с персистирующей неконтролируемой астмой (AMAZES): рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет. 2017; 12; 390: 659-668. Рандомизированное двойное слепое исследование с участием 420 пациентов с неконтролируемой персистирующей астмой, получавших средние и высокие дозы ИГКС в сочетании с ДДБА. Азитромицин в дозе 500 мг 3 раза в неделю уменьшал среднетяжелые/тяжелые обострения (1,07 на пациенто-год против 1,86 на пациенто-год, p<0,0001) и улучшал качество жизни при астме.
PMID: 28687413
Биологическая терапия
McGregor MC, Krings JG, Nair P, et al. Роль биологических препаратов при астме. Am J Respir Crit Care Med. 2019; 199:433-445. Обзор действия, показаний, ожидаемых преимуществ и побочных эффектов одобренных биологических препаратов для лечения тяжелой неконтролируемой астмы.
PMID: 30525902
Бесплатный полный текст
Menzies-Gow A, Corren J, Bourdin A, et al. Тезепелумаб у взрослых и подростков с тяжелой неконтролируемой астмой. N Engl J Med. 2021;384:1800-1809. Тезепелумаб представляет собой человеческое моноклональное антитело, блокирующее стромальный лимфопоэтин тимуса. Это РКИ с участием 1061 пациента с тяжелой неконтролируемой астмой показало, что тезепелумаб снижает годовую частоту обострений астмы (0,93 против 2,10 для плацебо, p < 0,001). Преимущество было значительным, но менее выраженным, с абсолютным количеством эозинофилов <300/мкл, а многочисленные измерения показали уменьшение бремени симптомов.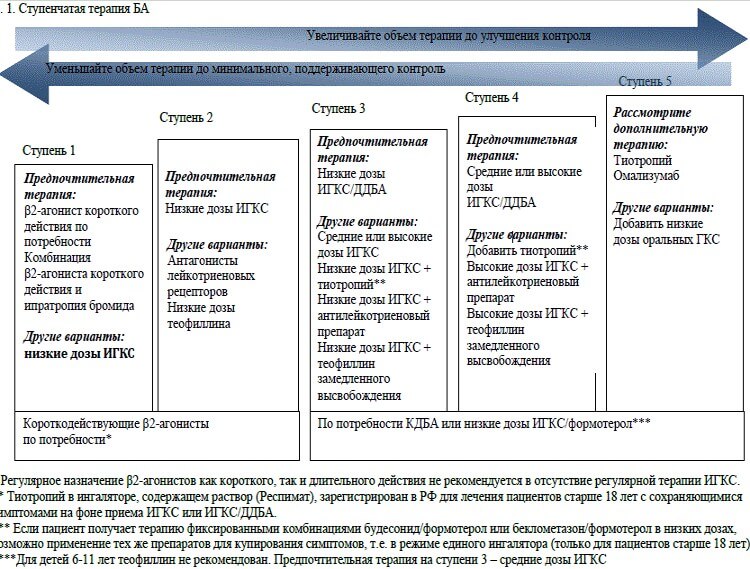
PMID: 33979488
Роль несоблюдения режима лечения при рефрактерной астме
Гэмбл Дж., Стивенсон М., МакКлин Э. и др. Распространенность несоблюдения режима лечения при тяжелой астме. Am J Respir Crit Care Med 2009; 180:817-22. В популяции пациентов, направленных к специалисту по поводу рефрактерной астмы, 35% пациентов выполнили менее половины назначенных им ингаляционных кортикостероидов. Неприверженные пациенты имели значительно более низкое качество жизни, характерное для астмы. Это исследование выдвигает на первый план важный и часто упускаемый из виду фактор рефрактерности астмы.
PMID: 19644048
Бронхиальная термопластика
Castro M, Rubin AS, Laviolette M, et al. Эффективность и безопасность бронхиальной термопластики при лечении тяжелой астмы: многоцентровое рандомизированное двойное слепое плацебо-контролируемое клиническое исследование. (Испытание AIR2) Am J Respir Crit Care Med 2010;181:116-24. Исследование AIR2 было первым крупномасштабным рандомизированным исследованием бронхиальной термопластики, включавшим фиктивный контроль. В исследование были включены 288 пациентов с симптомами астмы, несмотря на стандартную терапию. В течение 12 месяцев наблюдения в группе лечения было меньше случаев нежелательных респираторных явлений, тяжелых обострений, посещений отделений неотложной помощи и госпитализаций, а также большее количество (81%) субъектов, сообщивших об улучшении AQLQ. Примечательно, что 63% контрольных субъектов также сообщили о клинически значимом (> 0,5) улучшении AQLQ. Во время лечения 8,4% пациентов в группе лечения были госпитализированы из-за респираторных симптомов по сравнению с 2,0% в группе плацебо.
Исследование AIR2 было первым крупномасштабным рандомизированным исследованием бронхиальной термопластики, включавшим фиктивный контроль. В исследование были включены 288 пациентов с симптомами астмы, несмотря на стандартную терапию. В течение 12 месяцев наблюдения в группе лечения было меньше случаев нежелательных респираторных явлений, тяжелых обострений, посещений отделений неотложной помощи и госпитализаций, а также большее количество (81%) субъектов, сообщивших об улучшении AQLQ. Примечательно, что 63% контрольных субъектов также сообщили о клинически значимом (> 0,5) улучшении AQLQ. Во время лечения 8,4% пациентов в группе лечения были госпитализированы из-за респираторных симптомов по сравнению с 2,0% в группе плацебо.
PMID: 19815809
Бронхоконстрикция, вызванная физической нагрузкой
Parsons JP, Hallstrand TS, Mastronarde JG, et al. Официальное руководство по клинической практике Американского торакального общества: бронхоконстрикция, вызванная физической нагрузкой.