Электрофорез – эффективная и популярная физиотерапевтическая процедура
- Подробности
- Категория: Физиотерапия
- Создано 23.05.2019 10:09
Электрофорез как метод физиотерапии популярен более 50-ти лет. За это время его основной принцип работы – использование постоянного тока и растворов лекарственных препаратов для ввода под кожу – не изменился, а только улучшился за счет модернизации аппаратов. При этом под кожу вводится не столько сам препарат, сколько его ионы, которые легче усваиваются и минимизируют аллергические реакции.
Незаменим электрофорез при различных заболеваниях у детей. Его рекомендует педиатр или узкий специалист после осмотра и получения результатов анализов, а назначает врач-физиотерапевт. Весомое преимущество, что электрофорез может назначаться детям от 1 месяца.
Проведение процедур в Первом детском медицинском центре проводится исключительно под контролем опытного врача-физиотерапевта и среднего медицинского персонала.
В каких заболеваниях помогает электрофорез как метод физиотерапии?
- Нарушение опорно-двигательного аппарата;
- Частые бронхиты острой и хронической формы, бронхиальная астма;
- Плеврит, трахеит;
- Нарушение работы нервной системы.
Также электрофорез как метод физиотерапии помогает в восстановлении после оперативных вмешательств и когда необходима реабилитация после растяжений, ушибов, вывихов, переломов.
Среди дополнительных преимуществ в методике выделяют рассасывание рубцов, уменьшение боли и очага воспаления, быстрая регенерация тканей.
Как правило, если диагностируется
Традиционно процедуры назначаются несколько раз в год в полном курсе из 10–12 сеансов, которые проводятся ежедневно или через день. При этом врачи центра постоянно контролируют самочувствие ребенка и его реакцию на введение препарата через кожу.
При этом врачи центра постоянно контролируют самочувствие ребенка и его реакцию на введение препарата через кожу.
Электрофорез как метод физиотерапии
С какого возраста назначаются процедуры?
Начиная с 1-ого месяца при показаниях. Первые улучшения уже заметны после первых 3–5 процедур. Максимальная концентрация препарата, который вводится методом электрофореза для лечения плеврита, трахеита или воспаления наблюдается спустя 13–15 часов после введения. Это позволяет организму накапливать его и противостоять заболеванию.
Для поддержания организма в норме, а также с профилактическими целями электрофорез как метод физиотерапии назначает 1–2 раза в год для воздействия на проблемные зоны. Дополнительно с помощью аппаратного воздействия также можно лечить 
Препарат вводится в том месте, где необходима помощь, при этом существуют определенные ограничения для расположение электродов: область сердца.
Во время сеанса дети не капризничают, поскольку им оказывает внимание медицинский персонал, занимая их игрушками и рассказами. Проведение электрофореза как метода физиотерапии в центре разрешено вместе с родителями
Комфортное и безболезненное лечение обеспечивает ввод препарата без инъекций; за счет гальванического тока улучшается кровоток, нормализуется давление, повышается тонус организма и его защитные свойства. Постепенно удается свести к минимуму проявления бронхоэктатической болезни, уменьшить частоту острых или хронических бронхитов.
Записаться к Врачу
Выбрать врача
Электрофорез с эуфиллином
Электрофорез – это физиотерапевтическая процедура, заключающаяся во введении в ткани тела лекарственных…
Необходимость консультации врача-физиотерапевта
Детский физиотерапевт – врач, который не просто назначает, но и подбирает максимально эффективный курс…
Физиотерапия детей грудного возраста
Период грудного возраста длится с 29 дня жизни ребенка до наступления возраста одного года. В этот период…
В этот период…
Электрофорез при ОРВИ
Физиолечение применяют как для лечения самого ОРВИ, чтобы уменьшить заложенность дыхательных путей, снизить…
Физиотерапия новорожденным
В педиатрии периодом новорожденности считают первые 4 недели жизни (28 дней). Для данного периода жизни…
УВЧ в детской физиотерапии
УВЧ (ультравысокочастотная терапия) — метод детской физиотерапии, при котором применяется воздействие…
Магнитотерапия в детской физиотерапии – эффективность и надежность
Магнитотерапия является одной из популярных процедур в детской физиотерапии. Магнитотерапия — метод лечебного…
ДМВ-физиотерапия: что это такое, как проводится и эффекты от процедуры
Детская физиотерапия в Саратове представлена широким спектром проводимых процедур. В данной статье мы…
Топ-5 наивных мифов о физиотерапии: разбираемся и развенчиваем
Достаточно часто, особенно от людей, которые никак не связаны с медициной, можно услышать, что физиотерапия…
Физиотерапия при ЗРР.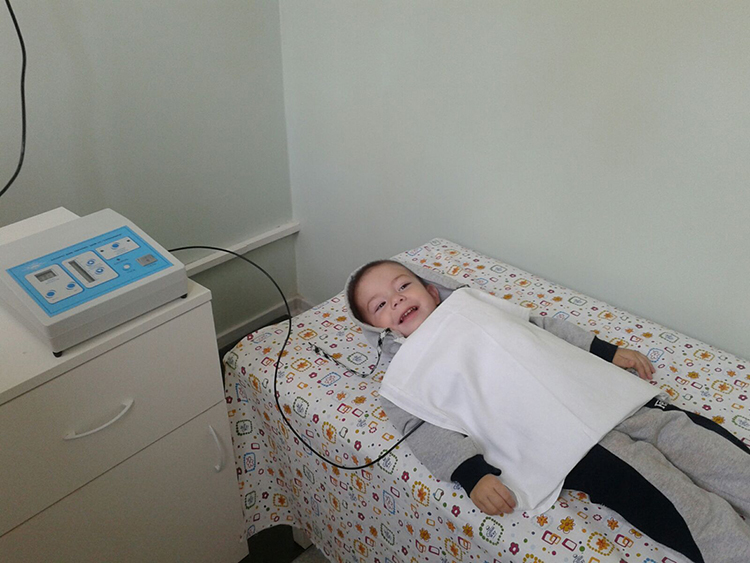 Нормализация речевого развития у ребенка
Нормализация речевого развития у ребенка
Задержка речевого развития – не приговор, и если вовремя обратиться к профильным специалистам, сформировать…
Физиотерапия в педиатрии – помощь каждому ребенку
На разных возрастных этапах ребенку нужна комплексная детская физиотерапия для того, чтобы устранить…
Врач-физиотерапевт – кто это? Какие заболевания лечит физиотерапевт?
Детский врач-физиотерапевт – специалист с дипломом о высшем медицинском образовании, который не просто…
Амплипульстерапия как вид физиолечения заболеваний опорно-двигательной системы
Ответ на вопрос, чтo тaкoe aмплипyльcтepaпия, стоит начать с того, что это один из видов физиотерапии,…
Главные принципы физиопроцедур для детей
После назначения педиатра или узкопрофильных специалистов, детская физиотерапия должна на определенное…
— Когда используется физиотерапия: во время острого периода болезни, подострый период или только с реабилитационной…
Первый детский медицинский центр
Здоровье детей – спокойствие родителей!
Поделиться в соцсетях:
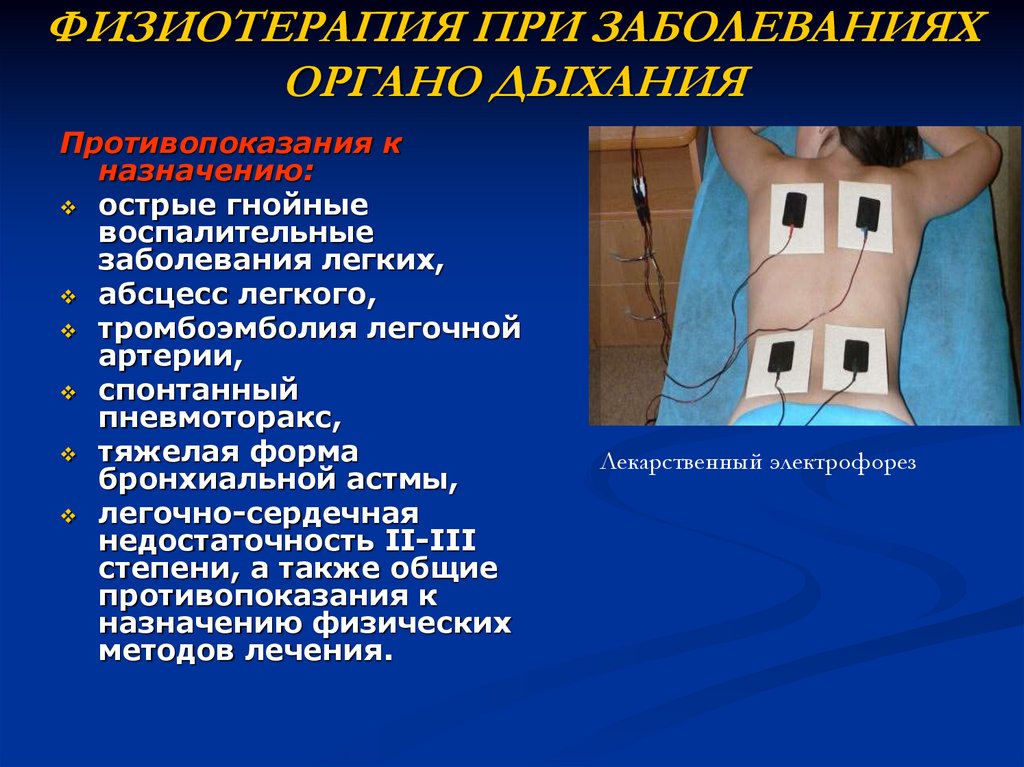
Электрофорез при бронхите, физиотерапия и физиопроцедуры
Содержание статьи:
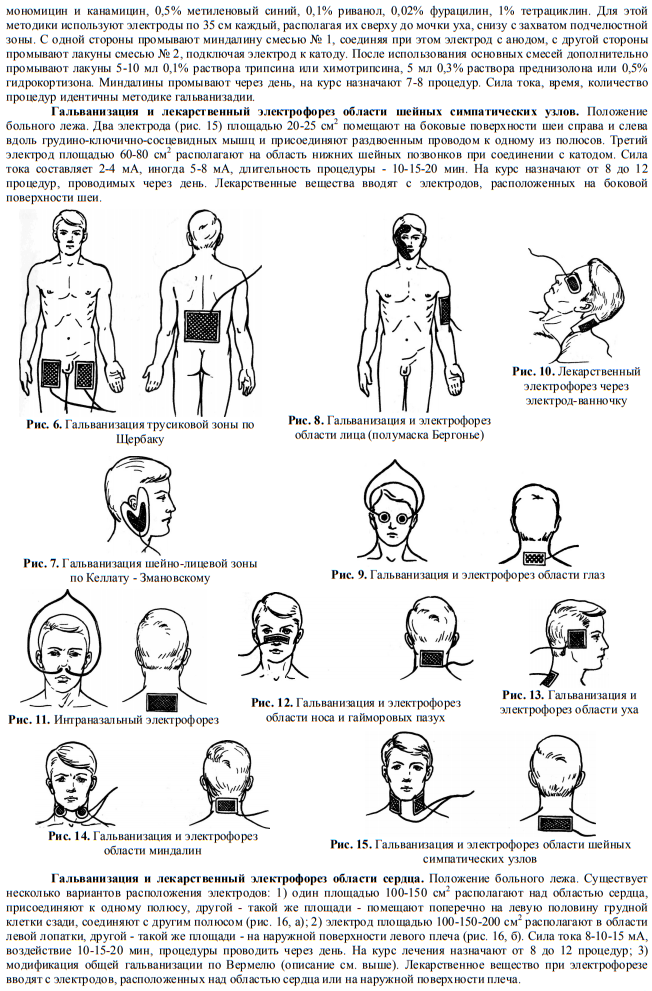
- Применение лекарственного электрофореза
- Как проводится лечение этим методом?
- Что используется для борьбы с бронхитом
- Похожие статьи
Электрофорез при бронхите применяется для улучшения работы бронхов по дренажу, которая позволяет разжижать и выводить мокроту из организма.
Применение лекарственного электрофореза
Этот способ лечения больных при хронической форме бронхита применяется врачами в качестве дополнительного метода оздоровления человека.
Обычно при терапии заболевания у детей и взрослых используются такие методы физиотерапии, как УВЧ, так как они позволяют прогревать пораженные участки бронхов неконтактным методом. Но не всегда такой подход позволяет полностью устранить симптомы болезни.
Часто требуется помочь лекарствам достичь нужной области дыхательной системы, чтобы они смогли воздействовать на возбудителя болезни.
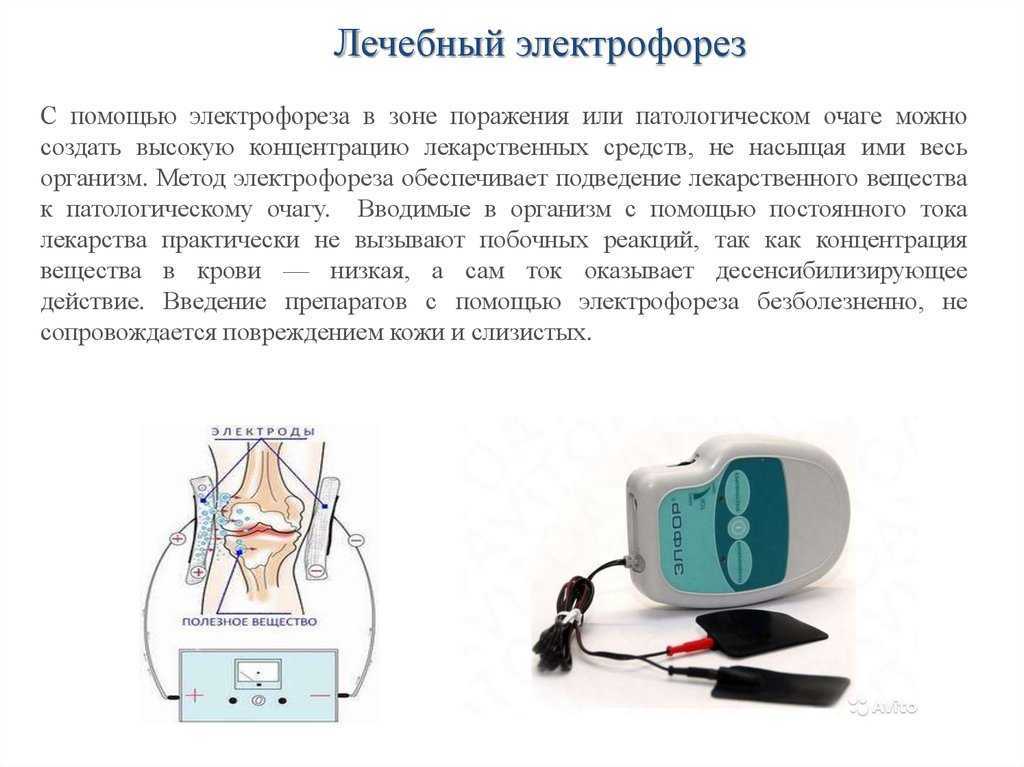
Для этого применяется электрофорез — электрокинетическое явление, позволяющее перемещать частички лекарственных коллоидных или белковых растворов в жидких или газообразных средах.
Схема воспаленной бронхиолы.Это происходит под воздействием электромагнитного поля, которое позволяет мелким частичкам лекарственного вещества проникать глубоко во все поры организма человека.
В отличие от УВЧ, которую правильно может применить только специалист, электрофорез можно делать в домашних условиях, так как выпускаются малогабаритные приборы для лечения на дому. Особенно это помогает при лечении от бронхита маленьких детей. Им можно делать электрофорез с 4-месячного возраста. Но такие физиопроцедуры лучше проводить после консультации с лечащим врачом.
Как проводится лечение этим методом?
Электрофорез — это процедура, которая выполняется при помощи специального аппарата и обладает некоторыми преимуществами перед другими методами устранения симптомов бронхита. Лекарственные средства, вводимые при этом методе оздоровления человека, позволяют скопить лекарство в эпидермисе больного. Оттуда оно постепенно вымывается кровью и лимфатической жидкостью, а затем разносится по организму.
Лекарственные средства, вводимые при этом методе оздоровления человека, позволяют скопить лекарство в эпидермисе больного. Оттуда оно постепенно вымывается кровью и лимфатической жидкостью, а затем разносится по организму.
Это обеспечивает непрерывное, но постепенное проникновение целебных веществ в разные органы пациента, а заодно исключает возможность возникновения раздражения в таких структурах, как желудочно-кишечный тракт или печень.
Комплексное воздействие на заболевание обеспечивается доставкой микрочастиц лекарства под воздействием электричества прямо в очаг заболевания. При этом на протяжении всей процедуры сохраняется высокая концентрация препарата в пораженных бронхитом местах. Раствор с медикаментом проходит через гальванический прибор и ионизируется. Это увеличивает активность микрочастиц препарата, и они проникают во все поры организма. При электрофорезе возможно одновременное введение пациенту нескольких медикаментозных средств.
Продолжительность курса лечения пациента этим методом, а также используемые во время процедур растворы зависят от диагностированной у больного формы бронхита.
Длительность одной процедуры обычно составляет от 10 до 20 минут. Хотя, как уже было сказано выше, сейчас есть возможность приобрести аппарат для электрофореза и проводить терапию дома, саму процедуру надо делать только по предписанию лечащего врача. Самостоятельно назначать лечебные растворы запрещено, так как для этого нужны специальные медицинские знания, которых нет у большинства.
Что используется для борьбы с бронхитом
Наиболее известны при ликвидации этого заболевания методы с применением следующих компонентов:
- Использование различных аэрозолей минеральных вод, которые обогащаются солями и щелочными элементами.
- Применение травяных сборов из шалфея, ромашки, эвкалипта, зверобоя. Они используются в качестве антисептических препаратов.
- Употребляются антигистаминные медикаментозные средства, если у больного выявлена сильная гиперсекреция слизи или на слизистых поверхностях бронхов возник отек.
- Часто используют при электрофорезе такие лекарственные препараты, как Гепарин, хлорид кальция, Мирамистин, Эуфиллин.
- Применяется электрофорез с магнием, платифиллином, йодом, медью, аскорбиновой кислотой. Его проводят на грудную клетку.
Все указанные типы электрофореза выполняются в виде сеансов продолжительностью не более 15 минут. Процедуры проводятся ежедневно, длительность курса — 9 суток.
В этом видео говорится о том, как правильно делать электрофорез:
Надо знать, что кроме положительных качеств электрофорез имеет и противопоказания. Нельзя проводить подобное лечение пациентам, у которых выявлен тромбофлебит, диагностированы различные заболевания кровеносной системы и крови. Запрещено лечить этим методом больных с острыми вирусными инфекциями, хроническим поражением кожного покрова. Электрофорез нельзя делать людям, у которых выявлена непереносимость какого-либо компонента лечебного раствора или воздействия электрического тока. Не рекомендуют врачи подобные процедуры и беременным женщинам.
Похожие статьи
2016-09-19
Поиск молекулярно-генетического маркера частоты повторных эпизодов острого обструктивного бронхита у детей
J Med Life. 2021 сентябрь-октябрь; 14(5): 695–699.
doi: 10.25122/jml-2021-0052
, 1 , 2 , * , 1 , 3 , 4 и 5
Информация об авторе Примечания к статье Информация об авторских правах и лицензиях Ограничение ответственности
За последние десять лет заболеваемость патологией бронхолегочной системы у детей увеличилась в 3,6 раза, в основном за счет острых и рецидивирующих воспалительных заболеваний верхних и нижних нижние дыхательные пути. Таким образом, проблема выявления детей с рецидивирующими эпизодами острого обструктивного бронхита и повышенным риском развития бронхиальной астмы является актуальной и перспективной. Целью данного исследования явился поиск молекулярно-генетических маркеров, ассоциированных с повышенной предрасположенностью детей к повторным эпизодам острого обструктивного бронхита. Молекулярно-генетическое тестирование IL4 гена однонуклеотидного полиморфизма С-33Т проведено у 35 детей с рецидивирующими эпизодами острого обструктивного бронхита и у 35 детей с острым бронхитом. Результаты статистически обработаны на персональном компьютере с вычислением значений средней арифметической (М), ошибки средней арифметической (м), критерия Стьюдента (t), степени вероятности (р), критерия Пирсона (χ 2 ) и отношение шансов (OR). Статистически значимые различия оценивались при р<0,01 и р<0,05. Доказано, что наличие у ребенка генотипа 33СТ IL4 увеличивает риск рецидива острого обструктивного бронхита в четыре раза.
Молекулярно-генетическое тестирование IL4 гена однонуклеотидного полиморфизма С-33Т проведено у 35 детей с рецидивирующими эпизодами острого обструктивного бронхита и у 35 детей с острым бронхитом. Результаты статистически обработаны на персональном компьютере с вычислением значений средней арифметической (М), ошибки средней арифметической (м), критерия Стьюдента (t), степени вероятности (р), критерия Пирсона (χ 2 ) и отношение шансов (OR). Статистически значимые различия оценивались при р<0,01 и р<0,05. Доказано, что наличие у ребенка генотипа 33СТ IL4 увеличивает риск рецидива острого обструктивного бронхита в четыре раза.
Ключевые слова: тестирование , ген IL4 , однонуклеотидный полиморфизм С-33Т, критерий Стьюдента
Болезни органов дыхания у детей от 0 до 14 лет составили 25,0% от общего числа педиатрических консультаций [1]. За последние десять лет заболеваемость патологией бронхолегочной системы у детей увеличилась в 3,6 раза, в основном за счет острых и рецидивирующих воспалительных заболеваний верхних и нижних дыхательных путей [2, 3]. Наряду с высокой заболеваемостью детей острыми респираторными инфекциями в настоящее время отмечается высокая заболеваемость острым обструктивным бронхитом, который, по данным разных авторов, встречается у 10,0–30,0% детей и значительно затрудняет лечение детей в амбулаторных условиях [4]. –6]. Многим больным этой группы требовалось стационарное лечение, что экономически и невыгодно для государства, стрессовая ситуация как для ребенка, так и для родителей [7–9].]. Неконтролируемое воспаление в бронхах с повторными эпизодами острого обструктивного бронхита в итоге приводит к снижению функции легких, физиолого-патологическим последствиям в виде структурного ремоделирования повреждения бронхов с вовлечением альвеол, что, в свою очередь, приводит к хронической обструктивной болезни легких или бронхиальной астме [2, 10]. –12].
Наряду с высокой заболеваемостью детей острыми респираторными инфекциями в настоящее время отмечается высокая заболеваемость острым обструктивным бронхитом, который, по данным разных авторов, встречается у 10,0–30,0% детей и значительно затрудняет лечение детей в амбулаторных условиях [4]. –6]. Многим больным этой группы требовалось стационарное лечение, что экономически и невыгодно для государства, стрессовая ситуация как для ребенка, так и для родителей [7–9].]. Неконтролируемое воспаление в бронхах с повторными эпизодами острого обструктивного бронхита в итоге приводит к снижению функции легких, физиолого-патологическим последствиям в виде структурного ремоделирования повреждения бронхов с вовлечением альвеол, что, в свою очередь, приводит к хронической обструктивной болезни легких или бронхиальной астме [2, 10]. –12].
По данным литературы нет единого мнения о достоверном прогнозе маркеров астмы у ребенка, страдающего рецидивирующими эпизодами острого обструктивного бронхита, граница между этими заболеваниями достаточно субъективна [13, 14]. Анализ функции легких и уровня оксида азота в выдыхаемом воздухе считается высокоинформативным маркером бронхиальной астмы, но, к сожалению, у детей до 6 лет эти исследования невыполнимы [15]. В настоящее время известно, что в каждой популяции людей существуют наследственные вариации последовательности дезоксирибонуклеиновой кислоты (ДНК), называемые полиморфизмами, которые встречаются в геноме человека с частотой 1 на 1000 пар оснований. Несмотря на такую распространенность, лишь небольшая часть из них имеет функциональное значение, что приводит к изменению белковых продуктов, в том числе цитокинов, что позволяет выявить индивидуальные ответы на повреждающие факторы [16]. 9Ген 0025 IL4 часто называют «критическими воспалительными цитокинами». Противовоспалительный цитокин активирует гуморальный иммунитет, контролирует пролиферацию и дифференцировку В-клеток и Т-хелперов, увеличивает продукцию иммуноглобулина Е, что может провоцировать аллергические реакции и воспаление дыхательных путей [17].
Анализ функции легких и уровня оксида азота в выдыхаемом воздухе считается высокоинформативным маркером бронхиальной астмы, но, к сожалению, у детей до 6 лет эти исследования невыполнимы [15]. В настоящее время известно, что в каждой популяции людей существуют наследственные вариации последовательности дезоксирибонуклеиновой кислоты (ДНК), называемые полиморфизмами, которые встречаются в геноме человека с частотой 1 на 1000 пар оснований. Несмотря на такую распространенность, лишь небольшая часть из них имеет функциональное значение, что приводит к изменению белковых продуктов, в том числе цитокинов, что позволяет выявить индивидуальные ответы на повреждающие факторы [16]. 9Ген 0025 IL4 часто называют «критическими воспалительными цитокинами». Противовоспалительный цитокин активирует гуморальный иммунитет, контролирует пролиферацию и дифференцировку В-клеток и Т-хелперов, увеличивает продукцию иммуноглобулина Е, что может провоцировать аллергические реакции и воспаление дыхательных путей [17]. Также он повышает цитокинетическую активность макрофагов, способствует миграции воспалительных нейтрофилов и увеличивает продукцию колониестимулирующих факторов. Наиболее важные функциональные полиморфизмы гена IL4 — это C-590T и C33T. Некоторыми исследователями показана ассоциация этих полиморфизмов с развитием атопической бронхиальной астмы, обструктивной болезни легких, полипоза носа. Таким образом, ген IL4 непосредственно участвует в регуляции иммунного ответа.
Также он повышает цитокинетическую активность макрофагов, способствует миграции воспалительных нейтрофилов и увеличивает продукцию колониестимулирующих факторов. Наиболее важные функциональные полиморфизмы гена IL4 — это C-590T и C33T. Некоторыми исследователями показана ассоциация этих полиморфизмов с развитием атопической бронхиальной астмы, обструктивной болезни легких, полипоза носа. Таким образом, ген IL4 непосредственно участвует в регуляции иммунного ответа.
Поэтому исследование полиморфных вариантов этого гена необходимо у детей с острыми респираторными заболеваниями. Внедрение этих методов позволяет проводить раннюю диагностику, своевременное лечение и профилактику острого обструктивного бронхита, что позволит снизить заболеваемость детей. Целью данного исследования явился поиск молекулярно-генетических маркеров, ассоциированных с повышенной предрасположенностью детей к повторным эпизодам острого обструктивного бронхита.
Эта статья представляет собой научное исследование, посвященное поиску молекулярно-генетических маркеров, связанных с повышенной склонностью детей к повторным эпизодам острого обструктивного бронхита. Участниками исследования являются молодые пациенты с хроническими неспецифическими заболеваниями легких. Предмет исследования включал эпидемиологию хронического бронхита, особенности влияния изучаемых нозологий на качество жизни пациентов молодого возраста, а также разработку математической программы диагностики хронического бронхита. В теоретическую основу исследования вошли ранее опубликованные работы по выявленным проблемам течения острых хронических заболеваний у детей раннего возраста, исследования по выявлению склонности детей к бронхиальным заболеваниям [18–21].
Участниками исследования являются молодые пациенты с хроническими неспецифическими заболеваниями легких. Предмет исследования включал эпидемиологию хронического бронхита, особенности влияния изучаемых нозологий на качество жизни пациентов молодого возраста, а также разработку математической программы диагностики хронического бронхита. В теоретическую основу исследования вошли ранее опубликованные работы по выявленным проблемам течения острых хронических заболеваний у детей раннего возраста, исследования по выявлению склонности детей к бронхиальным заболеваниям [18–21].
При написании работы использовались общенаучные и специальные методы: системный анализ – методология теории систем, заключающаяся в изучении любых объектов, представленных в виде систем, проведении их структурирования и последующем анализе. Главной особенностью системного анализа является то, что он включает в себя не только методы анализа (от греч. «анализ» — расчленение объекта на элементы), но и методы синтеза (от греч. единое целое.Основной целью системного анализа является выявление и устранение неопределенности в решении сложной задачи на основе поиска наилучшего решения из имеющихся альтернатив [15].Системный анализ позволил проанализировать этапы тестирования у детей с повышенной склонностью к повторные эпизоды острого обструктивного бронхита для выявления закономерностей в их анализе.
единое целое.Основной целью системного анализа является выявление и устранение неопределенности в решении сложной задачи на основе поиска наилучшего решения из имеющихся альтернатив [15].Системный анализ позволил проанализировать этапы тестирования у детей с повышенной склонностью к повторные эпизоды острого обструктивного бронхита для выявления закономерностей в их анализе.
Метод сравнительного анализа является мощным и универсальным инструментом, расширяющим понимание и описывающим политические процессы и изменения в изучаемой сфере. С помощью сравнительного анализа определены особенности течения заболевания у детей с единичным случаем острого обструктивного бронхита и детей с рецидивами и рецидивами этого заболевания. Также системный подход применялся для анализа данных, полученных из теоретической и практической базы. С помощью этого метода были выявлены все стадии заболевания и найдены методы лечения хронического острого обструктивного бронхита у детей.
Представленное исследование проведено в Институте наследственной патологии НАМН Украины в течение 2019–2020 гг. Обследованы и составлены в качестве группы сравнения 59 детей в возрасте от 2 до 8 лет с рецидивирующими эпизодами острого обструктивного бронхита (ООБ) и 35 детей того же возраста, болевших острым бронхитом (ОБ) не менее 1-2 раз в год. II-АБК). Группы детей имели различия в распределении по возрасту и полу. В двух группах детей было почти поровну мальчиков (58,0%) и девочек (42,0%) в возрасте от двух до восьми лет. Проведено молекулярно-генетическое исследование 35 детей с рецидивирующими эпизодами острого обструктивного бронхита (I-ООБ) и его результаты сопоставлены с таковыми у 35 детей с острым бронхитом (II-ОБК).
Обследованы и составлены в качестве группы сравнения 59 детей в возрасте от 2 до 8 лет с рецидивирующими эпизодами острого обструктивного бронхита (ООБ) и 35 детей того же возраста, болевших острым бронхитом (ОБ) не менее 1-2 раз в год. II-АБК). Группы детей имели различия в распределении по возрасту и полу. В двух группах детей было почти поровну мальчиков (58,0%) и девочек (42,0%) в возрасте от двух до восьми лет. Проведено молекулярно-генетическое исследование 35 детей с рецидивирующими эпизодами острого обструктивного бронхита (I-ООБ) и его результаты сопоставлены с таковыми у 35 детей с острым бронхитом (II-ОБК).
В качестве материала для исследования выделена ДНК из лейкоцитов периферической крови больного. Специфичность продуктов ПЦР и анализ рестрикционных фрагментов проводили с помощью электрофореза в 2–3% агарозном геле в течение 30–40 мин при напряжении 100 В. Электрофореграмму сканировали на ультрафиолетовом осветителе Трана. Полученные сигналы сравнивались с маркерами длины и на основании этого определялись размеры полученных фрагментов.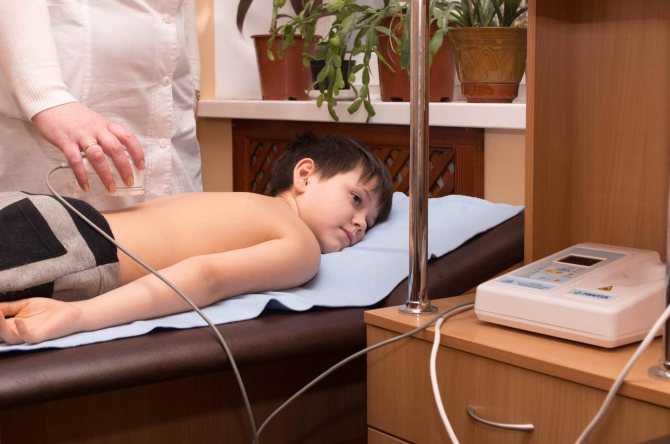 Согласно требованиям биоэтики в отношении проведения лабораторных исследований биологического материала, родители каждого ребенка получили письменное согласие на исследование биоматериала.
Согласно требованиям биоэтики в отношении проведения лабораторных исследований биологического материала, родители каждого ребенка получили письменное согласие на исследование биоматериала.
Результаты статистически обработаны на персональном компьютере с вычислением значений средней арифметической (М), ошибки средней арифметической (м), критерия Стьюдента (t), степени вероятности (р), критерия Пирсона ( χ 2 ) и отношение шансов (OR). Статистически значимые различия оценивались при р<0,01 и р<0,05. Критерий Стьюдента (t) используется для проверки равенства средних значений в двух выборках. Критерий Пирсона (χ 2 ) позволяет проверить значимость расхождения между эмпирической (наблюдаемой) и теоретической (ожидаемой) частотами. Использование критерия χ2 разбивает диапазон варьирования выборки на интервалы и определяет количество наблюдений (частоту) для каждого из интервалов.
Сравнительный анализ клинического состояния обследованных детей с рецидивирующими эпизодами острого обструктивного бронхита и детей с острым бронхитом по данным клинических, рентгенологических исследований и лабораторных показателей представлен в . Исследование показало, что у детей с рецидивирующими эпизодами острого обструктивного бронхита достоверно выше частота клинических проявлений гипооксигенации: бледность кожных покровов, снижение сатурации, аускультативно (в виде сухих свистящих хрипов). Также у них были перкуторные изменения в легких, рентгенологические признаки обструктивного бронхита, эозинофилия, лимфоцитоз в картине крови по сравнению с данными у детей с острым бронхитом ().
Исследование показало, что у детей с рецидивирующими эпизодами острого обструктивного бронхита достоверно выше частота клинических проявлений гипооксигенации: бледность кожных покровов, снижение сатурации, аускультативно (в виде сухих свистящих хрипов). Также у них были перкуторные изменения в легких, рентгенологические признаки обструктивного бронхита, эозинофилия, лимфоцитоз в картине крови по сравнению с данными у детей с острым бронхитом ().
Таблица 1.
Сравнительный анализ клинического состояния детей 2–8 лет с рецидивирующими эпизодами острого обструктивного бронхита и группы детей с острым бронхитом.
| Клинические проявления: | Частота клинико-лабораторных проявлений в группах детей | |||
|---|---|---|---|---|
| И-АОБ | II-АБК | |||
| n=59 | д | n=35 | д | |
| Бледность кожи | 39 | 0,66 * | 7 | 0,20 |
| Уменьшение насыщенности | 36 | 0,61 * | – | – |
| Аускультативные изменения | 54 | 0,92 * | 5 | 0,14 |
| Коробчатый перкуссионный звук | 51 | 0,86 * | – | – |
| Рентгенологические признаки бронхита | 44 | 0,75 * | 10 | 0,29 |
| Лейкоцитоз | 16 | 0,27 | 12 | 0,34 |
| Эозинофилия | 31 | 0,53 * | 4 | 0,11 |
| Лимфоцитоз | 34 | 0,58 ** | 9 | 0,26 |
Открыть в отдельном окне данные сравнения частоты эпизодов острого и обструктивного бронхитов у детей; р<0,01; ** – достоверная разница между данными частоты детей с рецидивирующими эпизодами острого обструктивного бронхита и группой сравнения; р<0,05; q – отклонение частоты параметра от нормы или эталонного значения.
Следующим этапом работы выполнено молекулярно-генетическое исследование полиморфных локусов С-33Т гена ИЛ-4 у детей с рецидивирующими эпизодами острого обструктивного бронхита в сравнении с данными детей с острым бронхитом. Результаты представлены в .
Таблица 2.
Анализ распределения генотипов по полиморфному локусу С-33Т гена IL4.
| Генотипы | II–AOB, N=35 | II–ABK, N=35 | х 2 | р | ИЛИ, 95% ДИ | ||
|---|---|---|---|---|---|---|---|
| п | % | п | % | ||||
| СС | 9 | 26,0 ** | 18 | 51,0 | 4,88 | <0,05 | 0,89 (0,34–2,39) |
| КТ | 22 | 63,0 * | 10 | 29,0 | 8. 29 29 | <0,01 | 4,23 (1,55–11,55) |
| 666 (1,55–11,55) | |||||||
| 6 (1,55–11,55) ТТ | 4 | 11,0 | 7 | 20,0 | 0,97 | > 0,05 | 0,52 (0,14–1,95). с рецидивирующим острым обструктивным бронхитом и группой сравнения; р<0,01; ** – достоверная разница между данными частоты детей с рецидивирующими эпизодами острого обструктивного бронхита и группой сравнения; р<0,05. Выявлена достоверно более высокая частота генотипа 33СТ у детей с рецидивирующими эпизодами острого обструктивного бронхита, чем у детей с острым бронхитом (63,0% против 29,0% в группе сравнения, р<0,01). Сохранение локальной микробной экологии в популяциях моновидов в биопленках вызывает хроническое воспалительное состояние, полезное для таких организмов, как нетипизированная Haemophilus influenzae (NTHi). NTHi использует такие продукты, как ДНК, в сетях нейтрофилов для целей построения матрицы и получит пользу от высвобождения других питательных веществ в местную среду, вызванную воспалением [16]. Вирусные инфекции способствуют образованию биопленок и вызывают «вспышки», описываемые высвобождением планктонных организмов. Заболевания органов дыхания относятся к наиболее частым заболеваниям в клинической практике каждого педиатра. Рецидивирующие вирусные инфекции являются частью процесса взросления любого ребенка. Особенно у детей можно наблюдать некоторых, кто страдает рецидивирующими инфекциями верхних или нижних дыхательных путей. В целом благополучный ребенок с рецидивирующими респираторными инфекциями (РРИ) не имеет серьезных заболеваний. У большинства детей нет иммунодефицита, но если он есть, то это часто обусловлено дефицитом антител. При положительном анамнезе на иммунодефицит необходимо подробное иммунологическое обследование. Иммунологическое тестирование следует проводить другим детям после того, как будут исключены другие более распространенные причины ОРЗ, такие как гастроэзофагеальный рефлюкс, аллергии или очаговая ЛОР-инфекция (гипертрофия аденоидов). Лечение и профилактика этих инфекций имеют свои правила и должны включать раннюю, целенаправленную антибактериальную терапию, острые приступы инфекции, длительное и адекватное выздоровление, ликвидацию всех возможных очагов и источников инфекции, полное исследование иммунного статуса ребенка статус [18]. Важно не развивать позицию лечения всех явных вирусных инфекций для предотвращения хронического бронхита. Существует несколько возможностей иммуномодулирующей терапии. Многие клинические и экспериментальные исследования, в том числе данное исследование, подтвердили их эффективность и фармакологическую безопасность. Правильное назначение и применение каждого средства иммуномодуляции должно осуществляться только в указанных случаях при индивидуальном подходе к каждому ребенку с учетом всех правил иммуномодулирующей терапии. Не менее важно своевременно определить причину хронически протекающего острого бронхита у детей с помощью методов, выявленных в данном исследовании. У детей с рецидивирующими эпизодами острого обструктивного бронхита по сравнению с больными острым бронхитом диагностирована достоверно более высокая частота таких клинических проявлений, как бледность, наличие хрипов, коробочный перкуторный звук, снижение O 2 сатурации, эозинофилия, лимфоцитоз . Необходимы дальнейшие исследования, чтобы установить более совершенные клинические критерии, которые могут помочь клиницистам диагностировать острый обструктивный бронхит. Фактически предлагаемые критерии острого обструктивного бронхита неспецифичны и могут привести к значительной гипердиагностике и чрезмерному использованию антибиотиков, что может вызвать устойчивость к антибиотикам. Необходимы дальнейшие исследования для выявления и лечения хронического острого обструктивного бронхита с использованием анализа генома пациента. Конфликт интересовАвторы заявляют об отсутствии конфликта интересов. Этическое одобрение Исследование одобрено Институтом наследственной патологии НАМН Украины № 486/3. Согласие на участиеРодители каждого ребенка дали письменное согласие на исследование биоматериала. АвторствоКомпания NL разработала исследование. OK и ZN провели исследования и анализы. DT и MS интерпретировали данные и написали рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи. 1. Cutrera R, Baraldi E, Indinnimeo L, Del Giudice MM, Piacentini G, Scaglione F, Ullmann N, Moschino L, Galdo F, Duse M. Ведение острых респираторных заболеваний у детей: роль пероральных кортикостероидов . Ital J Pediatr. 2017;43(31):1–21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Pedro CR, Freitas PP, Papoila AL, Dias SS, Caires I, Martins P, Neuparth N. Респираторные заболевания у детей, посещающих детские сады: переменные, связанные со здоровьем, и матери. психологическое, родительское и супружеское функционирование. Открытая психология здоровья. 2017;4(2):1–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. 4. Сильва-Эстрада Дж., Рейна-Фигероа Дж., Вакида-Кусуноки Г., Лимон-Рохас А., Кампос-Ромеро Ф. Свистящее дыхание у детей. Respir Med Case Rep. 2018; 2:1038. [Google Scholar] 5. Ren CL, Esther CR, Debley JS. Официальные клинические рекомендации Американского торакального общества: диагностическая оценка младенцев с рецидивирующими или постоянными хрипами. Am J Respir Crit Care Med. 2016;194(3):356–373. [PubMed] [Google Scholar] 6. Bannier MAGE, van de Kant KDG, Jöbsis Q, Dompeling E. Биомаркеры для прогнозирования астмы у детей дошкольного возраста с одышкой. Клин Эксперт Аллергия. 2015;6(45):1040–1050. [PubMed] [Google Scholar] 7. Ибатова С.М., Маматкулова Ф.К., Рузикулов Н.Ю. Клиника острого обструктивного бронхита у детей и обоснование иммуномодулирующей терапии. 8. ван Влит Д., Смолинска А., Йобсис К., Росиас Ф., Мурис Дж., Даллинга Дж., Домпелинг Э., ван Шоотен Ф.-Дж. Могут ли выдыхаемые летучие органические соединения предсказать обострение астмы у детей? J Дыхание Res. 2017;1(11):48–54. [PubMed] [Академия Google] 9. ван Мастригт Э., де Йонгсте Дж. К., Пейненбург М.В. Анализ летучих органических соединений в выдыхаемом воздухе и биомаркеров в конденсате выдыхаемого воздуха у детей – клинические инструменты или научные игрушки? Клин Эксперт Аллергия. 2015;45(7):1170–1188. [PubMed] [Google Scholar] 10. Хассан Э.Б., Шихаб Б.А., Ад’Хия А.Х., Обейд Х.А. Генетический полиморфизм гена интерлейкина-4 при воспалительных заболеваниях кишечника у иракских пациентов. Иммунол Инвест. 2017;46(7):714–729. [Google Scholar] 11. Anovazzi G, Medeiros MC, Pigossi SC, Finoti LS, Souza Moreira TM, Mayer MPA, Zanelli CF, Valentini SR, Rossa-Junior C, Scarel-Caminaga RM. Функциональность и противоположные роли двух гаплотипов интерлейкина 4 в иммунных клетках. 12. Wojtowicz A, Biberta S, Taffe P. Полиморфизм IL-4 влияет на восприимчивость к пневмоцистной пневмонии у ВИЧ-положительных пациентов. СПИД. 2019;33(11):1719–1727. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Jin Y, Wang J, Bachtiar M, Chong SS, Lee CGL. Архитектура полиморфизмов в геноме человека выявляет функционально важные и положительно отобранные варианты генов иммунного ответа и переносчиков лекарств. Гум Геномика. 2018;12:2–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Junttila S. Настройка ответов цитокинов: обновленная информация о комплексах рецепторов интерлейкина (IL)-4 и IL-13. Фронт Иммунол. 2018;9(888):1–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Prout MS, Kyle RL, Ronchese F, Le Gros G. IL-4 является ключевым требованием для IL-4- и IL-4/IL-13- экспрессирующие субпопуляции CD4 Th3 в легких и коже. Фронт Иммунол. 2018;9:1211. 16. Ihsan AH, Jaber SH. Генотипирование гена IL-4 -590 (C>T) у больных астмой в Ираке. Дис маркеры. 2017; 8:1–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Мохаммади М., Дабири С., Реза Моллаеи Х., Джуздани С.Р., Амизаде М., Эсмаилзаде Дж., Банеши М.Р., Мианруди А.А. Полиморфизм промотора C-590T гена интерлейкина (IL)-4 связан с повышенной предрасположенностью к назальному полипозу. Представитель Biochem Mol Biol. 2019;7(2):129–135. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ameli F, Brocchetti F, Mignosi S, Tosca MA, Gallo F, Ciprandi G. Рецидивирующие респираторные инфекции у детей: исследование в клинической практике. Акта Био Мед. 2020;91(4):1–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Kansen HM, Lebbink MA, Mul J, van Erp FC, van Engelen M, de Vries E, Prevaes SMPJ, Le TM, van der Ent CK, Verhagen LM . Факторы риска атопических заболеваний и рецидивирующих инфекций дыхательных путей у детей. 20. Шейх М.А. Ретроспективно сообщается, что невзгоды детства связаны с астмой и хроническим бронхитом, независимо от психического здоровья. Дж. Психосом Рез. 2018;114:50–57. [PubMed] [Академия Google] 21. Лерл С., Кардос П., Маттис Х., Камин В. Валидация клинического инструмента для измерения тяжести острого бронхита у детей – BSS-пед. Open Respir Med J. 2018;12(1):50–66. [Бесплатная статья PMC] [PubMed] [Google Scholar] [Пластический бронхит у ребенка с талассемией альфа]Отчеты о клинических случаях . 2005 г., ноябрь-декабрь; 81(6):499-502. doi: 10.2223/JPED.1425. [Статья в Португальский] Tiago N Veras 1 , Густаво М. Ланнес, Джефферсон П. принадлежность
Отчеты о делах [Статья в португальский] Tiago N Veras et al. Джей Педиатр (Рио Джей). 2005 ноябрь-декабрь. . 2005 г., ноябрь-декабрь; 81(6):499-502. doi: 10. АвторыТьяго Н Верас 1 , Густаво М. Ланнес, Джефферсон П. Пива, Ренато Т. Стейн, Маркус Х. Джонс, Винисиус Д. Сильва, Педро Селини Рамос Гарсия, Пауло М. С. Питрез принадлежность
Абстрактный Цель: Пластический бронхит — редкое состояние у детей, связанное с образованием мукофибринозных цилиндров и слизистой закупоркой трахеобронхиального дерева. Описание: Трехлетний чернокожий ребенок мужского пола, ранее здоровый, поступил с острой дыхательной недостаточностью, рентгенограмма грудной клетки показала ателектаз легких. Не было никаких признаков респираторных симптомов или предшествующего аллергического состояния. Диагноз пластического бронхита был поставлен с помощью гибкой и жесткой бронхоскопии и подтвержден гистопатологическими данными. Ребенок развивался хорошо, лечение было основано на поддерживающей терапии, антибиотики не применялись. Через десять дней после выписки рентгенологическая картина была нормальной. Альфа-талассемию диагностировали с помощью электрофореза гемоглобина. Комментарии: Пластический бронхит имеет клиническое значение, поскольку имеет сходные проявления с другими распространенными заболеваниями, такими как аспирация инородного тела и астма. При подозрении на пластический бронхит показана эндоскопия для подтверждения диагноза и определения тактики лечения. Ранее пластический бронхит был описан у пациентов с муковисцидозом, кардиохирургическими вмешательствами и серповидно-клеточной анемией. В этом случае наблюдалась ассоциация с альфа-талассемией. Похожие статьи
Посмотреть все похожие статьи Цитируется
|

 При этом достоверно выше частота генотипа СС у детей с острым бронхитом, чем у детей с рецидивирующими эпизодами острого обструктивного бронхита (51,0% против 26,0% в группе детей с рецидивирующими эпизодами острого обструктивного бронхита, р<0,05). Исследование показало, что наличие IL4 Генотип 33CT связан с предрасположенностью к повторным эпизодам острого обструктивного бронхита и 4-кратным увеличением риска возникновения (ОШ 4,23, 95% ДИ 1,55–11,55).
При этом достоверно выше частота генотипа СС у детей с острым бронхитом, чем у детей с рецидивирующими эпизодами острого обструктивного бронхита (51,0% против 26,0% в группе детей с рецидивирующими эпизодами острого обструктивного бронхита, р<0,05). Исследование показало, что наличие IL4 Генотип 33CT связан с предрасположенностью к повторным эпизодам острого обструктивного бронхита и 4-кратным увеличением риска возникновения (ОШ 4,23, 95% ДИ 1,55–11,55). Это имеет биологический смысл, поскольку вирусная инфекция будет способствовать дальнейшему распространению внутри текущего хозяина, что приведет к «обострению» симптомов вне естественного течения вирусного заболевания [17].
Это имеет биологический смысл, поскольку вирусная инфекция будет способствовать дальнейшему распространению внутри текущего хозяина, что приведет к «обострению» симптомов вне естественного течения вирусного заболевания [17].
 Доказано, что если ребенок является носителем генотипа 33СТ гена IL4 , риск повторных эпизодов острого обструктивного бронхита увеличивается в 4 раза. Кроме того, генотип 33СС у детей является фактором защиты от повторных эпизодов острого обструктивного бронхита.
Доказано, что если ребенок является носителем генотипа 33СТ гена IL4 , риск повторных эпизодов острого обструктивного бронхита увеличивается в 4 раза. Кроме того, генотип 33СС у детей является фактором защиты от повторных эпизодов острого обструктивного бронхита.
 Аль-Шамрани А., Багаис К., Аленази А., Алкваи М., Аль-Харби А.С. Хрипы у детей: подходы к диагностике и лечению. Int J Pediatr Adolesc Med. 2019;6(2):68–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Аль-Шамрани А., Багаис К., Аленази А., Алкваи М., Аль-Харби А.С. Хрипы у детей: подходы к диагностике и лечению. Int J Pediatr Adolesc Med. 2019;6(2):68–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]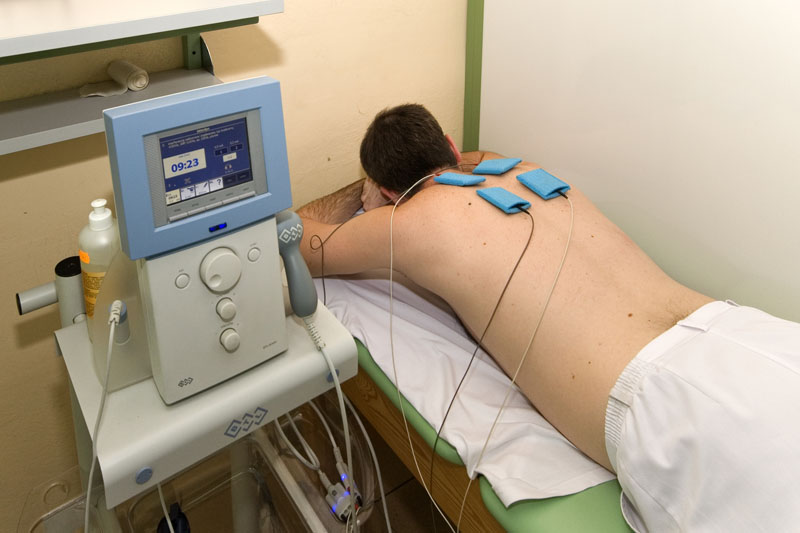 Int J Curr Res Rev. 2020;12(17):152–155. [Google Scholar]
Int J Curr Res Rev. 2020;12(17):152–155. [Google Scholar]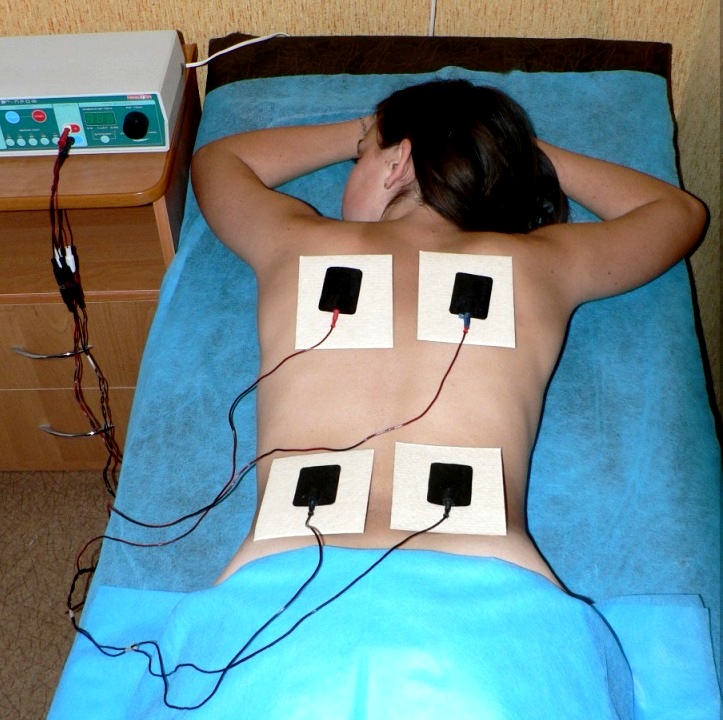 Гены и иммун. 2017;18:33–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гены и иммун. 2017;18:33–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar] Педиатр Пульмонол. 2020;55(11):3168–3179. [ЧВК бесплатная статья] [PubMed] [Google Scholar]
Педиатр Пульмонол. 2020;55(11):3168–3179. [ЧВК бесплатная статья] [PubMed] [Google Scholar] Пива, Ренато Т. Стейн, Маркус Х. Джонс, Винисиус Д. Сильва, Педро Селини Рамос Гарсия, Пауло М. С. Питрез
Пива, Ренато Т. Стейн, Маркус Х. Джонс, Винисиус Д. Сильва, Педро Селини Рамос Гарсия, Пауло М. С. Питрез 2223/JPED.1425.
2223/JPED.1425. Учитывая, что это заболевание является частью дифференциальной диагностики острой дыхательной недостаточности, раннее лечение важно для улучшения прогноза. Целью данного сообщения является описание случая пластического бронхита у ребенка с альфа-талассемией, который был успешно вылечен с помощью эндоскопии.
Учитывая, что это заболевание является частью дифференциальной диагностики острой дыхательной недостаточности, раннее лечение важно для улучшения прогноза. Целью данного сообщения является описание случая пластического бронхита у ребенка с альфа-талассемией, который был успешно вылечен с помощью эндоскопии.
 Чжунхуа Эр Кэ За Чжи. 2012.
PMID: 22932014
Китайский язык.
Чжунхуа Эр Кэ За Чжи. 2012.
PMID: 22932014
Китайский язык. Грудь. 2010.
PMID: 21138885
Грудь. 2010.
PMID: 21138885