Гемолитическая кишечная палочка у ребенка симптомы
Кишечная палочка у грудничка
Гемолитическая (гемолизирующая) кишечная палочка у грудничка
Микрофлора кишечника разнообразна. Для нормальной деятельности в нем должны быть полезные («хорошие») бактерии: прежде всего лактобактерии, бифидумбактерии, колибактерии. Они помогают переваривать пищу, вырабатывают полезные вещества, например, витамины. При рождении ребенок из стерильной среды попадает в мир, полный вирусов и бактерий. Соответственно в его кишечнике помимо «хороших» могут появиться вредные («плохие») микроорганизмы, такие как золотистый стафилококк, кандиду и др. которые способствуют росту патогенной микрофлоры. Причины этого различны: имевшаяся инфекция в организме мамы, слабый иммунитет, непереносимость ребенком лактозы, нарушения в пищеварительной системе, искусственное или неправильное питание малыша и т.п.
К числу патогенных микроорганизмов, нарушающих работу кишечника, относится представитель лактозонегативных энтеробактерий — гемолитическая (или гемолизирующая) кишечная палочка, которой в идеале в кишечнике не должно быть вовсе. Даже при наличии совсем малого ее количества организм грудничка не сможет работать нормально. У младенца появляются диатез, запоры, вздутие, болевые ощущения в животе, жидкий или кашеобразный пенистый стул со слизью и зелеными примесями. Возникший дисбактериоз нуждается в обязательном лечении, так как может стать причиной частых недомоганий ребенка, а в более старшем возрасте проявиться в ряде серьезных заболеваний.
Для того чтобы уточнить симптомы заболевания ребенка и поставить правильный диагноз, необходимо сдать анализы на дисбактериоз и копрологию, затем обратиться к детскому гастроэнтерологу, который определит и проконтролирует лечение.
Лечение гемолитической (гемолизирующей) кишечной палочки у грудничка
При наличии гемолитической кишечной палочки необходимо стабилизировать среду кишечника ребенка и увеличить количество полезных микроорганизизмов. Обычно с этой целью назначают препараты, содержащие полезные бактерии — пробиотики (Бифидумбактерин, Колибактерин, Линекс, Бифи-форм, Пробифор, Бифидумбактерин форте и др.), или препараты, способствующие формированию полезных бактерий в кишечнике, – пребиотики (Хилак–форте, Лизоцим, Дюфалак.
Лактулоза). Процесс избавления от палочки длительный, поэтому следует пройти весь назначенный курс лечения, а после его окончания обязательно сдать анализы.
Обычно с этой целью назначают препараты, содержащие полезные бактерии — пробиотики (Бифидумбактерин, Колибактерин, Линекс, Бифи-форм, Пробифор, Бифидумбактерин форте и др.), или препараты, способствующие формированию полезных бактерий в кишечнике, – пребиотики (Хилак–форте, Лизоцим, Дюфалак.
Лактулоза). Процесс избавления от палочки длительный, поэтому следует пройти весь назначенный курс лечения, а после его окончания обязательно сдать анализы.
Улучшить и закрепить эффект лечения можно, соблюдая диету (рекомендуется при грудном вскармливании — маме, в более старшем возрасте — ребенку): употреблять в пищу подсушенный зерновой хлеб, чернослив (сами плоды и их отвар), растворенный в воде мед.
Хороший результат при лечении заболевания дает кормление малыша грудным молоком: содержащаяся в нем лактоза пополняет кишечник ребенка полезными бактериями, в частности бифидобактериями, улучшает его работу за счет создания кислой среды, губительной для патогенных микроорганизмов. Если нет возможности кормить малыша грудью, лучше отдать предпочтение молочным смесям с пребиотиками (предварительно необходимо проконсультироваться с педиатром).
Лактозонегативная кишечная палочка у грудничка
Лактозонегативная кишечная палочка относится к числу условно-патогенных бактерий, которые всегда находятся в кишечнике. В норме (не более 5%) она безвредна и даже полезна (участвует в процессах обмена веществ, вырабатывает витамины В и К, способствует усваиванию кальция и железа), но при превышении нормы содержания способна подавлять полезную микрофлору кишечника и стать причиной дисбактериоза. В этом случае у малыша наблюдаются срыгивание, газообразование, чередование расстройств кишечника и запоров, наличие непереваренной пищи в кале, болевые ощущения в животе.
Поскольку превышение лактозонегативной палочки не рассматривается как серьезное заболевание ЖКТ, существуют различные точки зрения относительно того, как быстро необходимо нормализовать ее количество в кишечнике. Курс лечения обычно заключается в обеспечении кишечника пробиотиками и пребиотиками, в соблюдении щадящей диеты.
Курс лечения обычно заключается в обеспечении кишечника пробиотиками и пребиотиками, в соблюдении щадящей диеты.
Кишечная палочка: симптомы, лечение и локация
Кишечная палочка – бактерия из семейства Энтербактерий. Ее открыл в конце XIX столетия Теодор Эшерих. Поэтому бактерия имеет еще одно название – палочка Эшериха. Кишечная палочка принадлежит к факультативным анаэробам. Она может жить только при отсутствии кислорода.
Палочка Эшериха является грамотрицательной бактерией: кишечная палочка в мазке, который окрашивается по грамму, не изменяет цвет. Кишечная палочка на фото имеет продолговатый вид.
Бактерия может на протяжении длительного времени жить в почве, воде, продуктах и испражнениях. При температуре 60 градусов погибает на протяжении 15 минут, а при 100 градусах ̶ мгновенно. Быстро уничтожают бактерию дезинфицирующие вещества: формалин, хлорамин и другие.
Разновидности кишечной палочки
Палочка Эшериха характеризуется наличием около 100 штаммов. В основном бактерии группы кишечной палочки являются частью полезной микрофлоры желудочно-кишечного тракта. Они участвуют в синтезе витамина К и В, а также в процессах пищеварения. Но некоторые штаммы принадлежат к патогенным микроорганизмам. Среди них самой распространенной является гемолитическая или гемолизирующая кишечная палочка .
Патогенные разновидности приводят к серьезным отравлениям, развитию кишечного дисбактериоза и колибактериоза. Нередко они становятся причиной возникновения цистита, уретрита, кольпита, простатита, пиелонефрита, орхита, аднексита, менингита, мастита, пневмонии, перитонита, сепсиса.
Лактозонегативная кишечная палочка принадлежит к условно-патогенным микроорганизмам. Она может обитать в кишечнике ничем не выдавая себя. Но если концентрация бактерии увеличивается, то она становится причиной болезни.
Гемолитическая кишечная палочка у грудничка может даже привести к смерти, если своевременно не приступить к лечению.
Причины заболеваний
Заразиться болезнетворной формой кишечной палочки можно фекально-оральным путем. Обычно заражение осуществляется при:
Обычно заражение осуществляется при:
В основном патогенные штаммы палочки Эшериха обнаруживают у детей.
Гемолизирующая кишечная палочка у взрослых может появиться в результате снижения иммунитета (в основном после бесконтрольного приема антибиотиков), переохлаждения или простуды.
Симптомы
Если в организм проникла патогенная кишечная палочка, симптомы ее присутствия проявляются:
Вредоносная кишечная палочка у грудничка заявляет о себе болями в животе. Кал у ребенка становится зеленым, в нем появляются примеси слизи, развивается дисбактериоз.
Лечение кишечной палочки
Основной вопрос, ответ на который интересует больных: «Как лечить кишечную палочку?». Прежде всего, следует сделать бактериальный посев, чтобы определить штамм микроорганизма. При заболеваниях кишечника для посева берут материал рвотных масс или испражнений, при болезнях мочевыводящей системы – используют мочу, а при поражении половой системы – мазки со слизистых оболочек половых органов. С помощью бактериальных посевов идентифицируют бактерию, а затем определяют ее чувствительность к антибиотикам.
Больного обязательно госпитализируют и назначают диету. При поражении пищеварительной системы рекомендуется диета №4, а при поражении мочеполовой системы – диета №7. Если в организме присутствует болезнетворная кишечная палочка, лечение включает этиотропную, патогенетическую и постсиндромальную терапию .
Этиотропная терапия проводится с помощью антибиотиков и бактериофагов, учитывая антибиотикограмму. Если диагностируется дисбактериоз, то назначают пробиотики. Помогут восстановить равновесие в кишечнике и кисломолочные продукты.
Если диагностируется дисбактериоз, то назначают пробиотики. Помогут восстановить равновесие в кишечнике и кисломолочные продукты.
Патогенная терапия в основном осуществляется путем инфузионного лечения: в кровь вводят разнообразные растворы, чтобы восполнить запас жидкости и очистить организм от токсинов.
Постсиндромальная терапия назначается в зависимости от проявления болезни.
Особенности лечения в зависимости от локализации бактерии
Если обнаруживается кишечная палочка в моче, то такое явление называется бактериурией. Лечение кишечной палочки в моче осуществляют с помощью антибиотиков, уросептиков и биологически активных добавок, способствующих укреплению иммунной системы и останавливающих развитие инфекции.
Кишечная палочка во влагалище приводит к развитию воспалительных процессов в органах половой системы. Лечение кишечной палочки в гинекологии проводится коротким курсом антибиотиков и требует тщательного соблюдения личной гигиены и отказа от половых контактов.
Если кишечная палочка обнаруживается в зобе, то предстоит длительное лечение с применением антибиотиков и противогрибковых средств. Желательно пользоваться ополаскивателями ротовой полости, которые оказывают дезинфицирующий эффект.
Если выявлена кишечная палочка при беременности и у детей, то лечение начинают из применения пробиотиков и бактериофагов. Если они не оказывают нужного результата, то прибегают к помощи антибиотиков.
Гемолизирующая кишечная палочка у грудничка лечится пробиотиками. Они способствуют развитию полезных микроорганизмов и гибели болезнетворных. Благоприятно действует на микрофлору кишечника и материнское молоко.
Народная медицина против палочки Эшериха
Эффективно дополнят медикаментозное лечение средства народной медицины:
- Топинамбур (300 грамм) чистят, нарезают кубиками и кладут в кипящее молоко, разбавленное наполовину водой (500 миллилитров). Когда топинамбур размягчится его вынимают, а в молоко добавляют муку (20 грамм) и масло (40 грамм).
 Варят до загустения. Затем полученным соусом заливают топинамбур, добавляют зелень. Полученное блюдо прекрасно дополнит любую пищу.
Варят до загустения. Затем полученным соусом заливают топинамбур, добавляют зелень. Полученное блюдо прекрасно дополнит любую пищу. - Гусиную лапчатку (20 грамм) заваривают кипятком (250 миллилитров) и подержав на слабом огне четверть часа, оставляют на ночь. Пьют 3 раза в день по 80 миллилитров.
- Траву череды (10 грамм) заливают остывшей кипяченой водой (250 миллилитров) и помещают на 15 минут на водяную баню. Принимают отвар утром, в обед и вечером по 20 миллилитров.
- Перемешивают лекарственный донник, мать-и-мачеху и золототысячник в равных соотношениях. В смесь трав (20 грамм) вливают кипяток (250 миллилитров). Оставляют на четверть часа. Пьют один раз в день по 20-50 миллилитров.
Также можно перед принятием пищи трижды день на протяжении месяца съедать по половине грамма мумие.
Народные средства восстановят микрофлору кишечника и уменьшат негативное влияние патогенных бактерий.
Профилактика инфекций
Чтобы в организм не проникла гемолитическая кишечная палочка, необходимо следовать правилам личной гигиены, не пить воду из неизвестных источников, овощи и фрукты употреблять в пищу мытыми, правильно проводить тепловую обработку продуктов.
Мнение доктора биологических наук Гельфанда М. С. о кишечной палочке:
Как вылечить гемолитическую кишечную палочку
Содержание
Первыми симптомами кишечной палочки является диарея и понос. Вот такую болячку обнаружили у моей дочки, когда та ходила в детский садик. Однажды, приведя свое чадо домой, я заметила что ребенок ведет себя необычно — вяло и сонливо, кроме того, у нее была температура. Уже вечером у дочери отрылся понос, поочередно меняющийся со рвотой. Стандартные препараты, принимающиеся в таких ситуациях, ожидаемого результата не принесли, поэтому, следующим утром я поспешила вызвать врача, который, сразу по прибытию, отправил нас в лабораторию. В мазке обнаружили кишечную палочку. Затем оказалось, что не только моя дочь каким-то образом подхватила эту инфекцию, а и многие ребята из детского сада. Его впоследствии закрыли на карантин. Ну и по уже негласно принятому сценарию, руководство дошкольного учреждения свою вину отрицало, спихивая все на родителей и их детей. Правдой в этом утверждении и не пахло, что доказала санэпидемстанция во время проверки продуктов питания — в них нашли кишечную палочку.
Его впоследствии закрыли на карантин. Ну и по уже негласно принятому сценарию, руководство дошкольного учреждения свою вину отрицало, спихивая все на родителей и их детей. Правдой в этом утверждении и не пахло, что доказала санэпидемстанция во время проверки продуктов питания — в них нашли кишечную палочку.
Вездесущие бактерии
Бактерии кишечной палочки могут существовать и доставлять неприятности как в брюшной полости, так и во влагалище. В первую очередь это можно объяснить неправильностью проводимых процедур гигиены. Находят такую кишечную палочку в моче, поскольку инфекция быстро оказывается в мочевыводящих путях. Ее также находят в горле, легких, и, даже, в клетках мозга. Однако, самой распространенной кишечной инфекцией является гемолитическая, которую можно обнаружить при анализе кала. Ее наличие может стать причиной достаточно тяжелого состояния как ребенка, так и взрослого, спровоцировать развитие иных инфекционных заболеваний.
В действительности, разного рода бактерии и микроорганизмы существуют во всех пищеварительных процессах внутри организма. Иначе говоря, все мы являемся носителями бактерий, но их оптимальное количество и активность в сочетании создают благоприятную микрофлору. Если в организм из внешнего мира попадает кишечная палочка, характеризующаяся слабовыраженными ферментативными свойствами, баланс микрофлоры нарушается, и появляется множество совсем неприятных симптомов.
Лечим кишечную инфекцию
С момента обнаружения кишечной инфекции нужно срочно начинать ее лечение. В таком случае необходимо неотлагательное медикаментозное лечение, так как кишечная палочка активно размножается, порождая все большее количество негативных бактерий. Отнеситесь к этим словам с серьезностью — обезвоживание организма (результат деятельности палочки) может привести к самым печальным последствиям, в том числе — смерти.
Для лечения кишечной инфекции используют антибиотики . принадлежащие к группе аминогликозидов. Наиболее эффективным лечение будет при соблюдении следующих действий: из посева содержимого кишечника нужно определить конкретного возбудителя, и, исходя из этого, назначить самый подходящий препарат.
Но обязательно при таком заболевании необходимо содействие врача!
Тема: Гемолитическая кишечная палочка, энтерогеморрагическая кишечная палочка
Активный участник форума Диагноз Неспецифический язвенный колит Регистрация 18.04.2010 Возраст 35 Сообщения 299 Записей в дневнике 6
Гемолитическая кишечная палочка, энтерогеморрагическая кишечная палочка
Гемолитическая кишечная палочка, энтерогеморрагическая кишечная палочка
Норма <10% (103)
Кишечная палочка, или E.coliпредставлена несколькими разновидностями, одни из которых относятся к нормальной микрофлоре кишечника, другие являются возбудителями кишечных инфекций.
Заболевание кишечника, вызываемое гемолитической кишечной палочкой, носит название геморрагический колит и проявляется: диареей с примесью крови в стуле, болями в животе, повышением температуры тела. Возможно развитие геморрагического уремического синдрома – это тяжелое поражение почек, которое приводит к развитию почечной недостаточности.
Лечение назначается лечащим врачом на основании теста на чувствительность гемолитической кишечной палочки к тому или иному противомикробному лекарству. http://www.polismed.ru/lab-coprograma-post004.html или я что то не понимаю
Источники:
grudnichki.com, gastros.ru, prokishechnik.ru, kronportal.ru
Следующие материалы:
18 марта 2021 года
Комментариев пока нет!E. coli – это бактерия, обычно обнаруживаемая в нижних отделах кишечника теплокровных организмов.
Обзор
Бактерия Escherichia coli (E. coli), продуцирующая шигатоксин часто обнаруживается в кишечнике людей и теплокровных животных. Большинство штаммов E. coli безвредны. Однако некоторые штаммы, такие как энтерогеморрагическая E. coli (STEC), могут вызывать тяжелые болезни пищевого происхождения. Эта бактерия передается человеку, главным образом, при потреблении зараженных пищевых продуктов, таких как сырые или не прошедшие достаточную тепловую обработку продукты из мясного фарша, сырое молоко и загрязненные сырые овощи и ростки.
STEC производит токсины, известные как шига токсины, названные так из-за их сходства с токсинами, производимыми Shigella dysenteriae. Количество бактерий STEC может увеличиваться при температуре от 7°C до 50°С (оптимальная температура 37°С). Количество некоторых бактерий STEC может расти в кислых продуктах с показателем pH вплоть до 4,4, а также в продуктах с минимальной активностью воды (aw) на уровне 0,95.
Бактерии погибают при тщательной тепловой обработке пищевых продуктов — до тех пор, пока все части продуктов не достигнут температуры 70°С или выше. Наиболее значимым для общественного здравоохранения серотипом STEC является E. Coli O157:H7; однако возбудителями спорадических случаев и вспышек заболеваний часто являются и другие серотипы.
Симптомы
Симптомы болезней, вызываемых бактериями STEC, включают абдоминальные спазмы и диарею, которая в некоторых случаях может переходить в кровавую диарею (геморрагический колит). Возможны также лихорадка и рвота. Инкубационный период длится от 3 до 8 дней, при средней продолжительности 3-4 дня. Большинство пациентов выздоравливает в течение 10 дней, но у незначительного числа пациентов (особенно детей раннего возраста и пожилых людей) инфекция может приводить к развитию такой представляющей угрозу для жизни болезни, как гемолитический уремический синдром (ГУС). Для ГУС характерны острая почечная недостаточность, гемолитическая анемия и тромбоцитопения (низкий уровень тромбоцитов в крови).
Люди, страдающие от кровавой диареи или тяжелых абдоминальных спазмов, должны обращаться за медицинской помощью. Антибиотики не являются составной частью лечения пациентов с болезнью, вызванной STEC, и могут повышать риск развития ГУС.
По оценкам, ГУС может развиваться у 10 % пациентов с инфекцией STEC, а коэффициент летальности составляет от 3 до 5 %. Во всем мире ГУС является самой распространенной причиной острой почечной недостаточности у детей раннего возраста. Он может приводить к неврологическим осложнениям (таким как конвульсии, инсульт и кома) у 25 % пациентов и к хроническим заболеваниям почек, обычно нетяжелым, примерно у 50 % выживших пациентов.
Источники и передача инфекции
Имеющаяся о STEC информация относится, в основном, к серотипу O157:H7, так как с биохимической точки зрения его можно легко дифференцировать от других штаммов E. coli. Резервуаром этого патогенного микроорганизма является, в основном, крупный рогатый скот. Кроме того, значительными резервуарами считаются другие жвачные животные (такие как овцы, козы и олени), обнаруживаются и другие инфицированные млекопитающие (такие как свиньи, лошади, кролики, собаки, кошки) и птицы (такие как куры и индейки).
E. coli O157:H7 передается человеку, главным образом, в результате потребления в пищу зараженных пищевых продуктов, таких как сырые или не прошедшие достаточную тепловую обработку продукты из мясного фарша и сырое молоко. Загрязнение фекалиями воды и других пищевых продуктов, а также перекрестное загрязнение во время приготовления пищи (через продукты из говядины и другого мяса, загрязненные рабочие поверхности и кухонные принадлежности) также могут приводить к инфицированию. Примеры пищевых продуктов, явившихся причиной вспышек E. coli O157:H7, включают не прошедшие надлежащую тепловую обработку гамбургеры, копченую салями, непастеризованный свежевыжатый яблочный сок, йогурт и сыр, приготовленный из сырого молока.
Все большее число вспышек болезни связано с потреблением в пищу фруктов и овощей (включая ростки, шпинат, латук, капусту и салат), заражение которых может происходить в результате контакта с фекалиями домашних или диких животных на какой-либо стадии их выращивания или обработки. Бактерии STEC обнаруживаются также в водоемах, (таких как пруды и реки), колодцах и поилках для скота. Они могут оставаться жизнеспособными в течение нескольких месяцев в навозе и осадочных отложениях на дне поилок. Так же была зарегистрирована передача инфекции как через зараженную питьевую воду, так и через воды для рекреационного использования.
Близкие контакты людей являются одним из основных путей передачи инфекции (орально-фекальный путь заражения).
Профилактика
Для профилактики инфекции необходимо соблюдать контрольные меры на всех стадиях продовольственной цепи – от производства сельскохозяйственной продукции на фермах до переработки, обработки и приготовления пищевых продуктов как на коммерческих предприятиях, так и в домашних условиях.
В промышленных условиях
Число случаев заболевания можно уменьшить благодаря проведению разнообразных стратегий по снижению риска в отношении мясного фарша (например, обследование животных перед убоем для предотвращения попадания большого количества патогенных микроорганизмов в места для убоя скота). Надлежащая практика убоя скота и соблюдение гигиены снижают уровень загрязнения туш фекалиями, но не гарантируют отсутствия бактерий STEC в продуктах. Для сведения к минимуму микробиологического заражения крайне важно проводить обучение гигиеническим навыкам при обращении с пищевыми продуктами среди работников ферм, скотобоен и предприятий по производству пищевых продуктов. Единственным эффективным способом уничтожения бактерий STEC в пищевых продуктах является бактерицидная обработка, такая как нагревание (например, тепловая обработка или пастеризация) или облучение.
В домашних условиях
Меры для профилактики инфекции E. coli O157:H7 схожи с мерами, рекомендуемыми для профилактики других болезней пищевого происхождения. Основные практические методики надлежащей гигиены пищевых продуктов, приводимые в «Пяти принципах повышения безопасности пищевых продуктов» ВОЗ, могут способствовать предотвращению передачи патогенных микроорганизмов, вызывающих многие болезни пищевого происхождения, а также защищать от болезней пищевого происхождения, вызываемых STEC.
Пятью важнейшими принципами обеспечения более безопасных пищевых продуктов являются:
Эти рекомендации необходимо выполнять во всех случаях, особенно рекомендацию в отношении «надлежащей тепловой обработки продуктов», при которой температура в середине продуктов достигает, по меньшей мере, 70°C. Необходимо тщательно мыть фрукты и овощи, особенно если они употребляются в пищу в сыром виде. По возможности овощи и фрукты следует чистить. Уязвимым группам населения (таким как дети и пожилые люди) следует избегать потребления в пищу сырых или не прошедших надлежащую тепловую обработку мясных продуктов, сырого молока и продуктов, приготовленных из сырого молока.
Настоятельно рекомендуется регулярное мытье рук, в частности перед приготовлением пищи, едой и после посещения туалета, особенно для людей, ухаживающих за детьми раннего возраста, пожилыми людьми и людьми с ослабленным иммунитетом, так как бактерия может передаваться не только через пищевые продукты, воду и при прямых контактах с животными, но и от человека человеку.
Некоторое количество инфекций STEC возникает в результате контакта с водами для рекреационного использования. Поэтому, важно также защищать такие водоемы, равно как и источники питьевой воды, от попадания в них экскрементов животных.
Производители фруктов и овощей
Публикация ВОЗ «Пять важнейших принципов выращивания более безопасных фруктов и овощей», предназначаемая для сельскохозяйственных работников, выращивающих свежие фрукты и овощи для себя, своих семей и для продажи на местных рынках, содержит основные практические методики для предотвращения микробного загрязнения свежей продукции во время посадки, выращивания, сбора урожая и хранения.
Пятью важнейшими принципами выращивания более безопасных фруктов и овощей являются:
- Соблюдение надлежащей личной гигиены.
- Защита полей от загрязнения фекалиями животных.
- Использование обработанных фекальных отходов.
- Оценка рисков, связанных с использованием ирригационной воды, и управление этими рисками.

- Содержание оборудования и помещений для сбора и хранения урожая в чистоте и сухости.
Деятельность ВОЗ
ВОЗ проводит научные оценки для контроля пищевых продуктов на присутствие STEC. Эти оценки служат основанием для международных стандартов на пищевые продукты, руководящих принципов и рекомендаций, разрабатываемых Комиссией Кодекс Алиментариус.
В отношении профилактики ВОЗ разработала глобальную стратегию для уменьшения бремени болезней пищевого происхождения. ВОЗ разработала информационное сообщение «Пять основных правил для обеспечения более безопасных пищевых продуктов». Эти пять правил и связанные с ними учебные пособия являются материалами для стран, которые легко использовать, воспроизводить и адаптировать к различным целевым аудиториям.
ВОЗ способствует укреплению систем безопасности пищевых продуктов путем продвижения надлежащей практики производства и просвещения розничных торговцев и потребителей в отношении надлежащего обращения с пищевыми продуктами и предотвращения их загрязнения.
Во время вспышек E. coli, таких как вспышки, имевшие место в Европе в 2011 году, ВОЗ осуществляет поддержку координации в области обмена информацией и сотрудничества с помощью Международных медико-санитарных правил и в рамках Международной сети органов по безопасности пищевых продуктов (ИНФОСАН) во все мире; ВОЗ осуществляет тесное сотрудничество с национальными органами здравоохранения и международными партнерами, обеспечение технической помощи и предоставление последней информации о вспышках болезни.
Гемолизирующая кишечная палочка у детей, симптомы у грудничков
В число патогенной микрофлоры, нарушающей полноценную работу желудочно-кишечного тракта (ЖКТ), относится представитель лактозонегативных энтеробактерий – гемолизирующая (гемолитическая) кишечная палочка. Даже ее небольшое количество может становиться причиной сильного расстройства кишечника.
Гемолизирующая кишечная палочка у детей появляется в результате погрешности в питании.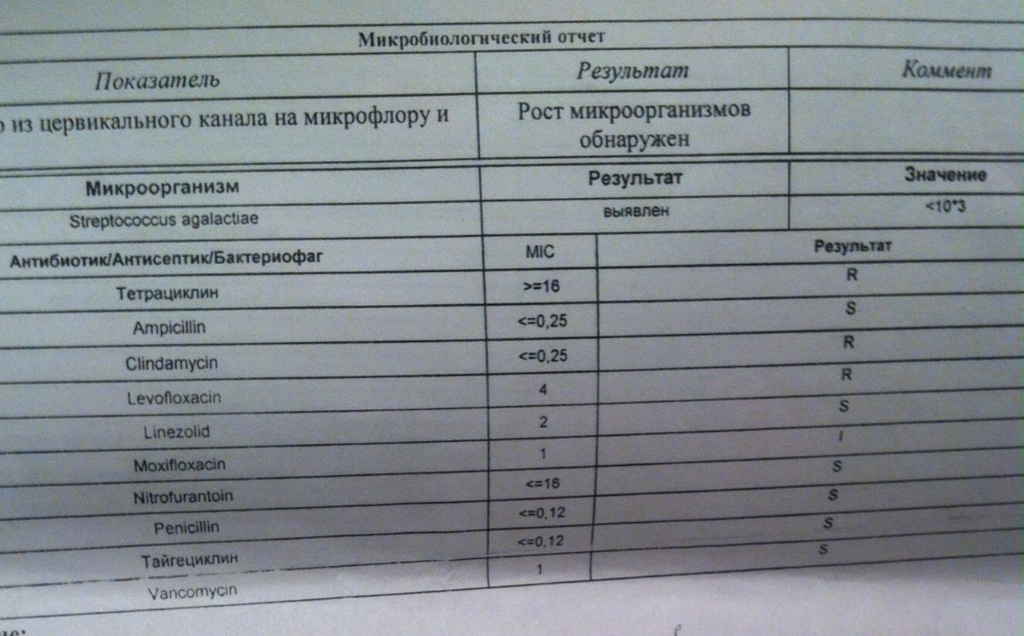 Причиной может выступать некачественная детская смесь, неправильное хранение молочных продуктов и т. д. Инфекция в детском возрасте может развиваться в результате снижения иммунной защиты.
Причиной может выступать некачественная детская смесь, неправильное хранение молочных продуктов и т. д. Инфекция в детском возрасте может развиваться в результате снижения иммунной защиты.
Симптомы
После проникновения в желудочно-кишечный тракт ребенка палочка начинает активно размножаться, что становится причиной нарушения баланса местной микрофлоры. Гемолизирующая кишечная палочка у грудничка и новорожденных малышей становится причиной развития дисбиоза.
Типичными признаками присутствия патогена в ЖКТ младенца становятся:
- регулярные кишечные колики – болевой синдром значительно усиливается после кормления;
- нарушение аппетита – ребенок отказывается принимать пищу;
- частое срыгивание – симптом обусловлен нарушением моторики кишечника;
- диарея – пенистый стул, содержащий слизистые включения, запах гнилостно-кислый;
- потеря веса;
- плохое общее самочувствие – малыш плохо спит, постоянно капризничает.
Особую опасность представляет обезвоживание организма. Признаками становятся: сухость кожи и слизистых поверхностей, появление не разглаживающихся кожных складок, нарушение мочеиспускания – ребенок писает реже 1 раз за 4 часа, плач без выделения слезной жидкости.
У детей более старшего возраста – от 1–1,5 лет – клиническая картина инфекции выглядит несколько иначе. Ее первоначальная симптоматика напоминает развитие гастроэнтерита. У ребенка появляется:
- боль в области эпигастрия схваткообразного или ноющего характера;
- приступы тошноты, иногда заканчивающиеся рвотой;
- тяжесть в желудке;
- понос;
- незначительное повышение температуры тела;
- головная боль, головокружение;
- нарушение аппетита;
- общая слабость, повышенная утомляемость;
- симптоматика обезвоживания.
В самом начале развития заболевание своими признаками напоминает гастроэнтерит
При тяжелом течении заболевания наблюдается побледнение кожного покрова вплоть до появления полноценного синего оттенка. Фиксируется замедление сердечного ритма и снижение показателей артериального давления.
Фиксируется замедление сердечного ритма и снижение показателей артериального давления.
Осложнения
Присутствие гемолитической кишечной палочки в организме ребенка может спровоцировать развитие гемолитико-уремического синдрома. Признаками выступают:
- стремительное повышение температуры тела;
- присутствие крови в составе каловых масс;
- воспаление толстого кишечника;
- побледнение кожи;
- наличие мелких кровоизлияний;
- тромбоз мелких сосудов – при тяжелом течении некротизирование;
- почечная недостаточность.
При оказании своевременной медицинской помощи состояние обратимое.
Диагностика
В качестве биологического материала используются каловые и рвотные массы, содержимое желудка после промывания. Они засеваются в чашку Петри. Для выращивания полноценной колонии требуется как минимум от 2 до 4 суток.
Лаборанты исследуют выделенные микроорганизмы и дают заключение. Одновременно с этим проводятся пробы на чувствительность патогенов к различным антибиотикам.
Если возникает необходимость в получении быстрого результата, то практикуется серологическая методика. У ребенка проводится забор венозной крови с последующим выделением антител к гемолитической кишечной палочке. Исследование имеет высокую диагностическую ценность. Дополнительно больному назначается общий анализ мочи, крови и кала.
Лечение инфекции
При составлении протокола лечения учитываются многие факторы. В частности: возраст ребенка, тяжесть заболевания, текущая симптоматика, ответ организма на медицинские препараты.
Схема терапии в каждом конкретном случае разрабатывается индивидуально с учетом текущей симптоматики
В целях подавления активности возбудителя назначается прием средств из группы антибиотиков. Часто используются лекарства из линейки фторхинолонов (Ципрофлоксацин, Гатифлоксацин, Левофлоксацин), отличающихся широким спектром действия и малым числом побочных эффектов. Синдром привыкания патогенов развивается медленно.
Синдром привыкания патогенов развивается медленно.
При легком течении заболевания ребенку рекомендована оральная регидратация. В течение дня он должен пить как можно больше жидкости. Это способствует восстановлению нарушенного водно-солевого баланса, а также компенсирует запасы потерянной организмом жидкости. Приобрести препараты можно в любой аптеке. Они выпускаются в виде порошка для приготовления водного раствора.
При тяжелом течении болезни используются солевые растворы для внутривенного введения. Инфузионная детоксикация проводится в условиях стационара и реализуется в целях выведения скопившихся в организме токсинов. Ребенок внутривенным способом (капельно) получает большой объем жидкости. Чаще всего используются растворы солей и глюкозы.
Симптоматическое лечение направлено на улучшение общего самочувствия. Больному могут назначаться:
- сорбенты – препараты, способствующие очищению ЖКТ;
- противодиарейные медикаменты – Иммодиум, Энтерофурил, Лоперамид и другие;
- спазмолитики – средства, устраняющие болевой синдром – Но-Шпа, Спазмалгон, Плантекс и т. д.;
- нестероидные противовоспалительные средства – необходимы для устранения воспалительного процесса – Ибупрофен, Индометацин, Кетопрофен и другие;
- эубиотики, пробиотики, пребиотики – препараты, восстанавливающие нарушенный дисбаланс микрофлоры – Лактовит, Бифидумбактерин, Линекс и т. д.;
- комплексы витаминов.
Начинается коррекция питания с 4 стола
В течение всего периода лечения ребенок должен придерживаться принципов диетического питания и соблюдать водный режим. В остром периоде (при сильном поносе) рекомендован стол №4, предусматривающий сокращение потребляемых жиров и углеводов, ограничение соли, частое дробное питание.
После улучшения состояния и стабилизации стула больного переводят на диету №2. Она обеспечивает выздоравливающий организм всеми необходимыми веществами.
Современная медицина шагнула далеко вперед и присутствие гемолизирующей кишечной палочки в организме ребенка значительной опасности для него не представляет. Вовремя начатая терапия позволяет избавиться от инфекции и исключает формирование каких-либо осложнений.
Вовремя начатая терапия позволяет избавиться от инфекции и исключает формирование каких-либо осложнений.
Гемолитические кишечные палочки и их опасность для человека
Когда в конце 19-го века немецкий бактериолог Теодор Эшерих открыл кишечную палочку, получившую впоследствии его имя — e coli гемолитические в кале у ребенка, вряд ли он догадывался, какой ящик Пандоры принесет она на землю. Грамотрицательная палочковидная бактерия — неприметная и даже полезная обитательница кишечной среды при условии, что ее количество в норме. Она играет не последнюю роль в здоровом функционировании ЖКТ, вырабатывая витамин В, жирные кислоты, участвуя в обмене веществ. Но если количество E. Coli (общепринятое сокращение) выходит за рамки обычного, человек обязательно почувствует недомогание. Диагноз – эшерихиоз, дискбактериоз или гемолитическая кишечная палочка. E. Coli вызывает не только недуги пищеварительного тракта, но и проблемы в половой и мочевыделительной системах. Самая опасная разновидность палочки Эшериха — гемолитическая кишечная палочка.Содержание:
Виды кишечной палочки
Норма E. Coli в организме
Виновники заболевания
Заболевания мочеполовой сферы, вызванные Escherichia coli
Гемолитико-уремический синдром
Симптомы
Лечение диареи
Лечение и его особенности в зависимости от локализации
Народные методы борьбы с кишечной инфекцией
Профилактика недугов
Виды кишечной палочкиРазновидностей эшерихии больше сотни, типы патогенных бактерий объединяют в 4 класса или вида:
Энтеротоксигенные. Прилипая к слизистой тонкой кишки, Escherichia coli вызывает на свет ядовитые вещества. Этот вид — причина поноса у грудничков.
Энтероинвазивные. Вызывают жидкую диарею с кровянистыми выделениями и боль в животе.
Энтеропатогенные. Этот вид характеризуется сильным поносом и жидким стулом, интенсивными болями в животе, подчас рвотой. Связанная с переменой климата «диарея путешественника» из этой серии.
Энтерогеморрагические. Наиболее опасны. Признаки – боли в животе схваткообразного характера, кровяная диарея, высокая температура. Заболевание такого рода длится почти декаду и чревато осложнениями – гемолитическим малокровием и нарушением функции почек. К виду энтерогеморрагических относится и гемолитическая кишечная палочка.
Вышеперечисленные виды обладают большой выносливостью, хорошо приспосабливаются к внешней среде. Пища, особенно молочные продукты – благоприятный климат для размножения бактерий.Довольно долго они могут обитать в земле, воде, фекальных массах. Но при кипячении и употреблении средств дезинфекции довольно быстро гибнут. Обеззараживание проводят при помощи формалина, хлорки, едкого натра и других средств. За несколько минут гибнут при попадании прямых солнечных лучей.Смотрим видео о том, что собой представляют кишечные палочки, почему возникают вспышки кишечных заболеваний:Норма E. Coli в организмеС рождения и до конца жизни в организме здорового человека Escherichia coli не должны превышать следующие нормы:
106—108 КОЕ/г в толстой кишке;
107—108 КОЕ/г в кале (из них 105 КОЕ/г лактозонегативные палочки и отсутствие гемолитических кишечных палочек).
Снижение до 105-106 КОЕ/г и повышение до 109-110 КОЕ/г – симптомы дисбактериоза.
Виновники заболеванияВспоминая детство, каждый помнит вечную установку мамы: «Мой руки перед едой», «Помой яблоко», «Не поднимай с пола». Эти советы дети обычно игнорируют, потому и попадают в группу риска в первую очередь.Не новы причины кишечных инфекций:
поедание плодов прямо с дерева или огорода;
игнорирование правил гигиены;
употребление некипяченого молока;
недостаточная термическая обработка мясных продуктов;
рукопожатие больного человека.
У взрослых эшерихия, в том числе гемолитическая, может появиться в результате иммунодефицита, на фоне ОРЗ, приема антибиотиков и др.Заболевания мочеполовой сферы, вызванные Escherichia coliЭшерихию нередко обнаруживают во время сдачи анализов у беременных.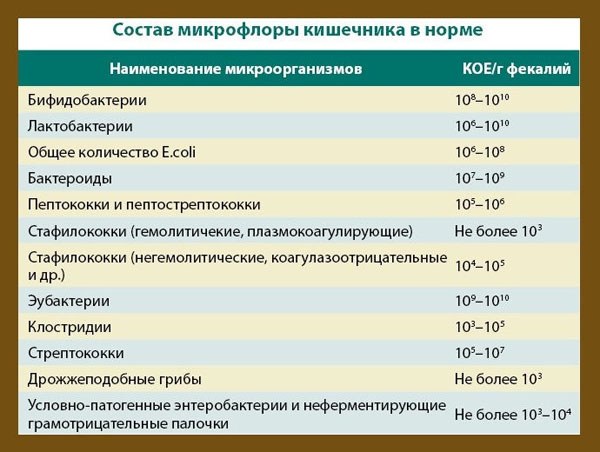 Присутствие кишечной палочки во влагалище – путь ко многим неприятным последствиям, это первый звонок о наличии воспаления в мочеполовой сфере. Инфицирование нередко происходит вследствие специфической половой жизни и несоблюдения гигиены.Кишечная палочка – виновница развития множества заболеваний половой и мочевыделительной систем:
Присутствие кишечной палочки во влагалище – путь ко многим неприятным последствиям, это первый звонок о наличии воспаления в мочеполовой сфере. Инфицирование нередко происходит вследствие специфической половой жизни и несоблюдения гигиены.Кишечная палочка – виновница развития множества заболеваний половой и мочевыделительной систем:
воспаление яичников у женщин;
хронический простатит у 8 из 10 мужчин;
цистит у лиц обеих полов;
пиелонефрит и многие другие.
Попадание эшерихии во влагалище лечить следует немедленно, последствия бывают слишком сложными, вплоть до бесплодия. Поэтому с профилактической целью мазок на Escherichia coli надо сдавать как минимум раз в год.
Присутствие палочки в моче называют бактериурией. Никаких симптомов нередко не имеет, тем не менее количество микробных тел в миллилитре мочи составляет 105 единиц. Если в моче параллельно обнаруживают лейкоциты, к тому же больной чувствует озноб, подташнивание, рвоту, боли в пояснице, это симптомы острого цистита или пиелонефрита.
Гемолитико-уремический синдромВ состоянии низкой сопротивляемости организма, наблюдающемся в большей степени у грудничков, женщин после родов, пожилых людей, гемолизирующая кишечная палочка может вызвать сбои микроциркуляции крови и стать причиной гемолитико-уремического синдрома. Признаки интоксикации при этой инфекции ярко выражены, начало заболевания – острое. Присутствие крови в испражнениях свидетельствует о развитии геморрагического колита. Токсины оказывают пагубное действие на тромбоциты, которые сначала активизируются, а потом склеиваются. При бледной коже становятся заметными кровоизлияния. В почечных канальцах и клубочках начинается ишемия, откладывается фибрин и возникают тромбы. Количество мочи становится все меньше, а потом и вовсе прекращается. Это признаки некрозов и развития почечной недостаточности.Вследствие повреждения эритроцитов токсинами гемолизирующей кишечной палочки развивается особый вид желтухи, кожа становится лимонного цвета. Восстановить функцию почек возможно при рациональных методах лечения, это удается в 75% случаев. В противном случае наступает летальный исход или хроническая почечная недостаточность. 3-7% заболевших гемолитико-уремическим синдромом не выживают.СимптомыНачальные признаки кишечной палочки большинству знакомы:
Восстановить функцию почек возможно при рациональных методах лечения, это удается в 75% случаев. В противном случае наступает летальный исход или хроническая почечная недостаточность. 3-7% заболевших гемолитико-уремическим синдромом не выживают.СимптомыНачальные признаки кишечной палочки большинству знакомы:
боль в животе (преимущественно острая)
диарея (понос)
возможно повышение температуры
подташнивание
Сколько продлится дискомфорт, вызванный гемолитической кишечной палочкой, зависит от ее штамма (классификация палочки подробно описана выше). Обычно заболевание проходит за 2-3 дня, не требуя особого лечения или обращения к врачу. В некоторых случаях лучше проконсультироваться со специалистом. Если через день-два диарея усилилась, появилась рвота, поднялась температура, больной чувствует слабость, обезвоживание, отсутствие аппетита, головокружение, рези в области живота, надо обязательно сдать анализ кала.Для детей такие симптомы могут быть смертельно опасны, поэтому вызывать врача следует не медля.Лечение диареиУдаление симптомов интоксикации — начало лечения гемолитической кишечной палочки. Экстренная терапия не требуется, поскольку за пару-тройку дней кишечник очистится природным путем. По симптомам лечащий врач должен определить – в процессе лечения надо уничтожить инфекцию или восстановить микрофлору и заселить ЖКТ нормальной палочкой. Но в обоих случаях необходимо остановить диарею. В эти дни врачи советуют придерживаться специального режима питания, ограничивая больного в еде, пить регидранты и сорбенты, отвар ромашки и коры дуба, чтобы не обезводить организм. Строго-настрого запрещено употреблять жирное, соленое, копченое, молоко и сырые овощи. Лучше включить в свой рацион кисель, чай, отварное мясо, рисовую кашу на воде, вместо хлеба сухари.Кисломолочные продукты (кефир, сметана, биойогурт) восстанавливают микрофлору. Об этом надо помнить при дисбактериозе. Активность защитной флоры ЖКТ помогут повысить отруби. Полезную простоквашу и биоквас, рецепты которых в достаточном количестве есть в Интернете, можно приготовить самому.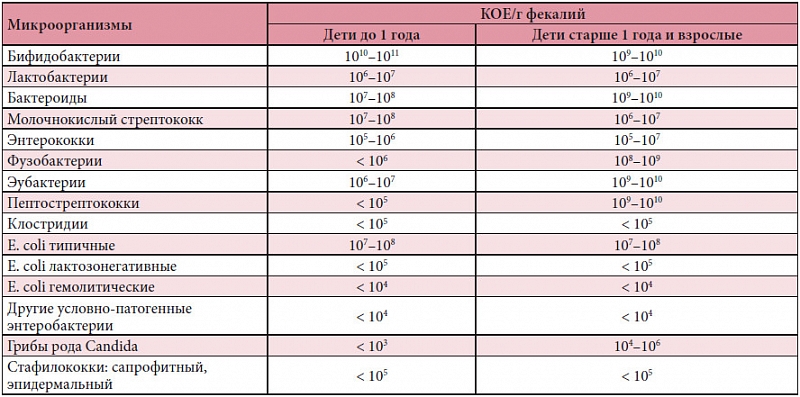 Не помешает сдать анализы, чтобы знать, какой именно штамм кишечной палочки вызвал заболевание. В зависимости от результата анализа, назначают антибиотики, но это делают в крайних случаях. После курса лечения анализы необходимо сдать повторно.Лечение в зависимости от локализацииКишечную палочку, обнаруженную в моче, называют бактериурией. При таком диагнозе назначают уросептики, антибиотики и БАДы. Препараты должны не только остановить развитие инфекции, но и укрепить иммунитет.Причина воспаления органов половой сферы (кольпит, вагинит) — кишечная палочка, обнаруженная во влагалище. В гинекологии эшерихию лечат небольшим курсом антибиотиков, отказавшись на это время от секса. Наружные половые органы омывают отваром ромашки, проводят спринцевания, ставят вагинальные свечи.Бывают случаи, когда кишечную палочку обнаруживают в зобе. Это длительная терапия комбинированием противогрибковых препаратов и антибиотиков. Дезинфицирующий эффект окажут ополаскиватели рта.Гемолитическую кишечную палочку у грудных младенцев лечат пробиотиками и пребиотиками. Цель лечения – стабилизация микрофлоры кишечника малыша. Кормящая мать при этом соблюдает строжайшую диету. Само по себе грудное вскармливание способствует наполнению кишечника крохи «хорошими» бактериями. Если ребенок на штучном вскармливании, выбирают смесь, насыщенную пребиотиками.Народные методы борьбы с кишечной инфекциейТрадиционную медицину в этом случае дополняют народные средства. Существует множество рецептов борьбы с кишечным недугом, сохранившихся от бабушек:
Не помешает сдать анализы, чтобы знать, какой именно штамм кишечной палочки вызвал заболевание. В зависимости от результата анализа, назначают антибиотики, но это делают в крайних случаях. После курса лечения анализы необходимо сдать повторно.Лечение в зависимости от локализацииКишечную палочку, обнаруженную в моче, называют бактериурией. При таком диагнозе назначают уросептики, антибиотики и БАДы. Препараты должны не только остановить развитие инфекции, но и укрепить иммунитет.Причина воспаления органов половой сферы (кольпит, вагинит) — кишечная палочка, обнаруженная во влагалище. В гинекологии эшерихию лечат небольшим курсом антибиотиков, отказавшись на это время от секса. Наружные половые органы омывают отваром ромашки, проводят спринцевания, ставят вагинальные свечи.Бывают случаи, когда кишечную палочку обнаруживают в зобе. Это длительная терапия комбинированием противогрибковых препаратов и антибиотиков. Дезинфицирующий эффект окажут ополаскиватели рта.Гемолитическую кишечную палочку у грудных младенцев лечат пробиотиками и пребиотиками. Цель лечения – стабилизация микрофлоры кишечника малыша. Кормящая мать при этом соблюдает строжайшую диету. Само по себе грудное вскармливание способствует наполнению кишечника крохи «хорошими» бактериями. Если ребенок на штучном вскармливании, выбирают смесь, насыщенную пребиотиками.Народные методы борьбы с кишечной инфекциейТрадиционную медицину в этом случае дополняют народные средства. Существует множество рецептов борьбы с кишечным недугом, сохранившихся от бабушек:
300 г земляной груши (топинамбура), нарезанных кубиками, опускают в разбавленное водой кипящее молоко в пропорции 50/50. Размягченный топинамбур вынуть, а в молоко добавить 20 г муки и 40 г масла и варить, пока не загустеет. Массой залить вынутый ранее топинамбур и добавить зелень. Своеобразный соус может служить дополнением к рису.
20 грамм лапчатки гусиной заварить в 250 миллилитрах кипятка. Подержать на пару 15 минут и оставить на ночь. Употреблять по 80 мл трижды в день.
Столовую ложку череды залить стаканом холодной кипяченой воды и держать на водяной бане четверть часа. Трижды в день отвар принимают по 20 мл.
Мать-и-мачеху, лекарственный донник и золототысячник в равных частях перемешать, чтобы в общей сложности получилось 20 грамм. Залить стаканом кипятка и настоять 15 минут. Пить раз в день от 20 до 50 мл.
Травы с противомикробным действием рекомендует и традиционная медицина. Кроме уже упомянутых мать-и-мачехи, череды и ромашки, рекомендуют настои корня аира, календулы и зверобоя. Отвары и кисели готовят из ягод шиповника, клюквы и черники. Закреплящий эффект при диарее оказывают кора дуба, семена конского щавеля. Полезны корочки граната, отваренные с изюмом. Убивает «плохие» палочки и восстанавливает микрофлору обыкновенный мед, многие даже не подозревают, каким целебным действием обладает этот продукт при лечении поноса и дисбактериоза.
Профилактика недуговИсходя из причин заболевания, выводы напрашиваются сами. Избежать заражения каким бы то ни было видом кишечной палочки помогут простые правила гигиены:
овощи и фрукты мыть перед употреблением и приготовлением
проводить достаточную тепловую обработку мясных продуктов
кипятить домашнее молоко
не употреблять воду из сомнительных источников
как можно чаще мыть руки с мылом.
Комментирование и размещение ссылок запрещено.
Все о кишечной палочке | Domestos
Причины передачи кишечной палочки, причины и каналы ее распространения, а также методы профилактики.
Кишечная палочка – это бактерия, которая может причинить вред вашему здоровью. Если вы узнаете о способах уничтожения и профилактики кишечной палочки, вы сможете снизить риск заражения и не допустить ее распространения.
Мы поможем вам разобраться с такими вопросами, как «кишечная палочка: причины», «как передается кишечная палочка?» и расскажем, каким образом Domestos может помочь убить вредоносные бактерии, живущие в вашем туалете, и предотвратить распространение заболевания. Давайте рассмотрим подробнее, что представляет собой эта бактерия.
Давайте рассмотрим подробнее, что представляет собой эта бактерия.
КИШЕЧНАЯ ПАЛОЧКА: СИМПТОМЫ
Кишечная палочка — это палочковидная бактерия, которая обитает в кишечнике человека и имеет множество разновидностей. Большинство из них — это безвредные микроорганизмы, но есть и такие, которые влекут за собой серьезные проблемы со здоровьем. Кишечная палочка возникает из-за несоблюдения гигиены и чистоты, поэтому использование хлоросодержащих моющих средств, таких как Domestos, необходимо.
Перед тем, как ответить на вопросы «откуда берется кишечная палочка?» и «как передается кишечная палочка?», нужно упомянуть симптомы, появляющиеся при заражении, такие как рвота, спазмы желудка и температура.
КИШЕЧНАЯ ПАЛОЧКА: ПРИЧИНЫ
Одним из первых шагов по профилактике кишечной палочки в вашем доме должен стать ответ на вопрос «как передается кишечная палочка?» Для этого существует несколько основных причин:
Зараженная еда:
Зараженные бактерии можно обнаружить в мясе крупного рогатого скота, включая говядину и баранину, так как бактерии кишечной палочки могут находиться в кишечнике животных. Кроме того, может быть заражена и фермерская продукция: зелень, фрукты и овощи.
Зараженная вода:
Подхватить кишечную палочку очень просто, выпив воды из зараженного источника.
Все описанные выше причины и являются ответом на вопрос «откуда возникает кишечная палочка?» А теперь перейдем к самому важному – профилактике кишечной палочки в вашем доме.
КИШЕЧНАЯ ПАЛОЧКА ПЕРЕДАЕТСЯ?
Присутствие безвредных разновидностей кишечной палочки является нормой для микрофлоры кишечника человека. Такие бактерии полезны для здоровья, так как препятствуют появлению других болезнетворных бактерий в кишечнике. Однако при нарушении работы пищеварительного тракта безвредная норма кишечной палочки может увеличиться и тогда необходима консультация доктора.
К сожалению, кишечная палочка заразна и тем самым еще более опасна. Кишечная палочка передается от человека к человеку воздушно-капельным и половым путем. Помимо прямого контакта с зараженным человеком, инфекция может передаваться путем употребления некачественной еды или загрязненной воды.
Кишечная палочка передается от человека к человеку воздушно-капельным и половым путем. Помимо прямого контакта с зараженным человеком, инфекция может передаваться путем употребления некачественной еды или загрязненной воды.
КИШЕЧНАЯ ПАЛОЧКА: ПРОФИЛАКТИКА С ПОМОЩЬЮ ЛИЧНОЙ ГИГИЕНЫ
Чтобы остановить распространение кишечной палочки, нужно обязательно мыть руки:
После обращения с животными
После любого контакта с зараженным человеком
Перед и после приготовления еды
После замены подгузников, грязной одежды или постельного белья
После использования туалета
После уборки
КИШЕЧНАЯ ПАЛОЧКА: ПРОФИЛАКТИКА ДОМА
Теперь перейдем к домашней уборке – важной части профилактики кишечной палочки. Следуйте этим простым советам, чтобы защитить свой дом:
Тщательно убирайте ванную комнату и туалет – пользуйтесь хлорсодержащими чистящими средствами при уборке раковин, сантехники и всех твердых поверхностей. Особое внимание стоит уделить туалету, так как он – один из основных источников распространения кишечной палочки. Использование Domestos поможет убить все вредоносные бактерии в вашем туалете и ванной. Такое чистящее средство сэкономит ваше время, а также позаботится о вашем здоровье. Однако, перед использованием любого нового средства, не забудьте его протестировать и внимательно читайте инструкцию.
Вытирайте все ручки в доме, чтобы не допустить распространения бактерий.
Протирайте стиральную машину после стирки грязной одежды и постельного белья.
Когда дело касается дезинфекции вашего дома, хлорсодержащие чистящие средства становятся основным способом поддержания гигиены. Многочисленные исследования не раз показывали эффективность геля Domestos, содержащего хлор, в уничтожении вредных бактерий и в борьбе по предотвращению кишечных инфекций.
Не стоит забывать и про использование туалетных блоков, которые помогут поддержать гигиеническую чистоту и предотвратить распространение бактерий. Туалетные блоки Domestos идеально встраиваются под ободок унитаза, плотно прилегая в самом критичном, с точки зрения грязи и микробов, месте.
Туалетные блоки Domestos идеально встраиваются под ободок унитаза, плотно прилегая в самом критичном, с точки зрения грязи и микробов, месте.
Максимальный эффект защиты вашего туалета может быть достигнут благодаря совместному использованию чистящего геля и туалетных блоков Domestos. Результат — чистый и опрятный туалет 24/7*!
*Защита от загрязнений (благоприятной среды для микробов) 24 часа в сутки, 7 дней в неделю при использовании согласно инструкции. По результатам инструментальных тестов Unilever, Италия, 2016
Частота выделения гемолизирующей кишечной палочки (E. coli Hly+) и ее влияние на бифидобактерии в анализах на дисбактериоз Текст научной статьи по специальности «Фундаментальная медицина»
2016, Т. 6, № 3
Материалы II Национального конгресса бактериологов
ЧАСТОТА ВЫДЕЛЕНИЯ ГЕМОЛИЗИРУЮЩЕЙ КИШЕЧНОЙ ПАЛОЧКИ (E. COLIHLY+) И ЕЕ ВЛИЯНИЕ НА БИФИДОБАКТЕРИИ В АНАЛИЗАХ НА ДИСБАКТЕРИОЗ
Е.В. Потап, Т.М. Кускова, А.А. Кутькина, О.Е. Суравицкая, Н.М. Сивкова, Г.В. Михайлова, О.В. Попова
Филиал ФБУЗ Центр гигиены и эпидемиологии в Ленинградской области в Ломоносовском районе
Введение. Пищеварительный тракт представляет собой одну из наиболее сложных экосистем. Микрофлора желудочно-кишечного тракта (ЖКТ) находится в постоянном динамическом равновесии с разнообразными факторами внешней среды, собственного организма и естественной резистентности.
Микрофлора кишечника является важнейшим звеном в системе защиты организма и сохранения гомеостаза, а также представляет собой высокочувствительную индикаторную систему, которая реагирует количественными и видовыми сдвигами на нарушения этого равновесия.
В толстом отделе кишечника содержится колоссальное количество микробов. В составе микрофлоры кишечника взрослых людей обнаружено более 260 видов микроорганизмов. Основную массу (96— 99%) составляют анаэробные бактерии (бифидобак-терии, бактероиды). На факультативно-анаэробную микрофлору, к которой относятся кишечная палочка, лактобациллы, энтерококки, приходится около 1—4% всей кишечной микрофлоры.
В составе микрофлоры кишечника взрослых людей обнаружено более 260 видов микроорганизмов. Основную массу (96— 99%) составляют анаэробные бактерии (бифидобак-терии, бактероиды). На факультативно-анаэробную микрофлору, к которой относятся кишечная палочка, лактобациллы, энтерококки, приходится около 1—4% всей кишечной микрофлоры.
Бифидобактерии — грамположительные палочки, строгие анаэробы, представители облигатной микрофлоры, присутствующие в кишечнике на протяжении всей жизни здорового человека, с высокой антагонистической активностью по отношению к патогенным микроорганизмам, препятствуют проникновению микробов в верхние отделы желудочно-кишечного тракта и другие внутренние органы, оказывают выраженное иммуностимулирующее действие на систему местного иммунитета кишечника.
Эшерихии — грамотрицательные подвижные палочки, условно-патогенные микроорганизмы, входящие в семейство Enterobactericae. Число кишечных палочек Escherichia coli среди других представителей микрофлоры кишечника не превышает 1%, но они играют важнейшую роль в функционировании желудочно-кишечного тракта. Кишечные палочки являются основными конкурентами условно-патогенной микрофлоры в отношении заселения ими кишечника. Кишечные палочки забирают из просвета кишечника кислород, который вреден для полезных для человека бифидо- и лактобактерий. Кишечные палочки вырабатывают ряд необходимых для человека витаминов: В1, В2, В3, В5, В6, В9, B12, К, участвуют в обмене холестерина, билирубина, холина, желчных и жирных кислот, оказывают влияние на всасывание железа и кальция.
Escherichia coli в кишечнике человека появляются в первые дни после рождения и сохраняются на протяжении жизни на уровне 106—108 КОЕ/г содержимого толстой кишки. В фекалиях здорового человека кишечные палочки (типичные) выявляются в количестве 107—108 КОЕ/г, при этом количество лактозоне-гативных кишечных палочек не должно превышать 105 КОЕ/г, а гемолитические кишечные палочки E. coli Hly+ должны отсутствовать. Гемолитические палочки способны вырабатывать токсины, действующие на нервную систему, могут вызывать аллергические
coli Hly+ должны отсутствовать. Гемолитические палочки способны вырабатывать токсины, действующие на нервную систему, могут вызывать аллергические
реакции. Кроме того, они провоцируют стойкие нарушения в пищеварительной системе, которые проявляются в виде запоров, чередующихся с диареей. усилением газообразования в кишечнике. При этом в каловых массах отмечаются примеси зеленоватого оттенка и большое количество слизи. Стоит заметить, что температура тела у человека не повышается или повышается незначительно.
Цель: определить частоту выявления гемолитической кишечной палочки в различных возрастных группах и выявить взаимосвязь между увеличением популяции гемолитической кишечной палочкой и снижением численности популяции бифидо-бактерий.
Материалы и методы. Объектом исследования явилась группа людей разных возрастных категорий с функциональными нарушениями желудочно-кишечного тракта (моторной и секреторной), состоящая из 334 человек. Были взяты 3 возрастные группы: дети до 1 года, дети от 1 года до 16 лет, взрослые.
Бактериологическое исследование качественного и количественного состава содержимого кишечника проводили по методикам Р.В. Эпштейн-Литвак и Ф.Л. Вильшанского в модификации Б.А. Ефимова, В.М. Коршунова и др. (1991, 2002).
Для выявления и подсчета бифидобактерий, лак-тобацилл, эшерихий, стафилококков, грибов рода Candida, клостридий использовали селективные питательные среды (тиогликолевую, Эндо, ЖСА, Сабуро, Вильсона—Блера, среда для лактобактерий). Грамположительные анаэробные стрептококки и би-фидобактерии изучали бактериоскопическим методом после культивирования на тиогликолевой среде. Для выделения патогенных и условно-патогенных микроорганизмов семейства Enterobacteriaceae использовали пластинчатые среды Левина, Эндо, Плоскирева, висмут-сульфитный агар, 5% кровяной агар. Все посевы инкубировали в термостате при 37°С в течение 24—48 ч. Через указанные сроки инкубирования проводили подсчет выросших колоний, выделение чистых культур и идентификацию. Для подсчета и выделения E. coli Hly+ использовали кровяной агар. Видовую диагностику условно-патогенных бактерий семейства Enterobacteriaceae, родов Klebsiella, Proteus, Enterobacter, Citrobacter, Morganella проводили классическим методом биохимического тестирования
Все посевы инкубировали в термостате при 37°С в течение 24—48 ч. Через указанные сроки инкубирования проводили подсчет выросших колоний, выделение чистых культур и идентификацию. Для подсчета и выделения E. coli Hly+ использовали кровяной агар. Видовую диагностику условно-патогенных бактерий семейства Enterobacteriaceae, родов Klebsiella, Proteus, Enterobacter, Citrobacter, Morganella проводили классическим методом биохимического тестирования
Результаты. В период 2011—2015 гг. проведено 334 исследований кала на дисбактериоз, из них 220 проб у детей до 16 лет и 114 проб от взрослых. Из общего числа обследованных 24,5% имели ге-молизирующую кишечную палочку. У детей E. coli Hly+ выделяется чаще, чем у взрослых (26,8% у детей и 20,1% у взрослых), а наиболее высокий процент выделения гемолизирующей кишечной палочки установлен у детей до года (33% у детей до 1 года, у детей от 1 года до 16 лет — 19,6%, от 16 лет и старше — 20,1%).
Помимо этого была прослежена взаимосвязь между увеличением количества гемолизирующей кишечной палочки и уменьшением числа бифидо-бактерий.
У лиц, у которых не выделялась гемолизирующая кишечная палочка, количество бифидобактерий 105 и менее встречалось в 11%.
Если процент выделения E. coli Hly+ от общего числа кишечной палочки составлял > 50%, то у 64% обследуемых количество бифидобактерий было 105 и менее.
Материалы II Национального конгресса бактериологов
Инфекция и иммунитет
При выделении E. coli Hly+ в диапазоне от 10% до 50%, количество бифидобактерий 105 и менее составляло 44%.
При выделении E. coli Hly+ < 10% количество бифидобактерий 105 и менее составляло 18%.
Выводы. В исследованиях на дисбактериоз штаммы гемолитической E. coli Hly+ чаще выделяются у детей, чем у взрослых, а наиболее высокий процент выделения гемолизирующей кишечной палочки у детей до года. Выявлена взаимосвязь между увеличением популяции гемолитической кишечной палочкой и снижением численности популяции бифидобактерий.
Возможности коррекции нарушений микробной колонизации кишечника у детей первого года жизни | Самсыгина Г.А., Буслаева Г.Н., Овечкина Н.В., Кац Т.Г., Никандрова Л.Я.
Для цитирования: Самсыгина Г.А., Буслаева Г.Н., Овечкина Н.В. и др. Возможности коррекции нарушений микробной колонизации кишечника
у детей первого года жизни. РМЖ. 2005;18:1215.
Под кишечным дисбактериозом подразумевают изменение кишечной микрофлоры, характеризующееся снижением общего количества типичной кишечной палочки, бифидобактерий и лактобактерий и появлением лактозонегативных эшерихий, гемолизирующих кишечных палочек, увеличением количества гнилостных, спороносных, гноеродных и других бактерий.
Нарушение микробной колонизации – частое состояние у новорожденных и детей первого года жизни. В детском возрасте склонность к более быстрому и легкому развитию кишечного дисбактериоза связана, прежде всего, с ферментативной, иммунной и двигательной незрелостью кишечника. Во–вторых, – с более частыми острыми инфекционными заболеваниями, особенно свойственными раннему детскому возрасту. При них желудочно–кишечный тракт, так или иначе, вовлекается в общий инфекционный процесс, а в лечении часто используются антибиотики. В третьих, в детском возрасте микроэкологическая система кишечника переживает период становления и адаптации к расширяющейся пищевой нагрузке. Это делает саму микроэкологическую систему нестабильной и особо уязвимой по отношению к воздействию неблагоприятных факторов.
Это делает саму микроэкологическую систему нестабильной и особо уязвимой по отношению к воздействию неблагоприятных факторов.
В то же время роль нормального биоценоза кишечника чрезвычайно велика и многообразна. Во–первых, в силу своих антагонистических по отношению к патогенным кишечным микроорганизмам свойствам, нормальная кишечная микрофлора является одним из основных факторов противоинфекционной защиты организма. Во–вторых, нормальная микрофлора способствует образованию короткоцепочечных жирных кислот, которые, являясь основными энергоносителями, обеспечивают нормальную трофику слизистой кишечника, снижают его проницаемость по отношению к различным антигенам. Ферменты нормальной микрофлоры участвуют в деконьюгации желчных кислот, преобразовании первичных желчных кислот во вторичные, большая часть из которых реабсорбируется, а меньшая определяет уровень гидратации кала и, соответственно, нормальный транзит каловых масс по кишечной трубке, и адекватный акт дефекации. Избыточное микробное обсеменение тонкой кишки, свойственное дисбактериозу, способствует преждевременной и избыточной деконъюгации желчных кислот и вызывает разжижение стула (секреторная диарея). С другой стороны, нарушение обмена желчных кислот при дефиците секреторного иммуноглобулина А, отмечаемого при нарушениях микрофлоры кишечника, и индигенной флоры может привести к нарушению функции печени.
Период становления кишечного биоценоза не ограничивается только неонатальным периодом жизни ребенка. У 85–90% детей он продолжается на протяжении всего первого года жизни, а у 10–15%, по–видимому, охватывает еще больший по продолжительности период жизни.
В связи с этим встает вопрос о целесообразности и необходимости коррекции микробиологических изменений, нередко обнаруживаемых при обследовании грудных детей. В настоящее время, когда медицинская практика располагает большим арсеналом препаратов и пищевых добавок с пробиотическим и пребиотическим действием, это далеко не праздный вопрос. Не секрет, что диагноз «дисбактериоз» является «расхожим» диагнозом, оправдывающим длительное, нередко малооправданное и малоэффективное назначение пробиотиков.
Нами изучена сравнительная клинико–лабораторная эффективность препаратов Линекс (пробиотик, содержащий лиофилизированные бактерии – Lactobacillus acidophilus, Bifidobacterium infantis v. liberorum, Streptococcus faecium), бифидумбактерин (пробиотик, содержащий только Bifidobacterium bifidum, а также лактозу), и хилак форте (пребиотик, содержащий продукты обмена Escherichia coli, Streptococcus faecalis, Lactobacillus acidophilus и Lactobacillushelvenicus, а также молочную кислоту).
В исследование были включены дети в возрасте до 1 года.
Критерии включения:
1. Учащение стула:
на естественном вскармливании:
для детей 1–х 6 месяцев жизни – более 6–8 раз в сутки,
для детей 6–12 месяцев жизни – более 4–6 раз в сутки,
на искусственном вскармливании:
для детей 1–х 6 месяцев жизни – более 4–6 раз в сутки,
для детей 6–12 месяцев жизни – более 2–4 раз в сутки;
2. Склонность к запорам:
на естественном вскармливании:
для детей 1–х 6 месяцев жизни – менее 1–2 раз в сутки,
для детей 6–12 месяцев жизни – менее 0–1 раз в сутки,
на искусственном вскармливании:
для детей 1–х 6 месяцев жизни – менее 0–1 раз в сутки,
для детей 6–12 месяцев жизни – 1 раз в 2–3 дня;
3. Диспептический характер стула: консистенция – жидкая, наличие непереваренных комочков, примесь слизи и зелени и др.
4. Сочетание нарушений стула со срыгиваниями и рвотой.
Во время проведения исследования не назначались антибиотики, бактериофаги, антимикотики и смеси, содержащие пробиотики.
Курс терапии составил 21 день. Препараты назначались 3 раза в день в дозировке: Линекс – по 1 капсуле, бифидумбактерин – по 5 доз, хилак форте – по 20 капель.
Всем детям проведено 3–х кратное микробиологическое исследование кала, копрологический анализ кала (до начала приема препарата, через 2 недели после начала приема препарата и через две недели после окончания приема препарата), а также анализ кала на углеводы (для исключения первичной лактазной недостаточности).
Критерии дисбактериоза соответствовали методическим рекомендациям по бактериологической диагностике дисбактериоза кишечника у детей:
I степень – количество бифидобактерий и лактобактерий в границах возрастной нормы, но количество аэробных микроорганизмов увеличено;
II степень – количество бифидобактерий и лактобактерий на нижней границе нормы, а количество аэробных микроорганизмов возрастает;
III степень – бифидо– и лактобактерии не выявляются в исследуемых разведениях, количество аэробных микроорганизмов в пределах нормы или увеличено;
IV степень – выраженные нарушения в соотношении анаэробных и аэробных микроорганизмов; бифидо– и лактобактерии не выявляются в исследуемых разведениях, количество аэробных микроорганизмов нарастает.
Полученные результаты
Все дети (30), которым был назначен Линекс, соответствовали критериям включения в исследование. Их возраст колебался от 19 дней до 10 месяцев. Из них около 1/4 находились на естественном вскармливании, 1/5 – на смешанном, а остальные – на искусственном вскармливании. Чуть меньше половины детей имели склонность к запорам. У остальных – учащенный стул или нормальный по частоте, но разжиженный, с примесью зелени и не переваренных комочков. Срыгивания с частотой более 4–5 раз отмечены лишь у 2–х пациентов, причем необильные, створоженным молоком. У остальных срыгивания также необильные, 1–3 раза в день. Аппетит снижен у 1/3 пациентов, у остальных – сохранен.
При бактериологическом исследовании нарушения микробиоценоза кишечника выявлены у всех. Из них у 27% – III степени, 27% – II степени и у 46% – I степени. Эти нарушения были обусловлены снижением менее 107 или полным отсутствием бифидобактерий у 28% обследованных, снижением лактобактерий ниже 106 вплоть до полного отсутствия – у 41%, снижением общего количества кишечной палочки ниже106 вплоть до полного отсутствия – у 27%, повышением содержания лактозонегативной кишечной палочки более 10% – у 18% и гемолизирующей кишечной палочки более 2% – у 59%, отсутствием энтерококков – у 45% и повышением их содержания более 107 – у 23%, повышением золотистого стафилококка более 103 – у 23%, других видов стафилококков более 106 – у 5%, повышением дрожжеподобных грибов более 104 – у 14%, пролиферацией протея более 103 – у 9%, Klebsiella pneumoniae более 10% – у 18%, Klebsiella oxytocae более 10% – у 5%, Citrobacter более 10% – у 5%.
При исследовании кала в этой группе пациентов было выявлено, что практически у всех определялись мыла, у большинства в небольшом количестве, а у 1/5 – в значительном. У 82% выявлено повышенное содержание слизи. У 1/3 определялись лейкоциты, преимущественно в тяжах слизи, в количестве от 3–5 до 15–20.
Содержание углеводов в кале было в пределах нормы лишь у 30%, у остальных отмечалось повышение от 0,3% до 0,95%. Части пациентов в связи с этим проводилась терапия лактазой.
Через 2 недели после начала терапии зарегистрировано улучшение в клинической картине. У половины пациентов с нарушением частоты стула отмечена тенденция к нормализации: при первоначальном учащении – урежение, а при урежении – учащение, хотя консистенция кала сохранялась измененной. Примерно у 1/3 уменьшилось содержание патологических примесей (не переваренные комочки, слизь) в кале.
При исследовании биоценоза выявлено следующее: увеличилось в 11/2 раза количество пациентов с дисбактериозом I степени. При этом возросло число детей с нормальной концентраций бифидобактерий, лактобактерий, энтерококков. Одновременно несколько снизилась общее количество кишечной палочки при значительном уменьшении лактозонегативной E. coli. Снизилось содержание Klebsiella pneumoniae и Citrobacter, при пролиферации золотистого стафилококка.
Через 2 недели после окончания лечения клиническое улучшение отмечено практически у всех детей. Аппетит полностью нормализовался, срыгивания сохранялись лишь у 3–х детей, необильные, 2–3 раза в день, прибавка в весе достаточная. При первоначально учащенном стуле нормализация частоты произошла у всех, кроме 1–го пациента, у которого в возрасте 7 месяцев стул был 5 раз на смешанном вскармливании. При первоначальной склонности к запорам более чем у половины отмечено учащение или стул стал регулярным. У большинства больных с первоначально разжиженным стулом или склонностью к запорам консистенция нормализовалась, цвет стал желтым, исчезли патологические примеси в виде зелени и непереваренных комочков.
При копрологическом исследовании мыла определялись в меньшем количестве, содержание слизи также уменьшилось, содержание лейкоцитов уменьшилось у всех до 1–10, кроме одного ребенка, у которого отмечено нарастание с 3–5 до 5–10 при отсутствии ухудшения стула и снижении содержания бифидобактерий с 109 до 107.
Исследование биоценоза показало, что полная нормализация биоценоза отмечена у 30% детей. При оценке содержания отдельных микроорганизмов выявлены нормальные концентрации: бифидобактерий – у 65% пациентов, лактобактерий – у 70%, общее количество E.coli – у 75%. Допустимое содержание Klebsiella pneumonia обнаружено у 85%, Klebsiella oxytocae и Citrobacter отсутствовали.
Все дети (30), которым был назначен бифидумбактерин, соответствовали критериям включения в исследование. Их возраст колебался от 3 недель до 10 месяцев. Из них около 3/4 находились на естественном вскармливании, 1/5 – на искусственном вскармливании. Учащенный стул или нормальный по частоте, но разжиженный, с примесью зелени и не переваренных комочков отмечался у 70% пациентов, у остальных – склонность к запорам. Срыгивания с частотой более 4–5 раз отмечены у 30% пациентов, причем необильные, створоженным молоком. У остальных срыгивания также были необильные, 1–3 раза в день. Аппетит снижен примерно у 1/4 пациентов, у остальных – сохранен.
При бактериологическом исследовании нарушения микробиоценоза кишечника выявлены у всех. Из них у 54% – III степени, 15% – II степени и у 31% – I степени. Эти нарушения были обусловлены снижением менее 107 или полным отсутствием бифидобактерий у 54% обследованных, снижением лактобактерий ниже 106 вплоть до полного отсутствия – у 31%, повышением гемолизирующей кишечной палочки до 100% – у 46% (при нормальном общем количестве E. coli), отсутствием энтерококков – у 16% или их избыточной пролиферацией до 109 – у 15, повышением золотистого стафилококка более 103 – у 15%, повышением дрожжеподобных грибов более 104 – у 23%, пролиферацией протея более 103 – у 15%, Klebsiella pneumoniae более 10% – у 23%.
При исследовании кала в этой группе пациентов было выявлено, что практически у всех определялись мыла, но в небольшом количестве. У 69% выявлено повышенное содержание слизи. Более чем у 1/3 детей определялись лейкоциты, преимущественно в тяжах слизи, в количестве от 3–5 до 10–12, у одного – сплошь.
Содержание углеводов в кале было в пределах нормы у 46%, у остальных отмечалось повышение от 0,4% до 0,8%. Части пациентов в связи с этим проводилась заместительная терапия лактазой. У 4 больных с лактазной недостаточностью в связи с ухудшением стула на фоне терапии бифидумбактерином препарат был заменен на Линекс.
Через 2 недели после начала терапии в клинической картине отмечено, что частота стула при изначально учащенном практически не изменилась, а при изначальной склонности к запорам выявлялось учащение на 1 раз в сутки, хотя консистенция кала и содержание патологических примесей (не переваренные комочки, слизь) сохранялись.
При исследовании биоценоза выявлено следующее: уменьшилось до 11% количество пациентов с дисбактериозом III степени и у одного ребенка с биоценоз полностью нормализовался. При этом возросло число детей с нормальной концентраций бифидобактерий, лактобактерий. У 11% пациентов отмечено увеличение общего количества Е.coli до 109. Отмечена тенденция к снижению содержания лактозонегативной и гемолитической кишечной палочки, дрожжеподобных грибов, при пролиферации золотистого стафилококка и протея.
Через 2 недели после окончания лечения клиническое улучшение отмечено практически у всех детей. Аппетит полностью нормализовался, но срыгивания сохранялись у 1/3 детей, необильные, 2–3 раза в день, прибавка в весе достаточная. При первоначально учащенном стуле нормализация частоты произошла у всех, кроме одного пациента. При первоначальной склонности к запорам примерно у половины отмечено учащение стула. У большинства больных с первоначально разжиженным стулом или склонностью к запорам консистенция нормализовалась, цвет стал желтым, но у 4–х пациентов оставалась примесь зелени и не переваренных комочков.
При копрологическом исследовании мыла и слизь определялись в меньшем количестве, количество лейкоцитов уменьшилось, но полностью не нормализовалось. У 2–х детей отмечалось нарастание количества лейкоцитов до 15–20 при отсутствии клинической картины и высоком содержании бифидобактерий – 109.
Исследование биоценоза показало, что биоценоз нормализовался у 33% обследованных детей. Выявлены нормальные концентрации бифидобактерий – у 92% пациентов, лактобактерий – у 84%, общего количества E.coli – у 92% при пролиферации лактозонегативной и гемолизирующей кишечной палочки, золотистого стафилококка, протея, Klebsiella pneumoniae и Citrobacter.
Все дети, которым был назначен хилак форте (30), соответствовали критериям включения в исследование. Их возраст колебался от 5 до 11 месяцев. Из них около половины находилось на смешанном, а половина – на искусственном вскармливании. Нормальный по частоте, но разжиженный, с примесью зелени и не переваренных комочков стул отмечался у 1/2 пациентов, у остальных – склонность к запорам. Срыгивания с частотой до 1–2 раз отмечены у 30% пациентов, необильные, створоженным молоком. Аппетит был снижен примерно у 40% пациентов, у остальных – сохранен.
При бактериологическом исследовании нарушения микробиоценоза кишечника выявлены у всех. Из них у 45% – II степени и у 55% – I степени, III степень не выявлена ни у одного ребенка. Бифидобактерии у всех определялись в нормальной концентрации. Эти нарушения были обусловлены снижением лактобактерий ниже 106 вплоть до полного отсутствия – у 50%, снижением общего количества кишечной палочки – у 33% при повышении гемолизирующей кишечной палочки у 17%, снижением и отсутствием энтерококков – у 34% и их пролиферацией до 108–9 – у 33%, повышением золотистого стафилококка более 103 – у 50%, повышением дрожжеподобных грибов более 104 – у 50%, пролиферацией протея более 103 – у 33%, Klebsiella pneumoniae более 10% – у 17% и Klebsiella oxytocae – у 17%.
При исследовании кала этой группы было выявлено, что у 60% пациентов определялись мыла, но в небольшом количестве.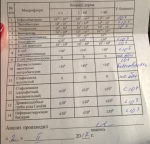 У 40% выявлено небольшое повышенное содержание слизи. Лейкоциты определялись у 1/6 детей, преимущественно в тяжах слизи, в количестве не более 6–8.
У 40% выявлено небольшое повышенное содержание слизи. Лейкоциты определялись у 1/6 детей, преимущественно в тяжах слизи, в количестве не более 6–8.
Содержание углеводов в кале было в пределах нормы практически у всех, за исключением нескольких детей, у которых отмечалось незначительное повышение до 0,3%.
Через 2 недели после начала терапии в клинической картине отмечено, что частота и консистенция стула практически не изменилась, хотя патологические примеси (не переваренные комочки, слизь) ни у кого не определялись.
При исследовании биоценоза выявлено следующее: у 27% биоценоз нормализовался полностью, у остальных отмечалась I степень дисбактериоза.
Содержание лактобактерий и золотистого стафилококка нормализовалось у всех. Оставалась пониженной концентрация кишечной палочки и энтерококков (17%). У 1/5 пациентов сохранялась пролиферация гемолизирующей E.coli, дрожжеподобных грибов, протея.
Через 2 недели после окончания лечения аппетит нормализовался у 80% детей. При первоначальной склонности к запорам учащение стула отмечено не у всех. У большинства больных консистенция и цвет кала нормализовалась, стал желтым, примеси не определялись.
При копрологическом исследовании мыла и слизь определялись в меньшем количестве, лейкоцитов не найдены.
Исследование биоценоза показало, биоценоз нормализовался у 40% обследованных детей. Выявлены нормальные концентрации бифидобактерий – у 100% пациентов, лактобактерий – у 100%, общего количества E.coli – у 60% при пролиферации гемолизирующей E.coli, энтерококков, золотистых стафилококков, дрожжеподобных грибов и Enterobacter aerogenes.
При сравнении эффективности препаратов Линекс и хилак форте в одинаковых возрастных группировках получены сходные результаты. При терапии Линексом нормализация биоценоза зарегистрирована у 37% детей.
Обсуждение полученных результатов
Назначение препарата Линекс сопровождалось клиническим улучшением ко 2 неделе приема препарата. Клиническое улучшение сопровождалось уменьшением выраженности изменений в копрологическом исследовании кала и отклонений в биоценозе фекалий. Характерна отчетливая тенденция к возрастанию количества бифидо– и лактобактерий, снижению количества кишечной палочки за счет штаммов с измененной ферментативной активностью (лактозонегативных, гемолизирующих штаммов) и увеличению степени колонизации энтерококками. Имелась тенденция к исчезновению или уменьшению степени колонизации грамнегативными бактериями семейства кишечных, такими как некоторые штаммы клебсиеллы, цитробактер. Наряду с этим нельзя не отметить, что сохранялась и даже несколько усиливалась колонизация фекалий золотистым стафилококком и грибами рода Кандида.
Характерна отчетливая тенденция к возрастанию количества бифидо– и лактобактерий, снижению количества кишечной палочки за счет штаммов с измененной ферментативной активностью (лактозонегативных, гемолизирующих штаммов) и увеличению степени колонизации энтерококками. Имелась тенденция к исчезновению или уменьшению степени колонизации грамнегативными бактериями семейства кишечных, такими как некоторые штаммы клебсиеллы, цитробактер. Наряду с этим нельзя не отметить, что сохранялась и даже несколько усиливалась колонизация фекалий золотистым стафилококком и грибами рода Кандида.
Полученный клинический эффект сохранялся в течение 2 недель после отмены терапии. Однако количественная характеристика микробиоценоза фекалий к 4–5 недели наблюдения демонстрировала тенденцию к восстановлению, но в меньшей степени, выявленных до начала терапии изменений микробиоценоза. При этом достоверно сохранялось нормальное количество лактобактерий, нормальной кишечной палочки и несколько возрастало количество энтерококков. Таким образом, полученные данные свидетельствовали о том, что после отмены препарата его протективный эффект сохранялся еще в течение 2 недель.
Использование препарата бифидумбактерин в терапии нарушений микробиоценоза у детей первого года жизни дает не однозначный результат. Поскольку препарат в своем составе содержит лактозу, а нарушения микробиоценоза у детей этого возраста часто сопровождаются вторичной лактазной недостаточностью, то в ряде случаев его назначение даже усугубляет клинические проявления ферментативной недостаточности и требует его отмены. Возможно этим же обусловлены более частые находки в копрологии по окончании курса терапии. В то же время нельзя не отметить, что назначение бифидумбактерина сопровождается отчетливым увеличением степени колонизации фекалий бифидобактериями, лактобактериями и тенденцией к снижению количества кишечной палочки с измененными свойствами. В то же время мы не отметили существенного возрастания количества энтерококков, не было выявлено подавляющего влияния препарата на рост стафилококков и условно–патогенных энтеробактерий. Более того, после окончания терапии у ряда пациентов появлялись новые для них виды условно–патогенной микрофлоры. Приведенные данные свидетельствуют о довольно ограниченном влиянии препарата на нормализации микробиоценоза у детей первого года жизни и клинический результат.
Более того, после окончания терапии у ряда пациентов появлялись новые для них виды условно–патогенной микрофлоры. Приведенные данные свидетельствуют о довольно ограниченном влиянии препарата на нормализации микробиоценоза у детей первого года жизни и клинический результат.
Результаты проведенного исследования свидетельствуют о положительном влиянии препарата хилак форте. К сожалению, полученные данные мало сопоставимы, т.к. 1) дети, получавшие препарат, в основном относятся к возрасту второго полугодия жизни, 2) в этой группе пациентов не было выявлено дисбактериоза III степени и 3) у всех обследованных отсутствовало снижение колонизационной резистентности, обусловленной снижением уровня бифидобактерий, представители транзиторной условно патогенной микрофлоры кишечника присутствовали в значительно меньшем количестве.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Гемолитико-уремический синдром (ГУС) — Симптомы и причины
Обзор
Гемолитико-уремический синдром (ГУС) — это состояние, которое может возникать при повреждении и воспалении мелких кровеносных сосудов в почках. Это повреждение может вызвать образование тромбов в сосудах. Сгустки закупоривают фильтрующую систему в почках и приводят к почечной недостаточности, что может быть опасно для жизни.
Любой может развить HUS , но чаще всего он встречается у маленьких детей.Во многих случаях HUS вызывается инфекцией определенными штаммами бактерий Escherichia coli (E. coli). Первым признаком этой формы HUS является диарея в течение нескольких дней, часто, но не всегда с кровью.
HUS также может быть вызван другими инфекциями, некоторыми лекарствами или состояниями, такими как беременность, рак или аутоиммунное заболевание. В некоторых случаях HUS является результатом определенных генетических мутаций. Эти формы HUS обычно не вызывают диарею..
HUS — состояние тяжелое. Но своевременное и соответствующее лечение обычно приводит к полному выздоровлению большинства людей, особенно маленьких детей.
Продукты и услуги
Показать больше товаров от Mayo ClinicСимптомы
Признаки и симптомы HUS могут различаться в зависимости от причины. Большинство случаев HUS вызвано инфицированием определенными штаммами E.coli, которые сначала поражают пищеварительный тракт. Первоначальные признаки и симптомы этой формы HUS могут включать:
- Диарея, часто с кровью
- Боль в животе, спазмы или вздутие живота
- Рвота
- Лихорадка
Все формы HUS — независимо от причины — повреждают кровеносные сосуды. Это повреждение вызывает разрушение эритроцитов (анемия), образование тромбов в кровеносных сосудах и повреждение почек.Признаки и симптомы этих изменений включают:
- Бледное окрашивание, включая потерю розового цвета на щеках и внутренней части нижних век
- Экстремальная усталость
- Одышка
- Легкие синяки или синяки необъяснимого характера
- Необычное кровотечение, такое как кровотечение из носа и рта
- Уменьшение мочеиспускания или кровь в моче
- Отек (отек) ног, ступней или щиколоток, реже лица, рук, ступней или всего тела
- спутанность сознания, судороги или инсульт
- Высокое кровяное давление
Когда обращаться к врачу
Немедленно обратитесь к врачу, если вы или ваш ребенок испытываете кровавую диарею или диарею в течение нескольких дней, за которой следует:
- Снижение диуреза
- Набухание
- Синяки необъяснимого происхождения
- Необычное кровотечение
- Экстремальная усталость
Обратитесь за неотложной помощью, если вы или ваш ребенок не мочитесь в течение 12 часов или более.
Причины
Наиболее частой причиной HUS — особенно у детей младше 5 лет — является инфицирование определенными штаммами бактерий E. coli. E. coli относится к группе бактерий, обычно обнаруживаемых в кишечнике здоровых людей и животных. Большинство из сотен типов кишечной палочки нормальны и безвредны. Но некоторые штаммы кишечной палочки вызывают диарею.
Некоторые штаммы кишечной палочки, вызывающие диарею, также производят токсин, называемый токсином шига.Эти штаммы называются E.coli, продуцирующей токсин Shiga, или STEC. Когда вы инфицированы штаммом STEC , токсин шига может попасть в ваш кровоток и вызвать повреждение кровеносных сосудов, что может привести к HUS . Но у большинства людей, инфицированных кишечной палочкой, даже более опасными штаммами, не развивается HUS .
Другие причины HUS могут включать:
- Другие инфекции, такие как инфицирование пневмококковыми бактериями, вирусом иммунодефицита человека (ВИЧ) или гриппом
- Использование определенных лекарств, особенно некоторых лекарств, используемых для лечения рака, и некоторых лекарств, используемых для подавления иммунной системы реципиентов трансплантата органов
- Редко HUS может возникать как осложнение беременности или состояния здоровья, такого как аутоиммунное заболевание или рак
Необычный тип HUS , известный как атипичный HUS , может передаваться детям генетически.Люди, унаследовавшие мутировавший ген, вызывающий эту форму HUS , не обязательно заболеют этим заболеванием. Но мутировавший ген может быть активирован после воздействия триггера, такого как инфекция, использование определенных лекарств или хроническое заболевание.
Но мутировавший ген может быть активирован после воздействия триггера, такого как инфекция, использование определенных лекарств или хроническое заболевание.
Факторы риска
Большинство случаев HUS вызвано инфицированием определенными штаммами бактерий E. coli. Контакт с кишечной палочкой может произойти, если вы:
- Есть зараженное мясо или производить
- Плавать в бассейнах или озерах, загрязненных фекалиями
- Тесно контактируйте с инфицированным человеком, например, в семье или в детском саду.
Риск развития HUS самый высокий для:
- Дети до 5 лет
- Взрослые 65 лет и старше
- Люди с ослабленной иммунной системой
- Люди с определенными генетическими изменениями, делающими их более восприимчивыми к HUS
Осложнения
HUS может вызвать опасные для жизни осложнения, в том числе:
- Почечная недостаточность, которая может быть внезапной (острой) или развиваться с течением времени (хронической)
- Высокое кровяное давление
- Инсульт или судороги
- Кома
- Проблемы со свертыванием, которые могут привести к кровотечению
- Проблемы с сердцем
- Проблемы с пищеварительным трактом, например проблемы с кишечником, желчным пузырем или поджелудочной железой
Профилактика
Мясо или продукты, зараженные E.coli не обязательно будет плохо выглядеть, чувствовать или пахнуть. Для защиты от инфекции E. coli и других болезней пищевого происхождения:
- Избегайте непастеризованного молока, сока и сидра.
- Тщательно мойте руки перед едой, после посещения туалета и смены подгузников.

- Часто очищайте посуду и пищевые поверхности.
- Готовьте мясо до внутренней температуры не менее 160 градусов по Фаренгейту.
- Размораживание мяса в микроволновой печи или холодильнике.
- Храните сырые продукты отдельно от готовых к употреблению продуктов.Не кладите приготовленное мясо на тарелки, ранее загрязненные сырым мясом.
- Храните мясо под продуктами в холодильнике, чтобы снизить риск попадания жидкостей, например крови, на продукты.
- Избегайте нечистых мест для купания. Не плавайте, если у вас понос.
(PDF) Встречаемость и характеристика токсигенных Bacillus cereus в пище и фекалиях младенцев
Escherichia coli O157 и B.cereus может не сообщаться, а
обычно, если посев кала был отрицательным на искомые
патогенов, то о случае диареи можно было сообщить как
«неизвестной этиологии» и / или «вирусной инфекции». В этом исследовании нам удалось впервые выделить B. cereus
из
образцов стула младенца. Мы предположили, что эти случаи детской диареи
были вызваны употреблением молочной смеси
, зараженной B. cereus, особенно то, что мы обнаружили токсигенные
B.cereus в этих продуктах, доступных на рынке. Распространенность
штаммов B. cereus, продуцирующих энтеротоксин и рвотный токсин
, в образцах стула больных диареей широко сообщается
[18,28,29]
.
В данном исследовании психротолерантные изоляты B. cereus
не были выделены из всех типов образцов.
может свидетельствовать об отсутствии B. cereus, продуцирующего рвотный токсин, а
согласуется с выводами Samapundo et al.
[8]
, что частота
психротолерантных B. cereus (рост при 7
C) в целом низкая.
Мы исследовали все изоляты B. cereus, выделенные в этом исследовании, на
их чувствительность к антимикробным препаратам. Все изоляты были устойчивы к
Все изоляты были устойчивы к
пенициллину G, в то время как чувствительны к ванкомицину, клиндамицину,
эритромицину, гентамицину и оксациллину. Наши результаты подтверждают общую картину чувствительности B.cereus
и подтверждают устойчивость к пенициллину G и чувствительность к клиндамицину
, ванкомицину и эритромицину
[30]
.
Всего 16 Bacillus-подобных изолятов были выделены из
различных образцов, но не были подтверждены как B. cereus
биохимическими тестами и ПЦР. Мы идентифицировали эти изоляты с помощью секвенирования рДНК 16S
и выявили, что B. licheniformis были более распространены на
, чем другие виды Bacillus, и были обнаружены в сыром
рисе, сыром молоке, образцах детских фекалий и детских молочных смесях.
B. licheniformis были извлечены из сырого и детского молока
порошка и причастны к случаям пищевого отравления
[31,32]
.
B. licheniformis проявляют патогенные свойства
и могут представлять опасность для здоровья
[33,34]
.
В заключение, присутствие токсигенных штаммов B. cereus в
рисе, сыром молоке и смесях для детского молока в Саудовской Аравии и
Египте указывает на возможный высокий риск инфекций пищевого происхождения, который может возникнуть в результате употребления
эти продукты.
Это было подтверждено выделением штаммов B. cereus из
образцов фекалий младенцев и детей в возрасте до трех лет
, в которых эти случаи были диагностированы как «этиол-
неустановленного происхождения». Результаты этого исследования подтверждают важность
, включая B. cereus, в программах контроля и профилактики заболеваний,
, а также в рутинных клинических лабораториях и лабораториях контроля качества пищевых продуктов
как в Саудовской Аравии, так и в Египте.Результат этого исследования
очень актуален для других стран Ближнего Востока и других
развивающихся стран, где данные о встречаемости токсигенных
B. cereus в пищевых продуктах и случаях диареи немногочисленны и трудны для получения
cereus в пищевых продуктах и случаях диареи немногочисленны и трудны для получения
, где Пищевое равновесие B. cereus недооценивается. Насколько известно авторам
, это первый отчет о
случаев заражения токсигенными B. cereus с пищевыми продуктами и фекалиями как в Саудовской Аравии
, так и в Египте.
Конфликт интересов
Мы заявляем, что у нас нет конфликта интересов.
Благодарности
Авторы выражают благодарность г-ну
Мохаммеду С. Альзахрани и г-ну Халеду Гази за техническую
помощь в приготовлении сред и реагентов, г-ну Аджелю М.
Аль-Рабаи и Г-ну Амеру К. Аль-Раби за помощь в отборе сырых молочных продуктов
и первичной изоляции бактерий,
и г-нуХаледу А. Сираджу за помощь в предоставлении образцов стула
пл и приготовлении сред и реагентов.
Ссылки
[1] Карлин Ф., Бриллард Дж., Бруссолл В., Клавель Т., Дюпор С., Джобин М.,
и др. Адаптация Bacillus cereus, повсеместно распространенного во всем мире патогена пищевого происхождения, к изменяющейся окружающей среде.
Food Res Int 2010; 43: 1885-94.
[2] Ceuppens S, Boon N, Uyttendaele M. Разнообразие штаммов группы Bacillus ce-
reus отражается в их широком спектре патогенных возбудителей и разнообразном экологическом образе жизни.FEMS Microbiol Ecol
2013; 84: 433-50.
[3] Эглезос С., Хуанг Б., Дайкс Г.А., Феган Н. Распространенность и концентрация
Bacillus cereus в розничных пищевых продуктах в Брисбене,
Австралия. Foodborne Pathog Dis 2010; 7: 867-70.
[4] Fangio MF, Roura SI, Fritz R. Выделение и идентификация Ba-
cillus spp. и родственные роды из разных крахмалистых продуктов. J Food
Sci 2010; 75: M218-21.
[5] Алтаяр М., Сазерленд AD.Bacillus cereus обычен в среде
, но изоляты, продуцирующие рвотный токсин, встречаются редко. J Appl
Microbiol 2006; 100: 7-14.
[6] Анколекар С. , Рахмати Т., Лабб
, Рахмати Т., Лабб
и РГ. Обнаружение токсигенных спор Ba-
cillus cereus и Bacillus thuringiensis в рисе США. Int J
Food Microbiol 2009; 128: 460-6.
[7] Чанг Х.Дж., Ли Дж.Х., Хан Б.Р., Квак Т.К., Ким Дж. Распространенность
уровней Bacillus cereus в блюдах из жареного риса и его экспозиция
Оценкаиз ресторанов в китайском стиле.Food Sci Biotechnol
2011; 20: 1351-9.
[8] Samapundo S, Heyndrickx M, Xhaferi R, Devlieghere F. Inci-
характеристики, разнообразие и характеристики токсинных генов штаммов группы Bacillus cereus
, выделенных из пищевых продуктов, продаваемых в Бельгии. Int
J Food Microbiol 2011; 150: 34-41.
[9] Fern´
andez-No IC, Guarddon M, B¨
ohme K, Ceppeda A, Calo-
mata P, Barros-Vel´
azquez J. Обнаружение и количественное определение порчи
и патогенные Bacillus cereus, Bacillus subtilis и
Bacillus licheniformis с помощью ПЦР в реальном времени.Food Microbiol 2011;
28: 605-10.
[10] Stenfors Arnesen LP, Fagerlund A, Granum PE. Из почвы в кишечник:
Bacillus cereus и ее токсины пищевого отравления. FEMS Microbiol Rev
2008; 32: 579-606.
[11] Нижний EJ. Bacillus cereus, летучий патоген для человека. Clin
Microbiol Rev 2010; 23: 382-98.
[12] Беннетт С.Д., Уолш К.А., Гулд Н.А. Вспышки болезней пищевого происхождения
, вызванные Bacillus cereus, Clostridium perfringens и Staphy-
lococcus aureus — США, 1998-2008 гг.Clin Infect Dis 2013;
57: 425-33.
[13] Министерство здравоохранения. Статистический ежегодник. Эр-Рияд: Министерство здравоохранения
; 2012.
[14] Рахими Э., Абдос Ф., Момтаз Х., Багбадорани З. Т., Джалали М. Ба-
cillus cereus в детском питании: исследование распространенности и распространение
энтеротоксигенных факторов вирулентности в Исфахане. Prov Iran Sci World J
2013; 2013: 1-5.
[15] Banyk´
o J, Vylet
elov´
a M.Определение источника Bacillus cereus
и Bacillus licheniformis, выделенных из сырого молока, пастеризованного молока
и йогурта. Lett Appl Microbiol 2009; 48: 318-23.
[16] Таллент С.М., Родхамел Э.Дж., Хармон С.М., Беннетт Р.В. Bacillus
cereus. В кн .: Руководство по бактериологическому анализу. США: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США
; 2012. [Онлайн] Доступно по адресу: http: // www.
fda.gov/Food/FoodScienceResearch/LaboratoryMethods/
ucm070875.htm [Доступно 20 февраля 2013 г.]
[17] Чжоу Г., Чжэн Д., Доу Л., Цай Ц., Юань З. Встречаемость психотолерантных штаммов группы Bacillus cereus в мороженом. Int J Food
Microbiol 2010; 28: 143-6.
[18] Банерджи М., Наир Г.Б., Рамамурти Т. Фенотипическая и генетическая
характеристика Bacillus cereus, выделенная у
пациентов с острой диареей. Индийский журнал J Med Res 2011; 133: 88-95.
Самир Рушди Органджи и др. / Asia Pac J Trop Biomed 2015; 5 (7): 515–520 519
Клиническая картина детской инфекции, вызванной Escherichia Coli: история, физика, причины
Nataro JP.Кишечная палочка. Лонг С., Пикеринг Л.К., Пробер К.Г. (редакторы). Принципы и практика детских инфекционных болезней . 3-е издание. Орландо, Флорида: Черчилль Ливингстон; 2008.
Диарея, вызванная Escherichia coli. Пикеринг LK, Бейкер CJ, Overturf GD, Prober CG (редакторы). Отчет Комитета по инфекционным заболеваниям Американской академии педиатров. Красная книга . 2008. 291-6.
Центры по контролю и профилактике заболеваний.Предварительные данные FoodNet о заболеваемости патогенами, обычно передаваемыми через пищу — 10 штатов, 2007 г. MMWR Morb Mortal Wkly Rep . 2008 г. 11 апреля. 57 (14): 366-70. [Медлайн].
2008 г. 11 апреля. 57 (14): 366-70. [Медлайн].
ВОЗ. Энтеротоксигенная кишечная палочка. Всемирная организация здоровья. Доступно по адресу http://www.who.int/vaccine_research/diseases/e_e_coli/en/. Дата обращения: 01.10.2008.
Гупта С.К., Кек Дж., Рам ПК, Крамп Дж. А., Миллер М.А., Минц ЭД. Часть III. Анализ пробелов в данных, касающихся энтеротоксигенных инфекций, вызванных Escherichia coli, в странах с низким и средним индексом человеческого развития, 1984-2005 гг. Эпидемиологическая инфекция . 2008 июнь 136 (6): 721-38. [Медлайн].
Qadri F, Svennerholm AM, Faruque AS и др. Энтеротоксигенная кишечная палочка в развивающихся странах: эпидемиология, микробиология, клинические особенности, лечение и профилактика. Clin Microbiol Ред. . 2005 июля 18 (3): 465-83. [Медлайн].
Bolin I, Wiklund G, Qadri F, et al. Энтеротоксигенная кишечная палочка с генотипами STh и STp связана с диареей как у детей в эндемичных районах, так и у путешественников. Дж. Клин Микробиол . 2006 ноябрь 44 (11): 3872-7. [Медлайн].
Rockabrand DM, Shaheen HI, Khalil SB и др. Энтеротоксигенные типы факторов колонизации кишечной палочки, собранные с 1997 по 2001 год у военнослужащих США во время операции «Яркая звезда» в северном Египте. Диагностика микробиологических инфекций . 2006 май. 55 (1): 9-12. [Медлайн].
Yolbas I, Tekin R, Kelekci S, Tekin A, Okur MH, Ece A, et al. Внебольничные инфекции мочевыводящих путей у детей: возбудители, чувствительность к антибиотикам и сезонные изменения. Eur Rev Med Pharmacol Sci . 2013 Апрель 17 (7): 971-6. [Медлайн].
webmd.com»> Canizalez-Roman A, Gonzalez-Nuñez E, Vidal JE, Flores-Villaseñor H, León-Sicairos N. Профили распространенности и антибиотикорезистентности диарейных штаммов Escherichia coli, выделенных из пищевых продуктов на северо-западе Мексики. Int J Food Microbiol . 2013 27 марта. 164 (1): 36-45. [Медлайн].
Buchholz U, Bernard H, Werber D, et al. Немецкая вспышка Escherichia coli O104: h5, связанная с проростками. N Engl J Med . 2011 26 октября. [Medline].
Франк С., Вербер Д., Крамер Дж. П. и др. Эпидемический профиль вспышки Escherichia coli O104: h5, продуцирующей шига-токсин, в Германии. N Engl J Med . 22 июня 2011 г. [Medline].
Центры по контролю и профилактике заболеваний. Escherichia coli O157: инфекция H7, связанная с употреблением сырого молока — Вашингтон и Орегон, ноябрь-декабрь 2005 г. MMWR Morb Mortal Wkly Rep .2007 марта 2. 56 (8): 165-7. [Медлайн].
Россит А.Р., де Алмейда М.Т., Ногейра Калифорния и др. Бактериальные, дрожжевые, паразитарные и вирусные энтеропатогены у ВИЧ-инфицированных детей из штата Сан-Паулу, юго-восток Бразилии. Диагностика микробиологических инфекций . 2007 Январь 57 (1): 59-66. [Медлайн].
Gassama A, Sow PS, Fall F, et al. Обычные и условно-патогенные энтеропатогены, ассоциированные с диареей у взрослых сенегальцев, в связи с серостатусом вируса иммунодефицита человека. Int J Infect Dis . 2001. 5 (4): 192-8. [Медлайн].
Hien BT, Scheutz F, Cam PD и др. Диарейные штаммы Escherichia coli и Shigella, выделенные у детей в ходе исследования методом случай-контроль в больнице в Ханое, Вьетнам. Дж. Клин Микробиол .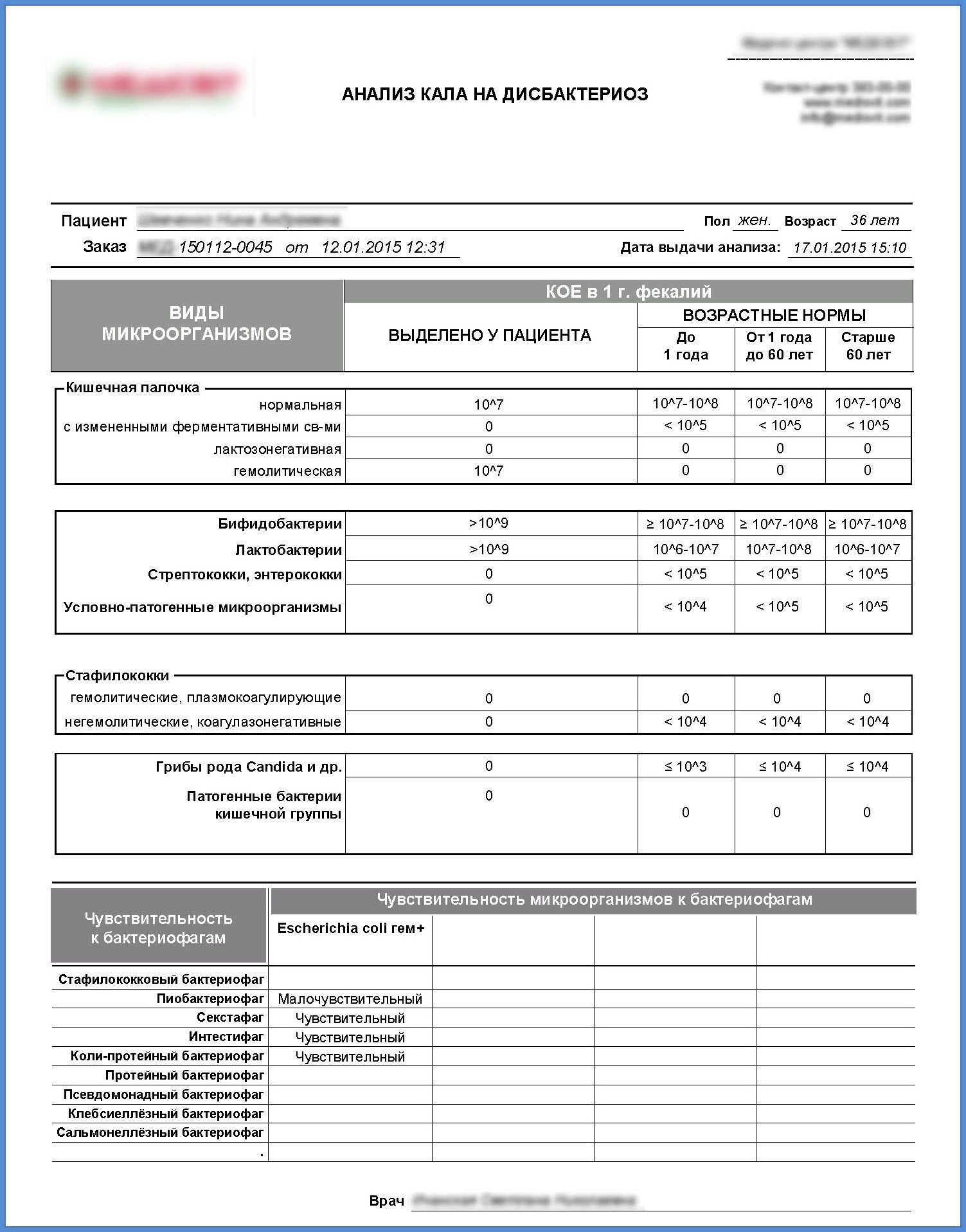 2008 г., 46 (3): 996-1004. [Медлайн].
2008 г., 46 (3): 996-1004. [Медлайн].
Аль-Галлас Н., Бахри О., Буратбин А. и др. Этиология острой диареи у детей и взрослых в Тунисе, Тунис, с акцентом на диареи, вызывающую кишечную палочку: распространенность, фенотипирование и молекулярная эпидемиология. Ам Дж. Троп Мед Хиг . 2007 Сентябрь 77 (3): 571-82. [Медлайн].
Ким MJ, Ким С.А., Кан Ю.С., Хван И.Г., Ри МС. Микробное разнообразие и распространенность патогенов пищевого происхождения в дешевой и нездоровой пище, потребляемой детьми младшего школьного возраста. Lett Appl Microbiol . 2013 г., 1 апреля [Medline].
Центры по контролю и профилактике заболеваний. Escherichia coli 0157: инфекции H7 у детей, связанные с сырым молоком и сырым молозивом коров — Калифорния, 2006. MMWR Morb Mortal Wkly Rep . 13 июня 2008 г. 57 (23): 625-8. [Медлайн].
Центры по контролю и профилактике заболеваний. Продолжающаяся многоуровневая вспышка инфекции Escherichia coli серотипа O157: H7, связанная с потреблением свежего шпината — США, сентябрь 2006 г. MMWR Morb Mortal Wkly Rep . 2006 29 сентября. 55 (38): 1045-6. [Медлайн].
Диарейная кишечная палочка. Центры по контролю и профилактике заболеваний.Доступно по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/diarrecoli_t.htm. Доступ: 1 октября 2008 г.
Serna A 4th, Boedeker EC. Патогенез и лечение инфекций Escherichia coli, продуцирующих токсин Shiga. Curr Opin Gastroenterol . 2008 24 января (1): 38-47. [Медлайн].
Zhang W, Bielaszewska M, Pulz M, et al. Новый иммуно-ПЦР-анализ для обнаружения низких концентраций шига-токсина 2 и его вариантов.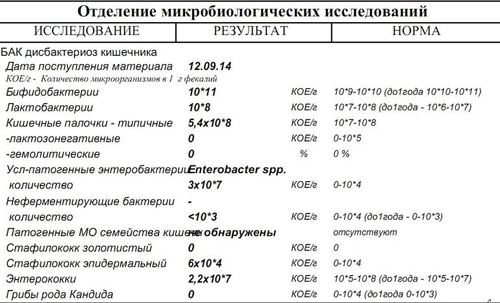 Дж. Клин Микробиол .2008 апр. 46 (4): 1292-7. [Медлайн].
Дж. Клин Микробиол .2008 апр. 46 (4): 1292-7. [Медлайн].
Beutin L, Steinruck H, Krause G, et al. Сравнительная оценка иммуноферментного анализа Ridascreen Verotoxin для обнаружения шигатоксин-продуцирующих штаммов Escherichia coli (STEC) из пищевых и других источников. J Appl Microbiol . 2007 марта 102 (3): 630-9. [Медлайн].
Лотигиус А., Янзон А., Бегум И. и др. Энтеротоксигенная кишечная палочка обнаруживается в пробах воды из эндемичного района с помощью ПЦР в реальном времени. J Appl Microbiol . 2008 апр. 104 (4): 1128-36. [Медлайн].
Морган Дж., Белл М., Сэдлер Массачусетс. КТ острого колита, связанного с кишечной палочкой. Emerg Radiol . 2007 июля. 14 (3): 187-9. [Медлайн].
Клигман Р. М., Берман Р. Э., Дженсон Х. Б. и др. Патофизиология жидкостей организма и инфузионная терапия. Учебник педиатрии Нельсона, 18-е изд. Elsevier Health Sciences, . 2007. Ch. 55.1.
Фор К.Роль противодиарейных препаратов как дополнительных средств лечения острой диареи у детей. Международный Педиатр . 2013. 2013: 612403. [Медлайн]. [Полный текст].
Wong CS, Jelacic S, Habeeb RL и др. Риск гемолитико-уремического синдрома после лечения антибиотиками инфекций, вызванных Escherichia coli O157: H7. N Engl J Med . 2000, 29 июня. 342 (26): 1930-6. [Медлайн].
Scheiring J, Andreoli SP, Zimmerhackl LB. Лечение и исходы гемолитико-уремического синдрома, ассоциированного с шига-токсином. Педиатр Нефрол . 2008 23 октября (10): 1749-60. [Медлайн].
Safdar N, Said A, Gangnon RE, Maki DG. Риск гемолитико-уремического синдрома после лечения антибиотиками энтерита, вызванного Escherichia coli O157: H7: метаанализ. JAMA . 2002, 28 августа. 288 (8): 996-1001. [Медлайн].
Ake JA, Jelacic S, Ciol MA, et al. Относительная нефропротекция при инфекциях Escherichia coli O157: H7: связь с увеличением объема внутривенного введения. Педиатрия . 2005 июн 115 (6): e673-80. [Медлайн].
Anjay MA, Anoop P, Britland A. Лейкоцитоз как предиктор прогрессирования гемолитико-уремического синдрома при инфекции Escherichia coli O157: H7. Арч Дис Детский . 2007 сентябрь 92 (9): 820-3. [Медлайн].
Джойши М., Джаухари П., Мэтью А.А. и др. Можем ли мы предсказать развитие гемолитико-уремического синдрома на ранней стадии инфекции Escherichia coli O157 ?. Арч Дис Детский . 2008 Февраль 93 (2): 180-1. [Медлайн].
Grisaru S, Xie J, Samuel S, Hartling L, Tarr PI, Schnadower D и др. Связь между статусом гидратации, внутривенным введением жидкости и результатами пациентов, инфицированных Escherichia coli, продуцирующей токсин шига: систематический обзор и метаанализ. Педиатр JAMA . 2017 г. 1. 171 (1): 68-76. [Медлайн].
Сапс М., Пенсабене Л., Ди Мартино Л. и др.Постинфекционные функциональные расстройства ЖКТ у детей. Дж. Педиатр . 2008 июн. 152 (6): 812-6, 816.e1. [Медлайн].
Frech SA, Dupont HL, Bourgeois AL, et al. Использование пластыря, содержащего термолабильный токсин из Escherichia coli, против диареи путешественников: рандомизированное двойное слепое плацебо-контролируемое полевое испытание фазы II. Ланцет . 2008, 14 июня. 371 (9629): 2019-25. [Медлайн].
Glenn GM, Villar CP, Flyer DC, et al.Безопасность и иммуногенность энтеротоксигенного пластыря вакцины против Escherichia coli, содержащего термолабильный токсин: использование предварительной обработки кожи для разрушения рогового слоя. Заражение иммунной . 2007 май. 75 (5): 2163-70. [Медлайн].
Ахмед А., Ли Дж., Шилоач И. и др. Безопасность и иммуногенность конъюгированной вакцины с О-специфическим полисахаридом против Escherichia coli O157 у детей 2-5 лет. J Заражение вирусом . 2006 15 февраля. 193 (4): 515-21. [Медлайн].
Амиева МР.Важные бактериальные патогены желудочно-кишечного тракта у детей: перспективы патогенеза. Детская клиника North Am . 2005 июн. 52 (3): 749-77, vi. [Медлайн].
Блэколл Д.П., Маркес МБ. Еще раз о гемолитико-уремическом синдроме: токсин шига, фактор H и образование фибрина. Ам Дж. Клин Патол . 2004 июн 121 Дополнение: S81-8. [Медлайн].
Дэвид Р.Д., DeBlieux PM, Press R. Рациональное лечение антибиотиками амбулаторных мочеполовых инфекций в изменяющейся среде. Am J Med . 2005 июл.118 Дополнение 7А: 7С-13С. [Медлайн].
Расследование множественной вспышки инфекции E. coli O157: H7: Обновлено 18 июля 2008 г. Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/ecoli/june2008outbreak/. Доступ: 30 сентября 2008 г.
Li F, Zhao C, Zhang W и др. Использование анализа амплификации ветвления для обнаружения Escherichia coli O157: H7 и других штаммов, продуцирующих токсин E. coli Shiga. Дж. Клин Микробиол . 2005 декабрь 43 (12): 6086-90. [Медлайн]. [Полный текст].
Mehnert-Kay SA. Диагностика и лечение неосложненных инфекций мочевыводящих путей. Врач Фам . 2005 августа 1. 72 (3): 451-6. [Медлайн].
Столл Б.Дж., Хансен Н. Инфекции у младенцев с очень низкой массой тела: исследования Сети исследований новорожденных NICHD. Семин Перинатол . 2003 27 августа (4): 293-301. [Медлайн].
Tarr PI, Gordon CA, Chandler WL.Escherichia coli, продуцирующая шига-токсин, и гемолитико-уремический синдром. Ланцет . 2005 19-25 марта. 365 (9464): 1073-86. [Медлайн].
Видал М., Крюгер Э., Дюран С. и др. Одноместный мультиплексный ПЦР-анализ для одновременного выявления шести категорий диареи, вызывающих кишечную палочку, связанных с кишечными инфекциями. Дж. Клин Микробиол . 2005 Октябрь 43 (10): 5362-5. [Медлайн]. [Полный текст].
Йейтс Дж. Диарея путешественника. Врач Фам .2005 г. 1. 71 (11): 2095-100. [Медлайн].
Yada N, Fujioka M, Bennett CL, Inoki K, Miki T, Watanabe A и др. STEC: O111-HUS, осложненный острой энцефалопатией, у молодой девушки успешно лечился с помощью набора гемодиафильтрации, стероидного пульса и растворимого тромбомодулина в условиях плазмафереза. Clin Case Rep . 2015 апр. 3 (4): 208-12. [Медлайн]. [Полный текст].
Таканаши Дж., Танейчи Х., Мисаки Т., Яхата Й, Окумура А., Исида Й и др.Клинические и радиологические особенности энцефалопатии во время вспышки E coli O111 в 2011 г. в Японии. Неврология . 2014 18 февраля. 82 (7): 564-72. [Медлайн].
Pape L, Hartmann H, Bange FC, Suerbaum S, Bueltmann E, Ahlenstiel-Grunow T. Экулизумаб при типичном гемолитико-уремическом синдроме (HUS) с неврологическим вовлечением. Медицина (Балтимор) . 2015 июн.94 (24): e1000. [Медлайн].
Dinh A, Anathasayanan A, Rubin LM. Безопасное и эффективное использование экулизумаба в лечении тяжелого гемолитико-уремического синдрома, связанного с токсином шига, вызванным Escherichia coli. Am J Health Syst Pharm . 2015 15 января. 72 (2): 117-20. [Медлайн].
Delmas Y, Vendrely B, Clouzeau B, Bachir H, Bui HN, Lacraz A, et al. Вспышка гемолитико-уремического синдрома Escherichia coli O104: h5 во Франции: исход лечения экулизумабом. Циферблат нефрола . 2014 29 марта (3): 565-72. [Медлайн]. [Полный текст].
Культура стула | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
Девкота, Б.(Обновлено 16 января 2014 г.). Культура стула. Спасательные препараты и болезни. [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/2107038-overview. Доступно 02.08.16.
Гуандалини С. и Фрай Р. (обновлено 19 августа 2015 г.). Понос. Наркотики и болезни, помогающие избежать болезней [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/928598-overview. Доступно 02.08.16.
Lehrer, J. (Обновлено 15 мая 2014 г.). Фекальный посев. Медицинская энциклопедия MedlinePlus [Он-лайн информация].Доступно в Интернете по адресу https://www.nlm.nih.gov/medlineplus/ency/article/003758.htm. Доступно 02.08.16.
Dowshen, S. (сентябрь 2014 г., обзор). Анализ стула: культура бактерий. KidsHealth от Nemours [Он-лайн информация]. Доступно в Интернете по адресу http://kidshealth.org/parent/system/medical/test_bac_culture.html. Доступно 02.08.16.
(обновлено в январе 2016 г.). Понос. ARUP Консультации [Он-лайн информация]. Доступно в Интернете по адресу https://live.arupconsult.com/node/1961/?tab=tab_item-3.Доступно 02.08.16.
ПерсоналMLO. (2013 17 августа). Молекулярная революция в диагностическом тестировании ЖКТ. MLO [Он-лайн информация]. Доступно в Интернете по адресу http://www.mlo-online.com/molecular-revolution-entering-gi-diagnostic-testing.php. Доступно 02.08.16.
Ролек, К. и др. (3 декабря 2014 г.). Группа экспертов по патогенам желудочно-кишечного тракта. Небраска Медицина [Он-лайн информация]. Доступно в Интернете по адресу http://www.nebraskamed.com/app_files/pdf/careers/education-programs/asp/gi-panel-guidance-12-3-14.pdf. Доступно 02.08.16.
Stein A, et al. Диарея, вызванная химиотерапией: патофизиология, частота и лечение на основе рекомендаций. Тер Адв Мед Онкол . 2010 Янв; 2 (1): 51–63. Доступно в Интернете по адресу http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3126005/. По состоянию на март 2016 г.
Симпозиум, Связь медицинской ассоциации и Двадцать седьмой ежегодный конгресс Общества медсестер онкологов. Управление симптомами диареи, вызванной химиотерапией: мультидисциплинарный подход.Доступно в Интернете по адресу http://www.cmecorner.com/macmcm/ons/ons2002_05.htm. По состоянию на март 2016 г.
Коселке Э., Крафт С. Диарея, вызванная химиотерапией: варианты лечения и профилактики. J журнал гематологии, онкологии и фармации; Декабрь 2012 г. Том 2, № 4. Доступно на сайте http://jhoponline.com/jhop-issue-archive/2012-issues/de December-2012-vol-3-no-4/15408-chemotherapy-unduced-diarrhea- опции. По состоянию на март 2016 г.
Источники, использованные в предыдущих обзорах
Томас, Клейтон Л., Редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (2001). Справочник по диагностическим и лабораторным испытаниям Мосби, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
(6 марта 2003 г.). Диарейная кишечная палочка. CDC, Отдел бактериальных и микотических заболеваний, информация о болезнях [онлайн-информация]. Доступно в Интернете по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/diarrecoli_t.htm.
(6 сентября 2002 г.). Campylobacter инфекции. CDC, Отдел бактериальных и микотических заболеваний, информация о болезнях [онлайн-информация]. Доступно в Интернете по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/campylobacter_g.htm.
(3 июля 2003 г., обновлено). Escherichia coli O157: H7. CDC, Отдел бактериальных и микотических заболеваний, информация о болезнях [онлайн-информация]. Доступно в Интернете по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/escherichiacoli_g.htm.
(8 марта 2001 г.).Escherichia coli O157: H7, Техническая информация. CDC, Отдел бактериальных и микотических заболеваний, информация о болезнях [онлайн-информация]. Доступно в Интернете по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/escherichiacoli_t.htm.
(7 марта 2003 г.). Salmonella Enteritidis. CDC, Отдел бактериальных и микотических заболеваний, информация о болезнях [онлайн-информация]. Доступно в Интернете по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/salment_g.htm.
(9 июня 2003 г.). Сальмонеллез. CDC, Отдел бактериальных и микотических заболеваний, информация о болезнях [онлайн-информация].Доступно в Интернете по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/salmonellosis_g.htm.
(7 марта 2003 г.). Шигеллез. CDC, Отдел бактериальных и микотических заболеваний, информация о болезнях [онлайн-информация]. Доступно в Интернете по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/shigellosis_g.htm.
(20 июня 2001 г.). Брюшной тиф. CDC, Отдел бактериальных и микотических заболеваний, информация о болезнях [онлайн-информация]. Доступно в Интернете по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/typhoidfever_g.htm.
(апрель 2000 г.). E. Coli инфекция. AAFP, familydoctor.org, Раздаточный материал [он-лайн информация]. Доступно в Интернете по адресу http://familydoctor.org/handouts/242.html.
Граха, П. (22 декабря 2002 г.). Campylobacter Enteritis. Медицинская информация MedlinePlus, Медицинская энциклопедия [он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000224.htm.
Котт, К. (20 февраля 2002 г.). Энтерит, вызванный кишечной палочкой. Медицинская информация MedlinePlus, Медицинская энциклопедия [он-лайн информация].Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000296.htm.
Коттон, К. (8 января 2002 г.). Фекальный посев. Медицинская информация MedlinePlus, Медицинская энциклопедия [он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003758.htm.
Коттон, К. (3 августа 2001 г.). Сальмонеллезный энтероколит. Медицинская информация MedlinePlus, Медицинская энциклопедия [он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000294.htm.
Парсонс, К. (31 июля 2002 г.). Шигеллезный энтерит. Медицинская информация MedlinePlus, Медицинская энциклопедия [он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000295.htm.
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (© 2007). Справочник по диагностическим и лабораторным испытаниям Мосби, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. Стр. 887.
Ву, А. (2006). Клиническое руководство по лабораторным исследованиям Тиц, четвертое издание. Сондерс Эльзевир, ул.Луис, штат Миссури. С. 1607-1610.
Лентнек А. (обновлено 12 ноября 2007 г.). Фекальная культура. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Дата обращения: 30.01.08. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003758.htm.
(январь 2011 г.). Понос. Национальный информационный центр по заболеваниям пищеварительной системы [он-лайн информация]. Доступно в Интернете по адресу http://digestive.niddk.nih.gov/ddiseases/pubs/diarrhea/. По состоянию на май 2011 г.
Гуандалини, С.(Обновлено 8 апреля 2010 г.). Понос. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/928598-overview. По состоянию на май 2011 г.
Vorvick, L. et. al. (Обновлено 4 мая 2010 г.). Фекальный посев. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003758.htm. По состоянию на май 2011 г.
Фишер, М. (обновлено в апреле 2011 г.). Диарея, оценка бактерий. ARUP Консультации [Он-лайн информация].Доступно в Интернете по адресу http://www.arupconsult.com/Topics/BacterialDiarrhea.html?client_ID=LTD. По состоянию на май 2011 г.
(© 1995–2011). Код единицы 50005: Культура кишечных патогенов, стул. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/50005. По состоянию на май 2011 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2011). Справочник Мосби по диагностическим и лабораторным испытаниям, 10-е издание: Mosby, Inc., Сент-Луис, Миссури. Стр. 911-912.
Forbes BA, Sahm DF, Weissfeld AS. Диагностическая микробиология Бейли и Скотта, 12-е издание: Мосби Эльзевьер, Сент-Луис, Миссури; 2007, С. 873-883.
границ | Enterococcus faecalis, выделенный из детских фекалий, подавляет токсигенные Clostridioides (Clostridium) difficile
Введение
Clostridioides (Clostridium) difficile — это грамположительная палочка, спорообразующая, анаэробная и токсин-продуцирующая бактерия. Инфекция C. difficile (CDI) является основной причиной диареи, связанной с антибиотиками (AAD) и внутрибольничной диареи, и ее проявления варьируются от легкой диареи до псевдомембранозного колита и смерти (1). В глобальном масштабе заболеваемость и тяжесть ИКД существенно выросли за последнее десятилетие, о чем свидетельствуют высокие показатели заболеваемости и смертности (1, 2).
Распространение C. difficile в медицинских учреждениях обычно связано с эндоспорами (3), которые обладают высокой устойчивостью к химическим веществам и экстремальным температурам и сохраняются в течение месяцев и даже лет.Было обнаружено, что окружающая среда вокруг пациентов с ИКД и толстый кишечник пациентов, получающих антибиотики широкого спектра действия, загрязнены спорами C. difficile . В отсутствие нормальной флоры и в соответствующих условиях споры созревают в вегетативные клетки кишечника, что в конечном итоге приводит к ИКД (2). Вегетативные клетки прикрепляются к эпителиальным клеткам и переносят токсины в клетки. Патогенез CDI опосредуется токсинами, такими как энтеротоксин (TcdA) и цитотоксин (TcdB), которые кодируются генами tcdA и tcdB соответственно (4).Эти токсины являются основными детерминантами вирулентности и проявляют как цитопатическое, так и цитотоксическое действие на клетки млекопитающих. В эпителиальных клетках кишечника эти эффекты опосредуются инактивацией ГТФаз семейства Rho, таких как Rho, Cdc42 и Rac, что приводит к нарушению и дезорганизации цитоскелета F-актина и плотным контактам, морфологическим изменениям и последующей гибели клеток (4, 5 ).
Ванкомицин и фидаксомицин обычно рекомендуются при ИКД. Однако о рецидиве инфекции сообщали до 24% пациентов в течение 2 месяцев после первого эпизода; риск рецидивов увеличивается (50–65%) после последующих эпизодов (5, 6).В странах Европы и Азии показатель устойчивости составляет более 60% (7). Следовательно, исследования с альтернативной профилактикой или лечением ИКД получили известность.
Пробиотики — это «живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина» (8). Систематические исследования показали, что некоторые пробиотические бактерии, особенно молочнокислые бактерии (LAB) и Bifidobacterium spp., Могут влиять на терапию CDI; В клинических испытаниях было показано, что пробиотики предотвращают AAD (17%) и предотвращают или лечат CDI 3% (9, 10).Пробиотики LAB приписывают различные противомикробные механизмы. К ним относятся конкуренция питательных веществ, предотвращение адгезии клеток слизистой оболочки и интернализация патогенов, таких как C. difficile (9, 11, 12). Более того, штаммы LAB могут продуцировать молочную кислоту и определенные антимикробные молекулы, такие как перекись водорода, жирные кислоты и бактериоцины, для проявления своей антимикробной активности (13, 14). Кроме того, гидролаза желчных солей (BSH), продуцируемая LAB для преобразования конъюгированной желчной кислоты в неконъюгированную желчную кислоту, может ингибировать прорастание спор C.difficile (10, 15).
Enterococcus spp. принадлежат к LAB (16) и продуцируют молочную кислоту и широкий спектр бактериоцинов (14, 16). Энтерококки повсеместно встречаются в виде микрофлоры в кишечной экосистеме животных и людей, особенно E. faecalis и E. faecium (17). Они также присутствуют в материнском молоке, вагинальных выделениях человека, ферментированных продуктах и молочных продуктах, в первую очередь из-за их устойчивости к экстремальным значениям pH, температуры и солености (16).В предыдущих исследованиях было показано, что пробиотические штаммы Enterococcus служат в качестве функциональных пищевых продуктов, которые смягчают или предотвращают диарею, вызванную пищевыми патогенами, такими как Escherichia coli , C. perfringens и C. difficile (12, 18). . Хотя было показано, что E. faecium NM1015, E. faecalis NM815 и E. faecalis NM915 ингибируют C. difficile in vivo (12), в нескольких исследованиях изучали анти- C.difficile активность энтерококков. В этом исследовании мы определили подходящие штаммы энтерококков, которые обладают не только антибактериальной активностью против штаммов C. difficile , но также обладают пробиотическими свойствами. Кроме того, мы оценили их защитный эффект на цитопатию C. difficile в клетках HT-29.
Материалы и методы
Сбор образцов кала и выделение LAB
образцов кала ( n = 38) грудных младенцев в больнице Сонгкланакаринд были собраны при необходимом одобрении комитетов по этике медицинского факультета Университета принца Сонгкла (REC.61-064-4-2). Младенцы включались в исследование в соответствии со следующими критериями: возраст <6 месяцев, получение исключительно грудного молока с преобладающими штаммами LAB, вагинальные роды, здоровые дети, матери без существующих или прошлых неблагоприятных заболеваний и доношенная беременность. Кал немедленно культивировали на агаре de Man Rogosa Sharpe (Merck Millipore, Дармштадт, Германия) при 37 ° C в течение 48 часов в анаэробных условиях. После инкубации каждую из выделенных колоний собирали и хранили при -80 ° C в бульоне BHI с 30% глицерином до тестирования.
Бактериальные штаммы и состояние культур
В этом исследовании использовали два эталонных штамма, C. difficile, ATCC 630 (риботип 012) и ATCC 43255 (риботип 087), полученные из Американской коллекции типовых культур (АТСС). Два клинических изолята, C. difficile 17 и C. difficile 541, которые были идентифицированы с использованием MALDI-TOF MS / MS, были получены из лаборатории клинической микробиологии больницы Сонгкланагаринд. Штаммы C. difficile культивировали на агаре с циклосерином, цефокситином и фруктозой (CCFA, Merck Millipore), и чашки с агаром инкубировали при 37 ° C в течение 48 часов в анаэробных условиях.Колонии переносили в тиогликолятный бульон (Merck Millipore) и инкубировали при 37 ° C в течение 18 часов. Штаммы C. difficile с различной морфологией, образованные подозреваемым энтерококком, хранили при -80 ° C в тиогликолятном бульоне с 30% глицерином до тестирования.
E. faecalis DMST 4736 был получен из Департамента медицинских наук Таиланда (DMST). Этот штамм культивировали на агаре BHI и инкубировали при 37 ° C в течение 18 часов. E. faecalis DMST 4736 хранили при -80 ° C в бульоне BHI с 30% глицерином до тестирования.
Скрининг фекальных изолятов на
C. difficileAgar well-diffusion assay использовали для тестирования ингибирующей активности выделенных колоний из образцов фекалий против токсигенного C. difficile согласно Nigam et al. (19) с небольшими изменениями. Вкратце, ночные культуры токсигенных C. difficile ATCC43255 и ATCC 630 инокулировали на агаре BHI и вырезали из агара. Каждую лунку заполняли 50 мкл 1 × 10 8 КОЕ / мл выбранных изолятов.Планшеты инкубировали при 37 ° C в течение 48 ч в анаэробных условиях и проверяли на наличие зон ингибирования. Испытания проводились в двух экземплярах.
Идентификация бактерий
Бактерии были идентифицированы с помощью окрашивания по Граму, микроскопического исследования и активности каталазы, проведенных в соответствии с руководством Bergey (20) и подтвержденных с помощью MALDI-Biotyper ® (Karlsruhe, Германия) в соответствии с инструкциями производителя. Кроме того, изоляты были идентифицированы путем амплификации их генов 16S рРНК с использованием универсальных праймеров 27F и 1492R (21) и секвенирования на 6 Applied Biosystems 3730xl (Macrogen, Корея).Последовательности были выровнены с базой данных NCBI с использованием инструмента поиска BLAST для установления сходства последовательностей (22).
Характеристика свойств пробиотиков
Выживание в условиях желудочно-кишечного тракта (ЖКТ)
Толерантность к низкому pH (pH 2,0, 3,0 и 4,0) и желчным солям проверяли в соответствии с процедурой, описанной Rodríguez et al. (23). Толерантность к моделированному пищеварению желудка и поджелудочной железы определялась с использованием описанного протокола, но с небольшими изменениями (24).Переносимость определяли путем смешивания 1 мл стимулированного желудочного (3 г / л, pH 2) или панкреатического сока (1 г / л, pH 8) с 0,5 мл бульона BHI, содержащего 10 8 КОЕ / мл бактериальных клеток. Смеси инкубировали при 37 ° C в течение 3 или 4 часов для желудочных или панкреатических состояний соответственно. Количество колоний на чашках BHI до и после инкубации со стимулированным желудочным и панкреатическим соками подсчитывали с использованием метода свободных чашек.
Уровень выживаемости (%) = [Конечный (Log КОЕ / мл) / Начальный (Log КОЕ / мл)] × 100Анализ гидрофобности клеточной поверхности
Гидрофобность изолятов определяли с помощью анализа экстракции ксилолом (25).Процент гидрофобности (H%) рассчитывали следующим образом:
H% = [(A0-A) / A0] × 100,, где A 0 и A — значения оптической плотности, измеренные до и после экстракции ксилолом.
Анализ адгезии клеток кишечника человека
Адгезионная способность пробиотических штаммов прикрепляться к эпителиальным клеткам кишечника способствует их колонизации и исключению патогенов при адгезии к эпителиальным клеткам кишечника. Адгезию бактериальных изолятов к клеткам аденокарциномы толстой кишки человека (клетки HT-29) измеряли, как описано Monteagudo-Mera et al.(24). Количество бактерий, прикрепившихся к клеткам HT-29, рассчитывали следующим образом:
% Адгезионная способность = (V1 × 100) / V0,, где V 0 — начальное количество жизнеспособных клеток, а V 1 — количество жизнеспособных клеток, прикрепленных к клеткам HT-29 после инкубации.
Скрининг на бактериоцины
Бактериоцины измеряли модифицированным методом (22). Вкратце, бактерии (10 8 КОЕ / мл) центрифугировали (7000 × г в течение 10 мин), и pH супернатанта доводили до 6.5 с 1 н. NaOH. Нейтрализованные супернатанты инкубировали с или без 1 мг / мл протеиназы К при 30 ° C в течение 2 часов, а затем нагревали при 80 ° C в течение 10 минут для инактивации протеазы. Супернатанты фильтровали через мембранные фильтры 0,2 мкм. Аликвоты супернатантов наносили на соответствующие чашки с агаром BHI, которые предварительно покрывали ночной культурой патогенных индикаторных бактерий, и инкубировали в аэробных условиях при 37 ° C в течение 48 часов. В зависимости от того, продуцируют ли тестируемые бактерии бактериоцины, вокруг лунок, инкубированных с 1 мг / мл протеиназы K.Их сравнивали с лунками, которые не обрабатывали протеиназой К.
.Производство перекиси водорода (H
2 O 2 ) и активность гидролазы желчных солей (BSH)H 2 O 2 Производство выбранных изолятов (26) и их активности BSH (27) были протестированы в соответствии с описанными процедурами.
Оценка безопасности
Факторы вирулентности
Гены, кодирующие потенциальные факторы вирулентности, были обнаружены с использованием методов амплификации с помощью полимеразной цепной реакции (ПЦР).Праймеры показаны в дополнительной таблице 1. Фенотипические анализы, продукция желатиназы, гемолитическая активность и деградация муцина выполнялись, как сообщалось ранее (28).
Чувствительность к антибиотикам
Чувствительность к антибиотикамопределялась в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI) 2019 г. (29). Антибиотики, выбранные для тестирования, включают ампициллин (10 мкг), пенициллин (10 мкг), имипенем (10 мкг), ванкомицин (30 мкг), гентамицин (10 мкг), эритромицин (15 мкг), тетрациклин (30 мкг) и ципрофлоксацин. (5 мкг).
Вирулентность в
Galleria mellonella МодельМодель G. mellonella была использована для определения токсичности предполагаемых пробиотических штаммов, как описано ранее (30). Вкратце, личинки инфицировали через гемоцель последней левой ложной ноги, используя стерилизованный инсулиновый шприц с 10-мкл инокулятами различных штаммов E. faecalis , содержащих 5 × 10 8 КОЕ / мл. E. faecalis DMST 4736 в качестве патогенного штамма и PBS также исследовали в тех же условиях, что и вирулентный контроль и неинфицированный контроль, соответственно.После инъекции личинок инкубировали в темноте при 37 ° C в течение 5 дней. Выживаемость личинок регистрировали каждый день.
Оценка потенциальной пробиотической активности против
C. difficile и его спорAgar Well-Diffusion Assay
Agar well-diffusion assay использовали для тестирования ингибирующей активности выделенных колоний из образцов кала в отношении токсигенного C. difficile в соответствии с описанной процедурой (19) с небольшими изменениями.Вкратце, ночные культуры токсигенных штаммов C. difficile ( C. difficile ATCC630, ATCC43255, 17 и 541) суспендировали в бульоне BHI для достижения плотности клеток 1 × 10 8 КОЕ / мл и распределяли по чашки с агаром BHI. Из агара вырезали пять лунок (каждая диаметром 9 мм). Каждую лунку заполняли 50 мкл 1 × 10 8 КОЕ / мл выбранного изолята. Планшеты инкубировали при 37 ° C в течение 48 ч в анаэробных условиях и измеряли зоны ингибирования.Каждый тест проводился в трех экземплярах.
Очистка спор
Этот метод был модифицирован из (31). C. difficile выращивали на агаре BHI в течение ночи при 37 ° C. Единственную колонию из чашки с агаром BHI инокулировали в 10 мл бульона BHI с 0,5% дрожжевого экстракта и 0,1% L-цистеина (Merck Millipore, Дармштадт, Германия) и инкубировали при 37 ° C в течение ночи в анаэробных условиях и 1 мл культуру BHI субкультивировали в агар BHI с 0,1% L-цистеином и инкубировали при 37 ° C в анаэробном сосуде в течение 7 дней.После 7 дней инкубации при 37 ° C эффективность споруляции была подтверждена с помощью фазово-контрастной микроскопии и измерения термостойких КОЕ и споровых культур, собранных сразу или после инкубации в течение ночи при 4 ° C. Споры дважды промывали PBS; суспендирован в PBS, содержащем 125 мМ Трис, 200 мМ EDTA, 0,3 мг / мл протеиназы К (Amresco, США) и 1% саркозила; и инкубировали при осторожном встряхивании при 37 ° C в течение 2 часов. Споры центрифугировали (6500 × g, , 10 мин), осадок ресуспендировали в воде и промывали 10 раз.После окончательного суспендирования в воде споры подвергали термообработке (60 ° C, 20 мин) для уничтожения любых остаточных клеток. Супернатанты спор хранили при 4 ° C до тестирования. Для расчета КОЕ спор аликвоты серийно разводили в PBS и высевали на агар BHI с добавлением 0,1% таурохолата натрия (Merck Millipore). Планшеты инкубировали 48 ч перед подсчетом КОЕ.
Тест на подавление прорастания
Тест на всхожесть был проведен по методу, измененному по протоколу (32).Вкратце, 15 мкл суспензии спор (5 × 10 6 спор / мл) добавляли в 96-луночные планшеты, содержащие 135 мкл бульона BHI и 0,01% таурохолата, с или без 10 8 КОЕ / мл специфического E .faecalis и инкубировали в анаэробных условиях при 37 ° C в течение 30 мин. Прорастающие споры подсчитывали путем посева на колониеобразующие единицы (КОЕ) на агаре BHI, и процент прорастания рассчитывали следующим образом:
Процент прорастания = [КОЕ после анализа / исходное КОЕ] × 100.Тест ингибирования споруляции
Следуя Carlson et al., Было измерено ингибирование споруляции (32). Спорообразование оценивали на бульонных культурах. Лог-фазовые культуры C. difficile BHI были инокулированы в бульоне с триптозным дрожжевым экстрактом (3% триптозы и 2% дрожжевой экстракт) с начальной плотностью 1 × 10 6 КОЕ / мл с 10 8 КОЕ / мл или без них. / мл штаммов E. faecalis . После 48 ч культивирования образцы анализировали на наличие вегетативных клеток и спор с помощью микроскопии.Рассчитывали процент споруляции.
% споруляции = [количество спор / (количество спор × количество вегетативных клеток] × 100Совместное культивирование пробиотиков и токсигенных
C. difficile с клетками HT-29Метод, описанный Valdes-Varela et al. был адаптирован для проверки влияния воздействия пробиотиков на цитопатические эффекты C. difficile на клетки HT-29. Шесть штаммов E. faecalis культивировали в бульоне BHI и инкубировали при 37 ° C в течение 18 часов в анаэробных условиях. Клетки E. faecalis дважды промывали PBS и ресуспендировали (10 8 КОЕ / мл) в среде для культивирования клеток HT-29 с добавлением токсигенных C. difficile , а затем инкубировали в течение 1 ч в анаэробных условиях при перемешивании ( 300 об / мин). Затем эти супернатанты непосредственно использовали для тестирования их цитотоксичности на монослоях HT-29; Клетки HT-29 высевали на 96-луночные планшеты для культуры ткани (5 × 10 4 клеток на лунку). Планшеты инкубировали при 37 ° C в 5% CO 2 до образования конфлюэнтного монослоя.К клеткам HT-29 добавляли по 20 микролитров каждого супернатанта. Планшеты инкубировали в течение 24 ч при 37 ° C в 5% CO 2 . Затем клетки исследовали под инвертированным микроскопом на предмет морфологических изменений. На цитопатический эффект указывало более 50% клеток округлой формы.
Иммунофлуоресцентный анализ
Процедура была адаптирована из ранее описанного метода (33, 34). Вкратце, клетки HT-29, подвергнутые обработке различными супернатантами, анализировали с помощью конфокальной микроскопии.Для этого в лунки 8-луночного планшета засевали 300 мкл (2 × 10 6 клеток HT-29 / мл) и инкубировали в течение 20 часов для достижения конфлюэнтного состояния. Затем супернатант удаляли, и лунки заполняли одинаковым объемом каждого супернатанта, содержащего различные бактериальные штаммы, с токсигенной средой C. difficile или DMEM (отрицательный контроль). Инкубацию продолжали еще 24 часа. Затем супернатант удаляли из каждой лунки и клетки HT-29 фиксировали 300 мкл 3.7% формальдегида в течение 15 мин. Образцы трижды промывали PBS в течение 5 минут и повышали проницаемость с помощью PBS, содержащего 0,1% Triton X-100, в течение 15 минут. Сайты неспецифического связывания блокировали обработкой 1% BSA в течение 20 минут, и клетки снова промывали PBS. Зонд Phalloidin-Alexa-Fluor-488 (Invitrogen, США) в отношении F-актина добавляли в 100 мкл PBS (конечная концентрация 1:40), и образцы инкубировали в течение 1 ч при 4 ° C в темноте. После трехкратной промывки PBS ядра клеток HT-29 окрашивали DAPI (Sigma Chemical Co.) при разведении 1: 1000 (конечное разведение в PBS) и инкубировали в течение 20 мин. Наконец, образцы были промыты и добавлено 50 мкл средств для фиксации против выцветания (Invitrogen) перед визуализацией под лазерным сканирующим конфокальным микроскопом сверхвысокого разрешения; SR-LSCM (ZEISS, Германия) с масляным объективом 63 × / 1,4.
Статистический анализ
Все анализы независимо выполняли трижды. Результаты выражены в виде среднего значения ± стандартное отклонение, а различия между группами оценивали с помощью теста Стьюдента t или одностороннего дисперсионного анализа (ANOVA) с использованием GraphPad Prism 5.Статистически значимым считалось значение p <0,05. Для анализа выживаемости применялась функция выживаемости Каплана-Мейера программного обеспечения Stata ( p <0,05).
Результаты
Выделение и скрининг бактерий, активных против
C. difficileВосемьдесят пять различных колоний LAB были собраны из фекалий 38 грудных детей. Из них девять выделенных штаммов проявили антимикробную активность против C. difficile, ATCC 43355 и ATCC 630.
Идентификация активных изолятов
В первую очередь, девять изолятов в форме кокков были грамположительными, каталазонегативными, толерантными к 6,5% NaCl и продуцировали эскулин желчи. Эти фенотипические свойства указывали на то, что изоляты были энтерококками. Кроме того, последовательности 16S рРНК всех изолятов показали> 97% гомологию с E. faecalis . Более того, выравнивание последовательностей генов 16S РНК изолятов между собой не показало 100% идентичности, что позволяет предположить наличие различных штаммов.MALDI-TOF MS-анализ изолятов показал соответствие штамму E. faecalis CLB21560 с оценкой от 2,302 до 2,443, что позволяет предположить, что идентификация видов была надежной.
Характеристика пробиотических свойств
Выживание в условиях ЖКТ требует толерантности к кислому pH, пепсину, панкреатину и солям желчных кислот. Это важные свойства пробиотических штаммов. Данные о выживаемости девяти изолятов E. faecalis и контрольного пробиотического штамма [ Lactobacillus plantarum ATCC14917 (TISTR 877)] в условиях ЖКТ суммированы в таблице 1.Девять изолятов E. faecalis могли выжить после воздействия pH 2–4 в течение 2 часов; однако снижение процента выживаемости (от 67,25 ± 2,01% до 96,55 ± 1,52%) наблюдалось при pH 2. При том же pH полностью ингибировалось L. plantarum ATCC14917. Когда изоляты E. faecalis были имплантированы в пепсин (pH 2), его выживаемость (от 54,06 ± 1,72% до 36,94 ± 1,92%) была значительно выше, чем у L. plantarum ATCC14917 (нежизнеспособный). E. faecalis PK2502 показал самый высокий процент выживаемости (54.06 ± 1,72%), затем E. faecalis PK1801 (49,97 ± 1,47%) и E. faecalis PK2004 (46,55 ± 1,86%). Кроме того, все штаммы E. faecalis показали хорошую выживаемость (от 122,32 ± 1,12% до 119,97 ± 0,16%) в присутствии фермента поджелудочной железы в течение 4 часов. Хотя жизнеспособность штаммов E. faecalis и L. plantarum ATCC 14917 в среде, содержащей соли желчных кислот, снизилась через 4 часа, процент выживаемости каждого штамма E. faecalis в солях желчных кислот был значительно выше, чем у каждого штамма E. faecalis . Л.plantarum ATCC 14917 (от 75,68 ± 6,43% до 74,16 ± 5,14% по сравнению с 30,97 ± 0,37%).
Таблица 1 . Тест на переносимость в условиях моделирования желудочно-кишечного тракта штаммов E. faecalis .
Гидрофобность девяти исследованных штаммов E. faecalis варьировала от 47,51 ± 3,02% до 85,00 ± 2,93%. Гидрофобность каждого штамма, кроме E. faecalis PK1202, была значительно выше, чем у L. plantarum ATCC 14917 (41.08 ± 0,89%) (рис. 1А). Анализ адгезии кишечных клеток человека проводили для подтверждения адгезии девяти штаммов E. faecalis к эпителиальным клеткам HT-29 кишечника. Результаты показали, что девять штаммов E. faecalis более прочно сцепились с клетками HT-29 по сравнению с L. plantarum ATCC 14917. E. faecalis PK1801 продемонстрировал самую высокую адгезионную способность (78,83 ± 4,16%) (Рисунок 1B). .
Рисунок 1 . Адгезия изолятов E. faecalis, и L.plantarum ATCC 14917 к линии клеток человека. (A) Адгезионная способность. (B) % гидрофобности. Планки погрешностей указывают на стандартное отклонение трех независимых экспериментов. * p <0,05.
Безопасность
изолятов E. faecalisПрофили чувствительности к антибиотикам штаммов E. faecalis перечислены в таблице 2. Все девять штаммов были чувствительны к ампициллину, пенициллину, имипенему и ванкомицину, но были устойчивы к гентамицину (100%).Пять штаммов E. faecalis (PK1003, PK1301, PK2003, PK2004 и PK2502) были устойчивы к эритромицину (55,56%) и тетрациклину (66,67%), и только E. faecalis PK1801 были устойчивы к тетрациклину. Интересно, что ни один из выделенных штаммов не был устойчив к ванкомицину. ПЦР-анализ не обнаружил гены Van-A или Van-B . Более того, результаты ПЦР-скрининга на наличие генов вирулентности энтерококков показали, что эти штаммы несли разные генные паттерны (таблица 3).Гены cpd, cob, ccf и cad кодируют детерминанты половых феромонов, которые способствуют конъюгации бактерий. В то время как cpd и cob переносились некоторыми штаммами E. faecalis , ccf и cad не были обнаружены ни в одном из штаммов E. faecalis . Все девять штаммов несли генов efaAfs и gel E, которые участвуют в адгезии клеток и кодируют желатиназу соответственно.
Таблица 2 .Чувствительность к антибиотикам штаммов Enterococcus .
Таблица 3 . Резюме анализов полимеразной цепной реакции и фенотипического скрининга детерминант вирулентности.
Фенотипические анализы продемонстрировали, что ни один из девяти штаммов E. faecalis не обладал детектируемой активностью желатиназы и не был способен разлагать муцин. Более того, три штамма E. faecalis , несущие esp , показали гемолитическую активность на чашках с кровяным агаром.Поэтому эти штаммы были исключены как потенциальные пробиотики.
Вирулентность остальных шести штаммов была признана безопасной и подтверждена с помощью анализа гибели G. mellonella . Патогенный штамм E. faecalis ATCC 4736 может убить личинок G. mellonella (85%). Напротив, выживаемость личинок составляла от 80 до 100%, когда им вводили шесть штаммов E. faecalis , даже при высоких дозах E. faecalis .Аналогичные результаты наблюдались с L. plantarum ATCC 14917. Эти данные позволяют предположить, что эти шесть штаммов E. faecalis были безопасны для использования в качестве потенциальных пробиотиков.
Бактериоцин-опосредованная антимикробная активность
E. faecalisВ первую очередь, шесть изолятов E. faecalis проявили антимикробную активность против C. difficile . Зоны ингибирования находились в диапазоне от 10,90 ± 0,10 до 14,00 ± 0,00 мм. Чтобы установить участие белковых агентов, бесклеточные супернатанты E.faecalis нейтрализовали до pH 7,2 и обрабатывали протеиназой К для переваривания растворимых белков в супернатанте. Четкая зона ингибирования не была обнаружена, что указывает на то, что ингибирующая активность штаммов E. faecalis против токсигенных C. difficile опосредована бактериоцинами. Кроме того, хотя активность BSH была обнаружена у всех штаммов E. faecalis , кроме PK1301 и PK1302, продукция H 2 O 2 не была обнаружена ни в одном из шести выбранных штаммов E.faecalis штаммов.
Потенциальный пробиотик
E. faecalis Активность против токсигенных Штаммы C. difficile , их образование спор и прорастаниеСущественным свойством пробиотика является его способность подавлять рост бактериальных патогенов. Отобранные шесть штаммов E. faecalis показали сильную способность ингибировать четыре токсигенных штамма C. difficile , включая C. difficile ATCC 630, C. difficile ATCC 43255 и два клинических изолята ( C.difficile 17 и C. difficile 541) (Таблица 4). Чтобы установить пробиотическую природу шести штаммов E. faecalis , мы изучили их способность ингибировать споруляцию и образование спор в токсигенных штаммах C. difficile .
Таблица 4 . Ингибирование токсигенных штаммов C. difficile изолятами Enterococcus (мм).
Способность подавлять споруляцию была протестирована на шести штаммах E. faecalis и L.plantarum ATCC 14917. Процент образования спор у штаммов C. difficile варьировал от 44,20 ± 15,97% до 78,07 ± 7,30%. После обработки шестью штаммами E. faecalis и L. plantarum ATCC 14917 процент споруляции C. difficile значительно снизился (с 1,19 ± 2,06% до 13,89 ± 12,49%) по сравнению с необработанными ( Фигура 2).
Рисунок 2 . Процент спор C. difficile с обработкой или без обработки шестью E.faecalis и L. plantarum ATCC 14917.
Шесть отобранных штаммов E. faecalis, и L. plantarum ATCC 14917 были проверены на их потенциальную пробиотическую активность против C. difficile путем изучения их способности ингибировать прорастание спор. Результаты показали, что воздействие токсигенных штаммов C. difficile на штаммы E. faecalis и L. plantarum ATCC 14917 привело к полному снижению их прорастания (0% -1.80 ± 2,17%) (Таблица 5), что указывает на пробиотические свойства для всех шести штаммов E. faecalis ().
Таблица 5 . Относительный процент прорастания токсигенного C. difficile при обработке изолятов E. faecalis .
Влияние совместного культивирования изолированного
E. faecalis и токсигенного C. difficile на клетки HT-29Цитопатические эффекты токсигенного C. difficile на клетки HT-29 оценивали с помощью анализа цитотоксичности.Результаты показали, что обработка клеток HT-29 бесклеточным супернатантом четырех штаммов C. difficile (ATCC 630, ATCC 43255 и клинические штаммы 17 и 541) приводила к изменениям морфологии клеток ( более 50% клеток были круглыми и сферическими), тогда как обработка бесклеточным супернатантом шести штаммов монокультуры E. faecalis и монокультуры L. plantarum ATCC 14917 вызывала только 5–10% HT -29 клеток, чтобы иметь округлую морфологию, аналогичную отрицательному контролю (рис. 3).Более того, когда клетки HT-29 обрабатывали бесклеточными супернатантами E. faecalis , которые ранее инкубировали с клиническими C. difficile 541, они оставались стабильными, а процент округления клеток снижался по сравнению с HT-29. клетки, обработанные бесклеточным супернатантом четырех штаммов C. difficile . Однако, когда клетки HT-29 обрабатывали совместной культурой бесклеточного супернатанта из шести E. faecalis , инкубированных с C.difficile ATCC 630, ATCC 43255 и клинический C. difficile 17,> 50% округлены. Тем не менее, эти клеточные повреждения были меньше, чем наблюдаемые после обработки бесклеточным супернатантом монокультуры C. difficile (фиг. 3).
Рисунок 3 . Сравнение цитотоксических эффектов отдельных штаммов C. difficile , E. faecalis и совместного культивирования E. faecalis с C. difficile на клетках HT-29. (A) монослойные клетки HT-29. (B – D) Клетки HT-29, обработанные бесклеточным супернатантом из токсигенного штамма C. difficile и E. faecalis . (E, F) Клетки HT-29, обработанные бесклеточным супернатантом из совместной культуры E. faecalis и C. difficile .
Кроме того, для изучения клеточных событий, вызванных различными видами лечения, детекцию F -актина проводили с использованием иммунофлуоресцентного анализа.Результаты показали, что в то время как клетки HT-29 контрольной группы демонстрировали типичный цитоскелет F -актина, поглощенное ядро и связанные клетки (Фиг.4), клетки HT-29, обработанные бесклеточным супернатантом индивидуума Монокультура C. difficile показала потерю опосредованных цитоскелетом F -актина взаимосвязей между клетками, а также обнаружила конденсированные ядра, что указывает на начальную стадию апоптоза. Клетки HT-29 стали округлыми, и плотные контакты были нарушены.Изображения клеток HT-29, монокультурных с бесклеточным супернатантом шести E. faecalis или L. plantarum ATCC 14917, были аналогичны изображениям контрольной группы, а актин F- показал нормальную морфологию. Интенсивность окрашивания DAPI ядра этих клеток была сравнима с таковой для контроля, но меньше, чем у клеток HT-29, обработанных бесклеточным супернатантом индивидуума C. difficile .
Рисунок 4 . Иммунофлуоресцентные изображения, полученные с помощью конфокальной сканирующей лазерной микроскопии клеток HT-29 через 24 часа с бесклеточным супернатантом индивидуума C.difficile ATCC630, E. faecalis 1302 и L. plantarum ATCC 14917 и с бесклеточным супернатантом, полученным после инкубации E. faecalis с C. difficile ATCC630 и L. plantarum ATCC 14917 с C. difficile ATCC630. (A) DAPI-окрашенное ядро (синее, возбужденное при 405 нм). (B) F-актин, окрашенный зондом Phalloidin-Alexa-Fluor-488 (зеленый, возбуждение при 490 нм). (C) Комбинация ядра и окрашенного F-актина.
Конфокальные изображения клеток HT-29, обработанных бесклеточными супернатантами, полученных из совместной культуры E. faecalis PK1302 или L. plantarum ATCC 14917 с каждым из четырех токсигенных C. difficile , показали, что HT Клетки -29 были менее повреждены по сравнению с клетками HT-29, которые обрабатывали бесклеточным супернатантом индивидуальной монокультуры C. difficile . Некоторые части цитоскелета F -актин имели взаимосвязанную структуру, и клетки имели нормальную морфологию.Хотя ядра большинства клеток были аналогичны ядрам контрольной группы, некоторые ядра были конденсированными.
В целом, эти результаты свидетельствуют о том, что бесклеточные супернатанты E. faecalis снижали цитопатические эффекты C. difficile , противодействуя эффекту токсинов C. difficile .
Обсуждение
Пробиотики изучаются как альтернативный терапевтический вариант лечения и профилактики ИКД (9). Выбор подходящего пробиотика против ИКД очень важен.Это в основном связано с тем, что не все пробиотические препараты эффективны против ИКД (35, 36).
Различные штаммы потенциальных пробиотиков были выделены из фекалий человека и животных, в частности потому, что этот источник общепризнан как безопасный для употребления в пищу человеком (16, 37). Энтерококки, а именно E. faecium и E. faecalis , преимущественно присутствуют в нормальной флоре кишечного тракта теплокровных животных. Они приносят пользу своему хозяину для здоровья (17).Поэтому новые штаммы энтерококков из фекалий обычно проверяются на предмет потенциальных пробиотических свойств. Штаммы, выделенные из фекалий грудных детей, обладают более высокой способностью выживать при прохождении через желудочно-кишечный тракт по сравнению со штаммами, выделенными из молочной пищи. Они конкурируют с патогенными бактериями за питательные вещества и эффективно колонизируют ЖКТ (38). Более того, в нескольких исследованиях сообщалось о новых пробиотиках из фекалий грудных детей, поскольку в них преобладают бифидобактерии, лактобациллы, энтерококки и другие LAB (23, 39–41).В этом исследовании девять штаммов E. faecalis , PK1003, PK1201, PK1202, PK1301, PK1302, PK180, PK2003, PK2004 и PK2502, были выделены из фекалий грудных детей из-за их высокой толерантности к состояниям ЖКТ. Способность прикрепляться к слизистой оболочке кишечника — важное свойство потенциального пробиотика. Адгезия пробиотических бактерий к эпителиальным клеткам человека может служить важным механизмом для предотвращения колонизации патогенов и предотвращения удаления бактерий из толстой кишки через перистальтику (42, 43).Адгезия к ЖКТ в основном связана с гидрофобностью поверхности бактериальных клеток (44). Здесь все штаммов E. faecalis показали высокую гидрофобность, что позволяет предположить, что они были способны прикрепляться к эпителиальным клеткам кишечника.
E. faecalis обычно используется в качестве пищевого продукта и молочной закваски. Недавно они использовались в качестве пробиотиков для терапевтического лечения, и до сих пор не сообщалось о побочных эффектах (16). Однако около штаммов E. faecalis являются внутрибольничными патогенами.Следовательно, если пробиотик не объявлен «общепризнанным безопасным», его параметры безопасности должны быть определены перед использованием. Устойчивость к антибиотикам является критическим фактором, который необходимо оценивать для оценки безопасности энтерококков, и необходимо убедиться, что они не содержат приобретенных и передаваемых детерминант устойчивости к антибиотикам. В частности, устойчивость энтерококков к ванкомицину является серьезной проблемой для безопасности пробиотиков, поскольку она горизонтально передается другим штаммам (45).Интересно, что все изолированные штаммы были чувствительны к ванкомицину и не содержали генов устойчивости к ванкомицину Van-A и Van-B . Все штаммы несли по крайней мере один вирулентный детерминантный ген; однако наличие генов вирулентности не указывает на патогенные свойства. Из девяти штаммов шесть штаммов E. faecalis представили efaAfs и gel E; efaAfs участвуют в адгезии клеток бактериальных патогенов (28, 46), что, в свою очередь, важно для прилипания пробиотиков к клеткам кишечника. gel E кодирует желатиназу, которая гидролизует коллаген, казеин и гемоглобин (28, 46). Три штамма E. faecalis (PK2003, PK2004 и PK2502), несущие esp , показали гемолитическую активность на чашках с кровяным агаром. Поэтому эти штаммы были исключены как потенциальные пробиотики. Вирулентность шести штаммов была также определена с использованием анализа киллинга G. mellonella , который является полезной моделью для изучения инфекций патогенов человека, поскольку врожденная иммунная система G.mellonella похожа на личинок позвоночных (47). Шесть отобранных штаммов E. faecalis () не уничтожили штаммов G. mellonella . Взятые вместе, эти результаты подтверждают тот факт, что все шесть штаммов E. faecalis могут быть использованы в качестве потенциальных пробиотических штаммов, которые были безопасны и удовлетворяли всем требованиям к свойствам пробиотиков.
Известно, что пробиотики действуют против ИКД через различные механизмы бактериального антагонизма, такие как конкуренция за адгезию к слизистой оболочке кишечника, продуцирование антимикробных молекул, модуляция воспаления кишечника, снижение токсичности, вызванной C.difficile и ингибирование спор C. difficile (48). Некоторые соединения, продуцируемые пробиотическими бактериями, такие как метаболиты, органические кислоты и бактериоцины, также могут способствовать антимикробной активности против энтеропатогенов (49). Enterococcus spp. может продуцировать энтероцины, такие как энтероцин A, энтероцин AS-48 и энтероцины L50A и L50B, которые могут образовывать поры в клеточной мембране, истощать трансмембранный потенциал и / или градиент pH, приводящий к утечке необходимых внутриклеточных молекул и лизису клеток (14, 16, 50).В этом исследовании бактериоцин был обнаружен во всех шести отобранных штаммах E. faecalis , которые могут ингибировать токсигенный C. difficile .
Споры C. difficile важны для передачи болезни. Они устойчивы к многочисленным воздействиям окружающей среды, включая низкий pH, тепло, радиацию и химические вещества (51). Кроме того, неспособность устранить спор C. difficile может привести к рецидиву ИКД в течение 2–3 месяцев (52). В настоящее время пробиотики используются в некоторых больницах для снижения C.difficile у пациентов, которым вводят антибиотики (53). Результаты исследования Rätsep et al. (15) показали, что комбинация ксилита с L. plantarum inducia подавляет прорастание спор и рост в вегетативные токсин-продуцирующие клетки C. difficile , а также снижает колонизацию кишечника патогеном, что впоследствии снижает CDI. тарифы. Что касается ингибирования, шесть штаммов E. faecalis , идентифицированные в этом исследовании, также проявили значительное ингибирующее действие на образование спор и прорастание C.difficile . Почти все штаммы E. faecalis , выделенные в этом исследовании, продуцировали ферменты BSH, которые участвуют в ингибировании прорастания спор C. difficile (10, 54).
C. difficile продуцирует токсины, в основном энтеротоксин (TcdA) и / или цитотоксин (TcdB). Эти токсины разрушают актиновый цитоскелет и плотные контакты, что приводит к дезорганизации цитоскелета F-актина и плотных контактов кишечных эпителиальных клеток, морфологическим изменениям и последующей гибели клеток (4, 5).В предыдущем исследовании энтерококки показали свою эффективность в профилактике ААД (16). Было показано, что E. faecalis NM815, E. faecalis NM915 и E. faecium NM1015 ингибируют C. difficile (12). Аналогичным образом, наши результаты показали, что шесть штаммов E. faecalis были способны ингибировать C. difficile , продуцируя бактериоцин и / или BSH. В предыдущем отчете было обнаружено, что некоторые пробиотики ингибируют токсинов C. difficile , продуцируя протеазные белки, которые гидролизуют TcdA и TcdB и ингибируют их связывание с соответствующими рецепторами щеточной каймы кишечника (10, 54).Valdes-Varela et al. проверили бифидобактерии и лактобациллы, которые были способны противодействовать цитотоксическому эффекту C. difficile на монослой кишечного эпителия HT29 (34). Они показали, что Bifidobacterium longum и Bifidobacterium breve были способны снизить токсические эффекты патогена на клеточные линии HT-29, и округление было предотвращено, а микроструктура F -актина и плотные контакты между соседними клетками были сохранены. E. faecium и L.lactis также помогает защитить эпителиальные клетки от токсинов C. difficile (11). Аналогичным образом, результаты нашего исследования показали, что шесть E. faecalis могут секретировать антибактериальные агенты, которые снижают цитотоксические эффекты токсинов C. difficile и защищают клетки HT-29.
Заключение
Шесть штаммов E. faecalis были идентифицированы как потенциальные пробиотики для предотвращения или контроля колонизации C. difficile или ИКД.Было обнаружено, что они подавляют токсикогенный эффект C. difficile за счет снижения токсического воздействия клостридий на клетки HT-29 и предотвращения образования и прорастания спор C. difficile . Однако необходимы дальнейшие исследований in vivo ингибирования C. difficile с использованием этих штаммов E. faecalis .
Заявление о доступности данных
Исходные материалы, представленные в исследовании, включены в статью / дополнительные материалы, дальнейшие запросы можно направлять соответствующим авторам.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены этическими комитетами медицинского факультета Университета принца Сонгкла. Письменное информированное согласие на участие в этом исследовании было предоставлено законным опекуном / ближайшими родственниками участников.
Авторские взносы
CR, AT и KS разработали и разработали эксперименты. CR, NI, PS и WC проводили эксперименты. CR и KS проанализировали данные. KS предоставил реагенты, материалы и инструменты для анализа.ЧР, А.А. и К.С. написали рукопись. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана медицинским факультетом Университета принца Сонгкла (номер гранта REC61-064-4-2). CR является стипендиатом медицинского факультета Университета принца Сонгкла.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарны доктору Сурасаку Сангкхатхату за предоставление клеток HT-29 и хотели бы поблагодарить Центральную исследовательскую лабораторию медицинского факультета Университета принца Сонгкла за предоставление необходимых лабораторных инструментов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fped.2020.572633/full#supplementary-material
Список литературы
1.Мартин Дж. С., Уилкокс М. Х. Инфекция Clostridium difficile : эпидемиология, диагностика и понимание передачи. Nat Rev Gastroenterol Hepatol. (2016) 13: 206–16. DOI: 10.1038 / nrgastro.2016.25
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Чепиль Дж., Дроздз М., Питуч Х., Куиджпер Э. Дж., Перуки В., Миелимонка А. и др. Инфекция Clostridium difficile : обзор. Eur J Clin Microbiol . (2019) 38: 1211–21. DOI: 10.1007 / s10096-019-03539-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3.Бриттон Р.А., Янг В.Б. Взаимодействие между кишечной микробиотой и хозяином при устойчивости к колонизации Clostridium difficile . Trends Microbiol. (2012) 20: 313–9. DOI: 10.1016 / j.tim.2012.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Рупник М., Уилкокс М.Х., Гердинг Д.Н. Clostridium difficile i Инфекция: новые разработки в эпидемиологии и патогенезе. Nat Rev Microbiol. (2009) 7: 526–36. DOI: 10.1038 / nrmicro2164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Кэрролл К.С., Бартлетт Дж. Биология Clostridium difficile : значение для эпидемиологии и диагностики. Annu Rev Microbiol. (2011) 65: 501–21. DOI: 10.1146 / annurev-micro-0-102824
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Вишванатан В.К., Маллоцци М.Дж., Ведантам Г. Инфекция Clostridium difficile : обзор болезни и ее патогенеза, эпидемиологии и вмешательств. Кишечные микробы. (2010) 1: 234–42.DOI: 10.4161 / gmic.1.4.12706
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Продовольственная и сельскохозяйственная организация Объединенных Наций / Всемирная организация здравоохранения. Руководство по оценке пробиотиков в пищевых продуктах . Продовольственная и сельскохозяйственная организация Объединенных Наций; Всемирная организация здравоохранения (2002 г.).
Google Scholar
9. McDonald LC, Gerding DN, Johnson S, Bakken JS, Carroll KC, Coffin SE, et al. Руководство по клинической практике для инфекции Clostridium difficile у взрослых и детей: обновление 2017 г., подготовленное Американским обществом инфекционных болезней (IDSA) и Обществом эпидемиологии здравоохранения Америки (SHEA). Clin Infect Dis. (2018) 66: e1–48. DOI: 10.1093 / cid / ciy149
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Parkes GC, Sanderson JD, Whelan K. Механизмы и эффективность пробиотиков в профилактике диареи, ассоциированной с Clostridium difficile, . Lancet Infect Dis. (2009) 9: 237–44. DOI: 10.1016 / S1473-3099 (09) 70059-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Доуделл П., Чанкхамхаенгдеча С., Панбангред В., Джанвилисри Т., Арооннуал А.Пробиотическая активность Enterococcus faecium и Lactococcus lactis , выделенных из таиландских ферментированных колбас, и их защитный эффект против Clostridium difficile . Пробиотики Антимикро . (2019) 12: 641–8. DOI: 10.1007 / s12602-019-09536-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Мансур Н.М., Эльхатиб В.Ф., Абошанаб К.М., Бахр ММА. Ингибирование Clostridium difficile у мышей с использованием смеси потенциальных пробиотических штаммов Enterococcus faecalis NM815, E.faecalis NM915 и E. faecium NM1015: новые кандидаты для борьбы с инфекцией C. difficile (CDI). Пробиотики Антимикроб . (2017) 10: 511–22. DOI: 10.1007 / s12602-017-9285-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Ратсеп М., Наабер П., Кольялг С., Смидт И., Шкут Э. Влияние штаммов Lactobacillus plantarum на клинические изоляты Clostridium difficile in vitro . J Пробное здоровье .(2014) 2: 119. DOI: 10.4172 / 2329-8901.1000119
CrossRef Полный текст | Google Scholar
15. Рятсеп М., Кылйалг С., Сепп Э., Смидт И., Труусалу К., Сонгисепп Э. и др. Комбинация пробиотика и пребиотика может предотвратить прорастание спор и инфекцию Clostridium difficile . Анаэроб. (2017) 47: 94–103. DOI: 10.1016 / j.anaerobe.2017.03.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Franz CMAP, Huch M, Abriouel H, Holzapfel W, Gálvez A.Энтерококки как пробиотики и их значение для безопасности пищевых продуктов. Int J Food Microbiol. (2011) 151: 125–40. DOI: 10.1016 / j.ijfoodmicro.2011.08.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Девриезе Л., Баэле М., Бутайе П. Род Enterococcus . В: М. Дворкин, С. Фалькоу, Э. Розенберг, К. Х. Шлейфер, Э. Стакебрандт, редакторы. Прокариоты: Том 4: Бактерии: Firmicutes, Cyanobacteria . Нью-Йорк, штат Нью-Йорк: Springer US (2006).п. 163–74.
Google Scholar
18. Chen C-C, Lai C-C, Huang H-L, Huang W-Y, Toh H-S, Weng T-C и др. Антимикробная активность видов Lactobacillus в отношении устойчивых к карбапенемам энтеробактерий. Front Microbiol. (2019) 10: 789. DOI: 10.3389 / fmicb.2019.00789
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Нигам А., Кумар А., Айенгар М.Х.В., Бхола Н. Скрининг in vitro антибактериальной активности молочнокислых бактерий против общих кишечных патогенов. J Biomed Sci. (2012) 1: 2. DOI: 10.3823 / 1010
CrossRef Полный текст | Google Scholar
20. Павел Д.В. Руководство по систематической бактериологии Bergeys. Фирмы . 2-е изд. Дордрехт; Нью-Йорк, штат Нью-Йорк: Спрингер. (2009).
Google Scholar
21. Hongoh Y, Yuzawa H, Ohkuma M, Kudo T. Оценка праймеров и условий ПЦР для анализа генов 16S рРНК из естественной среды. FEMS Microbiol Lett. (2003) 221: 299–304.DOI: 10.1016 / S0378-1097 (03) 00218-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Хан С.К., Шин М.С., Пак Х.И., Ким С.И., Ли В.К. Скрининг бактериоцин-продуцирующих штаммов Enterococcus faecalis на антагонистическую активность против Clostridium perfringens . Корейский J Food Sci Anim Resour . (2014) 34: 614–21. DOI: 10.5851 / kosfa.2014.34.5.614
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Родригес Э., Аркес Дж. Л., Родригес Р., Пейротен А., Ландете Дж. М., Медина М. Антимикробные свойства пробиотических штаммов, выделенных из младенцев, находящихся на грудном вскармливании. J Funct Foods. (2012) 4: 542–51. DOI: 10.1016 / j.jff.2012.02.015
CrossRef Полный текст | Google Scholar
24. Монтеагудо-Мера А., Родригес-Апарисио Л., Руа Дж., Мартинес-Бланко Х., Наваса Н., Гарсия-Арместо М. Р. и др. In vitro оценка физиологических пробиотических свойств различных штаммов молочнокислых бактерий молочного и человеческого происхождения. J Funct Foods. (2012) 4: 531–41. DOI: 10.1016 / j.jff.2012.02.014
CrossRef Полный текст | Google Scholar
25. Влкова Е., Рада В., Смехилова М., Киллер Дж. Автоагрегационная и коагрегационная способность бифидобактерий и клостридий. Folia Microbiol. (2008) 53: 263–9. DOI: 10.1007 / s12223-008-0040-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Сонг Ю.Л., Като Н., Мацумиа Ю., Лю С.Х., Като Х., Ватанабе К. Идентификация и производство перекиси водорода фекальными и вагинальными лактобациллами, выделенными от японских женщин и новорожденных. J Clin Microbiol. (1999) 37: 3062–4. DOI: 10.1128 / JCM.37.9.3062-3064.1999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Ван З, Цзэн Х, Мо И, Смит К., Го И, Лин Дж. Идентификация и характеристика гидролазы желчных солей из Lactobacillus salivarius для разработки новых альтернатив стимуляторам роста антибиотиков. Appl Environ Microbiol. (2012) 78: 8795–802. DOI: 10.1128 / AEM.02519-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Ревириего К., Итон Т., Мартин Р., Хименес Э., Фернандес Л., Гассон М.Дж. и др. Скрининг детерминант вирулентности у штаммов Enterococcus faecium , выделенных из грудного молока. J Hum Lact. (2005) 21: 131–7. DOI: 10.1177 / 08
405275394PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. CLSI. Методы тестирования антимикробной чувствительности анаэробных бактерий . 29 изд. Уэйн, Пенсильвания: Институт клинических и лабораторных стандартов (2019).
Google Scholar
30. Ян Х-Ф, Пан А-Дж, Ху Л-Ф, Лю И-Й, Ченг Дж, Йе Й и др. Galleria mellonella в качестве модели in vivo для оценки эффективности антимикробных агентов против инфекции Enterobacter cloacae . J Microbiol Immunol. (2017) 50: 55–61. DOI: 10.1016 / j.jmii.2014.11.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Лоули Т.Д., Краучер Нью-Джерси, Ю. Л., Клэр С., Себайхия М., Гулдинг Д. и др.Протеомная и геномная характеристика высокоинфекционных спор Clostridium difficile 630. J Bacteriol. (2009) 191: 5377–86. DOI: 10.1128 / JB.00597-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Carlson PE Jr, Kaiser AM, McColm SA, Bauer JM, Young VB, Aronoff DM, et al. Различия в прорастании клинических изолятов Clostridium difficile коррелируют с тяжестью заболевания. Анаэроб. (2015) 33: 64–70. DOI: 10.1016 / j.anaerobe.2015.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Джафари Н.В., Кюне С.А., Минтон Н.П., Аллан Э., Баджадж-Эллиотт М. Clostridium difficil e-опосредованные эффекты на эпителий кишечника человека: моделирование взаимодействий между хозяином и патогеном в камере вертикальной диффузии. Анаэроб. (2016) 37: 96–102. DOI: 10.1016 / j.anaerobe.2015.12.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Valdes-Varela L, Alonso-Guervos M, Garcia-Suarez O, Gueimonde M, Ruas-Madiedo P.Скрининг бифидобактерий и лактобацилл, способных противодействовать цитотоксическому действию Clostridium difficile на монослой кишечного эпителия HT29. Front Microbiol. (2016) 7: 577. DOI: 10.3389 / fmicb.2016.00577
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Аллен С.Дж., Уэрхэм К., Ван Д., Брэдли С., Хатчингс Н., Харрис В. и др. Lactobacilli и бифидобактерии в профилактике антибиотико-ассоциированной диареи и Clostridium difficile диареи у пожилых стационарных пациентов (PLACIDE): рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование. Ланцет. (2013) 382: 1249–57. DOI: 10.1016 / S0140-6736 (13) 61218-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Auclair J, Frappier M, Millette M. Lactobacillus acidophilus CL1285, Lactobacillus casei LBC80R и Lactobacillus rhamnosus CLR2 (Bio-K +): характеристика, производство, контроль конкретных механизмов действия и комбинация пробиотиков для первичной профилактики инфекции Clostridium difficile . Clin Infect Dis. (2015) 60 (Дополнение 2): S135–43. DOI: 10.1093 / cid / civ179
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Фернандес Л., Ланга С., Мартин В., Мальдонадо А., Хименес Е., Мартин Р. и др. Микробиота грудного молока: происхождение и потенциальная роль в здоровье и болезнях. Pharmacol Res. (2013) 69: 1–10. DOI: 10.1016 / j.phrs.2012.09.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Халил Р., Махрус Х., Эль-Халафави К., Камали К., Фрэнк Дж., Эль Сода М.Оценка пробиотического потенциала молочнокислых бактерий, выделенных из фекалий грудных детей в Египте. Afr J Biotechnol. (2007) 6: 939–49.
Google Scholar
40. Механна Н.С., Вали И., Аттиа А.Е., Лотфи В., Тавил А.Е., Механна Н.С. Связь между пробиотическими свойствами изолятов, выделенных из грудного молока и стула младенцев. NutrFood Sci. (2016) 46: 294–305. DOI: 10.1108 / NFS-10-2014-0091
CrossRef Полный текст | Google Scholar
41.Panya M, Lulitanond V, Rattanachaikunsopon P, Srivoramas T., Chaiwong T. Выделение, идентификация и оценка новых пробиотических штаммов, выделенных из фекалий грудных детей. J Med Assoc Thai. (2016) 99 (Дополнение 1): S28–34.
PubMed Аннотация | Google Scholar
43. Джордж Керри Р., Патра Дж. К., Гауда С., Парк Й, Шин Х. С., Дас Дж. Действие пробиотиков для здоровья человека: обзор. J Food Drug Anal. (2018) 26: 927–39. DOI: 10.1016 / j.jfda.2018.01.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Монтеагудо-Мера А., Расталл Р.А., Гибсон Г.Р., Харалампопулос Д., Хатцифрагкоу А. Механизмы адгезии, опосредованные пробиотиками и пребиотиками, и их потенциальное влияние на здоровье человека. Appl Microbiol Biotechnol. (2019) 103: 6463–72. DOI: 10.1007 / s00253-019-09978-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Лемпиайнен Х., Киннунен К., Мертанен А., фон Райт А.Распространенность факторов вирулентности среди изолятов кишечных энтерококков человека. Lett Appl Microbiol. (2005) 41: 341–4. DOI: 10.1111 / j.1472-765X.2005.01769.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Goldstein EJC, Johnson SJ, Maziade PJ, Evans CT, Sniffen JC, Millette M, et al. Пробиотики и профилактика инфекции Clostridium difficile . Анаэроб. (2017) 45: 114–9. DOI: 10.1016 / j.anaerobe.2016.12.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Халиги А., Бехдани Р., Кухестани С. Пробиотики: всесторонний обзор их классификации, механизма действия и роли в питании человека. В: В Рао, Л. Г. Рао, редакторы, Пробиотики и пребиотики в питании и здоровье человека . Риека: InTech (2016). п. 02. DOI: 10.5772 / 63646
CrossRef Полный текст | Google Scholar
50. Вимонт А., Фернандес Б., Хаммами Р., Абабса А., Даба Н., Флисс И. Вырабатывающий бактериоцин Enterococcus faecium LCW 44: потенциальный кандидат в пробиотики из сырого верблюжьего молока. Front Microbioly. (2017) 8: 865. DOI: 10.3389 / fmicb.2017.00865
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Zhu D, Sorg JA, Sun X. Биология Clostridioides difficile: споруляция, прорастание и соответствующие методы лечения инфекции C. difficile . Front Cell Infect Microbiol. (2018) 8:29. DOI: 10.3389 / fcimb.2018.00029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. McFarland LV, Ship N, Auclair J, Millette M.Первичная профилактика инфекций Clostridium difficile с помощью специального пробиотика, объединяющего штаммы Lactobacillus acidophilus, L. casei и L. rhamnosus : оценка доказательств. J Hosp Infect. (2018) 99: 443–52. DOI: 10.1016 / j.jhin.2018.04.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Castagliuolo I, Riegler MF, Valenick L, LaMont JT, Pothoulakis C. Протеаза Saccharomyces boulardii ингибирует эффекты Clostridium difficile токсинов A и B в слизистой оболочке толстой кишки человека. Infect Immun. (1999) 67: 302–7. DOI: 10.1128 / IAI.667.1.302-307.1999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гемолитико-уремический синдром
Что такое гемолитико-уремический синдром?
Гемолитико-уремический синдром (ГУС) — заболевание, вызывающее разрушение эритроцитов и тромбоцитов в крови. Иногда это может вызвать повреждение почек или, в редких случаях, смерть. Это вызвано особым штаммом бактерий (микробов) Escherichia coli, известных как E.coli O157: H7. ГУС встречается примерно у 5% детей, инфицированных этим микробом. Большинство детей, у которых развивается ГУС, моложе 5 лет.
Как мой ребенок получил HUS?
Микробы, вызывающие ГУС, обнаруживаются в кале или стуле (испражнениях) инфицированных людей или животных. Микробы распространяются путем «фекально-оральной передачи» микробов, проглоченных через продукты питания или предметы, которые контактировали с фекалиями, или руки, которые были недостаточно тщательно вымыты). Возможные источники включают:
- прямой контакт с инфицированным животным или человеческими фекалиями
- недоваренное мясо (обычно гамбургер)
- непастеризованное молоко, сок или сидр
- загрязненных предметов (например, игрушек)
Какие признаки ГУС?
- водянистый или кровянистый понос примерно за 1 неделю до появления других признаков
- Боль или спазмы в животе
- легко появляются синяки или кровотечения
- уменьшение количества мочи или крови в моче
- слабость, чувство усталости
- бледный цвет
- лихорадка
Что такое лечение?
У вашего ребенка будет внутривенная линия (IV) для введения жидкости, лекарств и калорий.Катетер (небольшая трубка) может быть введен в мочевой пузырь для измерения количества мочи.
Анализы крови будут выполнены для проверки гемоглобина (эритроцитов), количества тромбоцитов и факторов, показывающих, насколько хорошо работают почки.
Вашему ребенку могут делать переливания крови, чтобы получить эритроциты и тромбоциты, необходимые для выздоровления.
Если лабораторные исследования показывают, что почкам нужна помощь в избавлении от шлаков, потребуется перитонеальный диализ (ПД). Для этого лечения хирург вводит катетер в брюшную полость (живот).Если потребуется PD, ваш ребенок будет переведен в отделение детской интенсивной терапии (PICU). В брюшную полость вводится специальная жидкость, где она остается в течение определенного периода времени, а затем сливается. (См. Обучающий лист «Диализ»)
Когда анализы крови вернутся к норме, ваш ребенок почувствует себя лучше, и почки снова начнут вырабатывать мочу. БП будет постепенно прекращаться по мере того, как почки производят больше мочи. Катетер IV и PD будет удален, когда ваш ребенок будет хорошо есть, пить и мочиться.Это может занять несколько дней или недель.
Чтобы предотвратить распространение бактерий E. coli среди других, медицинские работники, ухаживающие за вашим ребенком в больнице, будут носить халаты и перчатки.
Вы и любое лицо, ухаживающее за вашим ребенком, должны хорошо мыть руки водой с мылом или использовать спиртовое дезинфицирующее средство для рук:
- после смены подгузников.
- после того, как помогли ребенку пользоваться туалетом.
- перед работой с едой или напитками.
- Также маленькие дети должны мыть руки хорошо и часто.
Что еще мне нужно знать?
Когда ваш ребенок уйдет из больницы домой, вам нужно будет запланировать последующие посещения врача. Очень важно соблюдать эти встречи. Во время этих посещений будет внимательно изучаться информация о еде, питье и мочеиспускании. Если вашему ребенку был проведен диализ, вам будут даны инструкции по смене повязки и уходу за участком.
Наш отдел инфекционного контроля должен сообщить об этом заболевании в Департамент здравоохранения штата.Это делается для того, чтобы определить, есть ли общий источник, который может заразить других.
Когда мой ребенок сможет вернуться в детский сад?
Ваш ребенок может вернуться в детский сад после того, как не принимал антибиотики в течение двух дней, и 2 стула с интервалом не менее 1 дня дали отрицательный результат на бактерии E. coli. В большинстве случаев микробы будут в стуле в течение 2 или 3 недель после первых признаков болезни, но у небольшого числа детей может пройти несколько месяцев, чтобы все микробы исчезли.
Когда мне позвонить врачу?
После выписки вашего ребенка из больницы немедленно звоните, если:
- признаки возврата ЖКХ.
- плохой аппетит более нескольких дней.
- рвота.
- лихорадка: температура выше 101 ° F (38,4 ° C).
- покраснение или дренаж в области БП (если у ребенка БП).
Вопросы?
Этот лист не предназначен специально для вашего ребенка, но содержит общую информацию. Если у вас возникнут вопросы, позвоните врачу.
Детские больницы и клиники Миннесоты
Обучение пациентов / семей
2525 Chicago Avenue South
Minneapolis, MN 55404
Последняя редакция 7/2015 © Авторское право
Вернуться к началу
Гемолитико-уремический синдром (ГУС)
Определение
HUS — это заболевание, при котором разрушаются эритроциты и нарушаются функции почек.ГУС — это заболевание, которое может следовать за диареей, вызванной E. coli O157: H7 или Shigella dysenteriae. Однако это может быть серьезным заболеванием: только у небольшого процента людей с E. coli O157: H7 или Shigella dysenteriae развивается ГУС. Не все случаи ГУС вызваны инфицированием этими бактериями.
Патогенная кишечная палочка и шигелла, включая HUS, подлежит регистрации в Департаменте здравоохранения штата Айова в соответствии с Административным кодексом штата Айова 641 IAC 1.
Симптомы
Заражение бактериями E.coli O157: H7 и Shigella dysenteriae могут вызывать следующие симптомы:
- Спазмы желудка
- Рвота
- Кровавый понос
- Легкая лихорадка
Если у человека продолжает развиваться ГУС, он становится вялым (чувство сильной усталости) и выделяет все меньше мочи. Другие функции включают:
- Высокое артериальное давление
- Почечная недостаточность
- Желтуха (изменение цвета кожи и белков глаз на желтоватый оттенок)
- Изъятия
- Кровотечение в кожу
HUS, если он возникает, развивается в среднем через 7 дней (но до 3 недель) после первых симптомов, когда диарея проходит.
Причины
HUS не распространяется. Однако бактерии E. coli O157: H7 и Shigella dysenteriae, которые могут вызывать ГУС, могут передаваться другим людям, если не соблюдаются правила гигиены персонала.
Факторы риска
Любой может получить ГУС, но дети до пяти лет и пожилые люди подвержены повышенному риску.
Профилактика
Не существует известного лечения, которое предотвратило бы развитие ГУС. Вы можете значительно снизить риск ГУС, уменьшив вероятность заражения E.coli O157: H7 или Shigella dysenteriae:
- Не готовьте еду для других, если у вас диарея.
- Всегда тщательно мойте руки водой с мылом перед едой, а также до и после приготовления любых продуктов, особенно сырого мяса.
- Вымойте руки после посещения туалета и после смены подгузников. (Также вымойте руки ребенка с подгузником)
- При уходе за больным диареей мойте руки большим количеством воды с мылом после уборки ванной комнаты, оказания помощи человеку в туалете или смены подгузников, грязной одежды или грязного простыни.Обязательно вымойте им руки.
- Всегда храните мясо в холодильнике. Никогда не оставляйте сырое мясо при комнатной температуре.
- Не допускайте контакта продуктов, которые будут употребляться в сыром виде, например фруктов и овощей, с продуктами питания от животных. (Тщательно мойте, особенно те, которые не будут вариться).
- Никогда не ешьте сырое мясо. Если в ресторане вам подали недоваренный гамбургер или другой говяжий фарш, отправьте его обратно для дальнейшего приготовления.
- Тщательно готовьте весь говяжий фарш и гамбургеры — до температуры 155 градусов по Фаренгейту, пока сок не станет прозрачным и не перестанет быть розовым.
- Всегда мойте руки, разделочные доски и посуду между закреплением сырого мяса или птицы и других предметов, таких как фрукты и овощи.
- Пейте только пастеризованное молоко, сок или сидр.
- Избегайте сексуальной практики, которая может привести к фекально-оральной передаче. Латексная барьерная защита (презервативы) должна использоваться для предотвращения распространения патогенной кишечной палочки среди половых партнеров, а также других патогенов.
Лечение
В тяжелых случаях функция почек значительно снижается, и может потребоваться диализ.Нарушения системы свертывания крови могут вызвать склонность к кровотечениям, а количество эритроцитов может быть низким (анемия). В тяжелых случаях часто требуется переливание. К счастью, большинство людей с ГУС полностью выздоравливают, и функция почек возвращается в норму. Однако часто требуется длительное пребывание в больнице.
