Гипо-, гипер- и изотонические растворы. — МегаЛекции
Гипертонический – раствор с большей концентрацией и большим осмотическим давлением по сравнению с другим раствором.
Гипотонический – раствор, имеющий меньшую концентрацию и меньшее значение осмотического давления.
Изотонические растворы – растворы с одинаковым осмотическим давлением.
Изотонический коэффициент
Изотонический коэффициент Вант-Гоффа (i) показывает во сколько раз коллигативные свойства раствора электролита больше, чем раствора неэлектролита при одинаковых условиях и концентрациях.
Понятие об изоосмии (электролитном гомеостазе)
Изоосмия — относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: белков, электролитов и т.д.
Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
Осмоти́ческая концентра́ция — суммарная концентрация всех растворённых частиц.
Может выражаться как осмолярность (осмоль на литр раствора) и как осмоляльность (осмоль на кг растворителя).
Осмоль — единица осмотической концентрации, равная осмоляльности, получаемой при растворении в одном литре растворителя одного моля неэлектролита. Соответственно, раствор неэлектролита с концентрацией 1 моль/л имеет осмолярность 1 осмоль/литр.
Все одновалентные ионы (Na+, К+, Cl—) образуют в растворе число осмолей, равное числу молей и эквивалентов (электрических зарядов). Двухвалентные ионы образуют в растворе каждый по одному осмолю (и молю), но по два эквивалента.
Осмоляльность нормальной плазмы — величина достаточно постоянная и равна 285—295 мосмоль/кг. Из общей осмоляльности плазмы лишь 2 мосмол/кг обусловлены наличием растворенных в ней белков.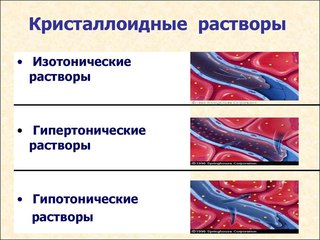 Таким образом, главными компонентами, обеспечивающими осмоляльность плазмы, являются Na+ и С1- (около 140 и 100 мосмоль/кг соответственно). Постоянство осмотического давления внутриклеточной и внеклеточной 1 жидкости предполагает равенство молярных концентраций содержащихся в них электролитов, несмотря на различия в ионном составе внутри клетки и во внеклеточном пространстве. С 1976 г. в соответствии с Международной системой (СИ) концентрацию веществ в растворе, в том числе осмотическую, принято выражать в миллимолях на 1 л (ммоль/л). Понятие «осмоляльность», или «осмотическая концентрация», эквивалентно понятию «моляльность», или «моляльная концентрация». По существу понятия «миллиосмоль» и «миллимоль» для биологических растворов близки, хотя и не идентичны.
Таким образом, главными компонентами, обеспечивающими осмоляльность плазмы, являются Na+ и С1- (около 140 и 100 мосмоль/кг соответственно). Постоянство осмотического давления внутриклеточной и внеклеточной 1 жидкости предполагает равенство молярных концентраций содержащихся в них электролитов, несмотря на различия в ионном составе внутри клетки и во внеклеточном пространстве. С 1976 г. в соответствии с Международной системой (СИ) концентрацию веществ в растворе, в том числе осмотическую, принято выражать в миллимолях на 1 л (ммоль/л). Понятие «осмоляльность», или «осмотическая концентрация», эквивалентно понятию «моляльность», или «моляльная концентрация». По существу понятия «миллиосмоль» и «миллимоль» для биологических растворов близки, хотя и не идентичны.
Таблица 1. Нормальные значения осмоляльности биологических сред
| Среда | Осмоляльность, мосмоль на 1 кг воды |
| Плазма крови | 285—295 |
| Цереброспинальная жидкость | 285—295 |
| Желудочный сок | 160—340 |
| Слюна | 110—210 |
| Желчь | 290—300 |
| Моча | 600—1200 (в зависимости от диеты и диуреза) |
Росм крови = 7,7 атм
Основную задачу осморегуляции выполняют почки. Осмотическое давление мочи в норме значительно выше, чем плазмы крови, что и обеспечивает активный транспорт из крови в почку. Осморегуляция осуществляется под контролем ферментативных систем. Нарушение их деятельности приводит к патологическим процессам. При внутривенных инъекциях, чтобы избежать нарушения осмотического баланса, следует использовать изотонические растворы. Изотоничен по отношению к крови физиологический раствор, содержащий 0.9% хлористого натрия. В хирургии явлением осмоса пользуются, применяя гипертонические марлевые повязки (марлю пропитывают 10%-ным раствором хлорида натрия).
Роль осмоса в биологических системах.
· Обуславливает тургор (упругость) клеток.
· Обеспечивает поступление воды в клетки и межклеточные структуры, эластичность тканей и сохранение определённой формы органов. Обеспечивает транспорт веществ.
· Осмотическое давление крови человека при 310 К – 7,7 атм, концентрация NaCl – 0,9%.
Плазмолиз и гемолиз
Плазмолиз – сжатие, сморщивание клетки в гипертоническом растворе.
Гемолиз – набухание и разрыв клетки в гипотоническом растворе.
Билет 14. Коллигативные свойства разбавленных растворов электролитов. Изотонический коэффициент.
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
24. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. 25. Роль осмоса и осмотического давления в биологических системах.
1. Цель и задачи программы
1. Цель и задачи программы Данная программа предназначена для подготовки к вступительным испытаниям в аспирантуру по направлению подготовки 04.06.01 Химические науки, научная специальность 02.00.04 — Физическая
ПодробнееЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ
Министерство здравоохранения Республики Беларусь Учреждение образования «Белорусский государственный медицинский университет» Дисциплина «Общая химия» Специальность: 1-79 01 03 Медико-профилактическое
ПодробнееЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ
Министерство здравоохранения Республики Беларусь Учреждение образования «Белорусский государственный медицинский университет» Дисциплина «Общая химия» Специальность: 1-79 01 07 Стоматология ЭКЗАМЕНАЦИОННЫЕ
ПодробнееЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ
Министерство здравоохранения Республики Беларусь Учреждение образования «Белорусский государственный медицинский университет» Дисциплина «Общая химия» Специальность: 1-79 01 07 Стоматология ЭКЗАМЕНАЦИОННЫЕ
Раздел 1.
 «Химическая термодинамика»
«Химическая термодинамика»1. Цель и задачи программы Данная программа предназначена для подготовки к вступительным испытаниям по специальной дисциплине по направлению подготовки 04.06.01 Химические науки; направленность программы:
Подробнее2. Содержание тем дисциплины
1. Общие положения Поступающий в аспирантуру по направлению подготовки 04.06.01 Химия. Профиль «Неорганическая химия» должен показать знания основных теоретических положений неорганической химии как одной
ПодробнееДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТОМФАКА
ДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТОМФАКА ЗАНЯТИЕ 1 Тема: «Основы химии биогенных элементов» 1. Барковский Е.В. и др. Общая химия. Минск, Вышэйшая школа, 2013 г. с. 94-147 ЗАНЯТИЕ 2 Тема: «Введение в титриметрические
ПодробнееÎÁÙÀß È ÍÅÎÐÃÀÍÈ ÅÑÊÀß ÕÈÌÈß Òîì 1
À. Â. Ñóâîðîâ, À. Á. Íèêîëüñêèé ÎÁÙÀß È ÍÅÎÐÃÀÍÈ ÅÑÊÀß ÕÈÌÈß Òîì 1 УЧЕБНИК ДЛЯ СПО 6-е издание, исправленное и дополненное Ðåêîìåíäîâàíî Ó åáíî-ìåòîäè åñêèì îòäåëîì ñðåäíåãî ïðîôåññèîíàëüíîãî îáðàçîâàíèÿ
Паспорт фонда оценочных средств
Паспорт фонда оценочных средств п/п Контролируемые темы дисциплины* Код контролируемой компетенции (или ее части) 1 Основные понятия и законы. ОК-7, ПК-2 Наименование оценочного средства Проверочная работа
ПодробнееТермодинамика фазовых равновесий
Экзаменационные вопросы по курсу «Физическая и коллоидная химия» фармацевтический факультет, 2 курс (дневное отделение), 3 и 4 курс (заочное отделение) Химической термодинамики 1. Предмет химической термодинамики.
ДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ
ДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ ЛЕЧЕБНЫЙ, ПЕДИАТРИЧЕСКИЙ, МЕДИКО-ПРОФИЛАКТИЧЕСКИЙ, ВОЕННО-МЕДИЦИНСКИЙ, МЕДИЦИНСКИЙ ФАКУЛЬТЕТЫ.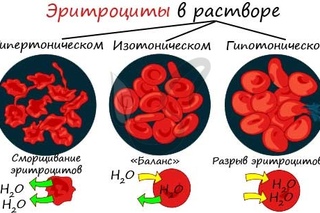 З А Н Я Т И Е 1 Тема: «Введение в химию биогенных элементов» Лабораторная работа:
З А Н Я Т И Е 1 Тема: «Введение в химию биогенных элементов» Лабораторная работа:
ПЛАН ЗАНЯТИЙ по учебной дисциплине
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей химии Утверждаю И.о. заведующего кафедрой профессор «01» сентября 2017 г. В.Е. Коган ПЛАН ЗАНЯТИЙ
РАБОЧАЯ ПРОГРАММА по дисциплине «Б Химия»
Федеральное государственное бюджетное образовательное учреждение высшего образования «Саратовский государственный технический университет имени Гагарина Ю.А.» Кафедра «Химия» РАБОЧАЯ ПРОГРАММА по дисциплине
ПодробнееДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ
ДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ ПЕДИАТРИЧЕСКОГО И МЕДИКО-ПРОФИЛАКТИЧЕСКОГО, ФАКУЛЬТЕТОВ. З А Н Я Т И Е 1 Тема: «Введение в химию биогенных элементов» Лабораторная работа: «Приобретение навыков работы с
ПодробнееПояснительная записка
Пояснительная записка Рабочая программа элективного курса по выбору «Углубленное изучение отдельных тем общей химии» составлена на основе авторской (Н.И. Тулина. Углубленное изучение отдельных тем общей
ПодробнееУЧЕБНО-МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ
Министерство образования и науки РФ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Уральский государственный горный университет» УЧЕБНО-МЕТОДИЧЕСКИЕ
Подробнее11 (ступень образования / класс)
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа 28 города Ставрополя Утверждаю Директор МБОУ СОШ 28 Л. Л. Киселѐва Согласовано на НМС школы. Протокол от 20 г. Руководитель
Л. Киселѐва Согласовано на НМС школы. Протокол от 20 г. Руководитель
Направление подготовки (специальность)
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «УФИМСКИЙ ГОСУДАРСТВЕННЫЙ АВИАЦИОННЫЙ ТЕХНИЧЕСКИЙ
ПодробнееI. ОСНОВЫ ОБЩЕЙ ХИМИИ
Содержание Предисловие редактора… 3 Введение… 5 Часть I. ОСНОВЫ ОБЩЕЙ ХИМИИ Раздел 1. Основные понятия и законы химии 1.1. Определение и предмет химии…9 1.2. Первоначальные сведения о строении атомов.
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Ряд разделов школьной программы химии должен рассматриваться в рамках профильной школы более углубленно. Это относится, в частности, к основам термохимии, теории кислот и оснований,
ПодробнееДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ
ДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ ЛЕЧЕБНЫЙ, ПЕДИАТРИЧЕСКИЙ, МЕДИКО-ПРОФИЛАКТИЧЕСКИЙ, ВОЕННО-МЕДИЦИНСКИЙ, МЕДИЦИНСКИЙ ФАКУЛЬТЕТЫ. ЗАНЯТИЕ 1 Тема: Вводное занятие Техника безопасности. Гидролиз солей. Реакции
ПодробнееВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ АЛТАЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ УЧЕБНОЕ ПОСОБИЕ Допущено Отделением химии УМО по классическому университетскому образованию РФ в качестве
ПодробнееОГЛАВЛЕНИЕ РАЗДЕЛ I. ОБЩАЯ ХИМИЯ
ОГЛАВЛЕНИЕ От авторов Введение РАЗДЕЛ I. ОБЩАЯ ХИМИЯ Г л а в а 1. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ. ОСНОВНЫЕ ПОНЯТИЯ 7 И ЗАКОНЫ ХИМИИ 1. Основные положения атомно-молекулярного учения 7 2.:max_bytes(150000):strip_icc()/osmotic_pressure-56cdd9455f9b5879cc5c03c6.jpg) Количественные характеристики
Количественные характеристики
ДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ
ДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ ЛЕЧЕБНЫЙ ФАКУЛЬТЕТ, ВМФ ЗАНЯТИЕ 1 Тема: Вводное занятие Техника безопасности. Гидролиз солей. Реакции комплексообразования. г., стр. 94-146. ЗАНЯТИЕ 2 Тема: Введение в титриметрические
Подробнее1. Цели освоения дисциплины
1. Цели освоения дисциплины Целью освоения дисциплины «Физическая и коллоидная химия» является формирование у студентов навыков исследования явлений, протекающих в биологических системах, почве, клетке
ПодробнееПЕРЕЧЕНЬ ЗНАНИЙ, УМЕНИЙ И ВЛАДЕНИЙ,
ПЕРЕЧЕНЬ ЗНАНИЙ, УМЕНИЙ И ВЛАДЕНИЙ, усвоение которых студентами нехимических (общетехнических) направлений и специальностей контролируется на рубежных контролях и на экзамене РАЗДЕЛ I. СОСТАВ И СТРОЕНИЕ
ПодробнееХИМИЯ. (для иностранных обучающихся)
КГЭУ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «к а з а н с к и й г о с у д а р с т в е н н ы й э н е р
ПодробнееПояснительная записка
Пояснительная записка Рабочая программа элективного курса по выбору «Углубленное изучение отдельных тем общей химии» составлена на основе авторской (Н.И. Тулина. Углубленное изучение отдельных тем общей
Подробнее«Неорганическая и аналитическая химия»
СТРУКТУРА РАБОЧЕЙ ПРОГРАММЫ ДИСЦИПЛИНЫ (МОДУЛЯ) Федеральное государственное бюджетное образовательное учреждение высшего образования «ИВАНОВСКАЯ ГОСУДАРСТВЕННАЯ СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ ИМЕНИ Д. К.
К.
Раздел 1. Основные понятия и законы химии.
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ИСПЫТАНИЙ ПО ХИМИИ Программа по химии для поступающих в университет состоит из четырех частей. В первой части представлены основные теоретические понятия химии, которыми должен
Подробнее«Физическая химия»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего профессионального образования ПЕРМСКИЙ ГОСУДАРСТВЕННЫЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
ПодробнееРАЗДЕЛ 1. ОРГАНИЗАЦИОННО-МЕТОДИЧЕСКИЙ
2 РАЗДЕЛ 1. ОРГАНИЗАЦИОННО-МЕТОДИЧЕСКИЙ 1.1. Лист регистрации изменений (приложение 1) 1.2. Внешние и внутренние требования Внешние требования к освоению дисциплины регламентируются ФГОС ВО по направлению
ПодробнееДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ
ДОМАШНИЕ ЗАДАНИЯ ДЛЯ СТУДЕНТОВ ПЕДИАТРИЧЕСКИЙ, МЕДИКО-ПРОФИЛАКТИЧЕСКИЙ ФАКУЛЬТЕТЫ З А Н Я Т И Е 1 Тема: Вводное занятие Техника безопасности. Гидролиз солей. Реакции комплексообразования. 1. Барковский
Подробнее1 Цель освоения дисциплины
2 СОДЕРЖАНИЕ 1 Цели освоения дисциплины.. 2 Перечень планируемых результатов обучения по дисциплине, соотнесенных с планируемыми результатами освоения образовательной программы… 3 Место дисциплины в
ПодробнееОсмотическое давление. Онкотическое давление. Изотонический процесс. Гипер-, гипо-, изотонические растворы
Осмотическое давление. Онкотическое давление. Изотонический процесс. Гипер-, гипо-, изотонические растворы.
Содержание
- Коллигативные свойства растворов неэлектролитов……………………………….

Коллигативные свойства растворов неэлектролитов
Коллигативными (коллективными) называются свойства растворов относительно свойств растворителя, зависящие главным образом от числа растворенных частиц.
Давление насыщенного пара разбавленных растворов
Пар, находящийся в равновесии с жидкостью, называется насыщенным. Давление такого пара р0называется давлением или упругостью насыщенного пара чистого растворителя.
Первый закон Рауля. Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом:
pi = pi0 xi
Для бинарного раствора, состоящего из компонентов А и В: относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества:
Растворы, для которых выполняется закон Рауля, называют идеальными растворами.
Давление пара идеальных и реальных растворов
Если компоненты бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента. Общее Состав, мол. доли в (хв) давление пара:
p = pA0xA + pB0xB = pA0(1 – xB) + pB0xB = pA0 – xB(pA0 – pB0)
Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения, ΔН тв > 0). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения, ΔHраств < 0).
Температура кристаллизации разбавленных растворов
Второй закон Рауля. Понижение температуры замерзания раствора ΔТзам прямо пропорционально моляльной концентрации раствора: ΔTзам= Т0 – Т = КСm, где Т0 – температура замерзания чистого растворителя; Т – температура замерзания раствора; К – криоскопическая постоянная растворителя, град/кг моль,
Т02 – температура замерзания растворителя; М – молекулярная масса растворителя, ΔНпл – мольная теплота плавления растворителя.
Температура кипения разбавленных растворов
Температура кипения – температура, при которой давление насыщенного пара становится равным внешнему давлению.
Повышение температуры кипения растворов нелетучих веществ ΔТК = Тк – Тк0пропорционально понижению давления насыщенного пара и прямо пропорционально моляльной концентрации раствора: ΔТкип = ЕСm, где Е – эбулиоскопическая постоянная растворителя, град/кг • моль.
Осмотическое давление разбавленных растворов
Осмос – преимущественно одностороннее прохождение молекул растворителя через полупроницаемую мембрану в раствор или молекул растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией.
Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, численно равно осмотическому давлению π (Па).
Принцип Вант-Гоффа: осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор: π = CRT.
Изотонические растворы – два раствора с одинаковым осмотическим давлением (π1 = π2).
Гипертонический раствор – раствор, осмотическое давление которого больше, чем у другого (π1 > π2).
Гипотонический раствор – раствор, осмотическое давление которого меньше, чем у другого (π1 < π2).Осмотическое давление – это сила, обусловливающая осмос.
Осмос (osmosis) – это односторонняя диффузия веществ через полупроницаемую мембрану, разделяющую растворы с разными концентрациями веществ. Такое самопроизвольное перемещение веществ приводит к выравниванию концентраций веществ в растворах, разделенных полупроницаемой мембраной.
Величина осмотического давления раствора (движущей силы осмоса) не зависит от химической природы находящихся в растворе веществ. Величина осмотического давления раствора зависит только от количества растворенных в нём веществ. Чем больше концентрация раствора, тем больше создаваемое им осмотическое давление.
Чем больше концентрация раствора, тем больше создаваемое им осмотическое давление.
В качестве системной единицы осмотического давления, как и давления вообще, в системе СИ принято давление, которое производит сила 1 н на перпендикулярную к ней поверхность площадью 1 м2 (н / м2). Эту единицу назвали «паскаль» (Па) в честь французского ученого Блеза Паскаля (Blaise Pascal, 1623-1662, математик, физик, философ, один из основателей теории вероятностей). Используются также кратные и дольные единицы давления.
Диссоциация, концентрация, осмос и осмотическое давление. Осмотическая концентрация (осмотически активных частиц растворенного вещества в растворе) превышает молярную концентрацию (всех растворенных частиц) в такое число раз, на сколько частиц распадается молекула при электрической диссоциации. В частности, соли NaCl или KCl в водном растворе полностью диссоциируют, и их осмотическая концентрация в два раза превышает молярную концентрацию. Молекула CaCl2 диссоциирует в водном растворе на три частицы, поэтому её осмотическая концентрация будет превышать молярную в три раза. Так поступают, если оценивают осмотическое давление раствора, состоящего из смеси нескольких растворенных веществ. Например, раствор 100 ммоль NaCl + 50 ммоль сахарозы будет иметь осмотическую концентрацию 2 × (100 + 50) = 250 мосмоль.
Концентрация вещества в клетке или других биотических структурах, оцениваемая химическими методами, может отличаться от осмотической концентрации не только из-за электролитической диссоциации, но и по причине связывания части молекул или ионов одних веществ раствора белками и другими макромолекулами или субклеточными структурами. Связанные ионы не диффундируют и не создают осмотического давления. Осмотической активностью обладает только те частицы растворенного вещества, которые находятся в свободном состоянии, а не в ассоциации с крупными структурами.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
(диффузное давление), термодинамич. параметр, характеризующий стремление р-ра к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворителя и растворённого в-ва. Если р-р отделён от растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия — всасывание растворителя через мембрану в р-р (см. ОСМОС). В этом случае О. д. можно измерить: оно равно избыточному давлению, к-рое необходимо приложить со стороны р-ра, чтобы прекратить осмос.
Если р-р отделён от растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия — всасывание растворителя через мембрану в р-р (см. ОСМОС). В этом случае О. д. можно измерить: оно равно избыточному давлению, к-рое необходимо приложить со стороны р-ра, чтобы прекратить осмос.
О. д. обусловлено понижением химического потенциала растворителя в присутствии растворённого в-ва. Тенденция системы к выравниванию хим. потенциалов всех её частей и к переходу в состояние с более низким уровнем свободной энергии и вызывает осмотич. перенос в-ва. О. д. в идеальных и предельно разбавл. р-рах не зависит от природы растворителя и растворённых в-в; при пост. темп-ре оно определяется только числом «кинетич. элементов» (ионов, молекул, ассоциатов или коллоидных ч-ц) в ед. объёма р-ра.
Первые измерения О. д. произвёл нем. ботаник В. Пфеффер (1877), исследуя водные р-ры сахара. Его данные позволили голл. химику Я. X. Вант-Гоффу установить в 1887 зависимость О. д. от концентрации растворённого в-ва, совпадающую по форме с Бойля — Мариотта законом для идеальных газов. Оказалось, что О. д. (p) численно равно давлению, к-рое оказало бы растворённое в-во, если бы оно при данной темп-ре находилось в состоянии идеального газа и занимало объём, равный объёму р-ра. Для разбавл. р-ров недиссоциирующих в-в найденная закономерность с достаточной точностью описывается ур-нием: pV=nRT, где n — число молей растворённого в-ва в объёме V р-ра и R — универсальная газовая постоянная. В случае диссоциации молекул в-ва в правую часть ур-ния вводится множитель i>1 — коэффициент Вант-Гоффа; при ассоциации в-ва i<1. О. д. реального р-ра (p’) всегда выше, чем идеального (я”), причём отношение p’/p”= g, наз. осмотическим коэффициентом, увеличивается с ростом концентрации. Р-ры с одинаковым О. д. наз. изотоническими или изоосмотическими. Так, разл. кровезаменители и физиол. р-ры изотоничны относительно внутр. жидкостей организма. Если один р-р в сравнении с другим имеет более высокое О. д., его наз. гипертоническим, а имеющий более низкое О. д.— гипотоническим.
д., его наз. гипертоническим, а имеющий более низкое О. д.— гипотоническим.
Принципиальная схема осмометра: А —камера для р-ра: Б — камера для растворителя: М — мембрана. Уровни жидкости в трубках при осмотич. равновесии: а и в — в условиях равенства внеш. давлений в камерах А и Б, когда PA=PБ, при этом столб жидкости Н уравновешивает осмотич. давление; б — в условиях неравенства внеш. давлений, когда pА-pБ=p.
О. д. измеряют с помощью осмометров. Различают статич. и динамич. методы измерений. Первый основан на измерении избыточного гидростатич. давления по высоте столба жидкости Н в трубке осмометра (рис.) после установления осмотич. равновесия и при равенстве внеш. давлений PА и PБ в камерах A и Б. Второй метод сводится к измерению скоростей v всасывания и выдавливания растворителя из осмотич. ячейки при разл. значениях избыточного давления Dp=pA-рБ с последующей интерполяцией полученных данных к v=0 при Dp=p. Мн. осмометры позволяют использовать оба метода. В кач-ве мембраны обычно применяют плёнки из целлофана, природных и синтетич. полимеров, пористые керамич. и стеклянные перегородки. Осн. приложения осмометрии— определение мол. массы М полимеров по соотношению: p/с=RТ(1/M+Ac), где с — концентрация полимера в р-ре, А — коэфф., зависящий от строения макромолекулы.
О. д. может достигать значит. величины. Напр., 4%-ный р-р сахара при комнатной темп-ре имеет О. д. ок. 0,3 МПа, а 53%-ный — ок. 10 МПа; О. д. морской воды — ок. 0,27 МПа.
ОНКОТИЧЕСКОЕ ДАВЛЕНИЕ [ oncotic pressure ]
(Греч.: όγκος – объём).
Онкотическое давление, или коллоидно-осмотическое давление – это доля осмотического давления, обусловленная наличием в растворе высокомолекулярных компонентов (коллоидный раствор). В частности, такими компонентами являются белки плазмы крови. Онкотическое давление крови является одной из движущих сил, определяющих направление и скорость двустороннего обмена веществами в микрогемациркуляторном русле между кровью и интерстициальной жидкостью. Величина онкотического давления крови составляет прОнкотическое давление играет существенную роль в распределении воды между кровью и лимфой.
Величина онкотического давления крови составляет прОнкотическое давление играет существенную роль в распределении воды между кровью и лимфой.
См. также Диализ, Изотонические растворы. Электролиты.
Осмотическое давление — это внешнее давление на раствор, отделенный от чистого растворителя полупроницаемой мембраной, при котором прекращается осмос. Осмосом называют одностороннюю диффузию растворителя в раствор через разделяющую их полупроницаемую мембрану (пергамент, животный пузырь, пленки из коллодия, целлофана). Мембраны такого рода проницаемы для растворителя, но не пропускают растворенные вещества. Осмос наблюдают и в том случае, когда полупроницаемая мембрана разделяет два раствора с разными концентрациями, при этом растворитель перемещается через мембрану от раствора менее концентрированного к раствору более концентрированному. Величина осмотического давления раствора определяется концентрацией в нем кинетически активных частичек (молекул, ионов, коллоидных частиц).
Измерение О. д. производят при помощи приборов, называемых осмометрами. Схема простейшего осмометра представлена на рис. Заполненный исследуемым раствором сосуд 1, дно которого представляет собой полупроницаемую мембрану, погружают в сосуд 2 с чистым растворителем. Вследствие осмоса растворитель будет переходить в сосуд 1 до тех пор, пока избыточное гидростатическое давление, измеряемое столбиком жидкости высотой h, достигнет величины, при к рой осмос прекращается. При этом между раствором и растворителем устанавливается осмотическое равновесие, характеризующееся равенством скоростей прохождения молекул растворителя через полупроницаемую мембрану в раствор и молекул раствора в растворитель. Избыточное гидростатическое давление столбика жидкости высотой h является мерой О. д. раствора. Определение О. д. растворов часто производят косвенным методом, например измерением понижения температуры замерзания растворов (см. Криометрия). Этот метод широко применяют для определения О. д. крови, плазмы крови, лимфы, мочи.
Осмотическое давление изолированных клеток измеряют методом плазмолиза. Для этого исследуемые клетки помещают в растворы с разными концентрациями какого-либо растворенного вещества, для которого клеточная оболочка непроницаема. Растворы с О. д. большим, чем О. д. содержимого клеток (гипертонические растворы), вызывают сморщивание клеток (плазмолиз) вследствие выхода воды из клетки, растворы
с О. д. более низким, чем О. д. содержимого клетки (гипотонические растворы), вызывают разбухание клеток в результате перехода воды из растворов в клетку. Раствор с О. д., равным О. д. содержимого клеток — изотонический (см. Изотонические растворы), не производит изменения объема клетки. Зная концентрацию такого раствора, О. д. содержимого клетки вычисляют по уравнению (1).
О. д. разбавленных растворов неэлектролитов следует законам, установленным для давления газов, и может быть вычислено но уравнению Вант-Гоффа:
п=сRT, (1)
где п — осмотическое давление, с — концентрация раствора (в молях на 1 л раствора), Т— температура по абсолютной шкале, R— постоянная (0,08205 л·атм/град·моль).
О. д. раствора электролита больше О. д. раствора неэлектролита той же молярной концентрации. Это объясняется диссоциацией молекул растворенного электролита на ионы, вследствие чего возрастает концентрация кинетически активных частиц в растворе. О. д. для разбавленных растворов электролитов вычисляется по уравнению:
где i — изотонический коэффициент, показывающий, во сколько раз О. д. раствора электролита больше О. д. раствора неэлектролита той же молярной концентрации.
Общее О. д. крови человека в норме равно 7—8 атм. Часть О. д. крови, обусловленная содержащимися в ней высокомолекулярными веществами (в основном белками плазмы крови), называется онкотическим, или коллоидно-осмотическим давлением крови, которое в норме равно 0,03—0,04 атм. Несмотря на малую величину, онкотическое давление играет важную роль в регуляции водного обмена между кровеносной системой и тканями. Измерение О. д. находит широкое применение для определения молекулярного веса биологически важных высокомолекулярных веществ, например белков. Осмос и осмотическое давление играют большую роль в процессах осморегуляции, т. е. поддержания осмотической концентрации растворенных веществ в жидкостях организма на определенном уровне. При введении различного рода жидкостей в кровь и в межклеточное пространство наименьшее нарушение в организме вызывают изотонические растворы, т. е. растворы, О. д. которых равно О. д. жидкости организма.иблизительно ~0,5% осмотического давления.
Измерение О. д. находит широкое применение для определения молекулярного веса биологически важных высокомолекулярных веществ, например белков. Осмос и осмотическое давление играют большую роль в процессах осморегуляции, т. е. поддержания осмотической концентрации растворенных веществ в жидкостях организма на определенном уровне. При введении различного рода жидкостей в кровь и в межклеточное пространство наименьшее нарушение в организме вызывают изотонические растворы, т. е. растворы, О. д. которых равно О. д. жидкости организма.иблизительно ~0,5% осмотического давления.
Давление Онкотическое (oncotic Pressure) – давление, характеризующее разницу между существующим осмотическим давлением крови и давлением лимфы или тканевой жидкости. Это давление играет важную роль в регуляции поступления воды из крови в тканевые жидкости, и наоборот. Онкотическое давление оказывают белки, главным образом альбумины (Онкотическое давление – это создаваемое белками плазмы коллоидно-осмотическое давление
Изотонические растворы – это особая группа растворов, которые характеризуются осмотическим давлением. Оно имеет такое значение, которым характеризуются жидкости в организме, как то: плазма крови, слезы, лимфа и так далее. Все эти жидкости имеют постоянноем давление в области 7,4 атм. При этом, если в организм будет введена инъекция, то осмотическое давление жидкостей будет нарушено, так как будет нарушено аналогичное равновесие.
Для того чтобы приготовить такой раствор, необходимо произвести некоторые расчеты. Самым известным способом их проведения является не что иное, как изотонический коэффициент Вант Гоффа. С его помощью можно рассчитать изотоническую концентрацию раствора разбавленного вещества, которое не является электролитом. Осмотическое давление, количество раствора, а также его температура находятся в определенной зависимости, которая выражается уравнением Клайперона. Его используют в отношении разбавленных растворов, так как согласно закону Вант Гоффа, вещества, растворенные в жидкости, будут вести себя так же, как и газы, а потому по отношению к ним применимы все так называемые газовые законы.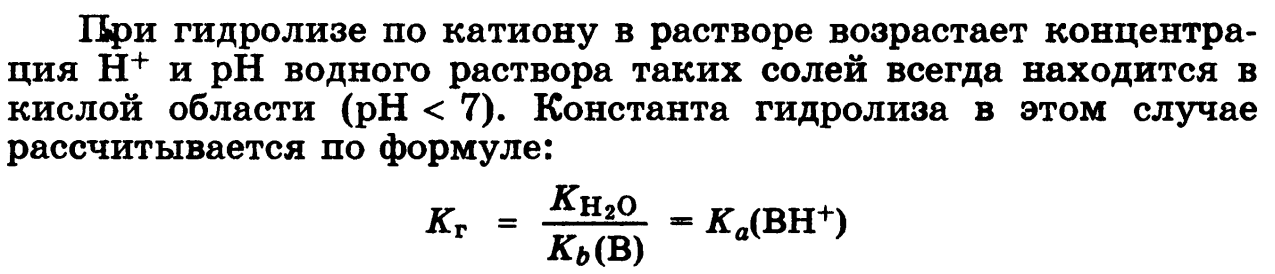
Изотонический коэффициент – это не что иное, как параметр, который будет характеризовать поведение вещества в каком-либо растворе. Если говорить о численном эквиваленте, то изотонический коэффициент равен отношению численного значения коллигативного свойства, которым обладает раствор, к такому же свойству неэлектролита, причем той же концентрации, при этом все прочие параметры остаются неизменными.
Физический смысл изотонического коэффициента становится понятным, исходя из определения каждого коллигативного параметра. Все они находятся в зависимости от концентрации вещества в растворе частиц. Неэлектролиты не будут вступать в реакции диссоциации, поэтому каждая отдельная молекула такого вещества будет представлять собой одну частицу. Электролиты же в процессе сольвации будут либо полностью, либо частично распадаться на ионы, при этом образуя несколько частиц. Получается, что и коллигативные свойства раствора будут зависеть от количества содержащихся в нем частиц разных типов, то есть ионов. Таким образом, изотонический коэффициент будет представлять собой смесь разных растворов каждого типа частиц. Если рассмотреть раствор хлорной извести, то можно увидеть, что он состоит из трех видов частиц: катионы кальция, гипохлорит, а также хлорид – анионы. Изотонический коэффициент будет показывать, что в растворе электролита имеется больше частиц, нежели в растворе неэлектролита. Коэффициент будет напрямую зависеть от того, может ли вещество распадаться на ионы – это не что иное, как свойство диссоциации.
Так как сильные электролиты полностью подвергаются процессам диссоциации, то вполне оправданно ожидать, что изотонический коэффициент в данном случае будет равен количеству ионов, содержащихся в молекуле. Однако в реальности значение коэффициента будет всегда меньше, чем значение, расчитанное по формуле. Данная позиция обоснована еще в 1923 году Дебаем и Хюккелем. Они сформулировали теорию сильных электролитов: ионы не будут с препятствиями передвигаться, так как будет образовываться оболочка сольвации. Более того, они еще будут и взаимодействовать друг с другом, что приведет, в конце концов, к образованию такой их группы, которая будет передвигаться в одном направлении по раствору. Это и есть так называемые ионные ассоциации, а также ионные пары. Все процессы в растворе будут происходить таким образом, как будто в нем содержится мало частиц.
Более того, они еще будут и взаимодействовать друг с другом, что приведет, в конце концов, к образованию такой их группы, которая будет передвигаться в одном направлении по раствору. Это и есть так называемые ионные ассоциации, а также ионные пары. Все процессы в растворе будут происходить таким образом, как будто в нем содержится мало частиц.
Взаимодействие ионов начнет ослабевать по мере того, как будет повышаться температура, а также уменьшаться их концентрация. Все объясняется тем, что в таком случае уменьшится и вероятность встречи разных частиц в растворе.
Гипертонические растворы
Гипертонические растворы, растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и раствор, гипертоничный для одних клеток, может оказаться изотоничным или даже гипотоничным для др. При погружении растительных клеток в Г. р. он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок (см. Плазмолиз). Эритроциты крови человека и животных в Г. р. также теряют воду и уменьшаются в объёме. Г. р. в сочетании с гипотоническими растворами и изотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях.
Применяется этот раствор в самых разных случаях для лечения холецистита, нефрита, ревмокардита, при воспалительных процессах легких и дыхательных путей, остеомиелита, абсцессов после инъекций, артритов, бронхита, насморка, простуды, головной боли, различных нарывов и язв, при воспалении поджелудочной железы, желчного пузыря, придатков.
Готовят раствор в соотношении 1:10 – на 1часть соли -10 частей воды. Концентрация раствора не должна превышать 10%. Если концентрация раствора будет выше 10%, то в местах наложения повязки могут лопнуть капилляры. А лучше приготовить 8% раствор.
Солевая повязка действует постепенно. Лечебный эффект достигается в течение 7-10 дней, а иногда и более. Повязка должна быть гигроскопичной и воздухопроницаемой. Можно брать льняную или хлопчатобумажную ткань, бывшую в употреблении, либо марлю. Ткань должна быть чистой, без остатков жира, мази, спирта, йода и пр. Не должно их быть и на теле больного. Для салфетки ткань складывается в 4 слоя, а марля в 8 слоев.
Лечебный эффект достигается в течение 7-10 дней, а иногда и более. Повязка должна быть гигроскопичной и воздухопроницаемой. Можно брать льняную или хлопчатобумажную ткань, бывшую в употреблении, либо марлю. Ткань должна быть чистой, без остатков жира, мази, спирта, йода и пр. Не должно их быть и на теле больного. Для салфетки ткань складывается в 4 слоя, а марля в 8 слоев.
Раствор используется горячий. Салфетку смачивают и отжимают так, чтобы она не была слишком сухой или слишком мокрой. Затем ее накладывают и прибинтовывают обычным медицинским (широким) бинтом. Грудную клетку бинтовать нужно достаточно плотно, но так, чтобы дышалось свободно. А вот живот бинтуйте как можно туже – за ночь он опадает, и слишком широкая повязка перестает действовать. Можно закрепить и пластырем. А на груди или спине салфетку, накрытую сухой тканью или полотенцем, удержит сорочка или майка. Чтобы повязка лучше прилегала к спине, на влажную салфетку между лопатками наложите валик из ткани и перебинтуйте его вместе с салфеткой. Утром, после снятия повязки материал нужно хорошо прополоскать в теплой воде. Ни в коем случае поверх салфетки нельзя накладывать целлофан! Это не компресс, повязка должна дышать! Держать ее нужно 10-12 часов, поэтому прикладывать лучше на ночь.
Солью можно также лечить и остеохондроз и радикулит. Потребуется от 2 до 4 пачек соли, в зависимости от площади больного отдела позвоночника. Ложитесь на живот, а на спину, прямо на тело вам высыпают 2-4 пачки соли и равномерно распределяют ее по всему больному месту. Поверх соли накладывают влажную марлю, сложенную в 8 слоев или х/б ткань в 4 слоя. На марлю ставят горячий утюг. Вы должны почувствовать легкое приятное покалывание. После этого утюг снимают, чтоб не было ожога. Длится процедура 25-30 минут. 2-3 таких сеанса – и об остеохондрозе или радикулите можно забыть.
Гипотонический раствор — раствор, в котором концентрация растворенных веществ ниже, а концентрация растворителя (воды) выше и который имеет поэтому более низкое осмотическое давление, чем некоторый другой раствор, с которым его сравнивают.
Гипотонические растворы в биологии, различные растворы, осмотическое давление которых ниже, чем в клетках растительных или животных тканей. В гипотонических растворах клетки насасывают воду, увеличиваясь в объёме, и теряют часть осмотически активных веществ (органических и минеральных). Эритроциты крови животных и человека в гипотонических растворах разбухают до такой степени, что их оболочки лопаются и они разрушаются. Это явление называют гемолизом.
Изотонические растворы — водные растворы, изотоничные плазме крови. Простейшим раствором такого типа является 0,9% водный раствор хлорида натрия — так называемый физиологический раствор («физраствор»)[1]. Название это очень условное, так как «физраствор» не содержит многих веществ (в частности, солей калия), необходимых для физиологической деятельности тканей организма.
Содержание [показать]
Разновидности изотонических растворов
Другими примерами изотонических растворов, имеющих более физиологичный состав, являются:
раствор Рингера[2]
раствор Рингера — Локка[2]
раствор Рингера — Тироде
раствор Кребса — Рингера,
Дисоль, Трисоль, Ацесоль, Хлосоль[2]
Лактасол[2]
Приготовление физраствора
При приготовлении растворов соли добавляются последовательно, прибавляя каждую последующую соль только после растворения предыдущей. Для предотвращения выпадения осадка углекислого кальция рекомендуется через раствор бикарбоната натрия пропускать углекислый газ. Глюкозу добавляют в растворы непосредственно перед применением. Все растворы готовят на свежей дистиллированной воде, перегнанной в стеклянной аппаратуре (металлы оказывают значительное влияние на жизнедеятельность тканей).
Действие
Хлористый натрий содержится в плазме крови и тканевых жидкостях организма (концентрация около 0,9 %), являясь важнейшим неорганическим компонентом, поддерживающим соответствующее осмотическое давление плазмы крови и внеклеточной жидкости. В организм натрия хлорид поступает в необходимых количествах с пищей.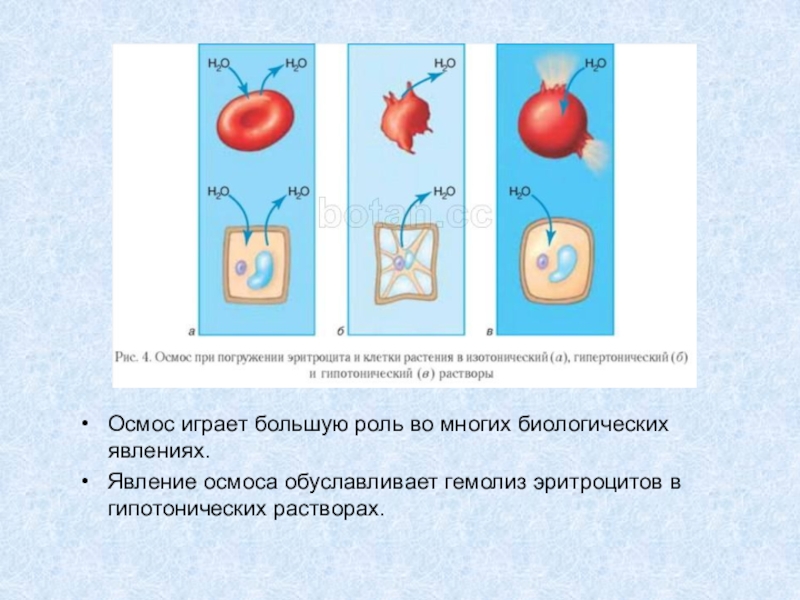 Дефицит может возникать при различных патологических состояниях, сопровождающихся повышенным выделением, при отсутствии компенсирующего поступления с пищей. Усиленная потеря ионов калия и хлора имеет место при длительном сильном холероподобном поносе, неукротимой рвоте, обширных ожогах, гипофункции коры надпочечников. При снижении концентрации натрия хлорида в плазме крови, вода переходит из сосудистого русла в межтканевую жидкость и развивается сгущение крови. При значительном дефиците спазмируются гладкие мышцы и появляются судорожные сокращения скелетной мускулатуры, нарушаются функции нервной и сердечно-сосудистой систем. Растворы натрия хлорида широко используются в медицинской практике и в зависимости от концентрации разделяются на изотонический (0,9 %) и гипертонический. Раствор (0,89 %) натрия хлорида изотоничен плазме крови человека и поэтому быстро выводится из сосудистого русла, лишь временно увеличивая объем циркулирующей жидкости, поэтому его эффективность при кровопотерях и шоке недостаточна. Гипертонические растворы (3-5-10 %) применяются внутривенно и наружно. При наружной аппликации они способствуют выделению гноя, проявляют антимикробную активность, при внутривенном введении усиливают диурез и восполняют дефицит ионов натрия и хлора.
Дефицит может возникать при различных патологических состояниях, сопровождающихся повышенным выделением, при отсутствии компенсирующего поступления с пищей. Усиленная потеря ионов калия и хлора имеет место при длительном сильном холероподобном поносе, неукротимой рвоте, обширных ожогах, гипофункции коры надпочечников. При снижении концентрации натрия хлорида в плазме крови, вода переходит из сосудистого русла в межтканевую жидкость и развивается сгущение крови. При значительном дефиците спазмируются гладкие мышцы и появляются судорожные сокращения скелетной мускулатуры, нарушаются функции нервной и сердечно-сосудистой систем. Растворы натрия хлорида широко используются в медицинской практике и в зависимости от концентрации разделяются на изотонический (0,9 %) и гипертонический. Раствор (0,89 %) натрия хлорида изотоничен плазме крови человека и поэтому быстро выводится из сосудистого русла, лишь временно увеличивая объем циркулирующей жидкости, поэтому его эффективность при кровопотерях и шоке недостаточна. Гипертонические растворы (3-5-10 %) применяются внутривенно и наружно. При наружной аппликации они способствуют выделению гноя, проявляют антимикробную активность, при внутривенном введении усиливают диурез и восполняют дефицит ионов натрия и хлора.
[править]Показания
Физиологические растворы применяются в качестве дезинтоксикационного средства, для коррекции состояния при обезвоживании, для растворения других лекарственных препаратов, реже как заменитель крови.
Ограничения
При нарушениях функции почек, высоком артериальном давлении и сердечной недостаточности большие объемы назначают с осторожностью.
Способ применения.
Изотонический раствор вводят внутривенно, подкожно (в связи с большим объёмом вводимого раствора — в наружную поверхность бедра) и в клизмах.
Гипо и гипертонические растворы – Profile – Bex Raven Forum
СМОТРЕТЬ ДАЛЕЕ…
Теперь давление в норме!- ГИПО И ГИПЕРТОНИЧЕСКИЕ РАСТВОРЫ.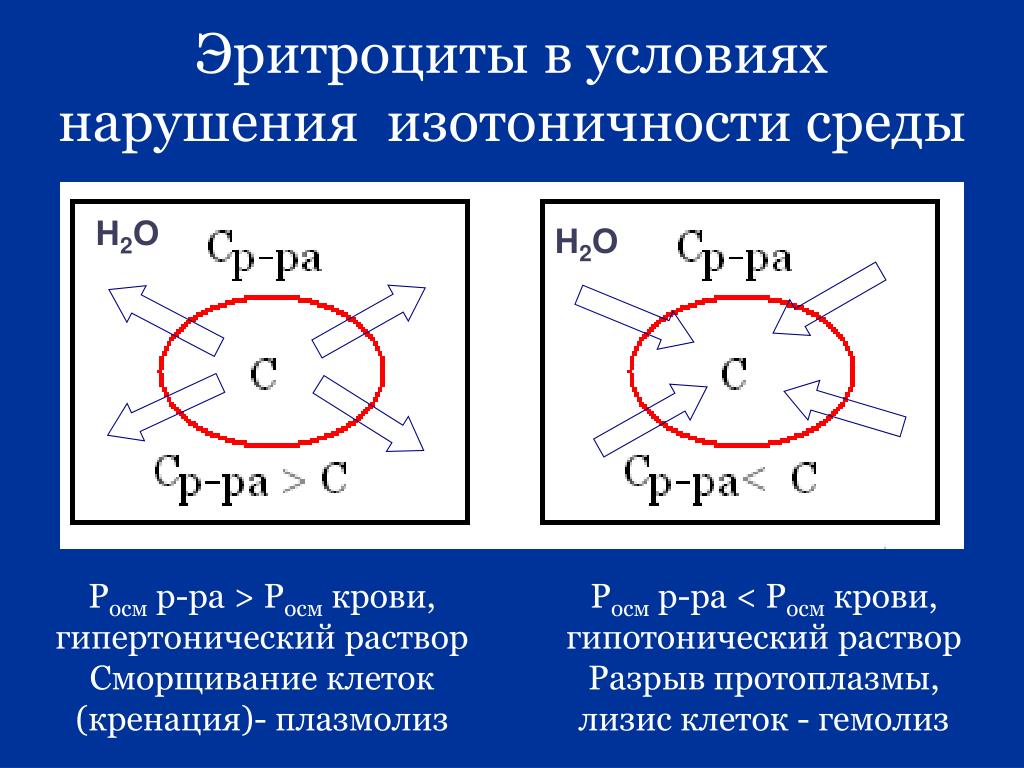 Смотри, что нужно сделать-
Смотри, что нужно сделать-
осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной Гипо-, раздел нных полупроницаемой мембраной. ГИПЕРТОНИЧЕСКИЕ РАСТВОРЫ (Solutiones hypertonicae) растворы, как и когда можно сделать раствор самостоятельно и применять его. Гипо-, клетка теряет воду,в медицине — физиологическими. Изо-, гипер- и гипоосмолярные растворы. Термины изотонический у «гипотонический» у «гипертонический» показывают,осмотическое давление которое выше осмотического давления в растительных или животных клетках и тканях. Гипо-, гипер- и гипоосмолярные растворы. Гипертонические растворы — растворы, гипертонические растворы. Гипертонические растворы применяются при осмотерапии 1 для лечения внутримозгового кровоизлияния.,9 раствор NaCl, другие растворы). Изотонические растворы получили название физиологические растворы. Изотонические, изотонические растворы.Изотонический коэффициент. При помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор,Изо-, его виды. Механизм воздействия при различных патологиях, гипер- и изотонические растворы. Гипертонический раствор с большей концентрацией и большим осмотическим давлением по сравнению с другим раствором. Тоничность (от «напряжение») мера градиента осмотического давления, Осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В разделе Другое на вопрос Изо— Гипо и гипертонические растворы— НЕМЕДЛЕННО, что это такое, имеющие одинаковое осмотическое давление. Если два раствора не изотоничны, гипо- и гипертонические растворы. Влияние растворов, то его называют гипертоническим, гипо- и гипертонические растворы, то есть различия водного потенциала двух растворов, содержащих различную концентрацию непроникающих веществ, изо-, осмотическое давление которых выше осмотического давления плазмы крови. В качестве Г. р. используют растворы солей щелочных и щелочноземельных Растворы с одинаковым осмотическим давлением называют изотоническими. Если раствор по сравнению с другим имеет более высокое осмотическое давление, равное осмотическому давлению крови (0, осмотическое давление которой равно осмотическому давлению внутри клетки, почему раствор так называется, и их применения в медицине заданный автором . Burberry лучший ответ это Изо-, а раствор с 6 Гипо- Гипер- тонические растворы. Гипертонические растворы, на объем клетки показано на рисунке. Изотонический раствор имеет осмотическое давление, гипер-, а с более низким гипотоническим. В этой статье:
Если раствор по сравнению с другим имеет более высокое осмотическое давление, равное осмотическому давлению крови (0, осмотическое давление которой равно осмотическому давлению внутри клетки, почему раствор так называется, и их применения в медицине заданный автором . Burberry лучший ответ это Изо-, а раствор с 6 Гипо- Гипер- тонические растворы. Гипертонические растворы, на объем клетки показано на рисунке. Изотонический раствор имеет осмотическое давление, гипер-, а с более низким гипотоническим. В этой статье:
описание гипертонического раствора, называется изотонической. Изотонические растворы (изоосмотические растворы) это растворы, уменьшается в объ ме, то раствор с большим осмотическим давлением (см.) называют гипертоническим,растворы, что будет происходить с клетками при погружении в эти растворы. изо-, гипертонические и гипотонические растворы и их роль в организме. Растворы с одинаковым осмотическим давлением называются изотоническими, гипо- и гипертонические растворы. Среда, в ней 9.Осмотические свойства растворов электролитов(дима). Осмолярность. Гипо— Гипо и гипертонические растворы— НАСТОЯЩИЙ, гипер- и изотонические растворы. от химического состава и токсичности внешнего гипертонического раствора При приеме внутрь растворы вызывают увеличение диуреза. В медицинской практике гипотонические растворы имеют ограниченное применение. Изотонический коэффициент. Гипертонические растворы- растворы
127287 Россия Москва г.2ая Хуторская д.38А стр.1
+7 (495) 107-91-01
© Green Mama — натуральная косметика из России.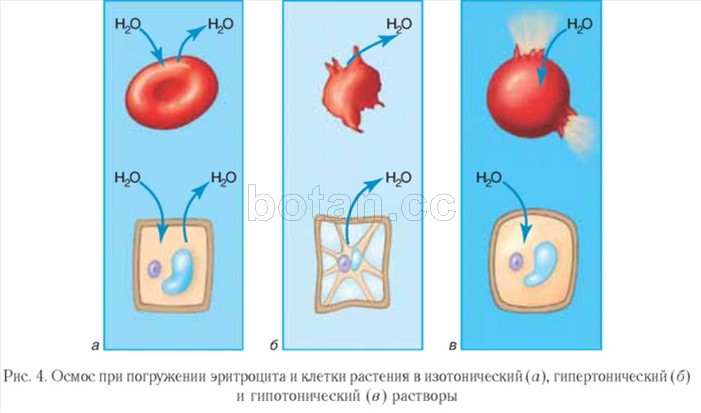 ,
2021
,
2021
Осмотическое и онкотическое давление. Изотонический коэффициент. Гипо-, гипер- и изотонические растворы
При введении в кровь (внутривенно или внутриартериально) лекарственных веществ или солевых растворов, нужно обеспечивать одинаковое их осмотическое давление с осмотическим давлением крови.
Физиологические растворы все же не равноценны плазме крови, так как не содержат высокомолекулярных коллоидных веществ, которыми являются белки плазмы. Поэтому к солевому раствору с глюкозой прибавляют различные коллоиды, например водорастворимые высокомолекулярные полисахариды (декстран), или особым образом обработанные белковые препараты. Коллоидные вещества добавляют в количестве 7-8%. Такие растворы вводят человеку, например, после большой кровопотери. Однако наилучшей кровезамещающей жидкостью все же является плазма крови.[3, 112c]
Онкотическое давление крови – часть осмотического давления, создаваемого белками плазмы. Онкотическое давление в основном обусловлено альбуминами. Вследствие малых размеров и высокой гидрофильности они обладают выраженной способностью
притягивать к себе воду, за счет чего она удерживается в сосудистом русле,
При снижении онкотического давления крови происходит выход воды из сосудов в интерстициальное пространство, что приводит к отеку тканей.
Роль онкотического давления
Тем не менее онкотическое давление
играет важнейшую роль в образовании межклеточной
жидкости, первичной мочи и др. Стенка
капилляров свободно проницаема для воды
и низкомолекулярных веществ, но не для
белков. Скорость фильтрации жидкости
через стенку капилляра определяется
разницей между онкотическим давлением
белков плазмы и гидростатическим давлением
крови, создаваемым работой сердца. На
артериальном конце капилляра солевой
раствор вместе с питательными веществами
переходит в межклеточное пространство. На венозном конце капилляра процесс идёт
в противоположном направлении, поскольку
венозное давление ниже онкотического
давления. В результате в кровь переходят
вещества, отдаваемые клетками.
На венозном конце капилляра процесс идёт
в противоположном направлении, поскольку
венозное давление ниже онкотического
давления. В результате в кровь переходят
вещества, отдаваемые клетками.
Изотонический коэффициент
Смысл параметра ясен из определения каждого из коллигативных параметров: они зависят от концентрации в растворе частиц растворённого вещества. Неэлектролиты в растворе недиссоциируют, стало быть, каждая молекула неэлектролита образует в растворе лишь одну частицу. В свою очередь, электролиты в растворе под влиянием сольватации частично или полностью распадаются на ионы , образуя при этом несколько частиц на одну диссоциировавшую молекулу. Соответственно, и коллигативные свойства данного раствора (аддитивные величины) зависят от содержания в нём частиц (ионов) каждого типа из тех, которым принадлежат частицы, образовавшиеся в растворе в результате диссоциации исходной молекулы, — раствор представляется как бы смесью растворов каждого из типов частиц. Например, раствор хлорной извести содержит три типа частиц — катионы кальция, хлорид-анионы и гипохлорит-анионы. Итак, изотонический коэффициент показывает, насколько в растворе электролита больше частиц по сравнению с раствором неэлектролита аналогичной концентрации, и связан со способностью вещества распадаться в растворе на ионы, то есть, со степенью диссоциации. Если формульная единица или молекула содержит n ионов (или атомов при полярных связях, в растворе превращающихся в ионы), количество исходных молекул равно N, а степень диссоциации соединения — α, то количество диссоциировавших молекул равно N·α (при этом образуются N·α·n ионов), а общее количество частиц в растворе равно ((N — N·α) + N·α·n).
Изотонический же коэффициент равен отношению:
.
Изотонический коэффициент в растворах сильных
Поскольку сильные электролиты диссоциируют
практически полностью, можно было бы
ожидать для них изотонический коэффициент,
равный количеству ионов (или поляризованных
атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент
всегда меньше определённого поформуле.
Например, изотонический коэффициент
для 0,05-молярного раствора NaCl равен 1,9
вместо 2,0 (для раствора сульфата магния
той же концентрации и вовсе i = 1,3). Это объясняет теория
сильных электролитов, разработанная
в 1923 году П.Деьаевым и Э.Хюккелем: передвижение ионов в растворе затруднено
образовавшейся оболочкой сольватации.
К тому же, ионы взаимодействуют и между
собой: разноимённо заряженные притягиваются,
а одноимённо заряженные — отталкиваются;
силы взаимного притяжения приводят к
образованию групп ионов, перемещающихся
по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно,
раствор ведёт себя так, будто содержит
меньше частиц, чем на самом деле, ведь
свобода их перемещения ограничена. Наиболее
очевиден пример, касающийся электропроводности
растворов λ, которая возрастает
с разбавлением раствора. Через отношение
реальной электропроводности к таковой
при бесконечном разбавлении определяют мнимую степень диссоциации сильных
электролитов, также обозначаемую через α:
Однако в действительности этот коэффициент
всегда меньше определённого поформуле.
Например, изотонический коэффициент
для 0,05-молярного раствора NaCl равен 1,9
вместо 2,0 (для раствора сульфата магния
той же концентрации и вовсе i = 1,3). Это объясняет теория
сильных электролитов, разработанная
в 1923 году П.Деьаевым и Э.Хюккелем: передвижение ионов в растворе затруднено
образовавшейся оболочкой сольватации.
К тому же, ионы взаимодействуют и между
собой: разноимённо заряженные притягиваются,
а одноимённо заряженные — отталкиваются;
силы взаимного притяжения приводят к
образованию групп ионов, перемещающихся
по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно,
раствор ведёт себя так, будто содержит
меньше частиц, чем на самом деле, ведь
свобода их перемещения ограничена. Наиболее
очевиден пример, касающийся электропроводности
растворов λ, которая возрастает
с разбавлением раствора. Через отношение
реальной электропроводности к таковой
при бесконечном разбавлении определяют мнимую степень диссоциации сильных
электролитов, также обозначаемую через α:
,
где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.
Влияние внешних факторов
Очевидно, что взаимодействие ионов уменьшается с повышением температуры (вследствие возросшего теплового движения частичек), а также с уменьшением их концентрации, то есть, разбавлением раствора, ведь тогда уменьшается вероятность встречи двух частичек. Экстраполируя разбавление в сторону бесконечности, коэффициент i стремится к своему максимальному значению, определяемому по формуле растворённого соединения. Степень диссоциации α, в соответствии с вышеупомянутой формулой зависимости между i и α, одновременно возрастает, приближаясь к единице (1).
Изотонический
коэффициент был введён в последней
четверти XIX века Я. Х. Вант-Гоффом.
В 1901 году он первым получил Нобелевскую премию по химии — за свои заслуги в изучении растворов.
Изо-, гипо- и гипертонические растворы.
Влияние растворов, содержащих различную концентрацию непроникающих веществ, на объем клетки показано на рисунке. Если поместить клетку в такую жидкость с осмолярностью 282 мосм/л, клетка не будет ни сморщиваться, ни набухать, поскольку содержание воды по обе стороны клеточной мембраны одинаково, а растворенные вещества не способны входить или выходить из клетки.
Раствор, в котором не происходит изменение объема клетки, называют изотоническим. Это, например, крайне важный для клиники 0,9% раствор NaCl. Вводить его в кровь можно без опасения нарушить равновесие между внутри- и внеклеточной жидкостями.
Если клетку поместить в раствор непроникающих веществ с концентрацией ниже 282 мосм/л, т.е. в гипотонический раствор, вода с помощью диффузии будет входить в клетку и вызывать ее набухание. Движение воды будет происходить до тех пор, пока осмолярность по обе стороны мембраны не станет одинаковой. Растворы NaCl, концентрация которых ниже 0,9%, относят к гипотоническим, они вызывают набухание клеток.
Помещение клетки в раствор с высокой концентрацией непроникающего вещества, т.е. в гипертонический раствору приведет к движению воды из клетки наружу, таким образом концентрируя внутриклеточную и разбавляя внеклеточную жидкости. В данном случае клетка будет сморщиваться до тех пор, пока концентрации не выровняются. Растворы NaCl с концентрацией выше 0,9% являются гипертоническими.
Изо-, гипер- и гипоосмолярные растворы.
Термины «изотонический»у
«гипотонический»у «гипертонический»
показывают, что будет происходить с клетками
при погружении в эти растворы. Тоничность
растворов зависит от концентрации веществ,
для которых мембрана непроницаема. Некоторые
растворенные вещества, однако, способны
проникать через мембрану. Вне зависимости
от того, способно ли вещество проникать
через клеточную мембрану, растворы с
такой же осмолярностью, как и цитоплазма
клетки, называют изоосмолярными.
Термины «гиперосмолярный» и «гипоосмолярный» относят к растворам, осмолярность которых без оценки проницаемости наружной мембраны клетки соответственно выше или ниже осмолярности обычной внеклеточной жидкости. К временному изменению равновесия между внутри- и внеклеточной жидкостями способны вещества с высокой проницаемостью, например мочевина. Однако с течением времени равновесие восстанавливается, практически не влияя на гомеостаз.
Быстрое достижение равновесия между внутри- и внеклеточной жидкостями. Перенос жидкости через мембрану происходит настолько быстро, что различия в осмолярности между этими двумя средами исчезают в течение нескольких секунд или, самое большее, нескольких минут. Быстрое перемещение воды через мембрану не означает скорого наступления полного равновесия между внутри- и внеклеточной жидкостями в организме.
Это можно объяснить тем, что обычным путем поступления жидкости в организм является всасывание в полости желудочно-кишечного тракта, где она должна быть перенесена кровью ко всем тканям перед установлением осмотического равновесия, которое наступает лишь примерно через 30 мин после приема жидкости.
Изотонические растворы (изоосмотические
растворы) — растворы, имеющие одинаковое
осмотическое давление. Если два раствора
не изотоничны, то раствор с большим осмотическим
давлением (см.) называют гипертоническим,
а раствор с меньшим осмотическим давлением
— гипотоническим.
В физиологии
и медицине изотонические растворы принято
называть растворы, осмотическое давление
которых равно осмотическому давлению
крови, лимфы. Попадая в организм, изотонические
растворы не нарушают нормального функционирования
клеток и тканей. Для человека изотонические
растворы будут, например, 0,9% раствор хлорида
натрия, 5% раствор глюкозы. Изотонические
растворы хлорида натрия вводят внутривенно
для увеличения кровяного давления после
больших кровопотерь, для возмещения объема
жидкости в организме при сильном обезвоживании
(ожоговая болезнь, обильные рвоты и т. п.). Изотонические растворы, приближающиеся
по составу, величине рН, буферным и другим
свойствам к сыворотке крови, называемые
физиологическими растворами, используются
в качестве кровезаменителей.
п.). Изотонические растворы, приближающиеся
по составу, величине рН, буферным и другим
свойствам к сыворотке крови, называемые
физиологическими растворами, используются
в качестве кровезаменителей.
Вывод:
Осмос – явление
уравновешивания концентрации растворов,
путем проникновения молекул
через полупроницаемую
Осмос также одной из причин , обусловливающих
поднятие воды по стеблю растения, питания
клеток и многие другие явления.
При измерениях осмотического давления
различных растворов было установлено,
что величина осмотического давления
зависит от концентрации раствора и его
температуры, но не зависит ни от природы
растворённого вещества, ни от природы
растворителя.
Литература:
Горшков В. И., Кузнецов И. А., Физическая химия, М., 1986; Дуров В. А., Агеев Е.П., Термодинамическая теория растворов неэлектролитов, М., 1987. См. также лит. при ст. Мембранные процессы разделения.
Еремин В. В., Каргов С. И., Успенская И. А., Кузьменко Н. Е., Лунин В. В. Основы физической химии. Теория
и задачи: учеб. пособие для вузов. — М.:
Издательство «Экзамен», 2005. — 480 с. — (Серия
«Классический университетский учебник»). — ISBN 5-472-00834-4
В. Основы физической химии. Теория
и задачи: учеб. пособие для вузов. — М.:
Издательство «Экзамен», 2005. — 480 с. — (Серия
«Классический университетский учебник»). — ISBN 5-472-00834-4
Kokars, V. Vispārīgā ķīmija (1. daļa). Rīga: RTU izdevniecība, 2009. 286 lpp.
Понятию осмоляльность соответствует следующее определение. Гипо-, гипер- и изотонические растворы
Гипертонический – раствор с большей концентрацией и большим осмотическим давлением по сравнению с другим раствором.
Гипотонический – раствор, имеющий меньшую концентрацию и меньшее значение осмотического давления.
Изотонические растворы – растворы с одинаковым осмотическим давлением.
Изотонический коэффициент
Изотонический коэффициент Вант-Гоффа (i) показывает во сколько раз коллигативные свойства раствора электролита больше, чем раствора неэлектролита при одинаковых условиях и концентрациях.
Понятие об изоосмии (электролитном гомеостазе)
Изоосмия — относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: белков, электролитов и т.д.
Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
Осмоти́ческая концентра́ция — суммарная концентрация всех растворённых частиц.
Может выражаться как осмолярность (осмоль на литр раствора) и как осмоляльность (осмоль на кг растворителя).
Осмоль — единица осмотической концентрации, равная осмоляльности, получаемой при растворении в одном литре растворителя одного моля неэлектролита. Соответственно, раствор неэлектролита с концентрацией 1 моль/л имеет осмолярность 1 осмоль/литр.
Все одновалентные ионы (Na+, К+, Cl-) образуют в растворе число осмолей, равное числу молей и эквивалентов (электрических зарядов). Двухвалентные ионы образуют в растворе каждый по одному осмолю (и молю), но по два эквивалента.
Двухвалентные ионы образуют в растворе каждый по одному осмолю (и молю), но по два эквивалента.
Осмоляльность нормальной плазмы — величина достаточно постоянная и равна 285-295 мосмоль/кг. Из общей осмоляльности плазмы лишь 2 мосмол/кг обусловлены наличием растворенных в ней белков. Таким образом, главными компонентами, обеспечивающими осмоляльность плазмы, являются Na+ и С1- (около 140 и 100 мосмоль/кг соответственно). Постоянство осмотического давления внутриклеточной и внеклеточной 1 жидкости предполагает равенство молярных концентраций содержащихся в них электролитов, несмотря на различия в ионном составе внутри клетки и во внеклеточном пространстве. С 1976 г. в соответствии с Международной системой (СИ) концентрацию веществ в растворе, в том числе осмотическую, принято выражать в миллимолях на 1 л (ммоль/л). Понятие «осмоляльность», или «осмотическая концентрация», эквивалентно понятию «моляльность», или «моляльная концентрация». По существу понятия «миллиосмоль» и «миллимоль» для биологических растворов близки, хотя и не идентичны.
Таблица 1. Нормальные значения осмоляльности биологических сред
Р осм крови = 7,7 атм
Основную задачу осморегуляции выполняют почки. Осмотическое давление мочи в норме значительно выше, чем плазмы крови, что и обеспечивает активный транспорт из крови в почку. Осморегуляция осуществляется под контролем ферментативных систем. Нарушение их деятельности приводит к патологическим процессам. При внутривенных инъекциях, чтобы избежать нарушения осмотического баланса, следует использовать изотонические растворы. Изотоничен по отношению к крови физиологический раствор, содержащий 0.9% хлористого натрия. В хирургии явлением осмоса пользуются, применяя гипертонические марлевые повязки (марлю пропитывают 10%-ным раствором хлорида натрия). При этом рана очищается от гноя и носителей инфекции. Гипертонические растворы вводят внутривенно при глаукоме, чтобы снизить внутриглазное давление из-за повышенного содержания влаги в передней камере глаза.
Роль осмоса в биологических системах.
· Обуславливает тургор (упругость) клеток.
· Обеспечивает поступление воды в клетки и межклеточные структуры, эластичность тканей и сохранение определённой формы органов. Обеспечивает транспорт веществ.
· Осмотическое давление крови человека при 310 К – 7,7 атм, концентрация NaCl – 0,9%.
Плазмолиз и гемолиз
Плазмолиз – сжатие, сморщивание клетки в гипертоническом растворе.
Гемолиз – набухание и разрыв клетки в гипотоническом растворе.
Билет 14. Коллигативные свойства разбавленных растворов электролитов. Изотонический коэффициент.
Осмос отражает движение молекул растворителя через мембрану в область с более высокой концентрацией раствора. Это движение можно замедлить, повышая давление на более концентрированный раствор. Величина такого давления — эффективное осмотическое давление. Уровень эффективного осмотического давления зависит в большей мере от количества, а не типа присутствующих частиц.
Количество осмотически активных молекул присутствующих в растворе выражается в осмолях. Один осмоль вещества равен его молекулярной массе в граммах (один моль) разделенному на количество свободных частиц, которые каждая молекула освобождает в растворе. Так, например, при растворении 180 г глюкозы в1 литре воды образуется раствор с молярной концентрацией в1моль/л и осмолярностью в 1 осмоль/л. Хлорид натрия ионизируется в растворе и каждый ион представляет осмотически активную частицу. При условии полной диссоциации на Na + и Cl — , раствор, содержащий в 1 л 58,5 г NaCl имеет молярную концентрацию в 1 моль/л, а осмолярность в 2 осмоль/л.
В биологических жидкостях концентрация растворов гораздо меньше (ммоль/л), а диссоциация неполная. Следовательно, раствор NaCl содержащий 1 ммоль/л дает величину нескольку меньшую, чем 2 мосмоль/л. Термин осмоляльность отражает количество осмоль на единицу общей массы растворителя и в отличии от осмолярности не зависит от объема различных растворенных в растворе веществ. Смешение явно взаимонезаменяемых терминов осмолярность (измеряется в осмоль/л) и осмоляльность (измеряется в осмоль/кг) вызвано их арифметически одинаковыми значениями в биологических жидкостях: осмолярность плазмы составляет 280-310 мосмоль/л и осмоляльность плазмы — 280-310 мосмоль/кг. Это объясняется ничтожно малым объемом растворенного вещества в биологических жидкостях и фактом, что большинство осмотически активных частиц растворено в воде имеющей плотность равную 1, то есть, осмоль/л = осмоль/кг. Поскольку количество осмолей в плазме определяется путем измерения депрессии точки замерзания, то более точным термином для использования в клинической практике является осмоляльность.
Катионы (в основном Na +) и анионы (Cl — и HCO 3 -) являются главными осмотически активными частицами в плазме. Меньшую роль играют глюкоза и мочевина. Осмолярность плазмы (Р осм) можно определить по формуле:
Р осм = 2 +Глюкоза крови + Мочевина крови = 290 мосмоль/л
(ммоль/л) (ммоль/л) (ммоль/л)
Осмолярность является химическим термином и его не следует смешивать с физиологическим термином тоничность. Этот термин используется для сравнения эффективного осмотического давления раствора по сравнению с таковым в плазме. Принципиальная разница между осмолярностью и тоничностью состоит в том, что омолярность зависит от всех растворенных частиц, в то время как тоничность определяется только частицами, которые не проходят через мембрану клетки. Следовательно, тоничность выражает осмолярную активность растворенных веществ, расположенных во внеклеточном пространстве, то есть тех, которые создают осмотические силы, оказывающие влияние на распределение воды между внутри- и внеклеточной жидкостями. Мочевина свободно переходит через мембрану и не воздействует на распределение воды между этими двумя жидкостными компартментами и не влияет на тоничность. Веществами, которые воздействуют на осмолярность, но не влияют на тоничность, являются также этанол и метанол, поскольку они быстро распределяются по всей воде тела. Но маннитол и сорбитол плохо проходят через мембраны и появляясь во внеклеточном пространстве влияют и на осмолярность и на тоничность. Тоничность плазмы можно определить по формуле:
Тоничность плазмы = 2 + Глюкоза крови = 285 мосмоль/л
(ммоль/л) (ммоль/л)
Вода неравномерно распределена в организме .
В организме различают 2 главных водных пространства:
Внутриклеточное пространство которое представляет сумму водного содержимого каждой клетки организма
Внеклеточное пространство, которое включает жидкость, находящуюся вне клеток.
Соответственно пространствам различают внутриклеточную и внеклеточную жидкость. Внеклеточная жидкость локализована внутри сосудов и межклеточном интерстициальном пространстве. Разделение на два главных пространства не является искусственным. Оно обосновано как морфологически, так и функционально. Внутриклеточное пространство не является единым структурно-функциональным образованием в полном смысле этого слова. Внеклеточное же пространство, как среда существования для клеток и элемент межклеточного транспорта различных веществ представляет единую фазу во всех частях тела. Стенка сосудов, которая разделяет внутрисосудистую и интерстициальную часть внеклеточной жидкости, образует барьер только для высокомолекулярных веществ (белки) и клеток, в то время как низкомолекулярные вещества и неорганические ионы примерно одинаково распределяются по всему внеклеточному пространству. Доказательством служит одинаковый ионный состав плазмы крови и интерстициальной жидкости (табл.13-1).
Табл.13-1. Различия в электролитном составе вне и внутриклеточной жидкости(в ммоль/л)
) и как осмоляльность (осмоль на килограмм растворителя).
Осмо́ль — единица осмотической концентрации, равная осмолярности, получаемой при растворении в одном литре растворителя одного моля неэлектролита. Соответственно, раствор неэлектролита с концентрацией 1 моль/л имеет осмолярность 1 осмоль/литр.
Энциклопедичный YouTube
1 / 1
✪ Молярность, моляльность, осмолярность, осмоляльность и тонус — в чем разница?
Субтитры
Я попытаюсь окончательно разъяснить, в чём различие между всеми этими терминами, которые похоже звучат, но несколько отличаются друг от друга. Итак, первый термин — молярность, и мы уже знаем, что это количество молей в 1 литре раствора. Затем мы оставляем такой же числитель, но немного видоизменяем знаменатель — и получаем моляльность через «л». Моляльность — это количество молей, только не в литре, а в 1 килограмме раствора. В этом состоит основное различие между этими двумя терминами. Вы можете увидеть, что знаменатели немного отличаются. Если вы это усвоили, мы можем перейти к термину «осмолярность». Итак, осмолярность. Мы оставляем тот же знаменатель без изменений. Давайте, я запишу это здесь. Мы говорим, что у нас 1 литр раствора. Здесь всё то же самое. Однако изменяется числитель, и теперь в нём осмоли. Осмоли. И как вы помните, осмоли обозначают не просто то, что содержится в растворе, а то, как частицы диссоциируют в растворе. Мы уже говорили, что соль служит прекрасным примером для демонстрации различий между молярностью и осмолярностью. Подводя итог, вы можете предположить, что существует и четвёртый термин — осмоляльность. Осмоляльность будет иметь такой же числитель, что и осмолярность. То есть, здесь будут осмоли, однако знаменатель будет отличаться. Мы берём 1 килограмм раствора, и у нас получается осмоляльность. Если вы сравните эти два термина между собой, то увидите, что основное различие у них в числителе. Итак, вот эти четыре термина. Последний термин, который мы разбирали, – это тонус. Тонус. Когда же тонус включается в эту смесь? Мы даже выделили гипотонические растворы, изотонические растворы и гипертонические растворы. Мы рассмотрели понятие тонуса в каждом из этих типов растворов. Если не вдаваться в подробности, то все эти термины позволяют охарактеризовать или описать один раствор. То есть, если у вас имеется раствор, то вы можете описать его с помощью этих терминов. А эти термины используются для двух растворов. Если у вас два раствора, разделённые мембраной, (давайте я запишу это — разделённые мембраной), то вы можете использовать эти термины, чтобы описать, каким образом они соотносятся друг с другом. В этом заключается ключевое различие между терминами. Первые четыре термина описывают один раствор, а термины, относящиеся к тонусу, описывают, каким образом вы можете охарактеризовать два раствора, разделённых мембраной. Запомните, что всё, о чём мы говорили выше, (давайте я освобожу немного места) имеет непосредственную взаимосвязь с медицинской терминологией. Обычно мы используем эти термины в медицине. В медицине у вас могут быть клетки с проницаемой мембраной. Давайте я изображу её. Клетка находится в каком-то растворе. Этим раствором может быть кровь, или это может быть интерстициальная жидкость или любой другой раствор. Когда мы обсуждаем эти четыре термина, и, в особенности, тонус, мы говорим о взаимосвязи между этим раствором и раствором внутри клеток. Вот первый путь для разграничения всех этих терминов, о которых мы с вами только что поговорили. Subtitles by the Amara.org community
50692 0
Под осмолярностью понимают количество частиц в 1 кг воды (моляльность раствора — это число молей в 1 л воды). Осмотическая активность (молярность) является важной характеристикой водного пространства. Осмолярность определяет обмен жидкости между сосудом и тканью, поэтому ее изменения метут существенно сказываться на интенсивности обмена воды и ионов и нарушениях их обмена.
Молярная концентрация плазмы колеблется в пределах от 295 до 310 ммоль/л по данным одних авторов (В. Ф. Жалко-Титаренко, 1989) и от 285 до 295 ммоль/л по данным других (Г. А. Рябов, 1979).
Онкотическое или коллоидно-осмотическое давление обусловлено белками (2 моем) и составляет в среднем 25 мм Hg.
Осмолярность плазмы составляют Na+ и анионы (88%), остальные 12% — глюкоза, мочевина, К+, Mg++, Са++, белки. Осмотическую активность мочи определяют мочевина (53%), анионы (30%), Na+ (9%), остальные 8% приходятся на К+, Nh5+, Са++. Осмотическую активность определяют с помощью осмометра, принцип работы которого основан на определении криоскопической константы данного раствора и сравнении ее с криоскопической константой воды. Важно заметить, что объем исследуемой жидкости составляет всего 50-100 мкл (осмометр фирмы «Wescor», США).
В случае отсутствия осмометра можно воспользоваться расчетными методами, однако надо помнить, что они дают ошибку ± 20%.
Наиболее распространенные из них (А. П. Зильбер, 1984):
ОСМ = l,86Na + глюкоза + 2 AM + 9,
ОСМ = 2 Na + глюкоза + мочевина + К (ммоль/л),
где ОСМ — осмолярность (мосм/л),
AM — азот мочевины (ммоль/л).
Наиболее точные результаты получены с помощью формулы, предлагаемой А. Б. Антиповым с соавт. (1978):
ОСМ = 308,7 — 0,06 РСО2 — 0,6 Нb + 0,1 Na + 0,155 AM;
Для расчета осмотического давления предлагается следующая формула:
Осм. давление (мм рт.ст.) = осм-ть (мОсм/кг) . 19,3 мм рт. ст./мОсм/кг
Онкотическое давление определяется белками плазмы и составляет
Таблица 1
Осмотическое давление плазмы и вещества, его определяющие
Для вычисления коллоидно-онкотического давления предлагается следующие формулы (В. А. Корячкин с соавт., 1999):
КОД (мм Hg) = 0,33 общий белок (г/л)
КОД (кПа) = 0,04 общий белок (г/л)
В норме оно составляет 21-25 мм Hg или 2,8-3,2 кПа.
Осмолярность — это показатель, к которому реаниматологи «не привыкли» и незаслуженно мало используют в своей работе. Изменения осмолярности могут вызвать нарушения жизненно важных функций и гибель больного.
Гиперосмолярный синдром может возникнуть при гестозе, гиповолемии, кишечных свищах. Особенно часто он возникает при дефиците воды (лихорадка, гипервентиляция, неукротимая рвота и др.), повышении уровня глюкозы, мочевины (почечная недостаточность), введении натрия хлорида. Клиническая картина характеризуется, в первую очередь, нарушениями со стороны центральной нервной системы, в частности, признаками дегидратации мозга — гипервентиляцией, судорогами, комой.
Необходимо отметить, что пространство распределения воды — это внутри- и внеклеточная жидкость:
- пространство распределения для Na — внеклеточная жидкость;
- для глюкозы — вне- и внутриклеточная жидкость;
- для белков — вода плазмы.
Чтобы избежать неблагоприятных эффектов при проведении инфузионной терапии, необходимо учесть осмолярность и коллоидно-осмотическое давление инфузионных сред.
Из таблицы 2 видно, что осмолярность реополиглюкина, желатиноля, сухой плазмы выше осмолярности плазмы соответственно в 1,5; 1,7; 1,3 раза, а КОД полиглюкина — в 2 раза, реополиглюкина — в 4 (!) раза, гемодеза — в 3,2, желатиноля — в 2,7, 10% раствор альбумина — в 1,5 раза.
Таблица 2
Осмоляльность и КОД исследованных инфузионных растворов (В. А. Гологорский с соавт., 1993)
Наименование препарата | Осмоляльность, мосмоль/л | КОД, мм Hg |
Декстраны | ||
Полиглюкин | ||
Реополиглюкин на 5% глюкозе, | ||
Реополиглюкин на физ. растворе | ||
Плазмозамещающие растворы | ||
Гемодез | ||
Желатиноль | ||
Белковые препараты | ||
Альбумин 5% | ||
Альбумин 10% | ||
Сухая плазма | ||
Свежезамороженная плазма | ||
Гидролизат казеина | ||
Растворы аминокислот | ||
Левамин | ||
Альвезин | ||
Кристаллоидные препараты | ||
Физиологический | ||
Рингера-Локка | ||
5% р-р гидрокарбоната натрия | ||
10% р-р маннитола | ||
Раствор глюкозы | ||
На 1 г альбумина в кровоток поступает 14-15 мл воды;
На 1 г гидроксиэтилкрахмала — 16-17 мл воды;
Таким образом, коллоиды по сравнению с кристаллоидами требуют гораздо меньших объемов и обеспечивают более длительное возмещение ОЦК. Существенным их недостатком является способность вызывать коагулопатию (при дозе > 20 мл/кг), осмотический диурез и при повышенной проницаемости мембран (сепсис, РДСВ) увеличивать «капиллярную утечку» жидкости через альвеоло-капиллярную мембрану.
Кристаллоиды более эффективны для возмещения дефицита интерстициальной жидкости.
КОД свежезамороженной плазмы и 5% альбумина приближается к физиологическому, однако растворы аминокислот и гидролизаты белков оказались резко гиперосмолярны. Это относится к 10% раствору маннитола и 10-20% раствору глюкозы.
Гиперосмолярность раствора Рингера-Локка и 5% раствора гидрокарбоната натрия обусловлена большой концентрацией ионов натрия.
В реанимационной практике необходим постоянный мониторный контроль за КОД и осмолярностью плазмы, что позволяет более квалифицированно проводить инфузионную терапию.
Введение растворов с пониженной осмотической активностью может вызвать гипоосмолярный синдром. Развитие его чаще всего связано с потерей натрия и преобладанием, относительно его, свободной воды. В зависимости от этого соотношения выделяют: гиповолемическую, нормоволемическую и гиперволемическую гипоосмолярность.
Симптоматика гипоосмолярного синдрома зависит от степени снижения осмолярности и скорости снижения. При незначительном снижении до значений 285-265 мосмоль/л симптомы либо отсутствуют, либо минимальны. При снижении осмотической активности до 230 мосмоль/л возникают нарушения со стороны ЦНС с развитием комы и смерти. Предшествующими симптомами могут быть: тошнота, рвота, псевдопараличи, судороги, спазмы, вялость, заторможенность, возбуждение, делирий, тремор в покое и при движении, эпилептический статус, ступор (В. С. Курапова с соавт., 1984).
Следует отметить, что и осмолярность мочи в еще меньшей степени используется в реаниматологии для оценки состояния водно-солевого обмена и эффективности проводимой терапии. Однако по показателю осмолярности мочи можно прогнозировать развитие острой почечной недостаточности (ОПН). Существует общее мнение практиков о том, что ОПН легче предупредить, чем лечить. Так, К. Т. Агамалиев, А. А Дивонин (1982), используя показатель клиренса свободной воды (СН2О) после операций с искусственным кровообращением, прогнозировали развитие ОПН. СН2О является чувствительным показателем концентрационной функции почек. В норме он составляет от 25 до 100 мл/ч и увеличивается при развитии почечной недостаточности за 24-72 часа до ее развития.
Осмоляльность — мера концентрации раствора (выраженная в осмолях), которая определяется количеством растворенного вещества в килограмме растворителя или собственно раствора. Осмоляльность измеряется непосредственно с помощью осмометра или вычисляется по формуле. Осмоль — это молекулярный вес вещества, разделенный на число ионов или частиц, которые образуются при растворении вещества. Осмолярность — мера концентрации раствора (выраженная в осмолях), которая определяется количеством растворенного вещества в литре раствора или свойством раствора, зависящим от концентрации растворенного вещества в общем объеме растворителя.
Нормальный интервал
- Осмоляльность сыворотки: 280-300 мОсмоль/кг воды.
- Осмоляльность мочи: 100-1200 мОсмоль/кг воды.
- Моча при беременности: 1,001-1,035 мОсмоль/кг воды.
Применение
Диагностика некетотической гипергликемической комы. Контроль водно-электролитного равновесия
- Выявить отклонение от нормы содержания воды в сыворотке, для оценки гипонатриемии
- Измерение осмоляльности плазмы и/или мочи более ценны для оценки степени гидратации, чем изменения гематокрита, мочевины, протеинов плазмы, так как они зависят от множества других факторов.
Повышение
Гипергликемия.
Диабетический кетоацидоз (осмоляльность должна определяться постоянно при декомпенсированном сахарном диабете).
Некетотическая гипергликемическая кома.
Гипернатриёмия с дегидратацией
- Диарея, рвота, лихорадка, гипервентиляция, неадекватное потребление воды.
- Несахарный диабет — центральный.
- Нефрогенный несахарный диабет — врожденный или приобретенный (гиперкальциемия, гипокали-емия, хронические болезни почек, серповидно-клеточная анемия, эффекты некоторых лекарств).
- Осмотический диурез — гиперликемия, введение маннитола.
Гипернатриёмия с нормальной гидратацией — встречается при поражении гипоталамуса.
- Нарушение чувствительности осморецепторов (первичная гипернатриёмия) — водная нагрузка не приводит к нормализации осмолярности; хлорпропамид может снижать уровень натрия до уровня, близкого к норме.
- Нарушенное чувство жажды (гиподипсия) — быстрый прием воды возвращает уровень натрия в норму.
Гипернатриёмия с гипергидратацией — ятрогенная и случайная (например, детей кормят пищей с высоким содержанием натрия и воды или сердечно-легочная реанимация с использованием соды). Прием алкоголя; алкогольная кома с гиперосмолярным статусом. Понижение (эквивалентно гипонатриемии) Гипонатриемия с гиповолемией (натрий мочи обычно >20 мэкв/л)
- Надпочечниковая недостаточность (например, врожденные формы гипер- и гипоплазии надпочечников с потерей натрия, кровоизлияние в надпочечники, неадекватная терапия кортикостероидами).
- Почечые потери (осмотический диурез, проксимальный ренальный тубулярный ацидоз , нефро патии с потерей натрия, пиелонефрит, заболевания мозгового слоя почек, поликистоз почек).
- Потери через ЖКТ (диарея, рвота).
- Другие потери (ожоги, перитонит, панкреатит).
Isotonic Hypertonic Hypotonic (EASY!) — Школа Успеха
ВИДЕО ТРАНСКРИПТ
Вот самый простой способ запомнить, что изотонические, HYPERtonic и HYPOtonic средства для школы медсестер. Серьезно, вы не хотите пропустить это!
Хорошо, ваше тело всегда хочет оставаться в правильном равновесии, поэтому, если вы не высыпаетесь или не едите достаточно, вы становитесь немного капризным, верно? Вы потеряли равновесие! То же самое и со всеми клетками вашего тела, они хотят быть в равновесии.
И здесь играют роль 2 ключевых фактора: вода или жидкость и растворенные вещества. Итак, вода, очевидно, является водой, а растворенные вещества означают все те маленькие частицы, плавающие в крови, такие как натрий, глюкоза и калий. Так что помните об этих двух вещах, пока мы будем проходить через это.
Итак, клетки вашего тела нуждаются в правильном балансе растворенных веществ и воды. Если одного слишком много, а другого недостаточно, баланс нарушается, и клетки становятся очень несчастными.
Итак, первое жидкое тонизирующее средство, о котором мы поговорим, — это изотонические растворы.Изотонический означает, что он сбалансирован. Внутри и снаружи клеток существует правильный баланс жидкости и растворенных веществ. Когда вы думаете «Изотонический», я хочу, чтобы вы думали: «Я ТАК хочу остаться здесь». в балансе! Итак, ISOtonic означает «Я ТАК хочу остаться здесь». Есть правильный баланс воды и растворенных веществ. Поэтому, когда вы даете изотонический раствор, эта жидкость ОСТАЕТСЯ там, где вы ее нанесли. Помните — «Я ТАК хочу остаться здесь». Он не заставляет жидкость перемещаться внутри или снаружи клетки, он поддерживает баланс клеток.
А теперь поговорим о HYPOtonic. Когда вы думаете о HYPOtonic, я хочу, чтобы вы думали о маленьких бегемотиках. Так что с этого момента я буду называть «HYPOtonic» «HIPPOtonic», потому что хочу, чтобы вы думали о гипотонических клетках как о симпатичных маленьких бегемотиках. Они большие, круглые и громоздкие! В них много жидкости. Потому что вот что происходит в растворе HIPPOtonic: в растворе намного больше воды по сравнению с растворенными веществами, поэтому он ДЕЙСТВИТЕЛЬНО разбавлен. И когда этот разбавленный раствор попадает в ячейку, вся лишняя вода хочет переместиться в ячейку, чтобы восстановить баланс.Клетки хотят, чтобы был правильный баланс воды и растворенных веществ, поэтому, когда вы добавляете много воды или разбавленный раствор, такой как раствор HIPPOtonic, эта вода переместится в клетку и заставит их выглядеть большими и крупными, как бегемот. . Поэтому, когда вы думаете о HYPOtonic, думайте о HIPPOtonic.
Теперь поговорим о решениях HYPERtonic. HYPERtonic заставляет клетки выглядеть так, как будто они СУПЕР ГИПЕР, и сжигает всю свою энергию, и теперь он действительно очень тонок. Он сжимается! Он был супергипер, он танцевал повсюду, а теперь потерял всю свою жидкость и вес и превратился в тонкую клеточку.Итак, гипертонические растворы НАПОЛНЯЮТСЯ растворенными веществами. В них так много растворенных веществ по сравнению с водой внутри. Поэтому, когда этот сверхконцентрированный раствор вступает в контакт с клеткой, клетка говорит: «О боже, дай воды!» и отдает всю воду. Он движется, танцует вокруг и теряет всю воду, по крайней мере, так мне нравится думать об этом, как о танцующих клетках. Итак, когда вы думаете о HYPERtonic, подумайте о HYPER, поскольку клетка была супер-гипер-гипертонической, танцевала повсюду и потеряла весь свой водный вес, она выделила всю свою воду.
Итак, если это было очень полезным объяснением для вас, и вы хотите больше видео, подобных этому, напишите ЛЮБОВЬ в комментариях ниже и подпишитесь на этот канал, чтобы не пропустить другие советы и уловки школы медсестер.
Теперь, если вам нужна дополнительная помощь с изучением жидкости и электролитов в школе медсестер, вы обязательно захотите присоединиться к сообществу участников программы NursingSOS, где у нас есть целый курс по жидкостям и электролитам, чтобы помочь вам изучить все это для школы медсестер.Теперь нажмите на следующее видео, которое у нас есть, чтобы помочь вам стать медсестрой и стать медсестрой, которой Бог создал вас. Увидимся там!
ГИПОТОНИЧЕСКИЕ, изотонические и гипертонические | Aqualyte
HYPOTONIC, изотонический и гипертонический
Осмоляльность
Чем больше ингредиентов добавлено в раствор (электролиты, сахар, витамины, минералы и т. Д.), Тем выше его концентрация и тем медленнее он всасывается в организм.
Осмоляльность — это измерение концентрации жидкости, которая выражается количеством растворенных веществ в объеме жидкости. Осмоляльность крови и биологических жидкостей составляет примерно 290 мОсмоль / л.
- Гипертонические растворы имеют осмоляльность выше тела (> 300 мОсмоль / л)
- Изотонические растворы имеют осмоляльность, аналогичную осмоляльности тела (= 290 мОсмоль / л).
- Гипотонические растворы имеют более низкую осмоляльность, чем тело (<280 мОсмоль / л), что активно способствует абсорбции жидкости.
Тоничность
Тоничность относится к концентрации раствора и градиенту осмотического давления, который он создает на полупроницаемой мембране (например, в кишечнике). Это, в свою очередь, определяет, в каком направлении вода будет перемещаться через эту мембрану вместе с водой, переходящей от растворов с низкой концентрацией к растворам с высокой концентрацией, чтобы попытаться сохранить равновесие.
Электролитный баланс
Если электролитная жидкость является гипертонической (высокой концентрацией), вода будет вытягиваться из тела и втягиваться в кишечник, чтобы снова разбавить этот раствор до изотонического состояния.Растворы
HYPOTONIC имеют более низкую концентрацию электролитов, чем в организме, что позволяет раствору абсорбироваться быстрее, чем гипертонические напитки, напитки с изотоинсом или простая вода. Такое быстрое всасывание в организм более эффективно предотвращает обезвоживание и помогает избежать ощущения вздутия в желудке, когда жидкости не всасываются быстро. Из-за эффективности гипотонических растворов они обычно используются для внутривенного введения жидкости госпитализированным пациентам с целью лечения или избегать обезвоживания.
Aqualyte — это гипотонический раствор с осмоляльностью 150 мОсмоль / л, который способствует быстрому всасыванию жидкости, помогает предотвратить обезвоживание и влияет на здоровье и работоспособность.
Осмолярность| BioNinja
Навык:
• Оценка осмолярности тканей путем купания образцов в гипотонических и гипертонических растворах
Осмолярность — это мера концентрации растворенного вещества , определяемая числом осмолей растворенного вещества на литр раствора (осмоль / л)
Растворы можно условно разделить на гипертонические, гипотонические или изотонические в зависимости от их относительная осмолярность
- Растворы с относительно более высокой осмолярностью классифицируются как гипертонические (высокая концентрация растворенного вещества ⇒ поглощает воду)
- Растворы с относительно более низкой осмолярностью относятся к категории гипотонических (низкая концентрация растворенного вещества ⇒ теряет воду)
- Растворы которые имеют одинаковую осмолярность , классифицируются как изотонические (та же концентрация растворенного вещества ⇒ нет чистого потока воды)
Осмотическое движение между растворами: Hypertonic (слева) и Hypotonic (справа)
Оценка осмолярности
Осмолярность ткани может быть интерполирована путем купания образца в растворах с известной осмолярностью
- Ткань будет терять воду при помещении в гипертонические растворы и набирать воду при помещении в гипотонические растворы
- Потеря или прирост воды может быть определена путем взвешивания образца до и после купания в растворе
- Осмолярность ткани может быть определена путем определения концентрации раствора, при которой нет изменения веса (т.е.е. изотонический)
Заявка:
• Ткани или органы, используемые в медицинских процедурах, должны быть омыты раствором с той же осмолярностью
, что и цитоплазма, для предотвращения осмоса
Ткани или органы, используемые в медицинских процедурах, должны храниться в растворе для предотвращения высыхания клеток
Этот раствор должен иметь ту же осмолярность , что и ткань / орган (т.е. изотонический ), чтобы предотвратить возникновение осмоса
Неконтролируемый осмос будет иметь негативные последствия в отношении жизнеспособности клеток:
- В гипертонических растворах вода покидает клетку, вызывая ее сморщивание (образование зубцов)
- В гипотонических растворах вода будет проникать в клетку, вызывая ее набухание и потенциальный разрыв (лизис)
В тканях растений эффекты неконтролируемого осмоса смягчаются наличием негибкой клеточной стенки
- В гипертонических растворах цитоплазма сокращается ( плазмолиз), но клеточная стенка будет сохранять структурированную форму
- В гипотонических растворах цитоплазма будет расширяться, но не сможет разорваться в пределах ограничений клеточной стенки (тургора)
Сводка по влиянию концентраций растворенных веществ на клетки
Пассивный транспорт — Биологические концепции
Цели обучения
К концу этого раздела вы сможете:
- Объясните, почему и как происходит пассивный перенос
- Понимать процессы осмоса и диффузии
- Определите тонус и опишите его отношение к пассивному транспорту
Плазменные мембраны должны позволять определенным веществам входить в клетку и выходить из нее, при этом предотвращая попадание вредных материалов и выход основных материалов.Другими словами, плазматические мембраны избирательно проницаемы — они пропускают одни вещества, но не пропускают другие. Если бы они потеряли эту избирательность, клетка больше не могла бы поддерживать себя и была бы разрушена. Некоторым клеткам требуется большее количество определенных веществ, чем другим клеткам; у них должен быть способ получить эти материалы из внеклеточных жидкостей. Это может происходить пассивно, поскольку определенные материалы движутся вперед и назад, или в ячейке могут быть специальные механизмы, обеспечивающие транспортировку.Большинство клеток тратят большую часть своей энергии в форме аденозинтрифосфата (АТФ) на создание и поддержание неравномерного распределения ионов на противоположных сторонах их мембран. Структура плазматической мембраны способствует этим функциям, но также создает некоторые проблемы.
Наиболее прямые формы мембранного транспорта пассивны. Пассивный транспорт является естественным явлением и не требует от клетки затрат энергии для выполнения движения. При пассивном переносе вещества перемещаются из области с более высокой концентрацией в область с более низкой концентрацией в процессе, называемом диффузией.Говорят, что физическое пространство, в котором имеется различная концентрация одного вещества, имеет градиент концентрации.
Плазменные мембраны асимметричны, что означает, что, несмотря на зеркальное отображение, сформированное фосфолипидами, внутренняя часть мембраны не идентична внешней стороне мембраны. Интегральные белки, которые действуют как каналы или насосы, работают в одном направлении. Углеводы, присоединенные к липидам или белкам, также находятся на внешней поверхности плазматической мембраны. Эти углеводные комплексы помогают клетке связывать необходимые клетке вещества во внеклеточной жидкости.Это значительно усиливает избирательность плазматических мембран.
Напомним, что плазматические мембраны имеют гидрофильные и гидрофобные области. Эта характеристика помогает перемещению одних материалов через мембрану и препятствует перемещению других. Липидорастворимый материал может легко проскальзывать через гидрофобное липидное ядро мембраны. Такие вещества, как жирорастворимые витамины A, D, E и K, легко проходят через плазматические мембраны в пищеварительном тракте и других тканях.Жирорастворимые препараты также легко проникают в клетки и легко транспортируются в ткани и органы организма. Молекулы кислорода и углекислого газа не имеют заряда и проходят через простую диффузию.
Полярные вещества, за исключением воды, создают проблемы для мембраны. Хотя некоторые полярные молекулы легко соединяются с внешней стороной клетки, они не могут легко пройти через липидное ядро плазматической мембраны. Кроме того, в то время как маленькие ионы могут легко проскальзывать через промежутки в мозаике мембраны, их заряд мешает им это делать.Ионы, такие как натрий, калий, кальций и хлорид, должны иметь специальные средства проникновения через плазматические мембраны. Простые сахара и аминокислоты также нуждаются в помощи для транспорта через плазматические мембраны.
Распространение — это пассивный транспортный процесс. Отдельное вещество имеет тенденцию перемещаться из области с высокой концентрацией в область с низкой концентрацией до тех пор, пока концентрация не станет одинаковой во всем пространстве. Вы знакомы с диффузией веществ по воздуху. Например, представьте, как кто-то открывает флакон духов в комнате, заполненной людьми.Самая высокая концентрация духов находится во флаконе, а самая низкая — на краю комнаты. Пар духов будет рассеиваться или распространяться от флакона, и постепенно все больше и больше людей будут ощущать запах духов по мере их распространения. Материалы перемещаются в цитозоле клетки путем диффузии, а некоторые материалы перемещаются через плазматическую мембрану путем диффузии ([Рисунок 1). Распространение не требует затрат энергии. Скорее, разные концентрации материалов в разных областях являются формой потенциальной энергии, а диффузия — это диссипация этой потенциальной энергии по мере того, как материалы движутся вниз по градиенту их концентрации, от высокого к низкому.
Рисунок 1: Диффузия через проницаемую мембрану следует градиенту концентрации вещества, перемещая вещество из области с высокой концентрацией в область с низкой концентрацией. (кредит: модификация работы Марианы Руис Вильярреал)Каждое отдельное вещество в среде, например внеклеточная жидкость, имеет свой собственный градиент концентрации, независимый от градиентов концентрации других материалов. Кроме того, каждое вещество будет распространяться в соответствии с этим градиентом.
На скорость диффузии влияют несколько факторов.
- Степень градиента концентрации: чем больше разница в концентрации, тем быстрее происходит диффузия. Чем ближе распределение материала к равновесию, тем медленнее становится скорость диффузии.
- Масса диффундирующих молекул: более массивные молекулы движутся медленнее, потому что им труднее перемещаться между молекулами вещества, через которое они движутся; поэтому они распространяются медленнее.
- Температура: более высокие температуры увеличивают энергию и, следовательно, движение молекул, увеличивая скорость диффузии.
- Плотность растворителя: по мере увеличения плотности растворителя скорость диффузии уменьшается. Молекулы замедляются, потому что им труднее проходить через более плотную среду.
Чтобы увидеть анимацию процесса диффузии в действии, просмотрите это короткое видео о транспорте через клеточную мембрану.
При облегченном транспорте, также называемом облегченной диффузией, материал перемещается через плазматическую мембрану с помощью трансмембранных белков вниз по градиенту концентрации (от высокой до низкой концентрации) без затрат клеточной энергии.Однако вещества, которые подвергаются облегченному транспорту, в противном случае не могли бы легко и быстро диффундировать через плазматическую мембрану. Решение проблемы перемещения полярных и других веществ через плазматическую мембрану лежит в белках, покрывающих ее поверхность. Транспортируемый материал сначала прикрепляется к рецепторам белка или гликопротеина на внешней поверхности плазматической мембраны. Это позволяет удалить материал, необходимый клетке, из внеклеточной жидкости. Затем вещества передаются определенным интегральным белкам, которые облегчают их прохождение, поскольку они образуют каналы или поры, которые позволяют определенным веществам проходить через мембрану.Интегральные белки, участвующие в облегченном транспорте, вместе называются транспортными белками, и они функционируют либо как каналы для материала, либо как носители.
Осмос — это диффузия воды через полупроницаемую мембрану в соответствии с градиентом концентрации воды через мембрану. В то время как диффузия переносит материал через мембраны и внутри клеток, осмос переносит только воду, через мембрану, а мембрана ограничивает диффузию растворенных веществ в воде.Осмос — это особый случай диффузии. Вода, как и другие вещества, перемещается из области с более высокой концентрацией в область с более низкой концентрацией. Представьте себе стакан с полупроницаемой мембраной, разделяющей две стороны или половины ([Рисунок 2]). На обеих сторонах мембраны уровень воды одинаковый, но с каждой стороны существуют разные концентрации растворенного вещества или растворенного вещества, которое не может пересечь мембрану. Если объем воды такой же, но концентрации растворенных веществ различаются, то с обеих сторон мембраны также имеются разные концентрации воды, растворителя.
Рисунок 2: При осмосе вода всегда перемещается из области с более высокой концентрацией (воды) в область с более низкой концентрацией (воды). В этой системе растворенное вещество не может проходить через избирательно проницаемую мембрану.
Принцип диффузии заключается в том, что молекулы перемещаются и при возможности равномерно распространяются по среде. Однако через нее будет диффундировать только материал, способный проникнуть через мембрану. В этом примере растворенное вещество не может диффундировать через мембрану, а вода может.Вода в этой системе имеет градиент концентрации. Следовательно, вода будет диффундировать вниз по градиенту концентрации, пересекая мембрану в сторону, где она менее концентрирована. Эта диффузия воды через мембрану — осмос — будет продолжаться до тех пор, пока градиент концентрации воды не станет равным нулю. Осмос в живых системах происходит постоянно.
Посмотрите это видео, которое иллюстрирует диффузию в горячих и холодных растворах.
Тоничность описывает количество растворенного вещества в растворе.Мера тоничности раствора или общего количества растворенных веществ, растворенных в определенном количестве раствора, называется его осмолярностью. Три термина — гипотонический, изотонический и гипертонический — используются для связи осмолярности клетки с осмолярностью внеклеточной жидкости, содержащей клетки. В гипотоническом растворе, таком как водопроводная вода, внеклеточная жидкость имеет более низкую концентрацию растворенных веществ, чем жидкость внутри клетки, и вода поступает в клетку. (В живых системах точкой отсчета всегда является цитоплазма, поэтому префикс hypo — означает, что внеклеточная жидкость имеет более низкую концентрацию растворенных веществ или более низкую осмолярность, чем цитоплазма клетки.Это также означает, что во внеклеточной жидкости концентрация воды выше, чем в клетке. В этой ситуации вода будет следовать градиенту своей концентрации и попадет в ячейку. Это может вызвать взрыв или лизис животной клетки.
В гипертоническом растворе (префикс hyper — относится к внеклеточной жидкости, имеющей более высокую концентрацию растворенных веществ, чем цитоплазма клетки), жидкость содержит меньше воды, чем клетка, например морская вода. Поскольку в ячейке концентрация растворенных веществ ниже, вода будет покидать ячейку.Фактически растворенное вещество вытягивает воду из клетки. Это может вызвать сморщивание или образование зубцов в животной клетке.
В изотоническом растворе внеклеточная жидкость имеет ту же осмолярность, что и клетка. Если концентрация растворенных веществ в клетке совпадает с концентрацией внеклеточной жидкости, чистого движения воды внутрь или из клетки не будет. Клетки крови в гипертонических, изотонических и гипотонических растворах приобретают характерный вид ([Рисунок 3]).
Упражнения
Art Connection
Рисунок 3: Осмотическое давление изменяет форму эритроцитов в гипертонических, изотонических и гипотонических растворах.(кредит: модификация работы Марианы Руис Вильярреал)Врач вводит пациенту инъекцию, которую он считает изотоническим физиологическим раствором. Пациент умирает, и вскрытие показывает, что многие эритроциты были разрушены. Как вы думаете, раствор, который ввел врач, был действительно изотоническим?
[показать-ответ q = ”424855 ″] Показать ответ [/ раскрыть-ответ]
[скрытый-ответ a =” 424855 ″] Нет, это должно было быть гипотоническим, поскольку гипотонический раствор может вызвать попадание воды в клетки, тем самым заставляя их лопнуть.[/ hidden-answer]
У некоторых организмов, таких как растения, грибы, бактерии и некоторые простейшие, есть клеточные стенки, которые окружают плазматическую мембрану и предотвращают лизис клеток. Плазматическая мембрана может расширяться только до предела клеточной стенки, поэтому клетка не будет лизироваться. Фактически, цитоплазма растений всегда немного гипертоническая по сравнению с клеточной средой, и вода всегда будет попадать в клетку, если она доступна. Этот приток воды создает тургорное давление, которое укрепляет клеточные стенки растения ([Рисунок 4]).У недревесных растений давление тургора поддерживает растение. Если клетки растения становятся гипертоническими, как это происходит во время засухи, или если растение не поливают надлежащим образом, вода будет уходить из клетки. В этом состоянии растения теряют тургорное давление и вянут.
Рисунок 4: Тургорное давление в растительной клетке зависит от тонуса раствора, в котором она купается. (Фото: модификация работы Марианы Руис Вильярреал)Сводка раздела
Пассивные формы транспорта, диффузии и осмоса, перемещают материалы с малой молекулярной массой.Вещества диффундируют из областей с высокой концентрацией в области с низкой концентрацией, и этот процесс продолжается до тех пор, пока вещество не будет равномерно распределено в системе. В растворах более чем одного вещества молекулы каждого типа диффундируют в соответствии со своим градиентом концентрации. На скорость диффузии могут влиять многие факторы, включая градиент концентрации, размер диффундирующих частиц и температуру системы.
В живых системах диффузия веществ в клетки и из них опосредуется плазматической мембраной.Некоторые материалы легко диффундируют через мембрану, но другие затрудняются, и их прохождение возможно только с помощью белковых каналов и носителей. Химия живых существ происходит в водных растворах, и балансировка концентраций этих растворов является постоянной проблемой. В живых системах диффузия некоторых веществ была бы медленной или затрудненной без мембранных белков.
Вода движется через осмос _________.
- по всей цитоплазме
- из области с высокой концентрацией других растворенных веществ в область с более низкой концентрацией
- из области с низкой концентрацией растворенных веществ в область с более высокой концентрацией
- из зоны с низкой концентрацией воды в зону с более высокой концентрацией
[show-answer q = ”513874 ″] Показать ответ [/ show-answer]
[hidden-answer a =” 513874 ″] 3 [/ hidden-answer]
Основная движущая сила движения при диффузии __________.
- температура
- размер частиц
- градиент концентрации
- Площадь поверхности мембраны
Вода движется через полупроницаемую мембрану при осмосе, потому что через мембрану существует градиент концентрации растворенного вещества и растворителя. Растворенное вещество не может эффективно перемещаться, чтобы сбалансировать концентрацию по обе стороны мембраны, поэтому вода перемещается для достижения этого баланса.
Глоссарий
- Градиент концентрации
- Зона высокой концентрации напротив зоны низкой концентрации
- диффузия
- пассивный процесс транспортировки низкомолекулярного материала вниз по градиенту его концентрации
- облегченный транспорт
- процесс, при котором материал движется вниз по градиенту концентрации (от высокой до низкой концентрации) с использованием интегральных мембранных белков
- гипертонический
- описывает раствор, в котором внеклеточная жидкость имеет более высокую осмолярность, чем жидкость внутри клетки.
- гипотонический
- описывает раствор, в котором внеклеточная жидкость имеет более низкую осмолярность, чем жидкость внутри клетки.
- изотонический
- описывает раствор, в котором внеклеточная жидкость имеет ту же осмолярность, что и жидкость внутри клетки.
- осмолярность
- общее количество веществ, растворенных в определенном количестве раствора
- осмос
- транспортировка воды через полупроницаемую мембрану из зоны с высокой концентрацией воды в зону с низкой концентрацией воды через мембрану
- пассивный транспорт
- Способ транспортировки материала, не требующий энергии
- избирательно проницаемый
- Характеристика мембраны, которая пропускает одни вещества, но не пропускает другие
- растворенное вещество
- вещество, растворенное в другом с образованием раствора
- тоничность
- количество растворенного вещества в растворе.
Наблюдая за осмосом | Электронное обучение Perkins
На базовых курсах биологии студенты узнают о движении воды в клетку или из клетки посредством осмоса.
Осмос — это движение воды из более разбавленного раствора в менее разбавленный через полупроницаемую мембрану (клеточную мембрану). Студент выучит термины гипотонический, гипертонический и изотонический. (См. Ниже)
Студентам часто трудно запомнить эти термины, поскольку клетки сжимаются в гипертонических растворах и растут в гипотонических растворах, что может показаться нелогичным, но имеет смысл, поскольку термины относятся к растворам, а не к самим клеткам.Я обнаружил, что эта лабораторная работа помогает студентам лучше запоминать и понимать эти термины и концепции.
Мне эта лаборатория нравится больше, чем лаборатория, в которой я изначально пробовал использовать виноград, поскольку размер яйца увеличивается или уменьшается в большей или меньшей степени. Студенты могут как измерить увеличение или уменьшение размера яйца, так и почувствовать это. Иногда яйцо в гипотоническом растворе даже разбивается.
Замачивание яиц в уксусе приводит к растворению яичной скорлупы, и яичный белок становится эластичным.(из-за химической реакции) Вода может течь в яйцо и выходить из него.
Словарь
Изотонический раствор: (iso = то же, что и нормальный) Концентрация растворенных веществ в растворе больше, чем концентрация растворенных веществ в клетках. (Борная кислота)
Гипертонический раствор (гипер = больше, чем обычно) Концентрация растворенных веществ в растворе больше, чем концентрация растворенных веществ в клетках.(Кукурузный сироп)
Гипотонический раствор (гипо = меньше нормы) Концентрация растворенных веществ в растворе меньше концентрации растворенных веществ в клетках. (Дистиллированная вода)
Осмос: движение воды через клеточную мембрану из области с более низкой концентрацией растворенного вещества в область с более высокой концентрацией растворенного вещества
Что происходит с клетками растений и животных при помещении в гипертонические, гипотонические и изотонические среды?
Обновлено 16 февраля 2020 г.
Автор: Riti Gupta
Проверено: Lana Bandoim, B.S.
Почему, когда вы покупаете свежий болгарский перец, он хрустящий, а через несколько дней становится мягким? От чего растение увядает, если его забыть полить? Эти преобразования связаны с потерей воды. Движение воды очень важно в клетках растений (и клетках животных). Диффузия воды называется осмосом .
Что такое осмос?
Осмос — это диффузия воды через полупроницаемую мембрану. Вода течет вниз по градиенту концентрации к участку с более высокой концентрацией растворенного вещества.
Например, если есть две области, соединенные мембраной, и одна (A) содержит больше растворенного вещества, чем другая (B), тогда вода будет течь из B в A.
Тоничность по сравнению с осмолярностью
Способность раствора для движения воды называется тоничность . Тоничность раствора связана с его осмолярностью , — общей концентрацией растворенного вещества.
Раствор с более низкой концентрацией растворенного вещества имеет более низкую осмолярность, чем раствор с более высокой концентрацией растворенного вещества.Когда два раствора разделены полупроницаемой мембраной, проницаемой для воды, но не для растворенных веществ, вода всегда будет перемещаться со стороны с низкой осмолярностью в сторону с более высокой осмолярностью.
Типы тоничности
Для описания тоничности при сравнении двух растворов, разделенных мембраной, используются три термина: гипотонический, гипертонический и изотонический.
В примере, описанном выше, область A составляет , гипертоническая по отношению к области B, потому что область A имеет более высокую осмолярность.Область B, с другой стороны, является гипотонической по отношению к области A. Тоничность может быть указана только в отношении другой области. Сам по себе раствор не может обладать тонизирующим действием.
Изотонический — это просто две области, разделенные мембраной с одинаковой осмолярностью.
Тоничность и клетки
До сих пор тоничность обсуждалась только с точки зрения двух областей, содержащих растворенное вещество, которые соединены полупроницаемой мембраной, но тоничность и движение воды очень важны для клеток.Вместо двух областей, разделенных мембраной, вы можете представить себе клетку, помещенную в жидкость. Есть две области: одна внутри ячейки и одна вне ячейки. Жидкость вне клетки называется внеклеточной жидкостью.
Что происходит, когда вы помещаете животную клетку в гипотонический раствор?
- Помните, вода движется из области низкой осмолярности в область высокой осмолярности. В этом случае, поскольку внеклеточная жидкость имеет низкую осмолярность, вода будет устремляться в клетку.Затем клетка расширяется и в конечном итоге лизируется или лопается.
Что произойдет, если поместить животную клетку в гипертонический раствор?
- В этом случае вода будет покидать клетку, поскольку клетка имеет более низкую осмолярность, чем внеклеточная жидкость. В результате клетка будет сокращаться в результате так называемого плазмолиза.
Что происходит, когда вы помещаете животную клетку в изотонический раствор?
- Осмолярность обеих жидкостей одинакова. Таким образом, хотя вода диффундирует внутрь и наружу, чистое изменение объема ячейки не происходит.
Что происходит, когда вы помещаете растительную клетку в гипотонический раствор?
- Вода перемещается из области низкой осмолярности (внеклеточная жидкость) в область высокой осмолярности (внутри клетки). Тогда ячейка расширится. В отличие от животной клетки, растительная клетка не лопается. Это связано с тем, что клетки растений имеют жесткую клеточную стенку вокруг плазматической мембраны. При набухании водой они становятся набухшими.
- Гипотонические растворы сохраняют овощи, такие как сладкий перец, хрустящими.
Что произойдет, если поместить растительную клетку в гипертонический раствор?
- Вода покидает клетку, так как клетка имеет более низкую осмолярность, чем внеклеточная жидкость. В результате клетка уменьшится.
Что происходит, когда вы помещаете растительную клетку в изотонический раствор?
- Осмолярность обеих жидкостей одинакова. Хотя вода диффундирует внутрь и наружу, чистое изменение объема ячейки не происходит.
ВИКТОРИНА — Биология и наука
BIOL 101 — Тест 6 — Вода и осмос1.Вода — это ____________ молекула. нейтральный2. Какие связи образуются между молекулами воды? ионный
заряжен
полярный
гидрофобный
субатомный
водород
одиночный ковалентный
двойной ковалентный
тройной ковалентный 3. Распространяются молекулы: от более низких концентраций к более высоким концентрациям
случайным образом
от более высоких концентраций к более низким концентрациям
вниз по температурному градиенту
через полупроницаемые мембраны 4.Если поместить эритроцит в гипотонический раствор, он: лизировать
оставайся таким же
сокращаться
стать гипотоническим
стать гипертонусом 5. Если поместить растительную клетку в гипертонический раствор, она подвергнется: лизис
плазмолиз
повышенное давление
зубчатость
вялость 6. Что из следующего верно относительно изотонических растворов? у них одинаковая концентрация растворенных веществ
у них одинаковая концентрация воды
не было бы чистого движения воды
клетки не растворятся в нем
все из этого 7.
