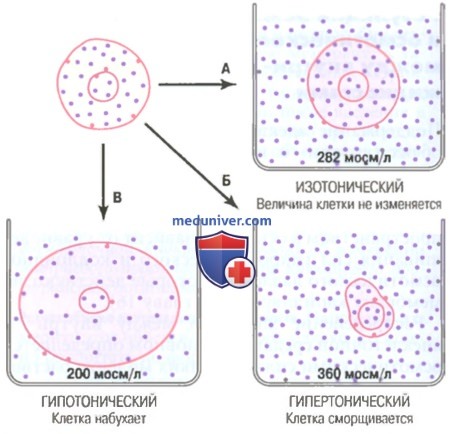
Гипо-, гипер- и изотонические растворы. — МегаЛекции
Гипертонический – раствор с большей концентрацией и большим осмотическим давлением по сравнению с другим раствором.
Гипотонический – раствор, имеющий меньшую концентрацию и меньшее значение осмотического давления.
Изотонические растворы – растворы с одинаковым осмотическим давлением.
Изотонический коэффициент
Изотонический коэффициент Вант-Гоффа (i) показывает во сколько раз коллигативные свойства раствора электролита больше, чем раствора неэлектролита при одинаковых условиях и концентрациях.
Понятие об изоосмии (электролитном гомеостазе)
Изоосмия — относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: белков, электролитов и т.д.
Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
Осмоти́ческая концентра́ция — суммарная концентрация всех растворённых частиц.
Может выражаться как осмолярность (осмоль на литр раствора) и как осмоляльность (осмоль на кг растворителя).
Осмоль — единица осмотической концентрации, равная осмоляльности, получаемой при растворении в одном литре растворителя одного моля неэлектролита. Соответственно, раствор неэлектролита с концентрацией 1 моль/л имеет осмолярность 1 осмоль/литр.
Все одновалентные ионы (Na+, К+, Cl—) образуют в растворе число осмолей, равное числу молей и эквивалентов (электрических зарядов). Двухвалентные ионы образуют в растворе каждый по одному осмолю (и молю), но по два эквивалента.
Осмоляльность нормальной плазмы — величина достаточно постоянная и равна 285—295 мосмоль/кг. Из общей осмоляльности плазмы лишь 2 мосмол/кг обусловлены наличием растворенных в ней белков. Таким образом, главными компонентами, обеспечивающими осмоляльность плазмы, являются Na+ и С1- (около 140 и 100 мосмоль/кг соответственно). Постоянство осмотического давления внутриклеточной и внеклеточной 1 жидкости предполагает равенство молярных концентраций содержащихся в них электролитов, несмотря на различия в ионном составе внутри клетки и во внеклеточном пространстве. С 1976 г. в соответствии с Международной системой (СИ) концентрацию веществ в растворе, в том числе осмотическую, принято выражать в миллимолях на 1 л (ммоль/л). Понятие «осмоляльность», или «осмотическая концентрация», эквивалентно понятию «моляльность», или «моляльная концентрация». По существу понятия «миллиосмоль» и «миллимоль» для биологических растворов близки, хотя и не идентичны.
Постоянство осмотического давления внутриклеточной и внеклеточной 1 жидкости предполагает равенство молярных концентраций содержащихся в них электролитов, несмотря на различия в ионном составе внутри клетки и во внеклеточном пространстве. С 1976 г. в соответствии с Международной системой (СИ) концентрацию веществ в растворе, в том числе осмотическую, принято выражать в миллимолях на 1 л (ммоль/л). Понятие «осмоляльность», или «осмотическая концентрация», эквивалентно понятию «моляльность», или «моляльная концентрация». По существу понятия «миллиосмоль» и «миллимоль» для биологических растворов близки, хотя и не идентичны.
Таблица 1. Нормальные значения осмоляльности биологических сред
| Среда | Осмоляльность, мосмоль на 1 кг воды |
| Плазма крови | 285—295 |
| Цереброспинальная жидкость | 285—295 |
| Желудочный сок | 160—340 |
| Слюна | 110—210 |
| Желчь | 290—300 |
| Моча | 600—1200 (в зависимости от диеты и диуреза) |
Росм крови = 7,7 атм
Основную задачу осморегуляции выполняют почки.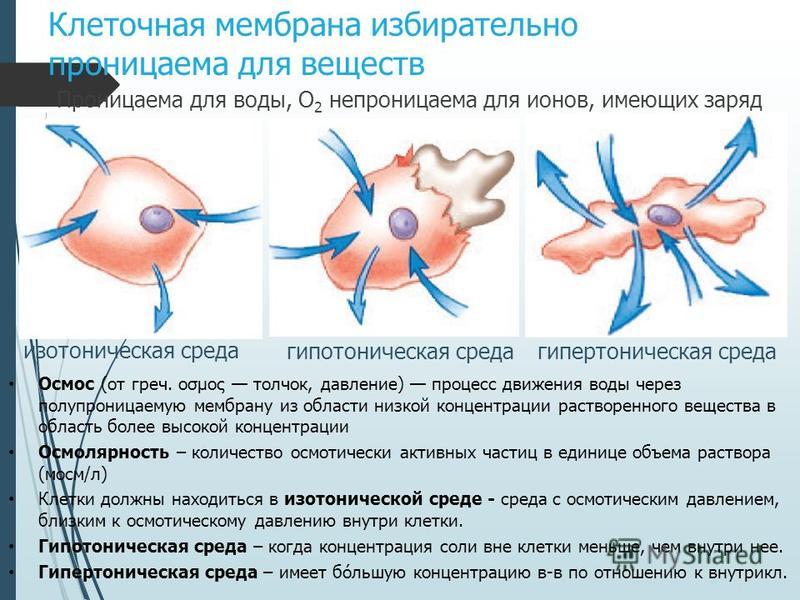 Осмотическое давление мочи в норме значительно выше, чем плазмы крови, что и обеспечивает активный транспорт из крови в почку. Осморегуляция осуществляется под контролем ферментативных систем. Нарушение их деятельности приводит к патологическим процессам. При внутривенных инъекциях, чтобы избежать нарушения осмотического баланса, следует использовать изотонические растворы. Изотоничен по отношению к крови физиологический раствор, содержащий 0.9% хлористого натрия. В хирургии явлением осмоса пользуются, применяя гипертонические марлевые повязки (марлю пропитывают 10%-ным раствором хлорида натрия). При этом рана очищается от гноя и носителей инфекции. Гипертонические растворы вводят внутривенно при глаукоме, чтобы снизить внутриглазное давление из-за повышенного содержания влаги в передней камере глаза.
Осмотическое давление мочи в норме значительно выше, чем плазмы крови, что и обеспечивает активный транспорт из крови в почку. Осморегуляция осуществляется под контролем ферментативных систем. Нарушение их деятельности приводит к патологическим процессам. При внутривенных инъекциях, чтобы избежать нарушения осмотического баланса, следует использовать изотонические растворы. Изотоничен по отношению к крови физиологический раствор, содержащий 0.9% хлористого натрия. В хирургии явлением осмоса пользуются, применяя гипертонические марлевые повязки (марлю пропитывают 10%-ным раствором хлорида натрия). При этом рана очищается от гноя и носителей инфекции. Гипертонические растворы вводят внутривенно при глаукоме, чтобы снизить внутриглазное давление из-за повышенного содержания влаги в передней камере глаза.
Роль осмоса в биологических системах.
· Обуславливает тургор (упругость) клеток.
· Обеспечивает поступление воды в клетки и межклеточные структуры, эластичность тканей и сохранение определённой формы органов.
· Осмотическое давление крови человека при 310 К – 7,7 атм, концентрация NaCl – 0,9%.
Плазмолиз и гемолиз
Плазмолиз – сжатие, сморщивание клетки в гипертоническом растворе.
Гемолиз – набухание и разрыв клетки в гипотоническом растворе.
Билет 14. Коллигативные свойства разбавленных растворов электролитов. Изотонический коэффициент.
Воспользуйтесь поиском по сайту:
Осмотическое давление. Онкотическое давление. Изотонический процесс. Гипер-, гипо-, изотонические растворы
Осмотическое давление. Онкотическое давление. Изотонический процесс. Гипер-, гипо-, изотонические растворы.
Содержание
- Коллигативные свойства растворов неэлектролитов……………………………….

Коллигативные свойства растворов неэлектролитов
Коллигативными (коллективными) называются свойства растворов относительно свойств растворителя, зависящие главным образом от числа растворенных частиц.
Давление насыщенного пара разбавленных растворов
Пар, находящийся в равновесии с жидкостью, называется насыщенным. Давление такого пара р0называется давлением или упругостью насыщенного пара чистого растворителя.
Первый закон Рауля. Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом:
pi = pi0 xi
Для бинарного раствора, состоящего из компонентов А и В: относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества:
Растворы, для которых выполняется закон Рауля, называют идеальными растворами.
Давление пара идеальных и реальных растворов
Если компоненты бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента. Общее Состав, мол. доли в (хв) давление пара:
p = pA0xA + pB0xB = pA0(1 – xB) + pB0xB = pA0 – xB(pA0 – pB0)
Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения, ΔН тв > 0). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения, ΔHраств < 0).
Температура кристаллизации разбавленных растворов
Второй закон Рауля. Понижение температуры замерзания раствора ΔТзам прямо пропорционально моляльной концентрации раствора: ΔTзам= Т0 – Т = КСm, где Т0 – температура замерзания чистого растворителя; Т – температура замерзания раствора; К – криоскопическая постоянная растворителя, град/кг моль,
Т02 – температура замерзания растворителя; М – молекулярная масса растворителя, ΔНпл – мольная теплота плавления растворителя.
Температура кипения разбавленных растворов
Температура кипения – температура, при которой давление насыщенного пара становится равным внешнему давлению.
Повышение температуры кипения растворов нелетучих веществ ΔТК = Тк – Тк0пропорционально понижению давления насыщенного пара и прямо пропорционально моляльной концентрации раствора: ΔТкип = ЕСm, где Е – эбулиоскопическая постоянная растворителя, град/кг • моль.
Осмотическое давление разбавленных растворов
Осмос – преимущественно одностороннее прохождение молекул растворителя через полупроницаемую мембрану в раствор или молекул растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией.
Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, численно равно осмотическому давлению π (Па).
Принцип Вант-Гоффа: осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор: π = CRT.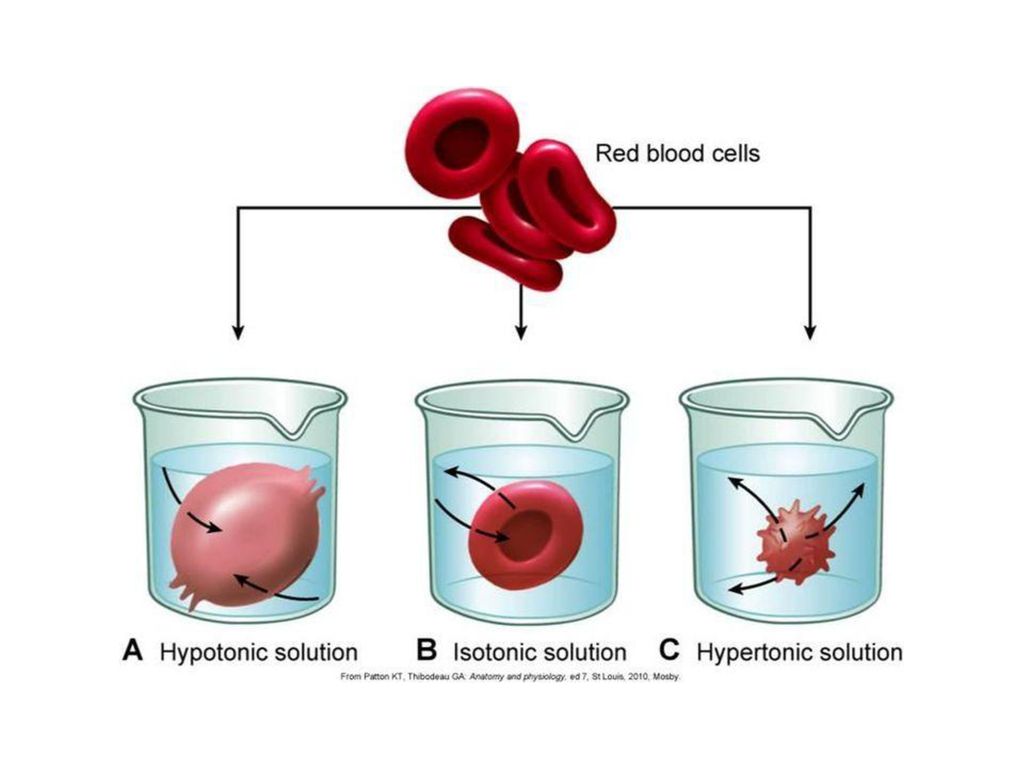
Изотонические растворы – два раствора с одинаковым осмотическим давлением (π1 = π2).
Гипертонический раствор – раствор, осмотическое давление которого больше, чем у другого (π1 > π2).
Гипотонический раствор – раствор, осмотическое давление которого меньше, чем у другого (π1 < π2).Осмотическое давление – это сила, обусловливающая осмос.
Осмос (osmosis) – это односторонняя диффузия веществ через полупроницаемую мембрану, разделяющую растворы с разными концентрациями веществ. Такое самопроизвольное перемещение веществ приводит к выравниванию концентраций веществ в растворах, разделенных полупроницаемой мембраной.
Величина осмотического давления раствора (движущей силы осмоса) не зависит от химической природы находящихся в растворе веществ. Величина осмотического давления раствора зависит только от количества растворенных в нём веществ. Чем больше концентрация раствора, тем больше создаваемое им осмотическое давление.
В качестве системной единицы осмотического давления, как и давления вообще, в системе СИ принято давление, которое производит сила 1 н на перпендикулярную к ней поверхность площадью 1 м2 (н / м2).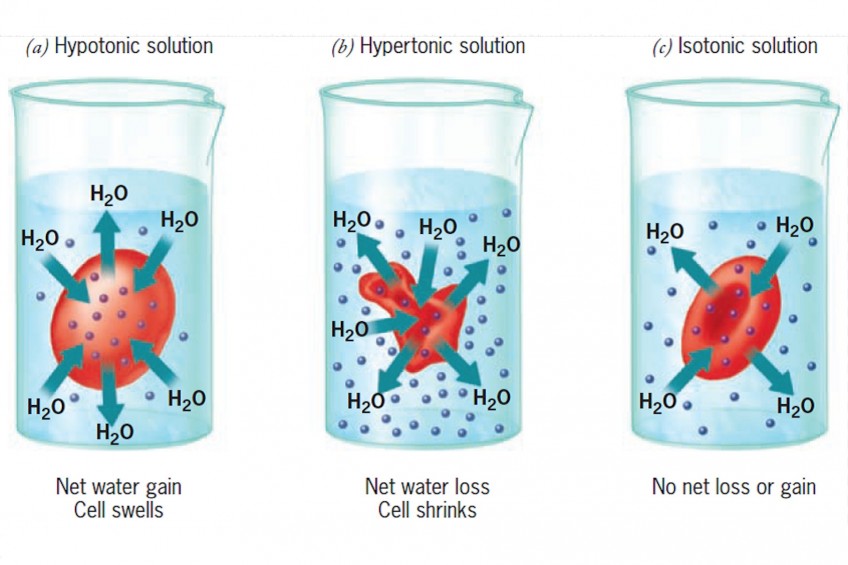 Эту единицу назвали «паскаль» (Па) в честь французского ученого Блеза Паскаля (Blaise Pascal, 1623-1662, математик, физик, философ, один из основателей теории вероятностей). Используются также кратные и дольные единицы давления.
Эту единицу назвали «паскаль» (Па) в честь французского ученого Блеза Паскаля (Blaise Pascal, 1623-1662, математик, физик, философ, один из основателей теории вероятностей). Используются также кратные и дольные единицы давления.
Диссоциация, концентрация, осмос и осмотическое давление. Осмотическая концентрация (осмотически активных частиц растворенного вещества в растворе) превышает молярную концентрацию (всех растворенных частиц) в такое число раз, на сколько частиц распадается молекула при электрической диссоциации. В частности, соли NaCl или KCl в водном растворе полностью диссоциируют, и их осмотическая концентрация в два раза превышает молярную концентрацию. Молекула CaCl2 диссоциирует в водном растворе на три частицы, поэтому её осмотическая концентрация будет превышать молярную в три раза. Так поступают, если оценивают осмотическое давление раствора, состоящего из смеси нескольких растворенных веществ. Например, раствор 100 ммоль NaCl + 50 ммоль сахарозы будет иметь осмотическую концентрацию 2 × (100 + 50) = 250 мосмоль.
Концентрация вещества в клетке или других биотических структурах, оцениваемая химическими методами, может отличаться от осмотической концентрации не только из-за электролитической диссоциации, но и по причине связывания части молекул или ионов одних веществ раствора белками и другими макромолекулами или субклеточными структурами. Связанные ионы не диффундируют и не создают осмотического давления. Осмотической активностью обладает только те частицы растворенного вещества, которые находятся в свободном состоянии, а не в ассоциации с крупными структурами.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
(диффузное давление), термодинамич. параметр, характеризующий стремление р-ра к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворителя и растворённого в-ва. Если р-р отделён от растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия — всасывание растворителя через мембрану в р-р (см. ОСМОС). В этом случае О. д. можно измерить: оно равно избыточному давлению, к-рое необходимо приложить со стороны р-ра, чтобы прекратить осмос.
О. д. обусловлено понижением химического потенциала растворителя в присутствии растворённого в-ва. Тенденция системы к выравниванию хим. потенциалов всех её частей и к переходу в состояние с более низким уровнем свободной энергии и вызывает осмотич. перенос в-ва. О. д. в идеальных и предельно разбавл. р-рах не зависит от природы растворителя и растворённых в-в; при пост. темп-ре оно определяется только числом «кинетич. элементов» (ионов, молекул, ассоциатов или коллоидных ч-ц) в ед. объёма р-ра.
Первые измерения О. д. произвёл нем. ботаник В. Пфеффер (1877), исследуя водные р-ры сахара. Его данные позволили голл. химику Я. X. Вант-Гоффу установить в 1887 зависимость О. д. от концентрации растворённого в-ва, совпадающую по форме с Бойля — Мариотта законом для идеальных газов. Оказалось, что О. д. (p) численно равно давлению, к-рое оказало бы растворённое в-во, если бы оно при данной темп-ре находилось в состоянии идеального газа и занимало объём, равный объёму р-ра. Для разбавл. р-ров недиссоциирующих в-в найденная закономерность с достаточной точностью описывается ур-нием: pV=nRT, где n — число молей растворённого в-ва в объёме V р-ра и R — универсальная газовая постоянная. В случае диссоциации молекул в-ва в правую часть ур-ния вводится множитель i>1 — коэффициент Вант-Гоффа; при ассоциации в-ва i<1. О. д. реального р-ра (p’) всегда выше, чем идеального (я”), причём отношение p’/p”= g, наз. осмотическим коэффициентом, увеличивается с ростом концентрации. Р-ры с одинаковым О. д. наз. изотоническими или изоосмотическими. Так, разл. кровезаменители и физиол. р-ры изотоничны относительно внутр. жидкостей организма. Если один р-р в сравнении с другим имеет более высокое О. д., его наз. гипертоническим, а имеющий более низкое О. д.— гипотоническим.
р-ров недиссоциирующих в-в найденная закономерность с достаточной точностью описывается ур-нием: pV=nRT, где n — число молей растворённого в-ва в объёме V р-ра и R — универсальная газовая постоянная. В случае диссоциации молекул в-ва в правую часть ур-ния вводится множитель i>1 — коэффициент Вант-Гоффа; при ассоциации в-ва i<1. О. д. реального р-ра (p’) всегда выше, чем идеального (я”), причём отношение p’/p”= g, наз. осмотическим коэффициентом, увеличивается с ростом концентрации. Р-ры с одинаковым О. д. наз. изотоническими или изоосмотическими. Так, разл. кровезаменители и физиол. р-ры изотоничны относительно внутр. жидкостей организма. Если один р-р в сравнении с другим имеет более высокое О. д., его наз. гипертоническим, а имеющий более низкое О. д.— гипотоническим.
Принципиальная схема осмометра: А —камера для р-ра: Б — камера для растворителя: М — мембрана. Уровни жидкости в трубках при осмотич. равновесии: а и в — в условиях равенства внеш. давлений в камерах А и Б, когда PA=PБ, при этом столб жидкости Н уравновешивает осмотич. давление; б — в условиях неравенства внеш. давлений, когда pА-pБ=p.
давление; б — в условиях неравенства внеш. давлений, когда pА-pБ=p.
О. д. измеряют с помощью осмометров. Различают статич. и динамич. методы измерений. Первый основан на измерении избыточного гидростатич. давления по высоте столба жидкости Н в трубке осмометра (рис.) после установления осмотич. равновесия и при равенстве внеш. давлений PА и PБ в камерах A и Б. Второй метод сводится к измерению скоростей v всасывания и выдавливания растворителя из осмотич. ячейки при разл. значениях избыточного давления Dp=pA-рБ с последующей интерполяцией полученных данных к v=0 при Dp=p. Мн. осмометры позволяют использовать оба метода. В кач-ве мембраны обычно применяют плёнки из целлофана, природных и синтетич. полимеров, пористые керамич. и стеклянные перегородки. Осн. приложения осмометрии— определение мол. массы М полимеров по соотношению: p/с=RТ(1/M+Ac), где с — концентрация полимера в р-ре, А — коэфф., зависящий от строения макромолекулы.
О. д. может достигать значит. величины. Напр.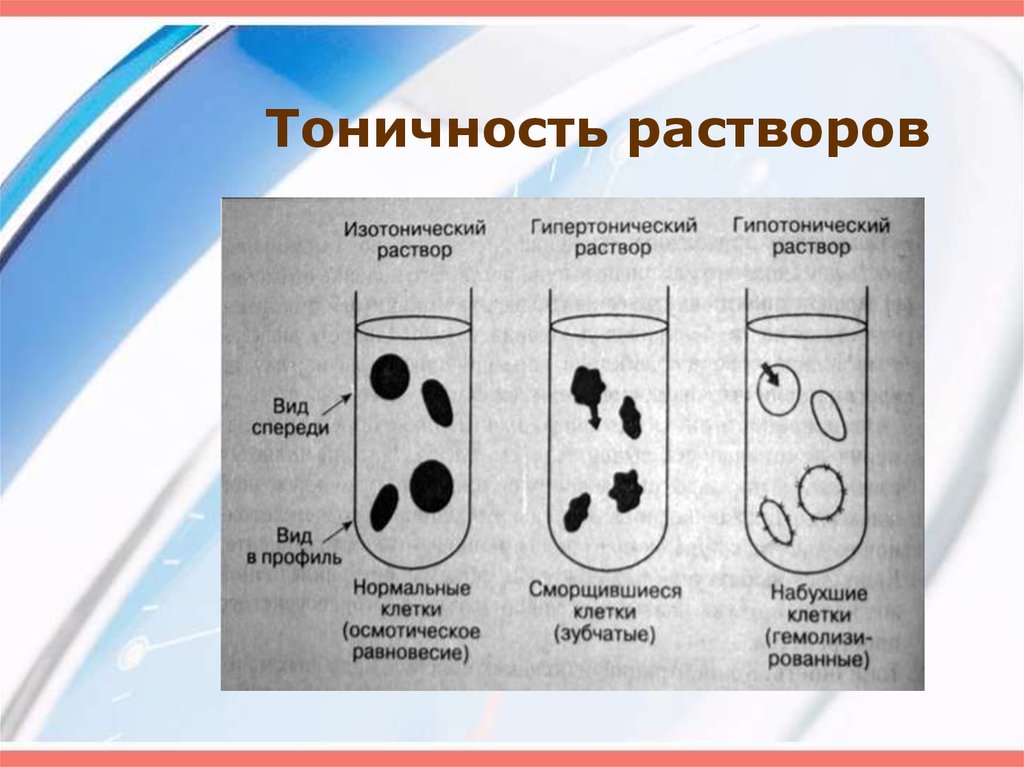 , 4%-ный р-р сахара при комнатной темп-ре имеет О. д. ок. 0,3 МПа, а 53%-ный — ок. 10 МПа; О. д. морской воды — ок. 0,27 МПа.
, 4%-ный р-р сахара при комнатной темп-ре имеет О. д. ок. 0,3 МПа, а 53%-ный — ок. 10 МПа; О. д. морской воды — ок. 0,27 МПа.
ОНКОТИЧЕСКОЕ ДАВЛЕНИЕ [ oncotic pressure ]
(Греч.: όγκος – объём).
Онкотическое давление, или коллоидно-осмотическое давление – это доля осмотического давления, обусловленная наличием в растворе высокомолекулярных компонентов (коллоидный раствор). В частности, такими компонентами являются белки плазмы крови. Онкотическое давление крови является одной из движущих сил, определяющих направление и скорость двустороннего обмена веществами в микрогемациркуляторном русле между кровью и интерстициальной жидкостью. Величина онкотического давления крови составляет прОнкотическое давление играет существенную роль в распределении воды между кровью и лимфой.
См. также Диализ, Изотонические растворы. Электролиты.
Осмотическое давление — это внешнее давление на раствор, отделенный от чистого растворителя полупроницаемой мембраной, при котором прекращается осмос. Осмосом называют одностороннюю диффузию растворителя в раствор через разделяющую их полупроницаемую мембрану (пергамент, животный пузырь, пленки из коллодия, целлофана). Мембраны такого рода проницаемы для растворителя, но не пропускают растворенные вещества. Осмос наблюдают и в том случае, когда полупроницаемая мембрана разделяет два раствора с разными концентрациями, при этом растворитель перемещается через мембрану от раствора менее концентрированного к раствору более концентрированному. Величина осмотического давления раствора определяется концентрацией в нем кинетически активных частичек (молекул, ионов, коллоидных частиц).
Осмосом называют одностороннюю диффузию растворителя в раствор через разделяющую их полупроницаемую мембрану (пергамент, животный пузырь, пленки из коллодия, целлофана). Мембраны такого рода проницаемы для растворителя, но не пропускают растворенные вещества. Осмос наблюдают и в том случае, когда полупроницаемая мембрана разделяет два раствора с разными концентрациями, при этом растворитель перемещается через мембрану от раствора менее концентрированного к раствору более концентрированному. Величина осмотического давления раствора определяется концентрацией в нем кинетически активных частичек (молекул, ионов, коллоидных частиц).
Измерение О. д. производят при помощи приборов, называемых осмометрами. Схема простейшего осмометра представлена на рис. Заполненный исследуемым раствором сосуд 1, дно которого представляет собой полупроницаемую мембрану, погружают в сосуд 2 с чистым растворителем. Вследствие осмоса растворитель будет переходить в сосуд 1 до тех пор, пока избыточное гидростатическое давление, измеряемое столбиком жидкости высотой h, достигнет величины, при к рой осмос прекращается.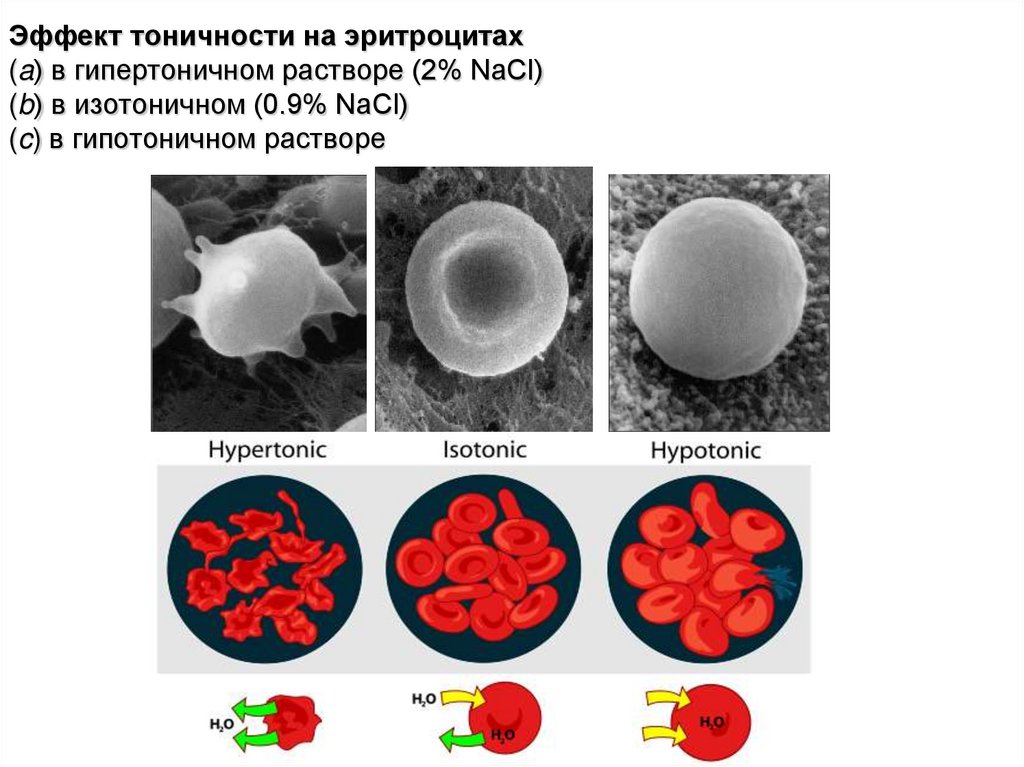 При этом между раствором и растворителем устанавливается осмотическое равновесие, характеризующееся равенством скоростей прохождения молекул растворителя через полупроницаемую мембрану в раствор и молекул раствора в растворитель. Избыточное гидростатическое давление столбика жидкости высотой h является мерой О. д. раствора. Определение О. д. растворов часто производят косвенным методом, например измерением понижения температуры замерзания растворов (см. Криометрия). Этот метод широко применяют для определения О. д. крови, плазмы крови, лимфы, мочи.
При этом между раствором и растворителем устанавливается осмотическое равновесие, характеризующееся равенством скоростей прохождения молекул растворителя через полупроницаемую мембрану в раствор и молекул раствора в растворитель. Избыточное гидростатическое давление столбика жидкости высотой h является мерой О. д. раствора. Определение О. д. растворов часто производят косвенным методом, например измерением понижения температуры замерзания растворов (см. Криометрия). Этот метод широко применяют для определения О. д. крови, плазмы крови, лимфы, мочи.
Осмотическое давление изолированных клеток измеряют методом плазмолиза. Для этого исследуемые клетки помещают в растворы с разными концентрациями какого-либо растворенного вещества, для которого клеточная оболочка непроницаема. Растворы с О. д. большим, чем О. д. содержимого клеток (гипертонические растворы), вызывают сморщивание клеток (плазмолиз) вследствие выхода воды из клетки, растворы
с О. д. более низким, чем О. д. содержимого клетки (гипотонические растворы), вызывают разбухание клеток в результате перехода воды из растворов в клетку. Раствор с О. д., равным О. д. содержимого клеток — изотонический (см. Изотонические растворы), не производит изменения объема клетки. Зная концентрацию такого раствора, О. д. содержимого клетки вычисляют по уравнению (1).
Раствор с О. д., равным О. д. содержимого клеток — изотонический (см. Изотонические растворы), не производит изменения объема клетки. Зная концентрацию такого раствора, О. д. содержимого клетки вычисляют по уравнению (1).
О. д. разбавленных растворов неэлектролитов следует законам, установленным для давления газов, и может быть вычислено но уравнению Вант-Гоффа:
п=сRT, (1)
где п — осмотическое давление, с — концентрация раствора (в молях на 1 л раствора), Т— температура по абсолютной шкале, R— постоянная (0,08205 л·атм/град·моль).
О. д. раствора электролита больше О. д. раствора неэлектролита той же молярной концентрации. Это объясняется диссоциацией молекул растворенного электролита на ионы, вследствие чего возрастает концентрация кинетически активных частиц в растворе. О. д. для разбавленных растворов электролитов вычисляется по уравнению:
где i — изотонический коэффициент, показывающий, во сколько раз О. д. раствора электролита больше О. д. раствора неэлектролита той же молярной концентрации.
Общее О. д. крови человека в норме равно 7—8 атм. Часть О. д. крови, обусловленная содержащимися в ней высокомолекулярными веществами (в основном белками плазмы крови), называется онкотическим, или коллоидно-осмотическим давлением крови, которое в норме равно 0,03—0,04 атм. Несмотря на малую величину, онкотическое давление играет важную роль в регуляции водного обмена между кровеносной системой и тканями. Измерение О. д. находит широкое применение для определения молекулярного веса биологически важных высокомолекулярных веществ, например белков. Осмос и осмотическое давление играют большую роль в процессах осморегуляции, т. е. поддержания осмотической концентрации растворенных веществ в жидкостях организма на определенном уровне. При введении различного рода жидкостей в кровь и в межклеточное пространство наименьшее нарушение в организме вызывают изотонические растворы, т. е. растворы, О. д. которых равно О. д. жидкости организма.иблизительно ~0,5% осмотического давления.
Давление Онкотическое (oncotic Pressure) – давление, характеризующее разницу между существующим осмотическим давлением крови и давлением лимфы или тканевой жидкости. Это давление играет важную роль в регуляции поступления воды из крови в тканевые жидкости, и наоборот. Онкотическое давление оказывают белки, главным образом альбумины (Онкотическое давление – это создаваемое белками плазмы коллоидно-осмотическое давление
Это давление играет важную роль в регуляции поступления воды из крови в тканевые жидкости, и наоборот. Онкотическое давление оказывают белки, главным образом альбумины (Онкотическое давление – это создаваемое белками плазмы коллоидно-осмотическое давление
Изотонические растворы – это особая группа растворов, которые характеризуются осмотическим давлением. Оно имеет такое значение, которым характеризуются жидкости в организме, как то: плазма крови, слезы, лимфа и так далее. Все эти жидкости имеют постоянноем давление в области 7,4 атм. При этом, если в организм будет введена инъекция, то осмотическое давление жидкостей будет нарушено, так как будет нарушено аналогичное равновесие.
Для того чтобы приготовить такой раствор, необходимо произвести некоторые расчеты. Самым известным способом их проведения является не что иное, как изотонический коэффициент Вант Гоффа. С его помощью можно рассчитать изотоническую концентрацию раствора разбавленного вещества, которое не является электролитом. Осмотическое давление, количество раствора, а также его температура находятся в определенной зависимости, которая выражается уравнением Клайперона. Его используют в отношении разбавленных растворов, так как согласно закону Вант Гоффа, вещества, растворенные в жидкости, будут вести себя так же, как и газы, а потому по отношению к ним применимы все так называемые газовые законы.
Осмотическое давление, количество раствора, а также его температура находятся в определенной зависимости, которая выражается уравнением Клайперона. Его используют в отношении разбавленных растворов, так как согласно закону Вант Гоффа, вещества, растворенные в жидкости, будут вести себя так же, как и газы, а потому по отношению к ним применимы все так называемые газовые законы.
Изотонический коэффициент – это не что иное, как параметр, который будет характеризовать поведение вещества в каком-либо растворе. Если говорить о численном эквиваленте, то изотонический коэффициент равен отношению численного значения коллигативного свойства, которым обладает раствор, к такому же свойству неэлектролита, причем той же концентрации, при этом все прочие параметры остаются неизменными.
Физический смысл изотонического коэффициента становится понятным, исходя из определения каждого коллигативного параметра. Все они находятся в зависимости от концентрации вещества в растворе частиц. Неэлектролиты не будут вступать в реакции диссоциации, поэтому каждая отдельная молекула такого вещества будет представлять собой одну частицу. Электролиты же в процессе сольвации будут либо полностью, либо частично распадаться на ионы, при этом образуя несколько частиц. Получается, что и коллигативные свойства раствора будут зависеть от количества содержащихся в нем частиц разных типов, то есть ионов. Таким образом, изотонический коэффициент будет представлять собой смесь разных растворов каждого типа частиц. Если рассмотреть раствор хлорной извести, то можно увидеть, что он состоит из трех видов частиц: катионы кальция, гипохлорит, а также хлорид – анионы. Изотонический коэффициент будет показывать, что в растворе электролита имеется больше частиц, нежели в растворе неэлектролита. Коэффициент будет напрямую зависеть от того, может ли вещество распадаться на ионы – это не что иное, как свойство диссоциации.
Электролиты же в процессе сольвации будут либо полностью, либо частично распадаться на ионы, при этом образуя несколько частиц. Получается, что и коллигативные свойства раствора будут зависеть от количества содержащихся в нем частиц разных типов, то есть ионов. Таким образом, изотонический коэффициент будет представлять собой смесь разных растворов каждого типа частиц. Если рассмотреть раствор хлорной извести, то можно увидеть, что он состоит из трех видов частиц: катионы кальция, гипохлорит, а также хлорид – анионы. Изотонический коэффициент будет показывать, что в растворе электролита имеется больше частиц, нежели в растворе неэлектролита. Коэффициент будет напрямую зависеть от того, может ли вещество распадаться на ионы – это не что иное, как свойство диссоциации.
Так как сильные электролиты полностью подвергаются процессам диссоциации, то вполне оправданно ожидать, что изотонический коэффициент в данном случае будет равен количеству ионов, содержащихся в молекуле. Однако в реальности значение коэффициента будет всегда меньше, чем значение, расчитанное по формуле. Данная позиция обоснована еще в 1923 году Дебаем и Хюккелем. Они сформулировали теорию сильных электролитов: ионы не будут с препятствиями передвигаться, так как будет образовываться оболочка сольвации. Более того, они еще будут и взаимодействовать друг с другом, что приведет, в конце концов, к образованию такой их группы, которая будет передвигаться в одном направлении по раствору. Это и есть так называемые ионные ассоциации, а также ионные пары. Все процессы в растворе будут происходить таким образом, как будто в нем содержится мало частиц.
Данная позиция обоснована еще в 1923 году Дебаем и Хюккелем. Они сформулировали теорию сильных электролитов: ионы не будут с препятствиями передвигаться, так как будет образовываться оболочка сольвации. Более того, они еще будут и взаимодействовать друг с другом, что приведет, в конце концов, к образованию такой их группы, которая будет передвигаться в одном направлении по раствору. Это и есть так называемые ионные ассоциации, а также ионные пары. Все процессы в растворе будут происходить таким образом, как будто в нем содержится мало частиц.
Взаимодействие ионов начнет ослабевать по мере того, как будет повышаться температура, а также уменьшаться их концентрация. Все объясняется тем, что в таком случае уменьшится и вероятность встречи разных частиц в растворе.
Гипертонические растворы
Гипертонические растворы, растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и раствор, гипертоничный для одних клеток, может оказаться изотоничным или даже гипотоничным для др.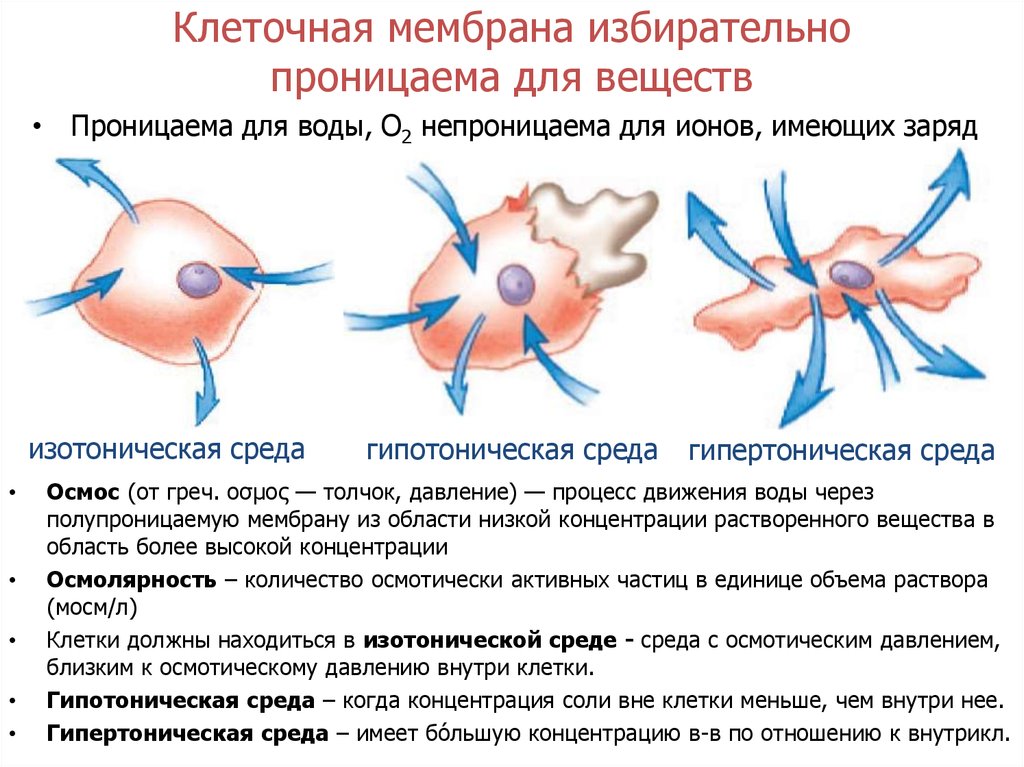 При погружении растительных клеток в Г. р. он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок (см. Плазмолиз). Эритроциты крови человека и животных в Г. р. также теряют воду и уменьшаются в объёме. Г. р. в сочетании с гипотоническими растворами и изотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях.
При погружении растительных клеток в Г. р. он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок (см. Плазмолиз). Эритроциты крови человека и животных в Г. р. также теряют воду и уменьшаются в объёме. Г. р. в сочетании с гипотоническими растворами и изотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях.
Применяется этот раствор в самых разных случаях для лечения холецистита, нефрита, ревмокардита, при воспалительных процессах легких и дыхательных путей, остеомиелита, абсцессов после инъекций, артритов, бронхита, насморка, простуды, головной боли, различных нарывов и язв, при воспалении поджелудочной железы, желчного пузыря, придатков.
Готовят раствор в соотношении 1:10 – на 1часть соли -10 частей воды. Концентрация раствора не должна превышать 10%. Если концентрация раствора будет выше 10%, то в местах наложения повязки могут лопнуть капилляры. А лучше приготовить 8% раствор.
Солевая повязка действует постепенно. Лечебный эффект достигается в течение 7-10 дней, а иногда и более. Повязка должна быть гигроскопичной и воздухопроницаемой. Можно брать льняную или хлопчатобумажную ткань, бывшую в употреблении, либо марлю. Ткань должна быть чистой, без остатков жира, мази, спирта, йода и пр. Не должно их быть и на теле больного. Для салфетки ткань складывается в 4 слоя, а марля в 8 слоев.
Раствор используется горячий. Салфетку смачивают и отжимают так, чтобы она не была слишком сухой или слишком мокрой. Затем ее накладывают и прибинтовывают обычным медицинским (широким) бинтом. Грудную клетку бинтовать нужно достаточно плотно, но так, чтобы дышалось свободно. А вот живот бинтуйте как можно туже – за ночь он опадает, и слишком широкая повязка перестает действовать. Можно закрепить и пластырем. А на груди или спине салфетку, накрытую сухой тканью или полотенцем, удержит сорочка или майка. Чтобы повязка лучше прилегала к спине, на влажную салфетку между лопатками наложите валик из ткани и перебинтуйте его вместе с салфеткой. Утром, после снятия повязки материал нужно хорошо прополоскать в теплой воде. Ни в коем случае поверх салфетки нельзя накладывать целлофан! Это не компресс, повязка должна дышать! Держать ее нужно 10-12 часов, поэтому прикладывать лучше на ночь.
Утром, после снятия повязки материал нужно хорошо прополоскать в теплой воде. Ни в коем случае поверх салфетки нельзя накладывать целлофан! Это не компресс, повязка должна дышать! Держать ее нужно 10-12 часов, поэтому прикладывать лучше на ночь.
Солью можно также лечить и остеохондроз и радикулит. Потребуется от 2 до 4 пачек соли, в зависимости от площади больного отдела позвоночника. Ложитесь на живот, а на спину, прямо на тело вам высыпают 2-4 пачки соли и равномерно распределяют ее по всему больному месту. Поверх соли накладывают влажную марлю, сложенную в 8 слоев или х/б ткань в 4 слоя. На марлю ставят горячий утюг. Вы должны почувствовать легкое приятное покалывание. После этого утюг снимают, чтоб не было ожога. Длится процедура 25-30 минут. 2-3 таких сеанса – и об остеохондрозе или радикулите можно забыть.
Гипотонический раствор — раствор, в котором концентрация растворенных веществ ниже, а концентрация растворителя (воды) выше и который имеет поэтому более низкое осмотическое давление, чем некоторый другой раствор, с которым его сравнивают.
Гипотонические растворы в биологии, различные растворы, осмотическое давление которых ниже, чем в клетках растительных или животных тканей. В гипотонических растворах клетки насасывают воду, увеличиваясь в объёме, и теряют часть осмотически активных веществ (органических и минеральных). Эритроциты крови животных и человека в гипотонических растворах разбухают до такой степени, что их оболочки лопаются и они разрушаются. Это явление называют гемолизом.
Изотонические растворы — водные растворы, изотоничные плазме крови. Простейшим раствором такого типа является 0,9% водный раствор хлорида натрия — так называемый физиологический раствор («физраствор»)[1]. Название это очень условное, так как «физраствор» не содержит многих веществ (в частности, солей калия), необходимых для физиологической деятельности тканей организма.
Содержание [показать]
Разновидности изотонических растворов
Другими примерами изотонических растворов, имеющих более физиологичный состав, являются:
раствор Рингера[2]
раствор Рингера — Локка[2]
раствор Рингера — Тироде
раствор Кребса — Рингера,
Дисоль, Трисоль, Ацесоль, Хлосоль[2]
Лактасол[2]
Приготовление физраствора
При приготовлении растворов соли добавляются последовательно, прибавляя каждую последующую соль только после растворения предыдущей. Для предотвращения выпадения осадка углекислого кальция рекомендуется через раствор бикарбоната натрия пропускать углекислый газ. Глюкозу добавляют в растворы непосредственно перед применением. Все растворы готовят на свежей дистиллированной воде, перегнанной в стеклянной аппаратуре (металлы оказывают значительное влияние на жизнедеятельность тканей).
Для предотвращения выпадения осадка углекислого кальция рекомендуется через раствор бикарбоната натрия пропускать углекислый газ. Глюкозу добавляют в растворы непосредственно перед применением. Все растворы готовят на свежей дистиллированной воде, перегнанной в стеклянной аппаратуре (металлы оказывают значительное влияние на жизнедеятельность тканей).
Действие
Хлористый натрий содержится в плазме крови и тканевых жидкостях организма (концентрация около 0,9 %), являясь важнейшим неорганическим компонентом, поддерживающим соответствующее осмотическое давление плазмы крови и внеклеточной жидкости. В организм натрия хлорид поступает в необходимых количествах с пищей. Дефицит может возникать при различных патологических состояниях, сопровождающихся повышенным выделением, при отсутствии компенсирующего поступления с пищей. Усиленная потеря ионов калия и хлора имеет место при длительном сильном холероподобном поносе, неукротимой рвоте, обширных ожогах, гипофункции коры надпочечников. При снижении концентрации натрия хлорида в плазме крови, вода переходит из сосудистого русла в межтканевую жидкость и развивается сгущение крови. При значительном дефиците спазмируются гладкие мышцы и появляются судорожные сокращения скелетной мускулатуры, нарушаются функции нервной и сердечно-сосудистой систем. Растворы натрия хлорида широко используются в медицинской практике и в зависимости от концентрации разделяются на изотонический (0,9 %) и гипертонический. Раствор (0,89 %) натрия хлорида изотоничен плазме крови человека и поэтому быстро выводится из сосудистого русла, лишь временно увеличивая объем циркулирующей жидкости, поэтому его эффективность при кровопотерях и шоке недостаточна. Гипертонические растворы (3-5-10 %) применяются внутривенно и наружно. При наружной аппликации они способствуют выделению гноя, проявляют антимикробную активность, при внутривенном введении усиливают диурез и восполняют дефицит ионов натрия и хлора.
При снижении концентрации натрия хлорида в плазме крови, вода переходит из сосудистого русла в межтканевую жидкость и развивается сгущение крови. При значительном дефиците спазмируются гладкие мышцы и появляются судорожные сокращения скелетной мускулатуры, нарушаются функции нервной и сердечно-сосудистой систем. Растворы натрия хлорида широко используются в медицинской практике и в зависимости от концентрации разделяются на изотонический (0,9 %) и гипертонический. Раствор (0,89 %) натрия хлорида изотоничен плазме крови человека и поэтому быстро выводится из сосудистого русла, лишь временно увеличивая объем циркулирующей жидкости, поэтому его эффективность при кровопотерях и шоке недостаточна. Гипертонические растворы (3-5-10 %) применяются внутривенно и наружно. При наружной аппликации они способствуют выделению гноя, проявляют антимикробную активность, при внутривенном введении усиливают диурез и восполняют дефицит ионов натрия и хлора.
[править]Показания
Физиологические растворы применяются в качестве дезинтоксикационного средства, для коррекции состояния при обезвоживании, для растворения других лекарственных препаратов, реже как заменитель крови.
Ограничения
При нарушениях функции почек, высоком артериальном давлении и сердечной недостаточности большие объемы назначают с осторожностью.
Способ применения.
Изотонический раствор вводят внутривенно, подкожно (в связи с большим объёмом вводимого раствора — в наружную поверхность бедра) и в клизмах.
Какая разница? – Veloforte
Команда Veloforte
Гипертонический, гипотонический, изотонический — мир спортивных напитков может запутать . Разнообразие жидкостей, которые вы можете налить в свою бутылку, больше похоже на способности супергероев, чем на простой напиток, предназначенный для увлажнения, замены электролитов и придания вам энергии на ходу.
Так что же означают все термины? В чем польза каждого напитка? И что вы должны потягивать, когда? Мы рады, что вы спросили.
Знай свой тонус
Спортивные энергетические напитки подразделяются на три разных типа в зависимости от их концентрации по сравнению с человеческим телом, или тоничности, чтобы дать ему техническое название.
Тонус напитка важен, когда вы тренируетесь, так как он влияет на количество углеводов, электролитов и жидкостей, поступающих в кровь, и на то, как быстро вы можете их усвоить, чтобы повысить свою работоспособность.
Три наиболее часто встречающихся типа спортивных напитков:
- Гипотонический имеет более низкую концентрацию жидкости, сахаров и солей, чем кровь.
- Hypertonic имеет более высокую концентрацию жидкости, сахаров и солей, чем кровь.
- Изотоник имеет аналогичную концентрацию жидкости, сахаров и солей в крови.
Каждый напиток по-своему полезен для тренировок.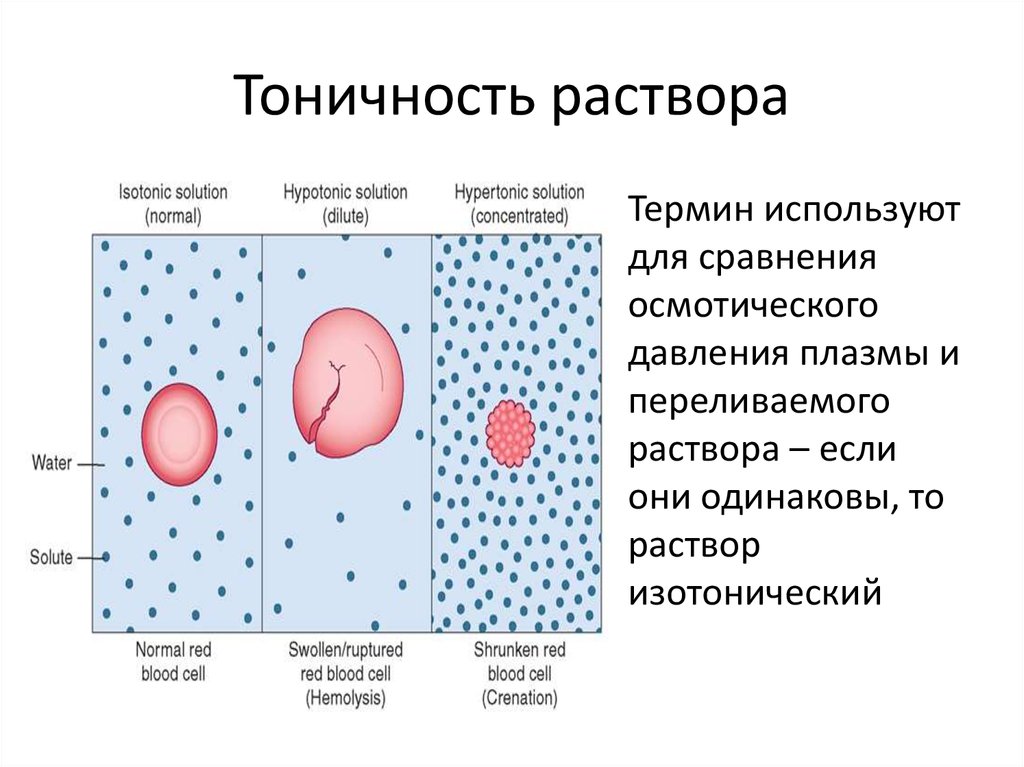 Вот что использовать, когда и почему.
Вот что использовать, когда и почему.
Гипотонические напитки
Подходит для : Быстрая регидратация
Когда использовать : Предварительная гидратация, при коротких тренировках, при длительных поездках, в жаркую погоду; когда вам нужен напиток для быстрого и эффективного восстановления водного баланса.
Что означает гипотонический?
Гипотонический означает, что он имеет более низкую концентрацию растворенных веществ, чем другой раствор . Например, гипотонические напитки имеют более низкую концентрацию углеводов (<5%) и соли, чем кровь. Это означает, что они быстрее всасываются в кровоток для быстрой гидратации и высвобождения электролита.
Гипотоники также могут содержать углеводы, помогающие увеличить общее потребление энергии.
Увлажняющие порошки Attivo и Vivo от Veloforte обеспечивают эту выигрышную комбинацию, обеспечивая быстрое увлажнение и большое количество быстро усваиваемых углеводов, которые добавляют к вашему общему потреблению энергии из батончиков и гелей, чтобы вы были заряжены энергией для успеха.
Наше новейшее и самое фруктовое средство для гидратации, Passo предлагает комбинацию быстрых углеводов и электролитов в невероятно сочной смеси манго и маракуйи, которые обеспечивают гидратацию, энергию и свежесть во время длительных сеансов.
Как действуют гипотонические спортивные напитки?
Когда вы пьете гипотонический напиток, раствор перемещается посредством осмоса через стенки кишечника в кровеносные сосуды. Это означает быструю регидратацию, так как напиток быстро всасывается через слизистую оболочку кишечника и быстро возмещает потерянную жидкость . Существует гораздо меньший риск вздутия живота, судорог и ужасных желудочно-кишечных расстройств, которые могут возникнуть и при употреблении других энергетических напитков.
Гипотонические напитки также обеспечат вам быстрое восполнение электролитов — жизненно важных солей и минералов, теряемых с потом, — чтобы помочь регулировать работу мышц и поддерживать баланс жидкости в организме.
Каковы недостатки гипотонических напитков?
Гипотонические напитки направлены на регидратацию и, следовательно, не обеспечивают максимальное количество углеводов (энергии) . Если вы собираетесь на воскресную длительную пробежку или планируете грандиозный день в седле, используйте эти напитки в сочетании с другим питанием, таким как энергетические батончики Veloforte или натуральные энергетические гели.
Почему бы не попробовать : Veloforte Solo, подслащенный стевией, является низкокалорийным гипотоническим продуктом, который идеально подходит для коротких тренировок, когда вы хотите избежать обезвоживания, но не хотите потреблять больше калорий, чем сжигаете.
Гипертонические напитки
Подходит для : Большие дозы углеводов
Когда использовать : В качестве восстановительного напитка после интенсивных или длительных упражнений, для получения дополнительных углеводов в преддверии гонки.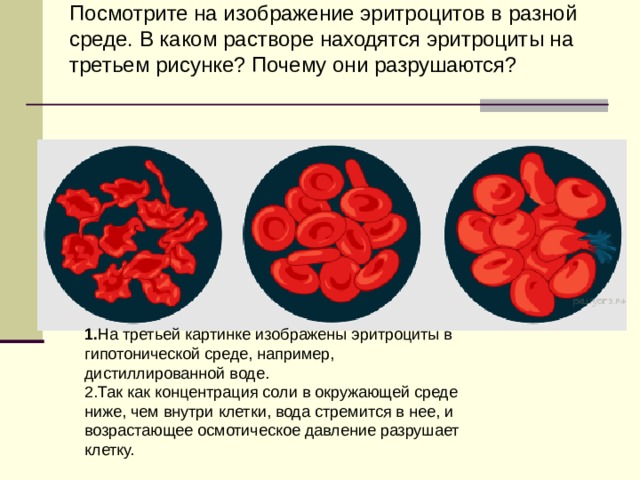
Что означает гипертонус?
Гипертонический означает, что он имеет более высокую концентрацию растворенных веществ, чем другой раствор . Например, гипертонические напитки содержат более высокую концентрацию соли и сахара, чем кровь, что делает их хорошим способом дополнить ежедневное потребление углеводов или пополнить запасы гликогена.
Гипертонические напитки также обычно используются в качестве восстановительных напитков и часто содержат добавленный белок.
Как действуют гипертонические спортивные напитки?
Гипертонические напитки содержат самую высокую дозу углеводов (>8%) среди всех энергетических напитков. Несмотря на более низкую скорость усвоения, чем гипотонические или изотонические напитки, они по-прежнему являются быстрым способом пополнения запасов гликогена , поскольку организм имеет тенденцию поглощать жидкости быстрее, чем твердую пищу.
Каковы недостатки гипертонических напитков?
Гипертонические напитки могут вызвать обезвоживание, так как организм должен перекачивать воду из кровотока в кишечник , чтобы разбавить жидкости, прежде чем он сможет их впитать.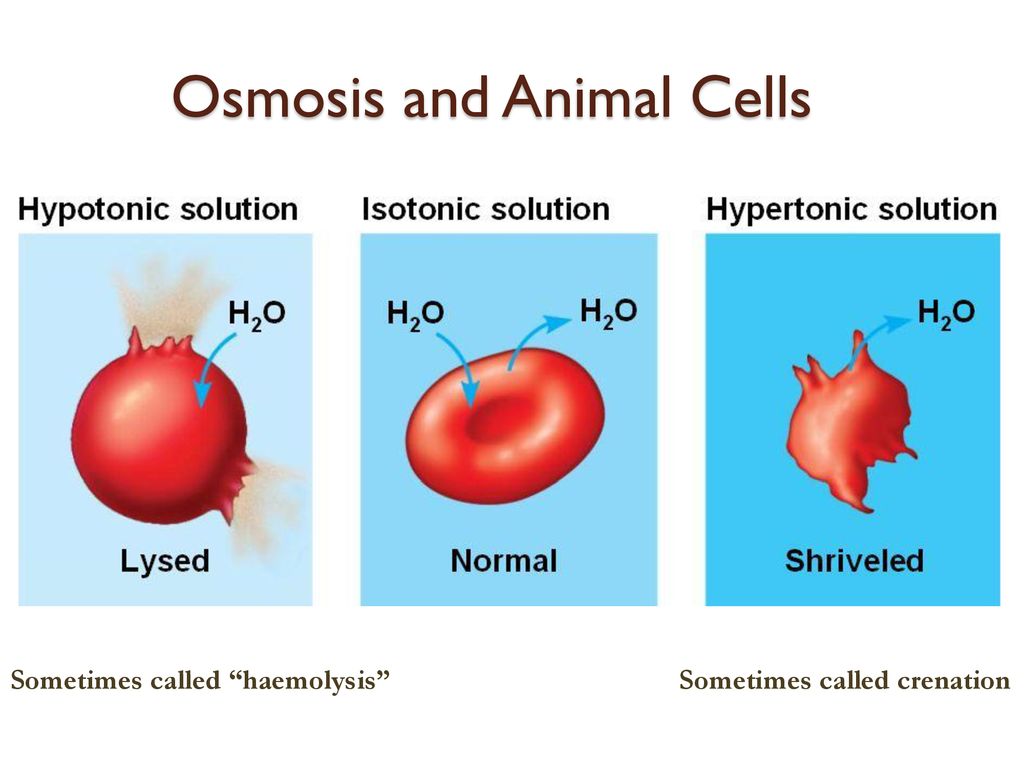 Это может вызвать у вас жажду, а иногда и тошноту. Хотя некоторые ультраспортсмены употребляют гипертонические напитки вместе с другими увлажняющими напитками во время тренировки, их лучше всего пить после тренировки.
Это может вызвать у вас жажду, а иногда и тошноту. Хотя некоторые ультраспортсмены употребляют гипертонические напитки вместе с другими увлажняющими напитками во время тренировки, их лучше всего пить после тренировки.
Почему бы не попробовать : Если вы предпочитаете дозаправляться настоящей едой после тренировки, съешьте закуску или еду вместе с гипотоническим напитком для гидратации Veloforte. Помимо столь необходимой регидратации, вы получите быстрое увеличение быстродействующих углеводов, чтобы пополнить запасы энергии, пока вы ждете переваривания твердых веществ.
Изотонические напитки
Подходит для : Высвобождение углеводов
Когда использовать : Тренировки меньшей продолжительности или высокой интенсивности; когда вы хотите, чтобы углеводы были перегидратированы во время упражнений на выносливость.
Что означает изотонический?
Изотонический означает, что он имеет ту же концентрацию растворенных веществ, что и другой раствор . Например, изотонические напитки имеют такую же концентрацию воды, соли и углеводов (6-8%), что и кровь. Обычно они обеспечивают больше энергии и электролитов, чем гипотонические напитки, но им требуется больше времени, чтобы попасть в кровоток.
Например, изотонические напитки имеют такую же концентрацию воды, соли и углеводов (6-8%), что и кровь. Обычно они обеспечивают больше энергии и электролитов, чем гипотонические напитки, но им требуется больше времени, чтобы попасть в кровоток.
Как действуют изотонические спортивные напитки?
Изотонические напитки являются источником углеводов, которые дают вам энергию во время тренировки и помогают восполнить потерю жидкости и электролитов с потом. Компромисс за дополнительные углеводы заключается в том, что изотоническим напиткам требуется больше энергии, чтобы пройти через стенку кишечника, чем гипотоническим напиткам , поэтому высвобождение энергии и электролитов происходит медленнее.
Каковы недостатки изотонических напитков?
Многие коммерческие спортивные напитки на рынке являются изотоническими, но беглый взгляд на ингредиенты часто показывает высокий уровень сахара, подсластителей и добавок , которые могут вызывать спазмы желудка и вздутие живота.
Если вы склонны к проблемам с желудочно-кишечным трактом, вы можете обнаружить, что разбавление изотонических напитков облегчает их пищеварительную систему. Хотя это изменит скорость, с которой они попадают в кровоток.
Почему бы не попробовать : Если липкая сладость изотонических напитков не нравится вам или вашему кишечнику, Veloforte Vivo и Attivo обеспечивают естественный гипотонический источник энергии с 22 г быстродействующих углеводов на порцию.
Восхитительные ароматы персика, малины и шиповника, а также дикой земляники и базилика получены из сублимированных фруктов, поэтому они имеют чистый вкус, избавляются от химикатов и намного мягче для вашего желудка. Для получения дополнительных углеводов добавьте батончики Veloforte.
На что еще обратить внимание при выборе лучшего спортивного напитка
1. Вкус
При выборе спортивного напитка легко запутаться в содержании углеводов и электролитов, но не забывайте о основы, как это вкусно?
Если вам не нравится вкус или текстура, вы, вероятно, не будете пить достаточное количество жидкости, а регидратация станет рутиной, а не чем-то, чего можно ожидать с нетерпением.
Все наши увлажняющие порошки тщательно разработаны с использованием сбалансированных нот трав и растительных компонентов, которые подчеркивают мягкую фруктовость сублимированных фруктов. Это означает стимулирующий сладкий и пикантный опыт, который больше похож на освежающий чай со льдом, чем на тошнотворный газированный напиток. Что-то, что вы будете с нетерпением ждать и от чего никогда не устанете.
2. Все еще не шипучий
В то время как многие спортивные напитки и шипучие таблетки вызывают появление пузырьков в бутылочках, гидратирующие порошки Veloforte негазированы. Наши негазированные напитки совершенно по-другому ощущаются во рту – никаких пушистых зубов и языка с пищевой содой, только хорошее, чистое освежение.
3. Натуральные ингредиенты
Искусственные добавки, подсластители и ингредиенты, произношение которых вы не можете произнести, не имеют большой питательной ценности и могут причинить вред кишечнику во время тренировки.
Напитки для гидратации Veloforte содержат полностью натуральные продукты на основе богатой электролитами кокосовой воды, розовой гималайской соли для натрия и чистого вкуса, полученного из сублимированных фруктов со всеми необходимыми витаминами и минералами.
Вы получите больше отдачи от затраченных средств, чем с традиционными шипучими увлажняющими таблетками и порошками.
4. Extra power
Если вы хотите, чтобы ваш напиток был более бодрящим, ищите напитки, содержащие кофеин. Veloforte Attivo содержит 75 мг натурального кофеина из гуараны для дополнительного заряда энергии, который поможет преодолеть эту гору или финишную черту.
Хотя кофеин не является источником энергии в отличие от сахара, его преимущества доказаны для всех, кто пытается тренироваться в течение длительного периода времени. Он действует как мягкий стимулятор центральной нервной системы, который может улучшить бдительность и концентрацию и взбодрить вас, если вы чувствуете усталость или вялость.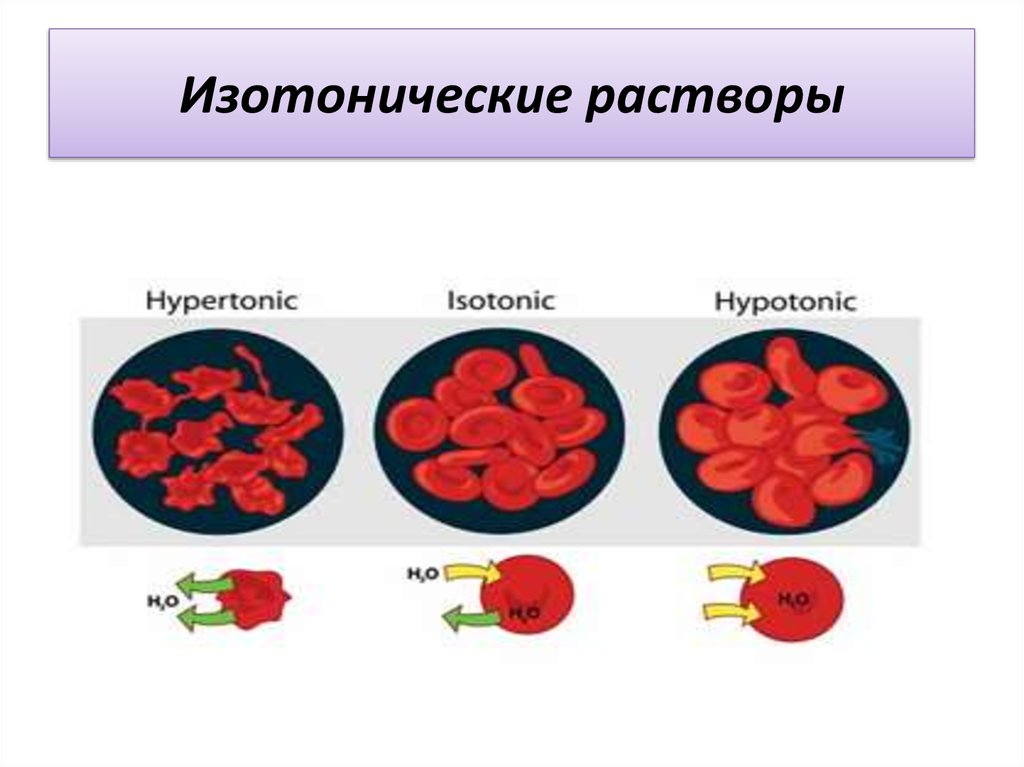
На практике это означает, что своевременная порция кофеина поможет вам тренироваться интенсивнее и дольше. Это также побуждает наш организм сжигать жир в качестве топлива и может уменьшить чувство боли и усталости.
Хотите узнать больше? Прочтите наши руководства по совершенствованию стратегии гидратации во время бега или езды на велосипеде или узнайте больше о различных типах энергетических напитков.
Беговая гидратация: советы и руководство по лучшим напиткам
Гидратация на велосипеде: советы и руководство по лучшим напиткам
Лучшие типы энергетических напитков для езды на велосипеде, чтобы подпитывать вашу поездку
- Теги: бокс кроссфит Езда на велосипеде Во время тренировки Футбол Пеший туризм Увлажнение Железный человек Марафон OCR Регби Бег Плавание Большой теннис Триатлон
Ссылка скопирована
Изотонический, гипотонический или гипертонический раствор
Воздействие изотонической, гипотонической и гипертонической внеклеточной среды на растительные и животные клетки одинаково. Однако из-за клеточных стенок растений видимые эффекты различаются. Хотя некоторые эффекты можно увидеть, жесткая клеточная стенка может скрывать масштабы того, что происходит внутри.
Однако из-за клеточных стенок растений видимые эффекты различаются. Хотя некоторые эффекты можно увидеть, жесткая клеточная стенка может скрывать масштабы того, что происходит внутри.
Осмос и диффузия
Осмос имеет разные значения в биологии и химии. Для биологов это относится к движению воды через полупроницаемую мембрану. Химики используют этот термин для описания движения воды, других растворителей и газов через полупроницаемую мембрану. И биологи, и химики определяют диффузию как движение частиц растворенного вещества (растворенных материалов) из области с более высокой концентрацией в область с более низкой концентрацией до тех пор, пока не будет достигнуто равновесие.
Как работает осмос
Осмос — это пассивная транспортная система, то есть не требующая энергии. Это заставляет воду двигаться внутрь и наружу клеток в зависимости от концентрации растворенных веществ в окружающей среде. Это движение вызвано градиентом концентрации, создаваемым при различных концентрациях растворенных веществ внутри и снаружи клетки. Неважно, какие растворенные вещества составляют растворенное вещество, важна только общая концентрация. Важно отметить, что клетки не регулируют движение молекул воды внутрь и наружу внутриклеточной жидкости. Они полагаются на другие системы организма (такие как почки) для обеспечения изотонической внешней среды (см. ниже).
Неважно, какие растворенные вещества составляют растворенное вещество, важна только общая концентрация. Важно отметить, что клетки не регулируют движение молекул воды внутрь и наружу внутриклеточной жидкости. Они полагаются на другие системы организма (такие как почки) для обеспечения изотонической внешней среды (см. ниже).
Изотонический раствор
Клетка в изотоническом растворе находится в равновесии с окружающей средой, что означает, что концентрации растворенных веществ внутри и снаружи одинаковы ( iso означает , равное на латыни). В этом состоянии нет градиента концентрации и, следовательно, нет большого движения воды внутрь или наружу. Однако молекулы воды свободно входят в клетку и выходят из нее, и скорость движения одинакова в обоих направлениях.
Гипотонический раствор
Гипотонический раствор имеет более низкую концентрацию растворенного вещества, чем внутри клетки (префикс гипо на латыни означает ниже или ниже ).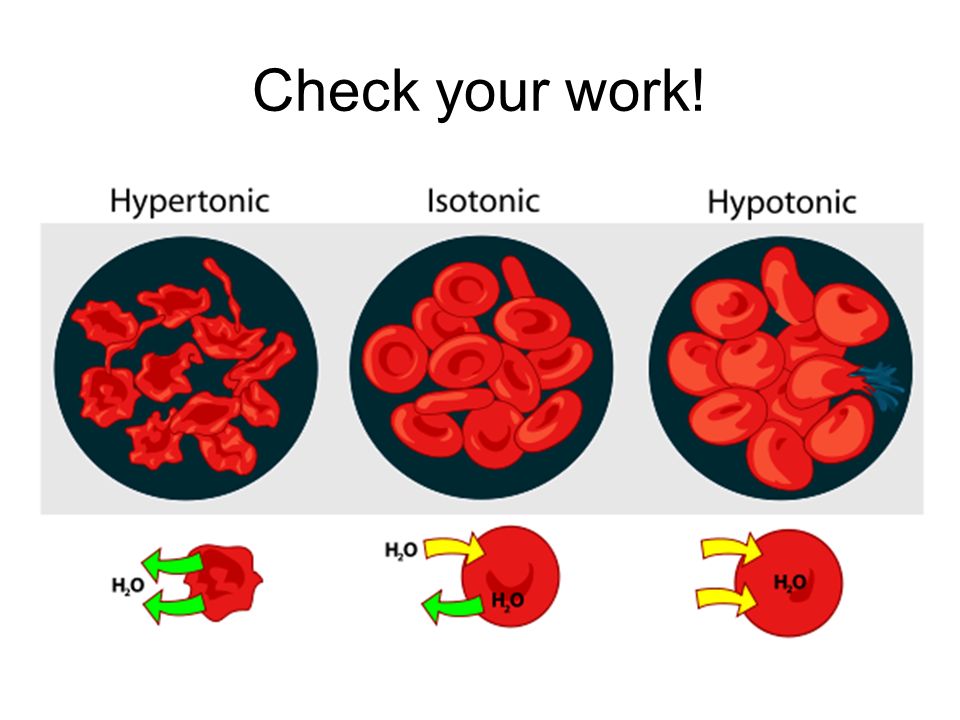 Разница в концентрации между отсеками вызывает попадание воды в клетку. Клетки растений могут переносить эту ситуацию лучше, чем клетки животных. У растений большая центральная вакуоль заполняется водой, и вода также поступает в межклеточное пространство. Комбинация этих двух эффектов вызывает тургорное давление, которое давит на клеточную стенку, заставляя ее выпячиваться. Клеточная стенка помогает предотвратить разрыв клетки. Однако, если оставить ее в сильно гипертоническом растворе, животная клетка будет набухать, пока не лопнет и не погибнет.
Разница в концентрации между отсеками вызывает попадание воды в клетку. Клетки растений могут переносить эту ситуацию лучше, чем клетки животных. У растений большая центральная вакуоль заполняется водой, и вода также поступает в межклеточное пространство. Комбинация этих двух эффектов вызывает тургорное давление, которое давит на клеточную стенку, заставляя ее выпячиваться. Клеточная стенка помогает предотвратить разрыв клетки. Однако, если оставить ее в сильно гипертоническом растворе, животная клетка будет набухать, пока не лопнет и не погибнет.
Гипертонический раствор
На латыни префикс гипер означает над или над . Гипертонические растворы имеют более высокую концентрацию растворенного вещества, чем внутри клетки. Это заставляет воду устремляться наружу, заставляя клетку сморщиваться или сморщиваться. Это хорошо видно в красных кровяных тельцах, подвергающихся процессу, называемому креацией. Растительные клетки в гипертоническом растворе могут выглядеть как игольница из-за того, что происходит внутри. Клеточная мембрана отслаивается от клеточной стенки, но остается прикрепленной в точках, называемых плазмодесмами. Плазмодесмы — это крошечные каналы между растительными клетками, которые используются для транспорта и связи. Когда внутренняя мембрана сжимается, она сужает плазмодесмы, что приводит к состоянию, называемому плазмолизом.
Клеточная мембрана отслаивается от клеточной стенки, но остается прикрепленной в точках, называемых плазмодесмами. Плазмодесмы — это крошечные каналы между растительными клетками, которые используются для транспорта и связи. Когда внутренняя мембрана сжимается, она сужает плазмодесмы, что приводит к состоянию, называемому плазмолизом.
Comparison Chart
| Isotonic Solution | Hypotonic Solution | Hypertonic Solution | ||
|---|---|---|---|---|
| High level of solutes outside of the cell | No | No | Yes | |
| Low level of solutes вне клетки | Нет | Да | Нет | |
| Движение воды зависит от типа растворенного вещества | Нет | No | No | |
| If uncontrolled, may lead to cell death | No | Yes | Yes | |
| Can cause the cell to wrinkle/shrivel | No | No | Yes | |
| Может вызывать набухание/разрыв клетки | Нет | Да | Нет | |
| У растений вызывает плазмолиз | Нет | Нет | ДаДа | 0294 |
| In plants, results in turgor pressure inside the cell | No | Yes | No | |
| Causes water movement via osmosis | No | Yes | Yes | |
| Represents a homeostatic state | Да | Нет | Нет |
На изображении выше показано, что происходит с клеткой в изотоническом, гипертоническом и гипотоническом растворах.