Дисбактериоз у грудничков. Как лечить дисбактериоз кишечника у новорожденного
Одной из самых важных проблем, волнующих родителей грудничков, было, есть и будет состояние органов пищеварения малыша. Ничего удивительного — ведь от того, как питается ребенок, от того, как функционирует его кишечник, зависит и развитие, и становление иммунитета, и даже настроение крохи. Малыш сам при малейшем неблагополучии со стороны пищеварения громко сигнализирует об этом, вселяя в своих родителей еще большую тревогу. Так что же стоит за большинством случаев кишечных колик, младенческих запоров, гиповитаминозов и беспокойного поведения?
Кишечник и его «обитатели»
Появившись на свет, ребенок попадает из абсолютно стерильной среды материнского организма в мир, заселенный огромным количеством разнообразных микробов. Он не может оставаться стерильным долгое время. Практически сразу после рождения его организм начинает заселяться представителями микробного мира. Кишечник ребенка частично заселяется микробами еще в процессе родов, когда малыш продвигается по родовым путям матери.
Все микроорганизмы кишечника делятся на две группы. Первая группа называется облигатной флорой. Эти микробы должны присутствовать в кишечнике обязательно. Ее составляют микробы, без которых не может быть ни нормального пищеварения, ни стойкого иммунитета, ни хорошего самочувствия. Это — бифидобактерии, лактобактерии и кишечная палочка. Также в эту группу входят бактерии-сапрофиты, не оказывающие никакого влияния на здоровье человека — ни положительного, ни отрицательного. Это бактероиды и энтерококки.
Вторая группа называется факультативной флорой. Ее присутствие в кишечнике не обязательно. Более того, при неблагоприятных условиях, к которым относится снижение иммунитета, инфекции, стресс, травма, погрешности в питании, микробы из этой группы могут стать патогенными (болезнетворными) и, размножившись в большом количестве, вызвать клинические проявления кишечной инфекции. Среди них есть микроорганизмы, именуемые условно патогенными (клостридии, клебсиелы) и микроорганизмы, присутствия которых в кишечнике ребенка в норме быть не должно. Это стафилококки, протей, дрожжевые грибы рода Кандида. Являясь условно патогенными для взрослого человека, для младенца они становятся болезнетворными непременно, то есть, если у взрослого эти микроорганизмы вызовут заболевание I только в определенных случаях, то у ребенка всегда.
Говоря о микробах, обитающих в кишечнике, нельзя не остановиться особо на группе полезных микробов.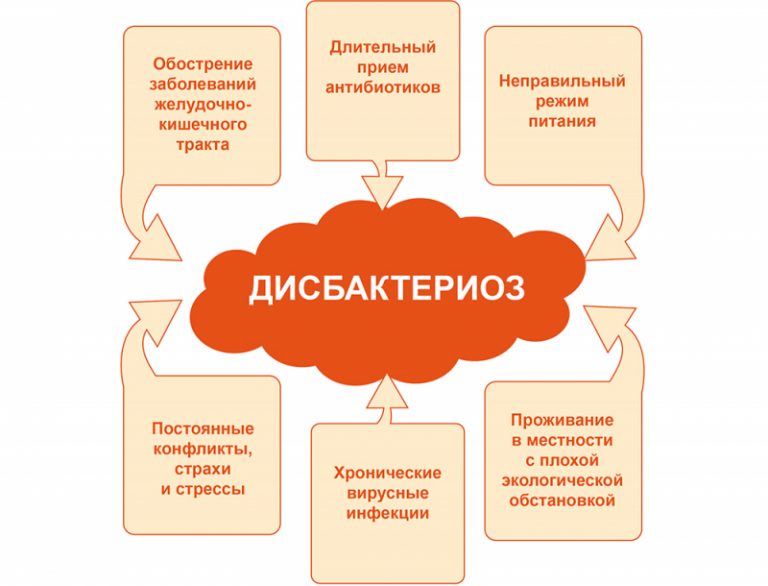 Это лактобактерии и бифидобактерии, являющиеся защитным фактором номер один. Существуя в кишечнике, они, во-первых, создают там условия, совершенно не подходящие для жизни болезнетворных микробов. Таким образом, они своей жизнедеятельностью обеспечивают защиту кишечника от избыточного роста условно-патогенных и патогенных микроорганизмов. Во-вторых, эти микробы стимулируют выработку иммунной системой ребенка собственных иммуноглобулинов — надежного щита на пути инфекции извне. В-третьих, бифидобактерии и лактобактерии способствуют выработке в кишечнике естественных витаминов, таких, как В6 В12 и фолиевая кислота. В-четвертых, эти микроорганизмы способствуют всасыванию в кишечнике таких важных компонентов пищи, как железо, кальций и витамин D. И, наконец, они стимулируют перистальтику (двигательную функцию) кишечника.
Это лактобактерии и бифидобактерии, являющиеся защитным фактором номер один. Существуя в кишечнике, они, во-первых, создают там условия, совершенно не подходящие для жизни болезнетворных микробов. Таким образом, они своей жизнедеятельностью обеспечивают защиту кишечника от избыточного роста условно-патогенных и патогенных микроорганизмов. Во-вторых, эти микробы стимулируют выработку иммунной системой ребенка собственных иммуноглобулинов — надежного щита на пути инфекции извне. В-третьих, бифидобактерии и лактобактерии способствуют выработке в кишечнике естественных витаминов, таких, как В6 В12 и фолиевая кислота. В-четвертых, эти микроорганизмы способствуют всасыванию в кишечнике таких важных компонентов пищи, как железо, кальций и витамин D. И, наконец, они стимулируют перистальтику (двигательную функцию) кишечника.
Правильное соотношение числа бактерий в кишечнике очень важно, при его нарушении происходит снижение иммунитета, а значит, повышается риск кишечных инфекций, возникает гиповитаминоз, может развиться анемия из-за недостаточного поступления железа и рахит — из-за дефицита кальция и витамина D.
Как формируется микрофлора кишечника?
Итак, ребенок рождается со стерильным кишечником. Соприкосновение с окружающими его в родильном зале предметами становится первым столкновением с микробным миром, отличным от материнского. В родовых путях матери в норме преобладают лактобактерии, бифидобактерии, кишечная палочка. Проходя по родовым путям матери, ребенок инфицируется этими микроорганизмами, и они частично заселяют его кишечник.
Однако этих микробов недостаточно, да и иммунная система новорожденного еще слишком несовершенна, чтобы полноценно противостоять натиску чужеродных микробов. Поэтому в первые минуты жизни младенцев укладывают маме на живот — ее кожа отдает часть своей микрофлоры, защищая ребенка от первичного заселения чужими микробами.
Но еще более важно первое прикладывание к груди. Когда новорожденный младенец берет в ротик материнский сосок, когда в его желудок попадают первые капли молозива, происходит закладка фундамента здоровья ребенка. Молозиво матери является поистине кладезем самых различных защитных факторов, обусловливающих становление как иммунитета, так и кишечной микрофлоры. В молозиве содержатся так называемые бифидогенные факторы, способствующие росту незаменимых бифидобактерии. Попадая в кишечник ребенка в первые два часа его жизни, бифидоргенные факторы создают там условия, благодаря которым бифидобактерии, полученные новорожденным при рождении, не погибают, а, напротив, растут и размножаются, формируя нормальную микрофлору кишечника. Кроме того, в молозиве содержатся иммуноглобулины, вырабатываемые материнским организмом в ответ на те инфекции, которыми она переболела за свою жизнь. Таким образом, малыш получает своеобразную прививку, и этот иммунитет будет защищать его на протяжении всего первого года жизни. Не вызывает никаких сомнений факт, что те младенцы, которые были приложены к груди в первый час жизни, быстрее и благополучнее преодолевают процесс формирования кишечной микрофлоры, у них реже развивается нарушение микробного пейзажа кишечника, они значительно лучше прибавляют в весе.
Молозиво матери является поистине кладезем самых различных защитных факторов, обусловливающих становление как иммунитета, так и кишечной микрофлоры. В молозиве содержатся так называемые бифидогенные факторы, способствующие росту незаменимых бифидобактерии. Попадая в кишечник ребенка в первые два часа его жизни, бифидоргенные факторы создают там условия, благодаря которым бифидобактерии, полученные новорожденным при рождении, не погибают, а, напротив, растут и размножаются, формируя нормальную микрофлору кишечника. Кроме того, в молозиве содержатся иммуноглобулины, вырабатываемые материнским организмом в ответ на те инфекции, которыми она переболела за свою жизнь. Таким образом, малыш получает своеобразную прививку, и этот иммунитет будет защищать его на протяжении всего первого года жизни. Не вызывает никаких сомнений факт, что те младенцы, которые были приложены к груди в первый час жизни, быстрее и благополучнее преодолевают процесс формирования кишечной микрофлоры, у них реже развивается нарушение микробного пейзажа кишечника, они значительно лучше прибавляют в весе.
На протяжении следующих 3-5 дней жизни ребенка происходит нарастающее инфицирование кишечника различными микроорганизмами, среди которых наряду с кишечной палочкой, бифидобактериями, лактобактериями присутствуют и условно патогенные микроорганизмы в достаточно большом количестве. В результате этого на протяжении первой недели после рождения развивается транзиторный (временный, преходящий) дисбактериоз кишечника. Проявляется он в виде неустойчивого водянистого стула, наличия в нем большого количества слизи, зелени, а также спастическими болями в животе, срыгиваниями. Но уже к концу первой недели наступает следующая фаза микробного заселения кишечника, когда бифидобактерии и лактобактерии начинают вытеснять других представителей микробного мира.
Транзиторный дисбактериоз кишечника не является заболеванием и при отсутствии отягощающих факторов (недоношенности, длительного приема антибиотиков, инфекционных заболеваний) благополучно завершается на второй неделе жизни ребенка. Однако для формирования нормальной микрофлоры необходим ряд важнейших условий — раннее (в течение первого часа жизни ребенка) прикладывание к груди, исключительно грудное вскармливание на протяжении первого месяца жизни малыша и, в идеале, совместное пребывание матери с ребенком. При несоблюдении этих условий риск развития истинного дисбактериоза, а вместе с ним и пищевой аллергии, нарушений пищеварения, снижения иммунитета, многократно возрастает.
Однако для формирования нормальной микрофлоры необходим ряд важнейших условий — раннее (в течение первого часа жизни ребенка) прикладывание к груди, исключительно грудное вскармливание на протяжении первого месяца жизни малыша и, в идеале, совместное пребывание матери с ребенком. При несоблюдении этих условий риск развития истинного дисбактериоза, а вместе с ним и пищевой аллергии, нарушений пищеварения, снижения иммунитета, многократно возрастает.
Дисбактериоз: что беспокоит малыша?
Младенец, в кишечнике которого нарушен количественный и качественный состав микрофлоры, зачастую ведет себя беспокойно, у него нарушается сон из-за болезненных спазмов кишечника, которые носят приступообразный характер и проявляются через 1,5-2 ч. после кормления. Практически всегда это сопровождается вздутием живота вследствие усиленного газообразования, урчанием по ходу кишечника. Вследствие вздутия живота и нарушения продвижения пищи по кишечнику отмечаются срыгивания и рвота. В особенно тяжелых случаях дисбактериоз кишечника сопровождается синдромом мальабсорбции (нарушением всасывания питательных веществ в тонком кишечнике), что проявляется поносом (пенистый кал с кислым или гнилостным запахом) и снижением темпов прибавки массы тела.
У многих малышей на фоне дисбактериоза развиваются упорные запоры, поскольку при отсутствии нормального числа бифидобактерий не вырабатывается в должном количестве вещество, стимулирующее сократительную активность кишечника.
По своему течению дисбактериоз бывает компенсированный и некомпенсированный.
При компенсированном дисбактериозе кишечника клинических проявлений нет. Ребенок чувствует себя вполне удовлетворительно, и нарушение микробного пейзажа становится случайной находкой, когда анализ кала (кстати, это исследование служить основным лабораторным критерием дисбактериоза) сдают совсем по другому поводу.
Некомпенсированный дисбактериоз сопровождается всеми теми клиническими признаками, о которых говорилось выше. В таких случаях жалоб очень много и вопрос о том, нуждается ребенок в лечении или нет, не поднимается. Родители малыша стремятся как можно скорее провести наиболее эффективный курс лечения, чтобы избавить ребенка от страданий.
В таких случаях жалоб очень много и вопрос о том, нуждается ребенок в лечении или нет, не поднимается. Родители малыша стремятся как можно скорее провести наиболее эффективный курс лечения, чтобы избавить ребенка от страданий.
Что же касается первого случая, когда жалоб практически нет, малыш хорошо набирает вес, прекрасно или вполне удовлетворительно спит, нет явных проявления аллергии, то родители задают традиционный вопрос: «Зачем лечить ребенка, если его ничего не беспокоит?» У детей более старшего возраста дело так и обстоит — если обнаруживается компенсированный дисбактериоз кишечника, то в лечении он, как правило, не нуждается. Совсем по-другому решается этот вопрос у грудничков — у них дисбактериоз в лечении нуждается в любом случае, потому что у таких маленьких детей компенсация нарушенной микрофлоры кишечника — состояние временное и очень неустойчивое вследствие несовершенства иммунитета. При малейшем нарушении этого равновесия (а его может вызвать и прорезывание зубов, и прививка, и переохлаждение и перевод на искусственное вскармливание, и простая простуда, и даже стресс) дисбактериоз становится некомпенсированным. Именно поэтому любой дисбактериоз у младенцев нуждается в лечении, которое должно быть строго индивидуальным, взвешенным, основанным на лабораторных данных, комплексным.
Именно поэтому любой дисбактериоз у младенцев нуждается в лечении, которое должно быть строго индивидуальным, взвешенным, основанным на лабораторных данных, комплексным.
Лечение и профилактика дисбактериоза
Одним из самых главных моментов в лечении дисбактериоза является грудное вскармливание. Любой ребенок нуждается в материнском молоке как можно дольше на протяжении первого года жизни. Дети же с проявлениями дисбактериоза кишечника — особенно. Как уже говорилось, материнское молозиво содержит множество веществ, способствующих формированию нормальной микрофлоры и защите от условно-патогенных микроорганизмов. Но и зрелое материнское молока не менее ценно с точки зрения профилактики нарушений микрофлоры кишечника. Оно не только обеспечивает оптимальные условия для роста здоровой микрофлоры, но и поддерживает существующее равновесие между бифидобактериями, лактобактериями и кишечной палочкой, помогая осуществлению полноценного пищеварения и предотвращая развитие аллергических реакций.
Однако при невозможности грудного вскармливания нужно отдавать предпочтение адаптированным смесям, обогащенным защитными факторами. Это и кисломолочные смеси; и смеси, содержащие живые бактерии; и смеси, в состав которых входят пребиотики — вещества, помогающие усвоению и размножению здоровой микрофлоры. Все эти смеси можно применять только по назначению врача.
После бактериологического исследования кала и постановки диагноза лечение (коррекция микрофлоры) должно состоять из двух этапов.
Первый этап включает подавление роста условно патогенных микроорганизмов. Достигается это или при помощи специальных иммунопрепаратов (бактериофагов), обладающих способностью поглощать и растворять внутри себя микробные клетки, или при помощи кишечных антисептиков или антибиотиков. Практически всегда при проведении бактериологического исследования кала проводится и определение чувствительности условно патогенных микробов к тому или иному бактериофагу или антибиотику. Безусловно, использование бактериофагов предпочтительнее. Если же по какой-то причине их применение невозможно, то из ряда антибактериальных препаратов необходимо выбирать те, которые, действуя только в просвете кишечника, не попадают в кровь и не оказывают общего воздействия на организм.
Безусловно, использование бактериофагов предпочтительнее. Если же по какой-то причине их применение невозможно, то из ряда антибактериальных препаратов необходимо выбирать те, которые, действуя только в просвете кишечника, не попадают в кровь и не оказывают общего воздействия на организм.
Второй этап коррекции микробного пейзажа кишечника преследует цель заселения его здоровой флорой и создания условий, подходящих для ее роста. Наряду с уже упоминавшимися пребиотиками для этого используются пробиотики — препараты, которые содержат живые микроорганизмы, такие, как известные нам бифидобактерии, лактобактерии и кишечная палочка, а также продукты их жизнедеятельности, помогающие им успешно поселиться в кишечнике. Курс лечения назначает в каждом конкретном случае врач. Пребиотики содержат неперевариваемые вещества, которые оказывают благоприятное воздействие на рост здоровой микрофлоры, и активизирует ее. К ним относится лактулоза, олигосахариды, клетчатка. Эти компоненты к тому же стимулируют двигательную функцию кишечника, помогая справиться с запорами.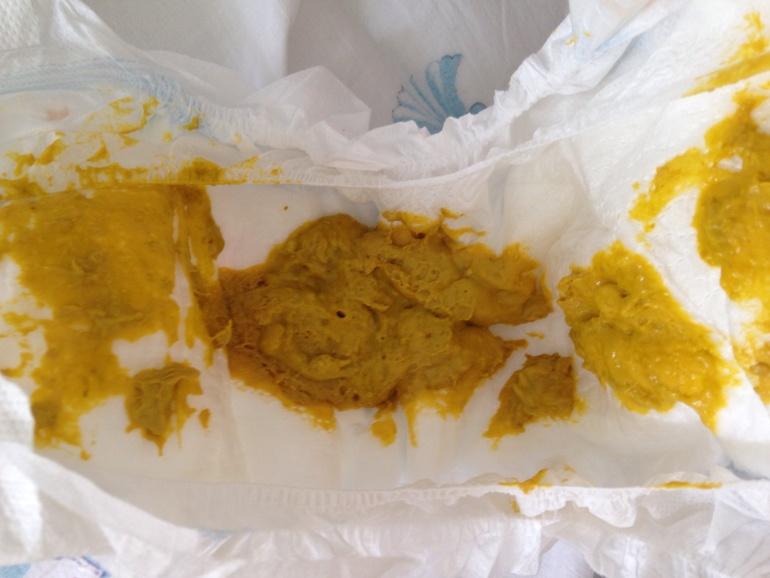
Так как же предупредить развитие дисбактериоза у малыша? Прежде всего, планируя беременность, будущей маме необходимо провести обследование у гинеколога, чтобы вовремя выявить и вылечить возможные нарушения флоры половых органов. Если беременность уже наступила, то не поздно позаботиться об этом сейчас — в настоящее время достаточно средств, позволяющих проводить такое лечение во время беременности. Необходимо тщательно следить за диетой, избегать приема антибиотиков, вести здоровый во всех отношениях образ жизни. Кроме того, нелишне заранее поинтересоваться в роддоме, практикуют ли в нем совместное пребывание матери и ребенка и как скоро после родов новорожденных прикладывают к груди.
Мамочки будьте спокойней, не впадайте в панику — дисбактериоз достаточно надуманная болезнь, он не так страшен, как звучит.
И если вы кормите грудью, то флора в кишечнике нормальзуется сама.
Единственное что, своё питание должно быть правильным. А так понятно дело, что если вы едите куриные окорочка, а они почти все наколоты антибиотиком, то и малышу может передастся. Отсюда и дисбак.
Отсюда и дисбак.
У моего ребёнка в 3 месяца была сильная сыпь по всему лицу. этто или аллергия или как раз нехватает бифидобактерий. Мы пропили курс бифидумбактерина и сыпь прошла.
Сейчас ребёнку 9 месяцев, с какашками всё в порядке и уже ходит в горшок. ))) На ГВ стул был жидкий 6 раз в день, с введением прикорма стал более плотным 1-2 раза в день.Обычно по утрам сажаю на горшок.
отличная статья! правда, по моему, по послеждним данным ребенок уже не со стерильным рождается кишечником.
пребиотики — очень важно, ибо без питания все наши заливания бифидобактерий в виде кисломолочки и препаратов — ничего не дадут! пробиотики не закрепятся на ПМЖ в кишечнике.
нам кстати недавно рекомендовали ввести кашу с пребиотиками, мы ввели Humana банановую.
мне врач сказал — мама, если сами часто простужаетесь (а я еще молочницу люблю ловить часто…) себе тоже добавляйте во взрослую кашу ложку-другую смеси — помогает восстановить имунитет
так и делаю
Ууу, тронутая нами тема уже не раз. И опробованная множеством препаратов. Увы многие действовали не так как им надо было действовать. Благодаря некоторым приходилось клизмы делать во второй и даже(!!!) в третий раз. К тому же у нас ребеночек немного недоношеный, ну и существовал некоторый риск несварения и дополнительных побочных эффектов
Перерыты всевозможные страницы в интернете, попался мне бифиформ из предыдущего сообщения «Лайки». Он отлично гармонировал с нашим малышом и спустя пару суток, прошли и колики и запоры. Теперь он всегда с нами в нашей общей аптечке.
Я не совсем согласна с автором. Лечить нужно. Ни в коем случае не запускать и не пускать на самотек, мол не стоит вмешиваться в природу. Какие муки терпит малыш! Сначала тоже пробовали и клизмочки, и компрессы… вся эта «народная» медицина не дает таких результатов. Как то нам совсем плохо стало, скорее в аптеку. Вот там нам и помогли. Женщина советовала пробиотики. Дала нам бифиформ бэби. Результат налицо. Жалею, что с первых дней не стали принимать. не было бы никаких проблем вкорне. И безопасен самое главное, даже для грудничков.
2012-09-12, polina127И диагноз есть, и болезнь тоже. Хотите убедиться — антибиотиков сильных попейте, а потом когда кишечник начнет с ума сходить- мы Вам сообщим, что это Вам чудиться. Ибо болезни то нет :)))
Неоднократно сталкивалась с этим заболеванием. Проверенный метод лечения — хилак форте. помогает отлично. Правда курс нужно обязательно полностью пропить. У меня дисбактериоз обычно проявляется на югах, поэтому лекарство вожу с собой.
Если долго мучатся, то что нибудь получится! Так вот, как то раз мы приехали с дачи ( были на даче 4 дня) и у нас закрепило животик( Клизму делать нам не нравится, но делали. Подруги мне посоветовали бифиформ. Мне стало интересно, что это такое, прочитала пару статей и решила попробовать. Бифиформ бейби, там идет суспензия и пипетка, очень удобная штука. В общем он нам помог, хороший препарат.
2012-04-16, Papayaпрочитала с удовольствием! у нас тоже кстати дисбиоз был по младенчестве, намучились тогда — страх! а все из-за врачихи, которая сказала что он сам пройдет, а он со временем только хуже да хуже становился. в конце концов достало это все, пошла к другому врачу, тот нам хилак-форте назначил курсом, пропили — и все прошло. сейчас иногда его для профилактики пропиваем, проблем с ЖКТ не имеем, ТТТ
2011-01-08, PorinaВсего 23 отзыва Прочитать все отзывы.
Дисбактериоз кишечника у грудничка — симптомы и лечение кишечника
Новорожденные дети и груднички более подвержены заболеваниям, чем люди остальных возрастов. И лечение дисбактериоза (дисбиоза) кишечника у малышей до года – непростая задача для мам и врачей. Между тем, это состояние далеко не столь опасно, как представляется на первый взгляд, и с ним можно справиться относительно простыми способами.
Дисбактериоз у грудничков: что это такое?
В норме кишечник малыша должен быть заселен определенными видами бактерий. Нарушение состава микрофлоры может и ничем себя не проявлять, но может и приводить к неприятным явлениям.
При рождении кишечник малыша стерилен. Однако затем ЖКТ постепенно начинает заселяться бактериями, попадающими в него из окружающей среды. Это происходит, прежде всего, в процессе кормления малыша, при контактах с матерью и т.д. К году кишечная среда стабилизируется.
Наиболее важными и полезными микроорганизмами среди всей кишечной микрофлоры признаны две группы бактерий – бифидобактерии и лактобациллы. Они в норме составляют до 90% содержимого толстого кишечника. Остальные бактерии занимают нейтральное положение. Это стрептококки, энтерококки, кишечная палочка. Их называют условно-патогенными, так как при нормальных условиях они не опасны. Набор и соотношение видов нейтральной микрофлоры уникальны для каждого ребенка.
Микрофлора кишечника участвует в выработке некоторых полезных веществ, способствует регенерации слизистой кишечника. Однако основная функция полезной микрофлоры кишечника – защитная.
Снижение численности полезной микрофлоры дает возможность занять ее место патогенным бактериям. Это могут быть как условно-патогенные микроорганизмы, ранее обитавшие в ЖКТ, так и проникшие в кишечник извне. Патогенные бактерии выделяют большое количество токсинов, которые частично могут попадать в кровь. При этом снижается иммунитет, нарушается формирование стула, может произойти общая интоксикация.
Причины
Органы пищеварения у грудничка еще несовершенны, поэтому высока их уязвимость к патогенным микроорганизмам. Однако чаще всего причины дисбактериоза кроются в питании. Основной фактор риска – искусственное вскармливание малыша, которому еще не исполнился год. Поэтому лучший способ профилактики дисбиоза у грудничка – вскармливание его материнским молоком. Ведь женское молоко содержит антитела к основным патогенным микроорганизмам (шигеллам, ротавирусам, кишечной палочке, холерному вибриону, сальмонеллам), вещества, способствующие росту нормальной микрофлоры.
Фото: PV productions / Shutterstock.com
Малыши, находящиеся на естественном вскармливании, имеют более высокий иммунитет, а их ЖКТ работает более стабильно. Поэтому дисбактериоз у ребенка, находящемся на естественном вскармливании – явление нечастое. Дисбактериоз у таких детей обычно проходит самостоятельно. Обычно дисбактериоз возникает у детей, которых рано перевели на искусственное вскармливание или поздно приложили к груди.
Состав женского молока также влияет на здоровье ЖКТ малыша. Нередко причиной плохого качества молока, его низких защитных функций является неправильная диета матери.
Также первопричиной дисбактериоза может быть прием антибиотиков, которые без разбору уничтожают все типы бактерий. Именно поэтому прием антибиотиков нельзя проводить самостоятельно, без консультации с врачом. Небезопасно также лечение ребенка другими типами медикаментов, например, противовоспалительными средствами. Недопустимо давать любые медикаменты ребенку без предписания врача. Но опасным может быть и прием препаратов матерью во время вскармливания ребенка молоком или на последних месяцах беременности. Способствовать синдрому могут также:
• осложнения при родах,
• тяжелые системные и инфекционные болезни малыша,
• стрессы,
• глистные инвазии.
Синдром чаще наблюдается у недоношенных малышей или у детей с ослабленным иммунитетом.
Симптомы дисбактериоза у грудничков
Внешне дисбактериоз у грудничков может проявляться по-разному. Основные симптомы – это нарушения стула. Каловые массы меняют цвет и консистенцию, в кале появляется слизь. Нормальный стул у младенца имеет желтый цвет и консистенцию сметаны. Небольшое количество слизи и пены – это не всегда признаки дисбиоза, это может быть вариантом нормы. Но если наблюдается учащение стула, то это может быть поводом для беспокойства. Иногда, наоборот, наблюдаются запоры.
Также характерны такие симптомы, как проявления метеоризма, колики, учащение срыгиваний. Живот у ребенка может быть вздутым. На языке появляется белый налет. Ухудшаются сон и аппетит. Частые признаки дисбактериоза – аллергические высыпания. При длительном расстройстве ЖКТ ребенок останавливается в росте и не набирает вес, много плачет. Часто при переводе с естественного молочного вскармливания на искусственное возможны кратковременные преходящие расстройства ЖКТ, не требующие лечения.
Диагностика
Внешние признаки дисбиоза с достаточной долей надежности могут быть подтверждены только при помощи дополнительных исследований. Делается анализ кала, на его основе выполняются копрограмма, посевы на патогенные микроорганизмы. Для анализа на дисбактериоз пригоден только свежесобранный кал ребенка. Всего достаточно не более 10 мл материала. Перед сдачей анализа необходимо отменить прием пробиотиков, слабительных, антибиотиков.
Фото: Alex_Traksel / Shutterstock.com
При исследовании анализов кала может обнаруживаться недостаток бактерий нормальной микрофлоры кишечника. Иногда выявляется наличие бактерий дизентерии и сальмонеллеза – в этом случае необходимо немедленно начать лечение этих заболеваний.
Лечение
Стоит ли лечить дисбактериоз у грудничков, или микрофлора кишечника восстановится сама? Среди педиатров нет единодушного мнения по этому вопросу. К тому же, поставить диагноз «дисбактериоз» не так-то просто. Не все врачи согласны с тем, что это самостоятельное заболевание. В большинстве случаев дисбактериоз – только следствие других проблем с ЖКТ или организмом.
Если педиатр решил, что дисбактериоз кишечника необходимо пролечить, то чаще всего он назначает ребенку препараты-пробиотики и пребиотики. Эти виды лекарственных средств призваны восстановить количество полезной микрофлоры в кишечнике и устранить неприятные симптомы расстройства ЖКТ. Отличие пробиотиков от пребиотиков заключается в том, что первые содержат живые бактерии, которые заселяют кишечник, а вторые – соединения, которые благоприятствуют заселению кишечника полезными бактериями.
Реже могут назначаться другие классы веществ:
- антибиотики, кишечные антисептики и бактериофаги, уничтожающие вредоносную микрофлору;
- ферментные препараты, улучшающие пищеварение;
- энтеросорбенты, удаляющие из ЖКТ токсины.
Антибиотики, антисептики и бактериофаги чаще всего применяются при дисбактериозе в начале лечения, когда ясно, что без них не справиться с патогенной микрофлорой в кишечнике. Однако пробиотики и пребиотики – основа лечения.
Фото: Nicoleta Ionescu / Shutterstock.com
Пробиотики чаще всего содержат бифидо- и лактобактерии. Они могут быть высушенными или активированными. В последнем случае бактерии помещают в специальную суспензию. Высушенные (лиофилизированные) бактерии представляют собой простой порошок. Если препарат содержит порошок, упакованный в пакетики, то его рекомендуется разводить в воде или другой жидкости. Но наибольшей надежностью обладают препараты, порошок которых заключен в кишечнорастворимые капсулы. Однако эта форма не совсем удобна для лечения грудных детей, ведь они не способны глотать капсулы, как взрослые. Поэтому порошок, содержащийся в капсулах, при лечении грудничков рекомендуется высыпать в какое-либо питье.
Попав в кишечник младенца, лакто- и бифидобактерии начинают свою полезную работу, постепенно заселяя стенки кишечника, и останавливая размножение патогенных микроорганизмов.
Содержащиеся в пребиотиках вещества также способствуют развитию нормальной микрофлоры в кишечнике. Как правило, пребиотики содержат клетчатку и лактулозу. Но поскольку пребиотики воздействуют на те бактерии, которые уже содержатся в кишечнике, их эффект может быть выше, чем у пробиотиков. Ведь приживаемость у бактерий экзогенного происхождения относительно низкая, меньше, чем у эндогенных микроорганизмов. Таким образом, пребиотики помогают местной микрофлоре, а не пытаются заселить ЖКТ чужеродными микроорганизмами, как пробиотики.
Большинство современных препаратов для лечения дисбактериоза имеют пробиотические и пребиотические компоненты, используя сильные стороны обоих типов препаратов. Также в некоторых препаратах присутствует энтеросорбент – активированный уголь, который впитывает все токсины в просвете кишечника.
В аптеках есть немало средств от дисбактериоза. Однако не все они подходят детям по своему составу. Можно ориентироваться на названия. Если в них присутствуют слова «Бэби» или «Малыш», то, скорее всего, они разрешены для детей грудного возраста. Также неплохо бы заглянуть перед покупкой средства в инструкцию к нему и узнать, с какого возраста его можно принимать. А еще лучше подбирать лекарства по рекомендации врача. К тому же надо помнить, что дисбактериоз – это симптом, свидетельствующий о том, что в организме не все в порядке, и поэтому одними пробиотиками и пребиотиками серьезное заболевание кишечника не устранить.
Для грудничка вскармливание материнским молоком – это единственная гарантия стабилизации кишечной микрофлоры. Однако многое зависит и от состава материнского молока. Поэтому кормящей маме необходимо позаботиться о своем рационе, чтобы в нем не было бы вредных продуктов, портящих качество молока. Наибольшую пользу для качества молока приносит кисломолочная продукция.
Фото: UvGroup / Shutterstock.com
Популярные пробиотики и пребиотики, применяемые для лечения дисбиоза у детей:
- Линекс;
- Нормофлорин;
- Бифидумбактерин;
- Аципол;
- Бификол;
- Максилак;
- Бифиформ;
- Ацилакт;
- Энтерол.
Необходимо строго придерживаться дозировки для грудного возраста. В этом случае эффект пробиотика будет максимальным.
Насколько полезен был этот пост?
Нажмите на звезду, чтобы оценить его!
Submit RatingСредний рейтинг / 5. Подсчет голосов:
Дисбактериоз у детей, симптомы и лечение
Каждая вторая мама знакома с таким недугом, как дисбактериоз кишечника у детей. Особенно активно он прогрессирует при ослаблении иммунной системы малыша.
Дисбактериоз представляет собой сбой в работе кишечника из-за нарушения баланса полезных и «вредных» бактерий в желудочно-кишечном тракте. Устранение дисбактериоза кишечника у детей значительно повышает качество жизни как малыша, так и мамы.
Дисбактериоз – нарушение соотношения нормальной микрофлоры кишечника. Состояние редко имеет идиопатический характер, не является самостоятельным заболеванием. Развивается в любом возрасте, более уязвимы грудные дети. Чтобы противостоять дисбактериозу, стоит ознакомиться с провоцирующими его факторами и знать, что делать при дисбактериозе кишечника у ребенка
Причины дисбактериоза и кишечный иммунитет
Перед рождением ребенок находится в стерильных условиях, его кишечник также стерилен. После первого сосания груди и приема молозива поступают питательные вещества, иммунные комплексы, гормоны, полезные бактерии. В течение последующих 5–7 дней бактериальные клетки колонизируются, подавляется рост патогенных микроорганизмов. У ослабленных и недоношенных малышей дисбаланс кишечной микрофлоры может развиваться самостоятельно, без фонового заболевания
Причины дисбактериоза у детей до года:
- неправильное питание кормящей женщины,
- резкая отмена грудного вскармливания,
- снижение иммунного ответа,
- кормление искусственными смесями,
- заражение золотистым стафилококком,
- прием антибактериальных средств.
Этиология дисбактериоза у детей после 1 года связана с глистной инвазией, частыми простудными болезнями, ослаблением моторики и ферментативной недостаточностью кишечника, подверженностью стрессовому воздействию. Все перечисленные состояния ведут к снижению иммунной реакции.
Местный иммунитет в кишечнике играет колоссальную роль в борьбе с патогенной микрофлорой, вирусными и бактериальными агентами. Клеточные макрофаги расщепляют и поглощают поступившие антигены.
Последствия ослабления иммунитета и возникновения дисбактериоза
Первым признаком дисбактериоза кишечника у детей является нарушение отхождения кашицеобразного стула. Он становится жидким, с резким кислым запахом, цвет от бледно-желтого до болотно-зеленого или отмечаются стойкие запоры с болезненным актом дефекации.
Другие последствия:
- урчание в животике;
- повышенное газообразование;
- появление колик у малыша, сопровождающееся болями;
- аллергические высыпания на фоне интоксикации;
- отставание в физическом развитии – недостаток витаминов группы В, витаминов Е, Д.
При выявлении подобных признаков рекомендовано обращение в клинику к педиатру. Только специалист сможет объективно оценить состояние здоровья малыша.
Первый сигнал о дисбактериозе – появление сыпи разной локализации на теле, которая чешется и для которой характерен полиморфизм высыпания. Так проявляются аллергические реакции на коже.
Что делать при дисбактериозе у малышей?
Коррекция дисбактериоза кишечника у детей направлена на устранение причины и симптомов нарушения. Женщинам, желающим узнать, как помочь малышу при коликах и газах, желательно ознакомиться с советами доктора. Зачастую специалист назначает:
- бактериофаги;
- пероральные сорбенты;
- ферментативные средства;
- ветрогонные препараты;
- назначают пробиотики для малышей, чтобы заселить микрофлору, или пребиотики для стимуляции роста собственных колоний;
- иногда антибиотик;
- прием интерферонов.
Для коррекции дисбиоза также показаны прогулки на свежем воздухе, дополнение рациона питания пробиотическими продуктами и нормализация режима сна и отдыха детей
Как поддержать естественную микрофлору
Поддерживать естественную микрофлору кишечника могут помочь капли для приема внутрь – Аципол® Малыш, капли. Они относятся к биологически активным добавкам, в состав которых входит необходимое количество колониеобразующих организмов – лактобактерии, бифидобактерии.
Способ дозирования средства очень прост – есть насадка-дозатор. Разводить вещество не нужно, оно выпускается в суспензии. Согласно инструкции по применению, Аципол® Малыш, капли дают ребенку 1 раз в день по 5 капель, допускается добавление в смесь, воду.
Действие компонентов Аципол® Малыш, капли
Действие Аципол® Малыш, капли сходно с аналогичными средствами, относящимися к группе пробиотиков. Лактобактерии и бифидобактерии заселяют желудочно-кишечный тракт и оказывают благотворное влияние на организм.
Образующиеся колонии полезных бактерий вытесняет патогенную микрофлору. Результатом использования такого средства служит нормализация стула малыша, уменьшение болей в животике, снижение интоксикации.
Стоит отметить, что применение только Аципол® Малыш, капли при дисбактериозе кишечника у детей нецелесообразно, обязательна комплексная терапия с применением лекарственных препаратов, которые вам назначит специалист вместе с Аципол® Малыш, капли
При выявлении первых признаков дисбактериоза у ребенка следует обратиться за медицинской помощью к профилирующему специалисту. Причин развития патологического состояния много, только специалист может определить этиологию недуга и назначить адекватное лечение с учетом возраста ребенка и степени тяжести патологии.
ABC-медицина
При эубиозе (то есть в норме) микрофлора кишечника представляет собой оптимальное соотношение различных бактерий – кишечной палочки, лактобацилл, энтерококков и др., всего более 500 видов. Дисбактериозом называют дисбаланс микробов, который длится продолжительное время. Это очень распространенное состояние, встречающееся примерно у 90 % взрослых и 95 % детей.
При должной коррекции, которую может назначить только врач, дисбактериоз кишечника проходит, но при отсутствии лечения обычно переходит в более тяжелую, прогрессирующую форму. Данное бактериологическое состояние принято рассматривать в качестве проявления или осложнения какого-либо заболевания, чаще всего – желудочно-кишечного тракта.
Причины развития дисбактериоза
Гибель полезных бактерий, населяющих микрофлору кишечника, может быть связана с такими факторами, как:
- изменение функций желудка, поджелудочной железы или печени, приводящее к недостатку пищеварительных ферментов и появлению непереваренных остатков пищи, которые способствуют росту болезнетворных микробов;
- пониженный тонус гладкой мускулатуры кишечника или ее спазмы, возникающие в результате психического или физического стресса, хирургического вмешательства, вегетососудистой дистонии – все это приводит к нарушению передвижения пищевых масс;
- различные заболевания желудочно-кишечного тракта, такие как холецистит, гастрит, панкреатит и пр., связанные с повышением кислотности или щелочности среды обитания бактерий, что влечет за собой изменение обмена веществ и клеточных мембран полезных микроорганизмов;
- неправильное пищевое поведение (диеты, недостаток кисломолочных продуктов и клетчатки, употребление консервантов) препятствует нормальному росту полезных микробов или провоцирует их уничтожение;
- наличие в кишечнике паразитов или болезнетворных микробов, чьи продукты жизнедеятельности убивают полезные микроорганизмы – обычно это связано с дизентерией, сальмонеллезом, вирусными заболеваниями и пр.;
- прием антибиотиков, пагубно действующих не только на вредных микробов, но и на полезных.
К факторам, повышающим риск развития дисбактериоза кишечника, относят постоянные стрессы и неблагоприятную экологию, от которых страдают жители современных мегаполисов.
Общая симптоматика
Симптомы дисбактериоза кишечника различаются по локализации дисбиотических изменений и степени их выраженности. На тяжесть клинических проявлений влияют возраст, образ жизни, состояние иммунной системы, стадия развития патологии.
1 стадия
На данном этапе дисбаланс бактерий выражен слабо: пациента могут беспокоить небольшие расстройства кишечника. Обычно такое состояние связано с кратковременным воздействием на микрофлору, например, со сменой привычной пищи, напитков. После окончания воздействия провоцирующих факторов или привыкания к новым условиям баланс микрофлоры восстанавливается.
2 стадия
Прекращается производство кишечником необходимого количества ферментов, обеспечивающих нормальное пищеварение. В результате возникает процесс брожения, который проявляется болью и вздутием живота, горечью во рту, метеоризмом, запорами или, наоборот, диареей. Это могут быть симптомы как прогрессирующего дисбактериоза, так и развития заболеваний желудочно-кишечного тракта.
3 стадия
На этой стадии при воздействии большого количества патогенной флоры на стенки кишечника развивается воспалительный процесс. Такой дисбактериоз уже требует медицинского вмешательства. К выраженным симптомам добавляются тошнота, рвота, непереваренные фрагменты пищи в стуле, сильные боли в животе. В некоторых случаях – повышение температуры тела.
4 стадия
Это состояние кишечника, при котором нормальная микрофлора практически полностью вытеснена болезнетворными микроорганизмами, что приводит к нарушению всасывания полезных веществ, развитию авитаминоза и даже анемии. Образующиеся в результате токсины попадают в кровь и провоцируют тяжелые аллергические реакции. Клинические проявления включают возникновение сыпи, экземы, крапивницы, возможно развитие астмы, бессонницы, хронической усталости. Пациент может жаловаться на проблемы с концентрацией внимания. При отсутствии своевременного лечения возникает угроза развития тяжелых кишечных инфекций.
Крайняя степень дисбактериоза – проникновение бактерий желудочно-кишечного тракта в кровь (бактериемия), в некоторых случаях – развитие сепсиса.
Диагностика дисбактериоза
Основная цель диагностики – определение вида микробов, заселяющих кишечник, и их количества. Как правило, используются следующие основные методы:
- бактериологическое исследование, на качество результатов которого влияют соблюдение сроков доставки и сохранности материала, а также условий культивирования разных видов бактерий;
- исследование метаболитов микрофлоры, которое основано на определении летучих жирных кислот, выделяемых микроорганизмами. Отличается точностью результатов, простотой и оперативностью выполнения.
При проведении диагностики и постановке диагноза учитывается также, что микрофлора кишечника индивидуальна для каждого человека. Ее состав может зависеть от возраста, потребляемой пищи и сезона. В связи с этим специалист основывается не только на результатах анализов, но и на дополнительных обследованиях, позволяющих выявить причину развития дисбактериоза.
Лечение дисбактериоза
Лечение дисбактериоза у взрослых зависит от причин и симптомов и назначается комплексно. Стандартная схема обычно включает меры, направленные на:
- устранение избыточности патогенных микроорганизмов;
- восстановление нормальной микрофлоры;
- улучшение процесса пищеварения;
- нормализацию моторики кишечника;
- стимулирование реактивности всего организма.
Помните, что назначить грамотное и эффективное лечение может только специалист. Чтобы получить квалифицированную консультацию, запишитесь на прием к врачу клиники «АВС-Медицина» по номеру +7 (495) 223-38-83 или заполните заявку на нашем сайте.
Симптомы дисбактериоза у грудничков. Как вылечить дисбактериоз у грудничка :: SYL.ru
Что это такое и опасно ли?
Дисбактериоз — неуравновешенность здоровой микрофлоры кишечника. При внутритрубном развитии ЖКТ плода стерилен.
Первые бактерии, микробы кожи и слизистой у ребёнка появляются при продвижении по родовым путям мамы.
Затем происходит контакт с матерью, врачами, оборудованием палаты, водой и т.д. Этот процесс неизбежен. Со временем у грудничка определяется индивидуальный состав микрофлоры.
Соотношение бактерий закладывается на генетическом уровне. В его кишечнике должны ужиться около 400 видов бактерий и «не поссориться».
На заметку. Неполадки в желудочно-кишечном тракте могут привести не только к дискомфорту в животе, а также к ряду других заболеваний.
Как можно диагностировать дисбактериоз
Это состояние не является признанным заболеванием, о нем мало известно, поэтому поставить диагноз сложно. Чаще всего это можно сделать по результатам лабораторных исследований кала ребенка. Особенно сложно понять, когда делать анализ на дисбактериоз у грудничка. Ведь у малышей, получающих грудное молоко, нарушения стула – нормальное явление. Поэтому нужно внимательно присматриваться к общему состоянию младенца. Каждая мама должна знать признаки, по которым можно понять, что у ребенка нарушение микрофлоры.
Степени болезни
Выделяют 4 степени болезни:
- Первая степень характеризуется повышенным содержанием бифидо- и лактобактерий. По сути, это здоровое состояние организма. Ребёнка ничего не беспокоит, симптомы никак не проявляются. Еще эту стадию называют дисбактериальной реакцией — краткосрочное нарушение микрофлоры. Первая стадия может возникнуть при замене смеси, а также при введении прикорма. Её лечить никак не следует, организм сам справляется и восстанавливает состав микрофлоры.
- Вторая степень характеризуется равным количеством полезных и вредных бактерий. В фекалиях выявляются гемолизирующие и лактозонегативные кишечные палочки. Эта степень приводит к вздутию, поносу, коликам. Возможна маленькая прибавка в весе. Педиатр назначает лечение, и пересматривает питание новорожденного.
- На этой стадии выявляются в большом количестве бактерии: клебсиеллы, стафилококки, серрации, протеи и др. Это может привести к воспалительному процессу в животе, болям в кишечнике, длительной диареи с крупицами непереваренной еды. Требует незамедлительного лечения.
- Огромный рост патогенной микрофлоры. При длительном поносе происходит потеря веса грудничка, а это опасно для новорожденного. На этой стадии дисбактериоз может перейти в хроническую форму. Справиться с проблемой становится намного сложнее.
Методы диагностики
- Копрограмма — один из методов диагностики, позволяющий выявить стадию заболевания (скорость и качество переваривания еды), а так же отсутствие или наличие воспаления. Основными параметрами выступают количество, запах, цвет, реакция кала, консистенция, наличие примесей и химический состав.
Справка. Копрограмма достаточно информативный анализ, который назначают при любых заболеваниях ЖКТ. - Посев кала, показывает соотношение полезной и патогенной микрофлоры, устанавливает чувствительность к антибиотикам. Для того, что бы узнать результат, нужно много времени (не менее недели), связано это с тем, что бактерии должны «вырасти» для изучения.
- Биохимический анализ кала. Показывает соотношение всех полезных и вредоносных бактерий. Может показать отдел кишечника, где сосредоточена проблема. Считается самым быстрым и информативным методом.
Обычно назначают бактериальный анализ (посев кала), но он не является самым информативным. Самым высокоинформативным методом является биохимический анализ, который и следует проводить.
Вернее всего отвезти фекалии в тот же день, когда они были собраны. Если же нет такой возможности, то кал должен храниться 3-4 часа в холодильнике. Обязательно используйте стерильную баночку для сбора фекалий. Приобрести баночку можно в аптеке.
Расшифровка анализа
| Показатель | Определение показателя | Норма у ребёнка до года | Норма у ребёнка после года |
| Энтеробактерии | Бактерии, вызывающую острую кишечную инфекцию. К ним относятся: шигеллы и сальмонеллы — возбудители дизентерии. | 0 | 0 |
| Кишечная палочка (общее количество) | Разделяется на три вида: кишечная палочка с нормальной ферментативной активностью, со сниженной активностью и гемолизирующая кишечная палочка.4 |
Роль грудного вскармливания в лечении
Многие молодые мамы не знают, что лучшей профилактикой дисбактериоза у ребенка является кормление его грудью хотя бы до года, а желательно и дольше. В грудном молоке содержатся антитела от ротавируса, кишечной палочки, сальмонеллы, лямблии и других бактерий. Поэтому никакие симптомы дисбактериоза у грудничков не могут быть причиной отказа от грудного вскармливания. Наоборот, его нужно постараться сохранить. Ведь именно грудное молоко поможет заселить микрофлору кишечника малыша полезными бифидобактериями, укрепит иммунитет и наладит пищеварение. Но для этого маме нужно сбалансированно питаться и соблюдать определенные правила.
Причины
Основной причиной дисбактериоза является неправильное питание малыша:
- Перекорм. Если мама выбирает вариант кормления не по режиму, а по требованию, она должна понимать что если ребёнок скушал достаточное количество смеси, то он проголодается через 2,5-3 часа. Слишком частое кормление, приводит к проблемам с пищеварением. Еда не расщепляется до конца, что приводит к вздутию, коликам, и беспокойству грудничка находящегося на искусственном вскармливании.
- Недокорм. Если ребенок не получает достаточного количества смеси, это может привести к вздутию животика, а так же к зелёному жидкому калу.
- Переход на другую смесь. Также проблемы с животиком у младенца могут появиться при переходе с одной смеси на другую. Наиболее частой причиной является недостаток лактозы. Её малое количество приводит к тому, что организм малыша не справляется с перевариванием и расщеплением еды. В данном случае необходимо перейти на низколактозные смеси. Не стоит переходить резко, это должно происходить в течении недели, чтобы ни навредить организму малыша.
- Раннее введение прикорма при ИВ. Как раз это и является наиболее частой причиной дисбактериоза у новорожденных.
Важно! Не стоит вводить прикорм в рацион малыша ранее 6 месяцев, это прямой путь к болезням пищеварительной системы грудничка. Прикорм вводится постепенно, при учете возраста и индивидуальных особенностей новорожденного.
Нужно ли лечить малыша
Некоторые мамы не обращаются к врачу, если у их ребенка наблюдается нарушение пищеварения, считая это нормальным явлением для грудничков. Или же начинают самостоятельно применять лекарства. Но чем лечить дисбактериоз у грудничка, может решить только врач после обследования ребенка. Обычно малышу, находящемуся на грудном вскармливании, не нужны лекарственные препараты. Им чаще всего помогает особая диета мамы и применение пребиотиков. Ведь грудное молоко содержит все нужные вещества для здоровья пищеварительной системы малыша.
Варианты лечения у малышей на ИВ
Лекарства
Чаще всего, врач назначает лечение в виде приёма препаратов: пробиотики и пребиотики.
Пробиотики
Разряд живых микроорганизмов, которые являются полезными для человека. Самые важные:
- дрожжевые грибы;
- бифидо- и лактобактерии;
- кишечные палочки.
Главная задача пробиотиков — нормализовать работу пищеварения. Они бывают сухими и жидкими. На сегодняшний день, существует 4 поколения пробиотиков:
- Однокомпонентные (только один штамм бактерий).
К ним относится «Биобактон». Принимается при дисбактериозе у новорожденного с первых дней жизни.Противопоказанием является чувствительность к Биобактону, кандидоз.
Принимается 1 доза внутрь за 30-40 мин до еды 2-3 раза в сутки.
Побочным действием может быть аллергическая реакция на компоненты препарата.
- Многокомпонентные (несколько штаммов бактерий).
К ним относятся:- «Линекс». Нормализует микрофлору кишечника. Принимают для лечения и профилактики дисбактериоза.
Противопоказанием является непереносимость компонентов препарата, а также молочных продуктов.В возрасте до 2 лет принимается 1 капсула 3 раза в сутки. Если грудничок не может проглотить капсулу, то следует вскрыть её, высыпать содержимое в ложку и смешать с небольшим количеством воды.
Побочных действий не обнаружено.
- «Аципол». Принимается при дисбактериозе. Показан новорожденным с 3 месяцев по 1 капсуле 2-3 раза в день. Также можно смешивать в ложке с водой.
Побочных действий не обнаружено.Противопоказанием является непереносимость компонентов препарата.
- Комбинированные (несколько видов разных бактерий, несколько штаммов одной бактерии).
К ним относится Бифиформ в разных формах выпуска.- «Бифиформ Малыш» назначают в возрасте от 1 до 3 лет. Разводят в воде или смеси по 1 пакетику порошка 2-3 раза в день.
«Бифиформ Бэби». Используют с помощью пипетки, рассчитывая дозу по весу малыша. Принимают 1 раз в сутки.
- Сорбционные (с добавлением энтерособрентов) — «Бифидумбактерин форте». Выпускают в форме порошка, принимают при дисбактериозе у новорожденного с первых дней жизни. Порошок перед употреблением смешивают со смесью. В возрасте до 6 месяцев принимают по 1 пакетику 2 раза в сутки, старше 6 месяцев по 1 пакетику 3-4 раза в день.
Курс приёма 2-3 дня. Побочных действий препарата не обнаружено. Противопоказанием является индивидуальная непереносимость.
Продолжительность лечения не менее 10 дней. Побочных действий не обнаружено.
Противопоказанием является гиперчувствительность к компонентам препарата.
дисбактериоз у грудных детей?!
Очень часто родители грудничков в России сталкиваются с необходимостью сдать анализы на дисбактериоз, а потом и лечить его. Ситуация обычно развивается по следующему сценарию: у ребенка наблюдается жидкий по сравнению с детьми на искусственных заменителях грудного молока и взрослыми стул, или зеленоватый стул, или пенистый стул, и врач рекомендует сдать анализы на дисбактериоз. Назначенное лечение, как правило, включает в себя прием препаратов, содержащих полезные бактерии-пробиотики и дрожжи. В худшем случае, грешат на грудное молоко и рекомендуют перевести ребенка на иные виды вскармливания. Что же такое дисбактериоз? Бывает ли он у грудных детей? Что делать, если ребенку ставят такой диагноз? Нужно ли волноваться? (Прим. автора. Тут я немного забегу вперед, чтобы успокоить всех мам. Дисбактериоз у грудных детей – неслыханная вещь!) Давайте шаг за шагом разберемся с вопросом, который поглощает умы всех мам во всех уголках планеты – содержимое подгузников ребенка и что это значит.
Содержимое кишечника и подгузников здорового грудничка
В период внутриутробного развития желудочно-кишечный тракт (ЖКТ) плода стерилен. Там нет никаких бактерий и других микроорганизмов. Когда ребенок рождается, ЖКТ заселяется, или колонизируется, бактериями, которые попадают ему в рот во время прохождения через родовые пути матери. Бактерии могут также попасть ребенку из материнского стула во время родов. Именно так создается нормальная и здоровая микрофлора кишечника. После рождения ЖКТ ребенка заселяется бактериями, которые находятся в окружающей среде, во рту и на коже матери. Это происходит во время кормления грудью, при поцелуях и прикосновениях к ребенку.
В грудном молоке содержится бифидус-фактор, вещество, которое способствует росту бифидобактерий. Неудивительно, что бифидобактерии составляют 95-99% флоры кишечника детей на грудном вскармливании. Бифидобактерии, которые иногда называют еще пробиотиками, являются частью здоровой флоры кишечника. Да-да, это те самые пробиотики, которые обычно прописывают как лечение от дисбактериоза. Эти добрые «рыцари» способствуют пищеварению, нормальной работе иммунной системы, а также не дают разростаться потенциально патогенным бактериям, которые приводят к заболеваниям. Бифидобактерии преобладают в кишечнике у грудного ребенка до тех пор, пока грудное молоко составляет бо́льшую часть питания ребенка. Помимо этого, в кишечнике грудничка в небольших количествах могут обитать стрептококки, бактероиды, клостридии, микрококки, энтерококки и кишечная палочка (E.Coli
). Все эти микроорганизмы являются нормальной флорой пищеварительного тракта ребенка на грудном вскармливании.
Сразу же после рождения ребенок начинает сосать грудь и получает молозиво, которое обладает слабительным эффектом. Это помогает быстро избавиться от первого стула новорожденного – мекония. Меконий – черный, липкий, похожий на смолу стул, без запаха. При частых прикладываниях в первые сутки, меконий выходит за первые 48 часов.
По мере прихода молока, стул новорожденного меняется с темного на более светлый. Переходный стул обычно зеленоватого цвета и жиже, чем меконий. К пятому дню жизни ребенка его стул становится желтым, похожим на горчицу или густой гороховый суп, часто зернистым, с вкраплениями, похожими на кусочки творога. Цвет стула грудного ребенка может варьироваться от желтого до желто-зеленого или желто-коричневого. Изредка стул может быть зеленым или пенистым. У стула грудных детей нет запаха или же запах неотталкивающий и слабый сладковатый или творожистый запах (что невероятно помогает менять грязные подгузники!)
В первые три дня после рождения число опорожнений кишечника должно соответствовать возрасту ребенка – в первые сутки ребенок должен опорожнить кишечник один раз, на вторые сутки – два, на третьи – три. После прихода молока грудной ребенок опорожняет кишечник минимум 3-4 раза в сутки, и количество стула довольно значительное. Большинство грудных детей опорожняют кишечник намного чаще, нередко после каждого кормления. Даже неопытная мама без труда распознает радостный залп похода в туалет у грудничка – его невозможно не услышать и пропустить.
По мере взросления, в районе 6 недель от рождения или чуть раньше, многие грудные дети переходят на более редкий режим дефекации – от раза в несколько дней до раза в неделю или даже реже. При этом отсутствуют признаки запора (сухой, твердый стул) – стул ребенка попрежнему неоформленный, пюреобразный.
Введение любой другой пищи помимо грудного молока приведет к изменению консистенции, цвета и запаха стула у грудного ребенка. Если вы начали вводить прикорм, в стуле можно будет заметить кусочки пищи, которую вы даете ребенку.
Как мы видим, нормы дефекации и стула грудных детей значительно отличаются от нормы взрослых. То, что стало бы признаком беспокойства и поводом обратиться к врачу у взрослых, является нормой у грудничков. Для сравнения, нормы детей на грудном вскармливании значительно отличаются от показателей и детей на смешанном и искусственном вскармливании. Например, флора кишечника младенца на искусственном вскармливании уже в 2 недели почти не отличается от взрослого человека. У детей на искусственном вскрамливании более редкая дефекация, а также более оформленный стул с заметным типичным запахом.
Содержимое подгузника грудничка, на которое следует обратить внимание
Отклонения от нормы частоты и внешнего вида стула не всегда означает, что ребенок обязательно чем-то болен. Однако, стул ребенка может быть полезным признаком достаточности питания или симптомом аллергии. В таких случаях изменение способа кормления или устранения аллергена – все что требуется для решения проблемы.
Частый, водянистый, зеленый и/или пенистый стул может быть признаком недоедания. Нередко такой стул бывает в сочетании с медленным набором веса. Иногда такое состояние называют дисбаланс переднего и заднего молока. Ребенок высасывает много переднего молока с низким содержанием жира, которое проходит через пищеварительную систему слишком быстро и вызывает вышеуказанные симптомы. Обычно это легко разрешается изменением поведения во время кормлений, а именно увеличение продолжительности сосания у одной груди. Это позволяет малышу дососаться до жирного заднего молока, которое переваривается медленнее.
Если у малыша постоянно зеленый и водянистый стул, это может быть признаком аллергии. Помимо этого у ребенка может быть рвота, слизь или кровь в стуле, а также раздражительность, высыпания на коже. В этом случае особенно важно продолжать кормить грудью, т.к. отлучение от груди сопряжено с повышением риска аллергий.
Если ваш малыш пачкает более 12-16 подгузников в сутки, и стул плохо пахнет и водянистый — это понос. Обычно понос у грудных детей быстро проходит сам по себе и без всяких осложнений. Причной поноса может стать инфекция, лечение антибиотиками, введение прикорма, чрезмерное потребление фруктовых соков. В случае острого поноса или поноса при приеме антибиотиков ребенка обязательно нужно как можно больше кормить грудью. В грудном молоке содержится все необходимое для предотвращения обезвоживания, а также антитела, которые помогают ребенку справится с инфекцией, и также факторы, которые позволяют восстановить нормальную флору кишечника. Американская ассоциация педиатрии рекомендует обязательно продолжать кормить ребенка грудью во время острого поноса. Исследования показывают, что прекращение кормления во время поноса увеличивает продолжительность и серьезность заболевания, а также вдвое увеличивает риск смертности. Если же причиной поноса стало введение прикорма или соки, возможно нужно отложить введение прикорма на некоторое время
Что такое дисбактериоз
Дисбактериоз (от гр. dys- «нарушение, расстройство», bacterio- «бактерии» и –sis «состояние») или дисбиоз – нарушение качественного или количественного баланса микроорганизмов в организме, в данном случае, в кишечнике.
Это значит, что изменилась пропорция бактерий в кишечнике или там появились необычные для нормальной флоры микроорганизмы. Дисбактериоз часто связывают с лечением антибиотиками и кишечными инфекциями.
Диагностирование дисбактериоза проводится по симптомам или же анализом кала на дисбактериоз. Обозначить симптомы дисбактериоза трудно, так как это состояние не является заболеванием согласно «Международной статистической классификации болезней и проблем, связанных со здоровьем» Десятого пересмотра (МКБ-10) — документу Всемирной организации здравоохранения, который является общепринятой международной диагностической классификацией в здравоохранении.
Обычно, показанием к анализу на дисбактериоз является непроходящий в течение двух или трех суток понос. У взрослых людей и детей на искусственном вскармливании понос определяется как частый и жидкий стул. Как уже было сказано выше, для грудных детей частый, неоформленный жидкий стул является нормой, поэтому не может являться показанием для анализов. Среди других симптомов, которые служат поводом для лабораторных исследований на дисбактериоз могут быть зеленоватый стул, стул со слизью, запор (редкий стул у грудных детей часто ошибочно принимают за запор), пенистый стул, частички непереваренной пищи. Все эти симптомы не у грудных детей действительно сопровождают поносы, которые часто вызваны патогенными бактериями и требуют лечения антибиотиками. У грудных детей каждый из перечисленных признаков может являться разновидностью нормы.
Насколько показательны анализы на дисбактериоз у здоровых грудных детей?
Изучение состава кишечной флоры у здорового грудного ребенка, то есть ребенка без видимых симптомов заболевания, в данном случае поноса, представляет интерес для ученых, но не для родителей или практикующих врачей. Многочисленные исследования показали, что грудное молоко защищает детей от заболеваний, даже если кишечник колонизирован патогенными микроорганизмами. Например, в грудном молоке содержатся антитела и факторы против кишечной палочки, холерного вибриона, сальмонеллы, шигеллы, ротавируса и лямблии. Это значит, что в стуле может высеваться патологический микроорганизм, но ребенок при этом не проявляет никаких симптомов заболевания.
Когда нужно обратится к врачу?
В крайне редких случаях грудному ребенку может понадобиться медицинская помощь.
Обратитесь к врачу, если у ребенка в первые недели жизни наблюдается
- понос (более 12 дефекаций в сутки, водянистый стул)
- рвота
- темпаратура
- летаргия
- низкий набор веса
- потеря в весе
Обратитесь к врачу с грудным ребенком любого возраста, если у ребенка появились признаки обезвоживания
- слабость
- сонливость или летаргия
- слабый плач
- кожа не разглаживается быстро, если ее ущипнуть
- отсутствие слез
- сухой рот, во рту мало или отсуствует слюна
- менее двух мокрых подгузников в сутки
- моча темная, с сильным запахом
- запавший родничок
- температура
Что нужно знать и помнить кормящей маме?
Кормление грудью является самой настоящей страховкой здоровья желудочно-кишечного тракта ребенка в течение первых лет жизни. Грудное молоко способствует росту бифидобактерий, которые препятствуют колонизации кишечника болезнетворными бактериями, а также содержит антитела и факторы, которые защищают ребенка от болезни, даже если патогенным бактериям удалось прижиться в кишечнике. Кормление грудью помогает восстановить баланс микрофлоры кишечника ребенка после лечения антибиотиками. Попросту говоря, грудным детям дисбактериоз не страшен.
https://www.llli.org/russian/OA/dysbacteriosis.html
Как лечить синдром раздраженного кишечника у детей: симптомы, лечение, диета
Оглавление
Синдром раздраженного кишечника (СРК) – общее название функциональных расстройств желудочно-кишечного тракта, не вызванных органной патологией. Встречается у взрослых и детей, на планете болеют порядка 30% людей.
Характеристика недуга
Под СРК подразумевают нарушения пищеварения в толстой кишке, связанные с этим изменения перистальтики и эвакуации переработанной пищи. Заболевание часто носит хронический характер, но протекает доброкачественно, легко поддается коррекции с помощью диеты и здорового образа жизни.
Причины возникновения
- Нарушения микрофлоры кишечника (баланса бактерий): ранний перевод ребенка на искусственное вскармливание, антибактериальная терапия
- Особенности нервной системы (вегетососудистая дистония, частые стрессы)
- Нарушения режима питания, распорядка (перекусы, переедания, гиподинамия, недостаточный сон)
- Несбалансированная диета (нехватка пищевых волокон, клетчатки)
- Генетическая предрасположенность
- Эндокринные болезни
- Инфекции (различные колиты), паразиты
Таким образом, лечение синдрома раздраженного кишечника у детей будет направлено против причины, его вызвавшей.
Классификация
- СРК с преобладанием поносов – частая дефекация, бесформенный или жидкий стул при малейших нарушения питания, режима, смене обстановки, волнении («медвежья болезнь»)
- С преобладанием запоров – дети подолгу находятся в туалете, стул может отсутствовать по несколько дней, кал твердый («овечий кал»)
- С преобладанием метеоризма – ребенка часто беспокоят спастические боли внизу живота, чувство распирания, вздутие, частое отхождение газов
Симптомы и признаки
- Спазмы гладкой мускулатуры кишечника с болью внизу живота (справа или слева), дискомфорт при надавливании на живот; ночью (во сне) боли исчезают
- Тимпанит (барабанный звук) над областями скопления газов
- Боли в подреберной области справа, отдающие в лопатку и шею
- Диспептический синдром (тошнота, отрыжка, скорое насыщение)
- Слизь в кале
Лечение синдрома раздраженного кишечника у ребенка обязательно будет включать симптоматическую терапию.
Осложнения и последствия
Если при наличии синдрома раздраженного кишечника у ребенка лечение не было доведено до конца, болезнь становится хронической. В более взрослом возрасте могут появиться такие осложнения, как:
- Геморрой, трещины прямой кишки
- Кишечная непроходимость
- Нарушения всасывания (авитаминоз, анемия, расстройство метаболизма)
- Заболевания верхних отделов желудочно-кишечного тракта (дуодениты, гастриты)
Диагностика и анализы
Учитывая схожесть СРК с другими заболеваниями желудочно-кишечного тракта и возможность осложнений, рекомендуется провести обследование ребенка, которое будет включать:
- Исследование кала (бактериальное) на дисбактериоз и копрограмму (состав кала)
- Общий клинический анализ мочи и крови
- Биохимический анализ крови (на белок, ферменты, электролиты)
- Абдоминальное УЗИ (печень, желчный пузырь, селезенка и поджелудочная железа)
- ФГДС (осмотр желудка и двенадцатиперстной кишки)
- Колоноскопия (осмотр толстого кишечника с помощью эндоскопа)
Лечение
При установленном синдроме раздраженного кишечника лечение детей ведется по трем направлениям:
- Устранение причины
- Устранение симптомов
- Коррекция режима и питания
Детям назначают легкие седативные препараты, родителям советуют меньше нагружать детей учебой, избегать стрессов дома, составить распорядок дня, следить за сном (не менее 9 часов в день), прогулками (не меньше 2 часов в день), физической нагрузкой (пресс, плаванье).
Для снятия болей назначают спазмолитики, для улучшения перистальтики (движений кишечника) – прокинетики.
При дисбактериозе – пробиотики (полезные бактерии, кисломолочные продукты).
Прогноз
Течение болезни и прогноз благоприятные: своевременное медицинское вмешательство и последующее наблюдение у детского гастроэнтеролога поможет избежать последствий во взрослом возрасте – как правило, при соблюдении врачебных рекомендаций, симптомы СРК исчезают после полового созревания.
Меры профилактики
Чтобы не допустить функциональных нарушений пищеварения у детей, особенно склонных к заболеванию СРК, нужно:
- Как можно дольше сохранять грудное вскармливание, а позднее – внимательно следить за рационом
- Соблюдать режим сна
- Обеспечить необходимое время для прогулки
- Создать спокойную доброжелательную атмосферу в семье
- Серьезно относиться к инфекционным и паразитарным заболеваниям, соблюдать личную гигиену, вовремя обращаться к докторам
Преимущества процедуры в МЕДСИ
- Чуткие доктора: прием ведут опытные гастроэнтерологи педиатрического профиля
- Наличие современной аппаратуры: детская эндоскопия (ФГДС, колоноскопия), в т. ч. эндоскопия во сне с записью на диск или флэш
- Детские диагносты
- Собственная лаборатория, которая выполняет широкий спектр клинических, биохимических, бактериологических исследований
- Для записи на прием звоните по телефону 8 (495) 7-800-500 (работает круглосуточно)
- Возможность посещения специалиста после получения результатов в одном и том же месте, скидки на повторный прием
Дисбактериоз у детей
Одним из часто встречающихся у детей заболеваний является дисбактериоз кишечника. При этом состоянии нарушается нормальный баланс микрофлоры, которая необходима для жизнедеятельности организма. Снижается количество «полезных» бактерий и увеличивается содержание патогенных микроорганизмов.
Причины
Основной причиной развития дисбактериоза у новорожденных и детей старшего возраста является нерациональная медикаментозная терапия. Особенно это относится к антибактериальному лечению. Однако дисбаланс микрофлоры может появляться и при наличии других заболеваний, а также под влиянием факторов, снижающих иммунитет:
- ожоги;
- тяжелые операции;
- повышенное влияние ионизирующего излучения;
- ухудшение экологической ситуации;
- перевод на искусственное питание, позднее начало грудного вскармливания, заболевания матери.
Симптомы дисбактериоза
Симптомы дисбактериоза зависят возраста ребенка.
У детей старшего возраста может наблюдаться:
- жидкий стул или запор;
- кусочки непереваренной пищи и прожилки крови в кале.
У грудничка патология проявляется следующими симптомами:
- рвота, срыгивания;
- вздутие и боли в животе; урчание в животе;
- обильный жидкий или кашицеобразный стул;
- медленный набор веса.
Такие дети плохо растут и мало прибавляют в весе, могут болеть рахитом или анемией.
Диагностика
Для определения нарушения микрофлоры используются следующие исследования:
- анализ кала, в том числе биохимическое исследование;
- бактериологическое изучение состава кишечного содержимого и желчи;
- эзофагогастроскопия с последующим бактериологическим изучением соскоба со слизистой оболочки двенадцатиперстной кишки;
- колоноскопия с бактериологическим исследованием соскоба слизистой оболочки толстой и прямой кишки.
Лечение дисбактериоза у детей
Лечение дисбактериоза начинается с устранения причины, которая способствовала его развитию. Для нормализации состава микрофлоры применяются пребиотики и пробиотики. В целом лечение похоже на лечение Дисбактериоз у взрослых.
Диета
Диета при дисбактериозе у детей зависит от особенностей клинической картины у каждого пациента: показателей кислотности желудочного сока, степени нарушения пищеварения, локализации патологического процесса. Питание ребенка при дисбактериозе должно быть сбалансированным и легкоусвояемым.
Опасность
Опасность заключается в нарушении водно-электролитного баланса, истощения малыша вследствие длительного поноса.
Группа риска
В группу риска входят малыши, которые перенесли:
- родовые травмы;
- глистные инвазии;
- искусственное вскармливание;
- Колит, энтерит;
- инфекционные заболевания (дизентерия, тиф).
Профилактика
Профилактика заключается в соблюдении режима питания малыша и проведении рациональной антибиотикотерапии.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Микробиом кишечника младенца как микробный орган, влияющий на благополучие хозяина | Итальянский педиатрический журнал
Пракаш С., Родес Л., Кусса-Чарли М., Томаро-Дюшено К. Микробиота кишечника: следующий рубеж в понимании здоровья человека и разработке биотерапевтических средств. Биопрепараты. 2011; 5: 71–86.
PubMed PubMed Central Google Scholar
Savage DC. Микробная экология желудочно-кишечного тракта.Annu Rev Microbiol. 1977; 31: 107–33.
CAS PubMed Статья PubMed Central Google Scholar
Miller TL, Wolin MJ, Conway de Macario E, Macario AJ. Выделение Methanobrevibacter smithii из фекалий человека. Appl Environ Microbiol. 1982. 43 (1): 227–32.
CAS PubMed PubMed Central Статья Google Scholar
Аманн Р.И., Людвиг В., Шлейфер К.Х.Филогенетическая идентификация и обнаружение in situ отдельных микробных клеток без культивирования. Microbiol Rev.1995; 59 (1): 143–69.
CAS PubMed PubMed Central Google Scholar
Zoetendal EG, Collier CT, Koike S, Mackie RI, Gaskins HR. Молекулярно-экологический анализ микробиоты желудочно-кишечного тракта: обзор. J Nutr. 2004. 134 (2): 465–72.
CAS PubMed Статья PubMed Central Google Scholar
Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Микробная экология: микробы кишечника человека, связанные с ожирением. Природа. 2006. 444 (7122): 1022–3.
CAS PubMed Статья PubMed Central Google Scholar
Суау А., Боннет Р., Сутрен М., Годон Дж. Дж., Гибсон Г. Р., Коллинз М. Д. и др. Прямой анализ генов, кодирующих 16S рРНК из сложных сообществ, позволяет выявить множество новых молекулярных видов в кишечнике человека. Appl Environ Microbiol.1999. 65 (11): 4799–807.
CAS PubMed PubMed Central Статья Google Scholar
Гилл С.Р., Поп М., Дебой Р.Т., Экбург П.Б., Тернбо П.Дж., Самуэль Б.С. и др. Метагеномный анализ микробиома дистального отдела кишечника человека. Наука. 2006. 312 (5778): 1355–9.
CAS PubMed PubMed Central Статья Google Scholar
Manichanh C, Rigottier-Gois L, Bonnaud E, Gloux K, Pelletier E, Frangeul L, et al.Уменьшение разнообразия фекальной микробиоты при болезни Крона, выявленное с помощью метагеномного подхода. Кишечник. 2006. 55 (2): 205–11.
CAS PubMed PubMed Central Статья Google Scholar
Rajilic-Stojanovic M, Smidt H, de Vos WM. Пересмотр разнообразия микробиоты желудочно-кишечного тракта человека. Environ Microbiol. 2007. 9 (9): 2125–36.
PubMed Статья Google Scholar
Turroni F, Peano C, Pass DA, Foroni E, Severgnini M, Claesson MJ и др. Разнообразие бифидобактерий в кишечной микробиоте младенцев. PLoS One. 2012; 7 (5): e36957.
CAS PubMed PubMed Central Статья Google Scholar
Экбург П.Б., Бик Е.М., Бернштейн С.Н., Пурдом Э., Детлефсен Л., Сарджент М. и др. Разнообразие микробной флоры кишечника человека. Наука. 2005. 308 (5728): 1635–8.
PubMed PubMed Central Статья Google Scholar
Клаэссон М.Дж., Кьюсак С., О’Салливан О., Грин-Диниз Р., де Верд Х., Фланнери Е. и др. Состав, изменчивость и временная стабильность кишечной микробиоты пожилых людей. Proc Natl Acad Sci U S. A. 2011; 108 (Приложение 1): 4586–91.
CAS PubMed Статья Google Scholar
Backhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI. Хозяин-бактериальный мутуализм в кишечнике человека. Наука. 2005; 307 (5717): 1915–20.
PubMed Статья CAS Google Scholar
Sender R, Fuchs S, Milo R. Пересмотренные оценки количества человеческих и бактериальных клеток в организме. PLoS Biol. 2016; 14 (8): e1002533.
PubMed PubMed Central Статья CAS Google Scholar
Цинь Дж., Ли Р., Раес Дж., Арумугам М., Бургдорф К.С., Маничан С. и др. Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования.Природа. 2010. 464 (7285): 59–65.
CAS PubMed PubMed Central Статья Google Scholar
Вентура М., Соцци Т., Туррони Ф, Маттеуцци Д., ван Синдерен Д. Влияние бактериофагов на пробиотические бактерии и разнообразие кишечной микробиоты. Genes Nutr. 2011. 6 (3): 205–7.
CAS PubMed Статья Google Scholar
Милани С., Дуранти С., Боттачини Ф., Кейси Э., Туррони Ф., Махони Дж. И др.Первые микробные колонизаторы кишечника человека: состав, деятельность и последствия для здоровья микробиоты кишечника младенца. Microbiol Mol Biol Rev.2017; 81 (4).
Каплан Дж. Л., Ши Х. Н., Уокер В. А.. Роль микробов в иммунологическом программировании развития. Pediatr Res. 2011; 69 (6): 465–72.
PubMed Статья Google Scholar
Клаасен HLBM, Вандерхейден П.Дж., Сток В., Поэльма Ф.Г.Дж., Купман Дж.П., Ванденбринк М.Э. и др.Апатогенные кишечные сегментированные нитчатые бактерии стимулируют иммунную систему слизистых оболочек мышей. Заражение иммунной. 1993. 61 (1): 303–6.
CAS PubMed PubMed Central Статья Google Scholar
Talham GL, Jiang HQ, Bos NA, Cebra JJ. Сегментированные нитчатые бактерии являются мощными стимулами физиологически нормального состояния иммунной системы слизистой оболочки кишечника мышей. Заражение иммунной. 1999. 67 (4): 1992–2000.
CAS PubMed PubMed Central Google Scholar
Gaboriau-Routhiau V, Rakotobe S, Lecuyer E, Mulder I, Lan A, Bridonneau C, et al. Ключевая роль сегментированных нитчатых бактерий в скоординированном созревании ответов Т-хелперных клеток кишечника. Иммунитет. 2009. 31 (4): 677–89.
CAS PubMed Статья Google Scholar
Корбетт А.Дж., Экл С.Б., Биркиншоу Р.В., Лю Л., Патель О., Махони Дж. И др. Активация Т-клеток преходящими неоантигенами, происходящими из различных микробных путей.Природа. 2014; 509 (7500): 361–5.
CAS PubMed Статья Google Scholar
Вонг Дж. М., де Соуза Р., Кендалл К. В., Эмам А., Дженкинс Д. Д.. Здоровье толстой кишки: ферментация и жирные кислоты с короткой цепью. J Clin Gastroenterol. 2006. 40 (3): 235–43.
CAS PubMed Статья Google Scholar
Turroni F, Ribbera A, Foroni E, van Sinderen D, Ventura M.Микробиота кишечника человека и бифидобактерии: от состава к функциональности. Антони Ван Левенгук. 2008. 94 (1): 35–50.
PubMed Статья Google Scholar
Мазманян СК, Раунд JL, Каспер DL. Фактор микробного симбиоза предотвращает воспалительные заболевания кишечника. Природа. 2008. 453 (7195): 620–5.
CAS PubMed Статья Google Scholar
Atarashi K, Tanoue T., Shima T., Imaoka A, Kuwahara T, Momose Y, et al. Индукция регуляторных Т-клеток толстой кишки аборигенными видами Clostridium. Наука. 2011. 331 (6015): 337–41.
CAS PubMed Статья Google Scholar
Zhang LL, Chen X, Zheng PY, Luo Y, Lu GF, Liu ZQ и др. Oral Bifidobacterium модулирует иммунное воспаление кишечника у мышей с пищевой аллергией. J Gastroenterol Hepatol. 2010. 25 (5): 928–34.
PubMed Статья CAS Google Scholar
Ливингстон М., Лоуч Д., Уилсон М., Таннок Г.В., Бэрд М. Комменсальный кишечник Lactobacillus reuteri 100-23 стимулирует иммунорегуляторный ответ. Immunol Cell Biol. 2010. 88 (1): 99–102.
PubMed Статья Google Scholar
Mangalam A, Shahi SK, Luckey D, Karau M, Marietta E, Luo N, et al. Комменсальные бактерии кишечного происхождения человека подавляют воспалительные и демиелинизирующие заболевания ЦНС.Cell Rep. 2017; 20 (6): 1269–77.
CAS PubMed PubMed Central Статья Google Scholar
Penders J, Thijs C, Vink C, Stelma FF, Snijders B., Kummeling I, et al. Факторы, влияющие на состав кишечной микробиоты в раннем детстве. Педиатрия. 2006. 118 (2): 511–21.
PubMed Статья PubMed Central Google Scholar
Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н. и др. Способ доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S. A. 2010; 107 (26): 11971–5.
PubMed PubMed Central Статья Google Scholar
Hopkins MJ, Macfarlane GT, Furrie E, Fite A, Macfarlane S. Характеристика кишечных бактерий в стуле младенцев с использованием ПЦР в реальном времени и анализов северной гибридизации.FEMS Microbiol Ecol. 2005. 54 (1): 77–85.
CAS PubMed Статья PubMed Central Google Scholar
Koenig JE, Spor A, Scalfone N, Fricker AD, Stombaugh J, Knight R и др. Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Proc Natl Acad Sci U S. A. 2011; 108 (Приложение 1): 4578–85.
CAS PubMed Статья PubMed Central Google Scholar
Палмер С, Бик Э.М., ДиДжиулио ДБ, Релман Д.А., Браун ПО. Развитие кишечной микробиоты младенца у человека. PLoS Biol. 2007; 5 (7): e177.
PubMed PubMed Central Статья CAS Google Scholar
Turnbaugh PJ, Hamady M, Yatsunenko T., Cantarel BL, Duncan A, Ley RE, et al. Основной микробиом кишечника у тучных и худых близнецов. Природа. 2009. 457 (7228): 480–4.
CAS PubMed Статья PubMed Central Google Scholar
Ковач А., Бен-Джейкоб Н., Тайем Х., Гальперин Е., Иракский Ф.А., Гофна У. Генотип является более сильным детерминантом, чем пол микробиоты кишечника мыши. Microb Ecol. 2011. 61 (2): 423–8.
PubMed Статья PubMed Central Google Scholar
Zhang CH, Zhang MH, Wang SY, Han RJ, Cao YF, Hua WY, et al. Взаимодействие между кишечной микробиотой, генетикой хозяина и диетой, имеющее отношение к развитию метаболических синдромов у мышей (том 4, стр. 232, 2010).ISME J. 2010; 4 (2): 312–3.
CAS Статья Google Scholar
Гудрич Дж. К., Давенпорт ER, Кларк АГ, Лей RE. Обращается внимание на взаимосвязь между геномом человека и микробиомом. Анну Рев Жене. 2017; 51: 413–33.
CAS PubMed PubMed Central Статья Google Scholar
Song SJ, Lauber C, Costello EK, Lozupone CA, Humphrey G, Berg-Lyons D, et al.Сожительствующие члены семьи разделяют микробиоту друг с другом и со своими собаками. eLife. 2013; 2: e00458.
PubMed PubMed Central Статья Google Scholar
Ley RE, Hamady M, Lozupone C, Turnbaugh PJ, Ramey RR, Bircher JS, et al. Эволюция млекопитающих и их кишечных микробов. Наука. 2008. 320 (5883): 1647–51.
CAS PubMed PubMed Central Статья Google Scholar
Muegge BD, Kuczynski J, Knights D, Clemente JC, Gonzalez A, Fontana L, et al. Диета способствует сближению функций микробиома кишечника в филогенезе млекопитающих и в организме человека. Наука. 2011. 332 (6032): 970–4.
CAS PubMed PubMed Central Статья Google Scholar
Munyaka PM, Khafipour E, Ghia JE. Внешнее влияние на формирование микробиоты кишечника в раннем детстве и последующие последствия для здоровья.Фронт Педиатр. 2014; 2: 109.
PubMed PubMed Central Статья Google Scholar
Garcia-Mantrana I, Alcantara C, Selma-Royo M, Boix-Amoros A, Dzidic M, Gimeno-Alcaniz J, et al. МАМИ: когорта новорожденных, сосредоточенная на микробиоте матери и ребенка в раннем возрасте. BMC Pediatr. 2019; 19 (1): 140.
PubMed PubMed Central Статья Google Scholar
Dogra S, Sakwinska O, Soh SE, Ngom-Bru C, Bruck WM, Berger B и др. Скорость установления микробиоты кишечника в младенчестве имеет последствия для здоровья в будущем. Кишечные микробы. 2015; 6 (5): 321–5.
PubMed PubMed Central Статья Google Scholar
Vael C, Desager K. Важность развития кишечной микробиоты в младенчестве. Curr Opin Pediatr. 2009. 21 (6): 794–800.
PubMed Статья PubMed Central Google Scholar
Saavedra JM, Dattilo AM. Раннее развитие кишечной микробиоты: последствия для здоровья в будущем. Гастроэнтерол Clin N Am. 2012. 41 (4): 717–31.
Артикул Google Scholar
Houghteling PD, Walker WA. Почему первоначальная бактериальная колонизация кишечника важна для здоровья младенцев и детей? J Pediatr Gastroenterol Nutr. 2015; 60 (3): 294–307.
PubMed PubMed Central Статья Google Scholar
Olszak T, An D, Zeissig S, Vera MP, Richter J, Franke A, et al. Воздействие микробов в молодом возрасте оказывает стойкое влияние на функцию естественных Т-клеток-киллеров. Наука. 2012; 336 (6080): 489–93.
CAS PubMed PubMed Central Статья Google Scholar
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352 (6285): 539–44.
CAS PubMed PubMed Central Статья Google Scholar
Джонсон СС, собственник ДР. Бактериальная микробиота кишечника младенцев и риск детской астмы и аллергических заболеваний. Перевод Рез. 2017; 179: 60–70.
PubMed Статья PubMed Central Google Scholar
Johnson CC, Ownby DR. Аллергия и астма: являются ли атопические расстройства результатом неадекватного иммунного гомеостаза, вызванного дисбактериозом кишечника младенцев? Эксперт Рев Клин Иммунол. 2016; 12 (4): 379–88.
CAS PubMed PubMed Central Статья Google Scholar
Азад МБ, Козырский АЛ. Перинатальное программирование астмы: роль кишечной микробиоты. Clin Dev Immunol. 2012; 2012: 932072.
PubMed Статья PubMed Central Google Scholar
Arrieta MC, Stiemsma LT, Dimitriu PA, Thorson L, Russell S, Yurist-Doutsch S, et al. Микробные и метаболические изменения в раннем младенчестве влияют на риск детской астмы. Sci Transl Med. 2015; 7 (307): 307ра152.
PubMed Статья CAS PubMed Central Google Scholar
Abrahamsson TR, Jakobsson HE, Andersson AF, Bjorksten B, Engstrand L, Jenmalm MC. Низкое разнообразие кишечной микробиоты в раннем младенчестве предшествует астме в школьном возрасте. Clin Exp Allergy. 2014; 44 (6): 842–50.
CAS PubMed Статья PubMed Central Google Scholar
Stiemsma LT, Arrieta MC, Dimitriu PA, Cheng J, Thorson L, Lefebvre DL, et al. Сдвиги у Lachnospira и Clostridium sp. В 3-месячном стуле микробиом ассоциируется с астмой дошкольного возраста.Clin Sci. 2016; 130 (23): 2199–207.
CAS PubMed Статья PubMed Central Google Scholar
Каллиомаки М., Салминен С., Арвиломми Х., Керо П., Коскинен П., Изолаури Е. Пробиотики в первичной профилактике атопических заболеваний: рандомизированное плацебо-контролируемое исследование. Ланцет. 2001. 357 (9262): 1076–9.
CAS PubMed Статья PubMed Central Google Scholar
Penders J, Thijs C., van den Brandt PA, Kummeling I, Snijders B, Stelma F, et al. Состав кишечной микробиоты и развитие атопических проявлений в младенчестве: когортное исследование KOALA Birth Cohort Study. Кишечник. 2007. 56 (5): 661–7.
CAS PubMed Статья PubMed Central Google Scholar
Penders J, Stobberingh EE, Thijs C., Adams H, Vink C., van Ree R, et al. Молекулярный фингерпринт микробиоты кишечника младенцев, у которых атопическая экзема развивалась или не развивалась.Clin Exp Allergy. 2006. 36 (12): 1602–8.
CAS PubMed Статья PubMed Central Google Scholar
Ван М., Карлссон К., Олссон С., Адлерберт И., Уолд А.Е., Страчан Д.П. и др. Уменьшение разнообразия в ранней фекальной микробиоте младенцев с атопической экземой. J Allergy Clin Immunol. 2008. 121 (1): 129–34.
PubMed Статья Google Scholar
Исмаил И.Х., Оппедисано Ф., Джозеф С.Дж., Бойл Р.Дж., Личчарди П.В., Робинс-Браун Р.М. и др. Уменьшение разнообразия кишечных микробов в раннем возрасте связано с более поздним развитием экземы, но не атопии у младенцев из группы высокого риска. Pediatr Allergy Immunol. 2012. 23 (7): 674–81.
PubMed Статья PubMed Central Google Scholar
Abrahamsson TR, Jakobsson HE, Andersson AF, Bjorksten B, Engstrand L, Jenmalm MC. Низкое разнообразие микробиоты кишечника у младенцев с атопической экземой.J Allergy Clin Immunol. 2012; 129 (2): 434–40 40 e1–2.
PubMed Статья PubMed Central Google Scholar
Nylund L, Nermes M, Isolauri E, Salminen S, de Vos WM, Satokari R. Тяжесть атопического заболевания обратно пропорциональна разнообразию кишечной микробиоты и бактерий, продуцирующих бутират. Аллергия. 2015; 70 (2): 241–4.
CAS PubMed Статья PubMed Central Google Scholar
Simonyte Sjodin K, Vidman L, Ryden P, West CE. Новые данные о роли микробиоты кишечника в развитии аллергических заболеваний. Curr Opin Allergy Clin Immunol. 2016; 16 (4): 390–5.
PubMed Статья CAS PubMed Central Google Scholar
Fujimura KE, Sitarik AR, Havstad S, Lin DL, Levan S, Fadrosh D, et al. Микробиота кишечника новорожденных связана с мультисенсибилизированной атопией у детей и дифференцировкой Т-клеток.Nat Med. 2016; 22 (10): 1187–91.
CAS PubMed PubMed Central Статья Google Scholar
Исмаил И.Х., Бойл Р.Дж., Личчарди П.В., Оппедисано Ф., Лахтинен С., Робинс-Браун Р.М. и др. Ранняя колонизация кишечника Bifidobacterium breve и B. catenulatum по-разному модулирует риск экземы у детей с высоким риском развития аллергических заболеваний. Pediatr Allergy Immunol. 2016; 27 (8): 838–46.
PubMed Статья PubMed Central Google Scholar
Каллиомаки М., Салминен С., Пусса Т., Изолаури Е. Пробиотики в течение первых 7 лет жизни: совокупное снижение риска экземы в рандомизированном плацебо-контролируемом исследовании. J Allergy Clin Immunol. 2007. 119 (4): 1019–21.
PubMed Статья PubMed Central Google Scholar
Исолаури Э., Арвола Т., Сутас Й., Мойланен Э., Салминен С. Пробиотики в лечении атопической экземы. Clin Exp Allergy. 2000. 30 (11): 1604–10.
CAS PubMed Статья PubMed Central Google Scholar
Копп М.В., Хеннемут I, Хайнцманн А., Урбанек Р. Рандомизированное двойное слепое плацебо-контролируемое испытание пробиотиков для первичной профилактики: отсутствие клинических эффектов от добавок Lactobacillus GG. Педиатрия. 2008; 121 (4): e850–6.
PubMed Статья PubMed Central Google Scholar
Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hammadi S, Agarwal A, et al. Рекомендации Всемирной аллергологической организации и Университета Макмастера по профилактике аллергических заболеваний (GLAD-P): пробиотики. World Allergy Organ J. 2015; 8 (1): 4.
PubMed PubMed Central Статья Google Scholar
Фили Т., Планкетт С.Х., Бао Р.Й., Хонг SMC, Каллин Е., Бельда-Ферре П. и др. У здоровых младенцев есть кишечные бактерии, защищающие от пищевой аллергии.Nat Med. 2019; 25 (3): 448.
CAS PubMed PubMed Central Статья Google Scholar
Диас М., Гуадамуро Л., Эспиноза-Мартос И., Манкабелли Л., Хименес С., Молинос-Норниелла С. и др. Микробиота и производные параметры в образцах фекалий младенцев с аллергией на белок коровьего молока, отличной от IgE, при строгой диете. Питательные вещества. 2018; 10 (10).
PubMed Central Статья CAS PubMed Google Scholar
Reinhardt C, Reigstad CS, Backhed F. Кишечная микробиота в младенчестве и ее значение для ожирения. J Pediatr Gastroenterol Nutr. 2009. 48 (3): 249–56.
PubMed Статья Google Scholar
Колева П.Т., Бриджман С.Л., Козырский АЛ. Микробиом кишечника младенца: данные о риске ожирения и диетическом вмешательстве. Питательные вещества. 2015; 7 (4): 2237–60.
CAS PubMed PubMed Central Статья Google Scholar
Каллиомаки М., Колладо М.К., Салминен С., Изолаури Э. Ранние различия в составе фекальной микробиоты у детей могут предсказать избыточный вес. Am J Clin Nutr. 2008. 87 (3): 534–8.
CAS PubMed Статья Google Scholar
Scheepers LE, Penders J, Mbakwa CA, Thijs C., Mommers M, Arts IC. Состав кишечной микробиоты и развитие веса у детей: когортное исследование KOALA Birth Cohort Study. Int J Obes. 2015; 39 (1): 16–25.
CAS Статья Google Scholar
Kerr CA, Grice DM, Tran CD, Bauer DC, Li D, Hendry P, et al. События ранней жизни влияют на метаболическое здоровье в течение всей жизни через микрофлору кишечника и проницаемость кишечника. Crit Rev Microbiol. 2015; 41 (3): 326–40.
CAS PubMed Статья Google Scholar
Blustein J, Attina T., Liu M, Ryan AM, Cox LM, Blaser MJ, et al.Связь кесарева сечения с ожирением у детей в возрасте от 6 недель до 15 лет. Int J Obes. 2013. 37 (7): 900–6.
CAS Статья Google Scholar
Dogra S, Sakwinska O, Soh SE, Ngom-Bru C, Bruck WM, Berger B, et al. На динамику микробиоты кишечника младенца влияют способ родоразрешения и продолжительность беременности, и она связана с последующим ожирением. mBio. 2015; 6 (1).
Гохир З., Рэтклифф Е.М., Слобода ДМ.Из ошибок, которые нас формируют: материнское ожирение, микробиом кишечника и долгосрочный риск заболеваний. Pediatr Res. 2015; 77 (1-2): 196-204.
PubMed Статья Google Scholar
Манко М. Микробиота кишечника и программирование развития мозга: от данных о поведенческих эндофенотипах до новых перспектив ожирения. Front Cell Infect Microbiol. 2012; 2: 109.
PubMed PubMed Central Статья Google Scholar
Луото Р., Каллиомаки М., Лайтинен К., Изолаури Э. Влияние перинатального пробиотического вмешательства на развитие избыточного веса и ожирения: последующее исследование от рождения до 10 лет. Int J Obes. 2010. 34 (10): 1531–7.
CAS Статья Google Scholar
Луото Р., Колладо М.К., Салминен С., Изолаури Э. Изменение микробиоты кишечника в раннем возрасте: функциональное влияние на риск ожирения? Энн Нутр Метаб. 2013; 63 (Дополнение 2): 17–26.
CAS PubMed Статья PubMed Central Google Scholar
Махана Д., Трент С.М., Курц З.Д., Бокулич Н.А., Батталья Т., Чунг Дж. И др. Нарушение антибиотиками микробиома кишечника мышей усиливает ожирение, инсулинорезистентность и заболевания печени, связанные с диетой с высоким содержанием жиров. Genome Med. 2016; 8 (1): 48.
PubMed PubMed Central Статья CAS Google Scholar
Cox LM, Yamanishi S, Sohn J, Alekseyenko AV, Leung JM, Cho I, et al. Изменение кишечной микробиоты во время критического периода развития имеет долгосрочные метаболические последствия. Клетка. 2014. 158 (4): 705–21.
CAS PubMed PubMed Central Статья Google Scholar
Нобель Ю.Р., Кокс Л.М., Киригин Ф.Ф., Бокулич Н.А., Яманиши С., Тейтлер И. и др. Метаболические и метагеномные исходы импульсного лечения антибиотиками в раннем возрасте.Nat Commun. 2015; 6: 7486.
PubMed PubMed Central Статья Google Scholar
Cox LM, Blaser MJ. Антибиотики в молодости и ожирении. Nat Rev Endocrinol. 2015; 11 (3): 182–90.
PubMed Статья PubMed Central Google Scholar
Турта О., Раутава С. Антибиотики, ожирение и связь с микробами — что мы делаем с нашими детьми? BMC Med.2016; 14: 57.
PubMed PubMed Central Статья Google Scholar
Korpela K, de Vos WM. Использование антибиотиков в детстве изменяет микробиоту кишечника и предрасполагает к избыточному весу. Microb Cell. 2016; 3 (7): 296–8.
CAS PubMed PubMed Central Статья Google Scholar
Gulden E, Wong FS, Wen L. Микробиота кишечника и диабет 1 типа.Clin Immunol. 2015; 159 (2): 143–53.
CAS PubMed PubMed Central Статья Google Scholar
de Goffau MC, Fuentes S, van den Bogert B, Honkanen H, de Vos WM, Welling GW, et al. Аберрантный состав микробиоты кишечника в начале диабета 1 типа у детей раннего возраста. Диабетология. 2014; 57 (8): 1569–77.
PubMed Статья CAS Google Scholar
Костич А.Д., Геверс Д., Сильяндер Х., Ватанен Т., Хиотилайнен Т., Хамалайнен А.М. и др. Динамика микробиома кишечника младенца человека в развитии и прогрессировании к диабету 1 типа. Клеточный микроб-хозяин. 2015; 17 (2): 260–73.
CAS PubMed PubMed Central Статья Google Scholar
Ширбель А., Фиокки С. Ориентация на врожденную иммунную систему при воспалительных заболеваниях кишечника у детей. Эксперт Рев Гастроэнтерол Гепатол.2011; 5 (1): 33–41.
CAS PubMed Статья Google Scholar
Ван Ф., Каплан Дж. Л., Голд Б. Д., Бхасин М. К., Уорд Н. Л., Келлермайер Р. и др. Выявление микробного дисбактериоза, связанного с детской болезнью Крона, несмотря на высокую изменчивость микробиоты кишечника. Cell Rep. 2016; 14 (4): 945–55.
CAS PubMed PubMed Central Статья Google Scholar
О’Махони С.М., Марчези Дж. Р., Скалли П., Кодлинг С., Сеолхо А. М., Куигли Е. М. и др. Стресс в раннем возрасте изменяет поведение, иммунитет и микробиоту у крыс: последствия для синдрома раздраженного кишечника и психических заболеваний. Биол Психиатрия. 2009. 65 (3): 263–7.
PubMed Статья Google Scholar
О’Махони С.М., Феличе В.Д., Налли К., Савиньяк Х.М., Клаессон М.Дж., Скалли П. и др. Нарушение микробиоты кишечника в молодом возрасте выборочно влияет на висцеральную боль во взрослом возрасте, не влияя на когнитивное или связанное с тревогой поведение у самцов крыс.Неврология. 2014; 277: 885–901.
CAS PubMed Статья Google Scholar
Кристоф К., Кочиш Э., Надь К. Клиническая микробиология раннего и позднего неонатального сепсиса, особенно среди недоношенных детей. Acta Microbiol Immunol Hung. 2009. 56 (1): 21–51.
PubMed Статья Google Scholar
Арболея С., Бинетти А., Салазар Н., Фернандес Н., Солис Дж., Эрнандес-Барранко А. и др.Становление и развитие кишечной микробиоты у недоношенных новорожденных. FEMS Microbiol Ecol. 2012. 79 (3): 763–72.
CAS PubMed Статья Google Scholar
Арболея С., Санчес Б., Милани С., Дуранти С., Солис Дж., Фернандес Н. и др. Развитие кишечной микробиоты у недоношенных новорожденных и действие перинатальных антибиотиков. J Pediatr. 2015. 166 (3): 538–44.
CAS PubMed Статья Google Scholar
Стюарт С.Дж., Эмблтон Н.Д., Маррс Э.С., Смит Д.П., Нельсон А., Абдулкадир Б. и др. Временное бактериальное и метаболическое развитие кишечника недоношенных выявляет специфические признаки здоровья и болезни. Микробиом. 2016; 4 (1): 67.
PubMed PubMed Central Статья Google Scholar
Уорд Д.В., Шольц М., Зольфо М., Тафт Д.Х., Шиблер К.Р., Тетт А. и др. Метагеномное секвенирование с разрешением на уровне штаммов указывает на уропатогенные E.coli при некротическом энтероколите и смертности недоношенных детей. Cell Rep. 2016; 14 (12): 2912–24.
CAS PubMed PubMed Central Статья Google Scholar
Leach ST, Lui K, Naing Z, Dowd SE, Mitchell HM, Day AS. Множественные условно-патогенные микроорганизмы, но не ранее существовавшие воспаления, могут быть связаны с некротическим энтероколитом. Dig Dis Sci. 2015; 60 (12): 3728–34.
PubMed Статья Google Scholar
Sim K, Shaw AG, Randell P, Cox MJ, McClure ZE, Li MS и др. Дисбактериоз, предвосхищающий некротический энтероколит у очень недоношенных детей. Clin Infect Dis. 2015; 60 (3): 389–97.
CAS PubMed Статья Google Scholar
Май В., Янг К.М., Уханова М., Ван Х, Сунь Й., Каселла Г. и др. Микробиота кала у недоношенных детей до некротического энтероколита. PLoS One. 2011; 6 (6): e20647.
CAS PubMed PubMed Central Статья Google Scholar
Морроу А.Л., Лагомарчино А.Дж., Шиблер К.Р., Тафт Д.Х., Ю З., Ван Б. и др. Ранние микробные и метаболомные признаки предсказывают более позднее начало некротического энтероколита у недоношенных детей. Микробиом. 2013; 1 (1): 13.
PubMed PubMed Central Статья Google Scholar
Torrazza RM, Ukhanova M, Wang X, Sharma R, Hudak ML, Neu J, et al. Микробная экология кишечника и факторы окружающей среды, влияющие на некротический энтероколит.PLoS One. 2013; 8 (12): e83304.
PubMed PubMed Central Статья CAS Google Scholar
Уорнер Б.Б., Дейч Э., Чжоу Й., Холл-Мур С., Вайншток Г.М., Содергрен Э. и др. Дисбактериоз кишечных бактерий и некротизирующий энтероколит у младенцев с очень низкой массой тела при рождении: проспективное исследование случай-контроль. Ланцет. 2016; 387 (10031): 1928–36.
PubMed PubMed Central Статья Google Scholar
Стюарт С.Дж., Нельсон А., Треуман А., Скит Т., Каммингс С.П., Эмблтон Н.Д. и др. Метаболомический и протеомный анализ сыворотки крови недоношенных детей с некротизирующим энтерколитом и поздним сепсисом. Pediatr Res. 2016; 79 (3): 425–31.
CAS PubMed Статья Google Scholar
Collado MC, Cernada M, Neu J, Perez-Martinez G, Gormaz M, Vento M. Факторы, влияющие на иммунное взаимодействие желудочно-кишечного тракта и микробиоты у недоношенных детей.Pediatr Res. 2015; 77 (6): 726–31.
PubMed Статья Google Scholar
Cernada M, Bauerl C, Serna E, Collado MC, Martinez GP, Vento M. Сепсис у недоношенных детей вызывает изменения в экспрессии генов слизистой оболочки и профилях микробиоты по сравнению с близнецами без сепсиса. Научный доклад 2016; 6: 25497.
CAS PubMed PubMed Central Статья Google Scholar
Мадан Дж. К., Салари Р. К., Саксена Д., Дэвидсон Л., О’Тул Г. А., Мур Дж. Х. и др. Колонизация кишечных микробов у недоношенных новорожденных прогнозирует неонатальный сепсис. Arch Dis Child Fetal Neonatal Ed. 2012. 97 (6): F456–62.
PubMed PubMed Central Статья Google Scholar
Май В., Торрацца Р.М., Уханова М., Ван Х, Сун Й, Ли Н и др. Нарушения в развитии кишечной микробиоты, связанные с поздним началом сепсиса у недоношенных детей.PLoS One. 2013; 8 (1): e52876.
CAS PubMed PubMed Central Статья Google Scholar
Arrieta MC, Stiemsma LT, Amenyogbe N, Brown EM, Finlay B. Кишечный микробиом в раннем возрасте: здоровье и болезни. Фронт Иммунол. 2014; 5: 427.
PubMed PubMed Central Статья CAS Google Scholar
Roger LC, Costabile A, Holland DT, Hoyles L, McCartney AL.Исследование фекальных популяций Bifidobacterium у младенцев, находящихся на грудном вскармливании и на искусственном вскармливании, в течение первых 18 месяцев жизни. Микробиология. 2010. 156 (Pt 11): 3329–41.
CAS PubMed Статья Google Scholar
Bergstrom A, Skov TH, Bahl MI, Roager HM, Christensen LB, Ejlerskov KT, et al. Установление кишечной микробиоты в раннем возрасте: продольное, исследовательское исследование большой когорты датских младенцев. Appl Environ Microbiol.2014. 80 (9): 2889–900.
CAS PubMed PubMed Central Статья Google Scholar
Валлес Й., Артачо А., Паскуаль-Гарсия А., Феррус М.Л., Госальбес М.Дж., Абеллан Дж. Дж. И др. Последовательность микробов в кишечнике: направленные тенденции таксономических и функциональных изменений в когорте новорожденных испанских младенцев. PLoS Genet. 2014; 10 (6): e1004406.
PubMed PubMed Central Статья CAS Google Scholar
Тиссье. Научные исследования нормальной кишечной флоры и ее патологии. [Диссертация]: Парижский университет; 1900.
Turroni F, Duranti S, Bottacini F, Guglielmetti S, Van Sinderen D, Ventura M. Bifidobacterium bifidum как пример специализированного комменсала кишечника человека. Front Microbiol. 2014; 5: 437.
PubMed PubMed Central Статья Google Scholar
Milani C, Turroni F, Duranti S, Lugli GA, Mancabelli L, Ferrario C и др.Геномика рода Bifidobacterium обнаруживает видоспецифичную адаптацию к богатой гликанами среде кишечника. Appl Environ Microbiol. 2016; 82 (4): 980–91.
CAS PubMed PubMed Central Статья Google Scholar
Дуранти С., Лугли Г.А., Манкабелли Л., Арманини Ф., Туррони Ф., Джеймс К. и др. Материнское наследование сообществ бифидобактерий и бифидофагов у младенцев путем вертикальной передачи. Микробиом.2017; 5 (1): 66.
PubMed PubMed Central Статья Google Scholar
Ventura M, Canchaya C, Tauch A, Chandra G, Fitzgerald GF, Chater KF, et al. Геномика актинобактерий: прослеживание эволюционной истории древнего типа. Microbiol Mol Biol Rev.2007; 71 (3): 495–548.
CAS PubMed PubMed Central Статья Google Scholar
Milani C, Mangifesta M, Mancabelli L, Lugli GA, James K, Duranti S, et al. Представляем биогеографию бифидобактерий ветви древа жизни млекопитающих. ISME J. 2017; 11 (12): 2834–47.
PubMed PubMed Central Статья Google Scholar
Duranti S, Lugli GA, Milani C, James K, Mancabelli L, Turroni F, et al. Bifidobacterium bifidum и микробиота кишечника младенца: интригующий случай совместной эволюции микроба и хозяина.Environ Microbiol. 2019; 21: 3683–95.
CAS PubMed Статья PubMed Central Google Scholar
Milani C, Hevia A, Foroni E, Duranti S, Turroni F, Lugli GA, et al. Оценка фекальной микробиоты: оптимизированный протокол анализа генов 16S рРНК с ионным потоком. PLoS One. 2013; 8 (7): e68739.
CAS PubMed PubMed Central Статья Google Scholar
Harmsen HJ, Wildeboer-Veloo AC, Raangs GC, Wagendorp AA, Klijn N, Bindels JG, et al. Анализ развития кишечной флоры у детей, находящихся на грудном и искусственном вскармливании, с использованием методов молекулярной идентификации и обнаружения. J Pediatr Gastroenterol Nutr. 2000. 30 (1): 61–7.
CAS PubMed Статья PubMed Central Google Scholar
Мюллер С., Сонье К., Ханиш С., Норин Е., Алм Л., Мидтведт Т. и др. Различия в фекальной микробиоте в разных европейских исследуемых популяциях в зависимости от возраста, пола и страны: кросс-секционное исследование.Appl Environ Microbiol. 2006. 72 (2): 1027–33.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Foroni E, Pizzetti P, Giubellini V, Ribbera A, Merusi P, et al. Изучение разнообразия популяции бифидобактерий в кишечном тракте человека. Appl Environ Microbiol. 2009. 75 (6): 1534–45.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Marchesi JR, Foroni E, Gueimonde M, Shanahan F, Margolles A и др. Микробиомный анализ популяции бифидобактерий в дистальном отделе кишечника человека. ISME J. 2009; 3 (6): 745–51.
CAS PubMed Статья Google Scholar
Тиссье Х. Речершер по нормальной кишечной флоре и патологии нуриссон. Париж: Парижский университет; 1900.
Google Scholar
Milani C, Mancabelli L, Lugli GA, Duranti S, Turroni F, Ferrario C и др. Изучение вертикальной передачи бифидобактерий от матери к ребенку. Appl Environ Microbiol. 2015; 81: 7078–87.
CAS PubMed PubMed Central Статья Google Scholar
Duranti S, Gaiani F, Mancabelli L, Milani C, Grandi A, Bolchi A, et al. Выяснение микробиома кишечника при язвенном колите: бифидобактерии как новые микробные биомаркеры.FEMS Microbiol Ecol. 2016; 92 (12).
PubMed Статья CAS PubMed Central Google Scholar
Иган М., О’Коннелл Мазервэй М., Килкойн М., Кейн М., Джоши Л., Вентура М. и др. Перекрестное питание Bifidobacterium breve UCC2003 во время совместного культивирования с Bifidobacterium bifidum PRL2010 в среде на основе муцина. BMC Microbiol. 2014; 14 (1): 282.
PubMed PubMed Central Статья CAS Google Scholar
Иган М., О’Коннелл Мазервэй М., Вентура М., ван Синдерен Д. Метаболизм сиаловой кислоты с помощью Bifidobacterium breve UCC2003. Appl Environ Microbiol. 2014. 80 (14): 4414–26.
PubMed PubMed Central Статья CAS Google Scholar
Ferrario C, Duranti S, Milani C, Mancabelli L, Lugli GA, Turroni F и др. Изучение аминокислотной ауксотрофии в Bifidobacterium bifidum PRL2010. Front Microbiol. 2015; 6: 1331.
PubMed PubMed Central Статья Google Scholar
Turroni F, Serafini F, Foroni E, Duranti S, O’Connell Motherway M, Taverniti V и др. Роль сортаза-зависимых пилей Bifidobacterium bifidum PRL2010 в модулировании взаимодействий бактерия-хозяин. Proc Natl Acad Sci U S. A. 2013; 110 (27): 11151–6.
CAS PubMed PubMed Central Статья Google Scholar
Серафини Ф, Страти Ф, Руас-Мадиедо П, Туррони Ф, Форони Э, Дуранти С. и др. Оценка адгезионных свойств и антибактериальной активности комменсального кишечника младенца Bifidobacterium bifidum PRL2010.Анаэроб. 2013; 21: 9–17.
CAS PubMed Статья PubMed Central Google Scholar
Серафини Ф., Туррони Ф., Руас-Мадиедо П., Лугли Г.А., Милани С., Дуранти С. и др. Кефирное молоко и кефиран способствуют росту Bifidobacterium bifidum PRL2010 и модулируют экспрессию его генов. Int J Food Microbiol. 2014; 178: 50–9.
CAS PubMed Статья PubMed Central Google Scholar
Turroni F, Taverniti V, Ruas-Madiedo P, Duranti S, Guglielmetti S, Lugli GA и др. Bifidobacterium bifidum PRL2010 модулирует врожденный иммунный ответ хозяина. Appl Environ Microbiol. 2014; 80 (2): 730–40.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Foroni E, Montanini B, Viappiani A, Strati F, Duranti S, et al. Глобальное профилирование транскрипции генома Bifidobacterium bifidum PRL2010 в условиях in vitro и идентификация эталонных генов для количественной ПЦР в реальном времени.Appl Environ Microbiol. 2011. 77 (24): 8578–87.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Strati F, Foroni E, Serafini F, Duranti S, van Sinderen D, et al. Анализ предсказанных систем транспорта углеводов, кодируемых Bifidobacterium bifidum PRL2010. Appl Environ Microbiol. 2012. 78 (14): 5002–12.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Serafini F, Mangifesta M, Arioli S, Mora D, van Sinderen D, et al. Экспрессия зависящих от сортировки пилей Bifidobacterium bifidum PRL2010 в ответ на условия окружающей среды кишечника. FEMS Microbiol Lett. 2014; 357 (1): 23–33.
CAS PubMed Статья PubMed Central Google Scholar
Zanotti I, Turroni F, Piemontese A, Mancabelli L, Milani C, Viappiani A, et al. Доказательства активности Bifidobacterium bifidum PRL2010 по снижению холестерина посредством модуляции микробиоты кишечника.Appl Microbiol Biotechnol. 2015; 99 (16): 6813–29.
CAS PubMed Статья Google Scholar
Turroni F, Ozcan E, Milani C, Mancabelli L, Viappiani A, van Sinderen D, et al. Активность перекрестного питания гликанов между бифидобактериями в условиях in vitro. Front Microbiol. 2015; 6: 1030.
PubMed PubMed Central Статья Google Scholar
Turroni F, Milani C, Duranti S, Mancabelli L, Mangifesta M, Viappiani A и др. Расшифровка метаболических взаимодействий, опосредованных бифидобактериями, и их влияния на микробиоту кишечника с помощью многопрофильного подхода. Исме Дж. 2016; 10: 1656–68.
CAS PubMed PubMed Central Статья Google Scholar
Turroni F, Milani C, van Sinderen D, Ventura M. Генетические стратегии метаболизма муцина в Bifidobacterium bifidum PRL2010: пример возможной коэволюции человека и микроба.Кишечные микробы. 2011; 2 (3): 183–9.
PubMed Статья Google Scholar
Turroni F, Bottacini F, Foroni E, Mulder I., Kim JH, Zomer A, et al. Анализ генома Bifidobacterium bifidum PRL2010 выявляет метаболические пути для кормления гликанов хозяина. Proc Natl Acad Sci U S. A. 2010; 107 (45): 19514–9.
CAS PubMed PubMed Central Статья Google Scholar
Colagiorgi A, Turroni F, Mancabelli L, Serafini F, Secchi A, van Sinderen D, et al. Понимание биосинтеза тейхоевой кислоты Bifidobacterium bifidum PRL2010. FEMS Microbiol Lett. 2015; 362 (17): fnv141.
PubMed Статья CAS PubMed Central Google Scholar
Манчино В., Дуранти С., Манкабелли Л., Лонги Г., Анзалоне Р., Милани С. и др. Передача бифидобактерий от матери к ребенку при исследовании модели на животных.Микроорганизмы. 2019; 7 (9).
PubMed Central Статья Google Scholar
Хупер Л.В., Сюй Дж., Фальк П.Г., Мидтведт Т., Гордон Дж. Молекулярный датчик, который позволяет кишечному комменсалу контролировать свою питательную основу в конкурентной экосистеме. Proc Natl Acad Sci U S. A. 1999; 96 (17): 9833–8.
CAS PubMed PubMed Central Статья Google Scholar
Caballero-Franco C, Keller K, De Simone C, Chadee K. Пробиотическая формула VSL # 3 индуцирует экспрессию и секрецию гена муцина в эпителиальных клетках толстой кишки. Am J Physiol Gastrointest Liver Physiol. 2007; 292 (1): G315–22.
CAS PubMed Статья PubMed Central Google Scholar
Руас-Мадиедо П., Геймонд М., Фернандес-Гарсия М., де лос Рейес-Гавилан К.Г., Марголлес А. Разложение муцина штаммами Bifidobacterium, выделенными из кишечной микробиоты человека.Appl Environ Microbiol. 2008. 74 (6): 1936–40.
CAS PubMed PubMed Central Статья Google Scholar
Lombard V, Golaconda Ramulu H, Drula E, Coutinho PM, Henrissat B. База данных по углеводно-активным ферментам (CAZy) в 2013 г. Nucleic Acids Res. 2014; 42 (выпуск базы данных): D490–5.
CAS PubMed Статья PubMed Central Google Scholar
Ventura M, Turroni F, Motherway MO, MacSharry J, van Sinderen D. Взаимодействия между хозяином и микробом, которые способствуют колонизации кишечника комменсальными бифидобактериями. Trends Microbiol. 2012. 20 (10): 467–76.
CAS PubMed Статья PubMed Central Google Scholar
Lopez P, Gonzalez-Rodriguez I, Gueimonde M, Margolles A, Suarez A. Иммунный ответ на штаммы Bifidobacterium bifidum поддерживает пластичность Treg / Th27. PLoS One.2011; 6 (9): e24776.
CAS PubMed PubMed Central Статья Google Scholar
Caffarelli C, Cardinale F, Povesi-Dascola C, Dodi I, Mastrorilli V, Ricci G. Использование пробиотиков при детских инфекционных заболеваниях. Expert Rev Anti-Infect Ther. 2015; 13 (12): 1517–35.
CAS PubMed Статья PubMed Central Google Scholar
ведущих медицинских специалистов собираются для решения проблемы дисбактериоза кишечника младенцев — Evolve BioSystems
Эксперты со всего США борются с возросшей распространенностью нарушения микробиома кишечника младенцев и ролью дисбактериоза в краткосрочных и долгосрочных результатах для здоровья
., 4 июня 2019 г. / PRNewswire / — Evolve BioSystems, производитель детского пробиотика Evivo®, объявила сегодня о созыве Консультативного совета по здоровью младенцев, в состав которого вошли ведущие эксперты медицинского и научно-исследовательского сообщества в области здоровья младенцев. Консультативный совет провел свое первое заседание 29 мая, на котором обсуждались способы восстановления полезных бактерий, необходимых для создания функционального микробиома младенца, и снижения риска краткосрочных и долгосрочных проблем со здоровьем.
Во время этого первого и последующих заседаний Консультативный совет по здоровью младенцев изучит, как безопасно и эффективно вернуть жизненно важные бактерии в микробиомы младенцев.В состав Консультативного совета по здоровью младенцев входят :
Доктор Крис Дамман, доктор медицины, старший сотрудник по программам, Глобальное здравоохранение, Фонд Билла и Мелинды Гейтс; Ассистент профессора, гастроэнтерология, Вашингтонский университет
Доктор Бенджамин Голд, доктор медицины, детский гастроэнтеролог, Детский центр здоровья пищеварительной системы, Атланта
Доктор Джэ Ким, доктор медицины, доктор философии, неонатолог и детский гастроэнтеролог, детская больница Рэди -Сан Диего; Клинический профессор педиатрии, Калифорнийский университет, Сан-Диего
Dr.Брайан Скоттолайн, доктор медицины, доктор философии, неонатолог, доцент педиатрии, Орегонский университет медицинских наук
Доктор Эрин Гамильтон Спенс, доктор медицины, неонатолог, Детская больница Кука, Форт-Уэрт; Медицинский директор, Банк материнского молока в Северном Техасе
Доктор Карл Сильвестр, доктор медицины, профессор хирургии и педиатрии, заместитель декана по исследованию здоровья матери и ребенка, Стэнфордский университет
«Проблема дисбактериоза проявляется по-разному. .«Очень важно объединить исследователей и клиницистов из разных дисциплин», — сказала д-р Эрин Гамильтон Спенс, доктор медицины, неонатолог Детской больницы Кука, Форт-Уэрт, и медицинский директор, Mother’s Milk Bank в Северном Техасе. «Каждый из нас видит проблемы в наш собственный объектив. Консультативный совет по здоровью новорожденных Evolve BioSystems предоставляет форум для обмена данными и генерации идей. Основываясь на нашей первой встрече, я очень взволнован нашим потенциалом пролить свет на очень сложные и все более распространенные проблемы со здоровьем младенцев в США и за их пределами.»
Ключевые полезные бактерии, B. infantis, , клинически доказано, что они снижают изобилие кишечных патогенов, таких как Clostridium и E. coli , которые связаны со все более распространенными аутоиммунными состояниями, такими как астма и аллергии. , экзема и диабет типа 1. Хотя B. infantis исторически присутствовал в кишечнике младенцев, важные современные медицинские методы, такие как антибиотики, кормление смесью и кесарево сечение, предотвратили естественный перенос полезных бактерий от матери к младенцу при рождении. .Действительно, недавние исследования показали, что до девяти из 10 младенцев, рожденных в США, в раннем возрасте отсутствовали в кишечном микробиоме B. infantis .
«Ведущие практики в области неонатальной и педиатрической науки и медицины начинают понимать, что дисбактериоз, характеризующийся нарушением нормального кишечного микробиома и нарушением симбиотических отношений между хозяином и связанными с ним микробами, становится все более распространенным среди детей в США, «сказал доктор Бенджамин Голд, доктор медицины, детский гастроэнтеролог, Детский центр здоровья пищеварительной системы, Атланта.»Это нарушение нормальной микрофлоры может затем привести к развитию заболеваний, в частности аутоиммунных, воспалительных и аллергических заболеваний, которые становятся настоящим кризисом для общественного здравоохранения. К счастью, мы добились больших успехов в поиске методов восстановления кишечник ребенка до нормального здорового состояния. Мы должны использовать эти мощные открытия и начать применять эту технологию к ряду различных парадигм болезней, чтобы определить, можно ли успешно снизить риск развития болезни путем восстановления нормального микробиома младенца.»
О компании Evolve BioSystems
Evolve BioSystems, Inc. — это частная компания, занимающаяся микробиомом, которая занимается разработкой следующего поколения продуктов для создания, восстановления и поддержания здорового микробиома кишечника. Evolve недавно завершила раунд серии C. финансирования, совместно возглавляемого Фондом Билла и Мелинды Гейтс и Horizons Ventures, венчурным подразделением Фонда Ли Ка Шинга. Evolve — это дочерняя компания Института продуктов питания для здоровья (FFHI) Калифорнийского университета в Дэвисе. на более чем десятилетних исследованиях, направленных на понимание уникального взаимодействия микробиома кишечника младенца и компонентов грудного молока.Благодаря разработке и коммерческому запуску продуктов для лечения дисбактериоза кишечника новорожденных, включая Evivo® EVC001 для младенцев, платформа открытий Evolve теперь применяется для решения проблемы дисбактериоза кишечника на протяжении всего жизненного цикла человека и животных. В дополнение к знаменательному испытанию, подтверждающему концепцию, Evolve проводит дальнейшие клинические исследования для создания своего набора решений на основе микробиома.
Изменение парадигмы с глубокими последствиями для патофизиологических концепций и новых терапевтических стратегий
Преждевременные роды представляют собой глобальную проблему с постоянно растущим бременем болезней в течение последних десятилетий.Прогресс в понимании этиопатогенеза пока не привел к сокращению числа недоношенных детей. Сбалансированное развитие микробиома хозяина в раннем возрасте является ключом к созреванию иммунной системы и многих других физиологических функций. Благодаря огромному прогрессу в новых диагностических возможностях, влияние изменений микробиоты на преждевременные роды, а также острые и долгосрочные последствия недоношенности стали предметом исследования. В этом обзоре обобщены последние достижения в понимании микробиомов амниотической полости и нижних половых путей женщин, а также того, как изменения в структурах микробиоты способствуют преждевременным родам.Выставление этих очень уязвимых младенцев к враждебной среде в отделении интенсивной терапии новорожденных обязательно влечет за собой быструю колонизацию несбалансированным микробиомом в ситуации, когда организм все еще очень подвержен и находится на ранней стадии развития. Глобальные исследовательские усилия по расшифровке патологических изменений проложат путь к новым концепциям дородовой и послеродовой терапии.
1. Введение
Микробиомы включают комменсальные, симбиотические и патогенные бактерии, грибы и вирусы, которые образуют экологическую единицу и взаимодействуют между собой и со своим конкретным хозяином.Долгое время считалось, что колонизация микробиоты ограничивается поверхностями тела, такими как кожа и желудочно-кишечный тракт. Однако в последние годы стало ясно, что микроорганизмы обитают почти во всех тканях человека, включая молочные железы, яичники, матку и плаценту. Таким образом, человеческое тело заселяют триллионы микробных обитателей. Они составляют разнообразное и индивидуально меняющееся экологическое сообщество, которое, кроме того, меняется с возрастом [1]. В соответствии с этим пришлось отказаться от прежней теории о том, что амниотическая полость представляет собой стерильную среду.Стало ясно, что здоровая материнско-фетальная единица заселена микробами и что это является предпосылкой для иммунного созревания, а также метаболического и гормонального гомеостаза. Жизнь плода и первый год жизни — это продолжительность жизни, которая имеет решающее значение для развития хорошо функционирующей иммунной системы и поддержания здоровья в долгосрочной перспективе. По этим причинам негативные события в раннем возрасте представляют особый риск для соматического и психомоторного развития. Патологические изменения микробиомов предрасполагают или способствуют возникновению острых и хронических заболеваний каждого органа в любом возрасте.Кроме того, функциональные изменения микробиомов вызывают инфекционные осложнения. В этом обзоре мы представляем последние сведения о структуре и функции нашего микробиома и о том, как патологические изменения способствуют преждевременным родам, преждевременным родам, а также острым и долгосрочным последствиям недоношенных детей. Несмотря на то, что грибы и вирусы являются частью микробиомов, до сих пор большая часть исследовательских усилий была сосредоточена на разнообразии бактерий. Таким образом, другие микробы, кроме бактерий, в основном исключены из этого обзора просто потому, что нет доступных данных.
2. Функциональные особенности микробиома нижних отделов урогенитального тракта и плода
Амниотическая полость долгое время считалась стерильной средой, в которой плод защищен от вредных внешних воздействий и угроз. Первые сообщения появились в начале нового тысячелетия, в которых эта гипотеза подвергалась сомнению и описывалась внутриутробная и плацентарная микробная среда [2–4]. С развитием молекулярных методов стало ясно, что плацента, амнион и плод имеют большие доли общего микробиома и что материнский микробиом управляет развитием иммунной системы плода [5, 6].Микробиом плаценты в физиологических условиях содержит непатогенные комменсалы, включая Firmicutes, Tenericutes, Proteobacteria, Prevotella, Neisseria, Bacteroidetes и Fusobacteria, а также потенциальные патогенные виды, такие как Escherichia coli [7]. Поскольку его обнаружение основано на молекулярных методах, продолжается научная дискуссия о том, содержит ли плацентарный микробиом жизнеспособную микробиоту или только микробные компоненты. Тем не менее, в настоящее время предполагается регуляторная функция [8].
Микробиом влагалища напоминает микробиом шейки матки и физиологически в нем преобладают Lactobacillales, но также регулярно обнаруживаются Clostridiales, Bacteroidales и Actinomycetales. Различия и сдвиги в бактериальном сообществе выявляются почти исключительно между разными штаммами Lactobacillus без какого-либо отрицательного воздействия на исходы беременности. Во время беременности количество и разнообразие микробов уменьшается, а количество бактерий увеличивается. В то же время сокращается распространенность потенциальных патогенов, таких как микробные виды уреаплазмы и микоплазмы.Таксономический состав микробного сообщества влагалища остается стабильным во время беременности с увеличением микробного разнообразия до рождения здорового ребенка в срок. Эти данные позволяют сделать вывод о том, что состав влагалищной микробиоты строго регулируется во время беременности и что переход к небеременной ситуации предшествует родам и, возможно, даже запускает их [9–13].
Разнообразие микроорганизмов и организованные структурные изменения в молодом возрасте являются ключевыми характеристиками здорового микробиома.Этническая принадлежность и региональные различия имеют ключевое влияние на микробиоту влагалища. Остается определить, объясняют ли изменения в микробиоме влагалища, наблюдаемые у латиноамериканских и чернокожих женщин, повышенную частоту преждевременных родов в этих этнических группах [14–16].
Плод заглатывает огромное количество околоплодных вод. Это объясняет, почему его кишечник заселяется внутриутробной микрофлорой еще до рождения. После рождения ребенок быстро заселяется материнской микробиотой влагалища, кишечника и кожи.У доношенного ребенка способ родоразрешения путем вагинальных родов или кесарева сечения определяет микробное разнообразие и то, колонизируется ли кишечник в первую очередь вагинальной и фекальной или кожной микробиотой матери. Эти данные являются первым научным свидетельством того, что ранние события оказывают долгосрочное воздействие на здоровье структур микробиоты [17–20]. В отличие от ситуации в срок, решение о преждевременных родах путем кесарева сечения или вагинальных родов не влияет на микробное разнообразие кишечника и продольные изменения микробиоты, и микробиота демонстрирует модель, отличную от таковой в срок.В качестве примера различий в микробиоте недоношенных детей не хватает видов Bacteroides , которые после кесарева сечения демонстрируют отложенную модель колонизации. Хотя микробиомы в основном способны адаптироваться к микробиомам доношенных детей в течение нескольких недель, внутриутробная и послеродовая неправильная колонизация представляет собой серьезную угрозу для здоровья недоношенных детей [21–23]. В следующих главах суммируются существенные достижения в нашем понимании структур и динамики микробиоты во время беременности и после родов.
3. Патологические изменения микробиома, связанные с преждевременными родами и преждевременными родами
Причины преждевременных родов включают множество различных причин, включая психосоциальный дистресс матери, гормональные изменения, чрезмерное растяжение матки, заболевания шейки матки, сосудистые и материнские расстройства и истощение. материнско-плодовой толерантности [24]. Среди них инфекция и воспаление являются основными причинами преждевременных родов и составляют по крайней мере половину преждевременных родов [24–26].На сегодняшний день гистопатология является золотым стандартом для определения хориоамнионита, в отличие от низкой чувствительности и специфичности клинических оценок и лабораторных параметров [27]. При тяжелом хориоамнионите наблюдается типичная картина с увеличением численности бактерий и уменьшением разнообразия с преобладанием бактерий, чего не наблюдается в физиологической ситуации [28]. Эволюционное ослабление иммунной системы матери и плода делает возможным внутриутробный рост плода, но в то же время иммунная толерантность матери подвергает плод риску инфицирования [29].Диагностика материнской инфекции имеет решающее значение, поскольку плод, подвергшийся воздействию микробиоты в амниотической полости, претерпевает иммунологическую адаптацию. Это новое явление получило название так называемой иммунотолерантности или иммунопаралича. Это означает, что предыдущее или продолжающееся воздействие микробиоты подавляет необходимый физиологический иммунный ответ и что адекватное увеличение классических маркеров воспаления и инфекции не гарантируется [30, 31]. Структуры плацентарной микробиоты демонстрируют различные закономерности у доношенных и недоношенных новорожденных, независимо от способа родов, и могут зависеть от условий жизни, таких как чрезмерная прибавка в весе во время беременности [32, 33].Микробные виды уреаплазмы и микоплазмы, а также Aerococcaceae, Bifidobacteriaceae и Fusobacteria преобладают или даже присутствуют исключительно в мембранах недоношенных детей. И наоборот, бактериальный дисбактериоз и воспаление плодных оболочек могут возникать без преждевременных родов и без типичных клинических признаков и, по-видимому, не подвергают плод риску преждевременных родов [2, 4, 34]. В случае преждевременных родов происходит смещение микробиоты с уменьшением микробного разнообразия.Последние молекулярные методы оказались лучше в обнаружении микробной инвазии и разнообразия по сравнению с традиционными методами культивирования, что открыло новые возможности для диагностики [35]. Давно превалирующая концепция бактериального восхождения или передачи из урогенитального тракта как основного фактора развития хориоамнионита и амниотического воспаления была основана на бактериологическом обнаружении обычно присутствующих микробов. К ним относятся виды бактерий из родов Streptococcus , E. coli, Gardnerella spp., Prevotella, Gonorrhea, Treponema, Chlamydia, Ureaplasma и Mycoplasma , а также дрожжи, такие как Candida [13, 36–38]. Другие виды, включая анаэробные Fusobacteriaceae, были недавно обнаружены методами, не основанными на культивировании.
Фактически, в микробиоме преобладают бактерии из урогенитального тракта, кишечника и полости рта (рис. 1). Этот сдвиг сопровождается изменениями в микробных и метаболических путях, которые, как предполагается, способствуют преждевременным родам и родам [34, 39].Нижняя часть урогенитального тракта и перианальная область составляют микробный эпитоп, на который сильно влияют бактериальная колонизация кишечника и местные условия жизнеспособности. Микробиомы меняются во время беременности, и давно признано, что различия в составе являются причиной вариаций в частоте преждевременных родов [11, 16, 40, 41]. Уменьшение микробного богатства и разнообразия, а также изменения в структуре микробиома, по-видимому, происходят на ранних этапах, в первом-втором триместре беременности, и, по-видимому, существуют расовые различия [14, 42–44].То есть микробиота шейки матки женщин с инфекцией Chlamydia trachomatis , которая предрасполагает к преждевременным родам, полностью отличается от таковой здоровых женщин в отношении микробного разнообразия. Они демонстрируют изменение микробных таксонов от видов Lactobacillus к анаэробам [43, 45]. В то время как виды Lactobacillus , которые доминировали в микробиоте шейки матки, имеют более низкий риск инвазии амниотической полости и хориоамнионита после преждевременного разрыва плодных оболочек, распространенность Gardnerella и Sneathia увеличивает вероятность [46].
Микробиота из ротовой полости может в равной степени вызывать хориоамнионит, когда они передаются через кровоток или половым путем. Представители родов Streptococcus, Porphyromonas, Filifactor, Campylobacter, и Fusobacterium представляют виды, которые неоднократно были связаны с преждевременными родами. Научные данные указывают на то, что микробиота кишечника является третьим источником бактериальной транслокации и может вызывать амниотическую инфекцию и хориоамнионит.Уменьшение микробного разнообразия и изменения микробиоты кишечника происходят во время беременности с преобладанием Proteobacteria и Acinetobacteria, за исключением Bifidobacterium , Streptococcus , Clostridiales и Bacteroides , которые предрасполагают к преждевременным родам и заболеваниям [47–51]. Патологические изменения в микробиоме околоплодных вод обнаруживаются в образцах мекония от недоношенных детей с высокой степенью соответствия. Микробиота переведена на штаммы родов Enterobacter , Enterococcus , Photorhabdus, и Tannerella , которые известны своими воспалительными и потенциально преждевременными родами свойствами [39, 52, 53].В соответствии с этими наблюдениями, тип диетического питания или активное воспалительное заболевание кишечника влияет на состав микробиоты кишечника, и у этих пациентов повышается риск преждевременных родов. Это подчеркивает концепцию, согласно которой изменение микробиоты кишечника матери является одним из ответственных факторов [54].
4. Последствия для недоношенного ребенка
Воспалительные заболевания представляют наибольшую угрозу для недоношенных детей и поражают все органы, включая незрелые легкие, сердечно-сосудистую систему, иммунную систему, мозг, глаза и желудочно-кишечный тракт, с острыми и стойкими последствия для здоровья пациента.Инфекция является причиной или усугубляет острый респираторный дистресс, истечение жидкости и артериальную гипотензию после рождения. В то же время все органы подвержены высокому риску вторичных осложнений, включая НЭК, внутрибольничную инфекцию, церебральное повреждение, ретинопатию недоношенных и эндокринологический дисбаланс. Инфекция способствует развитию БЛД, соматических нарушений и нарушений развития [55].
Антибиотикотерапия направлена на борьбу с опасными для жизни пре- или послеродовыми инфекциями, вызванными патогенной микробиотой, но она не может уменьшить или предотвратить сопутствующее воспалительное поражение органов.На данный момент доступно большинство патомеханических данных о воспалительном поражении незрелого легкого, а эффективные терапевтические вмешательства ограничиваются очень ограниченным количеством лекарств. Причина до сих пор безуспешного создания эффективных терапевтических вмешательств основана на сложности задействованных патомеханизмов. Сложное взаимодействие между различными центральными путями и стойкое искажение клеточного фенотипа после однократного повреждения создает дополнительные препятствия, которые необходимо преодолеть для достижения терапевтической эффективности [56-59].Следующие разделы посвящены подробному описанию некоторых из наиболее серьезных заболеваний, вызываемых микробным дисбиозом. Они суммируют фактический статус терапевтических вмешательств с доказанной эффективностью. Особое внимание уделяется влиянию нарушенного эндогенного микробиома кишечника (рис. 2).
5. Микробиота дыхательных путей и бронхолегочная дисплазия
Бронхолегочная дисплазия (БЛД) — хроническое заболевание легких недоношенных детей, приводящее к пожизненному ограничению функции легких [59].На патофизиологическом уровне БЛД характеризуется искаженным альвеолярным и сосудистым ростом на мешковидной стадии развития легких. Центральное место в патогенезе занимает воспалительная реакция легких после рождения, которая в основном провоцируется пре- и послеродовыми инфекциями, а также жизненно необходимыми методами искусственной вентиляции легких и подачи кислорода [58]. В то время как хориоамнионит и особые патогены, такие как виды бактерий, происходящие из уреаплазмы, общепризнанно вносят свой вклад в заболевание в испытаниях на животных и когортных исследованиях недоношенных детей, влияние микробной колонизации дыхательных путей внутриутробно, и после рождения, до недавнего времени игнорировалось [60–60]. 63].Это удивительно, учитывая огромное влияние микробиома на другие легочные заболевания и иммунитет легких, включая астму, пневмонию, муковисцидоз, ХОБЛ и даже легочный фиброз. Дыхательные пути недоношенного ребенка при рождении не стерильны, и на его микробиом сильно влияет микробиом околоплодных вод. Различия в колонизации и клинических параметрах позволяют разделить на группы болезней, которые позволяют прогнозировать клиническое течение и исход [64].Снижение микробного разнообразия при рождении, исходное обилие видов уреаплазм в трахеальном аспирате недоношенных новорожденных, находящихся на ИВЛ, и более выраженные изменения в продольном микробном сообществе связаны с более высокой степенью тяжести БЛД. Связь преобладания Proteobacteria и уменьшения количества видов Lactobacillus в дыхательных путях младенцев с тяжелой формой БЛД была повторена в модели на мышах, оказав существенное влияние на регуляцию центральных сигнальных путей легких [65–68].Хорошо принятое дополнительное измерение, возникающее из-за взаимодействия микробиоты кишечника с легкими при других легочных заболеваниях, называемых осью кишечник-легкие, необходимо установить для ПРЛ.
6. Значительное влияние микробиоты на некротический энтероколит
В отличие от БЛД, важный вклад бактерий в патогенез некротического энтероколита, который представляет собой одно из самых разрушительных заболеваний недоношенных, хорошо известен. НЭК считается многофакторным заболеванием.Воспалительная реакция кишечника на микроорганизмы является центральной гипотезой патогенеза некротического энтероколита [69, 70]. Большие положительные преимущества грудного молока объясняются разнообразием микробиоты и формированием иммунологических свойств [71]. Напротив, терапия антибиотиками вызывает микробный дисбиоз и увеличивает риск некротического энтероколита [72]. Исходя из этих результатов, преимущества профилактического применения пробиотических штаммов Bifidobacteria, Lactobacillus и Saccharomyces были протестированы в различных экспериментальных и клинических условиях.Несмотря на неоднородность результатов и необходимость крупномасштабных метаанализов, в самых последних обзорах четко установлено, что пробиотики позволяют почти вдвое снизить риск некротического энтероколита и снизить частоту внутрибольничных инфекций и смерти [73, 74].
Постнатально кишечник колонизируется грамположительными и грамотрицательными бактериями, в основном с факультативным или строго анаэробным метаболизмом. У доношенного ребенка в кишечнике преобладают Bifidobacteriales и Bacteroides .У недоношенного ребенка было описано наличие большого количества различных родов, включая Anaerococcus, Aquabacterium, Bacillus, Bifidobacterium, Corynebacterium, Micrococcus, Oceanobacillus, Propionibacterium, Pseudomonas, Rothia, Sarcina, Snetococcuathia, и . Как правило, в кишечном микробиоме недоношенных детей преобладают протеобактерии, даже когда обеспечивается обеспечение грудным молоком, а появление видов Clostridium и Vellonella задерживается [53, 75–78].На микробиом сильно влияет пре- и послеродовая антибактериальная терапия [79]. В этом контексте пробиотическая терапия направлена на создание и поддержание физиологических структур микробиоты кишечника.
Сильное преобладание грамотрицательных бактерий и уменьшение количества анаэробных бактерий описано до появления клинических симптомов некротического энтероколита, но остается открытым вопрос, предрасполагают ли измененные микробные структуры к некротическому энтероколиту или являются следствием желудочно-кишечной или иммунологической незрелости.Расхождения в структуре микробиома между фекалиями и образцами, взятыми из полости рта или желудка, а также влияние микробного дисбиоза верхних отделов желудочно-кишечного тракта требуют дальнейшего уточнения. Наличие грамотрицательных бактерий и стафилококков позволяет сделать вывод об их приобретении из среды интенсивной терапии интенсивной терапии [80]. Микробную колонизацию можно разделить на перипартальное приобретение, как описано, например, для Escherichia coli и Candida albicans и приобретенных в больнице микробных структур, включая Klebsiella , Enterobacter, и Acinetobacter видов и Candida видов. Candida albicans [81].Взятые вместе, исследования кишечного микробиома выявили снижение бактериального разнообразия и сдвиг микробиоты от Bacteroidetes и Firmicutes к Proteobacteria и потенциально патогенным видам, включая Staphylococcus aureus, Escherichia coli, Shigella spp. , Citrobacter spp. И Klebsiella spp. до появления клинических симптомов некротического энтероколита [78, 82–85].
7. Микробный дисбиоз и риск нозокомиальной инфекции
Нозокомиальные инфекции представляют особый риск для недоношенных детей.Из-за незрелости и иммунологической несостоятельности иммунной системы недоношенные дети особенно уязвимы для внутрибольничных инфекций во враждебной среде отделения интенсивной терапии новорожденных [30, 31, 86–90]. Более того, антенатальная терапия стероидами и магнием, а также недоношенный для гестационного возраста статус и дородовое курение, по-видимому, еще больше влияют и снижают способность иммунологического ответа [91–94]. Следовательно, колонизация и созревание микробиоты кожи и кишечника являются важными предпосылками для предотвращения чрезмерного роста патогенов и внутрибольничных инфекций.В коже здоровых доношенных и недоношенных детей преобладают Firmicutes, Actinobacteria, Proteobacteria и Bacteroidetes, которые подвергаются внутрибольничной инфекции [95, 96]. Физиологическое преобладание бифидобактерий в структурах микробиоты кишечника может служить фактором защиты от транслокации эпителия кишечника. Различия в микробиоте кишечника недоношенных и доношенных детей в начале сепсиса используются в качестве объяснения уязвимости недоношенных детей и важной роли микробиома кишечника в инициации заболевания.Соответствие микробиоты, выделенной из кишечника младенцев, сепсису и бактериям, идентифицированным в положительных культурах крови, подтверждает это предположение [97–99]. Фактическое понимание патомеханики предполагает следующую последовательность: недоношенный ребенок подвергается воздействию враждебной среды отделения интенсивной терапии новорожденных, и микробиота кишечника после рождения демонстрирует большое несоответствие. Единый микробиом устанавливается в течение первых недель жизни с преобладанием высокопатогенных бактерий, включая Staphylococcus, Enterococcus, и несколько Enterobacteriaceae, в то время как бифидобактерии выявляются редко.Снижение микробного разнообразия с преобладанием стафилококков снова является еще одним фактором, предрасполагающим к позднему началу инфекции [100]. Неудивительно, что пре- или послеродовая антибиотикотерапия снижает микробное разнообразие и препятствует формированию физиологической микробиоты кишечника с переходом от Firmicutes и Bacteroidetes к Proteobacteria и Actinobacteria [85, 101–103].
В совокупности микробиом кишечника недоношенного ребенка сильно зависит от эндогенных факторов и факторов окружающей среды, а также от материнских и послеродовых терапевтических вмешательств, что объясняет высокую восприимчивость к внутрибольничной инфекции (рис. 3).
8. Ось кишечник-мозг у недоношенных
Развитие и функции мозга претерпевают фундаментальные этапы в последнем триместре и на первом году жизни. Физиологические этапы свертывания мозга и этапы развития мозгового коннектома намного превосходят увеличение объема мозга и сильно влияют на функциональность. Их функциональное значение может быть получено у недоношенных детей с серьезными ограничениями функций мозга, у которых обнаруживаются огромные изменения на этих критических этапах [104, 105].Все больше и больше данных исследований на животных и людях подтверждают вывод о том, что микробиом кишечника, особенно на ранних постнатальных стадиях, оказывает огромное влияние на поведенческие реакции и реакции на стресс в более позднем возрасте [106–110]. Термин ось кишечник-мозг обобщает не только многочисленные и сложные функции головного мозга, но и эндокринный гомеостаз, симпатико-парасимпатическую и даже кишечную нервную систему. К неврологическим расстройствам относятся такие заболевания, как расстройства аутистического спектра, депрессия и тревожность, которые часто наблюдаются у недоношенных новорожденных и ограничивают качество их жизни за пределами интеллекта, крупной и мелкой моторики [111, 112].Даже стойкие гормональные нарушения у недоношенных детей становятся предметом исследований [113]. Подчеркивая функциональную значимость оси кишечник-мозг для исхода нервного развития после недоношенности, более высокая и сохраняющаяся распространенность бифидобактерий в микробиоме кишечника связана с улучшением показателей умственного развития через 24 месяца [114]. Убедительные данные на животных демонстрируют далеко идущее влияние пре- и постнатальных изменений микробиоты на развитие мозга и различные функциональные области, которые были воспроизведены в первых ассоциативных исследованиях у детей [115–117].Ось кишечник-мозг не односторонняя, но кишечник и мозг воздействуют друг на друга двунаправленно, что может привести к умножению величины эффекта [118–120]. Это особенно верно, поскольку недоношенный ребенок подвергается высоким уровням стресса и повторяющимся болезненным процедурам [121]. В будущих исследованиях необходимо будет выяснить, как микробиота модулирует развитие мозга и функционирует физиологически по сравнению с недоношенными, как эти события в раннем возрасте приводят к стойким психомоторным последствиям и являются ли клетки микроглии единственными мишенями в центральной нервной системе [122]. Наоборот, , еще предстоит определить, как нарушение функции мозга влияет на физиологические структуры микробиоты.
9. Грудное молоко и не только для формирования физиологической структуры микробиоты
Грудное молоко — это оптимальное питание для недоношенных детей с точки зрения острого и долгосрочного здоровья, соматического роста и психомоторного развития. Из исследований здорового новорожденного четко установлено, что микробиом младенца в решающей степени определяется и формируется микробиотой, противовоспалительными и антиоксидантными свойствами, факторами роста, гормонально активными веществами и цитокинами, обеспечиваемыми грудным молоком.В целом, грудное молоко способствует формированию и обогащению физиологической микробиоты кишечника [69]. Материнские микробы, выделяемые из молочной железы, контакт с кожей груди и питательные компоненты грудного молока способствуют созреванию иммунных функций и созданию стабильного физиологического богатого и разнообразного микробиома с преобладанием бифидобактерий и Lactobacillu s видов, но также присутствие видов из родов Staphylococcus, Streptococcus, Propionibacterium, Bacteroides, Rothia, Enterococcusi, и Pseudomonas [99, 123–129].Но также в грудном молоке были обнаружены строго анаэробные кишечные комменсалы Clostridiaceae, включая Blautia, Clostridium, Collinsella и Veillonella, вместе с Coprococcus , Faecalibacterium, и Roseburia видов, которые были одновременно изолированы от груди матерей. молоко и стул. Это позволяет сделать вывод, что помимо оси кожа-кишечник существует ось микробиома кишечника-груди матери и что микробиом кишечника младенца формируется микробиомом кишечника матери [128, 130, 131].Состав микробиоты кишечника после преждевременных родов отличается от такового у матерей, родивших в срок, с изменением вида с Bifidobacterium на Enterococcus . На нее влияет перинатальная антибактериальная терапия матери с уменьшением количества видов Lactobacillus, , Bifidobacterium, Staphylococcus, и Eubacterium [132]. Младенцы, вскармливаемые смесью, демонстрируют дальнейшее снижение микробного разнообразия и преобладание Enterobacteriaceae, Coriobacteriaceae и Bacteroides [95, 126].У недоношенных детей с высоким риском микробного дисбактериоза кишечника пробиотическая терапия с использованием бактериальных комменсалов, выявленных в ранее упомянутых исследованиях, оказалась в целом эффективной для снижения частоты некротического энтероколита, сепсиса и смерти. Однако оптимальный штамм или формула и продолжительность применения ждут дальнейшего изучения [73, 74]. Лактоферрин, белок семейства трансферринов с широким антимикробным действием, символизирует стремительный рост знаний о функциях грудного молока, формирующих микробиоту кишечника.Его рекомбинантное применение не только снижает риск инфекций, связанных с устройством, но и изменяет фекальный микробиом в сторону физиологической ситуации [133]. В отличие от этих медицинских терапевтических вмешательств, уход кожа к коже — это простой в применении клинический метод формирования микробиома младенца. Его постоянное содержание формирует микробиом полости рта недоношенного ребенка и помогает ускорить его созревание [134].
Имеющиеся данные убедительно подтверждают гипотезу о том, что пре- и постнатальный микробиом способствует преждевременным родам и острым последствиям у недоношенных детей.Несмотря на огромный научный прогресс, мы лишь прикоснулись к поверхности, чтобы понять последствия аберрантной микробиоты и их динамические изменения в возникновении и прогрессировании заболевания. Текущие данные убедительно подчеркивают их влияние на внутрибольничную инфекцию и НЭК, которые не только представляют собой огромное бремя болезней для недоношенных детей, но, что более важно, влекут за собой пожизненные последствия и значительную летальность. Тем не менее, для большинства острых осложнений и краткосрочных последствий, включая легочные и церебральные проблемы, четкая причинная связь все еще отсутствует.Остается определить, является ли патогенная микробиота причиной искажения долгосрочного соматического и психомоторного развития у недоношенных детей, которые не страдали тяжелыми острыми осложнениями, такими как инфекция или кровоизлияние в мозг. Следовательно, срочно необходимы комплексные и долгосрочные исследовательские усилия, чтобы охватить эти важные и клинически очень важные аспекты. Комплексное и механистическое понимание связи между микробным дисбиозом и возникновением и прогрессированием заболевания поможет разработать новые терапевтические концепции, направленные на контроль и восстановление физиологических микробных структур.Следующими важными темами исследований являются получение подробных знаний о микробных структурах и способах предотвращения загрязнения образцов, а также обеспечение сопоставимости исследований в отношении методов и подготовки образцов [135]. Остается открытым вопрос, как наш образ жизни и генетический фон влияют на микробиом беременной женщины и частоту преждевременных родов.
Успешное внедрение послеродовой пробиотической терапии и дальнейшее клиническое руководство вселяет надежды на снижение бремени болезней матери и плода в ближайшем будущем и на создание целенаправленной или даже персонализированной медицины.Следующие шаги могут быть получены на основе наблюдательных исследований и должны включать (1) разработку методов на месте оказания медицинской помощи для определения микробных структур на месте и в режиме реального времени для немедленного выявления матери и ребенка из группы риска, (2) оценка преимуществ персонализированных медицинских стратегий трансплантации вагинальной жидкости или кала плоду и новорожденному, (3) разработка новых стратегий для обнаружения бактериальной инфекции с высокой точностью прогноза, чтобы избежать ненужной и продолжительной антибактериальной терапии и последующего микробного дисбиоза, и (4) для тестирования более эффективные альтернативы существующим классическим пробиотикам, включая смеси различных бактериальных штаммов и бактериальных метаболитов.Каждая из этих областей создает огромные проблемы и возможности для окончательного снижения показателей преждевременных родов и связанных с ними заболеваний. Открытие и достижение этих новых рубежей в перинатальной науке дает возможность приблизиться к эффективной профилактике преждевременных родов, которые создают все более серьезное глобальное бремя и проблемы.
Раскрытие информации
Бирте Штауде и Франк Оемке имеют первое авторство.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Вклад авторов
Бирте Штауде, Франк Оемке, Тина Лауэр и Харальд Эрхардт подготовили рукопись и разработали рисунки. Юдит Бенке, Вольфганг Гёпель, Михаэль Шлотер, Хольгер Шульц и Сюзанна Краусс-Эчманн внесли ценный интеллектуальный вклад и отредактировали и исправили рукопись. Все авторы прочитали и одобрили окончательную версию рукописи.
Благодарности
Авторы высоко оценивают реализацию макета рисунка компанией CE Marketing & PR Services, Германия.Эта работа была поддержана исследовательскими грантами Немецкого исследовательского фонда (KFO 309), von Behring Röntgen Stiftung (63-0009 и 65-0019) и конкурса Leibniz Competition 2016 «Микробиота легких как интерфейс между эпителием дыхательных путей и окружающей средой».
на разработку нового терапевтического средства с использованием аминокислот, пребиотиков, пробиотиков и постбиотиков
Магуайр, Миа и Магуайр, Грег. «Дисбиоз кишечника, повышенная проницаемость кишечника и пролиферация кишечного эпителия при неврологических расстройствах: к разработке нового терапевтического средства с использованием аминокислот, пребиотиков, пробиотиков и постбиотиков» Reviews in the Neurosciences , vol.30, нет. 2, 2019, с. 179-201. https://doi.org/10.1515/revneuro-2018-0024 Магуайр, М., Магуайр, Г. (2019). Дисбиоз кишечника, повышенная проницаемость кишечника и пролиферация кишечного эпителия при неврологических расстройствах: к разработке нового терапевтического средства с использованием аминокислот, пребиотиков, пробиотиков и постбиотиков. Обзоры в неврологии , 30 (2), 179-201. https://doi.org/10.1515/revneuro-2018-0024 Магуайр, М.и Maguire, G. (2019) Дисбиоз кишечника, повышенная проницаемость кишечника и пролиферация кишечного эпителия при неврологических расстройствах: к разработке нового терапевтического средства с использованием аминокислот, пребиотиков, пробиотиков и постбиотиков. Обзоры в неврологии, Vol. 30 (Выпуск 2), стр. 179-201. https://doi.org/10.1515/revneuro-2018-0024 Магуайр, Миа и Магуайр, Грег. «Дисбиоз кишечника, повышенная проницаемость кишечника и пролиферация кишечного эпителия при неврологических расстройствах: к разработке нового терапевтического средства с использованием аминокислот, пребиотиков, пробиотиков и постбиотиков» Reviews in the Neurosciences 30, no.2 (2019): 179-201. https://doi.org/10.1515/revneuro-2018-0024 Магуайр М., Магуайр Г. Дисбиоз кишечника, повышенная проницаемость кишечника и пролиферация кишечного эпителия при неврологических расстройствах: к разработке нового терапевтического средства с использованием аминокислот, пребиотиков, пробиотиков и постбиотиков. Обзоры в области неврологии . 2019; 30 (2): 179-201. https://doi.org/10.1515/revneuro-2018-0024Изменение баланса экосистемы «микробов внутри нас»: NPR
ТЕРРИ ГРОСС, ХОЗЯИН:
Это СВЕЖИЙ ВОЗДУХ.Я Терри Гросс. Вы можете думать, что знаете, кто вы, но на самом деле это не так, если вы не знаете, что в вас и внутри вас живут триллионы микробов. Они влияют на ваше пищеварение, иммунитет, массу тела и общее состояние здоровья. Ученые изучают, что делают эти микробы и как мы можем улучшить свое здоровье, манипулируя балансом этих микробов. Экосистема микробов внутри людей и животных является предметом новой книги писателя-исследователя Эда Йонга «Я вмещаю множество».Он пишет о науке для The Atlantic и ведет научный блог National Geographic под названием «Not Exactly Rocket Science».
Эд Йонг, добро пожаловать в FRESH AIR. Итак, как вы говорите, наше тело на самом деле представляет собой экосистему. Каковы различные сообщества микробов на нашем теле и внутри него?
ЭД ЙОНГ: Их всего десятки триллионов, но они различаются от одной части к другой, потому что, например, мое предплечье — довольно сухая среда. Здесь немного пересохло, как в пустыне, тогда как что-то вроде моего рта или носа — это жаркая и влажная среда, больше похожая на тропический лес.И в каждом из этих мест обитает совершенно разное сообщество микробов.
GROSS: И много этих бактерий — многие из этих микробов — хорошие парни, помогающие вашему телу делать то, что ему нужно. Но, как вы указываете, если одна из хороших бактерий попадает не в то место, она становится плохой.
ЙОНГ: Верно. У нас была давняя идея, что микробы — это микробы, враги, которых нам нужно уничтожить, чтобы они не уничтожили нас. Но на самом деле мы начинаем понимать, что многие из этих микробов чрезвычайно важны для нашей жизни.Но я хотел передать в книге, что на самом деле нет таких вещей, как хороший микроб или плохой микроб. Они просто живут с нами. Они наши партнеры по жизни и часто могут принести нам огромную пользу. Они могут помочь переваривать пищу, настраивать нашу иммунную систему и защищать нас от болезней. Но если они попадут не в то место или если наши отношения с ними разорвутся, они также могут причинить нам вред.
GROSS: Итак, когда мы говорим о микробах в микробиоме, очевидно, что мы говорим о бактериях.Что еще мы включаем в это?
ЙОНГ: Значит, большинство из них составляют бактерии, но есть еще одна группа микробов, называемая архей, которые выглядят очень похоже, но на самом деле очень, очень разные. Есть одноклеточные грибы. Есть протисты. Вирусов тоже огромное количество. Некоторые люди могут не думать о них как о части микробиома, но они тоже есть и имеют огромное влияние.
ГРОСС: Я хочу поговорить с вами о пробиотиках.Многие люди принимают пробиотики в надежде на здоровье кишечника. И среди ученых, которые на самом деле изучают микробиом, который микробы, живущие в кишечнике, на самом деле это довольно спорно выполнить ли пробиотики ничего. Итак, давайте начнем с того, что должны делать пробиотики?
ЙОНГ: Итак, пробиотики — это продукты, которые содержат полезные микробы, и к ним прилагаются всевозможные заявления о пользе для здоровья, но на самом деле, если вы посмотрите на доказательства, стоящие за этими продуктами, они, как правило, немного не впечатляют с медицинской точки зрения.Так что они хороши при некоторых типах инфекционной диареи, но не при большинстве других. И даже регулирующие органы в США и — и в Европе скептически относятся ко многим из этих заявлений о вреде для здоровья. И я думаю, это потому, что пробиотики обычно содержат небольшое количество микробов, гораздо меньше, чем уже существует в вашем теле.
Многие из этих видов выбраны по историческим причинам, потому что они просты в производстве и упаковке, а не потому, что они отлично закрепляются в кишечнике.И часто это очень промышленные, проприетарные сорта. Вы знаете, они входят, а затем исчезают или проходят. Они не имеют большого влияния. И все же идея пробиотиков, идея о том, что мы могли бы дать себе полезные бактерии, улучшающие наше здоровье, эта идея имеет большой потенциал, и она прочна.
Но мы все еще находимся на очень ранних стадиях разработки, как это сделать. Речь идет о разработке целой экосистемы. Некоторые говорят, что это так сложно, как, например, изменить коралловый риф или пастбище.Это — это создание мира.
GROSS: Итак, когда мы принимаем пробиотик, купленный в магазине, могут ли бактерии, содержащиеся в этом пробиотике, повторно заселиться в нашем кишечнике?
ЙОНГ: Нет, это не так. Как правило, им не удается закрепиться, и они не живут долго, поэтому они не очень хорошие колонизаторы.
ГРОСС: И это микробы, которые обычно живут в нашем кишечнике?
ЙОНГ: Это микробы, которые обитают в кишечнике.Но они не … они не знаменитости. Это не те, которые особенно распространены или особенно хороши для колонизации кишечника.
GROSS: А как насчет йогурта, в котором обычно есть активные культуры, пробиотические культуры?
ЙОНГ: То же самое. Исследования показали, что вы их проглатываете, и эти бактерии исчезают. Они — я думаю о них, как о ветерке, который дует между двумя открытыми окнами. Он может задеть пару предметов на своем пути, но это не окажет длительного воздействия.
ГРОСС: Ты меня угнетаешь.
(СМЕХ)
ЙОНГ: Мне очень жаль.
БРУТТО: ОК. Когда вы принимаете антибиотики, они убивают множество бактерий в вашем теле, в том числе те, которые вы бы предпочли иметь, и некоторые из тех бактерий, которые вы бы предпочли иметь в кишечнике. И я думаю, что это, по крайней мере, одна из причин, почему прием антибиотиков может привести к диарее, потому что они убивают некоторые бактерии, которые поддерживают баланс кишечника.И обычно это время, когда даже врачи, не особо верящие в пробиотики, по-прежнему рекомендуют их принимать. Итак, что сейчас распространено среди ученых, которые на самом деле изучают этот вопрос, о ценности приема пробиотиков в качестве противоядия от антибиотиков?
ЙОНГ: Итак, некоторые типы диареи, связанной с антибиотиками, связаны с этой очень неприятной сорной бактерией под названием Clostridium difficile или C. diff, которая очень хороша при вторжении в кишечник, который неоднократно подвергался воздействию антибиотиков, и может вызывать повторяющиеся трудноизлечимые случаи понос.И на самом деле одно из лучших средств лечения C. diff — ох, и на самом деле, одно из самых успешных методов лечения на основе микробиома, которое у нас есть, — это трансплантация фекалий. Пересадка кала — это почти то, на что это похоже. Вы пытаетесь взять стул у здорового донора и имплантировать его в кишечник больному человеку. И вы делаете это почти как способ перезагрузки их внутренней экосистемы, замены сообщества, которое колеблется, подобно тому, как вы пытаетесь заново заделать газон, заросший одуванчиками или другими сорняками.
ГРОСС: И как это сейчас делается? Это было на экспериментальных стадиях, но я думаю, что они как бы совершенствуют способы сделать это, не будучи — без того, чтобы это было так грубо, как кажется.
ЙОНГ: Традиционный способ — использовать настоящий стул, и его можно доставить либо вверх по заднице, либо через нос через зонд. И, знаете ли, к этому действительно привязан этот особый фактор. Но он также чрезвычайно эффективен при лечении инфекций Clostridium difficile — C. diff — этой очень инвазивной сорной бактерии, которая может вызывать повторяющуюся тяжелую диарею.В одном теперь уже классическом исследовании около 20–27 процентов людей, принимавших обычные антибиотики, были излечены от инфекций C. diff, тогда как у тех, кто получил трансплантацию фекалий, около 94 процентов из них были излечены. Итак, мы находимся в странном положении, когда лечение C. diff номер один — это номер два. И …
ГРОСС: (Смех).
ЙОНГ: … Пересадка фекалий — уже — творила чудеса с этим конкретным заболеванием. Работает ли это при других заболеваниях — так в — так после успехов с C.diff, ученые и врачи пробовали трансплантацию фекалий при большом количестве других состояний, которые были связаны с микробиомами, таких как воспалительное заболевание кишечника или синдром раздраженного кишечника.
И там результаты меньше — конечно, менее успешные, менее стабильные. И это, вероятно, потому, что эти типы болезней — те экосистемы внутри нас — сложнее сбросить. Итак, другие … другие исследователи сейчас пытаются взять концепцию фекальной трансплантации и усовершенствовать ее, чтобы удалить бактерии и другие микробы, которые приносят пользу реципиентам, не беспокоясь о грубых фекальных частицах.
Итак, несколько компаний разработали таблетки, которые — вы можете думать о них как о сокращенном стуле или о пробиотиках, не так ли? Таким образом, они представляют собой сообщества микробов, которые должны воспроизводить многие преимущества стула.
Но недавно один из главных претендентов на эти поддельные таблетки фекалий отказался от участия в крупном клиническом испытании, которое, я думаю, подчеркивает, как мало мы знаем о том, почему эта старая процедура действительно работает и как рано мы находимся в процессе фактически манипулируя нашим микробиомом, чтобы улучшить наше здоровье.
GROSS: Вы сказали, что это старая процедура?
ЕНГ: Да. Ну, это сначала началось — я думаю, первые записи были из Китая несколько веков назад. И люди как бы открывали это снова и снова. И он стал — я не буду говорить, популярным — но определенно более заметным за последние 10, может быть, даже пять лет или около того.
GROSS: Так почему же трансплантация фекалий может быть более эффективной, чем таблетка с пробиотиками?
ЙОНГ: Итак, вы используете гораздо более широкое сообщество микробов.И вы даете их в большом количестве. И вы в любом случае используете те, которые естественным образом присутствуют в кишечнике. Так что это гораздо более реалистичное сообщество, которое можно внедрить в человека. Но вы знаете, что настоящего ответа на этот вопрос мы до сих пор не знаем.
Мы действительно не знаем, какие компоненты стула — какие члены этого сообщества — действительно работают, как они могут взаимодействовать с местными микробами в кишечнике реципиента или с самим кишечником, с иммунной системой хозяина.
Осталось еще так много вопросов, на которые нам нужно ответить. Все, что мы знаем, это то, что для этого конкретного состояния, инфекций C. diff, это кажется очень и очень хорошим лечением с несколькими известными побочными эффектами, если таковые имеются. И это очень дешево.
GROSS: Если вы только присоединяетесь к нам, мой гость — научный писатель Эд Йонг. Его новая книга называется «Я содержу множество: микробы внутри нас и более широкий взгляд на жизнь». Сделаем небольшой перерыв. А потом поговорим еще.Это СВЕЖИЙ ВОЗДУХ.
(ЗВУК МУЗЫКИ)
GROSS: Это СВЕЖИЙ ВОЗДУХ. И если вы только присоединяетесь к нам, мой гость — научный писатель Эд Йонг. Его новая книга называется «Я содержу множество: микробы внутри нас и более широкий взгляд на жизнь». Он также пишет о науке для The Atlantic и ведет научный блог для National Geographic под названием «Not Exactly Rocket Science».
Микробы могут способствовать развитию нашей иммунной системы. И вы описываете, как микробы могут вызвать воспаление.И микробы тоже могут подавить воспаление. Можете ли вы дать нам представление о взаимодействии между этими двумя наборами микробов и о том, как они регулируют нашу иммунную систему в лучшую или в худшую сторону?
ЙОНГ: Верно. Поэтому мы обычно думаем об иммунной системе как об этой милитаристской силе, которая защищает нас от микробов в окружающем нас мире. И все же мы видим, что определенные типы микробов помогают строить части иммунной системы. А потом еще и калибруют.
Таким образом, они устанавливают баланс между реакцией — между защитой себя от инфекций — но также и не чрезмерной реакцией.Так что они помогают — некоторые виды помогают не дать иммунной системе сойти с ума от безобидных вещей в нашей окружающей среде, таких как пыльца или пыль, которые могут вызвать аллергию.
И этот баланс между воспалением и противовоспалительным действием очень сильно зависит от наших микробов. Они устанавливают этот переломный момент, так же как термостат в моем доме может контролировать температуру в комнате и поддерживать ее на стабильном уровне.
GROSS: Это взаимодействие между микробами, подавляющими воспаление, и микробами, вызывающими его, изучается на мышах, свободных от микробов, на мышах, у которых должна быть контролируемая среда, потому что они свободны от микробов.Как создать мышь без микробов?
ЙОНГ: Вы поднимаете их в стерильных изоляторах, в этих пластиковых пузырях, которые полностью отделены от мира микробов. Внутри них живут только мыши. У них стерильная пища, стерильная вода. Все, что помещается внутрь, стерилизуется перед подключением к этим камерам.
И я думаю, что это делает этих мышей одними из самых странных животных на планете. Я посетил один из предприятий, который их выращивает. И я держал одного не голыми руками, а этой черной резиновой перчаткой, которая выступает в их пластиковый пузырь.И это животное, в отличие от всего остального — в отличие от вас, меня, слона или чего-то еще — не имеет микробов.
Это как силуэт, который еще не закрашен. И из-за этого у него много проблем. У него другое — у него проблемы с костями, кровеносными сосудами, кишечником, его поведением. Я думаю, это свидетельствует о том, насколько важны микробы для формирования и формирования нашего тела и насколько много может пойти не так, если мы проживем свою жизнь в их отсутствие.
GROSS: Итак, какие эксперименты по иммунитету и воспалению проводятся на этих стерильных мышах?
ЙОНГ: Так, например, вы можете дать им определенные микробы и посмотреть, какие типы иммунных клеток выходят на первый план, например, какие — видите ли вы воспалительную или противовоспалительную реакцию.И мы можем видеть, что определенные микробы могут фактически подавлять воспаление, что является странной концепцией, потому что я думаю, что мы думаем о микробах как о чужеродных, как о других, как о вещах, запускающих информацию. Принимая во внимание, что с помощью экспериментов на грызунах мы видим, что некоторые виды, которые живут с нами, на самом деле способны тушить воспалительные пожары, поэтому они способны успокаивать иммунную систему и говорить, что я пришел с миром.
GROSS: Каковы последствия этого для аутоиммунных заболеваний, заболеваний, при которых организм атакует здоровые клетки тела?
ЙОНГ: Итак, появляется все больше доказательств того, что раннее воздействие широкого спектра микробов важно для тщательного построения и калибровки нашей иммунной системы, чтобы установить баланс между иммунными реакциями и не сходить с ума от вещей в мире вокруг нас.И, возможно, избегая контакта с микробами, живя в городской среде или слишком очищая наш мир, мы разрываем наш контакт со всеми этими старыми друзьями, на которых мы полагаемся, чтобы настроить наш иммунитет, оставляя нас плохо подготовленными к работе. со всеми проблемами внешнего мира, чтобы справиться со всеми вещами, которые могут затем вызвать иммунный ответ.
GROSS: То, о чем вы тоже говорите, это теория, согласно которой, когда рождаются дети — когда дети рождаются и проходят через вагинальный канал, они подвергаются воздействию целого набора микробов, которые необходимы ребенку для развития здоровый микробиом и дети, рожденные через кесарево сечение, не подвергаются воздействию одних и тех же микробов.Не могли бы вы немного рассказать об этом и каковы последние мысли по этому поводу?
ЙОНГ: Конечно. Таким образом, матка — это стерильная среда, и мы — и младенцы впервые сталкиваемся с микробами, когда они проходят через вагинальный канал во время родов, и они задают тон всем другим микробам, которые затем колонизируют ребенка. Если вы родились через кесарево сечение, вы столкнетесь с другим набором микробов, которые могут появиться, скажем, из кожи или окружающей среды в больнице. Итак, мы видим разные сообщества в младенцах, рожденных от разных корней.
Что это значит для будущего здоровья ребенка, все еще очень неясно. Из исследований на взрослых мы видим, что люди, родившиеся через кесарево сечение или нормальные вагинальные корни, на самом деле не имеют совершенно разных сообществ микробов на своем теле. Таким образом, кажется, что в конечном итоге многие из этих различий исчезнут сами собой. Но могут ли эти временные различия повлиять на наше здоровье, изменят ли они способ развития нашего тела в очень важный момент нашей жизни, остается открытым вопросом.Мы пока не знаем ответов на этот вопрос.
ГРОСС: Что ж, я рад, что дети с кесаревым сечением, кажется, догоняют его, потому что многим женщинам нужно делать кесарево сечение, и мне не хотелось бы думать, что они должны чувствовать себя виноватыми из-за того, что их дети не в результате будет иметь здоровый микробиом.
ЙОНГ: Верно. Я не хочу ничего демонизировать, и я не думаю, что наука о микробиоме находится в этом … находится в достаточно зрелом состоянии, чтобы заставить людей беспокоиться или чувствовать себя виноватыми из-за своего выбора здоровья или своих жизненных решений.И полезно думать о теле как об этих огромных экосистемах. Знаете, если вы измените джунгли или пастбища, вы знаете, что простыми средствами это не сойдет с курса.
Часто вам нужно несколько раз избавиться от этих вещей от множества стрессов, скажем, от загрязнения, пожара или чего-то еще, прежде чем они исчезнут — они перейдут в необратимое новое состояние. Итак, экосистемы устойчивы. Они могут поглотить много изменений, и то же самое верно и для микробиома. Если вы пропустите его, скажем, антибиотиками, если вы измените его, скажем, с помощью кесарева сечения.Он будет двигаться. Он будет меняться, но часто приходит в норму. И главный вопрос, знаете ли, какие изменения вам нужны, чтобы действительно это изменить? И имеют ли эти небольшие изменения значение в краткосрочной перспективе? И я думаю, что мы не знаем.
ГРОСС: Мой гость — Эд Йонг, автор новой книги «Я сдерживаю множество» о триллионах микробов, которые живут в нас и на нас. После небольшого перерыва мы поговорим о микробах в грудном молоке и о том, как бактерии используются для предотвращения болезней, передаваемых комарами, таких как вирус Зика и лихорадка денге.А когда Олимпиада близится к завершению, у Майло Майлза есть рецензия на альбом бразильского ансамбля босанова. Я Терри Гросс, и это FRESH AIR.
(ЗВУК МУЗЫКИ)
GROSS: Это СВЕЖИЙ ВОЗДУХ. Я Терри Гросс с Эдом Йонгом, автором новой книги «Я содержу множество: микробы внутри нас и более широкий взгляд на жизнь». Речь идет о триллионах микробов, которые живут внутри и на людях и животных, и о том, как эта экосистема влияет на наше пищеварение, иммунитет и общее состояние здоровья.Когда мы закончили, мы говорили о том, как на эту экосистему влияют микробы, которым вы подвергались в младенчестве. Например, ученые изучают, как младенцы колонизируются бактериями во время родов, когда младенцы проходят через вагинальный канал.
Я думаю, что ученые также исследуют разницу между грудным вскармливанием и кормлением из бутылочки, когда речь идет о развитии здорового микробиома у младенца. Каковы некоторые различия между бактериальным составом или составом микробов — микробным составом грудного молока — грудным молоком человека — и коровьим молоком?
ЙОНГ: Итак, грудное молоко кажется очень простым способом вскармливания ребенка.Но на самом деле около 10 процентов грудного молока состоит из этих сахаров, этих сложных сахаров, которые младенцы вообще не могут переваривать. И они нужны для того, чтобы питать микробы в кишечнике ребенка. Существуют специфические штаммы, в том числе один под названием …
ГРОСС: Я остановлю вас здесь, поэтому часть грудного молока предназначена для кормления микробов (смех).
ЙОНГ: Верно, да.
GROSS: Это довольно интересно.
ЙОНГ: Это потрясающе, не правда ли? Думаю, именно поэтому я люблю науку о микробиоме, потому что она берет очень знакомые вещи, такие как кормление грудью, и представляет их в совершенно ином свете.Таким образом, грудное молоко — это не просто способ питания младенца. Это способ вскармливания первых микробов младенцев. Это действительно способ создания целого мира внутри тела ребенка. Вы знаете, кормящая мама — скульптор экосистем.
GROSS: А в коровьем молоке этого нет?
ЙОНГ: Грудное молоко, по причинам, которые до сих пор не ясны, кажется, содержит гораздо более широкий спектр этих сахаров, чем молоко любого другого млекопитающего. Существуют очень специфические штаммы микробов, в том числе штамм B infantis, которые эволюционировали, чтобы переваривать эти сахара с большой эффективностью.Таким образом, в кишечнике младенцев, находящихся на грудном вскармливании, эти микробы, как правило, преобладают.
И у них тоже есть преимущества для ребенка. В ответ они кормят клетки кишечника ребенка. Они помогают герметизировать слизистую оболочку кишечника и уменьшают воспаление. Так что у них есть огромные преимущества. И, подпитывая эти микробы, матери помогают своим детям.
GROSS: Я хочу вернуться к разговору о мышах, свободных от микробов, и об использовании мышей, которые живут в пузырьках, свободных от микробов, чтобы ученые могли экспериментировать с ними, подвергая их воздействию определенных микробов, чтобы увидеть, какова будет реакция.Одна из вещей, которые ученые изучают на этом виде стерильных мышей, — это ожирение и масса тела. Не могли бы вы дать нам представление о том, какие эксперименты проводятся в отношении массы тела с этими стерильными мышами?
ЙОНГ: Конечно. Итак, около 10 лет назад в очень классических экспериментах ученые взяли микробы от тучных и худых людей и поместили их в стерильных мышей. Таким образом, мыши, получившие оценку сообщества с ожирением, прибавили в весе больше, чем их коллеги, получившие оценку мышечной массы.И это было плодотворным открытием. Это действительно показало, что, возможно, эти микробы не просто, знаете ли, отправляются в путь. Может быть, они действительно хватаются за руль время от времени. Может быть, они серьезно влияют на наш вес, на то, как мы распоряжаемся энергией в пище.
Дело в том, что связь между ожирением и микробиомом на самом деле очень сложна. И даже несмотря на 10 лет исследований, мы все еще многого не знаем. Итак, люди обнаружили различия в микробных сообществах между толстыми и худыми людьми.Таким образом, вы получаете разные виды, которые выходят на первый план в разных группах. Но между исследованиями нет устойчивых различий. Так что все еще очень сложно сказать, как, скажем, цитировать, не цитировать, «тучный микробиом», не говоря уже о том, как вы могли бы манипулировать им.
И одно критическое исследование, которое было проведено снова с этими мышами, свободными от микробов, показало, что если вы возьмете микробы у худощавого человека и поместите их в грызуна, который набрал слишком много веса, то этот грызун похудеет, но только если он также придерживается традиционно здоровой диеты, богатой растениями и клетчаткой.И я думаю, это показывает, что микробиом может сильно влиять на нашу жизнь, но не дает легких решений для проблем со здоровьем. Когда около 10 лет назад появилась первая волна исследований, заголовки пестрели такими вещами, как, знаете ли, микробы виноваты в вашем весе или, может быть, мы сможем принять какой-нибудь пробиотик, который немедленно заставит нас похудеть. И я думаю, что это далеко не так просто.
Микробиом — не панацея от наших проблем со здоровьем. Это не объясняет их всех целиком.Я думаю, это просто показывает, насколько важны микробы в нашей жизни и какое сильное влияние они оказывают.
GROSS: Вот почему кто-то — я забыл, кто это — вручает награду, которая называется Overselling the Microbiome Award (смех).
ЙОНГ: (Смех) Верно, да. Его зовут Джонатан Эйзен. Он замечательный микробиолог. Он настоящий чемпион, проповедник микробов. Но он также очень скептичен, и я думаю, что есть веские основания для многих утверждений, связанных с микробиомом.Это одно из самых модных направлений, самых горячих направлений современной биологии. А микробиом связан со всевозможными проблемами со здоровьем.
Но многие из этих исследований все еще коррелятивны. Мы до сих пор не знаем, приводят ли микробы к заболеваниям, являются ли они их следствием, и то и другое вместе или ни то, ни другое. И мы все еще находимся на очень ранней стадии понимания нашего партнерства с микробами, которые разделяют нашу жизнь. Мы знаем, что они важны. Но насколько они важны? Каким образом и как мы можем на них повлиять?
GROSS: Итак, когда дело доходит до исследования микробиома, кажется, что мы все еще в зачаточном состоянии.Мы знаем достаточно, чтобы понимать, что это действительно многообещающая область. Мы можем много узнать о продуктах, которые нужно есть, а не есть, о вещах, которым нужно подвергать себя и не подвергать себя опасности. Возможно, мы найдем новые лекарства от аутоиммунных заболеваний. Но сейчас кажется, что он все еще находится на стадии становления, очень экспериментальный.
ЁНГ: Да, очень. Мы знаем о микробах более 350 лет. Но наука о человеческом микробиоме действительно начала развиваться только в последнее десятилетие или около того. И мы так многого не знаем.У нас до сих пор нет полного каталога видов, обитающих внутри нас. Мы до сих пор не совсем понимаем, чем мой микробиом отличается от вашего. Чем объясняются эти различия между людьми — не говоря уже о том, как выглядит хороший микробиом или как вы можете добраться до этой стадии.
Но я думаю, что потенциал здесь огромен, потому что микробиом теоретически очень гибкий. Мы должны суметь это изменить. Мы просто еще не совсем знаем, как это сделать. И, возможно, одной из более быстрых побед науки о микробиоме могло бы стать использование микробиома в качестве своего рода диагностического инструмента, чтобы посмотреть на него и сказать, что у вас с большей вероятностью разовьется — это заболевание или это расстройство, — или использовать его, чтобы повлиять на наше лечение.Итак, мы знаем, что микробы внутри нас влияют на то, насколько хорошо лекарства работают в нашем организме. Мы знаем, что множество различных лекарств, от новейших новейших препаратов для иммунотерапии рака до очевидных вещей, таких как парацетамол, могут работать у одних людей, но не у других, из-за того, какие микробы они переносят.
И, возможно, мы также сможем найти способы воздействия на микробиом без необходимости добавлять или вычитать штаммы. Итак, есть одна группа, которая много работает с сердечными заболеваниями. И мы даем — если у вас высокий риск сердечных заболеваний, ваш врач может прописать вам статин, который является лекарством, предназначенным для воздействия на ферменты, участвующие в метаболизме холестерина, которые вырабатываются вашим собственным организмом.Но бактерии также могут влиять на то, как вы справляетесь с холестерином, и тем самым повышают риск сердечных заболеваний. А теперь некоторая — одна группа ученых разработала молекулу, которая может остановить эти бактерии от повышения уровня холестерина. Так что, возможно, в будущем вы можете получить от своего врача комбинацию из двух лекарств: статина для лечения вашей человеческой половины и другого химического вещества, которое повлияет на микробную половину.
GROSS: Если вы только присоединяетесь к нам, мой гость — научный писатель Эд Йонг.Его новая книга называется «Я содержу множество: микробы внутри нас и более широкий взгляд на жизнь». Сделаем небольшой перерыв. Потом поговорим еще. Это СВЕЖИЙ ВОЗДУХ.
(ЗВУК МУЗЫКИ)
GROSS: Это FRESH AIR, и если вы только присоединяетесь к нам, мой гость — научный писатель Эд Йонг. Его новая книга называется «Я содержу множество: микробы внутри нас и более широкий взгляд на жизнь». Он также пишет о науке для The Atlantic и ведет научный блог для National Geographic под названием «Not Exactly Rocket Science».«Не у всех есть любимый микроб, но у вас есть (смех).
ЙОНГ: Да.
GROSS: Расскажите, что это такое.
ЕНГ: Я знаю. Он называется Wolbachia. Он был обнаружен в 1924 году и был обнаружен внутри обычного коричневого комара двумя учеными, Хертигом и Вольбахом. И в течение десятилетий никто не знал, что это делает, насколько это распространено, насколько это важно. Этим по большей части пренебрегали. А потом ученые поняли, что на самом деле это невероятно распространено. Он не встречается у людей, но встречается примерно у 4 из 10 видов насекомых и других членистоногих, которые сами по себе являются самыми многочисленными и самыми разнообразными животными на планете.
Итак, Wolbachia необычайно успешна и делает множество невероятных вещей. Таким образом, у некоторых хозяев это паразит, который имеет значение для мужчин, потому что Wolbachia передается только от матери к дочерям, и поэтому самцы являются для нее полным тупиком. У некоторых — у некоторых видов, например мокрицы, превращает самцов в самок. В других случаях он убивает самцов, так что самок в 100 раз больше, чем самок.
А у некоторых ос Wolbachia позволяет им воспроизводиться путем клонирования самих себя, поэтому они совершенно не нуждаются в самцах.Но в некоторых случаях эта штука тоже союзник. Это мутуалист. Это позволяет некоторым гусеницам, которые поедают листья, предотвращать их пожелтение. Он фактически сдерживает падение, чтобы эти — его хозяева могли есть больше. И у него есть свойства, которые действительно важны для нас, людей.
Итак, Wolbachia содержится в паразитических червях, вызывающих изнурительные тропические болезни, такие как слоновость и речная слепота. И, обнаружив лекарства, которые могут убить Wolbachia, ученые наконец ищут и открывают эффективные способы лечения и лечения этих болезней.
GROSS: А как насчет болезней, передаваемых комарами, таких как лихорадка денге и Зика? В этом, кажется, тоже есть какая-то актуальность.
ЙОНГ: Верно. Вольбахия оказалась действительно мощным средством борьбы с болезнями, передаваемыми комарами. Таким образом, ученые в Австралии потратили около 25 лет, пытаясь внедрить эту бактерию в Aedes aegypti, тигрового комара, который распространяет лихорадку денге и желтую лихорадку, а теперь печально известный вирус Зика. И они пытались сделать это, потому что Wolbachia, похоже, не дает этим насекомым передавать вирусы, вызывающие эти заболевания.
И Wolbachia настолько хорош в распространении среди дикой популяции, что если вы выпустите небольшое количество этих зараженных комаров, они должны улететь вдаль, и через несколько месяцев Wolbachia будет повсюду, что сделает все это сообщество насекомых неспособным к распространению. распространять болезнь. Они — бактерии превращают их из переносчиков в тупики. И это впервые было опробовано в 2011 году в нескольких пригородах Австралии. И эта команда действительно показала, что Wolbachia становится доминирующим среди этих естественных популяций, и теперь они пробуют этот подход в крупных мегаполисах по всему миру, в таких местах, как Бразилия и Колумбия, Индонезия и Вьетнам.А их так много …
GROSS: Места с комарами.
ЙОНГ: Места с комарами, места с серьезными проблемами денге. Первоначально этот подход был разработан для устранения лихорадки денге, но, похоже, он работает против вируса Зика, а также против многих других болезней, переносимых комарами, и имеет огромные преимущества. В отличие, скажем, от инсектицидов, которые токсичны и нуждаются в постоянной перекрашивании, у Wolbachia у этих комаров, похоже, нет никаких проблем, никаких рисков для безопасности.И он поддерживает себя. Как только вы выпустите насекомых, они уйдут по своим делам, и вам не нужно их пополнять.
ГРОСС: Значит, вы не играете с генетикой комаров. Вы вводите бактерии?
ЙОНГ: Верно. Нет генетической модификации. Эти комары — не ГМО. Они просто были объединены с бактерией, которая уже присутствует в значительной части других насекомых.
GROSS: Итак, теперь, когда вы видите в своем теле огромные сообщества микробов, как это изменило вашу жизнь? Изменилось ли это, например, то, что вы едите, или как вы себя ведете, или тому, чему вы подвергаетесь?
ЙОНГ: Я определенно меньше боюсь микробного мира, чем 20 лет назад.Вы знаете, я не … Я, конечно, мою руки, но я не сильно их вытираю. Я не использую дезинфицирующие средства. Но вы знаете, что на самом деле написание этой книги дало мне более широкую перспективу окружающего меня мира. Так что я всегда любил мир природы. Знаете, я был тем парнем, который все время ходил в зоопарки. Я смотрела документальные фильмы о дикой природе и читала книги о природе.
И теперь я понимаю, что вся эта биология, которую, как мне казалось, я знала, все эти существа, эти слоны, ястребы и рыбы, которыми я был очарован, эти вещи, которые я мог видеть своими глазами, на самом деле глубоко и глубоко подвержены влиянию вещей, которые я Не могу видеть.И я знаю, что если я пойду в зоопарк сейчас, каждое животное и каждый посетитель в этом зоопарке на самом деле будет зоопарком сам по себе.
GROSS: Приведите пример животного, которое вы теперь видите по-другому.
ЙОНГ: Есть — в очень глубоких океанах есть среды, называемые гидротермальными жерлами, эти дымоходы, извергающие перегретую воду. И в этих отверстиях живет червь, называемый рифтией, и он … он может вырасти до нескольких метров в длину, и у него есть красивые красные жабры, которые выглядят так, будто кто-то полностью вытолкнул тюбик помады.И этот червь живет в этой среде, в которой просто нет еды, но в ее теле есть микробы.
Большая часть его тела, вероятно, большая часть его, состоит из бактерий. Они захватывают минералы из вентилируемой среды и используют их для создания питательных веществ. Именно так и поддерживает себя червь. Это животное лишилось рта и кишечника, потому что зачем вообще беспокоиться о пищеварительной системе, если вам не нужно есть, когда у вас внутри есть микробы, которые обеспечивают вас всей вашей энергией? И я думаю, что это просто потрясающий пример того, насколько интимные животные могут развиваться, полагаясь на свои микробы.Это существо не смогло бы выжить без толпы внутри него.
GROSS: Вам не интересно, как выглядит мир с точки зрения микробов, о которых вы пишете, например, если бы один из микробов писал эту книгу, насколько он отличался бы (смех)?
ЙОНГ: Я чувствую, что о нас даже не будет упоминания.
ГРОСС: (Смех).
ЙОНГ: Мы всего лишь эта сноска, эта глазурь на… на этом гигантском микробном пироге.Знаете, в этой книге я говорю о том, как если бы вы сжали историю Земли в один календарный год, чтобы Земля была создана в первом января, а сейчас 31 декабря, как раз перед ударом полуночи. , то люди возникли около 30 минут назад. И даже все многоклеточные существа, то, что мы можем видеть, все животные и растения, с которыми мы знакомы, возникли всего пару месяцев назад, тогда как бактерии, вероятно, впервые эволюционировали, скажем, в начале марта. Итак, для подавляющего большинства живых существ на Земле все было микробиологическим.
Вы знаете, бактерии были правителями планеты на протяжении большей части истории Земли, и они все еще правят планетой. Они по-прежнему управляют перемещением химикатов по всему миру. Они есть во всех возможных средах обитания. Они вездесущи и имеют огромное влияние. И во многих отношениях наши тела, тела всех остальных животных или наши города, которыми мы так гордимся, — все это просто дополнительные среды обитания для бактерий и других микробов.
GROSS: Эд Йонг, большое вам спасибо.
ЙОНГ: Большое спасибо за то, что пригласили меня.
GROSS: Новая книга Эда Йонга о микробах внутри нас называется «Я вмещаю множество». После небольшого перерыва Майло Майлз сделает рецензию на альбом бразильского ансамбля босса-нова. Это СВЕЖИЙ ВОЗДУХ.
Авторские права © 2016 NPR. Все права защищены. Посетите страницы условий использования и разрешений на нашем веб-сайте www.npr.org для получения дополнительной информации.
стенограмм NPR созданы в срочном порядке компанией Verb8tm, Inc., подрядчик NPR, и произведен с использованием запатентованного процесса транскрипции, разработанного с NPR. Этот текст может быть не в окончательной форме и может быть обновлен или изменен в будущем. Точность и доступность могут отличаться. Авторитетной записью программирования NPR является аудиозапись.
2018 • Психология Колорадский колледж
Список докладчиков
Пейдж Э.Антон
Неврология
Советник: Лори Дрисколл
Bifidobacterium infantis 35624 Добавки для эубиотических крыс-подростков не влияют на тревожное или компульсивное поведение
Кишечные микробы общаются с мозгом посредством эндокринных, иммунных и нервных сигналов. Здоровый микробиом кишечника в раннем возрасте играет жизненно важную роль в формировании нейропсихиатрической функции, но относительное влияние конкретных штаммов микробов и механизмы, с помощью которых эти штаммы оказывают свое действие, неизвестны.Целью настоящего исследования было определить, влияет ли добавка пробиотиков с Bifidobacterium infantis 35624 (B. infantis) в подростковом возрасте на тревожное и компульсивное поведение у здоровых крыс, и зависят ли эти эффекты от передачи сигналов блуждающим нервом. Крысам-подросткам (N = 94) сделали поддиафрагмальную ваготомию или имитацию хирургического вмешательства, а затем им добавили B. infantis или носитель в течение 22 дней. Крыс тестировали в двух испытаниях лабиринта Elevated Plus Maze (EPM) через 0 и 2 недели после приема добавок для оценки немедленных и устойчивых эффектов B.Infantis о тревоге. Компульсивное поведение измерялось с помощью задачи по закапыванию мрамора (MBT). B. infantis существенно не уменьшал тревожное или компульсивное поведение у самцов или самок крыс; однако ваготомия значительно снизила тревожное поведение у мужчин в испытании EPM 1. Настоящие результаты показывают, что добавка B. infantis в подростковом возрасте не влияет на тревожное или компульсивное поведение у крыс с установленной кишечной микробиотой, и что блуждающий нерв может быть важен для информирования тревожное поведение у мужчин.Необходимы дальнейшие исследования, чтобы полностью выяснить роль блуждающего нерва в тревожном поведении и проверить долгосрочное влияние пробиотических добавок на тревожное и компульсивное поведение у здоровых животных.
| Вверх |
Пэтти Аткинсон
Психология
Советник: Кристи Эрдал
Изменения и улучшения в лечении спортсменов с расстройствами пищевого поведения
Расстройства пищевого поведения (ED) являются результатом сочетания нереалистичного культурного давления, восприимчивых черт личности и дисфункциональных когнитивных процессов.Для спортсменов сочетание культурных ожиданий и давления, направленного на достижение конкурентоспособности, приводит к большему риску развития ЭД. Общая черта перфекционизма среди ED проявляется у спортсменов в стремлении к соревновательному совершенству и принятию крайних мер для повышения производительности, что приводит для многих женщин к триаде спортсменок: расстройство пищевого поведения, аменорея и остеопороз. Понимание причин устойчивости к лечению у спортсменов с ЭД может помочь улучшить существующие методы лечения и повысить мотивацию к лечению.Современные методы лечения атлетов с нарушениями вызывают сильное беспокойство. Новые методы лечения должны быть нацелены на работу как со спортсменом, так и со спортивным персоналом, чтобы улучшить методы профилактики и обучения, а также предоставить адекватную информацию о питании. Необходимо обсудить опасность нарушения питания для работоспособности и здоровья. Когнитивно-поведенческая терапия (CBT) и когнитивно-поведенческий коучинг (CBC) должны использоваться, чтобы помочь изменить озабоченность спортсменов производительностью и чрезмерно самокритичными оценками.Несмотря на стигматизацию, упражнения могут оказаться полезными для поддержания набора веса, уменьшая тревогу и депрессию. Техники, основанные на медитации, также помогают уменьшить тревогу и депрессию и могут быть полезны при реструктуризации негативных эмоций у спортсменов. Здоровье, а не производительность, должно быть в центре внимания спортсмена, тренеров, спортивного персонала и лечебной бригады.
| Вверх |
Сара Баркер
Неврология
Советник: Лори Дрисколл
Межпоколенческие эффекты Bifidobacterium infantis 35624 на материнскую сдерживающую модель депрессии
Депрессия во время беременности — серьезная проблема общественного здравоохранения, при этом 18% беременных женщин страдают депрессивными симптомами.Предродовая депрессия коррелирует с осложнениями со здоровьем у матери, а также с физическими и поведенческими отклонениями у ребенка. Некоторым помогает психотерапия, но она доступна не всем, а безопасность использования антидепрессантов во время беременности убедительно не доказана. Альтернативный подход состоит в том, чтобы обратиться к здоровью оси головного мозга кишечника, двунаправленного пути передачи сигналов между микробиотой кишечника и центральной нервной системой. Пробиотики, капсулы жизнеспособных и полезных микроорганизмов, представляют собой эффективный способ изменить состав микробиоты кишечника и впоследствии улучшить такие расстройства центральной нервной системы, как депрессия и тревожность.В настоящем исследовании изучается влияние разных поколений добавок Bifidobacterium infantis 35624 на модель сдерживания материнской депрессии у крыс. Материнское ограничение по 45 минут три раза в день в течение шести-семи дней значительно усилило депрессивное поведение матерей. Материнская сдержанность дополнительно увеличивала вес потомства и увеличивала депрессивное поведение. Добавка Bifidobacterium infantis 35624 незначительно спасла этот дефицит. Хотя немногие результаты достигли статистической значимости, необходимы дальнейшие исследования с большим размером выборки для выяснения эффективности этого вмешательства в улучшении физического и психологического здоровья матери и ребенка.
| Вверх |
Ян Кэри и Эндрю Кирвин-Куамм
Психология
Консультанты: Кевин Холмс и Нора С. Ньюкомб
Пространственные категории в языке и мышлении: свидетельства категориального восприятия по кардинальным осям
Отношения между языковыми и нелингвистическими пространственными категориями были охарактеризованы с точки зрения двух противоположных позиций. Одна позиция предполагает, естественно, тесное соответствие между двумя наборами категорий.Другая позиция предполагает диссоциацию, при которой горизонтальная и вертикальная оси функционируют как границы нелингвистических категорий и прототипы языковых категорий. Последний счет предсказывает категориальное восприятие (CP) на осях, обнаруживаемое превосходным различением местоположений, охватывающих ось, по сравнению с неосевыми местоположениями — однако это предсказание не было проверено напрямую. Мы предоставляем доказательства такой аксиальной CP в двух экспериментах с использованием задач восприятия и памяти. Третий эксперимент воспроизводит эти результаты, но содержит важную оговорку.Многие исследования показывают, что левый и правый более запутаны в языке, чем верхний и нижний, и CP отражает это несоответствие: относительная сложность различения неосевых местоположений была более выражена, когда местоположения были разделены по горизонтали, чем по вертикали. Вместе эти результаты показывают, что отношения между языковыми и нелингвистическими пространственными категориями не полностью отражены ни в одном из существующих аккаунтов. То, что оси дают CP, предполагает, что они действительно функционируют как нелингвистические границы категорий, поддерживая учет диссоциации.Однако несоответствие CP между осями — зеркальное отражение и, возможно, усиленное лингвистическим преимуществом вертикальных терминов над горизонтальными — указывает на то, что языковые и нелингвистические пространственные категории фактически в значительной степени выровнены, хотя и не так, как предлагается заочный счет.
| Вверх |
Кейли Д. Кэссиди
Психология
Советник: Кристи Эрдал
Стигма при биполярном расстройстве: влияние причины и информация о лечении
Общественная стигма продолжает оставаться препятствием на пути к выздоровлению для людей с психическими заболеваниями.Предыдущие исследования показывают, что биогенетические причинные объяснения психических заболеваний усиливают определенные аспекты стигмы. Однако большая часть этих исследований была посвящена депрессии и шизофрении, и лишь несколько исследований изучали стигму биполярного расстройства. Таким образом, в настоящем исследовании изучалось влияние информации о причинах и лечении на стигму при биполярном расстройстве. Участники программы «Механический турок» от Amazon заполнили анкету, содержащую описание человека, страдающего биполярным расстройством, с разными причинами и информацией о лечении.Когда была дана биогенетическая причина, участники считали, что люди с биполярным расстройством менее ответственны за свое заболевание, но они также считали биполярное расстройство менее продолжительным с нормальным опытом. Информация о лечении уменьшила страх, восприятие опасности, желание дистанцироваться от общества и ответственность пациента. Жалость и страх опосредуют связь между информацией о лечении и социальной дистанцией. Эти результаты говорят о важности предоставления информации о лечении в кампаниях по дестигматизации.
| Вверх |
Грейс Коннолли
Неврология
Советник: Кристи Эрдал
Факторы восстановления после детской травмы головного мозга: обзор литературы
Детская черепно-мозговая травма (ЧМТ) — основная причина детской смертности и инвалидности в США. Нарушение критических процессов развития мозга может привести к последствиям ЧМТ, которые продолжаются в течение месяцев, лет или даже всей жизни после первоначальной травмы.Возраст на момент травмы — главный фактор в траектории восстановления, в значительной степени основанный на критических и чувствительных периодах развития мозга, присутствующих во время травмы. Страдание от ЧМТ в критический или чувствительный период может привести к оптимальной траектории восстановления в зависимости от повышенной пластичности мозга или, наоборот, привести к безвозвратному повреждению непрерывного развития за счет демонтажа важнейших нейронных процессов. В настоящем обзоре исследуется литература, в которой обсуждаются как преимущества, так и недостатки более раннего возраста при травмах, а также исследуются последствия ЧМТ в школьных условиях.Доступ к высококачественному вмешательству и информированным педагогам должен быть доступен для всех учащихся, независимо от способности семьи оплачивать услуги. Предлагаются стратегии реабилитации с учетом текущих когнитивных, поведенческих, социальных и эмоциональных способностей ребенка, а также текущих процессов развития. Поскольку каждая травма индивидуальна и требует уникального подхода к вмешательству, в этом обзоре подчеркивается ответственность школ за создание и реализацию планов вмешательства, которые подходят отдельным детям и направлены на их уникальное когнитивное, социальное, эмоциональное и поведенческое развитие.
| Вверх |
Келли Калшоу, Камилла Гинзбург и Мэтью Коул
Психология
Советник: Томи-Энн Робертс
Так ты думаешь, что ты урод? Сексуализация в молодежном танце
Два исследования изучали сексуализацию в популярных танцевальных видео на YouTube с участием молодежи. Первое исследование установило надежную схему кодирования сексуализированного внешнего вида и сексуализированных движений. Видео с наибольшим количеством просмотров имели значительно большую сексуализацию, чем видео с наименьшим количеством просмотров.Во втором исследовании использовалось отслеживание глаз, чтобы подтвердить эти элементы у наивных участников.
| Вверх |
Миранда Элизабет Эйнхорн
Психология
Советник: Кристи Эрдал
Когда мужчины плачут: восприятие мужских эмоций в контексте высокой мужественности
Исследование мужских эмоций и мужских слез показывает, что контекстные и ситуативные подсказки имеют наибольшее влияние на оценку этого поведения другими. Руководствуясь как социальными конструкционистскими, так и социальными нормами взглядов на мужественность, в этом исследовании изучалась оценка людьми плачущего поведения мужчин в ситуациях, когда они были особенно высоки.Используя экспериментальный план, 180 участников были случайным образом распределены по одному из шести условий, в которых они читали отрывок о Джеке, мужчине, который плачет после успеха или проигрыша. Чтобы исследовать влияние ярлыков на эмоциональную оценку, Джека описывали как делового человека, футбольного фаната или футбольного квотербека. Оценка поведения Джека проводилась по его типичности, уместности и предполагаемому соответствию участника поведению; Джека оценивали по его женственности и мужественности.Наконец, участники ответили на анкету о консерватизме. Результаты показали, что, хотя поддержка занятий спортом считается типичной для мужчин, фанаты не вовлечены настолько напрямую, что плач является социально приемлемым. Кроме того, двух- и трехсторонние взаимодействия показали, что восприятие женственности и мужественности варьируется в зависимости от пола участников. Казалось, что женщины ассоциируют мужественность с успехом, тогда как мужчины более чувствительны к описанию характера.
| Вверх |
Куинн Хасни
Психология
Советник: Джейсон Уивер
Друг и враг: личностные предикторы амбивалентной дружбы
Хотя дружба часто рассматривается в полярных терминах — как друг или враг, — дружба редко бывает столь дихотомической.Амбивалентная дружба, характеризующаяся сочетанием положительных и отрицательных эмоций, столь же обычна, как и доставляет беспокойство (Bushman & Holt-Lunstad, 2009; Campo et al., 2009). Настоящее исследование исследует личностные предикторы амбивалентной дружбы, уделяя особое внимание неуверенности в отношениях и чертам макиавеллизма как катализаторам амбивалентной дружбы. В двух самоотчетных исследованиях участники оценили свои личные качества, а затем личностные черты либо поддерживающего друга, либо амбивалентного друга.В разных исследованиях амбивалентные друзья воспринимались как более неуверенные в отношениях и более макиавеллистские, чем поддерживающие друзья. Относительно незащищенные участники оценили большую часть своих дружеских отношений как амбивалентные; тем не менее, макиавеллизм участников не был связан с амбивалентной идентификацией дружбы. Эти результаты проливают свет на роль личностных переменных в восприятии и идентификации амбивалентных дружеских отношений.
| Вверх |
Рэйчел Ипполит
Неврология
Консультанты: Джон Хорнер, Кэтрин Рейсснер, Мариан Сепульведа
Рилузол как усилитель GLT-1 с последствиями для кокаиновой зависимости
Фармакологический способ борьбы с рецидивом кокаина заключается в восстановлении биологических условий до их исходного состояния путем попытки уменьшить реакцию на наркотик после периода прекращения, известного как восстановление.Предыдущие эксперименты показали, что препараты, такие как цефтриаксон, восстанавливают уровни глутамата в прилежащем ядре, тем самым снижая восстановление за счет активации транспортера глутамата GLT-1. Также было обнаружено, что рилузол снижает вероятность возобновления употребления кокаина. В этом эксперименте крысы Sprawley-Dague самостоятельно вводили либо кокаин, либо физиологический раствор в течение 10 дней, затем вымерли, в течение которых кокаин больше не принимался самостоятельно. Во время исчезновения половина обеих групп получала внутрибрюшинные (IP) инъекции рилузола в течение 16 дней.Затем крыс умерщвляли и измеряли экспрессию GLT-1 в ядре прилежащего ядра с помощью вестерн-блоттинга. Экспериментальные группы, которые получали внутрибрюшинные инъекции рилузола, имели такие же уровни экспрессии GLT-1 в прилежащем ядре, что и контрольная группа. Однако в группе, которая самостоятельно вводила кокаин и получала внутрибрюшинные инъекции физиологического раствора, уровень экспрессии GLT-1 в прилежащем ядре был значительно ниже. Таким образом, рилузол, по-видимому, опосредует механизм активации GLT-1 для борьбы с восстановлением, что означает, что этот механизм ценен для будущего фармакологического лечения кокаиновой зависимости.
| Вверх |
Андрей Копель
Психология
Советник: Кевин Холмс
Согласование результатов в области языка и пространства: структура неопределенности
Смешанные выводы о существовании или отсутствии влияния языка на пространственное познание можно согласовать, рассматривая когнитивную неопределенность как модулятор эффектов языка. Когда ситуация вызывает у человека неуверенность, язык с большей вероятностью повлияет на его решения, чем если ситуация относительно определенная.Язык может быть инструментом, помогающим уменьшить неопределенность, но язык не является привилегированным сигналом, снижающим неопределенность (его функция не отличается категорично от других сигналов). Таким образом, в настоящем обзоре делается попытка нормализовать роль языка и предсказать, когда и как он повлияет на пространственное познание.
| Вверх |
Алек Шеффилд
Неврология
Советник: Флавио Фрёлих
Изменение мозговой активности с помощью магнитных полей: региональные эффекты префронтальной tSMS на нейронные колебания
Транскраниальная стимуляция статическим магнитным полем (tSMS) — это новый неинвазивный метод стимуляции мозга, который, как было показано, локально усиливает альфа-колебания в теменной и затылочной коре.Мы исследовали, увеличивает ли tSMS локально альфа-колебания в левой или правой префронтальной коре, так как баланс префронтальных альфа-колебаний влево / вправо (фронтальная альфа-асимметрия) связан с эмоциональной обработкой и расстройствами настроения. Следовательно, изменение фронтальной альфа-асимметрии с помощью tSMS может служить новым методом лечения психических заболеваний. Данные ЭЭГ собирали до, во время и после 10 минут tSMS, примененного к левой дорсолатеральной префронтальной коре (DLPFC), правой DLPFC или фиктивной.В отличие от нашей гипотезы, ни левый, ни правый tSMS локально не увеличивали фронтальные альфа-колебания. Однако альфа-колебания были выше в затылочной коре по сравнению с другими областями мозга во время tSMS левого DLPFC. И левый, и правый DLPFC tSMS увеличивали глобальные тета-колебания после стимуляции по сравнению с имитацией, с большим увеличением ответа на правую стимуляцию. Бета-колебания в левом полушарии увеличивали постстимуляцию для левого и правого DLPFC tSMS по сравнению с имитацией. Мы пришли к выводу, что DLPFC tSMS модулирует колебания сети в регионах, удаленных от места стимуляции.
| Вверх |
Люси Слоун и Аллиза Уорлинг
Неврология
Консультант: Боб Джейкобс
Морфология нейронов неокортекса африканского леопарда (Panthera pardus pardus)
Настоящее исследование впервые позволило количественно оценить соматодендритную морфологию неокортекса африканского леопарда (Panthera pardus pardus), расширив недавний каталог нейроморфологии не домашних кошек (Johnson et al., 2016).Образцы тканей были получены из лобной, моторной и зрительной коры, окрашены с использованием модифицированной быстрой техники Гольджи и количественно определены с помощью компьютерной морфометрии. Качественно наблюдали разнообразный спектр колючих нейронов и аспиновых нейронов (N = 258), похожих на те, что ранее наблюдались у домашней кошки, а также у амурского тигра и дымчатого леопарда. Количественно соматодендритные измерения всех нейронов, обнаруженных у африканского леопарда, были больше похожи по размеру и сложности на таковые у дымчатого леопарда, чем на таковые у амурского тигра.Эти результаты отражают положительную корреляцию между размером тела млекопитающих и размерами нейронов (Kaas, 2000) среди этих трех видов Panthera. Наконец, эти результаты согласуются с наблюдениями Бродмана (1909) и Бетца (1874), поскольку гигантопирамидные нейроны в моторной коре были больше, чем ожидалось, учитывая размер тела и мозга африканского леопарда.
| Вверх |
Кателин А. Тейген
Неврология
Советник: Лори Дрисколл
Добавление пробиотиков с Bifidobacterium infantis снижает социальную тревогу, но не влияет на компульсивное поведение у крыс-подростков
Становится все более очевидным, что комменсальная микробиота кишечника способна оказывать существенное влияние на центральную нервную систему и что они, вероятно, играют роль в проявлениях неврологических расстройств.Точный путь — нервный, гормональный или иммунный — через который происходит это общение, еще предстоит определить. Целью настоящего исследования было оценить, способен ли пробиотик Bifidobacterium infantis (B. infantis), продуцирующий предшественник серотонина в кишечнике, ослаблять тревожное и компульсивное поведение у крыс-подростков, и если да, то в какой степени этот эффект зависит от блуждающего нерва (т. е. нервной связи). Лечение B. infantis уменьшало тревожное поведение во время теста на социальное взаимодействие как у самцов, так и у самок крыс, но только в значительной степени у самцов.Напротив, добавка пробиотиков не влияла на возникновение компульсивного поведения у обоих полов, что измерялось тестом закапывания мрамора. Кроме того, нарушение нейронного коммуникативного пути поддиафрагмальной ваготомией не повлияло на способность B. infantis ослаблять тревожное поведение. Это исследование демонстрирует, что B. infantis обладают анксиолитическими свойствами, которые более выражены у мужчин, усиливаются в контексте стрессовой социальной ситуации и, по-видимому, не опосредуются блуждающим нервом.Хотя необходимы дополнительные исследования, эти результаты подтверждают предлагаемое использование пробиотиков в качестве альтернативы фармацевтическим препаратам для лечения неврологических заболеваний, сопутствующих дисбактериозу кишечной микробиоты.
| Вверх |
Аллиса П. Уорлинг, Мадлен Э. Гарсия и Ноа Беккет Ши-Шумски
Неврология, нейробиология, психология
Советник: Боб Джейкобс
Долговременные изменения дендритов и позвоночника после повторяющихся травм головного мозга
Повторяющаяся черепно-мозговая травма (RTBI) является фактором риска хронической травматической энцефалопатии (ХТЭ) нейродегенеративного заболевания.Мы изучили возможные долгосрочные изменения дендритных систем пирамидных нейронов лобной и затылочной долей после RTBI в случаях с диагнозом CTE и без него. Ткань шести мужчин с диагнозом RTBI в анамнезе, пяти с диагнозом CTE и одного без него, сравнивали с тканями 12 неврологически нормальных людей (Jacobs et al., 1997). Ткань была подготовлена с помощью быстрой техники Гольджи, а дендритные системы были проанализированы с помощью компьютерной морфометрии. Большинство количественных показателей дендритов и позвоночника были уменьшены в обеих областях коры во всей ткани после RTBI по сравнению с контрольной тканью, независимо от диагноза CTE.Префронтальная кора была повреждена сильнее, чем зрительная кора. Такое продолжительное уменьшение дендритов после RTBI может иметь негативные последствия для когнитивных функций, с нейродегенеративным диагнозом или без него.
| Вверх |
Роберт Велч
Неврология
Советник: Кевин Дж. Холмс
Принцип сложности: влияние языка на восприятие дискриминации зависит от сложности
Несмотря на то, что многие данные свидетельствуют о том, что язык влияет на восприятие дискриминации, относительно мало исследований изучали факторы, которые могли бы модулировать такие эффекты.Некоторые предположили, что влияние языка может быть сильнее для более сложных различений, чем для более простых, но предыдущие исследования либо негласно предполагали эту идею, либо проверяли ее таким образом, чтобы влияние языка рассматривалось как все или ничего, а не как градуированное. Здесь мы приводим доказательства дифференцированного воздействия языка на систематически меняющиеся уровни сложности дискриминации. Используя цвет в качестве испытательного стенда, мы показываем, что категориальное восприятие — усиленная дискриминация на границах категорий — линейно возрастает с трудностью, определяемой схожестью восприятия между цветами.Доказательства модулирующей роли трудности наблюдались в двух разных лингвистических категориях границ и перцептивных задачах. Наши результаты дают представление об условиях, при которых язык формирует восприятие наиболее сильно, и позволяют устранять несоответствия в данной области относительно того, влияет ли язык на восприятие цвета.
Как грудное молоко развивает кишечник ребенка (и кишечные микробы)
Выращивание ребенка — это процесс инженерии экосистемы.Вы заботитесь не только о ребенке, но и о целом мире.
С самого рождения младенцы колонизируются легионами микробов, которые обитают в их кишках, коже и многом другом. Это жизненно важно. Они помогают растущему человеку переваривать пищу и защищать от вредных микробов. Они настолько важны, что новорожденные временно подавляют собственную иммунную систему, чтобы дать своим микробным партнерам шанс утвердиться.
Мама тоже помогает. Ее вагинальные выделения дают ребенку стартовый набор микробов.А ее грудное молоко содержит особые сахара, которые, кажется, выборочно питают кишечные бактерии, в которых нуждаются младенцы.
Эрик Роже из Университета Кентукки обнаружил, что молочное антитело под названием SIgA также помогает создать правильное сообщество кишечных микробов. Без него молодые мыши сталкиваются с долгосрочными последствиями, включая несколько признаков воспалительных заболеваний кишечника (ВЗК). « Эти антитела создают более здоровую среду в кишечном тракте младенца, поэтому они лучше подготовлены к тому, чтобы противостоять экологическим проблемам в более позднем возрасте», — говорит Шарлотта Кетцель, руководившая исследованием.
Хотя команда исследовала только мышей, Кетцель отмечает, что несколько исследований показали, что у детей, находящихся на грудном вскармливании, меньше шансов заболеть ВЗК в более позднем возрасте. «Мы не говорим о черном и белом: вы защищены, если вы кормите грудью, и не защищены, если не кормите грудью», — говорит она. «Но я, конечно, утверждаю, что есть явная выгода».
«Сейчас мы все больше и больше осознаем, что факторы грудного молока влияют на микробиоту кишечника, которая, в свою очередь, настраивает иммунную систему на меньшее количество хронических заболеваний в более позднем возрасте», — говорит Аллан Уокер из Массачусетской больницы общего профиля.
Молоко содержит обширный коктейль молекул, и иммуноглобин А (IgA или SIgA) является одним из них. Это антитело, которое содержится в выделениях нашего тела. Мы производим его в смехотворных количествах: около чайной ложки каждый день . Он есть в молоке, слизи, слезах, слюне — везде, где наши клетки отводят жидкость во внешний мир. Проведите пальцем по любой поверхности своего тела, и если она намокнет, вероятно, на ней есть SIgA.
Мыши и люди в конечном итоге производят SIgA для самих себя, но в наши первые дни жизни материнское молоко является единственным источником антител.Когда Роджер сконструировал мышей-мутантов, которые не могли продуцировать SIgA в своем молоке, он обнаружил, что их детеныши выросли с особенным кишечником. В них обитали разные сообщества кишечных бактерий, а также было больше определенных групп, которые наблюдаются в кишечнике пациентов с ВЗК. И некоторые из этих микробов оказались в неожиданных местах.
По мере взросления мыши ее кишечные микробы взаимодействуют с ее собственными клетками кишечника, создавая герметичный барьер, не позволяющий посторонним материалам проникать в более глубокие ткани кишечника. Шлагбаум — хороший забор, который делает соседей хорошими.Но если новорожденные мыши не могут получить SIgA от матери, их кишечные барьеры будут пористыми, и бактерии проникают в нижележащие лимфатические узлы.
«Эти лимфатические узлы должны быть абсолютно стерильными», — говорит Кетцель. «Когда вы вынимаете их из взрослой мыши и выращиваете, вы не обнаружите бактерий. Когда мы взяли лимфатические узлы у потомков, у которых не было SIgA в молоке, они были на загружены бактериями ».
Самым распространенным видом был Ochrobactrum anthropi — условно-патогенная бактерия, которая была связана с растущим числом инфекций у пациентов больниц.Это также зависит от кислорода, что странно, поскольку большинство кишечных бактерий избегают этого вещества или, в лучшем случае, переносят его. «Обычно при воспалении наблюдается чрезмерный рост аэробных бактерий», — говорит Кетцель.
«Полезные бактерии в кишечном тракте имеют решающее значение, но не обязательно, чтобы они были слишком много, например, разрастались в лимфатических узлах», — говорит Кэти Хинд из Гарвардского университета. «Это исследование показывает, что проглоченный SIgA играет важную роль в ограничении бактериальной инвазии за пределы стенки кишечника.”
Эти ранние изменения сохранялись во взрослом возрасте и сделали мышей постоянно восприимчивыми к воспалению, даже если в конечном итоге они могли производить SIgA для себя. Когда команда добавила в питьевую воду воспалительное вещество, называемое DSS, те, кто не получил антитела от своих матерей, отреагировали более энергично. Они сильно активировали несколько генов, которые были связаны с ВЗК у людей.
Когда дело доходит до таких болезней, ученые часто говорят о триаде способствующих факторов: собственная биология хозяина, его микробы и факторы окружающей среды, такие как болезни пищевого происхождения, которые могут вызвать воспаление.«Эти мыши изменили две стороны этого треугольника», — говорит Кетцель. Им не хватило SIgA (фактора хозяина), и в итоге они получили странную микробиоту. DSS замкнул треугольник и привел к сильному воспалению.
Теперь команда хочет посмотреть, можно ли улучшить здоровье кишечника ребенка, вскармливаемого смесью, путем добавления в него SIgA, или даже могут ли очищенные антитела помочь детям старшего возраста или взрослым с проблемами кишечника.
И, конечно же, их исследование подчеркивает еще одно преимущество грудного вскармливания.Он уникален тем, что изолировал действие одного (основного) ингредиента молока, но Кетцель отмечает, что младенцы, находящиеся на грудном вскармливании, также получают широкий спектр других полезных веществ.
Например, он содержит собственных микробов. Лиза Фанкхаузер и Сет Борденштейн предположили, что лимфатическая система переносит бактерии из кишечника матери в ее молочные железы, где они могут быть поглощены грудным младенцем.
Если щенки, которые не получают SIgA от матери, имеют странные бактерии в лимфатических узлах, могут ли они передать различные микробы своему потомству , когда для них наступит время давать молоко? «Отказ от употребления sIgA с материнским молоком может привести к действительно захватывающим последствиям для разных поколений», — говорит Хайнде.
