Инфузионные растворы. Классификация инфузионных растворов.
Общие сведения про инфузионные растворы
Жидкие растворы, предназначенные для введения в организм через кровеносный сосуд, называются инфузионными растворами.
Обязательными свойствами для инфузионных растворов являются:
- текучесть,
- не токсичность в терапевтической дозе, как для компонентов крови, так и для органов,
- достаточно легкая дозированность,
- нейтральность инфузионной среды, особенно для различных препаратов,
- относительная стабильность, применяемых растворов.
Классификация инфузионных растворов и назначение
По основным характеристикам инфузионных сред, выделяют несколько групп растворов. В разных классификациях существует от 4 до 6 групп. Но более приемлемой выглядит так называемая «рабочая» классификация. Здесь, все инфузионные растворы разделены следующим образом.
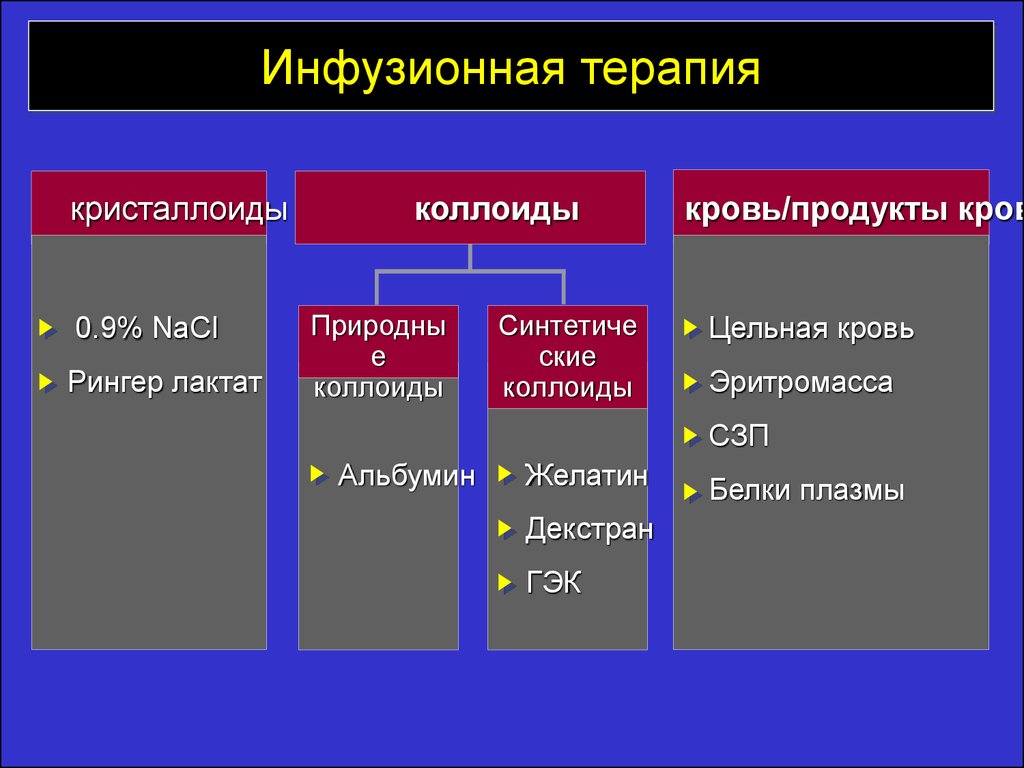
- кристаллоиды.
- коллоиды.

- препараты компонентов крови.
В ее основе лежит принадлежность к неорганическим и органическим веществам, а также обладание или нет онкотическими свойствами, что поределает их свойства и показания для применения.
Инфузионные растворы: кристаллоиды
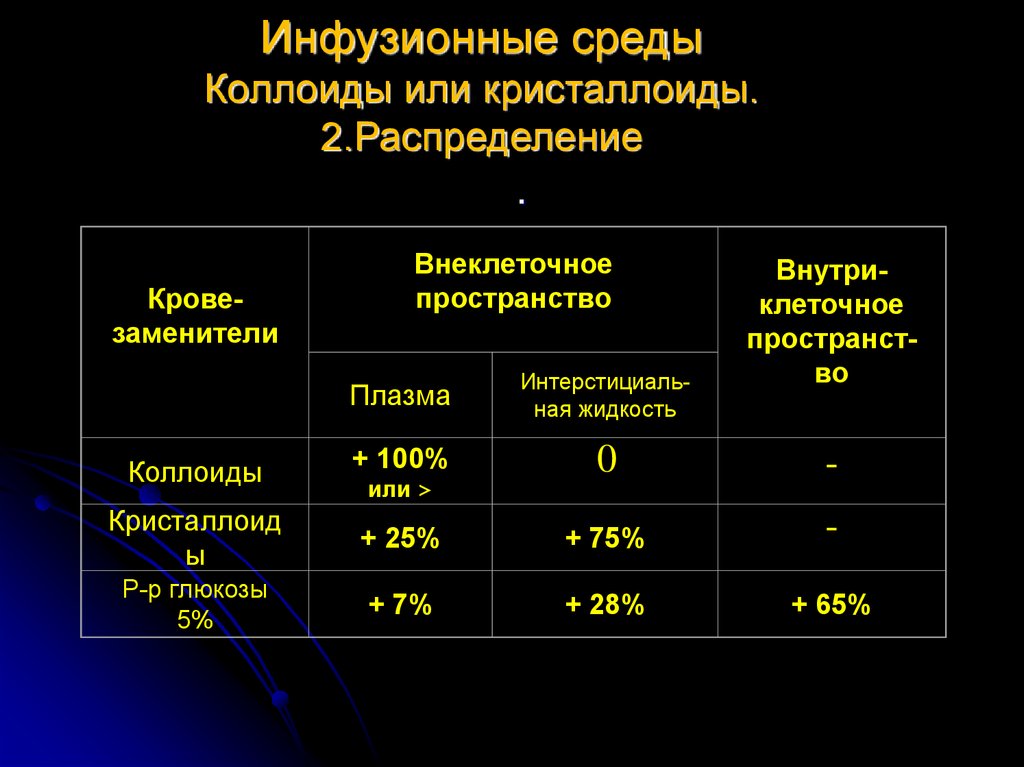
Основой для всех растворов является NaCL. Он же является растворителем, и он же может сам оказывать определенные эффекты. Дело в том, что плазма крови и межклеточная жидкость имеют концентрацию хлора и натрия в пределах 0,9%. Грубо говоря в 100 мл мене 1мг соли, а именно 900мкг. Все это дает возможность инфузионным растворам с концентрацией соли 0,9% быть нейтральными по отношению к буферным системам крови. По-другом такие растворы называются изотоническими.
К ним относя: физиологический раствор и раствор Рингера-Лока. Также, с известной долей условности, можно отнести хлосоль, дисоль, трисол. Дело в том, что по концентрации хлорида натрия они являются изотоническими. Но, с другой стороны в них добавлены другие соли, что при вливании данных растворов в большом количестве может привести к смешению электролитного баланса.
Также к кристаллоидам относятся растворы электролитов, которые превышают физиологическую норму и поэтому называются гипертоническими, и растворы с концентрацией солей ниже — гипотонические. Но только первые нашли широкое применение в медицине. Тогда как вторые применяются чаще при различных экспериментальных моделированиях на базах НИИ.
К гипертоническим растворам относят растворы глюкозы (5%, 25% и 40%), раствор соды, раствор поваренной соли (10% и 20%).
Отдельно рассматриваются растворы из органических кислот: янтарная, уксусная и др. Хотя, надо надо заметить, что в качестве растворитель используется физраствор. Одним из не многих и самым известным является реамберин.
Не смотря на достаточно широкую разницу в качественном составе, кристаллоиды имеют схожие показания.
- первичное восполнение ОЦК. Например, при кровопотере мене 10-15% и малой скорости кровотечения. Здесь применяются физраствор и р-р Рингера. Раньше, до появления современных коллоидов, эти растворы являлись обязательным при геморрагическом и других видах шоков, в качестве «препаратов» первого этапа.

- растворители для многих лекарственных средств. Для этих целей широко используются в основном изотонические и слабогипертонические (до 5-10%) растворы: физраствор, стерофундин, глюкоза 5%, р-р Рингера.
- восполнение дефицита тех или иных электролитов: стерофундин, трисоль, хлосоль, глюкозо-инсулин-калиевая смесь (на медицинском сленге — «полярка»).
- кровоостанавливающее средство: раствор аминокапроновой кислоты.
- восполнение дефицита энергии, детоксикация: реамберин.
Инфузионные растворы: коллоиды
В их основе лежат полимерные органические соединения. Они обладают так называемой «активным» осмосом. То есть, в отличии от кристаллоидов, осмотическая активность которых проявляется только при градиенте (разнице), коллоиды сами проявляют эту активность. Поэтому, данная группа растворов, в первую очередь предназначена для коррекции осмотического давления в кровеносном сосуде. Что приводит к стабилизации ОЦК, объема межклеточной жидкости, а значит и гемодинамики в целом. Другими словами, коллоидные растворы поддерживают артериальное давление на оптимальном уровне.
Другими словами, коллоидные растворы поддерживают артериальное давление на оптимальном уровне.
Инфузионные растворы: препараты крови
В отличи от двух предыдущих групп, эти препараты готовятся из «живого» сырья. А именно из крови животных и человека. Поэтому, они ближе всего по своим свойствам напоминают кровь. С другой стороны, они несут определенную антигенную нагрузку. То есть являются своего рода аллергичными, что и ограничивает их применение в объеме. Обычно он не превышает 500, реже 1000 мл/сутки.
В данную группу входят ряд препаратов, которые и определяют (своим строением) область применения.
- Альбумины. Показаны при гипопротеинемиях — снижении общего количества белка в крови.
- Плазма. Является очищенной от всех клеточных компонентов крови, что определяет основные ее свойства: детоксикация, коррекция текучести и объема циркулирующей крови — рео- и волюмокоррекция.
- Тромбоцитарная масса. Применяется при дефиците тромбоцитов крови.
- Эритроцитарная масса. Содержит только эритроциты крови. Используется при состояниях, в основе которых лежат низкие показатели гемоглобина.
- Лейкоцитарная масса. Чаще всего используются растворы нейтрофилов и моноцитов. Область применения данных препаратов ограниченна редкими случаями врожденных иммунодефицитов.
Документы
- Главная
- Рубрикатор МЗ РФ
- Новости
- О больнице
- Сведения о ГБУ РО «ОДКБ»
- Отделения
- Центр специализированной хирургической помощи
- Уроандрологическое отделение
- Хирургия
- Челюстно-лицевая хирургия
- Травматология и ортопедия
- ЛОР (оториноларингологическое отделение)
- Нейрохирургическое отделение
- Центр анестезиологии и реанимации
- Отделение реаниматологии и интенсивной терапии
- Отделение диализа и эфферентных методов терапии
- Отделение анестезиологии-реанимации
- Центр специализированной офтальмологической помощи
- Офтальмологический стационар круглосуточного пребывания
- Офтальмологический дневной стационар
- Поликлинический приём врача офтальмолога
- Кабинет ретинопатии недоношенных (RetCam)
- Лазерный офтальмологический кабинет
- Вспомогательные лечебно-диагностические подразделения
- Физиотерапевтическое отделение
- Отделение ультразвуковой диагностики
- Центр лабораторных технологий
- Отделение лучевой диагностики
- Эндоскопическое отделение
- Кабинет гипербарической оксигенации
- Кабинет трансфузиологии
- Центр детской онкологии и гематологии
- Отделение детской онкологии и гематологии
- Дневной стационар детской онкологии и гематологии с химиотерапией
- Центр по реабилитации и восстановительному лечению детей с патологией ЦНС
- Отделение медицинской реабилитации
- Дневной стационар медицинской реабилитации
- Приемное отделение
- Общая информация
- Врачи отделения
- Педиатрическое отделение
- Общая информация
- Интересные факты об «Армянской болезни»
- Фотогалерея
- Педиатрическое отделение
- Пульмонологическое отделение
- Пульмонологическое отделение
- Фотогалерея
- Врачи отделения
- Нефрологическое отделение
- Общая информация
- Фотогалерея
- Врачи отделения
- Инфекционное отделение (боксированное)
- Общая информация
- Фотогалерея
- Врачи отделения
- Стационар дневного пребывания
- Общая информация
- Фотогалерея
- Врачи отделения
- Отделение по оказанию платных медицинских услуг и по программам ДМС
- Общая информация
- Список врачей
- Прейскурант
- Консультативно-диагностический центр
- Консультативная диагностическая поликлиника
- Отделение выездной консультативной лечебно-профилактической помощи
- Отделение паллиативной медицинской помощи детям
- Общая информация
- Фотогалерея
- Врачи отделения
- Психоневрологическое отделение
- Общая информация
- Фотогалерея
- Врачи отделения
- Центр специализированной хирургической помощи
- График работы организации и приема
График работы организации и приема
- Документы
Документы
- Противодействии коррупции
- СОУТ
- Выписки из реестра лицензий
- Свидетельство о государственной регистрации
- Правила внутреннего распорядка
- Структура
- Тарифное соглашение
- Устав учреждения
- Руководство
Руководство.
 Сотрудники
Сотрудники - Правила и сроки госпитализации
Правила и сроки госпитализации
- Условия оказания медицинской помощи
Условия оказания медицинской помощи
- Перечень услуг
Перечень услуг
- Показатели доступности и качества медицинской помощи
Показатели доступности и качества медицинской помощи
- Страховые компании
Страховые компании
- Надзорные и контролирующие органы
Надзорные и контролирующие органы
- Наши контакты
- Отделения
- Документы
Документы
- Пациентам
- Перечень СМО
- График работы врачей поликлиники
- О возможности получения семьями ежемесячной выплаты в связи с рождением (усыновлением) первого ребенка
- Перечень видов МП, оказываемых бесплатно
- Перечень ЖНВЛП
- Права и обязанности граждан РФ
- Порядок оказания ВМП
- Информация о внештатных специалистах МЗ РО
- Приказ о порядке госпитализации в областные МО
- Показания для направления в ГБУ РО «ОДКБ»
- Правила госпитализации в ГБУ РО «ОДКБ».

- Необходимо для консультации (госпитализации) в ГБУ РО «ОДКБ».
- Правила подготовки к проведению исследований у детей
- Часто задаваемые вопросы
- Правила внутреннего распорядка
- Правила общения и поведения в ГБУ РО «ОДКБ» для работников, родителей, пациентов и посетителей
- О порядке и условиях признания лица инвалидом
- Пациентам
- О новой коронавирусной инфекции
- О профилактике гриппа
- ПРАВИЛА ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ ГРАЖДАНАМ УКРАИНЫ, ГРАЖДАНАМ ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ, ГРАЖДАНАМ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ И ЛИЦАМ БЕЗ ГРАЖДАНСТВА, ПРИБЫВШИМ НА ТЕРРИТОРИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ В ЭКСТРЕННОМ МАССОВОМ ПОРЯДКЕ
- Платные услуги
- Запись на приём
- Инструкция по записи на прием
- Запись на бесплатный прием
- Запись на платный приём (тел.
 300-80-39)
300-80-39) - Если возникли проблемы с записью
- Отзывы и обращения
- Порядком приема и рассмотрения обращений
- Читать отзывы или обращения
- Отправить отзыв или обращение
- Врачи
- Руководство
- Главные внештатные специалисты МЗ РО
- Детское уроандрологическое отделение
- Хирургическое отделение
- Отделение паллиативной медицинской помощи детям
- Отделение травматологии и ортопедии
- Пульмонологическое отделение
- Оториноларингологическое отделение
- Нейрохирургическое отделение
- Отделение реаниматологии и интенсивной терапии
- Отделение диализа и эфферентных методов терапии
- Отделение анестезиологии — реаниматологии
- Центр специализированной офтальмологической помощи
- Физиотерапевтическое отделение
- Отделение функциональной диагностики
- Отделение ультразвуковой диагностики
- Центр лабораторных технологий
- Отделение лучевой диагностики
- Эндоскопическое отделение
- Отделение детской онкологии и гематологии с химиотерапией
- Дневной стационар детской онкологии и гематологии с химиотерапией
- Отделение медицинской реабилитации
- Психоневрологическое отделение
- Дневной стационар медицинской реабилитации
- Приемное отделение
- Педиатрическое отделение
- Нефрологическое отделение
- Инфекционное отделение (боксированное)
- Стационар дневного пребывания
- Консультативно-диагностическая поликлиника
- Врачи отделения по оказанию платных медицинских услуг и по программам ДМС
- Медиа
- Фото
Фотогалерея
- Новости
- Отделения
- Видео
- 2015
- 2016
- 2017
- Фото
- Вакансии
- Нашим коллегам
- Путеводитель и контакты
- Рубрикатор МЗ РФ
- Medical Treatment In Russia
3 основных типа инфузионных насосов
Инфузионные насосы — это устройства, используемые для доставки жидкостей в организм пациента. Использование инфузионных насосов началось с конца 1960-х годов. Эти устройства обеспечивают лекарствами и питательными веществами в контролируемых количествах. Эти инструменты можно использовать во всех медицинских учреждениях для лечебных целей, и ими управляют профессиональные врачи, которые знают, как запрограммировать продолжительность и скорость подачи жидкости.
Использование инфузионных насосов началось с конца 1960-х годов. Эти устройства обеспечивают лекарствами и питательными веществами в контролируемых количествах. Эти инструменты можно использовать во всех медицинских учреждениях для лечебных целей, и ими управляют профессиональные врачи, которые знают, как запрограммировать продолжительность и скорость подачи жидкости.
Инфузионные насосы лучше, чем ручные насосы для введения жидкости, поскольку они могут подавать жидкости с точной частотой, объемом и интервалами. Вы можете использовать эти помпы для доставки лекарств, таких как обезболивающие, химиотерапевтические препараты, антибиотики и инсулин, среди многих других. В этой статье представлены основные классы инфузионных насосов и их отличительные характеристики.
Распространенные типы инфузионных насосов
Существуют различные категории инфузионных насосов. Вы можете классифицировать инфузионные насосы по разным группам на основе различных факторов. Но выделяются три основных класса инфузионных насосов. Эти типы инфузионных насосов включают:
Эти типы инфузионных насосов включают:
- Инфузионные насосы, классифицируемые по функциям
- Насосы инфузионные, организованные по объему подачи жидкости
- Инфузионные насосы, классифицируемые по их подвижности
Различные типы внутривенных помп в зависимости от их подвижности
Амбулаторные инфузионные помпы
Амбулаторные инфузионные помпы представляют собой легкие инфузионные помпы, часто используемые при лечении людей с инвалидизирующими заболеваниями. Иногда пациентам с изнурительными состояниями необходимо передвигаться со своими медицинскими вливаниями, потому что они нуждаются в лекарствах в течение дня. Мобильные и легкие инфузионные насосы помогают транспортировать таких пациентов, продолжая получать лекарства. Этот легкий инфузионный насос решает задачу доставки медицинских вливаний на ходу.
Стационарные инфузионные насосы
В отличие от переносных легких инфузионных насосов, стационарные инфузионные насосы не обязательно должны быть компактными и легкими, поскольку они не требуют перемещения. Лежачие больные с хроническими заболеваниями часто нуждаются в лекарствах или диетических вливаниях. Стационарные помпы обеспечивают внутривенные инфузии у постели больного, которым требуется частое питание или лекарства у постели больного. В отличие от легких инфузионных насосов, стационарные насосы не обязательно должны быть легкими.
Лежачие больные с хроническими заболеваниями часто нуждаются в лекарствах или диетических вливаниях. Стационарные помпы обеспечивают внутривенные инфузии у постели больного, которым требуется частое питание или лекарства у постели больного. В отличие от легких инфузионных насосов, стационарные насосы не обязательно должны быть легкими.
Классификация инфузионных насосов по объему подачи жидкости
Существует два типа категорий инфузионных насосов, определяемых объемом инфузий, которые они доставляют.
Шприцевые насосы или инфузионные насосы малого объема
Это инфузионные насосы, которые доставляют небольшие объемы лекарственного средства, требуемого в небольших количествах. Много раз они используются на младенцев и маленьких детей. Эти инфузионные насосы идеально подходят для доставки лекарств в небольших количествах, таких как гормоны, которые вы можете доставлять с помощью управляемого моторного механизма, в котором используется насосная система, работающая как поршень.
Насосы большого объема (LVP)
Насосы LVP представляют собой инфузионные насосы, которые вливают большие объемы питательных или лекарственных жидкостей. В LVP часто используются электронные перистальтические насосы. Насос управляется вручную или с помощью ролика, управляемого компьютером.
Классификация инфузионных насосов в зависимости от их функций
При рассмотрении вопроса об использовании существует два типа инфузионных насосов. К ним относятся специальные насосы и традиционные насосы.
Специальные насосы
Специальные инфузионные насосы предназначены для использования в исключительных медицинских случаях. Они обычно используются при оказании помощи на дому или при лечении определенных состояний, таких как диабет. В категорию специальных инфузионных насосов входят три основных класса насосов, включая имплантируемые, энтеральные и инсулиновые инфузионные насосы.
Традиционные инфузионные насосы
Традиционные инфузионные насосы можно использовать в медицинских учреждениях, таких как мобильные, домашние и учреждения длительного ухода. Эти насосы можно использовать как в стационарных, так и в мобильных условиях для введения обезболивающих, антибиотиков, химиотерапевтических препаратов и гидратирующих жидкостей. Традиционные инфузионные насосы подразделяются на три категории, в том числе:
Эти насосы можно использовать как в стационарных, так и в мобильных условиях для введения обезболивающих, антибиотиков, химиотерапевтических препаратов и гидратирующих жидкостей. Традиционные инфузионные насосы подразделяются на три категории, в том числе:
- Инфузионные шприцевые насосы
- Одноразовые насосы
- Насосы большого объема
- Эластомерные насосы
Вам или кому-либо из ваших близких требуется инфузионная система для медицинских целей? Не торопитесь, чтобы определить их медицинские потребности и идеальный инфузионный насос для их медицинских потребностей. Идеальный выбор гарантирует правильную доставку лекарств или диетических потребностей и быстрое выздоровление пациента.
Изделия медицинские; Устройства общего назначения для больниц и личного пользования; Классификация инфузионного насоса с альтернативным контроллером
Начало Преамбула
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, HHS.
Окончательная поправка; окончательный заказ.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA, Агентство или мы) относит инфузионный насос с альтернативным контроллером к классу II (специальные элементы управления). Специальные элементы управления, которые применяются к типу устройства, идентифицируются в этом порядке и будут частью кодифицированного языка для классификации инфузионных насосов с альтернативным контроллером. Мы предпринимаем это действие, потому что определили, что отнесение устройства к классу II (специальный контроль) обеспечит разумную гарантию безопасности и эффективности устройства. Мы считаем, что это действие также расширит доступ пациентов к полезным инновационным устройствам.
Дата вступления в силу: Настоящий приказ вступает в силу 4 февраля 2022 года.
Дата применения: Классификация применялась с 14 февраля 2019 года.
Начать дополнительную информацию
Райан Луберт, Центр устройств и радиологического здоровья, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, 109 лет.03 Нью-Гэмпшир-авеню, корп. 66, кв.м. 3574, Сильвер Спринг, MD 20993-0002, 240-402-6357, [email protected].
Конец дополнительной информации Конец преамбулы Начать дополнительную информацию
I. Исходная информация
По запросу FDA классифицировало инфузионный насос с альтернативным контроллером как класс II (специальные элементы управления), что, как мы определили, обеспечит разумную гарантию безопасности и эффективности. Кроме того, мы считаем, что это действие улучшит доступ пациентов к полезным инновациям, поместив устройство в более низкий класс устройств, чем автоматическое присвоение класса III.
Автоматическое присвоение класса III происходит в силу закона и без каких-либо действий со стороны FDA, независимо от уровня риска, связанного с новым устройством. Любое устройство, которое не находилось в коммерческом распространении до 28 мая 1976 г., автоматически классифицируется и остается в пределах класса III и требует предпродажного одобрения до тех пор, пока FDA не примет меры по классификации или реклассификации устройства (см. 21 U.S.C. 360c(f) (1)). Мы называем эти устройства «устройствами после внесения поправок», поскольку они не находились в коммерческом распространении до даты вступления в силу Поправок о медицинских устройствах от 1976, которым были внесены поправки в Федеральный закон о пищевых продуктах, лекарствах и косметических средствах (Закон FD&C).
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) может предпринимать различные действия в соответствующих обстоятельствах для классификации или реклассификации устройства в класс I или II. Мы можем издать распоряжение, в соответствии с разделом 513(i) Закона FD&C (см. 21 U.S.C. 360c(i)) о том, что новое устройство в значительной степени эквивалентно предварительному устройству, не требующему предпродажного утверждения. Мы определяем, эквивалентно ли новое устройство по существу предикатному устройству, с помощью процедур предпродажного уведомления в соответствии с разделом 510(k) Закона FD&C (21 U.S.C. 360(k)) и частью 807 (21 CFR часть 807).
Мы можем издать распоряжение, в соответствии с разделом 513(i) Закона FD&C (см. 21 U.S.C. 360c(i)) о том, что новое устройство в значительной степени эквивалентно предварительному устройству, не требующему предпродажного утверждения. Мы определяем, эквивалентно ли новое устройство по существу предикатному устройству, с помощью процедур предпродажного уведомления в соответствии с разделом 510(k) Закона FD&C (21 U.S.C. 360(k)) и частью 807 (21 CFR часть 807).
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США также может классифицировать устройство по классификации «De Novo» — общепринятому названию процесса, разрешенного в соответствии с разделом 513(f)(2) Закона FD&C. Раздел 207 Закона о модернизации Управления по санитарному надзору за качеством пищевых продуктов и медикаментов от 1997 г. (Pub. L. 105-115) установил первую процедуру классификации De Novo. Раздел 607 Закона о безопасности и инновациях Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (Pub. L. 112-144) изменил процесс подачи заявок De Novo, добавив вторую процедуру. Спонсор устройства может использовать любую процедуру классификации De Novo.
L. 112-144) изменил процесс подачи заявок De Novo, добавив вторую процедуру. Спонсор устройства может использовать любую процедуру классификации De Novo.
В рамках первой процедуры человек подает форму 510(k) на устройство, которое ранее не классифицировалось. После получения приказа от FDA об отнесении устройства к классу III в соответствии с разделом 513(f)(1) Закона FD&C, лицо затем запрашивает классификацию в соответствии с разделом 513(f)(2).
В соответствии со второй процедурой, вместо того, чтобы сначала подать 510(k), а затем запрос на классификацию, если лицо определяет, что не существует легально продаваемого устройства, на котором можно было бы основывать определение существенной эквивалентности, это лицо запрашивает классификацию в соответствии с раздел 513(f)(2) Закона о FD&C.
В соответствии с любой процедурой классификации De Novo FDA обязано классифицировать устройство письменным распоряжением в течение 120 дней.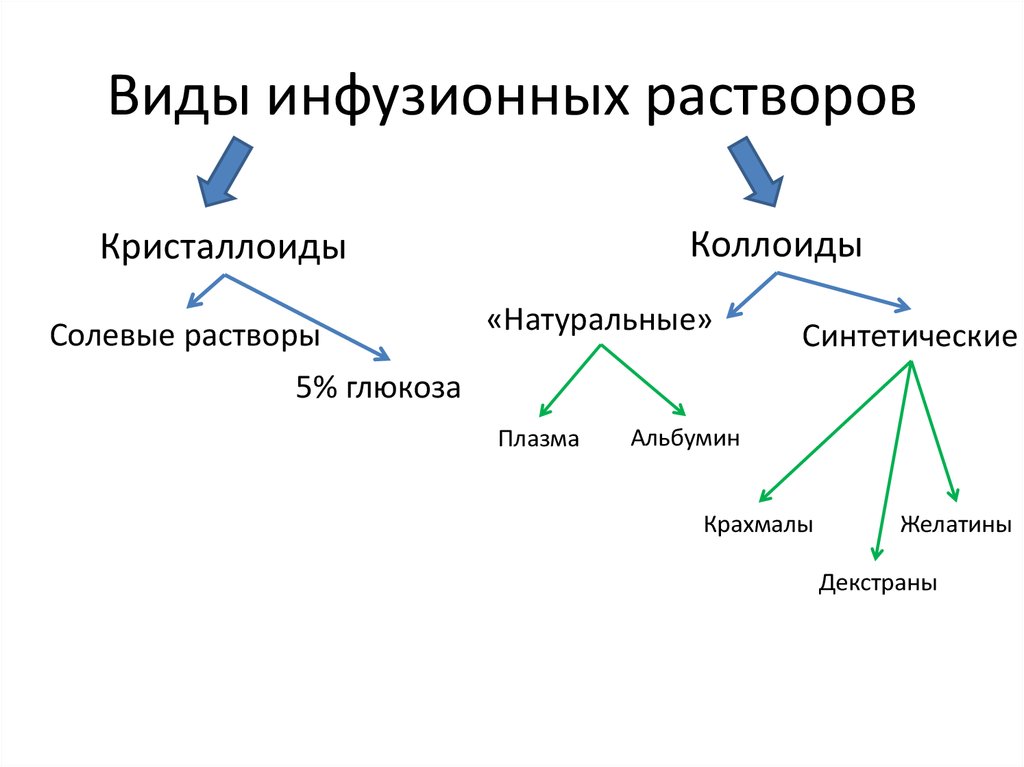 Классификация будет осуществляться в соответствии с критериями раздела 513(a)(1) Закона FD&C. Хотя устройство было автоматически отнесено к классу III, классификация De Novo считается начальной классификацией устройства.
Классификация будет осуществляться в соответствии с критериями раздела 513(a)(1) Закона FD&C. Хотя устройство было автоматически отнесено к классу III, классификация De Novo считается начальной классификацией устройства.
Мы считаем, что эта классификация De Novo расширит доступ пациентов к полезным инновациям. Когда FDA относит устройство к классу I или II посредством процесса De Novo, устройство может служить предикатом для будущих устройств этого типа, в том числе для 510(k)s (см. раздел 513(f)(2)(B) (i) Закона о FD&C). В результате другим спонсорам устройств не нужно подавать запрос De Novo или заявку на предварительное одобрение для продажи существенно эквивалентного устройства (см. раздел 513(i) Закона FD&C, определяющий «существенную эквивалентность»). Вместо этого спонсоры могут использовать менее обременительный процесс 510 (k), когда это необходимо, для продажи своего устройства.
II. Классификация Де Ново
29 октября 2018 г. FDA получило запрос Tandem Diabetes Care, Inc. на классификацию De Novo для t:slim X2.
Начать печать страницы 6423
инсулиновая помпа с интероперабельной технологией. FDA рассмотрело запрос, чтобы классифицировать устройство в соответствии с критериями классификации, изложенными в разделе 513(a)(1) Закона FD&C.
FDA получило запрос Tandem Diabetes Care, Inc. на классификацию De Novo для t:slim X2.
Начать печать страницы 6423
инсулиновая помпа с интероперабельной технологией. FDA рассмотрело запрос, чтобы классифицировать устройство в соответствии с критериями классификации, изложенными в разделе 513(a)(1) Закона FD&C.
Мы относим устройства к классу II, если общие средства контроля сами по себе недостаточны для обеспечения разумной уверенности в безопасности и эффективности, но имеется достаточно информации для установления специальных средств контроля, которые в сочетании с общими средствами обеспечения обеспечивают разумную уверенность в безопасности и эффективности устройства для его предполагаемого использования (см. 21 U.S.C. 360c(a)(1)(B)). Проанализировав информацию, представленную в запросе, мы определили, что устройство может быть отнесено ко II классу с установлением специальных мер контроля./51-1.jpg) Управление по санитарному надзору за качеством пищевых продуктов и медикаментов определило, что эти специальные средства контроля, в дополнение к общим средствам контроля, обеспечат достаточную уверенность в безопасности и эффективности устройства.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов определило, что эти специальные средства контроля, в дополнение к общим средствам контроля, обеспечат достаточную уверенность в безопасности и эффективности устройства.
Поэтому 14 февраля 2019 г. FDA выдало запросчику приказ о классификации устройства по классу II. В этом последнем заказе FDA кодифицирует классификацию устройства, добавляя 21 CFR 880.5730. [1] Мы назвали общий тип устройства «инфузионный насос с альтернативным контроллером», и он идентифицирован как инфузионный насос с альтернативным контроллером (насос ACE). Помпа ACE представляет собой устройство, предназначенное для вливания лекарств пациенту. Помпа АПФ может включать базальную и болюсную доставку лекарств с установленной или переменной скоростью. Помпы ACE предназначены для надежной и безопасной связи с внешними устройствами, такими как автоматизированные системы дозирования лекарств, чтобы обеспечить получение, выполнение и подтверждение команд доставки лекарств. Помпы ACE предназначены для использования как отдельно, так и в сочетании с устройствами с цифровым подключением для доставки лекарств.
Помпы ACE предназначены для использования как отдельно, так и в сочетании с устройствами с цифровым подключением для доставки лекарств.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов определило следующие риски для здоровья, связанные именно с этим типом устройства, и меры, необходимые для снижения этих рисков, в таблице 1.
| Меры по смягчению | |
|---|---|
| Нанесение вреда пациенту из-за неадекватной точности введения лекарственного средства, что приводит к избыточной или недостаточной инфузии лекарственного средства | Проверка точности базального и болюсного введения лекарств, проверка надежности использования устройства в течение всего срока службы, разработка мер по предотвращению перекрестных каналов. |
Утвержденные и отслеживаемые меры контроля рисков для выявленных опасностей. | |
| Нанесение вреда пациенту из-за невыявленной окклюзии помпы, создающей риск недостаточной инфузии лекарственного средства | Обнаружение опасности ( например, лекарственная окклюзия) проверочное тестирование. |
| Нанесение вреда пациенту из-за несовместимости между лекарственным средством и помпой, что может привести к избыточной или недостаточной инфузии лекарственного средства или к воздействию вредных веществ, выделяющихся из материалов помпы в инфузионный раствор лекарственного средства | Тестирование на совместимость лекарственных средств. |
| Невозможность обеспечить надлежащее лечение из-за потери связи с цифровыми подключенными устройствами управления помпой | Утвержденные спецификации, процессы и процедуры связи с цифровыми подключенными устройствами. |
Команды от альтернативных устройств управления помпой с цифровым подключением, которые противоречат существующим командам помпы, могут привести к непреднамеренной избыточной или недостаточной инфузии лекарственного средства. | |
| Конфликтующие интерфейсы, приводящие к избыточной или недостаточной доставке | Утвержденные спецификации, процессы и процедуры связи с устройствами с цифровым подключением, Утвержденные отказоустойчивые конструктивные особенности. |
| Нанесение вреда пациенту из-за незащищенной передачи данных | Утвержденные спецификации, процессы и процедуры связи с устройствами с цифровым подключением. |
| Нанесение вреда пациенту из-за невозможности определить источник ошибки дозирования при использовании в интегрированной системе | Подтвержденная возможность регистрации данных. |
| Нанесение вреда пациенту в результате воздействия опасных и небиосовместимых материалов или патогенов | Тестирование на биосовместимость, Валидация процедур обработки. |
| Нанесение вреда пациенту из-за помех при передаче данных/электромагнитных помех | Проверка электробезопасности, электромагнитной совместимости и безопасности беспроводной радиочастотной связи.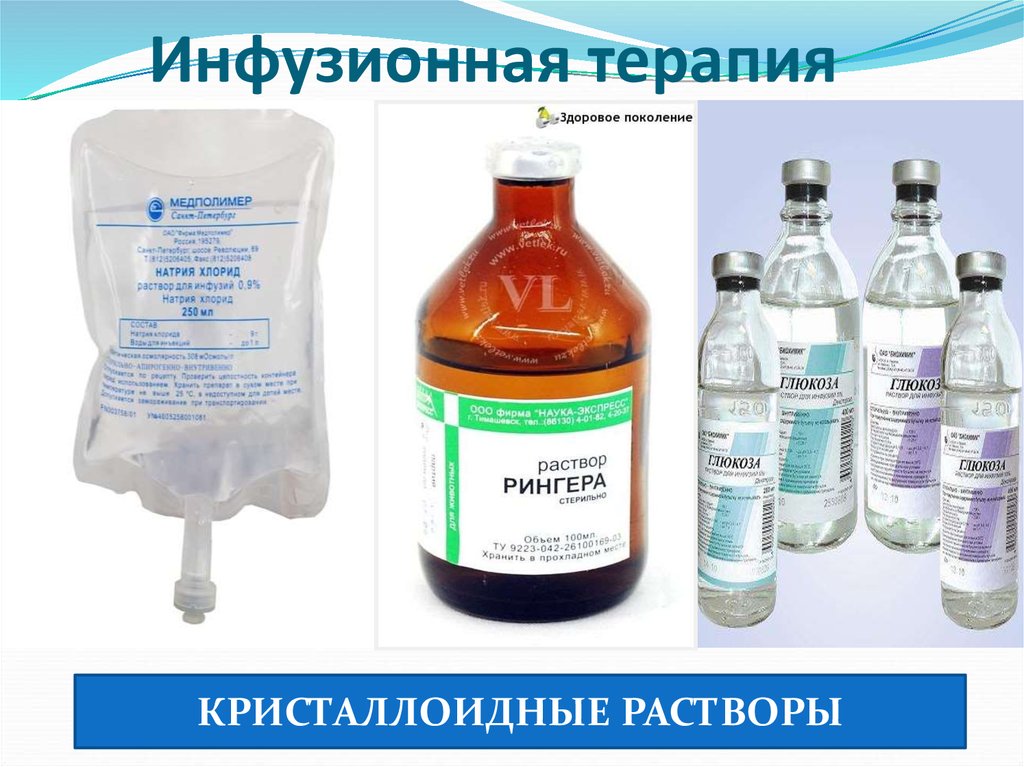 |
| Нанесение вреда пациенту из-за неправильного использования помпы, эксплуатационных ошибок и/или ошибок, связанных с эксплуатацией | Проверка с учетом человеческого фактора. Прозрачные описания характеристик помпы в маркировке. |
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов определило, что специальные меры контроля в сочетании с общими мерами контроля устраняют эти риски для здоровья и обеспечивают разумную гарантию безопасности и эффективности. Чтобы устройство подпадало под эту классификацию и, таким образом, избегало автоматического отнесения к классу III, оно должно соответствовать специальным требованиям контроля, указанным в этом окончательном приказе. Необходимые специальные меры контроля указаны в правилах, кодифицированных этим приказом. Это устройство подлежит предварительному уведомлению в соответствии с разделом 510(k) Закона FD&C.
III. Анализ воздействия на окружающую среду
Агентство определило в соответствии с 21 CFR 25. 34(b), что это действие относится к типу, который по отдельности или в совокупности не оказывает значительного воздействия на окружающую среду человека. Поэтому не требуется ни экологической оценки, ни заключения о воздействии на окружающую среду.
34(b), что это действие относится к типу, который по отдельности или в совокупности не оказывает значительного воздействия на окружающую среду человека. Поэтому не требуется ни экологической оценки, ни заключения о воздействии на окружающую среду.
IV. Закон о сокращении бумажной работы от 1995 г.
Этот окончательный приказ устанавливает специальные меры контроля, которые относятся к ранее утвержденным наборам информации, содержащимся в других правилах и руководствах FDA. Эти коллекции информации подлежат рассмотрению Административно-бюджетным управлением (OMB) в соответствии с Законом о сокращении бумажной работы от 19 года.95 (44 USC 3501-3521). Собрания информации в руководящем документе «Процесс классификации De Novo (Оценка автоматического обозначения класса III)» были утверждены под контрольным номером OMB 0910-0844; сбор информации в 21 CFR, часть 814, подразделы от A до E, относительно предпродажного утверждения, был одобрен под контрольным номером OMB 0910-0231; коллекции
Начать печать страницы 6424
информация в части 807, подраздел E, касающаяся подачи предпродажных уведомлений, была утверждена под контрольным номером OMB 09. 10-0120; сбор информации в части 820 21 CFR, касающейся регулирования системы качества, был одобрен под контрольным номером OMB 0910-0073; и сборники информации в части 801 21 CFR, касающиеся маркировки, были одобрены под контрольным номером OMB 0910-0485.
10-0120; сбор информации в части 820 21 CFR, касающейся регулирования системы качества, был одобрен под контрольным номером OMB 0910-0073; и сборники информации в части 801 21 CFR, касающиеся маркировки, были одобрены под контрольным номером OMB 0910-0485.
Стартовый список предметов
- Изделия медицинские
Конечный список тем
Таким образом, в соответствии с Федеральным законом о пищевых продуктах, лекарствах и косметических средствах и в соответствии с полномочиями, делегированными Уполномоченному по пищевым продуктам и лекарствам, часть 880 раздела 21 CFR изменена следующим образом:
Стартовая часть
Конечная часть Начало Поправки Часть
1. Ссылка на часть 880 продолжает читаться следующим образом:
Ссылка на часть 880 продолжает читаться следующим образом:
Конец Поправки Часть Стартовый орган
Власть: 21 США 351, 360, 360с, 360е, 360дж, 360л, 371.
Завершить полномочия Начало поправки, часть
2. Добавить § 880.5730 к подразделу F следующего содержания:
Конец поправки.
§ 880.5730
Инфузионный насос с включенным контроллером.
(а) Идентификация. Инфузионный насос с альтернативным контроллером (насос ACE) — это устройство, предназначенное для вливания лекарств пациенту. Помпа АПФ может включать базальную и болюсную доставку лекарств с установленной или переменной скоростью.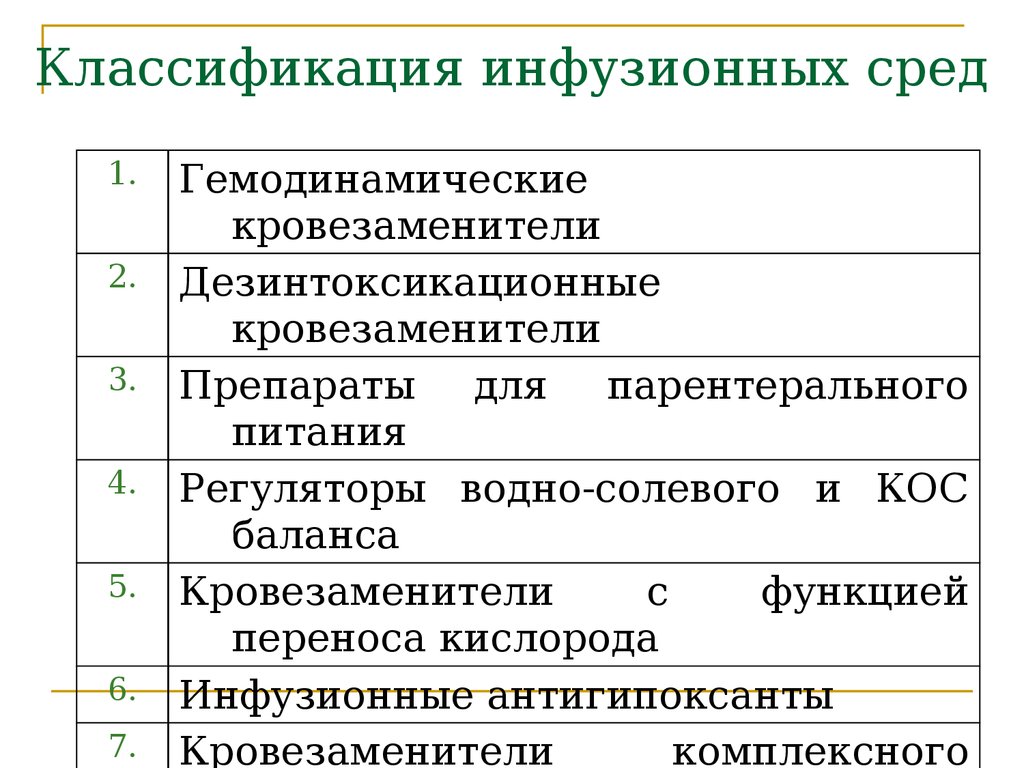 Помпы ACE предназначены для надежной и безопасной связи с внешними устройствами, такими как автоматизированные системы дозирования лекарств, чтобы обеспечить получение, выполнение и подтверждение команд доставки лекарств. Помпы ACE предназначены для использования как отдельно, так и в сочетании с медицинскими устройствами с цифровым подключением для доставки лекарств.
Помпы ACE предназначены для надежной и безопасной связи с внешними устройствами, такими как автоматизированные системы дозирования лекарств, чтобы обеспечить получение, выполнение и подтверждение команд доставки лекарств. Помпы ACE предназначены для использования как отдельно, так и в сочетании с медицинскими устройствами с цифровым подключением для доставки лекарств.
(б) Классификация. Класс II (специальный контроль). Специальные элементы управления для этого устройства:
(1) Верификация и валидация конструкции должны включать следующее:
(i) Доказательства, демонстрирующие, что точность подачи инфузии устройства соответствует определенным потребностям пользователя и предполагаемому использованию, а также подтверждается для обеспечения безопасного использования в реальных условиях использования.
(A) Входные проектные требования должны включать характеристики точности доставки при разумно предсказуемых условиях использования, включая изменения температуры окружающей среды, изменения давления ( например, высота напора, противодавление, атмосферное давление) и, при необходимости, различные свойства текучей среды лекарственного средства.
(B) Результаты испытаний должны продемонстрировать, что устройство соответствует входным проектным требованиям по точности доставки в условиях использования для программируемого диапазона скоростей и объемов доставки. Тестирование должно проводиться на статистически достоверном количестве устройств для учета различий между устройствами.
(ii) результаты валидационных испытаний, демонстрирующие способность помпы обнаруживать соответствующие опасности, связанные с доставкой лекарственного средства и путем введения ( например, закупорки, воздух в линии и т. д.) в течение клинически значимого периода времени в диапазоне программируемых скоростей и объемов доставки лекарств. Обнаружение опасностей должно соответствовать предполагаемому использованию устройства, а испытания должны подтверждать соответствующие характеристики в условиях использования устройства.
д.) в течение клинически значимого периода времени в диапазоне программируемых скоростей и объемов доставки лекарств. Обнаружение опасностей должно соответствовать предполагаемому использованию устройства, а испытания должны подтверждать соответствующие характеристики в условиях использования устройства.
(iii) Результаты валидационных испытаний, демонстрирующие совместимость с лекарственными средствами, которые можно использовать с помпой, на основании ее маркировки. Тестирование должно включать оценку стабильности лекарственного средства в разумно предсказуемых условиях применения, которые могут повлиять на стабильность лекарственного средства ( например, температура, освещенность или другие факторы по мере необходимости).
(iv) Биосовместимость частей устройства, прямо или косвенно контактирующих с пациентом, должна быть подтверждена. Это должно включать химические характеристики и определение твердых частиц на готовых компонентах устройства, контактирующих с жидкостью, демонстрирующих, что риск вреда от остатков, связанных с устройством, достаточно низок.
Это должно включать химические характеристики и определение твердых частиц на готовых компонентах устройства, контактирующих с жидкостью, демонстрирующих, что риск вреда от остатков, связанных с устройством, достаточно низок.
(v) Доказательства, подтверждающие надежность устройства в течение срока службы насоса ACE, как указано в файле проекта, с точки зрения всех функций устройства и производительности насоса.
(vi) Устройство должно быть разработано и протестировано на электрическую безопасность, электромагнитную совместимость, а также безопасность и доступность беспроводной радиочастотной связи в соответствии с требованиями безопасности пациента в условиях предполагаемого использования.
(vii) Для любого устройства, способного доставлять более одного лекарства, необходимо адекватно снизить риск перекрестного введения лекарств.
(viii) Для любых устройств, предназначенных для использования несколькими пациентами, испытания должны демонстрировать валидацию процедур повторной обработки и включать проверку того, что после повторной обработки устройство соответствует всем функциональным и эксплуатационным требованиям.
(2) Мероприятия по проверке и валидации проекта должны включать соответствующие входные и выходные данные проекта, необходимые для надлежащего функционирования устройства, которые были задокументированы, и включают следующее:
Опасности системы устройства и проектные решения, связанные с тем, как меры по управлению рисками влияют на основные характеристики, должны быть задокументированы.
(ii) Анализ прослеживаемости, демонстрирующий, что все опасности надлежащим образом контролируются и что все средства контроля были проверены в окончательной конструкции устройства.
(3) Устройство должно включать утвержденные спецификации интерфейса для устройств с цифровым подключением. Эти спецификации интерфейса должны, как минимум, обеспечивать следующее:
(i) Безопасная аутентификация (сопряжение) с внешними устройствами.
(ii) Безопасные, точные и надежные средства передачи данных между помпой и подключенными устройствами.
(iii) Обмен необходимой информацией о состоянии между насосом и любыми альтернативными контроллерами с цифровым подключением ( например, уровень заряда батареи, уровень в резервуаре, состояние насоса, условия ошибки).
(iv) Обеспечение продолжения безопасной работы насоса, когда данные получены способом, выходящим за пределы указанных параметров.
(v) Подробный процесс и процедура передачи спецификации интерфейса помпы устройствам с цифровым подключением и проверки правильности реализации этого протокола.
(4) В устройстве должны быть предусмотрены соответствующие меры для обеспечения безопасного лечения при прерывании, потере или восстановлении связи с цифровыми подключенными альтернативными управляющими устройствами после прерывания ( например, возврат к запрограммированной безопасной скорости доставки лекарственного средства). Результаты валидационного тестирования должны демонстрировать, что критические события, возникающие при потере связи ( например, команды, неисправности устройства, окклюзии и т. д.) обрабатываются надлежащим образом во время и после прерывания.
Результаты валидационного тестирования должны демонстрировать, что критические события, возникающие при потере связи ( например, команды, неисправности устройства, окклюзии и т. д.) обрабатываются надлежащим образом во время и после прерывания.
(5) Конструкция устройства должна обеспечивать хранение и доступность записей о критических событиях в течение достаточного периода времени, чтобы обеспечить возможность аудита связи между цифровыми подключенными устройствами и облегчить обмен соответствующей информацией с ответственными сторонами для этих подключенных устройств. . Критические события, которые должны храниться в системе, должны, как минимум, включать:
(i) Записи о доставке всех лекарств
(ii) Команды, отданные помпе, и подтверждения помпы
(iii) Неисправности устройства
(iv) Сигналы тревоги и оповещения и соответствующие подтверждения
(v) События подключения ( например, установление или потеря связи)
(6) Верификация и валидация проекта должны включать результаты, полученные с помощью
Начать печать страницы 6425
исследование человеческого фактора, демонстрирующее, что предполагаемый пользователь может безопасно использовать устройство по назначению.
(7) Маркировка устройства должна включать следующее:
(i) Отчетливое заявление, определяющее лекарства, совместимые с устройством, включая наименование и концентрацию этих лекарств, если это необходимо.
(ii) Описание минимальной и максимальной базальной скорости, минимального и максимального болюсного объема и размера приращения для базального и болюсного введения или другая аналогичная применимая информация о параметрах введения лекарственного средства.
(iii) Описание точности помпы при минимальном, промежуточном и максимальном объемах введения болюса и методов, используемых для определения точности введения болюса. Для каждого объема болюса точность помпы должна быть описана с точки зрения количества измеренных болюсных доз, которые находятся в заданном диапазоне по сравнению с заданным объемом. Приемлемое описание точности (в зависимости от доставленного лекарственного средства и объема болюса) может быть представлено следующим образом для каждого тестируемого объема болюса, если это применимо: <95 процентов, 95 процентов до <105 процентов, 105 процентов до <125 процентов, 125 процентов до <175 процентов, 175 до 250 процентов и >250 процентов от заданного количества.
(iv) Описание точности помпы при минимальной, промежуточной и максимальной базальной скорости введения, а также метод(ы), используемые для определения точности базальной дозы. Для каждой базальной скорости точность помпы должна быть описана с точки зрения количества лекарственного средства, доставленного после первой команды на базальное введение, без периода прогрева, до различных моментов времени. Предоставленная информация должна включать стандартную производительность насоса, а также производительность насоса в наихудшем случае, наблюдаемую во время испытаний с точки зрения как избыточной, так и недостаточной подачи. Приемлемое описание точности (в зависимости от доставляемого лекарственного средства) может быть представлено следующим образом, если это применимо: общий объем, доставленный через 1 час, 6 часов и 12 часов после начала доставки для типичной тестируемой помпы, а также для помпы, которая доставляла наименьший и насос, который доставил больше всего в каждый момент времени.
(v) Описание работы сигнализации об опасности доставки, если применимо. Для сигналов тревоги окклюзии должны сообщаться о производительности при минимальной, промежуточной и максимальной скоростях и объемах доставки. Это описание должно включать указание максимального периода времени, который может пройти до срабатывания сигнала тревоги о закупорке при каждом условии доставки, а также типичные результаты, наблюдаемые во время эксплуатационных испытаний насосов.
(vi) Для устройств, поддерживающих беспроводное соединение, описание качества беспроводного обслуживания, необходимого для надлежащего использования устройства.
(vii) Для любых инфузионных насосов, предназначенных для повторного использования несколькими пациентами, инструкции по безопасной обработке устройства между использованиями.
Начальная подпись
Конечная подпись Конец дополнительной информации
1.