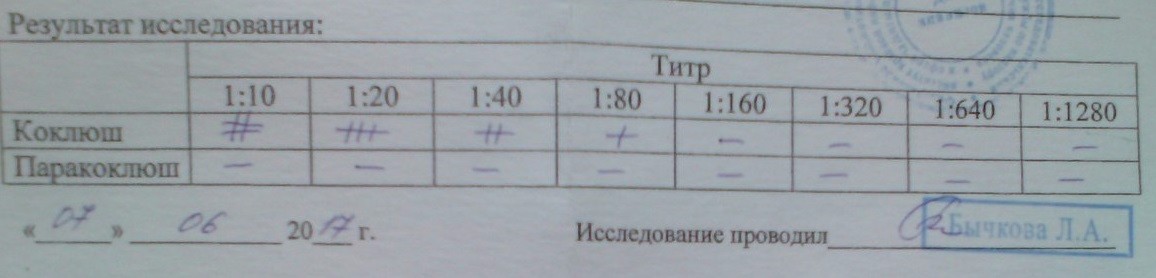
Анализ на коклюш ᐈ сдать кровь на (Bordetella pertussis), антитела IgG
Описание анализа:
Коклюш, антитела IgG – анализ, используемый для выявления у пациента антител к Bordetella pertussis – бактерии, вызывающей коклюш. Антитела IgG характерны для протекающей и недавно перенесенной инфекции и присутствуют в организме более длительное время, чем антитела IgM.
Возбудитель коклюша передается воздушно-капельным путем от заболевшего человека находящегося на 1-25-м дне болезни. Болезнь делится на несколько стадий: инкубационный период, катаральную, спазматическую (пароксизмальную), этап разрешения и реконвалесценции.
Инкубационный период со средней продолжительностью около недели, иногда сокращается до трех дней, но у некоторых пациентов может растянуться до двух недель. Симптомов в это время нет, а бактерия размножается в организме. Начинается болезнь с катаральной стадии с кашлем, насморком и чиханием, могут быть лихорадка и рвота.
Катаральной стадии, продолжительностью от 5-8 дней до двух недель, на смену приходит спазматическая или пароксизмальная, длительностью от двух до восьми недель, иногда возможно и дольше.
После этого пациент идет на поправку – начинается стадия разрешения (этап ранней реконвалесценции или обратного развития). Симптомы идут на спад, сокращается частота и длительность приступов кашля, сам кашель может становиться громче. Этот этап длится от 2 до 8 недель, после чего следует стадия реконвалесценции – полного выздоровления, занимающего от двух до шести месяцев.
Тяжелое течение коклюша может спровоцировать осложнения: судороги, потерю сознания, эмфизему легких, нарушения мозгового кровообращения, кровотечения, грыжи, бронхиты, пневмонию и пр. Такой характер болезни обычно наблюдается у самых маленьких больных (до 4 месяцев), также для них характерен короткий инкубационный период и более длительный пароксизмальный этап.
Синтез антител IgG начинается с третьей-четвертой недели болезни, их титр нарастает к 6-8 неделе, после чего начинает постепенно снижаться.
Показания к назначению
Исследование может быть назначено педиатром или терапевтом, инфекционистом, ЛОРом, или пульмонологом в следующих случаях:
- подозрение на коклюш;
- проверка лиц, имевших тесные контакты с больными коклюшем;
- дифференциальная диагностика коклюша с ОРВИ, корью, воспалением легких, бронхитом и бронхиальной астмой.
Значение результатов
Данные теста отображаются в виде индекса:
- значение менее 10,0 – результат отрицательный, антител IgG к коклюшу не обнаружено;
- 10,0 – 50,0 – слабопозитивный, наличие антител не достоверно, требуется дополнительное исследование;
- более 50,0 – положительный результат, антитела IgG к коклюшу выявлены.
Отрицательный результат возможен у здоровых пациентов или заболевших менее трех недель назад. Положительный – у больных коклюшем людей или переболевших в недавнем прошлом.
Положительный – у больных коклюшем людей или переболевших в недавнем прошлом.
Подготовка к обследованию: не нужна.
Материал для исследования: кровь из вены.
Метод исследования: иммуноферментный анализ.
Сроки проведения: 3 рабочих дня.
Анализ определения антител IgM к возбудителю коклюша (anti- Bordetella pertussis IgM) в медицинской лаборатории Оптимум г. Сочи.
- Главная
- Анализы и цены
- Антитела IgM к возбудителю коклюша
Подробнее о враче
Срок исполнения
(рабочие дни):
до 7 дн.
790 ₽*
* Взятие биоматериала оплачивается отдельно
Возбудитель Bordetella pertussis вызывает заболевание, которое называется коклюш. С помощью анализа на наличие данной бактериальной инфекции (IgM) можно выявить наличие коклюша (паракоклюша), а также узнать иммунный ответ на введение вакцины против этого заболевания.
С помощью анализа на наличие данной бактериальной инфекции (IgM) можно выявить наличие коклюша (паракоклюша), а также узнать иммунный ответ на введение вакцины против этого заболевания.
Подготовка к исследованию:
- Исследование проводится утром, натощак.
- С последнего приема пищи должно пройти не менее 8 часов.
- Исключить прием алкоголя не менее чем за 24 часа до взятия биоматериала.
- Не рекомендуется сдавать кровь на серологию после флюорографии, рентгена, физиотерапевтических процедур.
Тип биоматериала: венозная кровь
Синонимы (rus): Анализ крови на бордетелла пертуссис
Синонимы (eng): Anti- Bordetella pertussis IgM
Методы исследования: иммуноферментный анализ
Сроки выполнения:
Общие сведения о возбудителе коклюша
Возбудителем коклюша являются грамотрицательные аэробные бактерии, которые под микроскопом напоминают палочку с округленными концами. Передается Bordetella pertussis воздушно-капельным путем (при разговоре, чиханье, пользовании одной посудой). После контакта невакцинированного человека с больным риск заразиться коклюшем составляет более 90%.
Передается Bordetella pertussis воздушно-капельным путем (при разговоре, чиханье, пользовании одной посудой). После контакта невакцинированного человека с больным риск заразиться коклюшем составляет более 90%.Коклюшем обычно болеют дети (1,5-5 лет). Подростки и взрослое население также подвержены этому заболеванию, несмотря на то, что со временем (после вакцинации) иммунная реакция ослабевает. Как правило, картина болезни у них стертая и коклюш переносится в более легкой форме.
Антитела класса IgM вырабатываются после 14 дней от начала заболевания и свидетельствуют они об острой стадии течения коклюша. После 30 дней данный класс антител исчезает и образуется другой – IgG, который трактуется, как выработка иммунитета.
Показания для назначения анализа на антитела IgM
Исследование к возбудителю коклюша IgM рекомендовано лицам, у которых имеются все симптомы коклюша. Этот анализ позволит провести точную диагностику тяжелого состояния.
Анализ рекомендован, если:
- жалобы на сильный кашель, который может сопровождаться «лающими» звуками;
- частота характерных приступов (или по-другому — репризы) в день от 2-15 раз;
- во время приступа лицо синеет, шейные вены выбухают, а на склерах глаз от перенапряжения могут проявиться кровоизлияния;
- в период кашлевых толчков язык высунут, что может спровоцировать надрыв уздечки.

Усиление кашля отмечается через 2 недели от начала заболевания. Кроме того, специалист может порекомендовать анализ для ретроспективной диагностики или оценивания иммунного ответа после введения вакцины.
Потребность в анализе
Бактерия коклюша проникает в организм человека через респираторный тракт. В результате возникает сильный кашель с периодическими приступами удушья. Во время терапии важно не только употреблять лекарства, прописанные врачом, но и следить за качеством назначенного лечения, его эффективностью. Для этого рекомендуется определять концентрацию иммуноглобулинов класса М при помощи иммуноферментного анализа. Его проведение предоставляет для врача и пациента следующие возможности:
- отслеживание качества назначенного лечения, если оно правильное, концентрация IgM постепенно будет снижаться благодаря прекращению воспаления;
- выявление острого периода патологии, когда требуется срочно обратиться к врачу;
- определение типа возбудителя вместе с проведением анализа ПЦР;
- дифференциальная диагностика с другими респираторными заболеваниями, со схожей клинической симптоматикой;
- определение периода, когда острая инфекция переходит в хроническую стадию или в период выздоровления;
- своевременное определение осложнений, когда титр антител не уменьшается, а продолжает нарастать, что связано с активным воспалительным процессом.

Выявление острого периода коклюша наиболее важно, так как именно в это время требуется специфическое лечение, чтобы предотвратить приступы удушья, часто возникающие в ночное время. Врачи советуют периодически повторять анализ, чтобы отслеживать динамику патологии, но в этом случае лучше всего одновременно изучать концентрацию IgM и IgG.
Основные характеристики IgM
Важно не только выявить антитела острой стадии, но и знать их назначение и причину появления в организме. Для IgM характерны следующие особенности:
- первичное появление антител определяется на 3-5 сутки после проникновения бактерии в организм;
- максимальная концентрация формируется через 1 неделю после первичной продукции IgM;
- на 2-3 неделю антитела полностью исчезают, на смену им приходят более стойкие IgG, которые гарантируют продолжительный иммунитет;
- антитела отвечают за острую фазу и активный воспалительный процесс.
Исследование определяет не сам возбудитель, а именно защитные антитела против него, поэтому многие врачи советуют первоначально провести ПЦР анализ, чтобы убедиться в виде инфекции.
Интересные факты
Защитные иммуноглобулины определяют при помощи иммуноферментного анализа. Для него характерны некоторые интересные факты, которые могут понадобиться пациентам.
- Антитела выявляют только в венозной крови. Для этого анализа не подходит слюна, моча или другие биологические жидкости. Антитела не просачиваются через сосуды, а сохраняются только в кровотоке.
- ИФА – это исследование, проводимое при помощи полуавтоматического анализатора. Лаборант выполняет минимальные действия в виде перемещения плазмы в требующиеся зоны, остальные этапы аппаратура выполняет сама. Поэтому риск врачебной ошибки значительно снижается, данные получаются более достоверными.
- Для определения диагноза недостаточно просто провести 1 анализ. Важна комплексная диагностика, в которую входит сбор анамнеза, общий осмотр, оценка состояния носоглотки у отоларинголога, ПЦР и ИФА исследования.
- Когда пациент получает бланк с результатами анализа, он не может расшифровывать их самостоятельно.
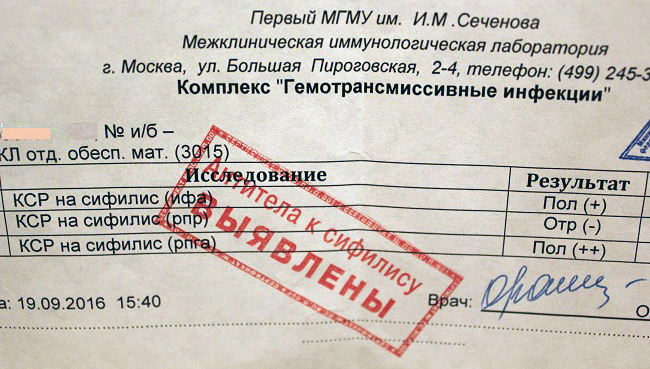 На листах указана только концентрация иммуноглобулина. Не каждый человек сможет понять, что это значит. Поэтому для расшифровки обращаются к инфекционисту, пульмонологу, терапевту, педиатру или другому врачу, который выдал направление на исследование.
На листах указана только концентрация иммуноглобулина. Не каждый человек сможет понять, что это значит. Поэтому для расшифровки обращаются к инфекционисту, пульмонологу, терапевту, педиатру или другому врачу, который выдал направление на исследование.
Требуется не только правильно провести тест, но и подготовиться к нему по всем этапам. Об этом должен предупредить лечащий врач. Чем раньше сдать анализ, тем выше шанс на полное отсутствие осложнений и быстрое завершение патологии.
Этапы анализа
Для иммуноферментного анализа первоначально требуется забор венозной крови. Только после этого можно приступать к дальнейшим этапам, учитывая все перечисленные правила.
- Забор венозной крови. В назначенное время приходят в кабинет медицинской сестры, которая берет кровь из локтевой ямки. Через иглу она перемещается в небольшую пробирку, на дне которой расположен антикоагулянт. Это вещество, которое не дает сформироваться тромбоцитарному сгустку, поэтому образец продолжительно сохраняется в жидком виде.
 Его сразу же доставляют в лабораторию, где приступают к дальнейшим этапам непосредственного анализа.
Его сразу же доставляют в лабораторию, где приступают к дальнейшим этапам непосредственного анализа. - Центрифугирование. По кругу в прибор вставляют все полученные пробирки, которые прокручивают на 1.000 оборотах. Это требуется для разделения венозной крови на фракцию с форменными элементами и плазму. Второй компонент остается наверху, он полупрозрачный, слегка желтоватый. Именно в плазме сосредоточены антитела, которые требуется подсчитать на оборудовании.
- Перемещение плазмы на планшет. На дне каждой лунки планшета содержится конъюгат. В нем сосредоточены меченые антигены, которые должны войти во взаимосвязь с антителами человека, образовав иммунные комплексы. Достаточно налить 1 мл плазмы в каждую лунку планшета при помощи специального измерительного лабораторного шприца.
- Инкубация. В прибор устанавливают планшет, немного увеличивая температуру до человеческих показателей. Так антитела быстрее соединяются с антигенами, именно эти комплексы требуют подсчета.

- Подсчет на фотокалориметре. После инкубации планшет вставляют в фотокалориметр, который пропускает световые волны через образцы. Как только они достигают комплекса из антигена и антитела, это определяет прибор. В конце он распечатывает бланк, на котором указано точное количество антител IgM.
На бланке будет указано, обнаружены ли антитела против коклюша, какова их концентрация.
Коклюш тяжело переносится большинством пациентов. Важно начать своевременное лечение после подтверждения диагноза при помощи лабораторных тестов, в том числе ИФА. Выявленные иммуноглобулины IgM будут свидетельствовать о наличии патологии в острой стадии.
Расшифровка анализа крови
| Показатели, u/ml | Расшифровка результата |
| Менее 0,9 | Отрицательный ответ |
| 0,9-1,1 | Сомнительный ответ |
| более1,1 | Положительный ответ |
 Положительный результат можно оценивать, как период острого заболевания коклюшем. Если недавно было проведено вакцинирование, то наличие антител может говорить о хорошей выработке иммунитета против заболевания.
Положительный результат можно оценивать, как период острого заболевания коклюшем. Если недавно было проведено вакцинирование, то наличие антител может говорить о хорошей выработке иммунитета против заболевания.Отрицательный результат можно трактовать, как норму. Однако при нарастании симптомов исследование необходимо переделать, так как отсутствие антител может быть связано со слабым иммунным ответом, а также с низким титром в связи с начальной стадией заболевания.
Сдача анализа является необходимой мерой для выбора эффективной тактики лечения. Коклюш является серьезным заболеванием, поэтому при первых симптомах нужно обратиться к лечащему доктору.
Сбор образцов и диагностическое тестирование
- Сбор образцов
- Диагностическое исследование
Ученые считают культуру золотым стандартом , поскольку это единственный метод, обеспечивающий 100% специфичность для Bordetella per кашель идентификация. Другие тесты, которые могут быть выполнены, включают полимеразную цепную реакцию (ПЦР) и серологию.
Другие тесты, которые могут быть выполнены, включают полимеразную цепную реакцию (ПЦР) и серологию.
Сбор образцов
Получение мазка или аспирата из носоглотки (НГ)
Определить, у кого коклюш, бывает сложно. Когда это возможно, клиницисты должны получить мазок из носоглотки или аспирацию от всех лиц с подозрением на коклюш. Правильно полученный мазок или аспират из носоглотки необходим для получения оптимальных диагностических результатов. Один и тот же образец можно использовать как для посева, так и для ПЦР.
Видео тестирования на коклюш: сбор клинического образца аспирата из носоглотки
(4:14 минут, дата выпуска: 14.02.2011)
В этом видео демонстрируются правильные методы сбора и транспортировки клинического образца коклюша из задней части носоглотки, полученного путем аспирации.
Надлежащая техника получения образца NP для выделения
Диагностическое тестирование
Клиницисты обычно используют несколько типов лабораторных тестов для диагностики Bordetella pertussis . Ученые считают культуру золотым стандартом , потому что это единственный 100% специфический метод идентификации. Другие тесты, которые могут быть выполнены, включают ПЦР и серологию.
Ученые считают культуру золотым стандартом , потому что это единственный 100% специфический метод идентификации. Другие тесты, которые могут быть выполнены, включают ПЦР и серологию.
Посев
- Использовать в течение первых 2 недель после начала кашля; снижается чувствительность и увеличивается риск ложноотрицательных результатов через 2 недели
- Золотой стандарт диагностики коклюша; единственный 100% специфический метод идентификации
Поскольку культура обладает высокой специфичностью, она особенно полезна для подтверждения диагноза коклюша при подозрении на вспышку. Многие другие респираторные патогены имеют клинические симптомы, сходные с симптомами коклюша, и встречаются сопутствующие инфекции. Получение изолятов из культуры позволяет идентифицировать штаммы и тестировать устойчивость к противомикробным препаратам. Определение штаммов 
Сроки сбора образцов для посева
В идеале образцы следует собирать в течение первых 2 недель болезни после начала кашля. Это когда в носоглотке еще присутствуют жизнеспособные бактерии. После первых 2 недель снижается чувствительность и возрастает риск ложноотрицательных результатов.
Если планируется посев, сразу же поместите собранный мазок из NP на планшет или сразу же поместите его в транспортную среду. Лаборанты должны покрыть мазки и аспираты из носоглотки
Посев имеет лучшую специфичность, чем ПЦР, но для получения результатов требуется до 7 дней.
ПЦР
- Использовать в течение 3–4 недель после начала кашля
- Самый экспресс-тест из доступных
ПЦР — это экспресс-тест, обладающий превосходной чувствительностью. Однако ПЦР-тесты различаются по специфичности. Результаты следует интерпретировать вместе с клиническими симптомами и эпидемиологической информацией, а в условиях вспышки должно произойти культуральное подтверждение как минимум одного случая.
Сроки сбора образцов для ПЦР
В идеале вы должны собрать образец в течение первых 3 недель болезни после начала кашля, но ПЦР может дать точные результаты для образцов, собранных до 4 недель. Один и тот же образец можно использовать как для посева, так и для ПЦР. После четвертой недели кашля количество бактериальной ДНК в носоглотке быстро уменьшается, что увеличивает риск получения ложноотрицательного результата.
Использование полимеразной цепной реакции (ПЦР) для диагностики коклюша: передовой опыт
Серология
- Используйте от 2 до 8 недель после начала кашля для достижения оптимальных результатов, но можно использовать до 12 недель после начала кашля
- Может быть проведен намного позже, чем посев и ПЦР, более полезен на более поздних стадиях заболевания
CDC и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) разработали серологический анализ, который был полезен для подтверждения диагноза, особенно во время предполагаемых вспышек коклюша..gif)
На коммерческой основе в США используется несколько различных серологических тестов с недоказанной или неизвестной клинической точностью. Центры по контролю и профилактике заболеваний США провели оценку нескольких коммерчески доступных анализов в Соединенных Штатах и обнаружили большие различия между ними в зависимости от используемого антигена или антитела и от того, были ли они откалиброваны по международной эталонной сыворотке. Анализ показал, что наиболее многообещающими являются анализы, в которых измеряются антитела IgG только против коклюшного токсина и которые калибруются по эталонному стандарту.
Сроки сбора образцов для серологического исследования
Для одноточечного серологического теста CDC оптимальное время сбора образцов составляет от 2 до 8 недель после начала кашля, когда титры антител максимальны. Тем не менее, тестирование может быть выполнено на образцах, собранных в течение 12 недель после начала кашля, поскольку серологические тесты более полезны для диагностики на более поздних стадиях заболевания.
Тем не менее, тестирование может быть выполнено на образцах, собранных в течение 12 недель после начала кашля, поскольку серологические тесты более полезны для диагностики на более поздних стадиях заболевания.
Увеличить
Безопасность бактериальной вакцины: биомаркеры вирулентности и аттенуации Bordetella Pertussis (коклюша) и бактерий сибирской язвы
Главный исследователь: Э. Скотт Стибиц, доктор философии
Офис/отдел/лаборатория: OVRR/DBPAP/LESTD
Общий обзор
Наша лаборатория изучает болезнетворные бактерии, для которых разрабатывается новая вакцина и новые терапевтические подходы разрабатываются.
Мы разрабатываем новые способы изучения респираторных инфекций, вызываемых бактерией Bordetella pertussis (коклюша), и механизмов, с помощью которых она вызывает тяжелое заболевание. Хотя вакцина против этого микроорганизма существует, число случаев коклюша в США продолжает расти, что делает это исследование жизненно важным для окончательного контроля.
Мы также поддерживаем разработку и оценку вакцин против золотистого стафилококка, который ежегодно вызывает множество инфекций в США, некоторые из которых являются чрезвычайно серьезными (например, «плотоядные» бактерии, которые могут вызвать смерть в течение нескольких часов). . S. aureus также вызывает инфекции имплантированных устройств, таких как кардиостимуляторы и протезы суставов, которые очень трудно лечить без удаления устройства. В настоящее время вакцины против этого заболевания не существует, и разработка новых вакцин против этого микроорганизма особенно важна из-за проблем с устойчивостью к антибиотикам, типичным примером которых является MRSA (метициллин-резистентный Staphylococcus aureus), и новые штаммы внебольничного MRSA (CA-MRSA).
Мы также изучаем живые биотерапевтические продукты (например, пробиотики — живые микроорганизмы, которые приносят пользу здоровью человека при употреблении в соответствующих количествах), чтобы помочь в лечении и профилактике бактериальных инфекций и других заболеваний. Исследование полного потенциала этих многообещающих продуктов в настоящее время сдерживается трудностями в оценке производственного процесса, чистоты, безопасности и качества этих продуктов. Мы стремимся решить эту проблему, разрабатывая более совершенные тесты на чистоту и безопасность пробиотиков, что позволяет проводить их дальнейшее тестирование и разработку в клинике.
Исследование полного потенциала этих многообещающих продуктов в настоящее время сдерживается трудностями в оценке производственного процесса, чистоты, безопасности и качества этих продуктов. Мы стремимся решить эту проблему, разрабатывая более совершенные тесты на чистоту и безопасность пробиотиков, что позволяет проводить их дальнейшее тестирование и разработку в клинике.
Также нацелены на диарейные заболевания. Мы изучаем возможность использования живого аттенуированного штамма Salmonella Ty21a в качестве платформы для индукции защитных иммунных реакций против других серьезных заболеваний, таких как шигеллез. Мы также изучаем способы более полного понимания некоторых еще не охарактеризованных генетических основ аттенуации у Ty21a, а также придания благоприятных признаков, таких как кислотоустойчивость. Мы также стремимся понять, почему некоторые бактериальные патогены, такие как шигеллы, могут вызывать артрит, и тестируем новые подходы к вакцинам против шигелл, чтобы контролировать это смертельное заболевание.
Еще одна серьезная проблема здравоохранения во всем мире и возникающая проблема в США – туберкулез – находится в отдельном классе с точки зрения сложности его изучения, его общей важности, его устойчивости к вакцинным вмешательствам на сегодняшний день и угрозы, связанной с устойчивостью к антибиотикам. Наша лаборатория работает над разработкой и внедрением новых способов оценки полезности вакцин-кандидатов, включая разработку моделей на животных и тестов in vitro для измерения реакции хозяина.
Малярия, хотя и не является бактериальным заболеванием, имеет огромное бремя во всем мире. Недавнее увлекательное исследование приблизило нас к созданию полезной противомалярийной вакцины. Наша лаборатория изучает биомаркеры тяжелой формы малярии, чтобы как лучше понять переменные, которые могут привести к трагическим исходам, так и лучше оценить, как современные вакцины-кандидаты контролируют болезнь и инфекцию.
Научный обзор
Наша лаборатория использует генетический подход к изучению бактериального патогенеза и разработке вакцин.
В наших исследованиях Bordetella pertussis мы вводим специфические мутации, влияющие на экспрессию и регуляцию факторов вирулентности, таких как токсины и адгезины. Затем мы проверяем влияние этих мутаций на мышиной модели респираторной инфекции, в которой используется биолюминесцентная B. pertussis для отслеживания инфекции без причинения вреда подопытному животному. Этот подход имеет несколько преимуществ по сравнению с более старыми методами, которые предусматривают умерщвление группы подопытных животных в каждый момент времени, и резко сокращает количество животных, которые необходимо использовать.
Наш подход к изучению патогенеза Bacillus anthracis также был в значительной степени генетическим. Мы разработали и недавно улучшили новые генетические инструменты для введения в этот организм определенных мутаций. Эти инструменты, которые в настоящее время широко используются во всем мире, значительно проще и мощнее, чем предыдущие подобные методы. Они также допускают последовательную делецию или мутацию неограниченного числа генов. Этот подход имел решающее значение для наших исследований стабильности вакцины против сибирской язвы. Например, это позволило нам создать улучшенные штаммы организма, используемые для получения защитного антигена (входит в состав токсина сибирской язвы). У этих штаммов отсутствует ряд секретируемых протеаз (в настоящее время до 16 отдельных делеций). Эта характеристика увеличивает выработку защитного антигена и приводит к получению очищенного продукта с повышенной стабильностью.
Этот подход имел решающее значение для наших исследований стабильности вакцины против сибирской язвы. Например, это позволило нам создать улучшенные штаммы организма, используемые для получения защитного антигена (входит в состав токсина сибирской язвы). У этих штаммов отсутствует ряд секретируемых протеаз (в настоящее время до 16 отдельных делеций). Эта характеристика увеличивает выработку защитного антигена и приводит к получению очищенного продукта с повышенной стабильностью.
Наша новая программа по золотистому стафилококку пойдет по тому же пути, объединяя наши генетические возможности с другими исследователями OVRR для оценки новых кандидатов на вакцины и выявления новых кандидатов на факторы вирулентности и вакцинные антигены. Мы также изучаем полезность нового подхода — терапии бактериофагами — для борьбы с устойчивым к антибиотикам S. aureus.
Мы используем бактериофаги для разработки улучшенных тестов для обнаружения патогенов в пробиотических продуктах. Мы планируем использовать исключительную специфичность этих бактериальных вирусов, чтобы целенаправленно уничтожать микроорганизмы продукта, тем самым повышая чувствительность обнаружения посторонних и потенциально вредных бактериальных патогенов, таких как сальмонелла и шигелла. Такие тесты необходимы для обеспечения безопасности этих препаратов, что особенно важно при тестировании в клинических испытаниях у очень больных или пациентов с другими нарушениями.
Такие тесты необходимы для обеспечения безопасности этих препаратов, что особенно важно при тестировании в клинических испытаниях у очень больных или пациентов с другими нарушениями.
Еще одним применением бактериофагов является лечение бактериальных заболеваний. Наша лаборатория инициирует проект по созданию модели на животных для изучения полезности фага при деколонизации хозяина золотистым стафилококком. В случае успеха это могло бы серьезно повлиять на носительство в больницах и значительно улучшить ситуацию там, где опасные штаммы с высоким содержанием антибиотиков, MRSA, наносят большой ущерб.
Публикации
Противомикробные агенты Chemother 2020 Сентябрь 64(9)):e00993-20
Комбинации бактериофагов и антибиотиков для Enterococcus faecium с различной чувствительностью к бактериофагам и даптомицинам.
Morrisette T, Lev KL, Kebriaei R, Abdul-Mutakabbir J, Stamper KC, Morales S, Lehman SM, Canfield GS, Duerkop BA, Arias CA, Rybak MJ
Biologicals 2020 Jul;66:53-61
Человек Семинар по испытаниям с вызовом: сосредоточьтесь на требованиях к качеству агентов по вызову, Ланген, Германия, 22 октября 2019 г.
Бекереджян-Динг И., Ван Молле В., Баай М., Нильс П., Конрад С., ван Дипен А., Форчун С., Гетц К. , Горриндж А., Хофт Д., Джонсон Р.А., Кремснер П., Крут О., Леви Ю., Мецгер В., Эпплинг В., Стибиц С., Талаат К.Р., Томас С., Уайлдфайр А., Якубу Б.Н.
Antimicrob Agents Chemother 2020 Jul;64(7):e00461-20
Стратегия комбинации бактериофагов и антибиотиков: альтернатива против метициллин-резистентных фенотипов Staphylococcus aureus.
Kebriaei R, Lev K, Morrisette T, Stamper K, Abdul-Mutakabbir JC, Lehman S, Morales S, Rybak MJ
PLOS Pathog 2020; и промоторная ДНК ptx сильно активирует транскрипцию генов коклюшного токсина у Bordetella pertussis.
Chen Q, Boucher PE, Stibitz S
Materials 2019 Dec 5;12(24):4052
Полное уничтожение агаровых биопленок на газонах путем систематического размещения гранул сульфата кальция с антибиотиками.
Душан Д.Х., Брукс Дж.Р., Синделдекер Д., Питерс К. В., Ли А, Фаррар Н.Р., Даймонд С.М., Кнехт К.С., Плаут Р.Д., Делури С., Айкен С.С., Лейкок П.А., Салливан А., Грейнджер Дж.Ф., Студли П.
В., Ли А, Фаррар Н.Р., Даймонд С.М., Кнехт К.С., Плаут Р.Д., Делури С., Айкен С.С., Лейкок П.А., Салливан А., Грейнджер Дж.Ф., Студли П.
Вакцина 2019 18 июля; 37 (31): 4256-61
Использование моделей контролируемых инфекций человека (CHIM) для поддержки разработки вакцин: регулятивные соображения США.
Ramanathan R, Stibitz S, Pratt D, Roberts J
mSphere 22 мая 2019 г.; 4(3):e00694-18
Генная эссенциальность и метаболизм in vivo у Bordetella pertussis.
Гоньяр Л.А., Гельбах П.Е., Макдаффи Д.Г., Коппель А.Ф., Чен К., Ли Г., Темпл Л.М., Стибиц С., Хьюлетт Э.Л., Папин Дж.А., Дамрон Ф.Х., Эби Дж.К.
Curr Opin Microbiol 2019 Feb;47:74-81
Регулятор вирулентности BvgASR Bordetella pertussis.
Чен К., Стибиц С.
MBio 8 января 2019 г.; 10 (1): 10: e02491-18
Corynebacterium pseudodiphtheriticum использует компоненты вирулентности Staphylococcus aureus в новой стратегии полимикробной защиты.
Hardy BL, Dickey SW, Plaut RD, Riggins DP, Stibitz S, Otto M, Merrell DS
Front Immunol 9 ноября 2018 г.; 9:2612
формирование зародышевого центра.
Парра М., Ян Дж., Вайтнер М., Деррик С., Ян А., Шмидт Т., Сингх Б., Морено А., Аккоюнлу М.
J Bacteriol 24 сентября 2018 г.; 200(20):e00175-18
Новый промотор, репрессированный Bvg, вызывает vrg-подобную транскрипцию fim3, но не приводит к продукции фимбрий серотипа 3 в режиме Bvg(-) Bordetella коклюш.
Chen Q, Lee G, Craig C, Ng V, Carlson PE Jr, Hinton DM, Stibitz S
Emerg Infect Dis 2018 Apr;24(4):691-9
Авирулентный штамм Bacillus anthracis с мишенями для молекулярного анализа заменитель инактивированных облучением вирулентных спор.
Plaut RD, Staab AB, Munson MA, Gebhardt JS, Klimko CP, Quirk AV, Cote CK, Bur TL, Rossmaier RD, Bernhards RC, Love CE, Berk KL, Abshire TG, Rozak DA, Beck LC, Stibitz S, Гудвин Б.Г. , Смит М.А., Сожаманнан С.
, Смит М.А., Сожаманнан С.
Clin Vaccine Immunol 2017 Dec 5;24(12):e00181-17
Стабильная хромосомная экспрессия O-антигенов Shigella flexneri 2a и 3a в живом векторе пероральной вакцины Salmonella Ty21a.
Дхармасена М.Н., Осорио М., Такеда К., Стибиц С., Копецко Д.Дж.
J Infect Dis 2017 15 ноября;216(10):1264-72
Новый биомаркер гаметоцитов для превосходного молекулярного обнаружения инфекционных резервуаров Plasmodium falciparum.
Essuman E, Grabias B, Verma N, Chorazeczewski JK, Tripathi AK, Mlambo G, Addison EA, Amoah AGB, Quakyi I, Oakley MS, Kumar S
Cell Host Microbe 8 ноября 2017 г .; 22 (5): 653- 66
Воздействие Staphylococcus aureus на кожу вызывает воспаление кожи посредством IL-36-опосредованного Т-клеточного ответа.
Лю Х., Арчер Н.К., Диллен К.А., Ван Ю., Ашбо А.Г., Ортинес Р.В., Као Т., Ли С.К., Кай С.С., Миллер Р.Дж., Маркитто М.С., Чжан Э., Риггинс Д.П., Плаут Р. Д., Стибиц С., Геха Р.С., Миллер ЛС
Д., Стибиц С., Геха Р.С., Миллер ЛС
Genome Announc 2017 Nov 9;5(45):e01231-17
Полногеномные последовательности вариантов Bacillus anthracis Sterne и их мутанты с делецией гена токсина.
Staab A, Plaut RD, Pratt C, Lovett SP, Wiley MR, Biggs TD, Bernhards RC, Beck LC, Palacios GF, Stibitz S, Jones KL, Goodwin BG, Smith MA, Sozhamannan S
J Bacteriol 2017 Oct 17 ;199(22):e00475-17
Активация Bvg-репрессированных генов у Bordetella pertussis с помощью RisA требует перекрестного взаимодействия с некоперонной гистидинкиназой RisK.
Chen Q, Ng V, Warfel JM, Merkel TJ, Stibitz S
MBio 10 октября 2017 г.; 8 (5): e01526-17
Регулон BvgAS Bordetella pertussis.
Мун К., Бонокора Р.П., Ким Д.Д., Чен К., Уэйд Дж.Т., Стибиц С., Хинтон Д.М. как наркотики.
Дрехер-Лесник С.М., Стибиц С., Карлсон П.Е. мл.
Вакцины NPJ 2017 15 июня; 2:17
Защита от ингаляционной сибирской язвы путем иммунизации Salmonella enterica серовара Typhi Ty21a, стабильно продуцирующего защитный антиген Bacillus anthracis.
Sim BKL, Li ML, Osorio M, Wu Y, Wai TT, Peterson JW, James ER, Chakravarty S, Gao LX, Xu R, Natasha KC, Stafford RE, Lawrence WS, Yeager LA, Peel JE, Sivasubramani SK, Чопра А.К., Филиппова С., Хоффман С.Л.
Proc Natl Acad Sci U S A 2017 Feb 21;114(8):E1519-27
Регуляторная система Bordetella PlrSR контролирует активность и вирулентность BvgAS в нижних дыхательных путях.
Bone MA, Wilk AJ, Perault AI, Marlatt SA, Scheller EV, Anthouard R, Chen Q, Stibitz S, Cotter PA, Julio SM
Clin Vaccine Immunol 5 января 2017 г.; 24(1):e00509-16
Тренированный иммунитет и восприимчивость к ВИЧ.
Derrick SC
PLoS One 2016 Dec 2;11(12):e0166814
Молекулярные маркеры радиационно-индуцированного ослабления у внутрипеченочных паразитов Plasmodium falciparum.
Окли М.С., Верма Н., Чжэн Х., Анантараман В., Такеда К., Гао Ю., Майерс Т.Г., Фам П.Т., Махаджан Б., Кумар Н., Сангвеме Д. , Трипати А.К., Мламбо Г., Аравинд Л., Кумар С.
, Трипати А.К., Мламбо Г., Аравинд Л., Кумар С.
Pathog Dis 2016 Nov;74(8):ftw098
Стабильная экспрессия генов O-антигена Shigella dysenteriae серотипа 1, интегрированных в хромосому живого вектора Ty21a для пероральной вакцины Salmonella.
Дхармасена М.Н., Осорио М., Филипова С., Марш С., Стибиц С., Копецко Д.Дж.
PLoS One 27 сентября 2016 г.; вакцина Доставка.
Дхармасена М.Н., Фейль К.М., Старке К.Е., Бхагват А.А., Стибиц С., Копецко Д.Дж.
J Microbiol Methods 2016 Dec;131:7-9
Упрощенный анализ ингибирования роста микобактерий (MGIA) с использованием прямого заражения спленоцитов мыши и системы MGIT.
Ян А.Л., Шмидт Т.Е., Стибиц С., Деррик С.К., Моррис С.Л., Парра М.
Научный представитель, 13 сентября 2016 г.; 6:32774
Многогранный регулон RisA Bordetella pertussis.
Coutte L, Huot L, Antoine R, Slupek S, Merkel TJ, Chen Q, Stibitz S, Hot D, Locht C
Clin Vaccine Immunol 5 июля 2016 г. ; 23(7):638-47
; 23(7):638-47
Индукция нетрадиционных Т-клеток мутантным штаммом БЦЖ, приготовленным в катионных липосомах, коррелирует с защитой от инфекций M.tuberculosis у мышей с ослабленным иммунитетом.
Derrick SC, Yabe I, Morris S, Cowley S
Viruses 2015 Dec 16;7(12):6675-88
Разработка фагового лизина LysA2 для использования в анализах повышенной чистоты живых биотерапевтических продуктов.
Дрехер-Лесник С.М., Шрайер Дж.Е., Штибиц С.
PLoS One 1 декабря 2015 г.; 10(12):e0142758
Усовершенствования системы безмаркерного аллельного обмена для Bacillus anthracis.
Plaut RD, Stibitz S
PLoS One 2015 Oct 27;10(10):e0141141
Коэкспрессия интерлейкина-15 усиливает защитные иммунные реакции, вызванные иммунизацией мышиной малярийной вакциной MVA, кодирующей циркумспорозоитный белок .
Парра М., Лю С., Деррик С.К., Ян А., Молина-Круз А., Бариллас-Мьюри С., МакГаверн Д.