Какие заболевания можно лечить электрофорезом — Клиника Современных Технологий
Какие заболевания можно лечить электрофорезом
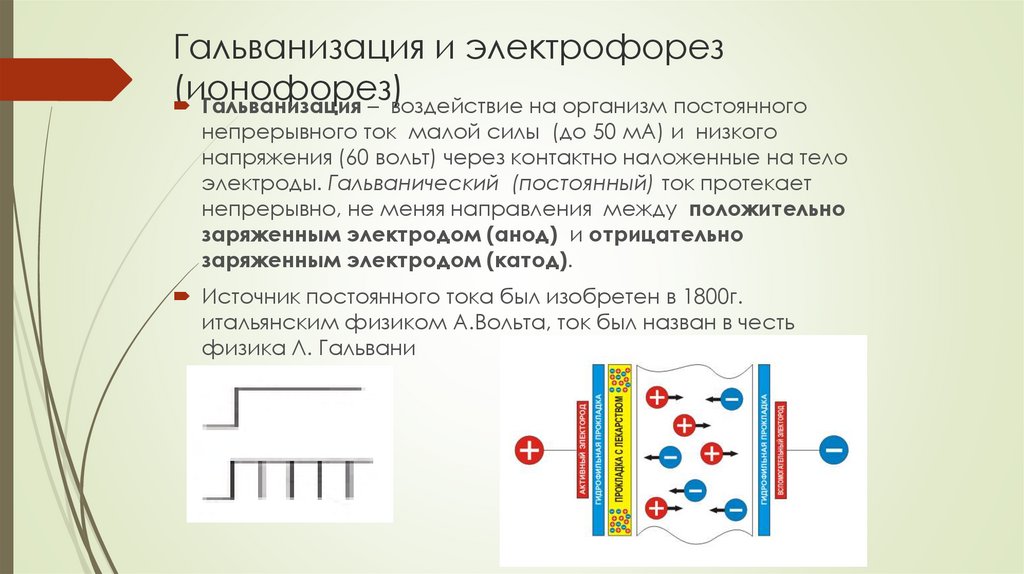
Электрофорез − один из методов физиотерапии, основой которого является воздействие на организм постоянным электрическим током и медицинскими препаратами. Использование электродов позволяет направить ионы лекарственных средств в глубоко расположенные ткани без проведения хирургического вмешательства. Электрофорез − это профилактика заболеваний ОДА (опорно-двигательного аппарата) и их успешное лечение, решение различных проблем со здоровьем.
Особенности проведения и плюсы процедуры
В основу электрофореза положены физические явления. На электроды надеваются специальные тканевые чехлы с нанесённым препаратом. Затем элементы фиксируются в нужной зоне тела, аппарат запускается, начинается перемещение ионов лекарства в ткани. Длительность сеанса − примерно 10-15 минут. Неприятных ощущений не возникает.
Электрофорез используют при лечении артроза, артрита, варикозного расширения вен, заболеваний ЖКТ и многих других болезней. Также физиотерапевтическая методика применяется при восстановлении после травм конечностей, при осложнениях, вызванных хирургическим вмешательством, и т. д.
Плюсы электрофореза:
- прицельная доставка лекарства;
- неинвазивность и безопасность;
- снижение нагрузки на печень за счёт отсутствия необходимости в приёме медикаментов;
- эффективность;
- доступная цена физиотерапии.
У процедуры есть противопоказания, среди которых − беременность, онкология, кожные болезни, сбои кроветворения, аутоиммунные заболевания. Ищете, где пройти курс электрофореза? Записывайтесь в «Клинику современных технологий».
Сеть медицинских центров «Клиника современных технологий» в Хабаровске предоставляет широкий спектр профессиональных медицинских услуг в различных областях, среди которых: кардиология, гастроэнтерология, офтальмология, гинекология, урология и многие другие.
Наши специалисты
Штат «Клиники современных технологий» сформирован из опытных специалистов. Диагностика и лечение проводятся врачами, работающими в таких направлениях, как хирургия, неврология, урология, педиатрия, эндокринология, кардиология и т. д. Несмотря на высокий уровень профессионализма, наши сотрудники продолжают шлифовать свои навыки и знания, регулярно повышают квалификацию. Доверьте своё здоровье опытным врачам!
В «Клинике современных технологий» очень внимательно относятся к формированию штата. У нас работают настоящие профессионалы, которые всегда готовы оказать помощь пациентам. Они смогут найти подход как к взрослому человеку, так и к ребёнку. Точная диагностика, грамотное лечение, успешная реабилитация − всё это возможно при обращении в «Клинику современных технологий». Мы стоим на страже вашего здоровья.
Мы стоим на страже вашего здоровья.
Выберите специализациюВсе специализацииАнгиохирургГастроэнтерологГематологГенетикГинекологДерматовенерологДерматологИммунологКардиологКМНКосметологМассажистНеврологНефрологОнкологОнколог-маммологОртопедОториноларингологОфтальмологПедиатрПсихиатрПсихологПсихотерапевтПульмонологРевматологРепродуктологСемейный врачСтоматологТерапевтТрихологУЗДУрологФизиотерапевтФункциональный диагностХирургЭндокринологЭндоскопист
Найти
Гончаров Александр Валерьевич
Врач хирург, эндоскопист
Ковалева Веста Владимировна
Врач невролог
Панкова Юлия Леонидовна
Оториноларинголог
Монахова Ольга Афанасьевна
Врач акушер-гинеколог, эндокринолог
Мацияс Дарья Владимировна
Отоларинголог
Килихевич Наталья Викторовна
Эндокринолог
Фролова Вероника Львовна
Отоларинголог
Максимова Екатерина Геннадьевна
Терапевт, врач УЗД
Степаненко Елена Юрьевна
Терапевт
Калашникова Юлия Дмитриевна
Массажист
Ермолаева Валентина Александровна
Врач УЗД
Дуплинская Инна Викторовна
Врач офтальмолог
Исаев Геннадий Михайлович
Врач уролог
Сергеев Александр Павлович
Ортопед взрослый
Семенцова Валерия Сергеевна
Эндокринолог, детский эндокринолог
Шкилёв Роман Владимирович
Врач детский уролог, хирург
Ершова Марина Игоревна
Врач педиатр
Воронова Юлия Владимировна
Врач гинеколог-эндокринолог, детский гинеколог, КМН
Старикова Ольга Павловна
Врач гастроэнтеролог, детский гастроэнтеролог
Катарева Марина Валентиновна
Врач детский иммунолог-аллерголог
Бекасова Анжелика Викторовна
Врач детский гематолог
Жирко Елена Вячеславовна
Врач детский кардиолог
Белоусова Анна Вячеславовна
Врач УЗД
Григорьева Анна Фёдоровна
Врач детский кардиолог
Глонин Александр Юрьевич
Врач детский ортопед-травматолог
Панкова Ирина Михайловна
Врач невролог
Тишина Светлана Сергеевна
Врач детский ортопед-травматолог
Глотова Анастасия Александровна
Врач УЗД, педиатр
Родионова Оксана Михайловна
Врач педиатр
Щетинина Светлана Александровна
Врач УЗД, педиатр
Майдурова Галина Михайловна
Врач УЗД, педиатр
Лукманова Оксана Валерьевна
Врач УЗД, кардиолог, терапевт
Мишанина Анастасия Сергеевна
Врач терапевт
Грельо Инна Григорьевна
Врач кардиолог, врач терапевт
Полякова Ольга Григорьевна
Врач кардиолог
Колушкина Ольга Николаевна
Врач УЗД
Баранова Светлана Вячеславовна
Врач онколог-маммолог
Мусянович Марина Геннадьевна
Врач акушер-гинеколог
Баранова Анна Алексеевна
Врач акушер-гинеколог
Канин Виталий Сергеевич
Врач гематолог
Щенников Эрнест Леонидович
Врач пульмонолог
Маркина Ольга Игоревна
Врач пульмонолог, гематолог
Гончар Сергей Александрович
Врач генетик
Кузьминых Ольга Геннадьевна
Врач оториноларинголог
Данилова Татьяна Александровна
Врач ревматолог
Крылова Ирина Евгеньевна
Врач иммунолог-аллерголог, пульмонолог
Луферова Жанна Ивановна
Врач дерматолог, дерматовенеролог, трихолог
Сорокопуд Ольга Петровна
Врач гастроэнтеролог
Пустовит Галина Петровна
Врач косметолог, психолог
Горячкина Татьяна Георгиевна
Косметолог по коррекции фигуры, массажист
Сорокина Евгения Александовна
Врач функциональной диагностики
Галич Юлия Александровна
Врач физиотерапевт
Милая Наталья Валерьевна
Врач педиатр
Овчинникова Ольга Викторовна
Детский невролог, эпилептолог
Сартакова Ольга Леонидовна
Врач эндокринолог
Волкова Алёна Викторовна
Врач офтальмолог
Емешкин Максим Игоревич
Врач ангиохирург- флеболог
Краснова Наталья Александровна
Врач аллерголог-иммунолог
Ромашко Светлана Сергеевна
Врач: Терапевт
Котова Татьяна Владимировна
Врач функциональной диагностики, УЗД
Душелюбова Анна Анатольевна
Офтальмолог
Носова Яна Ивановна
Врач психиатр
Ивлева Наталья Викторовна
Врач невролог, физиотерапевт
Бережанская Екатерина Викторовна
Врач педиатр
Глухова Ольга Петровна
Врач эндоскопист
Корякова Галина Андреевна
Врач УЗД
Сергеева Анна Васильевна
Врач офтальмолог
Чернышёва Александра Андреевна
Врач функциональной диагностики
«Клиника современных технологий» оказывает широкий спектр услуг пациентам всех возрастов. Со стоимостью услуг можно ознакомиться на нашем сайте. Так же на нашем сайте можно оплатить услуги, записаться на прием и задать интересующий вас вопрос.
Со стоимостью услуг можно ознакомиться на нашем сайте. Так же на нашем сайте можно оплатить услуги, записаться на прием и задать интересующий вас вопрос.
Электрофорез — что это? | Стоматология Доктора Манапова
2019-12-10
Электрофорез – это метод физиотерапевтического лечения, при котором в организм вводится лекарственный препарат посредством электрического тока малой силы. В основе данной процедуры лежит применение специальных лекарственных средств, которые способны распадаться на определенные ионы и под воздействием тока направленно проникать вглубь тканей даже через кожные покровы, но на небольшую глубину. Как правило, лекарство попадает в кровь и моментально разносится по всему организму. Кроме того, оно скапливается в органах, на которые непосредственно оказывается воздействие.
Основное показание к лечению электрофорезом – это инфицирование каналов зуба при пульпите, периодонтите, а также кистах и гранулемах. Благодаря целенаправленному введению лекарственного препарата происходит быстрое и эффективное восстановление зубных каналов, уменьшение болевого синдрома, удаление бактерий. После лечения проводится обязательная пломбировка каналов.
После лечения проводится обязательная пломбировка каналов.
Противопоказания:
- аллергические реакции на вводимые препараты
- гнойные воспалительные процессы в организме
- наличие кардиостимулятора
- тяжелая форма бронхиальной астмы
- злокачественные новообразования
- острые заболевания сердечно-сосудистой системы.
Показания:
- кисты и гранулемы
- пульпит – инфицирование каналов зуба
- периодонтит
- болевые ощущения после лечения или удаления зубов
- альвеолит
- стоматит.
Электрофорез в стоматологии: технология
- специальная прокладка смачивается в лекарственном препарате и фиксируется на пораженном участке. Если требуется лечение пульпита, то препарат вводится внутрь зуба, предварительно обрабатываются каналы,
- при помощи специального аппарата, вырабатывающего ток, проводится воздействие на ткань полости рта через прокладку с лекарственным средством.

Длительность одной процедуры – 10-30 минут, проводить их рекомендуется ежедневно или через день. Весь курс занимает от 10 до 20 процедур.
Электрофорез в стоматологии: преимущества
- безболезненность проведения процедуры: возможно лишь незначительное покалывание и жжение,
- быстрое снятие воспалительных процессов внутри канала зуба или в тканях, окружающих его верхушку,
- уменьшение болевого синдрома во время и после лечения различных зубных заболеваний,
- бактерицидное воздействие на ткани,
- целенаправленное введение лекарственного средства, его скопление непосредственно в очаге воспаления,
- минимальный риск развития аллергических реакций на вводимый лекарственный препарат,
увеличение эффективности лекарственных средств: оно медленнее выводится и сохраняется в течение нескольких недель.
Электрофорез в стоматологии: недостатки
- большое количество противопоказаний для проведения лечения.
Электрофорез – это не самостоятельное средство лечения, а, как и любой метод физиотерапии – лишь дополнительный способ восстановления организма при наличии каких-либо заболеваний полости рта. Главное преимущество электрофореза в том, что введение лекарственного препарата в организм происходит целенаправленно, что гораздо более эффективно даже капельниц, внутривенного введения или приема медикамента внутрь. При необходимости возможно выведение лекарственного средства из организма также посредством электрического тока.
Главное преимущество электрофореза в том, что введение лекарственного препарата в организм происходит целенаправленно, что гораздо более эффективно даже капельниц, внутривенного введения или приема медикамента внутрь. При необходимости возможно выведение лекарственного средства из организма также посредством электрического тока.
Что такое гель-электрофорез? – Ваш геном
- Гель-электрофорез — метод, обычно используемый в лабораториях для разделения заряженных молекул, таких как ДНК, РНК и белки, в зависимости от их размера.
- Заряженные молекулы движутся сквозь гель при пропускании через него электрического тока.
- Через гель пропускают электрический ток, так что один конец геля имеет положительный заряд, а другой — отрицательный.
- Движение заряженных молекул называется миграцией. Молекулы мигрируют к противоположному заряду. Таким образом, молекула с отрицательным зарядом будет притягиваться к положительному концу (противоположности притягиваются!).
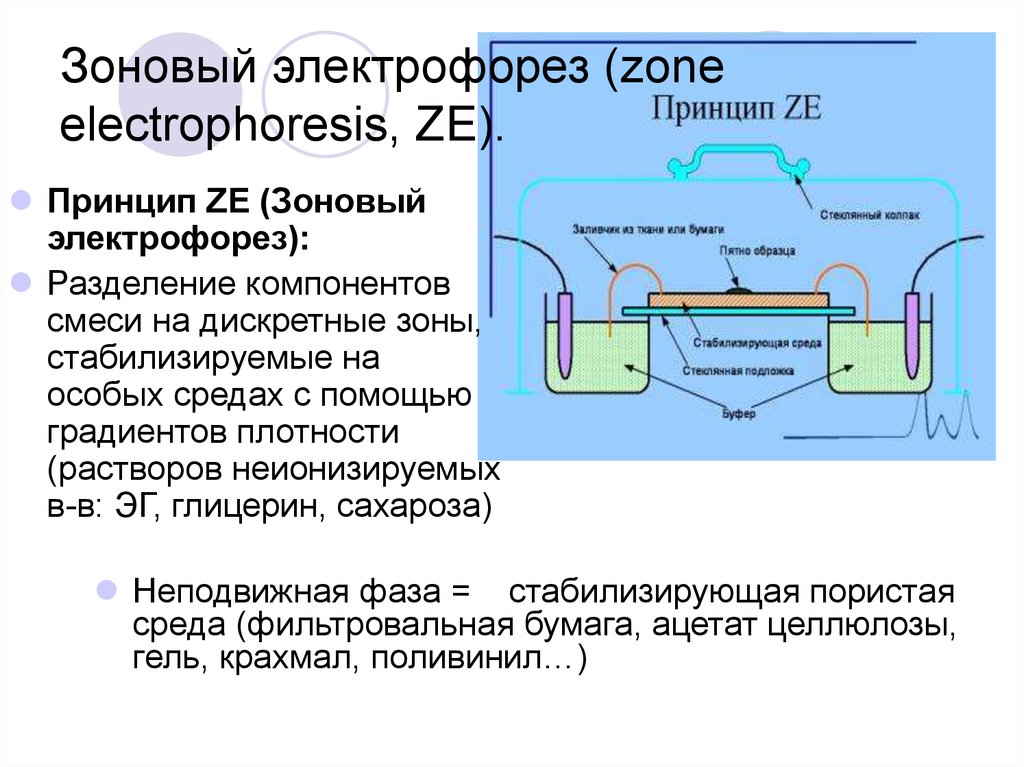
- Гель состоит из проницаемой матрицы, немного похожей на сито, через которую могут проходить молекулы при пропускании через нее электрического тока.
- Меньшие молекулы мигрируют через гель быстрее и, следовательно, перемещаются дальше, чем более крупные фрагменты, которые мигрируют медленнее и, следовательно, преодолевают более короткое расстояние. В результате молекулы разделяются по размеру.
Гель-электрофорез и ДНК
- Электрофорез позволяет различать фрагменты ДНК различной длины. ДНК
- заряжена отрицательно, поэтому при подаче на гель электрического тока ДНК будет мигрировать к положительно заряженному электроду.
- Более короткие нити ДНК проходят через гель быстрее, чем более длинные, в результате чего фрагменты располагаются в порядке их размера.
- Использование красителей, флуоресцентных или радиоактивных меток позволяет увидеть ДНК на геле после того, как они были разделены. Они появятся в виде полос на геле.

- Маркер ДНК с фрагментами известной длины обычно пропускают через гель одновременно с образцами.
- Сравнивая полосы образцов ДНК с полосами маркера ДНК, вы можете определить приблизительную длину фрагментов ДНК в образцах.
Как проводится гель-электрофорез?
Подготовка геля
- Агарозные гели обычно используются для визуализации фрагментов ДНК. Концентрация агарозы, используемой для приготовления геля, зависит от размера фрагментов ДНК, с которыми вы работаете.
- Чем выше концентрация агарозы, тем плотнее матрица и наоборот. Меньшие фрагменты ДНК разделяются при более высоких концентрациях агарозы, в то время как более крупные молекулы требуют более низких концентраций агарозы.
- Чтобы сделать гель, порошок агарозы смешивают с буфером для электрофореза и нагревают до высокой температуры, пока весь порошок агарозы не расплавится.
- Расплавленный гель затем выливают в лоток для заливки геля и на один конец помещают «гребенку», чтобы сделать лунки для пипетки, в которые следует пипетировать образец.

- После того, как гель остынет и затвердеет (теперь он будет непрозрачным, а не прозрачным), расческу снимают.
- Сейчас многие используют готовые гели.
- Затем гель помещают в резервуар для электрофореза и заливают в резервуар буфер для электрофореза до тех пор, пока поверхность геля не будет покрыта. Буфер проводит электрический ток. Тип используемого буфера зависит от приблизительного размера фрагментов ДНК в образце.
Подготовка ДНК к электрофорезу
- Краситель добавляется к образцу ДНК перед электрофорезом для увеличения вязкости образца, что предотвратит его всплывание из лунок и для того, чтобы миграция образца через гель можно увидеть.
- Маркер ДНК (также известный как стандарт размера или лестница ДНК) загружается в первую лунку геля. Фрагменты в маркере имеют известную длину, поэтому их можно использовать для приблизительного определения размера фрагментов в образцах.
- Подготовленные образцы ДНК затем пипетируют в оставшиеся лунки геля.

- Когда это сделано, крышку помещают на емкость для электрофореза, убедившись, что ориентация геля и положительного и отрицательного электродов правильная (мы хотим, чтобы ДНК мигрировала через гель к положительному концу).
Разделение фрагментов
- Затем включается электрический ток, так что отрицательно заряженная ДНК движется через гель к положительной стороне геля.
- Более короткие фрагменты ДНК движутся быстрее, чем более длинные, поэтому перемещаются дальше во время прохождения тока.
- Расстояние, на которое ДНК мигрировала в геле, можно оценить визуально, наблюдая за миграцией красителя загрузочного буфера.
- Электрический ток остается включенным достаточно долго, чтобы гарантировать, что фрагменты ДНК перемещаются достаточно далеко по гелю, чтобы разделить их, но не настолько долго, чтобы они сбежали с конца геля.
Иллюстрация оборудования для электрофореза ДНК, используемого для разделения фрагментов ДНК по размеру.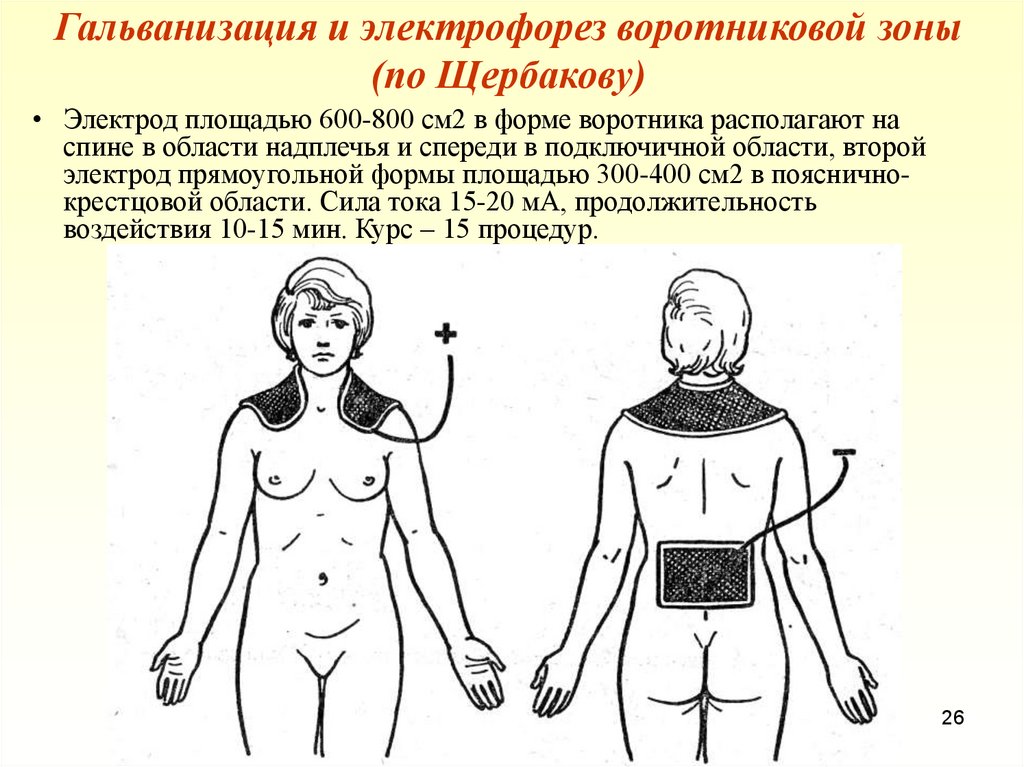 Гель находится в резервуаре с буфером. Образцы ДНК помещают в лунки на одном конце геля, и через гель пропускают электрический ток. Отрицательно заряженная ДНК движется к положительному электроду.
Гель находится в резервуаре с буфером. Образцы ДНК помещают в лунки на одном конце геля, и через гель пропускают электрический ток. Отрицательно заряженная ДНК движется к положительному электроду.
Изображение предоставлено: Genome Research Limited
Визуализация результатов
- Как только ДНК достаточно далеко мигрировала по гелю, отключается электрический ток и гель удаляется из резервуара для электрофореза.
- Для визуализации ДНК гель окрашивают флуоресцентным красителем, который связывается с ДНК, и помещают на ультрафиолетовый трансиллюминатор, который показывает окрашенную ДНК в виде ярких полос.
- В качестве альтернативы краситель можно смешать с гелем перед его заливкой.
- Если гель работает правильно, будет виден рисунок полос ДНК-маркера/стандарта размера.
- Затем можно судить о размере ДНК в образце, представляя себе горизонтальную линию, пересекающую полосы ДНК-маркера. Затем вы можете оценить размер ДНК в образце, сопоставив их с ближайшей полосой маркера.

Иллюстрация, показывающая полосы ДНК, разделенные на геле. Длину фрагментов ДНК сравнивают с маркером, содержащим фрагменты известной длины.
Последнее обновление этой страницы 21 июля 2021 г.
Электрофорез — StatPearls — NCBI Bookshelf
Введение
В 1937 году биохимик из Швеции Тиселиус продемонстрировал, что частицы, обладающие зарядом, можно разделить на основе их заряда с помощью электрического поля. Различные биомолекулы, такие как белки, пептиды, нуклеиновые кислоты, нуклеотиды и др., также обладают электрическим зарядом. При приложении электрического поля они мигрируют к аноду или катоду в зависимости от их суммарного заряда. Электрофорез определяется как миграция электрически заряженных молекул под действием электрического поля.[1]
Тизелиус использовал жидкую среду с меньшим разрешением из-за эффекта гравитации и диффузии. В электрофорезе используются твердые опорные среды с буферами для преодоления этих препятствий. Молекулы с одинаковым зарядом, массой, формой и размером стремятся двигаться вместе и разделяются на отдельные полосы или зоны. Примерами таких твердых носителей являются фильтровальная бумага Whatman, агароза, ацетат целлюлозы, полиакриламид и т. д. [1].
Молекулы с одинаковым зарядом, массой, формой и размером стремятся двигаться вместе и разделяются на отдельные полосы или зоны. Примерами таких твердых носителей являются фильтровальная бумага Whatman, агароза, ацетат целлюлозы, полиакриламид и т. д. [1].
Основные компоненты аппарата для электрофореза: См. носитель 1 (рисунок 1): Принципиальная схема аппарата для электрофореза.
Функции каждого компонента аппарата для электрофореза
Буфер : Пропускает ток и поддерживает pH среды.
Фитили : соединяет опорную среду с буфером для замыкания цепи.
Поддерживающая среда : Обеспечивает матрицу, в которой происходит разделение.
Крышка : Уменьшает испарение буфера и предотвращает загрязнение во время электрофореза.
Источник питания: Создает электрическое поле для движения заряженных частиц.
Денситометр: Количественное определение разделенных полос осуществляется путем сравнения оптической плотности полос.

Факторы, влияющие на электрофоретическую подвижность молекулы
Размер, форма и суммарный заряд молекулы
Подвижность обратно пропорциональна размеру молекулы и прямо пропорциональна суммарному заряду молекулы. Глобулярные белки имеют компактную структуру, поэтому они обладают большей подвижностью, чем волокнистые белки аналогичной молекулярной массы.[2]
Частицы с отрицательным зарядом (анионы) всегда движутся в направлении положительного полюса, тогда как частицы с положительным зарядом (катионы) всегда движутся в направлении отрицательного полюса. При проведении гель-электрофореза положительный полюс относится к аноду, а отрицательный полюс относится к катоду. В результате заряженные частицы будут перемещаться в подходящие для них узлы [например, анионы мигрируют от катода (-) к аноду (+)].[2]
Сила электрического поля
Подвижность прямо пропорциональна градиенту потенциала (напряжению) и обратно пропорциональна сопротивлению.

Буфер
Буферные функции для проведения тока и поддержания pH среды. Оптимальная ионная сила буфера необходима, так как более высокая ионная сила увеличивает долю тока, переносимого ионами буфера, и замедляет миграцию образца. Он также производит большое количество тепла, что приводит к увеличению диффузии разделительных полос. При этом низкая ионная сила буфера также снижает разрешающую способность из-за снижения общего тока, проходящего через среду.
Ионизация молекул, таких как белки, аминокислоты и т. д., зависит от рН среды. Изменение pH среды может изменить направление и скорость миграции.[2]
Поддерживающая среда
Среда, обладающая сродством к молекулам в образцах, может снизить скорость миграции и уменьшить разрешение разделения. Размер пор в опорной среде обратно пропорционален концентрации геля. Регулировка размера пор в соответствии со свойствами интересующей молекулы необходима для оптимального разрешения.
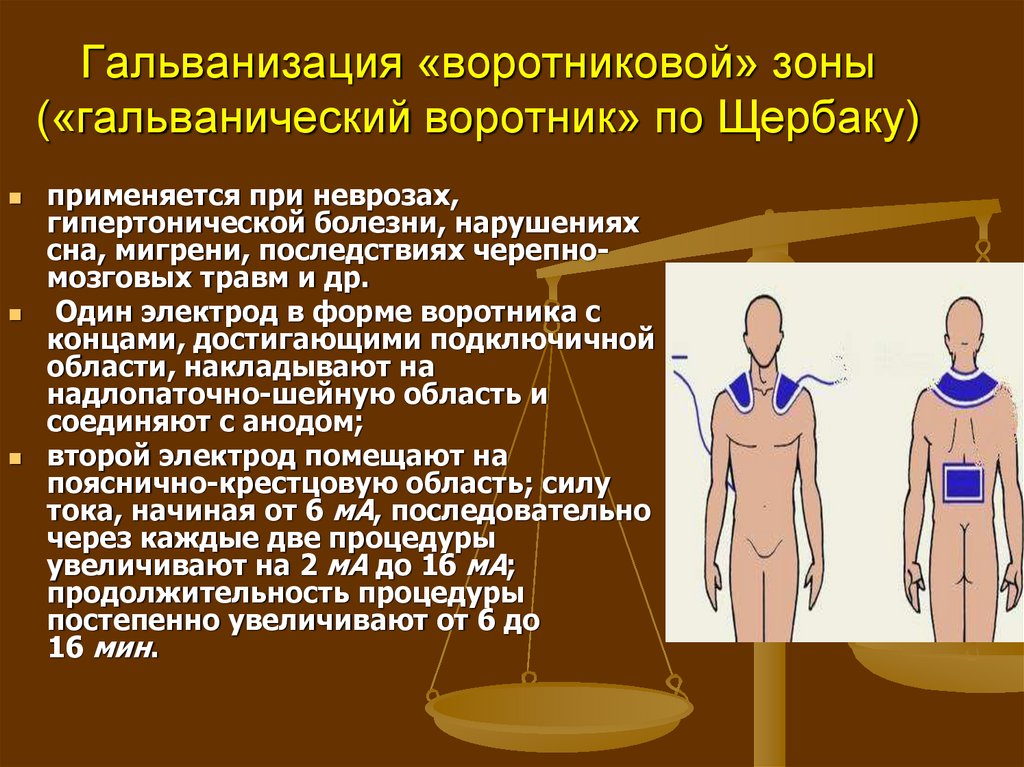
Фиксированные группы, такие как сульфат, ионизируются и приобретают отрицательный заряд при щелочном или нейтральном pH. Под действием электрического поля ионы HO, связанные с этими отрицательно заряженными группами, начинают мигрировать к катоду. Это движение препятствует движению образца к аноду и может снизить разрешение разделения. Этот эффект известен как электроэндосмос. Его можно уменьшить, используя сверхчистый агарозный гель с низким содержанием сульфатов.[3]
Типы опорной среды
Различные типы поддерживающей среды и буферов используются для эффективного разделения различных типов молекул.
Фильтровальная бумага Whatman: Фильтровальная бумага Whatman используется в качестве опорной среды. Поскольку для разделения требуется длительное время работы (12–16 часов) и низкое напряжение, разрешение плохое из-за повышенной диффузии разделенных аналитов.
Ацетат целлюлозы: Мембрана из ацетата целлюлозы является одной из предпочтительных твердых сред, поскольку она требует меньшего времени работы (<1 часа). Благодаря этому разрешение разделенных полос намного превосходит электрофорез на бумаге. Хотя это дорого, оно широко используется для разделения липопротеинов, белков, изоформ ферментов и вариантов гемоглобина из-за превосходного разрешения и меньшего взаимодействия с аналитами в образце.
Благодаря этому разрешение разделенных полос намного превосходит электрофорез на бумаге. Хотя это дорого, оно широко используется для разделения липопротеинов, белков, изоформ ферментов и вариантов гемоглобина из-за превосходного разрешения и меньшего взаимодействия с аналитами в образце.
Агарозный гель: Агароза представляет собой разновидность гетерополисахарида. Он образует вязкий раствор при растворении в горячем забуференном растворе (от 50 до 55 градусов по Цельсию), но затвердевает в виде геля при охлаждении. Он используется для разделения белков сыворотки, гемоглобина, нуклеиновых кислот, продуктов полимеразной цепной реакции и т. д. Фиксированные сульфатные группы, присутствующие в агарозе, могут снижать разрешение полос из-за усиления электроэндосмоса. Этого можно избежать, используя сверхчистый агарозный гель с низким содержанием сульфатов.[5][7]
Полиакриламидный гель : Образуется в результате полимеризации акриламида и бис-акриламида в присутствии персульфата аммония, N,N,N’N’-тетраметилэтилендиамина (TEMED) и рибофлавина в присутствии ультрафиолетовых (УФ) лучей. Размер пор геля можно очень хорошо контролировать, регулируя концентрацию мономеров. Этот гель можно использовать для широкого спектра аналитов, таких как белки, пептиды, нуклеиновые кислоты, нуклеотиды и т. д. Он может обеспечить отличное разрешение благодаря лучшему молекулярному ситу и минимальному взаимодействию молекул образца с матрицей.[5][8]
Размер пор геля можно очень хорошо контролировать, регулируя концентрацию мономеров. Этот гель можно использовать для широкого спектра аналитов, таких как белки, пептиды, нуклеиновые кислоты, нуклеотиды и т. д. Он может обеспечить отличное разрешение благодаря лучшему молекулярному ситу и минимальному взаимодействию молекул образца с матрицей.[5][8]
При кратковременном кипячении белкового раствора в присутствии додецилсульфата натрия (ДСН) и меркаптоэтанола белки в растворе денатурируются и приобретают равномерный отрицательный заряд, маскирующий собственный заряд белка. Это дает полипептидные цепи с постоянным отношением заряда к массе однородной формы. В этом состоянии электрофоретическая подвижность будет зависеть от количества аминокислот и массы полипептидных цепей.[5][9]
Другие варианты электрофореза
Изоэлектрическое фокусирование (ИЭФ): Матрица геля заполняется амфолитами (молекулами как с положительным, так и с отрицательным зарядом) и формируется градиент pH. При подаче электричества молекулы мигрируют к своему изоэлектрическому pH. Подвижность молекул образца прекращается при их соответствующем изоэлектрическом рН, когда суммарный заряд молекулы образца будет равен нулю. IEF может обеспечить отличное разрешение и фракционирование белков сыворотки и вариантов гемоглобина.[5][10]
При подаче электричества молекулы мигрируют к своему изоэлектрическому pH. Подвижность молекул образца прекращается при их соответствующем изоэлектрическом рН, когда суммарный заряд молекулы образца будет равен нулю. IEF может обеспечить отличное разрешение и фракционирование белков сыворотки и вариантов гемоглобина.[5][10]
Иммуноэлектрофорез и иммунофиксационный электрофорез: Сначала белки разделяют на агарозном геле. После разделения создаются лунки и добавляются специфические антитела против интересующих молекул. Образуются полосы преципитации за счет реакции антиген-антитело, что свидетельствует о наличии в образце специфического белка. Он используется для выявления аномального повышения фракций гамма-глобулина и свободных легких цепей у пациентов с подозрением на моноклональную или поликлональную гаммапатию.[11]
Высоковольтный электрофорез: Для разделения используется относительно более высокое напряжение (от 400 до 2000 Вольт) вместо 250 Вольт. Он обеспечивает очень быстрое разделение с хорошим разрешением и относительно меньшей диффузией. Он используется для разделения белков, гемоглобина и нуклеотидов.[5]
Он обеспечивает очень быстрое разделение с хорошим разрешением и относительно меньшей диффузией. Он используется для разделения белков, гемоглобина и нуклеотидов.[5]
Электрофорез в импульсном поле: Разделение длинных нуклеотидных фрагментов с хорошим разрешением при обычном электрофорезе затруднено. При электрофорезе в импульсном поле ток попеременно пропускают в двух разных направлениях, что приводит к движению фрагментов в двух направлениях, обеспечивая хорошее разделение с оптимальным разрешением.[12]
Капиллярный электрофорез: Капиллярная трубка очень малого диаметра, заполненная буферным раствором, амфолитами или гелем, используется в качестве поддерживающей среды. Из-за наличия большей площади поверхности для отвода тепла можно применять очень высокое напряжение для быстрого разделения и лучшего разрешения. Количество разделенных фракций можно определять одновременно, когда они проходят через детектор во время электрофоретического анализа.[13]
2-мерный (2D) электрофорез: Первоначально проводится изоэлектрическое фокусирование (ИЭФ) для разделения аналитов на основе их изоэлектрического рН. Затем гель, содержащий разделенные аналиты, подвергают электрофорезу в SDS-полиакриламидном геле в направлении 90 градусов для запуска IEF. Молекулы с одинаковой молекулярной массой можно разделить с помощью этого метода из-за различий в их изоэлектрическом рН. [5] [10]
Затем гель, содержащий разделенные аналиты, подвергают электрофорезу в SDS-полиакриламидном геле в направлении 90 градусов для запуска IEF. Молекулы с одинаковой молекулярной массой можно разделить с помощью этого метода из-за различий в их изоэлектрическом рН. [5] [10]
Требования к образцам и процедура
В зависимости от типа электрофореза и вовлеченного заболевания требования к образцам и их обработка различаются. Сыворотка, плазма, цельная кровь и гемолизат являются наиболее часто используемыми биологическими образцами в диагностических лабораторных установках.
Экстракты нуклеиновых кислот или белков из тканевых или клеточных лизатов, продукты полимеразной цепной реакции (ПЦР), продукты экспериментов по секвенированию и т. д. — это образцы, используемые в исследовательских лабораториях, работающих в области молекулярной биологии, геномики и протеомики.[5]
Процедуры тестирования
Подтверждение деталей образца с помощью формы заявки на тестирование. Первоначальная обработка образца осуществляется в соответствии с требованиями процедуры.
Первоначальная обработка образца осуществляется в соответствии с требованиями процедуры.
Сыворотку или плазму можно отделить центрифугированием от обычных флаконов или флаконов, содержащих антикоагулянт. Сыворотка и плазма используются для оценки и количественного определения белковых фракций для диагностики нарушений, связанных с их синтезом или удалением. Гемолизат можно приготовить с использованием буферов и образцов цельной крови из флакона, содержащего антикоагулянт. Гемолизат используется для оценки и количественного определения фракций гемоглобина для диагностики гемоглобинопатий и талассемии.[14]
Экстракты нуклеиновых кислот и продукты ПЦР можно использовать после их смешивания с сахарозой, буфером и трекинговым красителем. После настройки инструментов и геля наносится образец и включается электропитание. Когда отслеживающий краситель завершает прогон примерно 80% геля, подача электроэнергии отключается, и разделение полос количественно оценивается с помощью денситометрии.
Мешающие факторы
Основными мешающими факторами являются тепло, неспецифические адсорбционные группы на несущей среде и электроэндосмос. По мере увеличения силы тока и продолжительности электрофореза температура геля увеличивается за счет отвода тепла. Это увеличит случайное движение молекул в среде, снизив резкость/разрешение разделенных полос.
Неспецифические адсорбционные группы, присутствующие на опорной среде, приводят к связыванию аналитов с этими группами и затрудняют их подвижность в геле. Как описано ранее, электроэндосмос генерирует поток ионов, противоположный направлению движения аналитов, что приводит к снижению разрешения [16].
Результаты, отчетность и важные выводы
После завершения электрофореза гель окрашивается на интересующий аналит. После инкубации с окрашивающим раствором избыток красителя удаляют, обрабатывая гель раствором для обесцвечивания.
После окрашивания гель визуализируют с помощью света с подходящей длиной волны и количественно определяют оптическую плотность каждой отдельной полосы с помощью денситометрии.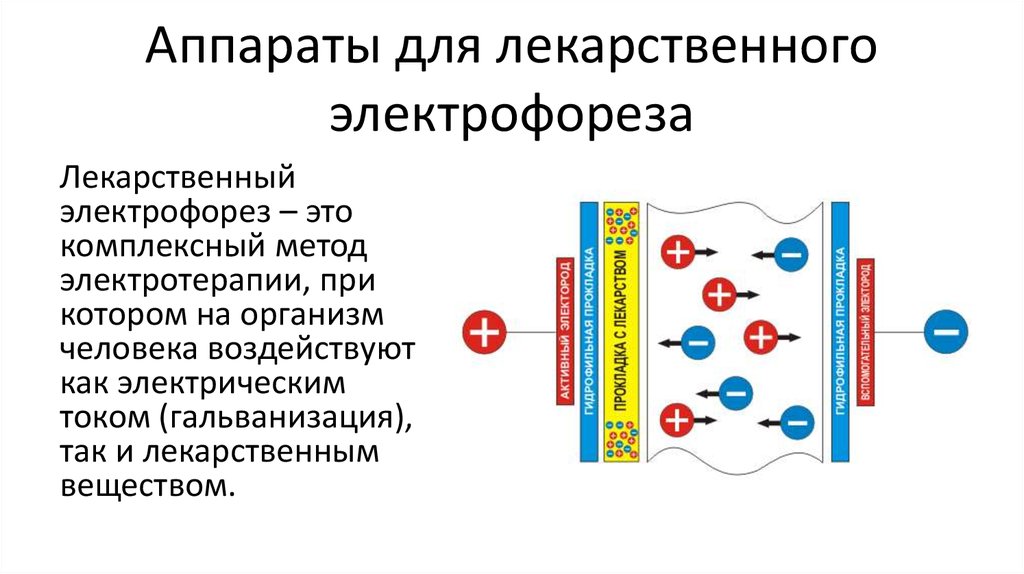 Оптическая плотность каждой отдельной полосы будет пропорциональна концентрации окрашенного аналита, присутствующего в этой полосе. Отчет содержит процентную долю каждого окрашенного аналита в образце.
Оптическая плотность каждой отдельной полосы будет пропорциональна концентрации окрашенного аналита, присутствующего в этой полосе. Отчет содержит процентную долю каждого окрашенного аналита в образце.
В следующей таблице показаны красители, используемые для различных аналитов.[17][18]
Стол
Ponceau S, синий камасси 250, морилка серебром, черный амидо
Аномальная электрофоретическая картина электрофореза сыворотки или гемоглобина может насторожить клинициста, чтобы он акцентировал внимание на выявлении аномальной фракции белка или гемоглобина в образце пациента. Критический анализ электрофоретических паттернов может помочь клиницисту диагностировать основное заболевание, которое привело к аномальному аналиту или отсутствию нормального аналита в конкретном случае.
Клиническое значение
Среда 2 (рисунок 2) показывает аномальные электрофоретические картины гемоглобина при различных гемоглобинопатиях и талассемии. Сравнение аномальной фракции с контрольным образцом помогает клиницисту сузить диагностику гемоглобинопатии и талассемии.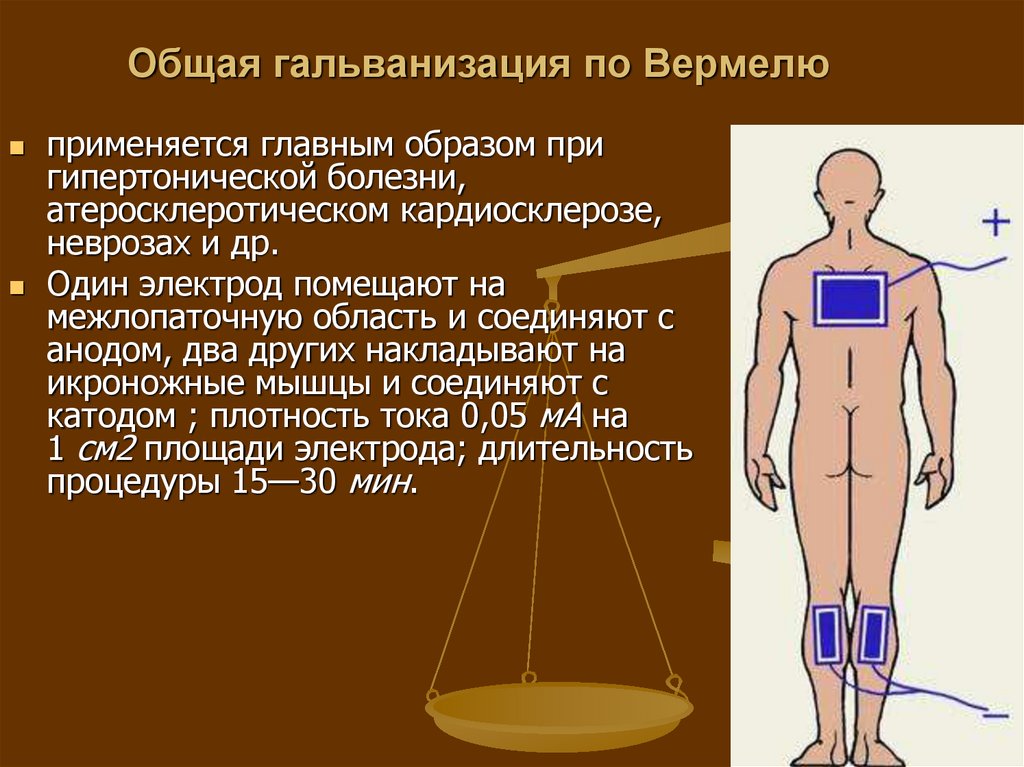 В следующей таблице показана интерпретация электрофоретических паттернов гемоглобина, показанных в Среде 2 (рис. 2) [19].][20]
В следующей таблице показана интерпретация электрофоретических паттернов гемоглобина, показанных в Среде 2 (рис. 2) [19].][20]
Наличие аномальных полос или затухание нормальной полосы при электрофорезе белков сыворотки может дать врачу представление о текущем патологическом процессе. В следующей таблице показано основное содержимое зоны электрофореза белков сыворотки крови (pH – 8,6) [21].
В следующей таблице показаны состояния, связанные с нарушением электрофоретического профиля белков сыворотки. [21][22]
Табл. плазмоклеточный лейкоз. (подробнее…)
Метод электрофореза также можно использовать для выявления аномально повышенных или пониженных изоформ ферментов. Различные клинические состояния демонстрируют специфические ферментативные паттерны, основанные на поражении тканей/органов, что может помочь клиницисту поставить диагноз и разработать план лечения для данного случая. В следующей таблице показано тканевое происхождение различных изоформ некоторых нефункциональных ферментов плазмы, имеющих клиническое значение.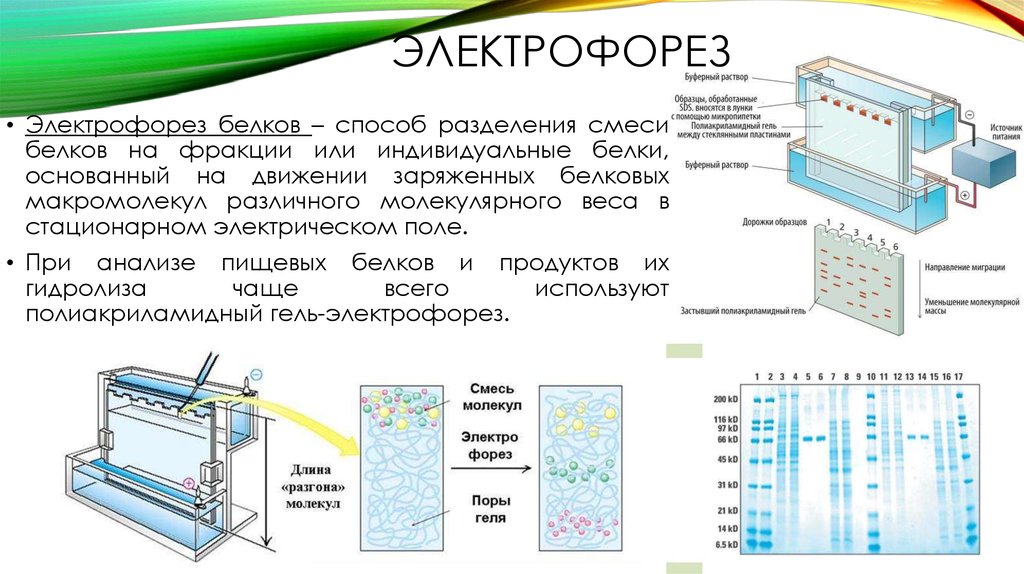
Полезность электрофореза не ограничивается диагностикой. Он широко используется для исследований в области геномики и протеомики. Полиморфизм длины рестрикционных фрагментов (ПДРФ), секвенирование нуклеотидов, секвенирование следующего поколения, саузерн-блоттинг, вестерн-блоттинг и т. д. являются примерами нескольких методов, одним из этапов которых является электрофорез. Отпечатки пальцев ДНК — это метод, используемый судебно-медицинскими экспертами для сравнения ДНК, полученной с места преступления, и ДНК подозреваемых и/или жертв. ДНК-дактилоскопия также используется для подтверждения биологических родителей ребенка в случае спора.[26]
Контроль качества и лабораторная безопасность
Имеющиеся в продаже контроли используются для сравнения движения интересующего аналита. Они широко используются для гемоглобина, белка сыворотки и электрофореза нуклеиновых кислот.
Необходимо соблюдать осторожность при приготовлении геля для электрофореза, приготовлении буфера, настройке аппарата, проведении электрофореза, окрашивании и визуализации аналита. Мономеры, используемые в препарате полиакриламидного геля, являются канцерогенными. Катализатор, используемый в приготовлении полиакриламидного геля, при контакте с ним может вызвать повреждение кожи, связанное со свободными радикалами. Ни один из растворов не следует пипетировать ртом. Барбиталовый буфер, содержащий барбитурат натрия, является известным депрессантом центральной нервной системы. Бромид этидия, используемый для окрашивания нуклеиновых кислот, является известным канцерогеном. Прямое воздействие на глаза ультрафиолетовых лучей во время визуализации геля может привести к серьезному повреждению глаза.[27]
Мономеры, используемые в препарате полиакриламидного геля, являются канцерогенными. Катализатор, используемый в приготовлении полиакриламидного геля, при контакте с ним может вызвать повреждение кожи, связанное со свободными радикалами. Ни один из растворов не следует пипетировать ртом. Барбиталовый буфер, содержащий барбитурат натрия, является известным депрессантом центральной нервной системы. Бромид этидия, используемый для окрашивания нуклеиновых кислот, является известным канцерогеном. Прямое воздействие на глаза ультрафиолетовых лучей во время визуализации геля может привести к серьезному повреждению глаза.[27]
Улучшение результатов работы команды здравоохранения
Диагностика состояния здоровья с помощью электрофореза оптимально выполняется и используется межпрофессиональной командой, в которую входят специалисты по внутренним болезням, биохимии и лабораторной медицине, а также медсестры и лаборанты.
Клиническая корреляция анамнеза пациента, осмотра и других исследований с картиной электрофореза может помочь клиницисту сузить круг до конкретного диагноза. Конкретная диагностика клинического состояния помогает лечащему врачу разработать план лечения в соответствии с основной патологией.
Конкретная диагностика клинического состояния помогает лечащему врачу разработать план лечения в соответствии с основной патологией.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
Электрофорез гемоглобина при различных гемоглобинопатиях и талассемии. Предоставлено Амитом Сонагра, доктором медицины
Рисунок
Схема устройства для электрофореза. Предоставлено Амитом Сонагра, доктором медицины
Ссылки
- 1.
Шринивас PR. Введение в электрофорез белков. Методы Мол Биол. 2019;1855:23-29. [PubMed: 30426403]
- 2.
Lee PY, Costumbrado J, Hsu CY, Kim YH. Электрофорез в агарозном геле для разделения фрагментов ДНК. J Vis Exp. 20 апреля 2012 г .; (62) [Бесплатная статья PMC: PMC4846332] [PubMed: 22546956]
- 3.
Guo Y, Li X, Fang Y.
 Эффекты электроэндосмоса в электрофорезе на агарозе. Электрофорез. 1998 июнь; 19 (8-9): 1311-3. [В паблике: 9694271]
Эффекты электроэндосмоса в электрофорезе на агарозе. Электрофорез. 1998 июнь; 19 (8-9): 1311-3. [В паблике: 9694271]- 4.
ЛАРСОН ДЛ, РЭННИ ХМ. Электрофорез гемоглобина человека на фильтровальной бумаге. Джей Клин Инвест. 1953 ноябрь; 32 (11): 1070-6. [Бесплатная статья PMC: PMC438444] [PubMed: 13108968]
- 5.
Ригетти П.Г. Электрофорез: марш копеек, марш копеек. J Chromatogr A. 2005 24 июня; 1079 (1-2): 24-40. [PubMed: 16038288]
- 6.
Кумар Р., Дербиньи, Вашингтон. Электрофорез гемоглобина на ацетате целлюлозы. Методы Мол Биол. 2019;1855:81-85. [PubMed: 30426408]
- 7.
Кунц Л. Электрофорез в агарозном геле. Методы Энзимол. 2013;529:35-45. [PubMed: 24011035]
- 8.
Green MR, Sambrook J. Электрофорез в полиакриламидном геле. Протокол Колд-Спринг-Харб. 01 декабря 2020 г. (12) [PubMed: 33262236]
- 9.
Брюнель Дж. Л., Грин Р. Одномерный электрофорез в SDS-полиакриламидном геле (1D SDS-PAGE).
 Методы Энзимол. 2014;541:151-9. [В паблике: 24674069]
Методы Энзимол. 2014;541:151-9. [В паблике: 24674069]- 10.
Фридман Д.Б., Ховинг С., Вестермайер Р. Изоэлектрическое фокусирование и двумерный гель-электрофорез. Методы Энзимол. 2009; 463:515-40. [PubMed: 19892190]
- 11.
Zhu S, Li W, Lin M, Li T. Электрофорез белков сыворотки и электрофорез иммунофиксации при множественной миеломе. J Coll Physicians Surg Pak. 2021 июль; 30 (7): 864-867. [PubMed: 34271795]
- 12.
Фейкова С., Клемент С. Гель-электрофорез в импульсном поле и его практическое применение. Клин Микробиол Инфекц Лек. 2007 Декабрь; 13 (6): 236-41. [В паблике: 18320503]
- 13.
Stolz A, Jooß K, Höcker O, Römer J, Schlecht J, Neusüß C. Последние достижения в области капиллярного электрофореза-масс-спектрометрии: аппаратура, методология и приложения. Электрофорез. 2019 Январь; 40 (1): 79-112. [PubMed: 30260009]
- 14.
BLACKWELL RQ, HUANG JT.
 УПРОЩЕННОЕ ПРИГОТОВЛЕНИЕ ГЕМОЛИЗАТОВ КРОВИ ДЛЯ ЭЛЕКТРОФОРЕЗА ГЕМОГЛОБИНА. Клин Хим. 1965 июнь; 11: 628-32. [PubMed: 14300079]
УПРОЩЕННОЕ ПРИГОТОВЛЕНИЕ ГЕМОЛИЗАТОВ КРОВИ ДЛЯ ЭЛЕКТРОФОРЕЗА ГЕМОГЛОБИНА. Клин Хим. 1965 июнь; 11: 628-32. [PubMed: 14300079]- 15.
Особое внимание к подготовке проб для электрофореза. Электрофорез. 2021 фев; 42 (3): 189. [PubMed: 33523528]
- 16.
Kurien BT, Scofield RH. Артефакты и распространенные ошибки электрофореза в белковом геле. Методы Мол Биол. 2019;1855:511-518. [PubMed: 30426446]
- 17.
Сандер Х., Уоллес С., Плоуз Р., Тивари С., Гомес А.В. Отходы Ponceau S: окрашивание Ponceau S для нормализации общего белка. Анальная биохимия. 2019 15 июня; 575: 44-53. [Бесплатная статья PMC: PMC6954006] [PubMed: 30914243]
- 18.
Williams LR. Окрашивание нуклеиновых кислот и белков в гелях для электрофореза. Биотехнологический гистохим. 2001 г., май; 76(3):127-32. [PubMed: 11475315]
- 19.
Munkongdee T, Chen P, Winichagoon P, Fucharoen S, Paiboonsukwong K.
 Обновление лабораторной диагностики талассемии. Фронт Мол Биоски. 2020;7:74. [PMC бесплатная статья: PMC7326097] [PubMed: 32671092]
Обновление лабораторной диагностики талассемии. Фронт Мол Биоски. 2020;7:74. [PMC бесплатная статья: PMC7326097] [PubMed: 32671092]- 20.
Winichagoon P, Svasti S, Munkongdee T, Chaiya W, Boonmongkol P, Chantrakul N, Fucharoen S. Быстрая диагностика талассемии и других гемоглобинопатий система электрофореза. Перевод рез. 2008 г., октябрь; 152 (4): 178–84. [В паблике: 18940720]
- 21.
O’Connell TX, Horita TJ, Kasravi B. Понимание и интерпретация электрофореза белков сыворотки. Ам семейный врач. 2005 01 января; 71 (1): 105-12. [PubMed: 15663032]
- 22.
Vavricka SR, Burri E, Beglinger C, Degen L, Manz M. Электрофорез белков сыворотки: малоиспользуемый, но очень полезный тест. пищеварение. 2009;79(4):203-10. [PubMed: 19365122]
- 23.
Read JA, Winter VJ, Eszes CM, Sessions RB, Brady RL. Структурные основы измененной активности М- и Н-изоферментных форм лактатдегидрогеназы человека.