Какие обследования нужно пройти, чтобы исключить у себя онкологическое заболевание (рак) — 12 декабря 2019
Врач Александр Гальперин
Фото: Анна Рыбакова / Е1.RU
Поделиться
Рак излечим, если обнаружить его на ранней стадии. При этом не обязательно ждать, когда что-то заболит, чтобы провериться на раковые клетки. Наши коллеги с E1.RU в компании врача Александра Гальперина составили список из 10 эффективных обследований. Рассказываем, что нужно обследовать, когда и каким образом.
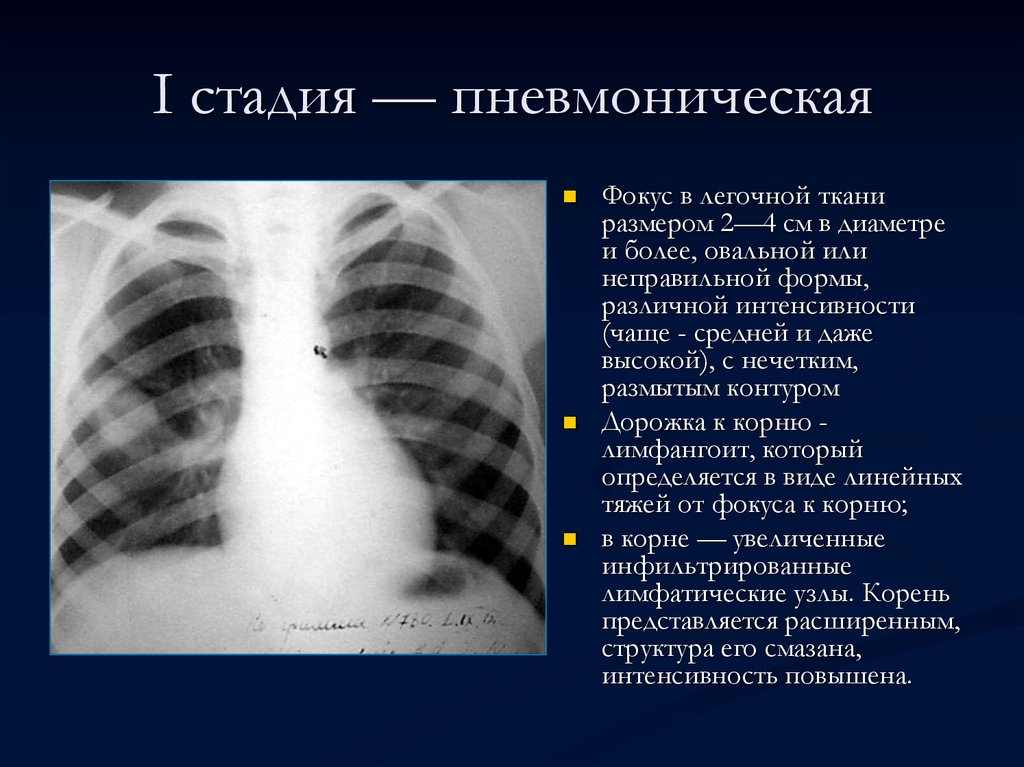
Самое распространенное онкологическое заболевание у мужчин. У женщин встречается реже. Основная причина развития рака легких — это курение (80–90% заболевших — курильщики). Особенность этого вида рака в том, что развивается он, как правило, очень быстро.
Кто в зоне риска: курильщики старше 50 лет (стаж курения 20 пачек/лет). Люди, которые не курят, тоже могут заболеть, но такие случаи встречаются реже. Как правило, это люди, работающие с асбестом, хромом, мышьяком или углем. В зоне риска пациенты с хроническими обструктивными заболеваниями легких и те, у кого есть наследственная предрасположенность к опухоли.
Как правило, это люди, работающие с асбестом, хромом, мышьяком или углем. В зоне риска пациенты с хроническими обструктивными заболеваниями легких и те, у кого есть наследственная предрасположенность к опухоли.
Как вычислить свой индекс курящего (ИК): количество выкуриваемых в день сигарет нужно умножить на стаж курения в годах и поделить на 20 (количество сигарет в пачке). Например, стаж 10 лет по 20 сигарет (1 пачке) в день, тогда ИК=20*10/20 = 200/20=10. Индекс больше 10 пачек/лет уже является фактором риска.
Какое обследование: компьютерная томография легких.
Как часто: курильщикам старше 50 лет рекомендуют делать компьютерную томографию раз в год. Проводить исследование раньше не рекомендуется (лучевая нагрузка во время исследования превышает риск развития рака легких).
— Эффективность компьютерной томографии в 10 раз выше рентгена легких и в 20 раз выше флюорографии, — комментирует Александр Гальперин. — Флюорографический тест не считается в этом случае эффективным.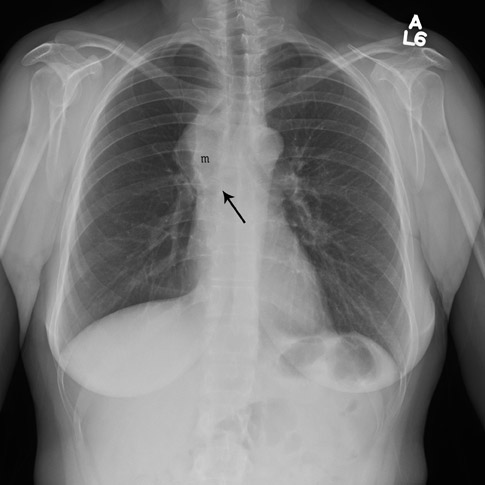 С его помощью можно определить далеко не все опухоли, то есть результат может быть ложноотрицательным.
С его помощью можно определить далеко не все опухоли, то есть результат может быть ложноотрицательным.
По статистике, женщины болеют раком чаще, чем мужчины
Фото: Анна Рыбакова / Е1.RU
Поделиться
Это собирательное понятие для рака (опухоли) различных отделов толстой и прямой кишки. Чаще всего развивается как перерождение аденоматозных (железистых) полипов. Если диагностировать заболевание на ранней стадии, в 95% случаев его можно предотвратить.
Кто в зоне риска: для людей младше 40 лет это заболевание редкое, зато часто встречается у людей 60–75 лет. Есть доказанные предрасполагающие факторы — лишний вес и избыточное употребление красного мяса, копченостей. Играет роль и наследственность.
Какое обследование: анализ кала на скрытую кровь иммунохимическим методом. Метод нельзя считать точным на 100%, при этом он самый простой и недорогой.
Более точный, но и более сложный метод — колоноскопия (эндоскопический метод исследование толстой кишки). Он требует специальной подготовки и высокой квалификации врача. Исследование проводится под наркозом. Во время процедуры можно увидеть полипы — предвестники рака — и безболезненно удалить их. Исследование стоит делать мужчинам старше 50 лет со средней степенью риска. Если степень риска неизвестна (нет данных по наследственности), то лучше сместить возраст первого исследования до 45 лет или даже раньше.
Он требует специальной подготовки и высокой квалификации врача. Исследование проводится под наркозом. Во время процедуры можно увидеть полипы — предвестники рака — и безболезненно удалить их. Исследование стоит делать мужчинам старше 50 лет со средней степенью риска. Если степень риска неизвестна (нет данных по наследственности), то лучше сместить возраст первого исследования до 45 лет или даже раньше.
Как часто: если есть полипы или другие патологии в толстой и прямой кишке, то исследования нужно проводить каждый год, если нет, то каждые 3–5 лет.
Колоректальный рак лучше всего покажет колоноскопия (эндоскопический метод исследование толстой кишки)
Фото: Артем Устюжанин / Е1.RU
Поделиться
Появление рака желудка чаще всего связано с влиянием внешних причин.
Кто в зоне риска: люди, которые питаются неправильно (повышенное употребление копченостей, вяленых продуктов, перегретых жиров — жареной еды с хрустящей корочкой, чипсов, жареных пирожков, соленой пищи в больших количествах, а также продуктов с нитратами). Люди, зараженные спиралевидной бактерией Helicobacter pylori, которая обитает в привратнике желудка, а также курильщики (особенно если совмещать курение с алкоголем).
Люди, зараженные спиралевидной бактерией Helicobacter pylori, которая обитает в привратнике желудка, а также курильщики (особенно если совмещать курение с алкоголем).
Это самая распространенная инфекция во всем мире. Считается, что носителями Helicobacter pylori являются 60% населения планеты.
Также в зоне риска люди с заболеванием желудка (язвенная болезнь), а вот наследственный фактор реже играет роль при возникновении рака желудка.
— В последнее время этот вид рака встречается гораздо реже. Это может быть связано с тем, что люди стали больше следить за своим питанием, а мы лучше научились лечить язвенную болезнь, которая тоже нередко приводила к опухолям, — говорит Александр Гальперин.
Какое обследование: фиброгастроскопия (ФГС). Во время этого обследования врачи смотрят желудок и двенадцатиперстную кишку. Рекомендуется также сделать исследование на хеликобактер (Helicobacter pylori) — микроорганизм, который инфицирует слизистую оболочку желудка и/или двенадцатиперстной кишки. Он способен вызывать гастрит, дуоденит, язвенную болезнь желудка и двенадцатиперстной кишки, а также злокачественные опухоли желудка.
Он способен вызывать гастрит, дуоденит, язвенную болезнь желудка и двенадцатиперстной кишки, а также злокачественные опухоли желудка.
Как часто: ФГС рекомендуют делать однократно в 40 лет, если нет жалоб.
В возрасте 40 лет нужно пройти исследование и на хеликобактер. Для того, чтобы узнать, есть у вас эта инфекция или нет, нужно сдать кровь на антитела класса IgA к H. pylori (иммуноглобулины класса A к возбудителю хеликобактериоза) или анализ сделают во время ФГС. Если результат положительный, инфекцию нужно лечить, затем повторять исследования каждые 3–5 лет.
По статистике, количество людей, которые живут с диагнозом «рак», растет
Фото: Анна Рыбакова / Е1.RU
Поделиться
На третьем месте у российских мужчин (после рака легких и рака предстательной железы) и на втором (после рака молочной железы) — у женщин. Этот вид опухоли развивается так же стремительно, как рак легких.
Кто в зоне риска: заболевание встречается у одного из 4000 человек, но в южных регионах России, где солнечное излучение интенсивнее, показатель значительно выше. Особенно подвержены раку кожи люди «северного типа» (со светлыми кожей и волосами).
Также в зоне риска люди, которые загорают под открытыми лучами солнца в дневное время (делать это можно только утром и вечером при условии использования солнцезащитного крема). Рискуют люди, которые регулярно ходят в солярий (во многих странах он уже запрещен, так как его лучи значительно повышают риск развития онкологического заболевания).
Какое обследование: главным тестом будет самоосмотр. Нужно обращать внимание на ранку, которая не заживает на протяжении нескольких недель, пятно, постепенно увеличивающееся в размерах, родинку, которая изменила форму или цвет. В пораженной области часто наблюдаются покраснение, зуд, боль, кровотечение или шелушение. Важно знать, что рак кожи способен развиться, в том числе и на слизистых оболочках — во рту или в полости носа, а также под волосами на голове.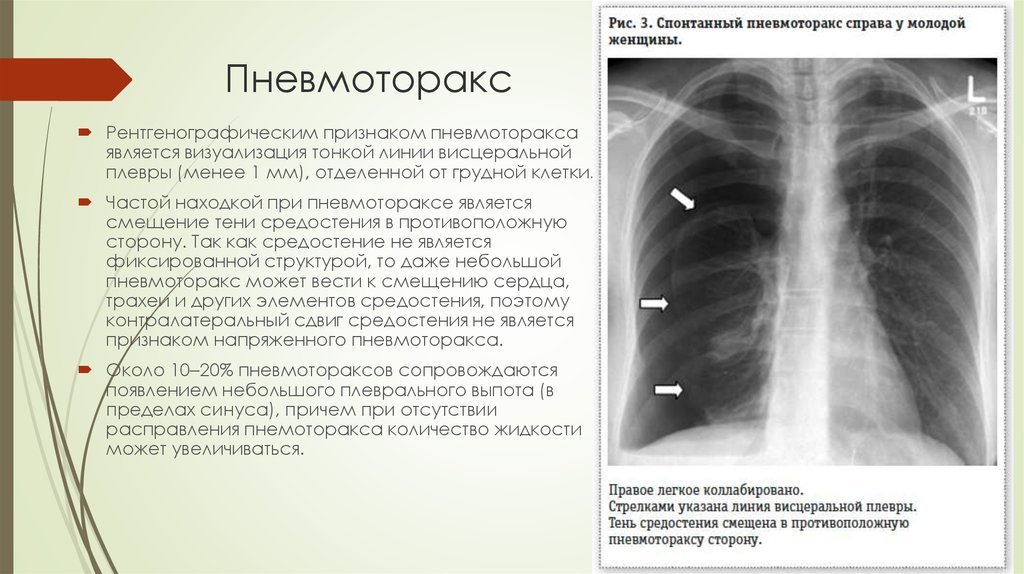
Если вы заметили у себя что-то подобное, нужно обратиться к дерматологу. Онкологи и дерматологи используют дерматоскоп — прибор, позволяющий разглядеть структуру новообразования детально, в поляризованном свете. Для окончательного подтверждения природы опухоли используется такой метод, как биопсия.
В случае если вы заметили на теле новую родину или ранку, которая долго не заживает, нужно записаться на прием к дерматологу, который проведет дерматоскопию
Фото: Артем Устюжанин / Е1.RU
Поделиться
Встречается только у мужчин. Доля рака предстательной железы составляет 14,4% от всех онкологических заболеваний мужчин, а смертность от этого вида рака находится на уровне 7,6%. Нужно знать, что рак предстательной железы поддается хирургическому вмешательству. Если удалось выявить заболевание на ранней стадии, то высока вероятность избавиться от заболевания полностью.
Кто в зоне риска: болезнь в 6 из 10 случаев диагностируется после 65 лет (у людей до 40 также встречается, но крайне редко).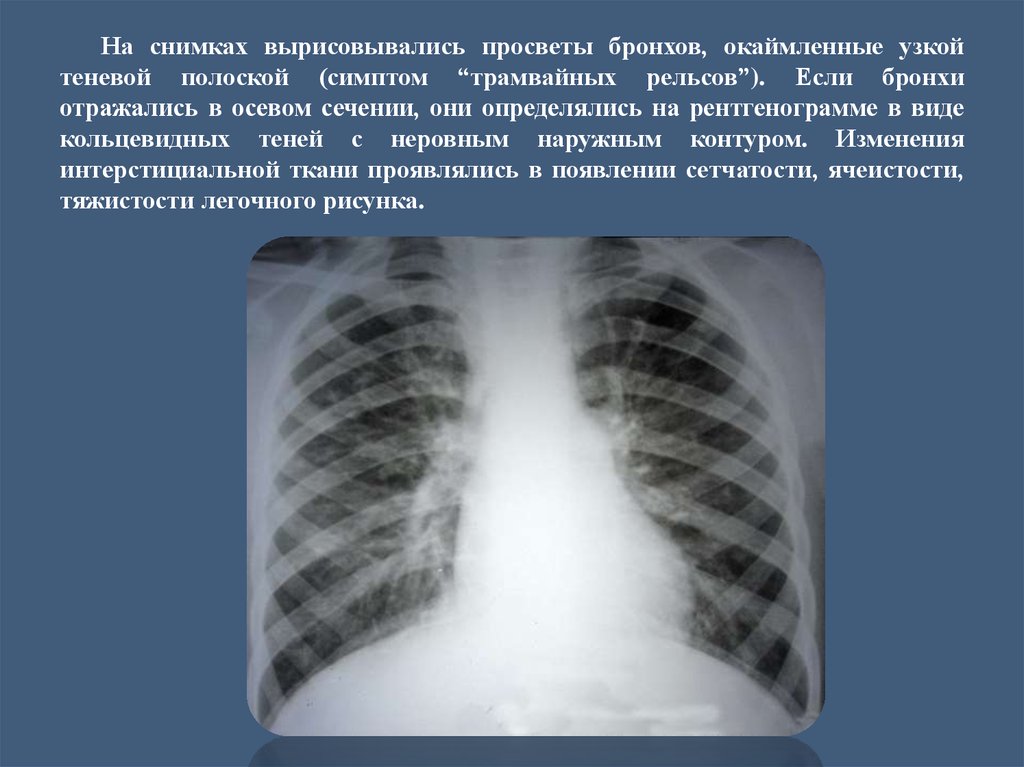 Средний возраст диагноза — 66 лет. В России в возрасте от 50 до 59 лет показатель смертности от рака предстательной железы не превышает 10 случаев на 100 тысяч человек, тогда так в возрасте от 70 до 79 лет он более чем в 15 раз выше — 150 на 100 тысяч мужчин.
Средний возраст диагноза — 66 лет. В России в возрасте от 50 до 59 лет показатель смертности от рака предстательной железы не превышает 10 случаев на 100 тысяч человек, тогда так в возрасте от 70 до 79 лет он более чем в 15 раз выше — 150 на 100 тысяч мужчин.
Какое обследование: анализ крови на общий ПСА (простатический специфический антиген). Сейчас об этом методе много спорят, потому что он нередко выдает ложноположительный результат (значения могут повышаться не только из-за возникновения опухоли, но и из-за других причин). Однако для врача результаты теста могут стать показателем того, что нужно направить пациента на более точное (но менее щадящее обследование) — биопсию.
Как часто: в 50 лет однократно (в 45 при наследственном факторе), далее — в зависимости от результата, но не реже чем раз в 3 года. Референсные значения должны быть в районе от 0 до 4 нг/мл.
Доля рака предстательной железы составляет 14,4% от всех онкологических заболеваний мужчин
org/Person»>Фото: Артем Устюжанин / Е1.RU
Поделиться
Встречается у женщин, редко — у мужчин.
Кто в зоне риска: до 40 лет вероятность развития опухоли составляет 0,5%, в возрасте 40–60 лет — уже 4%, а возрасте 60–80 лет — 7%. Однако случаи, когда молодые женщины умирают из-за этого заболевания, также встречаются, хоть и редко.
Какое обследование: золотым стандартом считается маммография (рентгеновское исследование молочной железы). Этот метод достаточно точный: на снимке видно всю молочную железу.
УЗИ молочных желез — метод менее точный. Результат во многом будет зависеть от врача, который проводит исследование. Так, например, нередки случаи, когда специалист пропускает опухоль при обследовании объемной молочной железы.
— Проводить самообследование также можно, но сейчас уже считается, что зачастую это приводит к повышенной тревожности у пациенток и ложноположительным результатам. Кроме того, эффективность самообследования серьезно подвергнута сомнению большими исследованиями, — комментирует Александр Гальперин.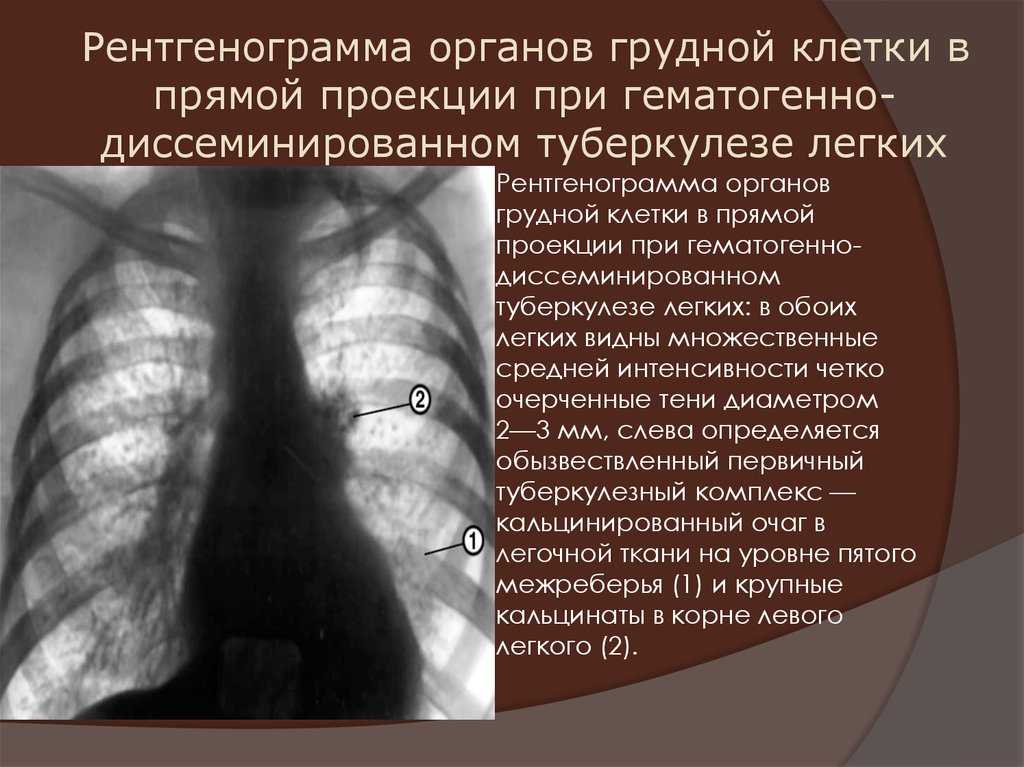
Как часто: маммографию рекомендуют делать после 40 лет регулярно, то есть раз в 2 года, после 50 лет — раз в год. УЗИ молочных желез до 40 лет — 1 раз в 2 года.
На сегодняшний день нет серьезных научных работ и исследований, которые бы доказывали, что экстракорпоральное оплодотворение (ЭКО) само по себе повышает риск возникновения онкологического заболевания, говорит врач.
— Скорее, тут стоит говорить о том, что гормональная нагрузка, которая дается женщине во время ЭКО, становится «катализатором» для того, чтобы опухоль, зародившаяся до процедуры, начала проявляться. Это связано с тем, что ЭКО, как и беременность, — стресс для организма, — объясняет Александр Гальперин. — Во время беременности редко, но случаются манифестации опухоли (1 случай на 10 тысяч). Но это не значит, что причиной возникновения опухоли стало ЭКО.
История Анджелины Джоли в России пока вряд ли возможна, потому что превентивное удаление органов у нас запрещено законом
org/Person»>Фото: Артем Устюжанин / Е1.RU
Поделиться
История Анджелины Джоли, говорит Гальперин, в России вряд ли возможна:
— Джоли превентивно удалили железистые ткани в молочной железе после генетического теста, показавшего высокую предрасположенность к раку молочной железы и раку яичников. Такой тест есть, и сделать его можно и у нас. Но оперировать здоровые органы у нас никто не будет, потому что превентивное удаление органа в России запрещено законодательно. Врачи оперируют только в том случае, если есть угроза жизни пациента.
Встречается часто, поэтому обследование нужно проводить регулярно, особенно если у женщины раньше был найден вирус папилломы человека (ВПЧ).
Кто в зоне риска: женщины, зараженные вирусом папилломы человека. ВПЧ выявляется у 100% больных раком. Причем за 70% случаев рака шейки матки ответственны папилломавирусы человека 16-го и 18-го штаммов.
Какое обследование: самый главный скрининговый тест — Pap-тест. Это исследование соскоба с шейки матки, которое проводится на цитологию (измененные клетки). Тест довольно простой, не болезненный, делается во время приема у гинеколога.
Это исследование соскоба с шейки матки, которое проводится на цитологию (измененные клетки). Тест довольно простой, не болезненный, делается во время приема у гинеколога.
Как часто: при периодическом обследовании девушек и женщин через 3 года после начала половой жизни, но не позже 21 года (рекомендовано брать анализ ежегодно и не реже чем каждые 3 года). Каждые 2–3 года, начиная с 30-летнего возраста и до 65 лет при трех последовательных отрицательных результатах.
Вирус папилломы человека выявляется у 100% больных раком, поэтому врачи рекомендуют прививать девочек от ВПЧ
Фото: Артем Устюжанин / Е1.RU
Поделиться
Ежегодно при наличии вируса папилломы человека (ВПЧ), при иммунной системе, ослабленной в результате трансплантации, химиотерапии или длительного применения стероидных гормонов.
— Для того чтобы снизить риск возникновения рака шейки матки, нужно проводить вакцинацию, — рассказывает Александр Гальперин. — Прививка в первую очередь необходима до начала сексуальной жизни. Разрешена она с 9 лет, но обычно делают 12–13-летним подросткам. Дополнительно рекомендуется привиться молодым сексуально активным женщинам до 25–26 лет: именно так произошло в Австралии, когда, кроме девочек-подростков, начали вакцинировать и молодых девушек. Имеет смысл прививаться и женщинам более старшего возраста. Доказано, что вакцина вреда не нанесет. Вакцина вводится 3 раза, вторая и третья дозы вводятся через 2 месяца и через 6 месяцев после первой. В США врачи рекомендуют и в части европейских стран проводить вакцинацию и мальчикам от ВПЧ, чтобы они не были носителями (при этом нет никаких доказательств того, что наличие ВПЧ может стать причиной онкологического заболевания у мальчиков). На сегодняшний день это единственная вакцина, которая борется с онкологическим заболеванием. Но в национальном календаре ее нет.
— Прививка в первую очередь необходима до начала сексуальной жизни. Разрешена она с 9 лет, но обычно делают 12–13-летним подросткам. Дополнительно рекомендуется привиться молодым сексуально активным женщинам до 25–26 лет: именно так произошло в Австралии, когда, кроме девочек-подростков, начали вакцинировать и молодых девушек. Имеет смысл прививаться и женщинам более старшего возраста. Доказано, что вакцина вреда не нанесет. Вакцина вводится 3 раза, вторая и третья дозы вводятся через 2 месяца и через 6 месяцев после первой. В США врачи рекомендуют и в части европейских стран проводить вакцинацию и мальчикам от ВПЧ, чтобы они не были носителями (при этом нет никаких доказательств того, что наличие ВПЧ может стать причиной онкологического заболевания у мальчиков). На сегодняшний день это единственная вакцина, которая борется с онкологическим заболеванием. Но в национальном календаре ее нет.
— Что такое скрининг?
— Это попытка идентифицировать болезнь или предболезненное состояние у внешне здоровых людей с помощью специальных тестов. Прежде чем понять, какие именно обследования проходить, нужно оценить все риски (например, определить, чем болели ваши родственники). Искать у себя редкие заболевания не надо. Так, по статистике, самая высокая смертность в России от болезней системы кровообращения (более половины умерших), на втором месте — смертность от новообразований — 14,4%. На это и нужно обратить внимание в первую очередь.
Прежде чем понять, какие именно обследования проходить, нужно оценить все риски (например, определить, чем болели ваши родственники). Искать у себя редкие заболевания не надо. Так, по статистике, самая высокая смертность в России от болезней системы кровообращения (более половины умерших), на втором месте — смертность от новообразований — 14,4%. На это и нужно обратить внимание в первую очередь.
— Чем скриниг отличается от диагностики?
— Диагностика и скрининг — это разные вещи. Мы диагностируем конкретную болезнь при определенных клинических симптомах. Как правило, человек обращается к врачу с конкретной проблемой, и доктор начинает искать, что это может быть (то есть заниматься диагностикой). Во время скрининга мы пытаемся идентифицировать болезнь или предболезненное состояние у людей, у которых нет жалоб и клинических проявлений той или иной болезни.
— Кому нужно пройти онкоскрининг?
— Каждый человек вправе проверять себя на разные заболевания, но есть нюансы. Нужно понимать, что скрининг — это не так просто, как кажется. Исследования стоят времени, нервов и денег. Поэтому то, что мы ищем, должно быть реальной проблемой, у этого состояния должна быть скрытая стадия, должен быть подходящий диагностический тест (безопасный), медицина должна уметь лечить это состояние, и это лечение должно быть доступно.
Нужно понимать, что скрининг — это не так просто, как кажется. Исследования стоят времени, нервов и денег. Поэтому то, что мы ищем, должно быть реальной проблемой, у этого состояния должна быть скрытая стадия, должен быть подходящий диагностический тест (безопасный), медицина должна уметь лечить это состояние, и это лечение должно быть доступно.
Каждый человек при желании может проверить себя на те или иные заболевания. Но лучше всё же понимать, что именно вы ищите и почему
Фото: Артем Устюжанин / Е1.RU
Поделиться
— Что такое ложнопозитивный результат?
— Медицина — наука неточная, и у любого, даже самого современного и крутого теста, может быть ложноположительный результат. После того как тест показывает такой результат, врач начинает углубленный поиск. То есть наступает время уже совсем не безобидных методов диагностики. Например, биопсия, при которой берутся кусочки ткани, и тяжелые лучевые методы.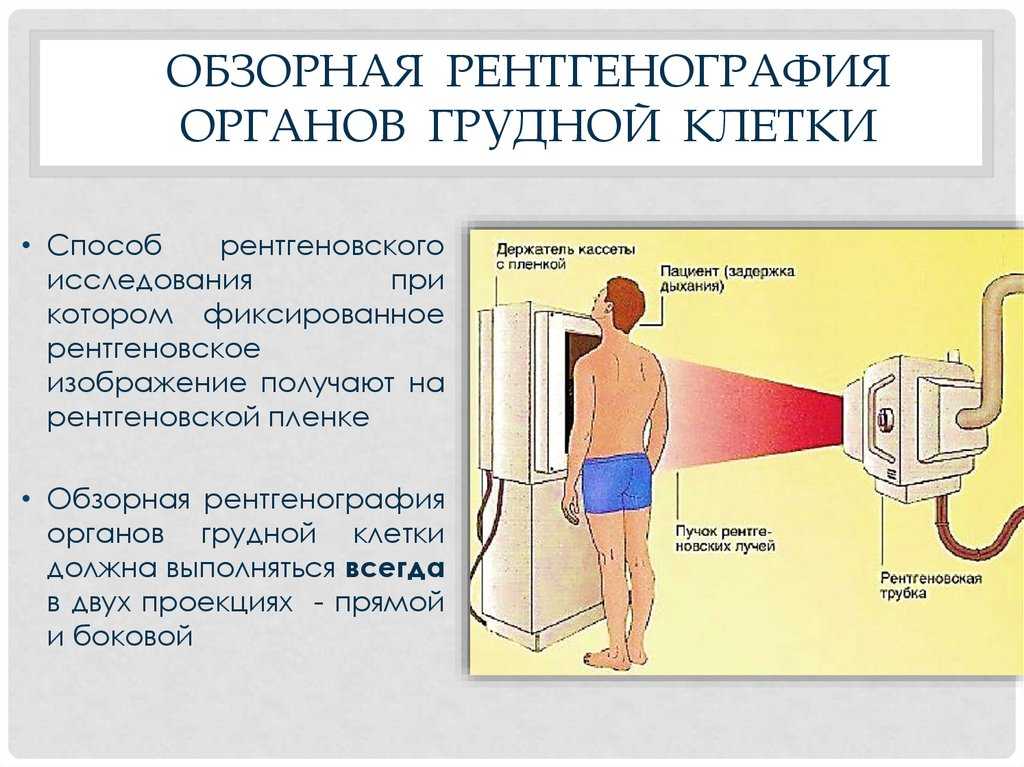
Случаются ложноположительные результаты при обследовании молочной железы. Есть случаи доброкачественных опухолей, которые сами по себе могут не нести негативных последствий для женщины. То есть она может не знать об этом новообразовании и прекрасно с ним жить. Но в некоторых случаях пациентке даже делают операцию, которая, по большому счету, была не нужна.
Это не значит, что пациенты должны быть фаталистами, думать: «Я никуда не пойду, потому что тогда у меня будут проблемы», «Я ничего не хочу знать», «Сколько мне отведено, столько я и проживу» (такое, кстати, часто встречается у мужчин). Нужно просто знать, что такой недостаток есть, и не паниковать раньше времени.
— Что такое ложноотрицательный результат?
— Это когда не самый надежный скрининговый тест показывает, что у вас всё в порядке. Один из таких тестов в России — это флюорография, с помощью которой никогда нельзя сказать наверняка, есть у человека заболевание или нет. Заключение будет примерно такое: «Патологии не выявлено, органы грудной клетки без изменений».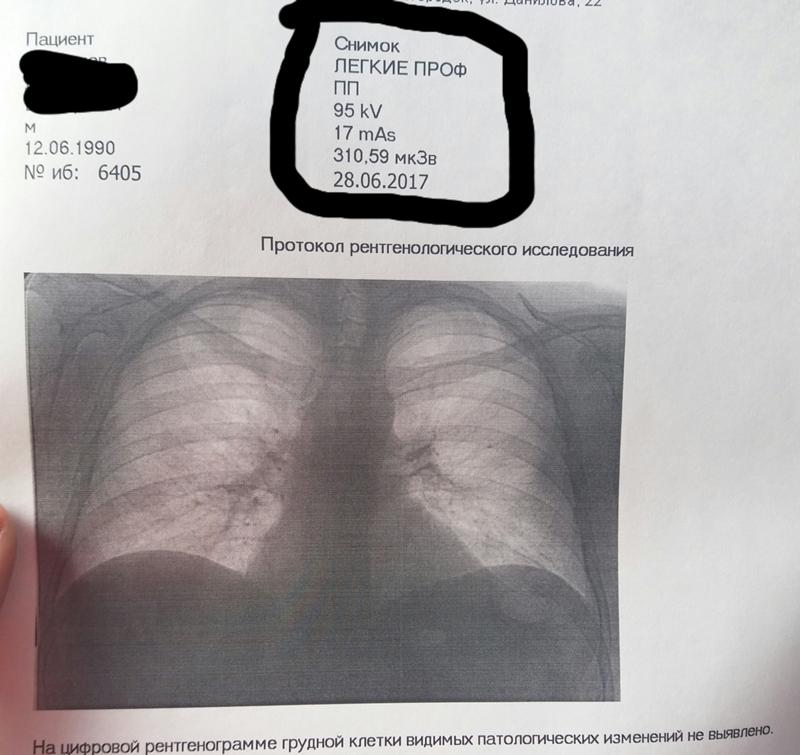
Что чаще всего делает врач, когда видит такое заключение? Он говорит, что у пациента всё хорошо, и больше никуда направлять его не будет. Но проблема в том, что такое заключение ровно ничего не значит. Есть очень много разновидностей опухолей, которые при флюорографических исследованиях в принципе не видно.
Флюорография может быть эффективна только для выявления туберкулеза на определенных стадиях. Но туберкулез — это, конечно, серьезное заболевание, но далеко не такое распространенное, как, например инфаркт. От проведения массовых флюорографических обследований в Европе и США давно отказались, а ведь у нас на флюорографию отправляют целыми предприятиями.
Флюорография может быть эффективна только для выявления туберкулеза на определенных стадиях, но не раковых заболеваний
Фото: Артем Устюжанин / Е1.RU
Поделиться
— Опасны ли скрининговые исследования?
— Само по себе обследование действительно может быть небезопасным. Например, скринингом можно назвать компьютерную томографию для человека, которого ничего не беспокоит. КТ — это рентгеновский метод и несет существенную лучевую нагрузку. Делать ее надо только при серьезных показаниях. Любимая многими УЗИ-диагностика — хороший метод, безопасный. Но сильно зависит от доктора, который его проводит. Также есть пределы разрешения метода, и, соответственно, могут быть ложноотрицательные результаты.
Например, скринингом можно назвать компьютерную томографию для человека, которого ничего не беспокоит. КТ — это рентгеновский метод и несет существенную лучевую нагрузку. Делать ее надо только при серьезных показаниях. Любимая многими УЗИ-диагностика — хороший метод, безопасный. Но сильно зависит от доктора, который его проводит. Также есть пределы разрешения метода, и, соответственно, могут быть ложноотрицательные результаты.
Существует множество других онкологических заболеваний, одни из них встречаются чаще, другие реже. Для них не существует тестов, достоверно указывающих на опухоль в доклинической (до появления симптомов) стадии. Поэтому важно следить за собой, если появились какие-то изменения в организме: стали худеть без причины, изменился голос, появились кровянистые выделения, незаживающие ранки, припухлости, длительные боли — надо идти к врачу. В таких случаях обследование будет проходить уже по другой программе. И помните, рак излечим, главное — не запустить болезнь.
Важная роль флюорографии в диагностике рака легких
11.03.2021
Рак лёгких является довольно распространенным и опасным онкологическим заболеванием, так как часто проходит с серьёзными осложнениями и в 85% случаев приводит к летальным исходам. Не зря в современном мире очень обеспокоены вопросом ранней диагностики данного заболевания. И так, что же такое рак лёгких?
Рак лёгких – злокачественная опухоль, берущая начало из тканей бронхов или легочной паренхимы.Это опасное заболевание характеризуется неконтролируемым ростом клеток в тканях лёгкого и склонностью к метастазированию. Данное заболевание встречается у представителей обоих полов, но чаще страдают от него мужчины.
Можно выделить целый ряд факторов, которые могут спровоцировать рак лёгких:
1. Курение, в том числе и пассивное;
2. Генетическая предрасположенность;
3. Хронические заболевания бронхо-легочной системы;
4. Злоупотребление спиртными напитками;
5. Наркотическая зависимость;
6. Неблагоприятная экологическая обстановка;
Неблагоприятная экологическая обстановка;
7. Работа в среде с потенциальными канцерогенами;
8. Употребление продуктов питания, содержащих канцерогены;
9. Радиационное облучение.
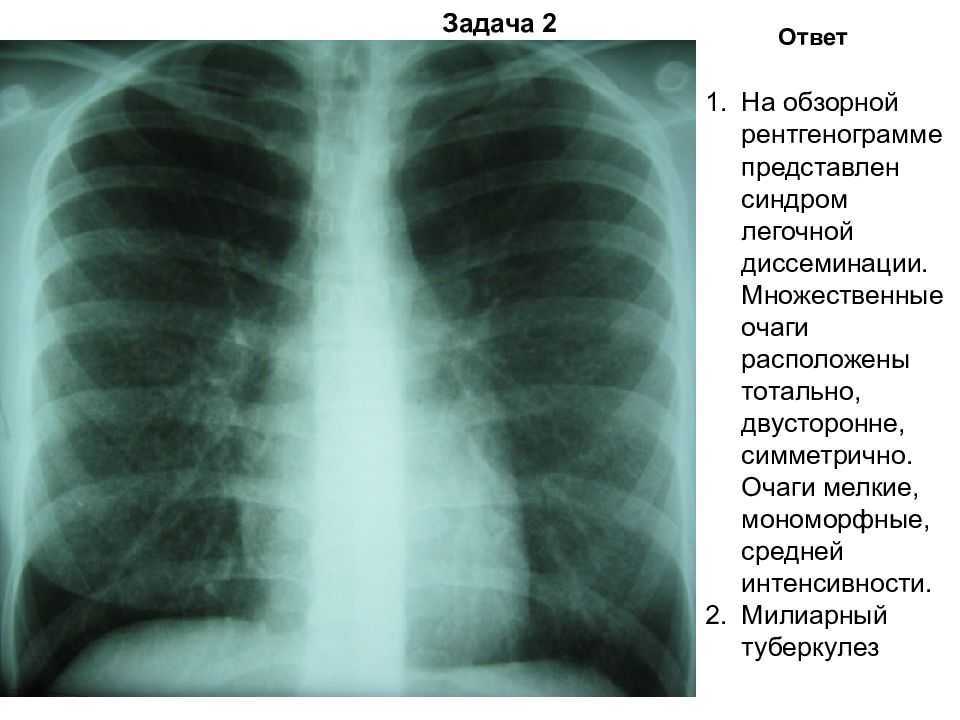
В зависимости от анатомического расположения выделяют несколько видов рака лёгкого: центральный, периферический, медиастинальный и диссеминированный. К сожалению, у рака лёгкого нет специфических симптомов, а в 15% случаев болезнь протекает бессимптомно.Однако, есть ряд симптомов, при наличии которых можно заподозрить данное заболевание, к таковым относятся кашель, одышка, кровохарканье, боль в грудной клетке, повышение температуры тела и общие интоксикационные симптомы (снижение аппетита, похудение, утомляемость, расстройства нервной системы и др.).
Таким образом, ранняя диагностика рака лёгких – это сложная организационная работа, направленная на ранее выявление опухоли, еще до появления клинических симптомов. Она осуществляется, прежде всего, массовыми профилактическими рентгенологическими обследованиями населения (флюорография).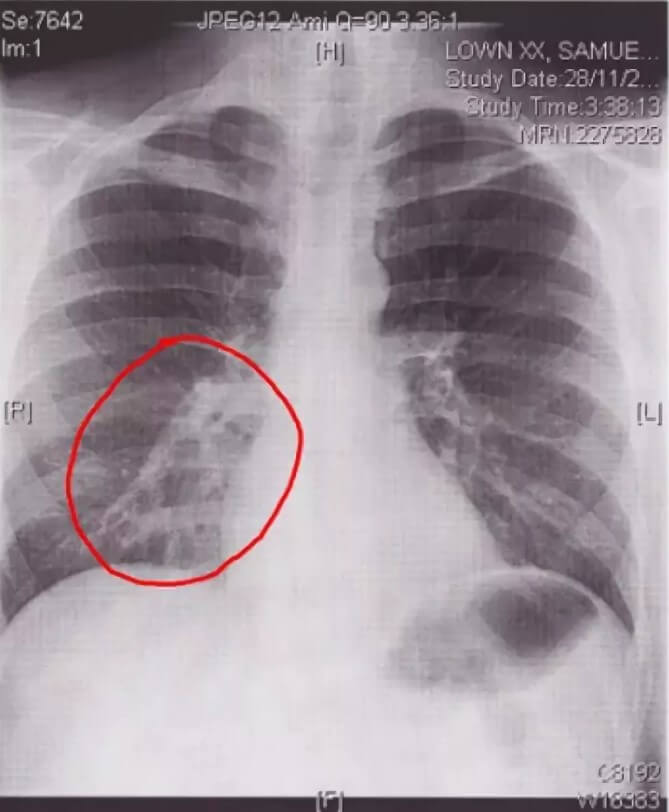
Флюорография грудной клетки – профилактический и диагностический метод рентгенологического обследования органов грудной полости и легких. Данное исследование простое, не требует почти никакой подготовки и занимает минимум времени. Флюорографию в рамках ежегодной диспансеризации рекомендуется проходить всем практически здоровым людям. Заключение о результатах флюорографии требуется при первичном посещении терапевта, госпитализации, трудоустройстве, поступлении на учебу, оформлении санаторной карты, записи в спортивные клубы и бассейны, получении водительских прав, перед планированием беременности. При наличии длительного кашля, одышки, похудания, слабости пациент направляется на флюорографию незамедлительно.
При проведении флюорографии врач-рентгенолог способен на снимке различить определённый рисунок и дать точную оценку состояния лёгких и присутствие каких-либо изменений и нарушений. На снимке можно обнаружить помутнение, затемнение или уплотнение в органах системы дыхания. Помимо этого, флюорография позволяет заподозрить начало патологического процесса, даже если сама опухоль еще не видна на снимке. Рак легких никогда не протекает абсолютно бессимптомно, обязательно есть признаки онкологии по данным инструментальных исследований, больные жалуются на общее состояние. При подозрении на онкологию и исключения онкологических рисков проводят дополнительные исследования.
Помимо этого, флюорография позволяет заподозрить начало патологического процесса, даже если сама опухоль еще не видна на снимке. Рак легких никогда не протекает абсолютно бессимптомно, обязательно есть признаки онкологии по данным инструментальных исследований, больные жалуются на общее состояние. При подозрении на онкологию и исключения онкологических рисков проводят дополнительные исследования.
Ошибочно считается, что во время прохождения флюорографии пациент получает значительную дозу облучения. Следует отметить, что при проведении данного исследования пациент получает облучение не больше, чем при работе за компьютером в течение 2-3 часов. Флюорографическое обследование абсолютно безопасно и не может никак повлиять на самочувствие человека. Противопоказанием к проведению флюорографии является беременность (особенно первый триместр), тяжёлое состояние пациента, период грудного вскармливания у женщин и возраст до 18 лет (только с письменного согласия законных представителей).
Таким образом, следует отметить, что рак лёгкого в настоящее время является серьёзным заболеванием, требующим своевременной диагностики и лечения.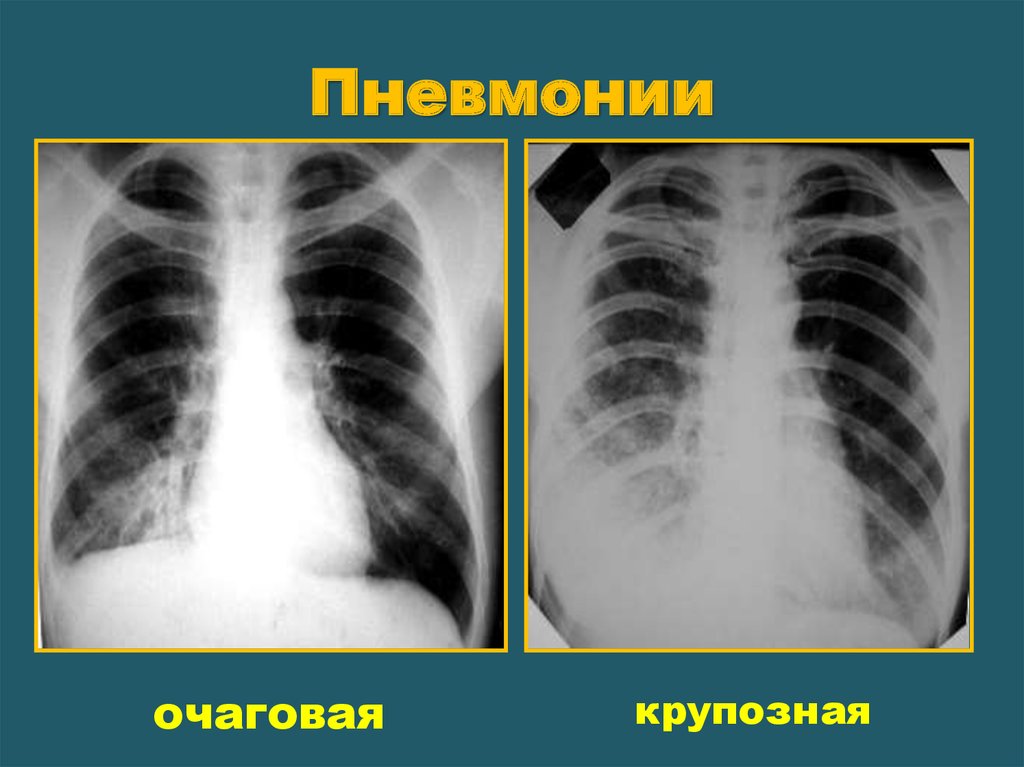 И флюорографическое обследование лёгких, являясь наиболее простым и доступным видом своевременного выявления новообразований в дыхательной системе, играет важнейшую роль в диагностике рака лёгкого на ранних стадиях.
И флюорографическое обследование лёгких, являясь наиболее простым и доступным видом своевременного выявления новообразований в дыхательной системе, играет важнейшую роль в диагностике рака лёгкого на ранних стадиях.
Пройти флюорографию можно в поликлинике по месту жительства! Будьте здоровы!
Врач-рентгенолог (заведующий) ГУЗ «Городская поликлиника №4 г. Гродно» Миклаш А.В..
Флуоресцентная визуализация для терапии рака и генной терапии рака
1. Ван Р.Э., Чжан Ю., Тянь Л., Цай В., Цай Дж. Визуализация HER-2 на основе антител: переход в клинику. Курс. Мол. Мед. 2013;13:1523–1537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Венто Дж., Малгаонкар А., Вулфорд Л., Нэм К., Кристи А., Багродиа А., де Леон А.Д., Ханнан Р., Боуман И. ., Маккей Р.М. Обнаружение PD-L1 с помощью иммуно-ПЭТ 89 Zr-атезолизумаб в опухолевых трансплантатах почечно-клеточного рака от пациента с благоприятным ответом на ниволумаб. Дж. Иммунотер. Рак. 2019;7:144. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Макканн Т.Е., Косака Н., Чойке П.Л., Кобаяши Х. Использование флуоресцентных белков для разработки зондов для визуализации раковых клеток. Методы Мол. биол. 2012; 872: 191–204. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Бхаумик С., Гамбхир С.С. Оптическая визуализация экспрессии репортерного гена люциферазы Renilla у живых мышей. проц. Натл. акад. науч. США. 2002; 99: 377–382. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Барнс Т.Г., Хомпс Р., Биркс Дж., Мортенсен Н.Дж., Джонс О., Линдси И., Гай Р., Джордж Б., Каннингем С., Йенг Т.М. Метиленовая синяя флуоресценция мочеточника во время колоректальной хирургии. Surg. Эндоск. 2018; 32:4036–4043. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Шебеш К.М., Бравански А., Хохенбергер К., Хохне Дж. Хирургия злокачественных опухолей головного мозга с использованием флуоресцентного натрия: история, современные концепции и будущий проект. Турк Нейрохирург. 2016;26:185–194. [PubMed] [Академия Google]
Турк Нейрохирург. 2016;26:185–194. [PubMed] [Академия Google]
7. Gioux S., Choi H.S., Frangioni J.V. Хирургия под визуальным контролем с использованием невидимого ближнего инфракрасного света: основы клинического применения. Мол. Визуализация. 2010;9:237–255. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Benya R., Quintana J., Brundage B. Побочные реакции на индоцианин зеленый: отчет о клиническом случае и обзор литературы. катет. Кардиовас. Диагн. 1989; 17: 231–233. [PubMed] [Google Scholar]
9. Прашер Д. К., Экенроде В. К., Уорд В. В., Прендергаст Ф. Г., Кормье М. Дж. Первичная структура зеленого флуоресцентного белка Aequorea victoria. Ген. 1992;111:229–233. [PubMed] [Google Scholar]
10. Саджеди С., Сабет Х., Чой Х.С. Интраоперационные системы биофотонной визуализации для вмешательств под визуальным контролем. Нанофотоника. 2019;8:99–116. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. ван Манен Л., Хандграаф Х.Дж.М., Диана М. , Дейкстра Дж., Исидзава Т., Вармейер А.Л., Миог Дж.С.Д. Практическое руководство по использованию индоцианина зеленого и метиленового синего в абдоминальной хирургии под флуоресцентным контролем. Дж. Сург. Онкол. 2018; 118: 283–300. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Дейкстра Дж., Исидзава Т., Вармейер А.Л., Миог Дж.С.Д. Практическое руководство по использованию индоцианина зеленого и метиленового синего в абдоминальной хирургии под флуоресцентным контролем. Дж. Сург. Онкол. 2018; 118: 283–300. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Моралес-Конде С., Аларкон И., Ян Т., Ликарди Э., Камачо В., Агилар Дель Кастильо Ф., Балла А. Флуоресцентная ангиография с индоцианином зеленым (ICG) для оценки анастомоза в колоректальной хирургии: где она имеет большую ценность? Surg. Эндоск. 2020;34:3897–3907. [PubMed] [Google Scholar]
13. Shen J.K., Jamnagerwalla J., Yuh B.E., Bassett M.R., Chenam A., Warner J.N., Zumkhawala A., Yamzon J.L., Whelan C., Ruel N.H. Индоцианиновая зеленая ангиография в режиме реального времени с помощью платформы флуоресцентной визуализации SPY уменьшает доброкачественные стриктуры мочеточников при отведении мочи, выполняемом во время радикальной цистэктомии. тер. Доп. Урол. 2019;11 1756287219839631. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Sun Z., Jing L., Fan Y., Zhang H., Chen L., Wang G., Sharma H.S., Wang J. Флуоресцентная хирургия глиом позвоночника: анализ 220 последовательных случаев. Междунар. Преподобный Нейробиол. 2020; 151: 139–154. [PubMed] [Google Scholar]
Sun Z., Jing L., Fan Y., Zhang H., Chen L., Wang G., Sharma H.S., Wang J. Флуоресцентная хирургия глиом позвоночника: анализ 220 последовательных случаев. Междунар. Преподобный Нейробиол. 2020; 151: 139–154. [PubMed] [Google Scholar]
15. Cavallo C., De Laurentis C., Vetrano I.G., Falco J., Broggi M., Schiariti M., Ferroli P., Acerbi F. Использование флуоресцеина в хирургии опухолей головного мозга : систематический обзор. Дж. Нейрохирург. науч. 2018;62:690–703. [PubMed] [Google Scholar]
16. Hillary S.L., Guillermet S., Brown NJ, Balasubramanian S.P. Использование метиленового синего и ближней инфракрасной флуоресценции в хирургии щитовидной и паращитовидной желез. Арка Лангенбека. Surg. 2018; 403:111–118. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Spinoglio G., Bertani E., Borin S., Piccioli A., Petz W. Флуоресценция зеленого индоцианина в роботизированной абдоминальной хирургии. Обновления Surg. 2018;70:375–379. [PubMed] [Google Scholar]
18. Квон И. Г., Сон Т., Ким Х. И., Хён В. Дж. Лимфаденэктомия под контролем флуоресцентной лимфографии во время роботизированной радикальной гастрэктомии при раке желудка. JAMA Surg. 2019;154:150–158. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Квон И. Г., Сон Т., Ким Х. И., Хён В. Дж. Лимфаденэктомия под контролем флуоресцентной лимфографии во время роботизированной радикальной гастрэктомии при раке желудка. JAMA Surg. 2019;154:150–158. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Gentileschi S., Servillo M., Albanese R., De Bonis F., Tartaglione G., Salgarello M. Лимфатическое картирование верхней конечности с лимфедемой до лимфатического супермикрохирургия путем зеркалирования здоровой конечности. Микрохирургия. 2017; 37: 881–889. [PubMed] [Google Scholar]
20. Smith B.L., Gadd M.A., Lanahan C.R., Rai U., Tang R., Rice-Stitt T., Merrill A.L., Strasfeld D.B., Ferrer J.M., Brachtel E.F., Specht M.C. Интраоперационное обнаружение остаточного рака молочной железы в стенках полости лампэктомии в режиме реального времени с использованием новой системы флуоресцентной визуализации, активируемой катепсином. Рак молочной железы Res. Обращаться. 2018;171:413–420. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Suurs F.V., Qiu S.Q., Yim J.J., Schröder C.P., Timmer-Bosscha H., Bensen E.S., Santini J.T., Jr., de Vries E.G.E., Bogyo M., van Dam G.M. Флуоресцентная хирургия под визуальным контролем при раке молочной железы путем внутривенного введения зонда на основе гасящей флуоресцентной активности для цистеиновых катепсинов в сингенной мышиной модели. EJNMMI Рез. 2020;10:111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Suurs F.V., Qiu S.Q., Yim J.J., Schröder C.P., Timmer-Bosscha H., Bensen E.S., Santini J.T., Jr., de Vries E.G.E., Bogyo M., van Dam G.M. Флуоресцентная хирургия под визуальным контролем при раке молочной железы путем внутривенного введения зонда на основе гасящей флуоресцентной активности для цистеиновых катепсинов в сингенной мышиной модели. EJNMMI Рез. 2020;10:111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Miampamba M., Liu J., Harootunian A., Gale A.J., Baird S., Chen S.L., Nguyen Q.T., Tsien R.Y., Gonzalez J.E. Sensitive in vivo Визуализация рака молочной железы с использованием логарифмического агента флуоресцентной визуализации, активируемого протеазой, AVB-620. Тераностика. 2017;7:3369–3386. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Брэдбери М.С., Паулия М., Занзонико П., Визнер У., Патель С. Интраоперационное картирование метастазов сигнальных лимфатических узлов с использованием клинически транслируемых сверхмалых наночастиц кремнезема. Уайли Междисциплинарный. Преподобный Наномед. Нанобиотехнология. 2016; 8: 535–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Уайли Междисциплинарный. Преподобный Наномед. Нанобиотехнология. 2016; 8: 535–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Baik F.M., Hansen S., Knoblaugh S.E., Sahetya D., Mitchell R.M., Xu C., Olson J.M., Parrish-Novak J., Méndez E. Флуоресцентная идентификация плоскоклеточного рака головы и шеи и высокого риска Оральная дисплазия с BLZ-100, конъюгатом хлоротоксин-индоцианин зеленый. JAMA Отоларингол. Хирургия головы и шеи. 2016; 142:330–338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Занзонико П., Карраскильо Дж. А., Пандит-Таскар Н., О’Донохью Дж. А., Хамм Дж. Л., Смит-Джонс П., Руан С., Дивги С. , Скотт А.М., Кемени Н.Е. Компартментальное моделирование антитела (124) I-A33 на основе ПЭТ: количественная характеристика специфического для пациента нацеливания на опухоль при колоректальном раке. Евро. Дж. Нукл. Мед. Мол. Визуализация. 2015;42:1700–1706. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Фаллахи Б., Хадеми Н., Карамзаде-Зиарати Н. , Фард-Эсфахани А., Эмами-Ардекани А., Фарзанефар С., Эфтехари М., Бейки Д. 99mTc-PSMA SPECT/CT Versus 68Ga- PSMA ПЭТ/КТ в оценке метастатического рака предстательной железы. клин. Нукл. Мед. 2021;46:e68–e74. [PubMed] [Google Scholar]
, Фард-Эсфахани А., Эмами-Ардекани А., Фарзанефар С., Эфтехари М., Бейки Д. 99mTc-PSMA SPECT/CT Versus 68Ga- PSMA ПЭТ/КТ в оценке метастатического рака предстательной железы. клин. Нукл. Мед. 2021;46:e68–e74. [PubMed] [Google Scholar]
27. Бхатнагар Дж., Хероман В., Мерфи М., Остин Г.Е. Иммуногистохимическое обнаружение карциноэмбрионального антигена в карциномах пищевода: сравнение с другими новообразованиями желудочно-кишечного тракта. Противораковый Рез. 2002;22:1849–1857. [PubMed] [Google Scholar]
28. de Geus S.W., Boogerd L.S., Swijnenburg R.J., Mieog J.S., Tummers W.S., Prevoo H.A., Sier C.F., Morreau H., Bonsing B.A., van de Velde C.J. Выбор опухолеспецифических молекулярных мишеней в аденокарциноме поджелудочной железы: прокладывая путь для хирургии поджелудочной железы под визуальным контролем. Мол. Визуализация Биол. 2016; 18:807–819. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Гебауэр Ф., Виклейн Д., Хорст Дж., Сандерманн П., Маар Х., Штрайхерт Т.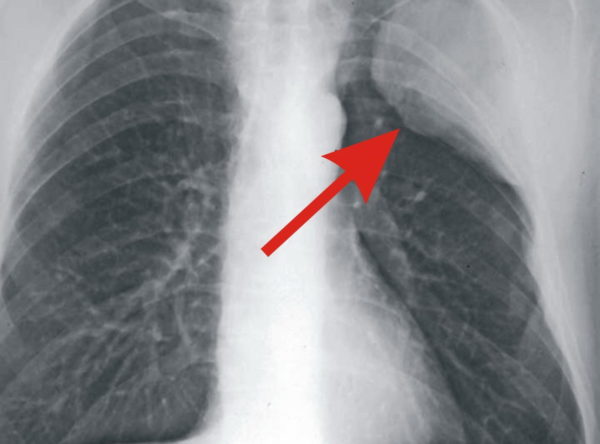 , Тачези М., Избицкий Дж. Р., Бокхорн М. , Schumacher U. Молекулы адгезии клеток, связанные с карциноэмбриональным антигеном (CEACAM) 1, 5 и 6, как биомаркеры рака поджелудочной железы. ПЛОС ОДИН. 2014;9:e113023. [PMC free article] [PubMed] [Google Scholar]
, Тачези М., Избицкий Дж. Р., Бокхорн М. , Schumacher U. Молекулы адгезии клеток, связанные с карциноэмбриональным антигеном (CEACAM) 1, 5 и 6, как биомаркеры рака поджелудочной железы. ПЛОС ОДИН. 2014;9:e113023. [PMC free article] [PubMed] [Google Scholar]
30. Kim J., Kaye F.J., Henslee J.G., Shively J.E., Park J.G., Lai S.L., Linnoila R.I., Mulshine J.L., Gazdar A.F. Экспрессия карциноэмбрионального антигена и родственных генов при раке легких и желудочно-кишечного тракта. Междунар. Дж. Рак. 1992; 52: 718–725. [PubMed] [Google Scholar]
31. Park S.-H., Ku K.-B., Chung H.-Y., Yu W. Прогностическое значение сывороточного и тканевого карциноэмбрионального антигена у больных аденокарциномой желудка. Рак рез. Обращаться. 2008; 40:16–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Hoogstins C.E.S., Boogerd L.S.F., Sibinga Mulder B.G., Mieog J.S.D., Swijnenburg R.J., van de Velde C.J.H., Farina Sarasqueta A., Bonsing B.A., Framery B., Pèlegrin A. Хирургия под визуальным контролем у пациентов с раком поджелудочной железы : Первые результаты клинических испытаний с использованием SGM-101, нового флуоресцентного агента ближнего инфракрасного диапазона, нацеленного на раково-эмбриональный антиген. Анна. Surg. Онкол. 2018;25:3350–3357. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Анна. Surg. Онкол. 2018;25:3350–3357. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Фреймери Б., Гутовски М., Дюма К., Эврар А., Мюллер Н., Дюбуа В., Хинонеро Дж., Шернински Ф., Пелегрин А. ., Cailler F. Токсичность и фармакокинетический профиль SGM-101, флуоресцентного химерного антитела против CEA для флуоресцентной визуализации опухолей у пациентов. Токсикол. Респ. 2019 г.;6:409–415. [PMC free article] [PubMed] [Google Scholar]
34. Gutowski M., Framery B., Boonstra M.C., Garambois V., Quenet F., Dumas K., Scherninski F., Cailler F., Vahrmeijer A.L., Pèlegrin A. SGM-101: инновационный конъюгат краситель-антитело для ближней инфракрасной области спектра, нацеленный на CEA, для флуоресцентной хирургии. Surg. Онкол. 2017;26:153–162. [PubMed] [Google Scholar]
35. Язаки П., Лвин Т., Минникс М., Ли Л., Шерман А., Молнар Дж., Миллер А., Франкель П., Чеа Дж., Поку Э. Усовершенствованная хирургия под контролем антител с красителем ближнего инфракрасного диапазона на пегилированном линкере для СЕА-положительных опухолей. Дж. Биомед. Опц. 2019;24:1–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Биомед. Опц. 2019;24:1–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Делонг Дж. К., Мураками Т., Язаки П. Дж., Хоффман Р. М., Буве М. Конъюгированные в ближней инфракрасной области гуманизированные антитела против раково-эмбрионального антигена нацелены на рак толстой кишки в ортотопическом обнаженном виде. — модель мыши. Дж. Сург. Рез. 2017; 218:139–143. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Lwin T.M., Murakami T., Miyake K., Yazaki P.J., Shivley J.E., Hoffman R.M., Bouvet M. Опухолеспецифическая маркировка рака поджелудочной железы с использованием гуманизированного антигена. -CEA-антитело, конъюгированное с флуорофором ближнего инфракрасного диапазона. Анна. Surg. Онкол. 2018;25:1079–1085. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Lwin T.M., Miyake K., Murakami T., DeLong J.C., Amirfakhri S., Filemoni F., Yoon S.N., Yazaki PJ, Shivley J.E., Datnow B. Флуоресцентное гуманизированное антитело против СЕА специфически маркирует метастатический рак поджелудочной железы в мышиной модели ортотопического ксенотрансплантата (PDOX), полученного от пациента. Онкотаргет. 2018;9:37333–37342. [PMC free article] [PubMed] [Google Scholar]
Онкотаргет. 2018;9:37333–37342. [PMC free article] [PubMed] [Google Scholar]
39. Metildi C.A., Kaushal S., Pu M., Messer K.A., Luiken G.A., Moossa A.R., Hoffman R.M., Bouvet M. Флуоресцентная хирургия с флуорофором. конъюгированное антитело к карциноэмбриональному антигену (CEA), которое выделяет опухоль, улучшает хирургическую резекцию и увеличивает выживаемость в ортотопических мышиных моделях рака поджелудочной железы человека. Анна. Surg. Онкол. 2014;21:1405–1411. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Adusumilli P.S., Eisenberg D.P., Stiles B.M., Chung S., Chan M.K., Rusch V.W., Fong Y. Интраоперационная локализация метастазов в лимфатических узлах с вирусом простого герпеса, способным к репликации. Дж. Торак. Кардиовас. Surg. 2006; 132:1179–1188. [PubMed] [Google Scholar]
41. Станциале С.Ф., Стайлз Б.М., Бхаргава А., Кернс С.А., Калаконда Н., Фонг Ю. Онколитический мутант вируса простого герпеса-1, экспрессирующий зеленый флуоресцентный белок, может обнаруживать и лечить рак брюшины. Гум. Джин Тер. 2004;15:609–618. [PubMed] [Google Scholar]
Гум. Джин Тер. 2004;15:609–618. [PubMed] [Google Scholar]
42. Gil Z., Cavel O., Kelly K., Brader P., Rein A., Gao S.P., Carlson D.L., Shah J.P., Fong Y., Wong R.J. Паракринная регуляция инвазии раковых клеток поджелудочной железы периферическими нервами. Дж. Натл. Рак инст. 2010; 102:107–118. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Айзенберг Д.П., Адусумилли П.С., Хендершотт К.Дж., Чанг С., Ю З., Чан М.К., Хезел М., Вонг Р.Дж., Фонг Ю. Интраоперационная в режиме реального времени выявление метастазов рака молочной железы в подмышечные лимфатические узлы с помощью вируса герпеса, экспрессирующего зеленый флуоресцентный белок. Анна. Surg. 2006; 243:824–830, обсуждение 830–832. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Adusumilli P.S., Eisenberg D.P., Chun Y.S., Ryu K.W., Ben-Porat L., Hendershott K.J., Chan M.K., Huq R., Riedl C.C., Fong Y. Вируснонаправленная флуоресцентная визуализация улучшает диагностическую чувствительность при обнаружении минимальных остаточная болезнь после потенциально излечивающей циторедуктивной хирургии.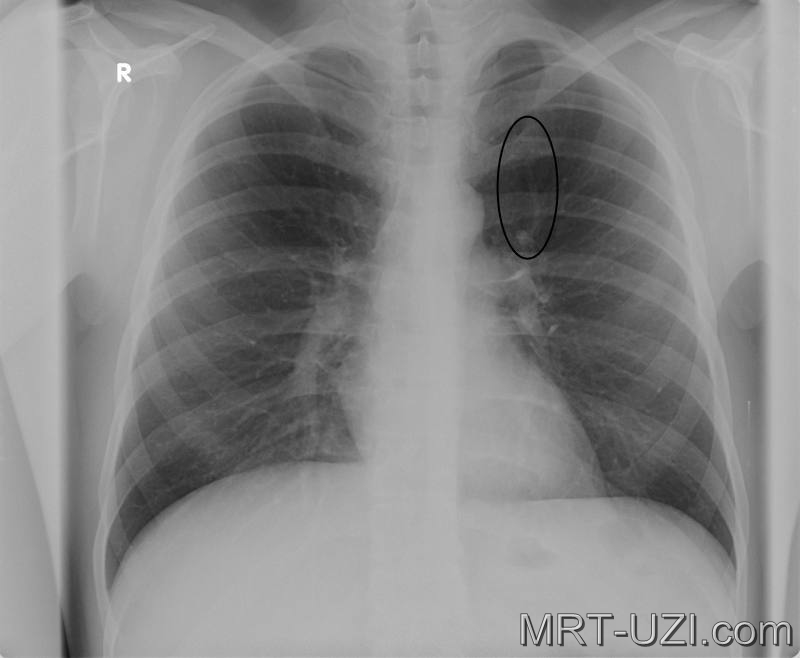 Дж. Гастроинтест. Surg. 2005; 9: 1138–1146, обсуждение 1146–1147. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Гастроинтест. Surg. 2005; 9: 1138–1146, обсуждение 1146–1147. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Келли К.Дж., Вонг Дж., Гонен М., Аллен П., Бреннан М., Койт Д., Фонг Ю. Испытание генетически модифицированного простого герпеса на людях Вирус для быстрого обнаружения положительной перитонеальной цитологии при постановке рака поджелудочной железы. ЭБиоМедицина. 2016;7:94–99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Холлоуэй Р.В., Кендрик Дж.Э., Стивенс А., Кеннард Дж., Берт Дж., ЛеБлан Дж., Селлерс К., Смит Дж., Кокли С. Фаз 1b исследование онколитического вируса коровьей оспы GL-ONC1 при рецидивирующем раке яичников (РПЯ) J. Clin. Онкол. 2018;36:5577. [Google Scholar]
47. Holloway R.W., Mendivil A.A., Kendrick J.E., Abaid L.N., Brown J.V., Fitzsimmons C.K., Kennard J.A., King M.M., LeBlanc J., Lopez K. Испытание VIRO-15 фазы II олвимулогена нанивацирепвека (Olvi -Vec)-примированная иммунохимиотерапия при резистентном к платине/рефрактерном раке яичников (PRROC) (NCT02759588) Гинекол. Онкол. 2020;159:60. [Google Scholar]
Онкол. 2020;159:60. [Google Scholar]
48. Zhang Q., Yu Y.A., Wang E., Chen N., Danner R.L., Munson P.J., Marincola F.M., Szalay A.A. Эрадикация солидных опухолей молочной железы человека у голых мышей с помощью внутривенной инъекции светоизлучающего онколитического вируса коровьей оспы. Рак рез. 2007;67:10038–10046. [PubMed] [Google Scholar]
49. Лауэр У.М., Шелл М., Бейл Дж., Берхтольд С., Коппенхёфер У., Глатцле Дж., Кенигсрайнер А., Мёле Р., Нанн Д., Фенд Ф. Фаз I Изучение онколитического вируса коровьей оспы GL-ONC1 у пациентов с перитонеальным карциноматозом. клин. Рак рез. 2018;24:4388–439[PubMed] [Google Scholar]
Фаза I испытания внутривенного онколитического вируса осповакцины (GL-ONC1) с цисплатином и лучевой терапией у пациентов с локорегионально распространенным раком головы и шеи. клин. Рак рез. 2017;23:5696–5702. [PubMed] [Google Scholar]
Лучшее сканирование для обнаружения рака
Лучшее сканирование для обнаружения рака
Медицинская визуализация
Раннее обнаружение и диагностика рака могут значительно повысить ваши шансы на успешное лечение. Лечение рака на ранних стадиях также может быть менее дорогим и сложным, чем более сложные методы лечения, которые могут избавить вас и вашу семью от душевных страданий.
Лечение рака на ранних стадиях также может быть менее дорогим и сложным, чем более сложные методы лечения, которые могут избавить вас и вашу семью от душевных страданий.
Раннее выявление также помогает врачам выявлять предраковые аномалии тканей, которым суждено стать опасными для жизни видами рака, что дает возможность раннего вмешательства для предотвращения развития рака вообще. Точно так же возможность точного выявления предраковых аномалий тканей и раннего рака до того, как он перерастет в потенциально фатальное злокачественное новообразование, также может избавить вас и вашу семью от потенциального финансового и физического бремени ненужного лечения.
Тем не менее слишком многим людям диагностируют рак на поздних стадиях, что ставит под угрозу их шансы на успешное лечение и долгосрочное выживание. Визуализация в диагностике рака может быть полезным инструментом для выявления злокачественных новообразований на самых ранних стадиях, чтобы повысить эффективность лечения.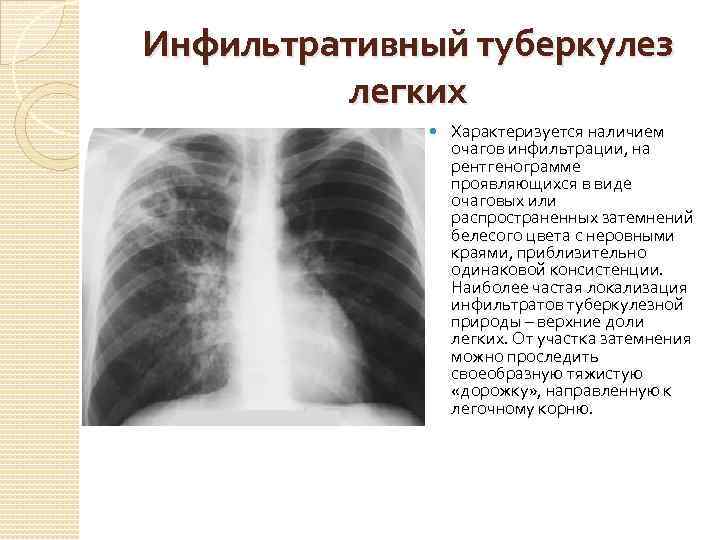
Что такое визуализирующие тесты и как они могут выявить рак?
Визуализирующие тесты помогают врачам понять, что происходит внутри вашего тела, а также могут показать врачу, насколько далеко распространился ваш рак и работает ли лечение.
Визуализирующие тесты работают, посылая различные виды энергии — например, звуковые волны, рентгеновские лучи, магнитные поля или радиоактивные частицы — через ваше тело. Ткани вашего тела затем изменяют эти энергетические паттерны, чтобы создать картинку или образ.
Врачи используют визуализирующие тесты для выявления рака различными способами, в том числе:
- Выявление рака на самых ранних стадиях, когда он мал и не распространяется, и у вас нет симптомов.
- Ищите припухлость или опухоль, если у вас есть симптомы. Они также могут определить, является ли это раком или другим заболеванием, вызывающим ваши симптомы.
- Прогнозирование того, является ли ваша опухоль потенциально злокачественной, и необходимо ли врачу удалить и проанализировать небольшой образец ткани, чтобы определить это.
- Увидеть, где находится ваша опухоль, даже если она находится глубоко внутри вашего тела.
- Выяснить, на какой стадии находится ваш рак и не распространился ли он на другие части тела.
- Планирование лечения, например, показ того, куда врачу нужно направить лучи лучевой терапии рака.
- Определение того, увеличилась ли ваша опухоль, уменьшилась ли она или осталась прежней после лечения. Это позволяет врачу узнать, насколько хорошо работает ваше лечение и необходимы ли какие-либо изменения в терапии.
- Определение рецидива рака после лечения.
Визуализирующие обследования — это лишь часть диагностики и лечения рака. Полное обследование на рак также включает информирование врача о вашей истории болезни. Вы расскажете им о своих факторах риска и симптомах. Они проведут медицинский осмотр и назначат анализ крови и, возможно, другие лабораторные анализы.
Запишитесь на прием в Envision Imaging
Типы визуализационных тестов для выявления рака и преимущества каждого из них
Итак, какие тесты проводятся для выявления рака? Различные типы сканирования на наличие рака включают следующее.
1. Компьютерная томография (КТ)
Врач использует компьютерную томографию, чтобы сделать снимки внутренней части вашего тела под разными углами с помощью рентгеновских лучей. Затем компьютер объединяет изображения в трехмерное детальное изображение, чтобы выявить любые опухоли или аномалии. В некоторых случаях врач закажет специальный краситель, называемый контрастным веществом, который техник даст вам перед сканированием, чтобы обеспечить лучшую детализацию изображения. Они либо введут краситель в вашу вену, либо дадут жидкость или таблетку, которую вы проглотите.
Общие области сканирования включают:
- Шея
- Головка
- Брюшная полость
- Сундук
- Конечности
- Таз
КТ всего тела обычно включает как минимум брюшную полость, грудную клетку и таз — обычно для определения стадии рака.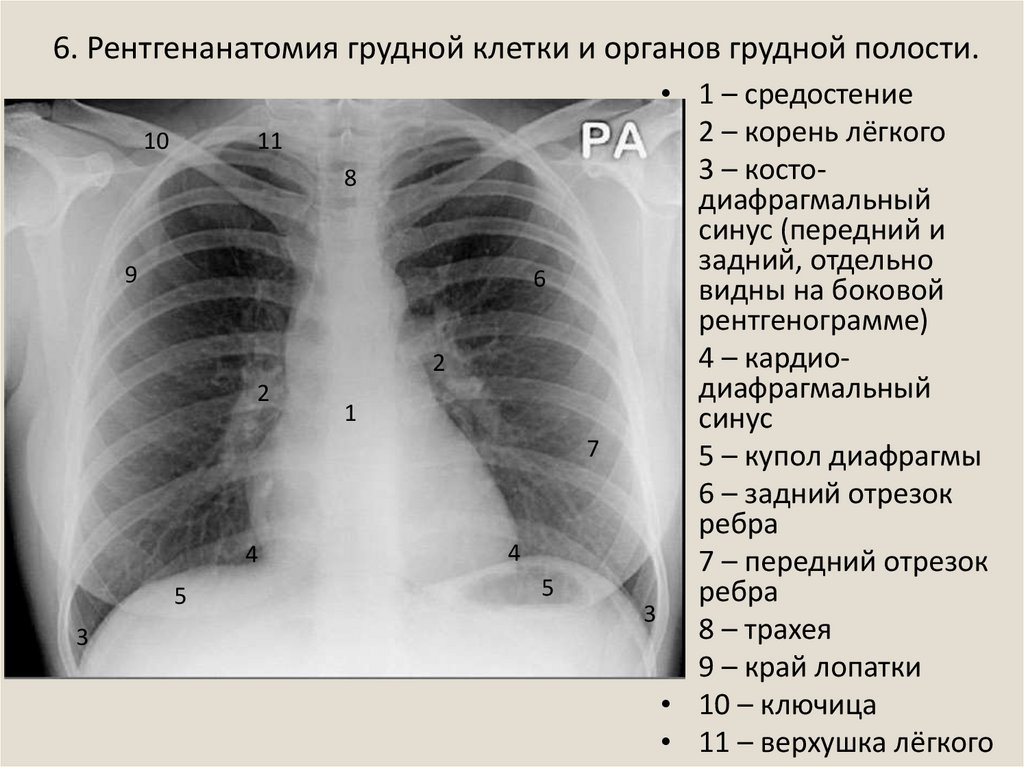
Преимущества компьютерной томографии
Компьютерная томография может помочь врачам:
- Узнать стадию своего рака. Когда врач знает об этом, он может выбрать лучший курс лечения и, возможно, даже предсказать ваши шансы на выздоровление.
- Определите правильную область для биопсии.
- План лучевой терапии.
- Оцените эффективность лечения во время контрольных визитов.
- Оценить успешность лечения после его завершения и во время последующего наблюдения.
2. Магнитно-резонансная томография (МРТ)
МРТ использует мощные радиоволны и магниты для создания подробных компьютерных изображений вашего тела. Врачи также используют его для измерения размера вашей опухоли. На стандартном аппарате МРТ есть узкое туннельное отверстие. В некоторых центрах есть более «открытые» или менее ограниченные аппараты МРТ, которые идеально подходят для пациентов, страдающих клаустрофобией.
МРТ не использует рентгеновские лучи или другие виды излучения.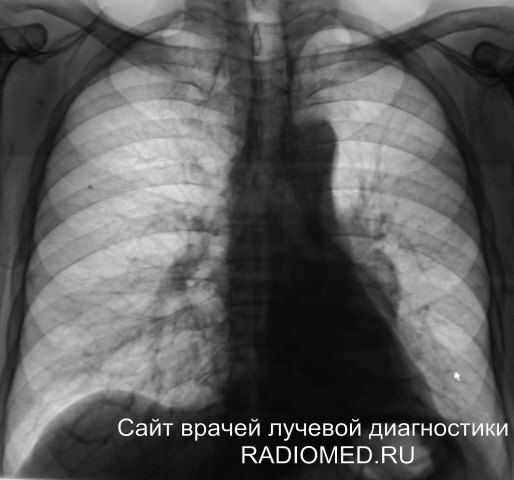 Из-за этого врачи обращаются за помощью к МРТ для поиска проблем в мужской и женской репродуктивной системе. Как правило, это безопасно, даже если вы беременны. Врачи используют МРТ, чтобы сделать снимки позвоночника, головного мозга, грудной клетки, живота и молочной железы.
Из-за этого врачи обращаются за помощью к МРТ для поиска проблем в мужской и женской репродуктивной системе. Как правило, это безопасно, даже если вы беременны. Врачи используют МРТ, чтобы сделать снимки позвоночника, головного мозга, грудной клетки, живота и молочной железы.
Преимущества МРТ
МРТ может помочь врачам:
- Определить, является ли опухоль злокачественной или доброкачественной.
- Определите размер и расположение опухоли.
- Мониторинг эффективности лечения.
- Спланируйте лечение рака, например лучевую терапию или хирургическое вмешательство.
3. Ультразвук
Ультразвук – это визуализирующие исследования, также называемые ультрасонографией или сонографией. Ультразвук создает изображения внутренних органов с помощью высокочастотных звуковых волн. Эти звуковые волны воздействуют на ваши органы, возвращаясь к устройству, известному как преобразователь. Этот преобразователь воспринимает звуковые волны и превращает их в изображения, отображаемые на компьютере.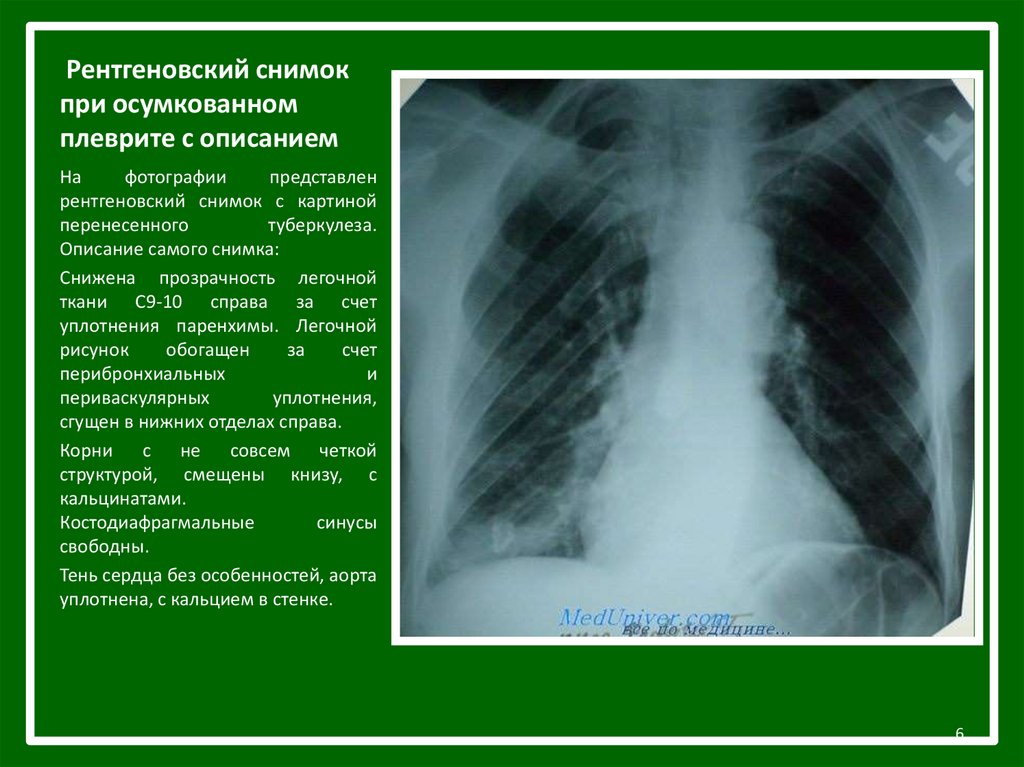
Звуковые волны имеют уникальное эхо, когда они отражаются от здоровых и аномальных тканей, помогая врачам обнаружить возможную опухоль. В ультразвуковых тестах нет рентгеновского облучения, что означает, что его можно безопасно использовать во время беременности.
Преимущества УЗИ
УЗИ помогает врачам увидеть опухоли в определенных областях тела, которые обычно плохо видны на рентгеновских снимках. Врачи часто используют ультразвук для направления игл во время биопсии. УЗИ, как правило, быстрое, и большинство из них не требует специальной подготовки. Часто врачи проводят их амбулаторно, и пациенты обычно не испытывают боли во время УЗИ.
Ультразвук — эффективный способ отличить солидные опухоли от заполненных жидкостью кист из-за их различной эхо-картины.
4. Позитронно-эмиссионная томография и компьютерная томография (ПЭТ-КТ)
Врачи могут сочетать ПЭТ-сканирование с компьютерной томографией. Однако ваш врач может назвать это сканированием ПЭТ. Это эффективный визуализирующий тест для выявления рака и определения его стадии. Стадия рака описывает локализацию рака, его распространение и изменение функции ваших органов. Когда ваш врач определит это, это поможет ему разработать для вас наилучший план лечения. Возможно, они даже смогут предсказать ваши шансы на выздоровление.
Это эффективный визуализирующий тест для выявления рака и определения его стадии. Стадия рака описывает локализацию рака, его распространение и изменение функции ваших органов. Когда ваш врач определит это, это поможет ему разработать для вас наилучший план лечения. Возможно, они даже смогут предсказать ваши шансы на выздоровление.
Преимущества ПЭТ-сканирования
ПЭТ-сканирование помогает врачам:
- Определить подходящее место для выполнения биопсии.
- Оцените лечение рака и узнайте, работает ли оно и насколько хорошо.
- План лучевой терапии.
5. Маммография
Маммография – это рентген, который врач использует для проверки женщин на наличие рака молочной железы. Маммограммы — это изображения, которые он производит. На изображениях могут быть видны небольшие опухоли, которые вы или врач не можете почувствовать. Маммограммы также могут указывать на другие аномалии груди.
Существует два типа маммографии.
- Скрининговая маммография: Врачи используют этот тип маммографии у женщин с раком молочной железы, но без симптомов.
 Цель состоит в том, чтобы выявить рак на ранней стадии, когда он более поддается лечению.
Цель состоит в том, чтобы выявить рак на ранней стадии, когда он более поддается лечению. - Диагностическая маммография: Врачи могут выполнять этот тест, чтобы ответить на конкретный вопрос или узнать больше об одном из ваших симптомов.
Преимущества скрининговой или диагностической маммографии
Скрининговые маммограммы в помощь врачам:
- Выявить подозрительную область.
- Подтвердите опухоль в груди.
- Определите причину необычных симптомов.
Диагностическая маммография в помощь врачам:
- Сделайте больше снимков груди, чем при скрининговой маммографии.
6. Магнитно-резонансная томография (МРТ) молочных желез
МРТ молочных желез — это диагностическое обследование, которое ваш врач может порекомендовать вам пройти после маммографии. Он захватывает несколько изображений тканей молочной железы с помощью магнитных полей. Аппарат объединяет изображения для создания подробных компьютерных изображений тканей груди.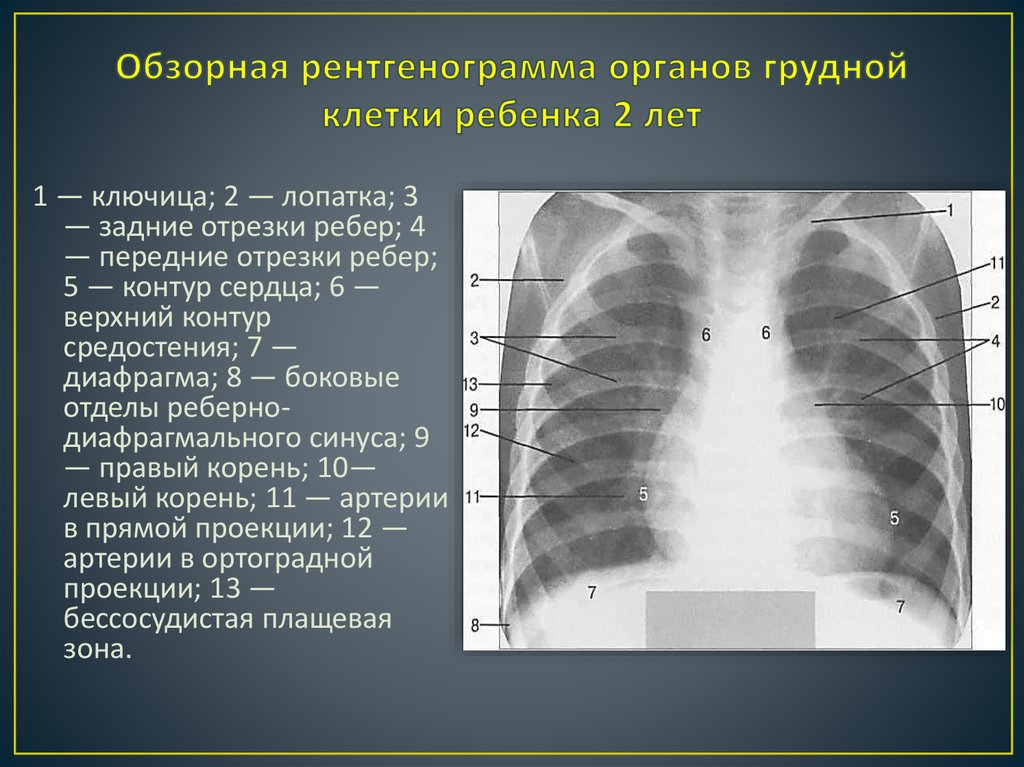
Преимущества МРТ груди
МРТ груди может помочь врачам:
- Обследование женщин с высоким риском рака груди.
- Диагностика и оценка опухолей молочной железы. Он лучше справляется с выявлением небольшого образования в женской груди, чем УЗИ или маммография, особенно если у вас нежировая, плотная ткань молочной железы.
- Узнайте больше о раке, выявленном при ощупывании груди, но не видимом на УЗИ или маммографии.
- Определение размера опухоли и степени ее распространения после постановки диагноза рака молочной железы (стадия рака).
- Мониторинг эффективности химиотерапии при лечении рака.
- Оцените область, где врач удалил раковую ткань молочной железы в рамках последующего наблюдения.
- Узнайте, не порвались ли ваши грудные имплантаты.
7. Рентгеновские снимки
Они помогают врачу выявить рак в различных частях тела, включая такие органы, как почки, желудок и кости. Рентген обычно делается быстро, безболезненно и не требует какой-либо специальной подготовки.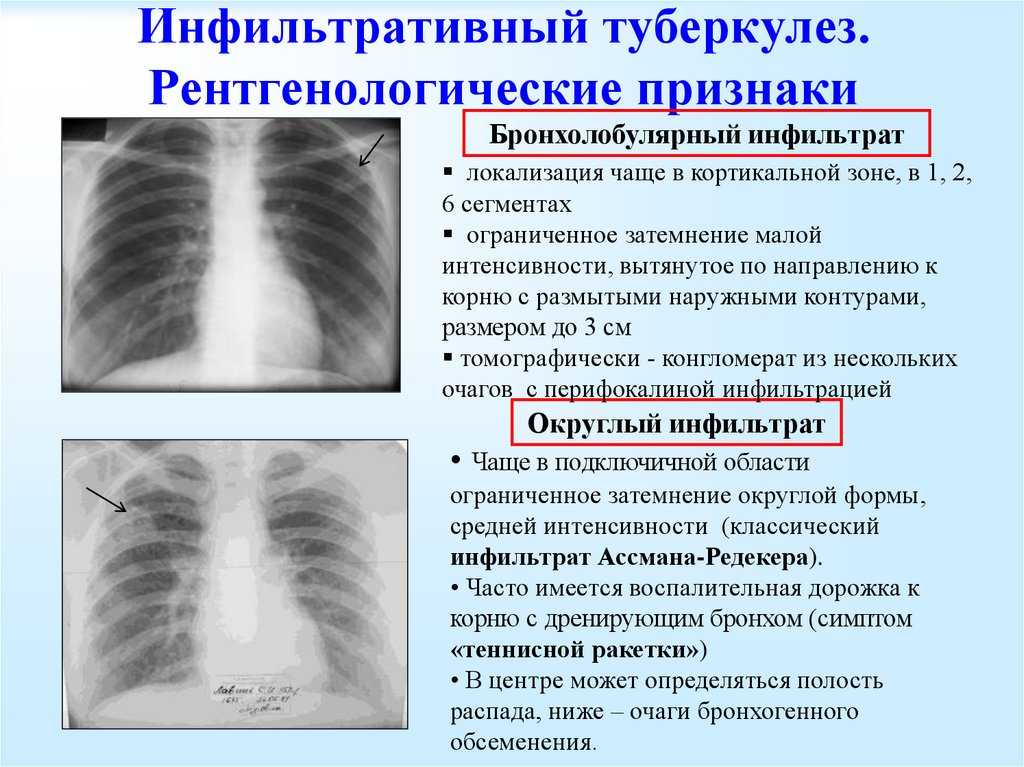 Контрастные исследования могут потребовать дополнительной подготовки и могут вызвать некоторые побочные эффекты и дискомфорт, в зависимости от вашего типа.
Контрастные исследования могут потребовать дополнительной подготовки и могут вызвать некоторые побочные эффекты и дискомфорт, в зависимости от вашего типа.
Контрастные исследования, представляющие собой особый вид рентгеновских исследований, используют контрастные вещества или красители на основе йода, такие как барий, в сочетании с рентгеновскими лучами, чтобы ваши органы выглядели выделенными на рентгеновском снимке, и врач мог получить более качественные изображения.
Преимущества рентгена
Рентген стоит не так дорого, как другие виды сканирования. Поэтому врачи могут использовать их для быстрого получения информации и перед назначением других последующих тестов. Рентгенологическое исследование безболезненно и быстро. В низких дозах врач может использовать их для получения изображений структур внутри вашего тела для обнаружения и определения стадии опухоли. Рентгеновские лучи производят минимальное радиационное воздействие, и, согласно исследованиям, преимущества перевешивают риски.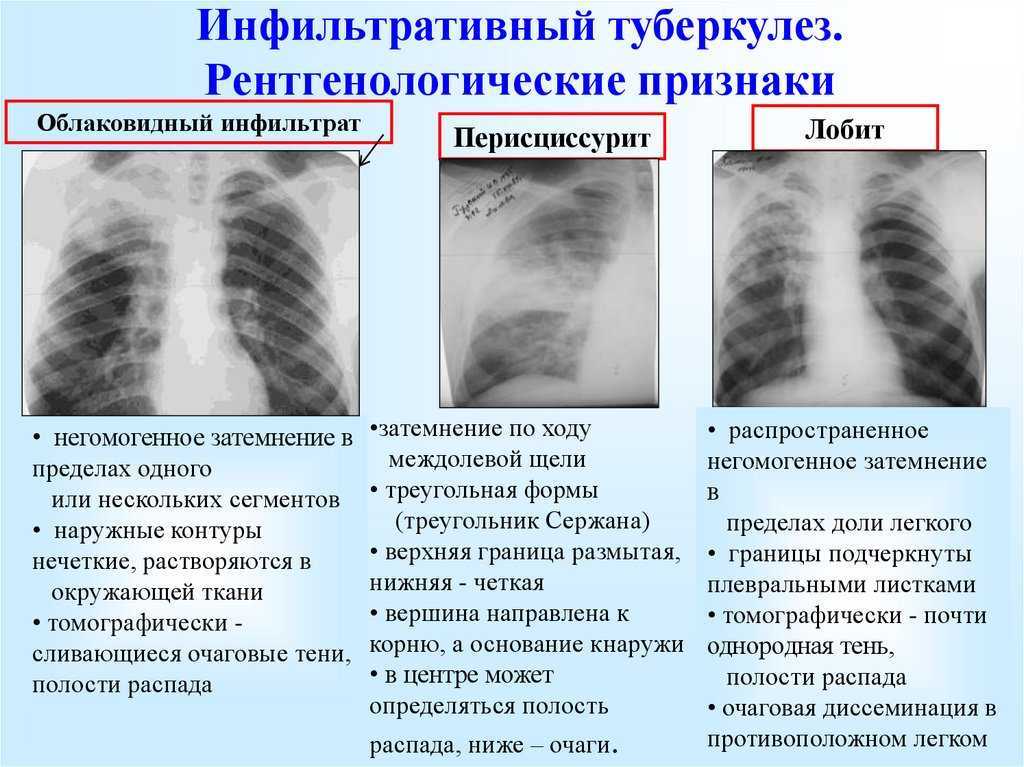 Врачи могут использовать рентгеновские лучи в более высоких дозах в лучевой терапии для уничтожения раковых клеток в организме.
Врачи могут использовать рентгеновские лучи в более высоких дозах в лучевой терапии для уничтожения раковых клеток в организме.
8. Сканирование ядерной медицины для выявления рака
Сканирование ядерной медицины генерирует изображения на основе химии вашего тела, а не на физических формах и формах, как при других тестах визуализации. При сканировании используются жидкие вещества, известные как радионуклиды, радиофармацевтические препараты или индикаторы, которые выделяют низкий уровень радиации.
Ткани тела, пораженные некоторыми заболеваниями, такими как рак, могут поглощать больше или меньше индикатора, чем нормальные ткани. Специальные камеры улавливают картину радиоактивности для создания изображений, которые показывают врачу, куда перемещается индикатор, а также где он собирается.
Опухоль может отображаться на изображении как «горячая точка», если рак присутствует. «Горячая точка» — это место повышенного поглощения индикатора и клеточной активности.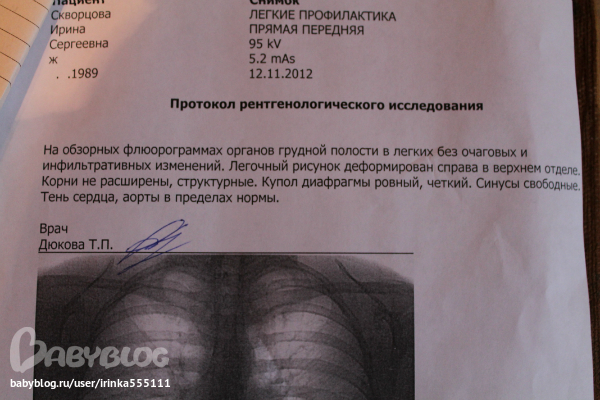
Врач определит тип ядерного сканирования, которое вы получите, в зависимости от того, какой орган он хочет исследовать. Несколько распространенных ядерных сканирований, используемых при раке, включают:
- ПЭТ-сканы
- Сканирование костей
- Галлиевые сканы
- Сканирование с множественными входами
- Сканирование щитовидной железы
Ядерное сканирование может не идентифицировать крошечные опухоли и не всегда может определить, является ли опухоль раком.
Преимущества сканирования ядерной медицины
Сканирование ядерной медицины помогает врачам выявлять опухоли и определять степень распространения рака по всему телу. Они также помогают врачам узнать, работает ли лечение. Это относительно безболезненные тесты, которые обычно проводятся амбулаторно.
Анализы, которые рекомендует врач, могут зависеть от нескольких факторов, в том числе:
- Расположение опухоли и ее тип. Некоторые визуализирующие тесты работают лучше, чем другие, для разных областей тела.
- Ваш пол, возраст и общее состояние здоровья
- Независимо от того, требует ли ваш врач биопсию
- Стоимость
- Баланс между любыми побочными эффектами или рисками и ожидаемой пользой
- Ваш выбор
Сообщите своему врачу, если у вас есть какие-либо вопросы по поводу рекомендуемого им метода визуализации. Попросите их объяснить вам причину теста, плюсы и минусы, что он может найти и могут ли другие альтернативы подойти лучше.
Запишитесь на прием в Envision Imaging для сканирования рака
Запишитесь на сканирование рака сегодня с помощью Envision Imaging. Наши специалисты в области здравоохранения очень сосредоточены на улучшении вашего благополучия и здоровья благодаря нашему гостеприимству и опыту.
Рассмотрите следующие преимущества выбора Envision Imaging для ваших нужд визуализации.
- Приятный и теплый опыт для пациентов : Мы относимся к нашим пациентам с величайшим уважением, обязуясь быть дружелюбными, полезными и своевременными. Вы обнаружите, что наши офисы наполнены светом, элегантны и удобны, и что мы проявляем сострадание, когда удовлетворяем ваши потребности.
- Быстрая скорость обработки : Мы оптимизировали скорость обработки, чтобы ваш врач мог позаботиться о ваших медицинских потребностях и вернуть вас к обычному графику как можно быстрее.
- Самая инновационная технология визуализации : Мы поддерживаем передовую технологию визуализации, которая обеспечивает надежность и точность результатов ваших процедур.

