Бронхиальная астма и курение uMEDp
Доля курильщиков среди больных бронхиальной астмой (БА) составляет 25–35%, что сопоставимо с распространенностью курения в популяции в целом. Активное и пассивное табакокурение ассоциируется с повышенным риском развития БА, увеличением частоты обострений, ускорением прогрессирования БА, потерей контроля над заболеванием, ухудшением или отсутствием ответа на терапию глюкокортикостероидами. Наряду с отказом от курения эффективной стратегией преодоления стероидной резистентности у курящих больных БА является назначение комбинированных препаратов ингаляционных глюкокортикостероидов (ИГКС) и бета-2-агонистов длительного действия.Благодаря таким свойствам, как оптимальное распределение препарата в малых дыхательных путях, выраженный бронхолитический и противовоспалительный эффект, уменьшение воздушных ловушек, улучшение функции легких и контроля БА, наиболее оправданным у курящих пациентов с БА представляется применение экстрамелкодисперсной фиксированной комбинации беклометазона дипропионата и формотерола (препарат Фостер).
Рис. 1. Факторы, влияющие на развитие и проявления БА
Рис. 2. Механизм повреждающего действия табачного дыма на дыхательные пути
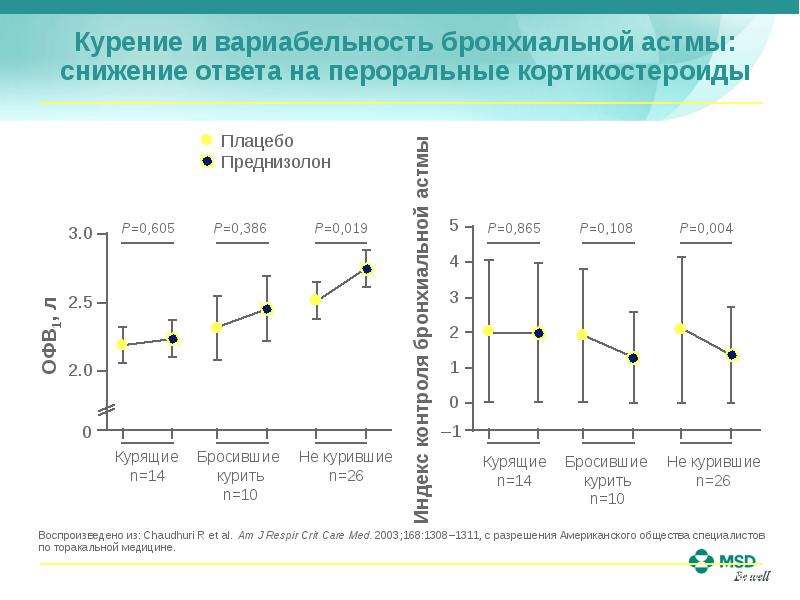
Рис. 3. Вариабельность ответа на ИГКС (изменения утренней ПСВ) у некурящих больных БА и курильщиков
Рис. 5. Механизм противовоспалительной активности ГКС и возможные пути и механизмы развития стероидной резистентности у курящих пациентов с БА*
Рис. 6. Динамика изменения функции легких в результате терапии ФП 1000 мкг/день у отказавшихся от курения больных БА и продолжающих курить
6. Динамика изменения функции легких в результате терапии ФП 1000 мкг/день у отказавшихся от курения больных БА и продолжающих курить
Рис. 8. Пропорция пациентов с разным уровнем контроля БА в зависимости от терапии различными фиксированными комбинациями ИГКС/ДДБА
Рис. 9. Сравнительная эффективность контроля БА у курящих пациентов при лечении фиксированными комбинациями ИГКС/ДДБА
Рис. 10. Динамика ОФВ1 в процессе терапии экстрамелкодисперсным БДП/Ф (Фостером) у больных среднетяжелой и тяжелой БА
Таблица. Состав табачного дыма*
Состав табачного дыма*

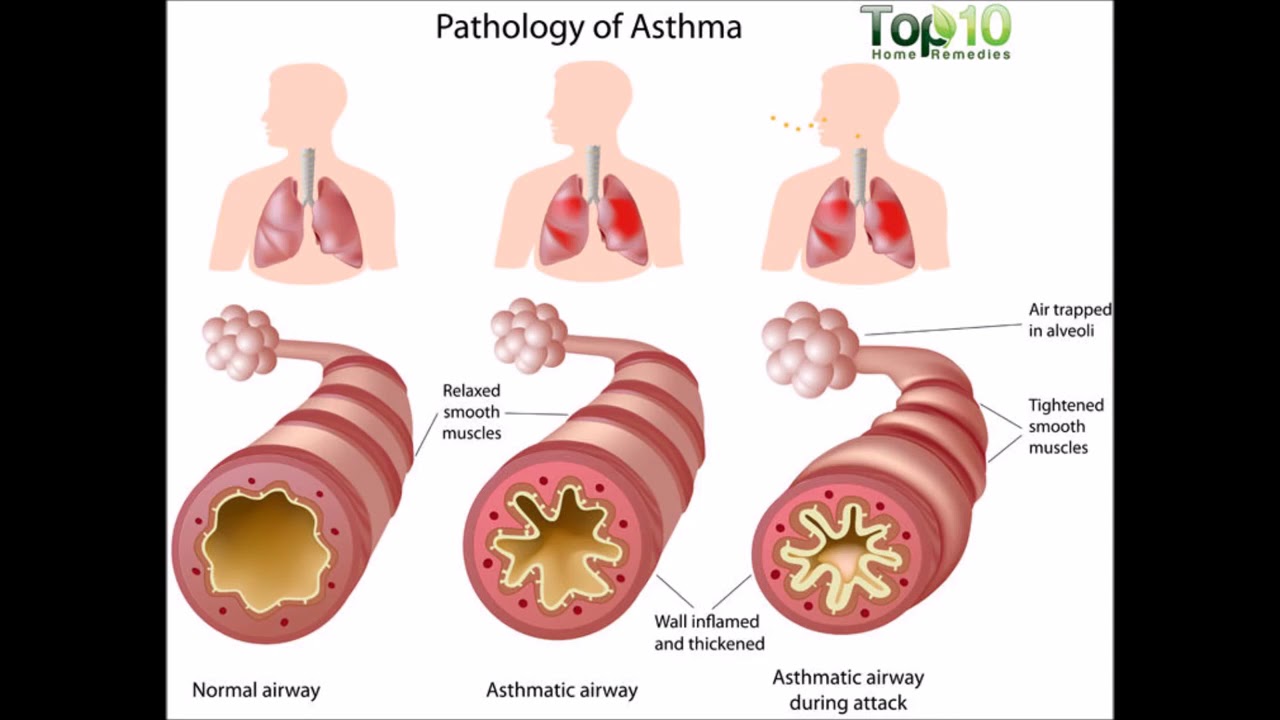
Механизм повреждающего действия табачного дыма на дыхательные пути
Табачный дым содержит две фракции: газообразную и корпускулярную, в состав которых входят основные ингредиенты, представленные в таблице [5]. Важной характеристикой частиц табачного дыма является их размер. Как оказалось, многие частицы имеют средний аэродинамический размер менее 1 мкм [6], а стало быть, могут достигать не только крупных и средних, но и мелких бронхов, внутренний диаметр которых ≤ 2 мм. Патологическое воздействие табачного дыма на дыхательные пути человека многообразно (рис.
Снижается биотрансформация химических соединений и, в первую очередь, токсических веществ табачного дыма клетками Клара. Это нецилиарные эпителиальные клетки, которых особенно много в терминальных отделах дыхательных путей. В таких условиях кадмий и формальдегид оказывают выраженное токсическое действие на все клетки аппарата дыхания. Наконец, табачный дым стимулирует высвобождение провоспалительных медиаторов (интерлейкин 8 (ИЛ-8), интерлейкин 6 (ИЛ-6), лейкотриен В4, простагландин E2, эотаксин-1 и др.), способствует повышению проницаемости эпителия и увеличению количества нейтрофилов в слизистой бронхов. Все эти изменения приводят к формированию преимущественно нейтрофильного типа воспаления слизистой оболочки дыхательных путей у курящих больных БА [8, 9].
Относительно недавнее клиническое исследование, включившее 147 больных БА, продемонстрировало более выраженный процесс ремоделирования бронхиальной стенки у курящих пациентов по сравнению с некурящими или бросившими курить больными БА [10]. При этом выраженность процесса ремоделирования коррелировала с выраженностью клинических симптомов БА. Кроме того, количество тучных клеток было больше, а число эозинофилов меньше в слизистой оболочке дыхательных путей курящих больных по сравнению с некурящими пациентами, что было показано с помощью бронхиальной биопсии.
Существуют исследования, доказывающие, что курение приводит к воспалительным изменениям и ремоделированию дыхательных путей независимо от наличия обструктивного синдрома, причем эти изменения развиваются как в центральных, так и в периферических бронхах [11, 12]. Таким образом, курение больных БА связано с индукцией воспаления (преимущественно нейтрофильного) в дыхательных путях (в основном в малых бронхах), развитием ремоделирования дыхательных путей (в том числе дистальных), формированием воздушных ловушек и гетерогенностью вентиляции легких [13, 14].
Курение и риск развития БА
Существует большая доказательная база исследований, в которых изучалось влияние курения женщины во время беременности на развитие БА у ребенка. Доказано, что курение беременных женщин приводит к снижению функции легких у детей и связано с заболеваниями, сопровождающимися свистящим дыханием у детей, как в первые годы жизни, так и после 16-летнего возраста [15–18]. У таких детей значимо выше частота развития БА и заболеваемость респираторными инфекционными болезнями. Курение матери во время беременности приводит к гиперпродукции иммуноглобулина класса Е (IgE), стимулирует синтез провоспалительных цитокинов и лимфопролиферативный ответ у новорожденного [19]. Это влияние может быть обусловлено развитием окислительного стресса в дыхательных путях ребенка в результате пассивного курения в раннем постнатальном периоде [20]. Именно поэтому мерами первичной профилактики аллергических заболеваний у детей, имеющих высокий риск их развития, являются:
- предупреждение патологического течения беременности;
- сохранение естественного вскармливания ребенка до 4–6 месяцев жизни;
- исключение влияния табачного дыма.

В популяционном исследовании R. Piipari и соавт. [22] изучили влияние активного курения в настоящем и в прошлом (бывшие курильщики) на развитие БА у взрослых. Как оказалось, случаи заболевания БА у активных курильщиков встречались значимо чаще (ОШ 1,33, ДИ 1,00–1,77) по сравнению с лицами, никогда не курившими. Среди бывших курильщиков заболеваемость БА тоже была в 1,5 раза выше (ОШ 1,49, ДИ 1,12–1,97). Примечательно, что у женщин влияние курения на развитие БА оказалось еще более значимым: частота развития БА была в 2,43 и 2,38 раза выше у курящих пациенток и бывших курильщиц соответственно. Результаты данного исследования поддерживают гипотезу о том, что курение может быть причиной БА у взрослых, с особым риском развития у женщин. Интересной представляется выявленная взаимосвязь между курением, в частности возрастом его начала, и разными фенотипами БА. Показано, что астма, развившаяся до начала курения, как правило, является атопической, а БА, начавшаяся после начала активного курения, чаще ассоциирована с низким показателем объема форсированного выдоха за 1-ю секунду (ОФВ1) [23].
Среди бывших курильщиков заболеваемость БА тоже была в 1,5 раза выше (ОШ 1,49, ДИ 1,12–1,97). Примечательно, что у женщин влияние курения на развитие БА оказалось еще более значимым: частота развития БА была в 2,43 и 2,38 раза выше у курящих пациенток и бывших курильщиц соответственно. Результаты данного исследования поддерживают гипотезу о том, что курение может быть причиной БА у взрослых, с особым риском развития у женщин. Интересной представляется выявленная взаимосвязь между курением, в частности возрастом его начала, и разными фенотипами БА. Показано, что астма, развившаяся до начала курения, как правило, является атопической, а БА, начавшаяся после начала активного курения, чаще ассоциирована с низким показателем объема форсированного выдоха за 1-ю секунду (ОФВ1) [23].
Влияние курения на течение БА
Существует много исследований, бесспорно демонстрирующих, что курение ухудшает контроль БА. В исследовании отечественных авторов [24], проведенном среди подростков, показана высокая распространенность курения среди подростков с БА (55% против 44,3% в среднем у подростков). У курящих подростков с БА достоверно чаще отмечены жалобы со стороны органов дыхания, повышенный уровень оксида углерода в выдыхаемом воздухе и котинина в моче. Курящие больные БА имеют приблизительно в 2 раза выше риск развития эпизодов неконтролируемой БА и обострений по сравнению с некурящими пациентами [5, 25, 26]. Исследование, проведенное в США в 2007 г. с помощью телефонного опроса 11 962 больных БА, выявило, что в течение последних 30 дней у курящих больных была выше частота приступов БА (ОШ 1,2; 95% ДИ 1,0–1,4) и ночных симптомов БА (OШ 2,0; 95% ДИ 1,4–2,7) по сравнению с некурящими больными [27]. Как известно, у больных с ночными симптомами БА выявляются нарушения функции малых дыхательных путей: повышено периферическое сопротивление и увеличена инфильтрация воспалительными клетками стенки дистальных бронхов [28–30].
У курящих подростков с БА достоверно чаще отмечены жалобы со стороны органов дыхания, повышенный уровень оксида углерода в выдыхаемом воздухе и котинина в моче. Курящие больные БА имеют приблизительно в 2 раза выше риск развития эпизодов неконтролируемой БА и обострений по сравнению с некурящими пациентами [5, 25, 26]. Исследование, проведенное в США в 2007 г. с помощью телефонного опроса 11 962 больных БА, выявило, что в течение последних 30 дней у курящих больных была выше частота приступов БА (ОШ 1,2; 95% ДИ 1,0–1,4) и ночных симптомов БА (OШ 2,0; 95% ДИ 1,4–2,7) по сравнению с некурящими больными [27]. Как известно, у больных с ночными симптомами БА выявляются нарушения функции малых дыхательных путей: повышено периферическое сопротивление и увеличена инфильтрация воспалительными клетками стенки дистальных бронхов [28–30].
Выраженное воспаление в малых бронхах, способствующее их раннему закрытию во время выдоха и формированию воздушных ловушек, может служить объяснением появления ночных симптомов БА у курящих пациентов. Курение приводит к большему нарушению и потере функции легких у больных БА, чем у некурящих пациентов [31]. Не только активное, но и пассивное курение отрицательно влияет на течение БА. При пассивном курении выделяют основной поток табачного дыма, выдыхаемого курильщиком, который составляет 15% от общей экспозиции, и боковую струю дыма, выделяемую горящей сигаретой, которая составляет 85% экспозиции табачного дыма [32, 33]. Важно, что частицы боковой струи табачного дыма составляют одну десятую размера частиц, выдыхаемых курящим, а значит, могут достигать дистальных дыхательных путей пассивного курильщика, то есть даже при невольном, пассивном, курении возможно поражение мелких бронхов.
Курение приводит к большему нарушению и потере функции легких у больных БА, чем у некурящих пациентов [31]. Не только активное, но и пассивное курение отрицательно влияет на течение БА. При пассивном курении выделяют основной поток табачного дыма, выдыхаемого курильщиком, который составляет 15% от общей экспозиции, и боковую струю дыма, выделяемую горящей сигаретой, которая составляет 85% экспозиции табачного дыма [32, 33]. Важно, что частицы боковой струи табачного дыма составляют одну десятую размера частиц, выдыхаемых курящим, а значит, могут достигать дистальных дыхательных путей пассивного курильщика, то есть даже при невольном, пассивном, курении возможно поражение мелких бронхов.
Курение родителей приводит к более частым обострениям БА у детей, потребности в неотложной помощи и интубации [34]. Пассивное курение детей связано с более выраженными симптомами и тяжестью БА, сниженной функцией легких, большей потребностью в препаратах неотложной помощи [35, 36]. Сокращение пассивного курения приводит к лучшему контролю БА и сокращению частоты визитов в отделение неотложной помощи и госпитализаций у детей с БА [37]. В исследовании S.K. Jindal и соавт. [38] проведено сравнение течения БА у 100 взрослых больных, имеющих частый контакт с табачным дымом вследствие пассивного курения, и 100 пациентов, не имеющих такой экспозиции. Оказалось, что частота экстренных обращений за медицинской помощью, обострений БА, потребность в глюкокортикостероидах (ГКС) и число пропущенных рабочих дней были статистически значимо (р
Существуют противоречивые данные о влиянии курения на риск развития угрожающих жизни и смертельных обострений БА, однако 6-летний уровень смертности в результате тяжелого обострения БА оказался выше среди курящих пациентов по сравнению с некурящими (ОШ 3,6, 95% ДИ 2,0–6,2) [39]. Таким образом, активное и пассивное курение существенно ухудшает контроль БА, увеличивает риск обострений и нарушает функцию легких, способствуя ее снижению с течением времени.
Влияние курения на эффективность фармакотерапии БА
Основу длительной терапии БА составляют ингаляционные глюкокортикостероиды (ИГКС), однако их эффективность существенно снижена у курящих пациентов. Впервые этот факт был отмечен в исследовании B. Pedersen в 1996 г. [40]. В этом исследовании изучали влияние низкой и высокой дозы будесонида или перорального теофиллина на легочную функцию, бронхиальную гиперреактивность (БГР) и воспалительные маркеры крови у 85 пациентов с БА. Последующий анализ, сравнивший эти показатели у курящих и некурящих больных, показал, что терапия будесонидом и в низкой, и в высокой дозах на протяжении 9 месяцев не привела к улучшению ОФВ1, БГР, уменьшению содержания эозинофилов и эозинофильного катионного белка в крови у курящих пациентов с БА. Последующие исследования подтвердили это явление. G.W. Chalmers и соавт. [41] в проспективном рандомизированном двойном слепом плацебоконтролируемом исследовании изучили эффективность высокой дозы флутиказона пропионата (ФП) (500 мкг дважды в день) или плацебо на протяжении 10 недель у пациентов с легкой БА.
Впервые этот факт был отмечен в исследовании B. Pedersen в 1996 г. [40]. В этом исследовании изучали влияние низкой и высокой дозы будесонида или перорального теофиллина на легочную функцию, бронхиальную гиперреактивность (БГР) и воспалительные маркеры крови у 85 пациентов с БА. Последующий анализ, сравнивший эти показатели у курящих и некурящих больных, показал, что терапия будесонидом и в низкой, и в высокой дозах на протяжении 9 месяцев не привела к улучшению ОФВ1, БГР, уменьшению содержания эозинофилов и эозинофильного катионного белка в крови у курящих пациентов с БА. Последующие исследования подтвердили это явление. G.W. Chalmers и соавт. [41] в проспективном рандомизированном двойном слепом плацебоконтролируемом исследовании изучили эффективность высокой дозы флутиказона пропионата (ФП) (500 мкг дважды в день) или плацебо на протяжении 10 недель у пациентов с легкой БА.
Некурящие пациенты продемонстрировали статистически значимое увеличение утренней пиковой скорости выдоха (ПСВ) в ответ на терапию ФП по сравнению с плацебо и курящими больными, получавшими ФП и плацебо (рис. 3) [41]. У курящих больных не отмечено никаких изменений в функциональных показателях, уровне БГР и эозинофилии мокроты. Однако в другом клиническом исследовании высокие дозы ФП оказались эффективны у больных среднетяжелой и тяжелой БА, независимо от статуса курения [42]. Обратимость обструкции бронхов, наравне с эозинофилией крови и мокроты, являлись предикторами высокой эффективности ФП в этом исследовании. Вместе с тем даже применение высокой дозы пероральных ГКС (40 мг преднизолона) в течение 14 дней у курящих пациентов с БА не приводит к увеличению ОФВ1, что было показано в двойном слепом плацебоконтролируемом исследовании [43]. Как видно из рисунка 4, у курящих пациентов с БА, равно как и у бывших курильщиков, не улучшались функция легких и показатели контроля БА в ответ на короткий курс перорального приема высокой дозы преднизолона, в отличие от некурящих пациентов, что свидетельствует о формировании кортикостероидной резистентности у этих пациентов [43].
3) [41]. У курящих больных не отмечено никаких изменений в функциональных показателях, уровне БГР и эозинофилии мокроты. Однако в другом клиническом исследовании высокие дозы ФП оказались эффективны у больных среднетяжелой и тяжелой БА, независимо от статуса курения [42]. Обратимость обструкции бронхов, наравне с эозинофилией крови и мокроты, являлись предикторами высокой эффективности ФП в этом исследовании. Вместе с тем даже применение высокой дозы пероральных ГКС (40 мг преднизолона) в течение 14 дней у курящих пациентов с БА не приводит к увеличению ОФВ1, что было показано в двойном слепом плацебоконтролируемом исследовании [43]. Как видно из рисунка 4, у курящих пациентов с БА, равно как и у бывших курильщиков, не улучшались функция легких и показатели контроля БА в ответ на короткий курс перорального приема высокой дозы преднизолона, в отличие от некурящих пациентов, что свидетельствует о формировании кортикостероидной резистентности у этих пациентов [43].
Противовоспалительное действие ГКС опосредовано активацией цитоплазматических глюкокортикоидных рецепторов (ГКР), действующих как лиганд-активированные факторы транскрипции, которые транслоцируются в ядро, где подавляют или стимулируют глюкокортикоидные гены-мишени. Существуют две изоформы ГКР. ГКР-альфа действуют, непосредственно связываясь с ДНК (трансактивация), или путем взаимодействия с провоспалительными факторами транскрипции (трансрепрессия). ГКР-бета, которые не связывают лиганд, в основном расположены в ядре и не могут трансактивировать глюкокортикоидчувствительные гены. Потенциальные пути и механизмы стероидной резистентности у курящих пациентов с БА (схематично представлены на рисунке 5) заключаются, по мнению N.C. Thomson и соавт. [9], в следующем:
Существуют две изоформы ГКР. ГКР-альфа действуют, непосредственно связываясь с ДНК (трансактивация), или путем взаимодействия с провоспалительными факторами транскрипции (трансрепрессия). ГКР-бета, которые не связывают лиганд, в основном расположены в ядре и не могут трансактивировать глюкокортикоидчувствительные гены. Потенциальные пути и механизмы стероидной резистентности у курящих пациентов с БА (схематично представлены на рисунке 5) заключаются, по мнению N.C. Thomson и соавт. [9], в следующем:
- Происходит гиперсекреция слизи в дыхательных путях, нарушающая связывание ГКС с ГКР.
- Курение снижает экспрессию бета-2-адренергических рецепторов, а также их связь с лигандом, что за счет взаимосвязи ГКС и бета-2-адренергических рецепторов может приводить к снижению функции и ядерной транслокации ГКР.
- Изменяется фенотип воспаления дыхательных путей, например, происходит увеличение числа нейтрофилов и CD8+-лимфоцитов в дыхательных путях и уменьшение числа эозинофилов.

- Повышается уровень провоспалительных цитокинов и медиаторов, например, увеличивается уровень ИЛ-4, ИЛ-8, фактора некроза опухоли альфа, снижается продукция ИЛ-10, возрастает нитрозативный стресс.
- Наблюдается дисбаланс в экспрессии ГКР, например, сверхэкспрессия ГКР-бета и снижение экспрессии ГКР-альфа.
- Активируются провоспалительные факторы транскрипции, например, ядерный фактор каппа В, активирующий белок 1, фактор, активирующий передачу сигнала.
- Снижается активность деацетилазы гистонов и повышается активность митоген-активированной протеинкиназы p38 [9].
 Это снижение активности деацетилазы делает ДНК доступной для факторов транскрипции, коррелирует с усилением индукции провоспалительных цитокинов и снижением ответа на ГКС in vitro [44, 45].
Это снижение активности деацетилазы делает ДНК доступной для факторов транскрипции, коррелирует с усилением индукции провоспалительных цитокинов и снижением ответа на ГКС in vitro [44, 45]. Возможные пути преодоления ГКС-резистентности у курящих пациентов с БА
Наиболее эффективным путем решения проблемы стероидной резистентности у курящих пациентов с БА является отказ от курения. В нескольких клинических исследованиях показано, что отказ от курения приводит к улучшению контроля БА, восстановлению эффективности ИГКС, уменьшению симптомов, увеличению функции легких в ответ на терапию ГКС, уменьшению БГР [46, 47]. На рисунке 6 представлена динамика функции легких в результате терапии ФП 1000 мкг/день у отказавшихся от курения и продолжающих курить больных БА. Отказ от курения привел к значимому улучшению функции легких в ответ на ИГКС, что сопровождалось улучшением качества жизни у этих больных [47].
Увеличение дозы ИГКС позволяет преодолеть резистентность к ГКС у курящих больных БА, что было продемонстрировано в исследовании J. E. Tomlinson и соавт. (2005) [48]. Низкая доза беклометазона дипропионата (БДП, 400 мкг/день) эффективно увеличивала утреннюю ПСВ у некурящих пациентов, в отличие от курящих больных, у которых только повышение дозы БДП в 5 раз (2000 мкг/день) вызвало положительную динамику ПСВ (рис. 7). В это исследование были включены пациенты с легкой БА, поэтому закономерно, что некурящие больные ответили на низкую дозу ИГКС, и назначение высокой дозы БДП у них в конечном итоге оказало такое же влияние на ПСВ. Полученные результаты демонстрируют возможность преодоления резистентности к ИГКС у курильщиков с БА путем назначения высоких доз препарата, но в этом случае возникает высокий риск развития нежелательных эффектов [48].
E. Tomlinson и соавт. (2005) [48]. Низкая доза беклометазона дипропионата (БДП, 400 мкг/день) эффективно увеличивала утреннюю ПСВ у некурящих пациентов, в отличие от курящих больных, у которых только повышение дозы БДП в 5 раз (2000 мкг/день) вызвало положительную динамику ПСВ (рис. 7). В это исследование были включены пациенты с легкой БА, поэтому закономерно, что некурящие больные ответили на низкую дозу ИГКС, и назначение высокой дозы БДП у них в конечном итоге оказало такое же влияние на ПСВ. Полученные результаты демонстрируют возможность преодоления резистентности к ИГКС у курильщиков с БА путем назначения высоких доз препарата, но в этом случае возникает высокий риск развития нежелательных эффектов [48].
Этого риска удается избежать при терапии комбинациями ИГКС и длительно действующих бета-2-агонистов (ДДБА), лечение которыми является еще одной стратегией преодоления кортикостероидной резистентности у курящих больных БА. Комбинация ИГКС и ДДБА положительно влияет на соотношение «эффективность/безопасность лечения», поскольку в два раза увеличивает клинический эффект ГКС без увеличения частоты нежелательных побочных явлений. Кроме того, ИГКС и ДДБА показали способность оказывать синергизм на клеточном уровне при воздействии на рецепторы. Путем увеличения внутриклеточной концентрации циклического аденозинмонофосфата и, как следствие, активации протеинкиназы бета-2-агонисты увеличивают ядерную транслокацию ГКР и непрямым путем оказывают влияние на них через активацию митоген-активированной протеинкиназы. ДДБА активируют неактивные ГКР, делая их более чувствительными для стероидзависимой активации. ИГКС, в свою очередь, повышают экспрессию гена бета-2-адренорецептора, тем самым активируя синтез этих рецепторов и увеличивая их экспрессию на клеточной мембране. ИГКС также препятствуют десенситизации бета-2-адренорецепторов.
В нашей стране зарегистрированы четыре оригинальных препарата ИГКС и ДДБА, являющиеся фиксированными комбинациями: флутиказона пропионат/салметерол (ФП/Сал), будесонид/формотерол (Буд/Ф), беклометазона дипропионат/формотерол (БДП/Ф), мометазона фуроат/формотерол (МФ/Ф) и одна свободная комбинация Буд и Ф. Все эти препараты обладают доказанной эффективностью в лечении разных фенотипов БА, но, к сожалению, в настоящее время существуют очень скромные данные об эффективности комбинированных препаратов ИГКС и ДДБА у курящих пациентов с БА. Исследования, проводившиеся в реальной клинической практике, в которых оценивалась эффективность трех фиксированных комбинаций ФП/Сал (Серетид), Буд/Ф (Симбикорт) и БДП/Ф (Фостер) у взрослых больных БА, закономерно включали популяцию курящих пациентов. Как показали результаты исследования V. Müller и соавт. [49], пациенты, получавшие терапию БДП/Ф при помощи дозированного аэрозольного ингалятора (ДАИ), достоверно чаще имели контролируемую БА по сравнению с больными, лечившимися Буд/Ф или ФП/Сал, доставляемыми с помощью порошковых ингаляторов (ПИ) (57% против 36% соответственно, р = 0,031) (рис. 8) [49].
Все эти препараты обладают доказанной эффективностью в лечении разных фенотипов БА, но, к сожалению, в настоящее время существуют очень скромные данные об эффективности комбинированных препаратов ИГКС и ДДБА у курящих пациентов с БА. Исследования, проводившиеся в реальной клинической практике, в которых оценивалась эффективность трех фиксированных комбинаций ФП/Сал (Серетид), Буд/Ф (Симбикорт) и БДП/Ф (Фостер) у взрослых больных БА, закономерно включали популяцию курящих пациентов. Как показали результаты исследования V. Müller и соавт. [49], пациенты, получавшие терапию БДП/Ф при помощи дозированного аэрозольного ингалятора (ДАИ), достоверно чаще имели контролируемую БА по сравнению с больными, лечившимися Буд/Ф или ФП/Сал, доставляемыми с помощью порошковых ингаляторов (ПИ) (57% против 36% соответственно, р = 0,031) (рис. 8) [49].
Доля курящих пациентов, включенных в данное исследование, составила 35%, а индекс курения у них – 19 ± 3,6 пачек/лет. Уровень контроля у курящих больных БА был примерно таким же, как у некурящих пациентов, но пропорция больных с неконтролируемой БА была среди курильщиков выше (23,1% против 11,0%, р
В свою очередь, это проявляется большей клинической эффективностью в сравнении c неэкстрамелкодисперсными фиксированными комбинациями, к которым относятся все остальные комбинированные препараты.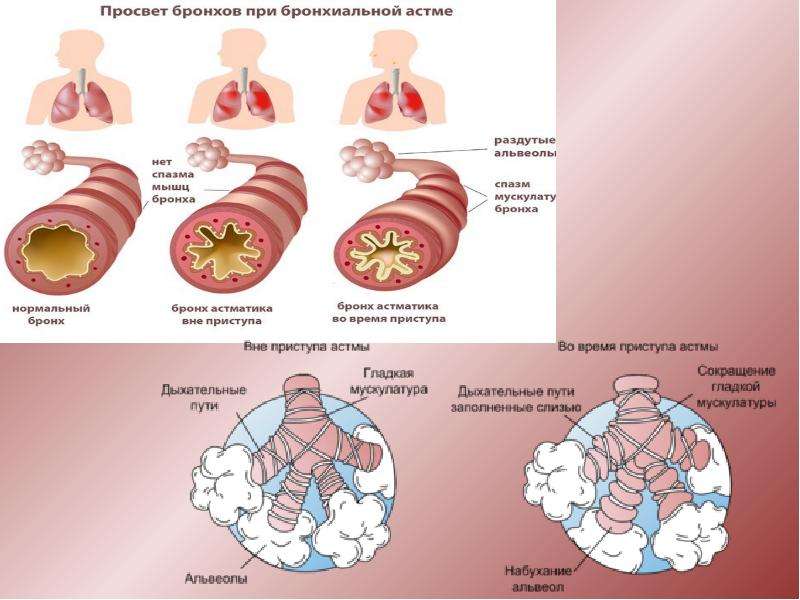 Это свойство БДП/Ф (Фостер) имеет особое значение при активном и пассивном курении пациентов, когда поражение мелких бронхов может иметь существенное значение в нарушении функции легких и может препятствовать достижению контроля БА. Косвенным доказательством этого положения служит недавно проведенное в Бельгии в условиях реальной клинической практики многоцентровое открытое исследование эффективности БДП/Ф (Фостер) у взрослых больных БА [50]. В это исследование было включено 619 пациентов со среднетяжелой и тяжелой БА. Эффективность лечения оценивалась у 568 больных, имевших исходные результаты АСQ6-теста (Asthma Control Questionnaire – Опросник для определения уровня контроля астмы, состоящий из 6 вопросов). 445 пациентов не курили, а 123 являлись активными курильщиками или бывшими курильщиками (но прекратившими курить менее года назад).
Это свойство БДП/Ф (Фостер) имеет особое значение при активном и пассивном курении пациентов, когда поражение мелких бронхов может иметь существенное значение в нарушении функции легких и может препятствовать достижению контроля БА. Косвенным доказательством этого положения служит недавно проведенное в Бельгии в условиях реальной клинической практики многоцентровое открытое исследование эффективности БДП/Ф (Фостер) у взрослых больных БА [50]. В это исследование было включено 619 пациентов со среднетяжелой и тяжелой БА. Эффективность лечения оценивалась у 568 больных, имевших исходные результаты АСQ6-теста (Asthma Control Questionnaire – Опросник для определения уровня контроля астмы, состоящий из 6 вопросов). 445 пациентов не курили, а 123 являлись активными курильщиками или бывшими курильщиками (но прекратившими курить менее года назад).
В данное исследование включались пациенты, которые не достигали контроля БА на монотерапии ИГКС или комбинированной терапии ИГКС/ДДБА, причем решение назначить пациентам экстрамелкодисперсную фиксированную комбинацию БДП/Ф врач принимал независимо от включения пациента в исследование. Критериями эффективности терапии БДП/Ф являлись функциональные показатели (ОФВ1 и ПСВ) и оценка контроля БА по критериям GINA (Global Initiative for Asthma – Глобальная инициатива по борьбе с астмой) и по опросникам ACQ6 (6 вопросов) и ACQ7 (6 вопросов + результаты измерения ОФВ1 или ПСВ). Преимуществом этого исследования являлась длительность наблюдения. После включения пациентов в исследование и оценки исходного уровня контроля БА следующий визит с оценкой текущего контроля проводился через 2–8 месяцев (в среднем через 168 дней), а заключительный, третий, визит – через 8–14 месяцев (в среднем через 358 дней) терапии. Как показала оценка исходного уровня, курящие пациенты имели тенденцию к более низким показателям ОФВ1 и ПСВ по сравнению с некурящими больными (р > 0,05) и достоверно более низкий уровень контроля БА, оцениваемый по ACQ6 (p
Критериями эффективности терапии БДП/Ф являлись функциональные показатели (ОФВ1 и ПСВ) и оценка контроля БА по критериям GINA (Global Initiative for Asthma – Глобальная инициатива по борьбе с астмой) и по опросникам ACQ6 (6 вопросов) и ACQ7 (6 вопросов + результаты измерения ОФВ1 или ПСВ). Преимуществом этого исследования являлась длительность наблюдения. После включения пациентов в исследование и оценки исходного уровня контроля БА следующий визит с оценкой текущего контроля проводился через 2–8 месяцев (в среднем через 168 дней), а заключительный, третий, визит – через 8–14 месяцев (в среднем через 358 дней) терапии. Как показала оценка исходного уровня, курящие пациенты имели тенденцию к более низким показателям ОФВ1 и ПСВ по сравнению с некурящими больными (р > 0,05) и достоверно более низкий уровень контроля БА, оцениваемый по ACQ6 (p
В результате лечения экстрамелкодисперсной фиксированной комбинацией БДП/Ф у всех пациентов, независимо от статуса курения, произошло значимое улучшение функции легких, оцениваемой по ОФВ1 (рис. 10) и ПСВ [50]. Контроль БА по АСQ6 и АСQ7 улучшился у всех пациентов в среднем на 1,22 и 1,16 балла (р
10) и ПСВ [50]. Контроль БА по АСQ6 и АСQ7 улучшился у всех пациентов в среднем на 1,22 и 1,16 балла (р
Назначение антагонистов лейкотриеновых рецепторов в комбинации с ИГКС или, в случае легкой БА, в качестве монотерапии может быть полезно у курящих пациентов с БА. В 8-недельном двойном слепом исследовании с перекрестным дизайном изучалось влияние низкой дозы ИГКС (160 мкг БДП дважды в день) или монтелукаста (10 мг однократно вечером) на клинико-функциональные параметры (ОФВ1 и ПСВ) и маркеры воспаления (БГР и эозинофилы индуцированной мокроты) у курящих и некурящих пациентов с персистирующей БА. Курящие больные имели лучший функциональный ответ на терапию монтелукастом. Увеличение утренней ПСВ у них было значимо выше по сравнению с таковым в ответ на БДП, а прирост ОФВ1 был одинаков. Терапия антагонистами лейкотриеновых рецепторов может иметь приоритет у этой группы больных как в качестве монотерапии при легкой персистирующей БА у курящих подростков, так и в качестве аддитивной (добавочной) терапии, усиливающей эффекты ИГКС у курящих пациентов со среднетяжелой персистирующей БА [51].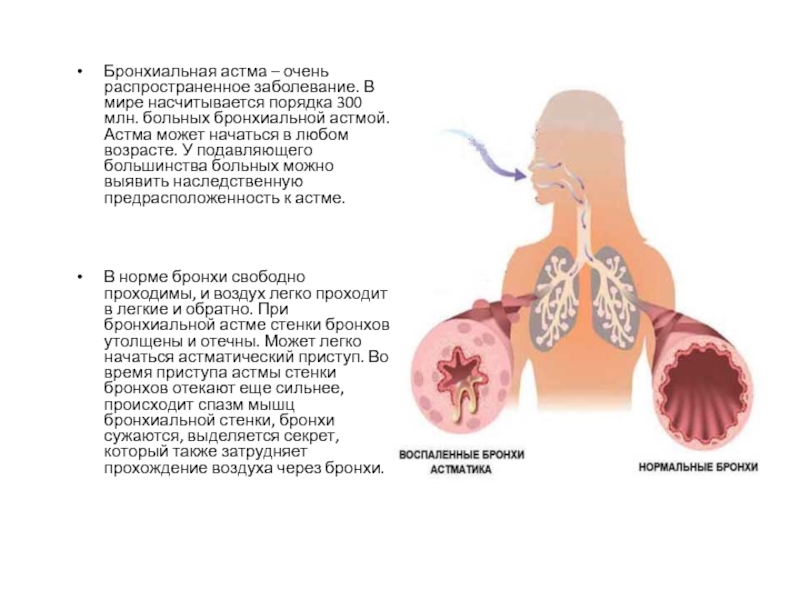
Еще одной возможностью преодоления резистентности к ГКС у курящих пациентов может быть назначение низких доз теофиллина. Теофиллин вызывает шестикратное увеличение активности деацетилазы гистонов альвеолярных макрофагов, полученных от больных хронической обструктивной болезнью легких (ХОБЛ), и значительно усиливает супрессивную активность дексаметазона в отношении ИЛ-8 [52]. Таким образом, теофиллин может способствовать восстановлению нарушенной стероидной чувствительности у курящих пациентов с ХОБЛ и БА.
Заключение
Распространенность курения среди лиц, страдающих бронхиальной астмой, не отличается от распространенности курения в популяции в целом и составляет от 25 до 35%. Как активное, так и пассивное курение способствует развитию БА, увеличивает ее тяжесть и риск обострений, препятствует достижению контроля и нарушает адекватный ответ на фармакотерапию. Курящие пациенты с БА не отвечают или имеют сниженный ответ на ГКС. В настоящее время существует несколько путей преодоления кортикостероидной резистентности у курящих больных БА.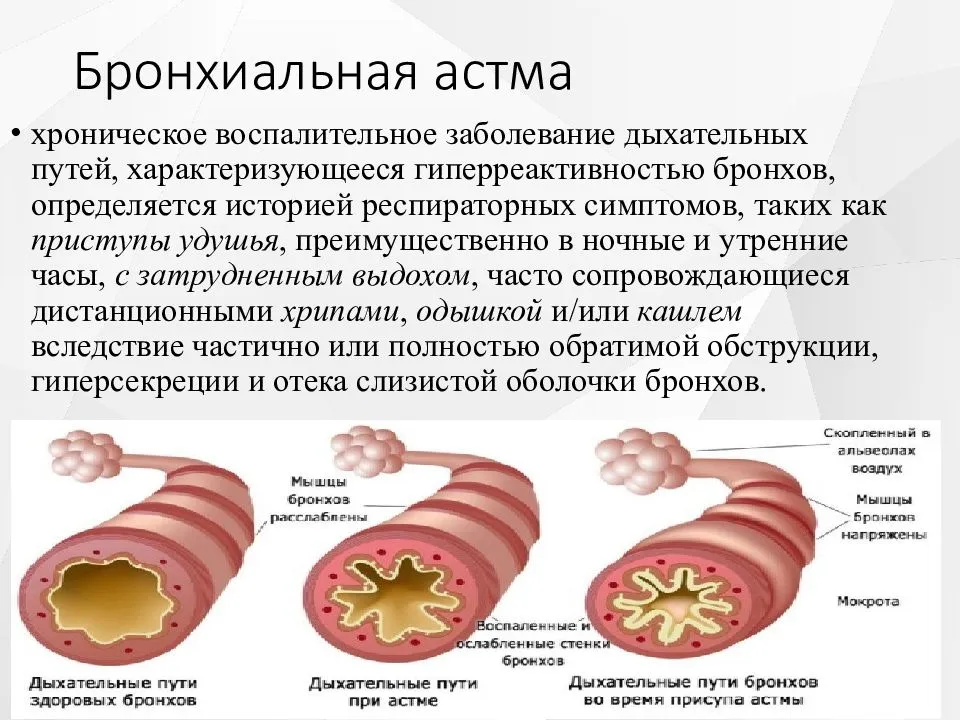 Наиболее радикальным является отказ от курения, стимулировать к которому необходимо каждого курящего пациента. Назначение комбинированных препаратов ИГКС и ДДБА является эффективной стратегией преодоления кортикостероидной резистентности, причем наиболее оправдано назначение курящим больным БА экстрамелкодисперсной фиксированной комбинации БДП/Ф. Дополнительные возможности по преодолению кортикостероидной резистентности предоставляет назначение антагонистов лейкотриеновых рецепторов (в комбинации с ИГКС или в монотерапии) или низких доз теофиллина.
Наиболее радикальным является отказ от курения, стимулировать к которому необходимо каждого курящего пациента. Назначение комбинированных препаратов ИГКС и ДДБА является эффективной стратегией преодоления кортикостероидной резистентности, причем наиболее оправдано назначение курящим больным БА экстрамелкодисперсной фиксированной комбинации БДП/Ф. Дополнительные возможности по преодолению кортикостероидной резистентности предоставляет назначение антагонистов лейкотриеновых рецепторов (в комбинации с ИГКС или в монотерапии) или низких доз теофиллина.
|
Курение является не только одним из основных факторов, способствующих развитию бронхиальной астмы, но и существенно утяжеляет её течение. Табачный дым, раздражая дыхательные пути, активно участвует в формировании гиперреактивности бронхов – состоянии, на фоне которого развивается астма. Доля курящих среди астматиков составляет 50%, тогда как всего в популяции их 35% – в 1,4 раза меньше. Механизм развития астмы курильщикаВ состав табачного дыма входит масса токсичных веществ, негативно влияющих на дыхательные пути вплоть до самых мелких ответвлений бронхов. Курение вызывает:
Респираторная аллергия, хроническое воспаление, инфекции дыхательных путей – ведущие факторы, создающие благоприятные условия для развития бронхиальной астмы. Можно ли курить при астмеКурение – как активное, так и пассивное – повышает тяжесть течения болезни, затрудняет медикаментозное лечение, снижает степень контроля над астмой. Табак вреден для здоровых людей, но для астматиков его опасность выше в несколько раз. Поэтому совершить решительный шаг – бросить курить жизненно важно для людей, страдающих бронхиальной астмой, и их ближайшего окружения. Последствия курения при астмеПри отказе бросить курить болезнь, как правило, быстро прогрессирует. Курение при бронхиальной астме приводит к тяжёлым, зачастую роковым последствиям, среди которых:
Лечение курящих пациентов с астмой – непростая задача, под силу только узким профильным специалистам – пульмонологам-аллергологам. Найти, где записаться на приём к аллергологу в Москве и регионах, узнать, почему так важен полный контроль астмы и как его добиться, поможет портал www.astma.help. Здесь также имеется много другой информации, позволяющей больным астмой улучшить качество жизни.
Читать далее:
|
Курение и астма
05.10.2017Табачный дым осложняет астматический статус
Бронхиальная астма на сегодняшний день является одним из самых распространенных заболеваний органов дыхательной системы, имеющих тяжелое течение и многократно снижающих качество жизни больного. Во многом широкому распространению данного заболевания способствует обилие и утяжеление течения данного заболевания.
Во многом широкому распространению данного заболевания способствует обилие и утяжеление течения данного заболевания.Это и плохие экологические условия, и недостаточная физическая активность, и наличие вредных привычек, особенно пагубной из которых в отношении астмы является курение, как активное, так и пассивное (вдыхание табачного дыма). Этот факт подтверждается результатами многочисленных исследований. Причем по своему совокупному вреду, который табачный дым наносит организму астматика, он намного превышает остальные атмосферные загрязнители.
Вдыхание табачного дыма за считанные минуты провоцирует приступ, купировать который не так то и просто. Подобная высокая патогенная активность дыма характеризуется наличием в нем различных компонентов — никотина, смол и т.д., которые и по отдельности являются сильными аллергенами и могут служить фактором развития бронхиальной астмы, а уж вместе они еще больше поражают реактивность иммунной системы.
Механизм развития приступа бронхиальной астмы при контакте с табачным дымом
Сущность данного механизма заключается в том, что контакт с дымом вызывает патологическое удушье, возникающее за счет суживающегося просвета путей дыхательной системы. Причем сужаются не только крупные, но и самые мелкие воздухоносные пути. По своей сути удушье — защитная реакция, которая должна предотвратить дальнейшее поступление аллергена в дыхательную систему.
Причем сужаются не только крупные, но и самые мелкие воздухоносные пути. По своей сути удушье — защитная реакция, которая должна предотвратить дальнейшее поступление аллергена в дыхательную систему.Сокращение просвета вызвано импульсом, поступающим от вегетативной нервной системы. В разумных пределах подобная реакция спасает организм от попадания в легкие инородных тел, химических и механических компонентов, которые могут присутствовать в атмосферном воздухе.
Однако при контакте с табачным дымом реакция возникает гиперергическая, и просвет суживается настолько, что человек не имеет возможности нормально дышать. Дополнительно стоит отметить, что поддерживает данный патологический процесс не только аллергическая природа сужения просвета воздухоносных путей, но и чрезмерная продукция слизи у астматиков, которая не отходит самостоятельно из-за низкой реактивности мельчайших ресничек, покрывающих слизистую бронхов.
Этот феномен формируется как раз на фоне активного и пассивного курения, когда реснички не справляются с обилием слизи, смешанной с мелкими механическими агентами, попадающими в верхние дыхательные пути и бронхи при курении или вдыхании дыма. А раз слизь не выводится, то она оказывает дополнительное раздражающее действие на органы дыхательной системы и ее становится больше и больше, пока она не закупоривает просветы мельчайших бронхиол.
А раз слизь не выводится, то она оказывает дополнительное раздражающее действие на органы дыхательной системы и ее становится больше и больше, пока она не закупоривает просветы мельчайших бронхиол.
В бронхиолах нет хрящевой основы, поэтому при приступе, спровоцированном импульсом от ВНС (вегетативной нервной системы), они сдавливаются мышцами, повреждаются, и мокрота полностью перестает отходить. Конечным результатом данного процесса является затруднение дыхания. При этом приступ, к сожалению, ведет не только к потере трудоспособности, но и опасности смертельного исхода. Поэтому астматик ни в коем случае не должен быть активным или пассивным курильщиком.
Табачный дым и его влияние на астматический статус будущих поколений
Взрослый человек — на то и взрослый, чтобы иметь право выбора и самостоятельно решать — курить ему или не курить. Зато дети, которые растут в семьях, где курит хотя бы один из родителей, оказываются в патовой ситуации. Физиологические особенности реакции детского организма в ответ на вдыхание табачного дыма таковы, что на дыхательные органы малышей пассивное курение оказывает намного более разрушительное действие, чем в случае со взрослыми.
Легочная ткань детского организма быстрей, чем у взрослых, раздражается, секреция слизи стремительно нарастает, и приступ у ребенка-астматика не заставит себя долго ждать. Что же касается здоровых детей, то у них пассивное курение ведет к меньшей устойчивости к ОРВИ и болезням органов дыхания, имеющим бактериальную природу. Ну и, конечно же, постоянная травматизация тканей бронхов ведет к повышению опасности заболевания астмой.
Говоря о влиянии курения на детский организм, нельзя не затронуть тему астматического статуса будущих поколений. Беременная женщина, которая курит сама или часто вдыхает дым сигарет, передает опасные вещества, которые находятся в дыме, плоду. Ситуация осложняется тем, что никотин, капля которого, как известно, убивает лошадь, свободно проникает через гемоплацентарный барьер.
Итогом этого является повышенная опасность развития астмы у данного ребенка на протяжении всей его последующей жизни. Кроме того, у него будет сниженный иммунитет, он может родиться раньше срока, с низкой массой тела и даже может умереть в первые месяцы жизни от синдрома внезапной смерти младенцев. Словом, курение никак не способствует здоровью детей — надежды и будущего любой нации.
Словом, курение никак не способствует здоровью детей — надежды и будущего любой нации.
Табачный дым и его действие на организм астматика
Итак, подведем итог всего вышесказанного, чтобы у вас не осталось и тени сомнения в том, что табачный дым вреден не только для астматиков, но и для любого человека.Вдыхание табачного дыма, как и курение, ведет к:
1. Активизации производства слизи в дыхательной системе;
2. Нарушению физиологического очищения дыхательной системы;
3. Аллергической реакции в ответ на попадание в организм смол и никотина, которые являются сильными аллергенами;
4. Изменению реактивности иммунной системы, что, в свою очередь, ведет к усилению чувствительности органов дыхательной системы.
Итогом контакта является постоянная хроническая готовность дыхательной системы среагировать на малейший раздражитель, на который бы ранее никакой особой реакции не последовало бы. Именно поэтому курение, как активное, так и пассивное, в данное время считается одним из самых сильных факторов риска развития у здорового человека бронхиальной астмы и других заболеваний органов дыхания. Ну а для астматика — это фактор, который увеличивает частоту и утяжеляет течение приступов, уменьшает эффективность лечения, ослабляет действие ингаляционных средств, купирующих приступы, провоцирует развитие осложнений и инфицирование органов дыхательной системы, а также снижает качество и продолжительность жизни. И поскольку курение вызывает такие необратимые последствия, стоит задуматься — а стоит ли гробить свое здоровье и укорачивать свою жизнь, получив мимолетное удовольствие от затяжки? Решать Вам…
Ну а для астматика — это фактор, который увеличивает частоту и утяжеляет течение приступов, уменьшает эффективность лечения, ослабляет действие ингаляционных средств, купирующих приступы, провоцирует развитие осложнений и инфицирование органов дыхательной системы, а также снижает качество и продолжительность жизни. И поскольку курение вызывает такие необратимые последствия, стоит задуматься — а стоит ли гробить свое здоровье и укорачивать свою жизнь, получив мимолетное удовольствие от затяжки? Решать Вам…
можно ли парить вейп при астме, особенности, последствия и советы
Астма – серьёзное заболевание, которое трудно поддаётся лечению. Часто фиксируются случаи, когда это вовсе невозможно. Симптомы можно заглушить лишь на некоторое время, поскольку болезнь относится к хроническим. Многие люди, страдающие от данного заболевания, являются курильщиками. Курение сигарет при астме категорически запрещено, однако возникает вопрос, можно ли парить при этой болезни?
Альтернативное курение
Отличной альтеративой обычной сигареты является вейп, который является лучшим вариантом при астме. Необходимо понимать, что представленное заболевание и курение несовместимы. К сожалению, далеко не каждый человек способен отказаться от этой вредной привычки, даже если она представляет угрозу для здоровья. Некоторые люди заменяют обычные сигареты на кальян либо вейп.
Необходимо понимать, что представленное заболевание и курение несовместимы. К сожалению, далеко не каждый человек способен отказаться от этой вредной привычки, даже если она представляет угрозу для здоровья. Некоторые люди заменяют обычные сигареты на кальян либо вейп.
На сегодняшний день ВОЗ не собирается вводить запрет на электронные сигареты, поскольку они считаются безопасными, особенно, если сравнивать с табачной продукцией. На это указывают также социологические опросы, демонстрирующие то, что многие люди смогли отказаться от табакокурения с помощью вейпа. Несмотря на то, что электронная сигарета является безопасной, всё же рекомендуется отказаться и от этого, когда речь касается астмы. Курение вейпа в этой ситуации может стать причиной развития бронхита, бронхиальной астмы и эмфиземы лёгких.
Астма и Vape
Производители электронных сигарет утверждают, что во многих жидкостях для вейпа отсутствует никотин, из-за чего считается, что его можно использовать для отказа от никотиновой зависимости. Необходимо понимать, что даже небольшое количество этого ядовитого вещества у астматика может спровоцировать приступ. Поэтому даже парение с никотином категорически запрещено. Если уж желание курить присутствует, нужно останавливать выбор на безникотиновых жидкостях. Такой способ может помочь избавиться человеку вовсе от вредной привычки. Постепенно снижая количество никотина либо полностью от него отказываясь, человек сможет значительно понизить негативное воздействие на организм.
Необходимо понимать, что даже небольшое количество этого ядовитого вещества у астматика может спровоцировать приступ. Поэтому даже парение с никотином категорически запрещено. Если уж желание курить присутствует, нужно останавливать выбор на безникотиновых жидкостях. Такой способ может помочь избавиться человеку вовсе от вредной привычки. Постепенно снижая количество никотина либо полностью от него отказываясь, человек сможет значительно понизить негативное воздействие на организм.
С точки зрения медицины
У многих людей появляется вопрос, способен ли вейп при астме стать выходом из ситуации. Вероятно, так и есть, однако сфера медицины вряд ли сможет это признать. Большинство врачей категоричны. Они считают, что при астме необходимо отказаться от любого вида курения. Врачи не берут на себя ответственность рекомендовать людям переходить на парение, поскольку, несмотря на их безопасность, это всё же риск для астматиков.
Невзирая на то, что уже неоднократно было доказано, что вейпы намного безопаснее для человека, нежели табакокурение, по миру продолжают спорить по этому вопросу. Некоторые специалисты придерживаются мнения, что длительное использование вейпа приводит к тому, что лёгкие человека теряют свою естественную способность справляться с воспалениями. В связи с этим, дыхательные органы с трудом борются с астмой.
Некоторые специалисты придерживаются мнения, что длительное использование вейпа приводит к тому, что лёгкие человека теряют свою естественную способность справляться с воспалениями. В связи с этим, дыхательные органы с трудом борются с астмой.
На сегодняшний день при наличии таких болезней как астма, рак лёгких и иных болезней дыхательной системы, эксплуатация электронной сигареты считается лишь рекомендацией, а не наставлением. Требуется понимать, что человеческий организм индивидуален, поэтому реакция на применение этого современного гаджета непредсказуема. Тем не менее, если после поставленного диагноза астма, Вы продолжаете курить сигареты, стоит перейти на вейп, который является более оптимальным вариантом. Отказавшись от никотина, Вы сможете максимально огородить себя от приступов астмы.
С астмой можно жить полноценно!
Термин «астма» был впервые высказан Гомером в «Илиаде». Когда Ахилл, убивая Гектора, протыкает ему глотку копьем, тот испытывает удушье. Состояние удушья и было названо «астмой». Болезнь известна давно, но в 20 веке, особенно в конце его, число больных резко увеличилось. Только в последние пятьдесят лет была до конца понята суть болезни – сверхчувствительность и воспалительный аллергический процесс в бронхах. А до этого в основном предлагалось симптоматическое лечение.
Состояние удушья и было названо «астмой». Болезнь известна давно, но в 20 веке, особенно в конце его, число больных резко увеличилось. Только в последние пятьдесят лет была до конца понята суть болезни – сверхчувствительность и воспалительный аллергический процесс в бронхах. А до этого в основном предлагалось симптоматическое лечение.
Многие великие люди пострадали от астмы. Умер Марсель Пруст. Алексей Константинович Толстой умер от передозировки морфина, когда пытался снять приступ удушья.
В Екатеринбурге по подсчетам специалистов примерно 7% горожан страдает астмой. И лишь 1% обращается к врачам-пульмонологам.
Но не будем сгущать краски. У нас есть поводы взглянуть на эту болезнь более оптимистично. А убедила нас в этом врач-пульмонолог Центра хронических заболеваний легких «Новой больницы» Лилия Беленко.
Стереотип №1: Астма очень тяжелая болезнь.
Астма может быть не тяжелой. Больной, страдающий этой болезнью не обязательно должен быть грузным, сидеть и пыхтеть.
Стереотип №2: Ингаляционные баллончики выдаются только в крайних случаях болезни. Так было раньше, поэтому ассоциировались степень тяжести астмы и баллончики.
Сейчас ингаляционное лечение с помощью баллончиков оптимально. Чем раньше пациент начинает пользоваться баллончиками, тем это грамотнее.
Стереотип №3: Гормональные ингаляторы – то есть содержащие кортико-стероидные гормоны, вредны.
Действительно вещества достаточно серьезные и когда их принимают в таблетках длительно и в больших дозах, они могут вызвать большие изменения, осложнения. Но как раз ингаляционная форма позволила, отобрав мощное отрицательное действие, воспользоваться потрясающей эффективностью. И сейчас прием этих препаратов по законам доказательной медицины признан первой линией лечения, то есть главным лечением. Если при самой легкой форме астмы начать лечение этими препаратами, то можно излечить болезнь, чего раньше вообще не было.
Стереотип №4: Астму провоцируют внешние факторы -загрязненная экология и т. д.
д.
Люди недооценивает домашнюю экологию -пыль, клещей в домашней пыли, споры плесени, которые живут на поверхности земли в горшках, домашних животных.
Стереотип №5: Насморк больше семи дней – это насморк простудный.
На самом деле поражение слизистой носа, аллергические насморки в 50% случаев осложняются бронхиальной астмой. К насморку надо относиться серьезно, потому что это ворота заболевания.
-Лилия Валентиновна, что за последнее время кардинально изменилось в медицине, в подходе к лечению астмы?
-Важно, что меняются взаимоотношения между врачом и пациентом. Раньше совершенно четко прослеживалось диктаторское отношение врача к больному. Врач в сознании больного был кем-то недоступным, умным, кто не будет делиться с ним своими знаниями. Врач диктовал пациенту, а тот должен был слепо за ним идти. И мы искренне считали, что такой подход к лечению эффективен. А когда открылись «двери», когда «занавес» пал, оказалось, мы были абсолютно не правы.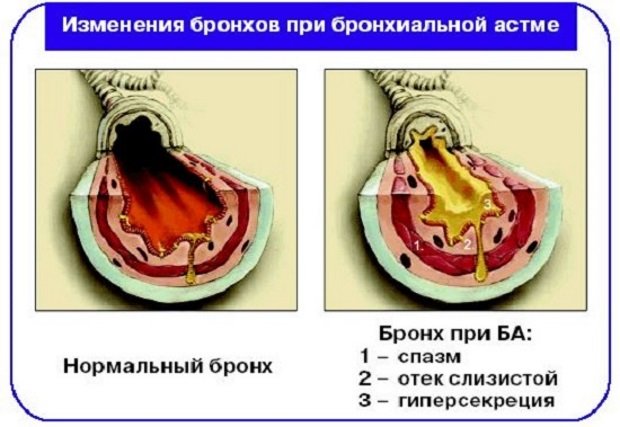 Сейчас по технологиям «доказательной медицины», понятно, что без обучения пациента мы не добьемся желаемых результатов. Больной лечится сам, врач только советует. Отношения врача и пациента меняются в сторону партнерства, сотрудничества, кооперации. Я как врач могу предложить лечение, расписать его, но, если пациент не понимает смысла этого лечения, я не буду его проводить. Или если лечение неудобно пациенту, то надо продумывать другие варианты, чтобы была реальная помощь от лечения.
Сейчас по технологиям «доказательной медицины», понятно, что без обучения пациента мы не добьемся желаемых результатов. Больной лечится сам, врач только советует. Отношения врача и пациента меняются в сторону партнерства, сотрудничества, кооперации. Я как врач могу предложить лечение, расписать его, но, если пациент не понимает смысла этого лечения, я не буду его проводить. Или если лечение неудобно пациенту, то надо продумывать другие варианты, чтобы была реальная помощь от лечения.
«Доказательная медицина» – это технологии, позволяющие определять эффективность лечения не методом тыка, а с помощью четкой математической доказанной на огромном количестве исследований.
-Как происходит обучение больных?
-В пульмонологии достаточно не банальные средства помощи – ингаляционная помощь – баллончики. Ими надо уметь пользоваться, если не уметь, не будет должного эффекта. Варианты обучения самые разные. Прежде всего, конечно, обучает врач на приеме, потому что к врачу остается достаточно высокий уровень доверия.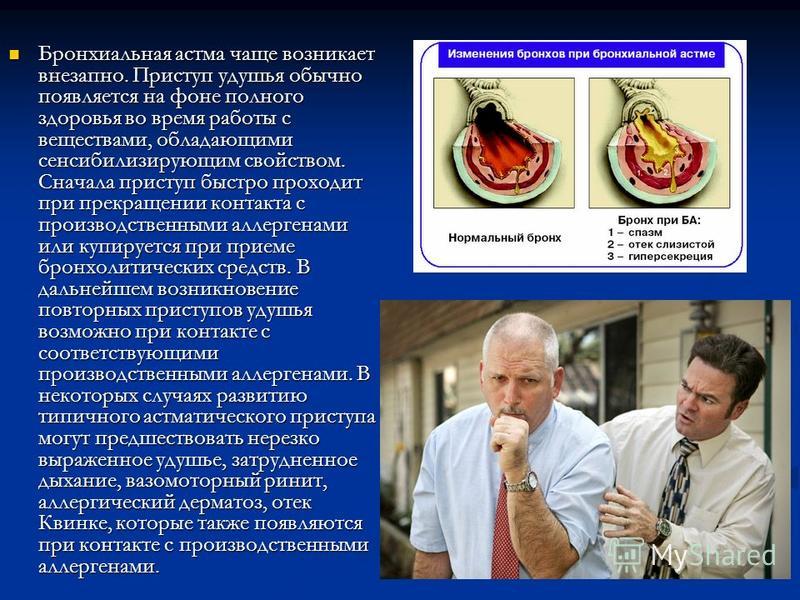 Существует групповое обучение в виде астма-школ. Мы создали астма-клуб. Обучение эффективно, когда мы к нему циклически возвращаемся, поэтому мы встречаемся уже в большой аудитории астма-клуба раз в квартал. Пытаемся донести что-то новое и освежить те знания, от которых в принципе наши больные очень далеки. Есть у нас и астма-телефон. Два раза в неделю в вечернее время работает телефон помощи. Очень важно, чтобы больной хронической болезнью понимал, какие процессы происходят в его организме, почему назначается эта терапия, а не другая, и как она правильно должна действовать.
Существует групповое обучение в виде астма-школ. Мы создали астма-клуб. Обучение эффективно, когда мы к нему циклически возвращаемся, поэтому мы встречаемся уже в большой аудитории астма-клуба раз в квартал. Пытаемся донести что-то новое и освежить те знания, от которых в принципе наши больные очень далеки. Есть у нас и астма-телефон. Два раза в неделю в вечернее время работает телефон помощи. Очень важно, чтобы больной хронической болезнью понимал, какие процессы происходят в его организме, почему назначается эта терапия, а не другая, и как она правильно должна действовать.
-Правда, что сейчас астма уже не считается тяжелейшим, почти не излечимым заболеванием?
-Раньше астма считалось заболеванием фатально тяжелым, оказалось, что это не так. Она может быть очень легкой, эпизодической, когда есть один-два раздражителя, человек попадает под действие раздражителей и болеет, но в отсутствие их, он чувствует себя абсолютно здоровым. Недавно к Международному Дню астмы мы открыли в Екатеринбурге Музей бронхиальной астмы. Потому что на наших глазах абсолютно поменялось лечение этого заболевания, подходы к нему, понимание его. Раньше, когда больной поступал в больницу, ему было сложно помочь. И даже выведя его из приступа, мы знали, что в любой момент приступ может повториться. Астматики были бесперспективные больные в плане серьезной помощи. Сейчас все наоборот. Мы можем не только облегчить симптомы, а вывести больных в такое состояние, чтобы они не чувствовали себя больными. Для абсолютного большинства больных это реально.
Недавно к Международному Дню астмы мы открыли в Екатеринбурге Музей бронхиальной астмы. Потому что на наших глазах абсолютно поменялось лечение этого заболевания, подходы к нему, понимание его. Раньше, когда больной поступал в больницу, ему было сложно помочь. И даже выведя его из приступа, мы знали, что в любой момент приступ может повториться. Астматики были бесперспективные больные в плане серьезной помощи. Сейчас все наоборот. Мы можем не только облегчить симптомы, а вывести больных в такое состояние, чтобы они не чувствовали себя больными. Для абсолютного большинства больных это реально.
-Почему поменялось понимание астмы как тяжелой болезни?
-Был распознан главный процесс – при астме чувствительность бронхов ненормальная. Воспаление развивается по типу аллергического. Почему человеку плохо дышится? Потому что бронхи из-за воспалительных процессов сужаются. И свист возникает, и кашель и одышка и удушье…
-Изменилась ли жизнь больных после этого открытия?
-Конечно. Речь идет об ином качестве жизни. Качество жизни для нас вещь достаточно новая. Русские привыкли страдать и терпеть – если уж ты больной, так болей. Сейчас идет чемпионат мира по футболу. В команде Великобритании играет Пол Скоуз, «рыжий Пол», он болен бронхиальной астмой, и при этом он один из самых выдающихся игроков Великобритании и «Манчестер Юнайтед». А нагрузки в спорте огромные. Тем не менее он чувствует себя нормально, благодаря современным средствам от астмы. Я общалась с бывшим пресс-секретарем Маргарет Тэтчер – сэром Бернардом Ингрэмом, у него тоже астма, тяжелая форма. Когда он был помоложе, прогрессивных препаратов не было, он принимал таблетки, и это сказалось внешне на нем. А сейчас он в преклонном возрасте чувствует себя хорошо – ездит по всему миру и читает лекции.
Речь идет об ином качестве жизни. Качество жизни для нас вещь достаточно новая. Русские привыкли страдать и терпеть – если уж ты больной, так болей. Сейчас идет чемпионат мира по футболу. В команде Великобритании играет Пол Скоуз, «рыжий Пол», он болен бронхиальной астмой, и при этом он один из самых выдающихся игроков Великобритании и «Манчестер Юнайтед». А нагрузки в спорте огромные. Тем не менее он чувствует себя нормально, благодаря современным средствам от астмы. Я общалась с бывшим пресс-секретарем Маргарет Тэтчер – сэром Бернардом Ингрэмом, у него тоже астма, тяжелая форма. Когда он был помоложе, прогрессивных препаратов не было, он принимал таблетки, и это сказалось внешне на нем. А сейчас он в преклонном возрасте чувствует себя хорошо – ездит по всему миру и читает лекции.
-Качество жизни, в чем должно проявляться?
—Во всем. В хорошем сне, например. Наши больные, если у них обострение, спят плохо. Ночные приступы очень характерны для бронхиальной астмы. Качество жизни – быть активным физически, позволять себе какие-то поездки, походы. Наша задача научить человека самостоятельно помогать себе, чтобы жизнь его радовала. Качество жизни – это не существование, а полноценная жизнь. Это возможность, несмотря на болезнь, жить в свое удовольствие. Например, заниматься любовью – это же тоже физическая нагрузка и стрессовая ситуация одновременно. И для сердечных больных и для наших это может быть большой проблемой. Но современное лечение вполне позволяет жить полноценно.
-Как происходит лечение современными препаратами?
-Понимание процесса воспаления дало козыри в руки ученых. Они изобрели местные противовоспалительные препараты, которые вдыхаются с помощью ингаляционных устройств. Маленькая доза идет на больное место – это безопасно и очень эффективно. Воспаление проходит, а если принимать препараты длительно, то и сама чувствительность бронхов уменьшается. Здесь, конечно, важно участие самого пациента, потому что постоянно нужно использовать ингаляционные средства. Астма в принципе заболевание неровное. В зависимости от разных ситуаций внешних и внутренних, гормональных колебаний и возрастных, все по-разному протекает. Может быть самопроизвольный длительный период, потом может быть обострение, но конечно, когда есть защита, то нет необходимости страдать. Есть сейчас и такие препараты, которые позволяют не чувствовать себя больным
Астма в принципе заболевание неровное. В зависимости от разных ситуаций внешних и внутренних, гормональных колебаний и возрастных, все по-разному протекает. Может быть самопроизвольный длительный период, потом может быть обострение, но конечно, когда есть защита, то нет необходимости страдать. Есть сейчас и такие препараты, которые позволяют не чувствовать себя больным
-Хотя бы один назовите?
-Например, Серетид. Он относится к препаратам-звездам на небосклоне пульмонологии, на небосклоне лечения астмы. В нем сосредоточилось лучшее. В Серетиде два вещества – бронхорасширяющий препарат длительного действия и лечебный кортеко-стероидный препарат. Он опережает по своей противовоспалительной активности все имеющиеся препараты минимум в два раза. У больного заметно улучшается самочувствие и физическая активность. Еще в нем очень интересная ингаляционная форма – это порошковый препарат, причем с эстетичным дизайном в виде фиолетовой «пудреницы». Кроме того, он прост в применении: мундштучок открывается, делается два движения, чтобы получить доступ к порошку и вдох, потом полощется рот. Назначается в основном один вдох два раза, это легко запомнить больному, что важно.
Назначается в основном один вдох два раза, это легко запомнить больному, что важно.
Вот один из случаев. Молодая женщина в детстве заболела и на определенном этапе она разуверилась во врачебной помощи при астме. Она выросла, но астма не стала протекать легче, хотя иногда так бывает с возрастом. Когда она к нам пришла, это был тяжелый больной, требующий почти что палаты интенсивной терапии. Мы расписали ей лечение, включая Серетид. Через короткое время она позвонила, сказала, что ей стало легче. Через год она появилась и рассказала, что весь год чувствовала себя совершенно здоровой. Она вспомнила, что такое нормально жить, дышать, заниматься аэробикой и т.д. Причем у нее и ребенок болеет астмой. Почти теми же препаратами лечится ребенок, он стал активнее. Короче говоря, хэппи-энд.
-Курение и астма как-то связаны друг с другом?
-Да. Доказано, что у курящих родителей в волосах их детей, имеющих предрасположенность к аллергии, остается больше продукта распадов никотина. Дети особенно чутко воспринимают табачный дым. Один из факторов, увеличивающий риск заболевания ребенка астмой – курящие родители. И пассивное курение тоже этому способствует. Само по себе курение может спровоцировать астму. Ведь при этом заболевании -ненормальная чувствительность дыхательных путей, и если туда запихивать 4000 ядов, а в одной сигарете столько, то оказывается мощное воздействие на слизистую. И при наследственной предрасположенности чаще всего болезнь выйдет наружу.
Дети особенно чутко воспринимают табачный дым. Один из факторов, увеличивающий риск заболевания ребенка астмой – курящие родители. И пассивное курение тоже этому способствует. Само по себе курение может спровоцировать астму. Ведь при этом заболевании -ненормальная чувствительность дыхательных путей, и если туда запихивать 4000 ядов, а в одной сигарете столько, то оказывается мощное воздействие на слизистую. И при наследственной предрасположенности чаще всего болезнь выйдет наружу.
-А курение при астме к чему может привести?
-Все же абсолютное большинство больных астмой не переносит табачный дым. Он выступает для них раздражителем, они не могут не то что курить, но даже находится рядом с курящим, что ограничивает их передвижения по общественным местам. Но курильщики-астматики есть. К астме у них присоединяется еще и бронхит, и он течет недоброкачественно. Качество жизни у таких больных ниже, чем у некурящих.
Записала Елена Немченко
Курение и астма — ЗдоровьеИнфо
Курение сигарет, сигар или трубок оказывает многостороннее вредное воздействие на организм, но особенно разрушительно действует на легкие больных астмой людей. Табачный дым – один из главных факторов, провоцирующих астматический приступ.
Табачный дым – один из главных факторов, провоцирующих астматический приступ.
Каким образом курение провоцирует астму?
Когда вы вдыхаете табачный дым, вредные вещества, содержащиеся в нем, раздражают слизистую бронхов. Такое воспаление может спровоцировать проявление симптомов астмы или астматический приступ.
Табачный дым разрушает тонкие волосковые образования на слизистой оболочке – реснички. В норме реснички посредством непрерывных движений вымывают слизь и пыль из дыхательных путей. Табачный дым повреждает реснички, нарушая их функцию. Таким образом, слизь и пыль не вымываются, а накапливаются в бронхах.
Курение способствует повышенной секреции слизи в легких и, как следствие, накопившаяся слизь может сама по себе спровоцировать приступ.
Опасно ли пассивное курение для больных астмой?
Пассивное курение – курение, при котором человек вдыхает табачный дым, исходящий от сигареты курящего человека.
Пассивное курение более опасно, чем активное (повреждающее действие сильнее), так как дым, исходящий от горящего конца сигареты, содержит большее количество вредных веществ (смолы, угарный газ, никотин и другие), чем вдыхает сам курильщик.
Пассивное курение особенно опасно для астматиков. Если вы пассивный курильщик и при этом больны астмой, это может ухудшить такие симптомы, как кашель или свистящее дыхание.
Как курение отражается на моем ребенке?
Курение еще более опасно для детей, чем для взрослых. При контакте с табачным дымом легкие ребенка раздражаются и начинают секретировать больше слизи, чем в норме. Так как дыхательные пути ребенка меньше, чем у взрослого, побочные эффекты пассивного курения отражаются на них быстрее, и могут сказаться также на функции легких во взрослом возрасте.
«Дети – пассивные курильщики» более склонны к развитию синусита и инфекционных заболеваний легких. Эти инфекционные заболевания ухудшают симптомы астмы и затрудняют контроль.
Как курение отражается на плоде во время беременности?
Курение влияет на развитие плода по многим направлениям. Никотин, вещество, к которому возникает зависимость, проходит через гемоплацентарный барьер и проникает прямо в организм плода.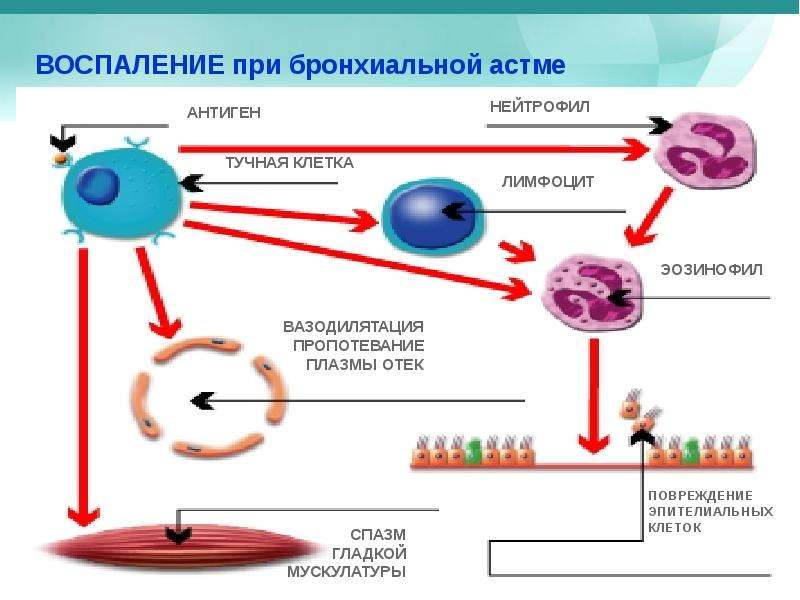
Дети, чьи мамы курили во время беременности, более склонны к развитию заболеваний легких и в 10 раз к развитию астмы, по сравнению с теми, чьи мамы не курили. С курением во время беременности могут быть связаны также: низкая масса тела при рождении, преждевременные роды, синдром внезапной остановки дыхания у ребенка.
Как избежать воздействия табачного дыма?
Как бороться с табачным дымом:
- Бросьте курить. Это всегда непросто, но есть множество эффективных программ и методик борьбы с курением. Проконсультируйтесь с врачом, что подойдёт вам. Если ваш супруг или другой член семьи курит, помогите ему, расскажите о вреде курения и убедите его в необходимости бросить.
- Не допускайте курения дома или в машине.
- Не позволяйте окружающим курить в вашем присутствии или в присутствии ребенка.
- Избегайте посещения ресторанов или других публичных мест, где разрешено курение.
О бронхиальной астме простым языком. Рассказывает врач-пульмонолог
Беседа с врачом-пульмонологом на радио «Эхо Москвы в Кирове».
Гости программы «Слушайте доктора»: врач-пульмонолог центра семейной медицины «ЛадаМед» Зонова Юлия Александровна, директор «ЛадаМед» Батогов Дмитрий Леонидович. Ведущая программы – Вера Власова.
(Вера Власова) — Добрый день! Это программа «Слушайте доктора». У микрофона Вера Власова. Сразу же хочу представить первой Юлию Александровну Зонову, врача-пульмонолога «Центра семейной медицины «ЛадаМед». Представляю первой, потому что по многочисленным отзывам Юлия Александровна является блестящим специалистом в своей области, и об этом мы в сегодняшней программе узнаем. А также сегодня в студии Дмитрий Леонидович Батогов, наш постоянный любимый гость, директор Центра семейной медицины «Лада-Мед». Здравствуйте, уважаемые гости!
(Юлия Зонова) — Здравствуйте!
(Дмитрий Батогов) — Здравствуйте!
(Вера Власова) — Добрый день! Итак, поскольку у нас в студии сегодня два прекрасных специалиста, один из которых врач-пульмонолог, конечно же, говорить мы сегодня, в первую очередь, будем о таком сложном понятии, как астма. Познакомимся сегодня, что это за болезнь такая, у кого она встречается, как она появляется и проявляется, и как же с ней бороться, как побеждать. Итак, Юлия Александровна, расскажите нам, пожалуйста, в первую очередь, что же такое астма, как давно она с нами, в нашей жизни человечества присутствует.
Познакомимся сегодня, что это за болезнь такая, у кого она встречается, как она появляется и проявляется, и как же с ней бороться, как побеждать. Итак, Юлия Александровна, расскажите нам, пожалуйста, в первую очередь, что же такое астма, как давно она с нами, в нашей жизни человечества присутствует.
(Юлия Зонова) — Астма давно присутствует в жизни человечества, первое упоминание об астме было в поэме Гомера. Именно слово «астма» взято из этой поэмы как из первоисточника. Что касается природы заболевания, тут много совершенно разных вариаций и теорий. Но доказано одно – что есть определённые предрасполагающие факторы, в частности, основной — это генетическая предрасположенность. В настоящее время считается, что она есть практически у всех людей. Другое дело, что человек, может быть, о ней не осведомлён, но в определённых условиях, как ключ к кодовому замку, появляется тот провоцирующий фактор, который реализует это заболевание.
(Вера Власова) — То есть, она может быть в каждом из нас, но дремать?
(Юлия Зонова) — Абсолютно. Что является предрасполагающими факторами? Их два больших блока – внутренние и внешние. Внутренние факторы – это те, с которыми, в частности, сложно бороться или мы не можем воздействовать на них. Отчасти, про генетику мы уже сказали, в том числе, это может быть лишний вес, ожирение, это может быть половая принадлежность. Известно, что до пубертатного возраста – возраста полового созревания – чаще болеют астмой мальчики, после полового созревания эта привилегия, в основном женской популяции. Помимо всего этого, это определённые факторы при рождении, это, скажем так, дефицит здоровья матери во время беременности, это курение матери во время беременности, плохое питание, плохое поступление в рацион определённых антиоксидантов, противовоспалительных веществ, т.е нарушение диеты, плохие экологические условия и так далее. Что касается внешних факторов – это различные аллергены, различные инфекции, инфекционные заболевания, некоторые паразитарные болезни, это могут быть погрешности в диете с дефицитом противовоспалительных агентов, это может быть воздействии каких-то провоцирующих факторов экологии, контакт с различными средами, газами, частицами, взвесями и так далее.
Что является предрасполагающими факторами? Их два больших блока – внутренние и внешние. Внутренние факторы – это те, с которыми, в частности, сложно бороться или мы не можем воздействовать на них. Отчасти, про генетику мы уже сказали, в том числе, это может быть лишний вес, ожирение, это может быть половая принадлежность. Известно, что до пубертатного возраста – возраста полового созревания – чаще болеют астмой мальчики, после полового созревания эта привилегия, в основном женской популяции. Помимо всего этого, это определённые факторы при рождении, это, скажем так, дефицит здоровья матери во время беременности, это курение матери во время беременности, плохое питание, плохое поступление в рацион определённых антиоксидантов, противовоспалительных веществ, т.е нарушение диеты, плохие экологические условия и так далее. Что касается внешних факторов – это различные аллергены, различные инфекции, инфекционные заболевания, некоторые паразитарные болезни, это могут быть погрешности в диете с дефицитом противовоспалительных агентов, это может быть воздействии каких-то провоцирующих факторов экологии, контакт с различными средами, газами, частицами, взвесями и так далее. По сути, это самое главное, о чём хотелось бы сказать о природе заболевания. Что касается самого заболевания, астма – это исходно хроническое заболевание, первично хроническое заболевание. Острая астма – это обострение хронического заболевания.
По сути, это самое главное, о чём хотелось бы сказать о природе заболевания. Что касается самого заболевания, астма – это исходно хроническое заболевание, первично хроническое заболевание. Острая астма – это обострение хронического заболевания.
(Вера Власова) — Давайте разберёмся. Первично хроническое – что это значит?
(Юлия Зонова) — Если человек заболел астмой, это заболевание будет всегда. Другое дело, что в наших силах полечить его так, чтобы человек, по сути, забыл, что он астматик, т.е. у него не будет ни клиники, ни симптомов, он будет полностью контролировать своё заболевание. Но риск его возобновления всегда останется.
(Вера Власова) — Возможно ли окончательно излечиться от астмы?
(Юлия Зонова) — Возможно достичь контроля над заболеванием, но излечиться от астмы – нет.
(Вера Власова) — То есть поставить лечение в систему, о которой мы позже поговорим, так чтобы оно вошло в привычку, образ жизни человека.
(Юлия Зонова) — Мало того, образ жизни – это главное в лечении астмы, и при хорошей коррекции жизненных факторов и хорошем сотрудничестве с доктором пациент может сойти с лечения, т.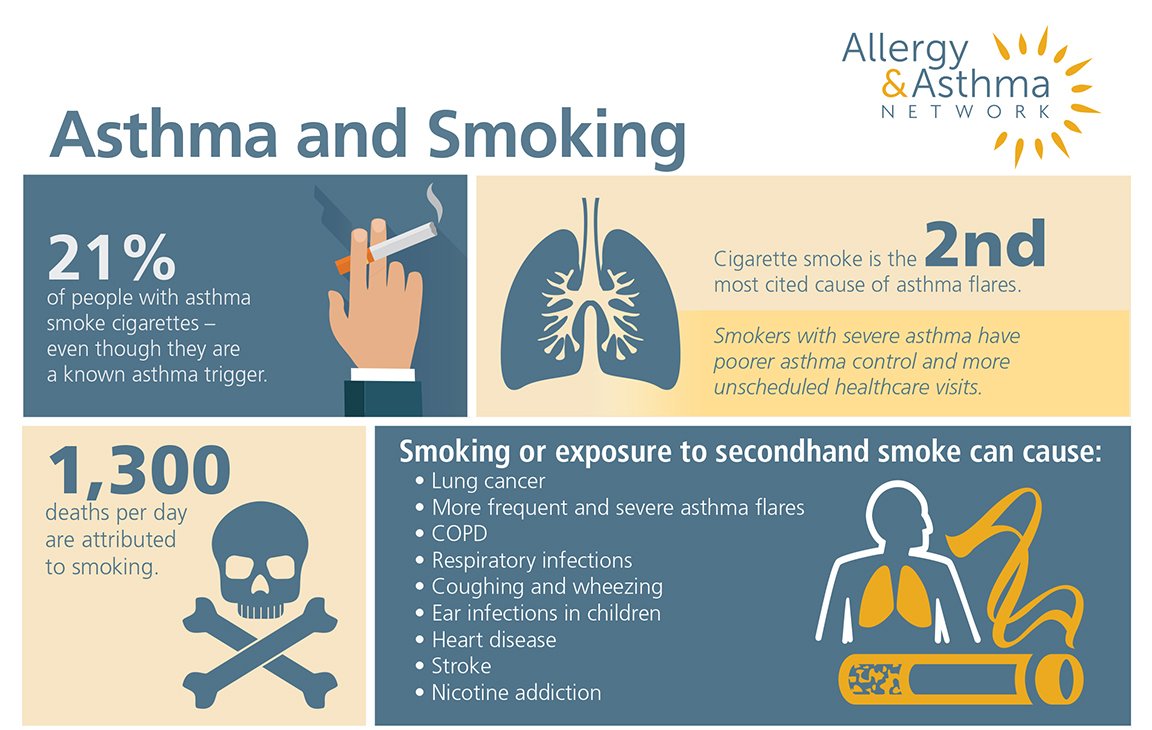 е. он может быть астматиком, но при этом не получать лечения и при этом быть в полном контроле своего заболевания.
е. он может быть астматиком, но при этом не получать лечения и при этом быть в полном контроле своего заболевания.
(Вера Власова) — Юлия Александровна, давайте разбираться, как этого достичь. Но перед этим мне всё-таки хочется от вас получить больше информации по поводу самого заболевания. Давайте поясним слушателям, во-первых, что происходит с человеком, когда он болеет астмой, какие процессы в организме происходят, как это проявляется.
(Юлия Зонова) — Астма – это хроническое воспаление с основной локализацией в бронхах, поэтому и называется она полностью «бронхиальная астма». В результате этого воспаления происходит отёк бронха, соответственно, просвет его становится уже, в результате некоторых других факторов возникает так называемый «бронхоспазм», т.е. резкое сужение бронхов, нехватка воздуха. И у многих пациентов в результате воспаления начинается выделение мокроты. Эти три момента приводят к следующим симптомам. Наши слушатели в первую очередь думают, что астма – это заболевание, которое проявляется удушьем, резкой нехваткой воздуха, буквально, как рыба ртом хватает.
(Вера Власова) — Мы видим такие проявления из популярных источников – фильмы, пресса…
(Юлия Зонова) — И очень часто пациенты, которые обращаются впервые, и обращаются вовремя, ещё до того, как астма приобрела классическую клинику, не согласны с диагнозом. В дебюте своём астма часто проявляется покашливаниями, длительными кашлями, сухими или с выделением мокроты, это может быть похрипывание или хрипы, свисты, ощущения хрипов или свистов в грудной клетке, это может быть при физической нагрузке, это может быть какой-то дыхательный дискомфорт, который может быть описан самим пациентом как удушье, как затруднение дыхания. Не дышится, нет ощущения полного вдоха, чувство неполного выдоха, т.е. какой-то дыхательный дискомфорт.
(Вера Власова) — Как узнать, что это именно астма, а не что-то другое?
(Дмитрий Батогов) – Прийти к врачу-пульмонологу.
(Вера Власова) — И как Вы это выявляете?
(Юлия Зонова) — Как это ни странно, в начале, в дебюте своём астма – это полностью обратимое заболевание. Если пришёл пациент вовремя, то симптомов вне провоцирующего фактора может не быть никаких. То есть, если дома, предположим, при контакте с каким-либо фактором-провокатором, ну, возьмём хотя бы, самый частый – домашние животные, пациент – аллергик, случаются приступы удушья. Он ушёл из дома, пришёл к доктору, посидел перед кабинетом, заходит – там всё чистенько в лёгких, нет никакой клиники, всё хорошо. Конечно, есть те функциональные тесты, например, определение функции внешнего дыхания (когда в трубочку дышат), которые позволяют нам увидеть, есть сужение бронхов – нет сужения бронхов (нарушен ли выход воздуха, если говорить обычным обывательским языком). Если у человека нет сейчас симптоматики, и эти тесты будут хорошими. Поэтому, в основном, диагноз «астма» всё-таки анамнестический, т.е. это подробная беседа с пациентом, установление всех нюансов. Есть так называемые факторы риска астмы и факторы отрицания астмы. Мы ищем баланс между ними. Это клиника – т.е. симптомы, которые мы чётко спрашиваем у пациента, это факторы — провокаторы, есть ли они.
Если пришёл пациент вовремя, то симптомов вне провоцирующего фактора может не быть никаких. То есть, если дома, предположим, при контакте с каким-либо фактором-провокатором, ну, возьмём хотя бы, самый частый – домашние животные, пациент – аллергик, случаются приступы удушья. Он ушёл из дома, пришёл к доктору, посидел перед кабинетом, заходит – там всё чистенько в лёгких, нет никакой клиники, всё хорошо. Конечно, есть те функциональные тесты, например, определение функции внешнего дыхания (когда в трубочку дышат), которые позволяют нам увидеть, есть сужение бронхов – нет сужения бронхов (нарушен ли выход воздуха, если говорить обычным обывательским языком). Если у человека нет сейчас симптоматики, и эти тесты будут хорошими. Поэтому, в основном, диагноз «астма» всё-таки анамнестический, т.е. это подробная беседа с пациентом, установление всех нюансов. Есть так называемые факторы риска астмы и факторы отрицания астмы. Мы ищем баланс между ними. Это клиника – т.е. симптомы, которые мы чётко спрашиваем у пациента, это факторы — провокаторы, есть ли они. Есть однотипные условия возникновения астмы. Это, конечно, наследственность. Мы чётко спрашиваем пациентов, о многих поколениях, были ли у него в роду астматики или кашляющие, задыхающиеся пациенты, если диагноз таковым не ставился. Это, естественно, употребление каких-либо лекарственных средств, которые либо провоцируют приступы (есть такие лекарства), либо, наоборот, помогают нашему пациенту. При астме некоторые группы препаратов запрещены. И у многих больных, в частности, пациентов с сердечно-сосудистыми заболеваниями, которым назначают некоторые препараты для лечения гипертонии или сердечной недостаточности, могут впервые спровоцировать дебют астмы. Мы можем спросить, какие именно препараты наш пациент принимает, какие таблетки назначались, т.е. взаимосвязь есть. Просто организм так среагировал, человек впервые столкнулся с этим веществом.
Есть однотипные условия возникновения астмы. Это, конечно, наследственность. Мы чётко спрашиваем пациентов, о многих поколениях, были ли у него в роду астматики или кашляющие, задыхающиеся пациенты, если диагноз таковым не ставился. Это, естественно, употребление каких-либо лекарственных средств, которые либо провоцируют приступы (есть такие лекарства), либо, наоборот, помогают нашему пациенту. При астме некоторые группы препаратов запрещены. И у многих больных, в частности, пациентов с сердечно-сосудистыми заболеваниями, которым назначают некоторые препараты для лечения гипертонии или сердечной недостаточности, могут впервые спровоцировать дебют астмы. Мы можем спросить, какие именно препараты наш пациент принимает, какие таблетки назначались, т.е. взаимосвязь есть. Просто организм так среагировал, человек впервые столкнулся с этим веществом.
(Вера Власова) — Но, опять-таки, если на первичном этапе — как это всё обратимо?
(Юлия Зонова) — Обратим сам приступ, сама клиника.
(Дмитрий Батогов) — Есть шанс, что это будет обратимо.
(Юлия Зонова) — Есть шанс, да, но ещё раз вернусь к началу разговора, астма – это исходно-хроническое заболевание, т.е. это хроническое заболевание, если мы полечили и нет клиники, нет симптомов, но случилась опять экспозиция этого фактора-провокатора, всё вернется снова, т.е заболевание оно никуда не делось. Просто в наших силах сделать так, чтобы оно отступило.
(Вера Власова) — Вы рассказали о генетической предрасположенности, на сколько высока на самом деле вероятность, что, если родители пациентов болели, и от кого больше от папы, от мамы, можно получить, либо через поколения как это происходит?
(Юлия Зонова) — Ну, вот четкой связи от мамы или от папы в настоящее время доказательной базы по этому моменту нет, но известно одно, что если болеет один из родителей, то вероятность астмы у ребенка увеличивается вдвое, если оба — то в четверо, это доказанный факт.
(Вера Власова) — А также аллергены, которые могут спровоцировать проявление астмы, есть ли какие-то аллергены, на которые вот астма особенно охотно, скажем так реагирует и проявляется после которых?
(Юлия Зонова) — Астма может достаточно активно и выражено на любой совершенно аллерген проявляться это один из клинических вариантов аллергии скажем так, но вот только что прошёл сезон и конечно самый большой процент пациентов которые обращаются, это пыльцевая аллергия и очень часто в астму приходят те люди у которых длительное время были насморки связанные с аллергией на пыльцу, т. е. симптомы аллергического ринита который плохо лечится или не чувствуется никогда, кстати сопряженность у молодых людей с аллергическим ринитом 80%, тут имеется ввиду астма про сопряженность.
е. симптомы аллергического ринита который плохо лечится или не чувствуется никогда, кстати сопряженность у молодых людей с аллергическим ринитом 80%, тут имеется ввиду астма про сопряженность.
(Вера Власова) — То есть у 80% людей, которые обращались с ринитом из-за пыльцы аллергической
(Юлия Зонова) — Которые не лечили свой аллергический ринит в последующем может развиться астма.
(Вера Власова) — Важный момент вы сказали, что первичный этап, когда ещё можно приостановить течение болезни, активное развитие болезни, сколько он длится, сколько есть у человека времени с тех пор, как он обратит внимание и каков следующий этап?
(Юлия Зонова) — Вы знаете нет опять же, мы говорим с вами о доказательной медицине, четких критериев продолжительности скажем так, того периода когда мы можем предотвратить астму нет, это индивидуальное, это условие реагирования каждого организма, но есть доказательная база по-другому моменту если астма длится более 2 лет от своего дебюта, пусть это был дебют в виде похрипываний, покашливаний и т. д. и пациент её не лечил, т.е. 2 года, всего лишь 2 года риск того, что астма не придет к контролю повышается на 30 процентов.
д. и пациент её не лечил, т.е. 2 года, всего лишь 2 года риск того, что астма не придет к контролю повышается на 30 процентов.
(Вера Власова) — Страшные цифры, которых очень хочется избежать, конечно же.
(Дмитрий Батогов) — Поэтому и пришли, чтоб привлечь, предупредить.
(Вера Власова) — Да пропаганда у нас здоровья во всеуслышание, на Эхо Москвы в Кирове. Диету вы ещё упомянули, чтоб взять должна быть диета, получается есть те продукты, которые провоцируют развитие астмы, так и те, которые скажем так позволяет стабилизировать заболевание, правда?
(Юлия Зонова) — У пациентов с пищевой аллергией, естественно это исключение, всех тех продуктов которые являются аллергенами или потенциальными аллергенами, известно всем, что при аллергии на пыльцу, есть перекрестно-пищевая аллергия и многие пациенты об этом не подозревают, но доказанный факт, что при аллергии на пыльцу березы очень у большого процента пациентов есть аллергия на яблоки и на морковь при употреблении в пищу, не всегда даже термическая обработка может нивелировать воздействие, поэтому в данном случае желательно исключать из рациона эти продукты или максимально термически их обрабатывать, т. е. какой-то шанс хотя бы, чтобы был. Естественно, у деток у маленьких существенно вмешивается в генез развитие астмы, да и многих воспалительных заболеваний белок коровьего молока. Что касается в принципе рациона, то в рационе должны присутствовать те продукты, которые содержат антиоксиданты, в частности Омега-3, это глубоководные сорта рыбы, различные растительные антиоксиданты.
е. какой-то шанс хотя бы, чтобы был. Естественно, у деток у маленьких существенно вмешивается в генез развитие астмы, да и многих воспалительных заболеваний белок коровьего молока. Что касается в принципе рациона, то в рационе должны присутствовать те продукты, которые содержат антиоксиданты, в частности Омега-3, это глубоководные сорта рыбы, различные растительные антиоксиданты.
(Вера Власова) — В любом случае, это полезная штука такая для развития мозга?
(Юлия Зонова) — Да, конечно, в принципе антиоксиданты вмешиваются во все наши процессы и хорошо влияют на любую… и конечно это употребление свежих овощей и фруктов, желательно без консервантов, т.е. не обработанных, для того, чтоб у нас был баланс антиоксидантных веществ в организме.
(Вера Власова) — То, что вы сейчас сказали, это Омега-3, антиоксиданты, это и есть основные факторы отрицания астмы или факторы отрицания астмы, это что-то другое. Вы, потому что упомянули, и у меня сложилось ощущение, что это как раз то, что может как-то нивелировать как, Вы сказали, развитие болезни.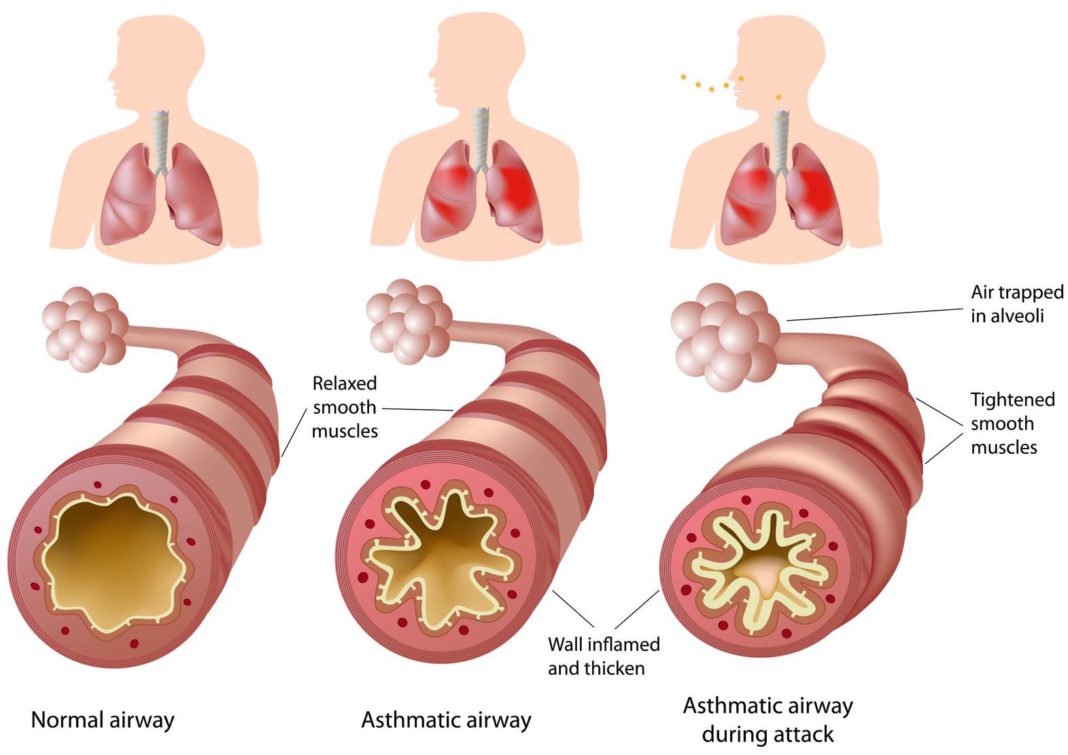
(Юлия Зонова) — Учитывая, что астма всё-таки хроническое воспаление, у предрасположенных лиц определенное вмешательство диеты в прогноз, в хороший прогноз, не возникновение астмы, конечно есть, т.е. у пациента предрасположенного, но с правильным питанием, с устранением провоцирующих факторов и внешних, в том числе не только пищевых, мы говорим с вами про аллергены, про избегать инфекции и т.д. Конечно, это может исключить возникновение астмы предрасположенного человека.
(Дмитрий Батогов) — Отсутствие курения — это тоже фактор отрицания.
(Юлия Зонова) — Курение — это фактор нивелирования риска не только астмы, это фактор риска сердечно-сосудистых заболеваний, а всем известно, что дыхательная система, сердечно-сосудистая система это брат и сестра по сути своей, поэтому всегда абсолютно дыхание вмешивается в плохое дыхание, дыхательные болезни вмешиваются в дисбаланс работы через сосудистые системы и наоборот, т.е. тут четкой взаимосвязи, конечно если пациент не курит, риск заболевания дыхательной системы в частности астмы существенно ниже.
(Вера Власова) — Ну, и упомянем ещё нашу любимую слушателями тему алкоголь, когда человек не употребляет алкоголь — это ведь тоже положительно на здоровье сказывается.
(Юлия Зонова) — На общее здоровье – да.
(Дмитрий Батогов) — Но, наверное, не так однозначно при астме.
(Юлия Зонова) — Есть некоторые моменты наблюдения по той простой причине, о чем, смотря, о чем мы с вами говорим. Если мы говорим с вами об употреблении пива, то, в частности, этот продукт он может вызвать увеличение отеков бронхиальной стенки, естественно он предрасположен у человека с астмой он может усугубить течение заболевания, особенно если это с солью вместе всё употреблять.
(Вера Власова) — С чем-то солененьким, как обычно это делают.
(Юлия Зонова) — Второй момент — это употребление бутилированных вин, которые содержат диоксид серы. Диоксид серы — это опять же для предрасположенных лиц один из провоцирующих факторов, провоцирующих аллергические реакции и фактор, который провоцирует воспаление, поскольку астма — это хронический воспалительный процесс, здесь тоже есть определенный риск и декомпенсации возникновения.
(Вера Власова) — Замечательно, т.е. алкоголь тоже исключаем?
(Дмитрий Батогов) — Чего замечательного?
(Юлия Зонова) — Хотя тоже небольшое вступление, если уж мы говорим всю правду, и всё обрисовываем честно, то небольшая доза чистого алкоголя, без консервантов, примесей и т.д., сорокаградусного, в определенных случаях, может помочь астматику приступ снять. Есть и такие наблюдения.
(Дмитрий Батогов) — Понятно не так всё однозначно с алкоголем.
(Юлия Зонова) — Да, это очень сложная ситуация, всё-таки маленькие дозировки алкоголя — это антистрессовый фактор.
(Вера Власова) — Но не будем забывать, что необходима консультация специалиста.
(Юлия Зонова) — Бесспорно, я не призываю совершенно.
(Дмитрий Батогов) — При других заболеваниях алкоголь вреден, тут даже нечего обсуждать.
(Юлия Зонова) — Ну, при астме, он тоже вреден, если мы говорим с вами о превышении…
(Вера Власова) — Идем дальше, про фактор отрицания нам ясно, давайте теперь разбираться — в каком возрасте можно спровоцировать такое заболевание?
(Юлия Зонова) — Астме подвержены абсолютно все возрастные категории человечества, если раньше всё-таки говорили, что астма — это болезнь молодых, то в последнее время мы всё чаще встречаем дебют астмы у пожилого населения.
(Вера Власова) — Почему так?
(Юлия Зонова) — Я думаю, что это, я так думаю, в принципе есть определенный… что вероятнее всего, это, во-первых, экология, во-вторых, употребление в пищу продуктов содержащих большое количество либо консервантов, либо однообразное питание без включения овощей и фруктов свежих, ну, и использование различных медикаментов, Вы знаете что у нас всё-таки пожилая популяция. Много разных лекарств используют из тех, что необходимы для лечения этих заболеваний, которые есть и тех, которые являются, скажем так, сопутствующими.
(Вера Власова) — Которые в случае могут спровоцировать появление астмы. Т.е беречь себя нужно в любом возрасте и особенно, если есть разное проявление этих первых симптомов?
(Юлия Зонова) — Бесспорно, в семьях, наверное, где астма уже присутствует у родителей при рождении ребенка быть особенно внимательным, если какие-то минимальные даже проявления есть.
(Дмитрий Батогов) — Как минимум, домашних животных хотя бы не заводить.
(Юлия Зонова) — Здесь тоже двоякий момент, если аллергии нет, астма ведь, если не аллергическая, т.е не обязательный аллергический компонент, есть другие варианты астмы, не обязательно аллергия, другое дело, что у деток чаще всего астма всё-таки аллергического генеза, тогда конечно аллергия провоцирует.
(Вера Власова) — Т.е. уже в детском возрасте можно понять?
(Юлия Зонова) — Я думаю да, вполне понятно и с самого маленького возраста, при контакте с определенными либо животными, либо продуктами возникают признаки, либо астмы, либо аллергии.
(Вера Власова) — Если человеку повезло — и на первичном этапе была диагностирована астма, именно это заболевание, как будет проходить лечение? И сразу же второй вопрос: «Если на первичном этапе не побеспокоился человек о своем здоровье, что дальше с ним происходит? Куда дальше ведет его болезнь, дальнейшие проявления, вот уже удушье получается?»
(Дмитрий Батогов) – То есть оптимистичный сценарий и пессимистичный сценарий.
(Вера Власова) – Да.
(Юлия Зонова) — Ну, давайте остановимся на первой части вопроса, она поприятней будет, я думаю да. Исходно наши пациенты должны получать два блока препаратов: первый препарат — это палочка-выручалочка, препарат экстренной помощи, который наш пациент — астматик носит абсолютно всегда с собой. Это тот самый баллончик — ингалятор, который содержит в себе бронхо- расширяющее вещество, снимающее все симптомы и действует он быстро, через 2-3 минуты уже есть достаточно серьёзный эффект, через 20 минут действие достаточно и сохраняется это действие от 6 до 8 часов. Этот препарат пациент использует по потребности, т.е., по сути, для снятия симптомов астмы и ещё один вариант, когда пациент знает, что он не может исключить контакт с провоцирующим фактором, по каким-либо причинам, он профилактически для предотвращения реакции на этот фактор тоже использует этот баллончик. Эти баллончики всем хороши, наши пациенты понимают, что они действуют и часто отказываются от второго блока лечения, но дело в том, что баллончики экстренной помощи они не лечат, они только снимают симптомы. И, если уж нам говорить о прогнозе, о лечении нашего пациента, то второй блок терапевтический — это самое главное, это противовоспалительные препараты, которые не только лечат астму, т.е. они убирают воспаление, ту причину симптомов, которые есть у наших пациентов, они улучшают прогноз, т.е. как раз на фоне лечения этими препаратами, нашими пациентами может быть достигнут полный контроль, именно на фоне лечения этими препаратами наш пациент может забыть, что он астматик, при условии регулярного, ежедневного, многомесячного, может быть и много годичного лечения. К таким препаратам относятся в первую очередь, конечно, ингаляционные гормоны, много различных средств, которые снимают воспаление, но доказательная база, самая лучшая доказательная база, в частности, по влиянию на прогноз, это, конечно, ингаляционный гормональный цикл.
И, если уж нам говорить о прогнозе, о лечении нашего пациента, то второй блок терапевтический — это самое главное, это противовоспалительные препараты, которые не только лечат астму, т.е. они убирают воспаление, ту причину симптомов, которые есть у наших пациентов, они улучшают прогноз, т.е. как раз на фоне лечения этими препаратами, нашими пациентами может быть достигнут полный контроль, именно на фоне лечения этими препаратами наш пациент может забыть, что он астматик, при условии регулярного, ежедневного, многомесячного, может быть и много годичного лечения. К таким препаратам относятся в первую очередь, конечно, ингаляционные гормоны, много различных средств, которые снимают воспаление, но доказательная база, самая лучшая доказательная база, в частности, по влиянию на прогноз, это, конечно, ингаляционный гормональный цикл.
(Вера Власова) — Как гормоны могут повлиять на состояние пациента?
(Юлия Зонова) — Улучшить его, если мы говорим о тех гормонах, которые применяются в пульмонологии в плановой терапии, регулярной терапии. Это тоже баллончики, либо баллончики -спреи, либо препараты в специальных устройствах, которые вдыхаются, как ингаляторы и эти препараты при соблюдении дозировок не обладают какими-либо системными явлениями, это не таблетки, это не инъекции, это не капельное введение препаратов, это сугубо местное действие на слизистую бронхов.
Это тоже баллончики, либо баллончики -спреи, либо препараты в специальных устройствах, которые вдыхаются, как ингаляторы и эти препараты при соблюдении дозировок не обладают какими-либо системными явлениями, это не таблетки, это не инъекции, это не капельное введение препаратов, это сугубо местное действие на слизистую бронхов.
(Дмитрий Батогов) — Юлия Александровна, а вот пациенты иногда спрашивают, что врач мне назначил ингаляционные гормоны, а можно как-то без них?
(Юлия Зонова) — Есть альтернативные средства, другие противовоспалительные препараты. Нужно ли называть все группы?
(Вера Власова) — Не обязательно, давайте по основным пройдемся.
(Юлия Зонова) — В первую очередь это антагонисты лейкотриеновых препаратов, другим образом влияющая.
(Дмитрий Батогов) — В общем альтернатива есть?
(Юлия Зонова) — Есть, бесспорно есть.
(Дмитрий Батогов) — И надо обратиться к врачу, и доктор подберет тогда.
(Юлия Зонова) — Дело в том, Дмитрий Леонидович, что, всё-таки, если мы говорим о противовоспалительном эффекте, все препараты, которые в современных рекомендациях присутствуют, они достаточным эффектом обладают, но в современных рекомендациях есть линия выбора лечения и есть альтернативная линия. В чем происходит вот, по какому принципу разграничение? Разграничение происходит четко по прогнозу, по влиянию на прогноз. Иуж если мы с программой максимум в лечении пациента ставим цель — достичь такого контроля, то можем сойти в лечении на «нет».
В чем происходит вот, по какому принципу разграничение? Разграничение происходит четко по прогнозу, по влиянию на прогноз. Иуж если мы с программой максимум в лечении пациента ставим цель — достичь такого контроля, то можем сойти в лечении на «нет».
(Дмитрий Батогов) — То без ингаляционных гормонов?
(Юлия Зонова) — Просто носить с собой баллончик на всякий случай, не будет ни клиники у нашего пациента и не будет потребности в ежедневной терапии, потому что всё хорошо, но, по сути, подавили воспаление максимально возможно, то это ингаляционные гормоны. И остальные хорошо работают, но на прогноз влияют.
(Дмитрий Батогов) — То есть ингаляционные гормоны – наиболее оптимистичный сценарий?
(Юлия Зонова) — Да, так и есть.
(Вера Власова) — Какие могут возникнуть проблемы с ингаляционными гормонами, почему человек хочет от них отказаться?
(Дмитрий Батогов) — Люди открывают инструкцию к препарату, там фармацевтические компании по традиции пишут всё, все возможные побочные эффекты какие они есть, там очень много страшных слов для простого человека, люди всё это сворачивают и эту инструкцию бросают в урну и понимают, что они никогда больше эти ингаляционные гормоны принимать не будут.
(Вера Власова) — А на самом деле это реальная угроза?
(Дмитрий Батогов) — Что является грубой ошибкой.
(Юлия Зонова) — Я думаю, что тут ещё не в этом даже дело, не в инструкциях, менталитет всё-таки наших людей редко, я очень уважаю этих людей, кто читает инструкцию подробно и полностью. Но в основном у нас почему-то как раз инструкции не читают наши пациенты, кстати, это плохо. Но пугает то наших пациентов слово гормоны, как таковое.
(Вера Власова) — Да, какое-то очень радикальное, бесповоротное слово.
(Юлия Зонова) — Да, т.е. есть понятие стероидофобия, т.е. выраженная боязнь гормонов в любом их виде, в любом их способе доставки, при любом заболевании и т.д. Нужно просто, наверное, ещё раз объяснить нашим пациентам, что если мы применяем те дозы, которые разрешены для применения в ингаляционных препаратах гормональных — то системных действий не будет. Могут быть побочные действия местного характера, это может быть небольшая осиплость голоса, это может быть першение в горле, это может быть молочница в ротовой полости, но все эти побочные действия предотвращаются легко. После ингаляции нужно обильно и тщательно, многократно прополоскать ротовую полость и горло водой и всё это сплёвывать. И всё.
После ингаляции нужно обильно и тщательно, многократно прополоскать ротовую полость и горло водой и всё это сплёвывать. И всё.
(Вера Власова) — Очень хорошо. И мы ещё хотели поговорить в этой программе об альтернативных способах лечения, то, что мы называем народная медицина, то, что совершенно не обязательно к применению, но по возможности, если у человека есть желание и возможность, после консультации со специалистом. Есть вот ещё некоторые способы, некоторые шаги, да?
(Юлия Зонова) — Да, конечно.
(Вера Власова) — Давайте перечислим, что это.
(Дмитрий Батогов) — Иногда пациенты спрашивают про фитотерапию, травы, иногда спрашивают про различные дыхательные гимнастики, авторов не будем называть, но вот там замедленное дыхание, наоборот форсированное дыхание и такой метод как иглоукалывание, акупунктура.
(Юлия Зонова) — Давайте сразу оговорим опять же, если мы рассматриваем оптимистичный сценарий, т.е. мы базируемся в сегодняшнем разговоре на доказательную медицину. Доказательной базы по альтернативным методам лечения – нет. Достаточной базы нет. Наши медикаменты они, проверены многочисленными исследованиями, многоцентровыми, крупномасштабными, был оценен польза и риск. Поскольку польза превышает риск, то и риска то нет — поэтому они введены доминантно, как лечебные моменты для астмы. Что касается альтернативных методик, здесь четко нужно понимать два момента. Момент первый — после консультации с доктором. Второй момент — альтернативный метод не должен вмешиваться в лечение основными препаратами, и он не заменяет лечение медикаментами, это сопутствующая терапия. Ещё один момент — этот дополнительный альтернативный метод не должен вмешиваться в лечение сопутствующих заболеваний, потому что плохое состояние сопутствующего фона тоже вмешивается в декомпенсацию астмы.
Доказательной базы по альтернативным методам лечения – нет. Достаточной базы нет. Наши медикаменты они, проверены многочисленными исследованиями, многоцентровыми, крупномасштабными, был оценен польза и риск. Поскольку польза превышает риск, то и риска то нет — поэтому они введены доминантно, как лечебные моменты для астмы. Что касается альтернативных методик, здесь четко нужно понимать два момента. Момент первый — после консультации с доктором. Второй момент — альтернативный метод не должен вмешиваться в лечение основными препаратами, и он не заменяет лечение медикаментами, это сопутствующая терапия. Ещё один момент — этот дополнительный альтернативный метод не должен вмешиваться в лечение сопутствующих заболеваний, потому что плохое состояние сопутствующего фона тоже вмешивается в декомпенсацию астмы.
(Дмитрий Батогов) — Прежде всего, сердечно-сосудистой системы.
(Юлия Зонова) — Да, конечно. Конечно, и в данной ситуации есть несколько методик, действительно эффективна акупунктура, есть точки воздействия. И восточные культуры часто ими пользуются, в том числе для снятия приступов астмы. Есть определенные варианты дыхательных практик. Для астмы наиболее эффективные дыхательные практики с медленным поверхностным дыханием через нос или с максимальной дыхательной паузой. Правильное дыхание астматика.
И восточные культуры часто ими пользуются, в том числе для снятия приступов астмы. Есть определенные варианты дыхательных практик. Для астмы наиболее эффективные дыхательные практики с медленным поверхностным дыханием через нос или с максимальной дыхательной паузой. Правильное дыхание астматика.
(Вера Власова) — Ну, тренировка получается?
(Юлия Зонова) — Да, да. Да, правильное дыхание астматика — чтобы не раздражать бронх, чтобы он не реагировал даже на поток воздуха. У многих астматиков, которые сейчас не в контроле, даже на поток, быстрый поток воздуха есть реакция бронхов. Правильно дышащий астматик — это пациент, который дышит очень медленно, поверхностно и носом. Дыхательные практики — на этой триаде. Есть такие дыхательные методики, опять же авторов называть не будем, идеально подходят для наших пациентов. Что касается фитотерапии, здесь не крупномасштабные исследования присутствуют. Всё-таки, экстракты трав, сейчас и многие фармацевтические компании используют уже готовые препараты, в аптеках их можно приобрести. Что активно вмешивается в воспалительный процесс при астме, нивелируя его или подавляя? Это, конечно, может быть экстракт чабреца, это ромашка, это календула, это алтей, т.е. в принципе любые препараты, которые обладают противовоспалительным значимым эффектом. Вот, наверное, это основные методики такие.
Что активно вмешивается в воспалительный процесс при астме, нивелируя его или подавляя? Это, конечно, может быть экстракт чабреца, это ромашка, это календула, это алтей, т.е. в принципе любые препараты, которые обладают противовоспалительным значимым эффектом. Вот, наверное, это основные методики такие.
(Дмитрий Батогов) — Юлия Александровна, можно ещё один, может быть, глупый вопрос? Пение и посещение хора это в плюс или в минус, если у человека астма? Ему противопоказано в хор ходить или наоборот?
(Юлия Зонова) — В поддержку астматиков, и, наверное, в удивление астматиков, хотелось бы сказать о том, что астматик – это обычный пациент, обычный человек, точно такой же, как человек без астмы, которому можно всё то, что не вызывает у него никаких дыхательных симптомов. И если пение в хоре у астматика не вызывает никаких неприятных ощущений, это не провоцирует кашель, хрипы, мало того ему легче становится дышать — пожалуйста, хоть 24 часа в сутки.
(Вера Власова) — На этом, к сожалению, всё, что мы успели сегодня рассказать, поведать про астму, мы рассказали, больше времени у программы, к сожалению, нет, но закончить эфир сегодняшний я хочу несколько иной темой. Обращаясь к первичным, наверное, знаниям Дмитрия Леонидовича Батогова.
Обращаясь к первичным, наверное, знаниям Дмитрия Леонидовича Батогова.
(Дмитрий Батогов) — К первой специальности
(Вера Власова) — К первой специальности, да, спасибо, что поправили. Дмитрий Леонидович у нас является врачом-инфекционистом, по первой специальности. Есть компания «Ключ здоровья», которая поддерживает сегодняшний эфир и многие эфиры «Слушайте доктора», благодаря которым мы ведем такое просвещение, пропаганду здоровья на радиостанции «Эхо Москвы». Дмитрий Леонидович, вот к Вам вопрос относительно, конечно же, пользы воды: «Сегодня очень популярно утверждение о том, что употребление качественной воды необходимо для нормальной работы организма. Что Вы думаете по этому поводу, как врач-инфекционист, и как же, всё-таки, качество воды влияет на здоровье?»
(Дмитрий Батогов) — Я полностью поддерживаю применение именно качественной воды, потому что это очень положительно влияет на здоровье и в свете нашей сегодняшней передачи, потому что чем меньше будет химических агентов присутствовать в воде всяких различных ненужных примесей, соответственно, тем будет меньше вероятность аллергии, и, соответственно, будет меньше вероятность провоцирования приступов бронхиальной астмы. А если, возвращаясь, к моей первой специальности, как врача-инфекциониста, то тут даже немножко наивно спрашивать, полезна ли чистая вода, потому что, чистая вода, она не содержит микроорганизмов патогенных, которых, к сожалению, в нечистой воде есть, и от нечистой, от некачественной воды риск заразиться кишечными инфекциями, очень разными кишечными инфекциями, которые могут привести к очень нехорошим последствиям, она, к сожалению, есть, поэтому я призываю пользоваться качественной водой, и я сам пользуюсь качественной водой.
А если, возвращаясь, к моей первой специальности, как врача-инфекциониста, то тут даже немножко наивно спрашивать, полезна ли чистая вода, потому что, чистая вода, она не содержит микроорганизмов патогенных, которых, к сожалению, в нечистой воде есть, и от нечистой, от некачественной воды риск заразиться кишечными инфекциями, очень разными кишечными инфекциями, которые могут привести к очень нехорошим последствиям, она, к сожалению, есть, поэтому я призываю пользоваться качественной водой, и я сам пользуюсь качественной водой.
(Вера Власова) — Спасибо большое, на сегодня успели очень большой объем информации про астму осветить, конечно же, времени нам не хватило, как всегда, бывает в данной компании. Надеюсь, что уважаемые гости ещё посетят эту студию и не раз, чтобы поведать о большей информации относительно астмы и ещё о многом слушателей предостеречь. Итак, в гостях у нас сегодня была Юлия Александровна Зонова – врач-пульмонолог центра семейной медицины «ЛадаМед» и Дмитрий Леонидович Батогов — директор центра семейной медицины «ЛадаМед». Спасибо большое уважаемые гости, ждем Вас снова. Всего доброго!
Спасибо большое уважаемые гости, ждем Вас снова. Всего доброго!
(Дмитрий Батогов) — Спасибо.
(Юлия Зонова) — Спасибо.
Запись на консультацию к врачу-пульмонологу по телефону:
(8332) 52-53-53; 22-03-03
Последствия курения при астме
Здоровая дыхательная система, показывающая дыхательные пути и легкие. Бронхи — это дыхательные пути, которые переходят в легкие.Какая связь между курением и астмой?
Дым сигар, сигарет и трубки вредит вашему телу во многих отношениях, но особенно он вреден для дыхательной системы. Дыхательные пути человека, страдающего астмой, очень чувствительны и могут реагировать на многие вещи или «триггеры».»Контакт с этими триггерами часто вызывает симптомы астмы. Табачный дым является мощным триггером астмы.
Что произойдет, если вы курите, страдая астмой?
Когда человек вдыхает табачный дым, раздражающие вещества оседают на влажной подкладке дыхательных путей и могут вызвать приступы астмы. Часто легкие людей, страдающих астмой, которые курят, находятся в состоянии постоянного плохого контроля над астмой. У этих людей часто наблюдаются постоянные симптомы астмы.
Часто легкие людей, страдающих астмой, которые курят, находятся в состоянии постоянного плохого контроля над астмой. У этих людей часто наблюдаются постоянные симптомы астмы.
Табачный дым также повреждает крошечные, похожие на волосы выступы в дыхательных путях, называемые ресничками.«Обычно реснички удаляют пыль и слизь из дыхательных путей. Сигаретный дым повреждает реснички, поэтому они не могут работать. Сигаретный дым также заставляет легкие вырабатывать больше слизи, чем обычно. В результате, когда реснички не работают, слизь и в дыхательных путях скапливаются другие раздражающие вещества.
Табачный дым также содержит много веществ, вызывающих рак («канцерогены», такие как смола). Эти вещества откладываются в легких и могут вызывать такие заболевания легких, как рак легких и эмфизему легких.
Каковы последствия пассивного курения при астме?
Вторичный дым — это сочетание дыма от горящей сигареты и дыма, выдыхаемого курильщиком.Вдыхание вторичного дыма (также называемого пассивным дымом или табачным дымом из окружающей среды) от курения другого человека может быть даже более вредным, чем курение самому. Дым, который выжигает кончик сигары или сигареты, содержит больше вредных веществ (смолы, окиси углерода, никотина и других), чем дым, вдыхаемый курильщиком.
Дым, который выжигает кончик сигары или сигареты, содержит больше вредных веществ (смолы, окиси углерода, никотина и других), чем дым, вдыхаемый курильщиком.
Взрослые и дети, живущие с курильщиками, более склонны к развитию респираторных заболеваний. Дети особенно подвержены риску, потому что их легкие меньше и все еще развиваются.Воздействие вторичного табачного дыма может привести к ухудшению функции легких и появлению таких симптомов воспаления дыхательных путей, как кашель, хрипы и увеличение выработки слизи, особенно у детей.
Дети, страдающие астмой, особенно чувствительны к пассивному курению. Вероятность развития симптомов астмы у них выше при воздействии вторичного табачного дыма. У них также чаще развиваются инфекции легких и носовых пазух. Эти инфекции могут усугубить симптомы астмы, и их будет труднее контролировать.
Способы уменьшения воздействия дыма
Если вы курите, бросьте курить для себя и своих детей.Если ваш супруг (а) или другие члены семьи курят, помогите им понять опасность курения и посоветуйте им бросить курить. Бросить курить не всегда легко. Существует множество программ и методов, которые помогут вам бросить курить. Попросите врача помочь вам подобрать наиболее подходящий для вас метод.
Бросить курить не всегда легко. Существует множество программ и методов, которые помогут вам бросить курить. Попросите врача помочь вам подобрать наиболее подходящий для вас метод.
- Не разрешайте курить дома или в машине.
- Не разрешайте опекуну вашего ребенка курить.
- Избегайте общественных мест, где разрешено курение.
Может ли курение нанести вред моему будущему ребенку?
Курение вредит как матери, так и ее будущему ребенку.Наряду с прямым повреждением легких матери никотин, вызывающее привыкание вещество в табачных изделиях, и другие вещества переносятся с кровотоком матери и попадают непосредственно к ребенку. Дети матерей, которые курили во время беременности, чаще страдают респираторными заболеваниями и в десять раз чаще заболевают астмой. Курение во время беременности также связано с рождением новорожденных с низким весом, преждевременными родами и синдромом внезапной детской смерти.
Как я могу бросить курить?
- Обсудите отказ от курения со своим врачом.
 Решите, когда вы бросите курить, и подготовьтесь к этому дню.
Решите, когда вы бросите курить, и подготовьтесь к этому дню. - Выбросьте все сигареты, зажигалки и пепельницы.
- Избегайте всех ситуаций, которые могут вызвать у вас желание курить. Например, если вы всегда выкуриваете сигарету после еды, вместо этого встаньте и прогуляйтесь или сразу начните убирать со стола и т. Д.
- Каждый раз, когда у вас появляется желание закурить, сделайте глубокий вдох и задержите дыхание на пять-десять секунд.
- Не позволяйте другим курить в вашем доме.
- Держите под рукой такие продукты, как морковные палочки.Или жевите жвачку, когда почувствуете желание закурить.
- Оставайтесь активными, чтобы не курить. Сходите на прогулку или почитайте книгу.
- Присоединитесь к группе поддержки или уроку по отказу от курения.
- Поговорите со своим врачом о средствах, заменяющих никотин (резинка, пластырь), которые могут помочь, когда вы пытаетесь бросить курить.
Влияние курения и астмы на здоровье
Жизнь с хроническим заболеванием легких, таким как астма, делает ваши легкие более чувствительными, чем у людей без астмы. Тем не менее, около 17 процентов взрослых с астмой в США курят по сравнению с 13,7 процента без астмы, хотя известно, что сигаретный дым вызывает приступы астмы. 1
Тем не менее, около 17 процентов взрослых с астмой в США курят по сравнению с 13,7 процента без астмы, хотя известно, что сигаретный дым вызывает приступы астмы. 1
Курение сигарет — причина номер один предотвратимой смерти в США. Сигаретный дым раздражает легкие, вызывая покраснение, отек и образование слизи. У ваших легких есть естественная защита от попадания грязи и микробов. Сигаретный дым разрушает легочную ткань и разрушает эту защиту. Это ставит людей, страдающих астмой, в затруднительное положение, потому что эти изменения в легких вызывают симптомы и приступы астмы.Кроме того, частые приступы астмы могут со временем вызывать изменения в легких и привести к более тяжелому заболеванию, хронической обструктивной болезни легких (ХОБЛ), которая включает хронический бронхит и эмфизему, или наложению астмы и ХОБЛ. Курение сигарет — фактор риска рака легких.
Защитите свои легкие
Отказ от курения снижает риск развития симптомов астмы и приобретения нового заболевания легких, такого как рак легких, ХОБЛ или синдром наложения астмы и ХОБЛ. Если вы курите, составьте план, чтобы бросить курить. У Американской ассоциации легких есть много ресурсов, которые могут помочь.
Если вы курите, составьте план, чтобы бросить курить. У Американской ассоциации легких есть много ресурсов, которые могут помочь.
- Lung HelpLine
Служба Lung HelpLine, укомплектованная респираторными терапевтами и сертифицированными специалистами по лечению табака, готова ответить на любой вопрос — хотите ли вы начать попытку бросить курить, хотите узнать больше о Freedom From Smoking Plus, Групповые клиники или руководство, которое поможет вам бросить курить, или вам нужна консультация по телефону у специалиста, который поможет вам бросить курить. Позвоните по телефону 1-800-LUNGUSA, чтобы узнать больше. - Сообщество онлайн-поддержки
Общайтесь и общайтесь с другими бросившими курить, которые понимают, через что вы проходите в нашем Inspire.com онлайн-сообщество «Бросить сейчас: свобода от курения». - Свобода от курения ®
Программа «Свобода от курения» помогла сотням тысяч людей бросить курить с момента ее первого выпуска в 1981 году. Узнайте больше о программе и о том, как она может вам помочь!
Узнайте больше о программе и о том, как она может вам помочь!
Кроме того, как можно больше избегайте пассивного курения, в том числе просите людей не курить рядом с вами. Пассивное курение может вызывать симптомы астмы, а также влиять на другие заболевания легких. По возможности старайтесь избегать общественной деятельности, которая подвергнет вас пассивному курению.Получите совет специалиста о том, как бросить курить.
Табак, вторичный дым и др.
Дым сигар, сигарет и трубки вредит вашему телу во многих отношениях. Это особенно вредно для легких человека, страдающего астмой. Табачный дым является мощным триггером симптомов астмы.
Как табачный дым вызывает астму?
Когда человек вдыхает табачный дым, раздражающие вещества оседают на влажной подкладке дыхательных путей. Эти вещества могут вызвать приступ у человека, страдающего астмой.
Кроме того, табачный дым повреждает крошечные, похожие на волосы структуры в дыхательных путях, называемые ресничками. Обычно реснички удаляют пыль и слизь из дыхательных путей. Табачный дым повреждает реснички, поэтому они не могут работать, позволяя пыли и слизи накапливаться в дыхательных путях.
Обычно реснички удаляют пыль и слизь из дыхательных путей. Табачный дым повреждает реснички, поэтому они не могут работать, позволяя пыли и слизи накапливаться в дыхательных путях.
Из-за дыма в легких вырабатывается больше слизи, чем обычно. В результате в дыхательных путях может скапливаться еще больше слизи, вызывая приступ.
Вредно ли пассивное курение для человека, страдающего астмой?
Пассивный дым — это комбинация дыма от горящей сигары или сигареты и дыма, выдыхаемого курильщиком.
Вдыхание пассивного дыма, также называемого «пассивным дымом» или «табачным дымом из окружающей среды», может быть даже более вредным, чем фактическое курение. Это потому, что дым, который горит от конца сигары или сигареты, содержит больше вредных веществ (смолы, окиси углерода, никотина и других), чем дым, вдыхаемый курильщиком.
Пассивное курение особенно вредно для людей, уже страдающих астмой. Когда человек, страдающий астмой, подвергается воздействию пассивного курения, он с большей вероятностью будет испытывать хрипы, кашель и одышку, связанные с астмой.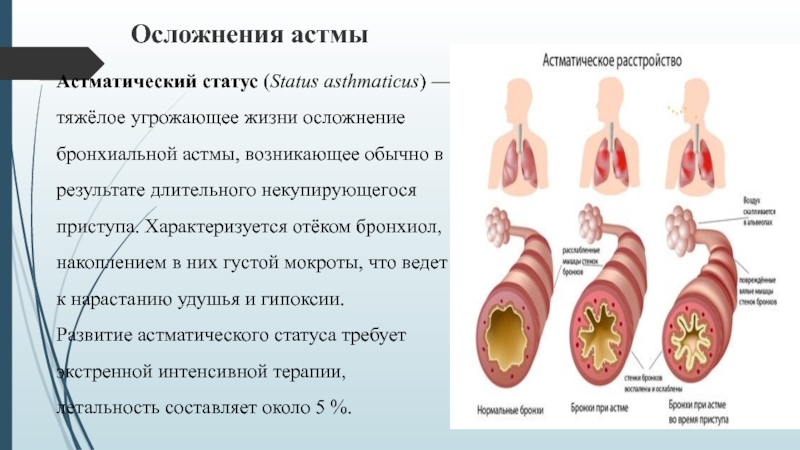
Может ли курение навредить моему ребенку?
Пассивное курение вредит детям, страдающим астмой, даже больше, чем взрослым.
Когда ребенок подвергается воздействию табачного дыма, его легкие раздражаются и выделяют больше слизи, чем обычно. Поскольку дыхательные пути у детей меньше, побочные эффекты пассивного курения влияют на них быстрее, а также могут повлиять на функцию легких в более позднем возрасте.
У детей курящих родителей также выше вероятность развития инфекций легких и носовых пазух. Эти инфекции могут усугубить симптомы астмы, и их будет труднее контролировать.
Может ли курение во время беременности повысить вероятность астмы у моего ребенка?
Курение вредит будущему ребенку во многих отношениях. Никотин, вызывающее привыкание вещество в табачных изделиях, переносится с кровотоком матери непосредственно в ребенка.
Дети женщин, которые курили во время беременности, более подвержены заболеваниям легких и в 10 раз чаще заболевают астмой. Курение во время беременности также связано с рождением новорожденных с низкой массой тела, преждевременными родами и синдромом внезапной детской смерти (СВДС).
Курение во время беременности также связано с рождением новорожденных с низкой массой тела, преждевременными родами и синдромом внезапной детской смерти (СВДС).
Как я могу не курить ребенка или себя?
Способы уменьшения воздействия табачного дыма включают:
- Если вы курите, бросьте. Бросить курить не всегда легко, но есть много программ и методов, которые могут помочь. Попросите вашего поставщика медицинских услуг помочь вам найти тот, который лучше всего подходит для вас. Если ваш супруг (а) или другие члены семьи курят, помогите им понять опасность курения и посоветуйте им бросить курить.
- Не разрешайте курить дома или в машине.
- Не позволяйте никому курить рядом с вами или вашим ребенком.
- Избегайте ресторанов и общественных мест, где разрешено курение.
Как я могу бросить курить?
Не существует единого способа бросить курить, который работал бы для всех, страдающих астмой. Может оказаться полезной программа отказа от курения. Спросите своего врача о программах в вашем районе.
Спросите своего врача о программах в вашем районе.
Прежде чем бросить курить сразу («холодная индейка»), вам поможет составление плана:
- Выберите дату, когда вы бросите курить, а затем подготовьтесь к этому.
- Сообщите семье и друзьям, что планируете бросить курить.
- Запишите, когда и почему вы курите. Вы узнаете, что побуждает вас курить.
- Запишите, что вы делаете, когда курите.
- Перечислите причины, по которым вы бросили курить. Прочтите список до и после того, как бросите курить.
- Найдите занятия, чтобы заменить курение. Будьте готовы заняться чем-нибудь другим, когда захотите курить.
- Спросите своего врача об использовании продуктов для замены никотина, таких как жевательная резинка, леденцы, пластыри, ингаляторы или назальные спреи. Это лекарства первого ряда, которые некоторые люди находят очень полезными.Лекарства, отпускаемые по рецепту, без никотина, такие как Chantix и Zyban, также могут помочь вам бросить курить.
Продолжение
Время выхода
В день, когда вы выберете, чтобы бросить курить, начните это утро без сигареты. Затем следуйте этим полезным советам:
- Не сосредотачивайтесь на том, что вам не хватает. Подумайте о том, что вы приобретаете.
- Скажите себе, что вы отличный человек, чтобы бросить курить. Напоминайте себе об этом, когда хотите покурить.
- Когда почувствуете желание закурить, сделайте глубокий вдох.Удерживайте его в течение 10 секунд, а затем медленно отпустите.
- Держите руки занятыми. Рисуйте, занимайтесь спортом, вяжите или работайте на компьютере.
- Измените действия, связанные с курением. Прогуляйтесь или почитайте книгу вместо того, чтобы делать перерыв.
- Не берите с собой зажигалку, спички или сигареты.
- Сходите в места, где запрещено курение, например, в музеи и библиотеки.
- Ешьте низкокалорийную полезную пищу, когда возникает желание закурить.
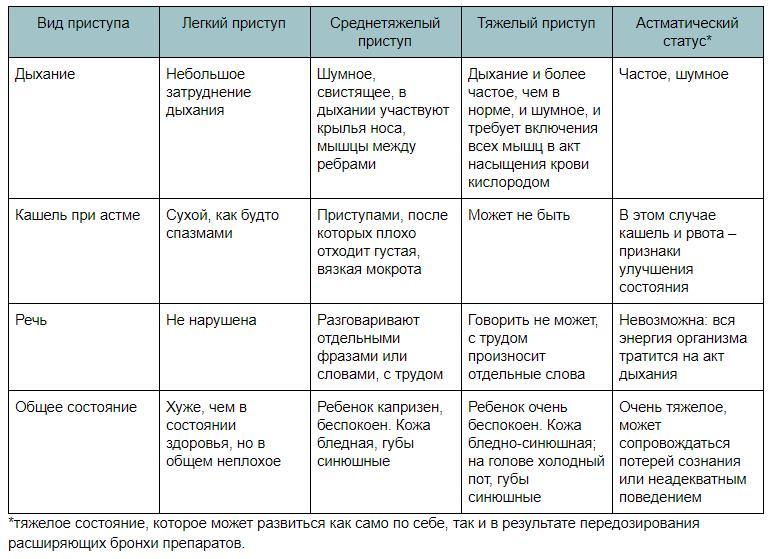 Палочки из моркови и сельдерея, свежие фрукты и обезжиренные закуски — хороший выбор.Избегайте сладкой или острой пищи, которая может вызвать тягу к сигаретам.
Палочки из моркови и сельдерея, свежие фрукты и обезжиренные закуски — хороший выбор.Избегайте сладкой или острой пищи, которая может вызвать тягу к сигаретам. - Пейте много жидкости. Избегайте алкогольных напитков. От них может захотеться курить. Выберите воду, травяные чаи, безалкогольные напитки без кофеина и соки.
- Упражнение. Это поможет вам расслабиться.
- Тусоваться с некурящими.
- Обратитесь за поддержкой, чтобы бросить курить. Рассказывайте другим о своих вехах с гордостью.
Продолжение
Как быстро я увижу выгоду от отказа от курения?
Через 20 минут отказа от курения:
- Ваше артериальное давление и частота пульса начинают снижаться.
- Кровообращение и температура ваших рук и ног начинают увеличиваться.
После 12 часов отказа от курения:
- Уровень угарного газа в крови возвращается к норме.
После 2 недель или 3 месяцев отказа от курения:
- Ваше тело лучше циркулирует кровь
- Ваши легкие функционируют лучше
После 1-9 месяцев отказа от курения:
- Кашель и одышка уменьшаются
После 1 года отказа от курения:
- Ваш риск сердечных заболеваний снижается вдвое по сравнению с риском курильщика.

После 5 лет отказа от курения:
- Ваш риск заболеть раком рта, горла или пищевода снижается вдвое по сравнению с курильщиком.
После 10 лет отказа от курения:
- Ваш риск смерти от рака легких снижается почти вдвое по сравнению с курильщиком.
- У вас снижается риск других видов рака, например рака гортани и поджелудочной железы.
После 15 лет отказа от курения:
- Ваш риск сердечных заболеваний снижается до уровня некурящих.
Продолжение
Что я буду чувствовать, когда брослю курить?
Когда вы впервые бросите курить, вы можете пройти через абстинентный синдром и:
- Тяга к сигаретам
- Чувствуете себя очень голодным
- Часто кашляете
- Головные боли
- Проблемы с концентрацией внимания
- Испытываете запор
- Чувствую себя очень усталой
- Чувствую нервный или грустный
- Болит горло
- Проблемы со сном
Хотя симптомы отмены будут самыми сильными, когда вы впервые бросите курить, они быстро улучшатся и должны полностью исчезнуть в течение нескольких недель.
Я уже пытался бросить курить и потерпел неудачу. Что делать, если я не могу этого сделать?
Чтобы бросить курить, нужно быть готовым эмоционально и морально. Прежде чем вы добьетесь успеха, может потребоваться несколько попыток. Некоторые люди готовы бросить курить больше, чем другие. Посмотрите на эти пять этапов изменения, которые проходят люди, чтобы бросить курить.
- Этап первый: Предварительное созерцание. Вы не хотите бросать курить, но вы можете попытаться бросить курить, потому что чувствуете давление, чтобы бросить курить.
- Этап второй: Созерцание. Вы хотите бросить курить в течение следующих 6 месяцев. Вы не предприняли шагов, чтобы бросить курить, но хотите бросить.
- Этап третий: Подготовка. Вы делаете небольшие шаги, чтобы бросить курить, например, сокращение курения или переход на более легкую марку.
- Четвертый этап: Действие. Вы обязуетесь бросить курить.
 Вы вносите изменения в свои действия и окружающую среду, чтобы помочь справиться с желанием закурить и не курить в течение 6 месяцев.
Вы вносите изменения в свои действия и окружающую среду, чтобы помочь справиться с желанием закурить и не курить в течение 6 месяцев. - Пятый этап: Техническое обслуживание. Вы не курите около 6 месяцев и стараетесь предотвратить рецидив.
Помните: повторное курение (рецидив) — обычное дело. Фактически, 75% бросивших курить снова будут курить. Большинство курильщиков трижды пытаются бросить курить, прежде чем добиваются успеха. Не сдавайся!
Астма и курение сигарет | Европейское респираторное общество
Реферат
В большинстве развитых стран около 25% взрослых, страдающих астмой, являются курильщиками сигарет. Астма и активное курение сигарет взаимодействуют, вызывая более серьезные симптомы, ускоренное снижение функции легких и нарушение краткосрочного терапевтического ответа на кортикостероиды.
Курение сигарет может изменять воспаление, связанное с астмой, хотя опубликованные данные о патологии дыхательных путей у курильщиков с астмой ограничены. На сегодняшний день данные указывают на сочетание как усиленных, так и подавленных воспалительных реакций у курильщиков по сравнению с некурящими, страдающими астмой.
На сегодняшний день данные указывают на сочетание как усиленных, так и подавленных воспалительных реакций у курильщиков по сравнению с некурящими, страдающими астмой.
Механизмы устойчивости к кортикостероидам у курильщиков-астматиков необъяснимы, но могут быть результатом изменений фенотипов воспалительных клеток дыхательных путей ( e.грамм. увеличение нейтрофилов или снижение эозинофилов), изменения в соотношении глюкокортикоидного рецептора-α к -β (, например, сверхэкспрессия глюкокортикоидного рецептора β) и повышенная активация провоспалительных факторов транскрипции ( например, ядерного фактора-κB) или снижение активность гистондеацетилазы.
В заключение, следует приложить все усилия, чтобы побудить курящих астматиков бросить курить, хотя влияние отказа от курения на устранение неблагоприятного воздействия табачного дыма на контроль астмы, терапевтический ответ на кортикостероиды и патологию дыхательных путей еще предстоит полностью выяснить. Пациентам с астмой, которые не могут бросить курить, необходимы альтернативные или дополнительные методы лечения ингаляционных кортикостероидов.
Пациентам с астмой, которые не могут бросить курить, необходимы альтернативные или дополнительные методы лечения ингаляционных кортикостероидов.
В середине шестнадцатого века сэр Уолтер Рэли ввел табак в Великобританию, и вскоре курение было рекомендовано для лечения различных заболеваний, включая респираторные заболевания. Курительные листья и корень дурмана ( Datura stramonium ), содержащие холинолитики, были впервые использованы для лечения астмы в семнадцатом веке 1.Курение «лекарства» от астмы оставалось популярным до появления адреналина в 1930-х годах. Во второй половине прошлого века вредное влияние табачного дыма в окружающей среде на детей и взрослых, страдающих астмой, получило все большее признание, при этом отмечалось отрицательное влияние на развитие астмы и обострение приступов 2–5. Совсем недавно были выявлены важные взаимосвязи между активным курением сигарет и астмой, включая влияние на заболеваемость, терапевтический ответ на кортикостероиды и механизмы заболевания (рис. 1⇓) 6. В этом обзоре обобщены опубликованные данные о клинических связях между активным курением сигарет и астмой, возможных биологических механизмах, которые могли бы объяснить эти связи, и потенциальных лекарствах для лечения курильщиков, страдающих астмой.
1⇓) 6. В этом обзоре обобщены опубликованные данные о клинических связях между активным курением сигарет и астмой, возможных биологических механизмах, которые могли бы объяснить эти связи, и потенциальных лекарствах для лечения курильщиков, страдающих астмой.
Распространенность курения сигарет
По оценкам Всемирной организации здравоохранения, во всем мире насчитывается около 1,25 миллиарда курильщиков, примерно две трети из которых живут в развивающихся странах. Во многих развитых странах по крайней мере каждый четвертый взрослый человек курит сигареты.Распространенность курения среди мужчин в США и Великобритании составляет 26 и 27%, соответственно, и 21 и 25%, соответственно, среди женщин 7, 8. Общий процент курильщиков варьируется между европейскими странами, 90 326 например. 38% в Германии, 30% во Франции, 29% в Италии и 18% в Швеции. Показатели распространенности курения выше в странах с более низкими доходами и среди молодежи, особенно среди женщин 8. Показатели курения, как правило, намного выше в слаборазвитых странах. Бывшие курильщики составляли 27% мужчин и 21% женщин в Великобритании 8.
Показатели курения, как правило, намного выше в слаборазвитых странах. Бывшие курильщики составляли 27% мужчин и 21% женщин в Великобритании 8.
Информации об уровне курения среди взрослых пациентов с астмой гораздо меньше, но активное курение является обычным явлением, причем показатели распространенности аналогичны показателям среди населения в целом. Текущие показатели курения среди астматиков из США и Великобритании колеблются в пределах 17–35% 9–15. В США особенно высокие показатели были обнаружены среди взрослых, обратившихся в отделения неотложной помощи больниц с острой астмой 12. Еще одно число взрослых астматиков — бывшие курильщики с показателями распространенности от 22 до 43% 9, 10.Таким образом, в большинстве развитых стран по крайней мере половина взрослого астматического населения, вероятно, будут курильщиками сигарет в настоящее время или в прошлом.
Развитие астмы у курильщиков
Активное курение сигарет было связано с развитием астмы примерно в 16–19, но не во всех исследованиях 20, 21. У бессимптомных подростков развитие астматических симптомов в течение 6-летнего периода было независимо связано с активным курением табака. (отношение шансов (ОШ) (95% доверительный интервал (ДИ) (2.1 (1.2–3.8)), а также атопии и гиперреактивности бронхов к метахолину 17. В ретроспективном исследовании случайной выборки населения из 15 813 взрослых, прошедших скрининг с использованием респираторного опросника, у курильщиков табака был повышенный уровень заболеваемости ИЛИ (95% ДИ) 1,6 (1,1–2,2) по сравнению с никогда не курильщиками по поводу астмы у взрослых у женщин, но не у мужчин 19. Было обнаружено, что курение тесно связано с началом астмы у лиц, не страдающих атопией (5,7 (1,7-19,2) ) 16 и является фактором риска астмы у пожилых людей (4.8 (2.3–10.1)) 18. Полиморфизм гена β 2 -адренергического рецептора, генотип аргинина-14, представляет повышенный риск астмы (7,8 (2,07–29,5)) у курильщиков по сравнению с никогда не курящими глицин-рецепторами. 16 гомозигот 22.
Различные фенотипы астмы могут быть связаны с началом курения 23. В исследовании факторов риска, связанных с астмой и началом курения сигарет, астма, развившаяся до начала курения, была связана с атопией, тогда как астма, развившаяся после начала курения, была связана с с меньшим объемом форсированного выдоха за одну секунду (FEV 1 ) 23.
В исследовании факторов риска, связанных с астмой и началом курения сигарет, астма, развившаяся до начала курения, была связана с атопией, тогда как астма, развившаяся после начала курения, была связана с с меньшим объемом форсированного выдоха за одну секунду (FEV 1 ) 23.
Клинические особенности
Контроль астмы и ее тяжесть
Заболеваемость и смертность от астмы у курильщиков сигарет выше, чем у никогда не куривших. Курильщики-астматики имеют более серьезные астматические симптомы 9, 10, большую потребность в спасательных препаратах 24 и худшие показатели состояния здоровья по сравнению с никогда не курившими 11, 24. Курение сигареты может вызвать острый бронхоспазм, хотя табачный дым не действует как острый раздражитель у всех пациентов 25.Исходный уровень ОФВ 1 напрямую связан с немедленной реакцией на вдыхание сигаретного дыма 26, предполагая, что курильщики-астматики с плохой функцией легких могут быть особенно восприимчивы к острому воздействию табачного дыма. Курильщики, страдающие атопической астмой, по сравнению с некурящими менее чувствительны к вдыханию аденозина, что может указывать на различия в воспалении дыхательных путей 27.
Курильщики, страдающие атопической астмой, по сравнению с некурящими менее чувствительны к вдыханию аденозина, что может указывать на различия в воспалении дыхательных путей 27.
Посещения отделения неотложной помощи в результате обострения астмы чаще случаются среди заядлых курильщиков сигарет, страдающих астмой, после дней с высоким уровнем загрязнения окружающей среды озоном 28.В настоящее время показатели курения аналогичны у пациентов с тяжелыми обострениями астмы, обратившимися в отделение неотложной помощи, независимо от того, развиваются ли симптомы в течение 3 часов или медленнее 29. Частота госпитализаций по поводу астмы и стационарного лечения увеличивается у курильщиков 11, 30, хотя, возможно, и не у молодых людей 31. Существуют противоречивые данные относительно того, является ли курение в настоящее время фактором риска почти смертельной астмы или астмы со смертельным исходом 13, 32–34. Однако шестилетняя смертность у курильщиков выше, чем у некурящих, после приступа астмы, близкого к летальному, с поправкой на возрастное отношение шансов (ДИ 95%), равное 3. 6 (2–6.2) 35.
6 (2–6.2) 35.
Снижение функции легких
Курение сигарет и астма в сочетании ускоряют ухудшение функции легких в большей степени, чем любой фактор по отдельности 15, 36. Копенгагенское городское исследование сердца включало продольное измерение ОФВ 1 за 15-летний период и обнаружило, что среднее снижение ОФВ 1 было больше у курильщиков-астматиков, чем у некурящих 36. Среднегодовое снижение ОФВ 1 у астматических мужчин в возрасте 40–59 лет составило 33 мл у некурящих (n = 36) и 58 мл у курильщиков (n = 150; р <0.001) 36. Наличие хронической гиперсекреции слизи и курение было связано с более значительным снижением ОФВ 1 36. Исследование 4000 взрослых в возрасте от 18 до 30 лет, которое продолжалось более 10 лет с серийными измерениями спирометрии. обнаружили, что снижение ОФВ 1 составило 8,5% у никогда не куривших без астмы (n = 2393), 10,1% у некурящих с астмой (n = 437) и 11,1% у курильщиков без астмы (n = 514). Комбинация астмы и курения ≥15 сигарет в день -1 (n = 101) оказала синергетический эффект на снижение функции легких и привела к 17 баллам.Снижение ОФВ на 8% 1 за 10 лет 15.
Комбинация астмы и курения ≥15 сигарет в день -1 (n = 101) оказала синергетический эффект на снижение функции легких и привела к 17 баллам.Снижение ОФВ на 8% 1 за 10 лет 15.
Терапевтический ответ на кортикостероиды
Международные руководящие принципы лечения астмы подчеркивают, что ингаляционные кортикостероиды являются наиболее эффективной противовоспалительной терапией хронической астмы 37. Доказательства этой рекомендации основаны на клинических исследованиях, которые проводились в основном с участием астматических пациентов, которые никогда не курили или были бывшими курильщиками. В нескольких исследованиях было высказано предположение, что эффективность кортикостероидов снижается у астматиков, которые активно курят сигареты 38–41, хотя этот вывод не подтверждается в другом исследовании 42.В 1993 году Kerstjens et al . 38 сообщили о результатах рандомизированного контролируемого исследования с участием пациентов с легкой и умеренно тяжелой обструктивной болезнью дыхательных путей (астма и хроническая обструктивная болезнь легких (ХОБЛ)), которое было разработано для выявления факторов, которые предсказывали терапевтический ответ на ингаляционные кортикостероиды. История нынешнего курения предсказывала снижение ОФВ 1 ответ на вдыхаемый беклометазон 800 мкг q.d. через 3 месяца 382 мл по сравнению с некурящими.Однако неясно, были ли это курильщики-астматики, пациенты с ХОБЛ или обе группы, которые были устойчивы к ингаляционным кортикостероидам. Анализ post hoc рандомизированного клинического исследования, разработанного для изучения долгосрочных эффектов ингаляционного будесонида (400 мкг qd или 1600 мкг qd ) или теофиллина (600 мг qd ) на маркеры воспаления и Функция легких при астме отметила, что эффективность ингаляционного будесонида проявлялась у некурящих астматиков, но не у курящих астматиков 39.У курильщиков не наблюдалось улучшения функции легких или маркеров эозинофилов даже после 9 месяцев приема высоких доз ингаляционного будесонида.
История нынешнего курения предсказывала снижение ОФВ 1 ответ на вдыхаемый беклометазон 800 мкг q.d. через 3 месяца 382 мл по сравнению с некурящими.Однако неясно, были ли это курильщики-астматики, пациенты с ХОБЛ или обе группы, которые были устойчивы к ингаляционным кортикостероидам. Анализ post hoc рандомизированного клинического исследования, разработанного для изучения долгосрочных эффектов ингаляционного будесонида (400 мкг qd или 1600 мкг qd ) или теофиллина (600 мг qd ) на маркеры воспаления и Функция легких при астме отметила, что эффективность ингаляционного будесонида проявлялась у некурящих астматиков, но не у курящих астматиков 39.У курильщиков не наблюдалось улучшения функции легких или маркеров эозинофилов даже после 9 месяцев приема высоких доз ингаляционного будесонида.
Эффект лечения ингаляционным пропионатом флутиказона (1000 мкг qd ) или плацебо в течение 3 недель изучался у взрослых пациентов с астмой, не получавших кортикостероиды, с помощью рандомизированного плацебо-контролируемого перекрестного исследования 40.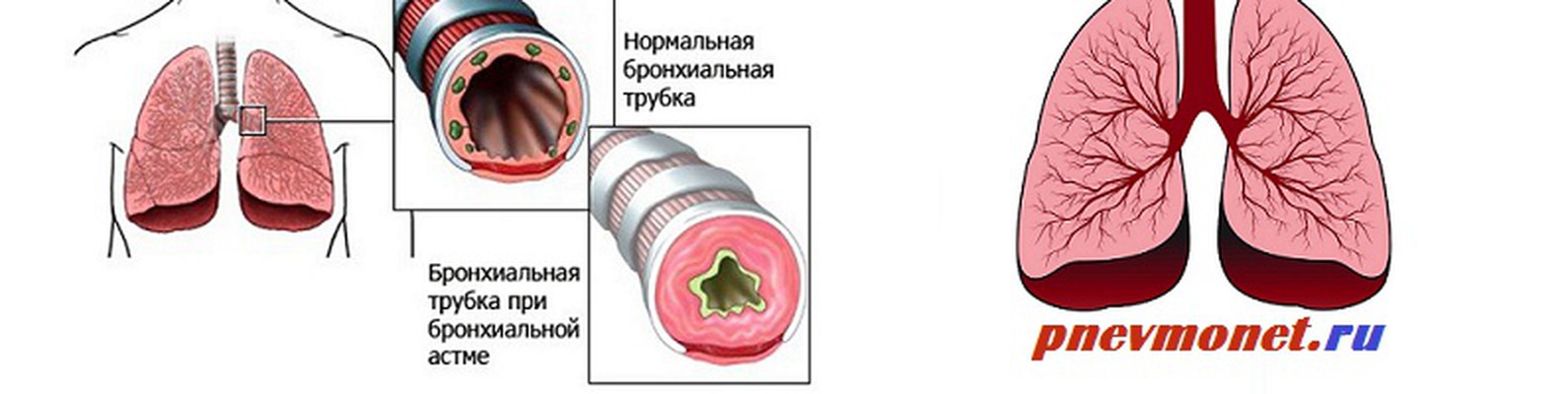 Все пациенты имели астму с доказательствами. гиперреактивности бронхов. У некурящих было значительное увеличение среднего утреннего пика выдоха (PEF; рис.2), средний ОФВ 1 и геометрическая средняя провокационная концентрация, вызывающая снижение ОФВ 1 (PC 20 ) метахолина на 20% и значительное снижение эозинофилов в мокроте после флутиказона по сравнению с плацебо. Эти показатели результатов не показали значительных изменений у курящих астматиков. В рандомизированном исследовании в параллельных группах с применением ингаляционного флутиказона пропионата (2000 мкг q.d. ) или плацебо в течение 6 недель изучалось влияние на чувствительность дыхательных путей к метахолину у 52 не лечившихся взрослых астматических пациентов, примерно половина из которых были курильщиками 42.Ингаляционный флутиказон снизил среднее геометрическое значение PC 20 метахолина по сравнению с плацебо (1,9 раза больше PC 20 ). Анализ множественной линейной регрессии показал, что текущее курение не влияло на величину эффекта вдыхаемого флутиказона на PC 20 метахолина.
Все пациенты имели астму с доказательствами. гиперреактивности бронхов. У некурящих было значительное увеличение среднего утреннего пика выдоха (PEF; рис.2), средний ОФВ 1 и геометрическая средняя провокационная концентрация, вызывающая снижение ОФВ 1 (PC 20 ) метахолина на 20% и значительное снижение эозинофилов в мокроте после флутиказона по сравнению с плацебо. Эти показатели результатов не показали значительных изменений у курящих астматиков. В рандомизированном исследовании в параллельных группах с применением ингаляционного флутиказона пропионата (2000 мкг q.d. ) или плацебо в течение 6 недель изучалось влияние на чувствительность дыхательных путей к метахолину у 52 не лечившихся взрослых астматических пациентов, примерно половина из которых были курильщиками 42.Ингаляционный флутиказон снизил среднее геометрическое значение PC 20 метахолина по сравнению с плацебо (1,9 раза больше PC 20 ). Анализ множественной линейной регрессии показал, что текущее курение не влияло на величину эффекта вдыхаемого флутиказона на PC 20 метахолина.
Эффективность краткосрочного перорального лечения кортикостероидами снижается у хронических стабильных курильщиков астмы. 41. Эффект преднизолона 40 мг q.d. или плацебо в течение 2 недель изучали в рандомизированном контролируемом перекрестном исследовании с участием курильщиков-астматиков, бывших курильщиков и никогда не куривших.Все пациенты имели клиническую астму с доказательством обратимости ОФВ 1 после ингаляционного сальбутамола ≥15%, а средний постбронходилататорный ОФВ 1 % предсказал> 80%. После перорального приема преднизолона по сравнению с плацебо наблюдалось значительное улучшение ОФВ 1 , утреннего PEF и контрольной оценки астмы у никогда не куривших астматиков, но не изменилось у курильщиков астмы (рис. 3 (). Текущее курение является предиктором нарушения реакции на лечение ингаляционными или пероральными кортикостероидами, что оценивается по улучшению FEV 1 , но не по изменениям PC 20 или качества жизни при астме при легкой нестабильной астме 43. Интересно, что у пациентов с ХОБЛ текущее курение является фактором, который наиболее сильно связан со снижением изменения ОФВ 1 после приема преднизолона 44.
Интересно, что у пациентов с ХОБЛ текущее курение является фактором, который наиболее сильно связан со снижением изменения ОФВ 1 после приема преднизолона 44.
В совокупности результаты этих клинических исследований позволяют предположить, что курильщики, страдающие астмой, могут быть устойчивыми к положительному терапевтическому эффекту кортикостероидов. Есть несколько клинических факторов, которые могут повлиять на реакцию на кортикостероиды у курильщиков-астматиков. К ним относятся:
Диагноз
Курение — главный фактор развития ХОБЛ.Курильщики-астматики в этих исследованиях имели несколько клинических особенностей, которые отличались от субъектов с ХОБЛ 40,41, поскольку они были моложе субъектов, обычно ассоциированных с симптоматической ХОБЛ 40, 41, и имели долгую историю астмы. Кроме того, у пациентов были доказательства гиперреактивности бронхов к метахолину 40 или обратимости после сальбутамола ≥15% 41.
Продолжительность терапии ингаляционными кортикостероидами
Еще предстоит установить, может ли продолжительность терапии влиять на реакцию на ингаляционные кортикостероиды. Оба краткосрочных рандомизированных контролируемых исследования Chalmers et al . 40, в котором ингаляционный флутиказон вводили в течение 3 недель, и более долгосрочное исследование Pedersen et al . 39, в которой ингаляционный будесонид вводили в течение 9 месяцев, показала устойчивость к кортикостероидам у курильщиков. В этих исследованиях использовались симптомы и функции легких для оценки реакции на лекарственную терапию, и не исключено, что введение ингаляционных кортикостероидов в течение длительного времени может иметь положительное влияние на другие клинические конечные точки, включая частоту обострений.
Оба краткосрочных рандомизированных контролируемых исследования Chalmers et al . 40, в котором ингаляционный флутиказон вводили в течение 3 недель, и более долгосрочное исследование Pedersen et al . 39, в которой ингаляционный будесонид вводили в течение 9 месяцев, показала устойчивость к кортикостероидам у курильщиков. В этих исследованиях использовались симптомы и функции легких для оценки реакции на лекарственную терапию, и не исключено, что введение ингаляционных кортикостероидов в течение длительного времени может иметь положительное влияние на другие клинические конечные точки, включая частоту обострений.
Интенсивность курения
В предыдущей работе по устойчивости к ингаляционным кортикостероидам у курильщиков-астматиков принимали участие люди с умеренно тяжелым стажем курения ≥10 лет 40,41, 45. Неизвестно, снижается ли ответ на кортикостероиды, когда в анамнезе курение более низкая интенсивность. В исследовании, в котором сообщалось, что текущее курение не влияло на величину эффекта вдыхаемого флутиказона на PC 20 метахолина 42, астматики выкуривали не менее пяти сигарет в день, но более подробной информации об интенсивности курения в анамнезе не было. Таким образом, еще предстоит определить, возникает ли резистентность к кортикостероидам только у пациентов с умеренным и высоким уровнем курения или она характерна для всех курильщиков-астматиков.
Продолжительность астмы
Неясно, устойчивы ли курильщики с недавно развившейся астмой к кортикостероидам.
Метаболизм теофиллина у курильщиков
Курение сигарет увеличивает клиренс наркотиков за счет индукции нескольких метаболизирующих ферментов 46.Цитохром P450-1A2 отвечает за метаболизм теофиллинов, и у курильщиков клиренс увеличивается на 60–100% по сравнению с некурящими. Отказ от курения на 1 неделю снижает выведение теофиллина на 35%.
Обучение пациентов и самоуправление
Нынешние курильщики с меньшей вероятностью будут использовать соответствующие методы для лечения как острой, так и хронической астмы 47, 48. Исследование пациентов, поступающих с острой астмой в отделения неотложной помощи в США, показало, что курение в настоящее время является предиктором недостаточных знаний об астме и самоконтроля управленческие навыки 48. Исследование, проведенное на уровне общины в Великобритании, показало, что курильщики с хронической астмой реже, чем некурящие, использовали ингаляционные кортикостероиды или измерители пикового потока и изменяли лечение во время обострения 47. Курильщики с астмой с меньшей вероятностью будут посещать образовательные программы по астме 49–51 . В амбулаторном исследовании 125 взрослых астматиков только 4% курильщиков по сравнению с 31% бывших курильщиков и 65% никогда не куривших прошли образовательную программу по астме 49.
Исследование, проведенное на уровне общины в Великобритании, показало, что курильщики с хронической астмой реже, чем некурящие, использовали ингаляционные кортикостероиды или измерители пикового потока и изменяли лечение во время обострения 47. Курильщики с астмой с меньшей вероятностью будут посещать образовательные программы по астме 49–51 . В амбулаторном исследовании 125 взрослых астматиков только 4% курильщиков по сравнению с 31% бывших курильщиков и 65% никогда не куривших прошли образовательную программу по астме 49.
Отказ от курения
Вредное воздействие активного курения сигарет на астму усиливает необходимость отказа от курения даже у людей с легкой формой заболевания.Однако многие взрослые курильщики, страдающие астмой, не верят, что они лично подвергаются риску курения 52. В исследовании группы постоянно курильщиков, страдающих астмой, среднее время до прекращения курения составляло 17 лет 53. Факторы, которые предсказывали более длительное время до прекращения курения — низкий образовательный уровень, более высокая интенсивность курения, начало курения в раннем возрасте и астма, развивающаяся в позднем детстве 53. В общей популяции вмешательства по отказу от курения с использованием кратких оппортунистических рекомендаций, поведенческой поддержки, никотинзаместительной терапии или все бупропион эффективны, хотя каждый год только небольшая часть курильщиков успешно бросает курить 54.Эти вмешательства не изучались специально в популяции астматиков, хотя их эффективность, вероятно, будет такой же, как у нынешних курильщиков в целом.
В общей популяции вмешательства по отказу от курения с использованием кратких оппортунистических рекомендаций, поведенческой поддержки, никотинзаместительной терапии или все бупропион эффективны, хотя каждый год только небольшая часть курильщиков успешно бросает курить 54.Эти вмешательства не изучались специально в популяции астматиков, хотя их эффективность, вероятно, будет такой же, как у нынешних курильщиков в целом.
Прекращение курения у лиц, не страдающих астмой, снижает респираторные симптомы, такие как кашель и выделение мокроты, а также частоту респираторных инфекций 55, 56. Легочная функция улучшается на ≤5%, а скорость снижения функции легких возвращается к показателям никогда не куривших. 57. Отказ от курения, вероятно, даст аналогичные клинические преимущества для курильщиков-астматиков, хотя доступные данные ограничены.Поперечное исследование 27 нынешних курильщиков и 27 бывших курильщиков показало, что у последней группы были более низкие уровни хронического кашля и мокроты 25; однако в другом исследовании оценка симптомов астмы была сходной между небольшой группой курильщиков и бывших курильщиков с астмой 41. Исследование 59 взрослых астматиков, которые бросили курить, показало, что 18 (30,5%) жаловались на ухудшение симптомов 58. Феннерти и др. . 59 сообщили, что двое из 14 пациентов с астмой жаловались на усиление симптомов в течение 24 часов после отказа от курения, но что у четырех из семи симптомы были менее выраженными через 1 неделю после отказа.Влияние курения на реакцию кортикостероидов может быть частично обратимым, поскольку бывшие курильщики, в отличие от нынешних курильщиков, показывают улучшение утренних значений PEF после перорального лечения кортикостероидами 41.
Исследование 59 взрослых астматиков, которые бросили курить, показало, что 18 (30,5%) жаловались на ухудшение симптомов 58. Феннерти и др. . 59 сообщили, что двое из 14 пациентов с астмой жаловались на усиление симптомов в течение 24 часов после отказа от курения, но что у четырех из семи симптомы были менее выраженными через 1 неделю после отказа.Влияние курения на реакцию кортикостероидов может быть частично обратимым, поскольку бывшие курильщики, в отличие от нынешних курильщиков, показывают улучшение утренних значений PEF после перорального лечения кортикостероидами 41.
Риск развития астмы по самооценке у бывших курильщиков по сравнению с никогда не курившими увеличивается после прекращения курения 21, 58, 60, но снижается со временем после прекращения курения 21. Этот эффект не считается причинным, а скорее является результат людей, приписывающих симптомы ХОБЛ астме, или в результате курильщиков, которые бросили курить из-за появления респираторных симптомов и позже у них была диагностирована астма 21, 60.
Биологические механизмы
Патология дыхательных путей
Курение сигарет может изменять воспаление, связанное с астмой; Однако данные о влиянии активного курения на патологию дыхательных путей при астме ограничены.
Фенотипы воспалительных клеток
Курение сигарет вызывает воспаление дыхательных путей у курильщиков, не страдающих астматизмом, без затруднения воздушного потока по сравнению с некурящими 61–64.У нормальных курильщиков наблюдается повышенное количество Т-лимфоцитов, в основном CD8 + клеток 65 и макрофагов в стенке дыхательных путей, более высокое количество нейтрофилов в бронхиальном секрете 61 и инфильтрация периферических дыхательных путей мононуклеарными клетками и макрофагами 61. Периферические срезы легких курильщиков, как сообщается, имеют имеют повышенное количество эозинофилов, проникающих в подслизистую основу, по сравнению с некурящими 66.
Нет опубликованных исследований гистологии воспаления дыхательных путей у курильщиков с астмой, оцениваемых либо с помощью биопсии бронхов, либо с помощью образцов резекции легкого. Количество индуцированных эозинофилов в мокроте снижено у курильщиков по сравнению с некурящими с легкой формой астмы 45. Причины снижения количества эозинофилов в мокроте у астматических курильщиков не выяснены 6, но могут быть объяснены экзогенным оксидом азота (NO) в сигаретном дыме. увеличение апоптоза активированных эозинофилов 67, 68. Кратковременное воздействие табачного дыма снижает реакцию на овальбумин у сенсибилизированных овальбумином мышей и снижает количество эозинофилов и макрофагов в бронхоальвеолярном лаваже (БАЛ) по сравнению с некурящими мышами 69.Никотин в табачном дыме может оказывать вторичное иммуномодулирующее действие на функцию эозинофилов, ингибируя высвобождение провоспалительных цитокинов из макрофагов 70, 71. Однако другие исследования на мышиных моделях аллергии отметили, что воздействие табачного дыма увеличивает гиперреактивность бронхов, эозинофилию и Т-хелперный (Th) 2-цитокиновый ответ после заражения аллергеном 72, 73. Было обнаружено, что индуцированное количество нейтрофилов в мокроте было повышено у курильщиков с легкой формой астмы, которые в среднем курили в анамнезе 21 пачку, по сравнению с некурящими астматиками 45.
Количество индуцированных эозинофилов в мокроте снижено у курильщиков по сравнению с некурящими с легкой формой астмы 45. Причины снижения количества эозинофилов в мокроте у астматических курильщиков не выяснены 6, но могут быть объяснены экзогенным оксидом азота (NO) в сигаретном дыме. увеличение апоптоза активированных эозинофилов 67, 68. Кратковременное воздействие табачного дыма снижает реакцию на овальбумин у сенсибилизированных овальбумином мышей и снижает количество эозинофилов и макрофагов в бронхоальвеолярном лаваже (БАЛ) по сравнению с некурящими мышами 69.Никотин в табачном дыме может оказывать вторичное иммуномодулирующее действие на функцию эозинофилов, ингибируя высвобождение провоспалительных цитокинов из макрофагов 70, 71. Однако другие исследования на мышиных моделях аллергии отметили, что воздействие табачного дыма увеличивает гиперреактивность бронхов, эозинофилию и Т-хелперный (Th) 2-цитокиновый ответ после заражения аллергеном 72, 73. Было обнаружено, что индуцированное количество нейтрофилов в мокроте было повышено у курильщиков с легкой формой астмы, которые в среднем курили в анамнезе 21 пачку, по сравнению с некурящими астматиками 45.
Общее количество клеток ЖБАЛ и концентрация альвеолярных макрофагов, лимфоцитов, нейтрофилов и эозинофилов, которые повышены у нормальных курильщиков, возвращаются к норме в течение 9 месяцев после прекращения курения 74. Однако предыдущее курение сигарет вызывает стойкое воспаление в легких у пациентов с ХОБЛ после прекращения курения 56, 75, 76. Индуцированное дифференциальное количество клеток в мокроте и фенотипы макрофагов у пациентов с ХОБЛ, которые курят в настоящее время, аналогичны по сравнению с бывшими курильщиками 76.Биопсии бронхов у нынешних и бывших курильщиков с хроническим бронхитом показывают одинаковую степень воспаления 75. Остается определить, уменьшит ли отказ от курения воспаление дыхательных путей у курильщиков с астмой, как это происходит у нормальных субъектов, или оно сохраняется, как у пациентов с ХОБЛ.
Цитокины и медиаторы
Уровни интерлейкина (ИЛ) -8 в мокроте повышены у курильщиков-астматиков, и эти концентрации положительно связаны с пропорциями нейтрофилов в мокроте и историей курения в пачках и отрицательно коррелируют с ОФВ 1 % предсказано 45. Эти данные косвенно подтверждают связь между курением, воспалением дыхательных путей и снижением функции легких у курильщиков-астматиков. Концентрации эозинофильного белка (ECP) в мокроте одинаковы у курильщиков и некурящих с астмой 45. IL-18 — это цитокин, который участвует в развитии ответов Th2-лимфоцитов и может играть регулирующую роль при астме, подавляя ответы Th3-лимфоцитов. Курение связано со значительным снижением уровня IL-18 как у здоровых, так и у астматиков по сравнению с некурящими, и этот эффект более выражен у астматиков, чем у здоровых людей 77.Экспрессия мРНК IL-18 была снижена у курильщиков-астматиков по сравнению с некурящими. Эти данные показывают, что курение сигарет может частично изменять воспаление дыхательных путей, потенциально изменяя баланс секреции Th2- / Th3-цитокинов. Курильщики-астматики имеют повышенные концентрации противовоспалительного белка липокортина-1 в образцах БАЛ по сравнению с некурящими, страдающими астмой 78. Эти авторы постулировали, что уровень липокортина-1 повышен у курильщиков как самозащитный механизм для подавления воспаления дыхательных путей.
Эти данные косвенно подтверждают связь между курением, воспалением дыхательных путей и снижением функции легких у курильщиков-астматиков. Концентрации эозинофильного белка (ECP) в мокроте одинаковы у курильщиков и некурящих с астмой 45. IL-18 — это цитокин, который участвует в развитии ответов Th2-лимфоцитов и может играть регулирующую роль при астме, подавляя ответы Th3-лимфоцитов. Курение связано со значительным снижением уровня IL-18 как у здоровых, так и у астматиков по сравнению с некурящими, и этот эффект более выражен у астматиков, чем у здоровых людей 77.Экспрессия мРНК IL-18 была снижена у курильщиков-астматиков по сравнению с некурящими. Эти данные показывают, что курение сигарет может частично изменять воспаление дыхательных путей, потенциально изменяя баланс секреции Th2- / Th3-цитокинов. Курильщики-астматики имеют повышенные концентрации противовоспалительного белка липокортина-1 в образцах БАЛ по сравнению с некурящими, страдающими астмой 78. Эти авторы постулировали, что уровень липокортина-1 повышен у курильщиков как самозащитный механизм для подавления воспаления дыхательных путей.
Уровни выдыхаемого NO (eNO) снижаются у курильщиков-астматиков, не страдающих легкими стероидами, по сравнению с некурящими астматиками 79. Сигаретный дым может снижать eNO путем ингибирования индуцируемой NO-синтазы в результате либо прямого воздействия высокой концентрации экзогенного NO 68, либо за счет монооксида углерода в сигаретном дыме, взаимодействующего с белками гема 80. У нормальных курильщиков уровни eNO повышаются после прекращения курения 81. Окислительный стресс усиливается при астме, ХОБЛ и у курильщиков без препятствий воздушному потоку 82, 83.Вероятно, повышенная окислительная нагрузка — это особенность курильщиков, страдающих астмой. Нейрогенное воспаление также может способствовать воспалению дыхательных путей у курильщиков, страдающих астмой 84.
Ремоделирование дыхательных путей
Ремоделирование дыхательных путей может быть более серьезным у курильщиков-астматиков, поскольку продольная сеть эластичных волокон дыхательных путей в образцах дыхательных путей, полученных от астматиков, умерших не от астмы, а у курильщиков по сравнению с некурящими 85.Увеличение площади эластичных волокон подслизистой оболочки может изменить механические свойства стенки дыхательных путей. Использование компьютерной томографии с высоким разрешением для оценки структурных изменений в легких 86, 87 показало, что наличие эмфиземы у курильщиков, страдающих астмой, связано с более длительным курением в анамнезе 88. Гиперинфляция или эмфизематозные изменения легких усиливаются при астматическом исходе. — курильщики, у которых было 49 паковок в анамнезе, по сравнению с никогда не курившими астматиками 89.
Циркулирующие клетки периферической крови
Количество эозинофилов в циркулирующей периферической крови снижено у курильщиков сигарет с астмой по сравнению с никогда не курившими с астмой 90, тогда как обратное наблюдается у здоровых неастматиков, у которых текущее курение связано с повышенным количеством циркулирующих эозинофилов 91–93. Эти результаты указывают на изменение воспалительного клеточного ответа у курильщиков, страдающих астмой, с подавлением повышенного количества эозинофилов в циркулирующей крови, связанного с астмой.Концентрации миелопероксидазы и ТЭК в циркулирующей крови у курильщиков-астматиков схожи по сравнению с некурящими и бывшими курильщиками с астмой 39. Выработка лейкотриена B 4 (LTB 4 ) лейкоцитами периферической крови увеличивается у пожилых пациентов с астмой, которые курят. по сравнению с некурящими 89. Курение сигарет в настоящее время положительно связано со специфическими антителами иммуноглобулина Е к клещу домашней пыли в общей популяции 94. Таким образом, возможно, что курение сигарет может влиять на иммунологический ответ на аллергены при астме.
Обзор патологии дыхательных путей у курильщиков, больных астмой
Обобщая результаты этих исследований, можно сделать вывод, что у курильщиков наблюдается сочетание как усиленных, так и подавленных воспалительных реакций по сравнению с некурящими, страдающими астмой. Например, количество эозинофилов снижается, тогда как количество нейтрофилов повышается в образцах индуцированной мокроты от курильщиков с астмой. Концентрации некоторых цитокинов, таких как IL-8, повышаются, а концентрации других, таких как IL-18, подавляются курением сигарет.Неясно, важны ли эти изменения количества клеток и концентраций цитокинов в патогенезе повышенной тяжести симптомов у курильщиков, страдающих астмой. В качестве альтернативы, эти изменения могут отражать продолжительность и интенсивность курения в анамнезе, но могут не иметь прямого отношения к механизмам заболевания у курильщиков-астматиков. Необходимы дальнейшие исследования с использованием как инвазивных, так и неинвазивных методов для оценки клеточных и структурных изменений в дыхательных путях курильщиков-астматиков по сравнению с некурящими астматиками и больными ХОБЛ.В частности, будет важно установить, является ли патология дыхательных путей у курильщиков-астматиков преимущественно патологией астматических некурящих, ХОБЛ или сочетанием этих двух состояний.
Механизмы устойчивости к кортикостероидам у курильщиков, больных астмой
Противовоспалительные эффекты кортикостероидов опосредуются активацией цитоплазматических глюкокортикоидных рецепторов (GR), которые действуют как лиганд-активируемые факторы транскрипции, которые перемещаются в ядро, подавляя или индуцируя гены-мишени глюкокортикоидов, либо путем прямого связывания с последовательностями ДНК (трансактивация). или путем взаимодействия с провоспалительными факторами транскрипции (трансрепрессия) 95–97.Различные механизмы вовлечены в резистентность к кортикостероидам у некурящих, страдающих астмой, и при других заболеваниях, включая воспалительное заболевание кишечника и ревматоидный артрит 95–99. Возможные механизмы резистентности к кортикостероидам у курильщиков-астматиков в значительной степени не изучены, но могут включать один или несколько путей, участвующих в возникновении у некурящих астматиков и других воспалительных заболеваний (рис. 4⇓; таблица 1⇓).
Фармакокинетика кортикостероидов
Проницаемость слизистой оболочки дыхательных путей in vivo увеличивается у курильщиков сигарет с нормальной функцией легких 100 и у некурящих с астмой по сравнению с нормальными субъектами 101.Неизвестно, существует ли аддитивный или синергетический эффект курения сигарет и астмы на проницаемость дыхательных путей, и если да, то может ли быть повышенный клиренс ингаляционных кортикостероидов из дыхательных путей курильщиков-астматиков по сравнению с некурящими астматиками. Курение сигарет вызывает хроническую гиперсекрецию слизи как у нормальных 102, так и у астматических курильщиков 36. Избыточная слизь, выстилающая дыхательные пути курильщиков-астматиков по сравнению с некурящими астматиками, может ухудшить доступ ингаляционных кортикостероидов к GR на клетках-мишенях в дыхательных путях.Однако должны действовать другие механизмы, поскольку у астматиков без симптомов хронической гиперсекреции слизи наблюдается снижение терапевтического ответа на ингаляционные кортикостероиды 40. Кроме того, на устойчивость кортикостероидов к пероральному введению преднизолона вряд ли повлияет избыток слизи в дыхательных путях или повышенная проницаемость слизистой оболочки дыхательных путей 41. Влияние курения сигарет на клиренс оральных кортикостероидов при астме неизвестно, но, вероятно, будет нормальным, поскольку курение не меняет фармакокинетику преднизолона, преднизона и дексаметазона у здоровых взрослых мужчин 46, 103.
Взаимодействие кортикостероидов и β
2 -адренергических рецепторовСообщалось, что хроническое курение сигарет снижает плотность β 2 -адренергических рецепторов на лимфоцитах, снижает связывание лиганда с β 2 -адренергическими рецепторами и ухудшает образование циклического аденозинмонофосфата 104. Эти эффекты обратимы через 8 недель отказа от курения 104, 105. Степень индуцированного курением подавления β 2 -адренергического рецептора может варьироваться между людьми в соответствии с их типом полиморфизма β 2 -адренергического рецептора 22.β 2 -агонисты могут усиливать действие кортикостероидов за счет увеличения ядерной локализации GR 106. Таким образом, у курильщиков, страдающих астмой, подавление функции β 2 -адренергических рецепторов может не только ухудшать клинический ответ на β . 2 -агонистов, но также благотворное влияние кортикостероидов.
Фенотипы воспалительных клеток
Сигаретный дым изменяет количество и функцию воспалительных клеток дыхательных путей 107, 108.Уменьшение количества эозинофилов в мокроте, обнаруженное у астматиков, которые курили в течение многих лет, по сравнению с некурящими астматиками 40, 45, может привести к нарушению реакции на кортикостероиды у курильщиков. С другой стороны, повышенное количество нейтрофилов в мокроте у курильщиков, страдающих астмой, может плохо реагировать на терапию кортикостероидами 109. Однако существуют противоречивые данные о влиянии кортикостероидов на нейтрофильное воспаление при астме 110. Ингибирование кортикостероидами пролиферации мононуклеарных Т-лимфоцитов периферической крови клеток нарушается у пациентов с кортикостероидной резистентной астмой по сравнению с пациентами с кортикостероидной астмой 111.Курильщики сигарет с нормальной функцией легких имеют повышенное количество CD8 + Т-лимфоцитов в ЖБАЛ, что положительно коррелирует с количеством выкуриваемых пачками 112 человек. Возможно, что если количество или активность CD8 + лимфоцитов в дыхательных путях у курильщиков с астмой увеличиваются, то эти клетки могут способствовать устойчивости к кортикостероидам, поскольку повышенные лимфоциты CD8 + также обнаруживаются при ХОБЛ 113, которая плохо реагирует на кортикостероиды.
Цитокины и медиаторы воспаления
Воздействие сигаретного дыма, in vitro или in vivo , увеличивает выработку провоспалительных цитокинов, включая IL-4 114, IL-8 115 и фактор некроза опухоли (TNF) -α 115, 116.Эти цитокины участвуют в резистентности к кортикостероидам, хотя точные механизмы не определены. Комбинация IL-2 и IL-4 при добавлении к Т-лимфоцитам in vitro приводит к снижению ответа на кортикостероиды 117. TNF-α вызывает устойчивость к кортикостероидам у мононуклеарных клеток человека invitro , возможно, за счет активации ядерных фактор-κB (NF-κB) 118.
Дефект индуцированного кортикостероидами синтеза Т-лимфоцитами противовоспалительного цитокина, IL-10, причастен к кортикостероидной резистентной астме 119.Уровни ИЛ-10 в мокроте снижены у нормальных курильщиков по сравнению со здоровыми некурящими 120. Способность кортикостероидов индуцировать высвобождение ИЛ-10 нарушена in vitro за счет ИЛ-2 в сочетании с ИЛ-4 121. В целом, эти результаты позволяют предположить, что подавление продукции IL-10 Т-лимфоцитами курильщиков-астматиков может способствовать нечувствительности к кортикостероидам.
NO присутствует в высокой концентрации в табачном дыме 122 и, in vitro , снижает сродство 123 связывания GR-лиганда.Было высказано предположение, что вызванный эндогенными факторами «нитрозативный стресс» может вызывать нарушение чувствительности к кортикостероидам при астме 124, и аналогичный механизм может действовать у курильщиков-астматиков в результате эффектов экзогенного и эндогенного «нитрозативного стресса», вызванного табачным дымом.
Число рецепторов глюкокортикоидов или сродство связывания
Есть две встречающиеся в природе изоформы GR: GR-α является функциональной, а GR-β, которая не связывается с лигандом, преимущественно расположена в ядре и не может трансактивировать гены, чувствительные к глюкокортикоидам.Было высказано предположение, что избыточная экспрессия GR-β может нарушать ответ на кортикостероиды, ингибируя действие активированного лигандом GR-α 97, 125–128. В качестве альтернативы, снижение количества GR-α также рассматривается как механизм устойчивости к кортикостероидам 129. Экспрессия GR-β увеличивается в различных типах клеток после воздействия провоспалительных цитокинов и медиаторов, которые усиливаются при воздействии сигаретного дыма . В комбинации, IL-2 и IL-4, но не отдельные цитокины по отдельности, увеличивают количество GR-β Т-лимфоцитов 130.IL-8 заставляет нейтрофилы увеличивать экспрессию GR-β 131, и это может объяснить слабый ответ этих клеток на кортикостероиды. TNF-α непропорционально увеличивает экспрессию GR-β по сравнению с GR-α в клетках S3 карциномы шейки матки человека 132. Снижение аффинности связывания GR может способствовать устойчивости к кортикостероидам у курильщиков. Культивируемые человеческие бронхиальные эпителиальные клетки курильщиков по сравнению с некурящими обладают GR с пониженной аффинностью связывания, хотя нет различий в количестве сайтов связывания 133.Аффинность связывания GR-лиганда снижается IL-2 и IL-4 в сочетании в мононуклеарных клетках периферической крови 117, 121, NO в фибробластах мыши 123 и IL-13 в моноцитах периферической крови 111. Неизвестно, есть ли изменение в соотношении GR-α к -β или сродстве к связыванию GR может способствовать устойчивости к кортикостероидам у курильщиков.
Активация провоспалительного фактора транскрипции
Вероятно, в сигаретном дыме может быть несколько компонентов, включая бактериальный липополисахарид (LPS), который, возможно, может активировать NF-κB 134.NF-κB связан с индукцией множества воспалительных цитокинов, включая TNF-α и IL-8. Курильщики сигарет с нормальной функцией легких демонстрируют повышенную экспрессию p65, основной субъединицы NF-κB в эпителии бронхов, по сравнению с некурящими 135. GR могут блокировать передачу сигналов NF-κB, но, наоборот, NF-κB может подавлять как функцию GR-α. фосфорилированием GR и способностью GR связываться с ДНК 96. NF-κB был связан с невосприимчивостью к кортикостероидам при болезни Крона 136, и возможно, что аналогичный механизм существует у курильщиков, страдающих астмой, где дисбаланс между GR-α функция и повышенная активность NF-κB взаимодействуют, вызывая резистентность к кортикостероидам.Возможно, что другие провоспалительные факторы транскрипции, включая протеин-активатор-1 и факторы транскрипции, активируемые сигнальной трансдукцией, сверхэкспрессируются в клетках курильщиков 137, и они могут способствовать устойчивости к кортикостероидам у курильщиков, страдающих астмой.
Сигнальные системы кортикостероидных клеток
Кортикостероиды требуют активности гистондеацетилазы (HDAC) для максимального подавления индукции цитокинов. 138. У курильщиков снижена активность HDAC2 в альвеолярных макрофагах, возможно, в результате «нитрозативного стресса», и это может привести к повышенной экспрессии воспалительных генов и снижению чувствительности к кортикостероидам. 139.Постулировано, что устойчивость к кортикостероидам при ХОБЛ действует по этому пути 140.
Активация митоген-активируемой протеинкиназы p38 (MAPK) происходит быстрее в бронхоальвеолярных клетках, стимулированных LPS у нормальных курильщиков, по сравнению с некурящими 141, а p38 MAPK фосфорилирует GR и снижает сродство к кортикостероидам и индуцированную кортикостероидами ядерную транслокацию GR 121. сигнальный путь p38 MAPK может активироваться у курильщиков-астматиков и вносить вклад в нечувствительность к кортикостероидам.
Возможные лекарственные препараты для лечения астмы курильщиков
Альтернативное или дополнительное лечение ингаляционным кортикостероидам может потребоваться для астматиков, которые не могут бросить курить или у которых после отказа от курения сохраняются симптомы. Нет опубликованных клинических испытаний некортикостероидной терапии у курильщиков-астматиков, но несколько лицензированных в настоящее время лекарств, а также разрабатываемых новых лекарств могут показать эффективность в этой группе пациентов (таблица 2).
Комбинация агониста рецептора β 2 длительного действия и ингаляционного кортикостероида очень эффективна при лечении астмы и, в меньшей степени, ХОБЛ 142, 143. Эти два препарата могут взаимодействовать, усиливая подавление связанного с воспалением при обоих состояниях 106, 144. Таким образом, возможно, комбинация этих препаратов может быть полезной при лечении курильщиков-астматиков. Теофиллин в низких дозах активирует HDAC, который задействуется кортикостероидами для подавления воспаления 145.Теофиллин отменяет подавляющее действие сигаретного дыма на HDAC in vitro 146 и, таким образом, потенциально может восстановить чувствительность к кортикостероидам у курящих астматиков. Эффективность селективных ингибиторов фосфодиэстеразы-4, таких как циломиласт и рофлумиласт, при лечении ХОБЛ 147 и их ингибирующее действие на функцию нейтрофилов позволяет предположить, что эти соединения могут быть эффективны у курильщиков-астматиков.
Ряд селективных агонистов GR, которые в настоящее время разрабатываются, обладают более мощными in vitro действиями, вызывающими трансрепрессию воспалительных генов, а не трансактивацию генов, которые больше связаны с побочными эффектами, вызванными кортикостероидами 148.Диссоциированные свойства этих соединений делают их потенциально менее склонными к побочным эффектам, но не известно, будут ли эти свойства влиять на их эффективность при наличии устойчивости к кортикостероидам.
Курение сигарет вызывает дозозависимое увеличение выработки цистеинил лейкотриена в моче E 4 149, а активность изоформы 15-липоксигеназы в дыхательных путях здоровых курильщиков 150. Эти данные могут указывать на роль антагонистов лейкотриеновых рецепторов при астме. курильщики.Антагонисты рецепторов гистамина-H 1 , такие как цетиризин и азеластин, ослабляют активность NF-κB 151 и, благодаря этому действию, могут подавлять потенциальные неблагоприятные эффекты NF-κB на чувствительность к глюкокортикоидам у курильщиков, страдающих астмой. Предварительные результаты предполагают, что блокада рецептора IL-2 может вызвать ремиссию при устойчивом к кортикостероидам язвенном колите 152. Препараты, которые блокируют действие других медиаторов, вызывающих воспаление дыхательных путей, вызванное сигаретным дымом, такие как TNF-α, LTB 4 , IL-8 , оксиданты, индуцибельный NO и некоторые хемокины, обладают потенциалом в качестве противоастматических средств для лечения курильщиков, страдающих астмой 148, 153.
Другие противовоспалительные методы лечения астмы, устойчивой к кортикостероидам, могут быть использованы в терапевтических целях при лечении курильщиков, страдающих астмой. Лечение интерфероном-α улучшило функцию легких, а также повысило чувствительность к кортикостероидам у пациентов с кортикостероидной резистентной астмой 154, 155. Дефект индуцированного кортикостероидами синтеза Т-лимфоцитами противовоспалительного цитокина IL-10 был связан с кортикостероидной резистентностью. астма 119, и агонист IL-10 может стать будущим лечением для этой группы пациентов.Ингибиторы p38 MAPK могут играть роль в лечении астмы, устойчивой к кортикостероидам, поскольку этот и другие MAPK снижают активацию GR кортикостероидами 121, 156. Препараты, нацеленные на ингибирование NF-κB, который активируется у курильщиков, антиоксиданты для блокирования окислительной стресс или макролидные антибиотики для подавления выработки IL-8 могут иметь значение при лечении заболеваний дыхательных путей, связанных с курением 148, 153.
Будущие направления исследований
Еще предстоит ответить на многие исследовательские вопросы, касающиеся взаимодействия между астмой и курением, включая следующие.1) Является ли резистентность к кортикостероидам у курильщиков сигарет системной реакцией или локализуется в легких? 2) Какие факторы влияют на терапевтический ответ на кортикостероиды у курильщиков, страдающих астмой, включая продолжительность или дозу ингаляционной терапии кортикостероидами, результат, используемый для оценки эффективности, продолжительность или интенсивность курения в анамнезе или продолжительность астмы? 3) Эффективны ли системные кортикостероиды при лечении курильщиков с острой астмой? 4) Что представляет собой патология дыхательных путей у курильщиков-астматиков? 5) Каковы механизмы устойчивости к кортикостероидам у курильщиков-астматиков? 6) Улучшает ли отказ от курения контроль астмы и терапевтический ответ на кортикостероиды? 7) Эффективны ли альтернативные или дополнительные методы лечения ингаляционным кортикостероидам для астматиков, которые не могут бросить курить или у которых после отказа от курения сохраняются симптомы?
Инжир.1.—Взаимодействие между астмой и курением сигарет. FEV 1 : объем форсированного выдоха за одну секунду; ↑: увеличение; ↓: уменьшение.
Рис. 2.—Среднее (95% доверительный интервал) изменение максимальной скорости выдоха (PEF; л · мин -1 ) у некурящих и курящих пациентов с астмой после лечения ингаляционным плацебо (□) или флутиказона пропионатом () ; 1000 мкг · сутки -1 ). # : p = 0,016, больше, чем у некурящих после плацебо; ***: p = 0,001, больше, чем у курильщиков после приема флутиказона.Воспроизведено с разрешения 40.
Рис. 3.—Средняя разница (95% доверительный интервал) после плацебо (•) и после преднизолона (○) у курильщиков с астмой, бывших курильщиков с астмой и никогда не куривших с астмой для а) изменение объема форсированного выдоха за одну секунду (ОФВ 1 ) и б) контрольная оценка астмы. Снижение оценки означает улучшение контроля астмы. # : p = 0,605; ¶ : p = 0,386; + : p = 0,019; § : p = 0,865; ƒ : p = 0.108; ## : p = 0,04. Воспроизведено с разрешения 41.
Рис. 4.—Противовоспалительные эффекты кортикостероидов опосредованы активацией цитоплазматических глюкокортикоидных рецепторов (ГР), которые действуют как лиганд-активируемые факторы транскрипции, которые перемещаются в ядро, подавляя или индуцируя глюкокортикоиды. гены-мишени. GR-α действует путем прямого связывания с последовательностями ДНК (трансактивация) или путем взаимодействия с провоспалительными факторами транскрипции (трансрепрессия). GR-β, который не связывает лиганд, преимущественно находится в ядре и не может трансактивировать гены, чувствительные к глюкокортикоидам.Возможные пути и механизмы устойчивости к кортикостероидам у курильщиков астмы включают следующее: 1) фармакокинетика кортикостероидов, например, повышенная проницаемость слизистой оболочки дыхательных путей, усиление бронхиального секрета; 2) взаимодействия кортикостероидов и β 2 -адренергических рецепторов (β 2 AR), например, подавление β 2 функция AR; 3) фенотипы воспалительных клеток, например, увеличение количества нейтрофилов в дыхательных путях или CD8 + лимфоцитов, уменьшение количества эозинофилов в дыхательных путях; 4) уровни цитокинов и медиаторов, е.грамм. повышенная продукция интерлейкина (IL) -4, IL-8, фактора некроза опухоли-α, снижение продукции IL-10, усиление нитрозативного стресса; 5) GR, например сверхэкспрессия GR-β, снижение экспрессии GR-α; 6) активация провоспалительного фактора транскрипции, например, ядерный фактор-κB (NF-κB), белок-активатор-1, фактор, активирующий передачу сигнала; и 7) сигнальные системы кортикостероидных клеток, например, снижает активность гистондеацетилазы (HDAC), увеличивает активность митоген-активируемой протеинкиназы p38.HAT: гистонацетилтрансфераза.
Таблица 1–Возможные механизмы устойчивости к кортикостероидам у курильщиков-астматиков
Таблица 2–Возможные лекарственные препараты для курильщиков-астматиков
Благодарности
Авторы хотели бы поблагодарить Национальную службу здравоохранения Шотландии, Управление главных ученых и Asthma UK за их поддержку. Авторы также хотели бы поблагодарить К. Макфолл (отдел медицинской иллюстрации, больница общего профиля Гартнавел, Глазго, Великобритания) за ее помощь.
- Получено 1 апреля 2004 г.
- Принято 6 июля 2004 г.
Ссылки
- ↵
Гандевиа Б. Исторический обзор использования парасимпатолитических средств в лечении респираторных заболеваний. Postgrad Med J 1975; 51: 13–20.
- ↵
Cook D, Strachan D. Резюме воздействия курения родителей на респираторное здоровье детей и значение для исследований.Thorax 1999; 54: 357–366.
Jaakkola MS, Piipari R, Jaakkola N, Jaakkola JJK. Табачный дым в окружающей среде и астма у взрослых: исследование случай-контроль на уровне населения. Am J Public Health 2003; 93: 2055–2060.
Chan-Yeung M, Dimich-Ward H. Воздействие табачного дыма на здоровье органов дыхания. Респирология 2003; 8: 131–139.
- ↵
Култас Д.Пассивное курение и риск астмы и ХОБЛ у взрослых: обновленная информация. Thorax 1998; 53: 381–387.
- ↵
Томсон Н., Чаудхури Р., Ливингстон Э. Активное курение сигарет и астма. Clin Exp Allergy 2003; 33: 1471–1475.
- ↵
Центры по контролю и профилактике заболеваний. Распространенность нынешнего курения сигарет среди взрослых в конкретных штатах: США, 2002 г. MMWR Morb Mortal Wkly Rep 2004; 52: 1277–1300.
- ↵
Правительство Великобритании. Жизнь в Великобритании: результаты Общего обследования домашних хозяйств 2002 года, Управление национальной статистики. www.statistics.gov.uk/lib2002. Дата последнего обновления: 20 апреля 2004 г. Дата последнего доступа: 28 июня 2004 г.
- ↵
Althuis M, Sexton M, Prybylski D. Курение сигарет и тяжесть симптомов астмы у взрослых астматиков. J Asthma 1999; 36: 257–264.
- ↵
Siroux V, Pin I, Oryszcyn MP, Le Moual N, Kauffmann F.Связь активного курения с астмой и тяжестью астмы в исследовании EGEA. Eur Respir J 2000; 15: 470–477.
- ↵
Sippel JM, Pedula KL, Vollmer WM, Buist AS, Osborne ML. Связь курения с больничной помощью и качеством жизни у пациентов с обструктивной болезнью дыхательных путей. Chest 1999; 115: 691–696.
- ↵
Сильверман Р.А., Будро Э.Д., Вудрафф П.Г., Кларк С., Камарго Калифорния мл.Курение сигарет среди взрослых, страдающих астмой, обращено в 64 отделения неотложной помощи. Chest 2003; 123: 1472–1479.
- ↵
Тернер М., Нортджойо К., Ведал С., Бай Т., Крамп С., Фицджеральд Дж. Факторы риска почти смертельной астмы. Исследование случай-контроль у госпитализированных пациентов с астмой. Am J Respir Crit Care Med 1998; 157: 1804–1809.
Уолш Л.Дж., Вонг Калифорния, Купер С., Гухан А.Р., Прингл М., Таттерсфилд А.Е.Заболеваемость астмой в связи с регулярным лечением: исследование на уровне сообщества. Thorax 1999; 54: 296–300.
- ↵
Апостол Г., Якобс Д., Цай А., и др. Факторы раннего возраста способствуют снижению функции легких в возрасте от 18 до 40 лет. Am J Respir Crit Care Med 2002; 166: 166–172.
- ↵
Plaschke P, Janson C, Norrman E, Bjornsson E, Ellbjar S, Jarvholm B. Начало и ремиссия аллергического ринита и астмы и связь с атопической сенсибилизацией и курением.Am J Repir Crit Care Med 2000; 162: 920–924.
- ↵
Rasmussen FSHC, Lambrechtsen J, Hansen HS, Hansen NC. Влияние лабильности дыхательных путей, атопии и курения табака на развитие астматических симптомов у бессимптомных подростков. Chest 2000; 117: 1–9.
- ↵
Kim Y, Kim SH, Tak YJ, et al. Высокая распространенность текущей астмы и активного эффекта курения среди пожилых людей. Clin Exp Allergy 2002; 32: 1706-1712.
- ↵
Торен К., Херманссон Б. Уровень заболеваемости астмой у взрослых в зависимости от возраста, пола, атопии и курения: шведское популяционное исследование с участием 15813 взрослых. Int J Tuberc Lung Dis 1999; 3: 192–197.
- ↵
Вестеринен Э., Каприо Дж., Коскенвуо М. Проспективное исследование астмы в связи с привычками курения среди 14729 взрослых. Thorax 1988; 43: 534–539.
- ↵
Troisi R, Speizer F, Rosner B, Trichopoulos D, Willet W.Курение сигарет и заболеваемость хроническим бронхитом и астмой у женщин. Сундук 1995; 108: 1557–1561.
- ↵
Wang ZCC, Niu T, Wu D, et al. Ассоциация астмы с бета-полиморфизмом гена 2 -адренергических рецепторов и курением сигарет. Am J Respir Crit Care Med 2001; 163: 1404–1409.
- ↵
Raherison C, Baldi I, Tunon De Lara J, Taytard A, Annesi-Maesano I.Фенотипы астмы в зависимости от времени начала курения у молодых людей. Int J Tuberc Lung Dis 2003; 7: 84–92.
- ↵
Галлефосс Ф, Бакке П. Влияет ли курение на результат обучения пациентов и самоконтроль астматиков? Советы по обучению пациентов, 2003; 49: 91–97.
- ↵
Higenbottam T, Feyeraband C, Clark T. Курение сигарет при астме. Br J Dis Chest 1980; 74: 279–284.
- ↵
Дженсен Э., Даль Р., Стеффенсен Ф.Бронхиальная реактивность на сигаретный дым; связь с функцией легких, респираторными симптомами, сывороточным иммуноглобулином E и количеством эозинофилов и лейкоцитов в крови. Респир Мед 2000; 94: 119–127.
- ↵
Oosterhoff Y, Jansen M, Postma D, Koeter G. Реакция дыхательных путей на аденозин-5′-монофосфат у курильщиков и некурящих с атопической астмой. J Allergy Clin Immunol 1993; 92: 773–776.
- ↵
Кассино К., Ито К., Бадер И., Чиотоли Дж., Терстон Дж., Рейбман Дж.Курение сигарет и использование в отделениях неотложной помощи, связанного с озоном, при астме взрослыми в Нью-Йорке. Am J Respir Crit Care Med 1999; 159: 1773–1779.
- ↵
Барр Р., Вудрафф П., Кларк С., Камарго С. Внезапно возникшие обострения астмы: клинические особенности, ответ на терапию и 2-недельное наблюдение. Eur Respir J 2000; 15: 266–273.
- ↵
Прескотт Э., Ланге П., Вестбо Дж. Влияние пола на госпитализацию по поводу астмы и распространенность астмы по самооценке: проспективное исследование, основанное на выборке из общей популяции.Thorax 1997; 52: 287–289.
- ↵
Rasmussen F, Taylor D, Flannery E, et al. Факторы риска госпитализаций по поводу астмы от детей до молодого взрослого: продольное популяционное исследование. J Allergy Clin Immunol 2002; 110: 220–227.
- ↵
LeSon S, Gershwin M. Факторы риска для астматических пациентов, которым требуется интубация. III. Наблюдения за молодыми людьми. J Asthma 1996; 33: 27–35.
Mitchell I, Tough S, Semple L, Green F, Hessel P. Почти смертельная астма: популяционное исследование факторов риска. Сундук 2002; 121: 1407–1413.
- ↵
Райан Г., Маск А., Перера Д., Сток Х, Найт Дж., Хоббс М. Факторы риска смерти у пациентов, госпитализированных с астмой: последующее исследование. Aust N Z J Med 1991; 21: 681–685.
- ↵
Marquette C, Saulnier F, Leroy O, et al. Долгосрочный прогноз астмы с почти смертельным исходом. Am Rev Respir Dis 1992; 146: 76–81.
- ↵
Lange P, Parner J, Vestbo J, Schnohr P, Jensen G. Последующее 15-летнее исследование вентиляционной функции у взрослых с астмой. N Engl J Med 1998; 339: 1194–1200.
- ↵
Глобальная инициатива по астме: глобальная стратегия лечения и профилактики астмы. Bethesda, MD, 1995 NHLBI / WHO Report 95–3695.
- ↵
Kerstjens H, Overbeek S, Schouten J, Brand P, Postma D.Гиперчувствительность дыхательных путей, реакция на бронходилататоры, аллергия и курение предсказывают улучшение ОФВ 1 во время длительного лечения ингаляционными кортикостероидами. Eur Respir J 1993; 6: 868–876.
- ↵
Педерсен Б., Даль Р., Карлстром Р., Петерсон С., Венге П. Активность эозинофилов и нейтрофилов при астме в однолетнем исследовании ингаляционного будесонида. Am J Respir Crit Care Med 1996; 153: 1519–1529.
- ↵
Чалмерс Г.В., Маклауд К.Дж., Литтл С.А., Томсон Л.Дж., МакШарри С.П., Томсон, Северная Каролина.Влияние курения сигарет на лечение ингаляционными кортикостероидами при легкой форме астмы. Thorax 2002; 57: 226–230.
- ↵
Чаудхури Р., Ливингстон Е., МакМахон А. Д., Томсон Л., Борланд В., Томсон, Северная Каролина. Курение сигарет ухудшает терапевтический ответ на пероральные кортикостероиды при хронической астме. Am J Respir Crit Care Med 2003; 168: 1308–1311.
- ↵
Convery R, Leitch D, Bromly C, Ward R, Bartlett G, Hendrick D.Влияние ингаляционного флутиказона пропионата на чувствительность дыхательных путей у лиц, не получавших лечение: меньшее преимущество у женщин. Eur Respir J 2000; 15: 19–24.
- ↵
Meijer R, Postma D, Kauffman HF, Arends LR, Koeter GH, Kerstjens HA. Точность эозинофилов и катионного белка эозинофилов для прогнозирования стероидного улучшения при астме. Clin Exp Allergy 2002; 32: 1096–1103.
- ↵
Burge P, Calverley PMA, Jones PW, Spencer S, Anderson J.Ответ на преднизолон у пациентов с хронической обструктивной болезнью легких: результаты исследования ISOLDE. Thorax 2003; 58: 654–658.
- ↵
Чалмерс Г., МакЛауд К., Томсон Л., Литтл С., МакШарри С., Томсон Н. Курение и воспаление дыхательных путей у пациентов с легкой астмой. Сундук 2001; 120: 1917–1922.
- ↵
Зевин С., Беновиц Н. Взаимодействие с лекарствами при курении табака. Clin Pharmacokinetics 1999; 36: 425–438.
- ↵
Маркс Г., Берни П., Премаратне Ю., Симпсон Дж., Уэбб Дж. Астма в Гринвиче, Великобритания: влияние болезни и текущие методы лечения. Eur Respir J 1997; 10: 1224–1229.
- ↵
Radeos M, Leak L, Hanrahan J, Clark S, Camargo C. Факторы риска из-за отсутствия знаний о самоконтроле астмы среди пациентов с ЭД, не принимающих ингаляционные стероиды. Am J Emerg Med 2001; 19: 253–259.
- ↵
Абдулвадуд О., Абрамсон М., Форбс А, и др. Посещаемость образовательного мероприятия по астме: характеристики участников и не участников. Респир Мед 1997; 91: 524–529.
Юн Р., Маккензи Д., Майлз Д., Бауман А. Характеристики участников и тех, кто не посещает образовательную программу по астме. Thorax 1991; 46: 886–890.
- ↵
Галлефосс Ф., Бакке П., Ван И., Гилья М., Гульсвик А. Статус курения, продолжительность заболевания и уровень образования женщин связаны с посещением школ астмы.Eur Respir J 2000; 15: 1022–1025.
- ↵
Уэйкфилдс М., Раффин Р., Кэмпбелл Д., Робертс Л., Уилсон Д. Связанные с курением убеждения и поведение взрослых с астмой в репрезентативной выборке населения. Aust N Z J Med 1995; 25: 12–17.
- ↵
Eisner M, Yelin E, Katz P, Shoiboski S, Henke J, Blanc PD. Предикторы курения сигарет и отказа от курения среди взрослых с астмой. Am J Public Health 2000; 90: 1307–1311.
- ↵
West R, McNeill A, Raw M. Рекомендации по прекращению курения для медицинских работников: обновление. Thorax 2000; 55: 987–999.
- ↵
Отчет главного хирурга. Польза для здоровья от отказа от курения. Бетесда, Служба общественного здравоохранения США (Управление по вопросам курения и здоровья), 1990; С. 1–627.
- ↵
Виллемсе Б., Postma DS, Timens W, et al. Влияние отказа от курения на респираторные симптомы, функцию легких, гиперчувствительность дыхательных путей и воспаление. Eur Respir J 2004; 23: 464–476.
- ↵
Энтонисен Н.Р., Коннетт Дж. Э., Мюррей РП. Курение и функция легких у участников исследования здоровья легких через 11 лет. Am J Respir Crit Care Med 2002; 166: 675–679.
- ↵
Hillerdahl G, Rylander R. Астма и отказ от курения.Clin Allergy 1984; 14: 45–47.
- ↵
Феннерти А., Бэнкс Дж., Эбден П., Беван С. Влияние отмены сигарет на курящих астматиков. Eur J Repir Dis 1987; 71: 395–399.
- ↵
Годтфредсен Н., Ланге П., Прескотт Э., Ослер М., Вестбо Дж. Изменения в привычке к курению и риску астмы: продольное популяционное исследование. Eur Respir J 2001; 18: 549–554.
- ↵
Saetta M, Turato G, Maestrell P, et al. Клеточно-структурные основы хронической обструктивной болезни легких. Am J Repir Crit Care Med 2001; 163: 1304–1309.
Джеффри П. Структурные и воспалительные изменения при ХОБЛ: сравнение с астмой. Thorax 1998; 53: 129–136.
Рот М., Арора А., Барски С., Клеруп Е., Симмонс М., Ташкин Д. Воспаление дыхательных путей у молодых курильщиков марихуаны и табака. Am J Respir Crit Care Med 1998; 157: 928–937.
- ↵
Kuschner W, D’Alessandro A, Wong H, et al. Дозозависимые воспалительные реакции, связанные с курением сигарет, у здоровых взрослых. Eur Respir J 1996; 9: 1989–1994.
- ↵
Ди Стефано А., Капелли А., Лусуарди М., и др. Снижение инфильтрации Т-лимфоцитов в биоптатах бронхов пациентов с тяжелой хронической обструктивной болезнью легких. Clin Exp Allergy 2001; 31: 893–902.
- ↵
Ламс Б., Суза А., Рис П., и др. Иммунопатология подслизистой оболочки легких дыхательных путей у курильщиков с хронической обструктивной болезнью легких и без нее. Am J Respir Crit Care Med 1998; 158: 1518–1523.
- ↵
Zhang X, Moilanen E, Lahti A, et al. Регулирование апоптоза эозинофилов с помощью оксида азота: роль c-Jun-N-терминальной киназы и преобразователя сигнала и активатора транскрипции 5.J Allergy Clin Immunol 2003; 112: 93–101.
- ↵
Assreuy J, Cunha F, Liew F, Moncada S. Ингибирование синтазы оксида азота с помощью оксида азота. Br J Clin Pharmacol 1993; 108: 833–837.
- ↵
Melgert BN, Postma DS, Geerlings M, et al. Кратковременное воздействие дыма уменьшает вызванное овальбумином воспаление дыхательных путей у мышей с аллергией. Am J Respir Cell Mol Biol 2004; 30: 880–885.
- ↵
Сопори М., Козак В. Иммуномодулирующие эффекты сигаретного дыма. J. Neuroimmunol 1998; 83: 148–156.
- ↵
Ван Х., Ю М., Очам М., и др. Субъединица 7 никотинового ацетилхолинового рецептора является важным регулятором воспаления. Природа 2003; 421: 348–388.
- ↵
Seymour BW, Schelegle ES, Pinkerton KE, et al. Вторичное курение увеличивает гиперреактивность бронхов и эозинофилию в модели аллергического аспергиллеза на мышах. Clin Dev Immunol 2003; 10: 35–42.
- ↵
Seymour BW, Pinkerton KE, Friebertshauser KE, Coffman RL, Gershwin LJ. Пассивное курение является адъювантом для ответа на Т-хелпер-2 на мышиной модели аллергии. J Immunol 1997; 159: 6169-6175.
- ↵
Skold C, Blaschke E, Eklund A.Преходящее повышение альбумина и гиалуронана в жидкости бронхоальвеолярного лаважа после отказа от курения: возможные признаки репаративных механизмов. Респир Мед 1996; 90: 523–529.
- ↵
Turato G, Di Stefano P, Maestrelli P, et al. Влияние отказа от курения на воспаление дыхательных путей при хроническом бронхите. Am J Respir Crit Care Med 1995; 152: 1262–1267.
- ↵
Domagala-Kulawik J, Maskey-Warzechowska M, Kraszewska I, Chazan R.Клеточный состав и фенотип макрофагов в индуцированной мокроте у курильщиков и бывших курильщиков. Chest 2003; 123: 1054–1059.
- ↵
McKay A, Komai-Koma M, MacLeod K, et al. Уровни интерлейкина-18 в индуцированной мокроте снижены у астматиков и обычных курильщиков. Clin Exp Allergy 2004; 34: 904–910.
- ↵
Van Hal P, Overbeek S, Hoogsteden H, et al. Эйзозаноиды и липокортин-1 в БАЛ при астме: эффекты курения и ингаляционных кортикостероидов.J. Appl Physiol 1996; 81: 548–555.
- ↵
Verleden G, Dupont L, Verpeut A, Demedts M. Влияние сигаретного дыма на выдыхаемый оксид азота у пациентов с легкой стероидной астмой. Chest 1999; 116: 59–64.
- ↵
White K, Marletta M. Синтаза оксида азота представляет собой гемопротеин типа цитохрома P-450. Биохимия, 1992; 31: 6627–6631.
- ↵
Роббинс Р., Миллатмал Т, Ласси К., Реннард С., Доутон Д.Отказ от курения связан с увеличением выдыхаемого оксида азота. Chest 1997; 112: 313–318.
- ↵
MacNee W, Rahman I. Окислители и антиоксиданты как терапевтические мишени при хронической обструктивной болезни легких. Am J Respir Crit Care Med 1999; 160: S58 – S65.
- ↵
Caramori G, Papi A. Окислители и астма. Thorax 2004; 59: 170–173.
- ↵
Kwong K, Wu Z-X, Kashon M, et al. Хроническое курение усиливает синтез тахикинина и повышает чувствительность дыхательных путей у морских свинок. Am J Respir Cell Mol Biol 2001; 25: 299–305.
- ↵
Кэрролл Н., Перри С., Карханис А., и др. Продольная сеть эластичных волокон дыхательных путей и складка слизистой оболочки у пациентов с астмой. Am J Respir Crit Care Med 2000; 161: 244–248.
- ↵
Little SA, Sproule MW, Cowan MD, et al. Компьютерная томографическая оценка с высоким разрешением толщины стенки дыхательных путей при хронической астме: воспроизводимость и взаимосвязь с функцией легких и тяжестью. Thorax 2002; 57: 247–253.
- ↵
Маклин А.Н., Спроул М.В., Коуэн М.Д., Томсон, Северная Каролина. Компьютерная томография высокого разрешения при астме. Thorax 1998; 53: 308–314.
- ↵
Линч Д., Ньюэлл Дж, Чомпер Б., Синк Т., Ньюман Л., Бетел Р. Неосложненная астма у взрослых: сравнение КТ легких у астматиков и здоровых субъектов.Радиология 1993; 188: 829–833.
- ↵
Mitsunobu F, Ashida K, Hosaki Y, et al. Влияние длительного курения сигарет на иммуноглобин Е-опосредованную аллергию, легочную функцию, компьютерную томографию высокого разрешения, денситометрию легких у пожилых пациентов с астмой. Clin Exp Allergy 2004; 34: 59–64.
- ↵
Суньер Дж., Спрингер Дж., Джеймисон Б., и др. Влияние астмы на клеточные компоненты периферической крови у курильщиков и некурящих.Clin Exp Allergy 2003; 33: 1500–1505.
- ↵
Халоннен М., Барби Р., Лебовиц М., Берроуз Б. Эпидемиологическое исследование взаимосвязи общего сывороточного иммуноглобулина Е, реактивности кожных тестов на аллергию и эозинофилии. J. Allergy Clin Immunol. 1982; 69: 221–228.
Тейлор Р., Гросс Э., Голландия Ф., Прайд Н. Курение, аллергия и дифференциальное количество лейкоцитов. Торакс 1985; 40: 17–22.
- ↵
Дженсен Э., Педерсен Б., Нарвестадт Э., и др. Количество эозинофилов и моноцитов в крови связано с курением и функцией легких. Респир Мед 1998; 92: 63–69.
- ↵
Джарвис Д., Чинн С., Лючинска С., Бёрни П. Связь курения с повышением чувствительности к обычным аллергенам окружающей среды: результаты исследования состояния здоровья Европейского сообщества. J Allergy Clin Immunol 1999; 104: 934–940.
- ↵
Barnes PJ, Adcock IM. Как кортикостероиды действуют при астме? Энн Интерн Мед 2003; 139: 359–370.
- ↵
Schaaf M, Cidlowski J. Молекулярные механизмы действия и устойчивости глюкокортикоидов. Дж. Стероид Биохим Мол Биол 2003; 83: 37–48.
- ↵
Леунг Д., Блум Дж. Обновленная информация о действии и устойчивости глюкокортикоидов. Журнал Allergy Clin Immunol 2003; 111: 3–22.
Кино Т., Хрусос Г. Тканевые синдромы гиперчувствительности к глюкокортикоидам: многофакторные состояния, имеющие клиническое значение. J Allergy Clin Immunol 2002; 109: 609–613.
- ↵
Фаррелл Р.Дж., Келлехер Д. Устойчивость к глюкокортикоидам при воспалительном заболевании кишечника. J Endocrinol 2003; 178: 339–346.
- ↵
Кеннеди С., Элвуд Р., Виггз Б., Паре П., Хогг Дж.Повышенная проницаемость слизистой оболочки дыхательных путей курильщиков: взаимосвязь с реактивностью дыхательных путей. Am Rev Respir Dis 1984; 129: 143–148.
- ↵
Ilowite J, Bennett W, Sheetz M, Groth M, Nierman D. Проницаемость слизистой оболочки бронхов до 99m Tc-DTPA при астме. Am Rev Respir Dis 1988; 139: 1139–1143.
- ↵
Cerveri I, Accordini S, Corsico A, et al. Хронический кашель и мокрота у молодых людей.Eur Respir J 2003; 22: 413–417.
- ↵
Rose J, Yurchak A, Meikle A, et al. Влияние курения на фармакокинетику преднизона, преднизолона и дексаметазона. Дж. Фармакокинет Биофарм 1981; 9: 1–14.
- ↵
Лаустиола К., Лассилия Р., Каприо Дж., Коскенвуо М. Снижение плотности бета-адренергических рецепторов и реакции катехоламинов у курильщиков сигарет мужского пола: исследование монозиготных пар близнецов, дискордантных для курения.Тираж 1988; 78: 1234–1240.
- ↵
Laustiola K, Kotamaki M, Lassilia R, Kallioniemi O, Manninem V. Курение сигарет изменяет регуляцию симпатоадреналовой функции за счет снижения плотности бета-адренорецепторов. 2 -адренорецептор: исследование отказа от курения. J. Cardiovasc Pharmacol, 1991; 17: 923–938.
- ↵
Barnes P. Научное обоснование комбинированной ингаляционной терапии с бета2-агонистами длительного действия и кортикостероидами.Eur Respir J 2002; 19: 182–191.
- ↵
Холт П. Иммунная и воспалительная функция у курильщиков сигарет. Thorax 1987; 42: 241–249.
- ↵
Floreani A, Rennard S. Роль сигаретного дыма в патогенезе астмы и в качестве триггера острых симптомов. Curr Opin Pulm Med 1999; 5: 38–46.
- ↵
Green RH, Brightling CE, Woltmann G, Parker D, Wardlaw AJ, Pavord ID.Анализ индуцированной мокроты у взрослых с астмой: определение подгруппы с изолированной нейтрофилией мокроты и плохой реакцией на ингаляционные кортикостероиды. Thorax 2002; 57: 875–879.
- ↵
Pizzichini M. Является ли эозинофилия мокроты хорошим или плохим показателем пользы от терапии ингаляционными кортикостероидами при астме? Eur Respir J 2002; 20: 1359–1361.
- ↵
Spahn J, Landwehr L, Nimmagadda S, Surs W, Leung D, Szefler S.Влияние глюкокортикоидов на активацию лимфоцитов у пациентов с чувствительной к стероидам и резистентной к стероидам астмой. J Allergy Clin Immunol 1996; 98: 1073–1079.
- ↵
Costabel U, Bross K, Reuter C, et al. Изменения в субпопуляциях иммунорегуляторных Т-клеток у курильщиков сигарет: фенотипический анализ бронхоальвеолярных лимфоцитов и лимфоцитов крови. Сундук 1986; 90: 39–44.
- ↵
Hattotuwa K, Gizycki M, Ansari T, Jeffrey P, Barnes N.Влияние ингаляционного флутиказона на воспаление дыхательных путей при хронической обструктивной болезни легких. Am J Respir Crit Care Med 2002; 165: 1592–1596.
- ↵
Байрон К., Варигос Дж., Вуттон А. Курильщики сигарет увеличивают производство ИЛ-4. Clin Exp Immunol 1994; 95: 333–336.
- ↵
Китингс В., Коллинз П., Скотт Д., Барнс П. Различия в интерлейкине-8 и факторе некроза опухоли-α в индуцированной мокроте у пациентов с хронической обструктивной болезнью легких и астмой.Am J Respir Crit Care Med 1996; 153: 530–534.
- ↵
Churg A, Dai J, Changshi X, Wright J. Фактор-α некроза опухоли является центральным фактором острого вызванного сигаретным дымом воспаления и разрушения соединительной ткани. Am J Respir Crit Care Med 2002; 166: 849–854.
- ↵
Kam J, Szefler S, Surs W., Sher E, Leung D. Комбинация IL-2 и IL-4 снижает аффинность связывания глюкокортикоидного рецептора и реакцию Т-клеток на глюкокортикоиды.J Immunol 1993; 151: 3460–3466.
- ↵
Franchimont D, Martens H, Hagelstein M-T, et al. Фактор некроза опухоли альфа снижается, а интерлейкин-10 увеличивается, чувствительность человеческих моноцитов к дексаметазону: потенциальная регуляция рецептора глюкокортикоидов. J Clin Endocrinol Metab 1999; 84: 2834–2839.
- ↵
Гаврилович К., Ричардс Д., Локи Т-К, Корриган С., Ли Т.Нарушение индуцированной кортикостероидами продукции IL-10 в Т-лимфоцитах у пациентов, устойчивых к кортикостероидам. J Allergy Clin Immunol 2002; 109: 369–370.
- ↵
Takanashi S, Hasegawa Y, Kanehira Y, et al. Уровень интерлейкина-10 в мокроте снижен при бронхиальной астме, ХОБЛ и курильщиках. Eur Respir J 1999; 14: 309–314.
- ↵
Ирусен Э., Мэтьюз Дж., Такахаши А., Барнс П., Чанг К., Адкок И.p38 Фосфорилирование глюкокортикоидного рецептора, индуцированное митоген-активированной протеинкиназой, снижает его активность: роль в стероид-нечувствительной астме. J Allergy Clin Immunol 2002; 109: 649–657.
- ↵
Норман В., Кейт С. Оксиды азота в табачном дыме. Nature 1965; 205: 915–916.
- ↵
Galigniana MD, Piwien-Pilipuk G, Assreuy J. Ингибирование связывания глюкокортикоидных рецепторов оксидом азота.Mol Pharmacol 1999; 55: 317–323.
- ↵
Харитонов СБП. Оксид азота, нитротирозин и модуляторы оксида азота при астме и хронической обструктивной болезни легких. Curr Allergy Asthma Rep 2003; 3: 121–129.
- ↵
Hamid Q, Wenzel S, Hauk P, et al. Повышение уровня глюкокортикоидного рецептора β в клетках дыхательных путей при астме, нечувствительной к глюкокортикоидам. Am J Respir Crit Care Med 1999; 159: 1600–1604.
Sousa A, Lane S, Cidlowski J, Staynov D, Lee T. Устойчивость к глюкокортикоидам при астме связана с повышенной экспрессией in vivo бета-изоформы рецептора глюкокортикоидов. J Allergy Clin Immunol 2000; 105: 943–950.
Хаук П., Голева Э., Стрикленд I, и др. Повышенная экспрессия бета-рецептора глюкокортикоидов превращает клетки гибридомы мышей в фенотип, нечувствительный к кортикостероидам.Am J Respir Cell Mol Biol 2002; 27: 361–367.
- ↵
Oakley RH, Jewell CM, Yudt MR, Bofetiado DM, Cidlowski JA. Доминирующая отрицательная активность бета-изоформы человеческого глюкокортикоидного рецептора. Специфика и механизмы действия. J Biol Chem 1999; 274: 27857–27866.
- ↵
Pujols L, Mullol J, Perez M, et al. Экспрессия альфа- и бета-изоформ человеческого глюкокортикоидного рецептора в респираторных эпителиальных клетках человека и их регуляция дексаметазоном.Am J Respir Cell Mol Biol 2001; 24: 49–57.
- ↵
Леунг Д., Хамид К., Воттеро А., и др. Ассоциация нечувствительности к глюкокортикоидам с повышенной экспрессией рецептора глюкокортикоидов β. J Exp Med 1997; 186: 1567–1574.
- ↵
Strickland I, Kisich K, Hauk PJ, et al. Высокое содержание конститутивного бета-рецептора глюкокортикоидов в нейтрофилах человека позволяет им снизить скорость спонтанной гибели клеток в ответ на кортикостероиды.J Exp Med 2001; 193: 585–594.
- ↵
Webster J, Oakley R, Jewell C, Cidlowski J. Провоспалительные цитокины регулируют экспрессию гена рецептора глюкокортикоидов человека и приводят к накоплению доминантно-отрицательной β-изоформы: механизму создания устойчивости к глюкокортикоидам. Proc Natl Acad Sci USA 2001; 98: 6865–6870.
- ↵
Verheggan M, Adriaansen-Soeting P, Berrevoets C, et al. Экспрессия рецепторов глюкокортикоидов в эпителиальных клетках бронхов человека: эффекты курения и ХОБЛ. Медиаторы Inflamm 1998; 7: 275–281.
- ↵
Wang J, Manning B, Wu Q, Blankson S, Bouchier-Hayes D, Redmond H. Эндотоксин / липополисахарид активирует NF-κB и усиливает адгезию и инвазию опухолевых клеток посредством β1-интегрин-зависимого механизма. J Immunol 2003; 170: 795–804.
- ↵
Ди Стефано А., Карамори Г., Оутс Т., и др. Повышенная экспрессия ядерного фактора-κB в биоптатах бронхов курильщиков и пациентов с ХОБЛ. Eur Respir J 2002; 20: 556–563.
- ↵
Бантел Х., Шмитц М., Райбл А., Грегор М., Шульце-Остхофф К. Критическая роль NF-κB и стресс-активируемых протеинкиназ в невосприимчивости к стероидам. FASEB J 2002; 16: 1832–1834.
- ↵
Рахман И., Макни У. Роль факторов транскрипции в воспалительном заболевании легких.Thorax 1998; 53: 601–612.
- ↵
Ито К., Карамори Г., Лим С., и др. Экспрессия и активность гистоновых деацетилаз в дыхательных путях человека, страдающего астмой. Am J Respir Crit Care Med 2002; 166: 392–396.
- ↵
Ито К., Лим С., Карамори Г., Чанг К., Барнс П., Адкок И. Курение сигарет снижает экспрессию гистондеацетилазы 2, усиливает экспрессию цитокинов и подавляет действие глюкокортикоидов в альвеолярных макрофагах.FASEB J 2001; 15: 1110–1112.
- ↵
Барнс П.Дж., Ито К., Адкок И.М. Устойчивость к кортикостероидам при хронической обструктивной болезни легких: инактивация гистондеацетилазы. Ланцет 2004; 363: 731–733.
- ↵
Mochida-Nishimura K, Surewicz K, Cross J, et al. Дифференциальная активация сигнальных путей MAPK и ядерного фактора-κB в бронхоальвеолярных клетках курильщиков и некурящих.Мол Мед 2001; 7: 177–185.
- ↵
Calverley P., Pauwels R, Vestbo J, et al. Комбинация салметерола и флутиказона в лечении хронической обструктивной болезни легких: рандомизированное контролируемое исследование. Ланцет 2003; 361: 449–456.
- ↵
Британское торакальное общество, Шотландская межвузовская сеть рекомендаций. Британские рекомендации по ведению астмы. Thorax 2003; 58: Дополнение.1: I1 – I94.
- ↵
Джонсон М., Реннард С. Альтернативные механизмы для пролонгированного действия β 2 -адренергических агонистов при ХОБЛ. Chest 2001; 120: 258–270.
- ↵
Ито К., Карамори Дж., Косио М., Чанг К., Адкок И.М., Барнс П. Молекулярный механизм действия теофиллина: индукция гистондеацетилазы для снижения экспрессии воспалительных генов. Proc Natl Acad Sci USA 2002; 99: 8921–8926.
- ↵
Ито К., Лим С., Чунг К.Ф., Барнс П.Дж., Адкок И.Теофиллин усиливает активность гистондеацетилазы и восстанавливает функцию глюкокортикоидов во время окислительного стресса. Am J Respir Crit Care Med 2002; 165: 625.
- ↵
Compton C, Gubb J, Nieman R, et al. Циломиласт, селективный ингибитор фосфодиэстеразы-4 для лечения пациентов с хронической обструктивной болезнью легких: рандомизированное исследование с диапазоном доз. Ланцет 2001; 353: 265–270.
- ↵
Карамори Г., Адкок И.Фармакология воспаления дыхательных путей при астме и ХОБЛ. Pulm Pharmacol Ther 2003; 16: 247–277.
- ↵
Фаулер Дж., Фролих Дж. Курение сигарет стимулирует выработку цистеинил лейкотриенов у человека. Eur J Clin Invest 1997; 27: 43–47.
- ↵
Чжу Дж., Килти И., Грейнджер Х., и др. Экспрессия генов и иммунолокализация изоферментов 15-липоксигеназы в слизистой оболочке дыхательных путей курильщиков с хроническим бронхитом.Am J Respir Cell Mol Biol 2002; 27: 666–677.
- ↵
Leurs R, Church M, Taglialatela M. H 1 -антигистаминные препараты: обратный агонизм, противовоспалительное действие и сердечные эффекты. Clin Exp Allergy 2002; 32: 489–498.
- ↵
Creed T, Norman M, Probert C, et al. Базиликсимаб (анти-CD25) в сочетании со стероидами может быть новым эффективным средством лечения стероидно-резистентного язвенного колита.Aliment Pharmacol Ther 2003; 18: 65–75.
- ↵
Barnes PJ. Хроническая обструктивная болезнь легких 12: новые методы лечения ХОБЛ. Thorax 2003; 58: 803–808.
- ↵
Саймон Х., Зеебах Х., Эманн Р., Шмитц М. Клинические и иммунологические эффекты лечения низкими дозами ИФН-альфа у пациентов с кортикостероидной резистентной астмой. Аллергия 2003; 58: 1250–1255.
- ↵
Gratzl S, Palca A, Schmitz M, Hans-Uwe S.Лечение IFN-α при астме, не отвечающей на кортикостероиды. J Allergy Clin Immunol 2000; 105: 1035–1036.
- ↵
Цитура, округ Колумбия, Ротман ПБ. Усиление передачи сигналов MEK / ERK способствует устойчивости к глюкокортикоидам в CD4 + Т-клетках. Дж. Клин Инвест 2004; 113: 619–627.
Курение и астма: опасные связи
Реферат
Курение сигарет и астма взаимодействуют, вызывая важные неблагоприятные эффекты на клинические, прогностические и терапевтические результаты.В этом обзоре изучаются недавние данные о вредных последствиях курения при астме, возможных основных воспалительных механизмах этого измененного ответа, вариантах ведения этих пациентов и потенциальных будущих терапевтических направлениях. Активные курильщики, особенно женщины, подвержены риску развития астмы. Показатели распространенности курения при астме относительно близки к показателям среди населения в целом. Курильщики, страдающие астмой, хуже справляются с астмой, чем некурящие, страдающие астмой. Механизмы побочных эффектов курения при астме включают воспаление дыхательных путей и нечувствительность к кортикостероидам.Отказ от курения может улучшить симптомы и функцию легких, но низкие показатели отказа от курения подчеркивают необходимость улучшения стратегий ведения таких пациентов. Клинические испытания, посвященные оценке новых методов лечения астмы, должны включать курильщиков, чтобы определить методы лечения, которые эффективны при фенотипе курения при астме.
Табакокурение является основной причиной предотвратимой преждевременной смертности в мире, и известно, что отказ от курения существенно снижает риск серьезных заболеваний, таких как рак легких, сердечно-сосудистые заболевания, инсульты, хронические заболевания легких и другие виды рака [1].Примечательно, что, несмотря на хронические респираторные симптомы, больные астмой начинают и продолжают курить с уровнем распространенности, относительно близким к показателям среди населения в целом [2–5]. Этот парадокс можно частично объяснить тем, что курение табака вызывает сильное привыкание и характерен ремиттирующий эффект астмы, особенно в ее легких и умеренных формах.
Было собрано впечатляющее количество клинических, функциональных, патологических и лечебных данных по хронической обструктивной болезни легких (ХОБЛ), архетипу заболевания дыхательных путей, вызванного курением, но до недавнего времени было известно относительно мало о взаимосвязи между активным курением и астма из-за исключения курильщиков из механистических исследований и клинических испытаний, отражающих озабоченность по поводу набора пациентов с ХОБЛ.Признание «фенотипа курения астмы» имеет важное значение для исследований, направленных на понимание механизмов заболевания и лечения этой подгруппы астмы. Растущее понимание того, что курение усугубляет астму, предполагает, что отказ от курения может принести дополнительную клиническую пользу курильщикам с астмой. Более того, курение может предсказать успешный ответ на одни методы лечения астмы, но не на другие, и улучшение фенотипирования курящих пациентов с астмой будет приобретать все большее значение для планирования будущих клинических испытаний и разработки лекарств.В этом обзоре изучаются доказательства неблагоприятных эффектов курения в контексте астмы, возможные основные воспалительные механизмы этого измененного ответа, варианты ведения этих пациентов и потенциальные будущие терапевтические направления. Данные для этого обзора были найдены путем поиска в Medline, Current Contents, PubMed, www.clinicaltrials.gov и ссылок из соответствующих статей с использованием поисковых терминов «астма», «курильщики», «курение» и «отказ от курения». Тезисы и отчеты собраний включались только в том случае, если они имели прямое отношение к ранее опубликованной работе.Были включены только статьи, опубликованные на английском языке в период с 1980 по 2012 год.
КУРЕНИЕ КАК ФАКТОР РИСКА РАЗВИТИЯ АСТМЫ
Эпидемиологическим свидетельствам связи между активным курением сигарет и астмой не хватает определенной последовательности. Популяционным исследованиям препятствуют перекрестные исследования и дизайн исследования случай-контроль, использование некачественных показателей воздействия табачного дыма и, в связи с их зависимостью от самоотчетов или анкет, возможность неточностей в диагностике астмы в результате систематической ошибки отзыва.Тем не менее, общие закономерности результатов указывают на более высокую распространенность астмы, особенно среди курящих женщин, по сравнению с некурящими женщинами (таблица 1) [6–9]. Например, Канадское национальное обследование здоровья населения [7] показало, что у курящих женщин уровень распространенности астмы на 70% выше, чем у некурящих, а взаимосвязь между курением и сексом особенно очевидна среди женщин в возрасте <25 лет (OR 2,18) и среди более тяжелых по сравнению с более легкими курильщиками или некурящими. Большинство исследований, в которых изучалась временная связь между курением и началом астмы, подтверждают предположение о том, что курение подвергает человека значительно повышенному риску развития астмы (таблица 1) [10–14].В попытке выяснить, является ли курение причинным или косвенным фактором риска, была исследована большая группа направленных в клинику взрослых пациентов, не страдающих астмой, с установленным аллергическим ринитом, чтобы определить важность активного курения сигарет как дополнительного фактора риска развития астмы. через 10 лет [15]. Курение было сильным предиктором развития новой астмы у взрослых аллергиков. В частности, оказалось, что интенсивность курения четко связана с учетом того, что влияние курения на дозу зависит от риска нового приступа астмы.
Таблица 1- Резюме побочных эффектов активного курения сигарет и астмыСерия систематических обзоров и эпидемиологических исследований предоставляет убедительные доказательства причинно-следственной связи между курением родителей и развитием астмы у детей [44–47]. В недавнем систематическом обзоре и метаанализе 76 исследований, посвященных изучению воздействия пассивного курения до и после родов, сообщается о повышении риска развития астмы на 21–85% [46]. Самый сильный эффект пренатального курения матери на астму у детей в возрасте до 2 лет имел OR 1.85 (95% ДИ 1,3–2,5) [3]. У подростков и взрослых пассивное курение также связано с развитием астмы [45]. Интересно, что пассивное курение в детстве связано с повышенным риском развития астмы у взрослых с OR 1,9 (95% ДИ 1,6–3,2) [48].
КЛИНИЧЕСКИЕ ИСХОДЫ У КУРЯЩИХ С АСТМОЙ
Сообщалось о повышении заболеваемости и смертности у курящих астматиков (таблица 1) [16]. По сравнению с некурящими, страдающими астмой, эта группа пациентов подвержена риску развития более серьезных симптомов и ухудшения качества жизни, связанного с астмой, что оказывает огромное влияние на ресурсы здравоохранения из-за незапланированных посещений врача и частой госпитализации [17–20].Более того, курение сигарет при астме связано с более высокой частотой обострений [21], увеличением числа опасных для жизни приступов астмы [22], а смертность от астмы выше среди заядлых курильщиков, страдающих астмой, по сравнению с астматиками, которые не курят [23]. Во время беременности обострения более распространены и более серьезны у курильщиков, чем у никогда не курящих, страдающих астмой [49], а аномалии роста плода встречаются чаще [50].
В соответствии с этими наблюдениями, степень тяжести астмы выше у курящих астматиков (таблица 1) [17–20].Используя Глобальную инициативу по классификации степени тяжести астмы [51], данные хорошо охарактеризованной клинической когорты пациентов с аллергией с высоким риском развития астмы, наблюдавшихся в течение 10 лет, показывают, что статус курения и продолжительность курения заметно связаны в зависимости от дозы. до уровня тяжести астмы [24]. Самая сильная связь с тяжестью заболевания наблюдалась у тех, кто курил> 20 пачок. Демонстрация сильной связи между активным курением сигарет и тяжестью астмы, а также четкой зависимости доза-реакция подтверждает причинную связь.
Однако в настоящее время признано, что классификация по тяжести заболевания просто предполагает статический признак, что явно не относится к повседневной клинической астме, где уровень тяжести варьируется в зависимости от количества принимаемых противоастматических препаратов. Эти соображения способствовали развитию более клинически информативной концепции контроля астмы [52, 53]. Несколько исследований продемонстрировали тесную взаимосвязь между курением сигарет и плохим контролем астмы в опросах населения, проведенных в Швейцарии [26], Великобритании [25, 27], Франции [28] и США (таблица 1) [29].В хорошо охарактеризованной когорте аллергиков с риском нового начала астмы статус курения и продолжительность курения также были связаны с плохим контролем астмы в зависимости от дозы [24].
Как и в случае активного курения сигарет, пассивное курение оказывает ряд неблагоприятных эффектов на контроль астмы и ее тяжесть у детей и взрослых. У детей, страдающих астмой, пассивное курение приводит к увеличению количества симптомов астмы, увеличению частоты обострений, употреблению снотворных, частоте госпитализаций и количеству приступов, угрожающих жизни [45].Взрослые, страдающие астмой, которые подвергаются пассивному курению, имеют плохой контроль симптомов, худшее качество жизни, более низкую функцию легких и более высокий уровень обращения за медицинской помощью [45, 54]. В исследовании, проведенном в Шотландии (Великобритания), изучалось влияние запрета отказа от курения в общественных местах на воспаление дыхательных путей и качество жизни работников бара. У работников бара, страдающих астмой, воспаление дыхательных путей снизилось, уровень оксида азота в выдыхаемом воздухе снизился с 34,3 частей на миллиард (ppb) до 27,4 ppb через 4 недели после запрета, а показатели качества жизни при астме улучшились на 7.3 балла [55].
ВЛИЯНИЕ КУРЕНИЯ НА ФУНКЦИЮ ЛЕГКИХ
Курение сигареты может вызвать острую бронхоспазм, особенно у курильщиков-астматиков с исходной функцией легких [56, 57]. Влияние курения на прогрессирующее снижение функции легких при ХОБЛ хорошо установлено [58], а более поздние исследования показали, что ускоренное снижение функции легких с течением времени также наблюдается у лиц, страдающих астмой [30, 31]. В большинстве лонгитюдных исследований скорость снижения функции легких у курильщиков с астмой выше, чем у некурящих, страдающих астмой (таблица 1) [30–34].Например, James et al. [34] продемонстрировал аддитивный эффект курения и астмы при уменьшении объема форсированного выдоха за 1 секунду (FEV 1 ), при этом наиболее быстрое снижение функции легких у мужчин и женщин наблюдалось у курящих астматиков по сравнению со здоровыми курильщиками. или некурящие астматики. Однако есть также несколько отрицательных исследований [31, 36], но они включали относительно небольшое количество курильщиков, страдающих астмой, и, возможно, не имели достаточной мощности, чтобы обнаружить влияние табака на снижение функции легких.Ускоренная потеря функции легких во взрослом возрасте, а также генетические факторы и факторы риска окружающей среды (кроме курения) и субмаксимальный рост легких в детстве также могут способствовать развитию стойкой обструкции дыхательных путей у курильщиков, страдающих астмой [31, 32]. Особому риску подвержены люди с тяжелой формой астмы в детстве, которые продолжают курить во взрослом возрасте. Стоит отметить, что изменения функции легких при астме могут улучшиться после нескольких недель отказа от курения [59].
КУРИТЬ И ПОНИЖЕННАЯ ЧУВСТВИТЕЛЬНОСТЬ КОРТИКОСТЕРОИДОВ
Курящие пациенты с астмой менее чувствительны к положительным эффектам краткосрочного и среднесрочного лечения ингаляционными кортикостероидами (ICS) или пероральными кортикостероидами в отношении улучшения респираторных симптомов, функции легких и частоты обострений по сравнению с пациентами с астмой, которые не курят (таблица 1) [37–43].Хотя повышенная доза ИКС может частично устранить отсутствие реакции [40], данные клинических испытаний показывают, что сниженная чувствительность к кортикостероидам сохраняется независимо от пути введения лечения или состава ИКС [16]. Данные о влиянии длительного лечения ИКС на скорость снижения функции легких у курильщиков, страдающих астмой, ограничены. В 23-летнем наблюдении за взрослыми пациентами с астмой средней и тяжелой степени тяжести, ICS не снизил годовое снижение ОФВ 1 у курильщиков [60], за исключением подгруппы мужчин, которые мало курили. .В дополнительном наблюдательном исследовании скорость снижения ОФВ 1 у курильщиков с астмой была снижена с 58 мл в год у субъектов, не получавших ICS, до 31 мл в год у пациентов, получавших лечение ICS [61]. В поддержку этих результатов следует отметить, что польза от терапии ингаляционным будесонидом для предотвращения снижения функции легких одинакова у курильщиков и некурящих с легкой устойчивой астмой [62].
МЕХАНИЗМЫ ПОБОЧНЫХ ПОСЛЕДСТВИЙ КУРЕНИЯ ПРИ АСТМЕ
Механизмы, объясняющие неблагоприятные последствия курения при астме, включая плохой контроль симптомов, ускоренное снижение функции легких и снижение чувствительности к кортикостероидам, плохо изучены, но, вероятно, связаны с различиями в воспалении дыхательных путей у курильщиков по сравнению с некурящими, страдающими астмой. (Рис.1).
Рисунок 1-Основные воспалительные механизмы смешанного фенотипа астма-курение. При аллергической астме первоначальное воздействие аллергена на профессиональные антигенпрезентирующие клетки (APC) в основном приводит к активации аллерген-специфических Т-хелперных (Th) 2 клеток и синтеза иммуноглобулина (Ig) E. Последующее воздействие аллергена вызывает рекрутирование воспалительных клеток (, например, . Эозинофилов) и активацию (, например, . Тучные клетки) и высвобождение медиатора; эти воспалительные явления ответственны за характерные ранние и поздние реакции дыхательных путей.В настоящее время имеются данные о том, что ответы Th2-клеток также могут быть ответственны за некоторые патогенные особенности у пациентов, страдающих хроническими формами атопии, включая апоптоз эпителия и активацию гладкомышечных клеток. Регуляторные Т-клетки (Treg) являются еще одним важным подмножеством CD4 + Т-клеток, влияющих на подавление ответов Th3-клеток у людей с участием ингибирующих цитокинов интерлейкина (IL) -10 и трансформирующего фактора роста (TGF) -β. Недавно идентифицированная субпопуляция CD4 + Т-клеток, клетки Th27, по-видимому, специфически связана с нейтрофильными воспалительными событиями, которые происходят во время обострения заболевания и при ремоделировании ткани.Сигаретный дым в сочетании с астматическим воспалением может вызвать важные изменения в эндотипе астмы с преобладанием активированных макрофагов (AM) и нейтрофилов в мокроте, дыхательных путях и паренхиме легких, как при ранней хронической обструктивной болезни легких. При активации сигаретным дымом AM будут производить множество провоспалительных молекул, активных форм кислорода (ROS), тканевых протеаз (, например, . Матриксная металлопротеиназа (MMP)) и хемокинов, участвующих в мобилизации и увеличении выживания нейтрофилов в легочная ткань ( e.г . Ил-8). Интересно, что AM у курильщиков, по-видимому, вырабатывают меньше IL-10, что приводит к меньшему развитию Th3-клеток и уменьшению количества B-клеток и более низких уровней IL-4 и IL-5. Это будет производить меньше и менее активных эозинофилов и более низкую продукцию IgE у курящих астматиков. Активированные AM участвуют в прямой стимуляции клеток Th2 и Th27, которые, в свою очередь, способствуют активации эпителиальных клеток бронхов и бокаловидных клеток для усиления воспалительных реакций, образования слизистой и ремоделирования тканей.Сигаретный дым может также напрямую активировать бронхиальные эпителиальные клетки для высвобождения дополнительных провоспалительных цитокинов, хемокинов, факторов роста и TGF-β, которые, как известно, модулируют пролиферацию гладкомышечных клеток и фибробластов с последующим прогрессированием до фиброза и отложения внеклеточного матрикса. При курении повышенные при астме уровни стромального лимфопоэтина тимуса могут дополнительно стимулировать тучные клетки к высвобождению медиаторов ремоделирования, таких как IL-13, независимо от клеток Th3. Повышенные MC вместе с активацией эпителиальных клеток, вызванной курением, могут увеличивать продукцию IL-8, способствуя дальнейшей инфильтрации нейтрофилов.Известно, что нейтрофильная инфильтрация способствует прогрессированию воспалительной реакции и повреждению легких курильщика, поскольку они являются богатым источником медиаторов воспаления, включая ROS, липидные медиаторы и тканевые протеазы (, например, . Эластаза нейтрофилов). Постоянное воздействие сигаретного дыма вызывает аддитивные или синергические воспалительные и ремоделирующие реакции (, например, . Хроническая гиперсекреция слизи) в дыхательных путях при астме, что объясняет сообщаемое ускоренное снижение функции легких и усиление обструкции дыхательных путей.LTB 4 : лейкотриен B 4 ; GM-CSF: колониестимулирующий фактор гранулоцитов-макрофагов; MHC: главный комплекс гистосовместимости; TCR: Т-клеточный рецептор; TNF-α: фактор некроза опухоли-α; IFN: интерферон-γ; ЛТ: лейкотриены; ПГ: простагландины.
В настоящее время накапливаются данные о том, что и табачный дым, и астматическое воспаление могут вызывать важные изменения в эндотипе астмы с преобладанием активированных макрофагов и нейтрофилов, как при ранней ХОБЛ [63, 64].Таким образом, можно предположить, что постоянное воздействие сигаретного дыма вызывает аддитивные или синергические воспалительные и ремоделирующие реакции в астматических дыхательных путях, что объясняет зарегистрированное ускоренное снижение функции легких и повышенную серьезность обструкции дыхательных путей. Нейтрофилы также могут способствовать гиперсекреции слизистой за счет высвобождения нейтрофильной эластазы и через индукцию генов муцина в бокаловидных клетках бронхиального эпителия и подслизистых железах. Хроническая гиперсекреция слизи может быть дополнительным фактором риска ускоренного снижения ОФВ 1 .Важно отметить, что известно, что количество нейтрофилов в дыхательных путях коррелирует со скоростью снижения функции легких [65]. Большинство курильщиков с астмой имеют неэозинофильный эндотип астматических дыхательных путей, но у курильщиков, страдающих астмой, также было выявлено повышенное количество тучных клеток по сравнению с некурящими [66]. Относительный вклад в воспалительный процесс, вызванный курением сигарет и астмой, вероятно, будет варьироваться между людьми из-за различий в продолжительности и интенсивности воздействия сигаретного дыма, а также в зависимости от продолжительности и тяжести астмы.
Модуляция воспаления, восстановления и патологического восстановления (ремоделирования) также зависит от тонкого баланса матриксных металлопротеиназ (MMP) и их внутренних ингибиторов, тканевых ингибиторов металлопротеиназ [67]. Концентрация MMP-12 в мокроте повышена у курильщиков с астмой по сравнению с некурящими, страдающими астмой, и уровни обратно пропорциональны функции легких и положительно связаны с количеством нейтрофилов в мокроте [68]. Следует отметить, что смесь протеолитических ферментов, выделяемых при аллергическом воспалении e.г . Триптаза тучных клеток может преобразовывать неактивную «про» форму MMP-12 или MMP-9 в активные формы, дополнительно усиливая провоспалительный сигнал коктейля MMP. Вероятно, что и курение, и аллергическая астма обеспечивают провоспалительные стимулы на нескольких уровнях, включая нарушение регуляции ММП, и, таким образом, могут способствовать повреждению легких.
У лиц, страдающих аллергией, постоянное воздействие сигаретного дыма и аллергена в комбинации может иметь комплексное воздействие на адаптивные и врожденные иммунные реакции, приводя к различным воспалительным эндотипам астмы.Исследования на людях и животных показали, что полиароматические углеводороды (присутствующие в фазе твердых частиц сигаретного дыма и дыма дизельного топлива) обладают способностью вызывать аллергические иммунные реакции и усиливать воспаление типа Т-хелперов (Th) 2 [69, 70]. Таким образом, развитие астмы у сенсибилизированных людей можно ожидать у тех, кто регулярно курит. Раздражающие вещества в сигаретном дыме могут также вызывать гиперчувствительность дыхательных путей и хроническое воспаление в дыхательных путях за счет врожденных иммунных реакций [71, 72], что способствует повышению риска развития астмы.
Постоянное воздействие сигаретного дыма не только усиливает аллергическое воспаление, вызванное Th3 [73], но также и воспалительные реакции, опосредованные Th2 [63, 64]. Учитывая, что смешанный воспалительный ответ Th2 / Th3 является ключевым событием в процессе развития более тяжелого фенотипа астмы [74], можно ожидать развития более тяжелого заболевания у тех аллергиков, которые регулярно курят. Нейтрофилы обычно не реагируют на кортикостероиды, и можно предположить, что курение сигарет, индуцируя эндотип с преобладанием нейтрофилов в астматических дыхательных путях [63, 64], создает основу для невосприимчивости к лечению астмы.Малозернистый воспалительный фенотип, обнаруживаемый у некоторых курильщиков с астмой, также будет нечувствителен к кортикостероидам [37]. Другие возможные механизмы, объясняющие невосприимчивость к кортикостероидам у курящих астматиков, могут быть связаны с окислительным стрессом. Сигаретный дым может вызывать окислительный стресс, который не только активирует путь ядерного фактора-κB, но также изменяет баланс гистондеацетилазы (HDAC) / гистонацетилтрансферазы через посттрансляционной модификации HDAC2 [75, 76].Другим возможным механизмом, объясняющим наблюдаемую невосприимчивость к кортикостероидам, может быть пониженное соотношение рецепторов глюкокортикоидов α: β, которое наблюдается как у здоровых курильщиков, так и у курильщиков-астматиков [77].
Помимо предполагаемых клеточных и молекулярных механизмов, чтобы попытаться объяснить сниженную чувствительность к кортикостероидам и тенденцию к неконтролируемому заболеванию, также важно учитывать роль несоблюдения режима лечения [78] и неправильного диагноза при ХОБЛ. Исследования показывают, что до одной трети курильщиков в возрасте> 40 лет с диагнозом астма на самом деле могут иметь ХОБЛ [79] или частичное поражение дыхательных путей.Кроме того, воздействие сигаретного дыма может увеличивать размер частиц ICS и, таким образом, уменьшать их отложение в дыхательных путях, что может снизить чувствительность к кортикостероидам [80].
Респираторные инфекции являются основными триггерами обострения астмы, и это может иметь прямые последствия для плохого контроля астмы у курящих астматиков. Многие врачи считают, что курящие астматики более восприимчивы к респираторным инфекциям, хотя количество конкретных исследований в этой области ограничено.Vernaske et al. [81] оценили исходные характеристики 101 пациента, госпитализированного с обострением астмы. Обнаружение риновирусов было тесно связано с госпитализацией по поводу астмы, и после поправки на исходную тяжесть астмы пациенты с положительной реакцией на риновирус с большей вероятностью были курильщиками. Patel et al. [21] сообщил, что курение сигарет при астме связано с более высокой частотой обострений. Кроме того, результаты исследования респираторного здоровья Европейского сообщества, по-видимому, предполагают, что обострения острой бактериальной астмы могут быть связаны с курением родителей [82].
ОТКАЗ ОТ АСТМЫ И КУРЕНИЯ
Помимо очевидного соображения, что отказ от курения имеет общее преимущество для здоровья, воздержание от курения также может быть полезным для некоторых конкретных аспектов контроля астмы. Несмотря на сообщения о пагубном влиянии курения на симптомы астмы, функцию легких и чувствительность к кортикостероидам, лишь в нескольких исследованиях изучалась роль прекращения курения на исходы астмы. В целом, эти исследования показывают улучшение симптомов и улучшение функции легких у тех астматиков, которые успешно бросили курить (таблица 2).
Таблица 2- Резюме исследований, изучающих влияние отказа от курения на исходы астмыНоваторское исследование Fennerty et al. [84], исследовали эффекты отказа от курения у 14 пациентов с астмой через 24 часа и после 7 дней воздержания. После прекращения лечения не наблюдалось никаких изменений в средней оценке симптомов или использовании бронходилататоров, но наблюдалось значительное увеличение максимальной скорости выдоха (ПСВ). Хотя через 24 часа не было значительного изменения гиперчувствительности дыхательных путей к гистамину, через 7 дней наблюдалось значительное улучшение.Интересно, что двое участников сообщили об ухудшении симптомов астмы после отказа от курения. Те, кто рецидивировал, сообщили, что сделали это из-за эффектов отмены, а не из-за ухудшения симптомов астмы. Совсем недавно в проспективном исследовании трех групп пациентов с астмой: сокращение курения, полное прекращение курения или продолжение курения [83], курильщики, страдающие астмой, которые бросили курить, имели значительное улучшение качества жизни, связанного с астмой, и снижение количества ночных и дневных спасательных операций β 2 — использование агонистов, использование ICS, дневные симптомы астмы и гиперреактивность дыхательных путей.Следует отметить, что меньшие улучшения произошли с препаратами, снижающими курение, что свидетельствует об очевидном доза-ответном эффекте. Эти результаты согласуются с результатами крупного продольного исследования, демонстрирующего улучшение гиперреактивности дыхательных путей через 1 год после прекращения курения у тех курильщиков, для которых было получено объективное доказательство прекращения курения [72]. Наконец, исследование 32 курильщиков с астмой показало клинически важные улучшения среднего ОФВ 1 на 450 мл у 10 из 21 участника, которым удалось бросить курить на срок до 6 недель, по сравнению с теми, кто продолжал курить [59].Кроме того, улучшился контроль астмы, восстановилась реакция на кортикостероиды у курящих астматиков и наблюдалось снижение нейтрофилов в мокроте через 6 недель отказа от курения.
Приведенные выше данные подчеркивают важность отказа от курения для улучшения клинических и патологических исходов астмы. Врачи обязаны предупреждать своих пациентов, страдающих астмой, о дополнительных рисках курения и принимать меры по прекращению курения. К сожалению, сильные аддиктивные качества табакокурения создают огромное препятствие даже для тех, у кого есть сильное желание бросить курить, и для достижения стойкого воздержания могут потребоваться многочисленные попытки и длительное лечение.Тем не менее, у взрослых пациентов с астмой были зарегистрированы лишь умеренные показатели отказа от курения, а в некоторых исследованиях сообщалось, что курильщики-астматики не верят, что курение может быть серьезной проблемой для их астмы. Кроме того, решение бросить курить сильно зависит от убеждений и привычек пациентов. Хотя в недавнем исследовании 51% курильщиков, страдающих астмой, сообщили, что они были бы готовы посещать сеансы с рекомендациями по отказу от курения [27], при астме сообщается лишь о скромных показателях отказа от курения [85]. Удивительно, но в большом опросе в Южной Австралии было обнаружено, что> 40% курящих астматиков не верят, что курение может быть серьезной проблемой для их астмы [86].
Ввиду сильного взаимодействия между физическими и психологическими компонентами, связанными с табачной зависимостью, текущие научно обоснованные рекомендации показывают, что программы по прекращению курения должны сочетать консультирование (в основном решение проблем / обучение навыкам и социальную поддержку) и лекарства от никотиновой зависимости для достижения наилучших результатов. [87]. В настоящее время препараты первой линии для лечения отказа от курения включают никотиновую заместительную терапию, бупропион и варениклин. Более того, улучшенное понимание механизмов, задействованных в никотиновой зависимости, недавно было преобразовано в новые препараты для улучшения никотиновой абстиненции [88].Известно несколько факторов, указывающих на то, бросит ли курильщик с большей вероятностью или нет, и это знание может увеличить количество бросающих курить. Хотя это специально не изучается у курильщиков-астматиков, они, как известно, включают позднее начало курения, более длительную предыдущую попытку бросить курить, отсутствие депрессии, никотиновую зависимость от низкой до умеренной, отсутствие проблем с алкоголем, устойчивый уровень мотивации, брак и / или отсутствие в доме других курильщиков [89]. На практике симптомы астмы (в первую очередь кашель) могут развиваться или ухудшаться после отказа от курения [90].Таким образом, курильщику-астматику, который хочет бросить курить, следует предупредить, что его симптомы астмы могут усилиться в течение первых двух недель после отказа от курения. Курильщики этой категории выиграют от временного увеличения количества противоастматических препаратов. Более того, учитывая, что дети, страдающие астмой, чрезвычайно уязвимы для вторичного табачного дыма, их родителям и другим членам семьи, которые курят, следует предложить лечение для отказа от курения [91]. «Предложить помощь в отказе от употребления табака» людям, страдающим никотиновой зависимостью, — это одна из шести проверенных стратегий, определенных Рамочной конвенцией Всемирной организации здравоохранения по борьбе против табака для расширения борьбы с табачной эпидемией [92], но для того, чтобы этот подход был эффективным, требуется интеграция с комплексной стратегией борьбы против табака [93].Дальнейшие подходы к прекращению курения изучаются в конкретных группах, включая курящих родителей детей с астмой (www.clinicaltrials.gov; NCT00862368), этнически разнородное население городских школьников, страдающих астмой (www.clinicaltrials.gov; NCT01175369), подростков с астма (www.clinicaltrials.gov; NCT01170676), пациенты, обращающиеся в отделения неотложной помощи с астмой (www.clinicaltrials.gov; NCT01079000), а также матери во время и после беременности (www.clinicaltrials.gov; NCT00499915).
ТЕКУЩИЕ ФАРМАКОЛОГИЧЕСКИЕ ПРОЦЕДУРЫ
Рекомендации по медикаментозному лечению астматиков, помимо отказа от курения, в целом не отличаются от рекомендаций для некурящих, страдающих астмой (таблица 3) [51]. Однако это мнение может быть оспорено, учитывая, что большинство рекомендаций по лечению наркозависимости основаны на клинических исследованиях, в которых пациенты тщательно отбираются, чтобы исключить нынешних курильщиков или бывших заядлых курильщиков. Отсутствие информации о наилучшем подходе к ведению курильщиков вызывает серьезную озабоченность, учитывая высокий уровень распространенности активного курения при астме и низкий уровень контроля над астмой в этой конкретной подгруппе [94].
Таблица 3– Возможные варианты лечения курильщиков-астматиков помимо отказа от куренияВ дополнение к терапии β 2 -агонистами короткого действия, следует ли лечить симптоматических курильщиков на этапе 2 добавлением низких или средних доз ICS? Несмотря на то, что курильщики, страдающие астмой, имеют пониженную чувствительность к кортикостероидам, кажется целесообразным, чтобы эти пациенты получали ИКС по нескольким причинам. Во-первых, длительное лечение ИКС может уменьшить снижение функции легких у некоторых курильщиков с астмой [60–62].Во-вторых, не все курильщики с астмой нечувствительны к ICS, возможно, из-за разницы в курении и / или воспаления дыхательных путей. Тем не менее, у большинства курильщиков, страдающих астмой, вероятно, сохранятся симптомы, несмотря на ICS, и этим пациентам потребуется усиление терапии. В нескольких недавних исследованиях было показано, что добавление β 2 -агониста пролонгированного действия приносит пользу курильщикам, страдающим астмой [31, 95, 98], и это, вероятно, будет предпочтительным вариантом по сравнению с увеличением дозы ICS [ 40], так как последний вариант может вызвать побочные эффекты.У курильщиков с астмой легкой и средней степени тяжести комбинация ингаляционного флутиказона и салметерола, принимаемая в дозе 250/50 мкг два раза в день, вызвала значительное улучшение гиперчувствительности дыхательных путей, а также их калибра по сравнению с удвоением дозы ингаляционного флутиказона [95 ]. Анализ post hoc исследования Gaining Optimal Asthma Control показал, что у курильщиков с астмой частота обострений снижалась при комбинированной терапии ингаляционным флутиказоном и сальметеролом (0,20 на пациента в год) по сравнению с одним ингаляционным флутиказоном (0.35 на пациента в год) [42]. Открытое исследование астматических пациентов с ограниченным анамнезом курения показало пользу от лечения комбинацией ингаляционных будесонидов и формотерола, вводимых в качестве поддерживающей и успокаивающей терапии [98]. Что касается других вариантов, антагонист лейкотриеновых рецепторов монтелукаст был обнаружен в клиническом испытании, подтверждающем концепцию, для увеличения утренних значений PEF у курильщиков с легкой астмой, но не у некурящих с легкой астмой, что позволяет предположить, что может быть большая польза от лейкотриеновых рецепторов. антагонисты у курильщиков [39].Предварительные результаты рандомизированного 6-месячного исследования в параллельных группах по оценке эффективности перорального монтелукаста, флутиказона пропионата и плацебо у 1019 пациентов с хронической астмой, которые курят сигареты, показали, что оба вмешательства дали небольшое улучшение в процентном соотношении дней борьбы с астмой. (первичный результат) по сравнению с плацебо (www.clinicaltrials.gov; NCT00284856). Эффективность добавления антилейкотриеновых препаратов к комбинированной терапии у курильщиков, страдающих астмой, неизвестна. Недавнее 12-недельное исследование показало, что пациенты с ХОБЛ и сопутствующей астмой достигают улучшения функции легких с помощью вдыхаемого тиотропия, что свидетельствует о том, что вдыхаемый тиотропий может быть полезен для курильщиков, особенно когда он связан со стойкой обструкцией дыхательных путей [97].В настоящее время проводится дальнейшее исследование эффективности ингаляционного тиотропия по сравнению с ингаляционным β 2 -агонистом длительного действия у курильщиков, страдающих астмой (www.clinicaltrials.gov; NCT00546234).
БУДУЩИЕ ТЕРАПИИ ДЛЯ КУРЯЩИХ С АСТМОЙ
Существует неудовлетворенная потребность в улучшенных методах лечения курильщиков с астмой, которые не могут бросить курить, как путем нацеливания на отказ от курения, так и путем разработки лекарств, которые восстанавливают чувствительность к кортикостероидам и / или противодействуют влиянию провоспалительных путей и окислительный стресс, связанный с патогенетическими механизмами у курильщиков-астматиков [37, 94].
Новые подходы к отказу от курения
Успехи в понимании механизмов, участвующих в никотиновой зависимости, недавно были преобразованы в новые лекарства и вакцины, которые препятствуют передаче сигналов никотина, многие из которых в настоящее время находятся на продвинутой стадии клинической разработки и предлагают многообещающие результаты [88]. К ним относятся новые фармацевтические никотиновые продукты, антагонисты каннабиноидного рецептора-1, антагонисты дофаминового рецептора D3 и ингибиторы моноаминоксидазы.Возможно, наиболее активными направлениями в программе отказа от курения являются разработка терапевтических вакцин и клинические испытания природных никотиновых лигандов с частичной агонистической активностью, таких как цитизин. Цитизин — природный алкалоид, структурный аналог никотина с частичными агонистическими свойствами в отношении никотинового рецептора α4β2. Цитизин уже много лет используется для отказа от курения в странах Центральной и Восточной Европы [99]. С нетерпением ждем результатов текущих контролируемых клинических испытаний.Никотиновые вакцины работают, заставляя иммунную систему вырабатывать антитела, направленные против никотина, полученного при курении табака, тем самым снижая скорость и количество никотина, поступающего в мозг [100]. Это уменьшает удовольствие и другие полезные эффекты, вызываемые никотином. В настоящее время продолжаются серьезные исследования этого нового фармакологического подхода. Положительные результаты испытаний фазы II показали, что эти вакцины безопасны и хорошо переносятся, а также могут повысить способность участников бросить курить [101, 102].В случае успеха никотиновые вакцины будут способствовать борьбе с табачной зависимостью, возможно, путем предотвращения рецидивов.
Восстановление чувствительности к кортикостероидам
В серии исследований in vitro было показано, что низкие дозы теофиллина восстанавливают чувствительность к кортикостероидам, возможно, за счет увеличения активности HDAC2, которая подавляется у курильщиков. Предварительные данные показывают, что добавление низких доз теофиллина с замедленным высвобождением восстанавливает чувствительность ICS, измеряемую функцией легких у курильщиков, страдающих астмой [96].Если более крупные исследования подтвердят эти данные, эта комбинация лечения может оказаться полезной для лечения курильщиков-астматиков. Считается, что низкие дозы теофиллина действуют, по крайней мере частично, за счет ингибирования фосфоинозитид-3 киназ (PI3K) [103]. Основываясь на обнадеживающих результатах доклинических исследований, предполагающих, что ингибиторы PI3K-δ потенциально могут изменить нечувствительность к кортикостероидам [104], селективные ингибиторы PI3K разрабатываются в качестве новых методов лечения заболеваний дыхательных путей, нечувствительных к кортикостероидам, включая курильщиков с астмой.Альтернативный подход к восстановлению чувствительности к кортикостероидам может заключаться в использовании витамина D, что основано на исследованиях, показывающих, что активация рецептора витамина D может иметь иммуномодулирующую роль при астме [105, 106]. CD4 + Т-клетки периферической крови пациентов с кортикостероидной резистентной астмой восстанавливают свою чувствительность к кортикостероидам после короткого курса перорального приема витамина D [106], и показаны клинические исследования для оценки эффективности этого подхода у курильщиков с астмой. В настоящее время проводится пилотное исследование, чтобы выяснить, может ли вдыхаемый сверхмелкозернистый беклометазон преодолеть нечувствительность к кортикостероидам у курильщиков с астмой, которая может быть результатом нарушения периферического отложения вдыхаемых кортикостероидов нормального размера [80] из-за более тяжелого поражения мелких дыхательных путей у курильщиков (www.Clinicaltrials.gov; NCT01620099).
Противовоспалительная терапия
Агонисты рецептора, активируемого пролифератором пероксисом (PPAR) -γ, оказывают противовоспалительное действие на множественные воспалительные клетки, включая нейтрофилы и эозинофилы [107]. Пилотное исследование с использованием агониста PPAR-γ розиглитазона продемонстрировало бронхолитический эффект у курильщиков от легкой до умеренной степени тяжести, страдающих астмой [108]. Профиль нежелательных эффектов перорального розиглитазона может препятствовать его развитию при астме, но клинические испытания перорального агониста PPAR-γ пиоглитазона при тяжелой астме продолжаются.Статины обладают противовоспалительным действием, потенциально значимым для лечения астмы [109]. Интересно отметить, что показатели качества жизни при астме улучшаются у курильщиков с астмой после краткосрочного лечения аторвастатином [110], хотя лечение статинами не показывает эффективности у некурящих с легкой или умеренной астмой [111]. Иммуномодулирующие свойства макролидов, включая противовоспалительное действие на нейтрофилы и их способность восстанавливать чувствительность к кортикостероидам, позволяют предположить, что они могут принести пользу курильщикам, страдающим астмой.Однако 12 недель лечения азитромицином при добавлении к ИКС не улучшают функцию легких или текущий контроль астмы у курильщиков с астмой [112].
Антиоксиданты
Сигаретный дым содержит огромное количество окислительных соединений, которые могут способствовать воспалению дыхательных путей и нечувствительности к кортикостероидам при астме. На сегодняшний день исследований антиоксидантов у курильщиков, страдающих астмой, не проводилось, отчасти из-за отсутствия подходящих антиоксидантных агентов, которые показали устойчивую эффективность при других связанных с курением заболеваниях дыхательных путей, таких как ХОБЛ [113].Тем не менее, в будущем сильнодействующие антиоксиданты могут сыграть роль в лечении курильщиков-астматиков.
ВЫВОДЫ И БУДУЩИЕ НАПРАВЛЕНИЯ
Взаимодействие между курением и астмой создает множество проблем для исследователя, клинициста и пациента. Курильщик-астматик может представлять особый «фенотип» с определенными иммуноклеточными изменениями, а также с нарушенными фармакологическими эффектами и плохой поведенческой реакцией на отказ от курения. Недавно было описано врожденное нарушение иммунной регуляции у астматиков, вызванное курением, но почему это происходит и как это можно регулировать, не ясно.Механизмы нечувствительности к кортикостероидам у курильщиков, страдающих астмой, также плохо изучены. Учитывая, что не все курильщики с астмой нечувствительны к ICS, поиск ключевых фенотипических предикторов этой нечувствительности может быть важной областью для будущих исследований. Растущее признание того, что активное курение и астма действительно представляют собой опасную связь, должно привести к активизации усилий по разработке и поощрению безопасных и эффективных программ отказа от курения и стратегий избегания. Высокие показатели распространенности курения сигарет при астме, особенно в развивающихся странах, низкий уровень контроля над астмой, с которым сталкиваются эти пациенты, несмотря на текущие методы лечения, и низкие показатели отказа от курения — все это подчеркивает необходимость в улучшенных методах лечения для курильщиков, страдающих астмой.Важно, чтобы будущие рандомизированные контролируемые испытания новых методов лечения астмы привлекали нынешних и бывших курильщиков с астмой, в том числе тех, кто много курил в анамнезе, что позволит провести предварительно запланированный анализ подгруппы с соответствующей мощностью. Агентства по лицензированию лекарств должны поддержать эту позицию, запросив подходящие исследования на курильщиках, страдающих астмой, до лицензирования новых методов лечения астмы.
Сноски
Заявление о поддержке
R.Исследования Полосы по курению и астме в настоящее время поддерживаются LIAF (Lega Italiana AntiFumo; Катания, Италия).
Заявление о заинтересованности
Заявление о заинтересованности для R. Polosa и NC Thomson можно найти по адресу www.erj.ersjournals.com/site/misc/statements.xhtml
- Получено 8 мая 2012 г.
- Принято к печати 26 июля 2012 г.
Астма и пассивное курение | Обзоры болезней / состояний | Советы бывших курильщиков
Что такое астма?
Астма — хроническое заболевание, поражающее дыхательные пути легких.Во время приступа астмы дыхательные пути (трубки, по которым воздух попадает в легкие) опухают, что затрудняет дыхание. 1,2 По мере того как стенки дыхательных путей набухают, они сужаются, и меньше воздуха попадает в легкие и выходит из них. Клетки в дыхательных путях могут выделять больше слизи (липкой густой жидкости), чем обычно, что может затруднить дыхание. 2
Симптомы приступа астмы включают: 1
- Кашель
- Одышка или затрудненное дыхание
- Свистящее дыхание
- Стеснение или боль в груди
Приступы астмы могут быть легкими, умеренными или серьезными и даже опасными для жизни. 1
Начало страницы
Как курение связано с астмой?
Если у вас астма, приступ астмы может возникнуть, когда что-то раздражает ваши дыхательные пути и «вызывает» приступ. Ваши триггеры могут отличаться от триггеров других людей. 3
Табачный дым — частый провоцирующий фактор астмы. Табачный дым, включая пассивное курение, вреден для всех, особенно для людей, страдающих астмой. 3,6 Пассивное курение представляет собой смесь газов и мелких частиц, которая включает: 4,5
- Дым от сжигания табачных изделий, таких как сигареты, сигары или трубки
- Дым, выдыхаемый (выдыхаемый) кем-то, кто курит
Пассивное курение содержит более 7000 химических веществ, в том числе сотни токсичных и около 70, которые могут вызвать рак. 6
Если у вас астма, важно избегать пассивного курения. 3
Если вы относитесь к 21% взрослого населения США, страдающего астмой и курящим, получите помощь в отказе от курения; поговорите со своим врачом о методах лечения, которые могут вам помочь, или позвоните по телефону 1-800-QUIT-NOW. 7
Начало страницы
Как предотвратить приступ астмы?
Если вы или член вашей семьи страдаете астмой, вы можете справиться с ней с помощью вашего поставщика медицинских услуг (например, принимая лекарства точно так, как вам говорит врач) и избегая триггерных факторов.Старайтесь избегать приступов астмы, держась подальше от табачного дыма. Еще несколько полезных советов:
- Не курите и не позволяйте другим курить в вашем доме или машине. Открытие окна не защищает от дыма. 8
- Если в вашем штате все еще разрешено курение в общественных местах, поищите рестораны и другие места, где курение запрещено. «Секции для некурящих» в том же ресторане, что и «секции для курения», не обеспечивают должной защиты от пассивного курения 8 — даже при наличии фильтра или системы вентиляции. 9
- Убедитесь, что в детских садах и школах ваших детей нет табака. Что касается школ, то политика запрета на табак в кампусе означает, что употребление табака или реклама на территории школы запрещены кем-либо и в любое время. Сюда входят школьные мероприятия за пределами кампуса. 8
- Учите детей не допускать пассивного курения. Будьте хорошим примером для подражания, не куря. 8
Начало страницы
Как лечится астма?
От астмы нет лекарства.Однако, чтобы помочь контролировать астму и избежать приступов: 2
- Принимайте лекарство точно так, как вам говорит врач.
- Держитесь подальше от вещей, которые могут вызвать атаку.
Все больные астмой не принимают одно и то же лекарство. Некоторые лекарства можно вдыхать, а некоторые принимать в виде таблеток. Есть два вида лекарств от астмы: 2
- Быстрое облегчение (помогает контролировать симптомы приступа астмы)
- Долгосрочный контроль (может помочь уменьшить количество приступов и облегчить их, но не поможет, пока у вас приступ астмы)
Начало страницы
Список литературы
- Центры по контролю и профилактике заболеваний.Национальная программа CDC по контролю над астмой: инвестиции в здоровье Америкиpdf icon, 2013. [по состоянию на 18 марта 2020 г.].
- Центры по контролю и профилактике заболеваний. Узнайте, как контролировать астму [последнее обновление: 26 сентября 2018 г .; по состоянию на 24 июня 2019 г.].
- Центры по контролю и профилактике заболеваний. Общие триггеры астмы [последнее обновление 14 декабря 2010 г .; по состоянию на 24 июня 2019 г.].
- Национальная программа токсикологии. Отчет о канцерогенных веществах, четырнадцатое издание, внешний значок. Парк Исследовательского Треугольника (Северная Каролина): U.S. Департамент здравоохранения и социальных служб, Служба общественного здравоохранения, 2016 г. [по состоянию на 24 июня 2019 г.].
- Институт медицины. Воздействие вторичного табачного дыма и сердечно-сосудистые эффекты: смысл свидетельств Внешний значок. Вашингтон: Национальная академия наук, Институт медицины, 2009 г. [доступ 24 июня 2019 г.].
- Министерство здравоохранения и социальных служб США. Последствия курения для здоровья — 50 лет прогресса: доклад главного врача. Атланта: Министерство здравоохранения и социальных служб США, Центры по контролю и профилактике заболеваний, Национальный центр профилактики хронических заболеваний и укрепления здоровья, Управление по курению и здоровью, 2014 г. [по состоянию на 24 июня 2019 г.].
- Центры по контролю и профилактике заболеваний. Статистика астмы: процент курильщиков с астмой [последнее обновление: 31 января 2013 г .; по состоянию на 24 июня 2019 г.].
- Министерство здравоохранения и социальных служб США. Отчет главного хирурга. Как табачный дым вызывает болезнь: что это значит для вас. Атланта: Министерство здравоохранения и социальных служб США, Центры по контролю и профилактике заболеваний, Национальный центр профилактики хронических заболеваний и укрепления здоровья, Управление по курению и здоровью, 2010 г. [по состоянию на 24 июня 2019 г.].
- Министерство здравоохранения и социальных служб США. Отчет главного хирурга. Последствия для здоровья недобровольного воздействия табачного дыма. Пассивное курение: что это значит для вас. Атланта: Министерство здравоохранения и социальных служб США, Центры по контролю и профилактике заболеваний, Национальный центр профилактики хронических заболеваний и укрепления здоровья, Управление по курению и здоровью, 2006 г. [по состоянию на 24 июня 2019 г.].
Каковы преимущества и риски?
Обзор
Астма — это хроническое заболевание легких, вызванное воспалением дыхательных путей.В результате ваши дыхательные пути сужаются. Это приводит к хрипам и затруднению дыхания.
По данным Национального института сердца, легких и крови, более 25 миллионов американцев страдают астмой. Многие из них ищут естественные и альтернативные методы лечения. Сюда входит марихуана (каннабис).
Марихуана легализована во многих штатах. Некоторые штаты легализовали его только в медицинских целях. Другие легализовали как медицинское, так и рекреационное использование этого наркотика.
Вам может быть интересно, может ли марихуана быть потенциальным средством лечения астмы, или, возможно, вы думаете, что она, вероятно, ухудшает астму.Фактически, хотя курение марихуаны может усугубить проблемы с дыханием, прием других форм растения, которые не требуют курения, потенциально может принести пользу людям, страдающим астмой.
Все большее количество исследований сосредоточено на влиянии марихуаны на астму и на том, могут ли растения каннабис облегчить это состояние. Акцент делается не столько на курении марихуаны, сколько на приеме каннабиноидов.
Каннабиноиды — это вещества, встречающиеся в природе в растениях марихуаны. Иногда они используются для лечения хронической боли и неврологических состояний, таких как артрит и рассеянный склероз.Это связано с их противовоспалительными свойствами.
Поскольку астма вызвана хроническим воспалением легких, исследователи пытаются выяснить, могут ли каннабиноиды иметь аналогичные эффекты при этом состоянии. Исследования особенно перспективны для людей, страдающих аллергической астмой.
Каннабиноиды могут быть доступны в виде добавок. Эти вещества также могут быть получены из курения марихуаны в нетрадиционных формах. Исследование, проведенное в 2013 году в журнале Substance Abuse, показало, что люди, которые курят марихуану с помощью испарителей, получают больше пользы от растения с меньшим раздражающим для легких дымом.
Тем не менее, у этих потенциальных преимуществ есть некоторые пределы. В одном исследовании, опубликованном в Current Opinion in Pulmonary Medicine, утверждается, что краткосрочное лекарственное использование марихуаны не может нанести вред легким. Это сравнивают с развлекательным или тяжелым курением. Однако неясно, насколько безопасно и как долго.
Несмотря на все возможные преимущества, марихуана также представляет собой огромный риск при астме. Это особенно актуально, если вы его курите. Курение любых веществ может усилить воспаление в легких.Это усугубляет симптомы астмы.
Курение марихуаны может даже увеличить риск приступа астмы. В тяжелых случаях может потребоваться госпитализация из-за приступа астмы. Это помогает предотвратить опасные для жизни осложнения.
Когда вы курите марихуану, в ваших легких могут образоваться большие воздушные мешочки, называемые буллами. Со временем это может нарушить ваше дыхание. По данным Американского торакального общества, у вас повышенный риск развития пузырей от курения марихуаны, если вы моложе 45 лет.
Со временем пузыри могут разрастаться и вызывать одышку. Еще опаснее развитие пневмоторакса. Это опасное для жизни состояние, которое возникает при разрыве булл в легких.
В краткосрочной перспективе курение марихуаны может вызвать:
- частый кашель
- инфекции легких
- мокроты
- одышку
- свистящее дыхание
Курение, возможно, является одним из наиболее распространенных способов употребления марихуаны.Тем не менее, это не единственная доступная форма марихуаны.
Помимо традиционных косяков, некоторые люди предпочитают курить марихуану другими инструментами, такими как бонг. Теоретически это может помочь уменьшить количество вдыхаемого дыма. Однако было проведено недостаточно исследований, чтобы определить, делают ли такие устройства более безопасным курение марихуаны.
Вейпинг марихуаны путем нагревания растения приводит к меньшему вдыханию дыма. CBD и THC, два соединения марихуаны, можно принимать перорально с едой или в капсулах.Масла с CBD можно наносить на кожу. Марихуана целиком содержится в продуктах питания.
Некурящие формы марихуаны также реже вызывают раздражение легких. К ним относятся экстракты, которые можно смешивать с пищевыми продуктами, и масла CBD, доступные в виде добавок.
Людям, страдающим астмой, доступны многочисленные традиционные методы лечения. Помимо лекарств быстрого действия, таких как ингаляторы, ваш врач может порекомендовать препараты, обеспечивающие более длительный контроль.Они помогают остановить симптомы астмы, уменьшая воспаление, прежде чем они станут проблематичными. Примеры включают:
- небулайзеры
- ингаляционные кортикостероиды
- лейкотриеновые таблетки
Если вы ищете более «естественные» формы лечения астмы, поговорите со своим врачом о следующих вариантах:
- дыхательные упражнения
- медитация
- массаж
- иглоукалывание
Когда дело доходит до употребления марихуаны при астме, продолжаются споры о преимуществах и рисках.

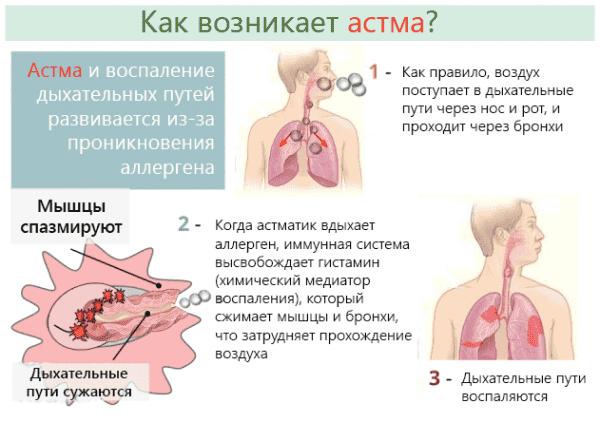 Пристрастие к табаку повышает риск и других респираторных заболеваний, которые в сочетании с астмой ускоряют развитие необратимых анатомических и функциональных изменений в бронхолёгочной системе и тяжких осложнений.
Пристрастие к табаку повышает риск и других респираторных заболеваний, которые в сочетании с астмой ускоряют развитие необратимых анатомических и функциональных изменений в бронхолёгочной системе и тяжких осложнений. У курильщиков риск развития астмы повышен почти в 4 раза по сравнению с некурящими. У курящих людей, имевших контакт с табачным дымом (пассивное курение) такой риск повышен почти в 9 раз. Курении матери во время беременности влечёт недоразвитие защитной выстилки лёгочных альвеол у плода и увеличивает вероятность астмы у ребёнка в 10 раз.
У курильщиков риск развития астмы повышен почти в 4 раза по сравнению с некурящими. У курящих людей, имевших контакт с табачным дымом (пассивное курение) такой риск повышен почти в 9 раз. Курении матери во время беременности влечёт недоразвитие защитной выстилки лёгочных альвеол у плода и увеличивает вероятность астмы у ребёнка в 10 раз. У курильщиков во время приступа гораздо чаще развиваются осложнения, требующие неотложной медицинской помощи – интенсивной терапии в отделении реанимации. Каждый такой приступ повышает вероятность смертельного исхода.
У курильщиков во время приступа гораздо чаще развиваются осложнения, требующие неотложной медицинской помощи – интенсивной терапии в отделении реанимации. Каждый такой приступ повышает вероятность смертельного исхода.