Об этом говорят
|
АКДС: правда и вымысел Некоторое время назад появилась информация об осложнениях, связанных с прививками АКДС. Можно понять беспокойство родителей, что может быть важнее состояние здоровья собственного ребенка? Но насколько обоснованными являются эти тревоги? За разъяснениями мы обратились к Ольге Евгеньевне Шитовой, заместителю главного врача по педиатрии ФГБУЗ КБ №172 ФМБА России. Надеемся, что пояснения опытного специалиста помогут читателям разобраться в ситуации. |
— Прививку АКДС прививают против трех инфекций – коклюша, дифтерии и столбняка, — рассказывает Ольга Евгеньевна Шитова, заместитель главного врача по педиатрии Клинической больницы №172 ФМБА России. — Почему это важно и необходимо делать? Чтобы сохранить здоровье, а во многих случаях и жизнь человека.
Многолетняя мировая и отечественная медицинская практики показывают, что единственным эффективным способом защиты от этих инфекций является вакцинация. Тем не менее, всегда были и есть люди, которые по разным соображениям пренебрегают мнением специалистов. Заражение столбняком происходит при попадании инфекции через поврежденные кожные покровы. Согласитесь, как бы вы не оберегали свое чадо от воздействия внешних факторов окружающей среды, полностью защитить ребенка от их воздействия невозможно. Ваши мальчик или девочка не ходят в скафандре, всегда есть риск получить мелкие ссадины, порезы, уколоться и т.д., то есть существует вероятность заражения инфекцией.
Цель Всемирной организации здравоохранения (ВОЗ) снизить заболеваемость дифтерией до 0,1 случая заболевания на 100 000 населения в России достигнута. Однако последняя массовая вакцинация взрослого населения против дифтерии проводилась более десяти лет назад. Общая прослойка иммунизированных граждан (так называемый коллективный иммунитет) снижается, что создает дополнительные риски для окружающих. В этих условиях лучше всего защитить себя и своего ребенка прививкой от дифтерии.
Если 7-10 лет назад коклюшем болели единицы, то в последнее время отмечается рост заболевания среди подростков и взрослых. Заболевание у данной категории протекает не всегда типично, что затрудняет диагностику.
Не думаю, что кому-то нужны такие испытания.
Вакцину АКДС вводят трехкратно с трехмесячного возраста с интервалом в месяц. Это называется вакцинацией. Через полтора года после третьей прививки проводится ревакцинация (повторное введение вакцины). Как правило, в это время ребенку полтора года. В возрасте 6-7 лет, обычно перед поступлением в школу делается еще одна ревакцинация. Правда, на этот раз используется вакцина АДС, то есть проводиться ревакцинация направленная только против дифтерии и столбняка. И последняя в детском возрасте ревакцинация делается в 14 лет. Далее, теперь уже взрослому человеку, ревакцинация против дифтерии и столбняка проводится каждые десять лет.
И последняя в детском возрасте ревакцинация делается в 14 лет. Далее, теперь уже взрослому человеку, ревакцинация против дифтерии и столбняка проводится каждые десять лет.
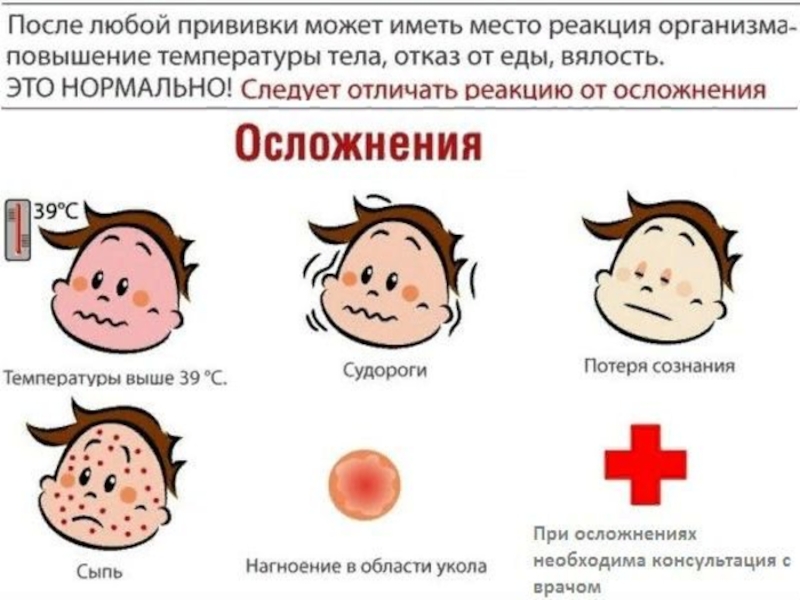
Специалисты никогда не скрывали, что прививка АКДС иногда дает реакции, которые могут беспокоить родителей. И вот почему. С вакциной в организм человека попадают два анатоксина – дифтерийный и столбнячный. Они не могут привести к заболеванию, но зато формируют иммунитет против дифтерии и столбняка. Также в состав отечественной вакцины входят мертвые клетки коклюшной палочки. Они-то и вызывают основные реакции на прививку, которые так часто беспокоят родителей.
Инструкция вакцины АКДС допускает развитие нормальных реакций организма на введение вакцины в виде местных и общих реакций. Реакции на АКДС могут проявиться первые трое суток после вакцинации. Частота местной реакции, особенно на повторные введения составляет от 40-50%. К нормальным (допустимым) общим реакциям относят повышение температуры, недомогание, потеря аппетита, сонливость.
Как отмечалось ранее, помимо общих реакций, есть местные. Собственно именно они стали причиной беспокойства в родительской среде. Местная реакция может проявляться в виде небольшой болезненности в месте укола. Возможно развитие покраснения, уплотнения и припухлости (инфильтрата). До восьми сантиметров в диаметре инфильтрат считается нормальной реакцией организма на прививку.
Объясню, почему возникают местные реакции. Компоненты вакцины в АКДС «насажены» на адьювант – вещество, которое обеспечивает более медленное равномерное всасывание всех составных частей, снижает развитие общих реакций, но при этом вызывает образование местной воспалительной реакции.
Местная реакция самостоятельно проходит в течение двух недель и чаще всего не требует лечения, возможно применение терапии для ускорения рассасывания.
Обычно первая и вторая прививка протекают без реакции. Но поскольку после этого организм уже знает, что ему будут вводить, то, как правило, третья и четвертая реакция дают большую реакцию. К этому и родителям и медработникам следует быть готовыми
Но если родителей беспокоит состояние ребенка после прививки, то необходимо обратиться к педиатру, для наблюдения и оказания медицинской помощи. Самолечением, особенно прикладыванием капустных листков, всяких лепешек, рисованием йодных сеток, заниматься не надо, это, как правило, приводит только к нежелательным последствиям. Надо иметь в виду, что инфильтрат – воспалительная реакция после введения чужеродного вещества. На него организм должен ответить. С этой целью он начинает вырабатывать клетки иммунной системы – лимфоциты, которые устремляются в этот очаг, словно бабочки на огонек в ночи.
Почему нельзя рисовать йодную сетку? Детская кожа нежная, восприимчивая к внешним воздействиям, не имеет таких защитных свойств как у взрослого, поэтому при использовании настойки йода возможно развитие химического ожога. К тому же йод, приобретенный в аптеке, порой долгое время стоит без применения и за это время спиртовая составляющая частично испаряется и концентрация йода увеличивается.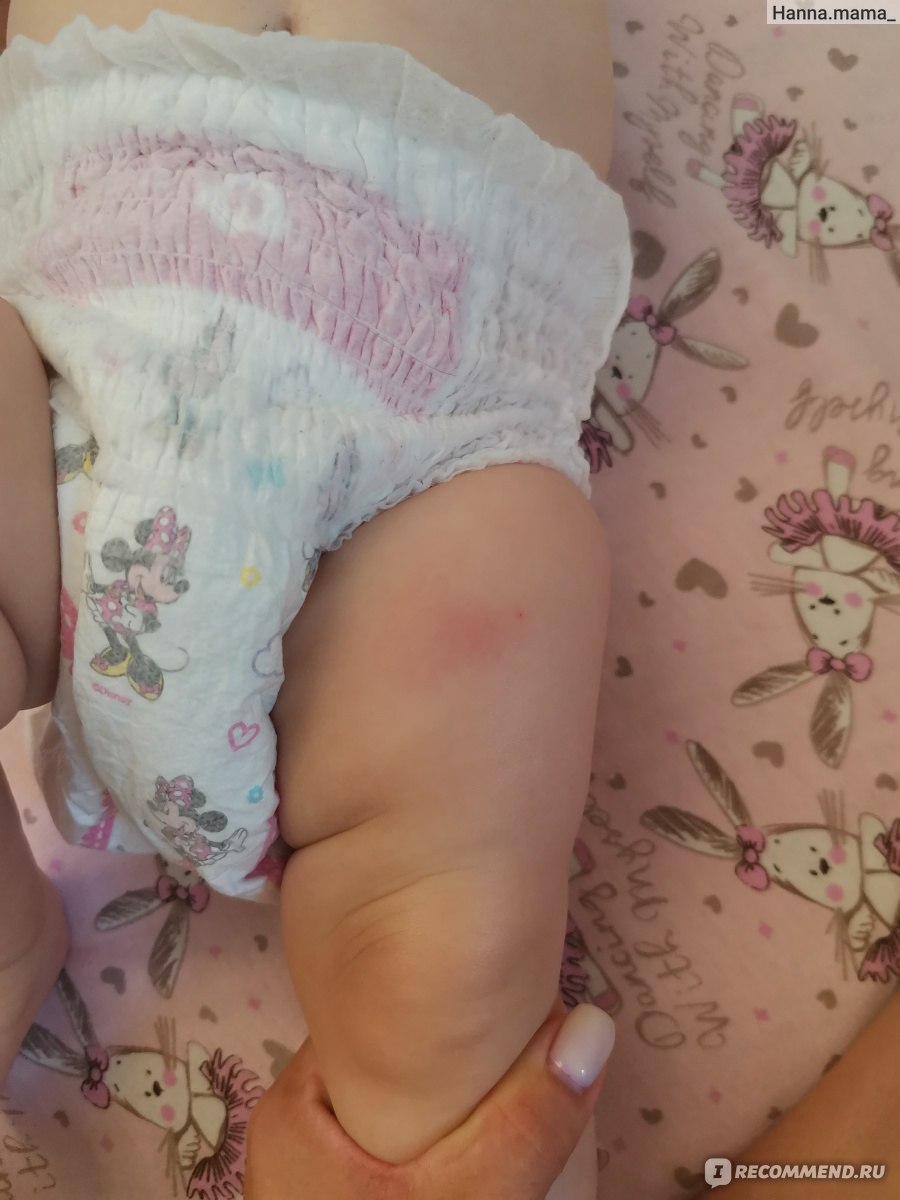
Периодически в обществе возникают разговоры о том, что медицинские работники не разъясняют родителям, что ожидать от прививок и что им делать в случае появления реакций. На самом деле перед прививкой информация матери и отцу предоставляется участковой медицинской сестрой в момент приглашения родителей с ребенком в поликлинику для проведения вакцинации, врачом-педиатром при проведении осмотра ребенка перед прививкой. Кроме того, родитель перед прививкой дает письменное, подчеркиваю письменное, согласие, что ему понятно с какой целью она проводится, какие реакции и осложнения возможны. Далее, когда родитель приходит в прививочный кабинет, процедурная медсестра еще раз дает пояснения относительно вакцины, возможных реакций и что делать в случае их появления. В частности, она предупреждает, что если ребенка что-то будет беспокоить, следует обратиться к врачу или к ней. Также медсестра просит родителя посидеть с ребенком после вакцинации возле прививочного кабинета в течение 30 минут.
Помимо этого, хочу заметить, что в детских поликлиниках в прививочных кабинетах работают медицинские сестры с большим стажем и опытом. На такой ответственный участок другие не допускаются.
Некоторые эмоциональные родители, приходя с ребенком на вакцинацию, сильно волнуются и не всегда могут воспринимать предоставляемую информацию или оказать медицинскому работнику необходимую помощь при проведении вакцинации. Между тем, малышу нужно хорошо зафиксировать ногу (вакцина вводится в бедро), чтобы ребенок не дернулся. Не все мамы способны сделать это. Поэтому, пожалуйста, пусть на прививку с мамой и ребенком приходит папа или близкий родственник, который сможет это сделать.
В заключении хотелось бы сказать следующее. Вакцинация – защита от опасных инфекций. Ребенок – не машина, он индивидуален, у него имеются особенности развития присущие только ему, что способствует проявлению местных и общих реакций. Вакцина же рассчитана на среднестатистического ребенка. Поэтому, если он наблюдается у педиатра, то врач учитывает особенности малыша при подготовке к прививке. Кроме того, у родителя, если у него есть вопросы, всегда есть возможность задать их как врачу, так и патронажной сестре. В случаях, когда вы считаете, что не получили необходимых пояснений, просим обращаться к заведующим детскими поликлиниками по месту жительства, руководители подразделений не откажут вам в помощи.
Поэтому, если он наблюдается у педиатра, то врач учитывает особенности малыша при подготовке к прививке. Кроме того, у родителя, если у него есть вопросы, всегда есть возможность задать их как врачу, так и патронажной сестре. В случаях, когда вы считаете, что не получили необходимых пояснений, просим обращаться к заведующим детскими поликлиниками по месту жительства, руководители подразделений не откажут вам в помощи.
Будьте здоровы!
Инфекционные болезни и вакцинация детей
Что такое коклюш?
Коклюш — это тяжелое инфекционное заболевание, поражающее дыхательные пути и проявляющееся развитием сухого приступообразного кашля.
Симптомы коклюша
Особенностью коклюша является постепенное нарастание симптомов, достигающих наибольшей выраженности спустя 2-3 недели после появления первых признаков заболевания.
— Насморк
— Заложенность носа
— Покраснение глаз и слезотечение
— Невысокая лихорадка
— Кашель ( в течении двух недель, кашель усиливается, приобретая типичный спазматический характер, становится приступообразным).
Что такое дифтерия?
Дифтерия – острое инфекционное заболевание бактериальной природы, характеризующееся развитием фибринозного воспаления в области внедрения возбудителя (поражается преимущественно верхние дыхательные пути, слизистая оболочка ротоглотки).
Симптомы дифтерии
Начало заболевания – острое, поднимается температура тела до фебрильных цифр, появляются симптомы умеренной интоксикации (головная боль, общая слабость, потеря аппетита, побледнение кожных покровов, повышение частоты пульса), боль в горле. Лихорадка длится 2-3 дня, ко второму дню налет на миндалинах, прежде фибринозный, становится более плотным, гладким, приобретает перламутровый блеск. Налеты снимаются тяжело, оставляя после снятия участки кровоточащей слизистой, а на следующие сутки очищенное место вновь покрывается пленкой фибрина.
Что такое столбняк?
Столбняк — это инфекционное заболевание, вызываемое бактерией Clostridium tetani, с острым характером течения и преимущественным поражением нервной системы.
Симптомы столбняка
Заболевание начинается с продромальных явлений (напряжение и тремор мышц в области проникновения инфекции, головная боль, потливость, раздражительность), но, как правило, первым признаком столбняка является боль тупого, тянущего характера в месте попадания в организм возбудителя, даже если рана полностью зажила.
Затем развиваются характерные симптомы столбняка: тризм (судорожное сокращение и напряжение жевательной мускулатуры, затрудняющее отрывание рта), дисфагия (затруднение глотания), ригидность затылочных мышц (не сопровождающаяся другими менингеальными симптомами), «сардоническая улыбка» (специфическое напряжение мимической мускулатуры: наморщенный лоб, суженные глазные щели, губы растянуты, уголки рта опущены).
Профилактика коклюша, дифтерии, столбняка
АКДС — адсорбированная коклюшно-дифтерийно-столбнячная вакцина, состоит из взвеси убитых коклюшных микробов и очищенных дифтерийного и столбнячного анатоксинов, сорбированных на геле гидроксида алюминия.
В результате вакцинации организм приобретает 100% иммунитет от столбняка и дифтерии на 10 лет, от коклюша на 7 лет!!!
Когда делать АКДС?
Вакцинация против коклюша, дифтерии, столбняка при отсутствии медицинских противопоказаний в первый раз проводится детям в возрасте 3-х месяцев; второй раз – в 4,5 месяцев; в третий – в 6 месяцев. Первая ревакцинация против коклюша, дифтерии и столбняка осуществляется в 1,5 года; вторая и третья ревакцинация выполняется только против дифтерии и столбняка соответственно в 6-7 и 14 лет.
Противопоказания
1.Заболевания, сопровождающиеся подъемом температуры, сыпью, кашлем.
2.Непереносимость компонентов вакцины.
3.Сильная реакция на предыдущее введение вакцины – отек, обширная гиперемия, температура выше 40 С, системная аллергия на прививку АКДС.
4.Прием иммуносупрессоров.
Возможные реакции на вакцину АКДС?
Местные
1.В месте укола после прививки АКДС образуется небольшое покраснение.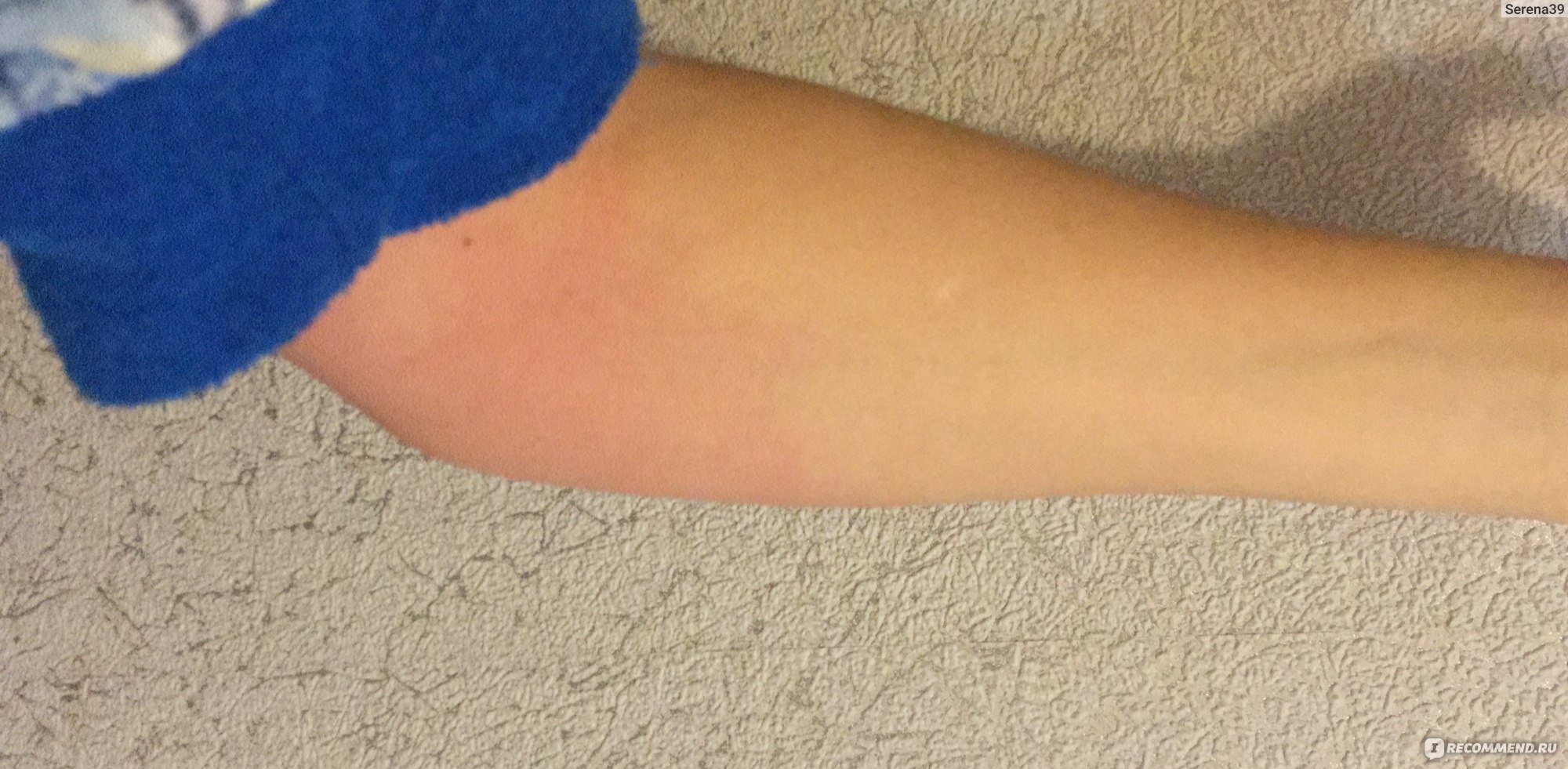 Такая реакция является типичной на введение чужеродного агента. Через сутки или чуть больше краснота исчезнет.
Такая реакция является типичной на введение чужеродного агента. Через сутки или чуть больше краснота исчезнет.
2.Уплотнение после прививки<8см . Уплотнение и шишка должны рассосаться в течение 10-14 дней.
3.В месте укола болезненность. Зависит от индивидуальной чувствительности. Облегчить состояние можно приложив лед к месту укола.
Общие
1.Повышение температуры. Необходимо принять жаропонижающие средства (парацетамол, ибупрофен).
2.Однократная диарея. Вызывается стрессом, который пережил ребенок.
3.Однократная рвота.
4.Кашель в течение суток.
Что такое полиомиелит?
Полиомиелит — энтеровирусная инфекция, вызываемая полиовирусами, поражающими мотонейроны передних рогов спинного мозга, что приводит к тяжелым паралитическим осложнениям с инвалидизацией больного. Наибольшая восприимчивость к полиомиелиту (60-80%) отмечается у детей в возрасте до 4-х лет.
Симптомы
Инкубационный период при различных формах полиомиелита в среднем составляет 8–12 дней.
Инаппарантная форма полиомиелита представляет собой носительство вируса, которое никак не проявляется клинически и может быть обнаружено только лабораторным путем.
Абортивная (висцеральная) форма полиомиелита составляет более 80% всех случаев болезни. Клинические проявления неспецифичны; среди них преобладают общеинфекционные симптомы – лихорадка, интоксикация, головная боль, умеренные катаральные явления, боли в животе, диарея. Болезнь заканчивается через 3-7 дней полным выздоровлением; остаточных неврологических симптомов не отмечается.
Менингеальная форма полиомиелита протекает по типу доброкачественного серозного менингита. При этом отмечается двухволновая лихорадка, головные боли, умеренно выраженные менингеальные симптомы (Брудзинского, Кернига, ригидность затылочных мышц). Через 3-4 недели наступает выздоровление.
Паралитическая форма полиомиелита имеет наиболее тяжелое течение и исходы. В препаралитическом периоде преобладает общеинфекционная симптоматика: повышение температуры, диспепсия, ринит, фарингит, трахеит и др.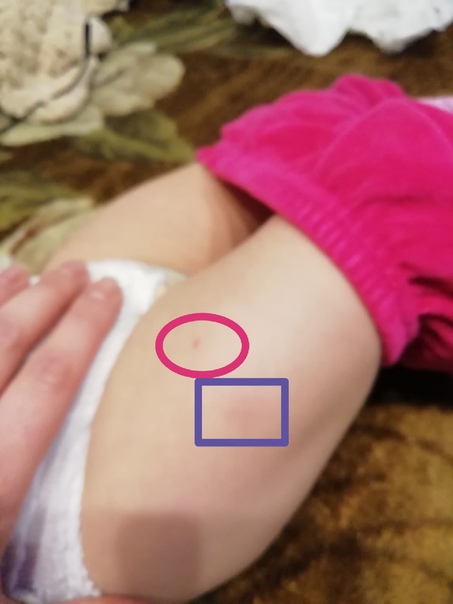 Вторая волна лихорадки сопровождается менингеальными явлениями, миалгией, болями в позвоночнике и конечностях, выраженной гиперестезией, гипергидрозом, спутанностью сознания и судорогами.
Вторая волна лихорадки сопровождается менингеальными явлениями, миалгией, болями в позвоночнике и конечностях, выраженной гиперестезией, гипергидрозом, спутанностью сознания и судорогами.
Профилактика полиомиелита
ИПВ расшифровывается как инактивированная полиомиелитная вакцина. Препарат содержит вирус полиомиелита, который был убит температурным воздействием либо химическим веществом. При попадании в организм антигенного материала начинается выработка антител, способных не допускать заражения при контакте с возбудителем.
Эффективность ИПВ высокая. После первой прививки вырабатывается стойкий иммунитет у 99% вакцинированных детей. После курса из трех доз ИПВ защищенными становятся 97-100% лиц.
Схема плановой вакцинации:
— первую дозу малышу вводят в 3 месяца;
— второй раз инъекцию делают в 4,5 месяца;
— последний раз прививают в полгода.
— Далее проводят ревакцинации в 3 и 6 лет.
Запрещается иммунизироваться ИПВ в следующих случаях:
— индивидуальная непереносимость компонентов вакцины;
— острая форма патологии любого типа;
— тяжелые неврологические расстройства;
— состояние аллергии;
— развитие осложнений и тяжелых реакций на предыдущую дозу.
Что такое вирусный гепатит В?
Вирусный гепатит В (сывороточный гепатит) – инфекционное заболевание печени, протекающее в различных клинических вариантах (от бессимптомного носительства до деструкции печеночной паренхимы). При гепатите В поражение клеток печени носит аутоиммунный характер.
Симптомы вирусного гепатита В
1. Преджелтушный период:
Диспепсический вариант течения характеризуется потерей аппетита (вплоть до анорексии), непрекращающейся тошнотой, эпизодами беспричинной рвоты. Для гриппоподобной формы клинического течения дожелтушного периода гепатита В характерно повышение температуры и общеинтоксикационная симптоматика, обычно без катаральных признаков, но с нередкими, преимущественно ночными и утренними, артралгиями (при этом визуально суставы не изменены). После движения в суставе боль обычно на некоторое время стихает. В случае, если в этот период отмечается артралгия, сочетанная с высыпаниями по типу крапивницы, течение заболевания обещает быть более тяжелым. Чаще всего такая симптоматика сопровождается лихорадкой. В преджелтушной фазе может отмечаться выраженная слабость, сонливость, головокружение, кровоточивость десен и эпизоды носовых кровотечений (геморрагический синдром).
Чаще всего такая симптоматика сопровождается лихорадкой. В преджелтушной фазе может отмечаться выраженная слабость, сонливость, головокружение, кровоточивость десен и эпизоды носовых кровотечений (геморрагический синдром).
1.Желтушный период:
При появлении желтухи улучшения самочувствия не наблюдается, чаще общая симптоматика усугубляется: нарастает диспепсия, астения, появляется кожный зуд, усиливаются геморрагии. Кожные покровы и слизистые оболочки имеют интенсивный охряной оттенок, отмечаются петехии и округлые кровоизлияния, моча темнеет, кал становится светлее вплоть до полного обесцвечивания.
Профилактика вирусного гепатита В
Вакцина против вирусного гепатита В- генетическая структура дрожжевых клеток (Saccharomycescerevisiae) предварительно подвергается изменению, в результате которого они получают ген, кодирующий поверхностных антиген гепатита В. Далее синтезированный дрожжами антиген очищается от базовой субстанции.
Схема введения прививки:
— в первые сутки после рождения;
— через месяц после рождения;
— через 6 месяцев после рождения.
Приобретенный иммунитет сохраняется в течение 10 лет.
Противопоказания:
— обострение хронических заболеваний;
— вес ребенка меньше 2500г.;
— сильная аллергия на прошлое введение вакцины.
Заведующий детской консультацией С. С. Зиганшина
Тел.:(44- 725- 51-65)
База данных RX List — используйте дженерики или торговые марки лекарств
ПОБОЧНЫЕ ЭФФЕКТЫ
Данные клинических исследований
Поскольку клинические испытания
проводимые в самых разных условиях, частота побочных реакций, наблюдаемая в
клинические испытания вакцины нельзя напрямую сравнивать с показателями в
клинические испытания другой вакцины и могут не отражать показатели, наблюдаемые в
упражняться. Однако информация о побочных реакциях, полученная в ходе клинических испытаний,
предоставить основу для выявления нежелательных явлений, которые, по-видимому, связаны с
использование вакцины и приблизительную частоту этих событий.
Приблизительно 18 000 доз Вакцина DAPTACEL вводилась младенцам и детям в 9 клинических исследования. Из них 3 дозы вакцины DAPTACEL были введены 4998 больным. детей, 4 дозы вакцины DAPTACEL были введены 1725 детям, и 485 детей получили 5 доз вакцины DAPTACEL. Всего 989 дети получили 1 дозу вакцины DAPTACEL после 4 предыдущих доз вакцины. Пентацел вакцина.
В рандомизированном двойном слепом исследовании
исследование эффективности вакцины против коклюша, Швеция I, проведенное в
Швеция в течение 1992-1995, безопасность вакцины DAPTACEL сравнивали с DT
и цельноклеточная коклюшная вакцина АКДС. Стандартная дневниковая карточка велась в течение 14 лет.
дни после каждой дозы и последующие телефонные звонки были сделаны через 1 и 14 дней
после каждой инъекции. Ежемесячно делались телефонные звонки для контроля
возникновение тяжелых явлений и/или госпитализаций в течение 2 месяцев после
последняя инъекция. Было меньше запрошенных общих местных и системных
реакции после вакцины DAPTACEL, чем после цельноклеточной коклюшной вакцины
вакцина АКДС. Как показано в Таблице 1, 2587 младенцев, получавших DAPTACEL
вакцины в возрасте 2, 4 и 6 месяцев имели одинаковую частоту реакций в течение 24 лет.
часов в качестве реципиентов DT и значительно более низкие показатели, чем младенцы, получающие
цельноклеточная коклюшная АКДС.
Как показано в Таблице 1, 2587 младенцев, получавших DAPTACEL
вакцины в возрасте 2, 4 и 6 месяцев имели одинаковую частоту реакций в течение 24 лет.
часов в качестве реципиентов DT и значительно более низкие показатели, чем младенцы, получающие
цельноклеточная коклюшная АКДС.
Таблица 1: Процент
Младенцы из Швеции I Испытание эффективности с местными или системными реакциями в течение 24 лет
Часы после введения дозы 1, 2 и 3 вакцины DAPTACEL по сравнению с DT и цельноклеточной вакциной
Вакцины против коклюша АКДС
| СОБЫТИЕ | Доза 1 (2 МЕСЯЦА) | Доза 2 (4 МЕСЯЦА) | Доза 3 (6 МЕСЯЦЕВ) | ||||||
| Вакцина DAPTACEL N = 2587 | ДТ Н = 2,574 | ДТП Н = 2,102 | Вакцина DAPTACEL N = 2 563 | ДТ Н = 2555 | ДТП Н = 2040 | Вакцина DAPTACEL N = 2549 | ДТ Н = 2,538 | ДТП Н = 2001 | |
| Местный | |||||||||
| Нежность (Любая) | 8,0* | 8,4 | 59,5 | 10,1* | 10,3 | 60,2 | 10,8* | 10 | 50 |
| Покраснение ≥ 2 см | 0,3* | 0,3 | 6 | 1,0* | 0,8 | 5. 1 1 | 3,7* | 2,4 | 6,4 |
| Отек ≥ 2 см | 0,9* | 0,7 | 10,6 | 1,6* | 2 | 10 | 6,3*† | 3,9 | 10,5 |
| Системный | |||||||||
| Лихорадка‡ ≥ 38°C (100,4°F) | 7,8* | 7,6 | 72,3 | 19,1* | 18,4 | 74,3 | 23,6* | 22,1 | 65,1 |
| Раздражительность§ | 32,3 | 33 | 82,1 | 39,6 | 39,8 | 85,4 | 35,9 | 37,7 | 73 |
| Анорексия | 11,2* | 10,3 | 39,2 | 9,1* | 8,1 | 25,6 | 8,4* | 7,7 | 17,5 |
| Сонливость | 32,7* | 32 | 56,9 | 25,9* | 25,6 | 50,6 | 18,9* | 20,6 | 37,6 |
| Плач ≥ 1 часа | 1,7* | 1,6 | 11,8 | 2,5* | 2,7 | 9,3 | 1,2* | 1 | 3,3 |
| Рвота | 6,9* | 6,3 | 9,5 | 5,2** | 5,8 | 7,4 | 4,3 | 5,2 | 5,5 |
| DT: Шведская национальная биологическая компания
Лаборатории АКДС: цельноклеточная коклюшная АКДС, Санофи Пастер Инк.  pertussis DTP pertussis DTP † p < 0,0001: вакцина DAPTACEL по сравнению с DT ‡ Ректальная температура § Статистические сравнения для этой переменной не проводились ** p < 0,003: вакцина DAPTACEL против цельноклеточной коклюшной АКДС | |||||||||
Заболеваемость серьезными и менее распространенными избранными системными событиями в исследовании эффективности Швеции I являются обобщены в Таблице 2.
Таблица 2: Отдельные системные
События: Показатели на 1000 доз после вакцинации в возрасте 2, 4 и 6 месяцев в
Швеция I Исследование эффективности
| СОБЫТИЕ | Доза 1 (2 МЕСЯЦА) | Доза 2 (4 МЕСЯЦА) | Доза 3 (6 МЕСЯЦЕВ) | ||||||
| Вакцина DAPTACEL N = 2587 | ДТ Н = 2,574 | ДТП Н = 2,102 | Вакцина DAPTACEL N = 2565 | ДТ Н = 2,556 | ДТП Н = 2040 | Вакцина DAPTACEL N = 2551 | ДТ Н = 2,539 | ДТП Н = 2002 | |
| Ректальная температура ≥ 40°C (104°F) в течение 48 часов после вакцинации | 0,39 | 0,78 | 3,33 | 0 | 0,78 | 3,43 | 0,39 | 1,18 | 6,99 |
| Гипотонический- гипореактивный эпизод в течение 24 часов после вакцинации | 0 | 0 | 1,9 | 0 | 0 | 0,49 | 0,39 | 0 | 0 |
| Постоянный плач продолжительностью ≥ 3 часов в течение 24 часов после вакцинации | 1,16 | 0 | 8. 09 09 | 0,39 | 0,39 | 1,96 | 0 | 0 | 1 |
| Припадки в течение 72 часов после вакцинации | 0 | 0,39 | 0 | 0 | 0,39 | 0,49 | 0 | 0,39 | 0 |
| DT: Шведская национальная биология
Laboratories DTP: цельноклеточная коклюшная DTP, Sanofi Pasteur Inc. N = Количество оцениваемых субъектов | |||||||||
В исследовании эффективности Швеции I,
один случай отека всей конечности и генерализованных симптомов с разрешением
в течение 24 часов после введения 2 дозы вакцины ДАПТАЦЕЛ. Нет серий
наблюдались анафилаксия или энцефалопатия. О приступах не сообщалось
в течение 3 дней после вакцинации вакциной DAPTACEL. На протяжении всего исследования
период, 6 приступов было зарегистрировано в группе вакцины DAPTACEL, 9 в группе DT
группу и 3 в группе цельноклеточной коклюшной АКДС, при общей частоте 2,3,
3,5 и 1,4 на 1000 вакцинированных соответственно. Один случай инфантильных спазмов был
сообщили в группе вакцины DAPTACEL. Случаев инвазии не было
бактериальная инфекция или смерть.
На протяжении всего исследования
период, 6 приступов было зарегистрировано в группе вакцины DAPTACEL, 9 в группе DT
группу и 3 в группе цельноклеточной коклюшной АКДС, при общей частоте 2,3,
3,5 и 1,4 на 1000 вакцинированных соответственно. Один случай инфантильных спазмов был
сообщили в группе вакцины DAPTACEL. Случаев инвазии не было
бактериальная инфекция или смерть.
В исследовании, проведенном в США, дети
получили 4 дозы вакцины DAPTACEL в возрасте 2, 4, 6 и 15-17 месяцев. А
всего 1454 ребенка получили вакцину DAPTACEL и были включены в
анализы безопасности. Из них 51,7% женщины, 77,2% европеоиды, 6,3% негры, 6,5%
Латиноамериканцы, 0,9% азиаты и 9,1% представители других рас. Применение вакцины DAPTACEL в качестве
пятая доза вакцины DTaP оценивалась в 2 последующих клинических исследованиях в США.
В одном исследовании 485 детей получили вакцину DAPTACEL в возрасте 4-6 лет.
возраст после 4 предыдущих доз вакцины DAPTACEL в младенчестве (DAPTACEL-primed).
В отдельном исследовании всего 989 детей получили вакцину DAPTACEL в возрасте 4-6 лет. лет после 4 предыдущих доз вакцины Pentacel в младенчестве
(Пентацель со штрихом). Дети, включенные в эти исследования пятой дозы, были
неслучайные подгруппы участников из предыдущих исследований DAPTACEL или Pentacel.
Подгруппы были репрезентативными для всех детей, получивших 4 дозы
Вакцина DAPTACEL или Pentacel в более ранних исследованиях в отношении частот
запрошенных местных и системных нежелательных явлений после четвертой дозы.
лет после 4 предыдущих доз вакцины Pentacel в младенчестве
(Пентацель со штрихом). Дети, включенные в эти исследования пятой дозы, были
неслучайные подгруппы участников из предыдущих исследований DAPTACEL или Pentacel.
Подгруппы были репрезентативными для всех детей, получивших 4 дозы
Вакцина DAPTACEL или Pentacel в более ранних исследованиях в отношении частот
запрошенных местных и системных нежелательных явлений после четвертой дозы.
В США DAPTACEL, 4 дозы
исследовании в возрасте 2, 4 и 6 месяцев вакцину DAPTACEL вводили
одновременно с конъюгированной вакциной против Haemophilus influenzae типа b (Hib)
(конъюгат столбнячного анатоксина) (Sanofi Pasteur SA), инактивированная вакцина против полиомиелита
(IPV) (Sanofi Pasteur SA) и 7-валентная пневмококковая конъюгированная вакцина (Wyeth
Фармасьютикалз Инк.). Младенцы получили первую дозу гепатита В
прививка в возрасте 0 мес. В возрасте 2 и 6 месяцев вакцинация против гепатита В
(рекомбинантный) (Merck & Co., Inc.) также вводили одновременно с
вакцина ДАПТАЦЕЛ. На основании случайного распределения четвертая доза вакцины DAPTACEL
вводили либо отдельно; одновременно с конъюгатом Hib (столбнячный анатоксин
конъюгированная) вакцина; или одновременно с конъюгатом Hib (столбнячный анатоксин
конъюгированная) вакцина, 7-валентная пневмококковая конъюгированная вакцина, корь, эпидемический паротит,
вакцина против краснухи (MMR) (Merck & Co., Inc.) и вакцина против ветряной оспы (Merck
& Co., Inc.). В исследованиях с пятой дозой вакцина DAPTACEL вводилась
одновременно с ИПВ (все пациенты, примированные DAPTACEL, и 47% пациентов, примированных Pentacel).
субъекты) и вакцина MMR.
На основании случайного распределения четвертая доза вакцины DAPTACEL
вводили либо отдельно; одновременно с конъюгатом Hib (столбнячный анатоксин
конъюгированная) вакцина; или одновременно с конъюгатом Hib (столбнячный анатоксин
конъюгированная) вакцина, 7-валентная пневмококковая конъюгированная вакцина, корь, эпидемический паротит,
вакцина против краснухи (MMR) (Merck & Co., Inc.) и вакцина против ветряной оспы (Merck
& Co., Inc.). В исследованиях с пятой дозой вакцина DAPTACEL вводилась
одновременно с ИПВ (все пациенты, примированные DAPTACEL, и 47% пациентов, примированных Pentacel).
субъекты) и вакцина MMR.
В исследованиях, проведенных в США, возникновение
запрошенных местных и системных нежелательных явлений, перечисленных в таблице 3, было зарегистрировано
ежедневно родителями или опекунами в течение 0-7 дней после вакцинации. Дней 0
и 1 после первых трех доз вакцины ДАПТАЦЕЛ, признаки и симптомы
HHE также были запрошены. Периодически звонили по телефону, чтобы узнать
неблагоприятные события.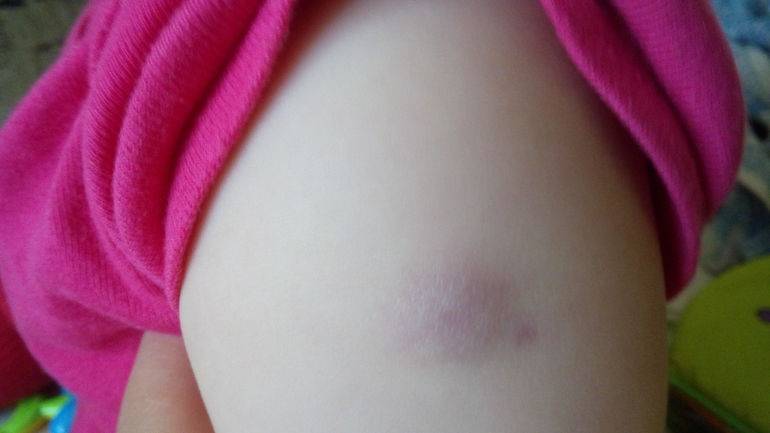 Серьезные нежелательные явления были
мониторинг в течение трех исследований в течение 6 месяцев после последней дозы
вакцина ДАПТАЦЕЛ.
Серьезные нежелательные явления были
мониторинг в течение трех исследований в течение 6 месяцев после последней дозы
вакцина ДАПТАЦЕЛ.
Частота и тяжесть избранные запрошенные местные и системные нежелательные явления, которые произошли в течение 3 дней после введения каждой дозы вакцины DAPTACEL показаны в таблице 3. частота покраснения, болезненности и припухлости в месте инъекции DAPTACEL увеличилось с четвертой и пятой дозами, с самыми высокими показателями, о которых сообщалось после пятой дозы. Частота покраснения, болезненности и припухлости в Точно так же увеличивалось место инъекции DAPTACEL при введении вакцины DAPTACEL. в качестве пятой дозы вакцины DTaP у детей, примированных Pentacel.
Таблица 3: Количество (в процентах)
детей из исследований в США с выбранными запрошенными местными и системными нежелательными явлениями
События по степени тяжести, происходящие в период от 0 до 3 дней после каждой дозы DAPTACEL
Вакцина
| Доза 1* | Доза 2* | Доза 3* | Доза 4* | Доза 5 | ||
| N= 1390-1406 % | N= 1346-1360 % | Н = 1301-1312 % | N= 1118-1144 % | грунтовка DAPTACEL* N = 473-481 % | Pentacel-грунтовка* N = 936–981 % | |
| Реакции в месте инъекции (вакцина DAPTACEL место инъекции) | ||||||
| Покраснение | ||||||
| > 5 мм | 6,2 | 7. 1 1 | 9,6 | 17,3 | 35,8 | 20,2 |
| 25–50 мм | 0,6 | 0,5 | 1,9 | 6,3 | 10,4 | 6,8 |
| > 50 мм | 0,4 | 0,1 | 0 | 3.1 | 15,8 | 6,6 |
| Отек | ||||||
| > 5 мм | 4 | 4 | 6,5 | 11,7 | 23,9 | 12 |
| 25–50 мм | 1,2 | 0,6 | 1 | 3,2 | 5,8 | 4.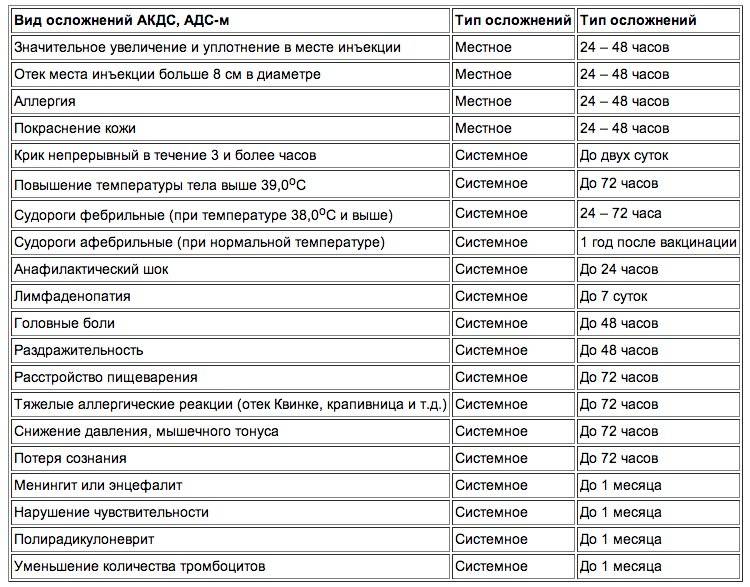 1 1 |
| > 50 мм | 0,4 | 0,1 | 0,1 | 1,6 | 7,7 | 2,9 |
| Нежность † | ||||||
| Любой | 48,8 | 38,2 | 40,9 | 49,5 | 61,5 | 50 |
| Умеренный | 16,5 | 9,9 | 10,6 | 12,3 | 11,2 | 7,4 |
| Тяжелый | 4.1 | 2,3 | 1,7 | 2,2 | 1,7 | 0,3 |
| Увеличение окружности руки‡ | ||||||
| > 5 мм | — | — | — | — | 38,3 | 28,6 |
| 20–40 мм | — | — | — | — | 14 | 7,6 |
| > 40 мм | — | — | — | — | 1,5 | 1,2 |
| Помехи Нормальная активность руки§ | ||||||
| Любой | — | — | — | — | 20,4 | 8,8 |
| Умеренный | — | — | — | — | 5,6 | 1,7 |
| Тяжелый | 0,4 | 0 | ||||
| Системные реакции | ||||||
| Лихорадка** | ||||||
| ≥ 38,0°C | 9,3 | 16,1 | 15,8 | 10,5 | 6. 1 1 | 4,6 |
| > 38,5–39,5°C | 1,5 | 3,9 | 4,8 | 2,7 | 2.1 | 2 |
| > 39,5°C | 0,1 | 0,4 | 0,3 | 0,7 | 0,2 | 0,2 |
| Снижение активности/вялость†† | ||||||
| Любой | 51,1 | 37,4 | 33,2 | 25,3 | 21 | 12,6 |
| Умеренный | 23 | 14,4 | 12,1 | 8,2 | 5,8 | 3,6 |
| Тяжелый | 1,2 | 1,4 | 0,6 | 1 | 0,8 | 0,4 |
| Безутешный плач‡‡ | ||||||
| Любой | 58,5 | 51,4 | 47,9 | 37,1 | 14,1 | 7,2 |
| Умеренный | 14,2 | 12,6 | 10,8 | 7,7 | 3,5 | 1,9 |
| Тяжелый | 2,2 | 3,4 | 1,4 | 1,5 | 0,4 | 0,3 |
| Беспокойство/раздражительность §§ | ||||||
| Любой | 75,8 | 70,7 | 67,1 | 54,4 | 34,9 | 22,9 |
| Умеренный | 27,7 | 25 | 22 | 16,3 | 7,5 | 5,3 |
| Тяжелый | 5,6 | 5,5 | 4,3 | 3,9 | 0,4 | 0,5 |
* В одном исследовании, проведенном в США, дети
получили четыре дозы вакцины DAPTACEL. Неслучайное подмножество этих детей
получили пятую дозу вакцины DAPTACEL в последующем исследовании. Неслучайный
подгруппа детей, ранее вакцинированных 4 дозами вакцины Pentacel в
предыдущие клинические исследования получили дозу вакцины DAPTACEL в возрасте 4-6 лет.
возраста в качестве пятой дозы вакцины DTaP в другом клиническом исследовании. Неслучайное подмножество этих детей
получили пятую дозу вакцины DAPTACEL в последующем исследовании. Неслучайный
подгруппа детей, ранее вакцинированных 4 дозами вакцины Pentacel в
предыдущие клинические исследования получили дозу вакцины DAPTACEL в возрасте 4-6 лет.
возраста в качестве пятой дозы вакцины DTaP в другом клиническом исследовании. † Дозы 1-4 — Умеренная: субъект плачет, когда Зона коснулся; Тяжелая: субъект плачет при движении ноги или руки. Доза 5 — умеренная: мешает деятельности, но не влияет. требуют медицинской помощи или прогула; Тяжелая: выводит из строя, не может выполнять обычной деятельности, может иметь/или нуждаться в медицинской помощи или прогулах. ‡ Окружность вакцины DAPTACEL руку на уровне подмышечной впадины контролировали после четвертого и пятого только дозы. Увеличение окружности руки рассчитывали путем вычитания исходная окружность до вакцинации (день 0) от окружности поствакцинальный. § Умеренная: снижено использование рук, но не требуется медицинское обслуживание или невыход на работу; Тяжелая: вывод из строя, отказ двигать рукой, может имели/или нуждались в медицинской помощи или прогулах.  ** Для доз 1-3 было измерено 53,7% температур ректально, 45,1% были измерены подмышечно, 1,0% были измерены орально и 0,1% были измерены по неустановленному маршруту. Для Дозы 4 35,7% температур были измерены ректально, 62,3% — подмышечно, 1,5% — орально и 0,5% были измерены неустановленным путем. Для Дозы 5 в DAPTACEL-загрунтованном детей 0,2% температур измеряли ректально, 11,3% измеряли подмышечной и 88,4% измерялись перорально. Для дозы 5 в Pentacel-грунтовке детей, 0,2% температур измеряли ректально, 0,5% измеряли тимпанально, 17% были измерены подмышечно, и 81,7% были измерены орально. Высокая температура основан на фактической температуре, зарегистрированной без каких-либо корректировок. измерение для маршрута. †† Доза 1–4 — Умеренная: препятствует и ограничивает повседневная активность, менее интерактивная; Тяжелая: отключение (не интересует обычное повседневная деятельность, субъект не может быть уговорен взаимодействовать с опекуном). Доза 5 — умеренная: мешает деятельности, но не влияет. 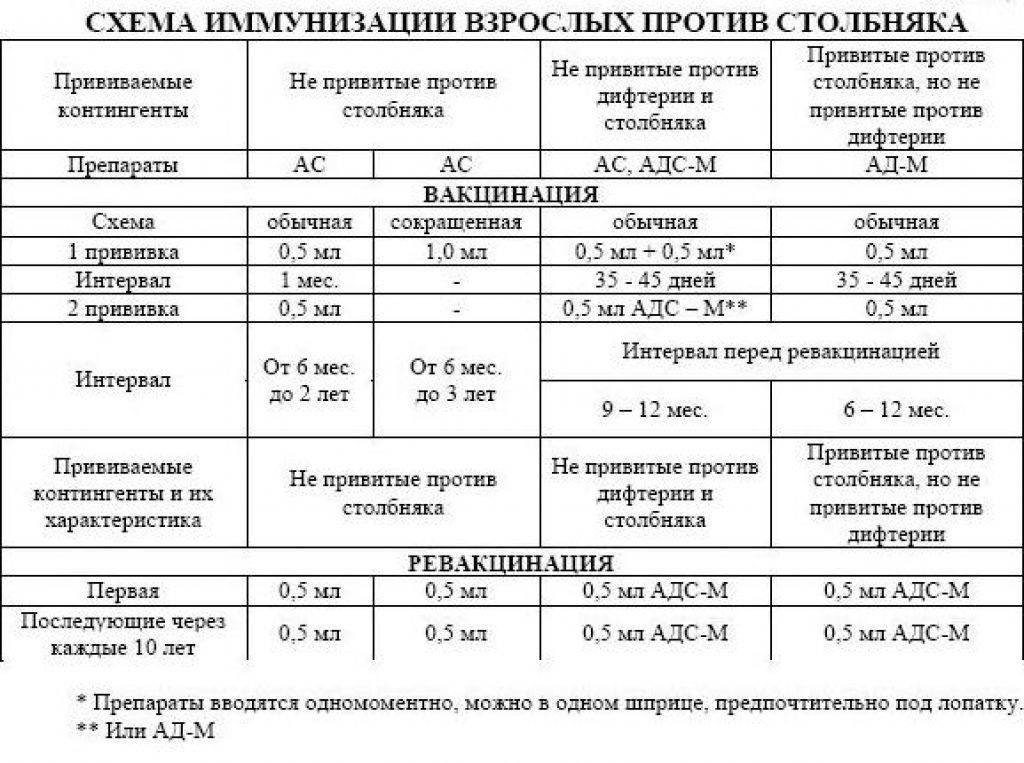 требуют медицинской помощи или прогула; Тяжелая: выводит из строя, не может выполнять
обычной деятельности, может иметь/или нуждаться в медицинской помощи или прогулах. требуют медицинской помощи или прогула; Тяжелая: выводит из строя, не может выполнять
обычной деятельности, может иметь/или нуждаться в медицинской помощи или прогулах. ‡‡ Дозы 1-4 — Умеренная: безутешный от 1 до 3 часов плач; Тяжелая: > 3 часов безутешного плача. Доза 5 — умеренная: мешала деятельности, но не требовала медицинское обслуживание или невыход на работу; Тяжелая: выводящая из строя, неспособная выполнять обычные деятельности, может иметь/или нуждаться в медицинской помощи или прогулах. §§ Дозы 1-4 — Умеренная: Раздражительность от 1 до 3 часов; Тяжелая: раздражительность в течение > 3 часов. Доза 5 — умеренная: мешает деятельности, но не влияет. требуют медицинской помощи или прогула; Серьезный: выводит из строя, не может выполнять обычную деятельность, может иметь / или требуется медицинской помощи или невыхода на работу. | ||||||
В исследовании США, в котором
дети получили 4 дозы вакцины DAPTACEL из 1454 человек, получивших
Вакцина DAPTACEL, 5 (0,3%) субъектов испытали судороги в течение 60 дней. после введения любой дозы вакцины DAPTACEL. Один приступ произошел в течение 7 дней.
после вакцинации: ребенок, перенесший афебрильные судороги с апноэ на
день первой прививки. Произошли еще три случая судорог.
от 8 до 30 дней после вакцинации. Из припадков, произошедших в течение 60
дня после вакцинации 3 были связаны с лихорадкой. В этом исследовании были
не сообщалось о случаях HHE после введения вакцины DAPTACEL. Был один летальный исход из-за
аспирация через 222 дня после вакцинации у субъекта с эпендимомой. В течение 30
дней после введения любой дозы вакцины DAPTACEL, 57 (3,9%) субъектов сообщили в
хотя бы одно серьезное нежелательное явление. В этот период наиболее часто
зарегистрированным серьезным нежелательным явлением был бронхиолит, зарегистрированный у 28 (1,9%)
предметы. Другие серьезные нежелательные явления, которые произошли в течение 30 дней после
Вакцина DAPTACEL включает три случая пневмонии, два случая менингита и
по одному случаю сепсиса, коклюша (после введения 1 дозы), раздражительности и
невосприимчивость.
после введения любой дозы вакцины DAPTACEL. Один приступ произошел в течение 7 дней.
после вакцинации: ребенок, перенесший афебрильные судороги с апноэ на
день первой прививки. Произошли еще три случая судорог.
от 8 до 30 дней после вакцинации. Из припадков, произошедших в течение 60
дня после вакцинации 3 были связаны с лихорадкой. В этом исследовании были
не сообщалось о случаях HHE после введения вакцины DAPTACEL. Был один летальный исход из-за
аспирация через 222 дня после вакцинации у субъекта с эпендимомой. В течение 30
дней после введения любой дозы вакцины DAPTACEL, 57 (3,9%) субъектов сообщили в
хотя бы одно серьезное нежелательное явление. В этот период наиболее часто
зарегистрированным серьезным нежелательным явлением был бронхиолит, зарегистрированный у 28 (1,9%)
предметы. Другие серьезные нежелательные явления, которые произошли в течение 30 дней после
Вакцина DAPTACEL включает три случая пневмонии, два случая менингита и
по одному случаю сепсиса, коклюша (после введения 1 дозы), раздражительности и
невосприимчивость.
В исследовании США, в котором Вакцину DAPTACEL вводили в виде пятой дозы DTaP пациентам, примированным DAPTACEL. субъектам в течение 30 дней после пятой дозы DAPTACEL подряд. вакцины, 1 (0,2%) субъект сообщил о 2 серьезных побочных эффектах (бронхоспазм и гипоксия). В исследовании США, в котором вакцина DAPTACEL вводилась в качестве пятой Доза DTaP у субъектов, примированных Pentacel, в течение 30 дней после DAPTACEL, 4 (0,4%) субъекты сообщили об одном или нескольких серьезных нежелательных явлениях (астма и пневмония; идиопатическая тромбоцитопеническая пурпура; рвота; целлюлит не место инъекции). В этих двух исследованиях не было сообщений о припадках в течение Через 30 дней после вакцинации DAPTACEL у лиц, примированных DAPTACEL, или Субъекты с Pentacel.
В другом исследовании (Швеция II
испытания эффективности), 3 вакцины АКДС и цельноклеточная вакцина против коклюша АКДС, ни одной
из которых лицензированы в США, были оценены для оценки относительной безопасности и
эффективность.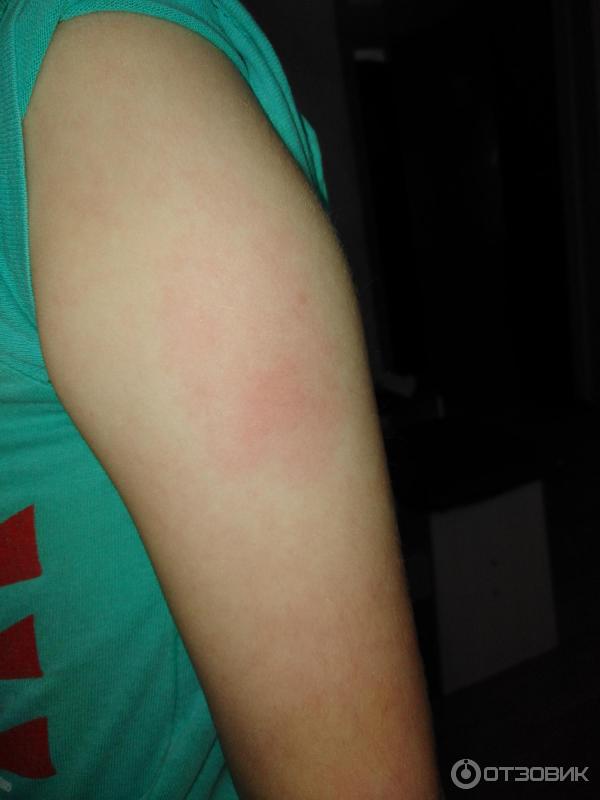 Это исследование включало HCPDT, вакцину, состоящую из тех же компонентов, что и
Вакцина DAPTACEL, но содержащая в два раза больше детоксицированного PT и четыре
раз превышает количество FHA (20 мкг детоксицированного PT и 20 мкг FHA). HHE наблюдался
после 29 (0,047%) из 61 220 доз HCPDT; 16 (0,026%) из 61 219 доз
бесклеточная коклюшная вакцина другого производителя; и 34 (0,056%) из
60,792 дозы цельноклеточной коклюшной вакцины АКДС. В других исследованиях с использованием HCPDT было 4 дополнительных случая HHE.
вакцина с общим показателем 33 (0,047%) в 69 525 дозах.
Это исследование включало HCPDT, вакцину, состоящую из тех же компонентов, что и
Вакцина DAPTACEL, но содержащая в два раза больше детоксицированного PT и четыре
раз превышает количество FHA (20 мкг детоксицированного PT и 20 мкг FHA). HHE наблюдался
после 29 (0,047%) из 61 220 доз HCPDT; 16 (0,026%) из 61 219 доз
бесклеточная коклюшная вакцина другого производителя; и 34 (0,056%) из
60,792 дозы цельноклеточной коклюшной вакцины АКДС. В других исследованиях с использованием HCPDT было 4 дополнительных случая HHE.
вакцина с общим показателем 33 (0,047%) в 69 525 дозах.
Данные постмаркетингового опыта
Следующие нежелательные явления были зарегистрированы спонтанно во время постмаркетингового применения даптацела. вакцины в США и других странах. Поскольку об этих событиях сообщается добровольно из популяции неопределенного размера, может оказаться невозможным достоверно оценить их частоту или установить причинно-следственную связь с вакцинацией контакт.
Следующие нежелательные явления
были включены на основании одного или нескольких из следующих факторов: тяжесть,
частота сообщений или сила доказательств причинно-следственной связи с
вакцина ДАПТАЦЕЛ.
Болезни крови и лимфатической системы
Лимфаденопатия
Болезни сердца
Цианоз
Желудочно-кишечные расстройства
Тошнота, диарея
Общие расстройства и Условия в месте введения
Местные реакции: в месте инъекции боль, сыпь в месте инъекции, узелок в месте инъекции, образование в месте инъекции, обширный отек инъецированной конечности (включая отек, затрагивающий соседние суставы).
Инфекции и инвазии
Целлюлит в месте инъекции, целлюлит, абсцесс в месте инъекции
Нарушения иммунной системы
Гиперчувствительность, аллергия реакция, анафилактическая реакция (отек, отек лица, отек лица, зуд, генерализованная сыпь) и другие виды сыпи (эритематозная, пятнистая, макуло-папулезные)
Заболевания нервной системы
Судороги: фебрильные судороги, большие судорожные припадки, парциальные припадки ГЭ, гипотония, сонливость, обморок
Психические расстройства
Крик
FDA одобряет первую вакцину против COVID-19
Пресс-релиз FDA
Одобрение означает ключевое достижение для общественного здравоохранения
- Для немедленного выпуска:
Español
Сегодня Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило первую вакцину против COVID-19. Вакцина была известна как Pfizer-BioNTech COVID-19.Вакцина, которая теперь будет продаваться как «Комирнаты» (koe-mir’-na-tee) для профилактики заболевания COVID-19 у лиц в возрасте 16 лет и старше. Вакцина также по-прежнему доступна в соответствии с разрешением на экстренное использование (EUA), в том числе для лиц в возрасте от 12 до 15 лет и для введения третьей дозы некоторым лицам с ослабленным иммунитетом.
«Одобрение FDA этой вакцины является важной вехой, поскольку мы продолжаем бороться с пандемией COVID-19. Хотя эта и другие вакцины соответствуют строгим научным стандартам FDA для разрешения на использование в экстренныхвакцины, общественность может быть полностью уверена в том, что эта вакцина соответствует высоким стандартам безопасности, эффективности и качества производства, которые FDA требует от одобренного продукта», — сказала исполняющая обязанности комиссара FDA Джанет Вудкок, доктор медицины. «Хотя миллионы людей уже безопасно перенесли COVID -19 вакцин, мы понимаем, что для некоторых одобрение вакцины FDA теперь может вселить дополнительную уверенность в возможности пройти вакцинацию. Сегодняшняя веха делает нас на один шаг ближе к изменению хода этой пандемии в США».
«Хотя миллионы людей уже безопасно перенесли COVID -19 вакцин, мы понимаем, что для некоторых одобрение вакцины FDA теперь может вселить дополнительную уверенность в возможности пройти вакцинацию. Сегодняшняя веха делает нас на один шаг ближе к изменению хода этой пандемии в США».
С 11 декабря 2020 г. вакцина Pfizer-BioNTech против COVID-19 доступна в рамках EUA для лиц в возрасте 16 лет и старше, а 10 мая разрешение было расширено для включения лиц в возрасте от 12 до 15 лет. 2021. EUA может использоваться FDA во время чрезвычайных ситуаций в области общественного здравоохранения для обеспечения доступа к медицинским продуктам, которые могут быть эффективными для профилактики, диагностики или лечения заболевания, при условии, что FDA определяет, что известные и потенциальные преимущества продукта при его использовании для предотвращения, диагностики или лечения заболевания, перевешивают известные и потенциальные риски продукта.
Вакцины, одобренные FDA, проходят стандартный процесс проверки качества, безопасности и эффективности медицинских продуктов. Для всех вакцин FDA оценивает данные и информацию, включенные в заявку производителя на получение лицензии на биопрепараты (BLA). BLA — это всеобъемлющий документ, который представляется агентству с очень конкретными требованиями. Для Comirnaty BLA основывается на обширных данных и информации, ранее представленных в поддержку EUA, таких как доклинические и клинические данные и информация, а также подробности производственного процесса, результаты испытаний вакцин для обеспечения качества вакцин и инспекции площадок. где производят вакцину. Агентство проводит собственный анализ информации в BLA, чтобы убедиться, что вакцина безопасна и эффективна и соответствует стандартам одобрения FDA.
Для всех вакцин FDA оценивает данные и информацию, включенные в заявку производителя на получение лицензии на биопрепараты (BLA). BLA — это всеобъемлющий документ, который представляется агентству с очень конкретными требованиями. Для Comirnaty BLA основывается на обширных данных и информации, ранее представленных в поддержку EUA, таких как доклинические и клинические данные и информация, а также подробности производственного процесса, результаты испытаний вакцин для обеспечения качества вакцин и инспекции площадок. где производят вакцину. Агентство проводит собственный анализ информации в BLA, чтобы убедиться, что вакцина безопасна и эффективна и соответствует стандартам одобрения FDA.
Comirnaty содержит информационную РНК (мРНК), своего рода генетический материал. мРНК используется организмом для имитации одного из белков вируса, вызывающего COVID-19. Результатом того, что человек получает эту вакцину, является то, что его иммунная система в конечном итоге будет защищаться от вируса, вызывающего COVID-19. мРНК в Comirnaty присутствует в организме только в течение короткого времени и не включается в генетический материал человека и не изменяет его. Comirnaty имеет тот же состав, что и вакцина EUA, и вводится в виде серии из двух доз с интервалом в три недели.
мРНК в Comirnaty присутствует в организме только в течение короткого времени и не включается в генетический материал человека и не изменяет его. Comirnaty имеет тот же состав, что и вакцина EUA, и вводится в виде серии из двух доз с интервалом в три недели.
«Наши научные и медицинские эксперты провели невероятно тщательную и вдумчивую оценку этой вакцины. Мы оценили научные данные и информацию, содержащиеся на сотнях тысяч страниц, провели собственный анализ безопасности и эффективности Comirnaty, а также провели детальную оценку производственных процессов, включая инспекции производственных мощностей», — сказал Питер Маркс, доктор медицинских наук, кандидат медицинских наук. Д., директор Центра оценки и исследований биологических препаратов FDA. «Мы не упускаем из виду, что COVID-19кризис общественного здравоохранения продолжается в США, и общественность рассчитывает на безопасные и эффективные вакцины. Общественность и медицинское сообщество могут быть уверены, что, несмотря на то, что мы одобрили эту вакцину в кратчайшие сроки, она полностью соответствовала нашим существующим высоким стандартам для вакцин в США». Первое EUA, выпущенное 11 декабря, для вакцины Pfizer-BioNTech против COVID-19 для лиц в возрасте 16 лет и старше было основано на данных о безопасности и эффективности, полученных в результате рандомизированного, контролируемого, слепого продолжающегося клинического исследования с участием тысяч людей. . Чтобы поддержать сегодняшнее решение FDA об одобрении, FDA рассмотрело обновленные данные клинического испытания, которое поддерживало EUA и включало более длительную продолжительность последующего наблюдения в большей популяции клинических испытаний. В частности, при рассмотрении FDA для утверждения агентство проанализировало данные об эффективности примерно 20 000 вакцин и 20 000 реципиентов плацебо в возрасте 16 лет и старше, у которых не было признаков вирусной инфекции COVID-19 в течение недели после получения второй дозы. Безопасность Comirnaty была оценена примерно у 22 000 человек, получивших вакцину, и у 22 000 человек, получивших плацебо, в возрасте 16 лет и старше. По результатам клинических испытаний эффективность вакцины в предотвращении заболевания COVID-19 составила 91%. Более половины участников клинических испытаний наблюдались на предмет безопасности в течение как минимум четырех месяцев после введения второй дозы. В целом, около 12 000 реципиентов наблюдались в течение как минимум 6 месяцев. Наиболее частыми побочными эффектами, о которых сообщали участники клинических испытаний, получавшие Comirnaty, были боль, покраснение и припухлость в месте инъекции, утомляемость, головная боль, боль в мышцах или суставах, озноб и лихорадка. Вакцина эффективна в профилактике COVID-19и потенциально серьезные исходы, включая госпитализацию и смерть. Кроме того, FDA провело тщательную оценку пострегистрационных данных наблюдения за безопасностью, касающихся миокардита и перикардита после введения вакцины Pfizer-BioNTech COVID-19, и определило, что данные демонстрируют повышенный риск, особенно в течение семи дней после вторая доза. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и Центры по контролю и профилактике заболеваний имеют системы мониторинга, обеспечивающие своевременное выявление и оценку любых проблем безопасности. Кроме того, FDA требует от компании проведения постмаркетинговых исследований для дальнейшей оценки рисков миокардита и перикардита после вакцинации препаратом Комирнати. Эти исследования будут включать оценку долгосрочных результатов среди лиц, у которых развился миокардит после вакцинации Комирнати. FDA предоставило этой заявке приоритетное рассмотрение. Разрешение было предоставлено компании BioNTech Manufacturing GmbH. ### Boilerplate Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, агентство Министерства здравоохранения и социальных служб США, защищает здоровье населения, гарантируя безопасность, эффективность и безопасность лекарственных препаратов для людей и животных, вакцин и другие биологические продукты для человека и медицинские устройства. Агентство также отвечает за безопасность продуктов питания, косметики, пищевых добавок, продуктов, испускающих электронное излучение, и за регулирование табачных изделий. Older
Older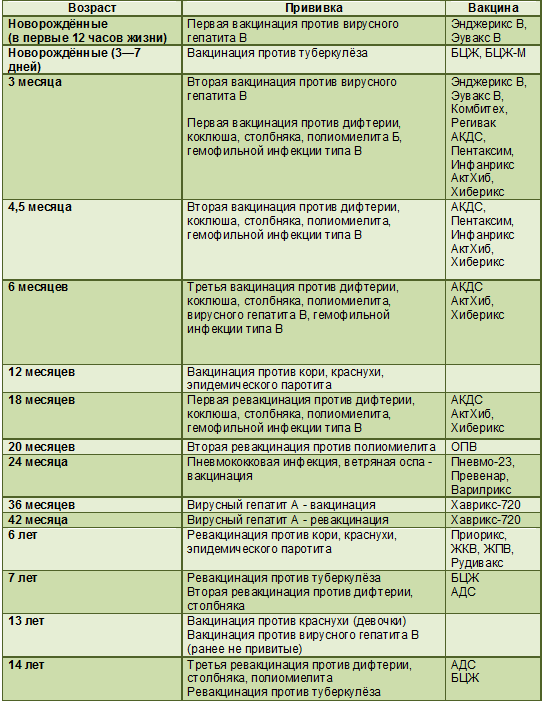
 Наблюдаемый риск выше среди мужчин в возрасте до 40 лет по сравнению с женщинами и мужчинами старшего возраста. Наблюдаемый риск наиболее высок у мужчин в возрасте от 12 до 17 лет. Имеющиеся данные краткосрочного наблюдения позволяют предположить, что у большинства людей симптомы исчезли. Тем не менее, некоторые люди нуждались в интенсивной терапии. Информация о потенциальных долгосрочных последствиях для здоровья пока отсутствует. Информация о назначении Comirnaty содержит предупреждение об этих рисках.
Наблюдаемый риск выше среди мужчин в возрасте до 40 лет по сравнению с женщинами и мужчинами старшего возраста. Наблюдаемый риск наиболее высок у мужчин в возрасте от 12 до 17 лет. Имеющиеся данные краткосрочного наблюдения позволяют предположить, что у большинства людей симптомы исчезли. Тем не менее, некоторые люди нуждались в интенсивной терапии. Информация о потенциальных долгосрочных последствиях для здоровья пока отсутствует. Информация о назначении Comirnaty содержит предупреждение об этих рисках. Текущий мониторинг безопасности
 Кроме того, хотя это и не соответствует требованиям FDA, компания обязалась провести дополнительные постмаркетинговые исследования безопасности, в том числе провести исследование регистра беременных для оценки исходов беременности и новорожденных после приема Комирнати во время беременности.
Кроме того, хотя это и не соответствует требованиям FDA, компания обязалась провести дополнительные постмаркетинговые исследования безопасности, в том числе провести исследование регистра беременных для оценки исходов беременности и новорожденных после приема Комирнати во время беременности. Дополнительная информация