Классификация растворов.
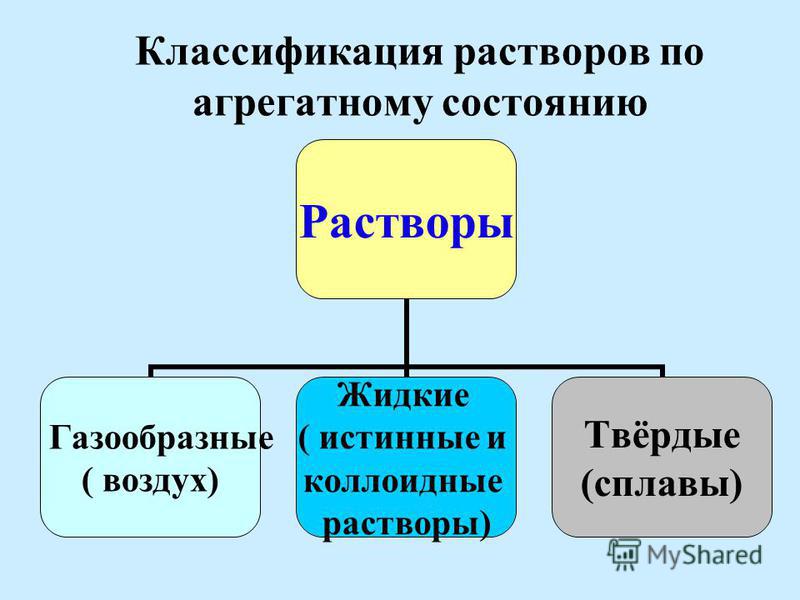
I.Растворы классифицируются по агрегатному состоянию растворителя и растворенного вещества.
Растворы могут быть жидкими, твердыми и газовыми.
Растворителемможет быть твердое вещество, жидкость и газ.
Практически все газы друг в друге растворяются. В жидкостях растворяются жидкости, газы и твердые вещества. В твердых телах растворяются только твердые тела. В твердых растворах происходит образование гомогенной системы из твердых компонентов.
Газовые растворы– это растворы
газов, жидкостей и твердых тел в газах.
В пределе при нулевом давлении любой
реальный газ представляет систему
независимых друг от друга частиц, т.е.
обладает признаками идеальной системы.
Смесь этих газов, называемаяидеальным
газом, подчиняетсязакону Дальтона:(гдеР– общее давление;Рi– парциальное давлениеi-го
компонента). С повышением давления
появляется взаимодействие между
частицами, тогда смесь реальных газов,
паров жидкости и твердых тел рассматривают
как газовый раствор.
С повышением давления
появляется взаимодействие между
частицами, тогда смесь реальных газов,
паров жидкости и твердых тел рассматривают
как газовый раствор.
Наибольшее распространение получили жидкие, в частности,водные растворы. В случае растворов «жидкость – газ» и «жидкость – твердое тело» растворителем принято считать жидкость. У растворов «жидкость – жидкость» растворителем считают компонент, который находится в избытке по сравнению с другими компонентами, именуемых растворенными веществами.
В зависимости от свойств растворенного вещества различают жидкие растворыне электролитов, электролитов и высокомолекулярных соединений(ВМС). Последние являются предметом рассмотрения в коллоидной химии.
Количество вещества, растворенного в данном объеме растворителя, называется
Способы выражения концентраций:
1)Молярная концентрация М (или молярность) – число молей вещества, растворенного в 1 м3 (или литре) раствора:
2)Моляльная концентрация т (или моляльность) – число молей растворенного вещества в 1 кг или 1000 г растворителя:
где Mp – масса растворителя.
3)Процентная концентрация ω
или
4)Мольная доляN – отношение числа молейniодного компонента к суммарному числу молейnвсех компонентов раствора:
Сумма мольных долей всех компонентов раствора равна единице:
Пример.Проведем расчет М,mиNпо известной массовой концентрации серной кислотыω=98%,плотность раствора равна 1,84 г/л; молярные массы компонентов раствора равныг/моль;г/моль.
Молярность раствора равна:
Моляльность раствора составляет:
Мольная доля серной кислоты равна:
II.Растворы подразделяются также по степени взаимодействия растворителя и растворенного вещества.

Растворы
идеальные
предельно разбавленные
реальные
(неидеальные)
Идеальными раствораминазываются такие растворы, у которых сила взаимодействия между одноименными и разноименными молекулами одинакова.
А – растворенное вещество, fA—A
В – растворитель, fВ-В
Раствор АВ fA—A= fВ-В= fA-В
В идеальных растворах энергия
взаимодействия молекул разных компонентов
одна и та же; все молекулы раствора
(растворенных веществ и растворителя)
обладают одинаковым силовым полем, а
объемы молекул всех компонентов равны.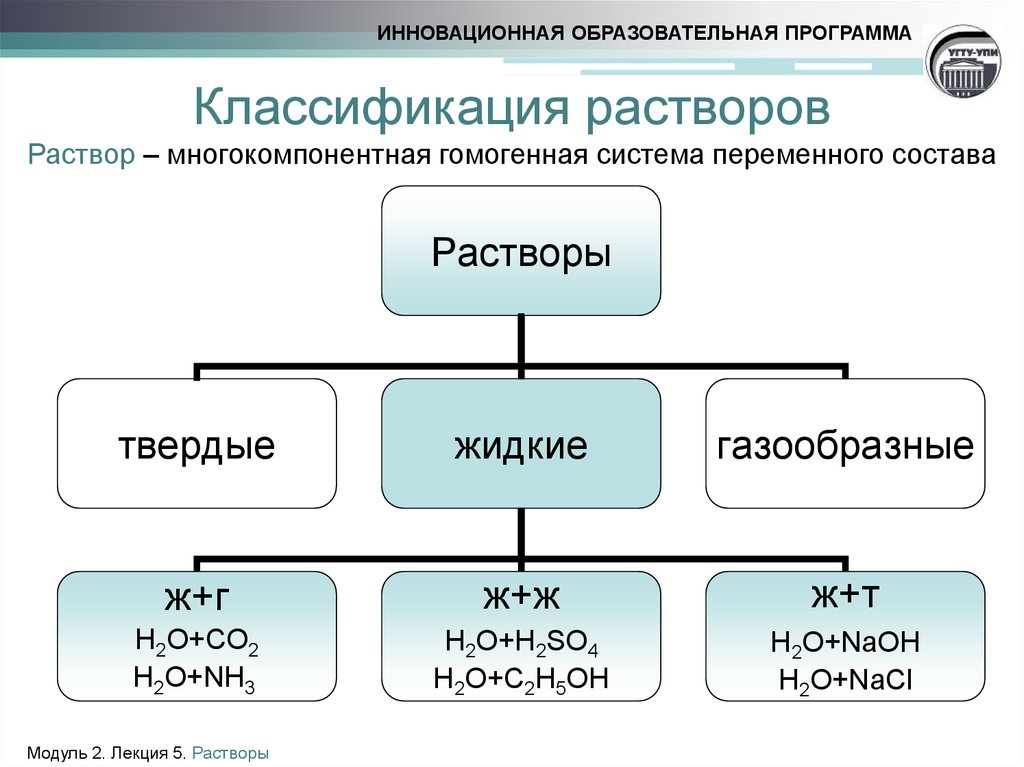
Одинаковый объем всех молекул обуславливает неизменность объема системы при образовании идеального раствора. Тепловой эффект при этом образовании идеального раствора равен нулю. В связи с этим можно дать другое определение идеальных жидких растворов.
ΔV=0; ΔH=0; ΔS=ΔSи. г.
г.
Объем и энтальпия идеальных растворов аддитивны и зависят от состава раствора.
Следует иметь в виду, что идеальными могут считаться растворы, когда выполняются все вышеперечисленные условия и, кроме того, должны быть равны парциальные давления компонентов, у них должны быть одинаковая температура и одно и то же агрегатное состояние.
Идеальные растворы потому и называются идеальными, что они не существуют в действительности. Однако имеется значительное число растворов, близких по свойствам к идеальным растворам. К ним относятся разбавленные растворы.
Энергия Гиббса i-го компонента идеального раствора численно равна химическому потенциалу и может быть представлена следующим образом:
Когда ∆H
, где
µi , µip–химические потенциалыi-го индивидуального
компонента в растворе;Ni –мольная доляi-го
компонента.
Продифференцируем данное уравнение и получим:
В связи с тем, что получаем:
Это уравнение показывает соотношение между химическим потенциалом компонентов идеального раствора и его составом, определяемым мольной долей компонентов раствора.
Рассмотрим предельно разбавленные растворы, которые часто называют просто разбавленными.Предельно разбавленными раствораминазываются такие растворы, у которых растворитель подчиняется законом идеальных растворов, а растворимое вещество – законам реальных растворов.
Концентрация растворенного вещества в разбавленном растворе бесконечно мала, поэтому взаимодействием между его молекулами можно пренебречь. Тогда предельно разбавленные растворы можно описать закономерностями и уравнениями, которые справедливы для идеальных растворов.
Неидеальными (реальными) раствораминазываются такие растворы, у которых
силы взаимодействия между одноименными
и разноименными молекулами различны.
Раствор АВ fA—A≠ fВ-В≠ fA-В
Реальные растворы не подчиняются закономерностям идеальных и предельно разбавленных растворов. Однако, введя вспомогательные величины, свойства неидеальных растворов тоже можно выразить через закономерности идеальных растворов.
Классификация растворов в химии
От Masterweb
09.06.2018 14:00
Растворами принято называть однородные смеси, состоящие минимум из двух компонентов. Один из них — растворитель. Он задает агрегатное состояние раствора и, как правило, составляет большую часть его массы. При этом в системе может содержаться одновременно несколько растворителей и растворенных веществ. Классификация растворов достаточно обширна. Разделение их на виды может быть основано на различных характеристиках.
Разделение их на виды может быть основано на различных характеристиках.
Классификация растворов по природе растворителя
В данном случае растворы подразделяются на водные и неводные. Вода — наиболее распространенный и универсальный растворитель на планете, однако она способна растворить не все вещества. При выборе растворителя часто руководствуются так называемым правилом подобия. Заключается оно в том, что в водной среде лучше растворяются вещества неорганической природы. Для растворения органических соединений же необходимо применять особые органические растворители, например бензол, хлороформ или спирты.
По размеру частиц растворенного вещества
Наиболее общий принцип классификации. В данном случае выделяют два типа систем: истинные и коллоидные.
В первом случае растворенное вещество находится в виде отдельных атомов и молекул. Размеры этих частиц настолько малы, что их невозможно различить визуально или при помощи оптического микроскопа. Истинными являются, например, водные растворы поваренной соли, сахара или уксусной кислоты. Основным их отличительным признаком является отсутствие помутнений.
Основным их отличительным признаком является отсутствие помутнений.
В коллоидных системах растворенное вещество содержится в виде агрегатов достаточно большого размера (от 1 до 1000 нм), которые заметны невооруженным взглядом. Свет, проходящий сквозь такой раствор, конусообразно рассеивается. Это явление получило название эффекта Тиндаля.
Классификация коллоидных систем
В свою очередь, коллоидные системы принято разделять на типы в зависимости от агрегатного состояния растворителя и растворенного вещества. В таблице ниже приведена их классификация. Агрегатное состояние растворителя указано по вертикали, а растворенного вещества — по горизонтали.
Дым представляет собой раствор твердых частиц углерода в воздухе.
При смешивании воды с маслом образуется еще один вид дисперсных систем — эмульсии. Как правило, они достаточно быстро расслаиваются. При необходимости в эмульсии добавляются специальные вещества-стабилизаторы.
Еще один довольно необычный пример раствора — морская пена. Причем ее можно рассматривать с двух точек зрения: как раствор воздуха в воде (на этом основано пенообразование как таковое) и как истинный водный раствор минеральных солей.
Классификация истинных растворов
Примерами истинных являются водные растворы соли, соды, сахара, уксусной кислоты и т. д. Их принято классифицировать в зависимости от концентрации растворенного вещества. По этому признаку выделяют три вида растворов в химии.
Если при данных условиях (температуре, давлении) можно растворить большее количество вещества, чем уже содержится в растворе, он называется ненасыщенным.
Насыщенный раствор содержит максимально возможное в условиях проведения эксперимента количество растворенного вещества.
Если же в растворе содержится больше вещества, чем в насыщенном, такая система называется пересыщенной. Получить ее можно при очень медленном и аккуратном охлаждении насыщенного раствора, приготовленного при более высокой температуре.
Пересыщенные растворы крайне неустойчивы. При нарушении равновесия моментально начинается процесс кристаллизации избыточно содержащегося растворенного вещества. Инициировать выпадение осадка может добавление маленького кристалла вещества, попадание инородного тела (например, пыли) или встряхивание раствора.
Классификация по степени насыщенности
Довольно распространен другой принцип разделения растворов на виды. Так, в зависимости от концентрации раствора, можно выделить два типа: разбавленные и концентрированные. Однако граница между ними весьма условна.
Разбавленный раствор характеризуется низким содержанием растворенного вещества. При этом его нельзя отождествлять с ненасыщенным.
Например, раствор, содержащий всего лишь 0,0000134 моль/л хлорида серебра, является разбавленным, так как концентрация растворенного вещества в нем очень мала. Однако при обычных условиях растворить большее количество соединения в нем невозможно, а потому такой раствор одновременно будет насыщенным.
Однако при обычных условиях растворить большее количество соединения в нем невозможно, а потому такой раствор одновременно будет насыщенным.
По физическим свойствам
Довольно часто вещества и их растворы классифицируют по способности проводить электрический ток. Ею обладают растворы веществ с ионной связью в молекулах. Под действием молекул воды эти соединения способны подвергаться электролитической диссоциации на ионы. Такие вещества и их растворы получили название электролитов. Примеры электролитов: растворы хлорида натрия, серной кислоты, бромида калия.
Органические вещества, как правило, находятся в растворе в виде нейтральных молекул или же малодиссоциированы. Такие системы не способны проводить ток и называются неэлектролитами.
Таким образом, классификация растворов обширна и разнообразна. Тип ее выбирается в зависимости от конкретных целей.
Types of Solutions — Solution in Chemistry
Дата последнего обновления: 29 марта 2023 г. , так как они присутствуют во всех обычных вещах, которые вы обычно используете в своей повседневной жизни, таких как газировка, дезодорант, который вы наносите, сахар, соль и т.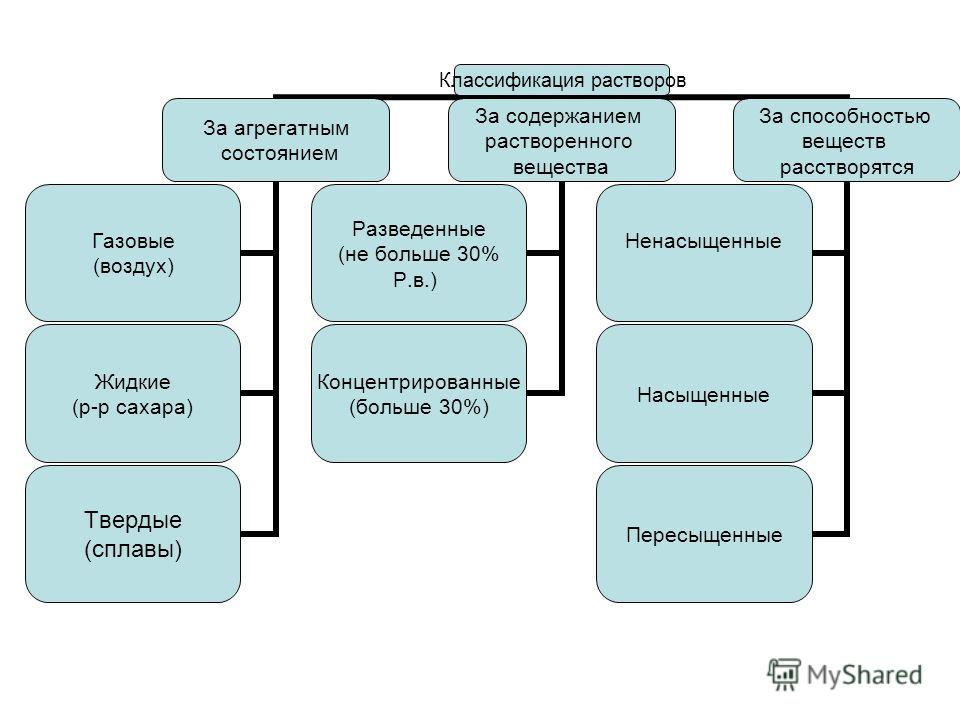 д., являются некоторыми общими примерами Решений. По сути, раствор — это тип смеси, в которой два или более вещества смешиваются вместе, образуя единый раствор; мы также можем сказать, что это просто и может изменить или не изменить их соответствующие свойства.
д., являются некоторыми общими примерами Решений. По сути, раствор — это тип смеси, в которой два или более вещества смешиваются вместе, образуя единый раствор; мы также можем сказать, что это просто и может изменить или не изменить их соответствующие свойства.
Компоненты раствора
Два компонента — растворитель и растворитель объединяются, образуя любой раствор в гомогенной смеси. Растворенное вещество – это вещество, состоящее из меньшего количества раствора, которое растворяется в растворителе, который присутствует в большем количестве, чем растворенное вещество. Состояние растворителя обычно определяет конечное состояние гомогенных растворов, хотя состояние растворенного вещества не имеет никакого значения в растворе, если оно растворимо в растворителе.
(Изображение будет загружено в ближайшее время)
Классификация растворов
Вещество в основном можно классифицировать как элементы, соединения, смеси, но раствор относится только к смесям. По характеру компонентов смеси можно разделить на два типа: гомогенные и гетерогенные смеси. Гомогенную смесь также можно назвать раствором. Смесь, имеющая компоненты любого состояния, которые проявляют одинаковые свойства во всем данном образце, известна как гомогенная смесь. Гетерогенными являются просто любые смеси, не основанные на едином составе.
По характеру компонентов смеси можно разделить на два типа: гомогенные и гетерогенные смеси. Гомогенную смесь также можно назвать раствором. Смесь, имеющая компоненты любого состояния, которые проявляют одинаковые свойства во всем данном образце, известна как гомогенная смесь. Гетерогенными являются просто любые смеси, не основанные на едином составе.
Примерами гомогенных растворов являются чашка кофе, духи, соль или сахар в воде и т. д., а примерами гетерогенных растворов являются раствор масла и воды, раствор песка и воды, раствор мелового порошка , и вода и т. д. Вещества, имеющие одну и ту же однородную фазу по всем свойствам, называются вполне смешивающимися друг с другом, если же вещества нерастворимы друг в друге, то их называют несмешивающимися. Примером смешиваемого вещества является этанол и вода, а примером несмешиваемого вещества является масло и вода.
Характеристики растворов
Характеристики растворов могут быть сформулированы следующим образом:
Раствор представляет собой гомогенную смесь двух или более веществ.

После образования раствора растворенное вещество не может быть отделено от раствора с помощью процесса фильтрации.
Луч света не должен проходить через раствор.
Человеческий глаз не может видеть частицы растворенного вещества внутри раствора.
Раствор стабилен и состоит только из одной фазы.
Формирование раствора: физический процесс
Сочетание растворенного вещества и растворителя для образования раствора является физическим, а не химическим процессом. Растворенное вещество и растворитель могут быть извлечены обратно с помощью методов разделения в химически неизменной форме, что можно показать на следующем примере растворения твердого нитрата цинка в воде с образованием водного раствора нитрата цинка.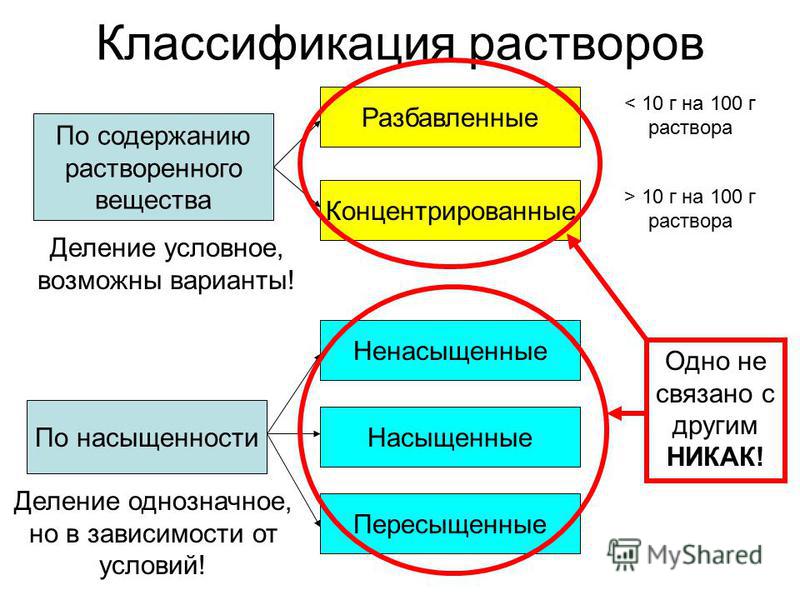
Zn(NO 3 ) 2 (т) + H 2 O(ж) Zn 2+ (водн.) + 2NO 3 — (водн.) 90 В приведенной выше реакции Zn(NO 3 ) 2 можно легко восстановить с помощью процесса выпаривания (выпаривания воды). Итак, мы можем сказать, что диссипация растворенного вещества в растворителе с образованием раствора не включает в себя химический процесс.
Типы растворов
Существуют различные типы растворов, которые можно классифицировать по разным основаниям, таким как разница в растворенном веществе и растворителе, количество критериев и т. д., которые можно показать следующим образом:-
1. Различные типы растворов на основе воды в качестве растворителя
Растворы можно разделить на два типа в зависимости от того, является раствор водой или нет.
Водный раствор
Раствор, в котором любое гомогенное соединение полностью растворяется в воде, в котором вода выступает в качестве растворителя. Примерами таких растворов являются сахар/соль в воде, углекислый газ в воде.
Примерами таких растворов являются сахар/соль в воде, углекислый газ в воде.
Неводный раствор
Эти растворы в основном противоположны водному раствору, так как доступный в них растворитель не является водой; это может быть что угодно, например, бензин, бензол, эфир и т. д. Примеры такого рода растворов включают фенолфталеин в бензоле, серу в сероуглероде и т. д.
2. Различные типы растворов в зависимости от количества добавленного растворенного вещества
Растворы можно разделить на три типа в зависимости от количества растворенного вещества, присутствующего в растворе.
Насыщенные растворы
Раствор считается насыщенным только в том случае, если он достигает своего предела растворения любого другого растворенного вещества в растворителе при определенной температуре.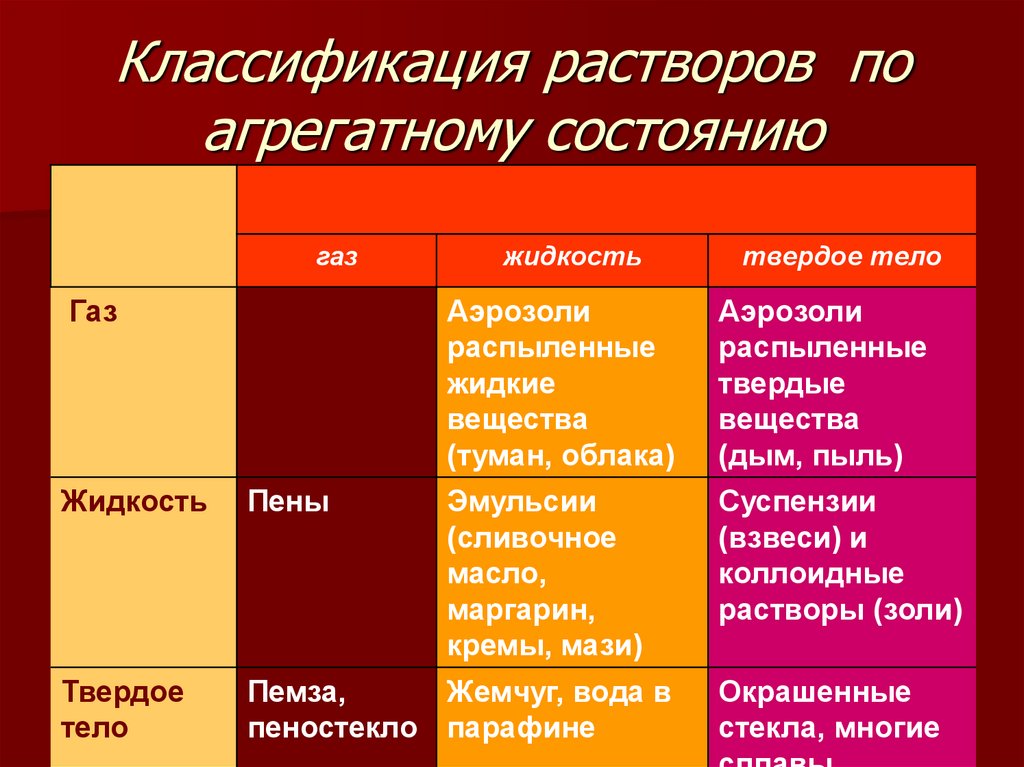
Ненасыщенные растворы
Если раствор еще может растворять больше растворенного вещества в растворителе, то говорят, что это ненасыщенный раствор.
Пересыщенные растворы
Раствор, в котором растворенное вещество присутствует в избыточном количестве и принудительно растворяется в растворителе за счет повышения температуры, называется перенасыщенным раствором. Эти избыточные частицы растворенного вещества позже обнаруживаются в виде кристаллов с помощью процесса кристаллизации.
3. Различные типы растворов в зависимости от количества добавленного растворителя
Растворы можно разделить на два типа в зависимости от количества растворителя, присутствующего в растворе.
Концентрированные растворы
К данному растворителю добавляют большое количество растворенного вещества для получения концентрированных растворов.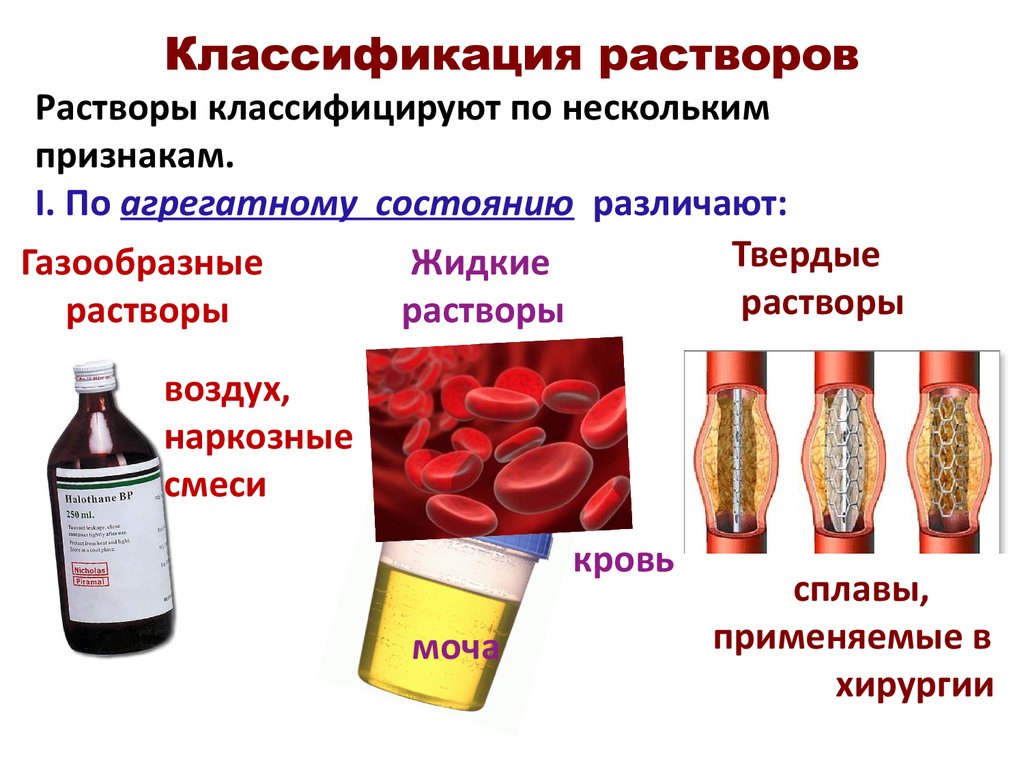
Разбавленные растворы
Раствор, содержащий небольшое количество растворенного вещества в большом количестве растворителя, называется разбавленным раствором.
4. Различные типы растворов в зависимости от количества концентрации растворенного вещества в двух растворах
Растворы можно разделить на три типа в зависимости от концентрации растворителя в двух растворителях (в стакане и ячейке в нем) в растворе.
Гипертонические растворы
Гипертонические растворы – это такие типы растворов, в которых концентрация растворенного вещества в стакане выше, чем в клетке, поэтому вода выходит из клетки, вызывая плазмолиз/сжатие клетки .
Гипотонические растворы
Гипотонические растворы — это такие растворы, в которых концентрация растворенного вещества в стакане меньше по сравнению с клеткой, поэтому вода будет перемещаться в клетку, заставляя ее набухать и впоследствии лопаться.
Изотонические растворы
Эти изотонические растворы имеют одинаковую концентрацию растворенного вещества как в стакане, так и в ячейке, поэтому вода будет двигаться вокруг ячейки в обоих направлениях.
Растворы можно отличить по их способности проводить электрический ток, так как те растворы, которые содержат молекулы, называются непроводниками, а те растворы, которые содержат ионы, известны как проводники.
Вещества, растворяющиеся в воде и распадающиеся на ионы, называются электролитами, а вещества, растворяющиеся в воде, но не образующие ионов, называются неэлектролитами. Эти ионообразующие вещества, которые проводят электрический ток в растворах, известные как электролиты, можно далее разделить на сильные электролиты и слабые электролиты.
Сильный электролит
Сильные электролиты доступны только в виде ионов, так как это заставляет лампочку ярко светиться на приборе проводимости (который используется для проверки электрического тока в растворе). NaCl является хорошим примером сильного электролита.
NaCl является хорошим примером сильного электролита.
Слабый электролит
Растворы, содержащие лишь несколько ионов, известны как слабые электролиты, из-за чего лампочка на приборе для измерения проводимости тускло светится. Слабые кислоты и основания являются хорошими примерами слабых электролитов.
Examples of solutions
Some Examples of the Solutions are Listed Below
S. No | Solute | Solvent | Referred Name of the Solution | Пласт | |
1 | Газ | Жидкость 9 | 3 | 130213 | Whipped cream |
2 | Liquid | Liquid | Emulsion | Mayonnaise | |
3 | Liquid | Solid | Гель | Желатин | |
4 | Твердый | 0 Твердый0003Solid Solution | Cranberry Glass | ||
5 | Solid | Gas | Solid Aero solution | Smoke |
Summary
Раствор представляет собой смесь двух или более веществ, которую называют гомогенной.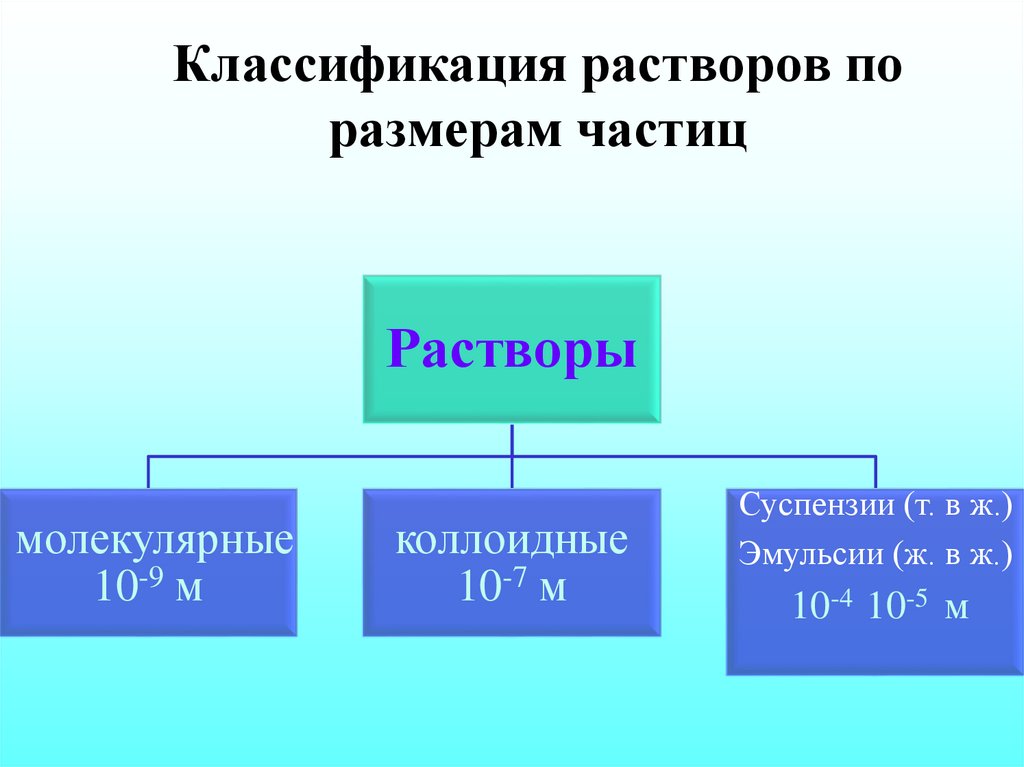 Любое состояние вещества (твердое, жидкое или газообразное) может выступать как растворителем, так и растворенным веществом при создании раствора. В результате существует девять различных типов растворов в зависимости от физического состояния растворенного вещества и растворителя.
Любое состояние вещества (твердое, жидкое или газообразное) может выступать как растворителем, так и растворенным веществом при создании раствора. В результате существует девять различных типов растворов в зависимости от физического состояния растворенного вещества и растворителя.
Классификация растворов — A Plus Topper
Решения бывают трех типов.
- True Solutions
- Suspension
- Colloids
1. True Solutions :
A solution is a homogeneous mixture of two or более чистые вещества. Раствор состоит из двух частей: растворенного вещества и растворителя. Обычно тот компонент, который присутствует в большем количестве, называют растворителем, а другой – растворенным.
Исх. В случае раствора сахара и воды сахар является растворенным веществом, а вода – растворителем.
Водные растворы
Растворы, полученные путем растворения различных веществ в воде, называются водными растворами.
Свойства растворов
- Раствор по своей природе гомогенен.
- Частицы растворенного вещества в растворе легко проходят через фильтровальную бумагу. Таким образом, истинный раствор проходит через фильтровальную бумагу.
- Частицы растворенного вещества в растворе не видны невооруженным глазом.
- Свойства растворенного вещества сохраняются в истинном растворе. Таким образом, раствор сахара имеет сладкий вкус, а раствор соли в воде имеет солоноватый вкус.
- Истинный раствор не рассеивает свет и, следовательно, не проявляет эффекта Тиндаля. Другими словами, растворы прозрачны для света.
- Частицы растворенного вещества в растворе не оседают при хранении.
- Диаметр частиц растворенного вещества в растворе около 10–9м.
Типы растворов
- Раствор твердого тела в твердом: Металлические сплавы представляют собой растворы твердых тел в твердых телах.

Пример. Латунь представляет собой раствор цинка в меди. Латунь получают смешиванием расплавленного цинка с расплавленной медью и охлаждением их смеси. - Раствор твердого вещества в жидкости: Это наиболее распространенный тип растворов. Раствор сахара и раствор соли представляют собой растворы твердых веществ в жидкости. Раствор йода в спирте, называемый «настойкой йода», также является раствором типа «твердое вещество в жидкости». Это потому, что он содержит твердое вещество (йод), растворенное в жидком (спиртовом) растворе.
- Раствор жидкости в жидкости: Уксус представляет собой раствор уксусной кислоты (этановой кислоты) в воде.
- Раствор газа в жидкости: Газированная вода представляет собой раствор углекислого газа в воде.
- Раствор газа в газе: Воздух представляет собой раствор газов, таких как кислород, аргон, углекислый газ, водяной пар и т.
 д., в газообразном азоте. Азот является растворителем в воздухе, а все остальные газы являются растворенными веществами.
д., в газообразном азоте. Азот является растворителем в воздухе, а все остальные газы являются растворенными веществами.
2. Суспензии:
Суспензия представляет собой гетерогенную смесь, в которой мелкие частицы твердого вещества распределены по всей жидкости, не растворяясь в ней.
Пример. Смесь меловой воды, Мутная вода, Молоко магнезии, Частицы песка, взвешенные в воде, и Мука в воде.
Свойства суспензий
- Суспензия представляет собой гетерогенную смесь.
- Частицы суспензии не проходят через фильтровальную бумагу. Следовательно, их можно разделить обычной фильтрацией.
- Частицы взвеси можно увидеть невооруженным глазом или с помощью простого микроскопа.
- Частицы суспензии оседают, если суспензию не трогать. Таким образом, подвеска неустойчива.
- Размер частиц в суспензии более 100 нм в диаметре.
- Суспензия непрозрачна для света.

