Бактерии устойчивы к антибиотикам. Что делать? Не принимать антибиотики
Автор фото, Getty Images
Ученые разрабатывают новый вид антибиотиков, который уже показал обнадеживающие результаты в первых испытаниях. Необходимость в новых лекарствах остра как никогда, если учесть, что укрепляющаяся резистентность бактерий к антибиотикам представляет серьезную угрозу.
Когда в 1940-х годах начали использовать антибиотики, их называли чудо-лекарством. Но сейчас существуют опасения, что из-за их слишком частого применения бактерии выработали устойчивость к препаратам.
Главный врач Великобритании Салли Дэвис заявила, что если антибиотики перестанут работать, медицина по сути дела скатится в средневековье. Но в чем первопричина проблемы?
Что такое антибиотики
Шотландский химик Александр Флемминг изобрел первый настоящий антибиотик в 1928 году.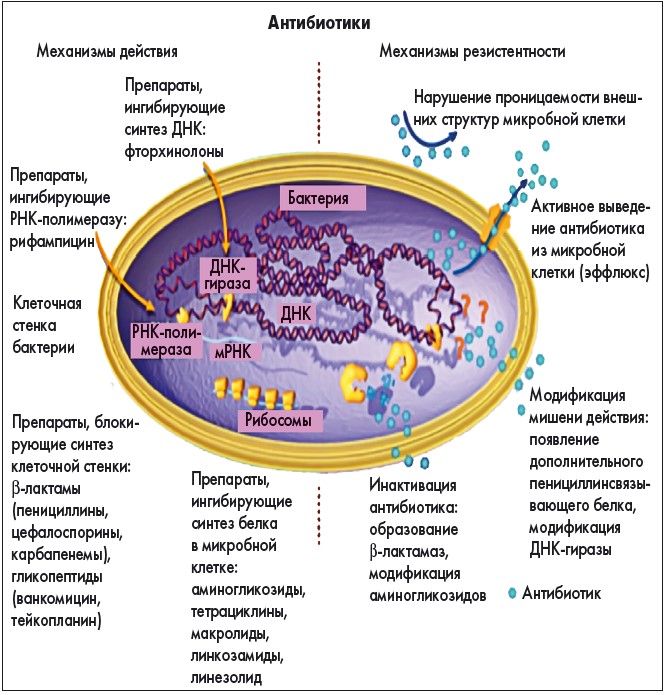 Произошло это практически случайно — в ходе опытов он выяснил, что плесень препятствует росту бактерий. Так появился пенициллин.
Произошло это практически случайно — в ходе опытов он выяснил, что плесень препятствует росту бактерий. Так появился пенициллин.
Его открытие стало революционным в лечении определенных видов инфекционных заболеваний и помогло спасти бессчетное число людей.
Антибиотики воздействуют на бактерии по-разному: в одних случаях они их уничтожают, в других не дают им распространяться.
Но есть у этих препаратов и слабая сторона.
Резистентность
Антибиотики эффективно нейтрализуют многие виды бактерий, но не все. Некоторые виды бактерий вырабатывают гены, которые защищают их от воздействия лекарств.
Они выживают при лечении и размножаются, передавая потомству свои гены, из-за чего в дальнейшем эффективность медицинских препаратов снижается.
Если человек заражается такими бактериями, устойчивыми к антибиотикам, лечить его лекарствами становится сложнее.
В настоящий момент могут прийти на помощь другие существующие виды антибиотиков, но вариантов становится все меньше, поскольку бактерии приспосабливаются и вырабатывают сопротивляемость к все большему количеству препаратов.
За последние четыре года в Англии количество случаев заражения передающимися через кровь инфекциями с устойчивостью к антибиотикам увеличилось на 35%. Это стало известно во многом благодаря тому, что медики начали активнее выявлять случаи сепсиса.
Но, несмотря на увеличение случаев таких инфекций, соотношение между передающимися через кровь инфекциями с устойчивостью к антибиотикам и инфекциями, поддающимися лечению, осталась на прежнем уровне.
Специалисты в области здравоохранения считают, что нужно приложить все усилия, чтобы не позволять бактериям с устойчивостью к антибиотикам превалировать над другими.
В ходе недавнего исследования ученые выяснили, что без эффективных антибиотиков случаев заражения опасными для жизни инфекциями во время клинических операций может стать больше.
Служба общественного здравоохранения Англии с 2013 года активно призывает сократить объемы антибиотиков, прописываемых пациентам.
Врачи утверждают, что слишком частое употребление антибиотиков является главной причиной появления устойчивости к ним у микроорганизмов. Чем чаще люди прибегают к антибиотикам, тем ниже становится их эффективность.
Нередко врачи прописывают антибиотики пациентам, которые не заражены бактериальными инфекциями, хотя это абсолютно бесполезно.
В целом уровень потребления антибиотиков по Британии с 2013 года снизился примерно на 5%, но данные отличаются в зависимости от региона.
Чем активнее врачи выписывают для лечения антибиотики, тем более высокая устойчивость к ним бактерий.
Автор фото, Getty Images
Подпись к фото,Зачастую врачи прописывают антибиотики пациентам, которые на заражены бактериальными инфекциями, хотя это абсолютно бесполезно.
Когда пациенты приходят в свои поликлиники с жалобой на кашель или простуду, примерно половине прописывают лечение антибиотиками.
Есть опасения, что проблема усугубляется из-за ожиданий пациентов.
По последним данным, 38% пациентов, обращаясь за медицинской помощью, предполагают, что их будут лечить антибиотиками.
Поэтому сейчас в Британии не только пытаются в целом сократить объем выписываемых антибиотиков, но и создать условия, при которых клиники не будут пытаться лечить ими пациентов с заболеваниями, которые проходят естественным образом через несколько дней.
Как обстоят дела в других странах?
Излишнее использование антибиотиков присуще не только Британии.
Европейская сеть по контролю за потреблением антимикробных средств назвала распространение устойчивых к антибиотикам бактерий угрозой здоровью населения.
По приблизительной оценке, каждый год в Европе от связанных с ними инфекций умирают около 25 тыс. человек.
На сегодняшний день потребление антибиотиков в Британии ниже среднего по сравнению с другими странами ЕС.
Многие страны с высоким потреблением антибиотиков обращаются за опытом к другим странам, особенно на севере Европы, где их потребление ниже.
Особо серьезные опасения вызывает лекарственно устойчивый туберкулез.
По данным Всемирной организации здравоохранения (ВОЗ), туберкулез остается самым смертельным инфекционным заболеванием в мире.
Но даже с учетом снижения коэффициента заболеваемости в мире на 2% в год инфекция остается в первой десятке основных причин смерти в мире.
1,6 млн примерное количество человек, умерших от туберкулеза в 2017
47% пациентов, зараженных туберкулезом с множественной лекарственной устойчивостью, живут в Китае, Индии и России.
Getty
В 2017 году 10 млн человек заболели туберкулезом, 1,6 млн из них в итоге скончались. Большинство — в развивающихся странах.
По информации ВОЗ, у 490 тыс. больных туберкулез с множественной лекарственной устойчивостью. В этом случае бактерии не реагируют на лечение двумя мощными препаратами — изониазидом и рифампицином — которыми в первую очередь лечат эту инфекцию.
Туберкулез с множественной лекарственной устойчивостью вылечить можно с помощью противотуберкулезных препаратов второго ряда. Но этот вариант лечения может быть долгим и дорогостоящим.
Что ждет в будущем
В последний раз новый класс антибиотиков был разработан 30 лет назад.
Бактерии развили резистентность ко всем существующим видам.
Производство антибиотиков — дело затратное, и от разработки до внедрения проходит немалый срок.
В результате общемировое снижение производительности труда обойдется глобальной экономике в 100 трлн долларов.
Поэтому организации здравоохранения в разных странах призывают врачей и больных перестать злоупотреблять антибиотиками.
Описание резистентности
Статья, описывающая феномен устойчивости к антибиотикам
Значения минимальной подавляющей концентрации (МПК) описывают восприимчивость конкретной бактерии к определенному антибиотику. Если концентрация антибиотика, необходимая для ингибирования роста, превышает определенный уровень – пограничное значение, то рассматриваемый антибиотик становится бесполезным в качестве терапевтического средства, поскольку пограничное значение означает максимальную дозу этого антибиотика, которую можно безопасно назначать пациентам. Более высокие дозы, даже если они могут быть эффективными на чашке с агаром в лаборатории, будут опасны для пациента. Пограничное значение – это разделительная черта между чувствительной или резистентной к антибиотику бактерией. Обычно медицинские микробиологические лаборатории делают заключение о бактериях, как о чувствительных или устойчивых к антибиотику, даже если были сделаны более точные измерения, такие как размер зоны вокруг диска антибиотика или МПК.Был разработан набор терминов для описания бактерий, резистентных к ряду не связанных между собой классов антибиотиков. Эта классификация связана с увеличением числа классов антибиотиков, к которым резистентны бактерии, от мультирезистентных (MDR), обладающих чрезвычайно высокой резистентностью (XDR) до панрезистентных микроорганизмов (PDR). Взаимосвязь между этими классами бактерий проиллюстрирована на диаграмме Венна ниже с определениями для каждого из них.Примечание:MDR (мультирезистентные штаммы) Нечувствительность как минимум к одному препарату трех и более классов антибиотиков;XDR (чрезвычайно-резистентные штаммы) Нечувствительность как минимум к одному препарату во всех классах антибиотиков, кроме двух или менее классов;PDR (панрезистентные штаммы) Нечувствительность ко всем классам антимикробных препаратов.
Более высокие дозы, даже если они могут быть эффективными на чашке с агаром в лаборатории, будут опасны для пациента. Пограничное значение – это разделительная черта между чувствительной или резистентной к антибиотику бактерией. Обычно медицинские микробиологические лаборатории делают заключение о бактериях, как о чувствительных или устойчивых к антибиотику, даже если были сделаны более точные измерения, такие как размер зоны вокруг диска антибиотика или МПК.Был разработан набор терминов для описания бактерий, резистентных к ряду не связанных между собой классов антибиотиков. Эта классификация связана с увеличением числа классов антибиотиков, к которым резистентны бактерии, от мультирезистентных (MDR), обладающих чрезвычайно высокой резистентностью (XDR) до панрезистентных микроорганизмов (PDR). Взаимосвязь между этими классами бактерий проиллюстрирована на диаграмме Венна ниже с определениями для каждого из них.Примечание:MDR (мультирезистентные штаммы) Нечувствительность как минимум к одному препарату трех и более классов антибиотиков;XDR (чрезвычайно-резистентные штаммы) Нечувствительность как минимум к одному препарату во всех классах антибиотиков, кроме двух или менее классов;PDR (панрезистентные штаммы) Нечувствительность ко всем классам антимикробных препаратов. Диаграмма, адаптированная из статьи Magiorakos et al. «Мультирезистентные, бактерии, обладающие чрезвычайно высокой резистентностью и панрезистентные бактерии: международное экспертное предложение классификации определений приобретенной резистентности». Эта статья доступна в формате pdf для загрузки ниже.
Диаграмма, адаптированная из статьи Magiorakos et al. «Мультирезистентные, бактерии, обладающие чрезвычайно высокой резистентностью и панрезистентные бактерии: международное экспертное предложение классификации определений приобретенной резистентности». Эта статья доступна в формате pdf для загрузки ниже.Резистентность к антибиотикам в свиноводстве: частые вопросы (1 из 2) — Статьи
Что такое антимикробная резистентность, почему и как она возникает?
Резистентность к антибиотикам – это явление, благодаря которому на бактерии не влияет летальное или ингибирующее воздействие антимикробной молекулы. Этот процесс происходит регулярно в природе в течение тысяч лет: антибиотики производятся бактериями и грибами в природе с целью устранения конкуренции в конкретной экологической нише.
Бактерии, которые контактируют с этими антибиотиками, разрабатывают механизмы, чтобы противостоять им, позволяя им колонизировать места с питательными веществами и малым числом конкурентов.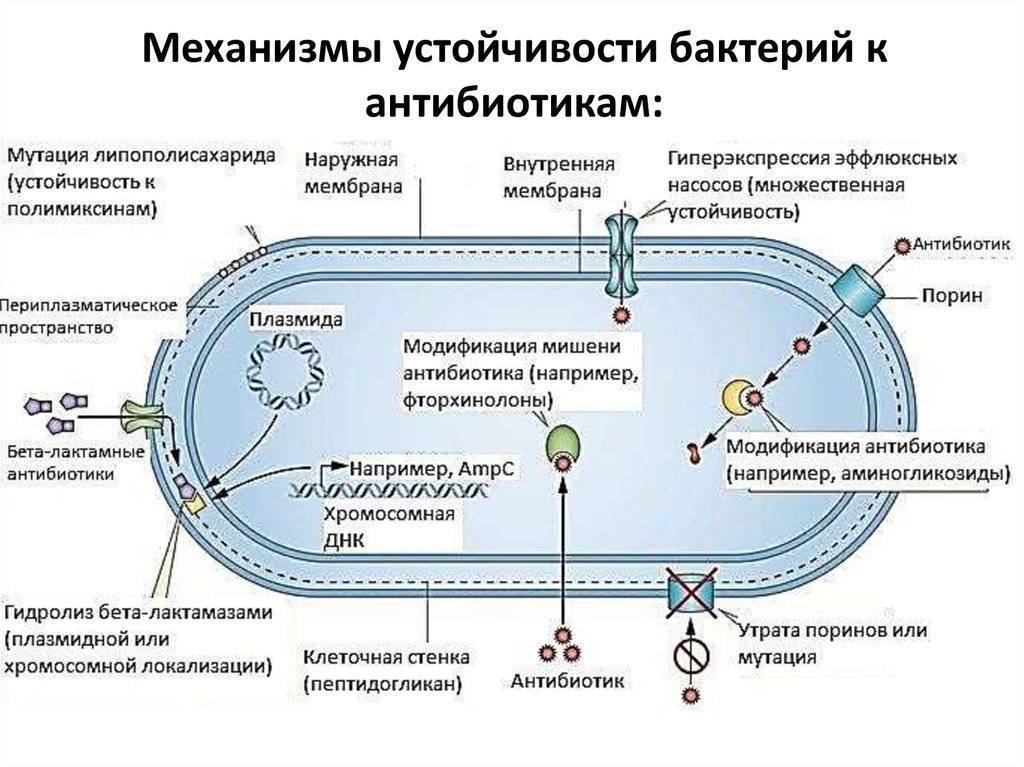
Большинство антибиотиков, используемых как в медицине человека, так и в ветеринарной медицине, происходят из природы от этих соединений, и это всего лишь вопрос времени, чтобы клиническое использование антибиотиков позволяло выбирать эти очень эффективные механизмы сопротивления, созданные природой.
Передается ли резистентность к антибиотикам между различными типами бактерий?
Да, и это одна из главных проблем. В общем, бактерии имеют три способа противодействовать воздействию антибиотиков: путем изменения мишени антибиотика, путем разрушения антибиотика или путем вытеснение антибиотика наружу. Как правило, эти механизмы сопротивления могут передаваться как по вертикали, так и по горизонтали, что означает, что они могут передаваться как следующим поколениям, так и другим бактериям того же или другого вида.
Могут ли одни и те же бактерии быть устойчивыми к нескольким антибиотикам?
Бактерии способны аккумулировать резистентные механизмы в отношении нескольких антибиотиков. Это происходит главным образом в местах с большим уровнем присутствия антибиотиков, таких как больницы или, в некоторой степени, животноводческие фермы. В такой среде бактерии должны развиваться, чтобы выжить, поэтому они адаптируются и приобретают резистентные гены из окружающей среды. Примером этого в условиях ферм являются бактерии из окружающей среды или бактерии, присутствующие в микробиоте животных, которые, возможно, недавно были определены в стада.
Это происходит главным образом в местах с большим уровнем присутствия антибиотиков, таких как больницы или, в некоторой степени, животноводческие фермы. В такой среде бактерии должны развиваться, чтобы выжить, поэтому они адаптируются и приобретают резистентные гены из окружающей среды. Примером этого в условиях ферм являются бактерии из окружающей среды или бактерии, присутствующие в микробиоте животных, которые, возможно, недавно были определены в стада.
Без сомнений. Поскольку это естественный защитный механизм против естественных антимикробных молекул, резистентные гены обнаруживаются во всех экологических нишах. Кроме того, распространение резистентных генов является глобальной проблемой, поскольку использование антибиотиков или их присутствие в окружающей среде привело к позитивному отбору бактерий с этими генами. В сегодняшнем мире, где человек, животное, еда или материал могут легко перемещаться с одного места на другое за тысячи километров в течение нескольких часов, не являются нереалистичными мысли, и даже доказано, что резистентные гены распространяются так легко.
Как может антимикробная резистентность быть измерена/ оценена?
Уровень антимикробной резистентности можно измерить с использованием нескольких методов. Классические методы, такие как определение антимикробной активности посредством диффузии и метод микроразведений, позволяют нам, когда выделен возбудитель, определить антибиотики, к которым он устойчив или чувствителен, и знать его уровень резистентности. Эти методы, широко используемые в медицине человека, должны быть в значительной степени реализованы в области ветеринарии, так как они имеют высокий уровень рентабельности.
С другой стороны, современные методы молекулярной биологии позволяют нам знать уровень резистентности в более широких пределах. В настоящее время наша лаборатория является частью самого важного европейского проекта ветеринарной медицины для борьбы с резистентностью к антибиотикам в пищевой цепи под названием EFFORT (Мониторинг экологии антимикробной резистентности от фермы до стола потребителя).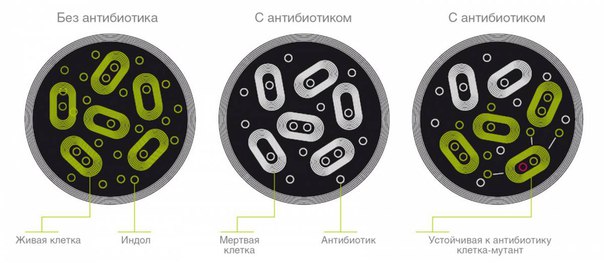 Этот проект осуществляется согласованным образом в 10 странах Европейского Союза, где были взяты образцы на всех уровнях, начиная от животноводческих хозяйств (свиноводческих хозяйств, птицеводческих хозяйств, хозяйств по выращиванию индеек, форели и крупного рогатого скота мясного направления) до бойни и розничных продавцов. Благодаря этому проекту мы сможем узнать уровень антимикробной резистентности в Европе, начиная от фермы и до стола.
Этот проект осуществляется согласованным образом в 10 странах Европейского Союза, где были взяты образцы на всех уровнях, начиная от животноводческих хозяйств (свиноводческих хозяйств, птицеводческих хозяйств, хозяйств по выращиванию индеек, форели и крупного рогатого скота мясного направления) до бойни и розничных продавцов. Благодаря этому проекту мы сможем узнать уровень антимикробной резистентности в Европе, начиная от фермы и до стола.
Классические методы для оценки антимикробной резистентности. Рисунок с левой стороны показывает Е-TEST для измерения минимальной концентрации антибиотика, который предотвращает бактериальный рост. Правая сторона показывает тест на определение чувствительности микроорганизмов к антимикробным препаратам с различными зонами подавления роста, вызванными действием антибиотиков.
Бактерии научились приобретать устойчивость к антибиотикам в два шага
Движение двух фронтов бактериальных колоний навстречу друг другу. В центре концентрация антибиотика максимальная.
В центре концентрация антибиотика максимальная.
Michael Baym et al., Science
С самого первого применения пенициллина и до наших дней
бактерии усердно эволюционируют в сторону невосприимчивости к антибиотикам, а
ученые непрерывно придумывают, что этому противопоставить. К несчастью, пока человечество
скорее проигрывает в этой борьбе.
К несчастью, пока человечество
скорее проигрывает в этой борьбе.
К лекарственной устойчивости можно прийти разными путями — приобрести молекулярный насос, выкачивающий молекулы антибиотика из клетки, научиться заблаговременно разрушать их, переделать до неузнаваемости мишень, на которую направлено действие препарата или, например, подставить антибиотику «ложные цели», как это научился делать золотистый стафилококк. В любом случае, для человечества результат закономерен — снижение эффективности лекарств, а в конце концов — полная их бесполезность в пока еще некоторых случаях.
Известно, что для бактерий приобретение резистентности не единственный
способ выживания — существует еще толерантность, подразумевающая «замирание» микроорганизма, при котором он не может расти и размножаться, но и не умирает. Попав в благоприятную среду,
бактерии не сразу переходят к экспоненциальному росту — ему предшествует
латентная фаза, когда микробы обживаются на новом месте. Некоторые антибиотики,
например ампициллин, препятствуют строительству клеточной стенки бактерий, то
есть действуют только в фазу активного роста. А значит микроорганизмам ради спасения не
обязательно изобретать способы борьбы с лекарством — достаточно просто задержаться
в латентной фазе и потом продолжить беззаботное существование. В основе обоих путей
борьбы с антибиотиками лежат мутации, но толерантность позволяет лишь переждать
неблагоприятные условия, а резистентность — справиться с ними раз и навсегда.
Некоторые антибиотики,
например ампициллин, препятствуют строительству клеточной стенки бактерий, то
есть действуют только в фазу активного роста. А значит микроорганизмам ради спасения не
обязательно изобретать способы борьбы с лекарством — достаточно просто задержаться
в латентной фазе и потом продолжить беззаботное существование. В основе обоих путей
борьбы с антибиотиками лежат мутации, но толерантность позволяет лишь переждать
неблагоприятные условия, а резистентность — справиться с ними раз и навсегда.
Единого мнения о том, как именно на эволюцию резистентности влияют толерантные штаммы, у научного сообщества до сих пор нет.
Чтобы разобраться в этом вопросе, ученые
взяли кишечную палочку и устроили эволюцию в лабораторном масштабе. Для этого культуры
помещали в питательную среду с высокой, но сопоставимой с терапевтическими
дозами концентрацией ампициллина. Через 4,5 часа клетки возвращали в среду с небольшой,
в сто раз меньшей, концентрацией антибиотика, где они восстанавливались и
нарастали в течение ночи. Затем клетки ночной культуры снова высевали на среду
с высокой концентрацией и повторяли цикл до тех пор, пока у бактерий не
выработалась резистентность.
Затем клетки ночной культуры снова высевали на среду
с высокой концентрацией и повторяли цикл до тех пор, пока у бактерий не
выработалась резистентность.
Эффект от возникших толерантных мутаций оценивали по проценту колоний, находившихся в латентной фазе дольше 4,5 часов, а эффект резистентных — по минимальной концентрации антибиотика, ингибирующей рост бактерий (МИК).
В результате, когда ученые добились резистентности, МИК оказалась по меньшей мере в семь раз выше по сравнению со значением для обычных популяций. Последующий геномный анализ устойчивых культур показал, что все они приобрели усиливающие экспрессию мутации промоторной области гена ampC, который кодирует разрушающий ампициллин фермент.
При дальнейшем анализе ученые обнаружили, что
уже после 3-4 циклов эксперимента большинство бактерий даже на нормальной среде
демонстрируют отложенный рост — ту самую задержку в латентной фазе. При этом
свидетельствующая о развитии резистентности МИК начинает расти существенно
позже — между 7 и 17 циклом. Не объясненным оставалось только как именно происходит
переход между обычной популяцией и резистентной — через толерантную или
напрямую.
При этом
свидетельствующая о развитии резистентности МИК начинает расти существенно
позже — между 7 и 17 циклом. Не объясненным оставалось только как именно происходит
переход между обычной популяцией и резистентной — через толерантную или
напрямую.
Предлагаемый авторами механизм возникновения резистентной популяции на фоне толерантной. Обыкновенная популяция эволюционирует в толерантную (синяя стрелка), что способствует выживанию большего числа бактерий и служит опорой для развития резистентности (красная стрелка)
Генетический анализ показал, что обладатели резистентных мутаций в ampC несут также и мутации, приводящие к толерантности, причем последние появились раньше, а значит резистентность возникла на фоне толерантности. Более того, оказалось, что на ее фоне резистентность развивается гораздо быстрее. Причина, судя по всему,
в том, что при таком цикличном протоколе возможность возникновения и
закрепления мутаций зависит от двух ключевых моментов — вероятности возникновения мутации как таковой и вероятности того, что тот, у кого она
возникла, пережил воздействие антибиотика. К тому же приводящие к толерантности
мутации возникают чаще — хотя бы потому, что могут происходить во многих местах генома,
в то время как резистентные ограничены зоной промотора гена ampC.
Причина, судя по всему,
в том, что при таком цикличном протоколе возможность возникновения и
закрепления мутаций зависит от двух ключевых моментов — вероятности возникновения мутации как таковой и вероятности того, что тот, у кого она
возникла, пережил воздействие антибиотика. К тому же приводящие к толерантности
мутации возникают чаще — хотя бы потому, что могут происходить во многих местах генома,
в то время как резистентные ограничены зоной промотора гена ampC.Вероятно, большее число толерантных особей создает потенциал, дающий преимущество для возникновения редких резистентных мутаций. Иными словами, толерантность способствует возникновению мутаций резистентности тем, что снижает вероятность потерять их. Ученые посчитали, что при выбранной схеме эксперимента переход от обычной популяции к резистентной напрямую, минуя толерантную, состоялся бы более чем через 100 циклов (против 17, наблюдавшихся в эксперименте).
В свете новых данных механизм приобретения
полной резистентности представляется следующим образом — часто происходящие
мутации приносят в популяцию толерантность, которая более чем на порядок увеличивает
выживаемость, а следующие за ними более узконаправленные мутации в ampC существенно повышают МИК,
увеличивая выживаемость еще сильнее. Особенно важно то, что происходит это даже
при очень высоких концентрациях антибиотика — толерантность позволяет
закрепиться частичной резистентности, которая затем легко переходит в полную.
Особенно важно то, что происходит это даже
при очень высоких концентрациях антибиотика — толерантность позволяет
закрепиться частичной резистентности, которая затем легко переходит в полную.
В целом, значимая для развития резистентности роль толерантности открывает возможность использовать ее в разработке новых подходов лечения, препятствующих возникновению устойчивости.
Юрий Солюс
Патогенные бактерии все менее восприимчивы к антибиотикам | Научные открытия и технические новинки из Германии | DW
Сегодня не только почти вся одежда и электроника, но и значительная часть лекарств производится в странах с низким уровнем заработной платы — прежде всего, в Китае и Индии. К вопросам охраны окружающей среды там относятся, скажем так, менее скрупулезно, чем в Европе. В сфере фармацевтического производства это чревато особенно драматическими последствиями — например, в том, что касается резистентности патогенных бактерий к антибиотикам. Эта проблема сегодня стоит чрезвычайно остро во всем мире: медики все чаще сталкиваются со штаммами болезнетворных микроорганизмов, совершенно невосприимчивых ко многим, даже самым мощным, антибиотикам.
В сфере фармацевтического производства это чревато особенно драматическими последствиями — например, в том, что касается резистентности патогенных бактерий к антибиотикам. Эта проблема сегодня стоит чрезвычайно остро во всем мире: медики все чаще сталкиваются со штаммами болезнетворных микроорганизмов, совершенно невосприимчивых ко многим, даже самым мощным, антибиотикам.
Подвижные гены резистентности
В принципе, резистентность может возникнуть при любом контакте бактериальной популяции с антибиотиком, будь то в почве, в водоеме или в организме-хозяине. Подавляющее большинство бактерий в результате этого контакта погибает, однако случается так, что отдельные экземпляры в силу своих генетических особенностей выживают, после чего начинают стремительно размножаться, реализуя это свое селективное преимущество.
Такая ситуация крайне опасна, даже если речь идет о вполне безвредных бактериях: ведь благодаря таким процессам как трансформация, трансдукция и конъюгация, между представителями различных видов микроорганизмов возможен обмен генами и даже еще более крупными фрагментами хромосом. В результате и у возбудителей опасных для человека инфекционных заболеваний могут вдруг появиться гены, делающие их устойчивыми к воздействию антибиотиков.
В результате и у возбудителей опасных для человека инфекционных заболеваний могут вдруг появиться гены, делающие их устойчивыми к воздействию антибиотиков.
Кстати, именно поэтому врачи настоятельно предупреждают пациентов о необходимости довести единожды начатый курс лечения антибиотиками до конца, иначе «недобитые» патогены могут стать родоначальниками резистентного штамма. Совершенно ясно, что неконтролируемое распространение антибиотиков в окружающей среде рано или поздно обязательно приведет к возникновению новых штаммов бактериальных инфекционных агентов, устойчивых к воздействию антибиотиков.
Не сточные воды, а раствор антибиотиков
Именно это и делает столь опасной ситуацию, сложившуюся в Индии. «Мы наблюдаем резкое увеличение количества генов, предопределяющих резистентность, в бактериях, обитающих вблизи места сброса сточных вод фармацевтических предприятий, — говорит шведский микробиолог Андерс Янзон (Anders Janzon). — Эти гены могут стать и частью генома возбудителей опасных инфекционных заболеваний, а те со временем обязательно попадут в организм человека. То есть здесь возникла совершенно новая ситуация с резистентностью к антибиотикам, причем эта ситуация практически не поддается контролю».
То есть здесь возникла совершенно новая ситуация с резистентностью к антибиотикам, причем эта ситуация практически не поддается контролю».
Андерс Янзон его коллеги, сотрудники Гётеборгского университета, провели в Индии микробиологический и химический анализ сточных вод, сбрасываемых комплексом очистных сооружений, который обслуживает сразу 90 компаний по производству лекарственных препаратов. Результаты исследования не могут не вызывать тревогу, говорит ученый: «Содержание определенных антибиотиков в сточных водах местами в 30 раз превышает концентрации, обычно возникающие в организме больных, которых лечат этими антибиотиками. Это очень опасная ситуация, ведь она означает, что бактерии вблизи места сброса сточных вод испытывают сильнейшее селекционное давление, способствующее развитию резистентности».
Пока не будет законов…
До сих пор, правда, исследователи не смогли обнаружить прямых доказательств, подтверждающих, что высокая концентрация антибиотиков в сточных водах уже породила резистентные штаммы инфекционных бактерий. Однако Андерс Янзон уверен в том, что этот процесс имеет место и уже давно идет полным ходом: «Я полагаю, что значительная часть генов резистентности, присутствующих сегодня в геноме возбудителей инфекционных заболеваний, изначально происходят от совершенно безвредных почвенных или водных микроорганизмов. В ряде случаев нам даже удалось непосредственно наблюдать в лаборатории перенос генов резистентности от безвредных бактерий к потенциальным патогенам».
Однако Андерс Янзон уверен в том, что этот процесс имеет место и уже давно идет полным ходом: «Я полагаю, что значительная часть генов резистентности, присутствующих сегодня в геноме возбудителей инфекционных заболеваний, изначально происходят от совершенно безвредных почвенных или водных микроорганизмов. В ряде случаев нам даже удалось непосредственно наблюдать в лаборатории перенос генов резистентности от безвредных бактерий к потенциальным патогенам».
Сегодня шведские исследователи пытаются выяснить, каковы масштабы этих процессов. При этом они тесно сотрудничают с местными экологическими организациями, выступающими за введение более строгих норм при очистке сточных вод. «По закону фармацевтические компании не обязаны заботиться о решении этих проблем, — поясняет Андерс Янзон. — А анализы вроде тех, что мы проводим, обходятся довольно дорого. Так что фармацевтические концерны палец о палец не ударят, пока не будет соответствующих законов».
Конечно, повысить эффективность очистки сточных вод технически возможно, но это потребует внушительных капиталовложений. Похоже, при решении вопроса о переносе производства в Китай или Индию несовершенство природоохранного законодательства в этих странах является для крупных фармацевтических концернов ничуть не менее привлекательным фактором, чем низкий уровень зарплат и налоговые льготы.
Похоже, при решении вопроса о переносе производства в Китай или Индию несовершенство природоохранного законодательства в этих странах является для крупных фармацевтических концернов ничуть не менее привлекательным фактором, чем низкий уровень зарплат и налоговые льготы.
Автор: Владимир Фрадкин
Редактор: Ефим Шуман
Устойчивость бактерий к антибиотикам стала мировой проблемой — Российская газета
В некоторых недавних публикациях отмечается, что искусственная вентиляция легких (ИВЛ) спасает жизнь больным с тяжелой формой коронавирусной пневмонии, но угроза бактериальных осложнений при этом неизбежна. И значительная часть пациентов (в разных источниках упоминаются цифры от 30 до 65 процентов) погибает от присоединившейся бактериальной инфекции, поскольку все имеющиеся в распоряжении врачей антибиотики с ней не справляются.
Почему с каждым годом все острее становится проблема устойчивости бактерий к антибиотикам, «РГ» рассказал ректор Смоленского государственного медицинского института, главный внештатный специалист Минздрава РФ по клинической микробиологии и антимикробной резистентности, член-корреспондент РАН Роман Козлов.
Роман Сергеевич, действительно ли этим пациентам не помогают все имеющиеся в распоряжении врачей антибиотики?
Роман Козлов: Это не совсем так. Если тяжесть состояния пациента действительно обусловлена присоединением бактериальной инфекции, своевременное назначение адекватной антибиотикотерапии высокоэффективно. Подчеркиваю — именно своевременное и адекватное. Но в ряде лечебных учреждений ситуация осложняется тем, что недоступна современная микробиологическая диагностика. Где-то ее и раньше не было. А где-то она стала недоступной из-за того, что клинический материал с накоплением возбудителя от пациентов с COVID-19 может исследоваться только в лабораториях, лицензированных для работы с микроорганизмами 2-й группы патогенности (вирус SARS-CoV2 отнесен ко 2-й группе патогенности), а у большинства лабораторий такого допуска нет. Поэтому подбирать антибиотики приходится эмпирически.
В этих условиях критически важным является наличие достоверных данных о резистентности основных возбудителей к антибиотикам в конкретном регионе. Этими исследованиями занимается наш университет и функционирующий на его базе Федеральный центр мониторинга резистентности к антимикробным препаратам. Эти данные по нашей стране можно найти на ресурсе «Карта антибиотикорезистентности России» https://amrmap.ru/.
Этими исследованиями занимается наш университет и функционирующий на его базе Федеральный центр мониторинга резистентности к антимикробным препаратам. Эти данные по нашей стране можно найти на ресурсе «Карта антибиотикорезистентности России» https://amrmap.ru/.
И это действительно огромная проблема современной медицины, в том числе и отечественной.
Значит, нужны совсем новые антибиотики?
Роман Козлов: Нужны не только новые антибиотики, активные в отношении резистентных микроорганизмов, но и современная микробиологическая диагностика, позволяющая быстро и качественно выявить возбудитель инфекции и определить, к каким антибиотикам он сохраняет чувствительность. Причем даже появление новых антибиотиков ни в коей мере не снизит роль микробиологической диагностики. Совсем наоборот. Ни один из разрабатываемых в настоящее время препаратов не решит кардинально все проблемы антибиотикорезистентности. И если где-то кто-то скажет, что такой препарат изобретен, — не верьте! Новые антибиотики — это очень дорогие лекарства, поэтому некачественная диагностика приведет не только к неэффективности лечения, но и к существенным экономическим потерям.
Нужны не только новые антибиотики, но и современная микробиологическая диагностика
Чем вызывается столь быстрый рост лекарственной устойчивости — неконтролируемым приемом антибиотиков населением или неправильным их применением в лечебной практике?
Роман Козлов: К сожалению, оба ответа будут верны. Поэтому и действовать нужно комплексно, особенно в сфере образования — как медицинских специалистов, так и населения в целом. Однако жесткие ограничительные меры, штрафы, наказания не смогут коренным образом изменить ситуацию. Образование и еще раз образование! Люди должны понимать, как следует поступать правильно, и почему именно так. Только в этом случае мы можем рассчитывать на успех. С этим связана подготовка и создание совершенно новой врачебной специальности — «Медицинская микробиология», профессиональный стандарт по которой сейчас находится на заключительных стадиях обсуждения.
Все ли антибактериальные препараты, имеющиеся на мировом фармрынке, доступны в нашей стране?
Роман Козлов: К глубокому сожалению, пока нет. В США и странах Европы уже зарегистрирован целый ряд антибиотиков, на данный момент недоступных в нашей стране. Некоторые из них были бы сейчас чрезвычайно полезны. В чем тут проблема? Новые препараты не могут быть дешевыми, а ниша для применения новых антимикробных препаратов относительно невелика и требует наличия качественной микробиологической диагностики. Существующие модели здравоохранения во всех странах пока не могут обеспечить достаточный объем финансирования применения новых антибиотиков. Видимо, пришло время переосмыслить наше отношение к антимикробной терапии. Фактически лечение инфекций должно выглядеть примерно так же, как это уже сейчас происходит в онкологии — целевая терапия (в большинстве случаев очень недешевая), основанная на современной микробиологической диагностике. Другого пути просто не существует.
В США и странах Европы уже зарегистрирован целый ряд антибиотиков, на данный момент недоступных в нашей стране. Некоторые из них были бы сейчас чрезвычайно полезны. В чем тут проблема? Новые препараты не могут быть дешевыми, а ниша для применения новых антимикробных препаратов относительно невелика и требует наличия качественной микробиологической диагностики. Существующие модели здравоохранения во всех странах пока не могут обеспечить достаточный объем финансирования применения новых антибиотиков. Видимо, пришло время переосмыслить наше отношение к антимикробной терапии. Фактически лечение инфекций должно выглядеть примерно так же, как это уже сейчас происходит в онкологии — целевая терапия (в большинстве случаев очень недешевая), основанная на современной микробиологической диагностике. Другого пути просто не существует.
Какие подходы к решению этой проблемы существуют, помимо антибиотиков? Были надежды на применение молекул-бактериофагов — оправдались ли они?
Роман Козлов: Другие методы лечения бактериальных инфекций есть, но в ближайшее время они никак не смогут заменить антибиотики.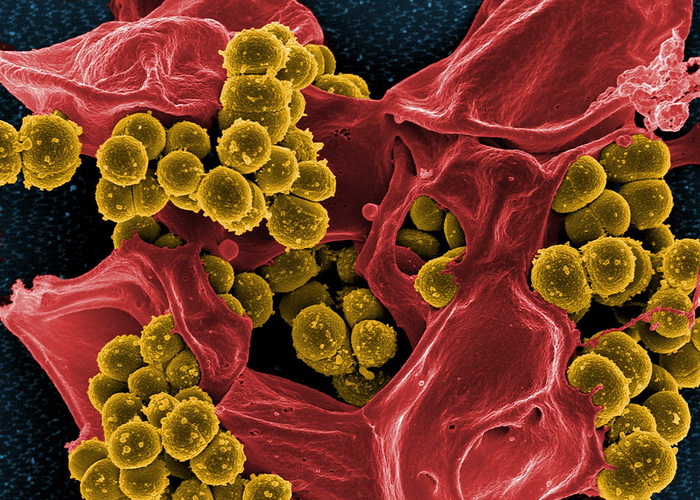 Упоминания, на мой взгляд, заслуживают три «альтернативных» направления.
Упоминания, на мой взгляд, заслуживают три «альтернативных» направления.
Начнем, конечно, с бактериофагов. На первый взгляд, эти вирусы, избирательно поражающие бактерии, выглядят крайне привлекательно как метод лечения инфекций. Но в реальности, во-первых, не существует универсально активных бактериофагов, то есть всегда существуют клоны микроорганизмов, мало восприимчивые к отдельно взятым фагам. Более того, микроорганизмы могут приобретать устойчивость к бактериофагам даже быстрее и легче, чем к антибиотикам. Проводившиеся ранее исследования не соответствуют современным стандартам клинических испытаний, в связи с чем доказательная база по клинической эффективности бактериофагов крайне недостаточна. Хотя, безусловно, в будущем бактериофаги могут стать одной из опций для терапии инфекций. Правда, скорее всего, в основном хронических, когда есть время выделить возбудитель инфекции и подобрать активный «фаговый коктейль».
А какие еще направления перспективны?
Роман Козлов: Еще одна возможная альтернатива антибиотикам — это моноклональные антитела, специфичные для конкретных возбудителей или их токсинов. Несколько таких препаратов находятся на различных стадиях клинических исследований. Но они не смогут заменить «классические» антибиотики. Кроме того, стоимость моноклональных антител также будет очень высокой.
Несколько таких препаратов находятся на различных стадиях клинических исследований. Но они не смогут заменить «классические» антибиотики. Кроме того, стоимость моноклональных антител также будет очень высокой.
И, наконец, группа препаратов, на настоящий момент представленная только одним продуктом, который находится на стадии клинических испытаний. Это липосомы (искусственно созданные микроскопические пузырьки, которые состоят из одного или нескольких слоев, разделенных между собой водной фазой, по своей структуре похожи на мембраны клеток. — Ред.). Фрагменты их стенок имитируют мишени бактериальных токсинов и, соответственно, эти токсины связывают. Но и этот препарат — не замена «классическим» антибиотикам, а дополнение к ним.
Можно ли сказать, что сокращение неконтролируемого приема антибиотиков существенно улучшит ситуацию?
Роман Козлов: Могу ответить: и да, и нет. Удручает то, что мировое сообщество, уже давно понимая вред неконтролируемого применения антибиотиков, так и не предприняло достаточных усилий для контроля ситуации.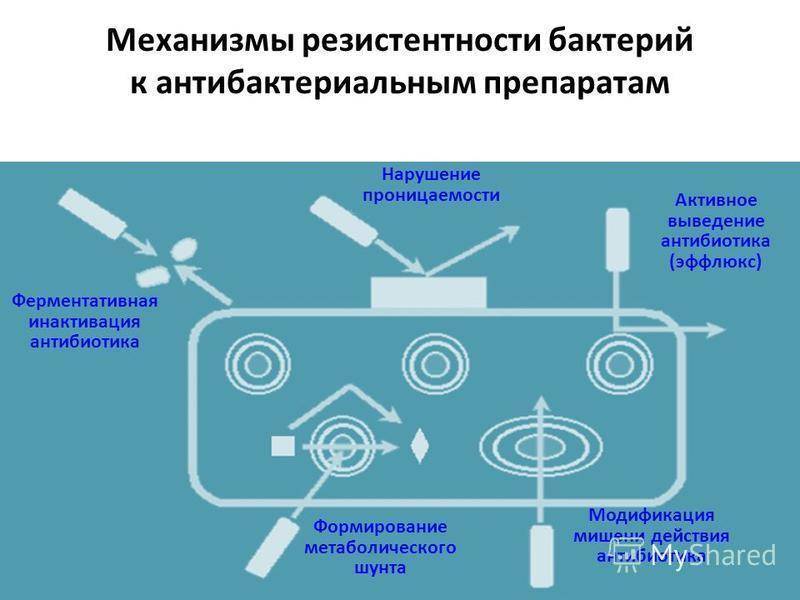 Конечно, если мы действительно серьезно, а не формально возьмемся за решение этой проблемы, ситуация улучшится. Но для этого нужны осознанные комплексные меры, включающие образование, повышение уровня микробиологической диагностики и инфекционного контроля, обеспечения современными антибиотиками. Все это, естественно, требует иного уровня финансирования. Но без этого улучшить ситуацию вряд ли возможно.
Конечно, если мы действительно серьезно, а не формально возьмемся за решение этой проблемы, ситуация улучшится. Но для этого нужны осознанные комплексные меры, включающие образование, повышение уровня микробиологической диагностики и инфекционного контроля, обеспечения современными антибиотиками. Все это, естественно, требует иного уровня финансирования. Но без этого улучшить ситуацию вряд ли возможно.
Инфографика «РГ» / Антон Переплетчиков / Татьяна Батенева
Устойчивость микробов к антибиотикам – глобальная проблема человечества
В конце апреля 2019 года ООН опубликовала поворотный по своей значимости отчет о масштабах и последствиях одной из глобальных проблем человечества – развития у опасных инфекций устойчивости (резистентности) к лекарствам, в том числе к антибиотикам. 700 тысяч человек ежегодно умирает из-за инфекций, вызванных микробами, которые стали невосприимчивыми к действию лекарственных препаратов. По прогнозам ученых, через 10 лет жертвами антибиотикорезистентности каждый год будут более 10 млн человек.
В этой статье старший научный сотрудник ФГБУ «ВГНКИ» Дмитрий Макаров рассказывает о причинах и масштабах проблемы и дает рекомендации, как избежать заражения опасными устойчивыми инфекциями.
Что такое антибиотикорезистентность?
Антибиотикорезистентность – это способность микробов противостоять действию антимикробных средств, в том числе антибиотиков. С 2000-х годов Всемирная организация здравоохранения называет антибиотикорезистентность одной из самых серьезных угроз для здоровья животных и человека.
Каждый год в мире более 700 тысяч человек умирает от инфекций, вызванных устойчивыми микробами. Для других пациентов удлиняется время госпитализации. Известный британский экономист профессор лорд Джим О’Нил прогнозирует, что через 30 лет от устойчивых микробов будет умирать уже 10 миллионов человек в год. Экономический ущерб исчисляется миллиардами долларов. Колоссальный урон наносится и отрасли животноводства.
При этом масштаб проблемы в мире неуклонно растет. В начале этого года в медицинском журнале The Lancet опубликована статья; авторы оценили, что урон для жизни и здоровья населения Европы от устойчивых инфекций с 2007 по 2015 год удвоился. Воспаление легких, дизентерия, сепсис, туберкулез, малярия – это всего лишь несколько болезней, при лечении которых врачи сталкиваются с устойчивостью возбудителей к антибиотикам.
В начале этого года в медицинском журнале The Lancet опубликована статья; авторы оценили, что урон для жизни и здоровья населения Европы от устойчивых инфекций с 2007 по 2015 год удвоился. Воспаление легких, дизентерия, сепсис, туберкулез, малярия – это всего лишь несколько болезней, при лечении которых врачи сталкиваются с устойчивостью возбудителей к антибиотикам.
Обнаруживают все больше патогенных бактерий с устойчивостью сразу к нескольким группам антибиотиков и даже так называемых ПАНРЕЗИСТЕНТНЫХ, т.е. устойчивых ко всем используемым против них препаратам. Если раньше такие бактерии находили только в больницах, то сейчас их находят даже в продуктах питания.
Как микробы становятся устойчивыми к антибиотикам?
Антибиотикорезистентность возникла и развивалась еще ДО открытия антибиотиков человеком.
Миллиарды лет бактерии вырабатывали вещества для борьбы с другими бактериями – антибиотики. Другие микроорганизмы, в свою очередь, приобретали механизмы защиты от таких соединений. Таким образом, антибиотикорезистентность – это древнее явление.
Таким образом, антибиотикорезистентность – это древнее явление.
Она всегда определяется генами и передается из поколения в поколение. Ученые нашли такие гены даже в арктической вечной мерзлоте возрастом 30 тысяч лет и в образцах кишечной микрофлоры Тирольского человека. Это найденная в Альпах мумия возрастом более 5 тысяч лет. И сейчас в окружающей среде и у диких животных устойчивые бактерии и гены устойчивости встречаются повсеместно.
Микробы становятся устойчивыми к антибиотикам либо в результате случайного изменения генов – мутаций, либо в результате передачи генов устойчивости от другого микроба, который уже обладает этим свойством. Даже если устойчивость приобрели безобидные бактерии, населяющие кишечник животных или человека, или свободные бактерии в окружающей среде – эти гены могут передаться оказавшимся рядом болезнетворным бактериям.
Если на группу бактерий (популяцию) в организме человека, животного или в окружающей среде воздействует антимикробное средство, в такой популяции выживают только устойчивые бактерии. Выиграв конкурентную борьбу, они размножаются, распространяются и передают свои гены дальше. Это явление под названием «селективное давление» и определяет опасность использования антибиотиков.
Выиграв конкурентную борьбу, они размножаются, распространяются и передают свои гены дальше. Это явление под названием «селективное давление» и определяет опасность использования антибиотиков.
Когда впервые появилась проблема?
На момент внедрения антибиотиков в практику устойчивость к ним бактерий была редким явлением. Это привело к беспрецедентному прорыву в медицине.
Однако специалисты уже тогда понимали, что долго такое благоденствие не продлится. Еще сэр Александр Флеминг, первооткрыватель пенициллина, первого антибиотика, в лекции по случаю вручения ему Нобелевской премии в 1945 году предупреждал об опасности приобретения патогенными бактериями устойчивости к пенициллину.
С учетом масштабов применения антибиотиков в животноводстве и медицине, рост и распространение устойчивости были всего лишь вопросом времени. Довольно долго ущерб от резистентности сдерживался открытием новых антибиотиков. Но если в период «антибиотикового бума» середины ХХ века в год ученые открывали десятки новых препаратов, то с начала XXI века медицина получила всего два новейших класса антибактериальных препаратов.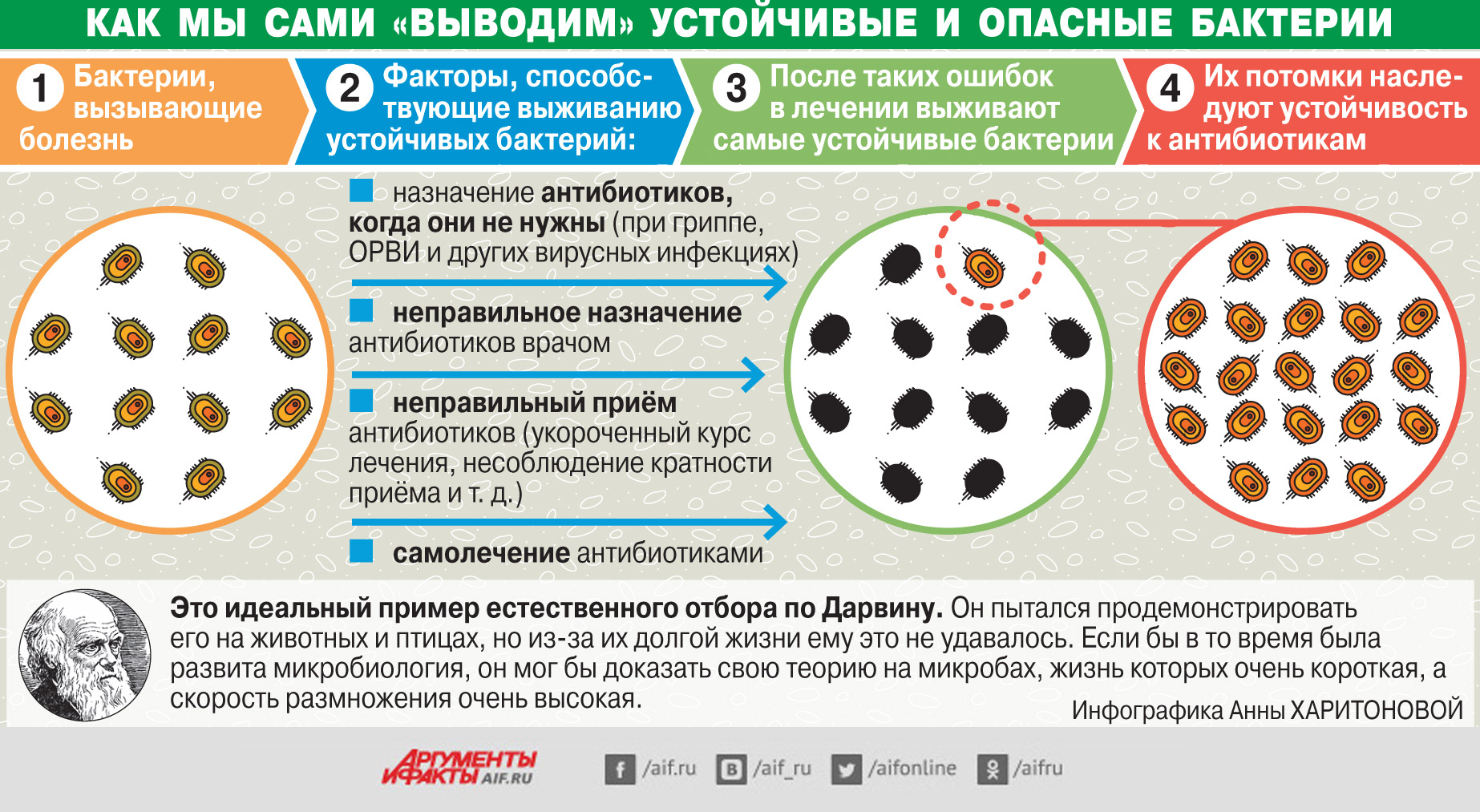
Применение антибиотиков в медицине и животноводстве
У проблемы антибиотикорезистентности есть две стороны: медицинская и ветеринарная. Конечно, основная проблема для здравоохранения – это применение антибиотиков в медицине, в особенности неправильное: например, назначения в отсутствие показаний, безрецептурная продажа и самолечение, изобилие контрафактных и некачественных антибиотиков.
Распространению резистентности способствует и то, что в развивающихся странах значительно возросла доступность препаратов для населения, а также все более активное перемещение по миру людей, животных, обмен продуктами питания и другими товарами, а с ними – и устойчивыми микроорганизмами.
Но и сельское хозяйство играет немаловажную роль в процессе развития и распространения резистентности.
На животноводство приходится приблизительно ¾ производимых в мире объемов антибактериальных средств. При этом большинство классов антимикробных средств – общие для медицины и ветеринарии. В сельском хозяйстве их используют для профилактики и лечения инфекций животных и даже в качестве стимуляторов роста.
Да-да, никто точно не знает как, но небольшое количество антибиотиков, добавляемое в корм скоту, действительно способствует увеличению привесов. Однако самая большая опасность для здоровья населения как раз и скрывается в таком постоянном использовании малых доз антибиотиков.
В хозяйствах появляются и распространяются устойчивые бактерии. Среди них есть и зоонозные, то есть те, которые могут вызывать заболевания как животных, так и человека.
Сальмонеллез, кампилобактериоз, колибактериоз, йерсиниоз… Эти инфекционные заболевания чаще всего характеризуются тошнотой, рвотой, диареей и сильными болями в течение нескольких дней. Намного опаснее зоонозные инфекции для людей с ослабленным иммунитетом, детей и пожилых, а некоторые штаммы вируса могут привести к летальному исходу. В тяжелых случаях для лечения необходимы антибиотики, поэтому заражение устойчивыми бактериями особенно опасно.
Возникающие в хозяйствах устойчивые бактерии заражают людей тремя основными способами:
– Через продукцию животноводства. Часто причиной заражения является плохо прожаренный фарш, сырые куриные яйца и молоко, но источниками заразы могут быть даже овощи с фруктами.
– Через контакт с зараженными животными – в зоне риска в первую очередь работники животноводческих предприятий.
– Через воду, почву и другие компоненты окружающей среды, животных-переносчиков, таких как насекомые, грызуны.
Вклад в проблему вносят, вероятно, и остатки антибиотиков в продуктах питания животного происхождения, способствуя селекции устойчивых бактерий в организме потребителей.
Бывает и так, что антибиотик снижает эффективность в медицине исключительно из-за его применения в животноводстве. Хороший пример – колистин. Долгое время этот препарат против кишечной палочки почти не применяли в медицине из-за тяжелых побочных эффектов, но его активно использовали в качестве стимулятора роста для скота. Однако, несмотря на побочные эффекты, препарат недавно был отнесен к резервным антибиотикам для людей, то есть таким, которые применяют, когда ничего другое уже не помогает.
Однако, несмотря на побочные эффекты, препарат недавно был отнесен к резервным антибиотикам для людей, то есть таким, которые применяют, когда ничего другое уже не помогает.
В Китае несколько лет назад колистин в медицине не использовали совсем, но неожиданно в госпиталях одного города врачи обнаружили устойчивую к нему кишечную палочку. Сравнив гены бактерий из больниц и с окрестных ферм, ученые выяснили: устойчивая к колистину кишечная палочка появилась на фермах и была занесена в больницы на лапках мух.
В результате в Китае запретили добавлять колистин в корм скоту для увеличения привесов.
Что мировое сообщество предпринимает для решения проблемы
Стратегия борьбы с устойчивостью к антибиотикам сегодня есть во многих странах, в том числе в сфере животноводства. Здесь им помогают организации, такие как Всемирная организация здравоохранения (ВОЗ) и Всемирная организация здравоохранения животных (МЭБ), которые разрабатывают стратегии борьбы и полезные рекомендации.
Основа таких мер, конечно же, – это ограничение применения антибиотиков за счет разумного и рационального их использования. Многочисленные научные исследования показали, что снижение применения антибиотиков ведет и к снижению распространения устойчивых бактерий.
В сфере животноводства ключевые пункты стратегий – это ограничения использования важных для медицины препаратов, таких как уже упоминавшийся колистин, ципрофлоксацин, цефалоспорины последних поколений, которые следует использовать только в том случае, если ничего другого животному уже не поможет, но никак не для профилактики или стимуляции роста.
Другой важный пункт – соблюдение правил санитарии, которое предотвращает занос инфекций.
Хорошее подспорье в профилактике и борьбе – это средства, альтернативные действию антибиотиков: вакцины, бактериофаги, пробиотики, эфирные масла растений и так далее.
Важно и обучение ветеринарных врачей грамотному назначению антимикробных препаратов.
Лидеры по снижению использования антибиотиков в животноводстве – страны Европы: Нидерланды, Дания, Норвегия, Франция, Бельгия, Германия и другие. Работают над этим и страны Азии, например Япония и Таиланд. США больше рассчитывают на открытие новых антибиотиков.
Работают над этим и страны Азии, например Япония и Таиланд. США больше рассчитывают на открытие новых антибиотиков.
Россией уже принята собственная Стратегия противодействия антибиотикорезистентности, составленная в соответствии с международными принципами. Исследования в рамках этой стратегии проводит в том числе наш институт – подведомственный Россельхознадзору Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов. Мы проводим научную работу, в которой изучаем устойчивость зоонозных бактерий ко всем группам антибиотиков. Бактерий – сальмонелл, кампилобактера, кишечную палочку, энтерококков – мы выделяем из продуктов питания животного происхождения и получаем от разных видов животных (коров, свиней и даже оленей) и птицы.
Как же снизить риск заражения устойчивыми бактериями?
Необходим помнить, что один из основных путей заражения – пищевой. Чтобы обезопасить себя от пищевых инфекций, необходимо соблюдать несколько несложных правил, сформулированных ВОЗ:
- Подвергайте пищу тщательной термической обработке.
 Температура продукта должна быть минимум 70 °С.
Температура продукта должна быть минимум 70 °С. - Съедайте приготовленную пищу горячей, поскольку при остывании велика вероятность размножения в ней различного рода бактерий. Если разогреваете пищу, то делайте это при той же температуре – не ниже 70 °С.
- Храните пищу при температуре не выше 10 °С.
- Не допускайте контакта сырой и приготовленной пищи. Например, не стоит резать ножом сырое мясо, а потом сразу сыр.
- Мойте руки перед приготовлением еды. Тщательно мойте фрукты и овощи.
- Держите кухню и все кухонные принадлежности в чистоте, не допускайте появления насекомых и тем более мышей и крыс.
- Помните, что опасные бактерии могут попасть в пищу от собак, кошек, птиц и других домашних животных. Соблюдайте простые правила гигиены и следите за здоровьем ваших питомцев.
Дмитрий Макаров, Анастасия Мазнева
Устойчивость бактерий к антибиотикам | Лабораторные тесты онлайн
Устойчивость к антибиотикам. ReAct. Доступно в Интернете по адресу https://www.group.org/toolbox/understand/antibiotic-resistance/health-care-associated-infections-and-resistance/. По состоянию на 30 мая 2018 г.
ReAct. Доступно в Интернете по адресу https://www.group.org/toolbox/understand/antibiotic-resistance/health-care-associated-infections-and-resistance/. По состоянию на 30 мая 2018 г.
(редакция апрель 2011 г.). Факты об устойчивости к антибиотикам. Общество инфекционных болезней Америки. Доступно в Интернете по адресу http://www.idsociety.org/AR_Facts/. По состоянию на 30 мая 2018 г.
(2013). Угрозы устойчивости к антибиотикам в США, 2013 г.Центры по контролю и профилактике заболеваний. Доступно на сайте https://www.cdc.gov/drugresistance/threat-report-2013/. По состоянию на 30 мая 2018 г.
(© 2014). Общие сведения: об устойчивости к антибиотикам. Альянс за разумное использование антибиотиков. Доступно в Интернете по адресу http://emerald.tufts.edu/med/apua/about_issue/about_antibioticres.shtml. По состоянию на 30 мая 2018 г.
(февраль 2014 г.). Остановите распространение супербактерий. Новости NIH в области здравоохранения. Доступно на сайте https: // newsinhealth. nih.gov/2014/02/stop-spread-superbugs. По состоянию на 30 мая 2018 г.
nih.gov/2014/02/stop-spread-superbugs. По состоянию на 30 мая 2018 г.
Вентола, Л.С. (апрель 2015 г.). Кризис устойчивости к антибиотикам, часть 1: причины и угрозы. Аптека и терапия . Доступно в Интернете по адресу https://www.ncbi.nlm.nih.gov/pm c / article / PMC4378521 /. По состоянию на 30 мая 2018 г.
Вентола, Л.С. (май 2015 г.). Кризис устойчивости к антибиотикам: Часть 2: Стратегии управления и новые агенты. Аптека и терапия . Доступно в Интернете по адресу https: // www.ncbi.nlm.nih.gov/pubmed/25987823. По состоянию на 30 мая 2018 г.
(обновлено 3 марта 2016 г.). Повышение безопасности здравоохранения. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/vitalsigns/protect-patients/index.html. По состоянию на 30 мая 2018 г.
Deak, D. et al. (6 сентября 2016 г.). Прогресс в борьбе с бактериями с множественной лекарственной устойчивостью? Обзор антибиотиков, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, 2010–2015 гг. Анналы внутренней медицины. Доступно на сайте http: // annals.org / цель / статья-аннотация / 2526197 / прогресс-борьба-против-бактерий с множественной лекарственной устойчивостью-обзор-u-s-food. По состоянию на 30 мая 2018 г.
Анналы внутренней медицины. Доступно на сайте http: // annals.org / цель / статья-аннотация / 2526197 / прогресс-борьба-против-бактерий с множественной лекарственной устойчивостью-обзор-u-s-food. По состоянию на 30 мая 2018 г.
Martens and Demain. (2017). Кризис устойчивости к антибиотикам, с особым вниманием к США Журнал антибиотиков . Доступно на сайте https://www.nature.com/articles/ja201730. По состоянию на 30 мая 2018 г.
(8 марта 2017 г.). Устойчивость к антибиотикам / противомикробным препаратам, роль CDC. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https: // www.cdc.gov/drugresistance/cdc_role.html. По состоянию на 30 мая 2018 г.
(обновлено 10 апреля 2017 г.). Национальная стратегия борьбы с устойчивостью к антибиотикам. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/drugresistance/federal-engagement-in-ar/national-strategy/index.html. По состоянию на 30 мая 2018 г.
(Обновлено 15 сентября 2017 г.). Устойчивость к антибиотикам в домах престарелых и детских садах. Центры по контролю и профилактике заболеваний, доступны в Интернете по адресу https: // www.cdc.gov/healthcommunication/toolstemplates/entertainmented/tips/AntibioticResistance.html. По состоянию на 30 мая 2018 г.
(обновлено 22 декабря 2017 г.). Устойчивость к антибиотикам от фермы к столу. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/foodsafety/challenges/from-farm-to-table.html
(© 2018). Что такое антибиотики и как они действуют? Общество микробиологов. Доступно в Интернете по адресу https://microbiologysociety.org/education-outreach/antibiotics-unearthed/antibiotics-and-antibiotic-resistance/what-are-antibiotics-and-how-do-they-work.html. По состоянию на 30 мая 2018 г.
(© 2018). Различные типы антибиотиков и их применение. Omics International. Доступно в Интернете по адресу https://www.omicsonline. org/conferences-list/different-types-of-antibiotics-and-their-applications. По состоянию на 30 мая 2018 г.
org/conferences-list/different-types-of-antibiotics-and-their-applications. По состоянию на 30 мая 2018 г.
Rifai, N. et al. (© 2018). Учебник Тиц по клинической химии и молекулярной диагностике, шестое издание. Устойчивость к противомикробным препаратам и рекомендации по тестированию основных бактериальных патогенов, стр. 173700014 — 173700024.Доступно в Интернете по адресу https://expertconsult.inkling.com/read/rifai-tietz-textbook-clinical-chemistry-molecular-diagnost-6e/chapter-75/antimicrobial-resistance-and. По состоянию на 30 мая 2018 г.
(© 2018). Профилактика инфекций, устойчивых к антибиотикам. NYU Langone Health. Доступно в Интернете по адресу https://nyulangone.org/conditions/antibiotic-resistant-infections/prevention. По состоянию на 30 мая 2018 г.
(обновлено 8 января 2018 г.). Борьба с устойчивостью к антибиотикам. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.Доступно на сайте https://www.fda.gov/ForConsumers/ConsumerUpdates/ucm092810. htm. По состоянию на 30 мая 2018 г.
htm. По состоянию на 30 мая 2018 г.
(обновлено 31 января 2018 г.). Действия США по борьбе с AR. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/drugresistance/us-activities.html. По состоянию на 30 мая 2018 г.
(5 февраля 2018 г.). Устойчивость к антибиотикам. Всемирная организация здоровья. Доступно в Интернете по адресу http://www.who.int/mediacentre/factsheets/antibiotic-resistance/en/. По состоянию на 30 мая 2018 г.
(23 февраля 2018 г.). Устойчивые к карбапенемам Enterobacteriaceae в медицинских учреждениях. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/hai/organisms/cre/index.html. По состоянию на 30 мая 2018 г.
(5 марта 2018 г.). О устойчивости к противомикробным препаратам. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/drugresistance/about.html. По состоянию на 30 мая 2018 г.
(обновлено 30 марта 2018 г. ). Сеть лабораторий по устойчивости к антибиотикам (AR).Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/drugresistance/solutions-initiative/ar-lab-networks.html. По состоянию на 30 мая 2018 г.
). Сеть лабораторий по устойчивости к антибиотикам (AR).Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/drugresistance/solutions-initiative/ar-lab-networks.html. По состоянию на 30 мая 2018 г.
(обновлено 3 апреля 2018 г.). Сдерживая необычное сопротивление. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/vitalsigns/contain-unusual-resistance/index.html. По состоянию на 30 мая 2018 г.
(обновлено 6 апреля 2018 г.). Гонорея, устойчивая к антибиотикам. Центры по контролю и профилактике заболеваний.Доступно в Интернете по адресу https://www.cdc.gov/std/gonorrhea/arg/default.htm. По состоянию на 30 мая 2018 г.
(обновлено 25 апреля 2018 г.). Устойчивость к антибиотикам. MedlinePlus. Доступно в Интернете по адресу https://medlineplus.gov/antibioticresistance.html. По состоянию на 30 мая 2018 г.
(обновлено 11 мая 2018 г.). О лабораторных испытаниях и ресурсах AR.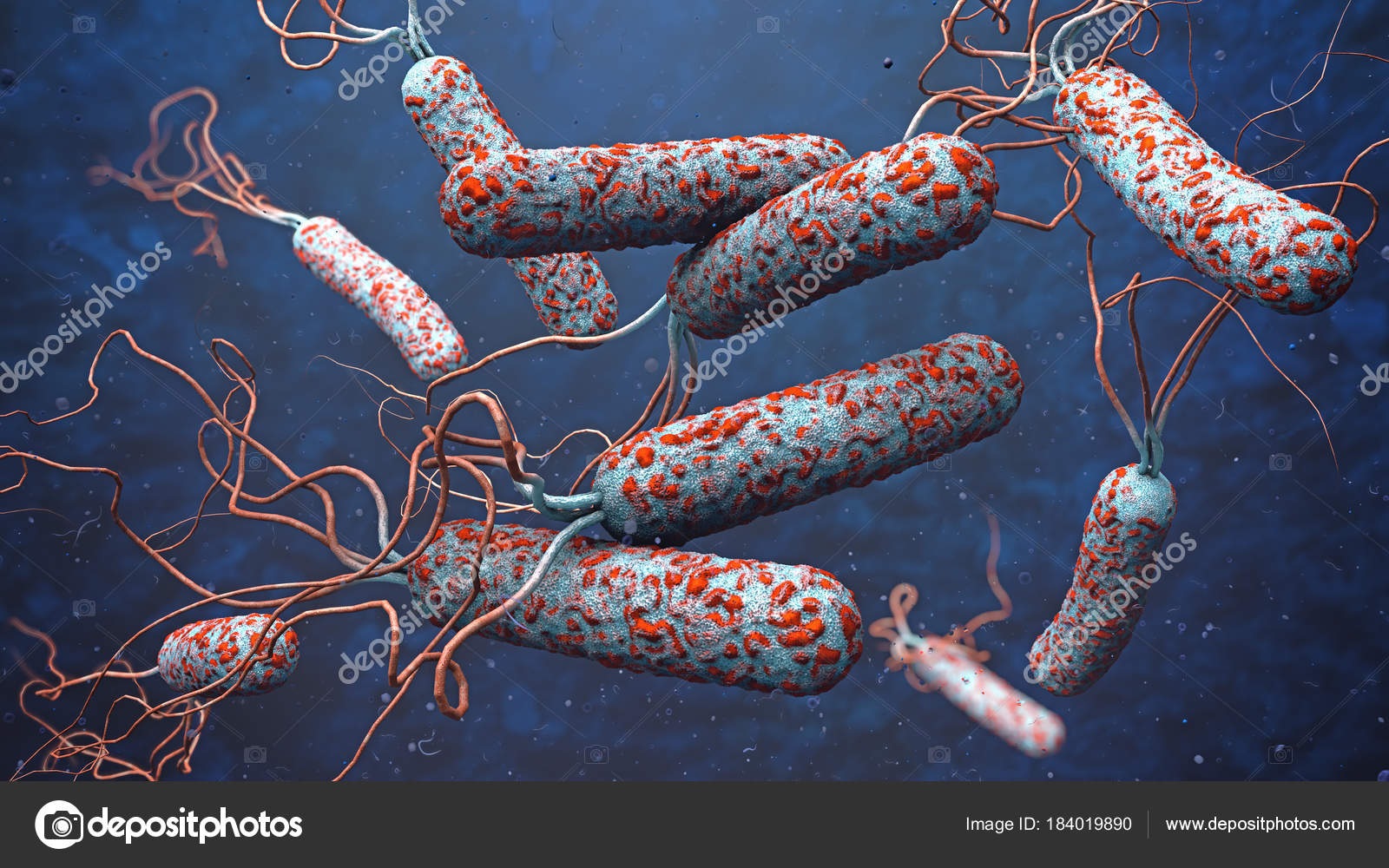 Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/drugresistance/laboratories.html. По состоянию на 30 мая 2018 г.
Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/drugresistance/laboratories.html. По состоянию на 30 мая 2018 г.
(обновлено 25 мая 2018 г.).Защита пациентов и предотвращение вспышек заболеваний. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/drugresistance/protecting_patients.html. По состоянию на 30 мая 2018 г.
Устойчивость к антибиотикам
Проблема устойчивости к антибиотикам является активной областью исследований в отделении. Некоторые ученые исследуют детали и механизмы того, как бактерии приобретают устойчивость к различным группам антибиотиков. Другие ищут новые способы борьбы с инфекциями, которые сопротивляются доступным антибиотикам.Одна из этих групп использует бактериофаги, а другая группа работает над разработкой пробиотического коктейля, который можно было бы использовать для лечения лекарственно-устойчивых заболеваний.
Устойчивость к фторхинолоновым антибиотикам
Доктор Линн Зехидрих изучает проблему устойчивости к антибиотикам более 25 лет. Одно из исследований в ее лаборатории было направлено на понимание механизма действия и механизмов устойчивости к антибиотикам, известным как фторхинолоны, одними из самых мощных, широко назначаемых антибиотиков широкого спектра действия, используемых во всем мире.Класс фторхинолоновых антибиотиков включает, среди прочего, ципрофлоксацин и левофлоксацин.
Одно из исследований в ее лаборатории было направлено на понимание механизма действия и механизмов устойчивости к антибиотикам, известным как фторхинолоны, одними из самых мощных, широко назначаемых антибиотиков широкого спектра действия, используемых во всем мире.Класс фторхинолоновых антибиотиков включает, среди прочего, ципрофлоксацин и левофлоксацин.
Фторхинолоны действуют, воздействуя на два основных бактериальных фермента, известных как топоизомеразы — гираза и топоизомераза IV, — которые помогают контролировать наматывание и раскручивание цепей ДНК во время важных клеточных процессов, таких как репликация ДНК, рекомбинация, транскрипция и сегрегация хромосом. Во время этих клеточных процессов цепи ДНК временно разрушаются топоизомеразами.Промежуточная форма разрушенной ДНК обычно недолговечна, но в присутствии фторхинолоновых антибиотиков промежуточная форма стабилизируется, что приводит к гибели бактериальных клеток. Лаборатория Цехидриха использует биохимические, биофизические и генетические подходы для определения того, как топоизомеразы выполняют свои клеточные роли и как лекарства блокируют их функцию.
В другом направлении исследований д-р Зехидрих и его коллеги изучают, можно ли повторно использовать препарат циклопирокс, противогрибковое средство, на которое не выдан патент, в качестве кандидата для использования в качестве антибиотика, особенно против грамотрицательных бактерий с множественной лекарственной устойчивостью.Возможность использовать лекарство, предназначенное для борьбы с одним типом микроорганизмов, для использования против другого, может обойтись без времени и денег, связанных с разработкой нового лекарства.
Группа Zechiedrich сообщила, что циклопирокс подавлял рост даже грамотрицательных бактерий с множественной лекарственной устойчивостью Acinetobacter baumannii , Escherichia coli и Klebsiella pneumoniae . Далее они исследовали механизм действия и обнаружили, что препарат влияет на метаболизм сахара в бактериях, изменяя состав молекул на внешней мембране бактериальной клетки.В своих текущих исследованиях в этой области они рассматривают лекарственную мишень как потенциально новую мишень для разработки новых антибиотиков.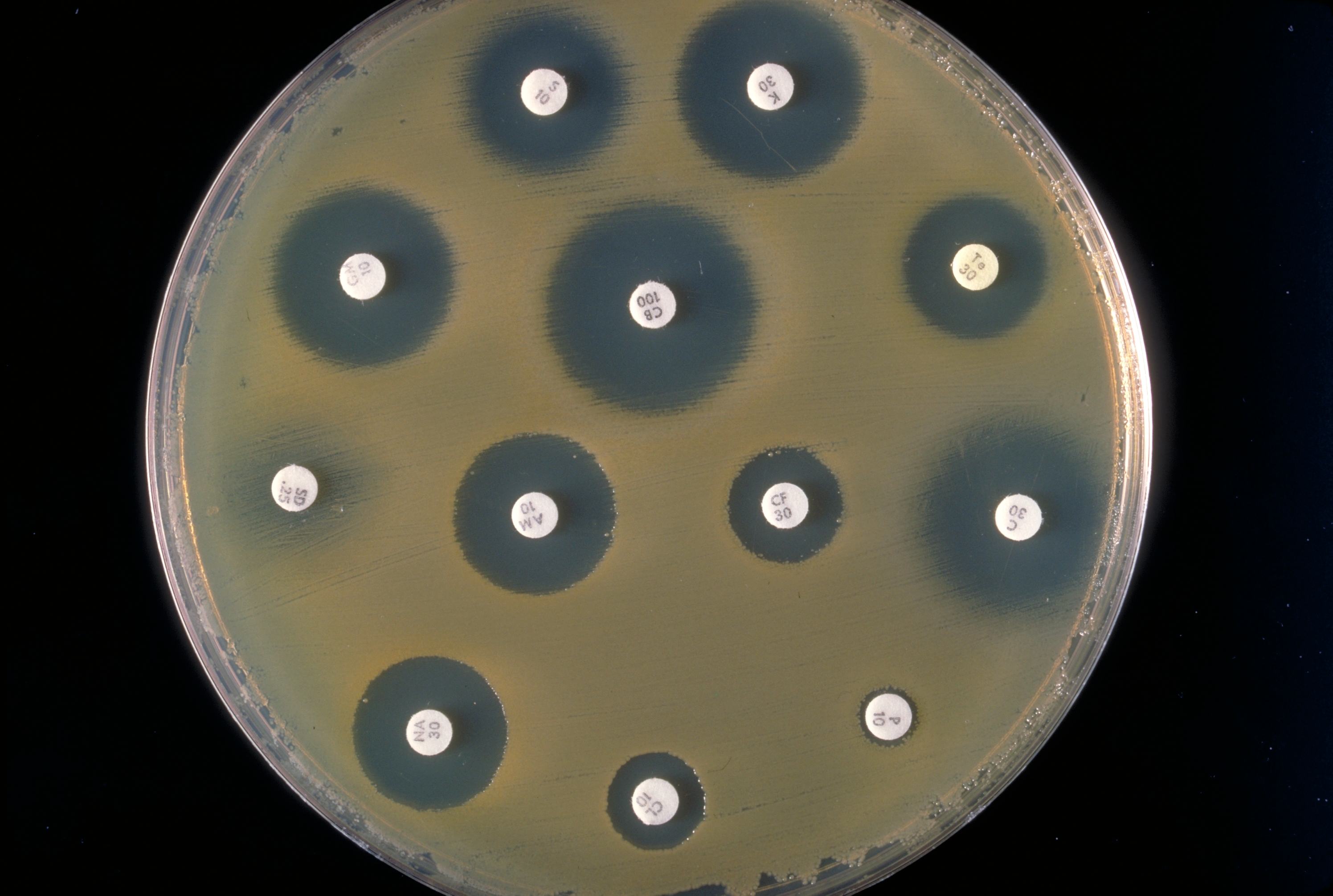
Устойчивость к бета-лактамным антибиотикам
Бета-лактамные антибиотики — наиболее широко используемый класс препаратов для лечения бактериальных инфекций. Они включают пенициллин и его производные, такие как метициллин и амоксициллин, а также другие группы антибиотиков, известные как цефалоспорины, карбапенемы и монобактамы.Часть бета-лактамного кольца антибиотика нацелена на пенициллин-связывающие белки (PBP), обнаруженные в мембране бактериальной клетки, которые участвуют в синтезе клеточной стенки. Связывание антибиотика с PBP предотвращает выполнение PBP своей основной роли и приводит к гибели бактериальной клетки.
Доктор Тимоти Палцкилл, профессор фармакологии, химической биологии, молекулярной вирусологии и микробиологии, и его исследовательская группа изучали механизмы устойчивости к бета-лактамным антибиотикам.У грамотрицательных бактерий наиболее распространенным механизмом устойчивости является гидролиз или разрушение антибиотиков ферментами, называемыми бета-лактамазами. Существует два широких класса бета-лактамаз: серин-бета-лактамазы и металло-бета-лактамазы. Доктор Палцкилл и его группа используют множество передовых генетических, биохимических и физических методов, чтобы понять детали структуры и функции обеих групп бета-лактамаз и их взаимодействия с лекарственно-устойчивыми формами антибиотиков, которые подвержены лекарственной устойчивости. .
Существует два широких класса бета-лактамаз: серин-бета-лактамазы и металло-бета-лактамазы. Доктор Палцкилл и его группа используют множество передовых генетических, биохимических и физических методов, чтобы понять детали структуры и функции обеих групп бета-лактамаз и их взаимодействия с лекарственно-устойчивыми формами антибиотиков, которые подвержены лекарственной устойчивости. .
Вместо лекарственной устойчивости за счет действия бета-лактамаз грамположительные бактерии приобретают устойчивость к бета-лактамным антибиотикам за счет выработки белка под названием PBP2a, который позволяет избежать ингибирующего действия антибиотиков. Это механизм, благодаря которому устойчивый к метициллину Staphylococcus aureus (MRSA) может сохраняться, несмотря на лечение несколькими бета-лактамными антибиотиками. Доктор Палцкилл и его коллеги провели исследование, в котором они обнаружили, что белок BLIP-II способен слабо связывать и ингибировать PBP2a, что делает его чувствительным к бета-лактамным антибиотикам. Они продолжают это направление исследований, ища мутации, повышающие сродство BLIP-II к PBP2a.
Они продолжают это направление исследований, ища мутации, повышающие сродство BLIP-II к PBP2a.
Устойчивость к колистину
Сокращение вариантов лечения из-за увеличения распространенности бета-лактамаз, расщепляющих бета-лактамные антибиотики, привело к увеличению использования полимиксиновых антибиотиков, таких как колистин. Полимиксины — это полипептиды, которые действуют путем связывания с бактериальной мембраной и последующего ее разрушения. Недавнее появление и распространение кодируемого плазмидой переносимого гена устойчивости к колистину, mcr-1, вызывает озабоченность.Ген mcr-1 кодирует фермент MCR-1, который модифицирует компонент мембраны и блокирует связывание колистина.
Доктор Палцкилл и его группа определили рентгеновскую структуру одной важной функциональной области белка MCR-1. Чтобы более полно понять механизм MCR-1, они работают над определением структуры полноразмерного фермента MCR-1. Кроме того, лаборатория работает над обнаружением ингибиторов фермента MCR-1, которые позволили бы обойти устойчивость и расширить возможности лечения колистина.
Использование бактериофагов для борьбы с устойчивыми к антибиотикам бактериями
Бактериофаги — это вирусы, которые специфически убивают бактерии. Доктора Энтони Марессо, Фрэнк Рамиг, Барбара Траутнер и их коллеги изучали возможность использования бактериофагов или фагов для борьбы с устойчивыми к лекарствам бактериями. Эта идея была первоначально предложена Феликсом д’Эреллем в 1926 году, но после открытия и первых успехов антибиотиков от этого подхода в значительной степени отказались (хотя несколько стран Восточной Европы использовали этот подход для успешного лечения некоторых бактериальных инфекций).
Учитывая текущие ограничения в лечении устойчивых к лекарствам бактериальных инфекций, исследователи пересмотрели эту идею и приступили к определению, могут ли фаги быть эффективными при уничтожении большой группы бактерий, устойчивых к антибиотикам. Их бактериальной мишенью была специфическая группа Escherichia coli, , называемая ST131, которая колонизирует желудочно-кишечный тракт, но может инфицировать участки вне кишечника (эта категория E. coli известна как внекишечные патогенные E.coli ) и считается основной причиной всех устойчивых к антибиотикам инфекций E. coli в США. Бактерии обладают множественной лекарственной устойчивостью, а также производят смертельные факторы вирулентности; неспособность контролировать их рост может привести к сепсису, который может быть фатальным.
coli известна как внекишечные патогенные E.coli ) и считается основной причиной всех устойчивых к антибиотикам инфекций E. coli в США. Бактерии обладают множественной лекарственной устойчивостью, а также производят смертельные факторы вирулентности; неспособность контролировать их рост может привести к сепсису, который может быть фатальным.
В своем исследовании они стремились идентифицировать фаги, которые убивали бы 12 штаммов устойчивых к антибиотикам бактерий, выделенных от пациентов. Они сделали это, сначала выделив фаги из фекалий птиц и собак, которые, как известно, являются резервуарами для E.coli ST131, а затем провести лабораторный анализ, чтобы выяснить, лизируют ли фаги бактерии или убивают их. Хотя ни один фаг не мог убить все 12 бактериальных штаммов в лабораторных культурах, они обнаружили комбинации двух или трех фагов, которые были эффективны против всех протестированных бактерий.
Затем они проверили фаги, чтобы выяснить, могут ли они также убить устойчивые к антибиотикам бактерии на мышиной модели сепсиса. При доставке животным фаги снижали уровень бактерий и существенно улучшали здоровье мышей.Результаты показали, что фаги, выделенные из окружающей среды, с небольшими экспериментальными манипуляциями, могут быть эффективными в борьбе даже с очень серьезными инфекциями супербактерий E. coli .
При доставке животным фаги снижали уровень бактерий и существенно улучшали здоровье мышей.Результаты показали, что фаги, выделенные из окружающей среды, с небольшими экспериментальными манипуляциями, могут быть эффективными в борьбе даже с очень серьезными инфекциями супербактерий E. coli .
Использование фагов вместо антибиотиков для борьбы с бактериальными инфекциями дает несколько преимуществ. Фаги не заражают клетки человека. Они очень специфичны для определенных видов или штаммов бактерий, поэтому их можно использовать для борьбы с «плохими» бактериями, не нанося вреда «хорошей» кишечной микробиоте.Тем не менее, при желании их можно заставить действовать широко через коктейли. Кроме того, фаги могут развиваться, поэтому в случае развития устойчивости к набору фагов новые фаги могут быть идентифицированы в окружающей среде или развиваться в лаборатории за считанные дни, в отличие от антибиотиков, разработка которых может занять много лет и при больших затратах. . Хотя ученые все еще несколько осторожны в отношении этого подхода, поскольку иногда иммунная система хозяина может нейтрализовать активность фагов, а некоторые фаги могут плохо работать у животных, они продолжают исследовать этот вариант.
Хотя ученые все еще несколько осторожны в отношении этого подхода, поскольку иногда иммунная система хозяина может нейтрализовать активность фагов, а некоторые фаги могут плохо работать у животных, они продолжают исследовать этот вариант.
В другом исследовании эти исследователи обнаружили, что определенные металлы усиливают уничтожение бактерий E. coli ST131 фагами в крови. Они заметили, что при обработке фагом E. coli ST131 фаг эффективно убивал бактерии в культуральной среде, но не в крови. Образцы крови содержали химическое вещество, называемое ЭДТА, которое использовалось для предотвращения свертывания и, как известно, связывается с металлами. Они увидели более эффективное уничтожение бактерий в крови, обработанной гепарином, естественным фактором, препятствующим свертыванию, предполагая, что разные результаты могут быть связаны с уровнем металлов в крови.
Когда они добавили металлы, кальций, магний и железо, которые обычно содержатся в крови, они обнаружили, что ингибирование уничтожения ST131 с помощью ЭДТА было преодолено добавлением металлов. Более того, усиленный металлами киллинг наблюдали для нескольких других штаммов внекишечного патогенного E. coli , а не только для ST131. Металлы также улучшили уничтожение ST131 в модельной системе мыши. Эта работа указывает на важную роль металлов в уничтожении бактерий фагами в крови.
Более того, усиленный металлами киллинг наблюдали для нескольких других штаммов внекишечного патогенного E. coli , а не только для ST131. Металлы также улучшили уничтожение ST131 в модельной системе мыши. Эта работа указывает на важную роль металлов в уничтожении бактерий фагами в крови.
Лечение антибиотиками изменяет микробиоту кишечника, что приводит к возникновению трудноизлечимых Clostridium difficile инфекций
Clostridium difficile — это грамположительная спорообразующая бактерия, которая по классификации CDC считается одной из трех лекарственно-устойчивых инфекций в США с самым высоким риском. Это условно-патогенная инфекция, поражающая толстую кишку пациентов после лечения антибиотиками. Микробиота, населяющая кишечник, обычно предотвращает C.difficile и подавляет C. difficile -ассоциированное заболевание, но лечение антибиотиками приводит к изменениям в составе микробиоты, которые позволяют C. difficile расти и вызывать заболевание.
difficile расти и вызывать заболевание.
C. difficile продуцирует токсины, которые повреждают клетки кишечника и вызывают воспаление, вызывая диарею, и могут быть смертельными. Из почти 500 000 инфекций ежегодно примерно 29 000 приводят к смерти. Это наиболее частая причина внутрибольничных инфекций в развитых странах.Инфекция очень трудно поддается лечению, и многие пациенты страдают от рецидивирующих инфекций. Бактерия от природы устойчива ко многим распространенным антибиотикам, таким как фторхинолоны, поэтому исследователи ищут альтернативные способы лечения болезни.
Доктор Роберт Бриттон и его исследовательская группа заинтересованы в понимании того, как кишечная микробиота обеспечивает барьер для входящих патогенов и как нарушение микробиоты может приводить к инфекциям, в первую очередь C.difficile инфекции . Они разработали мини-биореакторы и мышей, колонизированных кишечной микробиотой человека, чтобы определить, какие члены микробного сообщества ответственны за подавление инвазии C. difficile . Их цель — разработать пробиотический коктейль, полученный из кишечной микробиоты человека, который подавит инвазию C. difficile .
difficile . Их цель — разработать пробиотический коктейль, полученный из кишечной микробиоты человека, который подавит инвазию C. difficile .
Исследователи обнаружили, что две линии C. difficile , RT027 и RT078, стали более преобладающими и вирулентными за последние пару десятилетий, вызвав крупные вспышки.Чтобы определить факторы, которые увеличили вирулентность этих двух линий, доктор Бриттон и его коллеги исследовали, какие источники пищи предпочитают RT027 и RT078. Их исследование показало, что вирулентные клоны очень эффективно использовали диетическую сахарную трегалозу (которая содержится в диетической газировке и используется для стабилизации обработанных пищевых продуктов), что дает этим микробам конкурентное преимущество перед другими, менее вирулентными бактериями.
Используя свою мышиную модель, они обнаружили, что мыши, получавшие трегалозу в своем рационе, имели более тяжелое заболевание, с более высокими показателями смертности и производили более высокие уровни токсинов. Эти результаты предполагают, что введение трегалозы в качестве пищевой добавки в рацион человека незадолго до появления этих двух эпидемических линий помогло отобрать для их появления и способствовало вирулентности. Это исследование также демонстрирует, что диета может влиять на состав микробиоты и реакцию на инфекцию.
Эти результаты предполагают, что введение трегалозы в качестве пищевой добавки в рацион человека незадолго до появления этих двух эпидемических линий помогло отобрать для их появления и способствовало вирулентности. Это исследование также демонстрирует, что диета может влиять на состав микробиоты и реакцию на инфекцию.
Селективное уничтожение устойчивых к антибиотикам бактерий изнутри
Устойчивость инфекционных бактерий к антибиотикам — растущая проблема во всем мире, в значительной степени вызванная чрезмерным использованием антибиотиков.В статье Nature Biotechnology , López-Igual et al. 1 демонстрируют изящный способ избирательного отравления устойчивых к антибиотикам Vibrio cholerae бактерий — видов, вызывающих холеру — изнутри. Цель авторов — предложить целенаправленную альтернативу стандартным широкополосным антибиотикам.
Наше нынешнее чрезмерное использование антибиотиков вызвало несколько проблем, одна из которых связана с появлением устойчивых к антибиотикам бактерий. Другой заключается в том, что типичные антибиотики широкого спектра действия влияют не только на целевые болезнетворные (патогенные) бактерии, но и на наши нормальные полезные бактерии, которые защищают нас от инфекции и могут влиять на многие другие аспекты у людей, включая вес, настроение и аллергию (см. .nature.com/31x0csa). Специфика подхода, предложенного Лопес-Игуалем и его коллегами, позволяет избежать обеих этих проблем.
Авторский метод основан на способности бактерий переносить определенные части генетического материала («подвижную» ДНК) при межклеточном контакте в процессе, известном как конъюгация. López-Igual et al. использует это явление для передачи набора генов, кодирующих токсин (белок, называемый CcdB), и его антидот (белок, известный как CcdA) от бактерий-доноров к своим соседям.Система спроектирована таким образом, что токсин будет производиться только в V. cholerae , а противоядие будет производиться только в бактериях V. cholerae , которые чувствительны к антибиотикам, так что только устойчивые к антибиотикам V. cholerae будет убит (рис. 1).
cholerae будет убит (рис. 1).
Рисунок 1 | Отсроченное уничтожение Vibrio cholerae . López-Igual et al. 1 разработали систему, с помощью которой можно избирательно уничтожать устойчивые к антибиотикам V.cholerae , вид бактерий, вызывающих холеру. Они разработали круглый кусок генетического материала, который кодирует как токсин (красный), который прерывается компонентом, известным как интеин (желтый), так и противоядие от токсина (синий). Эти гены вставляются в бактерию-донор, а затем могут быть переданы другим бактериям в популяции посредством процесса переноса, называемого конъюгацией (пунктирные стрелки). a , если бактерия, которая получает генетический материал, не является V.cholerae , то токсин и антидот не экспрессируются, потому что бактерии не хватает соответствующего белка фактора транскрипции, который управляет их экспрессией. Такие клетки выживают. b , Если реципиент чувствителен к антибиотикам V. cholerae , бактерия вырабатывает антидот и токсин, которые не функционируют, поскольку содержат интеин. Со временем интеин выводится из токсина. Однако образующийся функциональный токсин инактивируется антидотом, и бактерия живет. c , Если реципиент является устойчивым к антибиотикам V. cholerae , экспрессия антидота блокируется репрессорным белком, называемым SetR, который кодируется геном, который способствует устойчивости к антибиотикам. Когда интеин удаляется из токсина, он генерирует активный токсин, и бактерия умирает.
cholerae , бактерия вырабатывает антидот и токсин, которые не функционируют, поскольку содержат интеин. Со временем интеин выводится из токсина. Однако образующийся функциональный токсин инактивируется антидотом, и бактерия живет. c , Если реципиент является устойчивым к антибиотикам V. cholerae , экспрессия антидота блокируется репрессорным белком, называемым SetR, который кодируется геном, который способствует устойчивости к антибиотикам. Когда интеин удаляется из токсина, он генерирует активный токсин, и бактерия умирает.
Лопес-Игуаль et al. использовал несколько хитрых уловок, чтобы гарантировать, что токсичность проявляется только в клетках-мишенях. Во-первых, они сконструировали гены, кодирующие токсин, чтобы они находились под контролем специфичного для Vibrio белка, фактора транскрипции ToxR (который необходим для V.cholerae , чтобы вызвать заболевание). Это означает, что если бы гены, кодирующие токсин, когда-либо были перенесены путем конъюгации к другим видам бактерий, токсин не мог бы образоваться.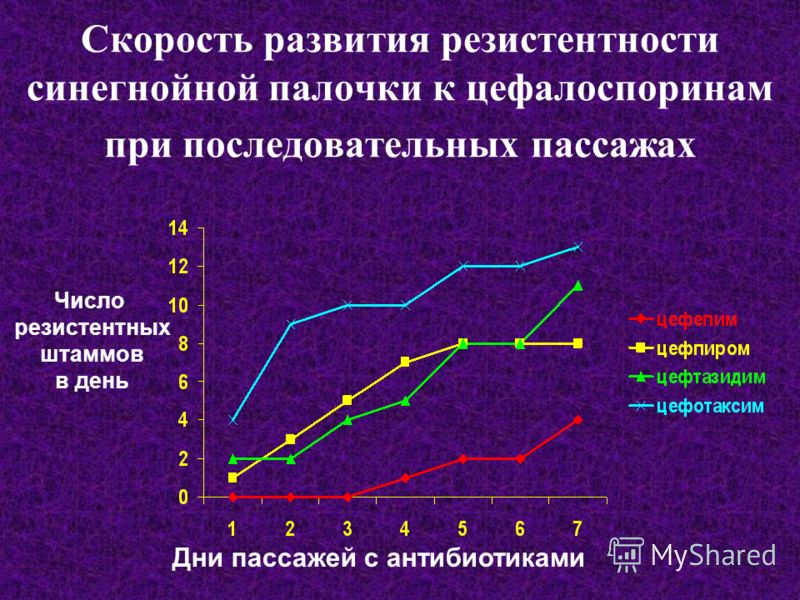 Во-вторых, чтобы гарантировать, что чувствительные к антибиотикам реципиенты V. cholerae не погибнут, авторы включили ген, кодирующий антидот, в набор мобилизуемых генов. Этот антидот производится во всех чувствительных к антибиотикам V. cholerae , но не в устойчивых к антибиотикам V. cholerae, , потому что у последних бактерий выработка антидота отключается репрессорным белком SetR, который кодируется, и также регулирует генетический элемент устойчивости к антибиотикам SXT у этих бактерий.
Во-вторых, чтобы гарантировать, что чувствительные к антибиотикам реципиенты V. cholerae не погибнут, авторы включили ген, кодирующий антидот, в набор мобилизуемых генов. Этот антидот производится во всех чувствительных к антибиотикам V. cholerae , но не в устойчивых к антибиотикам V. cholerae, , потому что у последних бактерий выработка антидота отключается репрессорным белком SetR, который кодируется, и также регулирует генетический элемент устойчивости к антибиотикам SXT у этих бактерий.
Однако простого наличия антидота может быть недостаточно для предотвращения уничтожения бактерий, которые не предназначены для использования в качестве мишени. Токсин CcdB очень мощный и действует быстро, убивая бактерии, нанося обширный ущерб их генетическому материалу — он действует, ингибируя фермент, называемый гиразой, блокируя его с ДНК, что приводит к разрывам ДНК. Поэтому авторы встроили механизм задержки — создание тикающей бомбы замедленного действия, которая становится смертельной только через некоторое время.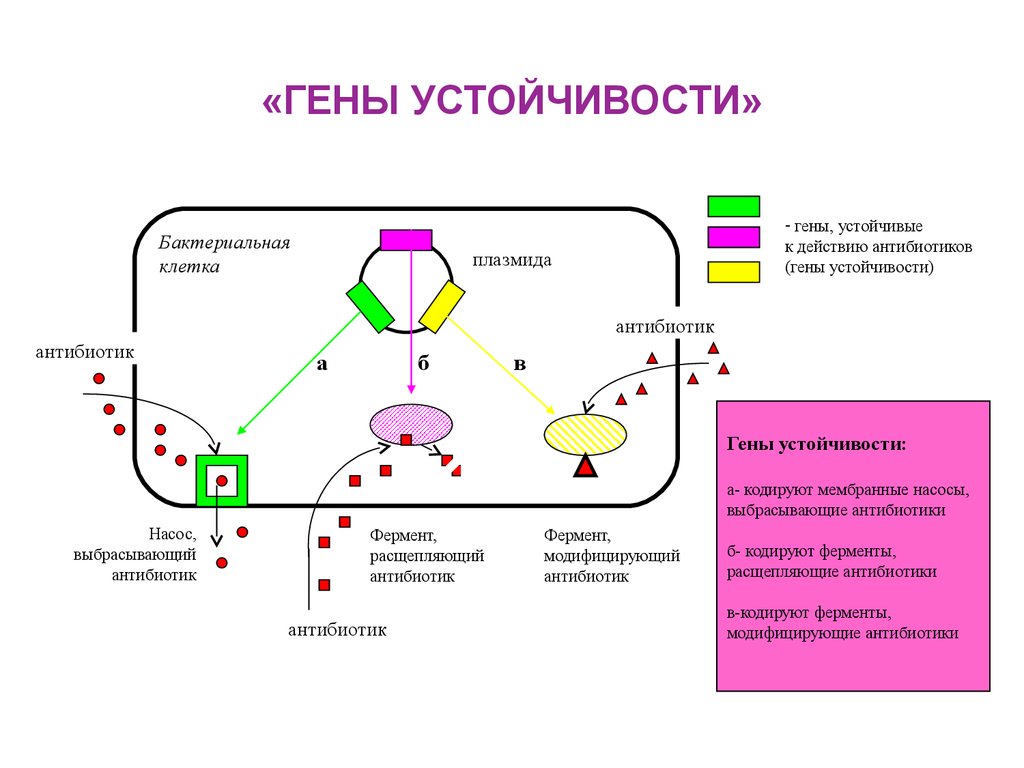
Для этого они вставили генетический модуль, который кодирует особый белок, известный как интеин, в ген токсина.Экспрессия модифицированного гена токсина продуцирует нефункциональный токсин, из которого белок интеин выделяется со временем посредством процесса, называемого сплайсингом, тем самым генерируя функциональный токсин. Эффект заключается в отсрочке смертельного действия токсина, позволяя бактериям, которые его получают, отреагировать. Время, необходимое для созревания токсина, позволяет бактерии, чувствительной к антибиотикам, производить достаточно антидота, чтобы выжить. Однако, если бактерия устойчива к антибиотикам, антидот не вырабатывается, и после созревания токсина клетка погибает.
Лопес-Игуаль et al. Далее показал, что их подход не ограничивается одним типом токсинового белка, а другими, а именно: HigB2 (который нацелен на фермент, называемый мРНКазой), RelE4 (который ингибирует синтез белка) и ParE2 (еще одна гираза). ингибитор) — также функционируют после интеин-опосредованного сплайсинга. Наконец, они проверили свой метод в трех естественных средах обитания V. cholerae : вода, личинки рыбок данио и личинки ракообразных. Они обнаружили, что их подход может искоренить устойчивый к антибиотикам V.cholerae во всех трех местообитаниях. Специфические регуляторы, которые они использовали, работают только для V. cholerae , но систему можно легко адаптировать для воздействия на различные бактерии.
Наконец, они проверили свой метод в трех естественных средах обитания V. cholerae : вода, личинки рыбок данио и личинки ракообразных. Они обнаружили, что их подход может искоренить устойчивый к антибиотикам V.cholerae во всех трех местообитаниях. Специфические регуляторы, которые они использовали, работают только для V. cholerae , но систему можно легко адаптировать для воздействия на различные бактерии.
Другие исследования 2 , 3 использовали вирусы, инфицирующие бактерии, а также методы конъюгации для доставки ферментов, переваривающих ДНК или РНК, называемых нуклеазами, для нацеливания на устойчивые к лекарствам бактерии. Как подход Лопес-Игуаля и его коллег соотносится с этим? Одним из преимуществ их системы является то, что эволюционирует меньшее количество бактерий, способных противостоять внутренней угрозе, и примерно один такой «ускользающий мутант» на 10 7 бактерий, которые получают токсин, что представляет собой уровень «ускользающих мутантов», который, по крайней мере, в сто раз ниже. чем при вирусном подходе 2 , 3 .
Тем не менее, эта скорость побега недостаточно низка, чтобы предотвратить развитие резистентности. Одним из факторов, который следует учитывать, является типичная численность популяции бактерий, являющихся мишенью 4 . Если популяция превышает прогнозируемый размер для создания «ускользающего» мутанта, то устойчивые бактерии уже будут присутствовать. Люди, больные холерой, производят около 10 8 бактерий V. cholerae на грамм фекального материала, а водоемы, связанные со вспышкой болезни, вероятно, будут содержать еще большее количество бактерий 5 .В таких больших популяциях вероятно, что тысячи мутантных клеток будут устойчивы к токсину и не будут затронуты системой уничтожения, описанной здесь. Дальнейшие исследования должны попытаться выяснить механизмы, стоящие за этим сопротивлением, и найти способы оптимизации системы.
Проблема с подходами конъюгации в целом заключается в том, что они неэффективны, и лишь несколько клеток из сотни фактически получают гены. Для создания функциональной терапии, вероятно, потребуются две вещи: во-первых, использование нескольких токсинов и / или систем доставки, чтобы попытаться ограничить количество ускользающих мутантов; и во-вторых, повышение эффективности переноса генов.Хотя система Лопес-Игуаля и его коллег, вероятно, не сразу решит проблему устойчивых к антибиотикам холерных инфекций, она может внести важный вклад в арсенал альтернативных методов лечения тяжелобольных.
Последний вопрос, возможно, более глубокий. Сильная водянистая диарея, характерная для холеры, по оценкам, вызывает около 100 000 смертей ежегодно 6 . Имея в виду эту мрачную статистику, зачем нацеливаться только на устойчивые к антибиотикам бактерии, если вместо этого вы можете попытаться убить их всех? Возможным преимуществом может быть более низкое давление отбора на В.cholerae , чтобы стать устойчивым к этому новому методу уничтожения. Однако необходимо заранее знать, что инфекция действительно устойчива к антибиотикам, или может потребоваться также использование антибиотиков параллельно для лечения инфекции. Возможно, система, описанная López-Igual et al. следует рассматривать как интригующее доказательство того, как в будущем можно будет использовать селективные альтернативы антибиотикам: его можно легко модифицировать для воздействия на все V. cholerae , независимо от того, устойчивы они к антибиотикам или нет.
устойчивых организмов | Encyclopedia.com
Введение
История болезни, характеристики и передача
Объем и распространение
Лечение и профилактика
Воздействия и проблемы
БИБЛИОГРАФИЯ
Устойчивые организмы, которые являются микробами, бактериями, паразитами, вирусами развили иммунитет к одному или нескольким лекарствам, используемым для их уничтожения. Лекарства, убивающие микробы, называются противомикробными.Устойчивость угрожает здоровью человека, поскольку снижает или устраняет эффективность лекарств, используемых для лечения инфекций. Если у организмов вырабатывается устойчивость к лекарствам быстрее, чем могут быть открыты новые лекарства, выбор врачей для лечения инфекций, вызванных этими организмами, будет сокращаться. Это произошло со многими реальными бактериями, вирусами, грибами и паразитами. Вероятность развития резистентности к лекарственному средству выше при его широком применении. В частности, устойчивость к антибиотикам возникла отчасти из-за хронического чрезмерного использования антибиотиков в медицинских и сельскохозяйственных условиях.Антибиотики часто назначают при вирусных, а не бактериальных инфекциях (антибиотики не действуют на вирусы), и ежегодно скоту дают миллионы фунтов антибиотиков. Большинство экспертов сходятся во мнении, что в начале двадцать первого века устойчивость к противомикробным препаратам достигла стадии кризиса.
История
Устойчивые организмы не возникли до середины двадцатого века, потому что не были известны противомикробные препараты, достаточно мощные, чтобы вызвать развитие устойчивости. Пенициллин, например, был открыт в 1928 году и впервые широко использовался во время Второй мировой войны (1939–45).Пенициллин-резистентные бактерии Escherichia coli впервые были обнаружены в 1940 году. Пенициллин-резистентные стафилококковые бактерии были зарегистрированы в 1944 году, а к 1950-м годам устойчивый к пенициллину штамм Staphylococcus aureus стал всемирной проблемой в больницах. К 1960-м годам большинство стафилококков были устойчивы к пенициллину.
Другой пример развития устойчивости — малярийный паразит и противомалярийный препарат хлорохин.
Хлорохин был представлен в 1940-х годах.Десять лет спустя устойчивость к хлорохину развивалась независимо в Азии и Южной Америке, но оставалась редкой. Еще через двадцать лет сопротивление появилось в Восточной Африке и затем быстро распространилось. Сегодня устойчивая к хлорохину малярия встречается в нескольких регионах мира. Малярия заражает от 300 до 500 миллионов человек ежегодно, убивая около 1 миллиона, почти все в развивающихся странах.
С конца 1980-х годов патогены, устойчивые к более чем одному лекарству, которые еще труднее лечить, чем организмы с устойчивостью к одному лекарству, появляются все более быстрыми темпами.Однако разработка новых антимикробных препаратов замедлилась.
Характеристики
В любой дикой популяции микроорганизмов, будь то бактерии или вирусы, между людьми будут небольшие случайные наследственные различия — генетические различия. Рецепт протеина для микроорганизма не является жестким и точным; его многие белки могут принимать несколько разные формы без ущерба для его способности к выживанию. Когда популяция микроорганизмов подвергается воздействию лекарства, предназначенного для ее уничтожения, генетические различия между людьми иногда позволяют микроорганизмам выжить.Таким образом, все следующее поколение микроорганизмов будет иметь тенденцию к большей устойчивости к этому препарату. Если этот эволюционный процесс изменения и отбора повторяется, сопротивление может развиваться.
В целом, чем чаще используется лекарство, тем быстрее может развиться резистентность. Однако резистентность также может развиться, когда используется недостаточное количество лекарства и некоторые микроорганизмы выживают. Чем меньше выживших, тем более стойкими они могут быть. Таким образом, дозировка до порога исключения может быть хуже, чем резко недодозировка (которая не так сильно влияет на устойчивость).
Устойчивость может развиваться даже при правильном дозировании лекарств. Так было с противовирусными, противогрибковыми и противопаразитарными средствами. Однако ненужное или неадекватное использование противомикробных препаратов способствует более быстрому развитию устойчивости.
СЛОВА, КОТОРЫЕ НЕОБХОДИМО ЗНАТЬ
АНТИБАКТЕРИАЛЬНОЕ средство: Вещество, уменьшающее или убивающее микробы (бактерии и другие микроорганизмы, кроме вирусов). Также часто термин используется для описания лекарства, используемого для лечения бактериальных инфекций.
АНТИБИОТИК: Препарат, например пенициллин, используемый для борьбы с инфекциями, вызванными бактериями. Антибиотики действуют только на бактерии и не эффективны против вирусов.
ПРОТИВОГРИБКИ: Противогрибковые препараты (также называемые противогрибковыми препаратами) — это лекарства, используемые для борьбы с грибковыми инфекциями. Они бывают двух видов: системные и актуальные. Системные противогрибковые препараты — это лекарства, которые принимают внутрь или в виде инъекций для лечения инфекций, вызванных грибком. Противогрибковые препараты местного действия — это лекарства, которые наносятся на кожу для лечения кожных инфекций, вызванных грибком.
ПРОТИВОМИКРОБНОЕ СРЕДСТВО: Материал, замедляющий рост бактерий или способный убивать бактерии. Включает антибиотики (которые можно использовать внутри тела) и дезинфицирующие средства (которые можно использовать только вне тела).
БАКТЕРИИ: Одноклеточные микроорганизмы, обитающие в почве, воде, растениях и животных, которые играют ключевую роль в разложении органических веществ и круговороте питательных веществ. Некоторые бактерии являются возбудителями болезней. Микроскопические организмы, деятельность которых варьируется от развития болезней до брожения.Бактерии имеют форму от сферической до палочковидной и спиральной. Различные типы бактерий вызывают множество заболеваний, передающихся половым путем, включая сифилис, гонорею и хламидиоз. Бактерии также вызывают заболевания от брюшного тифа до дизентерии и столбняка. Бактерии — это особая форма бактерий.
КОГОРТА: Когорта — это группа людей (или любых видов), обладающих общей характеристикой. Когорты идентифицируются и группируются в когортные исследования для определения частоты заболеваний или видов исходов болезней с течением времени.
ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ: Лекарственная устойчивость развивается, когда у инфекционного агента, такого как бактерия, гриб или вирус, развивается недостаточная чувствительность к лекарству, которое обычно могло бы контролировать или даже уничтожать их. Это, как правило, происходит при чрезмерном использовании противоинфекционных средств, при котором отбираются популяции микробов, наиболее способных им противостоять, и одновременно уничтожаются наиболее чувствительные организмы. В следующий раз, когда противоинфекционное средство будет использовано, оно будет менее эффективным, что в конечном итоге приведет к развитию резистентности.
МИКРООРГАНИЗМ: Микроорганизмы — мелкие организмы. За единственным, но известным исключением бактерии, которая достаточно велика, чтобы ее можно было увидеть без посторонней помощи, отдельные микроорганизмы имеют микроскопические размеры. Чтобы их можно было увидеть, их необходимо увеличить в оптический или электронный микроскоп. Наиболее распространенными типами микроорганизмов являются вирусы, бактерии, сине-зеленые бактерии, некоторые водоросли, некоторые грибы, дрожжи и простейшие.
ПАТОГЕН: Возбудитель болезни, такой как бактерии, вирус, грибок и т. Д.
ВИРУС: Вирусы — это, по сути, неживые репозитории нуклеиновой кислоты, которым требуется присутствие живой прокариотической или эукариотической клетки для репликации нуклеиновой кислоты. Существует ряд различных вирусов, которые бросают вызов иммунной системе человека и могут вызывать заболевания у людей. Обычно вирус представляет собой небольшой инфекционный агент, который состоит из ядра генетического материала (либо дезоксирибонуклеиновой кислоты (ДНК), либо рибонуклеиновой кислоты (РНК), окруженного оболочкой из белка.Очень простые микроорганизмы, вирусы намного меньше бактерий, которые проникают в клетки и размножаются внутри них. Вирусы часто обмениваются или передают свой генетический материал (ДНК или РНК) клеткам и могут вызывать такие заболевания, как ветряная оспа, гепатит, корь и эпидемический паротит.
Свойства, которые делают организм устойчивым к лекарственному средству, сильно различаются, потому что точные способы, которыми антимикробные средства атакуют организмы, сильно различаются. Любая мутация, препятствующая вредному действию препарата на организм, вызывает резистентность.Например, некоторые бактерии стали устойчивыми к антибиотику пенициллину за счет развития способности продуцировать бета-лактамазы, которые представляют собой ферменты (тип белка), которые деактивируют антибиотик. В других случаях микроорганизмы используют несколько методов устойчивости к антибиотикам: учатся препятствовать проникновению лекарств в клетку или их накоплению; изменение поверхностных молекул, с которыми связываются противомикробные препараты; или разработка альтернатив серии химических реакций в клетке (метаболические пути), которые блокируются антимикробными препаратами.
Передача
Передача устойчивых организмов происходит по тем же механизмам, что и у их неустойчивых родственников, но с большей вероятностью происходит в определенных условиях. Например, инфекция метициллин-резистентным стафилококком Staphylococcus чаще встречается в больничных отделениях интенсивной терапии и учреждениях длительного ухода. Устойчивый к метициллину S. aureus также был обнаружен у домашних животных, вероятно, передавался им от человека и может передаваться обратно человеку от этих животных.У пищевых животных не обнаружен.
В КОНТЕКСТЕ : РИСКИ В РЕАЛЬНОМ МИРЕПриобретенная адаптация бактерий ко многим антибиотикам стала проблемой с начала 1990-х годов. Например, многие больницы теперь вынуждены справляться с наличием метициллин-устойчивого Staphylococcus aureus (MRSA), который демонстрирует устойчивость почти ко всем применяемым в настоящее время антибиотикам. Для борьбы с инфекциями, вызванными MRSA и другими резистентными организмами, требуется увеличенное количество рабочих часов больничного персонала, увеличение запасов и может ограничить доступность больничных коек, когда необходима когортация (группировка пациентов с одним и тем же заболеванием) или изоляция.
Немногочисленные антибиотики, на которые действительно реагируют устойчивые к антибиотикам бактерии, как правило, дороги и имеют несколько вариантов доставки. Например, меропенум иногда назначают людям с пневмонией, менингитом или серьезными кожными инфекциями, которые вызваны микроорганизмами, устойчивыми к обычным антибиотикам. Меропенум можно вводить только путем внутривенной инъекции или инфузии, и он в два-три раза дороже, чем обычно назначаемые антибиотики при этих состояниях.
Кроме того, болезнетворные организмы иногда могут адаптироваться, чтобы они могли расти и размножаться на твердых поверхностях. Этот способ роста называется биопленкой. Окружающая среда биопленки вызывает множество изменений в растущих бактериях, некоторые из которых включают экспрессию ранее невыраженных генов и дезактивацию активно экспрессирующих генов. Структура биопленки и эти генетические изменения часто делают бактерии чрезвычайно устойчивыми ко многим антибиотикам. Биопленки иногда встречаются на некоторых поверхностях больниц и в имплантированных устройствах, таких как искусственные суставы и катетеры для длительного внутривенного доступа.
Устойчивые организмы чаще всего встречаются в местах, где наиболее широко используются противомикробные препараты. Поэтому они чаще всего встречаются в промышленно развитых странах. В Соединенных Штатах, например, около трети всех инфекций, вызванных Staphylococcus aureus , в настоящее время устойчивы к метициллину. Некоторые организмы, которые встречаются и лечатся почти исключительно в развивающихся странах, такие как паразиты малярии, развили устойчивые разновидности в этих регионах.
Когда врачи обнаруживают, что они пытаются лечить инфекцию с помощью резистентного организма, они используют метод проб и ошибок, чтобы найти лекарство, к которому этот организм не устойчив.Этот процесс обычно включает в себя пробу одного лекарства за другим, начиная с тех, которые наименее токсичны для пациента и наиболее специфичны для организма-мишени, и работая над лекарствами, которые менее желательны или потенциально вызывают более сильные побочные эффекты. Даже когда найдено действующее лекарство — а некоторые организмы теперь устойчивы ко всем агентам, применяемым против них, — задержка, связанная с этим процессом, опасна для пациента.
Центры США по контролю за заболеваниями (CDC) заявили, что устойчивость к антибиотикам является ключевой микробной угрозой для здоровья в Соединенных Штатах.В 1995 году CDC запустил Национальную кампанию по надлежащему использованию антибиотиков в обществе, которая в 2003 году была переименована в «Умей: знай, когда антибиотики работают». Эта кампания направлена на замедление развития устойчивости к антибиотикам, прежде всего за счет предотвращения ненужного использования антибиотиков при инфекциях верхних дыхательных путей. Семьдесят пять процентов антибиотиков, назначаемых врачами в офисе, предназначены для лечения инфекций верхних дыхательных путей, большинство из которых являются вирусными и, следовательно, не подвержены действию антибиотиков.
В последние годы устойчивость к противомикробным препаратам стала серьезной проблемой для общественного здравоохранения. По данным Национального института аллергии и инфекционных заболеваний США, туберкулез, гонорея, малярия и детские ушные инфекции сегодня лечить труднее из-за устойчивости к противомикробным препаратам, чем несколько десятилетий назад. Устойчивость к хлорохину, выработанная малярийным паразитом, угрожает миллионам жизней: с 1978 г. сообщалось о резистентности к хлорохину во всех тропических африканских странах, а в последние десятилетия она стала более распространенной.Воздействие на общественное здравоохранение было значительным: в некоторых африканских странах смертность от малярии увеличилась вдвое или втрое. В Сенегале детская смертность от малярии увеличилась в 6 раз по мере роста устойчивости к хлорохину. Все альтернативы хлорохину более дорогие и имеют сравнительно серьезные побочные эффекты.
Одним из наиболее спорных аспектов устойчивости к противомикробным препаратам сегодня является использование антибиотиков в сельском хозяйстве. Миллионы фунтов антибиотиков ежегодно скармливаются скоту в Соединенных Штатах и в других странах, в основном в качестве стимуляторов роста.Исследования последних нескольких десятилетий показали, что это способствует развитию устойчивых организмов. В 2005 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США запретило использование энрофлоксацина (антибактериального средства) у домашней птицы. Европейский Союз запретил использование ряда почти всех гормонов, способствующих росту, и противомикробных препаратов в сельском хозяйстве.
Некоторые эксперты также предупреждают, что почти повсеместное использование антимикробного домашнего мыла может способствовать развитию устойчивых организмов. Обычное мыло и вода смывают бактерии, а не убивают их напрямую, и поэтому не оказывают селективного давления на развитие устойчивости.Более того, исследования, проведенные в Индии, показали, что антимикробное мыло улучшает здоровье не больше, чем старомодное мыло.
Фаговая терапия — использование определенных вирусов для заражения и уничтожения бактерий — показывает некоторые перспективы в качестве альтернативной стратегии лечения инфекций, вызываемых множественно устойчивыми организмами, и исследования в этой области продолжаются.
См. Также Устойчивость к антибиотикам; Антимикробное мыло; Противовирусные препараты; Нозокомиальные (связанные со здравоохранением) инфекции; Устойчивые к ванкомицину энтерококки.
Книги
Сальерс, Эбигейл А. и Дикси Д. Уитт. Месть микробов: как устойчивость бактерий подрывает чудо антибиотиков . Вашингтон, округ Колумбия: ASM Press, 2005.
Periodicals
Cunha, Burke A. «Эффективные стратегии контроля устойчивости к антибиотикам». The Lancet 357 (2001): 1307.
Липсич, Марк и Мэтью Х. Самор. «Использование противомикробных препаратов и устойчивость к противомикробным препаратам: популяционная перспектива.» Новые инфекционные заболевания 8 (2002): 347-354.
Ши, Кэтрин М. «Устойчивость к антибиотикам: как влияет использование антибиотиков в сельском хозяйстве на здоровье детей?» Педиатрия 112 (2003): 253-258.
Смит, Дэвид Л. и др. «Сельскохозяйственные антибиотики и здоровье человека» PloS Medicine 2 (2005): 731-735.
Веб-сайты
Центры по контролю заболеваний (правительство США) . «План действий общественного здравоохранения по борьбе с устойчивостью к антибиотикам.”9 февраля 2005 г.
Центры по контролю за заболеваниями (правительство США) . «Об устойчивости к антибиотикам». 21 апреля 2006 г.
О резистентности — АЛЬЯНС ДЛЯ РАЗУМНОГО ИСПОЛЬЗОВАНИЯ АНТИБИОТИКОВ
Что такое устойчивость к антибиотикам?
Устойчивость к антибиотикам возникает, когда антибиотик теряет способность эффективно контролировать или уничтожать рост бактерий; Другими словами, бактерии «устойчивы» и продолжают размножаться в присутствии терапевтических уровней антибиотика.
Почему бактерии становятся устойчивыми к антибиотикам?
Устойчивость к антибиотикам — естественное явление. Когда используется антибиотик, бактерии, которые могут противостоять этому антибиотику, имеют больше шансов на выживание, чем «чувствительные». Чувствительные бактерии уничтожаются или ингибируются антибиотиком, что приводит к селективному давлению для выживания устойчивых штаммов бактерий.
Некоторая устойчивость возникает без вмешательства человека, поскольку бактерии могут производить и использовать антибиотики против других бактерий, что приводит к низкому уровню естественного отбора на устойчивость к антибиотикам.Однако нынешний более высокий уровень устойчивых к антибиотикам бактерий объясняется чрезмерным использованием и злоупотреблением антибиотиками. В некоторых странах и через Интернет антибиотики можно приобрести без рецепта врача. Иногда пациенты без необходимости принимают антибиотики для лечения вирусных заболеваний, таких как простуда.
Как бактерии становятся устойчивыми?
Некоторые бактерии обладают естественной устойчивостью к определенным типам антибиотиков. Однако бактерии также могут стать устойчивыми двумя способами: 1) в результате генетической мутации или 2) в результате приобретения устойчивости от другой бактерии.
Мутации, редкие спонтанные изменения генетического материала бактерий, как полагают, происходят примерно в одной из миллиона — в одной из десяти миллионов клеток. Различные генетические мутации приводят к разным типам устойчивости. Некоторые мутации позволяют бактериям производить сильнодействующие химические вещества (ферменты), инактивирующие антибиотики, в то время как другие мутации уничтожают клетку-мишень, которую атакует антибиотик. Третьи закрывают входные порты, через которые антибиотики попадают в клетку, а другие производят насосные механизмы, которые выводят антибиотик обратно наружу, чтобы он никогда не достиг своей цели.
Бактерии могут приобретать гены устойчивости к антибиотикам от других бактерий несколькими способами. Проходя простой процесс спаривания, называемый «конъюгацией», бактерии могут передавать генетический материал, включая гены, кодирующие устойчивость к антибиотикам (обнаруженные в плазмидах и транспозонах) от одной бактерии к другой. Вирусы — еще один механизм передачи признаков устойчивости между бактериями. Признаки устойчивости одной бактерии заключены в головную часть вируса. Затем вирус привносит признаки устойчивости в любые новые бактерии, которые он атакует.Бактерии также обладают способностью приобретать «свободную» ДНК от окружающей среды.
Любые бактерии, которые приобретают гены устойчивости в результате спонтанной мутации или генетического обмена с другими бактериями, обладают способностью противостоять одному или нескольким антибиотикам. Поскольку со временем бактерии могут приобретать несколько признаков устойчивости, они могут стать устойчивыми ко многим различным семействам антибиотиков.
Как распространяется устойчивость к антибиотикам?
Генетически устойчивость к антибиотикам распространяется через популяции бактерий как «вертикально», когда новые поколения наследуют гены устойчивости к антибиотикам, так и «горизонтально», когда бактерии делятся или обмениваются секциями генетического материала с другими бактериями.Горизонтальный перенос генов может происходить даже между разными видами бактерий. В экологическом отношении устойчивость к антибиотикам распространяется по мере того, как бактерии сами перемещаются с места на место; бактерии могут путешествовать через самолет, воду и ветер. Люди могут передавать резистентные бактерии другим; например, при кашле или контакте с немытыми руками.
Могут ли бактерии потерять устойчивость к антибиотикам?
Да, признаки устойчивости к антибиотикам можно утратить, но этот обратный процесс происходит медленнее.Если давление отбора, оказываемое присутствием антибиотика, устранено, популяция бактерий потенциально может вернуться в популяцию бактерий, которая реагирует на антибиотики.
Лекарственно-устойчивые бактерии — растущая проблема для здоровья — Harvard Health Blog
Устойчивые к антибиотикам бактерии ежегодно заболевают более двух миллионов американцев и являются причиной не менее 23000 смертей. Основная причина? Чрезмерное употребление антибиотиков.
В новом отчете Центров по контролю и профилактике заболеваний, Угрозы устойчивости к антибиотикам в США, 2013 , подробно описаны медицинские и финансовые затраты, связанные с устойчивостью к антибиотикам в Соединенных Штатах.Что касается здоровья, то устойчивость к антибиотикам должна входить в число 15 основных причин смерти по данным CDC. Это также добавляет 20 миллиардов долларов прямых затрат на здравоохранение. И проблема может усугубиться, прежде чем станет лучше.
«Устойчивость к антибиотикам растет ко многим различным патогенам, которые представляют угрозу для здоровья», — сказал директор CDC Том Фриден, доктор медицины, в подготовленном заявлении. «Если мы не будем действовать сейчас, наша аптечка опустеет, и у нас не будет антибиотиков, необходимых для спасения жизней».
Это очень сильные слова директора CDC.Как и многие врачи и граждане по всей стране, я остро осознаю опасность антибиотиков. Тем не менее слова доктора Фридена привлекли мое внимание.
Объяснение устойчивости к антибиотикам
Что такое устойчивость к антибиотикам? Вот простой пример. Если у вас стрептококковая ангина и вы принимаете пенициллин для лечения этой болезни, пенициллин убьет большую часть стрептококковых (стрептококковых) бактерий. Но некоторые стрептококковые бактерии могут выжить. Эти выжившие по разным причинам устойчивы к лекарствам.В следующий раз ангина может не отреагировать на пенициллин.
Вы можете приобрести лекарственно-устойчивые бактерии разными способами. Они могут возникнуть из-за чрезмерного употребления антибиотиков или их приема, когда в них нет необходимости, например, при вирусной инфекции. Вы можете развить устойчивость к антибиотикам, употребляя в пищу мясо, обработанное антибиотиками. Также возможно заразиться устойчивой к антибиотикам инфекцией от других людей — даже, к сожалению, от медицинских работников.
Почему устойчивость к антибиотикам является проблемой? Основная проблема заключается в том, что широко используемые антибиотики станут менее эффективными для лечения распространенных инфекций.Это означает, что врачи должны обратиться к более сильным, а иногда и менее дружественным антибиотикам, иначе в их арсенале может ничего не оказаться.
В своем отчете CDC определил три типа бактерий как неотложную опасность:
- Clostridium difficile . Эти бактерии могут вызывать тяжелую диарею, особенно у пожилых людей и тех, кто страдает серьезными заболеваниями.
- Enterobacteriaceae. Эти бактерии, которые обычно живут в пищеварительном тракте, могут проникать в другие части тела, например, в мочевыводящие пути, и вызывать инфекции.
- Neisseria gonorrhoeae. Эти бактерии вызывают гонорею, инфекцию, передающуюся половым путем.
Многие другие бактерии были перечислены как «серьезные» или «опасные». Среди них были некоторые очень распространенные бактерии, вызывающие пневмонию и ангины. Грибы, вызывающие некоторые распространенные дрожжевые инфекции, также попали в «серьезный» список.
CDC воспользовался возможностью, чтобы раскрыть четырехкомпонентный подход к мониторингу и решению проблемы. Его цель:
- предотвращение инфекций и распространения устойчивости к антибиотикам
- отслеживает устойчивые к антибиотикам инфекции по стране
- улучшить то, как врачи, пациенты, фермеры и другие лица используют антибиотики, и избежать их чрезмерного использования
- разрабатывает новые антибиотики и тесты для выявления устойчивости к антибиотикам
Принятие мер
Каждый может помочь уменьшить влияние устойчивости к антибиотикам и замедлить ее рост или даже полностью изменить ее.В первую очередь важно предотвратить заражение. Вот несколько шагов:
- Снизить чрезмерное употребление антибиотиков. Знайте, когда антибиотики действуют, а когда нет. Не требуйте от врача антибиотиков. Спросите, повлияют ли они на ваши симптомы. Кампания CDC Get Smart предлагает советы и инструменты.
- Предотвратить инфекции. Мытье рук (с обычным, не антибактериальным мылом) — отличный способ предотвратить все инфекции. Важны и другие меры гигиены.Например, чихайте в локоть, а не в руку. Больницы могут снизить риск с помощью продуманных мер и программ инфекционного контроля.
- Будьте в курсе своих прививок. Вакцинация от пневмонии может помочь снизить устойчивость к очень распространенным пневмококковым бактериям.
- Практикуйте безопасный секс. Используйте презервативы, чтобы предотвратить распространение болезней, передающихся половым путем.
- Узнайте больше об использовании антибиотиков в нашей пищевой цепи. Эти препараты также могут повышать устойчивость к антибиотикам. Принимайте обоснованные решения относительно продуктов, которые вы покупаете.
Я надеюсь, что этот важный отчет станет началом серьезной кампании против устойчивости к антибиотикам. Если эти идеи сработают, мы можем увидеть снижение сопротивляемости и инфекций. Если они этого не сделают, то мы будем идти по тревожному пути в нашей способности противостоять серьезным, опасным для жизни инфекциям.
Устойчивость к антибиотикам не только затрудняет уничтожение бактерий, но и делает их сильнее
Антибиотики — прекрасные лекарства для лечения бактериальных инфекций.К сожалению, болезнетворные бактерии могут стать устойчивыми к антибиотикам, которые их убивают. Это называется селективным давлением — бактерии, восприимчивые к действию препарата, погибают, а те, которые выдерживают действие антибиотика, выживают и размножаются. Этот процесс приводит к появлению устойчивых к антибиотикам штаммов.
Когда бактериальный штамм становится устойчивым к нескольким различным антибиотикам, он становится микробом с множественной лекарственной устойчивостью (МЛУ). Когда практически нет доступных антибиотиков для лечения инфицированного пациента, микроб считается «панрезистентным».«Эти штаммы становятся все более и более распространенными в больницах и в обществе в целом. Возможно, вы слышали о некоторых из них: например, устойчивый к метициллину Staphylococcus aureus (MRSA), устойчивый к ванкомицину Enterococci (VRE) и устойчивый к карбапенемам Enterobacteriaceae (CRE).
Бактерии могут стать устойчивыми к лекарствам двумя способами: устойчивость может быть естественной, что означает, что гены, ответственные за устойчивость, уже присутствуют в бактериальной хромосоме, или они могут быть приобретены путем мутации или заимствования генов устойчивости к антибиотикам от других микробов.
Теперь можно использовать новые технологии секвенирования ДНК, чтобы лучше понять, как устойчивость к антибиотикам может сделать некоторые бактерии слабее или сильнее. И в новом исследовании мы обнаружили, что — вопреки общепринятому мнению относительно антибиотиков — резистентность действительно может сделать некоторые бактерии более жизнеспособными и даже более опасными.
Штамм бактерий MRSA (устойчивый к метициллину Staphylococcus aureus) обнаружен в чашке Петри, содержащей агаровое желе для бактериальной культуры, в микробиологической лаборатории в Берлине.Фабрицио Бенш / ReutersВсегда ли фитнес — это цена устойчивости к антибиотикам?
На протяжении десятилетий в области инфекционных заболеваний установившейся догмой была так называемая «стоимость устойчивости к антибиотикам». Мы полагали, что для бактерий существует компромисс между устойчивостью к антибиотикам и тем, насколько хорошо они могут выполнять свои обычные жизненные задачи.
Идея состоит в том, что, хотя устойчивые к антибиотикам штаммы вызывают инфекции, которые труднее лечить, они также менее устойчивы.Либо они менее способны выжить в инфицированном хозяине, и / или менее вирулентны, вызывая менее серьезную инфекцию, с пониженной способностью передаваться другому человеку.
И мы знаем, что эта картина верна для некоторых бактерий. И Mycobacterium tuberculosis (вызывающая туберкулез), и Mycobacterium leprae (вызывающая проказу) могут стать устойчивыми к препарату рифампицин, который является одним из основных антибиотиков, используемых для лечения этих заболеваний.
Для M. tuberculosis и M. leprae устойчивость к рифампицину возникает благодаря мутации в одном гене. Мутация дает бактериям способность противостоять антибиотикам, но мешает нормальной физиологии клеток и факторам, которые делают их вирулентными. Как и следовало ожидать, сопротивление в этом случае имеет очевидную цену.
Но что, если сопротивление действительно делает некоторые бактерии более сильными и смертоносными? Наша команда использовала методы секвенирования ДНК, чтобы выявить взаимосвязь между устойчивостью к антибиотикам и стоимостью приспособленности при инфекциях у лабораторных животных.Оказывается, что у некоторых бактерий устойчивость к лекарствам на самом деле делает их более приспособленными.
Использование «прыгающих генов» для сравнения сопротивляемости и физической формы
Мы проанализировали бактерию под названием Pseudomonas aeruginosa . Это основная причина инфекций у людей с муковисцидозом, а также у очень больных пациентов в отделениях интенсивной терапии (ОИТ) и людей с ослабленной иммунной системой.
P. aeruginosa обладает естественной устойчивостью к нескольким антибиотикам и может приобретать устойчивость ко многим другим, что приводит к устойчивости к нескольким лекарствам или даже к пан-устойчивым.
Чтобы выяснить, есть ли стоимость приспособленности из-за устойчивости, мы создали мутантные штаммы P. aeruginosa , используя «прыгающие гены» для вставки мутаций в бактерии. Поскольку мы хотели узнать, во что обходится устойчивость, мы создали два вида мутантных штаммов. Некоторые мутантные штаммы потеряли свои естественные гены устойчивости, в то время как другие мутантные штаммы приобрели устойчивость из-за инактивации генов, которые сделали их восприимчивыми к антибиотикам.
Это означало, что мы могли использовать секвенирование ДНК, чтобы определить, как потеря каждого мутировавшего гена повлияла на общую способность P.aeruginosa , чтобы вызвать инфекцию у мышей и общую приспособленность бактерии.
Устойчивость к антибиотикам не всегда обходится дорого
При наличии такого организма, как P. aeruginosa , врачи часто обращаются к классу антибиотиков, называемых карбапенемами, для лечения инфекций. Карбапенемы убивают P. aeruginosa через канал или поры во внешней стенке бактерий, образованные белком OprD. Эта пора пропускает карбапенемы, что убивает клетку. Более чем в 70% случаев инфицирования людей устойчивыми к карбапенемам штаммами P.aeruginosa, бактерия перестала образовывать поры OprD — это означает, что антибиотик-убийца теперь не может проникнуть внутрь клетки. Мы создали мутантные штаммы P. aeruginosa , которые не могли продуцировать белок OprD, что придало им приобретенную устойчивость к карбапенемам.
В наших экспериментах выяснилось, что приспособленность не является компромиссом для устойчивости у P. aeruginosa . Мы обнаружили, что наиболее подходящими мутантами были те, которые стали устойчивыми к карбапенемам, потому что белок OprD больше не производился.
40% штаммов, выделенных из желудочно-кишечного тракта мышей, были мутантами OprD. Мышь через www.shutterstock.comУ мышей с инфекциями P. aeruginosa в желудочно-кишечном тракте мутанты OprD первоначально составляли менее 0,1% штаммов, используемых для установления инфекции. Но через пять дней мутанты OprD составили более 40% штаммов, которые мы извлекли из желудочно-кишечного тракта мышей. «Мутантные» бактерии распространялись не только потому, что их было трудно убить (мы не давали никаких антибиотиков), но потому, что они были более приспособленными, чем другие бактериальные штаммы, заражающие мышей.
Мы видели нечто подобное, когда использовали мутантные штаммы, чтобы вызвать у мышей бактериальную пневмонию. Мутанты OprD снова стали преобладающими штаммами, но многие из них были также устойчивы к другому распространенному антибиотику, называемому фосфомицином. Подобно устойчивости к карбапенему, устойчивость к фосфомицину также обусловлена одним геном.
В целом, когда бактерии приобрели устойчивость к фосфомицину и карбапенемным антибиотикам, они стали более здоровыми и более вирулентными. Это противоречит более общепринятой концепции, согласно которой из-за устойчивости к антибиотикам приходится платить за фитнес.
Фактически, мы обнаружили, что мутантные штаммы, утратившие свою естественную устойчивость к антибиотикам, стали менее пригодными. Таким образом, приобретение сопротивления делало бактериальные клетки сильнее, а потеря сопротивления делала их слабее.
А как насчет других видов бактерий?
Чтобы увидеть, ограничен ли этот эффект P. aerginoa , мы решили посмотреть на два других вида бактерий, чтобы увидеть, делает ли их устойчивость к антибиотикам также более приспособленными.
Мы изучили еще один организм с множественной и даже общей лекарственной устойчивостью к антибиотикам, названный Acinetobacter baumannii , который вызывает множество типов тяжелых инфекций в легких, крови и коже, и бактерию, не устойчивую к лекарственным средствам, Vibrio cholerae , которая вызывает холеру. V. cholera также имеет некоторые естественные гены устойчивости к антибиотикам.
Вместе с соавторами докторами Джоном Мекаланосом и Стивеном Лори из Гарвардской медицинской школы мы обнаружили, что для A. baumannii и V. cholerae потеря устойчивости к антибиотикам была связана с потерей физической формы и ослабленной способностью вызывать инфекцию.
Но когда бактерии приобрели устойчивость к антибиотикам в результате генетической мутации, они стали более вирулентными и обладали большей способностью вызывать инфекции на доклинических лабораторных моделях инфекций.
Недостаточно обеспечить правильное использование антибиотиков. Мытье рук очень важно для борьбы с распространением бактерий. Мытье рук через www.shutterstock.comЧто это означает для стратегий борьбы с устойчивыми к антибиотикам бактериями?
Мы не ожидаем, что эти результаты будут верны для всех видов бактерий. Но даже если они применимы только к некоторым организмам, это означает, что устойчивые штаммы не исчезнут, если мы просто уменьшим или будем контролировать использование антибиотиков.
Существует общее мнение, что если антибиотики используются только при необходимости, чувствительные к антибиотикам штаммы будут вытеснять менее приспособленные, но устойчивые штаммы.Но этой стратегии может быть недостаточно для борьбы с бактериями, которые становятся сильнее, когда становятся устойчивыми к лекарствам, а не становятся слабее.
Мытье рук и сопутствующие меры могут контролировать распространение устойчивых бактерий. Но нам также нужны вакцины и готовые антитела, которые можно вводить людям, которые находятся в группе риска или действительно инфицированы лекарственно-устойчивыми микробами.
