Сколько выводятся антибиотики из организма: очищение организма
Наверное, каждый из нас хоть раз интересовался вопросом: сколько выводятся антибиотики из организма? Вопрос и в самом деле имеет важное значение, ведь именно от того, за сколько выводятся антибиотики из организма, напрямую зависит безопасность и степень эффективности лечения данными препаратами.
От того, как долго выводятся антибиотики, зависит периодичность и длительность всего лечения. Например, есть препараты, которые пациенту следует принимать раз в 4 часа, а есть такие, которые можно пить только один раз в несколько дней. В процессе приема препарат концентрируется в определенных органах, и таким местом концентрации в большей степени определяются особенности его назначения врачом. Например, Линкомицин лучше всего накапливается в костях, поэтому чаще применятся именно при лечении воспалительных процессов в костных тканях.
Некоторые виды антибиотиков действуют по-другому – прикрепляясь к фагоцитам (клетки иммунной системы человека). При воспалительном процессе иммунные клетки концентрируются в этой области. Для подготовки к билетам на квадроцикл категории А1 пройдите тестирование на сайте AllPdd.ru.
При воспалительном процессе иммунные клетки концентрируются в этой области. Для подготовки к билетам на квадроцикл категории А1 пройдите тестирование на сайте AllPdd.ru.
Сколько выводится антибиотиков из организма за определенный период времени важно знать больше врачу, нежели его пациенту. Все дело в том, что при назначении курса лечения врач определяет совместимость тех или иных лекарственных препаратов. Лекарства, несовместимые с антибактериальными веществами, могут быть назначены исключительно после того, как они будут полностью выведены из организма.
Через сколько антибиотик полностью выводится, и где он накапливается определяется его химическим составом.
Отдельно стоит отметить, что время очищения организма должны обязательно учитывать семьи, планирующие рождение ребенка. Важно понимать и помнить, что целый ряд антибактериальных лекарственных средств могут негативным образом сказаться как непосредственно на процессе зачатия, так и на здоровье ребенка. Например, антибиотик из группы тетрадиклинов может негативно влиять на зачатие спустя 2 месяца после его приема.
Факторы, влияющие на скорость вывода
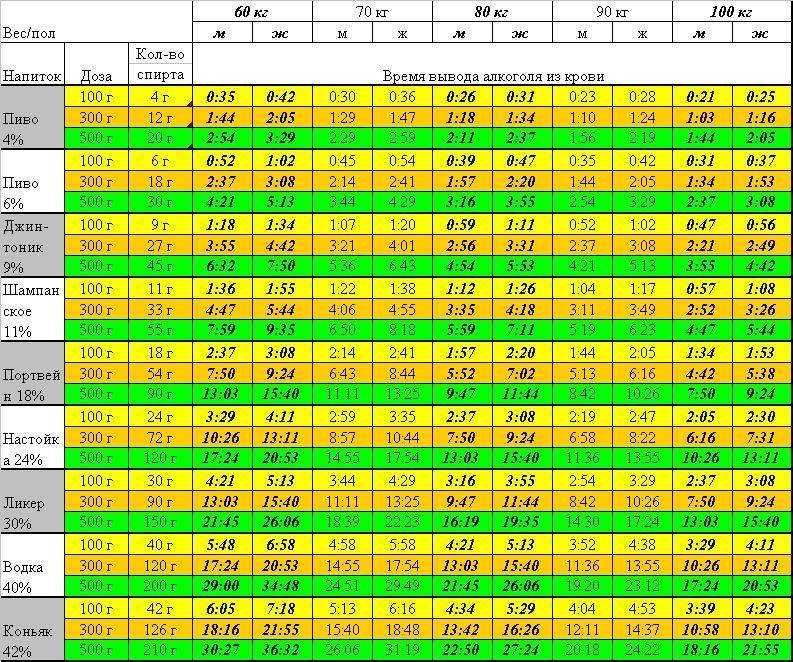
В среднем для полного вывода антибиотика организму требуется 6-12 часов. Однако следует отметить, что существуют препараты, которые выводятся дольше – около 14-ти дней. Через какое время из организма будет выведен антибиотик зависит не только от его химического состава, но и от целого ряда факторов:
- Формы, в которой он принимался. В виде инъекции препарат быстрее достигает лечебной концентрации и выводится на протяжении 12-ти часов. Если речь идет о таблетках, то по сравнению с инъекцией выводятся они достаточно медленно – до 3-х суток.
- Возраста пациента. После проведения целого ряда исследований на предмет, сколько времени необходимо для вывода антибиотиков у мужчин и женщин разных возрастов, было установлено, что у старших людей антибиотик выводится несколько дольше.
- Наличия или отсутствия хронических форм заболеваний. Например, если у пациента есть хроническое заболевание почек токсины из организма, равно как лекарственные препараты выведутся медленнее, чем у человека, не страдающего таким заболеванием.

- Образа жизни, которого придерживается человек. Врачи и фармацевты сходятся во мнении, что после лечения антибиотик выводится гораздо быстрее у людей, которые занимаются спортом и ведут активный образ жизни. Важен и рацион питания – прием в пищу качественных и полезных продуктов позитивно влияет на состояние организма и скорость его очищения.
Как ускорить очищение организма
Прежде подчеркнем, что при обычном курсе лечения каким-либо образом влиять на процесс вывода антибиотиков нежелательно, ведь для каждого лекарственного препарата характерна определенная продолжительность действия, и необходимо выждать этот период для того, чтобы препарат дал положительный результат. Тем не менее, очень часто имеют место ситуации, при которых необходимо ускорить процесс выведения лекарства. Например, быстрый вывод лекарства может потребоваться в случае, если у пациента возникла на него непредвиденная аллергическая реакция. Как вывести антибиотики из организма максимально быстро? Способствовать быстрому очищению организма можно медикаментозными и народными средствами.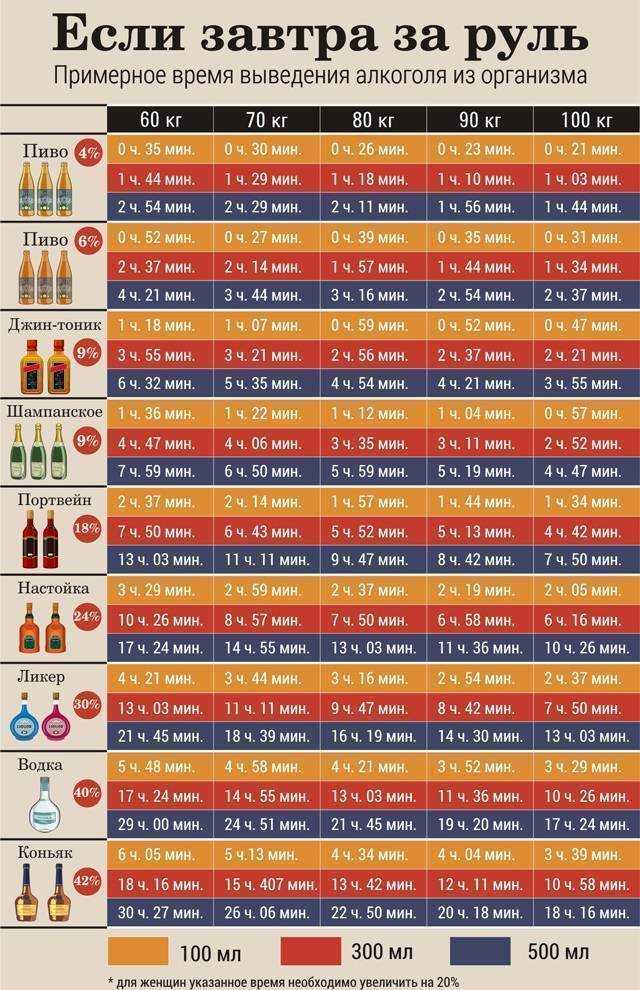 Рассмотрим каждый способ детально.
Рассмотрим каждый способ детально.
Медикаментозные методики
Большинство рассматриваемых нами препаратов выводятся кишечником и печенью. Следовательно, чаще всего после приема антибиотиков нарушается нормальная микрофлора именно этих органов. Для того чтобы быстрее вывести токсины и остатки лекарства врач может прописать пациенту прием:
— лекарственных средств, действие которых направленно на восстановление правильной работы печени;
— лекарственных средств, содержащих в своем составе бифидобактерии, благоприятно влияющие на нормализацию работы кишечника;
— комбинированные лекарственные средства, включающие в свой состав витамины, благоприятно влияющие на нормализацию работы и печени, и кишечника.
Сколько времени выводится антибиотик из организма при сильных передозировках или возникновении тяжелой аллергической реакции? Здесь стоит отметить, что в данном случае шлаки и антибактериальные вещества могут выводиться исключительно путем проведения специальной дезинтоксикационной терапии.2007/ukr/6/1.png) Такие терапевтические мероприятия осуществляются исключительно в стационарных условиях под постоянным наблюдением лечащего врача.
Такие терапевтические мероприятия осуществляются исключительно в стационарных условиях под постоянным наблюдением лечащего врача.
Народные средства
Вывести из организма лекарство можно и соответствующими народными средствами. Такие средства достаточно просто приготовить в домашних условиях и следует использовать в сочетании с очищающими организм медикаментами. Рассмотрим несколько действительно эффективных и распространенных рецептов:
- В емкость подходящего объема наливается 400 мл слегка подогретой воды. В воду добавляют чайную ложку меда и столовую ложку свежевыжатого лимонного сока. Ежедневно необходимо употреблять все 400 мл такого лекарства.
- В емкости объемом 2л готовится крапивный отвар (на 1л воды 1 ст. ложка сухих или молодых листьев). В день употребляется до 2-х литров отвара. Длительность приема – 2 недели.
- В одинаковых пропорциях берутся листья черники, корень аира, кора дуба. В термос кладут две столовые ложки этой смеси и заливают ее 1л кипятка.

Отдельно стоит вспомнить о необходимости включения в рацион питания продуктов, благоприятно влияющих на очищение организма после антибиотиков. К таким продуктам можно отнести: ряженку, бананы, петрушка. Вспомним также и о том, что хорошие результаты показывает регулярное употребление гречневых и овсяных круп.
Кроме упомянутого стоит отметить, что очистке кишечника и печени способствуют различные чаи. Благодаря наличию в них танинов происходит активная очистка организма от токсинов. В целом очень полезно употреблять как можно больше жидкости, ведь с ней выходят вредные вещества.
Подведем итоги
Дать однозначный ответ на вопросы как быстро и сколько дней требуется организму для полного очищения от лекарственных препаратов невозможно. Слишком много факторов оказывают влияние на данный процесс. Однако если вы принимали лекарство в правильной дозировке и не дольше того времени, чем это было нужно, поводов для беспокойства у вас быть не должно – ваш организм сам достаточно быстро очистится от принимаемых лекарств.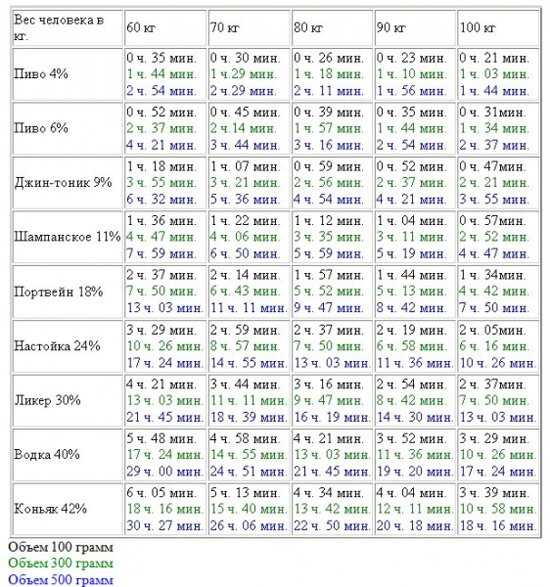
Сколько выводятся из организма антибиотики и как ускорить этот процесс
Не секрет, что использование медикаментозных препаратов не только избавляет от болезни, но и наносит некоторый вред человеческому телу. Вот поэтому следует знать, сколько выводятся из организма антибиотики. Ведь именно эти препараты чаще всего используются при лечении.
Как действуют
Лечение происходит следующим образом: антибиотики предотвращают рост микроорганизмов, что ведет к избавлению от воспалительного процесса. Это положительный момент, а теперь переходим к отрицательному, побочным действиям препарата.
- Происходит нарушение дыхания клетки, а это ведет к появлению кислородного голодания.
- Лекарство подавляет не только плохую микрофлору, но и полезную. Со временем ее замещают бактерии, которые устойчивы к препарату.
- Снижается иммунитет, долгое употребление антибиотиков может привести к полному его уничтожению.
- Печень истощается, она уже не может защищать организм от поступающих в него токсинов.
 Они начинают скапливаться в органе, что через некоторое время приводит к загрязнению организма.
Они начинают скапливаться в органе, что через некоторое время приводит к загрязнению организма.
Все эти негативные последствия возникают при приеме большого количества препарата. От него надо побыстрее избавиться, вот поэтому следует знать, через сколько выводится антибиотик из организма, какими способами можно этот процесс ускорить.
Как препараты выводятся
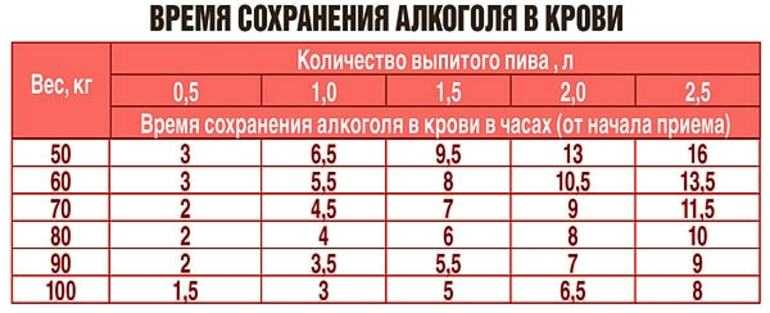
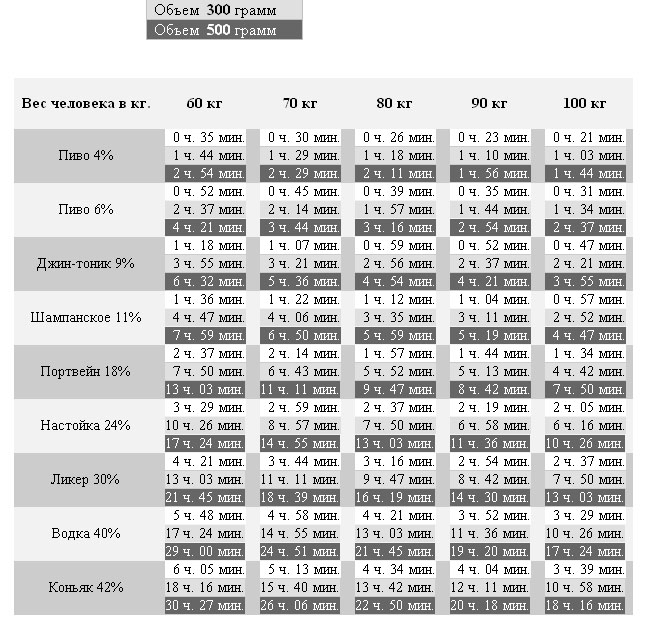
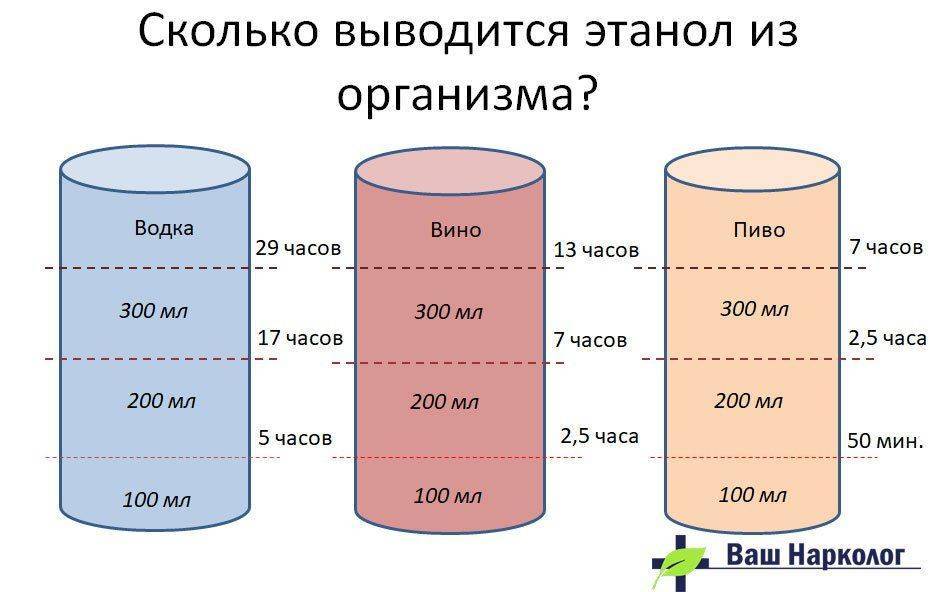
Существует мнение, что антибиотики выводятся из организма сложно. Их вредное воздействие человек чувствует очень долго. Большинство препаратов этой группы выходят вместе с мочой в течение восьми часов. В этот период в жидкости их концентрация велика. Только через два дня после завершения приема антибиотиков их количество в моче становится минимальным.
Сколько дней антибиотики выводятся из организма, зависит от:
- самого препарата;
- болезни;
- питания.
Некоторые лекарственные средства уходят вместе с калом. К этой группе относится натамицин. Его используют для избавления от микоза. Он почти не всасывается из желудочно-кишечного тракта.
Он почти не всасывается из желудочно-кишечного тракта.
Гентамицин и пенициллин выводятся только вместе с мочой.
Рифампицин и тетрациклин выходят из организма с мочой и желчью.
Если говорить о том, сколько выводятся из организма антибиотики, то этот период составляет от одного до семи дней. Как уже было сказано выше, этот срок зависит от нескольких причин.
О них более подробно
Основным фактором, влияющим на выведение антибиотика, является его химический состав. Для примера: азитромицин сохраняет высокую концентрацию через неделю после трехдневного курса, а цефазолин (инъекция) уже через сутки не обнаруживается в организме.
Второй фактор – это путь введения препарата и его лекарственная форма. При помощи инъекции можно добиться высокой концентрации лекарств очень быстро. Для их выведения тоже не потребуется много времени, от шести до двенадцати часов. Таблетки, капсулы действуют от двенадцати до двадцати четырех часов.
Сколько времени выводятся антибиотики из организма, зависит от возраста человека и состояния его внутренних органов.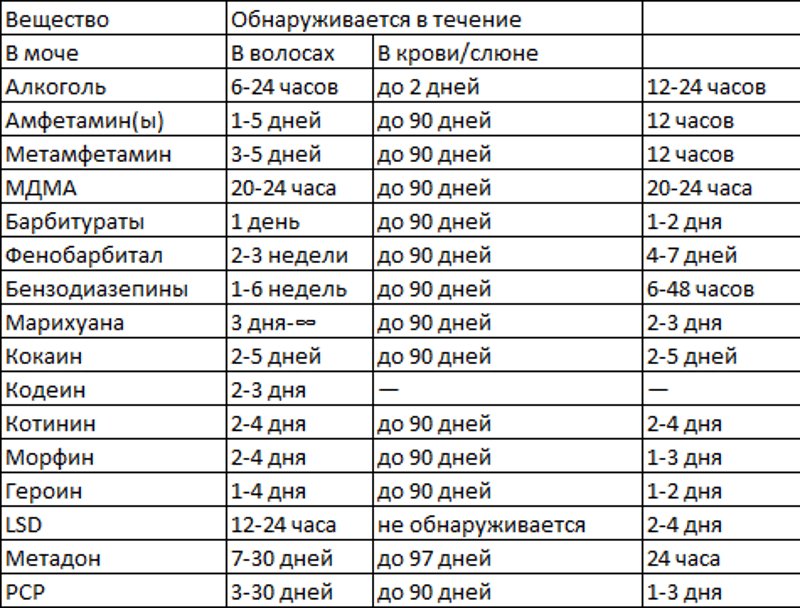 У пожилых людей и детей они выходят медленнее. Тормозят выведение лекарственных препаратов заболевания печени, почек, мочеполовой системы.
У пожилых людей и детей они выходят медленнее. Тормозят выведение лекарственных препаратов заболевания печени, почек, мочеполовой системы.
Еще один немаловажный фактор, и о нем не стоит забывать, – пища. Ни в коем случае нельзя нарушать последовательность применения антибиотика (до или после пищи). И помните, употребление жидкости и кисломолочных продуктов способствует ускорению выведения токсинов из тканей.
Помогает народная медицина
Для того чтобы ускорить процесс выведения антибиотиков из организма, можно прибегнуть к народной медицине. Несколько рецептов вам в помощь. Следующие сборы – это то, что пригодится:
- Листья черники, ягоды черемухи, кора дуба и корень аира.
- Ягоды черноплодной рябины, цветки черемухи, кора дуба и осины, спорыш, часть, растущая над землей, корень аира.
- Ольховые шишки, тысячелистник, часть, растущая над землей, цветки и плоды черемухи, плоды софоры, змеиный горец корень.
Сколько выводятся из организма антибиотики, зависит от правильности приготовления этих отваров. Вот об этом сейчас и поговорим.
Вот об этом сейчас и поговорим.
Все растения берутся в одинаковых пропорциях. Их измельчают и тщательно перемешивают. Полученная смесь засыпается в термос, заливается кипятком и оставляется на ночь. На один литр воды берется две столовые ложки смеси. Настой выпивается в течение суток, курс лечения — три месяца.
Неплохим средством выведения токсинов из организма является чай из листьев крапивы. Берется два литра крутого кипятка. К нему добавляется две столовые ложки сырья. Несколько минут заваривается, процеживается. На протяжении двух недель следует пить по полстакана несколько раз в день.
Заключение
Так все-таки, сколько выводятся из организма антибиотики? Однозначного ответа на данный вопрос нет. Как уже было сказано выше, продолжительность периода зависит от многих факторов. В среднем считается, что препараты выводятся около семи дней, но стоит делать корректировку на возраст человека, состояние его здоровья и интенсивность воздействия антибиотиков.
Остаточное выделение антибактериальных препаратов с мочой как показатель выбора терапевтического лечения и обработки сельскохозяйственных отходов действия по разработке эффективных альтернатив.
 Междунар. Дж. Антимикроб. Агенты. 2007; 49:12–24. doi: 10.1016/j.ijantimicag.2016.08.006. [PubMed] [CrossRef] [Google Scholar]
Междунар. Дж. Антимикроб. Агенты. 2007; 49:12–24. doi: 10.1016/j.ijantimicag.2016.08.006. [PubMed] [CrossRef] [Google Scholar]2. Диана А., Сантинелло М., Пенаса М., Скали Ф., Магни Э., Алборали Г.Л., Бертокки Л., Де Марчи М. Использование противомикробных препаратов в говядине крупный рогатый скот: обсервационное исследование на севере Италии. Пред. Вет. Мед. 2020;81:105032. doi: 10.1016/j.prevetmed.2020.105032. [PubMed] [CrossRef] [Академия Google]
3. Van Boeckel T.P., Glennon E.E., Chen D., Gilbert M., Robinson T.P., Grenfell B.T., Levin S.A., Bonhoeffer S., Laxminarayan R. Сокращение использования противомикробных препаратов у сельскохозяйственных животных. Наука. 2017; 357:1350–1352. doi: 10.1126/science.aao1495. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. O’Neill J. The Review on Antimicrobial Resistance. Wellcome Trust, правительство Ее Величества; Лондон, Великобритания: 2015 г. [(по состоянию на 19 ноября 2020 г.)]. Противомикробные препараты в сельском хозяйстве и окружающей среде: сокращение ненужного использования и отходов; стр. 1–44. Доступно в Интернете: https://amr-review.org/sites/default/files/Antimicrobials%20in%20agriculture%20and%20the%20environment%20-%20Reduction%20unnecessary%20use%20and%20waste.pdf [Google Scholar]
1–44. Доступно в Интернете: https://amr-review.org/sites/default/files/Antimicrobials%20in%20agriculture%20and%20the%20environment%20-%20Reduction%20unnecessary%20use%20and%20waste.pdf [Google Scholar]
5. Тан К.Л., Кэффри Н.П., Нобрега Д.Б., Корк С.С., Ронксли П.Е., Баркема Х.В., Полачек А.Дж., Ганшрон Х., Шарма Н., Келлнер Дж.Д. и др. Ограничение использования антибиотиков у сельскохозяйственных животных и его связь с устойчивостью к антибиотикам у сельскохозяйственных животных и людей: систематический обзор и метаанализ. Ланцет Планета Здоровье. 2017;1:316–327. doi: 10.1016/S2542-5196(17)30141-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. EMA (Европейское медицинское агентство) Категоризация антибиотиков для использования у животных для разумного и ответственного использования. [(по состоянию на 27 апреля 2021 г.)]; 2020 г. Доступно в Интернете: https://www.ema.europa.eu/en/documents/report/infographic-categorisation-antibiotics-use-animals-prudent-responsible-use_en. pdf
pdf
7. Регламент (ЕС) 2019/4 Европейского парламента и Совета от 11 декабря 2018 г. о производстве, размещении на рынке и использовании лечебных кормов, вносящий поправки в Регламент (ЕС) № 183/2005 Европейского Парламента и Совета и отменяющей Директиву Совета 90/167/ЕЕС. [(по состоянию на 23 марта 2021 г.)]; Off. Дж. Евр. Союз. 2019 Л. 4:1–23. Доступно в Интернете: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32019R0004 [Google Scholar]
8. Регламент (ЕС) 2019 г./6 Европейского парламента и Совета от 11 декабря 2018 г. о ветеринарных лекарственных препаратах и отменяющей Директиву 2001/82/ЕС. [(по состоянию на 23 марта 2021 г.)]; Off. Дж. Евр. Союз. 2019 Л. 4:43–167. Доступно в Интернете: https://www.legislation.gov.uk/eur/2019/6 [Google Scholar]
9. Riviere J.E., Spoo J.W. Глава 42. Антибиотики тетрациклинового ряда. В: Адамс Р.Х., редактор. Ветеринарная фармакология и терапия. 8-е изд. Издательство государственного университета Айовы; Эймс, ИА, США: 2001. стр. 828–940. [Академия Google]
стр. 828–940. [Академия Google]
10. Папич М.Г., Ривьер Ж.Э. Глава 45. Фторхинолоновые антимикробные препараты. В: Адамс Р.Х., редактор. Ветеринарная фармакология и терапия. 8-е изд. Издательство государственного университета Айовы; Эймс, ИА, США: 2001. стр. 898–917. [Google Scholar]
11. Vaden S.L., Riviere J.E. Глава 41. Пенициллины и родственные β-лактамные антибиотики. В: Адамс Р.Х., редактор. Ветеринарная фармакология и терапия. 8-е изд. Издательство государственного университета Айовы; Эймс, ИА, США: 2001. стр. 818–827. [Академия Google]
12. Qiu J., Zhao T., Liu Q., He J., He D., Wu G., Li Y., Jiang C., Xu Z. Остаточные ветеринарные антибиотики в экскрементах свиней после перорального введения сульфаниламидов . Окружающая среда. Геохим. Здоровье. 2016; 38: 549–556. doi: 10.1007/s10653-015-9740-x. [PubMed] [CrossRef] [Google Scholar]
13. Кьеза Л.М., Нобиле М., Пансери С., Ариоли Ф. Использование антибиотиков у тяжелых свиней: сравнение образцов мочи и мышц животных пищевой цепи, проанализированных с помощью ВЭЖХ-МС/ РС. Пищевая хим. 2017; 235:111–118. doi: 10.1016/j.foodchem.2017.04.184. [PubMed] [CrossRef] [Академия Google]
Пищевая хим. 2017; 235:111–118. doi: 10.1016/j.foodchem.2017.04.184. [PubMed] [CrossRef] [Академия Google]
14. Ахмед М.Б., Чжоу Дж.Л., Нго Х.Х., Го В.С. Адсорбционное удаление антибиотиков из воды и сточных вод: достижения и проблемы. науч. Общая окружающая среда. 2015; 532:112–116. doi: 10.1016/j.scitotenv.2015.05.130. [PubMed] [CrossRef] [Google Scholar]
15. Ахмед М.Б., Чжоу Дж.Л., Нго Х.Х., Го В.С., Джохир М.А.Х., Сорналингам К. Единичные и конкурентные сорбционные свойства и механизм функционализированного биоугля для удаления сульфонамидных антибиотиков из воды. хим. англ. Дж. 2017; 311:348–358. doi: 10.1016/j.cej.2016.11.106. [Перекрестная ссылка] [Академия Google]
16. Zhao H., Liu X., Cao Z., Zhan Y., Shi X., Yang Y., Zhou J., Xu J. Поведение и механизм адсорбции хлорамфениколов, сульфонамидов и неантибиотических фармацевтических препаратов на мульти- углеродные нанотрубки со стенками. Дж. Азар. Матер. 2016; 310: 235–245. doi: 10.1016/j.jhazmat.2016.02. 045. [PubMed] [CrossRef] [Google Scholar]
045. [PubMed] [CrossRef] [Google Scholar]
17. Ван Б., Цзян Ю.С., Ли Ф.Ю., Ян Д.Ю. Приготовление биоугля путем одновременной карбонизации, намагничивания и активации для удаления норфлоксацина из воды. Биоресурс. Технол. 2017;233:159–165. doi: 10.1016/j.biortech.2017.02.103. [PubMed] [CrossRef] [Google Scholar]
18. Ахмед М.Б., Чжоу Дж.Л., Нго Х.Х., Го В.С., Томайдис Н.С., Сюй Дж. Прогресс в технологиях биологической и химической очистки для удаления возникающих загрязнителей из сточных вод: критический обзор . Дж. Азар. Матер. 2017; 323: 274–298. doi: 10.1016/j.jhazmat.2016.04.045. [PubMed] [CrossRef] [Google Scholar]
19. Сейфртова М., Новакова Л., Лино С., Пена А., Солич П. Обзор аналитических методик определения антибиотиков в водах окружающей среды. Анальный. Чим. Акта. 2009 г.;649:158–179. doi: 10.1016/j.aca.2009.07.031. [PubMed] [CrossRef] [Google Scholar]
20. Haller M.Y., Müller S.R., McArdell C.S., Alder A.C., Suter M.J.F. Количественное определение ветеринарных антибиотиков (сульфаниламидов и триметоприма) в навозе животных методом жидкостной хроматографии-масс-спектрометрии. Ж. Хроматогр. А. 2002; 952: 111–120. doi: 10.1016/S0021-9673(02)00083-3. [PubMed] [CrossRef] [Google Scholar]
Ж. Хроматогр. А. 2002; 952: 111–120. doi: 10.1016/S0021-9673(02)00083-3. [PubMed] [CrossRef] [Google Scholar]
21. Schlüsener M.P., Bester K., Spiteller M. Определение антибиотиков, таких как макролиды, ионофоры и тиамулин, в жидком навозе методом ВЭЖХ–МС/МС. Анальный. Биоанал. хим. 2003;375:942–947. doi: 10.1007/s00216-003-1838-9. [PubMed] [CrossRef] [Google Scholar]
22. Zhou X., Wang J., Lu C., Liao Q., Gudda F.O., Ling W. Антибиотики в навозе животных и удобрениях на основе навоза: возникновение и экологический риск оценка. Хемосфера. 2020;255:127006. doi: 10.1016/j.chemosphere.2020.127006. [PubMed] [CrossRef] [Google Scholar]
23. Halling-Sørensen B., Nors Nielsen S., Lanzky P.F., Ingerslev F., Holten Lutzhoft H.C., Jorgensen S.E. Возникновение, судьба и воздействие фармацевтических веществ на окружающую среду – обзор. Хемосфера. 1998;36:357–393. doi: 10.1016/S0045-6535(97)00354-8. [PubMed] [CrossRef] [Google Scholar]
24. Ван К., Го М., Йейтс С.Р. Кинетика разложения сульфадиметоксина, полученного из навоза, в измененной почве.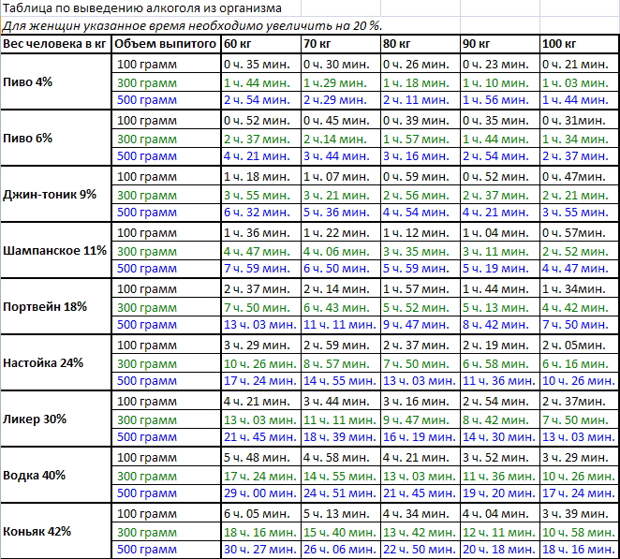 Дж. Агрик. Пищевая хим. 2006; 54: 157–163. doi: 10.1021/jf052216w. [PubMed] [CrossRef] [Google Scholar]
Дж. Агрик. Пищевая хим. 2006; 54: 157–163. doi: 10.1021/jf052216w. [PubMed] [CrossRef] [Google Scholar]
25. Tolls J. Сорбция ветеринарных препаратов в почве: обзор. крит. Преподобный Окружающая среда. науч. Технол. 2001; 35:3397–3406. doi: 10.1021/es0003021. [PubMed] [CrossRef] [Академия Google]
26. Hamscher G., Pawelzick H.T., Höper H., Nau H. Различное поведение тетрациклинов и сульфаниламидов в песчаных почвах после многократного удобрения жидким навозом. Окружающая среда. Токсикол. хим. 2005; 24:861–868. дои: 10.1897/04-182R.1. [PubMed] [CrossRef] [Google Scholar]
27. Сармах А.К., Мейер М.Т., Боксалл А.Б.А. Глобальная перспектива использования, продаж, путей воздействия, появления, судьбы и воздействия ветеринарных антибиотиков (ВА) на окружающую среду. Хемосфера. 2006; 65: 725–729.. doi: 10.1016/j.chemosphere.2006.03.026. [PubMed] [CrossRef] [Google Scholar]
Фармацевтические препараты, гормоны и другие органические загрязнители сточных вод в водотоках США, 1999–2000 гг. : национальная разведка. Окружающая среда. науч. Технол. 2002; 36: 1202–1211. doi: 10.1021/es011055j. [PubMed] [CrossRef] [Google Scholar]
: национальная разведка. Окружающая среда. науч. Технол. 2002; 36: 1202–1211. doi: 10.1021/es011055j. [PubMed] [CrossRef] [Google Scholar]
29. Баран В., Адамек Э., Земянская Ю., Собчак А. Эффекты присутствия сульфаниламидов в окружающей среде и их влияние на здоровье человека. Дж. Азар. Матер. 2011;196:1–15. doi: 10.1016/j.jhazmat.2011.08.082. [PubMed] [CrossRef] [Google Scholar]
30. Тиан Л., Халил С., Байен С. Влияние термической обработки на разложение остаточных количеств антибиотиков в пищевых продуктах. крит. Преподобный Food Sci. Нутр. 2017;57:3760–3770. doi: 10.1080/10408398.2016.1164119. [PubMed] [CrossRef] [Google Scholar]
31. Chu L., Chen D., Wang J., Yang Z., Yang Q., Shen Y. Деградация антибиотиков и инактивация генов устойчивости к антибиотикам (ARG) в Остатки ферментации цефалоспорина С с использованием ионизирующего излучения, озонирования и термической обработки. Дж. Азар. Матер. 2020;382:121058. doi: 10.1016/j.jhazmat.2019.121058. [PubMed] [CrossRef] [Google Scholar]
32. Gros M., Marti E., Balcázar J.L., Boy-Roura M., Busquets A., Colon J., Sanchez-Melsio A., Lekunberri I., Borrego К.М., Понса С. и др. Судьба фармацевтических препаратов и генов устойчивости к антибиотикам в полномасштабном заводе по переработке отходов животноводства. Дж. Азар. Матер. 2019;378:120716. doi: 10.1016/j.jhazmat.2019.05.109. [PubMed] [CrossRef] [Google Scholar]
Gros M., Marti E., Balcázar J.L., Boy-Roura M., Busquets A., Colon J., Sanchez-Melsio A., Lekunberri I., Borrego К.М., Понса С. и др. Судьба фармацевтических препаратов и генов устойчивости к антибиотикам в полномасштабном заводе по переработке отходов животноводства. Дж. Азар. Матер. 2019;378:120716. doi: 10.1016/j.jhazmat.2019.05.109. [PubMed] [CrossRef] [Google Scholar]
33. Хан Ю., Ян Л., Чен С., Цай Ю., Чжан С., Цянь М., Чен С., Чжао Х., Шэн М., Цао Г. и др. Удаление ветеринарных антибиотиков из сточных вод свиней с помощью анаэробной и аэробной биодеградации. науч. Общая окружающая среда. 2020;709:136094. doi: 10.1016/j.scitotenv.2019.136094. [PubMed] [CrossRef] [Google Scholar]
34. Гурмесса Б., Педретти Э.Ф., Кокко С., Карделли В., Корти Г. Эффекты анаэробного переваривания навоза и роль предварительной и последующей обработки ветеринарными антибиотиками и Эффективность удаления генов устойчивости к антибиотикам. науч. Общая окружающая среда. 2020;721:137532. doi: 10. 1016/j.scitotenv.2020.137532. [PubMed] [CrossRef] [Google Scholar]
1016/j.scitotenv.2020.137532. [PubMed] [CrossRef] [Google Scholar]
35. Zhang M., He L.Y., Liu Y.S., Zhao J.L., Liu W.R., Zhang J.N., Chen J., He L.K., Zhang Q.Q., Ying G.G. Судьба ветеринарных антибиотиков при компостировании навоза. науч. Общая окружающая среда. 2019;650:1363–1370. doi: 10.1016/j.scitotenv.2018.09.147. [PubMed] [CrossRef] [Google Scholar]
36. Marti E., Gros M., Boy-Roura M., Ovejero J., Busquets A.M., Colón J., Petrovic M., Ponsá S. Удаление фармацевтических препаратов в внутрихозяйственная установка по переработке навозной жижи свиней на основе систем разделения твердой и жидкой фаз и систем нитрификации-денитрификации. Дж. Управление отходами. 2020; 102: 412–419. doi: 10.1016/j.wasman.2019.11.001. [PubMed] [CrossRef] [Google Scholar]
37. Перес-Мойя М., Граэллс М., Кастельс Г., Амиго Дж., Ортега Э., Бухигас Г., Перес Л.М., Мансилья Х.Д. Характеристика характеристик деградации сульфаметазинового антибиотика с помощью процесса фото-Фентона. Вода Res. 2010;44:2533–2540. doi: 10.1016/j.waters.2010.01.032. [PubMed] [CrossRef] [Академия Google]
2010;44:2533–2540. doi: 10.1016/j.waters.2010.01.032. [PubMed] [CrossRef] [Академия Google]
38. Пруден А., Ларссон Д.Дж., Амескита А., Коллиньон П., Брандт К.К., Грэм Д.В., Лазорчак Дж.М., Судзуки С., Силли П., Снейп Дж.Р. и др. Варианты управления для снижения выброса антибиотиков и генов устойчивости к антибиотикам в окружающую среду. Окружающая среда. Перспектива здоровья. 2013; 121:878–885. doi: 10.1289/ehp.1206446. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Томас Г.К., Миллар Р.Г., Анстис П.В. Стабильность сульфаниламидных антибиотиков в ткани печени свиней с шипами при хранении в замороженном состоянии. J. АОАС междунар. 1997;80:988–996. doi: 10.1093/jaoac/80.5.988. [PubMed] [CrossRef] [Google Scholar]
40. Берендсен Б.Дж.А., Элберс И.Дж.В., Столкер А.А.М. Определение стабильности антибиотиков в матрице и эталонных растворах с использованием простой процедуры с применением масс-спектрометрического обнаружения. Пищевая добавка. Контам. Часть А. 2011; 28: 1657–1666. doi: 10.1080/19440049.2011.604045. [PubMed] [CrossRef] [Google Scholar]
Часть А. 2011; 28: 1657–1666. doi: 10.1080/19440049.2011.604045. [PubMed] [CrossRef] [Google Scholar]
41. Spoo JW, Riviere JE Глава 40. Сульфаниламиды. В: Адамс Р.Х., редактор. Ветеринарная фармакология и терапия. 8-е изд. Издательство государственного университета Айовы; Эймс, ИА, США: 2001. стр. 79.6–817. [Google Scholar]
42. Benchaoui H.A., Nowakowski M., Sherington J., Rowan T.G., Sunderland S.J. Фармакокинетика и концентрация тулатромицина в легочной ткани свиней. Дж. Вет. Фармакол. тер. 2004; 27: 203–210. doi: 10.1111/j.1365-2885.2004.00586.x. [PubMed] [CrossRef] [Google Scholar]
. Фармакокинетика сульфадиметоксина и сульфаметоксазола в комбинации с триметопримом после перорального однократного и многократного введения здоровым свиньям. Вет. рез. коммун. 2001; 25: 461–481. дои: 10.1023/A:1010660319832. [PubMed] [CrossRef] [Google Scholar]
Фармакокинетика сульфадиметоксина и сульфаметоксазола в комбинации с триметопримом после внутривенного введения здоровым и больным пневмонией свиньям.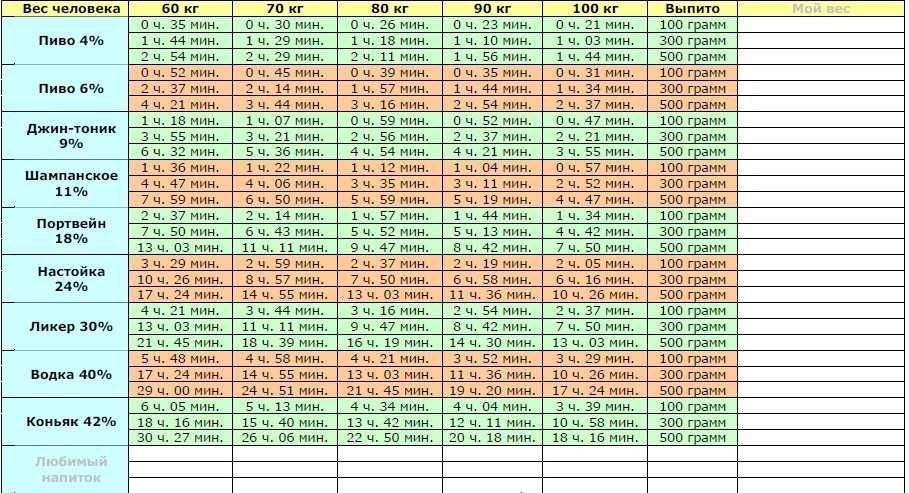 Дж. Вет. Фармакол. тер. 1995; 18: 243–253. doi: 10.1111/j.1365-2885.1995.tb00588.x. [PubMed] [CrossRef] [Google Scholar]
Дж. Вет. Фармакол. тер. 1995; 18: 243–253. doi: 10.1111/j.1365-2885.1995.tb00588.x. [PubMed] [CrossRef] [Google Scholar]
45. Zhang M., Liu Y.S., Zhao J.L., Liu W.R., He L.Y., Zhang J.N., Chen J., He L.K., Zhang Q.Q., Ying G.G. Возникновение, судьба и массовое введение антибиотиков в две системы очистки сточных вод свиней. науч. Общая окружающая среда. 2018;639: 1421–1431. doi: 10.1016/j.scitotenv.2018.05.230. [PubMed] [CrossRef] [Google Scholar]
46. Ziółkowski H., Grabowski T., Jasiecka A., Zuśka-Prot M., Barski D., Jaroszewski J.J. Фармакокинетика окситетрациклина у цыплят-бройлеров при различных путях введения. Вет. Ж. 2016; 208:96–98. doi: 10.1016/j.tvjl.2015.08.022. [PubMed] [CrossRef] [Google Scholar]
47. Эль Корчи Г., Пратс С., Арбуа М., Перес Б. Распределение окситетрациклина у свиней после введения двух препаратов длительного действия. Дж. Вет. Фармакол. тер. 2001; 24: 247–250. doi: 10.1046/j.1365-2885.2001.00342.x. [PubMed] [CrossRef] [Академия Google]
48. Zhi S., Shen S., Zhou J., Ding G., Zhang K. Систематический анализ распространенности, плотности и экологических рисков 45 ветеринарных антибиотиков: на семейных животноводческих фермах в бассейне озера Эрхай, Юньнань, Китай . Окружающая среда. Загрязн. 2020;267:115539. doi: 10.1016/j.envpol.2020.115539. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Zhi S., Shen S., Zhou J., Ding G., Zhang K. Систематический анализ распространенности, плотности и экологических рисков 45 ветеринарных антибиотиков: на семейных животноводческих фермах в бассейне озера Эрхай, Юньнань, Китай . Окружающая среда. Загрязн. 2020;267:115539. doi: 10.1016/j.envpol.2020.115539. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
49. Chee-Sanford J.C., Aminov R.I., Krapac I.J., Garrigues-Jeanjean N., Mackie R.I. Возникновение и разнообразие генов устойчивости к тетрациклину в лагунах и подземных водах два свиноводческих комплекса. заявл. Окружающая среда. микробиол. 2001;67:1494–1502. doi: 10.1128/AEM.67.4.1494-1502.2001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
50. Маки Р.И., Койке С., Крапак И., Чи-Сэнфорд Дж., Максвелл С., Аминов Р.И. Остатки тетрациклина и гены устойчивости к тетрациклину в грунтовых водах воздействие свиноводческих предприятий. Аним. Биотехнолог. 2006; 17: 157–176. doi: 10.1080/10495390600956953. [PubMed] [CrossRef] [Google Scholar]
51. Koike S., Krapac I.G., Oliver H.D., Yannarell A.C., Chee-Sanford J.C., Aminov R.I., Mackie R.I. Мониторинг и отслеживание источников генов устойчивости к тетрациклину в лагунах и прилегающих грунтовых водах на свиноводческие предприятия в течение 3 лет. заявл. Окружающая среда. микробиол. 2007; 73: 4813–4823. doi: 10.1128/AEM.00665-07. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Koike S., Krapac I.G., Oliver H.D., Yannarell A.C., Chee-Sanford J.C., Aminov R.I., Mackie R.I. Мониторинг и отслеживание источников генов устойчивости к тетрациклину в лагунах и прилегающих грунтовых водах на свиноводческие предприятия в течение 3 лет. заявл. Окружающая среда. микробиол. 2007; 73: 4813–4823. doi: 10.1128/AEM.00665-07. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Nielsen P., Gyrd-Hansen N. Биодоступность энрофлоксацина после перорального введения сытым и голодным свиньям. Фармакол. Токсикол. 1997; 80: 246–250. doi: 10.1111/j.1600-0773.1997.tb01967.x. [PubMed] [CrossRef] [Google Scholar]
53. Мессенджер К.М., Папич М.Г., Бликслагер А.Т. Распределение энрофлоксацина и его активного метаболита с использованием метода ультрафильтрации in vivo после инъекции энрофлоксацина свиньям. Дж. Вет. Фармакол. тер. 2012; 35: 452–459. doi: 10.1111/j.1365-2885.2011.01338.x. [PubMed] [CrossRef] [Академия Google]
54. Серрано М.Дж., Митяна О., Бонастре К. , Лаборда А., Фальчето М.В., Гарсия-Гонсало Д., Абилейра Э., Элордуй Дж., Буске-Мелу А., Мата Л. и др. Является ли кровь хорошим индикатором для обнаружения противомикробных препаратов в мясе? Доказательства разработки из методов наблюдения in vivo. Антибиотики. 2020;9:175. doi: 10.3390/антибиотики9040175. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Лаборда А., Фальчето М.В., Гарсия-Гонсало Д., Абилейра Э., Элордуй Дж., Буске-Мелу А., Мата Л. и др. Является ли кровь хорошим индикатором для обнаружения противомикробных препаратов в мясе? Доказательства разработки из методов наблюдения in vivo. Антибиотики. 2020;9:175. doi: 10.3390/антибиотики9040175. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Seymour E.H., Jones G.M., McGilliard M.L. Сравнение внутрихозяйственных скрининговых тестов для обнаружения остаточных количеств антибиотиков. Дж. Молочная наука. 1988;71:539–544. doi: 10.3168/jds.S0022-0302(88)79587-9. [PubMed] [CrossRef] [Google Scholar]
56. Регламент Комиссии (ЕС) № 37/2010 от 22 декабря 2009 г. о фармакологически активных веществах и их классификации в отношении максимально допустимых уровней остаточного содержания в пищевых продуктах животного происхождения. [(по состоянию на 23 марта 2021 г.)]; Off. Дж. Евр. Союз. 2010 Л. 15:1–72. Доступно в Интернете: https://ec.europa.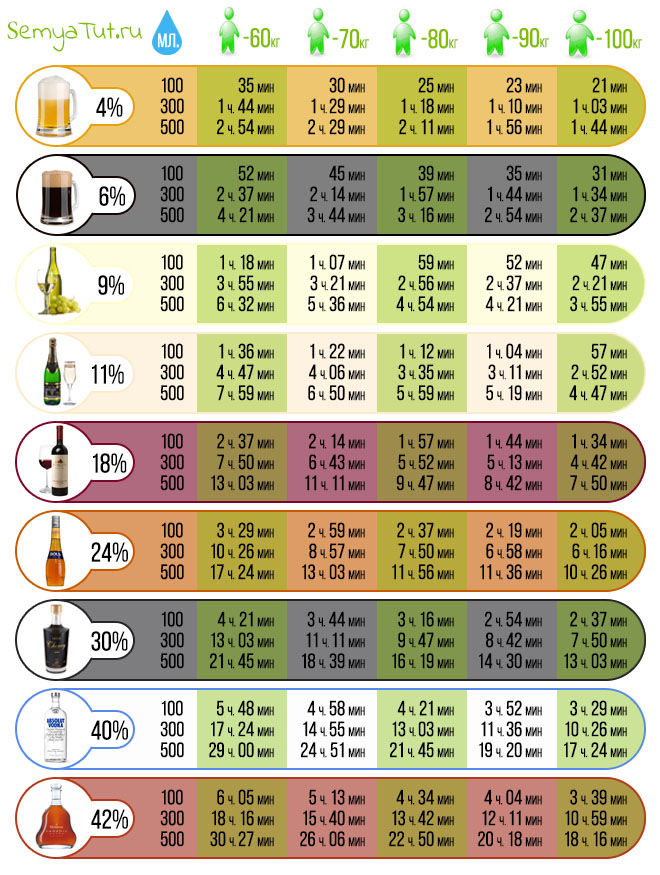 eu/health/sites/default/files/files/eudralex/vol-5/reg_2010_37/reg_2010_37_en.pdf [Google Scholar]
eu/health/sites/default/files/files/eudralex/vol-5/reg_2010_37/reg_2010_37_en.pdf [Google Scholar]
57. Де ла Торре А., Иглесиас И., Карбальо М., Рамирес П., Муньос М. Дж. Подход к картированию уязвимости почв Европейского Союза к загрязнению антибиотиками. науч. Общая окружающая среда. 2012; 414: 672–679. doi: 10.1016/j.scitotenv.2011.10.032. [PubMed] [CrossRef] [Google Scholar]
58. Кемпер Н. Ветеринарные антибиотики в водной и наземной среде. Экол. индик. 2008; 8:1–13. doi: 10.1016/j.ecolind.2007.06.002. [CrossRef] [Google Scholar]
59. Мартинес Дж. Л. Загрязнение окружающей среды антибиотиками и детерминантами устойчивости к антибиотикам. Окружающая среда. Загрязн. 2009 г.;157:2893–2902. doi: 10.1016/j.envpol.2009.05.051. [PubMed] [CrossRef] [Google Scholar]
60. Jechalke S., Focks A., Rosendahl I., Groeneweg J., Siemens J., Heuer H., Smalla K. Структурно-функциональная реакция сообщества почвенных бактерий к применению навоза свиней, получавших дифлоксацин. ФЭМС микробиол. Экол. 2014; 87: 78–88. doi: 10.1111/1574-6941.12191. [PubMed] [CrossRef] [Google Scholar]
ФЭМС микробиол. Экол. 2014; 87: 78–88. doi: 10.1111/1574-6941.12191. [PubMed] [CrossRef] [Google Scholar]
61. Heuer H., Schmitt H., Smalla K. Распространение гена устойчивости к антибиотикам из-за внесения навоза на сельскохозяйственных полях. Курс. мнение микробиол. 2011;14:236–243. doi: 10.1016/j.mib.2011.04.009. [PubMed] [CrossRef] [Google Scholar]
62. Ким К.-Р., Оуэнс Г., Квон С.-И., Со К.-Х., Ли Д.-Б., Ок Ю.С. Возникновение и экологическая судьба ветеринарных антибиотиков в земной среде. Вода Воздух Почва Загрязнение. 2011; 214:163–174. doi: 10.1007/s11270-010-0412-2. [CrossRef] [Google Scholar]
63. Европейское агентство по лекарственным средствам . Руководство по оценке воздействия ветеринарных лекарственных препаратов на окружающую среду в поддержку рекомендаций VICH GL6 и GL38, EMA/CVMP/ERA/418282/2005-Rev.1-Corr. Европейское агентство по лекарственным средствам; Лондон, Великобритания: 2016. [Google Scholar]
64. Ливермор Д.М. Наступила эра неизлечимых инфекций? Дж.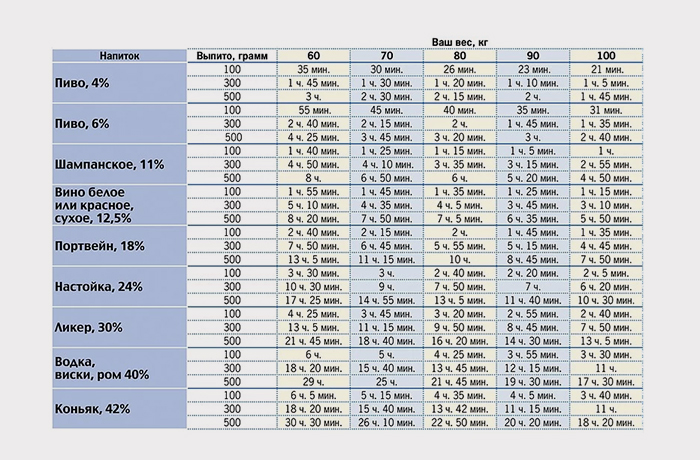 Антимикроб. Чемотер. 2009; 64:i29–i36. doi: 10.1093/jac/dkp255. [PubMed] [CrossRef] [Google Scholar]
Антимикроб. Чемотер. 2009; 64:i29–i36. doi: 10.1093/jac/dkp255. [PubMed] [CrossRef] [Google Scholar]
65. Trobos M., Jakobsen L., Olsen K.E., Frimodt-Møller N., Hammerum A.M., Pedersen K., Agerso Y., Porsbo L.J., Olsen J.E. Распространенность сульфаниламидов гены резистентности и интегронов класса 1 в изолятах Escherichia coli, полученных от бройлеров, мяса бройлеров, здоровых людей и инфекций мочевыводящих путей в Дании. Междунар. Дж. Антимикроб. Агенты. 2008; 32: 367–369.. doi: 10.1016/j.ijantimicag.2008.04.021. [PubMed] [CrossRef] [Google Scholar]
66. Адеканмби А.О., Адеджоба А.Т., Банджо О.А., Саки М. Обнаружение генов sul1 и sul2 в устойчивых к сульфонамидам бактериях (SRB) из сточных вод, источников аквакультуры, отходов животноводства и больниц сточные воды на юго-западе Нигерии. Gene Rep. 2020; 20:100742. doi: 10.1016/j.genrep.2020.100742. [CrossRef] [Google Scholar]
67. Lin H., Sun W., Jin D., Yu Q., Yang Y., Zhang Z., Sun P., Ma J. Влияние компостирования на конъюгативную передачу резистентность к сульфонамидам и устойчивая к сульфаниламидам бактериальная популяция. Дж. Чистый. Произв. 2021;285:125483. doi: 10.1016/j.jclepro.2020.125483. [Перекрестная ссылка] [Академия Google]
Дж. Чистый. Произв. 2021;285:125483. doi: 10.1016/j.jclepro.2020.125483. [Перекрестная ссылка] [Академия Google]
68. Темпини П.Н., Али С.С., Карле Б.М., Перейра Р.В. Остатки множественных лекарственных средств и модели устойчивости к противомикробным препаратам в отработанном молоке молочных ферм в Центральной Калифорнии. Дж. Молочная наука. 2018;101:8110–8122. doi: 10.3168/jds.2018-14398. [PubMed] [CrossRef] [Google Scholar]
69. Содхи К.К., Кумар М., Сингх Д.К. Понимание устойчивости к амоксициллину, экотоксичности и стратегий восстановления. J. Water Process Eng. 2021;39:101858. doi: 10.1016/j.jwpe.2020.101858. [Перекрестная ссылка] [Академия Google]
70. Riviere J.E. Всасывание, распределение, метаболизм и выведение. В: Ривьер Ж.Э., Папич М.Г., ред. Ветеринарная фармакология и терапия. 9-е изд. Уилли Блэквелл; Эймс, ИА, США: 2009. стр. 11–46. [Google Scholar]
71. Real Decreto 53/2013, от 1 февраля, por el que se establecen las normas basicas applicables para la protección de los animales utilizados en Experimentación y otros fines científicos, incluyendo la docencia. Болетин Официальный Estado. 2013;34:11370–11421. [Академия Google]
Болетин Официальный Estado. 2013;34:11370–11421. [Академия Google]
72. Директива 2010/63/ЕС Европейского парламента и Совета от 22 сентября 2010 г. о защите животных, используемых в научных целях. [(по состоянию на 23 марта 2021 г.)]; Off. Дж. Евр. Союз. 2010. Л. 276:33–79. Доступно в Интернете: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32010L0063 [Google Scholar]
Вызывают ли антибиотики, выделяемые людьми и животными, развитие резистентности в среда?
Согласно прогнозам, к 2050 году устойчивость к противомикробным препаратам станет основной причиной смерти во всем мире, что приведет к 10 миллионам смертей в год, многие из которых вызваны бактериальными инфекциями, устойчивыми к антибиотикам. Реализация стратегий смягчения последствий для ограничения распространения устойчивости к антибиотикам поможет ограничить как заболеваемость, так и смертность в будущем. Окружающая среда является недооцененным резервуаром как устойчивых к антибиотикам бактерий, так и генов устойчивости к антибиотикам, включая местные экологические бактерии, которые выработали устойчивость в ходе эволюции, и бактерии, связанные с человеком и животными, которые попадают в организм со сточными водами и фекальным загрязнением.
МСК были определены для ряда антибиотических соединений с использованием экспериментов по конкуренции отдельных видов, однако меньше антибиотиков было протестировано с использованием сложных микробных сообществ. Они более репрезентативны для окружающей среды и предоставляют возможности для горизонтального переноса генов устойчивости. Цель этой работы состояла в том, чтобы определить и сравнить значения MSC для нескольких антибиотических соединений из разных классов антибиотиков, в том числе из списка приоритетных опасных веществ Рамочной директивы ЕС по водным ресурсам (WFD).
Мы исследовали селективную способность четырех соединений-антибиотиков: азитромицина (макролид), кларитромицина (макролид), эритромицина (макролид) и ципрофлоксацина (фторхинолон), которые были внесены в итерацию WFD Watch List 2018 года.
Мы использовали неочищенные сточные воды в качестве инокулята в экспериментальных микрокосмах и развивали бактериальные популяции при различных концентрациях антибиотиков в течение семи дней. Мы использовали количественную ПЦР в реальном времени для определения изменений распространенности генов резистентности с течением времени как для ципрофлоксацина, так и для макролидов. Кроме того, для макролидных антибиотиков мы использовали посев и секвенирование метагенома для исследования селекции.
Эти эксперименты подтвердили, что антибиотические соединения обладают различной избирательной способностью в концентрациях, сходных с концентрациями в загрязненной водной среде. Это означает, что для определения риска, который эти соединения представляют для окружающей среды, необходимо провести оценку конкретных рисков соединений. Ципрофлоксацин был выбран из-за устойчивости в концентрациях, аналогичных концентрациям, обнаруженным в окружающей среде, и поэтому может потребоваться реализация стратегий смягчения последствий.

 Они начинают скапливаться в органе, что через некоторое время приводит к загрязнению организма.
Они начинают скапливаться в органе, что через некоторое время приводит к загрязнению организма.