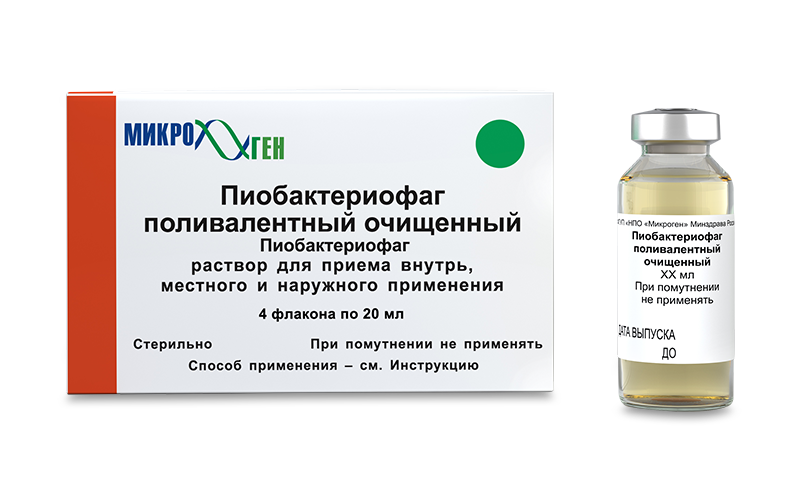
Бактеріофаг стафілококовий інструкція, ціна в аптеках України
На сайті немає в наявності товарів з торговою назвою «Бактеріофаг стафілококовий»
Редакторська група
Дата створення: 27.04.2021 Дата оновлення: 01.05.2023
Склад і форма випуску
склад:
Розчин Бактериофаг стафілококовий містить:
- Стерильний очищений фільтрат фаголізатов бактерій Staphylococcus;
- Консервант — хінозол.
Форма випуску:
Розчин Бактериофаг стафілококовий по 20 або 100 мл у флаконах, в пачку з картону вкладають 4 флакона по 20 мл або 1 флакон, що містить 100 мл розчину.
Фармакологічна дія
Бактеріофаг стафілококовий — лікарський препарат, що володіє специфічним бактерицидну дію відносно штамів стафілококів, найбільш значущих в етіології гнійних і запальних захворювань.
Бактеріофаг стафілококовий специфічно лизирует бактерії Staphylococcus. Фагові частки прикріплюються до мембрани чутливих бактерій, проникають всередину клітини та розмножуються за рахунок її ресурсів. Внаслідок цього відбувається загибель клітини та вихід зрілих фагових частинок, здатних до зараження інших чутливих бактеріальних клітин.
Бактеріофаг стафілококовий не впливає на інші бактерії, зокрема не порушує природну мікрофлору.
Показання
Бактеріофаг стафілококовий застосовують для лікування захворювань різної локалізації, які обумовлені стафілококами.
У ЛОР-практиці та пульмонології Бактериофаг стафілококовий застосовують для лікування пацієнтів з отитом, синуситом, ларингіт, трахеїт, фарингіт, гайморит, ангіною, плевритом, бронхітом і пневмонією.
У хірургічній практиці препарат використовують для лікування пацієнтів з інфікованими ранами, опіками, флегмоною, фурункулами та карбункулами, а також гідраденітом, мастит, остеомієліт, бурсит і парапроктитом.
Крім того, Бактериофаг стафілококовий використовують в лікуванні генералізованих септичних захворювань, а також урогенітальних і ентеральних інфекцій, включаючи уретрит, пієлонефрит, цистит, кольпіт, сальпінгоофорит, ендометрит, дисбактеріоз, гастроентероколіт і холецистит.
У педіатричній практиці Бактериофаг стафілококовий призначають новонародженим при піодермії, гастроентероколіті, сепсисі, омфаліт та кон’юнктивіті.
Рекомендується профілактична обробка післяопераційних і свежеінфіцірованних ран препаратом Бактериофаг стафілококовий.
Дозування
Бактеріофаг стафілококовий призначений для місцевого, ректального і перорального застосування. Перед застосуванням слід струснути флакон, при наявності видимого осаду або зміні прозорості розчин застосовувати не можна.
Для досягнення максимального терапевтичного ефекту лікування слід починати якомога раніше після появи симптомів захворювання.
Тривалість терапії, схему застосування препарату і дози визначає лікар.
Місцево препарат застосовують залежно від локалізації інфекції:
1) У гінекологічній практиці препарат застосовують у формі зрошень, аплікацій та тампонів, змочених розчином;
2) В хірургічній практиці розчин використовують у вигляді промивань, зрошень, тампонування, а також для введення в дренованих або обмежені порожнини;
3) Введення в суглобову, плевральну та інші обмежені порожнини, в тому числі дренированную порожнину сечового міхура і ниркової балії, через капілярний дренаж, нефростому або цистостому;
4) У отоларингологічній практиці розчин використовують для промивань, зрошень, змочування стерильних турунд, а також в якості назальних і вушних крапель;
5) При кишкових захворюваннях призначають ректальне введення бактеріофага (в комплексі з прийомом всередину).
Рекомендовані разові дози для пацієнтів різних вікових груп:
- Дітям молодше 6 місяців ректально, як правило, призначають 10 мл бактеріофага, перорально — 5 мл препарату. Перші дози препарату слід вводити у вигляді високих клізм, якщо не відзначається розвитку сригіваній, порушень травлення і інших небажаних ефектів бактеріофаг можна призначати перорально або перорально і ректально.
- Дітям 6-12 місяців ректально, як правило, призначають 20 мл бактеріофага, перорально — 10 мл препарату;
- Дітям 1-3 років ректально, як правило, призначають 30 мл бактеріофага, перорально — 15 мл препарату;
- Дітям 3-8 років ректально, як правило, призначають 40 мл бактеріофага, перорально — 20 мл препарату;
- Дорослим і дітям старше 8 років рекомендується призначення 30 мл розчину Бактериофаг стафілококовий перорально і 50 мл препарату при ректальному застосуванні.
Середня тривалість терапії становить від 7 до 20 днів. При рецидивуючих формах захворювань можна призначати кілька курсів препарату Бактериофаг стафілококовий в рік.
Слід враховувати, що якщо перед місцевим застосуванням препарату Бактериофаг стафілококовий проводилася обробка хімічними антисептиками, то до використання бактеріофага слід промити ділянку шкірного покриву фізіологічним розчином натрію хлориду.
Побічні дії
При застосуванні розчину Бактериофаг стафілококовий не було відзначено розвитку небажаних ефектів.
Протипоказання
Немає протипоказань до застосування розчину Бактериофаг стафілококовий.
вагітність:
Бактеріофаг стафілококовий в період вагітності та годування дитини грудьми може застосовуватися під контролем лікаря.
Взаємодія
Бактеріофаг стафілококовий допускається застосовувати сочетано з антибактеріальними препаратами, а також лікарськими засобами інших груп.
Передозування
Чи не надходило повідомлень про передозування препарату Бактериофаг стафілококовий.
Умови зберігання
Бактеріофаг стафілококовий слід зберігати в приміщеннях з температурним режимом від 2 до 8 градусів Цельсія.
Бактеріофаг стафілококовий придатний протягом 2 років після випуску.
Препарат Бактериофаг стафілококовий можна транспортувати при температурному режимі від 8 до 30 градусів Цельсія протягом не більше 30 днів.
Склад і форма випуску
склад:
Розчин Бактериофаг стафілококовий містить:
- Стерильний очищений фільтрат фаголізатов бактерій Staphylococcus;
- Консервант — хінозол.

Форма випуску:
Розчин Бактериофаг стафілококовий по 20 або 100 мл у флаконах, в пачку з картону вкладають 4 флакона по 20 мл або 1 флакон, що містить 100 мл розчину.
Фармакологічна дія
Бактеріофаг стафілококовий — лікарський препарат, що володіє специфічним бактерицидну дію відносно штамів стафілококів, найбільш значущих в етіології гнійних і запальних захворювань.
Бактеріофаг стафілококовий специфічно лизирует бактерії Staphylococcus. Фагові частки прикріплюються до мембрани чутливих бактерій, проникають всередину клітини та розмножуються за рахунок її ресурсів. Внаслідок цього відбувається загибель клітини та вихід зрілих фагових частинок, здатних до зараження інших чутливих бактеріальних клітин.
Бактеріофаг стафілококовий не впливає на інші бактерії, зокрема не порушує природну мікрофлору.
Показання
Бактеріофаг стафілококовий застосовують для лікування захворювань різної локалізації, які обумовлені стафілококами.
У ЛОР-практиці та пульмонології Бактериофаг стафілококовий застосовують для лікування пацієнтів з отитом, синуситом, ларингіт, трахеїт, фарингіт, гайморит, ангіною, плевритом, бронхітом і пневмонією.
У хірургічній практиці препарат використовують для лікування пацієнтів з інфікованими ранами, опіками, флегмоною, фурункулами та карбункулами, а також гідраденітом, мастит, остеомієліт, бурсит і парапроктитом.
Крім того, Бактериофаг стафілококовий використовують в лікуванні генералізованих септичних захворювань, а також урогенітальних і ентеральних інфекцій, включаючи уретрит, пієлонефрит, цистит, кольпіт, сальпінгоофорит, ендометрит, дисбактеріоз, гастроентероколіт і холецистит.
У педіатричній практиці Бактериофаг стафілококовий призначають новонародженим при піодермії, гастроентероколіті, сепсисі, омфаліт та кон’юнктивіті.
Рекомендується профілактична обробка післяопераційних і свежеінфіцірованних ран препаратом Бактериофаг стафілококовий.
Дозування
Бактеріофаг стафілококовий призначений для місцевого, ректального і перорального застосування. Перед застосуванням слід струснути флакон, при наявності видимого осаду або зміні прозорості розчин застосовувати не можна.
Перед застосуванням слід струснути флакон, при наявності видимого осаду або зміні прозорості розчин застосовувати не можна.
Для досягнення максимального терапевтичного ефекту лікування слід починати якомога раніше після появи симптомів захворювання.
Тривалість терапії, схему застосування препарату і дози визначає лікар.
Місцево препарат застосовують залежно від локалізації інфекції:
1) У гінекологічній практиці препарат застосовують у формі зрошень, аплікацій та тампонів, змочених розчином;
2) В хірургічній практиці розчин використовують у вигляді промивань, зрошень, тампонування, а також для введення в дренованих або обмежені порожнини;
3) Введення в суглобову, плевральну та інші обмежені порожнини, в тому числі дренированную порожнину сечового міхура і ниркової балії, через капілярний дренаж, нефростому або цистостому;
4) У отоларингологічній практиці розчин використовують для промивань, зрошень, змочування стерильних турунд, а також в якості назальних і вушних крапель;
5) При кишкових захворюваннях призначають ректальне введення бактеріофага (в комплексі з прийомом всередину).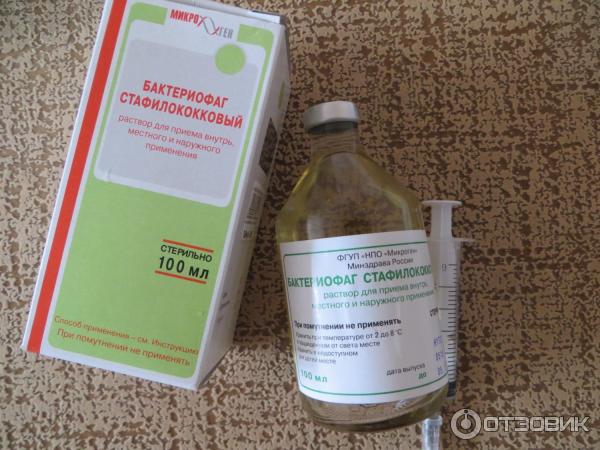
Рекомендовані разові дози для пацієнтів різних вікових груп:
- Дітям молодше 6 місяців ректально, як правило, призначають 10 мл бактеріофага, перорально — 5 мл препарату. Перші дози препарату слід вводити у вигляді високих клізм, якщо не відзначається розвитку сригіваній, порушень травлення і інших небажаних ефектів бактеріофаг можна призначати перорально або перорально і ректально.
- Дітям 6-12 місяців ректально, як правило, призначають 20 мл бактеріофага, перорально — 10 мл препарату;
- Дітям 1-3 років ректально, як правило, призначають 30 мл бактеріофага, перорально — 15 мл препарату;
- Дітям 3-8 років ректально, як правило, призначають 40 мл бактеріофага, перорально — 20 мл препарату;
- Дорослим і дітям старше 8 років рекомендується призначення 30 мл розчину Бактериофаг стафілококовий перорально і 50 мл препарату при ректальному застосуванні.
Середня тривалість терапії становить від 7 до 20 днів. При рецидивуючих формах захворювань можна призначати кілька курсів препарату Бактериофаг стафілококовий в рік.
Слід враховувати, що якщо перед місцевим застосуванням препарату Бактериофаг стафілококовий проводилася обробка хімічними антисептиками, то до використання бактеріофага слід промити ділянку шкірного покриву фізіологічним розчином натрію хлориду.
Побічні дії
При застосуванні розчину Бактериофаг стафілококовий не було відзначено розвитку небажаних ефектів.
Протипоказання
Немає протипоказань до застосування розчину Бактериофаг стафілококовий.
вагітність:
Бактеріофаг стафілококовий в період вагітності та годування дитини грудьми може застосовуватися під контролем лікаря.
Взаємодія
Бактеріофаг стафілококовий допускається застосовувати сочетано з антибактеріальними препаратами, а також лікарськими засобами інших груп.
Передозування
Чи не надходило повідомлень про передозування препарату Бактериофаг стафілококовий.
Умови зберігання
Бактеріофаг стафілококовий слід зберігати в приміщеннях з температурним режимом від 2 до 8 градусів Цельсія.
Бактеріофаг стафілококовий придатний протягом 2 років після випуску.
Препарат Бактериофаг стафілококовий можна транспортувати при температурному режимі від 8 до 30 градусів Цельсія протягом не більше 30 днів.
Бактеріофаг стафілококовий: інструкція
БАКТЕРІОФАГ СТАФІЛОКОКОВИЙ РІДКИЙ (UA/14622/01/01)
Форма випуску: рідина оральна, оромукозна, нашкірна, ректальна, вагінальна з активністю не менше 10 в 5 ступені по 20 мл у флаконах № 10, по 100 мл у пляшках № 1
Склад: 1 флакон (20 мл) або 1 пляшка (100 мл) містить стерильний розчин бактеріофагу, що лізує мікроорганізми виду Staphylococcus aureus, з активністю не менше 10 в 5 ступені
Производитель: Україна
Что такое бактериофаги и чем они лучше антибиотиков
Этот многообещающий способ преодолеть глобальную угрозу человечеству ещё нуждается в исследованиях.
Что такое бактериофаги
Бактериофаги — это вирусы, которые убивают бактерии, но не вредят другим живым организмам.
Корень «-фагос-» в переводе с древнегреческого означает «пожираю». Собственно, так и работают эти специфические вирусы. Они проникают внутрь бактерии, «заражают» её и заменяют бактериальный геном своим. Таким образом микроб теряет возможность размножаться. Вместо этого он начинает производить всё новые и новые бактериофаги, которые потихоньку изводят всю колонию бактерий.
Иногда бактериофаги называют просто фагами, а их применение в виде таблеток или инъекций для борьбы с патогенными бактериями — фаговой терапией, или фаготерапией.
Так же, как и антибиотики, бактериофаги относятся к антибактериальным средствам. В целом они выполняют одну и ту же работу — уничтожают бактерии, но делают это по‑разному.
Чем бактериофаги отличаются от антибиотиков
Антибиотики содержат химические вещества, которые убивают бактерии или лишают их возможности размножаться. Это плюс.
Это плюс.
Теперь минусы. Во‑первых, каждый антибиотик эффективен только против одного или нескольких видов патогенных микроорганизмов. Во‑вторых, бактерии, поскольку они живые, умеют приспосабливаться к действию препарата и со временем теряют к нему чувствительность. То есть складывается неприятная ситуация: вы принимаете антибиотик, а вылечить бактериальную инфекцию не получается. Такая устойчивость микробов к антибактериальным средствам называется антибиотикорезистентностью.
Каждый вид бактериофагов (а их миллионы) тоже эффективен только против «своего» вида бактерий. Но вот процесса, аналогичного антибиотикорезистентности, при их взаимодействии с микробами не возникает, потому что бактериофаги — это вирусы и они умеют меняться. Когда бактерия приспосабливается и прекращает подпускать вирус к геному, фаг может найти к ней новый «ключик» — и добиться своего.
Почему антибиотики известны, а бактериофаги — не очень
Это пример исторической несправедливости.
Вообще, фаготерапия появилась даже раньше, чем лечение антибиотиками. Ещё в конце XIX века ряд учёных, включая российского микробиолога Николая Гамалею — того, чьё имя носит Национальный исследовательский центр эпидемиологии и микробиологии, обнаружил, что некие вещества, содержащиеся, например, в речной воде, проявляют выраженную антимикробную активность.
Ещё в конце XIX века ряд учёных, включая российского микробиолога Николая Гамалею — того, чьё имя носит Национальный исследовательский центр эпидемиологии и микробиологии, обнаружил, что некие вещества, содержащиеся, например, в речной воде, проявляют выраженную антимикробную активность.
В 1917 году микробиолог из парижского Института Пастера Феликс д’Эрелль сообщил миру, что этими веществами оказались специфические вирусы — те самые бактериофаги. Учёный выяснил, что фаги всегда появлялись в стуле больных дизентерией, перед тем как пациенты шли на поправку.
Д’Эрелль помещал в чашку Петри образец фекалий, содержащих дизентерийную палочку. Добавлял туда образец, взятый от выздоравливающего пациента, и спустя несколько дней обнаруживал, что дизентерийные бактерии исчезли. «Растворились, как сахар в воде!» — описывал исследователь свои наблюдения.
На основе обнаруженных бактериофагов учёный изготовил инъекции и суспензии, которые начал вводить пациентам с дизентерией. Уже в 1920‑е годы фаготерапией успешно лечили не только эту болезнь, но и брюшной тиф, холеру, стафилококковые инфекции кожи и костей, сепсис.
Бактериофаги в качестве антибактериального средства завоёвывали мир. Их использовали в крупнейших больницах Европы и США, а в СССР благодаря д’Эреллю была создана лаборатория по производству таких лекарств. Но в 1940‑е мировая «фагомания» прекратилась.
Одной из причин стало развитие науки. В частности, резко выросли требования к качеству научных работ. А д’Эрелль и его последователи относились к этому небрежно: не совсем корректно проводили исследования, допускали ошибки в описании биологических и физиологических процессов.
Кроме того, тогда же был создан первый антибиотик на основе пенициллина. Авторы препарата подошли к исследованиям более скрупулёзно. В результате в Европе и США антибиотики стали признанным способом антибактериальной терапии, а о вирусах‑фагах забыли. Исследования «пожирателей бактерий» продолжались лишь в СССР.
Почему о бактериофагах заговорили именно сейчас
Потому что антибиотики сдают позиции. Люди привыкли к ним, воспринимают их как безопасные лекарства, которые можно принимать «для профилактики». В результате всё больше опасных бактерий становятся устойчивыми к антибиотикам и прекращают реагировать на них.
В результате всё больше опасных бактерий становятся устойчивыми к антибиотикам и прекращают реагировать на них.
ВОЗ уже не первый год называет антибиотикорезистентность одной из наиболее серьёзных угроз для здоровья человечества.
Совсем скоро люди могут обнаружить, что привычные и надёжные лекарства превратились в пустышку. Есть риск, что даже ангина или бактериальный отит снова станут смертельными инфекциями, от которых нет лечения.
Теоретически ничего не мешает создавать новые антибиотики, к которым у бактерий ещё не выработалась резистентность. Но на такие разработки нужны годы, а то и десятилетия.
В подобных условиях бактериофаги могут стать тем, что поможет миру преодолеть масштабный медицинский кризис. Лекарства на основе вирусов можно создавать значительно быстрее и дешевле, чем антибиотики. Но главное — бактериофаги умеют меняться вслед за целевой бактерией, а значит, такие препараты будут сохранять эффективность.
Могут ли бактериофаги полностью заменить антибиотики
Нет, по крайней мере пока.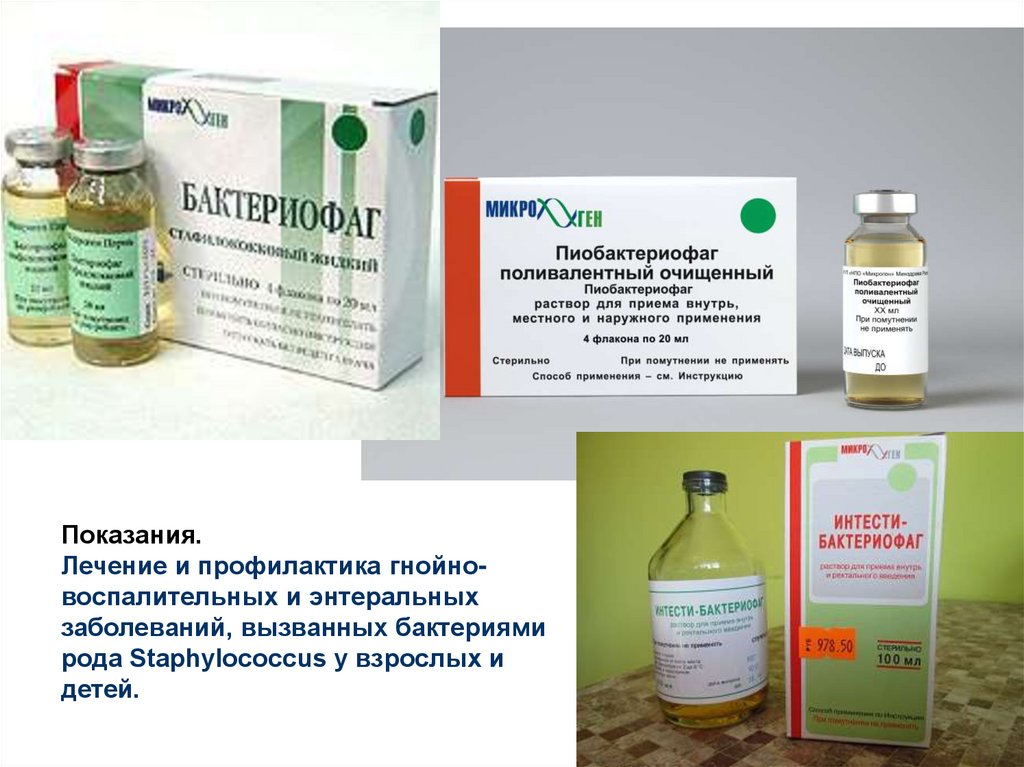 На то есть несколько причин.
На то есть несколько причин.
Бактериофаги ещё недостаточно изучены
Авторитетных масштабных исследований, которые подтвердили бы эффективность и безопасность фаготерапии, по‑прежнему не хватает.
Кроме того, надзорные органы разных стран с подозрением относятся к идее использовать вирусы для лечения. Например, американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило первое клиническое испытание внутривенного бактериофага лишь в феврале 2019 года.
Однажды процесс сертификации и лицензирования фагопрепаратов наверняка упростят. Но этот момент пока не наступил.
У бактериофагов слишком узкая специализация
Один антибиотик широкого спектра может лечить несколько бактериальных инфекций. А вот бактериофаги — снайперы: они прицельно уничтожают лишь один вид бактерий. Поэтому для каждого возбудителя болезни нужно выделить собственный фаг.
Мало того, бактериальные компоненты заболеваний отличаются от региона к региону, а иногда даже от человека к человеку. В результате, чтобы вылечить одну и ту же ангину у 10 человек в России и, например, в Италии, может потребоваться 10 разных бактериофагов или сложный коктейль из них.
В результате, чтобы вылечить одну и ту же ангину у 10 человек в России и, например, в Италии, может потребоваться 10 разных бактериофагов или сложный коктейль из них.
Сегодня универсальность и эффективность работающих антибиотиков несколько выше.
Кажется, лучше всего бактериофаги работают в комбинации с антибиотиками
Эксперименты на культурах клеток и животных показывают, что, если использовать одновременно бактериофаги и антибиотики, их общий эффект превышает сумму эффектов от каждого препарата по отдельности. Такое взаимное усиление называют синергией.
Пока нет убедительных доказательств, что синергия проявится и на людях. Но учёные оптимистично предполагают, что это неизбежно.
В одном исследовании бактериофаг OMKO1, скомбинированный с антибиотиком цефтазидимом, смог избавить пациента от суперинфекции, которую несколько лет безуспешно лечили традиционными антибиотиками.
Так что бактериофаги, скорее всего, не вытеснят антибиотики. Эти препараты будут дополнять друг друга, чтобы сделать лечение бактериальных заболеваний более быстрым и эффективным.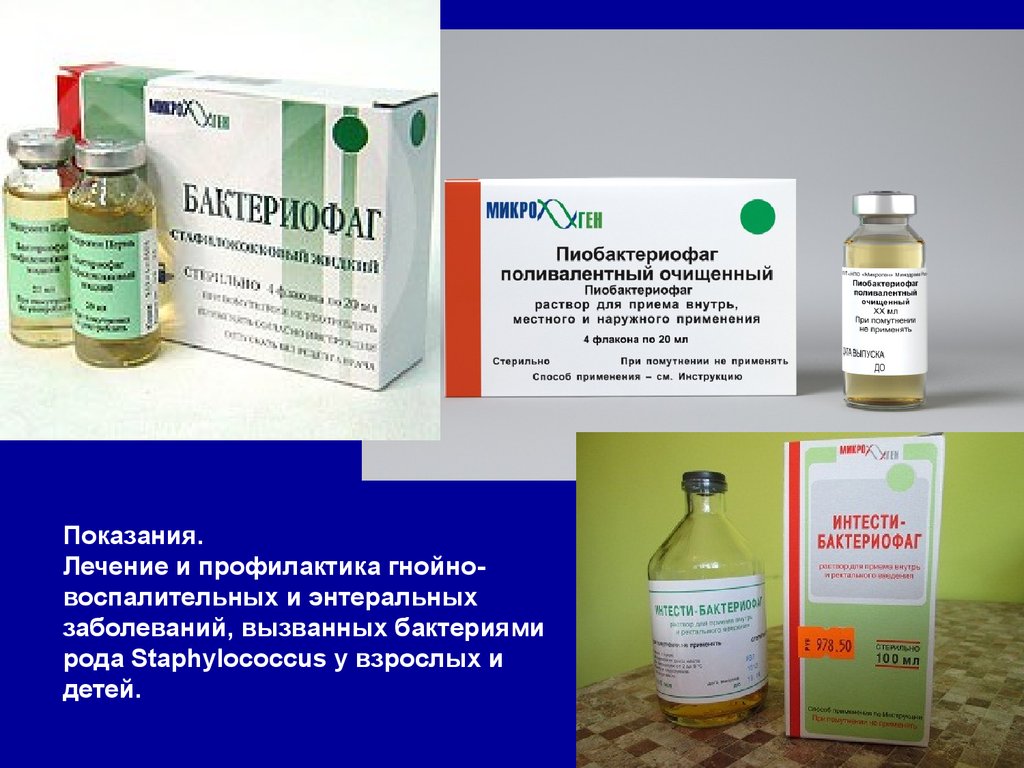
Читайте также 🦠🧬🌡
- Всё об антибиотиках: 22 ответа на важные вопросы
- Как бактерии помогут решить проблемы человечества
- 100 вопросов микробиологу о коронавирусе
- Не все вирусы одинаково опасны: они могут приносить человечеству пользу
- Как долго живут бактерии и вирусы в вашем доме
Безопасность терапии бактериофагами при тяжелой инфекции Staphylococcus aureus
Доступность данных
Геномы AB-SA01 опубликованы 4 и находятся в открытом доступе.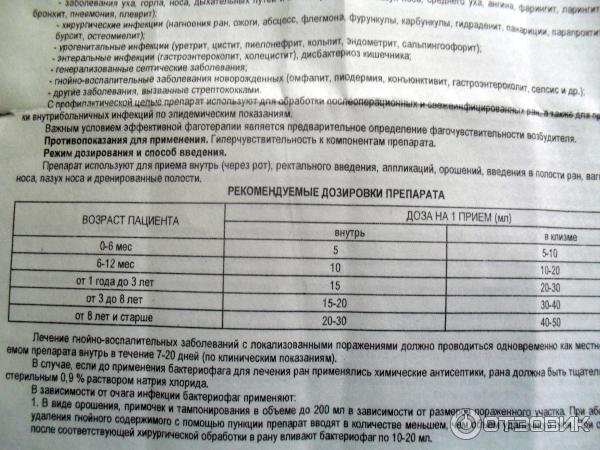 Чтения необработанных последовательностей доступны на NCBI под регистрационным номером BioProject PRJNA541589, а дополнительные данные представлены в дополнительном разделе. Клинические данные подлежат ограничениям конфиденциальности в соответствии с австралийским законодательством, и запросы должны быть направлены соответствующему автору.
Чтения необработанных последовательностей доступны на NCBI под регистрационным номером BioProject PRJNA541589, а дополнительные данные представлены в дополнительном разделе. Клинические данные подлежат ограничениям конфиденциальности в соответствии с австралийским законодательством, и запросы должны быть направлены соответствующему автору.
История изменений
05 марта 2020 г.
Исправление к данному документу опубликовано: https://doi.org/10.1038/s41564-020-0698-9
Ссылки 9 0003
Асгейрссон, Х. ., Thalme, A. & Weiland, O. Staphylococcus aureus бактериемия и эндокардит – эпидемиология и исход: обзор. Заразить. Дис. 50 , 175–192 (2018).
Артикул Google Scholar
Grubitzsch, H. et al. Хирургия эндокардита протезированного клапана: связь между заболеваемостью, смертностью и затратами.
Артикул Google Scholar
Watts, G. Фаговая терапия: возрождение ушедшего противомикробного препарата. Ланцет 390 , 2539–2540 (2017).
Артикул Google Scholar
Lehman, S.M. et al. Дизайн и доклиническая разработка фагового продукта для лечения устойчивых к антибиотикам инфекций
Артикул КАС Google Scholar
Ooi, M.L. et al. Безопасность и переносимость терапии бактериофагами при хроническом риносинусите, вызванном Staphylococcus aureus . JAMA Отоларингол. Хирургия головы и шеи. 145 , 723–729 (2019).
Артикул Google Scholar
- «>
Park, L. P. et al. Валидированная оценка риска для прогнозирования 6-месячной смертности при инфекционном эндокардите.
Артикул Google Scholar
Дурак, Д. Т., Люкс, А. С. и Брайт, Д. К. Новые критерии диагностики инфекционного эндокардита: использование специфических эхокардиографических данных. Служба эндокардита Герцога. 900:23 утра. Дж. Мед. 96 , 200–209 (1994).
Артикул КАС Google Scholar
Bouchiat, C. et al. Staphylococcus aureus инфекционный эндокардит против штаммов бактериемии: на карту поставлены тонкие генетические различия. Заразить. Жене. Эвол.
Артикул КАС Google Scholar
Австралийская группа по устойчивости к противомикробным препаратам Австралийская программа оценки исходов сепсиса, вызванная золотистым стафилококком (ASSOP), Годовой отчет за 2015 г.
 (под редакцией Coombs et al.) (Commun. Dis. Intell., 2018).
(под редакцией Coombs et al.) (Commun. Dis. Intell., 2018).Фабижан, А. П., Бен Закур, Н. Л., Хо, Дж., Лин, Р. С. Ю., Иределл, Дж. Поликлональный Staphylococcus aureus бактериемия. Препринт на https://annals.org/aim/article-abstract/2751455/polyclonal-staphylococcus-aureus-bacteremia (2019).
Джинн, А. Н. и др. Количественная мультиплексная тандемная ПЦР для прямого выявления бактериемии у пациентов в критическом состоянии. Патология 49 , 304–308 (2017).
Артикул КАС Google Scholar
Шули, Р. Т. и др. Разработка и использование персонализированных лечебных коктейлей на основе бактериофагов для лечения пациентов с диссеминированной резистентной инфекцией Acinetobacter baumannii . Антимикроб. Агенты Чемотер. 61 , e00954-17 (2017).
Артикул Google Scholar
- «>
Lin, R.C.Y. et al. PI3K(p110α) защищает от сердечной недостаточности, вызванной инфарктом миокарда. Артериоскл. Васк. Тром. 30 , 724–732 (2010).
Артикул КАС Google Scholar
Абедон, С. Фармакология фаготерапии: расчет дозировки фага. Доп. заявл. микробиол. 77 , 1–40 (2011).
Артикул Google Scholar
Горски А. и др. Фаги и иммуномодуляция. Будущая микробиология. 12 , 905–914 (2017).
Артикул КАС Google Scholar
Quan, H. et al. Обновление и проверка индекса коморбидности Чарлсона и оценки для корректировки риска в выписках из больницы с использованием данных из 6 стран. утра. Дж. Эпидемиол. 173 , 676–682 (2011).
Артикул Google Scholar
- «>
Капуццо, М. и др. Валидация систем оценки тяжести SAPS II и APACHE II в одноцентровой популяции.
Артикул КАС Google Scholar
Лопес, Дж. А. и Хорхе, С. Классификации RIFLE и AKIN для острого повреждения почек: критический и всесторонний обзор. клин. Kidney J. 6 , 8–14 (2013).
Артикул Google Scholar
Петрович А., Костаньсек Р., Рахели Г. и Кнежевич П. Первые бактериофаги семейства Siphoviridae, инфицирующие Bordetella bronchiseptica , выделенные из окружающей среды. Микро. Экол. 73
Артикул КАС Google Scholar
Фахардо-Лубиан, А., Бен Закур, Н. Л., Агиекум, А., Ци, К. и Иределл, Дж. Р. Адаптация хозяина и конвергентная эволюция повышают устойчивость к антибиотикам без потери вирулентности основного патогена человека.
 PLoS Патог. 15 , e1007218 (2019).
PLoS Патог. 15 , e1007218 (2019).Артикул Google Scholar
Maddocks, S. et al. Бактериофаговая терапия вентилятор-ассоциированной пневмонии и эмпиемы, вызванной
Артикул Google Scholar
Скачать ссылки
Благодарности
Мы благодарим Дж. Лай и Л. Ма из основного учреждения WIMR при поддержке Исследовательского центра Вестмида, Института рака Нового Южного Уэльса, Национального совета по здравоохранению и медицинским исследованиям и Фонда Яна Поттера; сотрудникам Отделения геномики патогенов, больницы Вестмид и Центра Рамачиотти (UNSW) за их технические консультации и поддержку в секвенировании; А. Нетлуч и П. Фа за аптечную поддержку; С. Чан, К. Гарнхэм, С. Н. Хутабарат, К. Ли, К. Робсон, А. Джинн, Б. Ройчудри, Н. Дж. Рай, а также персонал лаборатории микробиологии патологии Нового Южного Уэльса, госпиталь Вестмид, за их помощь с данными и образцами. коллекция, С. Чан за проведение операций по замене клапана и Б. Боуринг за лабораторную помощь. Мы благодарим сотрудников Ampliphi BioSciences Coporations (Сидней: С. Брэнстон; Сан-Диего: З. Ковач, К.-Л. Ланглайс Ферр, Ф. Росас, С. Леман, И. Билински и П. Гринт) за предоставление AB- SA01 и вся соответствующая информация о продукте и сертификаты анализа. Эта работа финансировалась Национальным советом по здравоохранению и медицинским исследованиям (правительство Австралии) и AmpliPhi Biosciences Corporation. Регистрация испытаний: Комитет по этике исследований на людях больницы Вестмид HREC/17/WMEAD/275; ClinicalTrials.gov: NCT03395769. ABPH предоставила исследовательский продукт AB-SA01 и частичную финансовую поддержку работы, проводимой в WSLHD и WIMR по лечению пациентов и анализу образцов, в качестве исследования под руководством исследователя, спонсируемого и компенсируемого WSLHD.
Джинн, Б. Ройчудри, Н. Дж. Рай, а также персонал лаборатории микробиологии патологии Нового Южного Уэльса, госпиталь Вестмид, за их помощь с данными и образцами. коллекция, С. Чан за проведение операций по замене клапана и Б. Боуринг за лабораторную помощь. Мы благодарим сотрудников Ampliphi BioSciences Coporations (Сидней: С. Брэнстон; Сан-Диего: З. Ковач, К.-Л. Ланглайс Ферр, Ф. Росас, С. Леман, И. Билински и П. Гринт) за предоставление AB- SA01 и вся соответствующая информация о продукте и сертификаты анализа. Эта работа финансировалась Национальным советом по здравоохранению и медицинским исследованиям (правительство Австралии) и AmpliPhi Biosciences Corporation. Регистрация испытаний: Комитет по этике исследований на людях больницы Вестмид HREC/17/WMEAD/275; ClinicalTrials.gov: NCT03395769. ABPH предоставила исследовательский продукт AB-SA01 и частичную финансовую поддержку работы, проводимой в WSLHD и WIMR по лечению пациентов и анализу образцов, в качестве исследования под руководством исследователя, спонсируемого и компенсируемого WSLHD.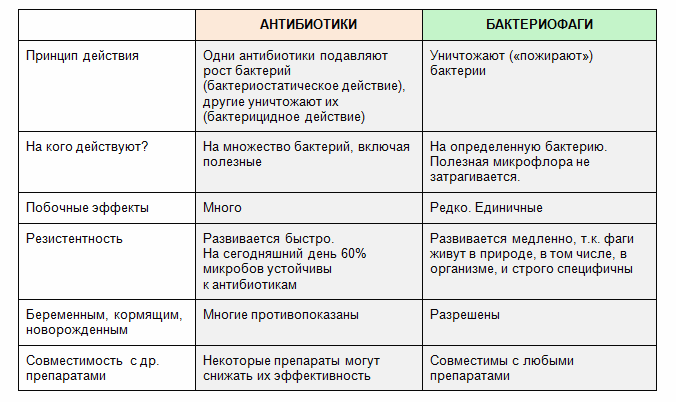 J.R.I., C.V. и Н.Б.З. поддерживаются грантами №№ 1104232 и 1107322 Австралийского национального совета по здравоохранению и медицинским исследованиям.
J.R.I., C.V. и Н.Б.З. поддерживаются грантами №№ 1104232 и 1107322 Австралийского национального совета по здравоохранению и медицинским исследованиям.
Информация об авторе
Примечания автора
Полный список авторов и их организаций приводится в конце статьи.
Эти авторы внесли равный вклад: R.C.Y. Lin и A. Petrovic Fabijan.
Авторы и организации
Центр инфекционных заболеваний и микробиологии, Вестмидский институт медицинских исследований, Сидней, Новый Южный Уэльс, Австралия
Александра Петрович Фабижан, Руби С. И. Лин, Джозефин Хо, Су Сан Мэддокс, Нури Л. Бен Закур, Джонатан Р. Иределл, Али Халид и Карола Вентурини
Больница Вестмид, Местный медицинский округ Западного Сиднея, Сидней, Новый Южный Уэльс, Австралия
Александра Петрович Фабижан, Руби С. И. Лин, Джозефин Хо, Сьюзан Мэддокс, Джонатан Р. Иределл, Инди Сандарадура и Тим Гилби
Медицинский факультет, Медицинская школа Сиднея, Университет Сиднея, Сидней, Новый Южный Уэльс, Австралия
Ruby C.
 Y. Lin, Susan Maddocks, Nouri L. Ben Zakour, Jonathan R. Iredell, Ali Khalid, Carola Venturini, Richard Chard & Indy Sandaradura
Y. Lin, Susan Maddocks, Nouri L. Ben Zakour, Jonathan R. Iredell, Ali Khalid, Carola Venturini, Richard Chard & Indy SandaraduraШкола медицинских наук, Университет Нового Южного Уэльса, Сидней, Новый Южный Уэльс , Австралия
Ruby C. Y. Lin
Отделение кардиоторакальной хирургии, больница Вестмид, Местный медицинский округ Западного Сиднея, Сидней, Новый Южный Уэльс, Австралия
Richard Chard
AmpliPhi BioSciences Corporation s, Сидней, Новый Южный Уэльс, Австралия
Сандра Моралес
Авторы
- Александра Петрович Фабижан
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Академия
- Ruby C.Y. Lin
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Josephine Ho
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Susan Maddocks
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Nouri L.
 Ben Zakour
Ben ZakourПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Джонатан Р. Иределл
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Consortia
Команда бактериофага Westmead
- Али Халид
- , Карола Вентурини
- , манда0016
- , Сандра Моралес
- , Инди Сандарадура
- и Тим Гилби
Взносы
J.R.I. задумал проект и разработал протокол лечения. С. Мэддокс, R.C.Y.L. и Дж.Х. принимали участие в изменении протокола v.2.0 и v.3.0. С. Мэддокс и Дж.Х. создал бланки отчетов о делах. Дж. Х. обследовали больных. Дж.Р.И., С. Мэддокс, Т.Г. и является. консультировались о пригодности пациентов. Р.К. консультировал пациентов с инфекционным эндокардитом и предоставлял образцы. J.R.I., R.C.Y.L. и А.П.Ф. проектировал эксперименты. J.R.I., A.P.F., R. C.Y.L., J.H. и С. Мэддокс написал статью. А.П.Ф., Р.С.И.Л. и Дж.Х. собрали и обработали образцы и проанализировали данные. Дж. Х. собрал данные о пациенте. А.П.Ф. провели и проанализировали чувствительность к фагам. А.П.Ф., Р.С.И.Л. и Дж.Р.И. проанализировали данные бактериальной и фаговой кинетики. Н.Л.Б.З. проанализировали данные секвенирования всего генома изолята. Р.С.И.Л. проанализировали данные транскриптома. С. Моралес участвовал в обсуждении данных и планировании проекта. Все члены WBTT участвовали в выявлении случаев и терапевтическом лечении. AmpliPhi Biosciences участвовала в разработке протокола и подготовила необходимые вспомогательные документы (в том числе Фармацевтическое руководство и информацию о продукте AB-SA01 и сертификаты анализа), участвовала в рассмотрении рассказов пациентов и произвела исследуемый фаговый продукт AB-SA01 в соответствии с требованиями GMP.
C.Y.L., J.H. и С. Мэддокс написал статью. А.П.Ф., Р.С.И.Л. и Дж.Х. собрали и обработали образцы и проанализировали данные. Дж. Х. собрал данные о пациенте. А.П.Ф. провели и проанализировали чувствительность к фагам. А.П.Ф., Р.С.И.Л. и Дж.Р.И. проанализировали данные бактериальной и фаговой кинетики. Н.Л.Б.З. проанализировали данные секвенирования всего генома изолята. Р.С.И.Л. проанализировали данные транскриптома. С. Моралес участвовал в обсуждении данных и планировании проекта. Все члены WBTT участвовали в выявлении случаев и терапевтическом лечении. AmpliPhi Biosciences участвовала в разработке протокола и подготовила необходимые вспомогательные документы (в том числе Фармацевтическое руководство и информацию о продукте AB-SA01 и сертификаты анализа), участвовала в рассмотрении рассказов пациентов и произвела исследуемый фаговый продукт AB-SA01 в соответствии с требованиями GMP.
Автор, ответственный за переписку
Джонатан Р. Иределл.
Декларации этики
Конкурирующие интересы
Перечисленные авторы или WBTT не получали личного финансового интереса. В США подана предварительная заявка на патент от 4 октября 2018 г. R.C.Y.L., J.R.I., A.P.F. и С. Моралес являются изобретателями (дело поверенного № 054249-512; «Лечение бактериофагами и уменьшение воспалительной реакции»). ABPH является единственным владельцем AB-SA01. Дж.Р.И. ранее выступал в качестве клинического консультанта C3J Therapeutics. C3J Therapeutics и ABPH объявили о слиянии 4 января 2019 г.стать «Армата Фармасьютикалз».
В США подана предварительная заявка на патент от 4 октября 2018 г. R.C.Y.L., J.R.I., A.P.F. и С. Моралес являются изобретателями (дело поверенного № 054249-512; «Лечение бактериофагами и уменьшение воспалительной реакции»). ABPH является единственным владельцем AB-SA01. Дж.Р.И. ранее выступал в качестве клинического консультанта C3J Therapeutics. C3J Therapeutics и ABPH объявили о слиянии 4 января 2019 г.стать «Армата Фармасьютикалз».
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Дополнительная информация Рис. 1 и 2 и дополнительные таблицы 1 и 3.
Сводка отчетов
Дополнительная таблица 2
Дополнительные данные 2: пациенты S. aureus выделяет метаданные, тип последовательности и родство SNP.
Права и разрешения
Перепечатка и разрешения
Об этой статье
Атомная структура стафилококкового бактериофага с помощью криоэлектронной микроскопии — Новости
Знание структуры с высоким разрешением является ключевым звеном между вирусной биологией и потенциальным терапевтическим применением из вирус для подавления бактериальных инфекций.
Фаг Андхра
Изображение предоставлено: Dokland lab Криоэлектронная микроскопия, проведенная исследователями Университета Алабамы в Бирмингеме, выявила структуру бактериального вируса с беспрецедентной точностью. Это первая структура вируса, способного инфицировать Staphylococcus epidermidis, и знание структуры с высоким разрешением является ключевой связью между вирусной биологией и потенциальным терапевтическим использованием вируса для подавления бактериальных инфекций.
Бактериофаги или «фаги» — термин, используемый для обозначения вирусов, поражающих бактерии. Исследователи UAB под руководством Терье Докланда, доктора философии, в сотрудничестве с Асмой Хатум-Аслан, доктором философии, из Иллинойсского университета Урбана-Шампейн, описали атомные модели для всех или части 11 различных структурных белков в фаг Андхра. Исследование опубликовано в Science Advances.
Андхра относится к группе пиковирусов. Диапазон его хозяев ограничен S. epidermidis. Эта кожная бактерия в основном доброкачественная, но также является основной причиной инфекций постоянных медицинских устройств. «Пиковирусы редко встречаются в коллекциях фагов и остаются недостаточно изученными и недостаточно используемыми для терапевтических применений», — сказал Хатум-Аслан, фаговый биолог из Университета Иллинойса.
Эта кожная бактерия в основном доброкачественная, но также является основной причиной инфекций постоянных медицинских устройств. «Пиковирусы редко встречаются в коллекциях фагов и остаются недостаточно изученными и недостаточно используемыми для терапевтических применений», — сказал Хатум-Аслан, фаговый биолог из Университета Иллинойса.
С появлением устойчивости к антибиотикам у S. epidermidis и связанного с ним патогена Staphylococcus aureus исследователи возобновили интерес к потенциальному использованию бактериофагов для лечения бактериальных инфекций. Пиковирусы всегда убивают клетки, которые они заражают, после связывания с бактериальной клеточной стенкой, ферментативным прорывом этой стенки, проникновением через клеточную мембрану и введением вирусной ДНК в клетку. У них также есть другие черты, которые делают их привлекательными кандидатами для терапевтического использования, включая небольшой геном и неспособность переносить бактериальные гены между бактериями.
Знание структуры белка в Андхре и понимание того, как эти структуры позволяют вирусу инфицировать бактерию, позволит производить фаги по индивидуальному заказу, предназначенные для конкретной цели, с использованием генетических манипуляций.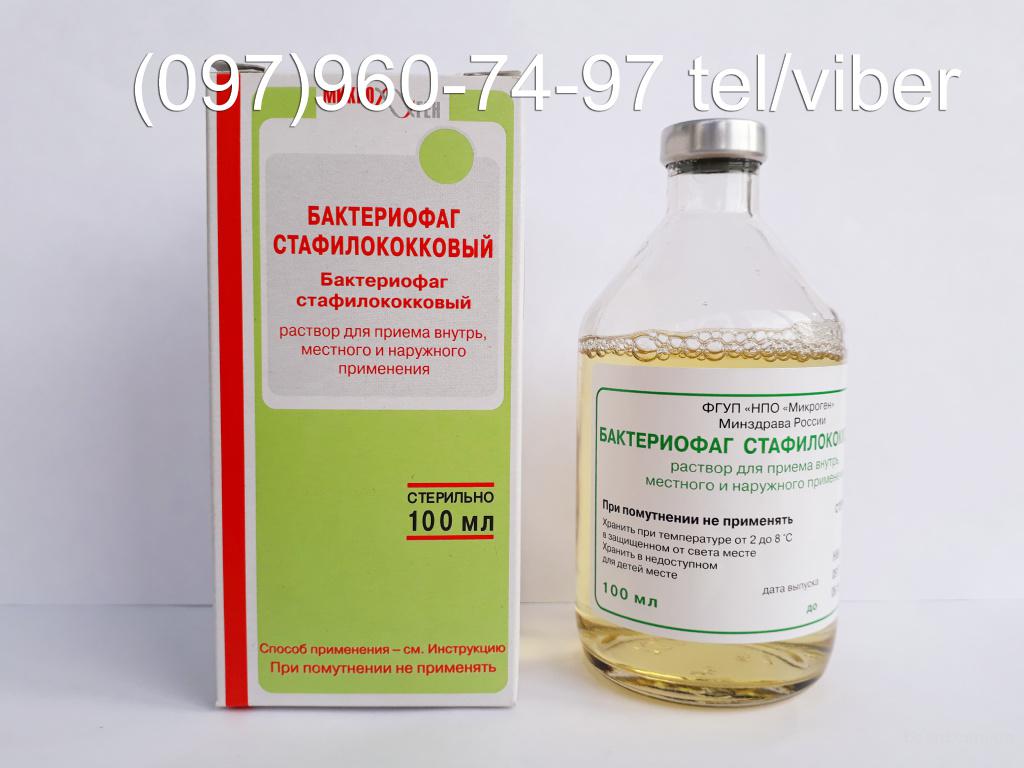
«Структурная основа специфичности хозяина между фагами, инфицирующими S. aureus и S. epidermidis, до сих пор плохо изучена», — сказал Докланд, профессор микробиологии в UAB и директор ядра криоэлектронной микроскопии UAB. «С помощью настоящего исследования мы лучше поняли структуру и функции продуктов гена Andhra и детерминанты специфичности хозяина, проложив путь к более рациональному дизайну пользовательских фагов для терапевтического применения. Наши результаты объясняют критические особенности сборки вириона, распознавания хозяина и проникновения».
Terje Dokland
Фотография: Lexi Coon Стафилококковые фаги обычно имеют узкий круг бактерий, которые они могут инфицировать, в зависимости от изменчивых полимеров стенок тейхоевой кислоты на поверхности различных бактериальных штаммов. «Этот узкий круг хозяев — палка о двух концах: с одной стороны, он позволяет фагам нацеливаться только на конкретный патоген, вызывающий заболевание; с другой стороны, это означает, что фаг может нуждаться в адаптации к пациенту в каждом конкретном случае», — сказал Докланд.
Общая структура Андхры представляет собой 20-гранную округлую икосаэдрическую капсидную головку, содержащую вирусный геном. Капсид прикреплен к короткому хвосту. Хвост в значительной степени отвечает за связывание с S. epidermidis и ферментативное разрушение клеточной стенки. Вирусная ДНК вводится в бактерию через хвост. Сегменты хвоста включают портал от капсида к хвосту, а также стебель, придатки, ручку и кончик хвоста.
11 различных белков, из которых состоит каждая вирусная частица, находятся в нескольких копиях, которые собираются вместе. Например, капсид состоит из 235 копий каждого из двух белков, а остальные девять белков вириона имеют число копий от двух до 72. Всего вирион состоит из 645 белковых фрагментов, включая две копии 12-го белка, структура которого была предсказана с помощью программы предсказания структуры белка AlphaFold.
Атомные модели, описанные Докландом, Хатумом-Асланом и соавторами Н’Тойей С. Хокинс, доктором философии, и Джеймсом Л. Киззией, доктором философии, отделение микробиологии UAB, показывают структуры для каждый белок — как описано на молекулярном языке, таком как альфа-спираль, бета-спираль, бета-спираль, бета-бочонок или бета-призма. Исследователи описали, как каждый белок связывается с другими копиями того же типа белка, например, образуя гексамерную и пентамерную поверхности капсида, а также как каждый белок взаимодействует с соседними белками разных типов.
Исследователи описали, как каждый белок связывается с другими копиями того же типа белка, например, образуя гексамерную и пентамерную поверхности капсида, а также как каждый белок взаимодействует с соседними белками разных типов.
Электронные микроскопы используют пучок ускоренных электронов для освещения объекта, обеспечивая гораздо более высокое разрешение, чем световой микроскоп. Криоэлектронная микроскопия добавляет элемент сверхнизких температур, что делает ее особенно полезной для разрешения околоатомной структуры более крупных белков, мембранных белков или образцов, содержащих липиды, таких как связанные с мембраной рецепторы, и комплексов нескольких биомолекул вместе.
За последние восемь лет новые детекторы электронов позволили криоэлектронной микроскопии добиться огромного скачка разрешения по сравнению с обычной электронной микроскопией. Ключевые элементы так называемой «революции разрешения» для криоэлектронной микроскопии:
- Мгновенная заморозка водных образцов в жидком этане, охлажденном до температуры ниже -256 градусов по Фаренгейту.
 Вместо кристаллов льда, которые разрушают образцы и рассеивают электронный луч, вода замерзает в виде «стекловидного льда», похожего на окно.
Вместо кристаллов льда, которые разрушают образцы и рассеивают электронный луч, вода замерзает в виде «стекловидного льда», похожего на окно. - Образец хранится в микроскопе при очень низких температурах, и используется низкая доза электронов, чтобы избежать повреждения белков.
- Чрезвычайно быстрые детекторы прямых электронов способны подсчитывать отдельные электроны со скоростью сотни кадров в секунду, позволяя корректировать движение образца на лету.
- Передовые вычисления объединяют тысячи изображений для создания трехмерных структур с высоким разрешением. Графические процессоры используются для обработки терабайтов данных.
- Столик микроскопа, на котором находится образец, также можно наклонять во время съемки изображений, что позволяет создавать трехмерные томографические изображения, аналогичные компьютерной томографии в больнице.
Анализ структуры вириона Андхра исследователями UAB начался с 230 714 изображений частиц.
