ДИАГНОСТИКА И СТУПЕНЧАТЫЙ ПОДХОД К КЛАССИФИКАЦИИ И ЛЕЧЕНИЮ БРОНХИАЛЬНОЙ АСТМЫ | Княжеская Н.П.
Несмотря на четкое определение бронхиальной астмы, достаточно яркие симптомы и возможности функциональных методов исследования диагностика заболевания вызывает трудности.
В статье показаны современные подходы к постановке диагноза, классификация и лечение бронхиальной астмы с помощью ступенчатого метода.
Despite the fact that bronchial asthma is well defined, its rather obvious symptoms and the capacities of functional techniques present some difficulties in diagnosing the disease. The paper outlines currently available approaches to making the diagnosis of bronchial asthma, its classification, and treatment by applying a stepwise approach.
Н. П. Княжеская, кафедра госпитальной терапии педиатрического факультета РГМУ, Москва
N.P. Knyazhevskaya, Department of Hospital Therapy, Russian State Medical University
Бронхиальная астма — хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клектки: тучные, зозинофилы, Т-лимфоциты.
Как показывают эпидемиологические исследования, несмотря на четкое определение заболевания, достаточно яркие симптомы и большие возможности функциональных методов исследования, бронхиальную астму плохо диагностируют, а следовательно, и плохо лечат [2]. Наиболее часто астму диагностируют как различные формы бронхита и как следствие этого неэффективно и неадекватно лечат курсами антибиотиков и противокашлевых препаратов [3 — 5]. Таким образом, распространенный тезис о том, что

В постановке диагноза бронхиальной астмы существенное значение придается анамнезу и оценке симптомов заболевания. Наиболее распространенными симптомами являются эпизодические приступы удушья, одышки, появление свистящих хрипов, ощущение тяжести в грудной клетке, а также кашель. Однако сами по себе эти симптомы еще не являются диагнозом. Важный клинический маркер бронхиальной астмы — исчезновение симптомов спонтанно или после применения бронходилататоров и противовоспалительных препаратов. При оценке и сборе анамнеза значение придается следующим фактам: повторные обострения, чаще всего провоцируемые аллергенами, ирритантами, физической нагрузкой или вирусной инфекцией, а также сезонная вариабельность симптомов и наличие атопических заболеваний у родственников [1, 6, 7].
 Однако необходимо помнить, что у некоторых больных даже в период обострения при аускультации хрипы могут не выслушиваться, в то время как с помощью объективных исследований будет зарегистрирована значительная бронхообструкция, вероятно, за счет преобладающего вовлечения в процесс мелких дыхательных путей. Поэтому измерение функции внешнего дыхания (ФВД) обеспечивает объективную оценку бронхообструкции, а измерение ее колебаний — непрямую оценку гиперреактивности дыхательных путей. Существует широкий диапазон различных методов оценки степени бронхиальной обструкции, но наиболее широкое применение получили измерение объема форсированного выдоха за 1 с (ОФВ1) и связанное с ним измерение форсированной жизненной емкости легких (ФЖЕЛ), а также измерение форсированной (пиковой) скорости выдоха (ПСВ) [8].
Однако необходимо помнить, что у некоторых больных даже в период обострения при аускультации хрипы могут не выслушиваться, в то время как с помощью объективных исследований будет зарегистрирована значительная бронхообструкция, вероятно, за счет преобладающего вовлечения в процесс мелких дыхательных путей. Поэтому измерение функции внешнего дыхания (ФВД) обеспечивает объективную оценку бронхообструкции, а измерение ее колебаний — непрямую оценку гиперреактивности дыхательных путей. Существует широкий диапазон различных методов оценки степени бронхиальной обструкции, но наиболее широкое применение получили измерение объема форсированного выдоха за 1 с (ОФВ1) и связанное с ним измерение форсированной жизненной емкости легких (ФЖЕЛ), а также измерение форсированной (пиковой) скорости выдоха (ПСВ) [8]. 
Многие исследования продемонстрировали, что предъявляемые пациентами жалобы не соответствуют степени бронхиальной обструкции.
Неправильная оценка степени тяжести течения астмы самим больным и его врачом является основным фактором, обусловливающим недостаточно адекватное противовоспалительное лечение, и может привести к тяжелому обострению или даже к летальному исходу. Применение пикфлоуметрии позволяет достаточно точно диагностировать и классифицировать тяжесть течения бронхиальной астмы и соответственно назначать противовоспалительную поддерживающую терапию с учетом тяжести заболевания, т. е. осуществлять так называемый ступенчатый подход [9].
Однако в ряде случаев кожные тесты приводят к ложнонегативным или ложнопозитивным результатам.
 Поэтому часто проводится исследование специфических IgE-антител в сыворотке крови.
Поэтому часто проводится исследование специфических IgE-антител в сыворотке крови. | Диагностика астмы строится на основании анализа симптомов и анамнеза, а также исследовании ФВД. Наиболее важными легочными функциональными тестами являются выявление ответа на ингаляции b2-агонистов, изменение вариабельности бронхиальной проходимости с помощью мониторирования ПСВ, провокации с помощью физической нагрузки у детей. Ценным дополнением к диагностике является определение аллергологического статуса. |
Как было уже сказано, бронхиальную астму довольно часто неправильно диагностируют и как следствие этого назначают неправильную терапию. Особенно трудно диагностировать астму у детей, пожилых людей, а также при воздействии профессиональных факторов риска, сезонности заболевания и при кашлевом варианте астмы.
.gif) Помощь в постановке диагноза оказывает выяснение семейного анамнеза, атопического фона. Повторные приступы ночного кашля у детей, в остальном практически здоровых, почти наверняка подтвержают диагноз бронхиальной астмы [10]. У некоторых детей симптомы астмы провоцирует физическая нагрузка [11].
Помощь в постановке диагноза оказывает выяснение семейного анамнеза, атопического фона. Повторные приступы ночного кашля у детей, в остальном практически здоровых, почти наверняка подтвержают диагноз бронхиальной астмы [10]. У некоторых детей симптомы астмы провоцирует физическая нагрузка [11]. Диагностика профессиональной астмы также представляет определенную сложность.

Они варьируют от высокоактивных низкомолекулярных соединений, таких как изоцианаты, до известных низкомолекулярных соединений, таких как изоцианаты, до известных иммуногенов, таких как соли платины, растительных комплексов и продуктов животного происхождения. Для постановки диагноза нужен четкий анамнез: отсутствие симптомов до начала работы, подтвержденная связь между развитием симптомов астмы на рабочем месте и их исчезновением после ухода с данного рабочего места. Точно подтвердить диагноз бронхиальной астмы можно при помощи исследования показателей ФВД: измерения ПСВ на работе и вне рабочего места, проведение специфических провокационных тестов. Следует учитывать, что даже при прекращении воздействия повреждающего агента сохраняется и продолжает ухудшаться течение бронхиальной астмы. Поэтому очень важны ранняя диагностика профессиональной астмы, прекращение контакта с повреждающим агентом, а также рациональная фармакотерапия.

Сезонная астма обычно связана с аллергическим ринитом. В период между сезонами симптомы бронхиальной астмы могут полностью отсутствовать. При постановке диагноза большое значение имеют анамнез и углубленное аллергообследование, а также измерение показателей ФВД и проведение ингаляционных тестов с b
Кашлевой вариант астмы представляет значительную трудность в диагностике данного заболевания. Кашель практически является основным, а иногда и единственным симптомом. У таких больных кашель часто возникает в ночные часы и, как правило, не сопровождается свистящими хрипами. При исследовании показетелей ФВД в дневные часы часто регистрируются нормальные значения. Для правильной постановки диагноза большое значение имеет определение вариабельности показателей ФВД в сочетании с поисками эозинофилов в мокроте и диагностическими тестами для выявления гиперчувствительности [13].
Классификация бронхиальной астмы проводится на основании этиологии, тяжести течения и особенностей проявления бронхиальной обструкции.
 В прошлые годы из-за отсутствия понимания основополагающих процессов, происходящих при астме, основной упор делали на более очевидные проявления бронхиальной астмы, а именно на острое воспаление, бронхоспазм и ограничение воздушного потока [14]. Это привело к преимущественному использованию бронходилататоров для коррекции всех проявлений астмы. В настоящее время известно, что воспаление воздушных путей подразумевает как обострение, так и хроническое течение астмы. В связи с этим произошло изменение подходов к лечению болезни по направлению к длительному использованию противовоспалительных лекарств. Для подбора адекватной противовоспалительной терапии важно определить тяжесть течения бронхиальной астмы. Ни один тест не позволит точно классифицировать степень тяжести бронхиальной астмы. Однако комбинирование оценки симптомов и показателей ФВД дает характеристику болезни в зависимости от степени тяжести.
В прошлые годы из-за отсутствия понимания основополагающих процессов, происходящих при астме, основной упор делали на более очевидные проявления бронхиальной астмы, а именно на острое воспаление, бронхоспазм и ограничение воздушного потока [14]. Это привело к преимущественному использованию бронходилататоров для коррекции всех проявлений астмы. В настоящее время известно, что воспаление воздушных путей подразумевает как обострение, так и хроническое течение астмы. В связи с этим произошло изменение подходов к лечению болезни по направлению к длительному использованию противовоспалительных лекарств. Для подбора адекватной противовоспалительной терапии важно определить тяжесть течения бронхиальной астмы. Ни один тест не позволит точно классифицировать степень тяжести бронхиальной астмы. Однако комбинирование оценки симптомов и показателей ФВД дает характеристику болезни в зависимости от степени тяжести. Установлено, что оценка течения бронхиальной астмы, основанная на клинических проявлениях болезни, связана с показателями степени воспаления дыхательных путей [15].

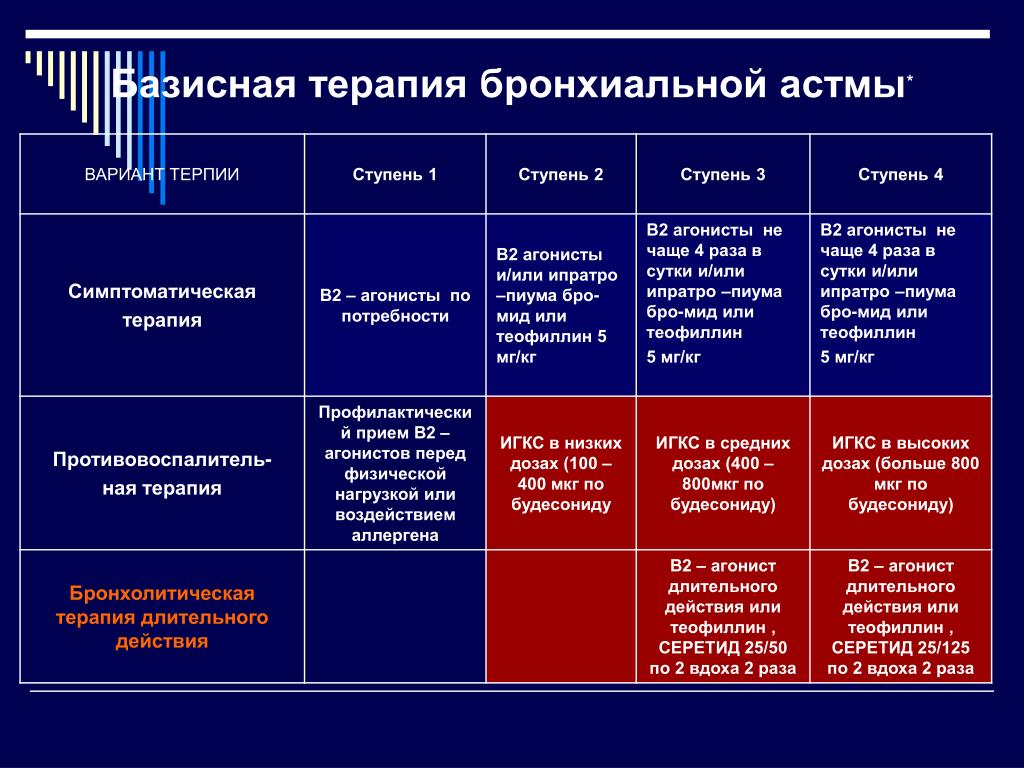
Как уровень обструкции, так и степень ее обратимости позволяют подразделить астму по степени тяжести на интермиттирующую, легкую персистирующую (хронического течения), средней тяжести (умеренную) и тяжелую [16]. При лечении астмы в настоящее время применяют ступенчатый подход, при котором интенсивность терапии увеличивается по мере увеличения степени тяжести астмы (рис. 1).
Ступенчатый подход к терапии астмы рекомендуется в связи с большим разнообразием тяжести течения астмы у различных людей и у одного и того же пациента в разные временны’е периоды. Цель такого подхода — достижение контроля над заболеванием с применением наименьшего количества препаратов. Количество и частота приема лекарств увеличиваются (ступень вверх), если течение астмы ухудшается, и уменьшается (ступень вниз), если течение астмы хорошо контролируется. Ступенчатый подход также предполагает необходимость избегать или контролировать триггеры на каждой ступени. |
После определения тяжести течения астмы у больного (см. рис. 1) врач должен решить вопрос о том, стоит ли проводить вначале максимальное лечение для наиболее быстрого достижения контроля над астмой с последующим снижением препаратов (ступень вниз) или начать лечение с небольшого объема лекарств, а затем усиливать его (ступень вверх) при необходимости. В любом случае если удается контролировать симптомы астмы в течение 3 мес, то можно тщательно обдумать вопрос об уменьшении терапии (ступень вниз). Переход на более низкую ступень позволяет установить наименьший объем терапии, необходимый для контроля.
Подходы к лечению в зависимости от тяжести течения астмы показаны на рис. 2. Следует учитывать, что наименьшая тяжесть течения астмы представлена в 1-й ступени, а наибольшая — в 4-й ступени. Ступенчатый подход к лечению предусматривает подъем на более высокий уровень, если контроль над астмой не удается достичь или он потерян. Однако при этом необходимо учитывать, правильно ли больной принимает лекарства соответствующей ступени и нет ли контакта с аллергенами или другими провоцирующими факторами.
Контроль считается неудовлетворительным, если у больного наблюдаются:
|
Ступень 1. Больные с легким интермиттирующим течением астмы — это пациенты, у которых симптомы астмы появляются только при контакте с аллергенами (например, пыльца или шерсть животных) или обусловлены физической нагрузкой, а также дети, у которых свистящее дыхание возникает во время респираторно-вирусной инфекции нижних дыхательных путей.
Интермиттирующая астма — это не обычная форма болезни. Тяжесть обострений может значительно варьировать у различных больных в разное время. Такие обострения могут быть даже угрожающими для жизни, хотя это встречается крайне редко при интермиттирующем течении заболевания.
Тяжесть обострений может значительно варьировать у различных больных в разное время. Такие обострения могут быть даже угрожающими для жизни, хотя это встречается крайне редко при интермиттирующем течении заболевания.
Длительная терапия противовоспалительными препаратами, как правило, не показана этим больным. Лечение включает профилактическй прием лекарств перед физической нагрузкой при необходимости (ингаляционные b2-агонисты или кромогикат, или недокормил). Как альтернатива для ингаляционных b2-агонистов короткого действия могут быть предложены антихолинергические препараты, пероральные b2-агонисты короткого действия или тнофиллины короткого действия, хотя эти препараты начинают действие позднее и/или у них выше риск развития побочных проявлений.
Иногда более тяжелые и длительные обострения требуют назначения короткого курса пероральных кортикостероидов (см. рис. 2).
Ступень 2. Больные с легким персистирующим течением астмы нуждаются в ежедневном длительном профилактическом приеме лекарств для достижения и поддержания контроля над астмой. Первичная терапия — это прием противовоспалительных препаратов. Лечение можно начинать с ингаляционных кортикостероидов, кромогликата натрия или недокромила натрия. Предлагаемая доза кортикостероидов — 200 — 500 мкг беклометазона дипропионата или будесонида, или ингакорта, или другого эквивалента в день. Может быть предложена терапия теофиллинами пролонгированного действия. Однако необходимость контролировать концентрацию его в плазме (терапевтический разброс 5 — 15 мг/л) может сделать такое лечение не всегда возможным. Ингаляционные b2-агонисты можно использовать для облегчения симптомов, но частота их приема не должна превышать 3 — 4 раз в сутки. Как альтернатива для ингаляционных b2-агонистов короткого действия могут быть предложены антихолинергические препараты, пероральные b2-агонисты короткого действия или теофиллины короткого действия, хотя эти препараты начинают действие позднее и/или у них выше риск развития побочных проявлений. Если больной принимает теофиллины пролонгированного действия, то прежде всего следует определить концентрацию теофиллина в плазме перед назначением теофиллинов короткого действия.
Первичная терапия — это прием противовоспалительных препаратов. Лечение можно начинать с ингаляционных кортикостероидов, кромогликата натрия или недокромила натрия. Предлагаемая доза кортикостероидов — 200 — 500 мкг беклометазона дипропионата или будесонида, или ингакорта, или другого эквивалента в день. Может быть предложена терапия теофиллинами пролонгированного действия. Однако необходимость контролировать концентрацию его в плазме (терапевтический разброс 5 — 15 мг/л) может сделать такое лечение не всегда возможным. Ингаляционные b2-агонисты можно использовать для облегчения симптомов, но частота их приема не должна превышать 3 — 4 раз в сутки. Как альтернатива для ингаляционных b2-агонистов короткого действия могут быть предложены антихолинергические препараты, пероральные b2-агонисты короткого действия или теофиллины короткого действия, хотя эти препараты начинают действие позднее и/или у них выше риск развития побочных проявлений. Если больной принимает теофиллины пролонгированного действия, то прежде всего следует определить концентрацию теофиллина в плазме перед назначением теофиллинов короткого действия. При более тяжелых и длительных обострениях требуется назначение короткого курса пероральных кортикостероидов.
При более тяжелых и длительных обострениях требуется назначение короткого курса пероральных кортикостероидов.
Если симптомы персистируют несмотря на начальную дозу ингаляционных кортикостероидов и врач уверен в том, что больной правильно использует препараты, дозу ингаляционных препаратов следует увеличить от 400 — 500 до 750 — 800 мкг в день (беклометазона дипропионат или эквивалент). Возможной альтернативой увеличению дозы ингаляционных гормонов, особенно для контроля ночных симптомов астмы (к дозе по крайней мере 500 мкг ингаляционных кортикостероидов), может быть назначение бронходилататоров пролонгированного действия на ночь.
Если контроля не удается достичь, что выражается более частыми симптомами, увеличением потребности в бронходилататорах или падением показателей ПСВ, то следует начать лечение по 3-й ступени.
Ступень 3. Больные со средней тяжестью течения астмы требуют ежедневного приема профилактических противовоспалительных препаратов для установления и поддержания контроля над астмой. Доза ингаляционных кортикостероидов должна быть на уровне 800 — 2000 мкг беклометазона дипротионата или его эквивалента. Рекомендуется использовать ингалятор со спейсером. Бронходилататоры длительного действия могут быть также назначены в добавление к ингаляционным кортикостероидам, особенно для контроля ночных симптомов. Можно применять теофиллины длительного действия, пероральные и ингаляционные b2-агонисты длительного действия. Необходимо мониторировать концентрацию теофиллина длительного действия (обычный диапазон терапевтической концентрации 5 — 15 мкг на 1 мл). Купировать симптомы следует b2-агонистами короткого действия или альтернативными препаратами, как описано во 2-й ступени. При более тяжелых обострениях можно проводить курс пероральных кортикостероидов.
Доза ингаляционных кортикостероидов должна быть на уровне 800 — 2000 мкг беклометазона дипротионата или его эквивалента. Рекомендуется использовать ингалятор со спейсером. Бронходилататоры длительного действия могут быть также назначены в добавление к ингаляционным кортикостероидам, особенно для контроля ночных симптомов. Можно применять теофиллины длительного действия, пероральные и ингаляционные b2-агонисты длительного действия. Необходимо мониторировать концентрацию теофиллина длительного действия (обычный диапазон терапевтической концентрации 5 — 15 мкг на 1 мл). Купировать симптомы следует b2-агонистами короткого действия или альтернативными препаратами, как описано во 2-й ступени. При более тяжелых обострениях можно проводить курс пероральных кортикостероидов.
Если контроля не удается достичь, что выражается более частыми симптомами, увеличением потребности в бронходилататорах, или падением показателей ПСВ, то следует начать лечение по 4-й ступени.
Рис. 1. Длительный контроль над астмой: диагностируйте и классифицируйте тяжесть течения
Рис.2. Длительный контроль над астмой: лечение с учетом ступенчатого подхода
Ступень 4. Больным с тяжелым течением бронхиальной астмы полностью контролировать астму не удается. Целью лечения становится достижение возможно лучших результатов: минимальное количество симптомов, минимальная потребность в b2-агонистах короткого действия, лучшие возможные показатели ПСВ, минимальный разброс ПСВ и минимальные побочные проявления от приема препаратов. Лечение обычно проводят с помощью большого количества контролирующих течение астмы препаратов.
Первичное лечение включает ингаляционные кортикостероиды в высоких дозах (от 800 до 2000 мкг в день беклометазона дипропионата или его эквивалента). В добавление к ингаляционным кортикостероидам рекомендуются пролонгированные бронходилататоры. Для достижения эффекта можно также 1 раз в день применять b2-агонисты короткого действия. Можно попробовать применить антихолинергический препарат (атровент), особенно больным, которые отмечают побочные явления при приеме b2-агонистов. При необходимости для облегчения симптомов можно использовать ингаляционные b2-агонисты короткого действия, но частота их приема не должна превышать 3 — 4 раз в сутки. Более тяжелое обострение может потребовать проведения курса пероральных кортикостероидов.
Можно попробовать применить антихолинергический препарат (атровент), особенно больным, которые отмечают побочные явления при приеме b2-агонистов. При необходимости для облегчения симптомов можно использовать ингаляционные b2-агонисты короткого действия, но частота их приема не должна превышать 3 — 4 раз в сутки. Более тяжелое обострение может потребовать проведения курса пероральных кортикостероидов.
Длительное лечение пероральными кортикостероидами следует проводить в минимальных дозах или, если возможно, через день. Лечение высокими дозами ингаляционных кортикостероидов назначают через спейсер, что способствует более эффективному контролю и снижает некоторые побочные проявления.
Ступень вниз. Снижение поддерживающей терапии возможно, если астма остается под контролем не менее 3 мес. Это помогает снизить риск побочного действия и повышает восприимчивость больного к планируемому лечению. Уменьшать терапию следует ступенчато, понижая или отменяя последнюю дозу или дополнительные препараты. Необходимо наблюдать за симптомами, клиническими проявлениями и показателями ФВД.
Необходимо наблюдать за симптомами, клиническими проявлениями и показателями ФВД.
Таким образом, хотя бронхиальная астма — заболевание неизлечимое, вполне уместно ожидать, что у большинства больных может и должен быть достигнут контроль за течением заболевания.
Важно также отметить, что подход к диагностике, классификации и лечению астмы с учетом тяжести ее течения позволяет создавать гибкие планы и специальные лечебные программы в зависимости от доступности противоастматических препаратов, системы регионального здравоохранения и особенностей конкретного больного.
Литература:
1. Бронхиальная астма. Глобальная стратегия. Приложение к журналу Пульмонология. Москва. 1996;196.
2. Burney PGJ. Current questions in the epidemiology of asthma, in Holgate ST, et al (eds), Asthma: Physiology. Immunology, and Treatment. London, Academic Press, 1993;3-25.
3. Чучалин А.Г. Бронхиальная астма. М., 1985.
5. Wilson NM. Wheezy bronchitis revisited. Arch Dis Child 1989;64:1194-9.
Wilson NM. Wheezy bronchitis revisited. Arch Dis Child 1989;64:1194-9.
6. Федосеев Г.Б., Емельянов А.В. Бронхиальная астма: трудные и нерешенные проблемы. Тер. арх. 1991;3:74-8.
7. Abramson MJ, et al. Evaluation of a new asthma questionnaire. J Asthma 1991;28:165-73.
8. Lebowitz MJ. The use of peak expiratory flow rate measurements in respiratory disease. Pediatr Pulmonol 1991;11:166-74.
9. Novak rm, et al. Comprison of peak expiratory flow and FEV1 admission criteria for acute bronchial asthma. Ann Emerg Med 1982;11:64-9.
10. Sporik R, Holgate ST, Codswell JJ. Natural history of asthma in childhood — a birth cohort study. Arch Dis Child 1991;66:1050-3.
11. Eggleston PA. Exercise — induced asthma, in Tinkelman DG, Npitz CK (eds), Childhood Asthma: Pathophysiology and Treatment, 2 nd. New York 6 Marcel Dekker, 1992;429-46.
12. Dow L, Coddon D, Holgate ST. Respiratory symptoms as predictors of airways in an elderly population. Respir Med 1992;146:402-7.
Respir Med 1992;146:402-7.
13. Cloutier MM, Loughlin GV. Chronic cough in children: a manifestation of airway hyperreactivity. Pediatrics 1981;67:6-12 Bousquet J, et al. Eosinophilic inflammation in asthma. N Engl J Med 1990;323:1033-9.
14. Чучалин А.Г. Лечебные программы бронхиальной астмы. Тер. арх. 1987;3:111-6.
15. Bousquet J, et al. Eosinophilic inflammation in asthma. N Engl J Med 1990;323:1033-9.
16. British Thoracic Society, et al. Guidelines on the managment of asthma. Thorax 1993;48:1-24.
.
Лечение бронхиальной астмы
Лечение бронхиальной астмы является комплексным, оно включает медикаментозное и немедикаментозное лечение при соблюдении противоаллергического режима.
Все
лекарственные препараты подразделяются
на два вида: препараты для купирования
острых состояний и препараты базисной
терапии. При лечении астмы
в настоящее время применяют «ступенчатый»
подход, при
котором интенсивность
терапии увеличивается по мере увеличения
степени тяжести астмы. Количество
и частота приема лекарства увеличиваются
(ступень вверх) при ухудшении
течения астмы и уменьшается (ступень
вниз), если
течение астмы хорошо
контролируется.
При лечении астмы
в настоящее время применяют «ступенчатый»
подход, при
котором интенсивность
терапии увеличивается по мере увеличения
степени тяжести астмы. Количество
и частота приема лекарства увеличиваются
(ступень вверх) при ухудшении
течения астмы и уменьшается (ступень
вниз), если
течение астмы хорошо
контролируется.
5
Контроль считается неудовлетворительным, если у больного:
эпизоды кашля, свистящего или затрудненного дыхания возникают более 3 раз в неделю;
симптомы появляются ночью или в ранние утренние часы;
увеличилась потребность в использовании бронходилататоров короткого дей ствия;
увеличился разброс показателей PEF.
Ступень
вниз. Снижение
поддерживающей терапии возможно, если
астма
остается под контролем не менее 3 месяцев.
Уменьшать терапию следует ступенчато,
понижая и отменяя последнюю дозу или
дополнительные препараты.
Следует учитывать, что наименьшая тяжесть течения астмы представлена в ступени 1, а наибольшая — в ступени 4, 5.
Ступень 1. Больные с интермиттирующим течением астмы.
Длительная терапия противовоспалительными препаратами из группы ГКС, как правило, не показана этим больным. Лечение включает профилактический прием в2-агонистов короткого действия перед физической нагрузкой или при необходимости. Как альтернатива ингаляционных в2- агонистов короткого действия могут быть использованы антихолинэргические препараты (атровент), пероральные в2-агонисты короткого действия или теофиллины короткого действия. Для противовоспалительной терапии иногда целесообразно применение кромогликата, недокромила. Интенсивность лечения зависит от тяжести обострения: пероральные стероиды могут быть востребованы даже и на этой ступени.
Ступень 2. Больные с легким персистирующим течением астмы.
Данная
группа больных нуждается в ежедневном
длительном профилактическом
приеме лекарств. Базисная
терапия:
ежедневный прием противовоспалительных
препаратов (кромоны или ИГКС в дозе от 200 до 800 мкг) в сочетании с аэрозольными
симпатомиметиками (сальбутамол, беротек). Для контролирования
ночной симптоматики целесообразно
назначение пролонгированных
в2-агонистов (сальматерол, формотерол). Данная ступень
лечения больных астмой
наиболее удобна для применения
комбинированных препаратов: серетид,
симбикорт, биастен. Симптоматическая
терапия: симпатомиметики
короткого действия при необходимости. Если контроля астмы
не удается достичь, то следует начать
лечение ступени 3.
Базисная
терапия:
ежедневный прием противовоспалительных
препаратов (кромоны или ИГКС в дозе от 200 до 800 мкг) в сочетании с аэрозольными
симпатомиметиками (сальбутамол, беротек). Для контролирования
ночной симптоматики целесообразно
назначение пролонгированных
в2-агонистов (сальматерол, формотерол). Данная ступень
лечения больных астмой
наиболее удобна для применения
комбинированных препаратов: серетид,
симбикорт, биастен. Симптоматическая
терапия: симпатомиметики
короткого действия при необходимости. Если контроля астмы
не удается достичь, то следует начать
лечение ступени 3.
Ступень 3. Больные со средней тяжестью течения астмы.
Требуется
ежедневный прием профилактических
противовоспалительных препаратов.
Базисная терапия: высокие дозы ИГКС (800-2000 мкг) в сочетании с в2-агонистами
короткого или длительного
действия.
Симптоматическая терапия:
симпатомиметики короткого действия по
потребности.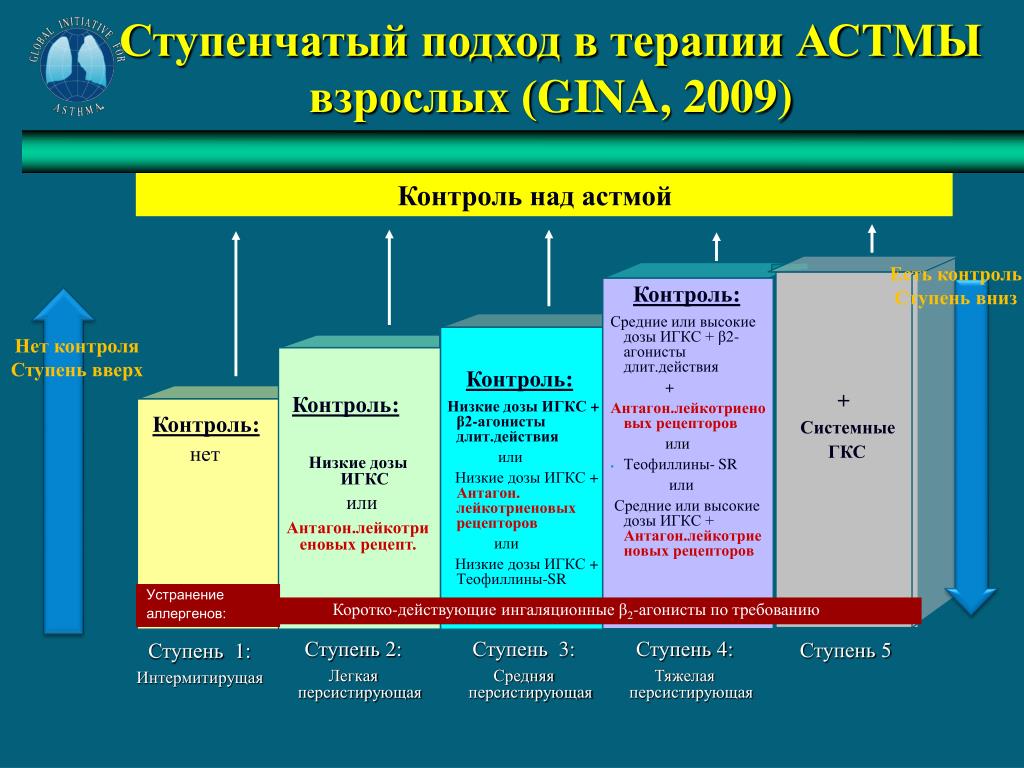 Рекомендуется использовать
ингалятор со спейсером.
Рекомендуется использовать
ингалятор со спейсером.
Возможно применение теофиллинов пролонгированного действия. При более тяжелых обострениях следует проводить курс пероральных кортикостероидов.
Бронхиальная астма. Лечение
Каким образом лечится атопическая бронхиальная астма, что такое базисная терапия и терапия по потребности, рассказывает врач-иммунолог Анна Николаевна Косова.
Здравствуйте. Меня зовут Косова Анна Николаевна, я врач педиатр, аллерголог-иммунолог клиники «Скандинавия». Сейчас мы будем говорить о лечении бронхиальной астмы. Лечение состоит из двух основных компонентов. Это базисная терапия, постоянная, которую получает пациент. И терапия по потребности для снятия приступов бронхиальной астмы. Лечением пациентов с атопической бронхиальной астмой занимается врач-аллерголог. Есть иные виды астмы, которые связаны с хронической обструктивной болезнью легких, то есть, не атопического генеза, не аллергического генеза. В такой ситуации, такими пациентами занимается пульмонолог.
Есть иные виды астмы, которые связаны с хронической обструктивной болезнью легких, то есть, не атопического генеза, не аллергического генеза. В такой ситуации, такими пациентами занимается пульмонолог.
Я буду говорить про атопическую бронхиальную астму. На данный момент это заболевание хроническое, то есть, лечение предполагается постоянное. Только в некоторых случаях, когда самый легкий вариант бронхиальной астмы, ее называют интермиттирующая, от приступа к приступу, а они бывают довольно редко, можно использовать препараты по потребности без базиса. Во всех остальных случаях применяется базисная терапия, которую пациент применяет ежедневно практически всю свою жизнь.
Базисная терапия это ингаляционные гормональные препараты глюкокортикостероиды. На данный момент это единственные препараты, которые могут сдерживать и снимать хроническое обострение. Применять их необходимо, так как в противном случае обострение придет к ремоделированию бронхов и переформированию нормальной ткани бронхиол, альвеол в соединительную ткань и развитию осложнений, таких как эмфизема легких и уменьшение поверхности дыхательной легочной ткани. Современные гормональные препараты совершенно безопасны для длительного применения. Мы не имеем таких серьезных страшных побочных эффектов от стероидов, какие были 30-40 лет назад при лечении бронхиальной астмы.
Современные гормональные препараты совершенно безопасны для длительного применения. Мы не имеем таких серьезных страшных побочных эффектов от стероидов, какие были 30-40 лет назад при лечении бронхиальной астмы.
На данный момент современное руководство рекомендует именно гормоны для базисной терапии. Дозировку и кратность приема подбирает врач-аллерголог. Для удобства подбора дозы, для правильного контроля бронхиальной астмы рекомендовано вести дневник пикфлоуметрии. Можно вести его не постоянно, но на период подбора дозы и в периоды обострений это делать необходимо. Есть периоды в жизни ребенка, сопровождающиеся взрослением, гормональной перестройкой, если переносит ОРВИ, если начинают цвести причинно-значимые растения, когда надо усиливать базисную терапию. В этом случае помогает пикфлоуметрия для контроля этого базиса.
Помимо базисной терапии могут существовать и вспомогательные препараты, которые доктор также может назначить. Например, антилейкотриеновые препараты.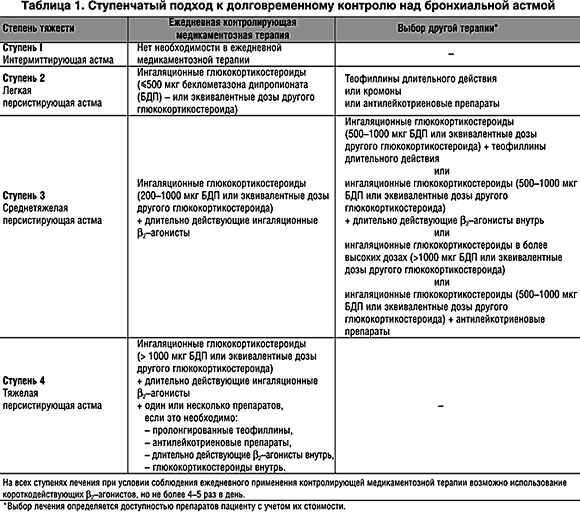 Не для всех пациентов они подходят, но в некоторых ситуациях, когда есть смешанный вариант бронхиальной астмы, реакция на физическую нагрузку, на некоторые медикаменты и холодный воздух, они достаточно хорошо могут помогать. Препараты скорой помощи. Если все-таки, не смотря на базисную терапию, обострение случилось, они могут использоваться по потребности и также выводить пациента обратно в хорошую стойкую ремиссию. Базис и препараты экстренной помощи. Помимо этого надо помнить, что без удаления аллергена, сколько бы мы базиса не давали, мы все равно будем провоцировать возникновение бронхоспазма. Поэтому даже для того, чтобы можно было легче выйти в стабильное состояние и уменьшить дозировку базисных препаратов, необходимо поддержание гипоаллергенного быта. Для этого, конечно, надо выявить причинно-значимый аллерген. Не существует гипоаллергенных домашних животных, ни собак, ни кошечек. Всегда у них есть аллергены, даже если нет шерсти у животного. Очень много аллергенов может содержаться в слюне и в выделениях собаки или кошки.
Не для всех пациентов они подходят, но в некоторых ситуациях, когда есть смешанный вариант бронхиальной астмы, реакция на физическую нагрузку, на некоторые медикаменты и холодный воздух, они достаточно хорошо могут помогать. Препараты скорой помощи. Если все-таки, не смотря на базисную терапию, обострение случилось, они могут использоваться по потребности и также выводить пациента обратно в хорошую стойкую ремиссию. Базис и препараты экстренной помощи. Помимо этого надо помнить, что без удаления аллергена, сколько бы мы базиса не давали, мы все равно будем провоцировать возникновение бронхоспазма. Поэтому даже для того, чтобы можно было легче выйти в стабильное состояние и уменьшить дозировку базисных препаратов, необходимо поддержание гипоаллергенного быта. Для этого, конечно, надо выявить причинно-значимый аллерген. Не существует гипоаллергенных домашних животных, ни собак, ни кошечек. Всегда у них есть аллергены, даже если нет шерсти у животного. Очень много аллергенов может содержаться в слюне и в выделениях собаки или кошки.
Отдельно надо поговорить об аллерген-специфической иммунотерапии АСИТ. Если аллерген выявлен и действительно есть на него реакция, что подтверждено лабораторно и кожными пробами, и у пациента имеется бронхиальная астма средней или даже тяжелой степени тяжести, мы можем проводить АСИТ – аллерген-специфическую иммунотерапию. Терапия достаточно длительная. Оптимальные сроки, как установлено многочисленными исследованиями, составляют около 4х лет, но это позволит достичь стойкой хорошей ремиссии в среднем на 7- 8 лет. Что это значит? Это не значит, что человек совсем откажется от базисных препаратов. Возможно, он существенно снизит дозировку гормонов, что очень важно, либо даже перейдет в режим интерметирующей бронхиальной астмы, то есть, приема препаратов исключительно по потребности. Но, повторю, что полного излечения на всю жизнь, к сожалению, на данный момент пока не существует. Помимо аллерген-специфической иммунотерапии есть еще терапия против иммуноглобулинов класса Е. Это препарат Ксалар омализумаб против вот этих самых иммуноглобулинов. Применяться может при бронхиальной астме средней и тяжелой степени тяжести в комплексе с базисной терапией. Из новых методов дополнительной терапии бронхиальной астмы средней степени тяжести и тяжелой, используются препараты против иммуноглобулинов класса E – именно иммуноглобулинов, провоцирующих аллергические реакции. Эта терапия
Это препарат Ксалар омализумаб против вот этих самых иммуноглобулинов. Применяться может при бронхиальной астме средней и тяжелой степени тяжести в комплексе с базисной терапией. Из новых методов дополнительной терапии бронхиальной астмы средней степени тяжести и тяжелой, используются препараты против иммуноглобулинов класса E – именно иммуноглобулинов, провоцирующих аллергические реакции. Эта терапия
должна подбираться врачом, как и любая другая базисная терапия.
Пиклоуметр – это прибор, который мы используем для контроля терапии бронхиальной астмы и можем его использовать для диагностики бронхиальной астмы у детей моложе 5 лет. Что это такое? Здесь есть шкала и бегунок, мундштук, на него одевается переходник, который можно снять и помыть. Это прибор индивидуального использования, он действует чисто механически. Мундштук пациент плотно охватывает губами, делает глубокий вдох и резкий короткий выдох. Бегунок, соответственно, идет вверх и останавливается на отметке, которая будет означать пиковую скорость выдоха количества литров в минуту – единица измерения. Есть нормы пиковой скорости выдоха, которые зависят от роста пациента. По таблице мы смотрим среднее значение, которое должно быть у пациента данного роста. Мы высчитываем диапазон минимально возможных значений. Если пациент укладывается, считается, что он находится в благоприятной зоне – так называемый зеленый коридор. Если пиковая скорость выдоха менее 80% от должной, но более 60% – это уже желтая зона, когда надо насторожиться. Менее 60% от должного – это уже красная зона, когда надо срочно обращаться к врачу. Уже в желтой зоне надо корректировать терапию. У пациентов с бронхиальной астмой средние показатели пиковой скорости выдоха могут отличаться от таковых у здоровых людей, то есть, могут быть индивидуальны и несколько ниже, чем рекомендуется согласно росту. Это все выясняется со временем, когда доктор наблюдает пациента
Есть нормы пиковой скорости выдоха, которые зависят от роста пациента. По таблице мы смотрим среднее значение, которое должно быть у пациента данного роста. Мы высчитываем диапазон минимально возможных значений. Если пациент укладывается, считается, что он находится в благоприятной зоне – так называемый зеленый коридор. Если пиковая скорость выдоха менее 80% от должной, но более 60% – это уже желтая зона, когда надо насторожиться. Менее 60% от должного – это уже красная зона, когда надо срочно обращаться к врачу. Уже в желтой зоне надо корректировать терапию. У пациентов с бронхиальной астмой средние показатели пиковой скорости выдоха могут отличаться от таковых у здоровых людей, то есть, могут быть индивидуальны и несколько ниже, чем рекомендуется согласно росту. Это все выясняется со временем, когда доктор наблюдает пациента
и подбирает ему терапию. Такой прибор желательно чтобы пациент с бронхиальной астмой имел.
Дата публикации: 22.11.16
Принципы подбора базисной терапии бронхиальной астмы Текст научной статьи по специальности «Клиническая медицина»
J
Принципы подбора базисной терапии бронхиальной астмы
Н.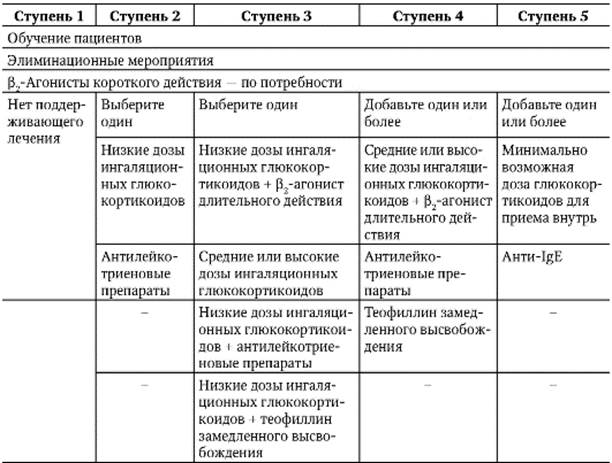 П. Княжеская
П. Княжеская
В современном обществе бронхиальная астма (БА) относится к числу наиболее распространенных заболеваний. Основной задачей лечения БА является достижение контроля над заболеванием, т.е. у пациента отсутствуют или минимально выражены симптомы болезни, больной не ограничен в повседневной деятельности, у него отсутствует (или минимальна) потребность в препаратах неотложной помощи, а частота обострений крайне низкая. Таким образом, достижение контроля над БА означает устранение проявлений заболевания с помощью адекватной и рациональной медикаментозной терапии. Высокий противовоспалительный эффект совместного использования ингаляционных глюко-кортикостероидов (ИГКС) и длительнодействующих в2-агонистов (ДДБА) служит аргументом в пользу применения такого терапевтического подхода. Бронхиальная астма -2 заболевание, которое сопровождается воспалением слизистой бронхов, ее отеком, экссудацией плазмы (повышением сосудистой проницаемости), гипертрофией гладкомышечных клеток и десквамацией эпителия.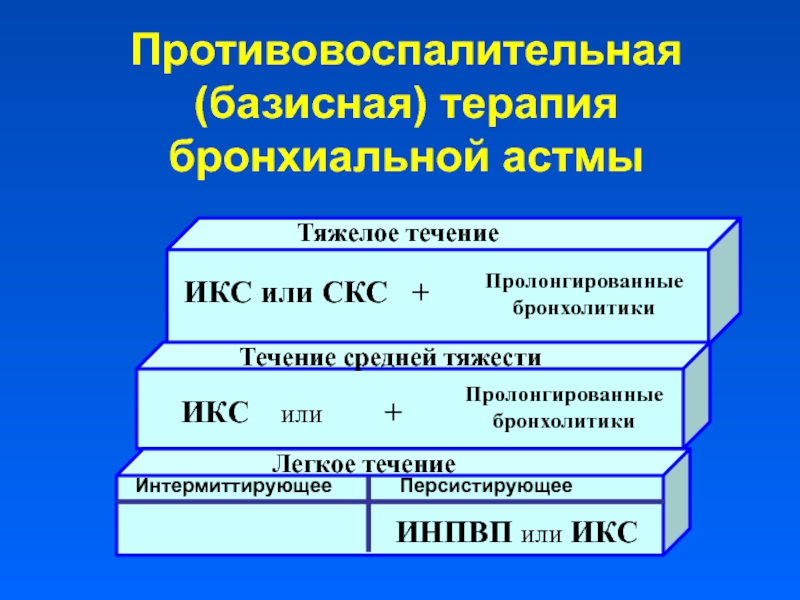 В исследовании GOAL (Gaining Optimal Asthma controL), результаты которого легли в основу стратегии контроля БА, представленной в GINA 2006 (The Global Initiative for Asthma), были продемонстрированы преимущества комбинированной терапии ИГКС и ДДБА при тяжелой и среднетяжелой БА. Первым препаратом с фиксированной комбинацией является Серетид, который широко и успешно применяется для достижения контроля над БА. Количественная оценка контроля осуществляется с помощью опросников, в том числе АСТ (Asthma Control Test).
В исследовании GOAL (Gaining Optimal Asthma controL), результаты которого легли в основу стратегии контроля БА, представленной в GINA 2006 (The Global Initiative for Asthma), были продемонстрированы преимущества комбинированной терапии ИГКС и ДДБА при тяжелой и среднетяжелой БА. Первым препаратом с фиксированной комбинацией является Серетид, который широко и успешно применяется для достижения контроля над БА. Количественная оценка контроля осуществляется с помощью опросников, в том числе АСТ (Asthma Control Test).
Ключевые слова: бронхиальная астма, базисная терапия, ингаляционные глюкокортикостероиды, комбинированные препараты, Серетид, АСТ.
Введение
В последние два десятилетия отмечается значительный прогресс в лечении бронхиальной астмы (БА). Это связано с пониманием данной патологии как хронического воспалительного заболевания дыхательных путей, требующего применения противовоспалительных противоастматиче-ских препаратов, прежде всего содержащих ингаляционные глюкокортикостероиды (ИГКС).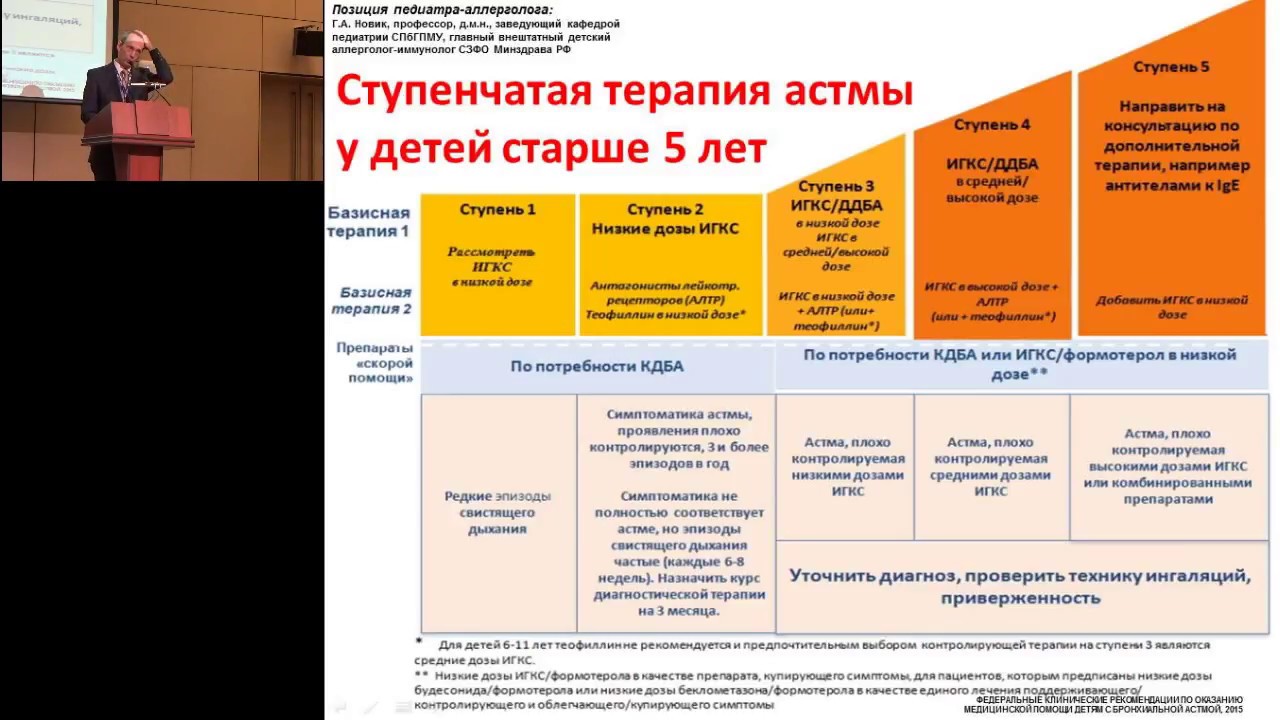 Однако, несмотря на достигнутые успехи, проблему БА нельзя считать решенной.
Однако, несмотря на достигнутые успехи, проблему БА нельзя считать решенной.
Основные принципы терапии БА
Основной задачей терапии БА является установление длительного контроля над заболеванием, а не просто устранение его симптомов. Рекомендации по лечению включают четыре основных аспекта:
1) использование показателей функции внешнего дыхания для объективной оценки степени тяжести течения заболевания и мониторирования ответа на терапию;
2) идентификация и элиминация факторов, усугубляющих симптомы, провоцирующих обострение и поддерживающих воспаление дыхательных путей;
3) адекватное фармакологическое лечение для устранения бронхоконстрикции и предотвращения и устранения воспаления дыхательных путей;
4) достижение партнерских отношений между пациентом и врачом.
Хотя метод излечения БА еще не найден, у большинства больных можно и нужно достигать контроля над заболеванием и поддерживать его. Как же определить контроль БА?
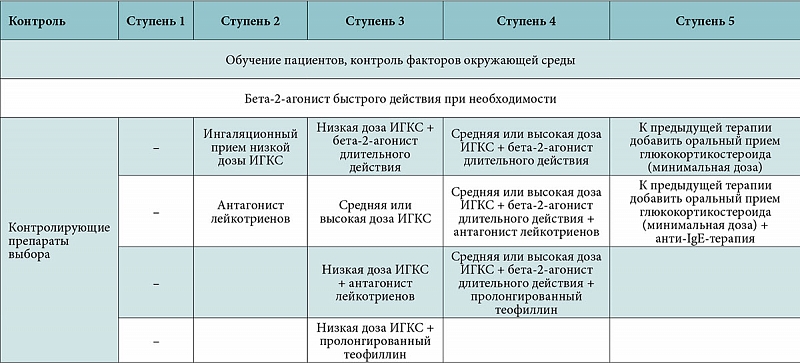
Критерии адекватности терапии БА
Исполнительный комитет GINA (The Global Initiative for Asthma) в 2006 г. рекомендовал применять более рациональный подход к лечению БА, основанный на уровне ее контроля, а не на степени тяжести [1]. Исходя из этих рекомендаций, основной задачей лечения БА является до-
Надежда Павловна Княжеская — доцент кафедры пульмонологии ФУВ Российского национального исследовательского медицинского университета им. Н.И. Пирого-ва, Москва.
стижение и поддержание контроля над заболеванием, что заключается в следующем: у пациента отсутствуют или минимально выражены симптомы болезни, нет ограничений в повседневной жизнедеятельности, отсутствует (или минимальна) потребность в препаратах неотложной помощи и частота обострений крайне низкая (табл. 1).
1).
В GINA 2009 и последующих ее вариантах рекомендован подход к достижению контроля с оценкой текущего и последующего снижения риска обострений, нестабильного течения заболевания, быстрого снижения функции легких, побочных эффектов (табл. 2) [2].
Увеличивают риск возникновения нежелательных явлений в будущем следующие факторы: плохой контроль клинических симптомов, частые обострения в течение предыдущего года, любое лечение больного БА в отделении неотложной помощи, низкий объем форсированного выдоха за 1-ю секунду.
Можно ли облегчить врачу оценку контроля БА в реальной практике? Следует помнить, что для многих хронических заболеваний, цели лечения которых определены, используются различные параметры достижения этих целей. Так, например, целью лечения артериальной гипертензии является достижение и поддержание артериального давления на уровне 140/90 мм рт. ст. или ниже, при атеросклерозе — это достижение уровня триглицеридов 5,0 ммоль/л и ниже, при сахарном диабете — достижение уровня гликемии 5,6 ммоль/л и т.п. В приведенных примерах цель лечения и оценка эффективности терапии конкретны и однозначны. Но для оценки контроля бА подобного четкого критерия не имеется, поэтому в ее осуществлении помогают опросники, которые позволяют проводить количественную оценку контроля БА; из принятых в России к ним относятся ACQ-5 (Asthma Control Questionnaire) и АСТ (Asthma Control Test). Asthma Control Test — тест по контролю над БА — состоит из 5 вопросов, ответы на которые представлены в виде пятибалльной оценочной шкалы. Результатом теста является сумма баллов по ответам: так, оценка в 25 баллов соответствует полному контролю, оценка в 20-24 балла — хорошему контролю, сумма баллов менее 20 свидетельствует о неконтролируемом течении заболевания, что требует вмешательства врача для со-
ст. или ниже, при атеросклерозе — это достижение уровня триглицеридов 5,0 ммоль/л и ниже, при сахарном диабете — достижение уровня гликемии 5,6 ммоль/л и т.п. В приведенных примерах цель лечения и оценка эффективности терапии конкретны и однозначны. Но для оценки контроля бА подобного четкого критерия не имеется, поэтому в ее осуществлении помогают опросники, которые позволяют проводить количественную оценку контроля БА; из принятых в России к ним относятся ACQ-5 (Asthma Control Questionnaire) и АСТ (Asthma Control Test). Asthma Control Test — тест по контролю над БА — состоит из 5 вопросов, ответы на которые представлены в виде пятибалльной оценочной шкалы. Результатом теста является сумма баллов по ответам: так, оценка в 25 баллов соответствует полному контролю, оценка в 20-24 балла — хорошему контролю, сумма баллов менее 20 свидетельствует о неконтролируемом течении заболевания, что требует вмешательства врача для со-
Л
Таблица 1. А 2006 [1]
А 2006 [1]
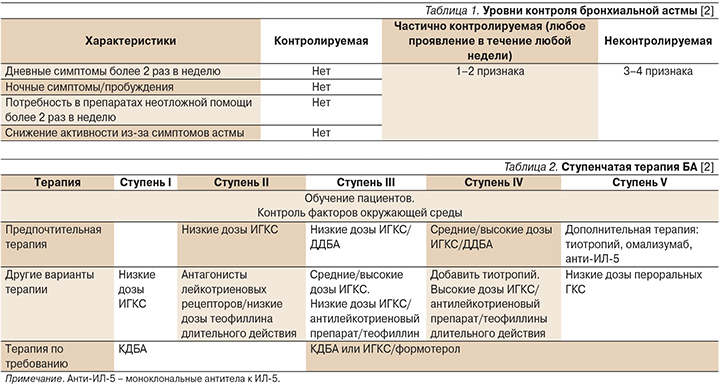
Характеристика я Хорошо контролируемая БА Частично контролируемая БА Неконтролируемая БА
Дневные симптомы Нет (2 раза и менее в неделю) Чаще 2 раз в неделю Три или более признака частично контролируемой БА еженедельно
Ограничение активности Нет Незначительное
Ночные симптомы/пробуждения Нет Незначительные
Потребность в ситуационных препаратах Нет (2 раза и менее в неделю) Чаще 2 раз в неделю
Функция дыхания (ПСВ или ОФВ1) Нормальная <80% от должного или лучшего значения,если оно известно
Обострения Нет Одно или более в год Еженедельно
Обозначения здесь и в табл. А 2009 [2]
А 2009 [2]
А. Оценка текущего уровня контроля (предпочтительно проводить в течение 4 нед)
Характеристика Я Контролируемая БА (всё нижеперечисленное) Частично контролируемая БА (любое проявление в течение любой недели) Неконтролируемая БА
Дневные симптомы Отсутствуют (или <2 эпизодов в неделю) >2 эпизодов в неделю Наличие трех или более признаков частично контролируемой БА в течение любой недели
Ограничения активности Отсутствуют Любые
Ночные симптомы/пробуждения Отсутствуют Любые
Потребность в препаратах неотложной помощи Отсутствует (или <2 эпизодов в неделю) >2 эпизодов в неделю
Функция легких (ПСВ или ОФВ1) Нормальная <80% от должного значения или от наилучшего для данного пациента показателя (если таковой известен)
Б. Оценка последующего риска (риск обострений, нестабильного течения заболевания, быстрого снижения функции легких, побочных эффектов)
Оценка последующего риска (риск обострений, нестабильного течения заболевания, быстрого снижения функции легких, побочных эффектов)
Показатели, связанные с увеличением риска возникновения нежелательных явлений в будущем, включают:
плохой контроль клинических симптомов, частые обострения в течение предыдущего года, любое лечение БА в отделении
неотложной помощи, низкий уровень ОФВ1, воздействие сигаретного дыма, высокие дозы принимаемой терапии
ставления или пересмотра плана лечения, направленного на достижение хорошего контроля над заболеванием.
Опросник соответствует совокупности целей лечения БА и коррелирует с указанными выше критериями GINA по контролю БА. Использование опросников, в том числе АСТ, является простым и удобным для применения в амбулаторных и стационарных условиях, а также достаточно чувствительным к изменению состояния больного методом. Тест позволяет не только провести количественную оценку контроля, но и клинически интерпретировать симптомы заболевания. Для заполнения опросника не требуется специальных знаний, поэтому с ним легко работать не только врачам, но и пациентам.
Тест позволяет не только провести количественную оценку контроля, но и клинически интерпретировать симптомы заболевания. Для заполнения опросника не требуется специальных знаний, поэтому с ним легко работать не только врачам, но и пациентам.
Несмотря на современные возможности базисной терапии БА, результаты проведенных в Европе масштабных эпидемиологических исследований свидетельствуют о необъективном восприятии самими пациентами своего состояния и, как следствие, низком уровне контроля БА. В связи с этим очень важно, чтобы больной был максимально полно проинформирован о своем заболевании и мог оценить уровень контроля, что возможно с помощью описанного выше специально разработанного опросника АСТ [3-6]. Определение уровня контроля БА в реальных условиях (в том чис-
ле амбулаторно-поликлинических) затруднительно в силу ряда причин, таких как дефицит времени, отсутствие специализированной дорогостоящей аппаратуры и т. п. Однако, используя опросники, врач, в том числе первичного звена, может дать достаточно полную оценку состояния больного БА, оценить эффективность лечения на текущий момент и в динамике. Кроме того, пациент сам активно участвует в контроле своего заболевания и, следовательно, начинает понимать цель лечения БА. С помощью АСТ возможно:
п. Однако, используя опросники, врач, в том числе первичного звена, может дать достаточно полную оценку состояния больного БА, оценить эффективность лечения на текущий момент и в динамике. Кроме того, пациент сам активно участвует в контроле своего заболевания и, следовательно, начинает понимать цель лечения БА. С помощью АСТ возможно:
• проводить скрининг пациентов и выявлять больных с неконтролируемой БА;
• вносить изменения в лечение для достижения лучшего контроля;
• повышать эффективность внедрения клинических рекомендаций по лечению БА;
• выявлять факторы риска неконтролируемой БА;
• оценивать уровень контроля над бА (как клиницистам, так и пациентам) [7]. Опросник АСТ рекомендован к применению основным международным руководством по диагностике и лечению БА — GlNA [1]. В России АСТ одобрен Российским респираторным обществом, Союзом педиатров России и Российской ассоциацией аллергологов и клинических иммунологов.
В России АСТ одобрен Российским респираторным обществом, Союзом педиатров России и Российской ассоциацией аллергологов и клинических иммунологов.
с
Одна из важных задач контроля — отсутствие обострений БА. Поэтому в амбулаторных условиях при обострении заболевания необходимо оценить уровень контроля, так как обострение является важнейшим признаком его утраты. Кроме того, чрезвычайно важно проводить оценку контроля с помощью тестов в амбулаторных условиях, когда пациент ведет привычный образ жизни (работает, учится). Достижение контроля над бА означает устранение проявлений заболевания с помощью адекватной и рациональной медикаментозной терапии, направленной на подавление воспаления в бронхиальном дереве.
Фармакотерапия БА
Фармакотерапия БА проводится с использованием двух классов препаратов — быстродействующих, которые устраняют симптомы острой бронхоконстрикции, и препаратов для длительного контроля заболевания (базисных), которые при регулярном применении улучшают контроль БА в целом. Даже при очень хорошем контроле БА не существует гарантий полного отсутствия симптомов и обострений. Контакт с аллергеном, в том числе неожиданный, пребывание в накуренном помещении и другие подобные ситуации могут вызывать затруднение дыхания, появление кашля и внезапное развитие приступа удушья. Это может случиться в любом месте и в любое время, а значит, необходимо иметь при себе средство для неотложной помощи и, конечно, уметь его применять.
Даже при очень хорошем контроле БА не существует гарантий полного отсутствия симптомов и обострений. Контакт с аллергеном, в том числе неожиданный, пребывание в накуренном помещении и другие подобные ситуации могут вызывать затруднение дыхания, появление кашля и внезапное развитие приступа удушья. Это может случиться в любом месте и в любое время, а значит, необходимо иметь при себе средство для неотложной помощи и, конечно, уметь его применять.
Для купирования симптомов БА ингаляции можно проводить различными способами, но наиболее распространенным является применение дозированного аэрозольного ингалятора. Обычно при его использовании пациент делает 1-2 вдоха с промежутком в 1-2 мин. Какой ингалятор наиболее эффективен и безопасен? Медицинские руководства единодушны в том, что препаратами первой линии для купирования приступа БА являются селективные Р2-агонисты с быстрым началом действия, оказывающие м2ощный бронхорасширяющий эффект, но мало влияющие на работу сердца (в сердечно-сосудистой системе преобладают Р1-адренорецепторы). При этом предпочтение отдается препаратам сальбутамола (Вентолин и др.), селективность которых максимальна [8-10].
При этом предпочтение отдается препаратам сальбутамола (Вентолин и др.), селективность которых максимальна [8-10].
Основными противовоспалительными препаратами для лечения БА являются ИГКС. В хорошо контролируемых исследованиях, проведенных с учетом требований доказательной медицины, была продемонстрирована их эффективность в плане улучшения функции дыхания, снижения гиперреактивности дыхательных путей, уменьшения выраженности симптомов, снижения частоты и тяжести обострений (уровень доказательности А) [11-14].
Противовоспалительный эффект ИГКс связан с их ингибирующим действием на клетки воспаления и их медиаторы, включая продукцию цитокинов, вмешательство в метаболизм арахидоновой кислоты и синтез лейко-триенов и простагландинов, снижение проницаемости на уровне микроциркуляторного русла, предотвращение прямой миграции и активации клеток воспаления, повышение чувствительности Р-рецепторов гладкой мускулатуры. Ингаляционные глюкокортикостероиды увеличивают синтез противовоспалительных белков (липо-кортина-1), повышают апоптоз и снижают количество эозинофилов путем ингибирования интерлейкина-5. Таким образом, ИГКС приводят к стабилизации клеточных мембран, уменьшают проницаемость сосудов, улучшают функцию Р-рецепторов (как путем синтеза новых Р-рецепторов, так и путем повышения их чувствительности к медикаментозному воздействию), стимулируют эпителиальные клетки [15].
Ингаляционные глюкокортикостероиды увеличивают синтез противовоспалительных белков (липо-кортина-1), повышают апоптоз и снижают количество эозинофилов путем ингибирования интерлейкина-5. Таким образом, ИГКС приводят к стабилизации клеточных мембран, уменьшают проницаемость сосудов, улучшают функцию Р-рецепторов (как путем синтеза новых Р-рецепторов, так и путем повышения их чувствительности к медикаментозному воздействию), стимулируют эпителиальные клетки [15].
Флутиказона пропионат (ФП) — один из самых высокоактивных противовоспалительных препаратов на сегодняшний день. Препарат имеет низкую системную биодоступность (-1%), а его абсолютная биодоступность составляет 10-30% в зависимости от типа ингалятора. Флутиказон обладает высоким сродством к глюкокорти-коидным рецепторам и имеет длительную связь с рецептором. Для предотвращения осиплости голоса и развития кандидоза при приеме ФП следует соблюдать те же правила, что и при приеме других ИГКС, т. е. полоскать рот и горло водой после ингаляции. В связи с высоким противовоспалительным действием ФП также показан больным с тяжелым течением БА и зависимостью от системных глю-кокортикостероидов [16].
е. полоскать рот и горло водой после ингаляции. В связи с высоким противовоспалительным действием ФП также показан больным с тяжелым течением БА и зависимостью от системных глю-кокортикостероидов [16].
Исследования 1980-х годов показали, что у пациентов, регулярно принимавших ßj-агонисты короткого действия перед приемом ИГКС, отмечалась значительно большая клиническая эффективность терапии, нежели у тех пациентов, которые использовали эти препараты только по потребности (on demand). Это обусловило необходимость создания класса селективных длительнодействующих ßj-агонистов (ДДБА). Указанные препараты представлены ингаляционными салметеролом и формотеролом, которые в комбинации с ИГКС являются основой базисной терапии БА, а в сочетании с ИГКС и бронхолитиками других классов — основой базисной терапии хронической обструк-тивной болезни легких. Включение ингаляционных ДДБА (салметерола и формотерола) в схему лечения больных, у которых БА не удается полностью контролировать с помощью различных доз ИГКС, позволяет достичь лучшего контроля над заболеванием, чем просто увеличение дозы ИГКС в 2 раза и более (уровень доказательности А). Таким образом, комбинация ИГКС + ДДБА в настоящее время является основой терапии БА у взрослых со среднетяже-лым и тяжелым течением и у детей с тяжелым течением заболевания. Данные классы препаратов (ИГКС и ДДБА) следует рассматривать как синергисты, что обусловлено их комплементарным воздействием на молекулярном и рецепторном уровнях. Важно отметить, что противовоспалительные эффекты ДДБА не могут играть определяющей роли у больных БА, так как снижение чувствительности ß2-адренорецепторов (десенситизация) и down-регуляция (у2меньшение количества рецепторов) в клетках воспаления возникают быстрее, чем в миоцитах бронхов. Поэтому при систематическом приеме стимуляторов ß2-адре-норецепторов толерантность к их противовоспалите2льным эффектам развивается достаточно быстро. Однако благодаря тому, что ИГКС способны увеличивать число и улучшать функцию ß2-адренорецепторов, снижая их десенси-тизацию и down-регуляцию, при совместном назначении ИГКС и ß2-агонистов противовоспалительная активность ДДБА может проявляться клинически [17-21].
Таким образом, комбинация ИГКС + ДДБА в настоящее время является основой терапии БА у взрослых со среднетяже-лым и тяжелым течением и у детей с тяжелым течением заболевания. Данные классы препаратов (ИГКС и ДДБА) следует рассматривать как синергисты, что обусловлено их комплементарным воздействием на молекулярном и рецепторном уровнях. Важно отметить, что противовоспалительные эффекты ДДБА не могут играть определяющей роли у больных БА, так как снижение чувствительности ß2-адренорецепторов (десенситизация) и down-регуляция (у2меньшение количества рецепторов) в клетках воспаления возникают быстрее, чем в миоцитах бронхов. Поэтому при систематическом приеме стимуляторов ß2-адре-норецепторов толерантность к их противовоспалите2льным эффектам развивается достаточно быстро. Однако благодаря тому, что ИГКС способны увеличивать число и улучшать функцию ß2-адренорецепторов, снижая их десенси-тизацию и down-регуляцию, при совместном назначении ИГКС и ß2-агонистов противовоспалительная активность ДДБА может проявляться клинически [17-21].
Салметерола ксинафоат (САЛ) относится к ингаляционным ДДБА. В клинических исследованиях было выявлено, что данный класс препаратов оказывает стабилизирующее влияние на тучные клетки, ингибирует IgE-опосредованное высвобождение ими гистамина, что приводит к уменьшению системной и местной концентрации гистамина [22]. Салметерол назначается только в качестве препарата для базисной терапии и не применяется по потребности. Следует использовать только рекомендованные дозы, а для купирования симптомов применять ß2-агонисты короткого действия. Необходимо отметить, что САЛ обладает и рядом неожиданных свойств, в частности, этот препарат вызывает снижение патогенности P. aeruginosa и оказывает протективный эффект в отношении H. influenzae в культурах эпителия респираторного тракта [23-25].
Серетид — комбинация ФП и САЛ. В исследовании S. Kirby et al. было установлено, что при использовании комбинации САЛ и ФП у здоровых людей не наблюдается каких-либо системных фармакодинамических или фар-макокинетических взаимодействий [26]. В исследовании GOAL (Gaining Optimal Asthma controL), результаты которого легли в основу стратегии контроля БА, представленной в GINA 2006, были продемонстрированы преимущества комбинированной терапии ИГКС + ДДБА при среднетяжелой и тяжелой БА [27]. Результаты исследования GOAL имеют важное практическое значение, так как в нем сформулированы критерии эффективности лечения БА. В этом исследовании у 71% больных БА, получавших фиксированную комбинацию САЛ/ФП (Серетид), был достигнут хороший контроль над заболеванием (согласно критериям GlNA) через 12 мес лечения. Не менее важно то, что в группе, получавшей в качестве базисной терапии фиксированную комбинацию, пациентов, у которых был достигнут полный контроль БА, было достоверно больше, чем в группе монотерапии ФП. Благодаря исследованию GOAL был сделан важный вывод о том, что улучшить результаты лечения можно, повысив требования к целям лечения, что, в свою очередь, потребует выбора наиболее эффективной базисной терапии.
В исследовании GOAL (Gaining Optimal Asthma controL), результаты которого легли в основу стратегии контроля БА, представленной в GINA 2006, были продемонстрированы преимущества комбинированной терапии ИГКС + ДДБА при среднетяжелой и тяжелой БА [27]. Результаты исследования GOAL имеют важное практическое значение, так как в нем сформулированы критерии эффективности лечения БА. В этом исследовании у 71% больных БА, получавших фиксированную комбинацию САЛ/ФП (Серетид), был достигнут хороший контроль над заболеванием (согласно критериям GlNA) через 12 мес лечения. Не менее важно то, что в группе, получавшей в качестве базисной терапии фиксированную комбинацию, пациентов, у которых был достигнут полный контроль БА, было достоверно больше, чем в группе монотерапии ФП. Благодаря исследованию GOAL был сделан важный вывод о том, что улучшить результаты лечения можно, повысив требования к целям лечения, что, в свою очередь, потребует выбора наиболее эффективной базисной терапии.
В относительно недавнем исследовании N. C. Barnes et al. у пациентов с персистирующей БА стартовая терапия САЛ/ФП по сравнению с ФП обеспечивала более быстрое достижение контроля [28]:
C. Barnes et al. у пациентов с персистирующей БА стартовая терапия САЛ/ФП по сравнению с ФП обеспечивала более быстрое достижение контроля [28]:
• в 1,65 раза более вероятное достижение хорошо контролируемой БА у пациентов с двумя признаками плохого контроля БА до лечения;
• в 2,6 раза более вероятное достижение хорошо контролируемой БА у пациентов с тремя признаками плохого контроля БА до лечения.
Таким образом, стартовая терапия препаратом Сере-тид является оправданной при начальной оценке пациента как больного БА средней тяжести (3-я ступень лечения).
Если контроль над заболеванием достигнут и сохраняется по меньшей мере 3 мес, следует предпринять попытку ступенчатого уменьшения объема поддерживающей терапии для определения минимального объема терапии, необходимого для контролирования БА. Следует помнить, что достижение контроля БА и его сохранение — длительный процесс. Поэтому не надо выполнять поспешных действий в виде быстрого уменьшения дозы. На каждом этапе уменьшения объема терапии следует проводить оценку контроля БА. Необходимо также учитывать тот факт, что отмена комбинированных препаратов и перевод на монотерапию ИГКС нередко приводят к потере контроля БА [29].
Следует помнить, что достижение контроля БА и его сохранение — длительный процесс. Поэтому не надо выполнять поспешных действий в виде быстрого уменьшения дозы. На каждом этапе уменьшения объема терапии следует проводить оценку контроля БА. Необходимо также учитывать тот факт, что отмена комбинированных препаратов и перевод на монотерапию ИГКС нередко приводят к потере контроля БА [29].
Заключение
Серетид представляет собой оригинальный комбинированный лекарственный препарат, в состав которого входит фиксированная комбинация из двух активных компонентов — ФП и САЛ. Применение оригинальных препаратов возможно только при имеющихся достоверно доказанных результатах лечения, полученных в клинических исследованиях по изучению безопасности и эффективности препарата. Так, на всех стадиях клинических исследований фиксируются абсолютно все неблагоприятные реакции. Это осуществляется и в течение ряда лет после вывода препарата на рынок. И эти условия определяют и цену, и ценность оригинальных препаратов. Как указывалось выше, основная цель лечения БА — достижение контроля над заболеванием. В многочисленных клинических иссле-
И эти условия определяют и цену, и ценность оригинальных препаратов. Как указывалось выше, основная цель лечения БА — достижение контроля над заболеванием. В многочисленных клинических иссле-
дованиях была продемонстрирована высокая эффективность Серетида. Препарат позволяет достигнуть облегчения симптомов благодаря ДДБА (тем самым повышается комплайнс пациента) и одновременно получить поддерживающую дозу ИГКС, которая воздействует на воспаление в дыхательных путях и улучшает контроль над заболеванием. Кроме того, использование фиксированных комбинаций снижает прямые и непрямые затраты на лечение по сравнению с применением тех же лекарственных средств в отдельных ингаляторах. Следует помнить, что данный препарат не назначают для купирования симптомов БА. С этой целью предпочтительно использовать Р2-агонисты короткого действия. При необходимости увеличения дозы ИГКС не следует превышать допустимые дозы САЛ. В этом случае следует назначить больному Серетид с более высоким содержанием ФП.
Список литературы
1. Global Initiative for Asthma. Workshop Report, 2006 // http://www.ginasthma.Org/documents/5/documents_variants/31
2. Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention. Update 2009 // http://www.siaip.it/ upload/879.pdf
3. Огородова Л.М., Кобякова О.С. // Аллергология. 2005. № 2. С. 50.
4. Bateman E.D. et al. // J. Allergy Clin. Immunol. 2010. V. 125. № 3. P. 600.
5. Schatz M. et al. // J. Allergy Clin. Immunol. 2006. V. 117. № 3. P. 549.
6. Thomas M. et al. // Prim. Care Respir. J. 2009. V. 18. № 1. P. 41.
7. Огородова Л.М. и др. // Consilium Medicum. 2008. Экстравыпуск. С. 6.
Огородова Л.М. и др. // Consilium Medicum. 2008. Экстравыпуск. С. 6.
8. Цой А.Н., Архипов В.В. // Рус. мед. журн. 2001. Т. 9. № 21. С. 930.
9. Dolovich M.B. et al.; American College of Chest Physicians; American College of Asthma, Allergy, and Immunology // Chest. 2005. V. 127. № 1. P. 335.
10. Hall I.P. // Asthma and COPD Basic Mechanisms and Clinical Management. 1st ed. / Ed. by P.J. Barnes et al. London, 2002.
11. Barnes P.J. et al. // Am. J. Respir. Crit. Care Med. 1998. V. 157. № 3. Pt. 2. P. S1.
12. Jeffery P.K. et al. // Am. Rev. Respir. Dis. 1992. V. 145. № 4. Pt. 1. P. 890.
13. Djukanovic R. et al. // Am. Rev. Respir. Dis. 1992. V. 145. № 3. P. 669.
14. Suissa S. et al. // N. Engl. J. Med. 2000. V. 343. № 5. P. 332.
Suissa S. et al. // N. Engl. J. Med. 2000. V. 343. № 5. P. 332.
15. Mak J.C. et al. // Am. J. Physiol. 1995. V. 268. № 1. Pt. 1. P. L41.
16. Pauwels R.A. et al. // Am. J. Respir. Crit. Care Med. 1998. V. 157. № 3. Pt. 1. P. 827.
17. Barnes P.J. // J. Allergy Clin. Immunol. 1999. V. 104. № 2. Pt. 2. P. S10.
18. Toogood J.H. et al. // J. Allergy Clin. Immunol. 1989. V. 84. № 5. Pt. 1. P. 688.
19. Greening A.P. et al. // Lancet. 1994. V. 344. № 8917. P. 219.
20. Woolcock A. et al. // Am. J. Respir. Crit. Care Med. 1996. V. 153. № 5. P. 1481.
21. van Noord J.A. et al. // Thorax. 1999. V. 54. № 3. P. 207.
22. Proud D. et al. // Clin. Exp. Allergy. 1998. V. 28. № 7. P. 868.
Proud D. et al. // Clin. Exp. Allergy. 1998. V. 28. № 7. P. 868.
23. Dowling R.B. et al. // Am. J. Respir. Crit. Care Med. 1997. V. 155. № 1. P. 327.
24. Dowling R.B. et al. // Eur. Respir. J. 1998. V. 11. № 1. P. 86.
25. Li X. et al. // Am. J. Respir. Crit. Care Med. 1999. V. 160. № 5. Pt. 1. P. 1493.
26. Kirby S. et al. // Eur. J. Clin. Pharmacol. 2001. V. 56. № 11. P. 781.
27. Bateman E.D. et al.; GOAL Investigators Group // Am. J. Respir. Crit. Care Med. 2004. V. 170. № 8. P. 836.
28. Barnes N.C. et al. // Respir. Med. 2007. V. 101. № 11. P. 2358.
29. Brozek J.L. etal.//http://jamanetwork.com/
Публикация осуществлена при финансовой поддержке компании ГлаксоСмитКляйн. Мнение автора может не совпадать с позицией компании. Компания ГлаксоСмитКляйн не несет ответственности за возможные нарушения авторских прав и иных прав третьих лиц в результате публикации и распространения данной информации. RU/SFC/0099/13 18.10.2013
Мнение автора может не совпадать с позицией компании. Компания ГлаксоСмитКляйн не несет ответственности за возможные нарушения авторских прав и иных прав третьих лиц в результате публикации и распространения данной информации. RU/SFC/0099/13 18.10.2013
Санаторно-курортное лечение бронхиальной астмы | #03/05
Санаторно-курортное лечение в России традиционно представляет собой составную часть государственной политики и важный раздел здравоохранения. По данным ГНИИ курортологии (г. Пятигорск), санаторно-курортное лечение позволяет существенно сократить трудовые и материальные потери: число больных, пользующихся освобождением от работы, — в 1,8–2,5 раза; количество дней временной нетрудоспособности — в 2,3–3,5 раза; потребность в госпитализации больных — в 2–4 раза, расходы на лечение больных в поликлиниках и стационарах — в 2,6–3,8 раза; выплаты пособий по больничным листам — в 1,8–2,5 раза; ущерб, наносимый производству в результате «недовыработки» продукции в связи с заболеваемостью, — в 2–3 раза.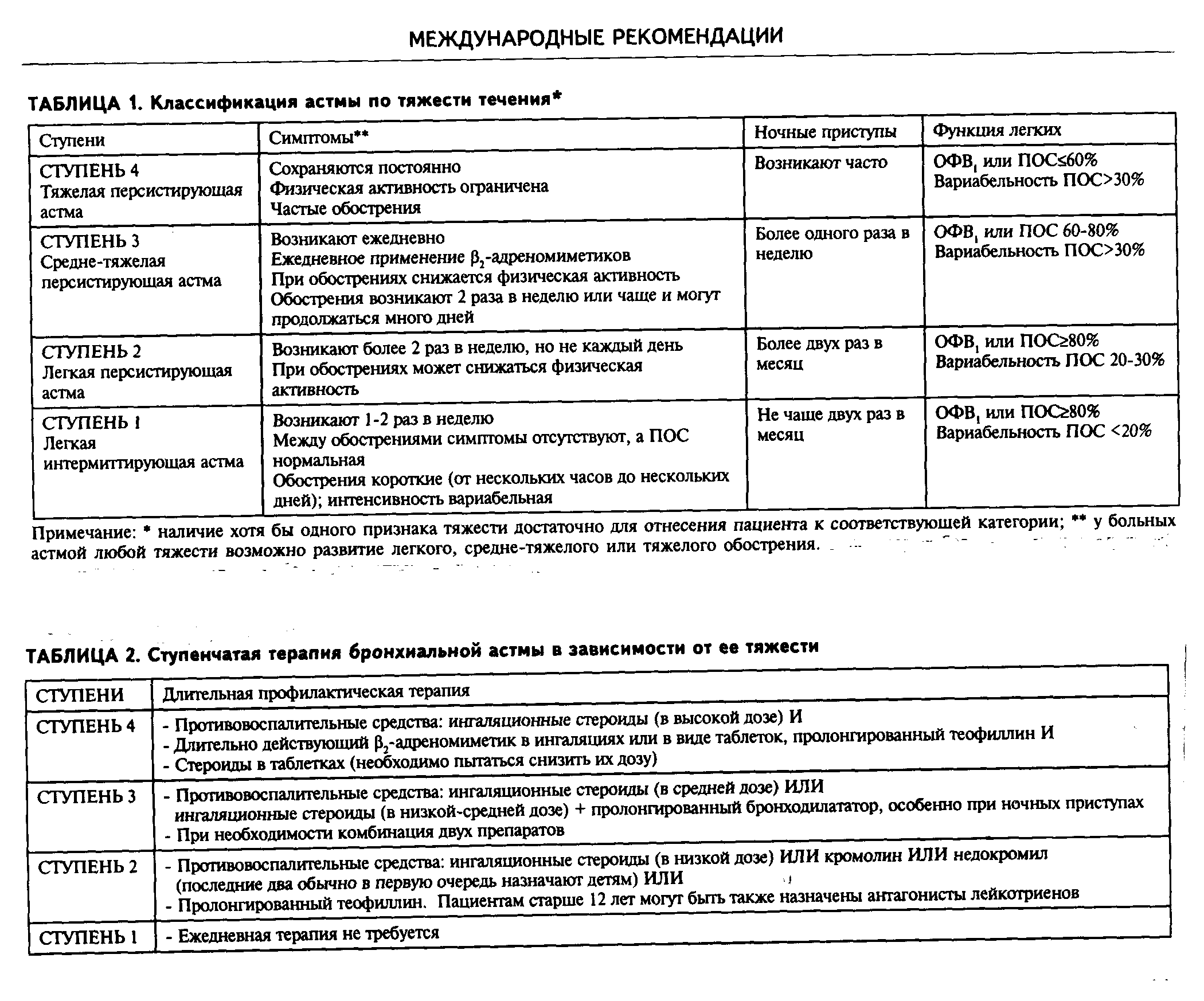
Проблема реабилитации больных бронхиальной астмой (БА) остается одной из самых значимых в пульмонологии: от 4 до 10% населения Земли страдают этим заболеванием различной степени тяжести, среди детей этот показатель повышается до 10–15%. По социальной значимости БА выходит на одно из первых мест среди заболеваний органов дыхания.
В соответствии с рекомендациями по диагностике и лечению БА, разработанными Институтом усовершенствования клинических систем ICSI и Респираторным управляющим комитетом (дата выпуска — 1994 г., пересмотрено в 2001 г.), при БА следует проводить ступенчатое лечение, цель которого — сохранить контроль над астмой на фоне применения минимального количества лекарственных препаратов. Важное место в терапии БА занимает санаторно-курортное лечение (табл. 1). Оно является одним из самых дорогих и одновременно его можно признать одним из наиболее рентабельных, учитывая благоприятное послекурортное действие. По данным исследований, проведенных в детском санатории «Смена» (г. Кисловодск) совместно с Пятигорским НИИ курортологии, длительность ремиссии через год после курортного лечения в среднем достигает 9,7 мес.
Кисловодск) совместно с Пятигорским НИИ курортологии, длительность ремиссии через год после курортного лечения в среднем достигает 9,7 мес.
О порядке медицинского отбора и направления больных на санаторно-курортное лечение
В мировой практике накоплен значительный опыт успешного лечения бронхиальной астмы на климатических курортах. Климатические факторы оказывают мощное терапевтическое воздействие и должны быть признаны сильнодействующими. Любой переезд в зону с измененными климатическими условиями, даже благоприятными для здоровья, всегда сопровождается реакцией адаптации, или, иными словами, кратковременными приспособительными физиологическими сдвигами многих функциональных систем, цель которых — обеспечение необходимого уровня жизнедеятельности в новых условиях. Длительность периода адаптации (акклиматизации) на курорте определяется индивидуально, в зависимости от особенностей болезни и контрастности смены климатических районов, а также от условий внешней среды. Важность этого вопроса подчеркивается в Приказе № 256 МЗСР РФ от 22 ноября 2004 г. «О порядке медицинского отбора и направления больных на санаторно-курортное лечение». При заполнении справки для получения путевки на санаторно-курортное необходимо указывать климатическую зону и климатические факторы в месте проживания.
Важность этого вопроса подчеркивается в Приказе № 256 МЗСР РФ от 22 ноября 2004 г. «О порядке медицинского отбора и направления больных на санаторно-курортное лечение». При заполнении справки для получения путевки на санаторно-курортное необходимо указывать климатическую зону и климатические факторы в месте проживания.
Особенно ответственно следует подходить к выбору климата курорта для метеочувствительных людей. Установлено, что при сдвиге часового пояса на 3 ч и более в организме могут развиваться болезненные расстройства, комплекс которых получил название десинхроноза, проявляющиеся чаще всего расстройством сна, снижением работоспособности, ухудшением течения основного заболевания. Наиболее выраженные изменения возникают при перемещении с запада на восток, когда происходит инверсия привычного хода суточного времени. При переездах в непривычные климатические условия может нарушаться и структура сезонного ритма погодных условий. Неблагоприятное действие на организм человека оказывает (при переезде весной из средней полосы в условия лета южных курортов), а его инверсия, что обычно наблюдается при поездке осенью в южные страны, где еще сохраняется летняя погода. Таким пациентам следует рекомендовать не перелеты, при которых смена климатических условий происходит в течение нескольких часов, а поездки на поезде.
Таким пациентам следует рекомендовать не перелеты, при которых смена климатических условий происходит в течение нескольких часов, а поездки на поезде.
На курорте больным в период адаптации (акклиматизации) не назначают сильнодействующие климатические процедуры, рекомендуют соблюдать режим, который уменьшил бы интенсивность раздражителей, вызванных сменой климатических районов, а также способствовал правильной тренировке приспособительных механизмов.
Нецелесообразно направление больных БА, проживающих в резкоконтинентальных зонах, на южные курорты осенью, поскольку их возвращение к месту постоянного проживания чревато обострением вследствие контрастных климатических условий и сниженной способности к реадаптации. Также нецелесообразны короткие курсы санаторно-курортного лечения, столь популярные сегодня. Больным БА следует ограничивать инсоляцию из-за активного влияния УФ на иммунную систему, возможности развития солнечных ожогов и, как следствие, дополнительной сенсибилизации.
При выборе курорта для больных бронхиальной астмой необходимо принимать во внимание не только климатическую зону, в которой расположен курорт, но и сезон, учитывая контрастность метеоусловий и пору цветения.
По заключению врачей болгарского курорта Сандански, на эффективность лечения влияют сезон, а также форма бронхиальной астмы. Наибольший эффект дает курортное лечение атопической формы осенью — 96,7%, а наименьший летом — 86,8%, при инфекцинно-аллергической форме наиболее результативным лечение оказывается летом — 88,3%, а наименее эффективным весной — 79,1%. При смешаной форме наибольший эффект приходится на осень — 92,6%, а наименьший на весну — 76%.
Эффективность санаторно-курортного лечения БА зависит от правильного выбора курорта. В отечественной курортологической литературе имеются лишь отрывочные данные о зарубежных курортах и нет достоверных сведений о современных возможностях лечения на российских курортах. Россия обладает разнообразными курортными ресурсами, многие из которых уникальны. В настоящей публикации мы приводим перечень курортов с указанием основных природных факторов. В таблице 2 отражены климатические особенности курортов, наличие спелеоклиматических и галокамер, ингаляториев, градирен. Указаны также основные типы минеральных вод питьевого и бальнеотерапевтического назначения, лечебных грязей, что позволит врачу подобрать курорт с возможностью лечения основного (БА) и сопутствующих (или конкурирующих) заболеваний.
В настоящей публикации мы приводим перечень курортов с указанием основных природных факторов. В таблице 2 отражены климатические особенности курортов, наличие спелеоклиматических и галокамер, ингаляториев, градирен. Указаны также основные типы минеральных вод питьевого и бальнеотерапевтического назначения, лечебных грязей, что позволит врачу подобрать курорт с возможностью лечения основного (БА) и сопутствующих (или конкурирующих) заболеваний.
Климатические зоны, показанные для больных БА
Континентальный климат равнин лесной и лесостепной зоны с коротким летом характерен для обширной полосы умеренных широт Северного полушария. Характеризуется преобладанием в летние месяцы теплой температуры, умеренной влажностью и достаточной солнечной радиацией. Климат лесной и лесостепной зоны Европейской части России создает щадящие условия для больных. Для пациентов с заболеваниями органов дыхания особенно показан таежный климат (зоны хвойных лесов), воздух которых насыщен фитонцидами.
На многих немецких и австрийских бальнеоклиматических курортах с хлоридными натриевыми водами устроены градирни (от нем. gradieren — сгущать соляной раствор; первоначально градирни служили для добычи соли выпариванием), представляющие собой устройства для охлаждения воды атмосферным воздухом. На курортах градирни выполняют роль бальнеотехнических сооружений. Они представляют собой деревянный каркас, длиной до нескольких сотен метров, заполненный хворостом. Хлоридная натриевая (соленая) вода поступает в верхнюю часть устройства (в высоту градирни достигают 15 м) откуда падает, разбиваясь о хворост, и разлетается мельчайшими брызгами. Мельчайшие частицы воды распыляются на расстояние до 500 м, образуя аэрозоль и создавая микроклимат, близкий к условиям морских побережий: увлажненный, ионизированный воздух, насыщенный солями и аэроионами. Пребывание близ градирни, вокруг которой образуется естественный ингаляторий, чрезвычайно эффективно при лечении неспецифических заболеваний органов дыхания, в том числе и БА.
Климат полупустынь и пустынь (аридный климат умеренных широт) способствует более легкой регуляции теплообмена между кожей и легкими, обильному потоотделению, облегчает работу почек, при этом повышаются содержание гемоглобина и количество эритроцитов в крови.
Степной климат (семиаридный климат умеренных широт) отличается от климата пустынь (аридного климата) более резкими перепадами между дневной и ночной температурой. На степных курортах европейской части России дополнительно используют лечение кумысом. Первый кумысолечебный санаторий близ Самары был организован в 1858 г. доктором Н. В. Постниковым. В трех словах ему удалось выразить сущность действия кумыса на организм человека: «nutrit, roborat, etalterat» — «питает, укрепляет, обновляет».
Характерными особенностями горного климата являются пониженное парциальное давление кислорода в воздухе, повышенная солнечная радиация и ионизация воздуха, значительные колебания суточной температуры. Акклиматизация к горному климату связана с внешней гипоксией, суточными колебаниями температуры, повышенной солнечной радиацией.
Акклиматизация к горному климату связана с внешней гипоксией, суточными колебаниями температуры, повышенной солнечной радиацией.
Уже более 100 лет низкогорный курорт Кисловодск считается одним из лучших для лечения больных БА. В 1873 г. профессор Зарубин в сборнике материалов, посвященных изучению Кавминвод, опубликовал статью «О Кисловодске как о лечебном приюте для страдающих грудными болезнями». Климат сибирского курорта «Белокуриха» отличается постоянным атмосферным давлением, большим количеством ясных и солнечных дней в году, умеренной влажностью, наличием теплых фенов в зимнее время года; кроме того, количество аэроионов здесь в два раза выше, чем в швейцарском Давосе.
Приморский климат (морских побережий) характеризуется относительно высоким атмосферным давлением, отсутствием резких перепадов температуры, чистотой и свежестью воздуха при высоком содержании в нем озона и морских солей, интенсивным солнечным излучением. Пребывание возле моря способствует повышению обмена веществ и усилению секреции эпителия бронхиального дерева, оказывает тонизирующее, общеукрепляющее и закаливающее действие.
Согласно традиционной точке зрения, для больных БА противопоказан климат влажных субтропиков, в частности курортов сочинской группы. Однако эта гипотеза до сих пор не получила научных обоснований. Наоборот, умеренная влажность, характерная для упомянутого региона, этим больным просто необходима, как и рациональная гидратация. Дегидратация же способствует формированию густой слизи в просвете бронхов, что нарушает их проходимость. Лечение больных с умеренными проявлениями бронхиальной обструкции оказывается вполне эффективным в условиях умеренно влажного климата, как в районе Сочи (санаторий «Чемитоквадже»), так и в Прибалтике (г. Светлогорск). Противопоказаны эти климатические условия только больным декомпенсированной формой БА (Л. М. Клячкин, А. М. Щегольков, 2000).
Спелеотерапия, лечебные штольни
Особое место в лечении в курортном лечении БА занимает спелеотерапия (греч. speleon — пещера) — метод лечения длительным пребыванием в условиях своеобразного микроклимата естественных карстовых пещер, гротов, соляных копей, искусственно пройденных горных выработок металлических, соляных и калийных рудников. История спелеотерапии насчитывает около 2500 лет. Лечение под контролем врачей впервые начали применять в XIX в. в штольнях серебряных рудников близ австрийского города Oberzeiring. В 1959 г. в старой проходке карстовой шахты около городка Велички, возле Кракова, на глубине 200 м был организован санаторий на 70 мест, а год спустя подземная лечебница открылась в соляных копях Прайда (Румыния). С 1977 г. действует первая в России и в мире сильвинитовая спелеолечебница в калийном руднике на Верхнекамском месторождении калийных солей (г. Березники Пермской области). Спелеотерапия практикуется в самом большом в Европе подземном отделении Украинской аллергологической больницы, открытой в 1979 г. в пос. Солотвино Закарпатской области. Больные здесь лечатся на «двух койках»: одна в стационаре на 260 мест, а вторая — в подземной лечебнице, где они проводят 7–12 ч в сут, чередуя дневные процедуры и ночной сон. В Германии создан Немецкий союз спелеотерапии, объединяющий 12 курортов; метод получил название Hohlentherapie (пещерное лечение) или Heilstollentherapie (лечебные штольни).
История спелеотерапии насчитывает около 2500 лет. Лечение под контролем врачей впервые начали применять в XIX в. в штольнях серебряных рудников близ австрийского города Oberzeiring. В 1959 г. в старой проходке карстовой шахты около городка Велички, возле Кракова, на глубине 200 м был организован санаторий на 70 мест, а год спустя подземная лечебница открылась в соляных копях Прайда (Румыния). С 1977 г. действует первая в России и в мире сильвинитовая спелеолечебница в калийном руднике на Верхнекамском месторождении калийных солей (г. Березники Пермской области). Спелеотерапия практикуется в самом большом в Европе подземном отделении Украинской аллергологической больницы, открытой в 1979 г. в пос. Солотвино Закарпатской области. Больные здесь лечатся на «двух койках»: одна в стационаре на 260 мест, а вторая — в подземной лечебнице, где они проводят 7–12 ч в сут, чередуя дневные процедуры и ночной сон. В Германии создан Немецкий союз спелеотерапии, объединяющий 12 курортов; метод получил название Hohlentherapie (пещерное лечение) или Heilstollentherapie (лечебные штольни). Врачи союза рекомендуют ежедневные процедуры по 2 ч, продолжительность курса должна составлять не менее
Врачи союза рекомендуют ежедневные процедуры по 2 ч, продолжительность курса должна составлять не менее
3-х нед. В Венгрии спелеотерапия признана официально. В настоящее время спелеотерапевтические лечебницы функционируют в Армении, Болгарии, Венгрии, Грузии, Киргизии, Польше, Румынии, Словакии, США (штат Монтана), Украине, Чехии. Длительность лечебных сеансов пещерного лечения составляет от 2 до 12 ч в сут, в продолжение которых пациенты читают, спят, занимаются дыхательной гимнастикой и даже играют в волейбол.
Клиническая эффективность подземной спелеотерапии в спелеолечебнице
г. Березники (15 лет наблюдений) составила 85,2% (у больных с тяжелой БА — 42,8%). При этом положительный эффект спелеотерапии у больных БА сохранялся в течение 1–3 лет в 93% случаев. По данным специализированного Спа-центра, расположенного на австрийском курорте Оберцайринг (Spa Center for Pulmonary Diseases Oberzeiring), эффективность лечения у пациентов с заболеваниями органов дыхания составила 72%.
Микроклимат подземных палат отличает факт стабильности: полное отсутствие пыльцевых аллергенов, практически стерильный воздух (3–5 микробов на 1 куб. м). Температура воздуха круглый год составляет 8–10 градусов выше нуля по Цельсию. В лечебных палатах отмечается высокий уровень ионизации воздуха (до 4000–5000 легких отрицательных ионов и 2200–3000 положительных аэроионов). Гамма-фон не превышает уровня, регистрирующегося на поверхности земли. Эффективность лечения атопических форм БА достигает 92%, а при инфекционно-зависимой форме — 67–78% (санаторий «Чон-Туз», Кочкарка, Киргизия).
Климатические камеры
Галотерапия (греч. hals — соль) — метод лечения с пребыванием в искусственно созданном микроклимате соляных пещер. Основным действующим фактором в этом случае является высокодисперсный сухой солевой аэрозоль (галоаэрозоль). Основную массу частиц аэродисперсной среды (более 97%) составляет респирабельная фракция (1–5 мкм), благодаря чему осуществляется эффективное воздействие аэрозоля во всех, в том числе самых глубоких отделах дыхательных путей. Физико-химические свойства аэрозоля определяют специфику методики галотерапии (ГТ), одной из особенностей которой является доставка в дыхательные пути чрезвычайно малых доз вещества. У пациентов с бронхиальной астмой ГТ способствует удлинению периода ремиссии и облегчению течения заболевания, в связи с чем становится возможен переход к меньшим дозам и более щадящим средствам базисной медикаментозной терапии БА. ГТ может применяться и у больных старших возрастных групп с хроническими обструктивными заболеваниями, имеющих, как правило, сопутствующую патологию, ограничивающую медикаментозную терапию.
Физико-химические свойства аэрозоля определяют специфику методики галотерапии (ГТ), одной из особенностей которой является доставка в дыхательные пути чрезвычайно малых доз вещества. У пациентов с бронхиальной астмой ГТ способствует удлинению периода ремиссии и облегчению течения заболевания, в связи с чем становится возможен переход к меньшим дозам и более щадящим средствам базисной медикаментозной терапии БА. ГТ может применяться и у больных старших возрастных групп с хроническими обструктивными заболеваниями, имеющих, как правило, сопутствующую патологию, ограничивающую медикаментозную терапию.
Галокамеры — приоритетные разработки русской физиотерапевтической школы. Ими оснащены многие санатории, городские медицинские центры, в настоящее время они широко импортируются за рубеж. Некоторые разработчики продолжают пользоваться термином «спелеотерапия» (греч. speleon — пещера), хотя это не корректно, так как подземные условия как таковые не воспроизводятся при моделировании микроклимата.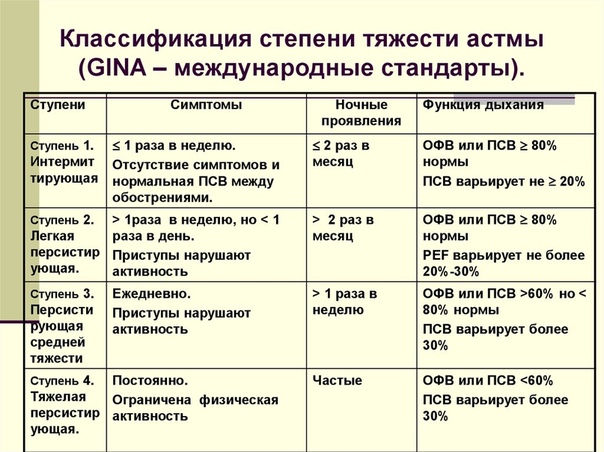 В настоящее время помещения, в которых создается микроклимат соляных пещер, называют по-разному: галокамера, спелеокамера, спелеоклиматическая камера, климатическая камера, соляная пещера, «живой воздух».
В настоящее время помещения, в которых создается микроклимат соляных пещер, называют по-разному: галокамера, спелеокамера, спелеоклиматическая камера, климатическая камера, соляная пещера, «живой воздух».
Спелеокамеры — это климатические камеры, облицованные сильвинитовыми блоками из Верхнекамских калийных рудников. Спелеокамеры позволяют производить высокоэффективное лечение особых категорий больных, которым противопоказано пребывание в подземных условиях (детей, стариков, инвалидов и т. п.). В отличие от галокамер, распылитель в спелеокамерах принципиально не используется. Клиническая эффективность сильвинитовой спелеоклиматотерапии БА у детей составляет 71%, при астме легкой степени — до 84 %.
Н. В. Маньшина
Медицинский центр «Медси», Москва
Раздел для практикующего врача, назначающего лечение, наглядно демонстрирующий применение новейших научных разработок в области медицины. Статьи носят рекомендательный характер, сочетая в себе практическую информацию и научные обзоры.

Информация только для специалистов в сфере медицины, фармации и здравоохранения!
С 18 по 20 февраля 2015 г. в Москве прошел XIII Международный конгресс Российской ассоциации аллергологов и клинических иммунологов, в рамках которого состоялся симпозиум «Эндотипы и фенотипы астмы — от алгоритма обследования до подбора терапии», посвященный современным подходам к диагностике и лечению пациентов с бронхиальной астмой.
С вступительной речью выступил председатель симпозиума д.м.н., профессор, заведующий кафедрой аллергологии и пульмонологии Иркутской государственной медицинской академии последипломного образования, главный внештатный аллерголог-иммунолог Сибирского и Дальневосточного федерального округа Борис Анатольевич Черняк:
Последние несколько десятилетий мы имеем дело с персонализированными подходами в медицине. GINA в последнюю свою редакцию внесла небольшое, на первый взгляд, но очень существенное изменение в определение бронхиальной астмы (БА). Ключевым стало слово «гетерогенное». То есть астма является гетерогенным заболеванием. А дальше — привычное нам «хроническое воспаление, протекающее с симптомами…» и т. д. И в этой же редакции GINA впервые определенно начала говорить о том, что существуют фенотип аллергической астмы, фенотип неаллергической бронхиальной астмы, астма с поздним дебютом, астма с фиксированной бронхиальной обструкцией, астма на фоне ожирения, синдром перекреста (о нем тоже сегодня пойдет речь) и т. д. Фенотип — это совокупность характеристик, развивающихся в результате взаимодействия генетических факторов под воздействием окружающей среды. Это общее определение фенотипа, которое относится в том числе и к БА. На самом деле понимание, что астма — гетерогенное заболевание, существует довольно давно. Еще в 20-х годах прошлого столетия профессор Акиман выделял по меньшей мере 2 формы БА — экзогенную и эндогенную. Профессора Адо и Булатов говорили про атопическую и неатопическую формы БА. Профессор Федосеев в 1977 г.
Ключевым стало слово «гетерогенное». То есть астма является гетерогенным заболеванием. А дальше — привычное нам «хроническое воспаление, протекающее с симптомами…» и т. д. И в этой же редакции GINA впервые определенно начала говорить о том, что существуют фенотип аллергической астмы, фенотип неаллергической бронхиальной астмы, астма с поздним дебютом, астма с фиксированной бронхиальной обструкцией, астма на фоне ожирения, синдром перекреста (о нем тоже сегодня пойдет речь) и т. д. Фенотип — это совокупность характеристик, развивающихся в результате взаимодействия генетических факторов под воздействием окружающей среды. Это общее определение фенотипа, которое относится в том числе и к БА. На самом деле понимание, что астма — гетерогенное заболевание, существует довольно давно. Еще в 20-х годах прошлого столетия профессор Акиман выделял по меньшей мере 2 формы БА — экзогенную и эндогенную. Профессора Адо и Булатов говорили про атопическую и неатопическую формы БА. Профессор Федосеев в 1977 г. уже дифференцировал БА на так называемые клинико-патогенетические фенотипы. И большинство вариантов (фенотипов, как теперь принято говорить) уже тогда им упоминались: атопические, аспириновые, дисгормональные (включая дисовариальную), холинергические и т. д. Таким образом, сегодня мы говорим о тех же вещах, но с позиции современной медицинской науки, с позиции доказательной медицины. При этом я хотел бы подчеркнуть одно новое для нас сегодня понятие, которое часто сопряжено с фенотипом, — эндотип. Если фенотипы воспринимают часто как внешнее проявление той или иной патологии, то эндотип — это подтипы или согруппы заболеваний, характеризующиеся уникальным или отличительным патофизиологическим (патогенетическим) механизмом, определяющим в значительной степени ответ на лечение. Профессор S. Wenzel — одна из крупнейших специалистов по гетерогенности астмы — совсем недавно предложила представление об эволюции подразделения астмы. В его основе лежит фенотип астмы как совокупность клинических и физиологических наследственных признаков, а дальше мы можем углубляться до молекулярного уровня, говоря о молекулярных фенотипах, которые включают связанные с клиническими проявлениями патобиологические характеристики и маркеры.
уже дифференцировал БА на так называемые клинико-патогенетические фенотипы. И большинство вариантов (фенотипов, как теперь принято говорить) уже тогда им упоминались: атопические, аспириновые, дисгормональные (включая дисовариальную), холинергические и т. д. Таким образом, сегодня мы говорим о тех же вещах, но с позиции современной медицинской науки, с позиции доказательной медицины. При этом я хотел бы подчеркнуть одно новое для нас сегодня понятие, которое часто сопряжено с фенотипом, — эндотип. Если фенотипы воспринимают часто как внешнее проявление той или иной патологии, то эндотип — это подтипы или согруппы заболеваний, характеризующиеся уникальным или отличительным патофизиологическим (патогенетическим) механизмом, определяющим в значительной степени ответ на лечение. Профессор S. Wenzel — одна из крупнейших специалистов по гетерогенности астмы — совсем недавно предложила представление об эволюции подразделения астмы. В его основе лежит фенотип астмы как совокупность клинических и физиологических наследственных признаков, а дальше мы можем углубляться до молекулярного уровня, говоря о молекулярных фенотипах, которые включают связанные с клиническими проявлениями патобиологические характеристики и маркеры.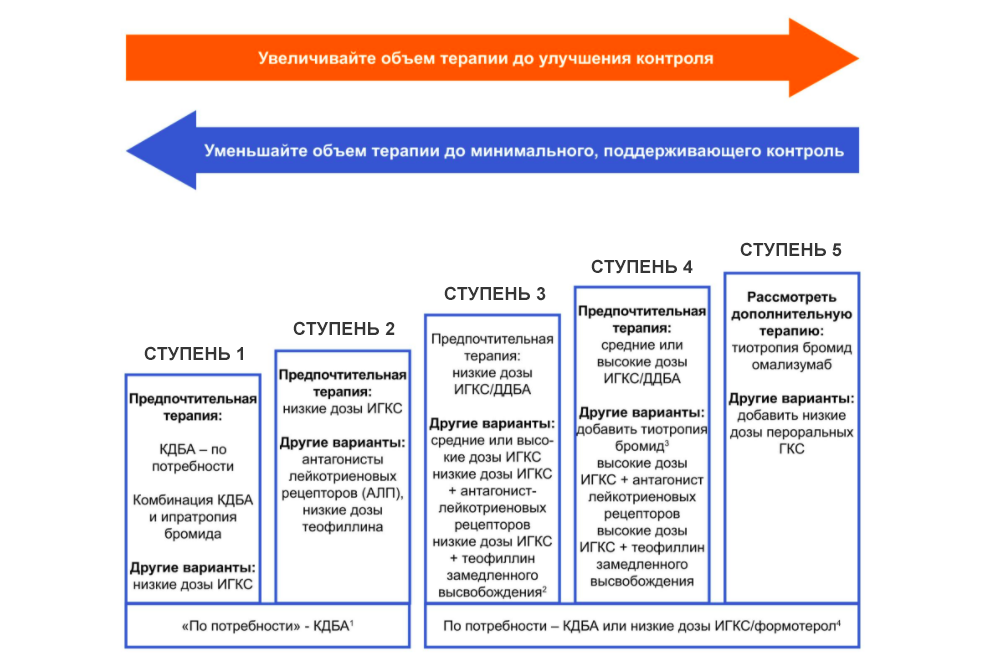 Но если мы выделяем конкретный патобиологический маркер, который может явиться субстратом или основанием для патогенетической терапии, то это уже можно называть эндотипом. Классический вариант, иллюстрирующий эту ситуацию, — атопическая БА с маркером на уровне молекулярной характеристики, когда мы можем назначать омализумаб, или эозинофильная астма, когда имеется повышенный уровень интерлейкина-5 и назначаются антиинтерлейкиновые препараты.
Но если мы выделяем конкретный патобиологический маркер, который может явиться субстратом или основанием для патогенетической терапии, то это уже можно называть эндотипом. Классический вариант, иллюстрирующий эту ситуацию, — атопическая БА с маркером на уровне молекулярной характеристики, когда мы можем назначать омализумаб, или эозинофильная астма, когда имеется повышенный уровень интерлейкина-5 и назначаются антиинтерлейкиновые препараты.
Wenzel предложила на основании молекулярного эндотипирования в рамках эндотипов Th3 и не Th3 воспаления выделять определенные фенотипы БА. Для ТН2 это аллергическая астма (в т. ч. ее вариант – атопическая астма), аспириновая БА, которая может быть самостоятельным аллергическим заболеванием или сочетаться с атопией. Сюда же частично относится синдром перекреста (атопическая БА в сочетании с ХОБЛ). Это все — ТН2 эндотип, который объединяет различные варианты бронхиальной астмы и эозинофильного воспаления. Не ТН2 эндотип — это астма с очень поздним дебютом, астма с ожирением, астма у курильщиков или астма нейтрофильная у некурящих людей. Сюда же входит очень интересный малоизученный в молекулярном плане вариант, когда речь идет о негранулоцитарном или малогранулоцитарном воспалении.
Сюда же входит очень интересный малоизученный в молекулярном плане вариант, когда речь идет о негранулоцитарном или малогранулоцитарном воспалении.
Почему же нам так важны эти фенотипы и эндотипы бронхиальной астмы? С моей точки зрения, ответ очевиден: разные этиологические факторы и факторы риска, разное течение заболевания обуславливают разные подходы к терапии и разный ответ на лечение и, соответственно, прогноз.
Д.м.н., главный аллерголог Министерства здравоохранения Республики Татарстан, заведующий кафедрой аллергологии Казанской государственной медицинской академии, профессор Рустем Салахович Фассахов выступил с докладом «Атопическая астма:
клиническая характеристика и возможности современной терапии»:
Атопия — это генетическая предрасположенность к аллергическим заболеваниям, обусловленная гиперпродукцией IgE-антител к аллергенам. Важнейшим отличительным признаком атопии является наследственная предрасположенность. Хорошо знакомые причины атопической астмы — это домашние аллергены, источниками которых служат животные, клещи домашней пыли, споры плесневых грибов и т. д.
д.
Какие клинические особенности выделяются у атопической БА? Считается, что типичен старт заболевания в детском возрасте, но на самом деле так происходит не всегда. В большинстве случаев воспалительный процесс в бронхах носит эозинофильный характер. Началу заболевания, как правило, предшествует аллергический ринит. Он выявляется практически у 100% больных с атопической БА.
Обсудим GINA в редакции 2014 г. Документ можно назвать революционным. Он категорически отличается от своих предыдущих версий. Надо сказать, что главное отличительный признак новой редакции — это приближенность к жизни. Большинство наших врачей довольно давно используют на практике рекомендации, впервые появившиеся в 2014 г.
На рисунке 1 вы можете увидеть все основные изменения, появившиеся в GINA 2014 г. Как уже было сказано ранее, наконец-то в определении астмы прозвучало, что это гетерогенное заболевание. Среди основных изменений в GINA – так же акцент на нефармакологическое влияние на БА. Если говорить о диагностике астмы, отмечено, что симптомы заболевания могут появляться при контакте с аллергенами. Для атопической астмы связь заболевания с контактом с аллергенами — очень важный признак.
Если говорить о диагностике астмы, отмечено, что симптомы заболевания могут появляться при контакте с аллергенами. Для атопической астмы связь заболевания с контактом с аллергенами — очень важный признак.
Один из моментов диагностики БА — наличие вариабельной обструкции. Для этого мы исследуем функцию внешнего дыхания пациента. Если первоначальное исследование дало отрицательный результат, повторите его в период наличия симптомов (сезон цветения, контакт с животными), либо после отмены бронхолитических препаратов.
Контроль астмы — это две составляющие: контроль факторов риска заболевания и учитывание проблем, связанных с проведением терапии. Факторы риска: риносинусит, ГЭРБ, ожирение, обструктивное апноэ во сне, депрессия. Все это может утяжелять симптомы БА и ухудшать качество жизни. Что подразумевается под проблемами, связанными с проведением терапии? Приверженность к терапии, правильность выполнения техники ингаляций, отношение больного к своему заболеванию и т. д. Очень важно выяснить, правильно ли проводится элиминационная терапия. Проводится ли она вообще? Сохранение контакта с аллергенами — это фактор риска необратимой обструкции.
д. Очень важно выяснить, правильно ли проводится элиминационная терапия. Проводится ли она вообще? Сохранение контакта с аллергенами — это фактор риска необратимой обструкции.
Как оценивается степень тяжести астмы? Ретроспективно по объему проводимой для контроля симптомов и обострений терапии в течение нескольких месяцев. Тяжесть БА может изменяться с течением времени. Например, терапия ринита существенно улучшает состояние больного БА. Что важно, когда мы начинаем оценивать проводимую терапию? В зависимости от результатов лечения проводится коррекция терапии, в т. ч. нефармакологическая. То есть соблюдение элиминационного режима, техника проведения ингаляций и т. д.
Что нового в вопросах терапии БА в последней редакции GINA? На второй ступени появляются группы препаратов (антагонисты лейкотриеновых рецепторов и КДБА), которые могут быть использованы у больных с БА и аллергическим ринитом. Периодический прием ИГКС и КДБА по потребности у больных с чисто пыльцевой БА при отсутствии симптомов вне сезона; назначение ИГКС сразу с появлением симптомов и продолжение терапии не менее 4 недель после завершения сезона.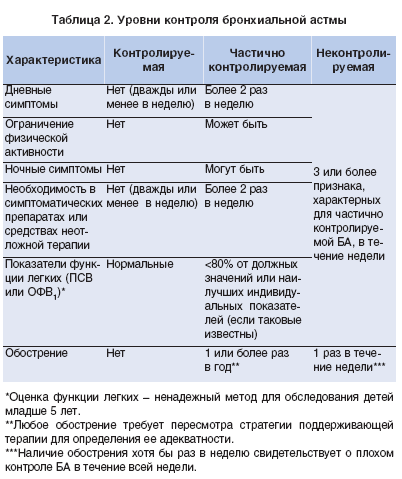 Как я уже сказал, это — новые аспекты терапии БА в редакции GINA 2014, но вполне привычные для наших специалистов.
Как я уже сказал, это — новые аспекты терапии БА в редакции GINA 2014, но вполне привычные для наших специалистов.
На третьей ступени есть серьезные изменения, касающиеся базовой терапии. Например, комбинация низких доз ИГКС плюс формотерол — как препараты поддержки, так и по потребности.
Астма — это заболевание вариабельное. Обострения могут возникать даже у пациентов с контролируемой БА под воздействием тех или иных триггеров. Но обострения можно предотвратить, увеличив дозу ИГКС в 4 раза. То есть причина увеличения дозы ИГКС — массивный и длительный контакт с триггером (например, в сезон цветения). Причина для увеличения дозы ДДБА — превентивное использование перед краткосрочными контактами с аллергенами.
На 4 ступени на первый план выходит терапия комбинированными препаратами ИГКС с ДДБА. Одна из таких фиксированных комбинаций — это Форадил Комби, содержащий в себе формотерол (12 мг) и будесонид (200) мг. Он прекрасно вписывается в рекомендации GINA 2014. Посмотрите на рисунок 2, где отражено место Форадила Комби в лечении астмы. Его доза отлично встраивается и в терапию третьей ступени, и четвертой, и пятой. На пятой ступени мы можем добавлять этот препарат по потребности, когда в этом есть необходимость. Дозу Форадила Комби можно как повышать, так и понижать. Раздельные ингаляции позволяют нам изменять дозировку каждого компонента в отдельности. Форадил Комби отлично подходил как для терапии впервые выявленной БА, так и в том случае, когда мы вынуждены больному менять один препарат на другой в силу тех или иных обстоятельств.
Посмотрите на рисунок 2, где отражено место Форадила Комби в лечении астмы. Его доза отлично встраивается и в терапию третьей ступени, и четвертой, и пятой. На пятой ступени мы можем добавлять этот препарат по потребности, когда в этом есть необходимость. Дозу Форадила Комби можно как повышать, так и понижать. Раздельные ингаляции позволяют нам изменять дозировку каждого компонента в отдельности. Форадил Комби отлично подходил как для терапии впервые выявленной БА, так и в том случае, когда мы вынуждены больному менять один препарат на другой в силу тех или иных обстоятельств.
Пятая ступень терапии БА — очень важная. Первая рекомендация — направление больного к специалисту на обследование. О чем это говорит? Первые четыре ступени лечит врач первичного клинического звена. И только на 5 ступени вы отправляете больного к пульмонологу или аллергологу. Опять же эксперты напоминают нам, что необходимо проверить технику использования ингалятора.
На 5 ступени возможно использование препарата омализумаб (антагонист лейкотриеновых рецепторов) у пациентов с подтвержденной аллергической БА, не поддающейся контролю терапией четвертой ступени. Он назначается тем больным, у которых не достигается контроля над заболеванием даже при самой адекватной, современной, правильно выполняемой терапии, в т. ч. комбинированным ингаляционным препаратом. Исследования INNOVATE и PERSIST показали лучший контроль астмы, снижение количества обострений и улучшение качества жизни у получающих препарат больных с аллергической астмой.
Он назначается тем больным, у которых не достигается контроля над заболеванием даже при самой адекватной, современной, правильно выполняемой терапии, в т. ч. комбинированным ингаляционным препаратом. Исследования INNOVATE и PERSIST показали лучший контроль астмы, снижение количества обострений и улучшение качества жизни у получающих препарат больных с аллергической астмой.
Резюмируя вышесказанное, хочу еще раз подчеркнуть, что большинство из новых рекомендаций GINA мы уже давно успешно используем. И это говорит о том, что мы ведем работу в правильном направлении, а экспертные рекомендации максимально приближаются к существующим реалиям.
К.м.н., доцент кафедры аллергологии и пульмонологии Иркутской государственной медицинской академии последипломного образования Ирина Ивановна Воржева выступила с докладом «Аспириновая астма: алгоритм диагностики и особенности лечения»:
Аспириновая бронхиальная астма (БА) была описана еще в начале прошлого века. Во второй половине ХХ столетия она получила название аспириновой или астматической триады, что отражало три главных признака этой болезни: наличие астмы, риносинусита (чаще всего полипозного) и непереносимости ацетилсалициловой кислоты (АСК), которая проявляется приступами удушья и назальной симптоматикой. В начале ХХI века появился другой термин: аспирин-индуцированное респираторное заболевание. Этот термин отражает сложившееся понимание, что астма и риносинусит сочетаются не случайно, а имеют очень тесные патогенетические связи, другими словами: одни воздушные пути, одна болезнь. При этом описано уже достаточное количество случаев развития непереносимости АСК у пациентов с риносинуситом без астмы. И, наконец, возникает относительно новое понятие — НПВП-индуцированное респираторное заболевание или NERD (от англ. nonsteroidal anti-inflammatory drugs-exacerbated respiratory disease), которое подчеркивает, что триггером может являться не только АСК, но и НПВП, относящиеся к ингибиторам циклооксигеназы 1 типа (ЦОГ-1). И поэтому при NERD наблюдается очень широкий перекрест реакции гиперчувствительности с различными неселективными НПВП.
Во второй половине ХХ столетия она получила название аспириновой или астматической триады, что отражало три главных признака этой болезни: наличие астмы, риносинусита (чаще всего полипозного) и непереносимости ацетилсалициловой кислоты (АСК), которая проявляется приступами удушья и назальной симптоматикой. В начале ХХI века появился другой термин: аспирин-индуцированное респираторное заболевание. Этот термин отражает сложившееся понимание, что астма и риносинусит сочетаются не случайно, а имеют очень тесные патогенетические связи, другими словами: одни воздушные пути, одна болезнь. При этом описано уже достаточное количество случаев развития непереносимости АСК у пациентов с риносинуситом без астмы. И, наконец, возникает относительно новое понятие — НПВП-индуцированное респираторное заболевание или NERD (от англ. nonsteroidal anti-inflammatory drugs-exacerbated respiratory disease), которое подчеркивает, что триггером может являться не только АСК, но и НПВП, относящиеся к ингибиторам циклооксигеназы 1 типа (ЦОГ-1). И поэтому при NERD наблюдается очень широкий перекрест реакции гиперчувствительности с различными неселективными НПВП.
В настоящее время выделяют пять вариантов чувствительности к АСК и НВПВ. NERD относится к неаллергической, неиммунологической гиперчувствительности, в основе которой лежат генетически обусловленные нарушения метаболизма арахидоновой кислоты.
НПВП — лишь часть триггеров аспириновой БА. Кроме них обсуждаются и другие различные пусковые механизмы: персистенция респираторных вирусов, стимуляция антигенами золотистого стафилококка и т. д. Распространенность NERD в общей популяции невелика, а вот от общего количества больных БА по данным анамнеза NERD составляет 11%, в то время как при проведении провокационных тестов частота его возрастает до 21—28%.
Типичная клиническая картина NERD включает БА, гиперпластический риносинусит, полипоз полости носа и придаточных пазух (это, правда, не является облигатным признаком) и характерную эозинофильную инфильтрацию слизистой респираторного тракта. Маркером этой болезни является гиперчувствительность к АСК и НПВП с проявлением симптомов астмы и/или ринита.
Типичным возрастом дебюта аспириновой астмы считается 20—40 лет. Аспириновая астма нередко бывает вариантом поздно возникшей БА. Для нее характерно персистирующее, недостаточно контролируемое течение с частыми обострениями, в т. ч. вирусоиндуцированными. При тяжелом течении может формироваться необратимая бронхиальная обструкции и стероидная зависимость, нередко в сочетании с атопией (до 70% случаев).
Диагностика NERD в рутинной практике достаточно проста: это анамнез БА, сочетающийся с выраженной патологией верхних дыхательных путей, а так же респираторные симптомы, обостряющиеся после применения АСК и/или НПВП. Используются рутинные лабораторные исследования: общий анализ крови, риноцитограмма, где выявляется эозинофилия. Риноскопия позволяет обнаружить гипертрофию слизистой полости носа или полипоз. Компьютерная томография носа и придаточных пазух выявляет гиперпластичность или полипозный риносинусит.
Предположение об аспириновой БА должно, конечно, возникать при всех случаях БА, сочетающейся с полипозным риносинуситом. В тоже время можно даже у больных с отсутствием полипозного риносинусита заподозрить формирование NERD, если течение БА становится неконтролируемым на фоне применения АСК и НПВП.
Диагностика гиперчувствительности к НПВП базируется в первую очередь на данных анамнеза. Провокационный тест (золотым стандартом является пероральный) применяется при наличии клинических признаков NERD, но отсутствии четких указаний в анамнезе на гиперчувствительность к аспирину и НПВП. Кожные пробы с АСК и НПВП не проводятся, т. к. механизм гиперчувствительности при NERD не является иммунологическим.
Лабораторная диагностика пока не получила широкого распространения, включая и тест активации базофилов, т. к. связана с недостаточной доказательной базой в отношении чувствительности, специфичности и воспроизводимости предлагаемых методов.
Принципы лечения NERD складываются из противовоспалительной терапии патологий верхних и нижних дыхательных путей, из исключения, а чаще ограничения триггеров, поддерживающих тканевое воспаление (АСК, НПВП, природные салицилаты), снижения чувствительности к аспирину и НПВП. В некоторых случаях имеются показания к десенситизации АСК, а так же новое направление — терапия биологическими препаратами.
Фармакотерапия аспириновой БА полностью соответствует принципам ступенчатого подхода к лечению астмы. И поскольку аспириновая астма — это чаще всего среднетяжелое, а в большей степени и тяжелое персистирующее течение, то лечению, как правило, соответствует 3—5 ступени по GINA. Это комбинации ингаляционных глюкокортикостероидов (ИГКС) и длительно действующих β2-агонистов (ДДБА) на всех ступенях. И если этого недостаточно, то прежде чем повышать дозы, усиливают терапию антилейкотриеновыми препаратами. На 5 ступени добавляют омализумаб и низкие дозы пероральных ГКС. Точки приложения действия противовоспалительных препаратов показаны на рисунке 3. Кортикостероиды прерывают всю цепочку метаболизма активации арахидоновой кислоты в самом начале. Ингибиторы 5-липоксигеназы в РФ не зарегистрированы, поэтому мы чаще всего пользуемся антагонистами цистеиниловых рецепторов лейкотриена. Это препараты, которые действуют в первую очередь в отношении рецепторов лейкотриена D4, в меньшей степени С4 и Е4. Антилейкотриеновые препараты (монтелукаст) применяются как для лечения астмы, так и для риносинусита. Однако они используются только в комбинации с кортикостероидами. Монотерапия антилейкотриеновыми препаратами не позволяет при NERD достичь полноценного контроля над сложными механизмами воспаления. В тоже время добавление монтелукаста к назальным кортикостероидам уменьшает частоту рецидивов полипоза носа после функциональной операции.
Новые направления в лечении NERD — целевая терапия. Используются моноклональные антитела к IgE (омализумаб). Рандомизированное двойное слепое плацебо-контролируемое исследование показало уменьшение выраженности симптомов риносинусита и астмы (блокада носа, ринорея, одышка), улучшение обоняния и качества жизни, уменьшение размера полипов (по данным компьютерной томографии). В другом – открытом исследовании, кроме улучшения клинико-функционального статуса было показано еще и повышение толерантности к АСК.
Что же касаемо моноклональных антител к IL-5 (меполизумаб), то по данным рандомизированного двойного слепого плацебо-контролируемого исследования отмечалось уменьшение симптомов полипозного риносинусита и размера самих полипов, а так же снижение эозинофилии в мокроте у больных.
На рисунке 4 представлены факторы риска обострений БА и развития фиксированной обструкции.
Следует сказать, что NERD является вариантом болезни, требующим особых подходов к диагностике и лечению. Далеко не всегда наблюдается типичная астматическая триада, что затрудняет диагностику. АСК и НПВП широко применяются в терапии многих заболеваний, поэтому гиподиагностика NERD способствует прогрессированию БА и может представлять угрозу для жизни пациента.
Элиминация АСК/НПВП и природных салицилатов не приводит к ремиссии, так как механизмы воспаления при аспириновой БА обусловлены влиянием многих факторов.
Для достижения контроля аспириновой БА необходима одновременная терапия воспаления верхних и нижних дыхательных путей, что в результате позволяет снизить суммарную суточную дозу кортикостероидов.
Контролируемые исследования показали, что доставка ИГКС и ДДБА в комбинированном ингаляторе так же эффективна, как и прием каждого препарата по отдельности (GINA 2014). Современные комбинированные препараты ИГКС/ДДБА улучшают клинико-функциональный статус и качество жизни большинства пациентов, в том числе с тяжелой аспириновой БА.
Результаты российских исследований показали быстрое достижение контролируемого течения БА с помощью комбинации формотерола и будесонида (препарат Форадил Комби) при БА средней степени тяжести и при тяжелой форме БА (рис. 5–6).
Оценка техники ингаляции и использование ингаляторов, которые обеспечивают надежную легочную депозицию, имеют важное значение в достижении контроля астмы (рис. 7).
При плохо контролируемой астме используется сначала бронходилататор, а потом через некоторое время кортикостероид, тогда вероятность попадания его в мелкие дыхательные пути увеличивается. Кроме того, очень удобно корректировать дозировку, изменяя ее от самых высоких доз ингаляционных стероидов до сочетания с ДДБА и постепенно снижая до низких доз монотерапии только одним будесонидом. Возможность использовать Форадил Комби таким образом послужила основанием называть его конструктором для лечения БА. При этом, конечно же, важно помнить, что для эффективного и безопасного применения Форадила Комби необходимо тщательное обучение пациента и постоянный контроль за правильным применением препарата.
Б.А. Черняк, доклад «Бронхиальная астма и хроническая обструктивная болезнь легких: синдром перекреста»:
Бронхиальная астма и хроническая обструктивная болезнь легких — сочетание этих двух заболеваний известно давно. Но проблема настолько значима, что два коллективных эксперта в области пульмонологии — GINA и GOLD — издали недавно документ, где рассматривается именно этот вопрос. Определение синдрома звучит так: синдром перекреста бронхиальной астмы и ХОБЛ (СПАХ) характеризуется постоянным ограничением воздушного потока и рядом симптомов, которые связаны с астмой, а также признаками, характерными для ХОБЛ. Соответственно СПАХ диагностируется при наличии клинических признаков, соответствующих как БА, так и ХОБЛ.
Это сочетание по данным разных авторов и в разных популяциях варьирует от 15 до 55%. Речь идет не просто о сочетании двух распространенных и тяжелых заболеваниях. Синдром взаимного отягощения приводит к более тяжелому течению заболевания, чем просто при БА или ХОБЛ:
• более частые обострения,
• более низкое качество жизни,
• более быстрое снижение функции легких,
• более высокая смертность,
• больший объем использования ресурсов здравоохранения.
Каковы клинические особенности синдрома перекреста? Обычно это пациент старше 40 лет (хотя в целом это категория больных моложе, чем при изолированной болезни легких) с клинико-функциональными параметрами ХОБЛ, у которых ранее диагностировалась БА. ХОБЛ при СПАХ развивается в более молодом возрасте, даже при меньшей продолжительности и интенсивности курения. Выделяют 2 фенотипа СПАХ: эозинофильный и нейтрофильный, которые различаются ответом на терапию ИГКС.
Синдромальный подход к диагнозу сочетания БА и ХОБЛ построен на том, что учитываются симптомы, характерные для астмы, и симптомы, характерные для ХОБЛ (рис. 8). Если имеются более чем три симптома, характерных для астмы, и 3 и более, характерных для ХОБЛ, то, как правило, этого достаточно, чтобы весьма обоснованно заподозрить сочетание этих заболеваний и синдром перекреста БА и ХОБЛ.
Когда речь идет о СПАХ, то образ больного может быть следующим: во-первых, возраст начала, как я уже сказал, обычно ≥40 лет, но может быть дебют и ранее. Во-вторых, характер респираторных симптомов, в т. ч. одышки при физической нагрузке: эти симптомы постоянные, но сочетаются с выраженной вариабельностью. Функция легких: ограничение воздушного потока не полностью обратимо, но опять же имеется вариабельность. Вне обострений наблюдается постоянное ограничение воздушного потока (ОФВ1/ФЖЕЛ <0,7). В анамнезе заболевания, в семейном анамнезе часто ранее диагностированная БА, аллергия и/или вредные воздействия. Заболевание протекает с типичным прогрессированием и имеет высокую потребность в лечении. При этом даже на фоне терапии симптомы уменьшаются не полностью. Обострения могут быть частыми, но уменьшаются на фоне лечения. Сопутствующие заболевания способствуют ухудшению течения СПАХ. Лучевая диагностика проводится так же, как и при ХОБЛ. При исследовании мокроты обнаруживаются эозинофилы и/или нейтрофилы.
На что следует обращать внимание из дополнительной диагностики? Еще до недавнего времени показатель бронхиальной гиперреактивности позиционировался как своего рода «водораздел» между БА и ХОБЛ. Бронхиальная гиперреактивность считалась признаком БА и была нехарактерна для ХОБЛ. На самом деле в последние годы стало ясно, что этот показатель не имеет диагностического значения. Просто при БА показатель бронихиальной гиперреактивности выше. Бронхиальная гиперреактивность имеет место почти в 90% случаев при ХОБЛ!
Актуальным при СПАХ является компьютерно-томографическое исследование высокого разрешения. Оно позволяет подчеркнуть, что имеет место не просто гиперинфляция легких, которая может отмечаться у больных астмой, не просто повышенная воздушность, а признаки эмфизематозных изменений. На рисунке 9 представлены методы дополнительного обследования.
Диагноз СПАХ строится на обнаружении клинических признаков и БА, и ХОБЛ, которые мы подтверждаем необратимостью бронхиальной обструкции и наличием (если имеются) признаков эмфиземы. Точно так же строится и терапия — на тех основаниях, которые есть для БА и для ХОБЛ.
Базисная фармакотерапия, включающая сочетание ИГКС с длительно действующими бронходилататорами (ДДБА, ДДмХБ или ДДБА + ДДмХБ). Если мы при БА можем в некоторых случаях проводить монотерапию ИГКС, то у пациентов с синдромом перекреста не должна проводиться монотерапия ИГКС или бронходилататорами. Всегда ИГКС должны сочетаться с длительно действующими бронходилататорами.
Другие важные стратегии лечения:
— отказ от курения,
— легочная реабилитация,
— вакцинация,
— лечение сопутствующих заболеваний.
Поскольку синдром перекреста отличается от «чистой», изолированной БА тем, что там присутствует ХОБЛ, программа реабилитации имеет чрезвычайно важное значение, нередко не менее значимое, чем фармакотерапия.Для успеха реабилитационных программ при ХОБЛ важное значение имеет адекватная медикаментозная терапия. В исследованиях было показано положительное влияние комбинации формотерола/будесонида на переносимость физической нагрузки и уровень одышки.
Еще один важный аспект – бронхопротективный эффект длительно действующих бронхолитиков. Обычно мы говорим о бронходилатирующих эффектах как об очень значимых. Но важна роль препарата и в профилактике возникновения бронхоконстрикции под воздействием различных факторов внешней среды. Длительно действующим бета-2-агонистам (ДДБА) и длительно действующим холинолитикам (ДДХЛ) отдается предпочтение в терапии таких пациентов.
Следует сказать несколько слов про использование холинергических препаратов при ХОБЛ, синдроме перекреста и при БА. Есть схема — участие парасимпатических нервных систем в БА и ХОБЛ, которую приводит в своих работах профессор Барнес (рис. 10). Здесь показана не только роль парасимпатической нервной системы в формировании повышенного тонуса парасимпатикуса и при бронхоспазме, но и то, что холинергические рецепторы, являются воспринимающим рецепторным полем для разных ирритарных воздействий, что ведет еще к более мощному формированию аксон-рефлекса с выбросом ацетилхолина и последующим каскадом реакций. С этим связаны предпосылки к использованию антихолинергических препаратов при бронхообструктивной патологии:
• Холинергические механизмы участвуют в патогенезе ХОБЛ, БА, СПАХ
• Влияние на ФВД (бронходилатация, снижение гиперинфляции)
• Снижают бронхиальную гиперреактивность и оказывают бронхопротективный эффект (метахолиновая бронхоконстрикция, β-блокаторы)
• Регулярное использование уменьшает гипертрофию гладких мышц дыхательных путей (профилактика ремоделирования бронхов и вторичной бронхиальной гиперреактивности)
• Уменьшение холинергически-опосредованной секреции слизи и ингибирование гиперплазии бокаловидных клеток и слизистых желез
• Снижение нейтрофильного ответа в нижних дыхательных путях
• Снижение экспрессии провоспалительных генов в гладких мышцах дыхательных путей и бронхиального эпителия
• Оказывает стероид-спаринг эффект у больных БА
Напоминаю вам в связи с этим о препарате гликопирроний (Сибри), который выпускается и используется с помощью ингалятора Бризхалер. Бронходилатационный эффект у Сибри сохраняется через 24 часа. Прием гликопиррония на протяжении года улучшает ОФВ1, снижается частота обострений, увеличивается время переносимости физических нагрузок. Кроме того, Сибри, как и Форадил, обладает бронхопротективным эффектом.
В заключение хочется сказать несколько слов о средствах доставки препаратов. Мало создать хорошую молекулу — нужно суметь эффективно доставить ее в дыхательные пути. Два ингалятора — порошковый и аэрозольный, бризхалер и аэролайзер — отличаются, во-первых, наличием низкого сопротивления, что важно для реализации хорошего вдоха. Ингаляторы с низким сопротивлением позволяют пациенту произвести эффективный маневр дыхания. Это приводит к тому, что депозиция легочной ткани возрастает существенно, а нелегочной — уменьшается. Значит, улучшается профиль безопасности.
Кроме того, важна возможность контроля пациентами своих действий. В данном случае при использовании этих ингаляторов пациенты:
• слышат, как вращается капсула при вдохе,
• чувствуют сладковатый привкус препарата (как при ингаляции формотерола, так и будесонида),
• видят насколько опорожнилась капсула после вдоха (при необходимости можно повторить вдох).
Таким образом, пациенты полностью контролируют процесс ингаляции.
Основным принципом лечения больных астмой при СПАХ остается ступенчатый подход: увеличивается объем терапии при снижении контроля или наличии факторов риска обострений, уменьшается — при достижении и сохранении приемлемого контроля заболевания в каждом конкретном случае.
Комбинация будесонид/формотерол в сочетании с ДДмХБ (и в частности, с гликопирронием) является эффективным выбором при ведении больных БА и ХОБЛ (СПАХ).
Гость симпозиума – сотрудник университетской клиники им. К.Г. Каруса (г. Дрезден, Германия), профессор Герт Хёффкен выступил с докладом «Опыт ведения пациентов с астмой в Германии»:
Как и во всем мире, врачи в Германии используют стандарты GINA. Однако у нас есть свои национальные рекомендации, которые немного отличаются от международных. Например, у нас используется всего 4 ступени терапии БА, а не пять. 4 и 5 ступени объединены в одно целое. И препараты тиотропия, согласно нашим рекомендациям, назначаются уже на 4 ступени терапии.
Рациональное мышление, принципами которого мы, конечно же, руководствуемся при лечении пациентов, это, во-первых, определение фенотипа БА. Эндотип определить сложнее — это более экспериментальный подход, но фенотипы (ТН-2 опосредованная астма или ТН-1) определяются обязательно. Используются биомаркеры — такие как уровень IgE, уровень эозинофилов, измеряется уровень оксида азота в выдыхаемом воздухе, проводятся тесты по переостину. Но, насколько мне известно, в России они не зарегистрированы.
Во-вторых, естественно проводится сбор анамнеза, выявление триггеров и патогенов, определение гиперчувствительности. Требуется объяснить пациенту, в чем конкретно заключается его заболевание, что его провоцирует. У нас есть масса образовательных материалов, которые мы используем в общении с нашими больными.
Терапия БА начинается с ингаляционных кортикостероидов. ИГКС – краеугольный камень в терапии БА, особенно в комбинации с ДДБА. Мы имеем широкий выбор ингаляционных кортикостероидов. Но какого-то определенного препарата, указываемого в национальных рекомендациях, нет. Мы используем наиболее часто комбинацию из будесонида и формотерола или флутиказона с сальметеролом. Лично я предпочитаю первый вариант. Хочу сказать, что я полностью согласен с российскими коллегами: наличие одного прибора для доставки двух препаратов — один ингалятор с двумя компонентами — предпочтительнее двух разных. Ведь мы не должны забывать об удобстве для пациентов. Поэтому мы придерживаемся подхода комбинирования в одном устройстве двух компонентов. На рисунке 11 вы можете посмотреть результаты исследования «Фиксированные комбинации ИГКС/ДДБА vs монокомпоненты в 2 ингаляторах: взгляд пациентов», проведенного в 2013 г.
Реальная жизнь, как в Германии, так и в России, и во всем мире, естественно, отличается от того, что написано в рекомендациях экспертного заключения. Число пациентов с полностью контролируемой астмой или частично контролируемой составляет около 50% от общего количества страдающих этим заболеванием (рис. 12). Исследование, проведенное в Германии несколько лет назад с участием 483 тыс. пациентов, показало, что обеспеченность необходимыми препаратами (даже для базисной терапии), к сожалению, все еще невысокая. Кто-то из пациентов получает только КДБА, кто-то ДДБА как монотерапию, но это, конечно, неправильно. Вот почему такие мероприятия действительно важны для нас, чтобы мы могли услышать друг друга и обменяться опытом.
Запись симпозиума: Маргарита Полякова
Ступенчатое лечение бронхиальной астмы — Когда дома больной — Каталог статей
Понятие и клиническая картина бронхиальной астмы: спазм гладкой мускулатуры бронхов, отек слизистой, образование вязкого трудноотделяемого секрета, склеротический процесс в бронхах. Принципы лечения и профилактики данного заболевания, проведение терапии.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Подобные документы
Ступени терапии бронхиальной астмы. Интермиттирующее, легкое персистирующее течение заболевания, его тяжелая и средней тяжести форма. Клиническая картина заболевания до лечения. Назначение ежедневной лекарственной терапии для контроля над симптомами.
презентация , добавлен 28.11.2013
Понятие, причины, признаки бронхиальной астмы. Этиология, патогенез, клиническая картина данного заболевания. Обзор и характеристика методов немедикаментозного лечения бронхиальной астмы. Исследование влияния здорового образа жизни на состояние больного.
курсовая работа , добавлен 19.12.2015
Клиническая картина бронхиальной астмы, основные цели и ступени ее лечения. Причины обострения средней тяжести, способы восстановления контроля над течением болезни. Жизнеугрожающие признаки тяжелого приступа астмы, действие системных глюкокортикоидов.
презентация , добавлен 17.02.2013
Хроническое аллергическое воспаление бронхов. Основные причины тяжелого течения и смертности от астмы. Основные цели и задачи терапии бронхиальной астмы у детей. Базисная терапия бронхиальной астмы у детей. Основные препараты группы b2-агонистов.
Ступенчатый подход в лечении
Внимание! Информация представлена
исключительно в ознакомительных целях.
Бронхиальная астма является серьезной проблемой современного общества. Люди всех возрастов во всем мире страдают этим хроническим заболеванием дыхательных путей. Сейчас практически невозможно найти человека, который бы не слышал об этом заболевании.
Антитела к IgE
Подробнее о том, что является «высокой» или «низкой» дозой можно прочитать здесь Ссылка.
Например, на первой ступени достаточно применять только адреномиметик быстрого действия. Если этого оказывается недостаточно, то нужно перейти на вторую ступень — добавить либо ингаляционный ГКС в низкой дозе, либо антилейкотриеновый препарат
У большинства пациентов с симптомами персистирующей астмы, лечение начинают со 2 ступени. Однако если при первичном осмотре симптомы указывают на отсутствие контроля над астмой, то лечение необходимо начинать с третьей ступени.
Если терапия, которую получает пациент, оказывается малоэффективной, то нужно перейти на ступень выше . И наоборот, если в течении 3 месяцев сохраняется хороший контроль над бронхиальной астмой, то можно перейти на ступень ниже .
Для лечения бронхиальной астмы в соответствии с международным стандартом можно обратиться сюда
Задачей врача является определение у каждого отдельного пациента текущего уровня терапии и уровня контроля над астмой. Это дает возможность подбирать лечение бронхиальной астмы индивидуально для каждого пациента. Ведь даже у людей с одинаковым диагнозом и одинаковыми клиническими проявлениями один и тот же препарат показывает разную эффективность.
4.2. Ступенчатая терапия бронхиальной астмы у детей, подростков и взрослых
Каждая ступень включает варианты терапии, которые могут служить альтернативами при выборе поддерживающей терапии БА, хотя и не являются одинаковыми по эффективности .
У большинства больных с симптомами персистирующей БА, не получавших терапии, следует начинать лечение со ступени 2. Если симптомы БА при первичном осмотре указывают на отсутствие контроля , лечение необходимо начинать со ступени 3 .
Если лечение неэффективно или ответ на него недостаточен, проверьте технику ингаляции, соблюдение назначений, уточните диагноз и оцените сопутствующие заболевания.
Обучение пациента и контроль над факторами окружающей среды являются важными составляющими эффективной терапии.
При принятии решения, какой препарат снижать первым и с какой скоростью, должны быть приняты во внимание тяжесть астмы, побочные эффекты лечения, продолжительность приема текущей дозы, достигнутый положительный эффект и предпочтения пациента.
Снижение дозы ингаляционных стероидов должно быть медленным в связи с возможностью развития обострения. При достаточном контроле возможно снижение дозы каждые три месяца, примерно от 25% до 50%.
Схема ступенчатой терапии БА приводится на рис. 2.
Рис. 2. Ступенчатая терапия бронхиальной астмы
Увеличивайте объем терапии до улучшения контроля
Уменьшайте объем терапии до минимального, поддерживающего контроль
Дополнительные средства поддерживающей терапии
β2-агонист короткого действия по потребности
Комбинация β2-агониста короткого действия и ипратропия бромида
Легкая интермиттирующая астма
СТУПЕНЧАТЫЙ ПОДХОД К ТЕРАПИИ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Противорецидивная терапия при бронхиальной астме у детей направлена на достижение и поддержание устойчивой ремиссии, при этом ее тактика определяется тяжестью течения болезни. Основу противорецидивного лечения составляет противовоспалительная терапия.
У детей с легким течением бронхиальной астмы противорецидивная терапия проводится кромогликатом или недокромилом натрия. В случае возникновения приступов бронхиальной астмы назначают эпизодически ингаляционные бета-2-агонисты. У больных с неустойчивым по бронхиальной астме состоянием эффективным может оказаться сочетанное лечение этими препаратами
.
У детей с бронхиальной астмой средне-тяжелого течения лечение начинают с назначения кромогликата или недокромила натрия и подключения в случае возникновения приступа бета-2-агонистов. В случаях возникновения ночных приступов бронхиальной астмы проводимая терапия может быть дополнена назначением пролонгированных теофиллинов или симпатомиметиков. Клиническая ремиссия у больных со средне-тяжелым течением бронхиальной астмы может быть достигнута и лечением комбинированными препаратами . В случаях, когда проводимая таким образом терапия оказывается неэффективной, присоединяют лечение ингаляционными кортикостероидами .
У детей с тяжелым течением бронхиальной астмы комплекс терапевтических мероприятий, включает ингаляционные кортикостероиды , нередко в комбинации с ингаляционными пролонгированными бета-2-агонистами или препаратами Теофиллина длительного действия, антихолинергическими препаратами. Перорально кортикостероиды назначают в случае неэффективности ингаляционных форм. В течение 5-7 дней назначают преднизолон в суточной дозе 1-2 мг/кг, затем проводится снижение дозы преднизолона и постепенная его отмена с переходом на ИКС.
Рис. 7-7 СТУПЕНЧАТЫЙ ПОДХОД К БАЗИСНОМУ ЛЕЧЕНИЮ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Как проводится ступенчатое лечение бронхиальной астмы
Сама по себе астма является болезнью, которая при недостаточном или неэффективном лечении сильно усложняет повседневную жизнь больного, а иногда и приводит даже к смерти. Поэтому лечение этого заболевания включает прием таблеток и антибиотиков, разных растворов и сиропов, а также различные виды ингаляторов.
Часто можно встретить на рекламных плакатах предлагаемые препараты против болезни, о которых говорится что они самые эффективные. Но который из них выбрать, чтобы еще больше не ухудшить положение. Какой из них на самом деле сможет помочь? Как же разобраться во всех препаратах и при этом не сделать ошибки? Для того чтобы выбрать правильный препарат ведущие светила медицины разработали ступенчатое лечение бронхиальной астмы. Ступеней лечения пять.
В первую начальную ступень входит самое минимальное лечение, в отличие от нее пятая ступень заключается в самом сильном лечении с помощью сильнодействующих препаратов. Если на первой ступени для лечения не достаточно приема адреномиметика быстрого действия, то приступают к лечению второй ступенью, которая влючает, еще и прием ингаляционного ГКС или прием антилейкотриенового препарата.
С чего начинают ступенчатое лечение бронхиальной астмы
Чаще всего лечение астмы начинается со второй ступени, но если на первом осмотре становится, очевидно, что контроль над болезнью полностью утрачен, назначают лечение с третьей ступени. Если лечение третьей ступени малоэффективно и практически не дает результата, приступают к лечению четвертой ступенью. Если же результат становится заметным уже по прошествии пары месяцев лечения, то лечение заболевания понижают на вторую ступеньку.
Для назначения ступенчатого лечения врач должен провести осмотр больного и только тогда назначать лечение конкретной ступенью. Для отдельного пациента лечение назначается индивидуально исходя из протекания бронхиальной астмы. Ведь препараты не всегда подходят людям с одинаковыми диагнозами, поэтому задача врача заключается в правильном диагнозе, подборе ступени лечения и выборе конкретных препаратов индивидуально для каждого больного.
Лечение больных астмой — Бронхиальная астма
Страница 8 из 8
Лечение больных астмой проводится длительно, как правило, пожизненно. При этом надо помнить, что медикаментозная терапия не заменяет меры по предотвращению контакта больного с аллергенами и ирритантами. Подход к лечению конкретного больного зависит от его состояния и той цели, которая стоит на данный момент перед врачом. На практике необходимо разграничивать следующие варианты терапии:
- купирование приступа;
- лечение обострения;
- базисная противорецидивная терапия;
- лечение астматического статуса.
Для купирования приступа астмы используются бронхорасширяющие средства , которые применяются самостоятельно пациентом ситуационно в виде дозированного аэрозольного устройства или медицинским персоналом через небулайзер .
Для лечения обострения рекомендуется подход «step down» – согласно схеме ступенчатого подхода к лечению астмы.
Базисная противорецидивная терапия осуществляется путем регулярного применения поддерживающей дозы противовоспалительных лекарственных средств, наиболее эффективными из которых являются ингаляционные глюкокортикоиды .
Лечение астматического статуса проводится с использованием высоких доз системных глюкокортикоидов внутривенно и бронхолитиков при коррекции кислотно-основного обмена и газового состава крови с помощью медикаментозных и немедикаментозных средств.
Схема ступенчатого подхода к лечению астмы существенно облегчает задачу врача и сводит к минимуму тактические ошибки ведения больного.
СХЕМА СТУПЕНЧАТОГО ПОДХОДА, НАПРАВЛЕННОГО НА ДОСТИЖЕНИЕ И ПОДДЕРЖАНИЕ КОНТРОЛЯ АСТМЫ.
На всех этапах терапии для купирования острой симптоматики следует применять ингаляционный b2-агонист быстрого действия*, но не чаще 3-4 раз/день.
Бронхиальная астма
При астме возможно возникновение внезапных приступов удушья, что характеризуется чёткими и затруднёнными увеличениями фазы выдоха.
Хронический тонзиллит
Продолжительная болезнь, где очагом инфекции выступают нёбные миндалины, вызывающие воспалительный процесс хронического характера.
Хроническое заболевание, при котором дилатация сосудов носовых раковин или назальная гиперактивность развиваются под воздействием неспецифических экзогенных или эндогенных факторов.
Полипы носа
Полипы в носу есть не что иное, как разрастания при воспалении околоносовых пазух или слизистой носа. Таким отклонением страдают 1-5% людей, полипы носа встречаются главным образом у мужчин взрослого возраста. Лечение носовых полипов без операции
Увеличенная носоглоточная миндалина, вызывающая затруднения носового дыхания, храпа, снижения слуха, а также других расстройств в детском возрасте. Лечение аденоидов без операции
В зависимости от формы представляет острое или хроническое воспаление верхнечелюстной пазухи. Название заболевания происходит от названия пазухи, в которой протекает болезнь.
Аллергия представляет собой необычную реакцию организма на действие разных факторов из внешнего окружения.
Источники: knowledge.allbest.ru, immunoterapia.ru, www.studfiles.ru, www.komkon.org, bronhialnaya-astma.com, lekmed.ru, lor-astma.ru
Режимы приема лекарств для лечения стабильной астмы
Abstract
Ведение астмы на основе руководств было разработано как средство стандартизации методов лечения астмы и улучшения результатов. Руководящие принципы Национальной программы обучения и профилактики астмы и Глобальной инициативы по астме содержат рекомендации для медицинских работников по рутинному ведению астмы. Быстро развивались новые методы лечения астмы, особенно с появлением новых устройств для доставки лекарств и биологических методов лечения тяжелой астмы.Мы все больше осознаем, что астма — это гетерогенное заболевание с разнообразной патофизиологией, и поэтому медицинским работникам необходимо начать понимать фенотипы и эндотипы астмы, а также значение этих классификаций для лечения, особенно тяжелой рефрактерной астмы. Эта статья представляет собой обзор терапии астмы, основанной на рекомендациях, и включает обновленную информацию об альтернативных методах лечения, новых подходах, в которых используются ранее признанные методы лечения, и особых группах пациентов с астмой.
Введение
Астма — гетерогенное заболевание, которое характеризуется как воспалением, так и гиперчувствительностью дыхательных путей. Астма поражает миллионы взрослых и детей во всем мире и связана со значительной степенью заболеваемости. Ведение астмы на основе руководящих принципов рекомендуется с 1990-х годов как средство стандартизации лечения астмы для всех возрастных категорий и как способ обобщения наилучших имеющихся данных по ведению астмы. Руководящие принципы Национальной программы обучения и профилактики астмы 1 (NAEPP) и Глобальной инициативы по борьбе с астмой 2 (GINA) предназначены для того, чтобы предоставить медицинским работникам инструменты, помогающие контролировать астму, с конкретными рекомендациями по выбору начальных методов лечения и систематической оценке реакции , и корректировка терапии в зависимости от индивидуальной реакции на лекарства.
Рекомендации NAEPP 1 последний раз обновлялись в 2007 году и включали ключевое изменение в приоритетах лечения астмы. Рекомендации NAEPP 2007 1 сместились с рекомендаций по лечению астмы, основанных на степени тяжести, к рекомендациям, направленным на достижение оптимального контроля астмы независимо от основной степени тяжести. Тяжесть астмы — неотъемлемая черта болезни, и все шире признается, что тяжесть не всегда можно изменить; однако контроль астмы можно оптимизировать независимо от серьезности заболевания.В соответствии с рекомендациями NAEPP, 1 хороший контроль для пациентов старше 12 лет включает следующее: симптомы астмы ≤2 дней в неделю, ночные пробуждения ≤2 раза в месяц, использование β-агонистов короткого действия 2 (SABA) ≤2 дней в неделю, отсутствие влияния на нормальную активность и прогнозируемый ОФВ 1 ≥80%.
Текущие рекомендации 1,2 рекомендуют систематические подходы к определению степени симптомов астмы, а затем к оценке нарушений, вызванных этими симптомами, с помощью стандартных вопросников, таких как Контрольный тест на астму и Контрольный опросник астмы.Эти инструменты можно вводить во время визитов к врачу, и корректировать терапию можно в зависимости от степени, в которой астма у отдельного пациента контролируется или неконтролируется. Рекомендации GINA 2 (2017) включали добавление новых методов лечения астмы, которых не было в предыдущих рекомендациях, в том числе использование таргетной терапии тиотропием и анти-интерлейкином-5. Оба руководства согласуются с рекомендацией о том, что противовоспалительная терапия на основе кортикостероидов является базовым лечением для всех пациентов с астмой с добавлением бронходилататоров (как кратковременного, так и длительного действия), антагонистов лейкотриена и целевой биологической терапии в качестве вспомогательной терапии, если Контроль астмы не достигается. 1,2 В этой статье дается обзор текущих рекомендаций и подходов к лечению в соответствии с действующими руководящими принципами и предлагается, чтобы лечение, как сейчас, так и в будущем, также основывалось на рассмотрении фенотипов и эндотипов, связанных с астмой человека. Эти классификации могут существенно повлиять на лечение астмы, особенно рефрактерной астмы. 1,2
Фенотипы и эндотипы астмы
Астма — это гетерогенное заболевание, состоящее из комбинации симптомов, воспаления и нарушений функции легких.Однако все чаще признается, что различные патофизиологические механизмы приводят к проявлению симптомов астмы. Фенотипы определяются как наблюдаемые свойства организма, которые возникают в результате взаимодействия генотипа и окружающей среды. Предполагается, что эндотип представляет собой подтип состояния, определяемого отдельным патофизиологическим механизмом. 3 Например, эозинофильная астма является фенотипом, но эндотипом будет эозинофильная астма с поздним началом, вызванная интерлейкином-5.Ранее считалось, что первичным воспалительным медиатором астмы является лежащее в основе аллергическое и эозинофильное воспаление, что привело к рекомендации, что ингаляционные стероиды должны быть краеугольным камнем терапии стойкой астмы.
Теперь мы понимаем, что большая часть пациентов с астмой (до 50% пациентов с астмой легкой и средней степени) не имеет основного эозинофильного воспаления, что делает маловероятным ответ на ингаляционные стероиды. 4–6 Это указывает на то, что значительное число пациентов получит больший эффект от начальной терапии бронходилататорами, таких как монотерапия мускариновыми антагонистами длительного действия, или от использования альтернативных противовоспалительных методов лечения, таких как теофиллин, рофлумиласт или модификаторы лейкотриена.Хотя доказательств, подтверждающих альтернативные подходы, растет, еще слишком рано вносить изменения в рекомендации по лечению астмы. Тот факт, что пациенты могут получать лечение, которое является дорогостоящим и маловероятным, что оно принесет пользу, подчеркивает важность правильного определения фенотипов астмы, особенно при тяжелой астме, когда можно назначать таргетную терапию.
Ключевым препятствием для правильной идентификации фенотипов и эндотипов астмы в клинических условиях является невозможность доступа к легкодоступному клиническому тесту, который точно классифицирует тип воспаления, присутствующего в легких у пациентов с астмой.Мокрота остается общепринятым стандартом для определения присутствия эозинофилов и нейтрофилов в легких у пациентов с астмой, но, за некоторыми исключениями, анализ мокроты остается инструментом исследования, и многие центры не имеют возможности проводить дифференциальный подсчет клеток мокроты у пациентов. при астме как средство лечения. До тех пор, пока эти проблемы не будут решены и не будут собраны дополнительные доказательства для принятия медицинских решений, мало шансов, что индивидуализированная медицина в лечении астмы будет полностью реализована.Разрабатываются альтернативные подходы, помогающие идентифицировать фенотипы и эндотипы астмы, включая использование протеомики на основе мокроты; носовые щетки; транскриптомика; и суррогатные измерения воспаления, такие как фракция выдыхаемого оксида азота, эозинофилов в крови и сывороточного иммуноглобулина E. Большинство этих маркеров требуют дополнительной проверки перед широким использованием. Ближе всего к персонализированной медицине астмы мы подошли к тяжелой астме, при которой назначают таргетную биологическую терапию на основе сывороточного иммуноглобулина Е (омализумаб) и периферических эозинофилов (реслизумаб, меполизумаб и бенрализумаб).Фенотипирование имеет решающее значение в лечении тяжелой астмы, и клиницисты должны серьезно подумать о том, чтобы включить его в повседневную практику в настоящее время. 7,8
Обзор поэтапного подхода к лечению стабильной астмы
Руководства NAEPP и GINA 1,2 основаны на поэтапном подходе к лечению симптомов астмы. Рекомендации NAEPP 1 включают 6 шагов в зависимости от степени тяжести астмы, которая определяется на основе нарушений функции легких, обострений и использования лекарств (рис.1). Астма 1-го этапа протекает в легкой форме с перерывами и обычно требует бронхолитической терапии «по мере необходимости»; 2-я стадия астмы сопровождается более стойкими симптомами, но продолжает ассоциироваться с нормальной функцией легких. 1 Устойчивые симптомы требуют добавления ежедневных терапий, направленных на уменьшение этих симптомов, которые включают низкие дозы ингаляционных стероидов или антагонистов теофиллина или лейкотриена. 1 По мере увеличения количества шагов астма у пациента характеризуется более стойкими симптомами и нарушениями функции легких с повышенной вероятностью обострений, ночных симптомов, ежедневных симптомов и использования бронходилататоров для спасения (шаги 3, 4) . 1
Рис. 1.Национальная программа обучения и профилактики астмы, пошаговый подход к лечению астмы у пациентов старше 12 лет. ICS = ингаляционный кортикостероид; LABA = β-агонист длительного действия; SABA = β-агонист короткого действия; LTRA = антагонист лейкотриеновых рецепторов; PRN = прописывается по мере необходимости. Из ссылки 1, с разрешения.
По мере обострения астмы дозы ингаляционных стероидов увеличиваются, и рекомендуется добавлять поддерживающую терапию бронходилататорами. В рекомендациях NAEPP, 1 рекомендуется бронходилататор, являющийся β-агонистом длительного действия (LABA), хотя имеется значительное количество доказательств в поддержку использования тиотропия в качестве альтернативы LABA или в качестве дополнительной терапии.Данные о тиотропиуме будут обсуждаться далее в разделе этой статьи — мускариновые антагонисты длительного действия (антихолинергические препараты длительного действия). Астма 5 и 6 стадий является тяжелой, стойкой и часто невосприимчивой к ингаляционным стероидам и бронходилататорам по отдельности. 1 Эти пациенты несут самое тяжелое бремя астмы, а также имеют самый высокий риск неблагоприятных исходов. У этих пациентов, у которых астма не контролируется высокими дозами ингаляционных стероидов и LABA, есть несколько альтернатив, включая использование тиотропия, биологическую терапию, направленную на интерлейкин-5 и иммуноглобулин E, и бронхиальную термопластику.
В руководстве GINA 2 используется аналогичный пошаговый подход к лечению астмы, и в рекомендации включены 5 шагов (рис. 2). Пациентам на этапе 1 требуется прерывистая терапия с учетом добавления ежедневной поддерживающей терапии, если есть стойкие симптомы, которые остаются неконтролируемыми; на этапе 2 терапии добавление поддерживающих ингаляционных стероидов важно для достижения контроля над астмой. 2 Этапы 3 и 4 требуют добавления поддерживающих бронходилататоров с увеличивающимися дозами ингаляционных стероидов, а этап 5 включает тяжелую астму, и этим пациентам могут потребоваться пероральные кортикостероиды и биологическая терапия в дополнение к их ингаляционной комбинированной терапии. 2 В отличие от рекомендаций NAEPP, 1 , рекомендации GINA 2 включают использование тиотропия на этапах 4 и 5 астмы как средство достижения контроля над астмой. Кроме того, включено использование ингаляционных стероидов и / или LABA-терапии для спасения. Руководства GINA 2 рекомендуют континуум, охватывающий оценку пациентов, корректировку терапии, анализ ответа и повторную оценку пациентов, чтобы определить, требуются ли дальнейшие корректировки. Кроме того, рекомендуется соблюдение режима лечения, переносимость лекарств, лечение сопутствующих заболеваний и сопутствующие факторы.Интересно, что последние рекомендации GINA 2 включают использование сублингвальной иммунотерапии для целевой группы пациентов с аллергическим ринитом, обострениями, прогнозируемым ОФВ 1 > 70% и чувствительностью к аллергенам клещей домашней пыли (рис. 2).
Рис. 2.Global Initiative for Asthma Пошаговый подход к контролю симптомов астмы и снижению риска. ICS = ингаляционный кортикостероид; LABA = β-агонист длительного действия; OCS = пероральный кортикостероид; SLIT = сублингвальная иммунотерапия; HDM = клещ домашней пыли.Из ссылки 2, с разрешения.
Рис. 3.Предлагаемый индивидуальный подход к лечению астмы. SABA = β-агонист короткого действия; ICS = ингаляционный кортикостероид; LABA = β-агонист длительного действия; LTRA = антагонист лейкотриеновых рецепторов.
Оценка способствующих факторов
Для достижения оптимального контроля в ведение пациентов с астмой необходимо включить всесторонний подход к смягчению способствующих факторов. На всех этапах лечения астмы обязательно оценивать сопутствующие заболевания, такие как гастроэзофагеальная рефлюксная болезнь, аллергический ринит и атопия, заболевание носовых пазух, апноэ во сне, дисфункция голосовых связок и ожирение.Кроме того, важно контролировать воздействие окружающей среды и / или триггеры, употребление табака и раздражители.
Наблюдение за астмой, оценка приверженности и обучение имеют важное значение для исходов астмы
В руководстве рекомендуется оценивать пациентов путем получения исходных измерений функции легких и установления уровня контроля астмы, управления сопутствующими факторами и сопутствующими состояниями, а затем внесением корректировок в терапия по показаниям. 1,2 Пациенты должны затем наблюдаться с трехмесячными интервалами, чтобы определить, достигнут ли контроль астмы и есть ли возможности либо для дальнейшей оптимизации терапии, либо для постепенного снижения лечения.Конечная цель — определить правильное количество лекарств, необходимых для достижения контроля, не подвергая пациентов рискам, связанным с использованием излишне высоких доз или чрезмерного количества лекарств.
Еще одна ключевая проблема, которую необходимо решить, — это образование по астме и повышение санитарной грамотности пациентов с астмой. Практикующие врачи должны следить за тем, чтобы пациенты соблюдали режим лечения астмы, и крайне важно не только выявлять несоблюдение режима лечения, но и решать проблемы, которые вызывают несоблюдение, чтобы улучшить приверженность и, следовательно, результаты лечения астмы.Сложные вопросы соблюдения режима лечения рассматриваются в статье «Вопросы соблюдения пациентом режима лечения» в этом выпуске журнала.
По мере того, как ситуация с ингаляционной терапией и уровнем комфорта в отношении устройств, используемых для доставки лекарств, становится все более сложным, пробелы в знаниях пациентов, поставщиков медицинских услуг и медицинских бригад вызывают дополнительную озабоченность. В настоящее время на рынке представлено несколько устройств, включая Respimat (Boehringer Ingelheim, Германия), ингалятор для сухого порошка, дозирующий ингалятор под давлением, устройства Diskus и Ellipta, каждое из которых имеет уникальный подход к срабатыванию, заливке и введению.Неправильная техника использования этих устройств является распространенной проблемой и приводит к плохой доставке лекарств и предсказуемо плохой реакции на лечение. Необходимо добиться прогресса в обучении пациентов правильному использованию прописанных им устройств для улучшения исходов астмы. Занятому практикующему врачу часто бывает сложно обратиться к преподаванию ингаляторов, но это должно быть ключевым компонентом любой программы лечения астмы.
Новые подходы к ведению стабильной астмы
Прерывистое дозирование контролирующих терапий при астме
Руководящие принципы рекомендуют регулярное, а не прерывистое использование долгосрочных контроллеров (ингаляционные стероиды и бронходилататоры длительного действия) у пациентов с устойчивой астмой. 1,2 Однако растет интерес к прерывистому дозированию контролирующих лекарств. В недавнем исследовании периодическое использование альбутерола короткого действия в сочетании с ингаляционными стероидами было связано с такой же частотой обострений астмы, что и регулярное использование беклометазона или комбинированной терапии (альбутерол-беклометазон) у пациентов с легкой персистирующей астмой. 9 Кроме того, в этом исследовании регулярное использование ингаляционной стероидной терапии не имело дополнительных преимуществ по сравнению с периодическим «по мере необходимости» в отношении уменьшения обострений астмы, что требовало пероральных стероидов у взрослых и детей с постоянной астмой. 10 Регулярное использование ингаляционных стероидов привело к улучшению контроля над астмой и уменьшению количества дней без симптомов. Однако это не дало дополнительных преимуществ в отношении FEV 1 , качества жизни, гиперреактивности дыхательных путей, побочных эффектов, госпитализаций и посещений отделений неотложной помощи по поводу астмы. 10 На основании имеющихся данных клиницисты могут рассмотреть возможность использования прерывистой ингаляционной терапии стероидами или комбинированной терапии у тщательно отобранных пациентов с легкой персистирующей астмой.
Альтернативные лекарства для лечения астмы
Использование бронходилататоров и ингаляционных кортикостероидов (ICS) для лечения астмы рассматривается в других статьях этого номера журнала «Бронходилататоры, ингаляционные и системные кортикостероиды». Есть несколько других новых многообещающих методов лечения, включая холинолитики и альтернативные противовоспалительные препараты, которые в настоящее время широко не используются для лечения астмы.
Мускариновые антагонисты длительного действия (антихолинергические средства длительного действия): тиотропиум и умеклидиний.
Тиотропиум — антихолинергический препарат, нацеленный на мускариновые рецепторы и оказывающий бронхолитическое действие на легкие у пациентов с астмой и ХОБЛ.Было показано, что тиотропий улучшает FEV 1 в дополнение к ICS или в качестве дополнительной терапии к ингаляционным стероидам и комбинированной терапии LABA 11,12 (см. Таблицу 1 для множества других исследований). Кроме того, тиотропий увеличивает время до первого обострения и уменьшает количество тяжелых обострений при добавлении к комбинированной терапии при тяжелой астме. 13 У афроамериканцев тиотропий не уступал LABA и не демонстрировал никаких различий в мерах безопасности и побочных эффектах. 14 В первоначальных исследованиях использовалось устройство HandiHaler (Boehringer Ingelheim, Германия), а более недавние испытания включали устройство Respimat, которое, как было показано, было эффективным в улучшении ОФВ 1 у детей, подростков и взрослых, страдающих астмой. 15–17 FDA разрешило использование Spiriva Respimat (Boehringer Ingelheim, Германия) для лечения взрослых и детей с астмой. Использование тиотропия в качестве монотерапии астмы — область постоянных исследований.Тиотропий был включен в рекомендации GINA 2 в качестве альтернативного варианта лечения на этапах 4 и 5 у взрослых пациентов с обострениями в анамнезе и, несомненно, будет рассмотрен в качестве дополнения к будущим пересмотренным рекомендациям NAEPP. 1
Таблица 1.Обзор клинических испытаний по оценке эффективности тиотропия при астме
Умеклидиний, новое дополнение к этому классу препаратов, изучался как в качестве монотерапии, так и в качестве дополнительной терапии к ингаляционным стероидам при астме.Наблюдалось умеренное улучшение минимального ОФВ 1 у субъектов, ранее не принимавших стероиды и получавших монотерапию умеклидинием 18 , а умеклидиний привел к улучшению ОФВ 1 в дополнение к ингаляционным стероидам по сравнению с только ингаляционными стероидами, эффект, который Сообщается, что был более заметным у пациентов с фиксированной обструкцией. 19 Исследования по определению роли умеклидиния и гликопирролата при астме продолжаются, и до сих пор неясно, как эти лекарства будут использоваться в будущем.Умеклидиний в настоящее время не одобрен FDA для лечения астмы.
Ингибитор фосфодиэстеразы-4: Рофлумиласт
Рофлумиласт представляет собой ингибитор фосфодиэстеразы-4, который обладает как бронхорасширяющим, так и противовоспалительным действием, и в настоящее время одобрен FDA для лечения взрослых пациентов с ХОБЛ, связанной с хроническим бронхитом и историей болезни. частые обострения. Рофлумиласт изучался при астме в качестве монотерапии, а также в качестве дополнительной терапии к ингаляционным стероидам (таблица 2 для нескольких исследований).Существуют исследования, которые продемонстрировали не меньшую эффективность по сравнению с ингаляционными стероидами с улучшением ОФВ 1 у пациентов с персистирующей астмой легкой и средней степени тяжести. Кроме того, рофлумиласт увеличивает время до первых обострений и оказывает некоторое влияние на улучшение качества жизни и симптомов астмы. Прием препарата вызывает тошноту и побочные эффекты со стороны желудочно-кишечного тракта, которые временны и улучшаются со временем. Кроме того, рофлумиласт у некоторых пациентов приводит к снижению веса.Потенциальная потеря веса и возможность связанного с этим улучшения контроля астмы у тех, кто страдает ожирением, могут быть желаемым эффектом терапии рофлумиластом в этой подгруппе пациентов с астмой. 20 Однако в крупном клиническом исследовании астмы рофлумиласт не привел к значительным изменениям веса. 21 Хотя рофлумиласт является многообещающим препаратом для лечения астмы, исследования фазы 3 еще не завершены, и в настоящее время препарат не одобрен FDA для лечения астмы.Основным ограничением были неприятные побочные эффекты терапии, которые необходимо уравновешивать с потенциальными преимуществами и сравнивать с более переносимыми альтернативами.
Таблица 2.Обзор клинических испытаний, оценивающих эффективность рофлумиласта при астме
Антагонисты 5-липооксигеназы: Зилеутон
Монтелукаст (Singulair, Merck, Kenilworth, NJ) является более часто используемым антагонистом рецепторов лейкотриена, одобренным FDA для лечения астмы у пациентов в возрасте ≥12 месяцев и считается терапией 2 этапа в рекомендациях NAEPP 1 с противовоспалительными свойствами.Менее известный препарат зилеутон представляет собой ингибитор 5-липоксигеназы, который значительно снижает выработку лейкотриенов. Он влияет как на функцию легких, так и на воспаление, что приводит к значительному улучшению ОФВ 1 , качества жизни при астме и обострений (см. Таблицу 3 для нескольких исследований). Кроме того, зилеутон уменьшает воспаление в легких у пациентов с астмой. Препарат был одобрен FDA для лечения астмы у лиц старше 12 лет и включен в рекомендации NAEPP 1 для лечения пациентов с астмой 3 степени или выше.Зилеутон связан с небольшим риском повышения результатов тестов функции печени; это чаще происходит в течение первых 3 месяцев лечения. Повышение показателей функции печени является преходящим и исчезает после прекращения терапии; Поэтому рекомендуется регулярно контролировать функцию печени после начала терапии зилеутоном. 22 Несмотря на добавление зилеутона в руководящие принципы, его широкому использованию препятствовали опасения по поводу побочных эффектов, связанных с печенью, и короткого периода полувыведения, который требует частого приема. 23 Кроме того, плохое страхование лекарств в сочетании с их высокой стоимостью привело к снижению их использования.
Таблица 3.Обзор клинических испытаний по оценке эффективности зилеутона в лечении астмы
Макролидный антибиотик: азитромицин
Азитромицин — азалидный антибиотик, близкий к макролидам, обладающий антимикробным и иммуномодулирующим действием и обладающий растущим антимикробным и иммуномодулирующим действием. интерес к его использованию в качестве терапии тяжелой персистирующей астмы.Были получены смешанные результаты клинических испытаний, в которых оценивалось использование макролидов в качестве дополнительной терапии при астме, с недавним исследованием, которое не продемонстрировало никаких эффектов при астме в целом, но анализ подгрупп показал, что, возможно, макролиды все еще могут оказывать влияние на уменьшение обострений у пациентов с тяжелыми формами болезни. -эозинофильная астма. 24,25 Существуют противоречивые результаты относительно влияния азитромицина на обострения астмы. Хотя в одном исследовании сообщалось, что азитромицин уменьшил количество обострений и улучшил качество жизни, терапия 26 не уменьшала продолжительность острых симптомов или время до исчезновения симптомов острой астмы.Кроме того, в отдельном исследовании обострений (AZALEA) азитромицин не привел к улучшению контроля астмы, качества жизни или функции легких. 27 Существует неопределенность в отношении долгосрочной роли макролидов при астме, в отличие от ХОБЛ, при которой эти методы лечения продемонстрировали эффективность в уменьшении обострений у отдельных пациентов с ХОБЛ с частыми обострениями. 28 Недавний метаанализ продемонстрировал повышенный риск потери слуха и устойчивости к противомикробным препаратам у субъектов с хроническим заболеванием легких, получающих долгосрочные макролиды, и, следовательно, эти вопросы необходимо учитывать как роль макролидов при астме. определяется в будущем. 29
Особые соображения среди населения
Астма, ХОБЛ, перекрытие
Астма и ХОБЛ ранее считались двумя разными заболеваниями без какого-либо значительного совпадения. Однако недавно был описан новый феномен, и термин «перекрытие ХОБЛ при астме» был придуман, чтобы охватить заболевание, при котором эти расстройства могут сосуществовать с признаками обоих присутствующих. 30 Астма Перекрытие ХОБЛ составляет примерно 15–25% обструктивных заболеваний дыхательных путей и связано с худшими исходами, чем только астма или ХОБЛ. 31–35 Пациенты с астмой и ХОБЛ имеют повышенный риск обострений; фармакологические последствия существуют при выборе подходящего лечения для этих пациентов. 36
Точное определение астмы, совпадающее с ХОБЛ, продолжает оставаться темой постоянных дискуссий, 37–40 и причиной заболевания может быть астма с последующим развитием хронической обструкции или ХОБЛ с аллергическими признаками. 41,42 Пациенты с астмой и с отсутствием обратимой обструкции воздушного потока и со значительным анамнезом употребления табака исключаются из клинических испытаний астмы, что, таким образом, ограничивает возможность обобщения методов лечения, одобренных FDA для лечения астмы, до этого уникального группа пациентов.Это справедливо для пациентов с ХОБЛ с любой историей астмы или аллергических заболеваний и их обратимости. В 2014 году руководство GINA 2 впервые обратилось к проблеме дублирования ХОБЛ при астме, подчеркнув важность оценки факторов риска обострений, включая нефармакологические методы лечения и стратегии в этой подгруппе пациентов. 43
Терапевтические подходы к пациентам с астмой накладываются друг на друга. ХОБЛ требует повышенной способности точно определять потенциальные основные механизмы воспаления (эндотипы), которые могут позволить проводить таргетную терапию. 44 Биомаркеры отчаянно необходимы, чтобы помочь охарактеризовать эти фенотипы и справиться с врожденной воспалительной гетерогенностью, которая присутствует при наложении ХОБЛ астмы. 45 Например, у некоторых пациентов с ХОБЛ преобладает эозинофильное воспаление, и поэтому их следует лечить ингаляционными стероидами, а не только бронходилататорами, вопреки текущим рекомендациям по лечению ХОБЛ (Глобальная инициатива по хронической обструктивной болезни легких). Болезнь). 46,47
Прекращение употребления табака и вакцинация являются краеугольными камнями терапии астмы, частично совпадающей с ХОБЛ, поэтому важно использовать ICS и бронходилататоры. Необходимы дальнейшие исследования, чтобы определить роль биологических препаратов в одновременном применении ХОБЛ при астме. 48 Влияние ХОБЛ на астму и исходы ХОБЛ по-прежнему будет областью активных исследований, и необходимы клинические испытания, чтобы помочь определить наиболее подходящие вмешательства для этих пациентов, которые несут более серьезное бремя болезни.
Афроамериканские пациенты и безопасность LABA
LABA являются основой терапии астмы для пациентов с персистирующей астмой, которые не контролируются при монотерапии ингаляционными стероидами. В 2006 году было опубликовано исследование SMART, в котором была высказана обеспокоенность по поводу возможности увеличения количества побочных эффектов у пациентов африканского происхождения, страдающих астмой. 43,49 В исследование SMART было включено 26 355 субъектов, получавших салметерол или плацебо для лечения астмы. 49 В промежуточных анализах исследование было прекращено из-за небольшого, но статистически значимого увеличения общей смертности при регулярном применении салметерола.Кроме того, при приеме сальметерола увеличивалось количество респираторных событий и связанных с астмой смертей, которые, по-видимому, происходили преимущественно у афроамериканцев, которые составляли 18% исследуемой популяции. 49
Мета-анализ подтвердил значительные преимущества LABA-терапии при астме; однако проблемы с безопасностью остались. 50 В 2007 году FDA выпустило предупреждение в виде черного ящика для любых лекарственных форм, содержащих LABA, которые запрещают использование этих лекарств в качестве монотерапии без сопутствующих ингаляционных стероидов. 51 Кроме того, были проведены исследования безопасности, чтобы определить, действительно ли существуют остаточные проблемы безопасности при назначении афроамериканским пациентам LABA в сочетании с ингаляционными стероидами. 52
Со времени исследования SMART было завершено несколько крупных клинических испытаний 49 , которые продемонстрировали эффективность LABA в сочетании с ICS для уменьшения обострений 53 и контроля астмы у афроамериканцев с приемлемым профилем безопасности и без показаний повышенной смертности. 14,54,55 На основании этих исследований FDA недавно удалило предупреждения о черном ящике на LABA. 56 Что еще не определено, так это то, будут ли повышенные дозы ингаляционных стероидов превосходить добавление LABA у афроамериканцев, и это область продолжающихся исследований.
Краткие рекомендации для клиницистов, оказывающих помощь пациентам со стабильной астмой
Клиницисты, лечащие пациентов с астмой, должны все больше осознавать влияние фенотипов и эндотипов на активность заболевания и реакцию на терапию.Более широкое признание патофизиологии, лежащей в основе симптомов пациента, и уровня контроля может помочь в принятии решений в отношении лечения астмы более индивидуально (рис. 3). Следует принимать во внимание и смягчать сопутствующие заболевания и способствующие факторы. Следует разработать структурированный подход к ведению пациентов с астмой в клинических условиях, включая использование стандартизированных вопросников для повседневной оценки 2 важных областей: риска (обострения) и контроля.Этот подход позволяет клиницистам определить, оправданы ли корректировки терапии. Более того, важно определить, не соблюдали ли пациенты свою терапию астмы, а также выявить и выявить причины несоблюдения режима лечения. Обучение астме является важной частью оказания медицинской помощи, особенно с учетом путаницы с ингаляторами, которая существует и усугубляется с постоянно растущим количеством устройств, имеющихся на рынке. В конечном итоге цель состоит в том, чтобы уменьшить обострения, оптимизировать функцию легких и уменьшить симптомы, которые негативно влияют на качество жизни каждого пациента.
Обсуждение
Williams:
Очень красивое резюме. Я не думаю, что будет получен окончательный ответ относительно того, как будет выглядеть следующая версия отчета Экспертной группы NIH, но я думаю, что есть хорошее резюме доказательств, поступающих от Агентства по исследованиям и качеству в области здравоохранения. Некоторые из вещей, которых мы можем ожидать, например, вопрос об использовании одних только ингаляционных стероидов по сравнению с ингаляционными стероидами и при необходимости стероидами, когда это необходимо, по сообщениям, не дали никаких результатов. Они чувствуют себя комфортно и поэтому рекомендуют только ингаляционные стероиды по сравнению с интермиттирующими стероидами для людей в возрасте ≥ 12 лет, но не для детей 5-11 лет из-за неполных доказательств.Я не совсем уверен, что понимаю, в чем заключается проблема тройной терапии по сравнению с комбинированной терапией, вы чувствуете, что ингаляционный стероид с LABA все еще будет доступен для пациента. Это верно?
Вильямс:
Может быть, это просто путаница?
Lugogo:
Например, есть пациенты, которые хорошо переносят тиотропий, и им нравится родоразрешение с помощью устройства Респимат, но не так хорошо, когда они комбинируют тиотропий с фиксированной комбинацией ICS / LABA.В некоторых случаях были опробованы все составы, представленные на рынке. Некоторые пациенты хорошо справляются с комбинацией ингаляционных стероидов и LABA плюс мускариновые антагонисты длительного действия (например, у одного из моих пациентов лучше всего получалось с беклометазоном в сочетании с тиотропиумом и олодатеролом [Stiolto, Boehringer Ingelheim, Германия]). Я понимаю, что это использование не по назначению, поэтому я не рекомендую этот подход; однако, чем больше ингаляторов имеется на рынке, тем больше возможных комбинаций. Комбинированная бронходилататорная терапия может иметь некоторые преимущества.Например, если вы принимаете LABA плюс антимускариновые антагонисты длительного действия, то вы действительно можете увеличить дозировку ICS во время обострений. Следовательно, если пациент принимает беклометазона пропионат все время, то он или она может увеличить дозу в четыре раза во время приступов астмы. Конечно, FDA в настоящее время все еще требует, чтобы, если вы используете LABA, он должен быть в ингаляторе с фиксированной комбинацией. Еще мы обнаружили, что пациенты полностью перегружены различными типами устройств; например, у одного пациента может быть спасательный pMDI, ингалятор Respimat с тиотропием и ингаляционные стероиды или фиксированная комбинация лекарств в устройстве Ellipta.Это вносит значительную путаницу в ингалятор. Большое количество устройств доставки также ложится тяжелым бременем на поставщиков услуг, которые ведут лечение этих пациентов. Специально для врачей первичного звена; Я не знаю, как поставщик может найти время, чтобы по-настоящему обучить пациента использованию 3-х различных устройств во время визита, который и без того ограничен во времени.
Макинтайр:
Нджира, я не лечу астму. Но предположим, что у вас есть относительно легкий пациент с астмой, у которого есть только прерывистые симптомы, что побуждает вас просто давать пациенту альбутерол, когда это необходимо, вместо чего-то простого, например, монтелукаста, по сравнению с комбинацией ICS / SABA? Что заставляет вас делать такой выбор?
Lugogo:
Я бы рекомендовал назначать SABA только пациентам с астмой, вызванной физической нагрузкой, или с очень легкой перемежающейся астмой, с редким использованием SABA, один раз в месяц или что-то в этом роде.Если у вас есть какие-либо виды атопии или аллергического ринита, а также симптомы, вызванные физической нагрузкой, которые полностью не контролируются с помощью SABA, я бы добавил ингибитор лейкотриена в качестве терапии первой линии. Но если у вас немного больше симптомов, например, у вас есть сезонные симптомы, или когда вы заболели инфекциями верхних дыхательных путей, вы кашляете в течение 3-4 недель за раз, или вы хорошо знаете, что для через полтора месяца весной у вас будут проблемы, тогда вы будете иметь право на прерывистое лечение с помощью ICS.Я подхожу к этой группе пациентов двумя способами: одна подгруппа пациентов получает периодическую сезонную терапию астмы. Поэтому я скажу: «Вы всегда болеете в апреле, начните свой ICS в марте, принимайте его в течение 2 месяцев, а затем вы можете прекратить его на следующие 9 месяцев, и если вы заболеете какой-либо инфекцией верхних дыхательных путей, идите. на ингаляционной терапии ». Другая подгруппа — это те, у кого нет сезонных колебаний, но которые действительно падают со скалы, когда заболевают, и им требуется вечность, чтобы выздороветь, несмотря на пероральные кортикостероиды и другие вмешательства.Этим пациентам я назначу прерывистое дозирование SABA / ICS, которое начинается в тот момент, когда они заболевают инфекцией верхних дыхательных путей. Это призвано снизить заболеваемость и затяжное течение.
Mann:
Я думаю, что есть немало пациентов с довольно тяжелой астмой, у которых на самом деле проблемы возникают только тогда, когда они простужаются. Мой сын был прекрасным примером. С ним все будет в порядке, но при простуде он будет синим и в реанимации. В конце концов я начал назначать ему преднизон, когда он простудился.Итак, я управлял своим сыном, возможно, неортодоксальным способом, давая ему преднизон во время простуды и ничего между ними. Я не уверен, что даже рекомендации по лечению согласятся с таким подходом, но врачи моего сына откровенно согласились с моим подходом. В конце концов он перерос астму и поправился. Я думаю, что это подтверждает мой второй и более важный комментарий, который заключается в том, что я считаю важным понимать разницу между рекомендациями по лечению и FDA и этикетками лекарств. FDA функционирует в соответствии с регулирующими стандартами, которые требуют очень строгих доказательств эффективности; мы называем это существенным.Существенный уровень доказательности обычно означает 2 рандомизированных двойных слепых испытания, которые воспроизводят эффективность. Вы также должны иметь очень полное и всестороннее представление о безопасности, чтобы очистить лекарство, а также иметь одобренные FDA показания и этикетку для новых лекарств. Клинические рекомендации по лечению разные. Они могут провести обзор литературы и своего опыта, а также попытаться проинформировать врачей о практике медицины. Если хотите, они могут выйти за рамки ярлыка. Я рад, что медицинская практика позволяет клиницистам понимать различные способы применения лекарств в более широком смысле.Я думаю, что FDA также говорит, что для нас это абсолютно нормально, медицинская практика важна, и мы не регулируем это. Я бы не хотел идти к врачу, который говорит: «Я назначаю только терапию, одобренную FDA». Я бы очень нервничал, потому что здесь много пробелов и дыр. Я просто хочу уточнить, когда люди критикуют FDA и говорят: «Почему вы не прояснили то или это? Все это делают! Почему, согласно результатам этого исследования, у нас нет необходимого использования? Почему бы вам не разрешить использование этого препарата для этой группы населения, если это полезно? Такие данные часто более подходят для клинических руководств или медицинской практики, и только в том случае, если данные соответствуют нормативным стандартам и представлены в FDA, они могут быть внедрены в маркировку.
Сноски
- Переписка: Njira L Lugogo MD, 300 North Ingalls St Suite 2C40, Ann Arbor, MI 48109-5400. Электронная почта: nlugogo {at} umich.edu.
Доктор Лугого раскрывает отношения с Sanofi, AstraZeneca, GlaxoSmithKline, Merck и Teva. Доктор Мегдадпур не обнаружил конфликта интересов.
Д-р Лугого представил версию этой статьи на 56-й конференции журнала Respiratory Care Journal «Респираторные препараты для лечения ХОБЛ и астмы у взрослых: фармакологические действия для клинического применения», проходившей 22–23 июня 2017 г. в Санкт-Петербурге, Флорида.
- Авторские права © 2018 by Daedalus Enterprises
Рекомендации GINA по лечению астмы у взрослых 2019
US Pharm. 2020; 45 (7/8): 18-24.
РЕЗЮМЕ: Установление контроля над симптомами астмы с помощью фармакологических и нефармакологических вмешательств улучшает качество жизни и предотвращает обострения у пациентов с астмой. Руководящие принципы Глобальной инициативы по астме 2019 содержат рекомендации по лечению астмы, разделенные на пять этапов, которые коррелируют с тяжестью заболевания.Варианты лечения включают ингаляционные кортикостероиды (ИКС), бета-агонисты 2 длительного действия, агонисты бета 2 короткого действия (SABA), антагонисты рецепторов лейкотриена и пероральные кортикостероиды. Последние данные показывают неблагоприятные исходы для SABA, используемых отдельно для лечения симптомов легкой формы астмы по мере необходимости. Изменения в рекомендациях включают использование низких доз ИКС с формотеролом для лечения по мере необходимости у взрослых с легкой степенью астмы или для использования всякий раз, когда будет использоваться SABA. Соответствующие эффективные схемы приема лекарств в сочетании с консультированием по правильной технике использования ингаляторов помогут пациентам достичь целей лечения астмы.
Астма, хроническое воспалительное заболевание дыхательных путей, характеризующееся повышенной реактивностью дыхательных путей, может проявляться такими симптомами, как хрипы, одышка, стеснение в груди и кашель. 1 Эти симптомы могут меняться со временем и по интенсивности, поэтому эффективное лечение астмы важно. Триггеры симптомов могут включать физические упражнения, вирусные респираторные инфекции и факторы окружающей среды, такие как курение. Оставленные без лечения симптомы могут привести к обострениям. Обострение — острый эпизод, при котором симптомы резко ухудшаются, а функция легких постепенно ухудшается.Любое возникновение обострения требует обсуждения текущего режима лечения астмы у пациента из-за рисков госпитализации, обращения за неотложной помощью и смерти, связанной с астмой.
Руководящие принципы Глобальной инициативы по борьбе с астмой (GINA) 2019 г. не рекомендуют использовать только ингалятор с бета-агонистом короткого действия 2 (SABA) для лечения легкой формы астмы; вместо этого они рекомендуют использование низких доз ингаляционных кортикостероидов (ИКС) -формотерола по мере необходимости и для поддерживающей терапии. 2 У пациентов с тяжелой или трудноизлечимой астмой в качестве дополнения к ингаляционной терапии могут быть рассмотрены другие варианты, такие как антагонисты лейкотриеновых рецепторов (LTRA), тиотропий, биопрепараты, азитромицин и пероральные кортикостероиды (OCS). ).
Asthma control обозначает степень, в которой признаки астмы могут наблюдаться у пациента или быть уменьшены или устранены лечением. 2 Контроль астмы следует пересмотреть за предыдущие 4 недели.Пациенту следует задать следующие вопросы: «Были ли у вас за последние 4 недели: 1) симптомы дневной астмы чаще, чем два раза в неделю? 2) какие-либо ночные пробуждения из-за астмы? 3) использовать лекарство от астмы при симптомах чаще, чем два раза в неделю? 4) какие-либо ограничения активности из-за астмы? » Если пациент отвечает «нет» на все четыре вопроса, его или ее астма хорошо контролируется. Если пациент отвечает «Да» на один или два вопроса, астма частично контролируется, но если ответ «Да» на три-четыре вопроса, астма плохо контролируется. 2 Факторы риска, которые могут вызвать обострение, включают неконтролируемую астму, курение, воздействие аллергенов, загрязнение воздуха, сопутствующие заболевания, такие как ожирение, и частое употребление SABA.
Еще один важный шаг — оценка приверженности пациента ингаляционным лекарствам. Существует множество причин, по которым пациент может не придерживаться приема лекарств от астмы, в том числе трудности с использованием ингаляционных устройств, стоимость лекарств, забывчивость, непонимание предписанных инструкций и ощущение того, что в лекарствах нет необходимости. 2
Цели терапии астмы включают достижение контроля над симптомами для поддержания нормального уровня активности, предотвращение постоянного ограничения воздушного потока и уменьшение побочных эффектов лекарств, обсуждаемых в ТАБЛИЦЕ 1 . Фармакологические и нефармакологические вмешательства снижают риск будущих обострений, ведущих к госпитализации или смерти, связанной с астмой. 2
Нефармакологические вмешательства для всех пациентов с астмой включают дыхательные упражнения, повышенную физическую активность, включение здорового питания и избегание воздействия дыма и других веществ. 2 Практика йоги и методов дыхания, таких как методы Бутейко и Папворта, изменяют характер дыхания, чтобы уменьшить гипервентиляцию, тем самым способствуя добровольному сокращению употребления вспомогательных средств и облегчению симптомов астмы. 3 У пациентов с ожирением потеря веса в сочетании с аэробными и силовыми упражнениями два раза в неделю более эффективна для контроля симптомов, чем одна физическая активность. 2 Консультации по правильной технике использования ингаляторов помогут пациентам в достижении целей лечения астмы.
Фармакологическое управлениеВ схемы лечения астмы вносятся корректировки с помощью цикла лечения астмы на основе контроля, изображенного на РИСУНОК 1. 2
После того, как диагноз астмы был поставлен , лечение контроллером ICS должно быть начато из-за большего улучшения функции легких, чем когда лечение контроллером ICS не используется. Это важное изменение в рекомендациях GINA 2019 года, поскольку ранее рекомендовалось назначать только что диагностированным пациентам только SABA.Комбинированный ингалятор ИКС-формотерол является предпочтительным по мере необходимости вспомогательной терапией независимо от тяжести астмы. Альтернативная вспомогательная терапия — SABA; однако он должен быть соединен со вторым ингалятором, содержащим ICS. Ингаляторы ИКС-формотерола безопасны и эффективны, а их способность использоваться как по мере необходимости, так и для поддерживающей терапии делает их легкими в использовании для пациентов. 2
GINA рекомендует следующие этапы лечения астмы. 2 :
• Шаг 1. Этот шаг рекомендуется пациентам с легкой формой астмы, у которых симптомы проявляются реже двух раз в месяц и нет риска обострений.Как упоминалось ранее, основываясь на новых данных, рекомендации GINA 2019 больше не рекомендуют использовать только SABA для лечения астмы.
• Шаг 2: Предпочтительный контрольный режим — это по мере необходимости низкие дозы ИКС-формотерола или ежедневные низкие дозы ИКС плюс по мере необходимости SABA. Режим ИКС-формотерол устраняет необходимость в ежедневном ИКС, обеспечивая при этом те же преимущества для вызванного физической нагрузкой бронхоспазма, что и ежедневный ИКС с необходимыми SABA.
• Этап 3: Предпочтительное контролируемое лечение включает низкие дозы ICS-агониста бета 2 длительного действия (LABA) плюс по мере необходимости SABA или низкие дозы ICS-формотерола как для поддерживающей, так и для вспомогательной терапии.
• Этап 4: Предпочтительным контролируемым лечением является ИКС-формотерол в низких дозах в качестве поддерживающей и облегчающей терапии или ИКС-ДДБА в средних дозах в качестве поддерживающей терапии плюс SABA по мере необходимости. Обратите внимание, что ICS-формотерол не следует сочетать с ICS-LABA, содержащим другой LABA.
• Шаг 5: Продолжаются обострения или ухудшение симптомов, несмотря на соблюдение режима лечения и правильную технику ингаляции. Считается, что эти пациенты страдают тяжелой или трудноизлечимой астмой, и их следует направить к пульмонологу.
Переход к этапам, описанным выше, уместен, когда у пациентов постоянно плохой контроль симптомов или обострения, несмотря на лечение низкими дозами ИКС в течение 2–3 месяцев. Уменьшение целесообразно, если у пациента наблюдается хороший контроль симптомов и стабильная функция легких в течение как минимум 3 месяцев. Варианты снижения зависят от того, какое лекарство принимает пациент и на каком этапе находится пациент, но для большинства пациентов результат хуже, если ICS или LABA полностью прекращены. 2 Дозирование ICS описано в таблице 2 .
Симптомы можно оценить с помощью таких инструментов, как Анкета контроля астмы, Контрольный тест астмы и Три вопроса Королевского колледжа врачей. 2 Эти анкеты позволяют связать оценку с симптомами и спрашивают пациентов о частоте и типах симптомов, таких как ночные пробуждения и ограничения в повседневной деятельности.
ОбостренияТермин обострение астмы относится к резкому ухудшению функции легких и симптомам, выходящим за рамки того, что обычно испытывает пациент.Предпочтительным облегчением во время обострения является ИКС-формотерол в низких дозах, которые могут быть увеличены по мере необходимости при ухудшении симптомов. Использование ICS-LABA (беклометазон или будесонид и формотерол) в качестве вспомогательного и контролирующего лекарства улучшает контроль симптомов и снижает количество госпитализаций и использование OCS по сравнению с такой же или более высокой дозой контроллера плюс по мере необходимости SABA. 4
Короткий курс OCS — это вариант лечения во время обострения, когда пациент не реагирует на повышенную дозу лекарства и регулятора через 2-3 дня, имеет в анамнезе внезапные тяжелые обострения или быстро ухудшается функция легких. (пиковая скорость выдоха или объем форсированного выдоха за 1 секунду <60% от личного лучшего или прогнозируемого значения). 4
Побочные эффекты лекарств от астмыСм. ТАБЛИЦА 1 , где приведена сводка побочных эффектов различных лекарств от астмы. 5-16
Тяжелая или трудноизлечимая астма относится к неконтролируемой астме на этапах лечения 4 и 5, несмотря на адекватное соблюдение режима лечения и лечения сопутствующих факторов. После первоначальной оценки пациенты в возрасте 12 лет и старше с неадекватно контролируемой астмой, которые принимают средние дозы ICS плюс LABA и / или третий контроллер, такой как LTRA или теофиллин с замедленным высвобождением, переключаются на испытание высокой дозы. доза ICS от 3 до 6 месяцев.Помимо увеличения ICS, можно рассмотреть возможность применения дополнительных небиологических препаратов, таких как тиотропий, модификатор лейкотриена или OCS. Для взрослых пациентов, у которых наблюдаются стойкие симптомы астмы, несмотря на умеренные или высокие дозы ICS и LABA, рекомендации GINA 2019 рекомендуют азитромицин в качестве дополнения. 17
Если небиологические препараты, такие как LABA, тиотропий и модификаторы лейкотриена, не справляются с симптомами астмы у пациента, то можно рассмотреть возможность использования биопрепаратов в зависимости от цены и ресурсов пациента.Лечение антииммуноглобулином Е, например омализумабом, может быть рекомендовано пациентам с аллергической астмой. В случае, если биопрепараты не подходят для пациента, можно рассмотреть возможность применения OCS в дозировке 7,5 мг или менее в день, эквивалентной преднизону. Однако OCS связаны со значительными побочными эффектами, такими как остеопороз, ожирение, диабет, катаракта, гипертония и подавление надпочечников, и поэтому их следует рассматривать в последнюю очередь. 17
В двойном слепом исследовании, проведенном О’Бирном и его коллегами, изучалась польза от использования ICS в сочетании с SABA по сравнению с традиционным лечением. 18 В общей сложности 3849 пациентов в возрасте 12 лет и старше с легкой формой астмы были случайным образом распределены на группы тербуталина (плацебо два раза в день плюс тербуталин 0,5 мг в сутки), будесонид-формотерол (плацебо два раза в день плюс будесонид-формотерол 200 мкг / 6 мкг. prn) или поддерживающая терапия будесонидом (будесонид 200 мкг дважды в день плюс тербуталин prn). Основная цель состояла в том, чтобы определить, превосходит ли будесонид-формотерол по мере необходимости тербуталин для контроля симптомов. Этот результат был измерен с помощью данных, полученных из электронного дневника симптомов.
Будесонид-формотерол по мере необходимости превосходил пациентов с легкой астмой с точки зрения контроля симптомов астмы по сравнению с тербуталином по мере необходимости. Пациенты с будесонидом и формотеролом демонстрировали хорошо контролируемую астму в течение 34,4% недель по сравнению с 31,1% недель в группе тербуталина ( P = 0,046). Тербуталин был связан с самым высоким годовым уровнем тяжелых обострений (0,20) по сравнению с будесонидом-формотеролом (0,07) и поддерживающей терапией будесонидом (0,09). Преимущество использования будесонида-формотерола заключалось в том, что воздействие кортикостероидов было снижено из-за более низкой дозы будесонида на 17% в этой группе по сравнению с группой поддерживающей будесонид (57 мкг против340 мкг соответственно). 18
Бейтман и его коллеги исследовали эффективность ингаляционного глюкокортикоидного компонента с быстродействующим средством для облегчения астмы легкой степени. 5 Это 52-недельное двойное слепое многоцентровое исследование включало 4215 пациентов с легкой формой астмы в возрасте от 12 лет и старше, которые соответствовали критериям лечения регулярными ингаляционными глюкокортикоидами. Участники были разделены на две группы, чтобы оценить, будет ли поддерживающая терапия будесонидом-формотеролом или будесонидом два раза в день более эффективна в отношении ежегодных показателей тяжелых обострений.Группа будесонид-формотерол не уступала группе поддерживающей будесонид в отношении тяжелых обострений. Кроме того, средняя дневная отмеренная доза ингаляционного глюкокортикоида была ниже в группе будесонид-формотерол (66 мкг), чем в группе поддерживающей терапии будесонидом (267 мкг). Время до первого обострения в группах было одинаковым; однако разница составила 0,11 ЕД в пользу группы поддерживающей терапии будесонидом, у которой были более низкие баллы по Контрольному опроснику астмы-5 (ACQ-5) по сравнению с группой будесонида-формотерола.Минимальная клинически значимая разница в баллах ACQ-5 составляет 0,5 ЕД. Кроме того, не было различий в побочных эффектах, прекращении лечения из-за астмы или уровне смертности между двумя группами. Это исследование и исследование О’Бирна подтверждают текущую рекомендацию GINA 2019 года против использования только SABA и вместо использования ICS-формотерола.
В исследовании Гибсона и его коллег изучали эффективность и безопасность перорального азитромицина в качестве дополнительной терапии у пациентов с неконтролируемой персистирующей астмой, также принимающих средние или высокие дозы ICS в сочетании с LABA. 17 В этом рандомизированном двойном слепом плацебо-контролируемом исследовании с параллельными группами 420 пациентов были случайным образом распределены в одну из двух групп лечения (азитромицин 500 мг или плацебо три раза в неделю в течение 48 недель). Первичные конечные точки эффективности включали частоту общих (тяжелых и умеренных) обострений астмы и общее качество жизни, связанное с астмой, за период исследования.
В исследовании Гибсона было установлено, что азитромицин снижает частоту обострений астмы; 44% пациентов с азитромицином испытали по крайней мере одно обострение по сравнению с 61% пациентов, получавших плацебо ( P <.0001). Кроме того, использование азитромицина значительно улучшило качество жизни, связанное с астмой, что обозначено улучшением всех категорий оценочной шкалы (то есть активности, симптомов, эмоций и окружающей среды) для качества жизни, связанного с астмой. Единственное другое заметное различие между исследуемыми группами заключалось в частоте диареи, которая была значительно выше у пациентов с азитромицином (34% против 19% пациентов, получавших плацебо). Для контроля безопасности ЭКГ проводились при скрининге, через 6 недель лечения и в конце лечения.Удлинение QTc более 480 мс привело к исключению из исследования двух пациентов (по одному из каждой группы). 17
Рекомендации 2019 года включают пять заметных изменений в отношении лечения астмы у взрослых. Первым изменением является переход от лечения только SABA к лечению, содержащему ICS, для лечения симптомов астмы легкой степени тяжести по мере необходимости. 4 Второе изменение — это использование дополнительных низких доз азитромицина три раза в неделю для длительного лечения пациентов с симптоматической астмой, несмотря на лечение средними или высокими дозами ICS-LABA; однако следует учитывать возможные побочные эффекты. 17
Третье изменение — это рекомендация для дупилумаба, моноклонального антитела против рецептора интерлейкина-4 альфа, в качестве дополнительного варианта лечения пациентов в возрасте 12 лет и старше с тяжелой формой астмы 2 типа или астмой, зависимой от ОСК. 19 Испытание Венцеля и его коллег продемонстрировало, что дупилумаб усиливает функцию легких и уменьшает количество тяжелых обострений у пациентов с неконтролируемой персистирующей астмой. 20
Четвертое изменение должно включать лечение высокими дозами ICS-LABA только на этапе 5, тогда как ранее оно было включено в этап 4 с ICS-LABA умеренных доз; Это связано с рекомендацией назначать высокие дозы ИКС только на несколько месяцев с учетом сопутствующих побочных эффектов. 17 Пятое изменение — это переключение поддерживающей OCS с «предпочтительного» варианта лечения на «другой вариант контроллера» на этапе 5, исходя из высокого риска неблагоприятных исходов. 19
На основании новых данных обновленные рекомендации GINA 2019 не рекомендуют использовать только ингалятор SABA для лечения легкой формы астмы; вместо этого в качестве поддерживающей терапии и терапии по мере необходимости рекомендуется использовать ИКС-формотерол в низких дозах. Для пациентов с тяжелой или трудноизлечимой астмой в качестве дополнительного лечения к ингаляционной терапии могут быть рассмотрены другие варианты, включая LTRA, тиотропий, биопрепараты, азитромицин и OCS.Чтобы обеспечить лучшее соблюдение режима лечения, схемы лечения астмы должны быть индивидуальными для пациента, с поэтапным подходом к поиску режима, который контролирует симптомы астмы у пациента, сохраняя при этом пациенту самую низкую возможную дозу, а также должен быть рентабельным.
СПРАВОЧНАЯ ИНФОРМАЦИЯ 1. Американский фонд астмы и аллергии. Астма. www.aafa.org/asthma-symptoms. Проверено 8 апреля 2020 г.
2. Глобальная инициатива по астме. Глобальная стратегия лечения и профилактики астмы, 2019.www.ginasthma.org. По состоянию на 8 апреля 2020 г.
3. Сантино Т.А., Чавес Г.С., Фрейтас Д.А. и др. Дыхательные упражнения для взрослых, страдающих астмой. Кокрановская база данных Syst Rev. 2020; 3 (3): CD001277.
4. О’Бирн П.М., Фицджеральд Дж. М., Бейтман Э. Д. и др. Ингаляция комбинированного будесонида и формотерола по мере необходимости при легкой форме астмы. N Engl J Med . 2018; 378 (20): 1865-1876.
5. Бейтман Э.Д., Реддел Х.К., О’Бирн П.М. и др. Будесонид-формотерол по мере необходимости в сравнении с поддерживающим будесонидом при легкой форме астмы. N Engl J Med . 2018; 378 (20): 1877-1887.
6. Симбикорт (будесонид-формотерол) -вставка в упаковку. Уилмингтон, Делавэр: AstraZeneca Pharmaceuticals LP; Январь 2017 г.
7. Reed CE. Астма у пожилых людей: диагностика и лечение. J Allergy Clin Immunol . 2010; 126 (4): 681-687.
8. Вкладыш в упаковку ProAir HFA (альбутерол). Фрейзер, Пенсильвания: Teva Respiratory, LLC; Февраль 2019.
9. Фловент ГФА (флутиказон) вкладыш. Парк Исследовательского Треугольника, Северная Каролина: GlaxoSmithKline; Январь 2019.
10. Singulair (монтелукаст) вкладыш. Станция Уайтхаус, Нью-Джерси: Merck & Co, Inc; Апрель 2020 г.
11. Вальджи А.К., Роджерс М.А., Лин П. и др. Кратковременное употребление пероральных кортикостероидов и связанный с ним вред среди взрослых в США: популяционное когортное исследование. BMJ . 2017; 357: j1415.
12. Фостер Дж. М., Макдональд В. М., М. Гуо, Реддел HK. «Я проиграл во всех аспектах своей жизни»: скрытое бремя тяжелой астмы. Eur Respir J . 2017; 50 (3): 1700765.
13. Rayos (преднизон) вкладыш в упаковку.Дирфилд, Иллинойс: Horizon Pharma, Inc; 2012.
14. Spiriva HandiHaler (тиотропиум) вкладыш в упаковку. Риджфилд, Коннектикут: Берингер Ингельхайм Фармасьютикалз, Инк; Февраль 2018.
15. Спирива Респимат (тиотропиум) вкладыш. Риджфилд, Коннектикут: Берингер Ингельхайм Фармасьютикалз, Инк; Март 2019.
16. Ксолайр (омализумаб) вкладыш в упаковку. Южный Сан-Франциско, Калифорния: Genentech, Inc; Май 2019.
17. Гибсон П.Г., Ян И.А., Упхэм Дж. В. и др. Влияние азитромицина на обострения астмы и качество жизни у взрослых с персистирующей неконтролируемой астмой (AMAZES): рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет . 2017; 390 (10095): 659-668.
18. О’Бирн П.М., Барнс П.Дж., Родригес-Ройзин Р. и др. Низкие дозы ингаляционного будесонида и формотерола при персистирующей астме легкой степени: рандомизированное исследование OPTIMA. Am J Respir Crit Care Med . 2001; 164 (8): 1392-1397.
19. Кастро М., Коррен Дж., Паворд И.Д. и др. Эффективность и безопасность дупилумаба при неконтролируемой астме средней и тяжелой степени тяжести. N Engl J Med. 2018; 378 (26): 2486-2496.
20. Венцель С., Кастро М., Коррен Дж. И др. Эффективность и безопасность дупилумаба у взрослых с неконтролируемой персистирующей астмой, несмотря на использование средних и высоких доз ингаляционных кортикостероидов плюс агонист бета2 пролонгированного действия: рандомизированное двойное слепое плацебо-контролируемое базовое исследование по определению дозировки фазы 2b. Ланцет. 2016; 388 (10039): 31-44.
Информация, содержащаяся в этой статье, предназначена только для информационных целей. Содержание не предназначено для замены профессиональной консультации. Вы полагаетесь на любую информацию, представленную в этой статье, исключительно на свой страх и риск.
Чтобы прокомментировать эту статью, свяжитесь с [email protected].
Фармакологическое лечение астмы сегодня
Реферат
Современная концепция лечения астмы основана на поэтапном подходе, в зависимости от тяжести заболевания, и цель состоит в том, чтобы уменьшить симптомы, возникающие в результате обструкции дыхательных путей и воспаления, предотвратить обострения и поддерживать нормальную функцию легких.
β 2 Агонисты адренорецепторов и глюкокортикоиды в настоящее время являются наиболее эффективными лекарствами для лечения обструкции и воспаления дыхательных путей, с теофиллином, антагонистами рецепторов лейкотриена и антихолинергическими средствами в качестве терапии второй или третьей линии. На сегодняшний день не существует дополнительных или недавно разработанных препаратов, которые существенно дополняют текущие стратегии или даже заменяют агонисты или глюкокортикоиды β 2 -адренорецепторов. Новые подходы в терапии астмы рекомендуют лекарственные комбинации ингаляционных стероидов, в первую очередь с агонистами β 2 -адренорецепторов длительного действия, на основании их улучшенной эффективности и возможности сберегать стероиды.
Хотя существующие фармацевтические организации способны контролировать подавляющее большинство пациентов с легкой и умеренной астмой, соблюдение пациентами (и врачами) руководящих принципов и стратегий лечения далеко не соответствует желаемым стандартам.
Однако варианты лечения различаются в зависимости от страны и должны учитывать удобство для пациента и возникновение побочных эффектов. Кроме того, стоимость терапии и политика компенсации также влияют на терапевтические стратегии.
Бронхиальная астма — воспалительное заболевание дыхательных путей, характеризующееся гиперреактивностью бронхов и различной обструкцией дыхательных путей. Современная фармакотерапия направлена, прежде всего, на улучшение симптомов за счет использования бронходилататоров и подавление воспаления дыхательных путей и уменьшение гиперреактивности бронхов за счет использования противовоспалительной терапии.
Целью современного и признанного лечения астмы является минимизация симптомов, поддержание нормальной функции легких и предотвращение необратимых изменений в дыхательных путях.В будущем будет важно разработать профилактические и, возможно, лечебные терапевтические подходы, основанные на улучшенном понимании патогенеза и патофизиологии астмы.
Современные стратегии лечения рекомендуют поэтапный подход к лечению, который зависит от тяжести заболевания 1. Эта классификация требует стандартизированной клинической оценки, а также измерения функции легких. Современная фармакотерапия должна обеспечивать адекватный контроль за большинством пациентов; однако выполнение текущих рекомендаций, включая измерение функции легких и рациональную терапию, все еще далеко отстает от желаемых стандартов 2.
Общие соображения
Симптомы астмы в основном вызваны повторяющимися эпизодами острого сужения дыхательных путей, которые, как полагают, являются результатом гиперчувствительности дыхательных путей и воспаления, независимо от того, является ли заболевание аллергическим или неаллергическим. Основные механизмы гиперреактивности дыхательных путей все еще далеки от полного понимания.
При аллергической астме предполагается, что реакция на ранней стадии основана на опосредованной иммуноглобулином (Ig) -E реакции с антигеном перекрестного связывания молекул Ig-E, связанных со специфическими рецепторами на тучных клетках.Последующая активация Ig-E (рецепторов FcεRI) приводит к высвобождению медиаторов, ограничивающих бронхоспазм, включая лейкотриены и гистамин. Напротив, аллергическая реакция поздней фазы, как полагают, является результатом инфильтрации стенки дыхательных путей воспалительными клетками, такими как эозинофилы и лимфоциты, особенно CD4-положительными Т-клетками. Медиаторы, которые выделяются этими клетками, не только вызывают сужение бронхов, но и повышают реактивность бронхов после воздействия аллергена.Повторяющееся воздействие аллергена может привести к хроническим изменениям в дыхательных путях и хорошо описанным патологическим аспектам дыхательных путей у пациентов с астмой, или повреждение эпителия, гиперплазия слизистых желез, субэпителиальный фиброз, отложение коллагена, инфильтраты воспалительных клеток и увеличение гладкомышечной массы через гиперплазию и гипертрофию.
На сегодняшний день степень тяжести астмы классифицируется в соответствии с частотой симптомов в сочетании с параметрами функции легких, такими как объем форсированного выдоха за одну секунду и пиковая скорость выдоха; Эта классификация составляет основу поэтапного подхода к терапии астмы.Хотя параметры, которые, как предполагается, отражают изменения в воспалении дыхательных путей, успешно использовались для характеристики пациентов и оценки терапевтических эффектов в рамках клинических исследований, эти параметры не были приняты во внимание в текущих рекомендациях по лечению астмы. Эти индикаторы воспаления дыхательных путей, которые, как считается, непосредственно вовлечены в патофизиологию астмы, представляют собой воспалительные клетки (эозинофилы, лимфоциты и тучные клетки) в индуцированной мокроте и жидкости бронхоальвеолярного лаважа (БАЛ), медиаторы воспаления (цитокины, хемокины, иммуноглобулины, лейкотриены и т. простаноиды) в сыворотке, моче, мокроте и БАЛ, а также тканях, полученных из дыхательных путей с помощью биопсии (структура, молекулы адгезии и рецепторы).Лучшее понимание взаимосвязи между симптомами, с одной стороны, и функцией легких и воспалительными параметрами, с другой, составляет основу новых концепций и подходов к лечению астмы.
Установленная терапия и ее дальнейшее развитие
Установленное лечение астмы в основном включает два класса лекарств: бронходилататоры и противовоспалительные / иммунодепрессанты. Безусловно, наиболее эффективными бронходилататорами при астме являются β 2 -адреноцепторагонисты.Ингаляционные β 2 -адреноцепторагонисты короткого действия или, реже, антихолинергические препараты используются либо по мере необходимости, либо с профилактической целью, , то есть перед тренировкой, либо в качестве спасательного лекарства. Противовоспалительные глюкокортикоиды — это, в первую очередь, препараты длительного действия, нацеленные на лечение воспаления дыхательных путей и повышенную чувствительность 3. В очень отдельных случаях динатрий кромогликат и недокромил доступны в качестве альтернативы лечению очень низкими дозами ингаляционных стероидов.Из-за значительных побочных эффектов системные стероиды используются исключительно для лечения тяжелой астмы или обострений астмы, против которых другие методы лечения не дают достаточного эффекта.
Бронходилататоры
β
2 Агонисты адренорецепторовНа протяжении десятилетий агонисты β 2 -адренорецепторов были одними из наиболее важных классов препаратов для лечения бронхиальной астмы. Тем временем стали доступны ингаляционные агонисты β 2 -адренорецепторов короткого и длительного действия.Рекомендуется использовать препараты короткого действия (, например, фенотерол, сальбутамол и тербуталин) по мере необходимости, тогда как препараты длительного действия (сальметерол и формотерол) следует использовать в сочетании с ингаляционными глюкокортикоидами в рамках длительное лечение. Препараты как короткого, так и длительного действия обладают надежным бронхолитическим действием. Более того, есть некоторые свидетельства того, что агонисты β 2 -адренорецепторов короткого действия также обладают противовоспалительным действием 4, хотя прямое доказательство in vivo было трудно получить.В этом контексте влияние препаратов пролонгированного действия в сочетании со стероидами на частоту обострений может свидетельствовать о дополнительном эффекте этого класса препаратов на воспаление дыхательных путей 5, 6.
В настоящее время клинический и экспериментальный опыт применения агонистов β 2 -адренорецепторов короткого и длительного действия, по-видимому, позволяет предположить, что в обозримом будущем вряд ли будут разработаны новые бронходилататоры, которые лучше переносятся и более эффективны. .Поскольку считается, что агонисты β 2 -адренорецепторов вызывают расслабление гладкой мускулатуры дыхательных путей, в первую очередь за счет повышения внутриклеточных уровней циклического аденозинмонофосфата и открытия калиевых каналов, были предприняты попытки имитировать эти эффекты с помощью других веществ, таких как неселективные ингибиторы фосфодиэстеразы и калий. открыватели каналов. Было показано, что эти препараты гораздо менее эффективны в качестве бронходилататоров по сравнению с агонистами β-адренорецепторов, а их применение в более высоких дозах ограничивалось заметными побочными эффектами.Таким образом, текущие исследования в области лекарственных средств сосредоточены в первую очередь на разработке новых веществ, влияющих на пути воспаления, и тех, которые могут обеспечить профилактические подходы к лечению астмы.
Антихолинергические препараты
Расслабление гладкой мускулатуры дыхательных путей может быть вызвано стимуляцией адренергической нервной системы с помощью агонистов β 2 -адренорецепторов, с одной стороны, и, с другой стороны, ингибирования холинергической нервной системы холинолитиками.Однако антагонисты мускариновых рецепторов, такие как ипратропия бромид короткого действия, которые неселективно подавляют действие ацетилхолина на мускариновые рецепторы, играют лишь незначительную роль в лечении астмы. Бромид ипратропия вводят путем ингаляции и в основном используют в качестве «лекарства по мере необходимости» в случаях непереносимости β-агонистов. Поскольку недавно разработанные холинолитики длительного действия используются в основном при лечении хронической обструктивной болезни легких 7, 8, они не будут здесь обсуждаться.
Противовоспалительная терапия
Медиаторы, такие как простаноиды, гистамин, лейкотриены, цитокины, хемокины и иммуноглобулины, как полагают, играют центральную роль в патогенезе и поддержании воспаления дыхательных путей при астме. Их индивидуальный вклад, влияние и происхождение в настоящее время интенсивно исследуются. Лучшее понимание этих путей могло бы способствовать раскрытию механизма действия используемых в настоящее время эффективных классов лекарств ( e.грамм. глюкокортикоидов) и могут выявить новые мишени для терапии астмы.
Противовоспалительная или иммуносупрессивная терапия может влиять на уровни синтеза, высвобождения и эффекты медиаторов воспаления. По идее, лучшее понимание регуляторных механизмов должно привести к более специфической и, следовательно, более эффективной форме терапии. Однако, приведут ли такие конкретные подходы к ожидаемым эффектам in vivo , необходимо оценить в клинических исследованиях.Разработка таких «индивидуальных» вмешательств будет осложнена различиями между видами, поскольку результаты исследований на животных, как правило, имеют лишь ограниченную прогностическую ценность в клинических условиях; это еще более очевидно из данных недавних клинических испытаний, рассмотренных позже.
Глюкокортикоиды
Глюкокортикоиды — самые эффективные противовоспалительные препараты, применяемые при лечении астмы. Клинические исследования показали, что стероиды в первую очередь влияют на аллергическую реакцию поздней фазы 9.Хотя астму можно контролировать с помощью высоких доз системных стероидов (преднизон, преднизолон, метилпреднизолон, флуокортолон и триамцинолон) почти у каждого пациента, использование системных стероидов в течение более длительного периода времени ограничено заметными побочными эффектами.
Ингаляционные стероиды (будесонид, беклометазона дипропионат (BDP), флунизолид и флутиказон), которые в низких дозах почти не вызывают каких-либо нежелательных эффектов, хотя побочные эффекты были описаны в высоких дозах, стали доступны с начала 1970-х годов.Ингаляционные кортикостероиды в настоящее время являются препаратами первого выбора при длительном лечении астмы и единственными препаратами для лечения этого состояния, которые имеют документально подтвержденное влияние на смертность 10.
Действие глюкокортикоидов опосредуется через цитоплазматический рецептор глюкокортикоидов. Связавшись с этим рецептором, стероиды попадают в ядро, где регулируют транскрипцию гена; синтез провоспалительных цитокинов повышен, а противовоспалительных цитокинов усилен 11.Было высказано предположение, что противовоспалительные эффекты стероидов опосредуются главным образом инактивацией факторов транскрипции, тогда как нежелательные эффекты возникают в основном из-за связывания стероидов с дезоксирибонуклеиновой кислотой 12. На этом основании разработка лекарств была направлена на разработку стероидов с повышенным рибонуклеиновым действием. улучшенное соотношение желаемых и нежелательных эффектов, например Коэффициент трансактивации / трансрепрессии . Остается оценить, верна ли эта концепция в клинической практике.
Кроме того, в настоящее время проходят испытания глюкокортикоиды с новыми фармакокинетическими профилями 13.Даже современные ингаляционные глюкокортикоиды, такие как флутиказон, с высокой липофильностью, всасываются через легкие после местного применения и, следовательно, могут вызывать побочные эффекты, несмотря на высокую степень метаболизма первого прохождения 13, 14. Поэтому усилия прилагаются. вырабатываются стероиды, которые метаболизируются локально в легких или в плазме и / или не всасываются на слизистых оболочках, например циклезонид 15.
Более того, отказ от продуктов, содержащих хлорфторуглерод (CFC), привел к разработке новых дозированных ингаляторов.Было показано, что БДФ, содержащий гидрофтоуралкан, не содержащий ХФУ, имеет улучшенный профиль отложения по сравнению с ХФУ-БДФ, достигая малых дыхательных путей 16. Это может иметь последствия для дозировки и лечения пациентов с воспалением, главным образом, в малых дыхательных путях.
Кромоны
Хотя динатрий кромогликат и недокромил использовались для лечения астмы в течение многих лет, механизм их действия остается неизвестным. Клинические исследования показали, что они почти не оказывают бронхорасширяющего действия, уменьшая при этом как ранний, так и поздний аллергический ответ 9.Эти препараты безопасны и у отдельных пациентов с легкой формой астмы могут использоваться в качестве альтернативной противовоспалительной терапии 17, хотя в настоящее время предпочтительны низкие дозы ингаляционных стероидов.
Метилксантины
Неселективные ингибиторы циклической нуклеотидной фосфодиэстеразы, такие как теофиллин, использовались для лечения бронхиальной астмы в течение нескольких десятилетий 18 и до сих пор включены в текущие руководящие принципы 1, 19.
Наряду с умеренным бронхорасширяющим эффектом 20, 21, ингибиторы фосфодиэстеразы уменьшают воспаление дыхательных путей 22, 23 и эффективны против аллергических реакций на ранней и поздней фазах.Механизмы, с помощью которых метилксантины вызывают эти эффекты, включают антагонизм аденозиновых рецепторов 24–26 и, за счет повышения внутриклеточных концентраций циклического аденозинмонофосфата 27, 28, прямой релаксантный эффект на гладкие мышцы, а также ингибирование высвобождения медиатора из воспалительных клеток 29
Клинические исследования показали, что влияние теофиллина на раннюю и позднюю фазы аллергического ответа не может быть объяснено его умеренным бронходилатирующим эффектом 20, 30, который, если вообще может быть продемонстрирован только в ответ на очень высокие дозы, которые часто сопровождается побочными эффектами.Более вероятно, что эффекты на аллергическую реакцию, которые могут наблюдаться даже после низких доз теофиллина, являются результатом прямого воздействия на воспалительные клетки 22, 31.
Использование теофиллина часто ограничивается его побочными эффектами, которые, вероятно, являются результатом неселективного ингибирования изоферментов фосфодиэстеразы. Поэтому в последние годы исследования лекарственных средств были направлены на разработку селективных ингибиторов фосфодиэстеразы с уменьшенными побочными эффектами.
Антагонисты лейкотриеновых рецепторов и ингибиторы синтазы
Лейкотриены и гистамин являются наиболее важными медиаторами аллергической астмы 32 и высвобождаются после контакта с аллергеном из тучных клеток, эозинофилов и базофилов.Хотя антигистаминные препараты не обладают доказанным и задокументированным действием при астме, были разработаны «антилейкотриены», которые ингибируют либо синтез лейкотриенов (ингибиторы 5-липоксигеназы), либо взаимодействие лейкотриенов с их рецепторами. На сегодняшний день три препарата из этого класса антилейкотриенов, которые были одобрены для комбинации с ингаляционными стероидами в различных частях мира, антагонисты лейкотриеновых рецепторов, монтелукаст, зафирлукаст и пранлукаст 33. В клинических исследованиях было показано, что монтелукаст снижает бронхоспазм, вызванный аллергеном и физической нагрузкой.Другие исследования продемонстрировали, что ингибирование лейкотриенового пути может уменьшить симптомы астмы, повысить функцию легких и сократить использование спасательных препаратов 34. Однако только определенная подгруппа пациентов, включая некоторых пациентов с тяжелой астмой, по-видимому, реагирует на лечение антилейкотриенами. Хотя было указано, что пациенты с аспириновой астмой могут получить пользу от этого лечения 35, к сожалению, невозможно определить подгруппу заранее.
Комбинированная терапия
Ингаляционные стероидные препараты, отдельно или в сочетании с агонистами β 2 -адренорецепторов длительного действия 36, составляют основу длительного лечения астмы.В зависимости от тяжести астмы эту комбинацию лекарств можно дополнить ингибитором фосфодиэстеразы теофиллином не только из-за его легкого бронходилатирующего действия, но и из-за его предполагаемых стероидсберегающих эффектов 37.
Комбинирование глюкокортикоидов и β
2 агонистов адренорецепторовКомбинированные ингаляторы, содержащие агонист β 2 -адренорецепторов длительного действия и ингаляционный стероид, , т.е. салметерол / флутиказон-дипропионат 36, 38-40 и формотерол / будесонид 6, 41 совсем недавно были одобрены для лечения астма и хроническая обструктивная болезнь легких.Фиксированная комбинация, по крайней мере, так же эффективна, как оба ее компонента индивидуально, и имеет то преимущество, что пациент должен использовать только один ингалятор, что, как ожидается, хотя и не доказано, повысит приверженность к терапии 38. Кроме того, она имеет Было показано, что добавление агониста β 2 -адрецептора длительного действия к ингаляционному стероиду дает большее клиническое преимущество, чем удвоение дозы ингаляционных стероидов у пациентов с симптоматической астмой 36, 42. Комбинация обоих препаратов в одном ингаляторе не влияет ни на что. фармакодинамические и фармакокинетические характеристики, а также профили побочных эффектов отдельных веществ 40.
Сочетание глюкокортикоидов и теофиллина
Подобно результатам с агонистами β 2 -адренорецепторов пролонгированного действия, теофиллин может оказывать стероидсберегающий эффект, т.е. добавление теофиллина может дать такой же или даже больший клинический эффект, чем удвоение дозы ингаляционного стероида 37, 43
Сочетание глюкокортикоидов и антилейкотриенов
Подобно агонистам β 2 -адренорецепторов длительного действия и теофиллину, антагонисты лейкотриеновых рецепторов, как было продемонстрировано в недавно опубликованном клиническом исследовании, обладают стероидсберегающим эффектом.Добавление агониста лейкотриеновых рецепторов монтелукаста к текущему лечению снизило потребность в ингаляционных кортикостероидах среди пациентов, которым для поддержания контроля над астмой требуются умеренные или высокие дозы кортикостероидов 44.
Клинический подход
Согласно руководящим принципам, астма по степени тяжести может быть классифицирована как перемежающаяся, легкая стойкая, умеренно стойкая или тяжелая стойкая на основе стандартизированной оценки симптомов астмы и функции легких в сочетании с текущим лекарством 1, 17, 45.Несмотря на то, что эти критерии классификации были опубликованы в 1995 году, категории все еще действительны и, вероятно, будут сохранены в следующих рекомендациях Глобальной инициативы по борьбе с астмой, которые будут опубликованы в ближайшем будущем. Клиническая классификация степени тяжести астмы лежит в основе поэтапного подхода к фармакотерапии астмы. Однако, помимо и независимо от степени тяжести или «шага», важной целью всегда должно быть предотвращение или контроль триггеров астмы. «Пошаговый» подход представлен в таблице 1⇓.
Таблица 1Краткое изложение поэтапного подхода к лечению астмы *
В целом, лекарства от астмы можно разделить на две группы: 1) регуляторы, такие как кортикостероиды, которые принимаются ежедневно на долгосрочной основе для лечения и удержания стойкой астмы под контролем; и 2) вспомогательные средства, например, β 2 Агонисты -адренорецепторов, которые быстро действуют для облегчения бронхоспазма и сопровождающих его острых симптомов, таких как кашель, стеснение в груди и хрипы, и которые также могут использоваться по мере необходимости, i.е. как спасательное средство.
При лечении пациентов с перемежающейся астмой (этап 1) агонисты β 2 -адренорецепторов короткого действия следует использовать по мере необходимости для облегчения симптомов и предотвращения тех, которые спровоцированы физическими упражнениями или воздействием аллергенов. Если контроль не достигнут и симптомы требуют применения агонистов β 2 -адренорецепторов более одного раза в неделю, следует рассмотреть возможность повышения.
Пациенты с устойчивой астмой легкой степени (этап 2) должны, в первую очередь, ежедневно лечиться ингаляционными стероидами, 200–500 мкг, или, в качестве альтернативы, кромонами (см. Предыдущие комментарии) или теофиллином с замедленным высвобождением.Для облегчения острых симптомов следует использовать ингаляционные агонисты β 2 -адренорецепторов в дозах, не превышающих трех или четырех применений в день. Если астма недостаточно контролируется, доза ингаляционного стероида может быть увеличена (до 800 мкг) и / или добавлен агонист β 2 -адренорецепторов длительного действия, особенно при стойких ночных симптомах.
Лечение персистирующей астмы средней степени тяжести (этап 3) включает ингаляционные кортикостероиды в дозе 800–2000 мкг и использование агонистов β 2 -адренорецепторов длительного действия.Специально для ночных симптомов могут быть добавлены теофиллин с замедленным высвобождением или пероральные агонисты β 2 -адренорецепторов длительного действия, а для лечения острых симптомов следует использовать бронходилататоры короткого действия по мере необходимости до трех или четырех раз. день. Добавление агониста β 2 -адренорецепторов длительного действия или теофиллина в низких дозах может иметь такой же или даже лучший эффект, чем удвоение дозы ингаляционного стероида. Дополнительным вариантом может быть лечение антилейкотриенами.
Пациенты с тяжелой персистирующей астмой (стадия 4) должны получать ингаляционные кортикостероиды в дозе ≥800–2000 мкг и агонисты β 2 -адренорецепторов длительного действия и / или теофиллин с замедленным высвобождением, а также пероральные кортикостероиды длительного действия. Для облегчения симптомов следует использовать агонисты β 2 -адренорецепторов короткого действия. Во время обострений пероральный прием кортикостероидов может потребоваться в любое время и на любом этапе. Если контроль сохраняется на любом из четырех этапов в течение ≥3 месяцев, следует оценить возможность постепенного постепенного сокращения лечения.
Варианты лечения
Установленные терапевтические стратегии, рекомендованные действующими руководящими принципами и основанные на понимании патофизиологических и иммунологических механизмов астмы, обсуждались выше. Существует еще много подходов и новых разработок, таких как специфическая иммунотерапия и цитокины, хемокины или агонисты / антагонисты молекул адгезии, а также моноклональные антитела, которые частично рассматриваются в других статьях этого дополнения.Выбор лечения отличается в зависимости от страны и должен учитывать удобство для пациента и наличие побочных эффектов. Кроме того, стоимость терапии и политика возмещения также влияют на терапевтические стратегии.
Однако, похоже, несмотря на все усилия, приложенные для разработки новых стратегий лечения астмы, признанные лекарственные препараты, такие как агонисты β 2 -адренорецепторов с длительным действием и ингаляционные кортикостероиды, остаются терапией первой линии, рекомендованной текущие руководящие принципы.В целом сегодняшние комбинации лекарств, которые в первую очередь снижают тонус гладких мышц дыхательных путей, с теми, которые обладают контролирующим действием на воспаление дыхательных путей, останутся завтрашним лечением в обозримом будущем.
- Получено 14 июня 2001 г.
- Принято 20 июня 2001 г.
Список литературы
- ↵
Глобальная инициатива по астме. Глобальная стратегия управления и профилактики астмы. Отчет о семинаре NHLBI / ВОЗ. Публикация №95‐3659. 1995.
- ↵
Rabe KF, Vermeire PA, Soriano JB, Maier WC. Клиническое ведение астмы в 1999 г .: исследование Asthma Insights and Reality in Europe (AIRE). Eur Respir J 2000; 16: 802–807.
- ↵
Sont JK. Как мы можем контролировать астму? Аллергия 1999; 54: 68–73.
- ↵
Butchers PR, Varday CJ, Johnson M. Salmeterol: мощный ингибитор пролонгированного действия высвобождения медиатора воспаления из легких человека.Br J Pharmacol 1991; 104: 672–676.
- ↵
Pauwels RA, Lofdahl CG, Postma DS, et al. Влияние ингаляционного формотерола и будесонида на обострения астмы. Международная исследовательская группа по установлению терапии формотеролом и кортикостероидами (FACET). N Engl J Med 1997; 337: 1405–1411.
- ↵
Кипс Дж. К., О’Коннор Б.Дж., Инман М.Д., Свенссон К., Пауэлс Р.А., О’Бирн П.М. Долгосрочное исследование противовоспалительного эффекта низких доз будесонида плюс формотерол по сравнению с высокими дозами будесонида при астме.Am J Respir Crit Care Med 2000; 161: 996–1001.
- ↵
Пауэлс Р.А., Buist AS, Calverley PM, Jenkins CR, Hurd SS. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких. Итоги семинара Глобальной инициативы NHLBI / ВОЗ по хронической обструктивной болезни легких (GOLD). Am J Respir Crit Care Med 2001; 163: 1256–1276.
- ↵
Диссе Б. Антимускариновое лечение заболеваний легких: от исследований к клинической практике.Life Sci 2001; 68: 2557–2564.
- ↵
Кокрофт Д.В., Мердок, Кентукки. Сравнительные эффекты ингаляционного сальбутамола, кромогликата натрия и дипропионата беклометазона на индуцированные аллергеном ранние астматические реакции, поздние астматические реакции и повышенную реактивность бронхов на гистамин. J Allergy Clin Immunol 1987; 79: 734-740.
- ↵
Suissa S, Ernst P, Benayoun S, Baltzan M, Cai B. Низкие дозы ингаляционных кортикостероидов и предотвращение смерти от астмы.N Engl J Med 2000; 343: 332–336.
- ↵
Barnes PJ, Adcock IM. NF-κB: ключевая роль в лечении астмы и новая мишень для терапии. Trends Pharmacol Sci 1997; 18: 46–50.
- ↵
Vayssiere BM, Dupont S, Choquart A, et al. Синтетические глюкокортикоиды, которые диссоциируют трансактивацию и трансрепрессию AP-1, проявляют противовоспалительную активность in vivo . Мол Эндокринол 1997; 11: 1245–1255.
- ↵
Barnes PJ, Pedersen S, Busse WW. Эффективность и безопасность ингаляционных кортикостероидов. Новые разработки. Am J Respir Crit Care Med 1998; 157: S1 – S3.
- ↵
Липуорт Б.Дж., Джексон СМ. Безопасность ингаляционных и интраназальных кортикостероидов: уроки нового тысячелетия. Drug Saf 2000; 23: 11–33.
- ↵
Тейлор Д.А., Дженсен М.В., Канабар В., и др. Дозозависимый эффект нового ингаляционного кортикостероида циклесонида на чувствительность дыхательных путей к аденозин-5′-монофосфату у пациентов с астмой. Am J Respir Crit Care Med 1999; 160: 237–243.
- ↵
Leach CL, Davidson PJ, Boudreau RJ. Улучшенное нацеливание на дыхательные пути с помощью дозированного ингалятора HFA-беклометазона, не содержащего CFC, по сравнению с CFC-беклометазоном. Eur Respir J 1998; 12: 1346–1353.
- ↵
Wettengel R, Berdel D, Hofmann D, et al. Asthmatherapie bei Kindern und Erwachsenen. Empfehlungen der Deutschen Atemwegsliga in der Deutschen Gesellschaft für Pneumologie. Мед Клин 1998; 93: 639–650.
- ↵
Weinberger M, Hendeles L. Теофиллин при астме. N Engl J Med 1996; 334: 1380–1388.
- ↵
Руководство по диагностике и лечению астмы. Отчет экспертной комиссии 2. Публикация № 1997 97‐4051. 1997.
- ↵
Пауэлс Р., ван Рентергем Д., Ван дер Стретен М., Йоханнессон Н., Перссон CGA.Влияние теофиллина и энпрофиллина на спазм бронхов, вызванный аллергеном. J Allergy Clin Immunol 1985; 76: 583–590.
- ↵
Ward AJ, McKenniff M, Evans JM, Page CP, Costello JF. Теофиллин: иммуномодулирующая роль при астме. Am Rev Respir Dis 1993; 147: 518–523.
- ↵
Баннер KH, Страница CP. Противовоспалительное действие теофиллина и селективных ингибиторов фосфодиэстеразы.Clin Exp Allergy 1996; 26: 2–9.
- ↵
Карлссон Дж-А. Теофиллин: противовоспалительное действие. В : Лефф А.Р., редактор. Фармакология и терапия легких и интенсивной терапии. США, McGraw-Hill, 1996; С. 609––620.
- ↵
Крими Н., Полоса Р., Мистретта А. Роль аденозина в патогенезе бронхиальной астмы. Recenti Prog Med 1989; 80: 372–376.
Карлссон Дж-А.Пурины и сенсорные нейропептиды при астме человека. Bull Eur Physiopathol Respir 1987; 23: 95–101.
- ↵
Coward W, Sagara H, Церковь MK. Астма, аденозин, тучные клетки и теофиллин. Clin Exp Allergy 1998; 28: 42–46.
- ↵
Бергстранд Х. Ингибирование фосфодиэстеразы и теофиллин. Eur J Respir Dis 1980; 109: 37–44.
- ↵
Хилл Дж. Э., Андерсон Дж. Л., Уиттен К. В..Кетамин подавляет вызванное агонистами накопление цАМФ в гладкомышечных клетках дыхательных путей человека. Джан Дж. Анаэст 1999; 46: 1172–1177.
- ↵
Louis R, Bury T., Corhay JL, Radermecker M. LY18665, ингибитор фосфодиэстеразы, ингибирует высвобождение гистамина из человеческих базофилов, легких и фрагментов кожи. Int J Immunopharmacol 1992; 14: 191–194.
- ↵
Ward JK, Belvisi MG, Fox AJ, et al. Модуляция холинергических бронхоконстрикторных реакций эндогенным оксидом азота и вазоактивным кишечным пептидом в дыхательных путях человека in vitro . Дж. Клин Инвест, 1993; 92: 736–742.
- ↵
Карлссон Дж-А. Противовоспалительное действие ингибиторов фосфодиэстеразы. In : Leff AR, ed. Фармакология и терапия легких и интенсивной терапии. США, McGraw-Hill, 1996; С. 621––633.
- ↵
Рокет А., Дален Б., Кумлин М., и др. Комбинированный антагонизм лейкотриенов и гистамина вызывает преимущественное ингибирование индуцированной аллергеном обструкции дыхательных путей в ранней и поздней фазах у астматиков. Am J Respir Crit Care Med 1997; 155: 1856–1863.
- ↵
Маркхэм А., Фолдс Д. Монтелукаст. Наркотики 1998; 56: 251–256.
- ↵
Drazen JM, Israel E, O’Byrne PM. Лечение астмы препаратами, изменяющими лейкотриеновый путь. N Engl J Med 1999; 340: 197–206.
- ↵
Dahlen B, Nizankowska E, Szczeklik A, et al. Преимущества от добавления ингибитора 5-липоксигеназы зилеутона к традиционной терапии астматиков с непереносимостью аспирина. Am J Respir Crit Care Med 1998; 157: 1187–1194.
- ↵
Шрусбери С., Пайк С., Бриттон М. Мета-анализ повышенной дозы ингаляционного стероида или добавления салметерола при симптоматической астме (МИАЗМА). BMJ 2000; 320: 1368–1373.
- ↵
Укена Д., Харнест Ю., Сакалаускас Р., и др. Сравнение добавления теофиллина к ингаляционным стероидам с удвоением дозы ингаляционных стероидов при астме. Eur Respir J 1997; 10: 2754–2760.
- ↵
Bateman ED, Britton M, Carillo T, Almeida J, Wixon C. Комбинированный ингалятор салметерола / флутиказона. Новое, эффективное и хорошо переносимое лекарство от астмы. Clin Drug Invest 1998; 16: 193–201.
Chapman KR, Ringdal N, Backer V, Palmqvist M, Saarelainen S, Briggs M. Салметерол и флутиказона пропионат (50/250 мкг) вводили с помощью комбинированного ингалятора Diskus : так же эффективно, как при введении через отдельных ингалятора Diskus. Can Respir J 1999; 6: 45–51.
- ↵
Спенсер К.М., Джарвис Б. Комбинация салметерола и флутиказона пропионата. Наркотики 1999; 57: 933–940.
- ↵
McGavin JK, Goa KL, Jarvis B. Ингаляционная комбинация будесонид / формотерол. Наркотики 2001; 61: 71–78.
- ↵
van Noord JA, Schreurs AJ, Mol SJ, Mulder PG. Добавление салметерола по сравнению с удвоило дозу флутиказона пропионата у пациентов с легкой и умеренной астмой. Thorax 1999; 54: 207–212.
- ↵
Эванс Д.А., Тейлор Д.А., Зеттерстрём О, Чунг К.Ф., О’Коннер Б.Дж., Барнс П.Дж.Сравнение низких доз ингаляционного будесонида плюс теофиллин и высоких доз ингаляционного будесонида при астме средней степени тяжести. N Engl J Med 1997; 337: 1412–1418.
- ↵
Lofdahl CG, Reiss TF, Leff JA, et al. Рандомизированное плацебо-контролируемое исследование действия антагониста лейкотриеновых рецепторов монтелукаста на снижение дозы ингаляционных кортикостероидов у пациентов с астмой. BMJ 1999; 319: 87–90.
- ↵
Британское торакальное общество.Руководство BTS по ведению хронической обструктивной болезни легких. Торакс 1997; 52: S1 – S28.
Лечение астмы: 3 шага к лучшему контролю над астмой
Лечение астмы: 3 шага к лучшему контролю над астмой
Следуйте этому трехэтапному подходу, чтобы держать симптомы астмы под контролем и предотвращать приступы астмы.
Персонал клиники МэйоЭффективное лечение астмы требует регулярного отслеживания симптомов и измерения того, насколько хорошо работают ваши легкие.Активное участие в управлении лечением астмы поможет вам в долгосрочной перспективе контролировать астму, предотвратить приступы астмы и избежать долгосрочных проблем.
Составьте вместе с врачом письменный план действий при астме. Этот письменный план послужит руководством по лечению астмы, адаптированным к вашим конкретным потребностям. Это поможет вам выполнить следующие три важных шага и вести записи о лечении астмы:
1. Отслеживайте свои симптомы
Ежедневно записывайте свои симптомы в дневник астмы.Запись симптомов поможет вам распознать, когда вам нужно скорректировать лечение в соответствии с вашим планом действий при астме. Используйте свой дневник астмы, чтобы записать:
- Одышка или свистящие звуки при выдохе (хрипы).
- Нарушение сна, вызванное одышкой, кашлем или хрипом.
- Стеснение или боль в груди.
- Использование быстродействующего (аварийного) ингалятора — запишите, когда вам нужно использовать быстродействующий ингалятор, такой как альбутерол (Proventil HFA, Ventolin HFA, ProAirHFA), и запишите, сколько вдохов вы делаете.
- Нарушения на работе, учебе, занятиях спортом или другой повседневной деятельности, вызванные симптомами астмы.
- Симптомы астмы во время тренировки.
- Изменение цвета мокроты при отхаркивании.
- Симптомы сенной лихорадки, такие как чихание и насморк.
- Все, что вызывает обострения астмы.
2. Запишите, насколько хорошо работают ваши легкие
Ваш врач может попросить вас периодически записывать результаты тестов на дыхание (функциональные тесты легких).Если ваши легкие не работают должным образом, возможно, ваша астма не находится под контролем. Существует два основных функциональных теста легких:
- Пиковый расход. Этот тест проводится дома с помощью простого портативного устройства, называемого пикфлоуметром. Измерение пиковой скорости выдоха показывает, насколько быстро вы можете вытеснить воздух из легких. Показания пикового потока иногда измеряются как процент от того, как ваши легкие работают наилучшим образом. Это называется вашим личным лучшим пиковым расходом.
Спирометрия.Спирометрию можно сделать в кабинете врача с помощью прибора, называемого спирометром. Некоторые люди используют портативный спирометр для измерения дома.
Спирометрические тесты измеряют, сколько воздуха могут удерживать ваши легкие и сколько воздуха вы можете выдохнуть за одну секунду после глубокого вдоха. Это измерение называется объемом форсированного выдоха (ОФВ1). Ваш показатель ОФВ1 сравнивается с типичным значением ОФВ1 для людей, не страдающих астмой. Как и в случае с показаниями пикового расхода, это сравнение часто выражается в процентах.
3. Отрегулируйте лечение в соответствии с вашим планом действий при астме
Когда ваши легкие работают не так хорошо, как должны, вам может потребоваться скорректировать прием лекарств в соответствии с планом, который вы заранее составили с врачом. Ваш письменный план действий при астме позволит вам точно знать, когда и как вносить изменения.
Приведенная ниже таблица может помочь вам определить, хорошо ли вы справляетесь с астмой. Подобная система должна быть включена в ваш план действий при астме.В зависимости от того, где в таблице находится ваш контроль астмы, вам может потребоваться скорректировать свои лекарства.
| Хорошо контролируемый ЗЕЛЕНАЯ ЗОНА | Плохо контролируемый ЖЕЛТАЯ ЗОНА | Очень плохо контролируется КРАСНАЯ ЗОНА | |
|---|---|---|---|
| Симптомы, такие как кашель, хрипы или одышка | Два дня в неделю или меньше | Более двух дней в неделю | Ежедневно и всю ночь |
| Ночное пробуждение | Два раза в месяц или реже | Один-три раза в неделю | Четыре раза в неделю или чаще |
| Влияние на повседневную деятельность | Нет | Некоторые ограничения | Чрезвычайно ограниченный |
| Использование быстродействующего ингалятора для контроля симптомов | Два дня в неделю или меньше | Более двух дней в неделю | Несколько раз в день |
| Показания исследования легких | Более 80% вашего личного рекорда | От 60 до 80% вашего личного лучшего прогноза | Менее 60% вашего личного лучшего прогноза |
Существует два основных типа лекарств, используемых для лечения астмы:
- Лекарства длительного контроля , такие как ингаляционные кортикостероиды, являются наиболее важными лекарствами, используемыми для контроля астмы.Эти профилактические препараты лечат воспаление дыхательных путей, которое приводит к симптомам астмы. При ежедневном использовании эти лекарства могут уменьшить или устранить обострения астмы.
- Ингаляторы быстрого действия содержат быстродействующие лекарства, такие как альбутерол. Эти лекарства иногда называют ингаляторами для экстренной помощи. Их используют по мере необходимости, чтобы быстро открыть дыхательные пути и облегчить дыхание. Знание того, когда использовать эти лекарства, может помочь предотвратить надвигающийся приступ астмы.
Лекарства долгосрочного контроля — ключ к удержанию астмы под контролем и в зеленой зоне.Если вы часто используете быстродействующий ингалятор для лечения симптомов, ваша астма не находится под контролем. Обратитесь к врачу по поводу изменения режима лечения.
Убедитесь, что вы знаете, как правильно принимать лекарства от астмы. Они будут держать вашу астму под контролем, только если вы будете их правильно использовать.
Проконсультируйтесь с врачом
Симптомы и тяжесть астмы постоянно меняются. Следование вашему плану поможет вам избежать приступов астмы и свести к минимуму сбои, вызванные ее симптомами.
Регулярно посещайте врача, чтобы пересмотреть свое лечение. Возьмите с собой дневник астмы и план действий, чтобы вы могли просмотреть их со своим врачом и внести необходимые изменения в свой план лечения.
Вот несколько причин, по которым вам может потребоваться изменить прием лекарств:
- Если у вас все еще наблюдаются неприятные симптомы, несмотря на то, что вы следуете своему плану, поговорите со своим врачом о возможном увеличении или изменении приема лекарств.
- Если ваша астма хорошо контролируется, вы можете уменьшить количество принимаемых лекарств.
- Если у вас есть триггеры сезонной аллергии, в определенное время года может потребоваться увеличить прием лекарств от астмы.
- Fanta CH. Обзор лечения астмы. https://www.uptodate.com/contents/search. По состоянию на 29 мая 2019 г.
- Краткий справочник по лечению астмы: Диагностика и лечение астмы. Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/sites/default/files/media/docs/asthma_qrg_0_0.pdf.По состоянию на 29 мая 2019 г.
- Инструменты для борьбы с астмой. Центры по контролю и профилактике заболеваний. https://www.cdc.gov/asthma/tools_for_control.htm. По состоянию на 29 мая 2019 г.
- Составьте план ведения астмы. Американская ассоциация легких. https://www.lung.org/lung-health-and-diseases/lung-disease-lookup/asthma/living-with-asthma/managing-asthma/create-an-asthma-action-plan.html. По состоянию на 29 мая 2019 г.
Продукты и услуги
- Книга: Книга домашних средств защиты клиники Мэйо
.
Раствор для инъекций: 1 мг / мл (1: 1000) | 0,01 мл / кг / доза подкожно (максимум 0,4–0,5 мл каждые 20 минут для 3 доз или каждые 4 часа при необходимости) | 0.2–0,5 мг подкожно каждые 20 минут (максимум 3 дозы) или каждые 2 часа при необходимости | Подкожное введение не более эффективно, чем ингаляция, и может иметь больше побочных эффектов. Применение у взрослых вызывает споры и может быть противопоказано при наличии серьезных сердечно-сосудистых заболеваний. | |
Раствор для инъекций: 1 мг / мл | <12 лет: 0.005–0,01 мг / кг каждые 20 минут до 3 доз; при необходимости можно повторять каждые 2–6 часов ≥ 12 лет: как для взрослых | 0,25 мг однократно подкожно Можно повторить через 15–30 минут (максимум 0,5 мг в течение 4 часов) | ||
Агонисты бета-2 короткого действия | ||||
4–8 затяжек каждые 20 минут для 3 доз, затем каждые 1–4 часа при необходимости | MDI так же эффективен, как распыленный раствор, если пациенты могут координировать ингаляционный маневр с помощью спейсера и удерживающей камеры. | |||
Раствор для распыления: 5 мг / мл и 0,63, 1,25 и 2,5 мг / 3 мл | 0,15 мг / кг (минимум 2,5 мг) каждые 20 минут для 3 доз, затем 0,15–0,3 мг / кг до 10 мг каждые 1–4 часа при необходимости В качестве альтернативы, непрерывное распыление 0,5 мг / кг / час | 2.5–5 мг каждые 20 минут на 3 приема, затем 2,5–10 мг каждые 1–4 часа при необходимости В качестве альтернативы, непрерывное распыление со скоростью 10–15 мг / час также эффективно, но увеличивает частоту побочных эффектов. | ||
4–8 затяжек каждые 20 минут для 3 доз, затем каждые 1–4 часа при необходимости | Левальбутерол представляет собой R -изомер альбутерола. 0,63 мг эквивалентно 1,25 мг рацемического альбутерола. Левальбутерол может иметь меньше побочных эффектов, чем альбутерол. | |||
Распыляемый раствор: 0,63 и 1,25 мг / 3 мл | 0,075 мг / кг (минимум 1.25 мг) каждые 20 минут для 3 доз, затем 0,075–0,15 мг / кг до 5 мг каждые 1–4 часа при необходимости В качестве альтернативы, непрерывное распыление 0,25 мг / кг / час | 1,25–2 мг каждые 20 минут на 3 приема, затем 1,25–5 мг каждые 1–4 часа при необходимости В качестве альтернативы, непрерывное распыление 5–7,5 мг / час | ||
Раствор для небулайзера: 500 мкг / 2.5 мл (0,02%) | 0,25–0,5 мг каждые 20 минут на 3 приема, затем каждые 2–4 часа при необходимости | 0,5 мг каждые 20 минут на 3 приема, затем каждые 2–4 часа при необходимости | Ипратропий следует добавлять к бета-2 агонистам и не использовать в качестве терапии первой линии. Можно смешивать в том же небулайзере, что и альбутерол. Доза, полученная от MDI, низкая и не изучалась при обострениях. | |
Ипратроприй и альбутерол | 20 мкг ипратроприя и 100 мкг альбутерола / вдох | 1 вдох каждые 30 минут для 3 доз, затем каждые 2–4 часа при необходимости | Ипратропиум продлевает бронхолитический эффект альбутерола. | |
Распыленный раствор: 0,5 мг ипратропия и 2,5 мг альбутерола во флаконе объемом 3 мл | 1,5 мл каждые 20 минут для 3 доз, затем каждые 2–4 часа при необходимости | 3 мл каждые 30 минут для 3 доз, затем каждые 2–4 часа при необходимости | ||
Таблетки: 2, 4, 8, 16 и 32 мг | Стационарный: 1 мг / кг каждые 6 часов в течение 48 часов, затем 0.5–1,0 мг / кг два раза в день (максимум 60 мг / день) до достижения PEF = 70% от прогнозируемого или личного наилучшего Амбулаторный импульс: 0,5–1,0 мг / кг два раза в день (максимум 60 мг / день в течение 3-5 дней) | Стационарный: 40–60 мг каждые 6–8 часов в течение 48 часов, затем 60–80 мг / день до достижения PEF = 70% от прогнозируемого или личного наилучшего Амбулаторный импульс: 40–60 мг однократно или в 2 приема в течение 5–7 дней | IV не имеет преимуществ перед пероральным приемом, если желудочно-кишечная функция в норме. Более высокие дозы не дают преимущества при тяжелых обострениях. Обычный режим заключается в продолжении частых многократных ежедневных доз до тех пор, пока ОФВ1 или ПСВ не станут равными 50% от прогнозируемого или личного наилучшего, а затем снижение дозы до двух раз в день, обычно в течение 48 часов. Терапия после госпитализации или посещения неотложной помощи может длиться 5–10 дней. Снижение дозы не требуется, если пациентам также назначают ингаляционные кортикостероиды. | |
Таблетки, распадающиеся при пероральном введении: 10, 15 и 30 мг | ||||
Раствор: 5, 10, 15, 20 и 25 мг / 5 мл | ||||
Таблетки: 1, 2.5, 5, 10, 20 и 50 мг | ||||
Раствор: 5 мг / мл и 5 мг / 5 мл | ||||
Как лечится астма? | AAFA.org
Лечение астмы
Хотя мы не можем вылечить астму, мы можем ее контролировать. Каждый случай астмы индивидуален, поэтому вы и ваш врач должны составить план лечения астмы специально для вас. В этом плане будет информация о ваших триггерах астмы и инструкции по приему ваших лекарств.
Посмотреть видео на YouTube
Что мне нужно знать о лекарствах от астмы?
Вы принимаете большинство лекарств от астмы, вдыхая их с помощью ингалятора или небулайзера. Но некоторые лекарства от астмы выпускаются в форме таблеток. Ингалятор или небулайзер позволяют лекарству попадать прямо в легкие.
Ингаляторы (также называемые буферами)
Есть два типа ингаляторов: дозирующий ингалятор (MDI) и ингалятор сухого порошка (DPI).
- Ингаляторы с отмеренными дозами: используйте баллончик с аэрозолем, вставленный в пластиковый мундштук, чтобы доставить короткую порцию лекарства
- Ингаляторы для сухого порошка: доставляют лекарство в виде сухого порошка с помощью специального ингалятора
Ингаляторы от астмы по всей стране
Различные типы ингаляторов
Чтобы ингаляторы работали хорошо, необходимо их правильно использовать.Но более половины всех людей, использующих ингаляторы, не используют их должным образом. Попросите врача или медсестру присмотреть за вами и проверить вашу технику. Если его все еще сложно использовать, у вас есть два варианта. Попросите их порекомендовать прокладку или камеру выдержки . Это устройство прикрепляется к ингалятору, чтобы облегчить его использование и помочь большему количеству лекарства попасть в легкие. Каждый может извлечь выгоду из использования распорки или удерживающей камеры, особенно дети. Или спросите об использовании ингалятора, активируемого дыханием, который автоматически высвобождает лекарство при вдохе.
Ингалятор вставлен в распорку или камеру
Небулайзеры
Небулайзер — это устройство с трубкой, которое принимает жидкое лекарство и превращает его в туман, который вы вдыхаете. Небулайзеры — это вариант для тех, кто испытывает трудности с использованием ингалятора от астмы.
Какие существуют виды лекарств от астмы?
Есть два типа лекарств от астмы: препараты длительного действия и быстродействующие. Разница между ними может сбивать с толку.Вот почему вам нужно понимать, что делает каждый вид лекарств и как они помогают при астме. Также важно научиться правильно использовать каждое лекарство. Всегда принимайте лекарства и следуйте инструкциям врача.
Лекарства длительного контроля
Лекарства длительного действия помогают предотвратить симптомы астмы и контролировать их. Для достижения наилучших результатов вам может потребоваться принимать это лекарство каждый день. Существует несколько видов препаратов длительного контроля:
- Ингаляционные кортикостероиды предотвращают и уменьшают отек дыхательных путей.Они также уменьшают количество слизи в легких. Это самые эффективные доступные лекарственные средства длительного контроля. Кортикостероиды — это не то же самое, что анаболические стероиды, которые принимаются некоторыми спортсменами и запрещены во многих спортивных мероприятиях.
- Вдыхаемые бета-агонисты длительного действия открывают дыхательные пути, расслабляя гладкие мышцы вокруг дыхательных путей. Если используется, этот тип лекарства всегда следует принимать в сочетании с ингаляционными кортикостероидами.
- Комбинированные ингаляционные лекарства содержат как ингаляционный кортикостероид, так и бета-агонист длительного действия.Если вам нужны оба этих лекарства, это удобный способ принимать их вместе.
- Biologics — это уколы или вливания, вводимые каждые несколько недель. Они работают, воздействуя на клетку или белок в вашем теле, чтобы предотвратить воспаление дыхательных путей. Они могут быть очень дорогостоящими и обычно назначаются только в том случае, если другие лекарства от астмы не помогают справиться с ней.
- Модификаторы лейкотриенов принимают в таблетках или в жидкой форме. Этот вид лекарства уменьшает отек дыхательных путей и расслабляет гладкие мышцы.
- Кромолин натрия — это ингаляционный нестероидный препарат. Он предотвращает отек дыхательных путей при контакте с возбудителем астмы.
- Теофиллин выпускается в виде таблеток, капсул, раствора и сиропа для приема внутрь. Это лекарство помогает открыть дыхательные пути, расслабляя гладкие мышцы.
- Пероральные кортикостероиды принимают в таблетках или в жидкой форме. Это лекарство может быть назначено для лечения приступов астмы, которые не поддаются лечению другими лекарствами от астмы.Они также используются в качестве долгосрочной терапии для некоторых людей с тяжелой астмой. Кортикостероиды — это не то же самое, что анаболические стероиды, принимаемые некоторыми спортсменами и запрещенные во многих спортивных мероприятиях.
Лекарства быстрой помощи
Вы используете лекарства быстрого действия, чтобы облегчить симптомы астмы, когда они случаются. Эти лекарства действуют быстро, расслабляя напряженные мышцы дыхательных путей. Это позволяет дыхательным путям открываться, чтобы воздух мог проходить через них. При появлении симптомов астмы следует принимать быстродействующее лекарство.Если вы принимаете это лекарство более двух дней в неделю, поговорите со своим врачом о том, как контролировать астму. Возможно, вам придется внести изменения в свой план лечения.
- Бета-агонисты короткого действия вводятся при вдыхании и быстро снимают симптомы астмы. Эти лекарства расслабляют гладкие мышцы дыхательных путей. Эти лекарства — лучший выбор для быстрого облегчения симптомов астмы.
- Мускариновые антагонисты длительного действия (LAMA) или холинолитики вдыхаются, но действуют медленнее, чем бета-агонисты короткого действия.Они используются как для контроля, так и для облегчения симптомов. Эти лекарства открывают дыхательные пути, расслабляя гладкие мышцы дыхательных путей. Они также уменьшают выработку слизи.
- Комбинированные препараты быстрого действия содержат как холинолитики, так и бета-агонисты короткого действия. Эта комбинация выпускается в виде ингалятора или небулайзера для ингаляций.
Может ли лекарство
в одиночку помочь моей астме?Обычно нет. Хотя лекарства очень помогают, в одиночку они не справятся.Вы должны по возможности избегать вещей, которые вызывают или провоцируют симптомы астмы. Триггеры астмы могут быть обнаружены снаружи или внутри вашего дома, в школе или на работе.
Всегда ли мне нужно принимать одинаковое количество лекарства?
Не всегда. Вы, вероятно, примете больше лекарств, когда начнете лечение, чтобы контролировать свою астму. Через некоторое время вы и ваш врач узнаете, какое лекарство (а) лучше всего контролирует вашу астму и сколько вам нужно. Как только ваша астма будет под контролем, можно будет уменьшить количество принимаемых вами лекарств.Цель этого пошагового метода — как можно скорее получить контроль над астмой, а затем контролировать ее с помощью как можно меньшего количества лекарств. После начала долгосрочной противовоспалительной терапии ваш врач будет контролировать вас каждые 1-6 месяцев.
Придется ли мне постоянно принимать лекарства?
Может и нет. Астма — это хроническое заболевание, которое поддается контролю, но не поддается лечению. По этой причине при длительном воздействии триггеров у вас, скорее всего, появятся симптомы астмы. Это так, даже если симптомы проявляются нечасто.Ваше лечение будет зависеть от тяжести и частоты ваших симптомов. Если ваша астма находится под контролем, ваше лечение будет сосредоточено на быстром облегчении острых симптомов и лечении эпизодов, когда они возникают.
Если ваши симптомы возникают в определенное время и вы знаете, что их вызвало, вы и ваш врач можете использовать эту информацию, чтобы выбрать лучшее лечение. Например, если у вас сезонная астма из-за определенной аллергии на пыльцу, вы можете принимать лекарства только тогда, когда эта пыльца находится в воздухе.Но такая специфическая астма встречается нечасто. Многие люди, страдающие астмой, принимают какие-либо лекарства почти или постоянно.
Поможет ли медицина мне лучше спать?
Да. Симптомы астмы часто возникают ночью. Многие люди просыпаются с такими симптомами астмы, как кашель или хрипы. Вы можете контролировать ночные симптомы, регулярно принимая лекарства от астмы.
Многие люди страдают аллергией на пылевых клещей и плесень, обнаруженные в постельных принадлежностях. Использование матраса или наволочек может помочь сдержать эти аллергены.Осушители также могут помочь снизить влажность в вашем доме, необходимую для существования пылевых клещей и плесени. Использование воздушных фильтров в спальне также может помочь уменьшить ночные симптомы, вызванные другими аллергенами, такими как домашние животные.
Помогут ли лекарства мне дышать лучше, когда я тренируюсь?
Да. Физические упражнения, особенно на холодном воздухе, могут вызвать воспаление дыхательных путей или бронхоспазм, вызванный физической нагрузкой (EIB). Обычно это контролируют быстродействующие лекарства от астмы, принимаемые до и во время тренировки.Благодаря этим лекарствам многие олимпийские и профессиональные спортсмены делают успешную спортивную карьеру даже при астме.
Есть ли побочные эффекты у лекарств от астмы?
Да. Все лекарства имеют побочные эффекты. Вы должны сообщить своему врачу всю историю своего здоровья, а не только симптомы астмы. Расскажите своему врачу, как вы реагируете на лечение и есть ли у вас какие-либо побочные эффекты. Регулярно консультируйтесь с врачом, чтобы контролировать астму с наименьшим количеством лекарств и с наименьшими побочными эффектами.
Что делать, если лекарства не помогают при симптомах астмы?
Бронхиальная термопластика — это вариант лечения для людей, симптомы астмы которых не купируются лекарствами. Это серия процедур, в которых используется нагревательное устройство для уменьшения избытка гладких мышц в дыхательных путях. Это может уменьшить количество эпизодов или приступов астмы у людей с тяжелой астмой. AAFA выступила с заявлением в поддержку бронхиальной термопластики как варианта без лекарств для людей с тяжелой неконтролируемой астмой.
Медицинское обозрение, сентябрь 2015 г.
Астма: диагностика и лечение — Европейский медицинский журнал
ИСТОРИЯ
Астма — разнородное заболевание, поражающее многих людей. Во всем мире около 235 миллионов человек страдают астмой, 1 человек, а в 2015 году было около 383 000 смертей, связанных с астмой. 1 В одних только США ежегодные расходы на астму составляют приблизительно 56 миллиардов долларов, значительная часть этой суммы приходится на косвенные затраты, такие как количество дней, потерянных на работе или в школе. 2 У большинства пациентов астму можно контролировать с помощью соответствующей ингаляторной терапии. Для многих пациентов с тяжелой формой астмы значительный прогресс в области медицинской помощи позволил уменьшить количество обострений и улучшить качество жизни. Соответствующий диагноз, распознавание различных фенотипов и понимание различных вариантов лечения имеют первостепенное значение при ведении астмы. Этот обзор будет посвящен диагностике и лечению астмы.
ДИАГНОСТИКА
Астма — заболевание нижних дыхательных путей, поражающее мужчин и женщин всех возрастов.Диагноз ставится клинически, но единого «золотого стандарта» не существует; Патофизиология и клинические проявления астмы неоднородны, и возможен гипердиагностический клинический диагноз, особенно у пациентов без спирометрического подтверждения. 3 Таким образом, для диагностики астмы важны тщательный сбор анамнеза и физикальное обследование, а также спирометрия.
Клиническая презентация
Симптомы астмы могут быть неспецифическими и разнообразными, что затрудняет диагностику.Пациенты часто жалуются на хрипы, одышку и кашель, которые чаще возникают ночью и рано утром. 4 Симптомы часто носят эпизодический характер и могут быть вызваны различными триггерами, такими как раздражители, специфические аллергены и упражнения. Свистящее дыхание и ночная одышка сильно коррелируют с диагнозом астмы (относительный риск: 26% и 29% соответственно), а хрипы являются наиболее чувствительным и распространенным симптомом при диагностике астмы. 5,6 Респираторные симптомы, которые меняются со временем и по интенсивности, усиливаются ночью или утром и имеют определенные триггеры, связаны с более высокой вероятностью диагноза астмы. 7 С другой стороны, наличие хронического выделения мокроты, боли в груди и изолированного кашля без других респираторных симптомов снижает вероятность астмы. 7 Подробный сбор анамнеза — важный шаг в диагностике астмы, и для подтверждения наличия болезни необходимы доказательства переменного ограничения воздушного потока, подтвержденные врачом. 7
Дифференциальная диагностика
Астма может имитировать другие заболевания, поэтому важно учитывать различные дифференциальные диагнозы у пациентов с симптомами, подобными астме.Дифференциальный диагноз астмы включает заболевания верхних и нижних дыхательных путей, патологии сердечно-сосудистой и желудочно-кишечной систем, а также психические заболевания (вставка 1). 8 Например, застойная сердечная недостаточность может вызывать хрипы и затруднение воздушного потока из-за отека легких и закупорки легочных сосудов, имитируя астму. 9 Это состояние получило название «сердечная астма», и лечение основной сердечной недостаточности часто приводит к улучшению симптомов. 10
Вставка 1: Дифференциальный диагноз астмы.
Дисфункция голосовых связок (VCD) — еще один распространенный дифференциальный диагноз астмы. У этих пациентов часто возникают рецидивирующие обострения астмы, которые не поддаются лечению кортикостероидами или бронхолитиками. VCD вызывается эпизодической обструкцией внешних дыхательных путей из-за парадоксального движения голосовых связок и тесно связан с гастроэзофагеальным рефлюксом, ларингофарингеальным рефлюксом, тревогой и депрессией. 11 Распознавание VCD важно для ограничения ненужного воздействия кортикостероидов и использования медицинских услуг. 11
Хроническая обструктивная болезнь легких (ХОБЛ) — это прогрессирующая обструктивная болезнь легких, которая проявляется аналогично астме. Оба заболевания поражают мелкие дыхательные пути и обнаруживают обструкцию дыхательных путей при спирометрии; тем не менее, пациенты с ХОБЛ имеют ограниченную гиперчувствительность дыхательных путей (<12% улучшение форсированного выдоха за 1 секунду [FEV 1 ] после ингаляции бронходилататора при тесте функции легких [PFT]) и часто имеют значительный анамнез курения.Астма и ХОБЛ могут существовать как спектр обструктивных заболеваний, и иногда их трудно отличить друг от друга, особенно у пациентов с хронической, плохо контролируемой астмой, которая приводит к постоянной обструкции дыхательных путей из-за хронического воспаления и ремоделирования дыхательных путей, поскольку это может вызвать различить эти два заболевания труднее. 4,12 Некоторые из этих пациентов могут иметь хроническую стойкую обструкцию дыхательных путей с аспектами астмы и соответствовать диагнозу наложения синдрома астмы и ХОБЛ. 13 Понимание и распознавание этих двух болезненных процессов очень важно.
Спирометрия и бронхопровокационное тестирование
В настоящее время Глобальная инициатива по астме (GINA) и Национальная образовательная программа по профилактике астмы (NAEPP) рекомендуют спирометрическое тестирование у пациентов с подозрением на астму. 7,14,15 Астма характеризуется различной обструкцией дыхательных путей и гиперчувствительностью; преграда воздушного потока с коэффициентом ОФВ 1 / принудительная жизненная емкость легких <0.7 или меньше нижнего предела нормы (LLN) и обратимости воздушного потока после ингаляции бета-2-агониста короткого действия (SABA), определяемого как улучшение FEV 1 , по крайней мере, на 12% и 200 мл указывает на диагноз астмы. Однако, учитывая переменный характер обструкции воздушного потока, пациенты с астмой могут иметь нормальные результаты спирометрии.
У таких пациентов с нормальными результатами спирометрии бронхопровокация метахолином или маннитолом может быть полезна при диагностике астмы. Падение провокационной концентрации ОФВ 1 на> 20% (PC 20 <16 мг / мл), а в последнее время провокационная доза (PD 20 ) <400 мкг в настоящее время используется и рекомендуется для диагностики.Метахолин является прямым стимулятором гладкой мускулатуры дыхательных путей, связываясь с рецепторами ацетилхолина, вызывая бронхоспазм и обструкцию дыхательных путей, и является чувствительным инструментом для диагностики астмы. У пациентов с астмой будет повышенная реакция на ингаляцию метахолина, и этот тест можно использовать для диагностики астмы, особенно у пациентов с активной астмой. 16 Сухой порошок маннита является непрямым стимулятором сужения бронхов, который является более специфическим, чем чувствительным диагностическим средством.Несколько исследований показали, что и метахолин, и маннит имеют схожую чувствительность и специфичность при диагностике астмы, особенно у пациентов без активных симптомов. 17,18 Таким образом, бронхопровокационные тесты могут быть полезны для исключения астмы, особенно у пациентов, которые в настоящее время не получают лечение ингаляционными кортикостероидами (рис. 1).
Рисунок 1: Алгоритм диагностики астмы.
FEV 1 : объем форсированного выдоха за 1 секунду; ФЖЕЛ: функциональная жизненная емкость легких; PC 20 : провокационная концентрация, вызывающая снижение ОФВ на 20% 1 ; PD 20 : провокационная доза, вызывающая снижение ОФВ на 20% 1 ; PFT: исследование функции легких.
Фракционное выведение оксида азота
Оксид азота (NO), продуцируемый эпителием дыхательных путей, является косвенным маркером повышенного воспаления дыхательных путей. 19,20 Уровень NO в выдыхаемом воздухе можно легко измерить, и он использовался для обнаружения воспаления дыхательных путей у пациентов с подозрением на астму и с диагнозом астмы. Однако фракционная экскреция NO (FeNO) более чувствительна к эозинофильному воспалению дыхательных путей и не так полезна при диагностике неэозинофильной астмы. 19 Американское торакальное общество (ATS) рекомендует использовать измерения FeNO <25 частей на миллиард у взрослых, чтобы указать на более низкую вероятность эозинофильного воспаления и чувствительности к кортикостероидам. 20
Существуют противоречивые данные относительно использования FeNO для мониторинга астмы. Исследования показали, что повышенный уровень FeNO тесно коррелирует с тяжестью астмы и что использование FeNO и количества эозинофилов в мокроте для мониторинга астмы может помочь снизить общее воздействие ингаляционных кортикостероидов (ICS). 21,22 Однако исследование Shaw et al. 23 показали, что не было значительного снижения количества обострений астмы или общего объема использования ICS у тех, за которыми наблюдали с использованием FeNO, по сравнению с теми, кто не контролировался. Кроме того, исследование Szefler et al. 24 показали повышенные дозы ICS без улучшения симптомов у тех, кого контролировали с помощью тестирования FeNO, чем у пациентов без мониторинга FeNO. Несмотря на эти результаты, рекомендации ATS продолжают рекомендовать использование измерений FeNO для мониторинга активности заболевания у пациентов с астмой. 20,25
Тестирование с упражнениями
У пациентов с бронхоспазмом, вызванным физической нагрузкой, для диагностики можно использовать тест с нагрузкой. 26 Во время этого теста пациенты быстро увеличивают интенсивность упражнений на велотренажере или беговой дорожке каждые 2–4 минуты, чтобы достичь высокого уровня вентиляции, по крайней мере в 17,5–21,0 раз превышающего исходный уровень ОФВ 1 . Снижение ОФВ 1 > на 10% соответствует диагнозу EIB, при этом уровни > на 25% и <50% указывают на умеренную EIB, а > на 50% указывают на тяжелую EIB. 26 Проба с физической нагрузкой должна рассматриваться при подозрении на ЕИБ при отрицательном результате обследования.
ТЯЖЕСТЬ АСТМЫ
Понимание тяжести заболевания важно для лечения. NAEPP определяет серьезность как внутреннюю интенсивность заболевания до лечения с помощью долгосрочной контрольной терапии; 15 Понимание серьезности заболевания для начала терапии и достижения контроля над заболеванием подчеркивается в рекомендациях NAEPP.По степени тяжести астма бывает перемежающейся, легкой, средней, тяжелой и стойкой. Частота ежедневных симптомов, пробуждение в ночное время, использование SABA, нарушение нормальной жизнедеятельности и функция легких — все это компоненты, используемые для определения тяжести заболевания у не лечившихся астматиков.
GINA определяет степень тяжести астмы на основе интенсивности активного лечения для достижения хорошего контроля над заболеванием. Пациенты должны принимать контролирующие лекарства в течение нескольких месяцев, чтобы установить степень тяжести, с целью титрования лечения до минимально эффективного уровня для поддержания контроля. 7 Большинство пациентов могут добиться хорошего контроля симптомов с помощью контролирующих препаратов длительного действия; однако у пациентов со стойкими симптомами необходимо оценивать правильный диагноз, комплаентность, технику ингаляции, сопутствующие заболевания и постоянное воздействие сенсибилизирующих агентов.
Поскольку астма является клиническим заболеванием и спирометрические измерения не всегда отражают тяжесть заболевания пациента, были разработаны анкеты для контроля симптомов, которые были утверждены для количественной оценки симптомов пациента.К ним относятся контрольный тест на астму (ACT), опросник качества жизни при астме (AQLQ) и контрольный опросник астмы (ACQ), и их можно использовать при каждом посещении врача, чтобы лучше оценить симптомы пациента. 27-29
Кроме того, измерение пиковой скорости выдоха (PEFR) является важным объективным инструментом для мониторинга процесса болезни пациента и усиления режима контроля. Исследования Игнасио-Гарсия и Гонсалес-Сантос 30 и Lahdensuo et al. 31 показали, что субъекты с ежедневным домашним мониторингом PEFR в рамках программы самоконтроля астмы улучшили использование медицинских услуг, снизили потребление дополнительных лекарств и улучшили функцию легких. Однако, учитывая значительный разброс в измерениях PEFR, который может составлять > 20% в сутки, GINA в настоящее время рекомендует использовать мониторинг PEFR только для пациентов с тяжелой астмой и пациентов с нарушенным восприятием значительного ограничения воздушного потока. 7
ПАТОФИЗИОЛОГИЯ АСТМЫ И ЕЕ ФЕНОТИПЫ
Астма — хроническое заболевание дыхательных путей различной патофизиологии, которое включает эозинофильный, нейтрофильный, смешанный гранулоцитарный и пауцигранулоцитарный пути. Классический путь развития астмы включает высвобождение стромального лимфопоэтина тимуса эпителиальными клетками при попадании аллергена или инфекционного агента в дыхательные пути. Затем это активирует клетки Th3, которые продуцируют различные цитокины, включая IL-4, IL-5 и IL-13. Эти цитокины затем приводят к образованию IgE и активации эозинофилов, ответственных за гиперчувствительность дыхательных путей (рис. 2). 25 Активация тучных клеток посредством присоединения IgE к высокоаффинным рецепторам IgE приводит к высвобождению гистамина, цистеинил лейкотриенов и простагландинов, которые также участвуют в бронхостенозе. 32
Рисунок 2: Th3-патогенез астмы.
ILC2: врожденные лимфоидные клетки 2 типа; TSLP: лимфопоэтин стромы тимуса.
Неэозинофильный путь астмы включает активацию эпителиальных клеток дыхательных путей и макрофагов TLR4 и CD14, что приводит к продукции NFκB и IL-8, которые дополнительно активируют нейтрофилы. 33,34 Существует множество фенотипов и эндотипов астмы, каждый из которых имеет свою клиническую картину и патофизиологию. В предыдущих крупных исследованиях использовались клинические данные, такие как пол, возраст начала, аллергический статус, функция легких и симптомы астмы, для классификации пациентов с астмой в кластеры. Было описано множество различных фенотипов, но большинство из них можно отличить по раннему и позднему началу, наличию атопии и значительных аллергических симптомов, тяжести снижения функции легких и реакции на лечение. 32,35,36
К ранним аллергическим фенотипам относятся те, у кого в раннем детстве проявляются симптомы, которые сохраняются и во взрослом возрасте. У этих пациентов часто наблюдается повышение уровня IgE наряду с сопутствующими аллергическими и атопическими симптомами, и они хорошо реагируют на лечение, направленное на ответ Th3 и подавление IgE. С другой стороны, пациенты с поздним эозинофильным фенотипом имеют более тяжелые, стойкие симптомы, которые имеют менее аллергическое происхождение. Эти пациенты часто не реагируют на кортикостероиды, и их заболевание включает преимущественно активацию пути цистеинилового лейкотриена.Эозинофильный фенотип включает пациентов, у которых обнаруживается значительное количество эозинофилов в мокроте (> 2%) и которые имеют хороший ответ на кортикостероиды. Фенотип астмы, вызванной физической нагрузкой, включает активацию тучных клеток и цитокинов Th3, часто с легкими перемежающимися симптомами, которые возникают во время физических упражнений. Пациенты с фенотипом, связанным с ожирением, лишены биомаркеров Th3 и имеют менее четкий путь к гиперчувствительности дыхательных путей. Нейтрофильный фенотип включает пациентов со стойкой астмой, которые менее чувствительны к кортикостероидам.У этих пациентов часто повышается уровень нейтрофилов при обострениях, и они, как правило, лучше реагируют на биопрепараты и альтернативные методы лечения, включая терапию макролидами. Пациентам с чувствительностью к аспирину, астмой, вызванной физической нагрузкой, и бронхолегочным микозом потребуется дополнительное лечение, направленное на каждую неаллергическую причину. Таким образом, понимание различных фенотипов и эндотипов важно при выборе курса лечения.
По мере того, как мы лучше понимаем различные фенотипы астмы и биомаркеры, которые их идентифицируют, мы можем более точно нацелить медицинскую терапию и разработать новые агенты, нацеленные на определенные патологические пути астмы.
ЛЕЧЕНИЕ
Целью лечения астмы является контроль симптомов и предотвращение будущих обострений. 7,8 Это включает понимание неоднородной патофизиологии и фенотипов астмы и индивидуальный план лечения. Обучение пациентов и письменный план действий при астме могут повысить осведомленность об ухудшении симптомов, надвигающихся обострениях и необходимости титрования терапии для лучшего контроля симптомов. 7,8,15 Самоконтроль и общий подход к лечению также улучшают исходы астмы. 37,38 Кроме того, для всех пациентов с астмой критически важно обучение правильным методам использования ингаляторов, соблюдению режима приема лекарств и недопущению появления аллергенов и раздражителей.
Рекомендуется поэтапный подход к фармакологическому лечению. Первоначальный выбор лекарства определяется вышеупомянутой классификацией степени тяжести астмы по NAEPP (прерывистая, легкая, умеренная и тяжелая стойкая). 15 В зависимости от контроля симптомов в соответствии с рекомендациями GINA рекомендуется повышающая или понижающая терапия. 7 В настоящее время всем больным астмой рекомендуется иметь ингаляторы SABA для неотложной терапии. Пациентам с персистирующей астмой рекомендуется добавление низких доз ИКС в титруемых дозах. Пациентам с устойчивой астмой средней и тяжелой степени тяжести в схему ИКС часто добавляют агонисты бета-2 длительного действия (LABA) или ингибиторы лейкотриена. Для пациентов с более тяжелыми формами астмы, которые трудно поддаются контролю, можно рассмотреть возможность использования биологических агентов.
Бета-2 агонисты
Агонисты бета-2 являются бронходилататорами, которые играют важную роль в борьбе с астмой и лечении обострений.Они связываются с бета-2-адренорецепторами на гладкомышечных клетках бронхов, вызывая расслабление гладких мышц и расширение бронхов. 39,40 SABA часто используются для лечения легкой перемежающейся астмы и острых обострений, но не должны рассматриваться как контролирующее лекарство; Более частое использование SABA было связано с худшим контролем над астмой, и ICS иногда может быть добавлен к лечению пациентов с легкой перемежающейся астмой, чтобы ограничить использование SABA. 41 SABA наиболее эффективны при лечении острого бронхоспазма и имеют быстрое начало действия — 1–5 минут, с максимальным эффектом — через 2 часа и средней продолжительностью действия 3 часа. 42-44 Примеры SABA включают альбутерол, левалбутерол, тербуталин, метапротеренол и пирбутерол.
LABA включает салметерол и формотерол и может оказывать бронхолитическое действие продолжительностью более 12 часов. 44 Однако LABA следует назначать только в сочетании с ICS у пациентов с астмой. В крупном рандомизированном контрольном исследовании (SMART 45 ) было изучено более 26 000 пациентов с астмой и сравнили LABA (сальметерол) и плацебо при добавлении к обычному лечению астмы. Исследователи обнаружили, что у пациентов, получавших LABA, было больше смертей, связанных с респираторными заболеваниями и астмой, и у тех, кто получал плацебо.
Однако безопасность и преимущества комбинации LABA / ICS были продемонстрированы в нескольких исследованиях. Исследования Peters et al. 46 и O’Byrne et al. 47 показали, что использование комбинации LABA / ICS было связано с более низким риском обострения астмы и улучшением функции легких по сравнению с одним ICS. Таким образом, использование комбинированного ингалятора LABA – ICS является безопасным и потенциальным средством повышения эффективности лечения пациентов с астмой.
Кортикостероиды
Кортикостероиды являются неотъемлемой частью лечения обострений астмы и контроля хронических заболеваний, поскольку значительная часть астматических пациентов имеет воспалительный фенотип.ICS — важная часть постоянного лечения астмы, особенно для пациентов с эозинофильным фенотипом. Препараты снижают гиперчувствительность дыхательных путей и воспалительную реакцию на аллергены за счет подавления активации эозинофилов и тучных клеток. 48 Исследования показали, что использование ИКС (будесонида) улучшило измерения пиковой скорости потока у пациентов с астмой по сравнению с пациентами, получающими только лечение бета-агонистами. 49,50 ICS также снижает частоту обострений и улучшает функцию легких. 51,52 Было обнаружено, что у пациентов с персистирующей астмой средней и тяжелой степени добавление LABA к ICS является полезным. Исследования Kavuru et al. 53 и Шапиро и др. 54 показали, что комбинация салметерола и флутиказона приводила к улучшению PEFR, уменьшению количества симптомов, ночных симптомов и использованию альбутерола по сравнению с одним флутиказоном. Исследование O’Byrne et al. 47 показали, что только ICS снижает риск тяжелых обострений и плохо контролируемых дней симптомов, и что добавление LABA к ICS дополнительно улучшает общую функцию легких.Примеры доступных в настоящее время ICS включают беклометазон, триамцинолон, флунизолид, циклесонид, будесонид, флутиказон и мометазон.
Системные кортикостероиды особенно важны при лечении неконтролируемой астмы и обострений астмы. Кратковременное применение системных кортикостероидов может быть эффективным средством уменьшения системного воспаления и сужения бронхов. Однако длительное использование системных кортикостероидов не рекомендуется из-за их связи с многочисленными долгосрочными побочными эффектами, включая увеличение веса, гастрит, остеопороз, гипертензию, подавление надпочечников и психоз.Не существует стандартной рекомендованной продолжительности или дозировки кортикостероидов для лечения обострения астмы. 55 Пациенты, которые не могут быть отлучены от системных кортикостероидов для поддержания контроля над заболеванием, должны быть обследованы на предмет лечения биологическими препаратами и сопутствующих заболеваний и направлены к специалисту по астме.
Антагонисты лейкотриеновых рецепторов и ингибитор синтеза
Лейкотриены являются липидными медиаторами, участвующими в сужении бронхов и воспалении дыхательных путей.Лекарства, модифицирующие лейкотриены, включая зафирлукаст, монтелукаст и зилеутон, действуют путем ингибирования синтеза лейкотриенов или выступают в качестве конкурентных антагонистов рецепторов лейкотриена. 45 Цистинил лейкотриены высвобождаются из тучных клеток и эозинофилов и участвуют в сокращении гладких мышц бронхов и увеличении секреции слизи. 56 Действуя как антагонисты рецепторов и подавляя синтез лейкотриенов, эти препараты подавляют воспаление дыхательных путей; также было показано, что они улучшают симптомы астмы и функцию легких и служат в качестве дополнительной терапии к ICS.Текущие руководства рекомендуют использовать антагонисты лейкотриеновых рецепторов только в качестве альтернативного лечения ИГК у пациентов с умеренной персистирующей астмой, которые не переносят ИГК, и в качестве дополнительной терапии к тем, кто получает комбинированную ДДБА / ИКС.
Антимускариновые препараты
Использование антимускариновых средств для облегчения бронхоспазма и одышки насчитывает сотни лет. 57 Парасимпатическая система, контролируемая ацетилхолином и активацией мускариновых рецепторов, способствует сокращению гладких мышц дыхательных путей и секреции слизи. 58 Антимускариновые препараты используются для нарушения этой блуждающей активации мускариновых рецепторов, что приводит к последующей бронходилатации. Доступные в настоящее время мускариновые антагонисты короткого действия (SAMA) включают ипратропий, а мускариновые антагонисты длительного действия (LAMA) включают тиотропий, аклидиний, умеклидиний и гликопирроний.
И SAMA, и LAMA могут использоваться для лечения тяжелых, плохо контролируемых обострений астмы и в качестве дополнительной поддерживающей терапии к терапии LABA / ICS. 59 Peters et al. 60 изучали эффективность добавления тиотропия к беклометазону по сравнению с добавлением салметерола к беклометазону или удвоением дозы беклометазона у 210 пациентов с астмой. Результаты показали, что добавление тиотропия привело к большему улучшению PEFR, контрольных дней астмы, FEV 1 и ежедневных симптомов по сравнению с удвоением ICS или добавлением салметерола. 60 Кроме того, в двух повторных испытаниях, PrimoTinA-asthma 1 61 и PrimoTinA-asthma 2, 62 , изучалась эффективность тиотропия у пациентов с плохо контролируемой астмой при лечении высокими дозами ICS / LABA.Это исследование показало, что у тех, кто дополнительно получал тиотропий, улучшился ОФВ 1 и время до первого тяжелого обострения, а также снизился риск обострения на 21%. 63 LAMA остается потенциальным средством лечения для людей с плохо контролируемой астмой.
Биологическая терапия
Тем, кто страдает тяжелой астмой, следует тщательно рассмотреть возможность использования биологических агентов. Целенаправленное использование биологической терапии позволяет этим пациентам достичь контроля, ограничивая при этом пероральное воздействие кортикостероидов (таблица 1). 64-72 Омализумаб — первый одобренный биологический препарат для лечения астмы, который действует путем связывания с IgE и подавляет активацию воспаления дыхательных путей. В клинических испытаниях было показано, что омализумаб снижает общую частоту обострений астмы на 25% и тяжелых обострений на 50%, а также улучшает качество жизни пациентов с неконтролируемой астмой средней и тяжелой степени с постоянной чувствительностью к аэроаллергенам. 64
Таблица 1: Биопрепараты для лечения астмы.
FEV 1 : объем форсированного выдоха за 1 секунду; FeNO: фракционное выведение оксида азота; ИКС: ингаляционные кортикостероиды; LABA: агонисты бета-2 длительного действия.
Также доступны новые биологические агенты, нацеленные на пути IL-5. IL-5 является основным цитокином, ответственным за рост, дифференциацию и выживание эозинофилов, которые играют большую роль в воспалении дыхательных путей. Меполизумаб представляет собой гуманизированное моноклональное антитело против IL-5, следовательно, оно блокирует путь IL-5.Испытания меполизумаба показали снижение общей частоты обострений более чем на 50%, снижение частоты госпитализаций или обращений в отделение неотложной помощи на> 60%, улучшение показателей качества жизни и снижение дозы пероральных кортикостероидов на 50% для тех, кто постоянно принимает пероральные кортикостероиды. . 65,66
Reslizumab — еще одно моноклональное антитело против IL-5, которое одобрено для использования у пациентов с плохо контролируемой астмой и с уровнем IgE ≥400 клеток / мкл. Клинические испытания показали улучшение частоты обострений более чем на 50%, повышение качества жизни при астме и улучшение функции легких на 90–160 мл по сравнению с плацебо, особенно у пациентов с более высокими уровнями периферических эозинофилов. 67 Бенрализумаб также является моноклональным антителом против рецептора IL-5, которое заставляет собственные естественные клетки-киллеры организма нацеливаться на эозинофилы и выводить их из организма. Было показано, что он снижает частоту обострений более чем на 50%, снижает дозу хронического перорального приема кортикостероидов на 75% и улучшает функцию легких на 24%. 68,69
Другие биологические препараты включают дупилумаб, моноклональное антитело против рецептора IL-4, которое блокирует IL-4 и IL-13. По данным исследования фазы III, дупилумаб снижает частоту обострений, улучшает функцию легких и снижает хроническое употребление пероральных кортикостероидов. 70,71 Он особенно эффективен у пациентов с уровнем периферических эозинофилов> 300 клеток / мкл и уровнем FeNO ≥25 частей на миллиард. Тезепелумаб представляет собой моноклональное антитело, которое блокирует действие клеточного сигнального белка тимического стромального лимфопоэтина и подавляет воспалительный путь, ответственный за астму. Этот препарат в настоящее время проходит III фазу исследований, но в исследовании II фазы было показано значительное снижение частоты обострений астмы. 72 По мере того, как становятся доступными все новые биопрепараты, фенотипирование и эндотипирование каждого пациента необходимо, чтобы получить представление о наиболее подходящей долгосрочной терапии.
Бронхиальная термопластика
Бронхиальная термопластика (BT) предлагает немедикаментозную терапию для пациентов с астмой, не отвечающих на стандартное лечение ICS и бронходилататорами. BT использует тепловую энергию для бронхоскопической абляции гладких мышц дыхательных путей, чтобы уменьшить бронхоспазм и гиперплазию дыхательных путей. 73 Эффективность этого лечения первоначально была замечена в исследовании AIR в 2007 году, в котором пациенты с умеренной или тяжелой астмой были рандомизированы в группу BT или контрольную группу.У тех, кто получал BT, наблюдалось значительное улучшение утреннего PEFR, процента дней без симптомов и уменьшения количества баллов по симптомам. 74 Кроме того, исследование RISA рандомизировало 32 плохо контролируемых пациента с астмой в группу BT или контрольную группу и сообщило, что в группе BT увеличилась исходная краткосрочная заболеваемость, но значительно улучшились показатели FEV до приема бронходилататора 1 и оценка симптомов астмы. 75 За этими исследованиями последовало исследование AIR2, которое снова продемонстрировало значительное улучшение симптомов астмы и обострений у тех, кто был рандомизирован в группу BT. 74 BT, следовательно, может быть эффективным немедикаментозным лечением астмы у пациентов с тяжелым заболеванием, устойчивым к фармакотерапии; однако существуют значительные побочные реакции, связанные с БТ, включая опасные для жизни тяжелые обострения и смерть. 74,75
КОМОРБИДНЫЕ СОСТОЯНИЯ
Лечение сопутствующих заболеваний и предотвращение воздействия окружающей среды и аллергических факторов имеют важное значение в ведении астмы. Например, ожирение, гастроэзофагеальная рефлюксная болезнь, беспокойство и депрессия, ринит и синусит, а также сезонные и постоянные аллергии — все это связано с ухудшением симптомов астмы. 8,15,76-79 Дополнительные методы лечения, направленные на эти сопутствующие заболевания, могут значительно улучшить контроль над астмой, особенно у пациентов с тяжелой астмой.
ЗАКЛЮЧЕНИЕ
Астма — разнородное заболевание, от которого страдают миллионы людей во всем мире. Он характеризуется гиперчувствительностью дыхательных путей и воспалением дыхательных путей с различной обструкцией дыхательных путей. Понимание различных фенотипов и патофизиологий, а также предоставление индивидуального лечения, соответствующего сопутствующим заболеваниям и образу жизни пациента, имеет важное значение при лечении астмы.
.