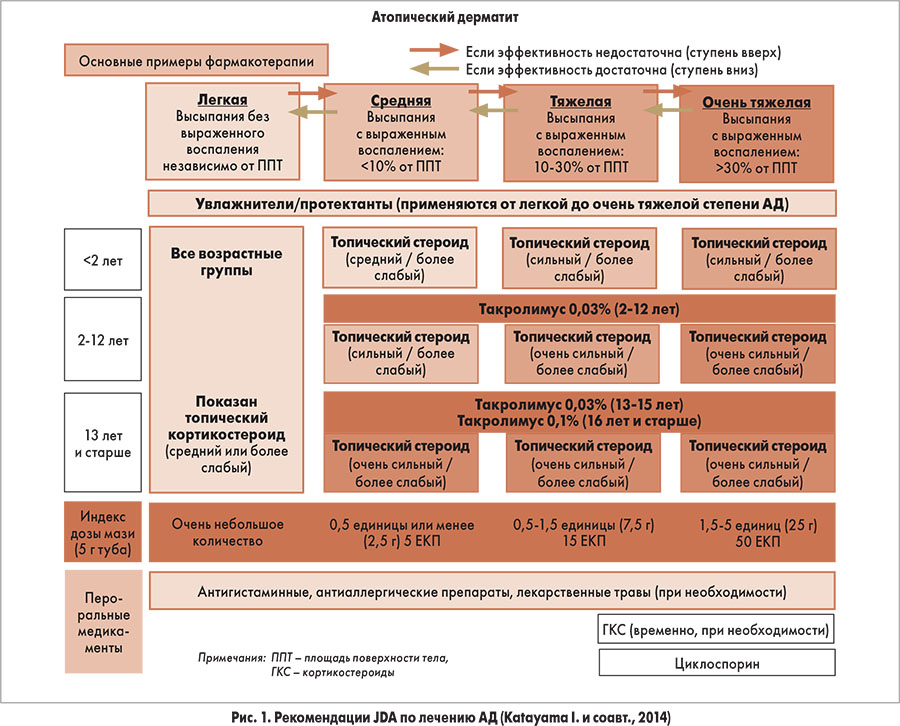
Риск возникновения побочных эффектов при применении интраназальных кортикостероидов
Согласно современным клиническим рекомендациям [1], интраназальные кортикостероиды (ИКС) широко применяются в клинической практике при лечении воспалительных заболеваний носа и околоносовых пазух различной этиологии. В зависимости от характера патологического процесса длительность применения ИКС может варьировать в широких пределах — от 1—2 нед до нескольких месяцев и лет [1].
В ряде исследований сообщается о случаях возникновения нежелательных эффектов и осложнений на фоне применения ИКС, однако такие публикации часто посвящены описанию отдельных наблюдений и не позволяют сделать вывод о причинно-следственной зависимости между использованием данной группы препаратов и патологическими изменениями в полости носа. В связи с этим очевидна актуальность анализа результатов релевантных исследований, в которых рассматриваются побочные эффекты применения ИКС. В целом побочные явления можно разделить на локальные и системные.
К наиболее часто встречающимся локальным побочным эффектам относятся носовые кровотечения, которые после применения ИКС в течение 3 мес и более регистрируются у 5—9% пациентов [2, 3]. Авторы отмечают, что существует связь между возникновением кровотечения и техникой применения ИКС, и считают, что причиной кровотечения скорее являются погрешности при использовании лекарственного средства, а не сами препараты.
Многочисленные публикации свидетельствуют о том, что регулярное использование ИКС сопровождается ощущениями сухости и жжения в носу, чиханием, дискомфортом в горле, неприятным послевкусием [4—6]. Однако данные жалобы, как правило, носят временный характер и разрешаются спонтанно без прекращения курса лечения [7].
Отмечено, что возникающая на фоне применения ИКС атрофия слизистой оболочки полости носа является существенным фактором риска перфорации перегородки носа [5]. А. Cervin и М. Andersson установили, что использование ИКС было общим фактором риска в 11 из 32 случаев, выявленных перфораций перегородки носа [8]. По данным шведского национального регистра, в течение 10 лет было зафиксировано 38 случаев перфорации перегородки носа вследствие применения ИКС. При этом в большинстве случаев перфорация была выявлена у молодых женщин в течение первых 12 мес от начала терапии [8]. Авторы другого исследования [9] скептически относятся к возможности возникновения атрофии слизистой оболочки полости носа под влиянием ИКС. Отмечено, что из 34 соответствующих публикаций термин «атрофия» слизистой оболочки полости носа упоминался в 17 статьях. При этом определение термина приводилось только в 10 публикациях, а в остальных оно значительно варьировало, отсутствовали также четкие гистологические доказательства повреждающего влияния ИКС на слизистую оболочку полости носа. Авторы отмечают, что связь между использованием ИКС и возникновением атрофии слизистой оболочки полости носа является мифом независимо от показаний, типа препарата, его дозы и длительности применения [9].
Andersson установили, что использование ИКС было общим фактором риска в 11 из 32 случаев, выявленных перфораций перегородки носа [8]. По данным шведского национального регистра, в течение 10 лет было зафиксировано 38 случаев перфорации перегородки носа вследствие применения ИКС. При этом в большинстве случаев перфорация была выявлена у молодых женщин в течение первых 12 мес от начала терапии [8]. Авторы другого исследования [9] скептически относятся к возможности возникновения атрофии слизистой оболочки полости носа под влиянием ИКС. Отмечено, что из 34 соответствующих публикаций термин «атрофия» слизистой оболочки полости носа упоминался в 17 статьях. При этом определение термина приводилось только в 10 публикациях, а в остальных оно значительно варьировало, отсутствовали также четкие гистологические доказательства повреждающего влияния ИКС на слизистую оболочку полости носа. Авторы отмечают, что связь между использованием ИКС и возникновением атрофии слизистой оболочки полости носа является мифом независимо от показаний, типа препарата, его дозы и длительности применения [9].
Отмечено, что кроме носовых кровотечений риск возникновения других нежелательных эффектов минимален [4, 7]. Менее характерными побочными эффектами от применения ИКС являются головная боль, тошнота, локальные грибковые инфекции [12]. Описан, в частности, единичный случай появления кандидоза полости носа у пациентки, принимавшей ИКС в течение 1,5 года [13]. Кроме полости носа кандидоз также может возникать в глотке [14].
Таким образом, единственным достоверным побочным эффектом от применения топических ИКС на локальном уровне является появление носовых кровотечений. В то же время данные о потенциальном риске возникновения перфораций перегородки носа на фоне терапии ИКС неоднозначны.
В то же время данные о потенциальном риске возникновения перфораций перегородки носа на фоне терапии ИКС неоднозначны.
Большинство локальных побочных эффектов может быть минимизировано путем правильного применения ИКС. Отмечено, что ключевое значение имеет объяснение пациентам того факта, что распыление препарата должно осуществляться в латеральном направлении для избегания контакта с перегородкой носа [5, 15].
Системные побочные эффектыНесмотря на то что применение системных глюкокортикостероидов сопровождается значительным количеством побочных эффектов, в отношении ИКС ситуация несколько иная. Как известно, для II поколения ИКС (мометазона фуроат, флутиказона пропионат, циклесонид, флутиказона фуроат) характерна минимальная биодоступность (менее 1%) по сравнению с более ранней генерацией данной группы препаратов (триамцинолона ацетонид, флунизолид, беклометазон, дексаметазон), системная биодоступность которых находится в пределах 34—49% [5].
Одним из наименее желаемых эффектов при применении системных кортикостероидов является торможение (задержка) роста детей. Установлено, что при применении рекомендуемых доз ИКС воздействие препарата на гипоталамо-гипофизарно-надпочечниковую систему минимально [17]. В исследовании E. Schenkel и соавт. [18] наблюдение за детьми, получавшими ИКС (мометазона фуроат в дозе 100 мкг 1 раз в сутки в течение 1 года), также не выявило влияния препарата на гипоталамо-гипофизарно-надпочечниковую систему или задержку роста. Указанные изменения не были зафиксированы и в исследовании с применением флутиказона пропионата (в дозе 200 мкг ежедневно) [19].
Вместе с тем при длительном применении ИКС в дозах, превышающих рекомендованные, отмечается возможность влияния препарата на темп роста [5]. D. Skoner и соавт. обследовали 100 детей препубертатного возраста, которые в течение года получали беклометазона дипропионат (в дозе 168 мкг) или плацебо. Было отмечено, что темп роста в группе детей, получавших ИКС, отличался от значений контрольной группы. Так, в исследуемой группе пациентов отставание в росте составило в среднем 1 см, но при этом изменения со стороны гипоталамо-гипофизарно-надпочечниковой системы отсутствовали [20]. В исследовании D. Lee и соавт. [21] небольшая группа пациентов получала 220 мкг триамцинолона ацетонида или 200 мкг мометазона фуроата в течение 3 нед, в итоге не было выявлено изменений в уровнях кортизола в моче и плазме, а также остеокальцина. Однако минимальное снижение утреннего кортизола было обнаружено у пациентов, принимавших ежедневно 400 мг беклометазона 1 или 2 раза в день [22]. Схожие результаты были получены и в исследовании с применением триамцинолона ацетонида [5].
Остается неоднозначным влияние ИКС на орган зрения. В ряде исследований обращается внимание на риск развития катаракты [5, 25] и/или глаукомы [26] на фоне применения ИКС, однако в других работах это не нашло достоверных доказательств. N. Ahmadi и соавт. проанализировали 10 исследований, в которых пациенты получали ИКС, и ни в одном не было выявлено различий в частоте возникновения глаукомы между контрольной и основной группами. В 6 других исследованиях также не было выявлено различий в возникновении катаракты и изменении прозрачности хрусталика глаза у лиц, применявших ИКС, и пациентов контрольной группы [27].
Схожие результаты наблюдались и у детей, получавших в течение 1 года мометазона фуроат (в дозе 100 мкг) или беклометазона дипропионат (в дозе 168 мкг), только у 1 пациента, принимавшего беклометазона дипропионат, было выявлено повышение внутриглазного давления [28]. Также не было выявлено появления глауком и катаракт в исследовании L. Derby и W. Maier, в котором в течение 3—9 мес пациенты получали 200 мг будесонида или 200 мкг беклометазона дипропионата [29]. В ретроспективном исследовании, включавшем 286 078 пациентов, принимавших ИКС, оральные стероиды или плацебо, не было выявлено различий в частоте развития катаракты в группе больных, принимавших ИКС, по сравнению с контролем [30].
Несмотря на то что инъекции кортикостероидов в носовые раковины и полипы не являются топическим применением, решение включить соответствующие данные в настоящий обзор связано с тем, что такое использование этой группы препаратов распространено в клинической практике. В исследовании W.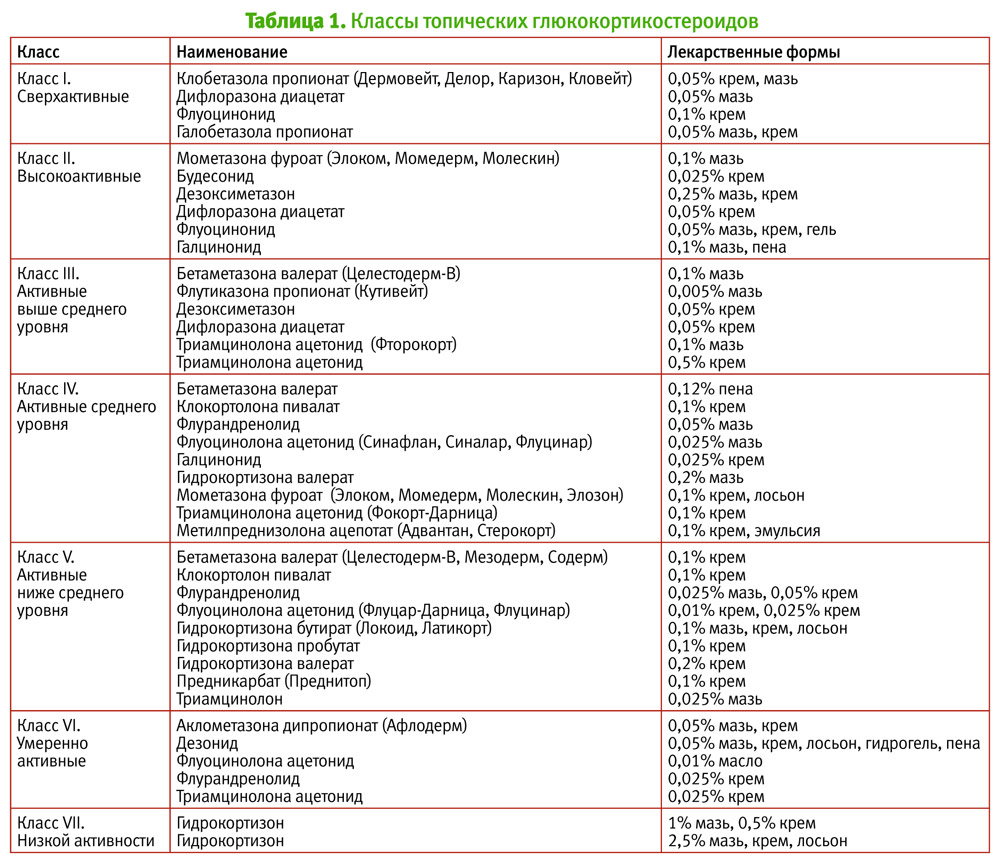 Moss и соавт. было выполнено 237 инъекций метилпреднизолона ацетата и триамцинолона ацетонида, из них 152 введения в нижние носовые раковины и 85 — в полипы. После выполнения инъекций в полип только у 1 пациента возникло осложнение в виде транзиторной слепоты, которая купировалась спонтанно. В дополнение авторы проанализировали еще 9 серий исследований, в которых было выполнено в общей сложности 117 669 инъекций, при этом только в 3 (0,003%) случаях возникли осложнения. В этих 3 случаях осложнения разрешились также спонтанно без остаточных явлений. Авторы отмечают, что при правильной технике выполнения инъекции риск развития осложнений минимален [31].
Moss и соавт. было выполнено 237 инъекций метилпреднизолона ацетата и триамцинолона ацетонида, из них 152 введения в нижние носовые раковины и 85 — в полипы. После выполнения инъекций в полип только у 1 пациента возникло осложнение в виде транзиторной слепоты, которая купировалась спонтанно. В дополнение авторы проанализировали еще 9 серий исследований, в которых было выполнено в общей сложности 117 669 инъекций, при этом только в 3 (0,003%) случаях возникли осложнения. В этих 3 случаях осложнения разрешились также спонтанно без остаточных явлений. Авторы отмечают, что при правильной технике выполнения инъекции риск развития осложнений минимален [31].
В литературе описано 3 случая полной слепоты, возникшей после инъекции кортикостероидов в слизистую оболочку перегородки носа. Однако при этом отмечается отсутствие достаточных сведений о технике введения препарата и показаний для такого рода вмешательств [32, 33].
Существует также мнение, что применение ИКС может оказывать влияние на уровень глюкозы у пациентов с сахарным диабетом. В исследовании, включавшем 1768 человек, принимавших ИКС в течение не менее 3 мес, было выявлено, что уровень глюкозы был значительно выше у больных, получавших триамцинолона ацетонид, по сравнению с пациентами, принимавшими другие ИКС. Однако уровень гликированного гемоглобина существенно не изменился ни в одной группе пациентов. Установлено, что длительные курсы лечения ИКС в целом являются безопасными для пациентов с сахарным диабетом, однако необходим постоянный мониторинг соответствующих показателей, в особенности у больных, получающих триамцинолона ацетонид [34].
В исследовании, включавшем 1768 человек, принимавших ИКС в течение не менее 3 мес, было выявлено, что уровень глюкозы был значительно выше у больных, получавших триамцинолона ацетонид, по сравнению с пациентами, принимавшими другие ИКС. Однако уровень гликированного гемоглобина существенно не изменился ни в одной группе пациентов. Установлено, что длительные курсы лечения ИКС в целом являются безопасными для пациентов с сахарным диабетом, однако необходим постоянный мониторинг соответствующих показателей, в особенности у больных, получающих триамцинолона ацетонид [34].
Несмотря на отсутствие серьезных системных побочных эффектов, анализ литературы выявил 1 случай острой надпочечниковой недостаточности, развившейся вследствие применения флутиказона пропионата, однако важно отметить, что данный пациент принимал дозу, превышающую рекомендованную [35]. Важно также подчеркнуть, что применение ИКС в утренние часы снижает нефизиологический эффект стероидов, так как препятствует вечернему снижению уровня кортизола [17].
При беременности не описано случаев тератогенного эффекта ИКС [36].
Отмечено, что терапевтический эффект, а также риск развития нежелательных явлений топических ИКС в значительной степени определяются частотой, длительностью применения и дозировкой препарата [5, 17]. При правильном использовании топических ИКС существенный риск возникновения побочных эффектов как системного, так и локального характера минимален [17].
Таким образом, использование ИКС последнего поколения существенно минимизирует риск возникновения любых побочных эффектов, однако, несмотря на это, необходимо контролировать состояние пациента в процессе лечения.
Автор заявляет об отсутствии конфликта интересов.
МЕСТО ТОПИЧЕСКОЙ СТЕРОИДНОЙ ТЕРАПИИ В ЛЕЧЕНИИ ОСТРОГО РИНОСИНУСИТА | Косяков
1. Fokkens W.J., Lund V.J., Mullol J. et.al. European Position Paper on Rhinosinusitis and Nasal Polyps. Rhinology. 2012; 50: 23: 1–299.
2. D. Passali, M.C. Spinosi, A. Crisanti, L. M. Bellussi. Mometasone furoate nasal spray: a systematic review. Multidisciplinary Respiratory Medicine (2016) 11: 18 DOI 10.1186/s40248—016–0054—3.
M. Bellussi. Mometasone furoate nasal spray: a systematic review. Multidisciplinary Respiratory Medicine (2016) 11: 18 DOI 10.1186/s40248—016–0054—3.
3. Ashworth M, Charlton J, Ballard K, Latinovic R, Gulliford M. Variations in antibiotic prescribing and consultation rates for acute respiratory infection in UK general practices 1995–2000. Br J Gen Pract. 2005; 55(517): 603–608.
4. Dosh SA, Hickner JM, Mainous AG III, Ebell MH; Upper Peninsula Research Network. Predictors of antibiotic prescribing for nonspecifi c upper respiratory infections, acute bronchitis, and acute sinusitis. An UPRNet study. J Fam Pract. 2000; 49(5): 407–414.
5. Snow V, Mottur-Pilson C, Hickner JM. Principles of appropriate antibiotic use for acute sinusitis in adults. Annals of International Medicine 2001; 134(6): 495–7.
6. Little DR, Mann BL, Godbout CJ. How family physicians distinguish acute sinusitis from upper respiratory tract infections: a retrospective analysis. Journal of the American Board of Family Practice 2000; 13(2): 101–6.
7. Zalmanovici Trestioreanu A, Yaphe J. Intranasal steroids for acute sinusitis. Cochrane Database Syst Rev. 2013; 12: CD005149.
8. Anand VK. Epidemiology and economic impact of rhinosinusitis. Ann Otol Rhinol Laryngol 2004; 113(Suppl 193): 3–5.
9. Pleis JR, Coles R. Summary health statistics for U.S. adults: National Health Interview Survey, 1998. National Center for Health Statistics. Vital Health Stat 2002; 10: 1–113.
10. Kaliner MA, Osguthorpe JD, Fireman P, et al. Sinusitis: bench to bedside. Current findings, future directions. Otolaryngol Head Neck Surg 1997; 116(6 Pt 2): S1–S20.
11. Рязанцев С.В. Принципы этиопатогенетической терапии острых синуситов: Методические рекомендации. 2013. – 40 с.
12. Денисов И.Н. Острый риносинусит: клинические рекомендации. 2014. – 27с.
13. Eccles R. Mechanisms of the symptoms of rhinosinusitis. Rhinology. 2011 Jun; 49(2): 131–8.
14. Lin SW, Wang YH, Lee MY, Ku MS, Sun HL, Lu KH, et al. Clinical spectrum of acute rhinosinusitis among atopic andnonatopic children in Taiwan. Int J Pediatr Otorhinolaryngol. 2012 Jan; 76(1): 70–5.
Int J Pediatr Otorhinolaryngol. 2012 Jan; 76(1): 70–5.
15. Melvin TA, Lane AP, Nguyen MT, Lin SY. Allergic rhinitis patients with recurrent acute sinusitis have increased sinonasal epithelial cell TLR9 expression. Otolaryngology-head and neck surgery: official journal of American Academy of Otolaryngology-Head and Neck Surgery.2010 May; 142(5): 659–64.
16. Vlastos I, Athanasopoulos I, Mastronikolis NS, Panogeorgou T, Margaritis V, Naxakis S, et al. Impaired mucociliary clearance in allergic rhinitis patients is related to a predisposition to rhinosinusitis. Ear, nose, & throat journal. 2009 Apr; 88(4): E17–9.
17. Spector SL, Bernstein IL, Li JT, Berger WE, Kaliner MA, Schuller DE, et al. Parameters for the diagnosis and management of sinusitis. Journal of Allergy and Clinical Immunology 1998; 102(Suppl): 107–44.
18. Zuskin E, Mustajbegovic J, Schachter EN, Kern J, Deckovic-Vukres V, Pucarin-Cvetkovic J, et al. Respiratory findings in pharmaceutical workers. Am J Ind Med. 2004 Nov; 46(5): 472–9.
2004 Nov; 46(5): 472–9.
19. Jaakkola MS, Jaakkola JJ. Office equipmentand supplies: a modern occupational health concern? Am J Epidemiol. 1999 Dec 1; 150(11): 1223-8.
20. Duclos P, Sanderson LM, Lipsett M. The1987 forest fire disaster in California: as ses sment of emergenc y room visits. Arch Environ Health. 1990 Jan-Feb; 45(1): 53–8
21. Winther B, Gwaltney JM Jr. Therapeutic approach to sinusitis: antiinfectious therapy as the baseline of management. Otolaryngology Head and Neck Surgery 1990; 103(5 (Pt 2)): 876–9.
22. Pitkaranta A, Arruda E, Malmberg H, et al. Detection of rhinovirus in sinus brushings of patients with acute community-acquired sinusitis by reverse transcription-PCR. J Clin Microbiol 1997; 35: 1791–3.
23. Pitkaranta A, Starck M, Savolainen S, et al. Rhinovirus RNA in the maxillary sinus epithelium of adult patients with acute sinusitis. Clin Infect Dis 2001; 33: 909-11.
24. MacNaughton MR. Occurrence and frequency of coronavirus infections in humans as determined by enzyme-linked immunosorbent assay. Infect Immun 1982; 38: 419–23.
Infect Immun 1982; 38: 419–23.
25. Gwaltney Jr JM, Sydnor Jr A, Sande MA. Etiology and antimicrobial treatment of acute sinusitis. Ann Otol Rhinol Laryngol 1981; 90: 68–71.
26. Wald ER, Milmoe GJ, Bowen A. Acute maxillary sinusitis in children. N Engl J Med 1981; 304: 749–54.
27. Gwaltney Jr JM. The common cold. In: Mandell GL, Douglas Jr RG, Bennett JE, editors. Principles and practice of infectious diseases. 3rd ed. New York (NY): Churchill Livingstone; 1990. p. 489–93.
28. Heikkinen T, Jarvinen A. The common cold. Lancet. 2003 Jan 4; 361(9351): 51-9.
29. Demoly P. Safety of intranasal corticosteroids in acute rhinosinusitis. Am J Otolaryngol. 2008; 29(6): 403–413.
30. Tutkun A, Inanli S, Batman C, Uneri C, Sehitoglu MA. The impact of intranasal steroid as an adjunct to therapy for sinusitis. Marmara Medical Journal 1996; 9(1): 11–4
31. Shapiro GG, Rachelefski GS. Introduction and definition of sinusitis. Journal of Allergy and Clinical Immunology 1992; 90: 417–8
32. Penagos M, Compalati E, Tarantini F, BaenaCagnani CE, Passalacqua G, Canonica GW. Efficacy of mometasone furoate nasal spray in the treatment of allergic rhinitis. Meta-analysis of randomized, double-blind, placebo-controlled, clinical trials. Allergy. 2008; 63(10): 1280–91.
Penagos M, Compalati E, Tarantini F, BaenaCagnani CE, Passalacqua G, Canonica GW. Efficacy of mometasone furoate nasal spray in the treatment of allergic rhinitis. Meta-analysis of randomized, double-blind, placebo-controlled, clinical trials. Allergy. 2008; 63(10): 1280–91.
33. Baldwin CM, Scott LJ. Mometasone furoate: a review of its intranasal use in allergic rhinitis. Drugs. 2008; 68(12): 1723–39.
34. Blaiss MS. Evolving paradigm in the management of allergic rhinitis associated ocular symptoms: intranasal corticosteroids. Curr Med Res Opin. 2008; 24(3): 821–36.
35. Slavin RG. Sinusitis in adults and its relation to allergic rhinitis, asthma, and nasal polyps. J Allergy Clin Immunol 1988; 82: 950–6.
36. Slavin RG, Spector SL, Bernstein IL. The diagnosis and management of sinusitis: a practice parameter update. J Allergy Clin Immunol 2005; 116: S13–S47.
37. Morris P., Leach A. Antibiotics for persistent nasal discharge (rhinosinusitis) in children. Cochrane Database Syst Rev 2008; (3): CD001094
38. Kassel JC, King D, Spurling GK. Saline nasal irrigation for acute upper respiratory tract infections. Cochrane Database Syst Rev. 2010; (3): CD006821
Kassel JC, King D, Spurling GK. Saline nasal irrigation for acute upper respiratory tract infections. Cochrane Database Syst Rev. 2010; (3): CD006821
39. Hildenbrand T, Weber R, Heubach C, Mosges R. Nasal douching in acute rhinosinusitis (Article in German). Laryngorhinootologie. 2011; 90(6): 346–51
40. Chow A. W., Benninger M. S., Brook I. et al. IDSA clinical practice guideline for acute bacterial rhinosinusitis in children and adults. Clin Infect Dis. 2012; 54 (8): e72–e112
41. Лопатин А.С., Свистушкин В.М. Острый риносинусит: этиология, патогенез, диагностика и принципы лечения. Клинические рекомендации. М.: Российское общество ринологов, 2009. 26 с.
42. Low DE, Desrosiers M, McSherry J, et al. A practical guide for the diagnosis and treatment of acute sinusitis. CMAJ. 1997; 156(Suppl 6): S1– S14.
43. Candy B, Hotopf M. Steroids for symptom control in infectious mononucleosis. Cochrane Database Syst Rev. 2006; 3: CD004402.
44. Russell K, Wiebe N, Saenz A, et al.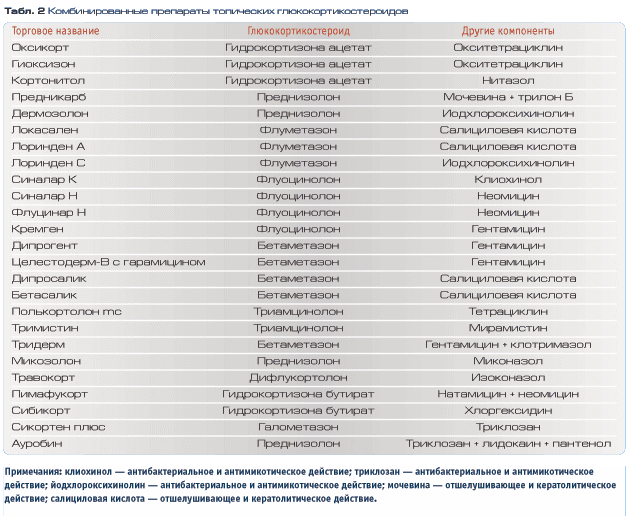 Glucocorticoids for croup. Cochrane Database Syst Rev. 2004; (1): CD001955.
Glucocorticoids for croup. Cochrane Database Syst Rev. 2004; (1): CD001955.
45. Hayward G, Thompson M, Heneghan C, Perera R, Del Mar CB, Glasziou P. Corticosteroids for pain relief in sore throat: systematic review and meta-analysis. BMJ. 2009; 339: b2976.
46. Mygind N, Nielsen LP, Hoffmann HJ, et al. Mode of action of intranasal corticosteroids. J Allergy Clin Immunol 2001; 108: S16–25.
47. Hutchison KA, Scherrer LC, Czar MJ, et al. Regulation of glucocorticoid receptor function through assembly of a receptor-heat shock protein complex. Ann NY Acad Sci 1993; 684: 35–48.
48. Wissink S, van de Stolpe A, Caldenhoven E, et al. NF-kappa B/Rel family members regulating the ICAM-1 promoter in monocytic THP-1 cells. Immunobiology 1997; 198: 50–64.
49. LeVan TD, Behr FD, Adkins KK, et al. Glucocorticoid receptor signaling in a bronchial epithelial cell line. Am J Physiol 1997; 272: L838–43.
50. Dolor RJ, Witsell DL, Hellkamp AS, et al, for the Ceftin and Flonase for Sinusitis (CAFFS) Investigators. Comparison of cefuroxime with or without intranasal fluticasone for the treatment of rhinosinusitis: The CAFFS trial: a randomized controlled trial. JAMA 2001; 286: 3097–105.
Comparison of cefuroxime with or without intranasal fluticasone for the treatment of rhinosinusitis: The CAFFS trial: a randomized controlled trial. JAMA 2001; 286: 3097–105.
51. Huang A, Govindaraj S. Topical therapy in the management of chronic rhinosinusitis. Curr Opin Otolaryngol Head Neck Surg. 2013; 21(1): 31 – 8.
52. G. Hayward, C. Heneghan, R. Perera, M. Thompson. Intranasal Corticosteroids in Management of Acute Sinusitis: A Systematic Review and Meta-Analysis. Ann Fam Med 2012; 10: 241–249. doi: 10.1370/afm.1338.
53. Kim KT, Rabinovitch N, Uryniak T, et al. Effect of budesonide aqueous nasal spray on hypothalamic-pituitary-adrenal axis function in children with allergic rhinitis. Ann Allergy Asthma Immunol 2004; 93: 61–7.
54. Bross-Soriano D, Hanenberg-Milver C, Schimelmitz-Idi J, et al. Effects of three nasal topical steroids in the intraocular pressure compartment. Otolaryngol Head Neck Surg 2004; 130: 187–91.
55. Opatowsky I, Feldman RM, Gross R.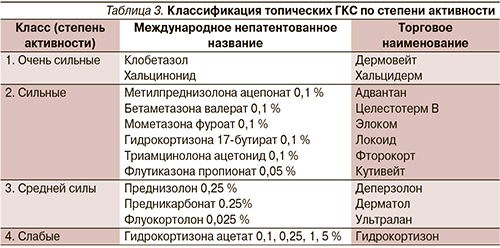 Intraocular pressure elevation associated with inhalation and nasal corticosteroids. Ophthalmology 1995; 102: 177–9.
Intraocular pressure elevation associated with inhalation and nasal corticosteroids. Ophthalmology 1995; 102: 177–9.
56. Affrime MB, Kosoglou T, Thonoor CM, Flannery BE, Herron JM. Mometasone furoate has minimal effects on the hypothalamic-pituitaryadrenal axis when delivered at high doses. Chest. 2000; 118(6): 1538 – 46.
57. Skoner DP, Meltzer EO, Milgrom H, Stryszak P, Teper A, Staudinger H. Effects of inhaled mometasone furoate on growth velocity and adrenal function: a placebo-controlled trial in children 4-9 years old with mild persistent asthma. J Asthma. 2011; 48(8): 848 – 59.
58. Schenkel EJ, Skoner DP, Bronsky EA, Miller SD, Pearlman DS, Rooklin A. Absence of growth retardation in children with perennial allergic rhinitis after one year of treatment with mometasone furoate aqueous nasal spray. Pediatrics 2000; 105: E22
59. Johnson M. Pharmacodynamics and pharmacokinetics of inhaled glucocorticoids. J Allergy Clin Immunol 1996; 97: 169–76.
60. Nayak AS, Settipane GA, Pedinoff A, et al, and the Nasonex Sinusitis Group. Effective dose range of mometasone furoate nasal spray in the treatment of acute rhinosinusitis. Ann Allergy Asthma Immunol 2002; 89: 271–8.
Effective dose range of mometasone furoate nasal spray in the treatment of acute rhinosinusitis. Ann Allergy Asthma Immunol 2002; 89: 271–8.
61. The Childhood Asthma Management Program Research Group. Long-term effects of budesonide or nedocromil in children with asthma. N Engl J Med 2000; 343: 1054–63.
62. Samoliński B, Nowicka A, Wojas O, Lipiec A, Krzych-Fa ł ta E, Tomaszewska A. Intranasal glucocorticosteroids not only in allergic rhinitis In the 40th anniversary of intranasal glucocorticosteroids ’ introduction. Otolaryngol Pol. 2014; 68(2): 51–64.
63. Penagos M, Compalati E, Tarantini F, BaenaCagnani CE, Passalacqua G, Canonica GW. Efficacy of mometasone furoate nasal spray in the treatment of allergic rhinitis. Meta-analysis of randomized, double-blind, placebo-controlled, clinical trials. Allergy. 2008; 63(10): 1280 – 91.
64. Baldwin CM, Scott LJ. Mometasone furoate: a review of its intranasal use in allergic rhinitis. Drugs. 2008; 68(12): 1723 – 39.
65. Blaiss MS. Evolving paradigm in the management of allergic rhinitis associated ocular symptoms: intranasal corticosteroids. Curr Med Res Opin. 2008; 24(3): 821 – 36.
Blaiss MS. Evolving paradigm in the management of allergic rhinitis associated ocular symptoms: intranasal corticosteroids. Curr Med Res Opin. 2008; 24(3): 821 – 36.
66. Nielsen LP, Dahl R. Comparison of intranasal corticosteroids and antihistamines in allergic rhinitis: a review of randomized, controlled trials. Am J Respir Med. 2003; 2(1): 55 – 65.
67. Weiner JM, Abramson MJ, Puy RM. Intranasal corticosteroids versus oral h2-receptor antagonists in allergic rhinitis: systematic review of randomised controlled trials. BMJ. 1998; 317(7173): 1624–9.
68. Fausnight TB, Craig TJ. Mometasone furoate dry powder inhaler for the treatment of asthma. Expert Opin Pharmacother. 2011; 12(17): 2707–12.
69. Milgrom H. Mometasone furoate in children with mild to moderate persistent asthma: a review of the evidence. Paediatr Drugs. 2010; 12(4): 213 – 21.
70. Mion OG, Mello JF Jr, Dutra DL, Andrade NA, Almeida WL, Anselmo-Lima WT et al. Position statement of the Brazilian Academy of Rhinology on the use of antihistamines, antileukotrienes, and oral corticosteroids in the treatment of inflammatory sinonasal diseases. Braz J Otorhinolaryngol. 2017 Mar – Apr; 83(2): 215–227.
Braz J Otorhinolaryngol. 2017 Mar – Apr; 83(2): 215–227.
Эффективность топических назальных стероидных спреев при лечении хронической заложенности носа
Ринит представляет собой воспаление слизистой оболочки, выстилающей носовые полости, и вызывает такие симптомы, как выделения из носа, заложенность или блокировка носового дыхания, зуд/дискомфорт в горле и кашель из-за заднего дренажа из носа. нос, и редко носовые кровотечения. Другие симптомы, вызванные основной аллергией (аллергический ринит), включают чихание и покраснение/слезотечение/зуд в глазах. Большинство людей с этими симптомами находят значительное облегчение при медикаментозной терапии, и существует множество вариантов лечения, которые следует учитывать. В редких случаях заложенность носа вызывается полипами или даже опухолями носа, которые не реагируют на лекарства и требуют немедленного медицинского вмешательства. Консультация с медицинским работником рекомендуется всем, у кого есть серьезные симптомы, которые приводят к необходимости длительного приема лекарств. Большинству пациентов с воспалительными причинами ринита наибольшую пользу принесут назальные стероидные спреи, и цель этого блога — объяснить, как их следует использовать и почему они эффективны.
Большинству пациентов с воспалительными причинами ринита наибольшую пользу принесут назальные стероидные спреи, и цель этого блога — объяснить, как их следует использовать и почему они эффективны.
Что такое назальные стероидные спреи для местного применения?
Стероидные спреи для местного применения содержат различные кортикостероидные препараты, которые уменьшают воспаление в носу, не затрагивая другие части тела. Некоторые из назальных стероидных спреев, доступных на рынке, включают триамцинолон, мометазон, беклометазон, флутиказон и будесонид. Уменьшение воспаления в носу уменьшает отек, улучшает носовое дыхание и снижает выработку слизи с последующим улучшением носового дренажа и постназального затекания. Потенциальные побочные эффекты назальных стероидных спреев включают носовые кровотечения, сухость в носу и корки в носу. Пациенты, испытывающие эти побочные эффекты, должны прекратить использование спреев на несколько дней, пока эти симптомы не исчезнут, после чего можно безопасно возобновить спреи. Назальные стероидные спреи не должны использоваться пациентами с невылеченными инфекциями носа, беременными женщинами или сразу после операции на носу без предварительной консультации с врачом.
Назальные стероидные спреи не должны использоваться пациентами с невылеченными инфекциями носа, беременными женщинами или сразу после операции на носу без предварительной консультации с врачом.
Сколько времени нужно, чтобы спрей подействовал?
Топические назальные стероидные спреи не обеспечивают немедленного облегчения и требуют от нескольких дней до двух недель, чтобы обеспечить заметное улучшение симптомов у многих пациентов. Как и любое лекарство от хронического заболевания, они эффективны только при ежедневном применении. Врач может попросить пациентов с тяжелым воспалением носа использовать назальные стероидные спреи два раза в день, пока их состояние не улучшится. Когда симптомы вызваны сезонной аллергией (пыльца присутствует только в определенное время года), может быть необходимо использовать назальный стероидный спрей только в периоды симптомов.
Избегайте ловушек
Противозастойные спреи, такие как Afrin®, хотя и эффективны для немедленного уменьшения заложенности носа, никогда не должны использоваться более 3 дней подряд из-за риска развития рецидивирующей заложенности носа и прогрессирующего повреждения слизистой оболочки носа (медикаментозный ринит). ). Противоотечные спреи при длительном применении также могут вызвать перфорацию носовой перегородки. Хотя это и не является настоящей зависимостью, прекращение использования противоотечных спреев может быть трудным для многих пациентов, которые чувствуют, что их нос полностью заложен, когда они не используют спреи часто. Топические назальные стероидные спреи, заменяемые противоотечными спреями, помогают уменьшить отек и улучшить носовое дыхание без рикошетных эффектов и безопасны при длительном использовании. В некоторых случаях лекарств может быть недостаточно для облегчения заложенности носа из-за хронического злоупотребления назальными деконгестантами, и может потребоваться хирургическое вмешательство в виде уменьшения носовых раковин. Консультация с врачом, специализирующимся на носовых заболеваниях, может помочь пациентам найти наиболее эффективные методы лечения их конкретных заболеваний.
). Противоотечные спреи при длительном применении также могут вызвать перфорацию носовой перегородки. Хотя это и не является настоящей зависимостью, прекращение использования противоотечных спреев может быть трудным для многих пациентов, которые чувствуют, что их нос полностью заложен, когда они не используют спреи часто. Топические назальные стероидные спреи, заменяемые противоотечными спреями, помогают уменьшить отек и улучшить носовое дыхание без рикошетных эффектов и безопасны при длительном использовании. В некоторых случаях лекарств может быть недостаточно для облегчения заложенности носа из-за хронического злоупотребления назальными деконгестантами, и может потребоваться хирургическое вмешательство в виде уменьшения носовых раковин. Консультация с врачом, специализирующимся на носовых заболеваниях, может помочь пациентам найти наиболее эффективные методы лечения их конкретных заболеваний.
Если вам нужна консультация
Если вы или кто-то из ваших знакомых страдает от заложенности носа и других симптомов хронического ринита, подумайте о пробном применении назальных стероидных спреев в течение одного-двух месяцев. В то время как таблетки от аллергии, антигистаминные спреи, муколитики, деконгестанты и другие подобные лекарства играют определенную роль в лечении назальных симптомов, только назальные стероидные спреи оказались наиболее эффективными для облегчения симптомов в ходе многочисленных исследований. Посетите ринолога, прошедшего стажировку, доктора Куперана из Хьюстонского отделения Advanced Nose and Sinus, чтобы обсудить ваши симптомы и способы их наилучшего лечения.
В то время как таблетки от аллергии, антигистаминные спреи, муколитики, деконгестанты и другие подобные лекарства играют определенную роль в лечении назальных симптомов, только назальные стероидные спреи оказались наиболее эффективными для облегчения симптомов в ходе многочисленных исследований. Посетите ринолога, прошедшего стажировку, доктора Куперана из Хьюстонского отделения Advanced Nose and Sinus, чтобы обсудить ваши симптомы и способы их наилучшего лечения.
Топические назальные стероиды при интермиттирующем и персистирующем аллергическом рините у детей
Кокрановский синтез доказательств и методы ►
Аллергический ринит — очень распространенное хроническое заболевание, поражающее от 10% до 40% детей во всем мире. За последние два десятилетия наблюдалось значительное увеличение распространенности среди детей, и это увеличение сопровождалось параллельным увеличением сопутствующих заболеваний, таких как астма. Симптомы включают чихание, зуд, насморк и заложенность носа.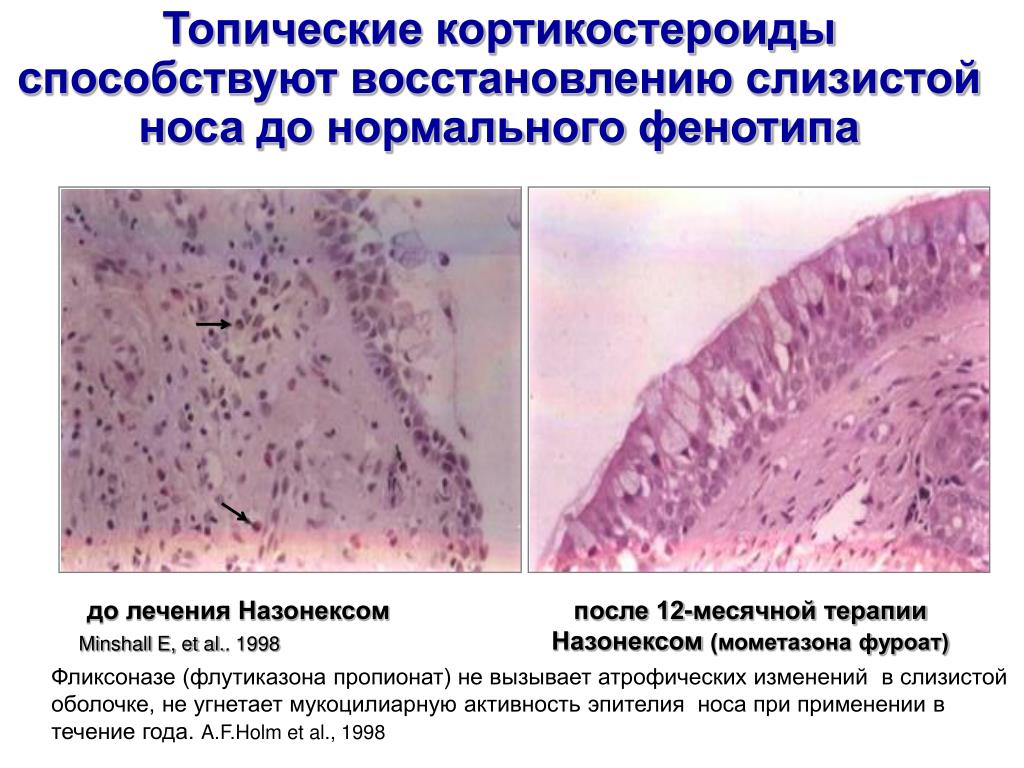 Аллергический ринит может быть определен как «персистирующий» или «перемежающийся». Эти классификации в общих чертах соответствуют круглогодичному (круглогодичному) аллергическому риниту и сезонному аллергическому риниту («сенная лихорадка»). Существует широкий спектр медикаментозного лечения, включая местные и пероральные деконгестанты, местные и пероральные антигистаминные препараты, местные и системные кортикостероиды, антагонисты лейкотриенов и ряд безрецептурных препаратов. Часто назначают местные стероиды (назальные спреи), которые действуют непосредственно на слизистую оболочку носа для уменьшения симптомов.
Аллергический ринит может быть определен как «персистирующий» или «перемежающийся». Эти классификации в общих чертах соответствуют круглогодичному (круглогодичному) аллергическому риниту и сезонному аллергическому риниту («сенная лихорадка»). Существует широкий спектр медикаментозного лечения, включая местные и пероральные деконгестанты, местные и пероральные антигистаминные препараты, местные и системные кортикостероиды, антагонисты лейкотриенов и ряд безрецептурных препаратов. Часто назначают местные стероиды (назальные спреи), которые действуют непосредственно на слизистую оболочку носа для уменьшения симптомов.
Авторы обзора выявили большое количество рандомизированных контролируемых испытаний, однако многие из них были исключены из-за использования «спасательных» (дополнительных) препаратов, которые могли исказить результаты.
Три включенных испытания предоставили некоторые слабые и ненадежные доказательства эффективности Беконазы® и флунизолида, применяемых местно в нос для лечения интермиттирующего и персистирующего аллергического ринита у детей. Авторы обзора пришли к выводу, что до тех пор, пока не будут доступны дополнительные исследования, решения об использовании местных стероидов должны основываться на клиническом опыте врача и индивидуальных обстоятельствах и предпочтениях пациентов.
Авторы обзора пришли к выводу, что до тех пор, пока не будут доступны дополнительные исследования, решения об использовании местных стероидов должны основываться на клиническом опыте врача и индивидуальных обстоятельствах и предпочтениях пациентов.
Выводы авторов:
Три включенных испытания предоставили некоторые слабые и ненадежные доказательства эффективности Беконазы® и флунизолида, применяемых местно интраназально для лечения интермиттирующего и персистирующего аллергического ринита у детей. Уменьшение тяжести симптомов, по оценке исследователей, не может быть подтверждено предоставленными данными, и решения об использовании этих препаратов должны до тех пор, пока не будут доступны более надежные доказательства, руководствоваться клиническим опытом врача и индивидуальными особенностями пациентов. обстоятельства и предпочтения.
Читать аннотацию полностью…
Справочная информация:
Аллергический ринит — очень распространенное хроническое заболевание, поражающее от 10% до 40% детей во всем мире. За последние два десятилетия наблюдалось значительное увеличение распространенности среди детей, и это увеличение сопровождалось параллельным увеличением сопутствующих заболеваний, таких как астма.
За последние два десятилетия наблюдалось значительное увеличение распространенности среди детей, и это увеличение сопровождалось параллельным увеличением сопутствующих заболеваний, таких как астма.
Цели:
Оценить терапевтическую эффективность и профили побочных эффектов местных назальных стероидов при прерывистом и персистирующем аллергическом рините у детей.
Стратегия поиска:
Мы провели поиск в Кокрановском регистре групповых испытаний по заболеваниям уха, носа и горла, Кокрановском центральном регистре контролируемых испытаний (CENTRAL) ( Кокрановская библиотека , выпуск 3, 2005 г.), MEDLINE (с 1950 г.) и EMBASE. (с 1974 г.) 5 th сентября 2005 г. CINAHL, m RCT (база метаданных контролируемых испытаний), NRR (Национальный регистр исследований), LILACS, MedCarib, KOREAMED, IndMed, Samed, Panteleimon, Zetoc, Также был проведен поиск в материалах ISI, в базе данных клинических испытаний GlaxoSmithKline и на веб-сайтах компаний AstraZeneca, Schering Plough и Aventis.
Критерии отбора:
Рандомизированные контролируемые испытания, в которых сравнивались местные назальные стероидные препараты друг с другом или с плацебо, назначаемые при аллергическом рините у детей.
Сбор и анализ данных:
Два автора независимо оценивали качество испытаний и извлекали данные из включенных испытаний. Ограниченное и изменчивое качество представленных данных не позволило объединить результаты, и представлено только описательное резюме.
Основные результаты:
Были включены три испытания с участием 79 человек. Все три исследования, в которых сравнивали местные назальные стероиды с плацебо при круглогодичном рините, предоставили некоторые, хотя и ограниченные данные, относящиеся к нашим основным исходам; но в двух испытаниях анализ данных был ошибочным, а в третьем испытании он был непонятен. Ни одно из испытаний не предоставило данных, относящихся к нашим вторичным исходам. Ни в одном из вмешательств не сообщалось о нежелательных явлениях.
