Грудное молоко защищает ребенка от стрептококка группы В
Резюме. Если в его составе содержится специфический олигосахарид — лакто-n-дифукогексоза I
Ученые из Имперского колледжа Лондона (Imperial College London), Великобритания, в ходе новой работы обратили внимание, что в грудном молоке некоторых женщин содержится углевод, который может защитить новорожденного от стрептококка группы В. Данная бактерия, которая при определенных условиях может быть опасной для жизни, является основной причиной менингитов у детей раннего возраста. Результаты работы опубликованы в журнале «Clinical and Translational Immunology».
Стрептококк группы В выявляют у преобладающего большинства женщин во влагалище и кишечнике. В 30% случаев бактерия передается ребенку во время родов или через грудное молоко, которое содержит различные типы углеводов, именуемые олигосахаридами грудного молока. Последние не перевариваются пищеварительной системой ребенка и используются только в качестве питательной среды для микрофлоры кишечника. Известно, что тип углеводов, содержащийся в молоке, частично определяется генетическими факторами, в частности антигенами системы Льюиса, которые являются биологической основой групповой принадлежности крови.
Известно, что тип углеводов, содержащийся в молоке, частично определяется генетическими факторами, в частности антигенами системы Льюиса, которые являются биологической основой групповой принадлежности крови.
Участницами данного исследования стали 183 женщины из Гамбии. Исследователи проанализировали состав их грудного молока и определили содержащиеся в нем углеводы. Кроме того, они исследовали женщин и их детей на предмет носительства стрептококка группы В в день родов, а также через 6 и 60–89 дней. Оказалось, что у тех женщин, у которых продуцируются углеводы, связанные с системой Льюиса, значительно реже, чем у других кормящих матерей, определялась анализируемая бактерия в кишечнике, а их детям она редко передавалась во время родов. Кроме того, ученые отметили, что в молоке женщин, чьим детям в момент рождения передан стрептококк группы В, присутствовал специфический углевод — лакто-n-дифукогексоза I, — который, по всей видимости, способствовал полному уничтожению бактерии в организме ребенка через 60–89 дней после рождения. Учитывая полученные результаты, авторы исследования предположили, что олигосахариды грудного молока, синтез которых связан с генами, определяющими систему Льюиса, имеют протективные свойства.
Учитывая полученные результаты, авторы исследования предположили, что олигосахариды грудного молока, синтез которых связан с генами, определяющими систему Льюиса, имеют протективные свойства.
Во второй части исследования ученые проанализировали бактерицидные способности различных проб грудного молока, полученных от участниц. Они выявили, что уничтожение стрептококка группы В более активно происходило в образцах молока, содержащего лакто-n-дифукогексозу I, чем в тех, в составе которых не отмечали специфический олигосахарид. Исследователи предполагают, что лакто-n-дифукогексоза I содержится в грудном молоке около половины женщин планеты.
Автор данной работы доктор Николас Андреас (Nicholas Andreas) заявил, что, несмотря на то, что исследование является одним из первых в данном направлении, уже сегодня можно говорить о сложности состава грудного молока и о его позитивном влиянии на состояние здоровья ребенка. Он предположил, что олигосахариды, входящие в состав молока, защищают организм ребенка от таких инфекционных агентов, как ротавирус и стрептококк группы В, и в то же время стимулируют рост нормальной микрофлоры его кишечника. Ученые надеются, что полученные результаты помогут в разработке новых методов, направленных на защиту кормящих матерей и их детей от инфекционных патологий. Например, они предлагают анализировать кровь беременных или недавно родивших женщин и определять у них наличие активной копии генов системы Льюиса. Это позволит оценивать риск колонизации организма их ребенка стрептококком группы В в долгосрочной перспективе.
Ученые надеются, что полученные результаты помогут в разработке новых методов, направленных на защиту кормящих матерей и их детей от инфекционных патологий. Например, они предлагают анализировать кровь беременных или недавно родивших женщин и определять у них наличие активной копии генов системы Льюиса. Это позволит оценивать риск колонизации организма их ребенка стрептококком группы В в долгосрочной перспективе.
Н. Андреас отметил, что некоторые компании уже занимаются изучением возможности добавления различных олигосахаридов в состав молочных смесей, однако он полагает, что воссоздать их природное соотношение будет крайне сложно. Существующие сегодня экспериментальные молочные смеси содержат лишь пару специфических углеводов, в то время как в грудном молоке их десятки. Кроме того, количество каждого углевода в молоке постоянно изменяется по мере взросления ребенка, и новорожденный получает олигосахаридов больше, чем ребенок, достигший возраста 6 мес.
Юлия Котикович
Сдать анализ грудного молока на стерильность можно в «ОН КЛИНИК Рязань»
Кормление ребенка грудью – это мощнейший механизм формирования его здоровья и укрепления иммунитета, заложенный самой природой. Лучшие педиатры сходятся во мнениях о том, что именно грудное вскармливание является лучшим питанием для малыша с момента его появления на свет до достижения им годовалого возраста.
Лучшие педиатры сходятся во мнениях о том, что именно грудное вскармливание является лучшим питанием для малыша с момента его появления на свет до достижения им годовалого возраста.
В материнском молоке содержатся все компоненты, важность которых для правильного развития ребенка сложно переоценить: это белки, углеводы и жиры, а также различные витамины, минералы, ферменты и микроэлементы. К другим очевидным преимуществам грудного вскармливания перед искусственным относятся создание благодаря ему в кишечнике ребенка нормальной микрофлоры и установление тесного эмоционального контакта между малышом и его мамой.
Тем не менее, грудное молоко способно и навредить ребенку. Речь идет о тех случаях, когда в нем присутствуют болезнетворные микроорганизмы. Во избежание передачи инфекции малышу до начала грудного вскармливания врачи рекомендуют сдать анализ на стерильность грудного молока. Сделать это можно в лаборатории нашей частной клиники в Рязани.
В каких случаях данный анализ необходим?
Как происходит инфицирование молока? Болезнетворные микроорганизмы способны проникать в него через трещинки на сосках новоиспеченной мамы. Подобные нарушения целостности кожи, зачастую не видимые невооруженным глазом, есть абсолютно у всех кормящих женщин, но инфицирование происходит лишь у тех из них, чей иммунитет ослаблен, или страдающих хроническими заболеваниями пациенток. В этих случаях анализ грудного молока может продемонстрировать присутствие в нем таких микробов, как стрептококк и стафилококк, а также синегнойная палочка и бактерии – возбудители энтеритов. Все эти болезнетворные микроорганизмы способны привести к развитию у ребенка серьезных и зачастую опасных не только для его нормального развития, но и жизни, заболеваний!
Сдать анализ грудного молока на стерильность необходимо в следующих случаях:
- наличие у новорожденного любых инфекций;
- расстройства пищеварения у ребенка, в частности – постоянная диарея.

- мамам, чьи дети появились на свет преждевременно;
- наличие высыпаний на кожных покровах ребенка;
- наличие у кормящей мамы мастита и застойных явлений в молочной железе.
Кроме того, в обязательном порядке сдать этот анализ необходимо женщинам – донорам грудного молока.
Лабораторное исследование грудного молока позволяет выявить, присутствуют ли в нем какие-либо опасные для здоровья малыша микробы, а также определить их вид. Это необходимо для того, чтобы подобрать эффективное лечение – дело в том, что различные микроорганизмы уязвимы перед разными фармпрепаратами. В ряде случаев – например, при необходимости проведения антибиотикотерапии – от кормления грудью придется отказаться на время лечения.
Подготовка к забору грудного молока на анализ
Перед тем, как собрать биоматериал для анализа, следует купить в аптеке специальные контейнеры – по одному для левой и правой молочных желез. Перед сцеживанием обработайте соски спиртом , а руки вымойте с антибактериальным гелем или мылом. Первые 10 мл молока сцеживайте мимо, а в контейнер соберите вторую порцию молока примерно такого же объема. Очень важно передать материал для исследования в лабораторию не позднее хотя бы трех часов после его забора.
Перед сцеживанием обработайте соски спиртом , а руки вымойте с антибактериальным гелем или мылом. Первые 10 мл молока сцеживайте мимо, а в контейнер соберите вторую порцию молока примерно такого же объема. Очень важно передать материал для исследования в лабораторию не позднее хотя бы трех часов после его забора.
Если у Вас остались связанные с особенностями подготовки к этому анализу вопросы, задайте их своему лечащему врачу. Неправильный сбор молока для лабораторного исследования может повлечь за собой получение некорректного результата.
Как производится анализ и его расшифровка?
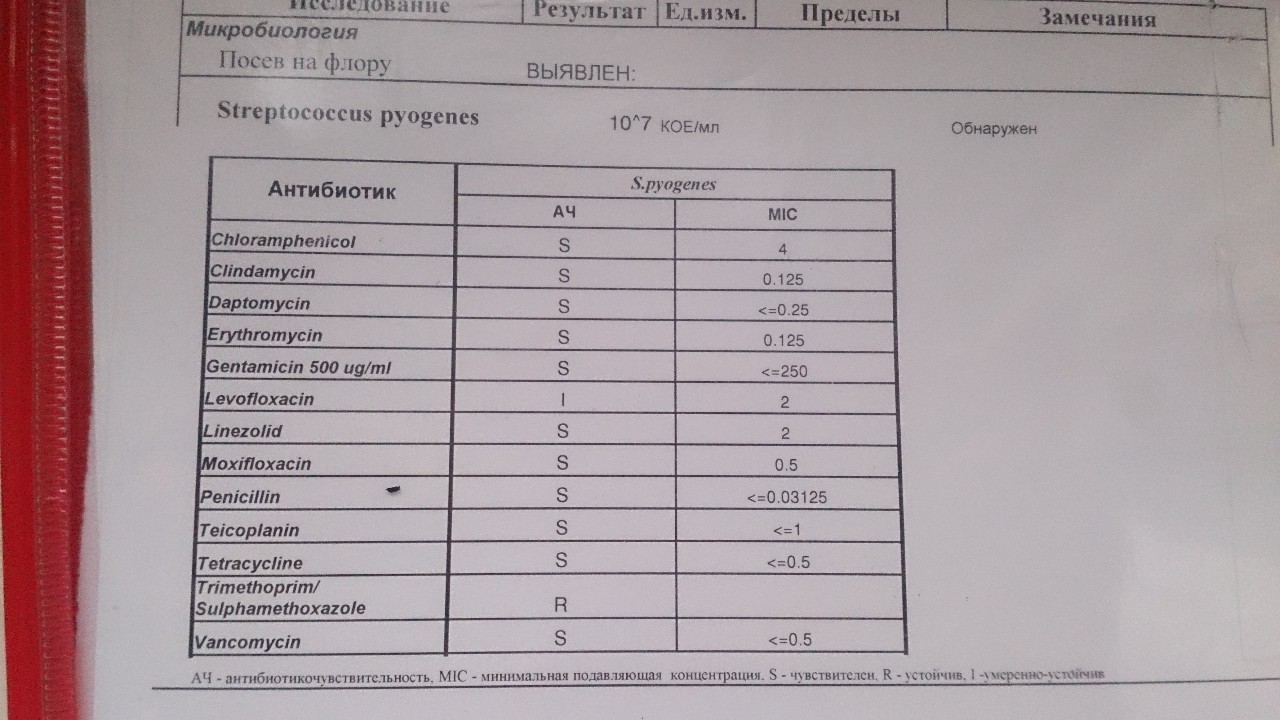
Для выявления в образце биоматериала потенциально опасных микробов лаборанты «ОН КЛИНИК Рязань» делают посев на питательные среды. Не является патологией наличие в грудном молоке стрептококков и стафилококков – лишь стремительный рост концентрации этих бактерий является поводом для беспокойства. В норме 1 мл грудного молока не должен содержать более 250 колоний этих бактерий.
В лаборатории нашей частной клиники в Рязани Вы можете сдать анализ грудного молока, анализ мокроты, ДНК-тест и другие анализы в удобное Вам время. Мы принимаем пациентов ежедневно, в том числе – в выходные и праздничные дни. Результаты анализов будут готовы в кратчайший срок; вы можете получить их лично или по электронной почте.
Стрептококк группы B с поздним началом, зараженное грудное молоко и матери, постоянно отрицательные на СГБ: отчет о 3 случаях | BMC Pediatrics
- История болезни
- Открытый доступ
- Опубликовано:
- Джанджакомо Николини ORCID: orcid.org/0000-0003-4259-4540 1 ,
- Мартина Бореллини 2
- Vitaliana Loizzo 3 ,
- Roberta Creti 4 ,
- Luigi Memo 1 &
- …
- Alberto Berardi 5
Педиатрия BMC том 18 , Номер статьи: 214 (2018) Процитировать эту статью
9569 Доступы
10 цитирований
7 Альтметрический
Сведения о показателях
Abstract
Справочная информация
Грудное молоко имеет основополагающее значение для своих питательных свойств и для защиты новорожденных, но оно не стерильно и иногда может передавать бактерии. Несколько неподтвержденных случаев предполагают, что грудное молоко может быть возможным источником группы B Streptococcus (GBS) заболевание с поздним началом, хотя патогенез до конца не ясен.
Несколько неподтвержденных случаев предполагают, что грудное молоко может быть возможным источником группы B Streptococcus (GBS) заболевание с поздним началом, хотя патогенез до конца не ясен.
Описание случая
Мы сообщаем о 3 случаях позднего начала заболевания СГБ у доношенных новорожденных. Свежие культуры грудного молока давали GBS, но у матерей новорожденных не было признаков мастита, и они оставались устойчиво отрицательными по GBS в ректовагинальной области.
Выводы
Грудное молоко, содержащее группу B Streptococcus , может быть фактором риска позднего начала заболевания. Стойкий отрицательный статус материнского GBS подтверждает предположение, что новорожденные, колонизированные в горле, могут быть исходным источником GBS, тогда как молочная железа может действовать как место репликации GBS. Неясно, может ли низкая бактериальная нагрузка представлять собой только контаминацию, а не истинную инфекцию молока.
Отчеты экспертной оценки
Исходная информация
Грудное молоко имеет первостепенное значение для кормления новорожденных из-за его питательных свойств и вклада в развитие защитных сил организма [1]. Однако грудное молоко не стерильно и иногда может передавать бактерии. Группа B Streptococcus (GBS) является ведущей причиной неонатальных инфекций в развитых странах [2]. Выделяют два различных синдрома: заболевание с ранним началом (EOD, от рождения до 6-го дня) и заболевание с поздним началом (LOD, с 7-го по 89-й день).) [3]. В нескольких отчетах о случаях грудное молоко было предложено как возможный источник LOD GBS [4]. Тем не менее, механизмы передачи СГБ и патогенез LOD еще не ясны. Колонизация СГБ желудочно-кишечного и мочеполового тракта встречается часто и колеблется у беременных от 4 до 36% [5, 6]. Однако только от 0,8 до 3,5% матерей несут СГБ в грудном молоке [7, 8].
Мы сообщаем о 3 случаях LOD у доношенных новорожденных, которые находились на грудном вскармливании молоком, зараженным GBS. У матерей новорожденных не было признаков мастита, а их ректовагинальные мазки были постоянно отрицательными на СГБ (как при пренатальном скрининге, так и на момент постановки диагноза LOD). Эти данные свидетельствуют о том, что передача может происходить по циркулярному механизму: новорожденный (колонизированный в горле) может быть первоначальным источником СГБ, тогда как молочная железа может действовать как место репликации СГБ.
У матерей новорожденных не было признаков мастита, а их ректовагинальные мазки были постоянно отрицательными на СГБ (как при пренатальном скрининге, так и на момент постановки диагноза LOD). Эти данные свидетельствуют о том, что передача может происходить по циркулярному механизму: новорожденный (колонизированный в горле) может быть первоначальным источником СГБ, тогда как молочная железа может действовать как место репликации СГБ.
Представление случая
Случай 1 (Таблица 1)
Новорожденный мальчик европеоидной расы родился на 38 недель беременности в результате вагинальных родов. Ректовагинальный скрининг культуры был отрицательным для GBS. Масса тела при рождении 3290 г; Оценка по шкале Апгар составила 9 и 10 через 1 и 5 минут соответственно. Новорожденный страдал легким тахипноэ в 1-е сутки, но был здоров и находился на грудном вскармливании, когда был выписан домой на 3-и сутки. На 9-е сутки он был госпитализирован в отделение неотложной помощи в связи с раздражительностью и плохим питанием. При поступлении ЧСС 220 уд/мин. Анализ крови показал слегка повышенный уровень лактата (3,9ммоль/л) и прокальцитонин (ПКТ, 3,24 мкг/л). Антибиотики широкого спектра действия (ампициллин и цефотаксим внутривенно) вводили немедленно после сбора культур. Анализ мочи, УЗИ грудной клетки и брюшной полости не выявили источника инфекции. СГБ культивировали в крови и в грудном молоке, хотя у матери не было признаков мастита. Ректовагинальные культуры и посев мочи у матери были стерильны. Грудное вскармливание не прекращали, но посев молока стал стерильным после 7 дневного курса перорального приема амоксициллина матерью. Состояние новорожденного быстро улучшилось, и через 7 дней в/в. антибиотики были переведены на пероральный амоксициллин, прием которого был прекращен на 10-й день. Рецидива СГБ не наблюдалось. Оба штамма GBS, выделенные из крови и молока новорожденных, относились к серотипу III.
При поступлении ЧСС 220 уд/мин. Анализ крови показал слегка повышенный уровень лактата (3,9ммоль/л) и прокальцитонин (ПКТ, 3,24 мкг/л). Антибиотики широкого спектра действия (ампициллин и цефотаксим внутривенно) вводили немедленно после сбора культур. Анализ мочи, УЗИ грудной клетки и брюшной полости не выявили источника инфекции. СГБ культивировали в крови и в грудном молоке, хотя у матери не было признаков мастита. Ректовагинальные культуры и посев мочи у матери были стерильны. Грудное вскармливание не прекращали, но посев молока стал стерильным после 7 дневного курса перорального приема амоксициллина матерью. Состояние новорожденного быстро улучшилось, и через 7 дней в/в. антибиотики были переведены на пероральный амоксициллин, прием которого был прекращен на 10-й день. Рецидива СГБ не наблюдалось. Оба штамма GBS, выделенные из крови и молока новорожденных, относились к серотипу III.
Случай 2
Новорожденный мальчик родился на 37 неделе беременности после вагинальных родов у женщины европеоидной расы. Антенатальный скрининг GBS был отрицательным. Масса тела при рождении 3375 г; Оценка по шкале Апгар на 5 минуте составила 10. Новорожденный был здоров и находился на грудном вскармливании при выписке домой. На 17-й день он был госпитализирован в отделение неотложной помощи из-за плохого питания, раздражительности и лихорадки ( T > 38 °C). Широкий спектр в.в. антибиотики (ампициллин и гентамицин) вводили после сбора культур. Лабораторные тесты показали сильно повышенный уровень СРБ (22 мг/дл) и лейкоцитов в спинномозговой жидкости (8000/мм 9 ).0014 3 , с преобладанием полиморфноядерных клеток). При УЗИ головного мозга выявлено умеренное расширение боковых желудочков. Кровь, спинномозговая жидкость и свежие культуры грудного молока дали GBS. Посевы ректовагинальной и мочи матери были стерильны, у женщины не было признаков мастита. Младенец был выписан домой после 14-дневного курса внутривенного введения. ампициллин и не имели дальнейших рецидивов LOD. Как неонатальные, так и материнские изоляты GBS были серотипом III и имели идентичный генетический профиль по данным электрофореза в геле с импульсным полем [9].
Антенатальный скрининг GBS был отрицательным. Масса тела при рождении 3375 г; Оценка по шкале Апгар на 5 минуте составила 10. Новорожденный был здоров и находился на грудном вскармливании при выписке домой. На 17-й день он был госпитализирован в отделение неотложной помощи из-за плохого питания, раздражительности и лихорадки ( T > 38 °C). Широкий спектр в.в. антибиотики (ампициллин и гентамицин) вводили после сбора культур. Лабораторные тесты показали сильно повышенный уровень СРБ (22 мг/дл) и лейкоцитов в спинномозговой жидкости (8000/мм 9 ).0014 3 , с преобладанием полиморфноядерных клеток). При УЗИ головного мозга выявлено умеренное расширение боковых желудочков. Кровь, спинномозговая жидкость и свежие культуры грудного молока дали GBS. Посевы ректовагинальной и мочи матери были стерильны, у женщины не было признаков мастита. Младенец был выписан домой после 14-дневного курса внутривенного введения. ампициллин и не имели дальнейших рецидивов LOD. Как неонатальные, так и материнские изоляты GBS были серотипом III и имели идентичный генетический профиль по данным электрофореза в геле с импульсным полем [9]. ].
].
Случай 3
Женщина была доставлена вагинально (при сроке беременности 40 недель) женщине европеоидной расы, у которой культура скрининга на СГБ была отрицательной. Масса тела новорожденного при рождении составляла 3176 г, а оценка по шкале Апгар на 5 минуте равнялась 10. Она была здорова и находилась на грудном вскармливании, когда ее выписали домой. На 8-й день жизни ребенок поступил в отделение неотложной помощи с лихорадкой, плохим кормлением и тахикардией. Лабораторные анализы показали повышенный уровень СРБ (13,5 мг/дл). Антибиотики широкого спектра действия (ампициллин и гентамицин) вводили внутривенно. после сбора культур (кровь и спинномозговая жидкость). Люмбальная пункция показала низкий уровень глюкозы (9мг/дл), повышенный уровень белка (300 мг/дл) и 6700 клеток/мм 3 с преобладанием полиморфноядерных клеток (95%). Посев крови был стерильным, в то время как ЦСЖ и свежие культуры грудного молока давали СГБ (80 000 КОЕ/мл в грудном молоке). Ребенку был назначен 12-дневный курс ампициллина, и он был выписан домой через 14 дней после поступления. Рецидивов не наблюдалось. У матери не было признаков мастита, и на момент постановки диагноза LOD у нее был подтвержден GBS-отрицательный результат в ректовагинальной области.
Рецидивов не наблюдалось. У матери не было признаков мастита, и на момент постановки диагноза LOD у нее был подтвержден GBS-отрицательный результат в ректовагинальной области.
Полная таблица
Обсуждение и выводы
В этом отчете рассматриваются три случая LOD у доношенных новорожденных, которые, возможно, связаны с употреблением грудного молока содержащие ГБС. Случаи с сепсисом и/или менингитом на 9, 17 и 8 день соответственно. Ни у одной из матерей не было признаков мастита, и все они были GBS-негативными в ректовагинальной области (как при скрининге, так и во время диагностики LOD). В случаях 1 и 2 неонатальные и материнские изоляты GBS были серотипа III. Количество бактерий в молоке было доступно только в случае 3.
Берарди и др. оценили колонизацию GBS у 160 пар мать-ребенок. GBS был идентифицирован в 53 неонатальных посевах из горла и 77 неонатальных ректальных посевах. GBS в грудном молоке был связан с тяжелой неонатальной колонизацией [10]. Однако механизм передачи LOD через грудное вскармливание плохо изучен. Ретроградная теория предполагает, что СГБ, присутствующий в горле младенца, колонизирует молочные протоки во время грудного вскармливания. Нагрузка GBS увеличивается в молоке, и, в свою очередь, младенец заражается во время грудного вскармливания (циркулярный механизм) [4]. В качестве альтернативы некоторые авторы предполагают, что СГБ может достигать молочной железы за счет транслокации бактерий из материнского кишечника через лимфатические сосуды [11].
GBS в грудном молоке был связан с тяжелой неонатальной колонизацией [10]. Однако механизм передачи LOD через грудное вскармливание плохо изучен. Ретроградная теория предполагает, что СГБ, присутствующий в горле младенца, колонизирует молочные протоки во время грудного вскармливания. Нагрузка GBS увеличивается в молоке, и, в свою очередь, младенец заражается во время грудного вскармливания (циркулярный механизм) [4]. В качестве альтернативы некоторые авторы предполагают, что СГБ может достигать молочной железы за счет транслокации бактерий из материнского кишечника через лимфатические сосуды [11].
В недавнем обзоре литературы были проанализированы случаи LOD, при которых грудное молоко было положительным на GBS [4]. В обзоре указано, что роль грудного молока в LOD остается спорной, хотя молоко будет более убедительным источником, когда LOD возникает у новорожденного, рожденного от матери с отрицательным статусом GBS, родоразрешенного после планового КС и когда нозокомиальные источники не могут быть идентифицированы. В обзоре также сообщается, что менее половины матерей с СГБ в грудном молоке страдали маститом [4] и что большинство матерей (59%) были GBS-отрицательными при дородовом скрининге. Однако Берарди и соавт. показали, что только у нескольких матерей (~ 25%) новорожденных с LOD был подтвержден отрицательный GBS в ректовагинальном участке при повторном тестировании во время диагностики LOD [12]. Следовательно, доля матерей, которые действительно являются носителями СГБ в ректовагинальной области, безусловно, занижена, если матери с отрицательным СГБ при скрининге не проходят повторное тестирование во время диагностики LOD.
В обзоре также сообщается, что менее половины матерей с СГБ в грудном молоке страдали маститом [4] и что большинство матерей (59%) были GBS-отрицательными при дородовом скрининге. Однако Берарди и соавт. показали, что только у нескольких матерей (~ 25%) новорожденных с LOD был подтвержден отрицательный GBS в ректовагинальном участке при повторном тестировании во время диагностики LOD [12]. Следовательно, доля матерей, которые действительно являются носителями СГБ в ректовагинальной области, безусловно, занижена, если матери с отрицательным СГБ при скрининге не проходят повторное тестирование во время диагностики LOD.
В текущем исследовании 3 случая LOD произошли в 3 разных больницах, поэтому штаммы GBS, безусловно, не связаны между собой. У всех матерей был подтвержден GBS-отрицательный результат при ректовагинальном исследовании. Новорожденные могли быть колонизированы СГБ на поверхности слизистой оболочки (горла) после рождения (от лиц, осуществляющих уход, или из источников окружающей среды), и впоследствии они могли передать СГБ в молочную железу матери. Действительно, в случае 2 СГБ, полученный из грудного молока и новорожденного, показал идентичный генетический профиль. В этих случаях циркулярный механизм кажется особенно наводящим на размышления, тогда как бактериальная транслокация из материнского кишечника маловероятна из-за стойкого отрицательного результата ректовагинального посева на СГБ.
Действительно, в случае 2 СГБ, полученный из грудного молока и новорожденного, показал идентичный генетический профиль. В этих случаях циркулярный механизм кажется особенно наводящим на размышления, тогда как бактериальная транслокация из материнского кишечника маловероятна из-за стойкого отрицательного результата ректовагинального посева на СГБ.
Переход от тихой колонизации молочных протоков к активному размножению СГБ зависит от многих факторов, таких как застой молока и бактериальная нагрузка. Некоторые исследователи обнаружили, что у матерей с маститом бактериальная нагрузка СГБ была выше (1 000 000 КОЕ/мл), чем у матерей без мастита (≤100 000 КОЕ/мл) [12]. Более низкое количество бактерий может свидетельствовать о контаминации во время отбора проб, а не об активном размножении бактерий. В текущем исследовании ни у одной из матерей не было признаков мастита, а количество бактерий в молоке, доступное только в 1 из 3 культур, составляло 80 000 КОЕ/мл. В некоторых исследованиях сообщалось об общем количестве бактерий < 10 6 КОЕ/мл как физиологический порог бактериальной нагрузки в грудном молоке [13, 14]. Происхождение молочных бактерий до сих пор недостаточно изучено, но несколько исследований подтвердили существование динамической сети между грудным молоком и микробиотой полости рта новорожденных [15]. Причинная роль грудного молока в LOD является результатом взаимодействия нескольких материнских и неонатальных факторов. Недоношенность, незрелая иммунная система, бактериальная нагрузка и поражение барьера слизистой оболочки кишечника являются признанными факторами риска развития инфекции после употребления грудного молока, зараженного СГБ [4, 16]. Это исследование имеет некоторые ограничения. Хотя матери, по-видимому, были отрицательными, мы не можем полностью исключить, что у них была легкая колонизация, не обнаруженная ректовагинальными культурами. Однако такой вариант кажется маловероятным. Кроме того, у нас нет данных о генетических профилях большинства СГБ, выделенных от матерей. Наконец, поверхностные культуры не были собраны у членов семьи и новорожденных. Эта дополнительная информация может способствовать пониманию способов и механизмов передачи СГБ.
Происхождение молочных бактерий до сих пор недостаточно изучено, но несколько исследований подтвердили существование динамической сети между грудным молоком и микробиотой полости рта новорожденных [15]. Причинная роль грудного молока в LOD является результатом взаимодействия нескольких материнских и неонатальных факторов. Недоношенность, незрелая иммунная система, бактериальная нагрузка и поражение барьера слизистой оболочки кишечника являются признанными факторами риска развития инфекции после употребления грудного молока, зараженного СГБ [4, 16]. Это исследование имеет некоторые ограничения. Хотя матери, по-видимому, были отрицательными, мы не можем полностью исключить, что у них была легкая колонизация, не обнаруженная ректовагинальными культурами. Однако такой вариант кажется маловероятным. Кроме того, у нас нет данных о генетических профилях большинства СГБ, выделенных от матерей. Наконец, поверхностные культуры не были собраны у членов семьи и новорожденных. Эта дополнительная информация может способствовать пониманию способов и механизмов передачи СГБ.
Выявление основных механизмов постнатальной передачи СГБ будет иметь решающее значение для предотвращения случаев LOD. На сегодняшний день исследования не выявили преобладающий путь (материнский, нозокомиальный или внебольничный) постнатальной передачи СГБ. GBS в грудном молоке может быть фактором риска для GBS LOD. Стойкий культурально-отрицательный статус материнского СГБ предполагает передачу по циркулярному механизму, при этом новорожденный (колонизированный в горле) является первоначальным источником СГБ, а молочная железа — местом репликации СГБ. Высокая или низкая бактериальная нагрузка в грудном молоке может помочь отличить случаи, когда грудное молоко действительно инфицировано, от случаев, когда грудное молоко «загрязняется» только во время отбора проб.
Тестирование ректовагинального статуса матери по СГБ и сбор культур грудного молока во время диагностики LOD могут помочь пролить свет на механизмы LOD по СГБ.
Сокращения
- КОЕ:
Колониеобразующая единица
- CRP:
С-реактивный белок
- ТС:
Кесарево сечение
- ЦСФ:
Спинномозговая жидкость
- ОВД:
Болезнь с ранним началом
- ГБС:
Группа B Стрептококк
- LOD:
Заболевание с поздним началом
- ПКТ:
Прокальцитонин
- WBC:
Лейкоциты
Ссылки
Американская академия педиатрии. Грудное вскармливание и использование человеческого грудного молока. Педиатрия. 2012;129:e827–41.
Артикул Google Scholar
Cossey V, Vanhole C, Eerdekens A, Rayyan M, Fieuws S, Schuermans A. Пастеризация материнского молока у недоношенных детей не снижает заболеваемости поздним сепсисом. Неонатология. 2013;103:170–6.
Артикул пабмед Google Scholar
Берарди А., Каттелани С., Крети Р., Маргарит И., Майоне Д., Феррари Ф. и др. Стрептококковые инфекции группы В у новорожденных и потенциальная ценность материнской вакцинации. Expert Rev Anti-Infect Ther. 2015;13:1387–99.
Артикул пабмед КАС Google Scholar
Циммерманн П., Гви А., Кертис Н. Спорная роль грудного молока в позднем развитии СГБ.
 J Inf Secur. 2017;74:С34–40.
J Inf Secur. 2017;74:С34–40.Google Scholar
Родригес-Грейнджер Дж., Альваргонсалес Дж. К., Берарди А., Спеллерберг Б., Пуэртас А., Роза-Фрейле М. и др. Новый взгляд на профилактику стрептококковой инфекции новорожденных, вызванной стрептококком группы В. Европейский проект DEVANI. Eur J Clin Micorbiol Infect Dis. 2012;31:2097–104.
Артикул КАС Google Scholar
Creti R, Imperi M, Berardi A, Recchia S, Alfarone G, Baldassarri L, et al. Инфицирование новорожденных стрептококком группы В. Стратегии профилактики, клинические и микробиологические характеристики за 7 лет наблюдения. Pediatr Infect Dis J. 2017; 36: 256–62.
Артикул пабмед Google Scholar
Бурянова И., Паулова М., Чермак П., Янота Дж. Колонизация грудного молока группы В у матерей с положительной реакцией на группу В.
 Дж. Гум Лакт. 2013;29(4): 586–90.
Дж. Гум Лакт. 2013;29(4): 586–90.Кубин В., Мрастикова Х., Паулова М., Мотлова Ю., Франек Ю. Стрептококки группы В в молоке кормящих матерей. Zentralbl Bacteriol Mikrobiol Hyg A. 1987;265:201–7.
Google Scholar
Империя М., Герарди Г., Берарди А., Дикуонцо Г., Орефичи Г., Крети Р. и др. Инвазивные неонатальные GBS-инфекции из исследования по эпиднадзору в Италии. Клин Микробиол Инфект. 2011; 17:1834–1839.
Артикул пабмед КАС Google Scholar
Берарди А., Росси С., Крети Р., Вентурелли С., Румпианези Ф., Феррари Ф. и др. Колонизация стрептококком группы B у 160 пар мать-ребенок: проспективное когортное исследование. J Педиатр. 2013; 163:1099–104.
Артикул пабмед Google Scholar
Bertini G, Dani C.
 Стрептококковый сепсис группы B с поздним началом с подчелюстной флегмоной у недоношенного ребенка после начала грудного вскармливания. J Matern Fetal Neonatal Med. 2008; 21: 213–5.
Стрептококковый сепсис группы B с поздним началом с подчелюстной флегмоной у недоношенного ребенка после начала грудного вскармливания. J Matern Fetal Neonatal Med. 2008; 21: 213–5.Артикул пабмед Google Scholar
Берарди А., Росси С., Лугли Л., Пьеполи М., Контьеро Р., Феррари Ф. и др. Стрептококк группы В с поздним началом: 2003-2010 гг. Педиатрия. 2013; 131:e361–8.
Артикул пабмед Google Scholar
Boix-Amorós A, Collado MC, Mira A. Взаимосвязь между микробиотой молока, бактериальной нагрузкой, макроэлементами и клетками человека во время лактации. Фронт микробиол. 2016;7:492.
Артикул пабмед ПабМед Центральный Google Scholar
Хайден Н., Пимпел Б., Ассадиан О., Танхойзер М., Робертс К.Д., Бергер А. и др. Сравнение количества бактерий в сцеженном грудном молоке при соблюдении стандартных или строгих режимов инфекционного контроля в отделениях интенсивной терапии новорожденных: соблюдение рекомендаций матерями имеет значение.
 Джей Хосп заражает. 2016;92:226–8.
Джей Хосп заражает. 2016;92:226–8.Артикул пабмед КАС Google Scholar
Родригес Дж.М. Происхождение бактерий грудного молока: существует ли бактериальный энтеромаммарный путь на поздних сроках беременности и в период лактации? Ад Нутр. 2014;5:779–84.
Артикул пабмед ПабМед Центральный Google Scholar
Le Doare K, Kampmann B. Грудное молоко и стрептококковая инфекция группы B: переносчик или средство защиты? вакцина. 2014;32:3128–32.
Артикул пабмед ПабМед Центральный Google Scholar
Ссылки на скачивание
Доступность данных и материалов
Наборы данных, использованные и/или проанализированные в ходе текущего исследования, можно получить у соответствующего автора по обоснованному запросу.
Информация об авторе
Авторы и организации
Unità Operativa Complessa di Pediatria e Patologia Neonatale, Ospedale San Martino, Belluno, Italy
Giangiacomo Nicolini & Luigi Memo
55550048 Dipartimento Salute della Donna e del Bambino, Scuola di Specializzazione in Pediatria, Università di Padova, Падуя, ИталияScuola di Specializzazione in Pediatria, Università degli Studi di Modena e Reggio Emilia, Италия
, Università degli Studi di Modena e Reggio Emilia Vitaliana Loizzo
Dipartimento di Malattie Infettive, Istituto Superiore di Sanità, Roma, Italy
Roberta Creti
Unità Operativa di Terapia Intensiva Neonatale, Dipartimento Integrato Materno-Infantile, Azienda Ospedaliero-Universitaria Policlinico, Modena, Italy
Alberto Berardi
Martina Borellini
Авторы
- Giangiacomo Nicolini
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Martina Borellini
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Vitaliana Loizzo
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Академия
- Roberta Creti
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Luigi Memo
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Alberto Berardi
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Вклады
GN внес существенный вклад в разработку концепции и дизайна, сбор данных и участвовал в пересмотре рукописи. МБ внес существенный вклад в разработку концепции и дизайна, сбор данных и участвовал в составлении рукописи. В.Л. провел первоначальный анализ, рассмотрел и отредактировал рукопись. RC провел первоначальный анализ, рассмотрел и отредактировал рукопись. Л.М. участвовал в критической проверке рукописи на предмет важного интеллектуального содержания. AB участвовал в критической проверке рукописи на предмет важного интеллектуального содержания и дал окончательное одобрение версии для публикации. Все авторы прочитали и одобрили окончательный вариант рукописи.
МБ внес существенный вклад в разработку концепции и дизайна, сбор данных и участвовал в составлении рукописи. В.Л. провел первоначальный анализ, рассмотрел и отредактировал рукопись. RC провел первоначальный анализ, рассмотрел и отредактировал рукопись. Л.М. участвовал в критической проверке рукописи на предмет важного интеллектуального содержания. AB участвовал в критической проверке рукописи на предмет важного интеллектуального содержания и дал окончательное одобрение версии для публикации. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Джанджакомо Николини.
Декларация этики
Утверждение этики и согласие на участие
Неприменимо.
Согласие на публикацию
Родители описанных новорожденных дали информированное письменное согласие на публикацию.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья распространяется в соответствии с условиями международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение, и воспроизведение на любом носителе, при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
Перепечатки и разрешения
Об этой статье
Грудное молоко и стрептококковая инфекция группы B: переносчик или средство защиты?
1. Nocard N., Mollereau R. Sur une mammite contagieuse des vaches laitieres. Энн Инст Пастер. 1887; 1: 109–126. [Google Scholar]
2. Лэнсфилд Р.Х.Р. Серологическая дифференциация патогенных и непатогенных штаммов гемолитических стрептококков у рожениц. J Эксперт Мед. 1935; 61: 335–349.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Эксперт Мед. 1935; 61: 335–349.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Фрай Р. Смертельные инфекции гемолитическим стрептококком группы B. Lancet 1938;1:199–201.
4. Худ М., Дженни А., Дэмерон Г. Бета-гемолитический стрептококк группы В связан с проблемами перинатального периода. Am J Акушер-гинеколог. 1961, октябрь; 82: 809–818. [PubMed] [Google Scholar]
5. Baker CJ, Barrett FF, Gordon RC, Yow MD. Гнойный менингит, вызванный стрептококками группы B Лансфилда: исследование 33 младенцев. J Педиатр 1973;82(4):724–9. [PubMed]
6. Fluegge K., Siedler A., Heinrich B., Schulte-Moenting J., Moennig M.J., Bartels D.B. Заболеваемость и клиническая картина инвазивных неонатальных стрептококковых инфекций группы В в Германии. Педиатрия. 2006; 117 (июнь (6)): e1139–e1145. [PubMed] [Google Scholar]
7. Kalliola S., Vuopio-Varkila J., Takala A.K., Eskola J. Неонатальная стрептококковая инфекция группы B в Финляндии: десятилетнее общенациональное исследование. Pediatr Infect Dis J. 1999; 18 (9 сентября)): 806–810. [PubMed] [Академия Google]
Pediatr Infect Dis J. 1999; 18 (9 сентября)): 806–810. [PubMed] [Академия Google]
8. Нето М.Т. Стрептококковая инфекция группы B у португальских детей в возрасте до 90 дней. Arch Dis Child Fetal Neonatal Ed. 2008;93(2):F90–F93. [PubMed] [Google Scholar]
9. Filleron A., Lombard F., Jacquot A., Jumas-Bilak E., Rodiere M., Cambonie G. Стрептококки группы B в молоке и поздние неонатальные инфекции: анализ случаев в литературе. Arch Dis Child Fetal Neonatal Ed. 2013; 99 (август) [PubMed] [Google Scholar]
10. Вайснер А.М., Джонсон А.П., Ламаньи Т.Л., Арнольд Э., Уорнер М., Хит П.Т. Характеристика стрептококков группы В, выделенных от младенцев с инвазивным заболеванием в Англии и Уэльсе. Клин Инфекция Дис. 2004;38(май (9)): 1203–1208. [PubMed] [Google Scholar]
11. Phares C.R., Lynfield R., Farley MM, Mohle-Boetani J., Harrison L.H., Petit S. Эпидемиология инвазивной стрептококковой инфекции группы B в США, 1999–2005 гг. ДЖАМА. 2008; 299 (17 мая)): 2056–2065 гг. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
12. Heath PT, Balfour G., Weisner AM, Efstratiou A., Lamagni TL, Tighe H. Стрептококковая инфекция группы B у детей младше 90 дней в Великобритании и Ирландии. Ланцет. 2004; 363 (январь (9405)): 292–294. [PubMed] [Академия Google]
13. Зангвилл К.М., Шухат А., Венгер Дж.Д. Стрептококковая инфекция группы В в США, 1990 г.: отчет многогосударственной системы активного эпиднадзора. MMWR CDC Surveill Summ. 1992; 41 (ноябрь (6)): 25–32. [PubMed] [Google Scholar]
14. Профилактика CfDCa. Отчет о надзоре за активной бактериальной базой, Сеть программы по новым инфекциям, стрептококк группы B, 2012 г. Атланта; 2012 [дата обращения: 19.03.14]. Доступно по адресу: http://www.cdc.gov/abcs/reports-findings/survreports/gbs12.html.
15. Грей К.Дж., Беннетт С.Л., Френч Н., Фири А.Дж., Грэм С.М. Инвазивная стрептококковая инфекция группы В у младенцев, Малави. Em Infect Dis. 2007; 13 (февраль (2)): 223–229. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Беркли Дж. А., Лоу Б. С., Мванги И., Уильямс Т., Бауни Э., Мварумба С. Бактеремия среди детей, поступивших в сельскую больницу в Кении. N Engl J Med. 2005; 352 (январь (1)): 39–47. [PubMed] [Google Scholar]
Беркли Дж. А., Лоу Б. С., Мванги И., Уильямс Т., Бауни Э., Мварумба С. Бактеремия среди детей, поступивших в сельскую больницу в Кении. N Engl J Med. 2005; 352 (январь (1)): 39–47. [PubMed] [Google Scholar]
17. Sigauque B., Roca A., Mandomando I., Morais L., Quinto L., Sacarlal J. Внебольничная бактериемия у детей, госпитализированных в сельскую больницу в Мозамбике. Pediatr Infect Dis J. 2009; 28 (февраль (2)): 108–113. [PubMed] [Google Scholar]
18. Darmstadt G.L., Saha S.K., Choi Y., El Arifeen S., Ahmed N.U., Bari S. Популяционная заболеваемость и этиология внебольничной неонатальной бактериемии в Мирзапуре, Бангладеш: исследование наблюдательное исследование. J заразить дис. 2009; 200 (6 сентября)): 906–915. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Kuruvilla K.A., Thomas N., Jesudasan M.V., Jana A.K. Неонатальная стрептококковая бактериемия группы B в Индии: десятилетний опыт. Акта Педиатр. 1999; 88 (сентябрь (9)): 1031–1032. [PubMed] [Google Scholar]
20. Лим Н.Л., Вонг Ю.Х., Бу Н.Ю., Касим М.С., Чор С.Ю. Бактериальные инфекции в отделении интенсивной терапии новорожденных — девятимесячное исследование. Med J Малайзия. 1995; 50 (март (1)): 59–63. [PubMed] [Google Scholar]
Лим Н.Л., Вонг Ю.Х., Бу Н.Ю., Касим М.С., Чор С.Ю. Бактериальные инфекции в отделении интенсивной терапии новорожденных — девятимесячное исследование. Med J Малайзия. 1995; 50 (март (1)): 59–63. [PubMed] [Google Scholar]
21. Dagnew A.F., Cunnington M.C., Dube Q., Edwards M.S., French N., Heyderman R.S. Различия в зарегистрированной неонатальной заболеваемости стрептококковой инфекцией группы B в развивающихся странах. Клин Инфекция Дис. 2012; 55 (июль (1)): 91–102. [PubMed] [Google Scholar]
22. Verani JR, McGee L, Schrag SJ, Отдел бактериальных заболеваний, Национальный центр иммунизации и респираторных заболеваний, Центры по контролю и профилактике заболеваний (CDC). Профилактика перинатальной стрептококковой инфекции группы В: взгляд общественного здравоохранения. ММВР 2010;19(59(RR-10)):1–36. [PubMed]
23. Джонс Н., Оливер К., Джонс Ю., Хейнс А., Крук Д. Носительство стрептококка группы В у беременных из Оксфорда, Великобритания. Джей Клин Патол. 2006; 59(4 апреля)): 363–366. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Bergeron M.G., Ke D., Menard C., Picard F.J., Gagnon M., Bernier M. Быстрое выявление стрептококков группы B у беременных женщин при родах. N Engl J Med. 2000; 343 (июль (3)): 175–179. [PubMed] [Google Scholar]
25. Bedford H, de Louvois J, Halket S, Peckham C, Hurley R, Harvey D. Менингит в младенчестве в Англии и Уэльсе: наблюдение в возрасте 5 лет. BMJ 2001;323(7312):533–6. [Бесплатная статья PMC] [PubMed]
26. Kotiw M., Zhang G.W., Daggard G., Reiss-Levy E., Tapsall J.W., Numa A. Поздняя и рецидивирующая неонатальная стрептококковая инфекция группы B, связанная с передачей через грудное молоко. Педиатр Дев Патол. 2003; 6 (май – июнь (3)): 251–256. [PubMed] [Google Scholar]
27. Масло M.D.C. Streptococcus agalactiae как причина менингита у новорожденных и бактериемии у взрослых. Антони Ван Левенгук. 1967; 33(4):439. [Google Scholar]
28. Бурьянова И., Паулова М., Чермак П., Джанота Дж. Колонизация стрептококком группы В грудного молока матерей, инфицированных стрептококком группы В. Дж. Гум Лакт. 2013;29(ноябрь (4)): 586–590. [PubMed] [Google Scholar]
Колонизация стрептококком группы В грудного молока матерей, инфицированных стрептококком группы В. Дж. Гум Лакт. 2013;29(ноябрь (4)): 586–590. [PubMed] [Google Scholar]
29. Квист Л.Дж., Ларссон Б.В., Холл-Лорд М.Л., Стин А., Шален С. Роль бактерий в лактационном мастите и некоторые соображения по поводу использования лечения антибиотиками. Int Breastfeed J. 2008; 3:6. [PubMed free article] [PubMed] [Google Scholar]
30. Кубин В., Мрастикова Х., Паулова М., Мотлова Ю., Франек Ю. Стрептококки группы В в молоке кормящих матерей. Zentralbl Bacteriol Mikrobiol Hyg A. 1987; 265 (1–2 июня)): 210–217. [PubMed] [Академия Google]
31. Шанлер Р.Дж., Лау К., Херст Н.М., Смит Э.О. Рандомизированное исследование донорского грудного молока по сравнению со смесью для недоношенных в качестве заменителей материнского молока при вскармливании крайне недоношенных детей. Педиатрия. 2005; 116 (август (2)): 400–406. [PubMed] [Google Scholar]
32. Serafini A.B., Andre M.C., Rodrigues M. A., Kipnis A., Carvalho C.O., Campos M.R. Микробиологическое качество грудного молока из бразильского банка молока. Преподобный Сауд Публика. 2003; 37 (декабрь (6)): 775–779. [PubMed] [Академия Google]
A., Kipnis A., Carvalho C.O., Campos M.R. Микробиологическое качество грудного молока из бразильского банка молока. Преподобный Сауд Публика. 2003; 37 (декабрь (6)): 775–779. [PubMed] [Академия Google]
33. Джеринк П.В., ван Бергенхенгоувен Дж., Хименес Э., Книппельс Л.М., Фернандес Л., Гарссен Дж. Человеческое молоко: источник большей жизни, чем мы себе представляем. Польза микробов. 2013; 4 (март (1)): 17–30. [PubMed] [Google Scholar]
34. Эванс Т.Дж., Райли Х.К., Нил Л.М., Додж Дж.А., Леварн В.М. Влияние хранения и нагревания на антимикробные белки в грудном молоке. Арч Дис Чайлд. 1978; 53 (март (3)): 239–241. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Ewaschuk J.B., Unger S., O’Connor D.L., Stone D., Harvey S., Clandinin M.T. Влияние пастеризации на отдельные иммунные компоненты донорского грудного молока. Дж. Перинатол. 2011; 31 (сентябрь (9)): 593–598. [PubMed] [Google Scholar]
36. Кристен Л., Лай С.Т., Хартманн Б., Хартманн П.Е., Геддес Д. Т. Влияние пастеризации УФ-С на бактериостатические свойства и иммунологические белки донорского человеческого молока. ПЛОС ОДИН. 2013;8(12):e85867. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Т. Влияние пастеризации УФ-С на бактериостатические свойства и иммунологические белки донорского человеческого молока. ПЛОС ОДИН. 2013;8(12):e85867. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Даванцо Р., Де Кунто А., Траван Л., Баколла Г., Крети Р., Демарини С. Кормить или не кормить? Презентация клинического случая и рекомендации по передовой практике кормления грудным молоком и стрептококка группы B в развитых странах. Дж. Гум Лакт. 2013;29(ноябрь (4)): 452–457. [PubMed] [Google Scholar]
38. Cossey V., Vanhole C., Eerdekens A., Rayyan M., Fieuws S., Schuermans A. Пастеризация материнского молока у недоношенных детей не снижает частоту поздних начало сепсиса. Неонатология. 2013;103(3):170–176. [PubMed] [Google Scholar]
39. Джонс К.А. Материнская передача инфекционных возбудителей через грудное молоко. J Педиатр Здоровье ребенка. 2001; 37 (декабрь (6)): 576–582. [PubMed] [Google Scholar]
40. Лоуренс Р.М., Лоуренс Р.А. Грудное молоко и инфекции. Клин Перинатол. 2004; 31 (сентябрь (3)): 501–528. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клин Перинатол. 2004; 31 (сентябрь (3)): 501–528. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Перес П.Ф., Доре Дж., Леклерк М., Левенес Ф., Беньякуб Дж., Серрант П. Бактериальный импринтинг неонатальной иммунной системы: уроки материнских клеток? Педиатрия. 2007; 119 (март (3)): e724–e732. [PubMed] [Google Scholar]
42. Албешарат Р., Эрманн М.А., Коракли М., Язаджи С., Фогель Р.Ф. Фенотипический и генотипический анализ молочнокислых бактерий в местных ферментированных пищевых продуктах, грудном молоке и фекалиях матерей и их детей. Сист Appl Microbiol. 2011; 34 (апрель (2)): 148–155. [PubMed] [Академия Google]
43. Gagneur A., Hery-Arnaud G., Croly-Labourdette S., Gremmo-Feger G., Vallet S., Sizun J. Инфицированное грудное молоко, связанное с поздним началом и рецидивирующей стрептококковой инфекцией группы B у новорожденных близнецов : генетический анализ. Eur J Педиатр. 2009; 168 (9 сентября)): 1155–1158. [PubMed] [Google Scholar]
44. Olver WJ, Bond D. W., Boswell T.C., Watkin S.L. Неонатальная стрептококковая инфекция группы В, связанная с инфицированным грудным молоком. Arch Dis Child Fetal Neonatal Ed. 2000; 83 (июль (1)): F48–F49. [Бесплатная статья PMC] [PubMed] [Google Scholar]
W., Boswell T.C., Watkin S.L. Неонатальная стрептококковая инфекция группы В, связанная с инфицированным грудным молоком. Arch Dis Child Fetal Neonatal Ed. 2000; 83 (июль (1)): F48–F49. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Goldman A, Chheda, S, Keeney, SE. В: Полин Р.А., Фокс В.В., Абман С.Х., редакторы. Физиология плода и новорожденного, 3-е изд., т. 1, с. 2. Эльзевир, Филадельфия; 2002. с. 2022–32 [глава 184].
46. Хансон Л.А., Короткова М. Роль грудного вскармливания в профилактике неонатальной инфекции. Семин Неонатол. 2002; 7 (август (4)): 275–281. [PubMed] [Google Scholar]
47. Лаббок М.Х., Кларк Д., Голдман А.С. Грудное вскармливание: поддержание незаменимого иммунологического ресурса. Нат Рев Иммунол. 2004; 4 (июль (7)): 565–572. [PubMed] [Академия Google]
48. Васильев Т.Л., Велёва К.В. Природные полиреактивные аутоантитела IgA и IgM в молозиве человека. Сканд Дж. Иммунол. 1996; 44 (ноябрь (5)): 535–539. [PubMed] [Google Scholar]
49. Ньюбург Д.С., Уокер В.А. Защита новорожденных с помощью врожденной иммунной системы развивающегося кишечника и грудного молока. Педиатр рез. 2007; 61 (январь (1)): 2–8. [PubMed] [Google Scholar]
Ньюбург Д.С., Уокер В.А. Защита новорожденных с помощью врожденной иммунной системы развивающегося кишечника и грудного молока. Педиатр рез. 2007; 61 (январь (1)): 2–8. [PubMed] [Google Scholar]
50. Морроу А.Л., Руис-Паласиос Г.М., Алтай М., Цзян С., Герреро М.Л., Мейнцен-Дерр Дж.К. Эпитопы группы крови олигосахаридов грудного молока и врожденная иммунная защита от кампилобактериальной и калицивирусной диареи у младенцев, находящихся на грудном вскармливании. Adv Exp Med Biol. 2004; 554:443–446. [PubMed] [Академия Google]
51. Леви О. Врожденный иммунитет новорожденных: основные механизмы и клинические корреляты. Нат Рев Иммунол. 2007; 7 (май (5)): 379–390. [PubMed] [Google Scholar]
52. LeBouder E., Rey-Nores J.E., Raby A.C., Affolter M., Vidal K., Thornton C.A. Модуляция неонатального микробного распознавания: врожденные иммунные реакции, опосредованные TLR, специфически и дифференциально модулируются грудным молоком. Дж Иммунол. 2006; 176 (март (6)): 3742–3752. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
53. Исаакс С.Э., Литов Р.Е., Тормар Х. Антимикробная активность липидов, добавленных в грудное молоко, детскую смесь и коровье молоко. Дж. Нутр Биохим. 1995; 6 (июль (7)): 362–366. [PubMed] [Google Scholar]
54. Brandtzaeg P. Индукция секреторного иммунитета и памяти на слизистых оболочках. вакцина. 2007; 25 (30 июля)): 5467–5484. [PubMed] [Google Scholar]
55. Гольдман А.С. Модуляция желудочно-кишечного тракта младенцев грудным молоком. Интерфейсы и взаимодействия. Эволюционная перспектива. Дж Нутр. 2000; 130 (февраль (2S Дополнение)): 426S–431S. [PubMed] [Google Scholar]
56. Krakauer R., Zinneman H.H., Hong R. Дефицит секреторного Ig-A и кишечная мальабсорбция. Am J Гастроэнтерол. 1975; 64 (октябрь (4)): 319–323. [PubMed] [Google Scholar]
57. Dickinson E.C., Gorga J.C., Garrett M., Tuncer R., Boyle P., Watkins S.C. Добавка иммуноглобулина А предотвращает бактериальную транслокацию и сохраняет архитектуру кишечного эпителия. Операция. 1998; 124 (август (2)): 284–290. [PubMed] [Google Scholar]
Операция. 1998; 124 (август (2)): 284–290. [PubMed] [Google Scholar]
Секреторные антитела против Giardia lamblia в грудном молоке: защитный эффект против диареи. Педиатрия. 1994; 93 (январь (1)): 28–31. [PubMed] [Google Scholar]
59. Эдмонд К., Заиди А. Новые подходы к профилактике, диагностике и лечению неонатального сепсиса. ПЛОС Мед. 2010;7(март (3)):e1000213. [PMC free article] [PubMed] [Google Scholar]
60. Cruz J.R., Gil L., Cano F., Caceres P., Pareja G. Антитела IgA к термолабильным токсинам Escherichia coli в грудном молоке защищают от индуцированная токсинами детская диарея. Acta Pediatr Scand. 1988; 77 (сентябрь (5)): 658–662. [PubMed] [Академия Google]
61. Стивенс С., Кеннеди К.Р., Лахани П.К., Бреннер М.К. Иммунные реакции in vivo у детей, находящихся на грудном и искусственном вскармливании, на антиген столбнячного анатоксина и на нормальную кишечную флору. Acta Pediatr Scand. 1984; 73 (июль (4)): 426–432. [PubMed] [Google Scholar]
62. Weaver LT, Wadd N, Taylor CE, Greenwell J, Toms GL. Онтогенез сывороточного IgA у новорожденных. Pediatr Allergy Immunol 1991; 2:2–75.
Weaver LT, Wadd N, Taylor CE, Greenwell J, Toms GL. Онтогенез сывороточного IgA у новорожденных. Pediatr Allergy Immunol 1991; 2:2–75.
63. Яцык Г.В., Куваева И.Б., Грибакин С.Г. Иммунологическая защита желудочно-кишечного тракта новорожденных: значение грудного вскармливания. Acta Pediatr Scand. 1985; 74 (март (2)): 246–249. [PubMed] [Google Scholar]
64. Edén CS, Carlsson B, Hanson LA, Jann B, Jann K, Korhonen T, et al. Антипилиантные антитела в грудном молоке. Ланцет 1979.ii:1235. [PubMed]
65. Aniansson G., Andersson B., Lindstedt R., Svanborg C. Антиадгезионная активность человеческого казеина в отношении Streptococcus pneumoniae и Haemophilus influenzae . Микроб Патог. 1990; 8 (май (5)): 315–323. [PubMed] [Google Scholar]
66. Ван де Перре П. Перенос антител через материнское молоко. вакцина. 2003; 21 (июль (24)): 3374–3376. [PubMed] [Академия Google]
67. Hahn-Zoric M., Carlsson B., Jeansson S., Ekre H.P., Osterhaus A.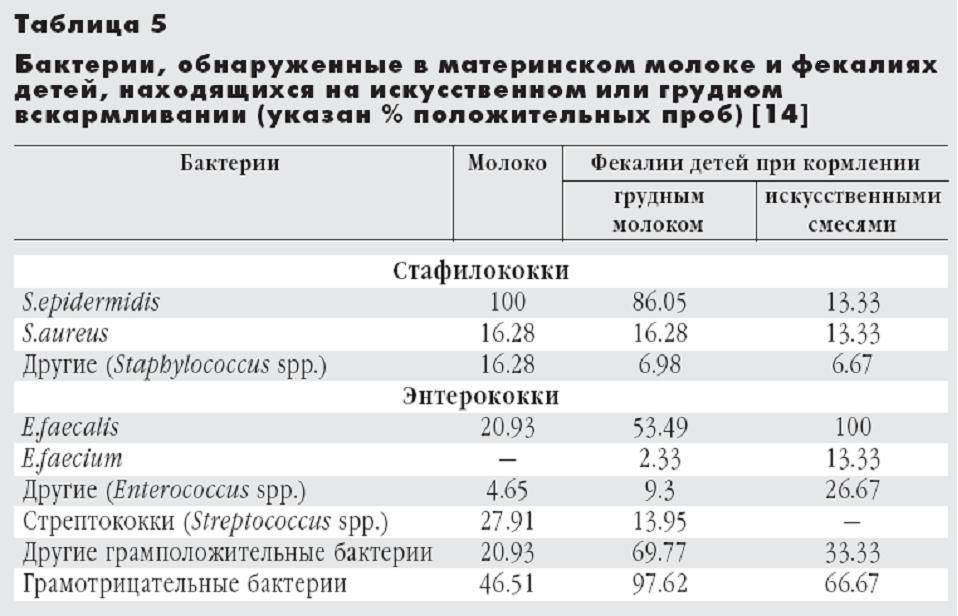 D., Roberton D. Антиидиотипические антитела к полиовирусным антителам в коммерческих препаратах иммуноглобулина, человеческой сыворотке и молоке. Педиатр рез. 1993; 33 (май (5)): 475–480. [PubMed] [Google Scholar]
D., Roberton D. Антиидиотипические антитела к полиовирусным антителам в коммерческих препаратах иммуноглобулина, человеческой сыворотке и молоке. Педиатр рез. 1993; 33 (май (5)): 475–480. [PubMed] [Google Scholar]
Плацентарный и грудной перенос антител после иммунизации матери полисахаридной менингококковой вакциной: рандомизированная контролируемая оценка. вакцина. 2002; 20 (17–18 мая)): 2404–2409.. [PubMed] [Google Scholar]
Иммунизация матери пневмококковой полисахаридной вакциной в третьем триместре беременности. вакцина. 2001; 20 (5–6 декабря)): 826–837. [PubMed] [Google Scholar]
70. Weisman L.E., Dobson F.M. Потенциальное воздействие стрептококковых антител группы В на грудное молоко. Adv Exp Med Biol. 1991; 310:345–351. [PubMed] [Google Scholar]
71. Лагергард Т., Тирингер К., Вассен Л., Шнеерсон Р., Тролльфорс Б. Изотипный состав антител к полисахариду стрептококка группы В типа III и к столбнячному анатоксину в материнской, пуповинной крови сыворотке и в грудном молоке. Eur J Педиатр. 1992; 151 (февраль (2)): 98–102. [PubMed] [Google Scholar]
Eur J Педиатр. 1992; 151 (февраль (2)): 98–102. [PubMed] [Google Scholar]
72. Эдвардс М.С., Муньос Ф.М., Бейкер С.Дж. Антитела к полисахариду стрептококка группы В типа III в грудном молоке. Pediatr Infect Dis J. 2004; 23 (октябрь (10)): 961–963. [PubMed] [Google Scholar]
73. Berardi A., Rossi C., Creti R., China M., Gherardi G., Venturelli C. Колонизация стрептококками группы B у 160 пар мать-ребенок: проспективное когортное исследование. J Педиатр. 2013; 163 (октябрь (4)) 1099–104.e1. [PubMed] [Академия Google]
74. Хейман Х.С., Вейсман Л.Е. Трансплацентарная или энтеральная передача индуцированных материнской иммунизацией антител защищает крысят-сосунков от стрептококковой инфекции типа III группы B. Pediatr Res 1989;26(6):629–32. [PubMed]
75. Грей Б.М., Иган М.Л., Притчард Д.Г. Специфичность моноклональных антител против стрептококка группы В типа II и ингибирование их связывания выделениями человека. Педиатр рез. 1988; 24 (июль (1)): 68–72. [PubMed] [Google Scholar]
76. Андерссон Б., Поррас О., Хэнсон Л.А., Лагергард Т., Сванборг-Эден К. Ингибирование привязанности Streptococcus pneumoniae и Haemophilus influenzae грудным молоком и рецепторными олигосахаридами. J заразить дис. 1986; 153 (февраль (2)): 232–237. [PubMed] [Google Scholar]
Андерссон Б., Поррас О., Хэнсон Л.А., Лагергард Т., Сванборг-Эден К. Ингибирование привязанности Streptococcus pneumoniae и Haemophilus influenzae грудным молоком и рецепторными олигосахаридами. J заразить дис. 1986; 153 (февраль (2)): 232–237. [PubMed] [Google Scholar]
77. Cravioto A., Tello A., Villafan H., Ruiz J., del Vedovo S., Neeser J.R. иммуноглобулиновые и олигосахаридные фракции молозива и грудного молока человека. J заразить дис. 1991; 163 (июнь (6)): 1247–1255. [PubMed] [Академия Google]
78. Ruiz-Palacios G.M., Calva J.J., Pickering L.K., Lopez-Vidal Y., Volkow P., Pezzarossi H. Защита грудных детей от диареи Campylobacter с помощью антител в грудном молоке. J Педиатр. 1990; 116 (май (5)): 707–713. [PubMed] [Google Scholar]
79. Holmgren J., Svennerholm A.M., Ahren C. Неиммуноглобулиновая фракция грудного молока ингибирует адгезию бактерий (гемагглютинацию) и связывание энтеротоксинов Escherichia coli и Vibrio cholerae .

