Как выглядят вирусы под микроскопом: описания и фото
Назад к списку
Вирусы составляют особую группу микроскопических организмов и представляют собой внеклеточную форму жизни. Они настолько малы, что в обычный микроскоп их увидеть невозможно. Размеры вирусов составляют от 20 до 300 нанометров. Для их рассмотрения используют только электронные микроскопы. Это приборы нового класса, впервые появившиеся в начале 80-х годов прошлого века. Благодаря им удалось изучить и увидеть не только «портрет» вируса, но и исследовать процессы, происходящие внутри зараженной клетки.
Как выглядят вирусы под микроскопом?
Сегодня описано больше 5 тысяч вирусов, и каждый из них питается и размножается за счет других клеток, то есть паразитирует внутри организма. По мнению ученых, вирус способен выживать в экстремальных условиях, обладает разумом и хитростью. Сам по себе вирус не представляет никакой опасности, но, попадая в организм, начинает активно размножаться.
Многие вирусы считаются смертельными. При этом даже самые безобидные могут при определенных обстоятельствах настолько мутировать, что, попав в организм, вызовут тяжелые заболевания.
Смотрите, как выглядят под микроскопом маленькие «монстры», которые правят нашим миром, медленно убивая нас внутри или образуя невероятные эпидемии! Первые два из них самые опасные.
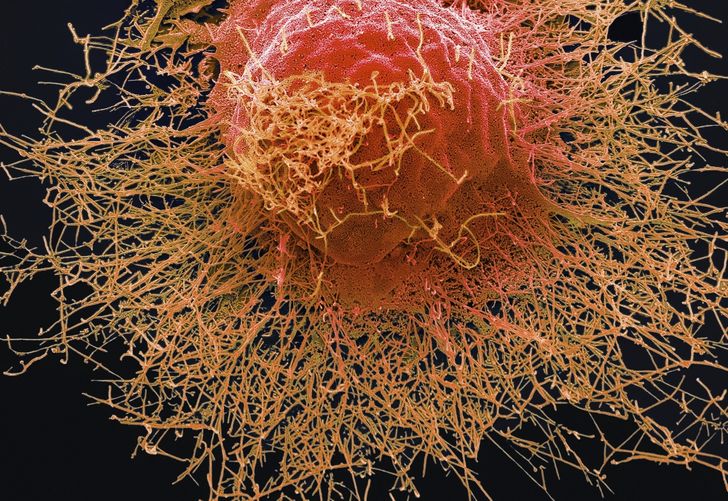
Эбола — вирус, вызывающий геморрагическую лихорадку, сопровождающуюся резким повышением проницаемости сосудов. Болезнь развивается очень быстро. Человек погибает за несколько дней от массивных кровотечений.
Бешенство — болезнь, вызываемая смертельным для человека вирусом. Передается от больных животных контактным путем или через укус. Вирус в организме продвигается со скоростью 3 мм/ч и поражает, в первую очередь, нервную систему.
Вирус в организме продвигается со скоростью 3 мм/ч и поражает, в первую очередь, нервную систему.
ВИЧ — медленное и прогрессирующее заболевание, вызванное вирусом, поражающим иммунные клетки. За несколько лет заболевание перерастает в СПИД.
Вирус полиомиелита вызывает детский спинномозговой паралич, который может развиться за 2 дня. В группу высокого риска входят дети до 7 лет. Вакцинация — лучший способ избежать заболевания.
Вирус папилломы размножается в верхних слоях кожи и является очень заразным заболеванием, вызывающим рак. Особенно опасен для людей со сниженным иммунитетом.
Вирус гепатита С поражает печень, при этом заболевание проходит бессимптомно. Этот вирус считается «ласковым убийцей». В организме начинает мутировать, поэтому можно обнаружить до 40 модификаций. Человек понимает, что заболел, когда болезнь переходит в тяжелую форму, и уже ничем нельзя помочь.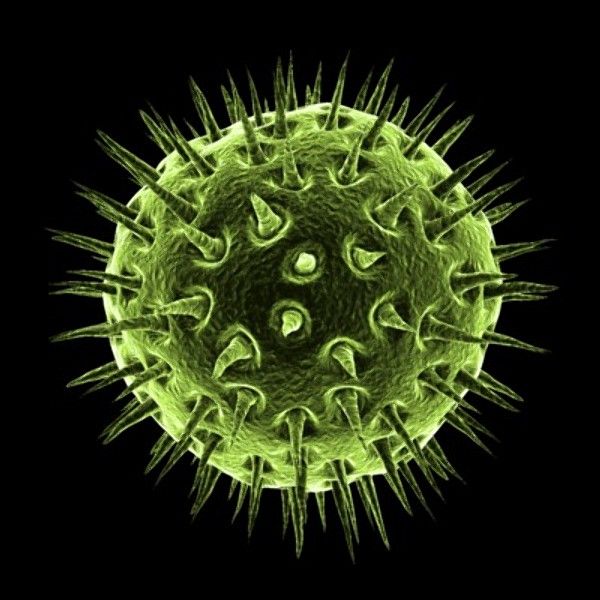
Оспа — высокозаразное и опасное заболевание, которое также вызывает вирус. Поражает в основном детей, вызывая различные осложнения.
Герпес — разновидность оспы, проявляется высыпанием пузырьков на коже (это безобидная простуда на губе). У взрослых старше 60 лет вирус герпеса может вызвать обширные высыпания. В этом случае вирус «съедает» миелиновую оболочку нервов. Болезнь протекает с сильными болями, она не смертельная, но очень мучительная.
Вирусы гриппа вызывают острое инфекционное респираторное заболевание верхних дыхательных путей, которое без отсутствия лечения может протекать в тяжелой форме и вызывать осложнения. Сегодня описано более 2000 видов данного вируса.
Ротавирус вызывает кишечные инфекции. Попадая в пищеварительный тракт, начинает активно размножаться в тонком кишечнике. Главная опасность — обезвоживание организма, которое может привести к печальным последствиям.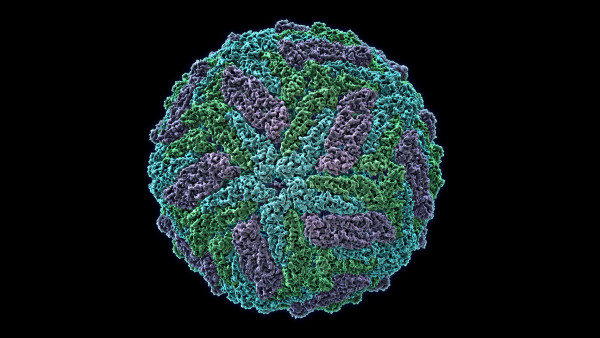
По мнению ученых, вирусы являются самым загадочным явлением на Земле. Только современные электронные микроскопы способны максимально увеличивать такие микроскопические объекты и позволяют человеку изучать их разновидности, правильно ставить диагнозы, лечить, а, самое главное, находить способы профилактики и защиты.
Назад к списку
Вирус под микроскопом: от визуализации к манипуляции
Денис Корнеев
«Наука из первых рук» №3/4(57/58), 2014
Вирусы являются чрезвычайно малыми объектами, имеющими размер от нескольких десятков до нескольких сотен нанометров. Первым и на несколько десятилетий единственным методом их визуализации стала электронная микроскопия, позволившая не только подробно изучить строение самих вирусных частиц, называемых вирионами, но и исследовать процессы, происходящие в зараженной клетке — репликацию вируса. «Монополия» электронной микроскопии была нарушена появлением в начале 1980-х годов принципиально нового класса приборов — сканирующих зондовых микроскопов.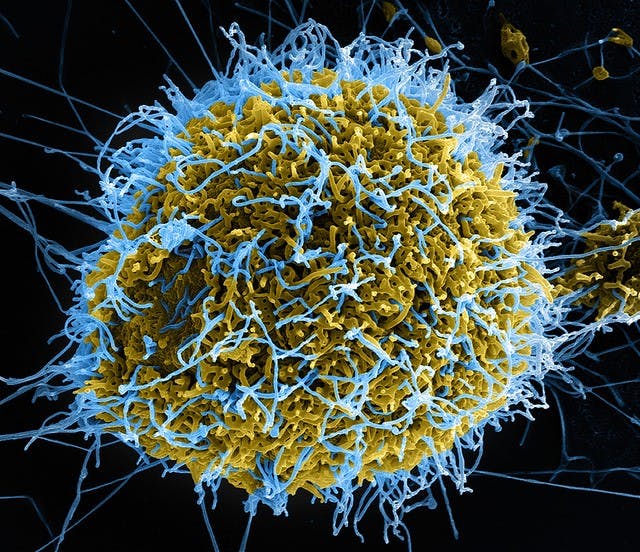
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки — адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Об автореДенис Владимирович Корнеев — научный сотрудник лаборатории ультраструктурных исследований, председатель Совета молодых ученых Государственного научного центра вирусологии и биотехнологии «Вектор» (Новосибирская область, Кольцово). |
В известной песне Владимира Высоцкого поется: «…не поймаешь нейтрино за бороду / И не посадишь в пробирку…». Конечно, вирус — это не нейтрино, не атом и даже не молекула, но все же объект настолько малый, что его невозможно увидеть не только глазом, но и в обычный световой микроскоп. Однако электронная микроскопия, в сотни тысяч раз увеличившая возможности нашего зрения, позволила не только увидеть эти удивительные объекты, но и рассмотреть их до мельчайших подробностей. А атомно-силовая микроскопия, в такой же степени обострившая наше осязание, позволила осуществить прямую механическую манипуляцию вирусными частицами.
Вирусы являются чрезвычайно малыми объектами — их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.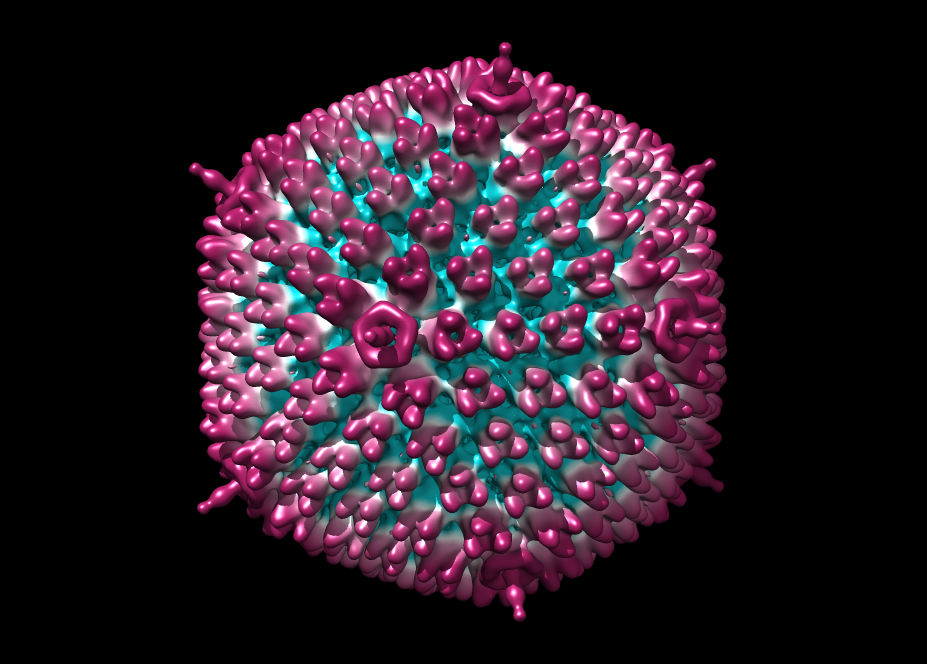
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Еще большее разнообразие было обнаружено для стратегии репликации (размножения) вирусов. Единственным фундаментальным свойством, общим для всех без исключения вирусов, оказался их статус облигатного внутриклеточного паразита. Это означает, что для размножения вируса его генетический материал должен в обязательном порядке проникнуть в живую клетку и «захватить» ее ферментативный аппарат, переключив последний на производство копий вируса.
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Спецификой электронной микроскопии является изучение фиксированных, т. е. подготовленных специальным образом, объектов — по сути, она работает только с «мертвой» материей
е. подготовленных специальным образом, объектов — по сути, она работает только с «мертвой» материей
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора — ультратома — делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование — прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование — прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ — атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.
Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.
С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимодействии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.
И, надо отметить, в большинстве случаев изучен недостаточно.
Поистине захватывающие перспективы исследований в этом направлении открывает АСС. Зафиксировав одиночную вирусную частицу на острие зонда АСМ, можно осуществить измерение силы, возникающей при контакте вирусной частицы с поверхностью клетки, исследовать кинетические характеристики данного взаимодействия и даже «вдавить» вирион внутрь клетки, одновременно ведя наблюдение при помощи мощного светового микроскопа. В таком эксперименте исследователь из пассивного наблюдателя превращается в активного участника процесса, осуществляя механическую манипуляцию исследуемым наноразмерным объектом — такую возможность не может предоставить ни один из других видов микроскопии.
Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
Главный вопрос, на который необходимо ответить при интерпретации любых результатов атомно-силовой спектроскопии, можно сформулировать следующим образом: «Силы между какими объектами были измерены?»
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
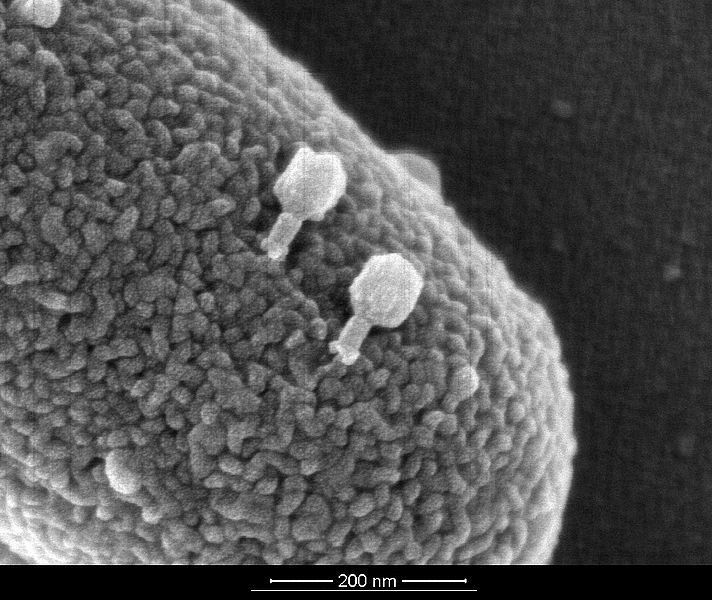
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами.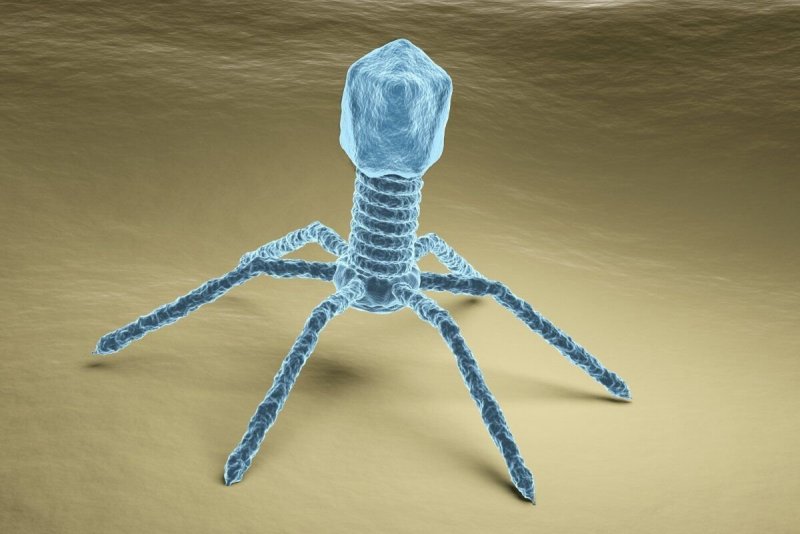 Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень — от структурных исследований к функциональным.
Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень — от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований — наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
В публикации использованы фото автора
Литература
1..jpg) Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73–77.
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73–77.
2. Миронов В. Л. Основы сканирующей зондовой микроскопии. Нижний Новгород: ИФМ РАН, 2004. 182 с.
3. Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3 (10). P. 3063–3068.
4. Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F. Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
5. Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56 (9). P. 930–933.
6. Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1–104.
7. Malkin A. J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85–108.
Malkin A. J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85–108.
* Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения.
Современное использование электронной микроскопии для обнаружения вирусов
1. Адриан, М., Дж. Дюбоше, Дж. Лепо и А. В. Макдауэлл. 1984. Криоэлектронная микроскопия вирусов. Природа 308 : 32-36. [PubMed] [Google Scholar]
2. Almeida, JD 1963. Классификация вирусов на основе морфологии. Может. Мед. доц. J. 89 : 787-798. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Almeida, JD, and AP Goffe. 1965. Антитела к вирусу бородавок в сыворотке крови человека продемонстрированы с помощью электронной микроскопии и тестов на преципитацию. Ланцет II : 1205-1207. [PubMed] [Google Scholar]
Almeida, JD, and AP Goffe. 1965. Антитела к вирусу бородавок в сыворотке крови человека продемонстрированы с помощью электронной микроскопии и тестов на преципитацию. Ланцет II : 1205-1207. [PubMed] [Google Scholar]
4. Алмейда, Дж. Д., и А. Д. Уотерсон. 1970. Некоторые последствия морфологически ориентированной классификации вирусов. Арка Gesamte Virusforsch. 32 : 66-72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Anderson, TF, and WM Stanley. 1941 г. Изучение с помощью электронного микроскопа реакции между вирусом табачной мозаики и его антисывороткой. Дж. Биол. хим. 139 : 339-344. [Google Scholar]
6. Bayer-Garner, IB 2005. Вирус оспы обезьян: гистологические, иммуногистохимические и электронно-микроскопические данные. Дж. Кутан. Патол. 32 : 28-34. [PubMed] [Google Scholar]
7. Biel, S. S., A. Nitsche, A. Kurth, W. Siegert, M. Ozel и HR Gelderblom. 2004. Обнаружение полиомавирусов человека в моче пациентов с трансплантацией костного мозга: сравнение электронной микроскопии с ПЦР. клин. хим. 50 : 306-312. [PubMed] [Google Scholar]
S., A. Nitsche, A. Kurth, W. Siegert, M. Ozel и HR Gelderblom. 2004. Обнаружение полиомавирусов человека в моче пациентов с трансплантацией костного мозга: сравнение электронной микроскопии с ПЦР. клин. хим. 50 : 306-312. [PubMed] [Google Scholar]
8. Боуэн, Э. Т., Г. Ллойд, У. Дж. Харрис, Г. С. Платт, А. Баскервиль и Э. Э. Велла. 1977. Вирусная геморрагическая лихорадка в южном Судане и северном Заире. Предварительные исследования этиологического агента. Ланцет i : 571-573. [PubMed] [Google Scholar]
9. Брике С. и К. Вакеро. 2002. Иммунолокальные исследования антисмыслового белка в ВИЧ-1-инфицированных клетках и вирусных частицах. Вирусология 292 : 177-184. [PubMed] [Google Scholar]
10. Бузинаро, М. Г., П. П. Фрейтас, Дж. Дж. Киселлиус, М. Уеда и Дж. А. Херес. 2003. Идентификация бисегментированного двухцепочечного РНК-вируса (пикобирнавируса) в фекалиях телят. Вет. J. 166 : 185-187. [PubMed] [Google Scholar]
Вет. J. 166 : 185-187. [PubMed] [Google Scholar]
11. Carter, KC 2003. Возникновение причинно-следственных концепций болезней: истории болезни. Ашгейт, Олдершот, Хэмпшир, Великобритания.
12. ЦКЗ. 2006. Протокол электронной микроскопии с отрицательным окрашиванием при сыпи. http://www.bt.cdc.gov/agent/smallpox/lab-testing/pdf/em-rash-protocol.pdf.
13. ЦКЗ. 1988. Перспективы профилактики заболеваний и обновления здоровья: универсальные меры предосторожности для предотвращения передачи вируса иммунодефицита человека, вируса гепатита В и возбудителей, передающихся через кровь, в медицинских учреждениях. MMWR Морб. Смертный. еженедельно. Респ. 37 : 377-388. [PubMed] [Google Scholar]
14. Чен Д., Р. Нимс, С. Дусинг, П. Миллер, В. Луо, М. Квертинмонт, Б. Парех, Дж. Пурбо, Дж. А. Буз и Э. М. Аткинсон. 2008 г. Расследование первопричины инцидента с вирусным загрязнением, произошедшего во время тестирования и характеристики главного банка клеток (MCB) — тематическое исследование.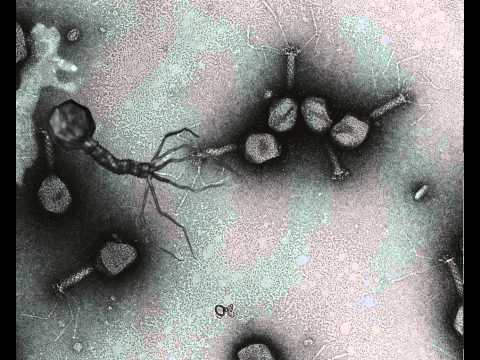 Биопрепараты 36 : 393-402. [PubMed] [Google Scholar]
Биопрепараты 36 : 393-402. [PubMed] [Google Scholar]
15. Chua, K.B., E.M. Wong, B.C. Cropp, and AD Hyatt. 2007. Роль электронной микроскопии в расследовании и борьбе со вспышками вируса Нипах. Мед. J. Малайзия 62 : 139-142. [PubMed] [Google Scholar]
16. Cossart, YE., AM Field, B. Cant, and D. Widdows. 1975. Парвовирусоподобные частицы в сыворотке крови человека. Ланцет i : 72-73. [PubMed] [Google Scholar]
17. Dalton, A.J., and F. Haguenau. 1973. Ультраструктура вирусов животных и бактериофагов: атлас. Academic Press, Нью-Йорк, штат Нью-Йорк.
18. Доан, Ф. В. и Н. Андерсон. 1987. Электронная микроскопия в диагностической вирусологии: практическое руководство и атлас. Издательство Кембриджского университета, Нью-Йорк, штат Нью-Йорк.
19. Доан, Ф. В., Н. Андерсон, Дж. Чао и А. Нунан. 1974. Двухчасовая процедура встраивания для внутриклеточного обнаружения вирусов с помощью электронной микроскопии. заявл. микробиол. 27 : 407-410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
заявл. микробиол. 27 : 407-410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Дростен К., С. Гюнтер, В. Прейзер, С. ван дер Верф, Х. Р. Бродт, С. Беккер, Х. Рабенау, М. Паннинг, Л. Колесникова, Р. А. Фушье, А. Бергер, А. М. Бургьер, Дж. Чинатль, М. Эйкманн, Н. Эскриу, К. Грюна, С. Крамме, Дж. К. Манугерра, С. Мюллер, В. Рикертс, М. Штурмер, С. Вит, Х. Д. Кленк, А. Д. Остерхаус, Х. Шмитц и Х. В. Дорр. 2003. Идентификация нового коронавируса у пациентов с тяжелым острым респираторным синдромом. Н. англ. Дж. Мед. 348 : 1967-1976. [PubMed] [Google Scholar]
21. Эстрада, Дж. К., М. А. Селим и С. Э. Миллер. 2005. ПЭМ ткани из залитых парафином окрашенных гематоксилин-эозином 6-микронных срезов для диагностики вируса (необычный случай паповавируса), с. 964CD. В Р. Прайс, П. Котула, М. Марко, Дж. Х. Скотт, Г. Ф. Вандер Воорт, Э. Манилова, М. М. Л. Нг, К. Смит, Б. Гриффин, П. Смит и С. МакКернан (ред.), Микроскопия и микроанализ, т. 1, с. 11 (С2). Издательство Кембриджского университета, Гонолулу, Гавайи.
МакКернан (ред.), Микроскопия и микроанализ, т. 1, с. 11 (С2). Издательство Кембриджского университета, Гонолулу, Гавайи.
22. Fauquet, C.M., M.A. Mayo, J. Maniloff, U. Desselberger, and L.A. Ball (ред.). 2005. Таксономия вирусов. Классификация и номенклатура вирусов. Восьмой отчет Международного комитета по таксономии вирусов. Elsevier Academic Press, Нью-Йорк, штат Нью-Йорк.
23. Fischer, S.A., M.B. Graham, M.J. Kuehnert, C.N. Kotton, A. Srinivasan, F.M. Marty, J.A. Comer, J. Guarner, C.D. Paddock, D.L. DeMeo, WJ Shieh, B.R. Erickson, U. Bandy, A. ДеМария-младший, Дж. П. Дэвис, Ф. Л. Дельмонико, Б. Павлин, А. Ликос, М. Дж. Винсент, Т. К. Сили, К. С. Голдсмит, Д. Б. Джерниган, П. Э. Роллин, М. М. Паккард, М. Патель, К. Роуленд, Р. Ф. Хелфанд, С. Т. Николь , Дж. А. Фишман, Т. Ксиазек и С. Р. Заки. 2006. Передача вируса лимфоцитарного хориоменингита при трансплантации органов. Н. англ. Дж. Мед. 354 : 2235-2249. [PubMed] [Google Scholar]
24.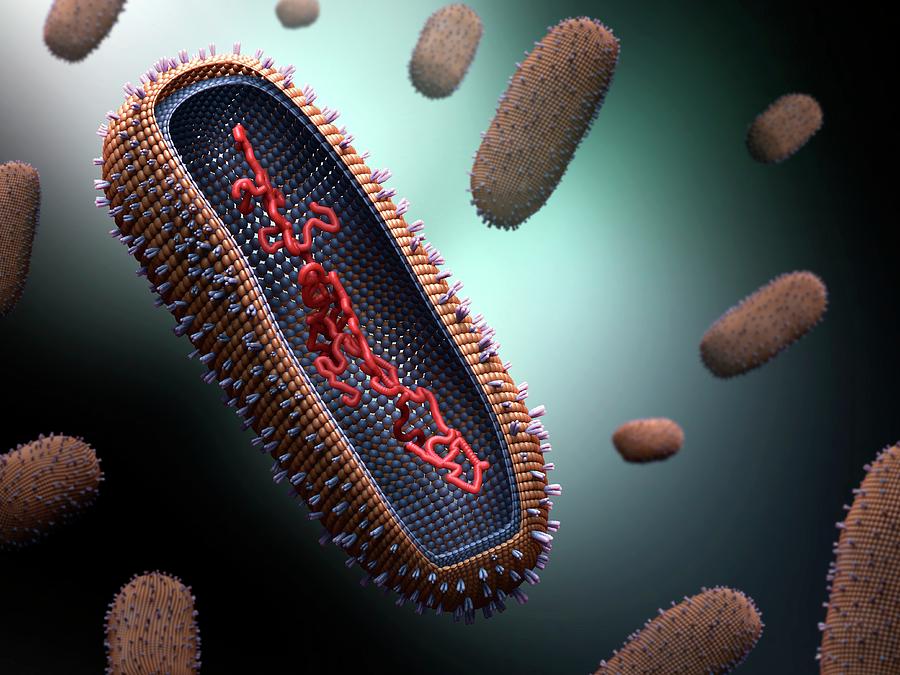 Фридлендер М., Д. Х. Мур и Х. Копровски. 1955. Изучение под электронным микроскопом взаимоотношений вирус-хозяин в клетках асцитной опухоли Эрлиха. II. Локализация и возможное развитие вируса Anopheles A в эндоплазматическом ретикулуме клеток-хозяев. Дж. Эксп. Мед. 102 : 371-378. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Фридлендер М., Д. Х. Мур и Х. Копровски. 1955. Изучение под электронным микроскопом взаимоотношений вирус-хозяин в клетках асцитной опухоли Эрлиха. II. Локализация и возможное развитие вируса Anopheles A в эндоплазматическом ретикулуме клеток-хозяев. Дж. Эксп. Мед. 102 : 371-378. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Фридлендер М., Д. Х. Мур, Р. Лав, Р. А. Браун и Х. Копровски. 1955. Изучение под электронным микроскопом взаимоотношений вирус-хозяин в клетках асцитной опухоли Эрлиха. I. Идентификация и структура вируса Anopheles A. Дж. Эксп. Мед. 102 : 362-370. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Гаспер-Смит, Н., Д. М. Кроссман, Дж. Ф. Уайтсайдс, Н. Менсали, Дж. С. Оттингер, С. Г. Плонк, М. А. Муди, Г. Феррари, К. Дж. Вайнхольд, С. Э. Миллер, К. Ф. Райх III, Л. Цинь, С. Г. Селф, Г. М. Шоу, Т. Н. Денни, Л. Э. Джонс, Д. С. Писецкий и Б. Ф. Хейнс. 2008. Индукция плазмы (TRAIL), TNFR-2, лиганда Fas и микрочастиц плазмы после передачи вируса иммунодефицита человека типа 1 (ВИЧ-1): последствия для дизайна вакцины против ВИЧ-1. Дж. Вирол. 82 : 7700-7710. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Индукция плазмы (TRAIL), TNFR-2, лиганда Fas и микрочастиц плазмы после передачи вируса иммунодефицита человека типа 1 (ВИЧ-1): последствия для дизайна вакцины против ВИЧ-1. Дж. Вирол. 82 : 7700-7710. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Geisbert, T.W., and P.B. Jahrling. 1995. Дифференциация филовирусов с помощью электронной микроскопии. Вирус Рез. 39 : 129-150. [PubMed] [Google Scholar]
28. Гейсберт, Т. В., П. Б. Ярлинг, М. А. Хейнс и П. М. Зак. 1992. Ассоциация родственных Эболе частиц вируса Рестон и антигена с поражениями тканей обезьян, завезенных в США. Дж. Комп. Патол. 106 : 137-152. [PubMed] [Google Scholar]
29. Goldsmith, C.S., LH Elliott, CJ Peters, and S.R. Zaki. 1995. Ультраструктурная характеристика вируса Sin Nombre, возбудителя хантавирусного легочного синдрома. Арка Вирол. 140 : 2107-2122. [PubMed] [Google Scholar]
30. Granzow, H., F. Weiland, D. Fichtner, H. Schutze, A. Karger, E. Mundt, B. Dresenkamp, P. Martin и T.C. Mettenleiter. 2001. Идентификация и ультраструктурная характеристика нового вируса рыб. Дж. Генерал Вирол. 82 : 2849-2859. [PubMed] [Google Scholar]
Granzow, H., F. Weiland, D. Fichtner, H. Schutze, A. Karger, E. Mundt, B. Dresenkamp, P. Martin и T.C. Mettenleiter. 2001. Идентификация и ультраструктурная характеристика нового вируса рыб. Дж. Генерал Вирол. 82 : 2849-2859. [PubMed] [Google Scholar]
31. Guarner, J., B.J. Johnson, C.D. Paddock, WJ Shieh, C.S. Goldsmith, M.G. Reynolds, I.K. Damon, R.L. Regnery, and S.R. Zaki. 2004. Передача и патогенез оспы обезьян у луговых собачек. Эмердж. Заразить. Дис. 10 : 426-431. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Гаст, И. Д., Дж. Калдор, Г. Ф. Кросс, М. Во и А. А. Феррис. 1971. Вирусоподобные частицы, связанные с фекальным антигеном больных гепатитом и австралийским антигеном. Ауст. Дж. Эксп. биол. Мед. науч. 49 : 1-9. [PubMed] [Google Scholar]
33. Хандисурья А., С. Гилч, Д. Винтер, С. Шафти-Керамат, Д. Маурер, Х. М. Шетцль и Р. Кирнбауэр. 2007. Вакцинация частицами, подобными папилломавирусам, содержащими прионовые пептиды, индуцирует аутоантитела к нормальному прионному белку, которые препятствуют выработке патологического прионного белка в инфицированных клетках. ФЕБС Дж. 274 : 1747-1758. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кирнбауэр. 2007. Вакцинация частицами, подобными папилломавирусам, содержащими прионовые пептиды, индуцирует аутоантитела к нормальному прионному белку, которые препятствуют выработке патологического прионного белка в инфицированных клетках. ФЕБС Дж. 274 : 1747-1758. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Haqshenas, G., H.L. Shivaprasad, P.R. Woolcock, D.H. Read, and X.J. Meng. 2001. Генетическая идентификация и характеристика нового вируса, связанного с вирусом гепатита Е человека, от кур с синдромом гепатита-спленомегалия в Соединенных Штатах. Дж. Генерал Вирол. 82 : 2449-2462. [PubMed] [Google Scholar]
35. Hayat, MA, and S.E. Miller. 1990. Негативное окрашивание: применение и методы McGraw-Hill, New York, NY.
36. Haycox, C.L., S. Kim, P. Fleckman, L.T. Smith, M. Piepkorn, J.P. Sundberg, D.N. Howell, and S.E. Miller. 1999. Trichodysplasia spinulosa — недавно описанная фолликулоцентрическая вирусная инфекция у хозяина с ослабленным иммунитетом.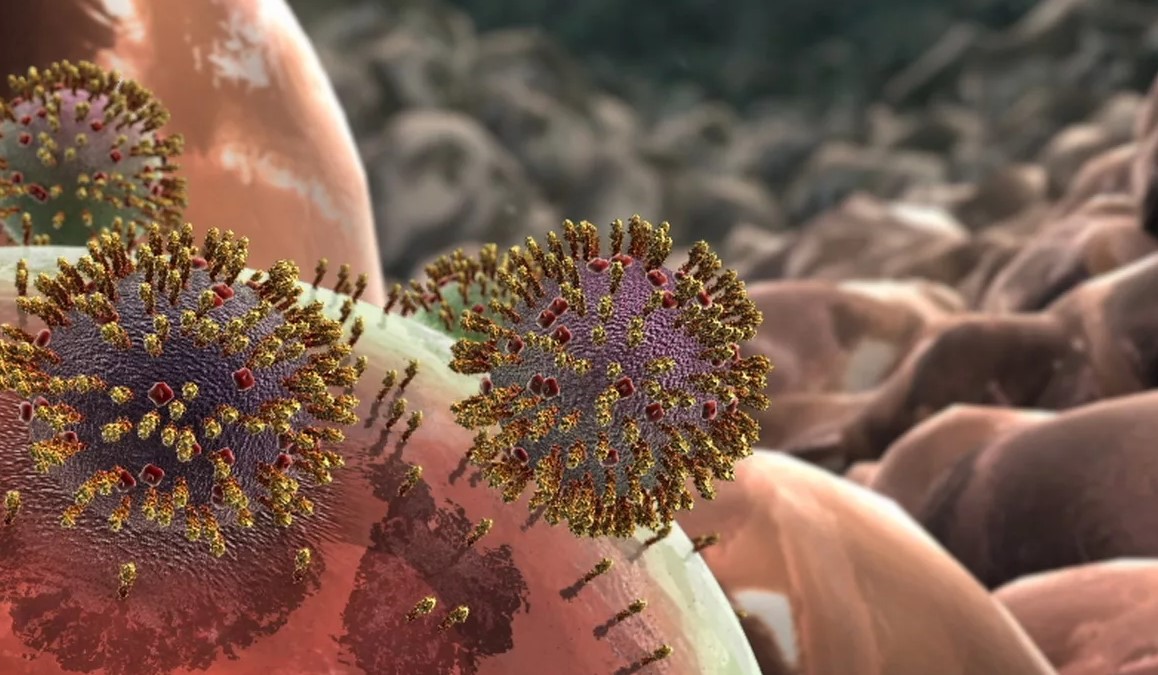 Дж. Расследование. Дерматол. Симп. проц. 4 : 268-271. [PubMed] [Google Scholar]
Дж. Расследование. Дерматол. Симп. проц. 4 : 268-271. [PubMed] [Google Scholar]
37. Хейзелтон, П. Р. и Х. Р. Гелдерблом. 2003. Электронная микроскопия для экспресс-диагностики инфекционных агентов в экстренных ситуациях. Эмердж. Заразить. Дис. 9 : 294-303. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Hessling, JJ, SE Miller, and NL Levy. 1980. Прямое сравнение методов обнаружения микоплазмы в культуре тканей. Дж. Иммунол. Методы 38 : 315-324. [PubMed] [Google Scholar]
39. Хауэлл, Д. Н., Д. У. Баттерли и С. Э. Миллер. 2002. Диагностика полиомавирусных инфекций мочевыводящих путей: корреляционный подход. Патол. Дело 7 : 278-283. [Google Scholar]
40. Howell, D. N., S. R. Smith, D. W. Butterly, P. S. Klassen, H. R. Krigman, J. L. Burchette, Jr. и S. E. Miller. 1999. Диагностика и лечение ВК полиомавирусного интерстициального нефрита у реципиентов почечного трансплантата. Трансплантация 68 : 1279-1288. [PubMed] [Google Scholar]
Трансплантация 68 : 1279-1288. [PubMed] [Google Scholar]
41. Hsiung, G.D., C.K.Y. Fong, and M.L. Landry. 1994. Диагностическая вирусология Сюна: на примере световой и электронной микроскопии. Издательство Йельского университета, Нью-Хейвен, Коннектикут.
42. Hyatt, A.D., and P.W. Selleck. 1996. Ультраструктура морбилливируса лошадей. Вирус Рез. 43 : 1-15. [PubMed] [Google Scholar]
43. Hyatt, A.D., M. Williamson, B.E. Coupar, D. Middleton, S.G. Hengstberger, A.R. Gould, P. Selleck, TG Wise, J. Kattenbelt, A.A. Cunningham и J. Ли. 2002 г. Первая идентификация ранавируса у зеленых питонов (Chondropython viridis). Дж. Уайлдл. Дис. 38 : 239-252. [PubMed] [Академия Google]
44. Hyatt, A.D., S.R. Zaki, C.S. Goldsmith, T.G. Wise и S.G. Hengstberger. 2001. Ультраструктура вирусов Хендра и Нипах в культивируемых клетках и животных-хозяевах.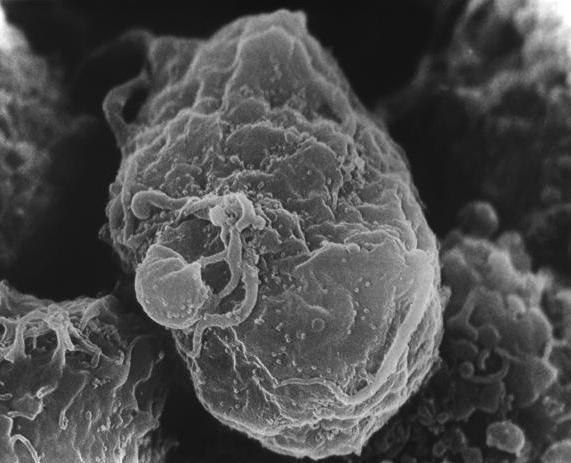 микробы заражают. 3 : 297-306. [PubMed] [Google Scholar]
микробы заражают. 3 : 297-306. [PubMed] [Google Scholar]
45. Джонсон, К. М., Дж. В. Ланге, П. А. Уэбб и Ф. А. Мерфи. 1977. Выделение и частичная характеристика нового вируса, вызывающего острую геморрагическую лихорадку в Заире. Ланцет i : 569-571. [PubMed] [Академия Google]
46. Капикян А. З., Р. Г. Вятт, Р. Долин, Т. С. Торнхилл, А. Р. Калица и Р. М. Чанок. 1972. Визуализация с помощью иммуноэлектронной микроскопии 27-нм частицы, связанной с острым инфекционным небактериальным гастроэнтеритом. Дж. Вирол. 10 : 1075-1081. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Кауше Г., Э. Пфанкух и Х. Руска. 1939. Die Sichtbarmachung von pflanzlichem Virus im Übermikroskop. Натурвиссеншафтен 27 : 292-299. [Google Scholar]
48. Клупп, Б.Г., Х. Гранцов, Э. Мундт и Т.С. Меттенлейтер. 2001. Продукт гена UL37 вируса псевдобешенства вовлечен во вторичную оболочку.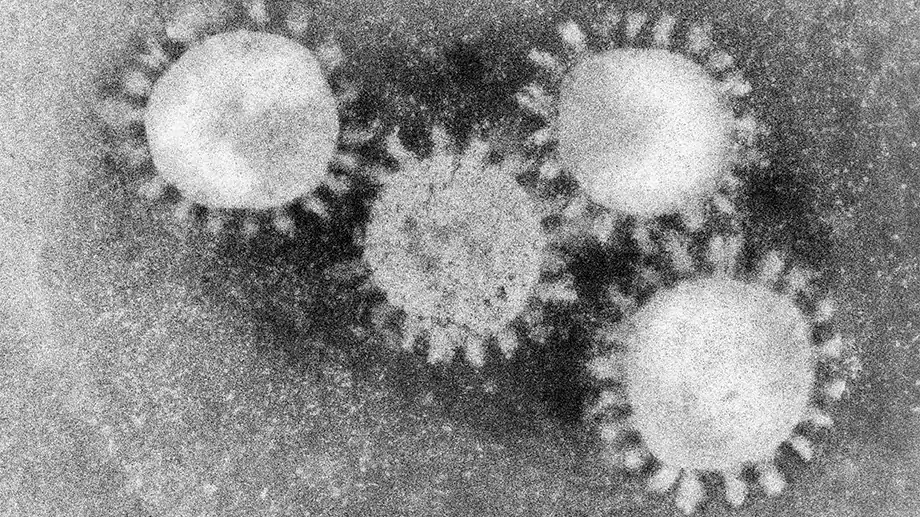 Дж. Вирол. 75 : 8927-8936. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Вирол. 75 : 8927-8936. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Кок, Л. П. и М. Е. Бун. 1992. Поваренная книга для микроскопистов. Искусство и наука визуализации, 3-е изд. Coulomb Press Leyden, Лейден, Нидерланды.
50. Ксиазек, Т. Г., Д. Эрдман, К. С. Голдсмит, С. Р. Заки, Т. Перет, С. Эмери, С. Тонг, К. Урбани, Дж. А. Комер, У. Лим, П. Э. Роллин, С. Ф. Доуэлл, А. Э. Линг , CD Humphrey, WJ Shieh, J. Guarner, CD Paddock, P. Rota, B. Fields, J. DeRisi, JY Yang, N. Cox, JM Hughes, JW LeDuc, WJ Bellini и LJ Anderson. 2003. Новый коронавирус, связанный с тяжелым острым респираторным синдромом. Н. англ. Дж. Мед. 348 : 1953-1966. [PubMed] [Google Scholar]
51. Линь Ю., С. Ян, В. Цао, К. Ван, Дж. Фэн, Дж. Дуань и С. Се. 2004 г. Исследование структуры коронавируса SARS с помощью сканирующей электронной микроскопии. Антивир. тер. 9 : 287-289. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
52. Лю Дж., А. Бартесаги, М. Дж. Боргния, Г. Сапиро и С. Субраманиам. 2008. Молекулярная архитектура нативных тримеров gp120 ВИЧ-1. Природа 455 : 109-113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. McKelvey, TA, SC Andrews, SE Miller, CA Ray и DJ Pickup. 2002. Идентификация гена p4c ортопоксвируса, который кодирует структурный белок, направляющий внутриклеточные зрелые вирусные частицы во включения А-типа. Дж. Вирол. 76 : 11216-11225. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Melnick, JL, and C.A. Phillips. 1970. Энтеровирусы: вакцины, эпидемиология, диагностика, классификация. CRC крит. Преподобный Клин. лаборатория науч. 1 : 87-118. [PubMed] [Google Scholar]
55. Miller, SE 2003. Биотерроризм и электронно-микроскопическая дифференциация поксвирусов от герпесвирусов: что можно и что нельзя делать.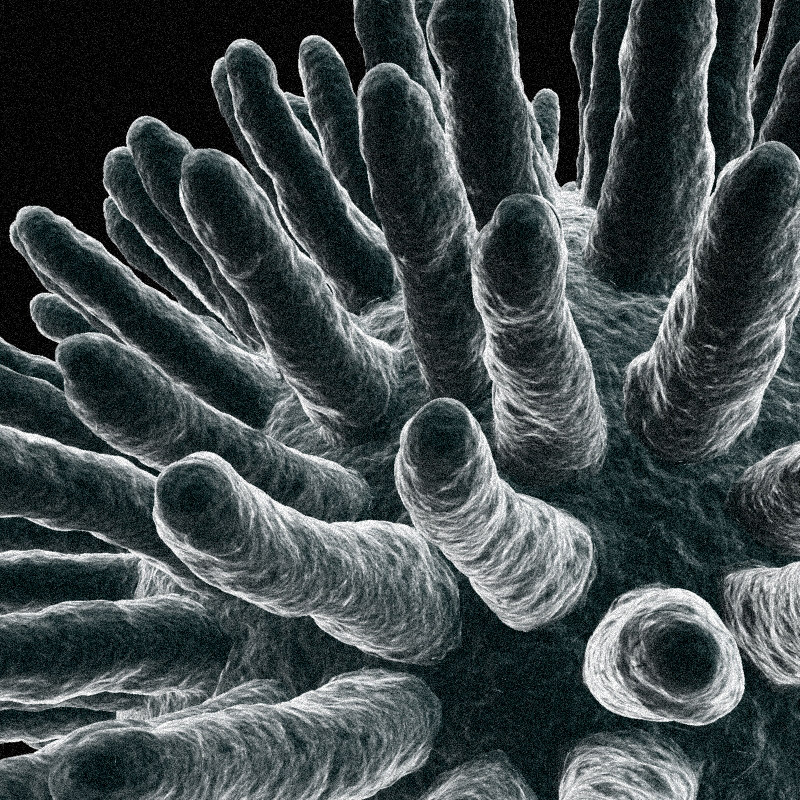 Ультраструктур. Патол. 27 : 133-140. [PubMed] [Google Scholar]
Ультраструктур. Патол. 27 : 133-140. [PubMed] [Google Scholar]
56. Miller, SE 1986. Обнаружение и идентификация вирусов с помощью электронной микроскопии. Дж. Электр. микроск. Тех. 4 : 265-301. [Google Scholar]
57. Miller, S. E. 1995. Диагностика вирусной инфекции методом электронной микроскопии, с. 37-78. В Э. Х. Леннетт, Д. А. Леннетт и Э. Т. Леннетт (ред.), Диагностические процедуры вирусных, риккетсиозных и хламидийных инфекций, 7-е изд. Американская ассоциация общественного здравоохранения, Вашингтон, округ Колумбия.
58. Миллер, С. Э., Р. М. Левенсон, К. Олдридж, С. Хестер, Д. Дж. Кенан и Д. Н. Хауэлл. 1997. Идентификация очаговых вирусных инфекций методом конфокальной микроскопии для последующего ультраструктурного анализа. Ультраструктур. Патол. 21 : 183-193. [PubMed] [Google Scholar]
59. Модис Ю., Б. Л. Трус и С. К. Харрисон. 2002. Атомная модель капсида папилломавируса. EMBO J. 21 : 4754-4762. [Бесплатная статья PMC] [PubMed] [Google Scholar]
К. Харрисон. 2002. Атомная модель капсида папилломавируса. EMBO J. 21 : 4754-4762. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Murphy, FA 1975. Таксономия аренавирусов: обзор. Бык. WHO 52 : 389-391. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Нагао С., С. Иидзима, Х. Судзуки, Т. Йокота и С. Шигета. 1982. Вирусоподобные частицы ВК в моче больного с нефротическим синдромом — электронно-микроскопическое наблюдение. Фукусима Дж. Мед. науч. 29 : 45-49. [PubMed] [Google Scholar]
62. Наглер Ф. П. и Г. Рейк. 1948. Использование электронного микроскопа в диагностике натуральной оспы, коровьей оспы и ветряной оспы. Дж. Бактериол. 55 : 45-51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Newcomb, W. W., D. R. Thomsen, FL Homa и JC Brown. 2003. Сборка капсида вируса простого герпеса: идентификация растворимых каркасно-портальных комплексов и их роль в формировании портосодержащих капсидов. Дж. Вирол. 77 : 9862-9871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Вирол. 77 : 9862-9871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Ницше, А., Х. Р. Гелдерблом, К. Эйзендл, Н. Романи и Г. Паули. 2007. Подводные камни при диагностике инфекций, вызванных вирусом оспы человека. Дж. Клин. Вирол. 38 : 165-168. [PubMed] [Google Scholar]
65. Нода Т., Х. Эбихара, Ю. Мурамото, К. Фуджи, А. Такада, Х. Сагара, Дж. Х. Ким, Х. Кида, Х. Фельдманн и Ю. Каваока. 2006. Сборка и почкование Эболавируса. PLoS Патог. 2 : e99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. О’Доннелл, Дж., К. А. Тейлор и М. С. Чепмен. 2009. Аденоассоциированный вирус-2 и его первичная клеточная структура рецептор-крио-ЭМ гепаринового комплекса. Вирусология 385 : 434-443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Онг, Х. и В. Чандран. 2005. Идентификация желудочно-кишечных вирусов с помощью электронной микроскопии с использованием спектральных характеристик более высокого порядка.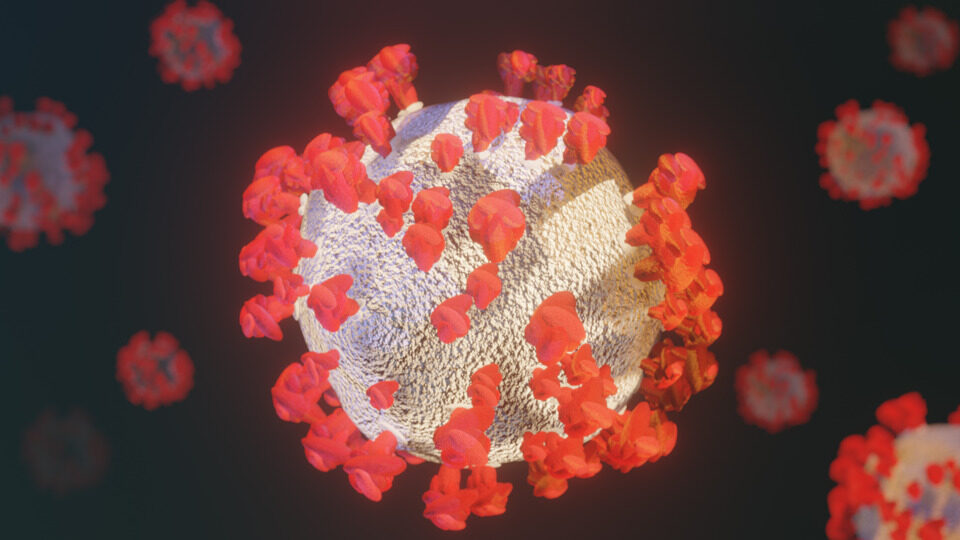 Дж. Клин. Вирол. 34 : 195-206. [PubMed] [Google Scholar]
Дж. Клин. Вирол. 34 : 195-206. [PubMed] [Google Scholar]
68. Осиро, Л. С. и С. Э. Миллер. 1992. Применение электронной микроскопии для диагностики вирусных инфекций, с. 45-68. В Э. Х. Леннетт (ред.), Лабораторная диагностика вирусных инфекций, 2-е изд. Марсель Деккер, Нью-Йорк, штат Нью-Йорк.
69. Палмер, Э. Л. и М. Л. Мартин. 1982. Атлас вирусов млекопитающих. CRC Press, Бока-Ратон, Флорида.
70. Палмер, Э. Л. и М. Л. Мартин. 1988. Электронная микроскопия в диагностике вирусов. CRC Press, Бока-Ратон, Флорида.
71. Паттин С., Г. ван дер Гроен, Г. Куртель, В. Джейкоб и П. Пиот. 1977. Выделение марбургского вируса от больного геморрагической лихорадкой в Заире. Ланцет i : 573-574. [PubMed] [Google Scholar]
72. Петренко В.А., Сорокулова И.Б. 2004. Обнаружение биологических угроз. Задача направленной молекулярной эволюции.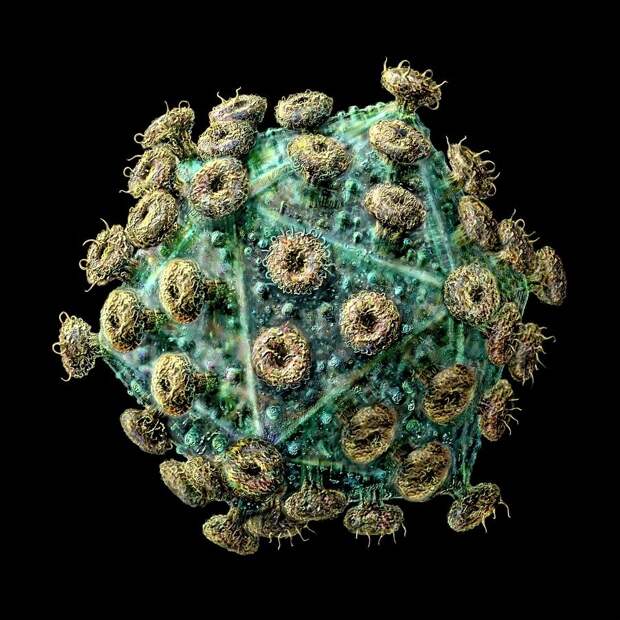 Дж. Микробиол. Методы 58 : 147-168. [PubMed] [Google Scholar]
Дж. Микробиол. Методы 58 : 147-168. [PubMed] [Google Scholar]
73. Провенчер С. В. и Р. Х. Фогель. 1988. Трехмерная реконструкция по электронным микрофотографиям неупорядоченных образцов. I. Метод. Ультрамикроскопия 25 : 209-221. [PubMed] [Google Scholar]
74. Рейган Р.Л. и А.Л. Брюкнер. 1952. Морфологические наблюдения с помощью электронной микроскопии штамма Lansing вируса полиомиелита после размножения у швейцарских мышей-альбиносов. Техас Rep. Biol. Мед. 10 : 425-428. [PubMed] [Google Scholar]
75. Рид, К. Д., Дж. В. Мельский, М. Б. Грэм, Р. Л. Регнери, М. Дж. Сотир, М. В. Вегнер, Дж. Дж. Казмерчак, Э. Дж. Стратман, Ю. Ли, Дж. А. Фэрли, Г. Р. Суэйн, В. А. Олсон, Э. К. Сарджент, С. К. Кель, М. А. Фрайс, Р. Клайн, С. Л. Фолди, Дж. П. Дэвис и И. К. Дэймон. 2004 г. Обнаружение оспы обезьян у людей в Западном полушарии. Н. англ. Дж. Мед. 350 : 342-350.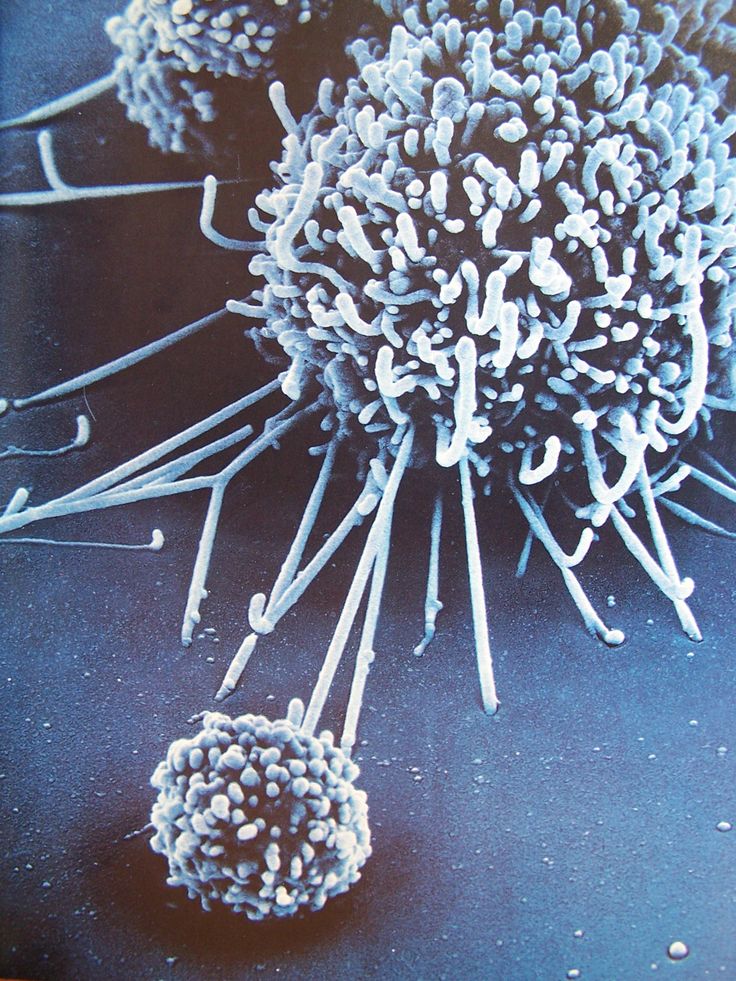 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
76. Roingeard, стр. 2008. Обнаружение вирусов с помощью электронной микроскопии: прошлое, настоящее и будущее. биол. Сотовый 100 : 491-501. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Rossmann, M.G., M.C. Morais, PG Leiman, and W. Zhang. 2005. Сочетание рентгеновской кристаллографии и электронной микроскопии. Структура 13 : 355-362. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Ryner, M., JO Strömberg, C. Söderberg-Nauclér и M. Homman-Loudiyi. 2006. Идентификация и классификация капсидов цитомегаловируса человека на текстурированных электронных микрофотографиях с использованием сопоставления деформированных матриц. Вирол. Дж. 3 : 57-69. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Шоепп, Р. Дж., М. Д. Морин, М. Дж. Мартинес, Д. А. Кулеш, Л. Хенсли, Т. В. Гейсберт, Д. Р. Брэди и П.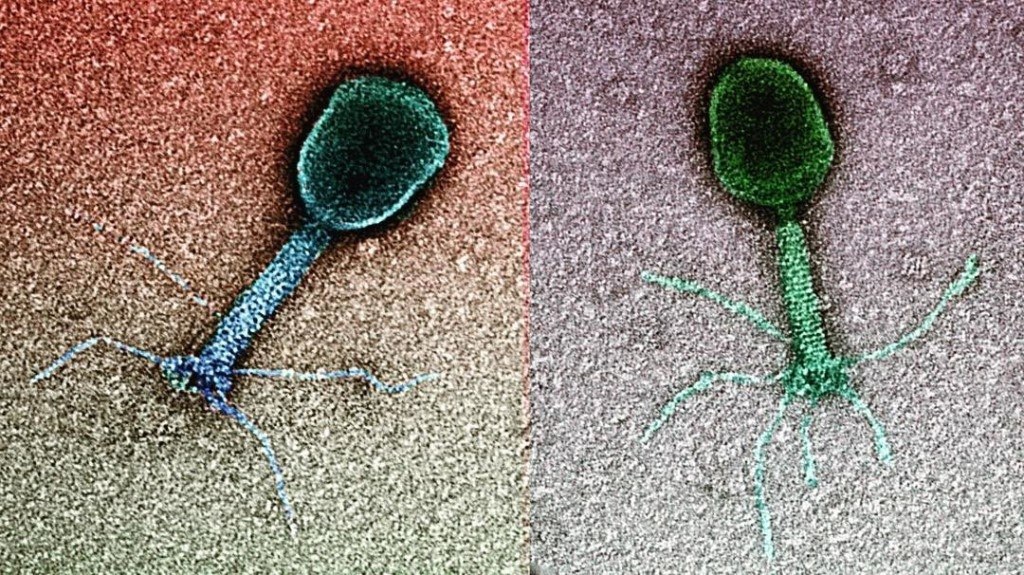 Б. Ярлинг. 2004. Обнаружение и идентификация вируса натуральной оспы в фиксированных тканях человека после длительного архивного хранения. лаборатория расследование 84 : 41-48. [PubMed] [Google Scholar]
Б. Ярлинг. 2004. Обнаружение и идентификация вируса натуральной оспы в фиксированных тканях человека после длительного архивного хранения. лаборатория расследование 84 : 41-48. [PubMed] [Google Scholar]
80. Шеперд, А. Дж., Н. Дж. Уилсон и К. Т. Смит. 2003. Характеристика эндогенного ретровируса в клеточных линиях грызунов, используемых для производства биологических препаратов. Биопрепараты 31 : 251-260. [PubMed] [Google Scholar]
81. Siegel, JD, E. Rhinehart, M. Jackson, L. Chiarello, et al. 2007 г. Руководство по мерам предосторожности при изоляции: предотвращение передачи инфекционных агентов в медицинских учреждениях. Являюсь. Дж. Заразить. Управление 35 : S65-S164. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Сингх, Х.К., К.А. Андреони, В. Мэдден, К. Тру, Р. Детвайлер, К. Век и В. Никелейт. 2009 г. Наличие мочи по Хауфену точно предсказывает полиомавирусную нефропатию.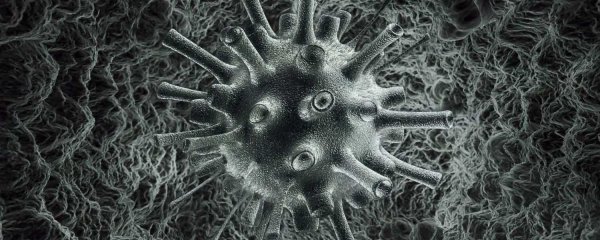 Варенье. соц. Нефрол. 20 : 416-427. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Варенье. соц. Нефрол. 20 : 416-427. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Singh, HK, V. Madden, YJ Shen, BD Thompson и V. Nickeleit. 2006. Электронная микроскопия мочи с отрицательным окрашиванием для выявления полиомавирусных инфекций. Ультраструктур. Патол. 30 : 329-338. [PubMed] [Google Scholar]
84. Smith, J. A., J. F. Wellehan, Jr., R. M. Pogranichniy, A. L. Childress, J. A. Landolfi, and K. A. Terio. 2008. Идентификация и выделение нового вируса герпеса в содержавшейся в неволе стае восточно-серых кенгуру (Macropus giganteus). Вет. микробиол. 129 : 236-245. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Sougrat, R., A. Bartesaghi, JD Lifson, AE Bennett, JW Bess, DJ Zabransky и S. Subramaniam. 2007. Электронная томография контакта между Т-клетками и ВИО/ВИЧ-1: значение проникновения вируса. PLoS Патог. 3 : е63.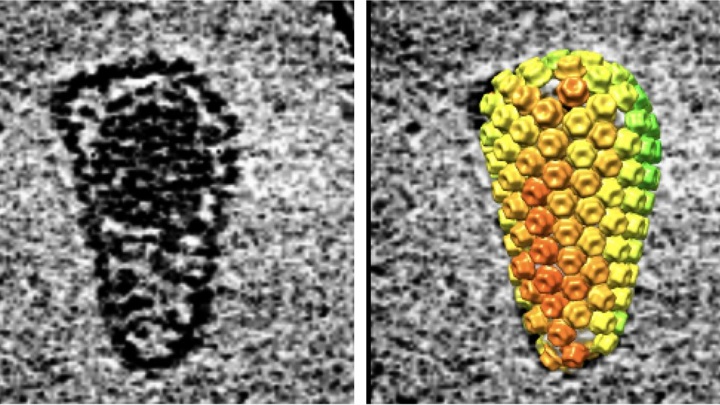 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Subramaniam, S., A. Bartesaghi, J. Liu, AE Bennett, and R. Sougrat. 2007. Электронная томография вирусов. Курс. мнение Структура биол. 17 : 596-602. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Teunis, PF, CL Moe, P. Liu, SE Miller, L. Lindesmith, R.S. Baric, J. Le Pendu и RL Calderon. 2008. Вирус Норуолк: насколько он заразен? Дж. Мед. Вирол. 80 : 1468-1476. [PubMed] [Google Scholar]
88. Тонг, С.Ю., Р. Хилтон, Э.М. МакМахон, Л. Браун, П. Пантелидис, И.Л. Кристи, И.М. Кидд, М.Ф. Тунгекар и Дж.М. Паттисон. 2004. Мониторинг развития нефропатии, ассоциированной с вирусом BK, у реципиентов почечного трансплантата. Нефрол. Набирать номер. Пересадка. 19 : 2598-2605. [PubMed] [Google Scholar]
89. Touze, A., and P. Coursaget. 1998. Перенос генов in vitro с использованием частиц, подобных вирусу папилломы человека.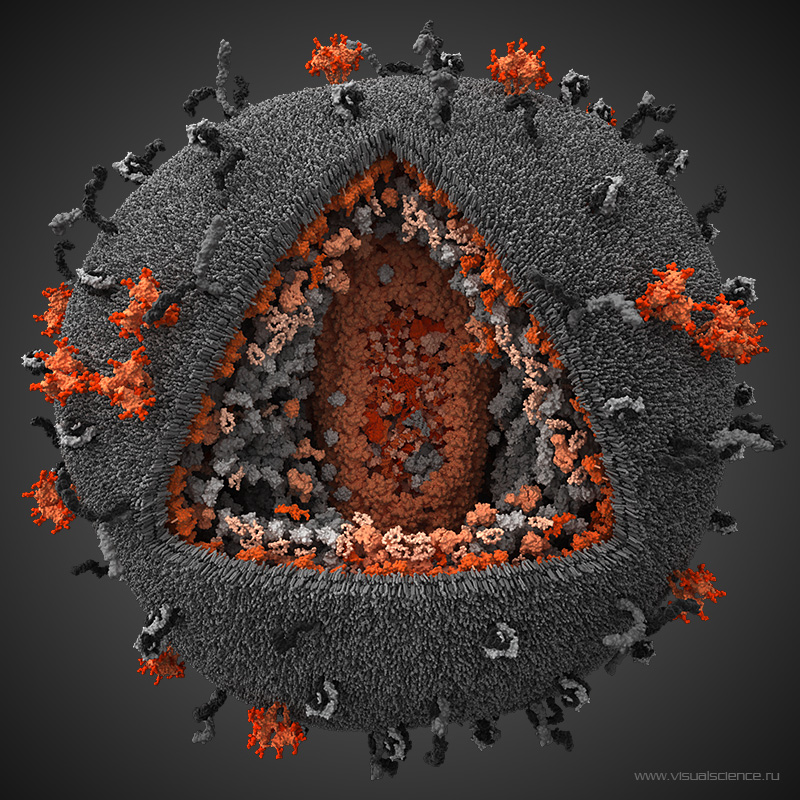 Нуклеиновые Кислоты Res. 26 : 1317-1323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 26 : 1317-1323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Touze, A., C. Dupuy, D. Mahe, P.Y. Sizaret и P. Coursaget. 1998. Производство рекомбинантных вирусоподобных частиц из вирусов папилломы человека типов 6 и 11 и изучение серологической реактивности между ВПЧ 6, 11, 16 и 45 с помощью ИФА: значение для профилактики и обнаружения папилломавируса. ФЭМС микробиол. лат. 160 : 111-118. [PubMed] [Google Scholar]
91. Трус, Б. Л., Р. Б. Роден, Х. Л. Гринстоун, М. Врхел, Дж. Т. Шиллер и Ф. П. Буй. 1997. Новые структурные особенности капсида вируса папилломы крупного рогатого скота, выявленные с помощью трехмерной реконструкции с разрешением 9 Å. Нац. Структура биол. 4 : 413-420. [PubMed] [Google Scholar]
92. Ван Ройен, К. Э. и Г. Д. Скотт. 1948. Диагностика оспы со специальной ссылкой на электронную микроскопию. Может.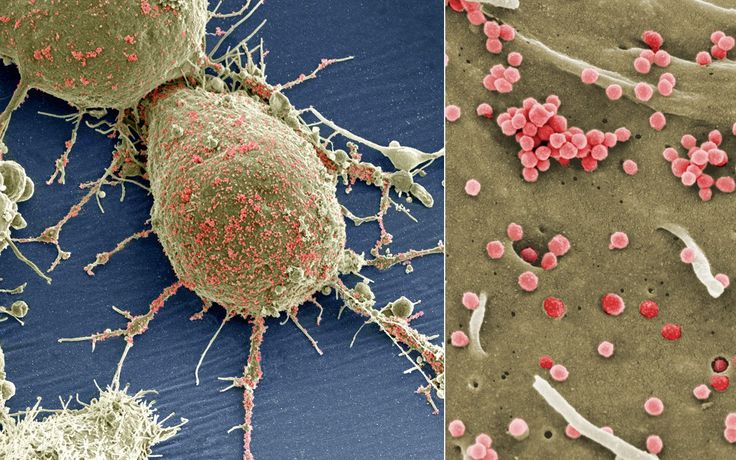 J. Общественное здравоохранение 39 : 467-477. [PubMed] [Google Scholar]
J. Общественное здравоохранение 39 : 467-477. [PubMed] [Google Scholar]
93. Vogel, R. H., and S. W. Provencher. 1988. Трехмерная реконструкция по электронным микрофотографиям неупорядоченных образцов. II. Реализация и результаты. Ультрамикроскопия 25 : 223-239. [PubMed] [Google Scholar]
94. фон Шведлер, Великобритания, К. М. Стрей, Дж. Э. Гаррус и У. И. Сандквист. 2003. Функциональные поверхности капсидного белка вируса иммунодефицита человека типа 1. Дж. Вирол. 77 : 5439-5450. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Webster, P. 2007. Обработка и встраивание с помощью микроволнового излучения для просвечивающей электронной микроскопии. Методы Мол. биол. 369 : 47-65. [PubMed] [Google Scholar]
96. Welch, AB 1971. Очистка, морфология и частичная характеристика реовирусоподобного агента, связанного с диареей новорожденных телят.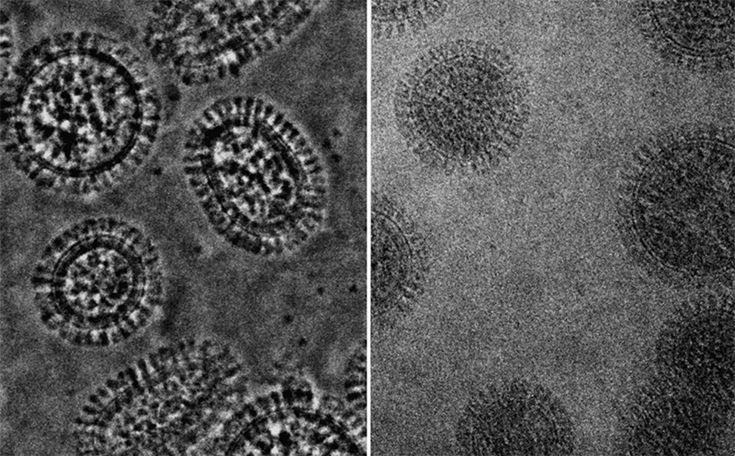 Может. Дж. Комп. Мед. 35 : 195-202. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Может. Дж. Комп. Мед. 35 : 195-202. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Вулкокка П. Р. и Х. Л. Шивапрасад. 2008. Электронно-микроскопическая идентификация вирусов, вызывающих энтерит индюшат, у индеек, выращенных в Калифорнии в 1993-2003 гг. Авиан Дис. 52 : 209-213. [PubMed] [Google Scholar]
98. Xu, P., SE Miller, and WK Joklik. 1993. Генерация ядерных частиц реовируса в клетках, инфицированных гибридными вирусами коровьей оспы, которые экспрессируют сегменты генома L1, L2, L3 и S2. Вирусология 197 : 726-731. [PubMed] [Академия Google]
99. Zaki, S.R., P.W. Greer, L.M.Coffield, C.S.Goldsmith, K.B.Nolte, K.Foucar, R.M.Feddersen, R.E.Zumwalt, G.L.Miller, A.S.Khan, et al. 1995. Хантавирусный легочный синдром. Патогенез возникающего инфекционного заболевания. Являюсь. Дж. Патол. 146 : 552-579. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Зауча, Г. М., П. Б. Ярлинг, Т. В. Гейсберт, Дж. Р. Сверенген и Л. Хенсли. 2001. Патология экспериментальной аэрозольной вирусной инфекции обезьяньей оспы у яванских макаков (Macaca fascicularis). лаборатория расследование 81 : 1581-1600. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Зауча, Г. М., П. Б. Ярлинг, Т. В. Гейсберт, Дж. Р. Сверенген и Л. Хенсли. 2001. Патология экспериментальной аэрозольной вирусной инфекции обезьяньей оспы у яванских макаков (Macaca fascicularis). лаборатория расследование 81 : 1581-1600. [Бесплатная статья PMC] [PubMed] [Google Scholar]
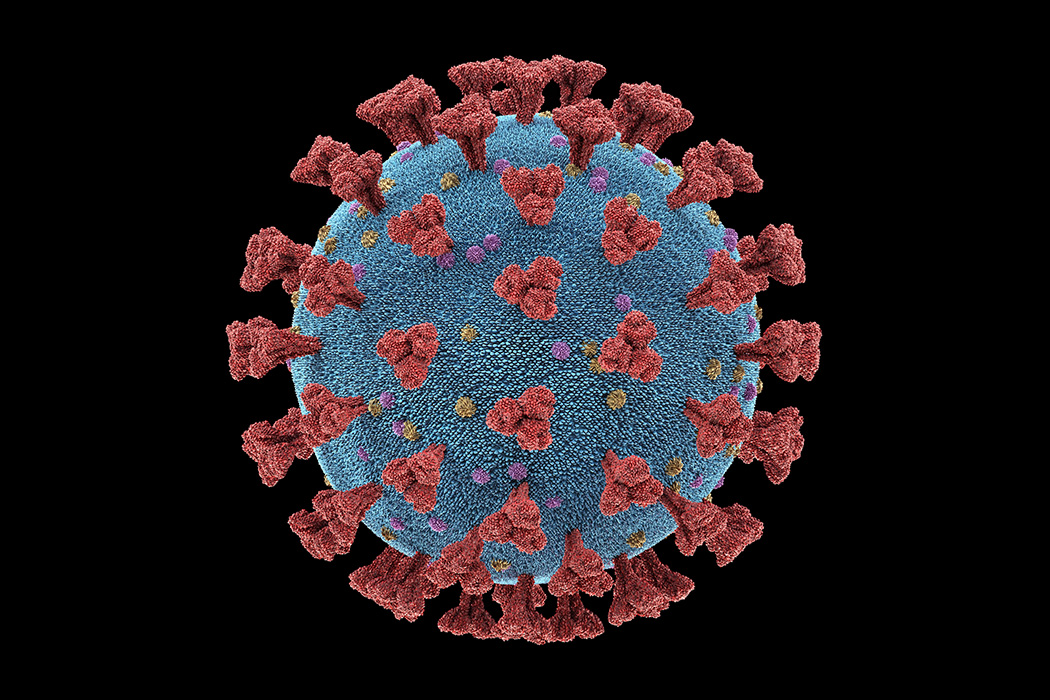
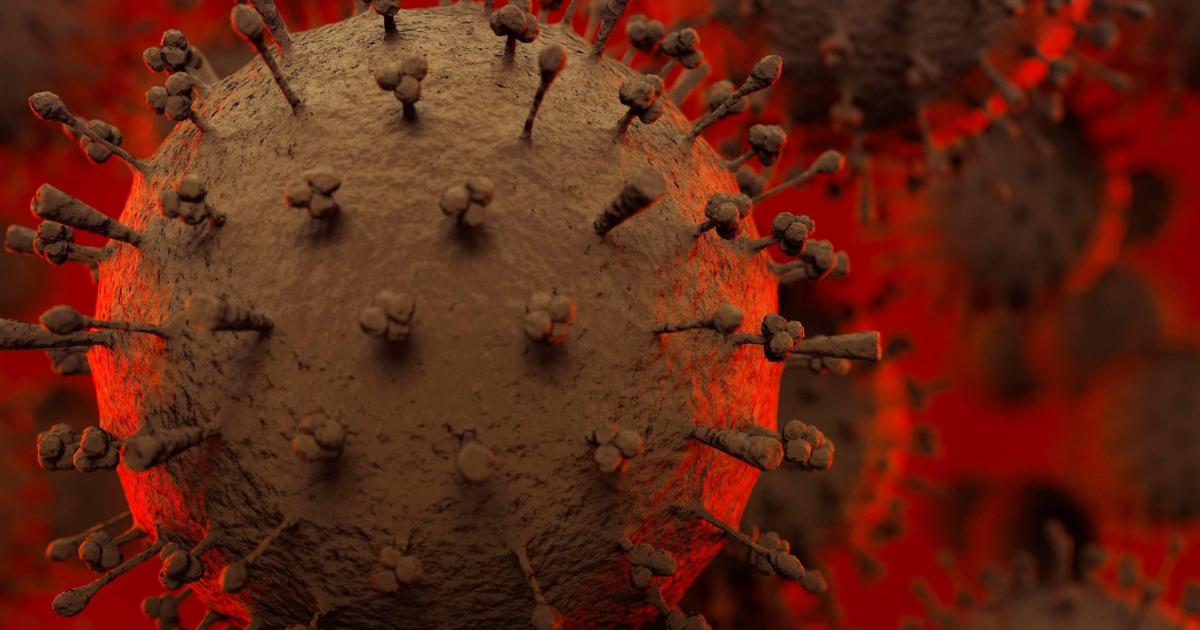
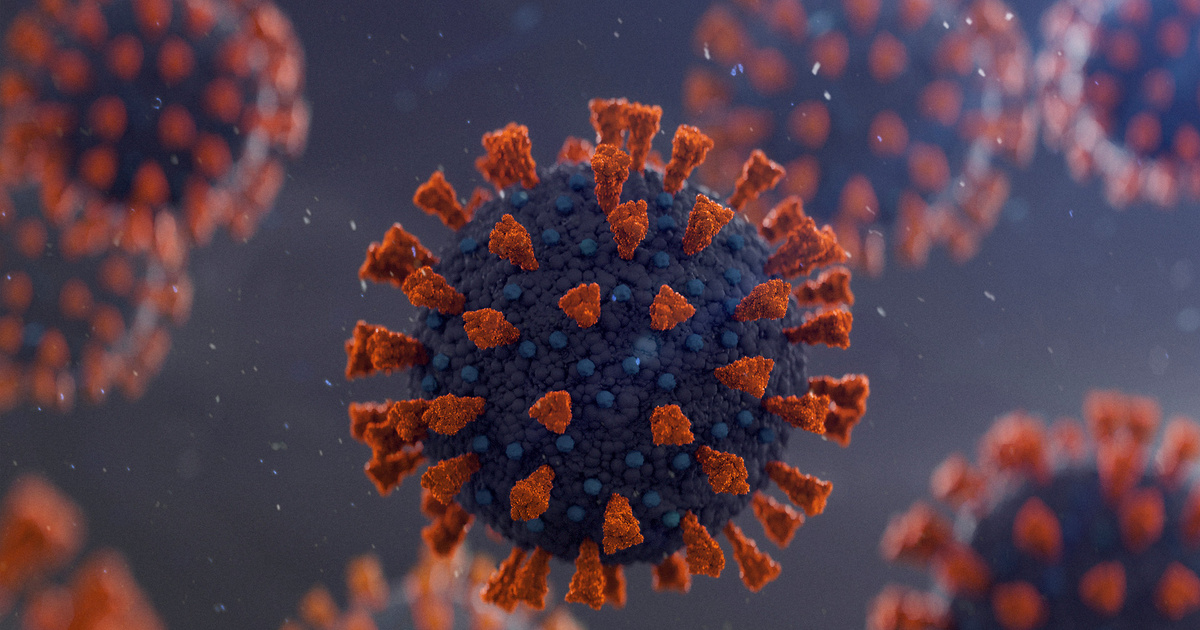
Вирус COVID-19 под микроскопом
Национальный институт аллергии и инфекционных заболеваний Rocky Mountain Laboratories (NIAID-RML), расположенный в Гамильтоне, штат Монтана, смог сделать снимки нового коронавируса (SARS-CoV-2, ранее известного как 2019-nCoV) на сканирующем электронном микроскопе и просвечивающем электронном микроскопе. SARS-CoV-2 вызывает болезнь COVID-19, которая привела к глобальной пандемии.
На этом изображении, полученном с помощью сканирующего электронного микроскопа, видно появление SARS-CoV-2 (круглые золотые объекты) с поверхности клеток, культивируемых в лаборатории. SARS-CoV-2 — это вирус, вызывающий COVID-19. Показанный вирус был выделен от пациента в Соединенных Штатах.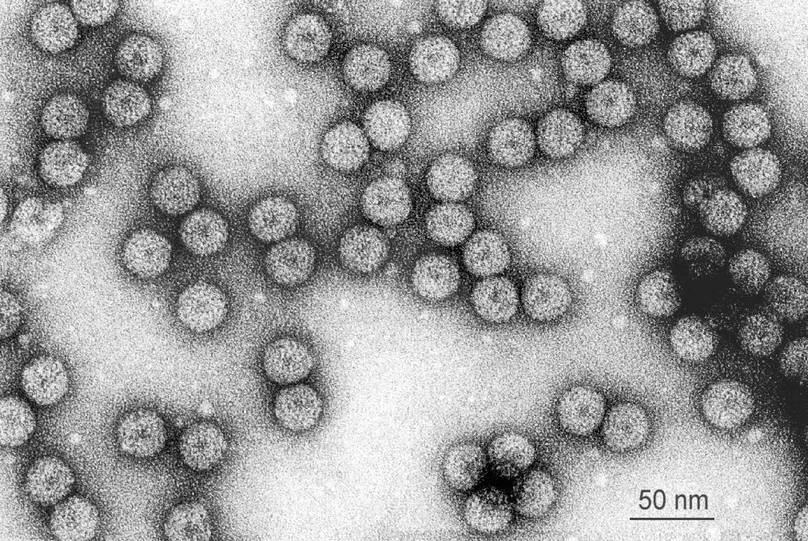 Кредит: НИАИД-РМЛ.
Кредит: НИАИД-РМЛ.
Это микрофотография частиц вируса SARS-CoV-2, выделенных от пациента. Изображение было получено с помощью просвечивающего электронного микроскопа и улучшено в цвете в Интегрированном исследовательском центре NIAID (IRF) в Форт-Детрик, штат Мэриленд.
Это трансмиссионная электронная микрофотография частиц вируса SARS-CoV-2, выделенных от пациента. Изображение было получено с помощью просвечивающего электронного микроскопа и улучшено в цвете в Интегрированном исследовательском центре NIAID (IRF) в Форт-Детрик, штат Мэриленд.
На этом изображении, полученном с помощью сканирующего электронного микроскопа, виден SARS-CoV-2 (круглые объекты пурпурного цвета), появляющиеся на поверхности клеток, культивируемых в лаборатории. SARS-CoV-2 — это вирус, вызывающий COVID-19.. Показанный вирус был выделен от пациента в Соединенных Штатах. Кредит: НИАИД-РМЛ.
Это изображение, полученное с помощью просвечивающего электронного микроскопа, показывает SARS-CoV-2, вирус, вызывающий COVID-19, выделенный от пациента в Соединенных Штатах. Показано, что вирусные частицы появляются с поверхности клеток, культивируемых в лаборатории. Шипы на внешнем крае вирусных частиц дали коронавирусу название «коронообразный». Кредит: НИАИД-РМЛ.
Показано, что вирусные частицы появляются с поверхности клеток, культивируемых в лаборатории. Шипы на внешнем крае вирусных частиц дали коронавирусу название «коронообразный». Кредит: НИАИД-РМЛ.
На этом изображении, полученном с помощью сканирующего электронного микроскопа, показан SARS-CoV-2 (желтым цветом), вирус, вызывающий COVID-19, выделенный от пациента в Соединенных Штатах, выходящий из поверхности клеток (синий и розовый), культивируемых в лаборатории. Кредит: НИАИД-РМЛ.
Просвечивающий электронный микроскоп был использован для захвата вирусных частиц SARS-CoV-2, выделенных от пациента. Изображение было получено и улучшено в цвете в Интегрированном исследовательском центре NIAID (IRF) в Форт-Детрике, штат Мэриленд.
На этом изображении, полученном с помощью сканирующего электронного микроскопа, показан SARS-CoV-2 (желтым цветом), также известный как 2019-nCoV, вирус, вызывающий COVID-19, выделенный у пациента в Соединенных Штатах, выходящий с поверхности клетки (розовые), выращенные в лаборатории.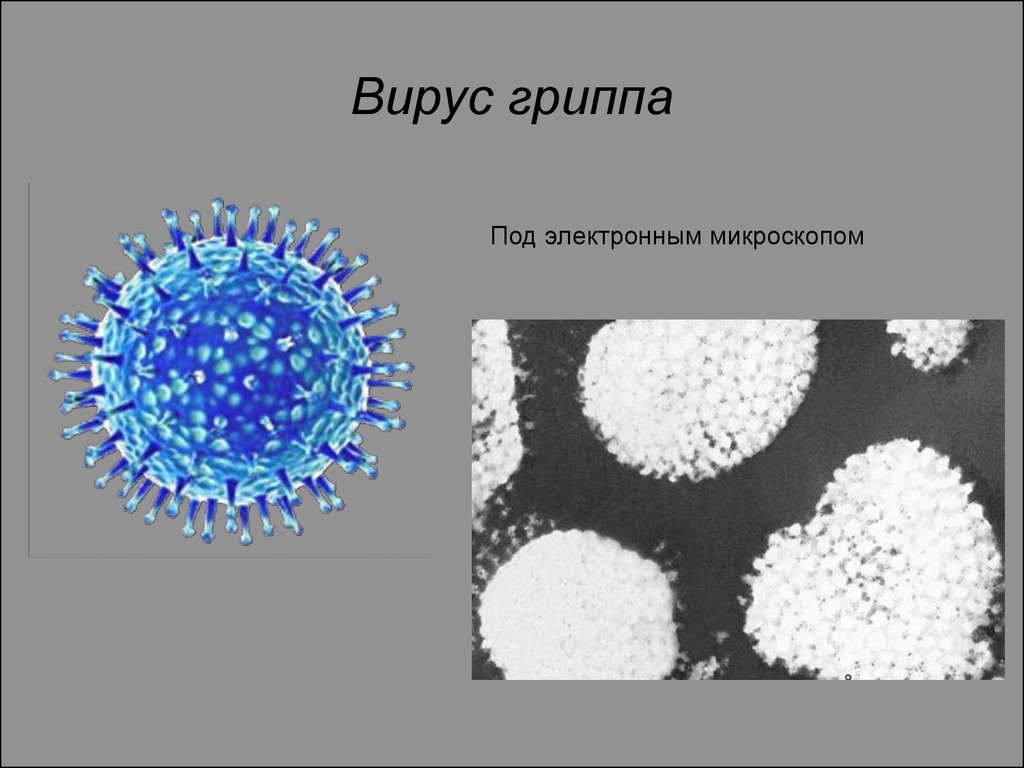 Кредит: НИАИД-РМЛ.
Кредит: НИАИД-РМЛ.
Это трансмиссионная электронная микрофотография частиц вируса SARS-CoV-2, выделенных от пациента. Изображение было получено и улучшено в цвете в Интегрированном исследовательском центре NIAID (IRF) в Форт-Детрике, штат Мэриленд.
На этом изображении, полученном с помощью сканирующего электронного микроскопа, видно, что SARS-CoV-2 (круглые синие объекты) появляется на поверхности клеток, культивируемых в лаборатории. SARS-CoV-2 — это вирус, вызывающий COVID-19. Показанный вирус был выделен от пациента в Соединенных Штатах. Кредит: НИАИД-РМЛ.
На этом изображении, полученном с помощью просвечивающего электронного микроскопа, показан SARS-CoV-2, вирус, вызывающий COVID-19, выделенный от пациента в США. Показано, что вирусные частицы появляются с поверхности клеток, культивируемых в лаборатории. Шипы на внешнем крае вирусных частиц дали коронавирусу название «коронообразный». Кредит: НИАИД-РМЛ.
На этом изображении, полученном с помощью сканирующего электронного микроскопа, показан SARS-CoV-2 (оранжевым цветом), вирус, вызывающий COVID-19, выделенный у пациента в США, возникающий с поверхности клеток (зеленый цвет), культивируемых в лаборатории. . Кредит: НИАИД-РМЛ.
Как увидеть COVID-19 под микроскопом?
Новый коронавирус (SARS-CoV-2) вызывает заболевание COVID-19, и его можно наблюдать под сканирующим электронным микроскопом или просвечивающим электронным микроскопом. Вирусы нельзя рассматривать под стандартным световым составным микроскопом.
Что такое сканирующий электронный микроскоп?
Сканирующий электронный микроскоп (СЭМ) сканирует образец сфокусированным электронным лучом и получает изображения с информацией о топографии и составе образцов. Сканирующие электронные микроскопы широко используются в нанотехнологиях, исследованиях материалов, науках о жизни, полупроводниках, сырье и промышленности.
Это сканирующий электронный микроскоп Zeiss EVO.
Что такое трансмиссионный электронный микроскоп?
Просвечивающий электронный микроскоп (ПЭМ) использует пучки электронов, прошедших через образец, для формирования изображения. Образец обычно представляет собой ультратонкий срез толщиной менее 100 нм. Изображение увеличивается и фокусируется на устройстве формирования изображения, таком как слой фотопленки.
Просвечивающие электронные микроскопы позволяют получать изображения со значительно более высоким разрешением, чем световые микроскопы, благодаря меньшей длине волны де Бройля электронов. Это позволяет ПЭМ фиксировать мелкие детали, даже такие маленькие, как один столбец атомов, который в тысячи раз меньше, чем разрешаемый объект, видимый в световой микроскоп.
Просвечивающие электронные микроскопы используются в исследованиях рака, вирусологии, материаловедении, нанотехнологиях, палеонтологии и исследованиях полупроводников.
Микроскоп Вопросы?
Если у вас есть какие-либо вопросы относительно сканирующих электронных микроскопов, просвечивающих электронных микроскопов или простых световых микроскопов, свяжитесь с Microscope World, и мы будем рады помочь.