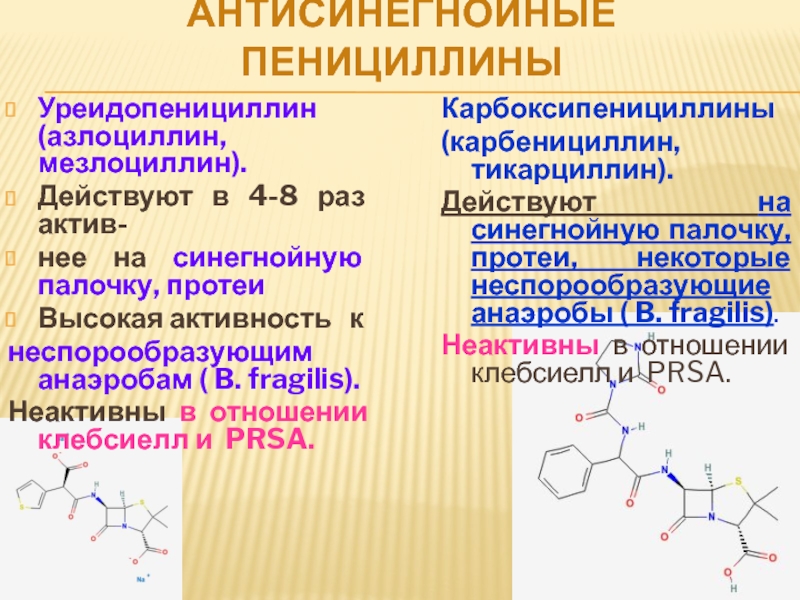
Защищенные пенициллины в амбулаторной практике педиатра
27.03.2015| тематический номер: ИНФЕКЦИИ В ПРАКТИКЕ ВРАЧА |
Среди многочисленных антибактериальных препаратов особое место
в широкой терапевтической и педиатрической практике занимают
так называемые защищенные пенициллины – современные, удобные
в применении и безопасные средства для лечения разнообразных инфекций. Эти препараты разработаны уже давно – более трех десятков лет тому назад, и с тех пор не теряют своей актуальности. Несмотря на все возрастающие требования современной медицины к эффективности и безопасности антибактериальных средств, такой защищенный пенициллин,
как амоксициллин/клавуланат, соответствует самым высоким стандартам
и остается одним из наиболее востребованных антибиотиков во всем мире.
На наши вопросы о преимуществах этого препарата отвечает
доктор медицинских наук, профессор кафедры педиатрии № 2 с курсом медицинской генетики и неонатологии Национального медицинского университета им. А.А. Богомольца Сергей Петрович Кривопустов.
– Чем была обусловлена необходимость разработки защищенных пенициллинов?
– История применения пенициллинов в медицине уходит своими корнями к работам А. Флеминга и к Нобелевской премии, которая была вручена группе ученых в 1945 г. за открытие пенициллина и его лечебного эффекта при инфекционной патологии. Вместе с тем уже в 40-50-х гг. XX ст. было доказано, что природные антибиотики все же недостаточно эффективны при приеме внутрь, прежде всего – в связи с их разрушением в кислой среде желудка. Из этих соображений в конце 50-х гг. были получены синтетические пенициллины (ампициллин и др.).
 Биодоступность нового препарата составила 90% при пероральном приеме и не зависела от приема пищи, в то время как биодоступность ампициллина не превышала 40% и дополнительно снижалась в 2 раза при приеме пищи. Кроме того, амоксициллин намного реже, чем ампициллин, оказывал побочные эффекты (диарею). Более высокая активность против пневмококка была еще одним преимуществом, благодаря которому амоксициллин быстро занял лидирующее положение среди пенициллинов.
Биодоступность нового препарата составила 90% при пероральном приеме и не зависела от приема пищи, в то время как биодоступность ампициллина не превышала 40% и дополнительно снижалась в 2 раза при приеме пищи. Кроме того, амоксициллин намного реже, чем ампициллин, оказывал побочные эффекты (диарею). Более высокая активность против пневмококка была еще одним преимуществом, благодаря которому амоксициллин быстро занял лидирующее положение среди пенициллинов.
Наиболее широко в практике современной педиатрии применяется клавулановая кислота, которая была получена в начале 70-х гг. из культуры Streptococcus clavuligeris. Это вещество приводит к конкурентной необратимой ингибиции β-лактамаз, образует с этим ферментом стойкие неактивные комплексы, предотвращает разрушение антибиотика и продлевает постантибиотическое действие амоксициллина. Таким образом, в результате сочетания пенициллинов с ингибиторами β-лактамаз восстанавливается природная активность антибиотиков.
– Какие современные защищенные пенициллины представляются наиболее перспективными?
 В настоящее время это соотношение представляется гораздо более выгодным и составляет 7:1, что усиливает бактерицидный эффект амоксициллина и увеличивает период, в течение которого сохраняется активность препарата.
В настоящее время это соотношение представляется гораздо более выгодным и составляет 7:1, что усиливает бактерицидный эффект амоксициллина и увеличивает период, в течение которого сохраняется активность препарата.– Чем вызван интерес к этому антибиотику?
– Кламокс мы рассматриваем как антибиотик для стартового эмпирического лечения в очень многих клинических ситуациях, поскольку он обладает оптимальным спектром антимикробной активности. Известные исследования, которые изучали этиологию основных бактериальных возбудителей респираторных инфекций (Alexander Project, 1998-2000 гг.
Помимо собственно спектра антимикробной активности клиницистов всегда интересует вопрос: может ли быть сохранена антимикробная активность при длительном применении различных препаратов? В контексте этой проблемы большое значение имеет исследование, проведенное R.N.Jones (Университет штата Айова, США, 1999 г.), где было показано, что важным является мониторинг характеристик резистентности H. influenzae и M. catarrhalis и использование данных, полученных в регионе, для эмпирического выбора препарата. В настоящее время примером антимикробного препарата, сохраняющего эффективность в отношении большинства микроорганизмов, является именно амоксициллин/клавуланат.


– Каково же место этого препарата в ежедневной практике врача?
В педиатрической практике при отитах, синуситах препаратом первого выбора является амоксициллин или амоксициллин/клавуланат; согласно протоколу стартовой эмпирической антимикробной терапии заболеваний бронхолегочной системы у детей препаратом выбора является амоксициллин/клавуланат; при назначении стартовой терапии острого пиелонефрита наиболее оправдано применение защищенных пенициллинов; наконец, современные подходы к лечению инфекций кожи и мягких тканей, в том числе у детей, предполагают, что амоксициллин/клавуланат должен быть препаратом выбора при целлюлите, импетиго, фолликулите; особое место этот препарат занимает при инфекциях в результате укусов животных.

На сегодня опубликовано значительное количество работ, которые показывают целесообразность как эмпирического, так и целенаправленного этиотропного лечения различных инфекций с помощью амоксициллина/клавуланата. Так, обращает на себя внимание мультицентровое исследование АРМИД (Н.А. Коровина и соавт., 2004), согласно результатам которого при инфекциях мочевой системы у детей резистентность E. coli к амоксициллину/клавуланату была незначительной (3,9%) по сравнению с таковой к ампициллину и незащищенному амоксициллину (51,5%). Поскольку кишечная палочка является ведущим ответственным патогеном при инфекциях мочевых путей, в качестве их эмпирической терапии в педиатрии наиболее часто используется амоксициллин/клавуланат.
 В результате исследования обнаружилось, что основные возбудители этих заболеваний в 88-100% случаев были чувствительны к амоксициллину/клавуланату, который был назван авторами оптимальным антибиотиком для стартовой терапии больных с острой гнойной ЛОР-патологией.
В результате исследования обнаружилось, что основные возбудители этих заболеваний в 88-100% случаев были чувствительны к амоксициллину/клавуланату, который был назван авторами оптимальным антибиотиком для стартовой терапии больных с острой гнойной ЛОР-патологией.Этот же препарат, наряду с незащищенным амоксициллином, по мнению известного специалиста в области микробиологии и антимикробной терапии профессора Л.С.Страчунского (2000), является препаратом выбора при легком и среднетяжелом течении синуситов у детей. Важно, что при легком и среднетяжелом течении терапию синуситов следует проводить пероральными препаратами.
– А как обстоит дело с лечением внебольничных пневмоний?
– Следует напомнить, что во взрослой практике лечения внебольничных пневмоний, существует два различных подхода. Как было отмечено профессором И.Г. Березняковым и соавт. (2006), один, условно говоря, «американский», в качестве препаратов выбора предлагает антибиотики, активные в отношении атипичных микроорганизмов, – макролиды, респираторные фторхинолоны, доксициклин. Другой – «европейский» (принятый в том числе и в нашей стране) – исходит из того, что β-лактамы сохраняют свои лидирующие позиции в амбулаторной терапии больных с внебольничной пневмонией.
Другой – «европейский» (принятый в том числе и в нашей стране) – исходит из того, что β-лактамы сохраняют свои лидирующие позиции в амбулаторной терапии больных с внебольничной пневмонией.
В детской практике, как известно, респираторные фторхинолоны не применяются. Учитывая данные ряда исследований, одним из ведущих антибиотиков в педиатрии при лечении внебольничной пневмонии остается амоксициллин/клавуланат. Так, в исследовании профессора Г.А. Самсыгиной и соавт. (2000), где изучались структура и чувствительность к антибиотикам возбудителей внебольничных инфекционных заболеваний бактериальной природы у детей, чувствительность к амоксициллин/клавуланату выделенных штаммов оказалась наиболее высокой – 90,1%, причем 79,9% были высокочувствительны. Для стрептококков этот показатель достиг 93% (в том числе для пневмококков – 62,7%), для стафилококков – 90,7%.
– Подводя итоги нашего разговора, чем для вас сегодня является амоксициллин/клавуланат?
– Хотелось бы сделать важный вывод, о котором следует помнить всем практическим врачам. Амоксициллин/клавуланат – препарат выбора в лечении инфекций мочевой системы, при воспалении среднего уха, синуситах, нетяжелых инфекций респираторного тракта, после укусов животных. Как высококачественный, безопасный и удобный в применении препарат амоксициллина/клавуланата Кламокс целесообразно применять в амбулаторной практике, в том числе и педиатрии.
Амоксициллин/клавуланат – препарат выбора в лечении инфекций мочевой системы, при воспалении среднего уха, синуситах, нетяжелых инфекций респираторного тракта, после укусов животных. Как высококачественный, безопасный и удобный в применении препарат амоксициллина/клавуланата Кламокс целесообразно применять в амбулаторной практике, в том числе и педиатрии.
Подготовила Ирина Старенькая
- Номер:
- № 2/1 февраль — Акушерство. Гинекология. Репродуктология
Алергічні захворювання є значним тягарем для хворих дітей, їх сімей та суспільства. У клінічній практиці педіатри часто стикаються з алергічним ринокон’юнктивітом (АР) і кропив’янкою. Симптоми, що супроводжують ці захворювання, можуть порушувати режим сну та заважати повсякденній діяльності, призводити до емоційного стресу і поведінкових проблем, що шкідливо впливає на навчання. …
У клінічній практиці педіатри часто стикаються з алергічним ринокон’юнктивітом (АР) і кропив’янкою. Симптоми, що супроводжують ці захворювання, можуть порушувати режим сну та заважати повсякденній діяльності, призводити до емоційного стресу і поведінкових проблем, що шкідливо впливає на навчання. …
Повна відмова від тютюну та нікотину є найкращим вибором для тих, хто курить. Утім, далеко не всім курцям це вдається. Дорослі курці, які не збираються кинути курити, заслуговують на інформацію про кращі альтернативи звичайним сигаретам та доступ до них. Науково доведено, що такі продукти здатні зменшити ризики для здоров’я, пов’язані зі вживанням тютюну. Одним із провідних виробників таких продуктів є компанія Philip Morris International (PMI). Завдяки передовим науковим дослідженням та технологіям PMI створила низку альтернативних бездимних систем, що поділяються на три категорії: системи для нагрівання тютюну (бездимні продукти), електронні випаровувачі та продукти для орального застосування. Наявність різних продуктів дає змогу індивідуально підібрати найбільш прийнятний варіант для повнолітніх курців….
Завдяки передовим науковим дослідженням та технологіям PMI створила низку альтернативних бездимних систем, що поділяються на три категорії: системи для нагрівання тютюну (бездимні продукти), електронні випаровувачі та продукти для орального застосування. Наявність різних продуктів дає змогу індивідуально підібрати найбільш прийнятний варіант для повнолітніх курців….
Кислотозалежні захворювання (КЗЗ) охоплюють групу розладів шлунково-кишкового тракту, як-от гастроезофагеальна рефлюксна хвороба (ГЕРХ), виразкова хвороба та диспепсія. Їх об’єднує механізм розвитку через порушення захисних функцій слизової оболонки чи посилення секреції кислоти [1]. …
…
Радіаційна небезпека існувала від початку виникнення атомних електростанцій. В умовах війни рф проти України увага всього світу прикута до них, адже наслідки аварії чи ядерної атаки можуть бути масштабними та катастрофічними. У березні 2022 року росіяни захопили Чорнобильську АЕС, а пізніше з’явилася загроза в Енергодарі. Відтоді розпочалися запеклі дискусії стосовно йодної профілактики….
Пенициллины в комбинациях: фармакологическая группа
Пенициллины в комбинациях: фармакологическая группаИнформация исключительно для работников здравоохранения.
Являетесь ли Вы специалистом здравоохранения?
- Выбор препаратов
- Синонимы
- Антибиотик — пенициллин полусинтетический + бета-лактамаз ингибитор
- Антибиотик, пенициллин полусинтетический + бета-лактамаз ингибитор
- Язвы пептической средство лечения
Подобрать препарат можно с помощью фильтров. Чтобы увидеть в перечне лекарства, входящие в подгруппы, отметьте галочкой «включить препараты подгрупп». Нажав на иконку , можно добавить препарат в избранное и проверить на дубли и межлекарственные взаимодействия.
Чтобы увидеть в перечне лекарства, входящие в подгруппы, отметьте галочкой «включить препараты подгрупп». Нажав на иконку , можно добавить препарат в избранное и проверить на дубли и межлекарственные взаимодействия.
Полужирным начертанием выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан еженедельный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
Сбросить фильтрывключить препараты подгрупп
Действующее вещество* Все ДВ Амоксициллин + Клавулановая кислота Амоксициллин + Сульбактам Ампициллин + Оксациллин Ампициллин + Сульбактам Бензатина бензилпенициллин + Бензилпенициллин натрия + Бензилпенициллин прокаина Бензатина бензилпенициллин + Бензилпенициллин прокаина Пиперациллин + Тазобактам Сультамициллин
Лек. форма
Все лек. формы гранулы для приготовления суспензии для приема внутрь капсулы лиофилизат для приготовления раствора для внутривенного введения лиофилизат для приготовления раствора для инфузий полуфабрикат-порошок порошок для приготовления раствора для внутривенного введения порошок для приготовления раствора для внутривенного и внутримышечного введения порошок для приготовления раствора для внутримышечного введения порошок для приготовления раствора для инфузий порошок для приготовления суспензии для внутримышечного введения порошок для приготовления суспензии для приема внутрь субстанция субстанция-порошок субстанция-смесь таблетки диспергируемые таблетки с модифицированным высвобождением, покрытые пленочной оболочкой таблетки, покрытые оболочкой таблетки, покрытые пленочной оболочкой таблеток и капсул набор
формы гранулы для приготовления суспензии для приема внутрь капсулы лиофилизат для приготовления раствора для внутривенного введения лиофилизат для приготовления раствора для инфузий полуфабрикат-порошок порошок для приготовления раствора для внутривенного введения порошок для приготовления раствора для внутривенного и внутримышечного введения порошок для приготовления раствора для внутримышечного введения порошок для приготовления раствора для инфузий порошок для приготовления суспензии для внутримышечного введения порошок для приготовления суспензии для приема внутрь субстанция субстанция-порошок субстанция-смесь таблетки диспергируемые таблетки с модифицированным высвобождением, покрытые пленочной оболочкой таблетки, покрытые оболочкой таблетки, покрытые пленочной оболочкой таблеток и капсул набор
Дозировка
Все дозировки 0.5 г+0.1 г 0.5 г+0.25 г 1 г+0.2 г 1 г+0.5 г 1 г+200 мг 1 г+500 мг 1.2 млн.ЕД+300 тыс.ЕД 1000 мг+200 мг 1000 мг+500 мг 1000 мг+62. 5 мг 1200000 ЕД 125 мг+125 мг/5 мл 125 мг+31.25 мг 125 мг+31.25 мг/5 мл 133.4 мг+66.6 мг 133.4+66.6 мг 2 2 г+0.25 г 2 г+1 г 200 мг+28.5 мг/5 мл 2000 мг+1000 мг 250 мг+125 мг 250 мг+250 мг 250 мг+250 мг/5 мл 250 мг+50 мг 250 мг+62.5 мг 250 мг+62.5 мг/5 мл 250 мг/5 мл 333.5+166.5 мг 335.5 мг+166.5 мг 375 мг 375 мг+125 мг 4 4 г+0.5 г 400 мг+57 мг/5 мл 500 мг+100 мг 500 мг+125 мг 500 мг+250 мг 500 мг+500 мг 600 мг+42.9 мг 600 мг+42.9 мг/5 мл 600000 ЕД 667 мг+333 мг 7 875 мг+125 мг Без дозировки
5 мг 1200000 ЕД 125 мг+125 мг/5 мл 125 мг+31.25 мг 125 мг+31.25 мг/5 мл 133.4 мг+66.6 мг 133.4+66.6 мг 2 2 г+0.25 г 2 г+1 г 200 мг+28.5 мг/5 мл 2000 мг+1000 мг 250 мг+125 мг 250 мг+250 мг 250 мг+250 мг/5 мл 250 мг+50 мг 250 мг+62.5 мг 250 мг+62.5 мг/5 мл 250 мг/5 мл 333.5+166.5 мг 335.5 мг+166.5 мг 375 мг 375 мг+125 мг 4 4 г+0.5 г 400 мг+57 мг/5 мл 500 мг+100 мг 500 мг+125 мг 500 мг+250 мг 500 мг+500 мг 600 мг+42.9 мг 600 мг+42.9 мг/5 мл 600000 ЕД 667 мг+333 мг 7 875 мг+125 мг Без дозировки
Производитель
Все производители АВВА РУС АО АВВА РУС ОАО Аболмед ООО [Видное] Алкем Лабораториз Альпа Лабораториз Лтд Астеллас Фарма Юроп Б.В. Ауробиндо Фарма Биохимик АО Биохимик ОАО Биохимик ПАО Брынцалов-А ЗАО Вайет Ледерле С.п.А. Ви-Эм-Джи Фармасьютикалз Пвт. Лтд. Глаксо Вэллком Продакшен Джодас Экспоим Пвт. Жеюнг Фармасьютикал Ко., Лтд. Жухай Юнайтед Лабораториз Ко. Интерфарма ООО Ипка Лабораториз Лтд. Карнатака Антибиотикс & Фармасьютикалс Лимитед Кенгбо Фармацевтикал Ко. Лтд Красфарма ПАО ЛЕККО ЗАО Лабесфал Лабораториос Алмиро С.А. Лабораториос Багу АО Лаборатория Рейг Хофре С.А. Лек д.д. Медокеми Лтд. Микро Лабс Лимитед Мустафа Невзат Илач Санаи Новалек Фармасьютикал Пвт. Лтд Ранбакси Лабораториз Лимитед Рейонг Фармасьютикал Ко. Лтд. Рузфарма С.П.Инкомед Пвт. СТИ-МЕД-СОРБ Сан Фармасьютикал Индастриз Лтд. Сандживани Парантерал Лимитед Сандоз Сандоз д.д. Северная Китайская Фармацевтическая Корпорация Синтез ОАО СмитКляйн Бичем Лимитед СмитКляйн Бичем ПиЭлСи СмитКляйн Бичем Фармасьютикалз Фармасинтез АО Фармтехнология Фермик С.А. де С.В. Хемофарм А.Д. Вршац, производственная площадка Дубовац Цилу Фармасьютикал Ко., Лтд. Эльфа Лабораториз
Лтд Красфарма ПАО ЛЕККО ЗАО Лабесфал Лабораториос Алмиро С.А. Лабораториос Багу АО Лаборатория Рейг Хофре С.А. Лек д.д. Медокеми Лтд. Микро Лабс Лимитед Мустафа Невзат Илач Санаи Новалек Фармасьютикал Пвт. Лтд Ранбакси Лабораториз Лимитед Рейонг Фармасьютикал Ко. Лтд. Рузфарма С.П.Инкомед Пвт. СТИ-МЕД-СОРБ Сан Фармасьютикал Индастриз Лтд. Сандживани Парантерал Лимитед Сандоз Сандоз д.д. Северная Китайская Фармацевтическая Корпорация Синтез ОАО СмитКляйн Бичем Лимитед СмитКляйн Бичем ПиЭлСи СмитКляйн Бичем Фармасьютикалз Фармасинтез АО Фармтехнология Фермик С.А. де С.В. Хемофарм А.Д. Вршац, производственная площадка Дубовац Цилу Фармасьютикал Ко., Лтд. Эльфа Лабораториз
Информация исключительно для работников здравоохранения.
Являетесь ли Вы специалистом здравоохранения?
Наш сайт использует файлы cookie, чтобы улучшить работу сайта, повысить его эффективность и удобство. Продолжая использовать сайт rlsnet.ru, вы соглашаетесь с условиями использования файлов cookie.
Войти через:
Защита in vivo чувствительных к пенициллину Bacteroides melaninogenicus от пенициллина факультативными бактериями, продуцирующими бета-лактамазу
. 1984 г., 30 января (1): 98–104. дои: 10.1139/m84-017.И. Брук, Дж. Паццалия, Дж. К. Кулбо, Р. И. Уокер
- PMID: 6143608
- DOI: 10.1139/м84-017
Я Брук и др. Может J Microbiol. 1984 Январь
. 1984 г., 30 января (1): 98–104. дои: 10.1139/m84-017.Авторы
И. Брук, Дж. Паццалия, Дж. К. Кулбо, Р. И. Уокер
Брук, Дж. Паццалия, Дж. К. Кулбо, Р. И. Уокер
- PMID: 6143608
- DOI: 10.1139/м84-017
Абстрактный
Мы исследовали возможность того, что штаммы Klebsiella pneumoniae и Staphylococcus aureus, продуцирующие бета-лактамазу, могут защищать организмы группы Bacteroides melaninogenicus от пенициллина. У мышей индуцировали смешанную инфекцию в виде подкожного абсцесса с участием инкапсулированного B. melaninogenicus, чувствительного к пенициллину, и штамма, продуцирующего бета-лактамазу, K. pneumoniae или S. aureus. Зараженных животных лечили в течение 7 дней однократной или комбинированной антимикробной терапией. Использовали только пенициллин, клавулановую кислоту, метронидазол и гентамицин. Комбинации противомикробных препаратов включали пенициллин и клавулановую кислоту, пенициллин и гентамицин, метронидазол и гентамицин. Введение одного агента было эффективным при лечении абсцессов, вызванных чувствительными микроорганизмами. Единственной эффективной терапией смешанных инфекций была комбинированная терапия пенициллином и клавулановой кислотой или метронидазолом и гентамицином. Это исследование подтверждает гипотезу о том, что факультативные бактерии, продуцирующие бета-лактамазу, могут защищать своих анаэробных собратьев от терапии пенициллином, тем самым способствуя сохранению инфекции.
Введение одного агента было эффективным при лечении абсцессов, вызванных чувствительными микроорганизмами. Единственной эффективной терапией смешанных инфекций была комбинированная терапия пенициллином и клавулановой кислотой или метронидазолом и гентамицином. Это исследование подтверждает гипотезу о том, что факультативные бактерии, продуцирующие бета-лактамазу, могут защищать своих анаэробных собратьев от терапии пенициллином, тем самым способствуя сохранению инфекции.
Похожие статьи
- Синергизм между пенициллином, клиндамицином или метронидазолом и гентамицином в отношении видов групп Bacteroides melaninogenicus и Bacteroides fragilis.
Брук И., Кулбо Дж. К., Уокер Р. И., Вайс Э. Брук И. и др. Противомикробные агенты Chemother. 1984 Январь; 25 (1): 71-7. doi: 10.1128/AAC.25.1.71. Противомикробные агенты Chemother. 1984. PMID: 6142680 Бесплатная статья ЧВК.

- Защита in vivo бета-гемолитических стрептококков группы А от пенициллина с помощью продуцирующих бета-лактамазу видов Bacteroides.
Брук I, Паццалия Г., Кулбо Дж. К., Уокер Р. И. Брук И. и др. J Антимикробная химиотерапия. 1983 Декабрь; 12 (6): 599-606. doi: 10.1093/jac/12.6.599. J Антимикробная химиотерапия. 1983. PMID: 6363381
- Лечение антибиотиками и клавулановой кислотой подкожных абсцессов, вызванных только Bacteroides fragilis или в сочетании с аэробными бактериями.
Брук I, Кулбо Дж. К., Уокер, Р. И. Брук И. и др. J заразить дис. 1983 г., июль; 148 (1): 156-9. doi: 10.1093/infdis/148.1.156. J заразить Dis. 1983. PMID: 6350486
- Роль бактерий, продуцирующих бета-лактамазы, в инфекциях дыхательных путей.

Брук И. Брук И. Scand J Infect Dis Suppl. 1988;57:41-9. Scand J Infect Dis Suppl. 1988 год. PMID: 3074471 Обзор.
- Роль бета-лактамазопродуцирующих бактерий в персистенции стрептококковой инфекции миндалин.
Брук И. Брук И. Преподобный Заражает Дис. 1984 сен-октябрь;6(5):601-7. doi: 10.1093/клиниды/6.5.601. Преподобный Заражает Дис. 1984. PMID: 6390637 Обзор.
Посмотреть все похожие статьи
Цитируется
- Энтеротоксин тилимицин из обитающих в кишечнике клебсиелл способствует мутационной эволюции и устойчивости к антибиотикам у мышей.
Кинесбергер С., Косич А., Кицера М., Раффл С., Хизингер М., Лейтнер Э., Хальвакс Б., Горкевич Г., Глабонжат Р.
 А., Рабер Г., Лембахер-Фадум С., Брейнбауэр Р., Шильд С., Зехнер Э.Л.
Кинесбергер С. и соавт.
Нат микробиол. 2022 ноябрь;7(11):1834-1848. doi: 10.1038/s41564-022-01260-3. Epub 2022 26 октября.
Нат микробиол. 2022.
PMID: 36289400
Бесплатная статья ЧВК.
А., Рабер Г., Лембахер-Фадум С., Брейнбауэр Р., Шильд С., Зехнер Э.Л.
Кинесбергер С. и соавт.
Нат микробиол. 2022 ноябрь;7(11):1834-1848. doi: 10.1038/s41564-022-01260-3. Epub 2022 26 октября.
Нат микробиол. 2022.
PMID: 36289400
Бесплатная статья ЧВК. - Деградация антибиотиков комменсальными микробами защищает от патогенов.
Gjonbalaj M, Keith JW, Do MH, Hohl TM, Pamer EG, Becattini S. Гьонбалай М. и др. Заразить иммун. 2020 23 марта; 88 (4): e00012-20. doi: 10.1128/IAI.00012-20. Печать 2020 23 марта. Заразить иммун. 2020. PMID: 31964746 Бесплатная статья ЧВК.
- Бактерии, продуцирующие β-лактамазу, при инфекциях верхних дыхательных путей.
Брук И. Брук И. Curr Infect Dis Rep. 2010 Mar;12(2):110-7.
 дои: 10.1007/s11908-010-0081-8.
Curr Infect Dis Rep. 2010.
PMID: 21308507
дои: 10.1007/s11908-010-0081-8.
Curr Infect Dis Rep. 2010.
PMID: 21308507 - Роль бактерий, продуцирующих бета-лактамазу, при смешанных инфекциях.
Брук И. Брук И. BMC Infect Dis. 2009 14 декабря; 9:202. дои: 10.1186/1471-2334-9-202. BMC Infect Dis. 2009. PMID: 20003454 Бесплатная статья ЧВК. Обзор.
Типы публикаций
термины MeSH
вещества
Сконструированные бактерии могут помочь защитить «хорошие» кишечные микробы от антибиотиков | MIT News
Антибиотики — это лекарства, которые спасают жизнь, но они также могут нанести вред полезным микробам, живущим в кишечнике человека. После лечения антибиотиками у некоторых пациентов существует риск развития воспаления или оппортунистических инфекций, таких как Clostridiodes difficile . Неизбирательное использование антибиотиков против кишечных микробов также может способствовать распространению устойчивости к лекарствам.
После лечения антибиотиками у некоторых пациентов существует риск развития воспаления или оппортунистических инфекций, таких как Clostridiodes difficile . Неизбирательное использование антибиотиков против кишечных микробов также может способствовать распространению устойчивости к лекарствам.
Стремясь снизить эти риски, инженеры Массачусетского технологического института разработали новый способ защиты естественной флоры пищеварительного тракта человека. Они взяли штамм бактерий, который безопасен для потребления человеком, и разработали его для безопасного производства фермента, расщепляющего класс антибиотиков, называемых бета-лактамами. К ним относятся ампициллин, амоксициллин и другие часто используемые препараты.
Когда это «живое биотерапевтическое средство» дается вместе с антибиотиками, оно защищает микробиоту в кишечнике, но позволяет поддерживать высокий уровень антибиотиков, циркулирующих в кровотоке, как обнаружили исследователи в исследовании на мышах.
«Эта работа показывает, что синтетическую биологию можно использовать для создания нового класса инженерных терапевтических средств для уменьшения побочных эффектов антибиотиков», — говорит Джеймс Коллинз, профессор медицинской инженерии и науки в Термеере в Институте медицинской инженерии и науки Массачусетского технологического института ( IMES) и Департамента биологической инженерии, а также старший автор нового исследования.
Андрес Кубильос-Руис, доктор философии 15 года, научный сотрудник IMES и Института биологической инженерии Висса при Гарвардском университете, является ведущим автором статьи, опубликованной сегодня в журнале Nature Biomedical Engineering . Среди других авторов — аспиранты Массачусетского технологического института Мигель Алькантар и Пабло Карденас, штатный научный сотрудник Института Висса Нина Донгиа и научный сотрудник Института Броуда Джулиан Авила-Пачеко.
Защита кишечника
Исследования последних двух десятилетий показали, что микробы в кишечнике человека играют важную роль не только в обмене веществ, но и в работе иммунной и нервной систем.
«На протяжении всей жизни эти кишечные микробы собираются в очень разнообразное сообщество, которое выполняет важные функции в вашем организме», — говорит Кубильос-Руис. «Проблема возникает, когда такие вмешательства, как лекарства или определенные виды диет, влияют на состав микробиоты и создают измененное состояние, называемое дисбиозом. Одни микробные группы исчезают, а метаболическая активность других возрастает. Этот дисбаланс может привести к различным проблемам со здоровьем».
Одним из серьезных осложнений, которые могут возникнуть, является инфекция C. difficile , микроб, который обычно живет в кишечнике, но обычно не причиняет вреда. Когда антибиотики убивают штаммы, которые конкурируют с C. difficile , эти бактерии могут взять верх и вызвать диарею и колит. C. difficile ежегодно заражает около 500 000 человек в Соединенных Штатах и вызывает около 15 000 смертей.
Врачи иногда назначают пробиотики (смеси полезных бактерий) людям, принимающим антибиотики, но эти пробиотики обычно также чувствительны к антибиотикам и не полностью воспроизводят нативную микробиоту кишечника.
«Стандартные пробиотики не могут сравниться с разнообразием местных микробов, — говорит Кубильос-Руис. «Они не могут выполнять те же функции, что и родные микробы, которых вы взращивали на протяжении всей своей жизни».
Чтобы защитить микробиоту от антибиотиков, исследователи решили использовать модифицированные бактерии. Они разработали штамм бактерий под названием Lactococcus lactis , который обычно используется в производстве сыра, для доставки фермента, расщепляющего бета-лактамные антибиотики. Эти препараты составляют около 60% антибиотиков, выписываемых в США.
При пероральном введении эти бактерии временно заселяют кишечник, где секретируют фермент, который называется бета-лактамазой. Затем этот фермент расщепляет антибиотики, которые достигают кишечного тракта. Когда антибиотики вводятся перорально, лекарства попадают в кровоток в основном из желудка, поэтому они все еще могут циркулировать в организме в больших количествах. Этот подход также можно использовать вместе с антибиотиками, которые вводятся инъекционно и в конечном итоге также попадают в кишечник. После завершения своей работы сконструированные бактерии выводятся из организма через пищеварительный тракт.
После завершения своей работы сконструированные бактерии выводятся из организма через пищеварительный тракт.
Использование сконструированных бактерий, разлагающих антибиотики, предъявляет уникальные требования безопасности: ферменты бета-лактамазы придают устойчивость к антибиотикам клеткам-убежищам, а их гены могут легко распространяться между различными бактериями. Чтобы решить эту проблему, исследователи использовали подход синтетической биологии, чтобы перекодировать способ, которым бактерия синтезирует фермент. Они разделили ген бета-лактамазы на две части, каждая из которых кодирует фрагмент фермента. Эти генные сегменты расположены на разных участках ДНК, что делает крайне маловероятным перенос обоих генных сегментов в другую бактериальную клетку.
Эти фрагменты бета-лактамазы экспортируются за пределы клетки, где они собираются повторно, восстанавливая ферментативную функцию. Поскольку бета-лактамаза теперь может свободно распространяться в окружающей среде, ее активность становится «общественным благом» для кишечных бактериальных сообществ. Это не позволяет сконструированным клеткам получить преимущество перед нативными кишечными микробами.
Это не позволяет сконструированным клеткам получить преимущество перед нативными кишечными микробами.
«Наша стратегия биологической защиты позволяет доставлять ферменты, разлагающие антибиотики, в кишечник без риска горизонтального переноса генов другим бактериям или получения дополнительных конкурентных преимуществ за счет живых биотерапевтических средств», — говорит Кубильос-Руис.
Поддержание микробного разнообразия
Чтобы проверить свой подход, исследователи давали мышам две пероральные дозы сконструированных бактерий на каждую инъекцию ампициллина. Сконструированные бактерии пробились в кишечник и начали выделять бета-лактамазу. У этих мышей исследователи обнаружили, что количество ампициллина, циркулирующего в кровотоке, было таким же высоким, как и у мышей, которые не получали модифицированные бактерии.
В кишечнике мышей, получавших искусственные бактерии, сохранялся гораздо более высокий уровень микробного разнообразия по сравнению с мышами, получавшими только антибиотики. У этих мышей уровень микробного разнообразия резко снизился после того, как они получили ампициллин. Более того, ни у одной из мышей, которым вводили сконструированные бактерии, не развились условно-патогенные C. difficile , в то время как у всех мышей, получавших только антибиотики, наблюдались высокие уровни C. difficile в кишечнике.
У этих мышей уровень микробного разнообразия резко снизился после того, как они получили ампициллин. Более того, ни у одной из мышей, которым вводили сконструированные бактерии, не развились условно-патогенные C. difficile , в то время как у всех мышей, получавших только антибиотики, наблюдались высокие уровни C. difficile в кишечнике.
«Это убедительная демонстрация того, что этот подход может защитить микробиоту кишечника, сохраняя при этом эффективность антибиотика, поскольку вы не изменяете его уровень в кровотоке», — говорит Кубильос-Руис.
Исследователи также обнаружили, что устранение эволюционного давления лечения антибиотиками значительно снижает вероятность развития у микробов кишечника устойчивости к антибиотикам после лечения. Напротив, они обнаружили много генов устойчивости к антибиотикам у микробов, которые выжили у мышей, получавших антибиотики, но не у сконструированных бактерий. Эти гены могут передаваться вредоносным бактериям, что усугубляет проблему устойчивости к антибиотикам.
