Антигистаминные препараты в дерматологической практике
Длительное время антигистаминные препараты (АГП) используются в дерматологической практике с целью купирования зуда — основного субъективного симптома большинства воспалительных дерматозов. Применение первой генерации АГП в большинстве случаев способствовало развитию широкого спектра нежелательных явлений, которые были обусловлены липофильностью препаратов и, как следствие, их проникновением через гематоэнцефалический барьер (ГЭБ). Появление АГП нового поколения (неседативные) в значительной степени повысило переносимость терапии и в настоящий момент они являются лекарственными средствами первой линии при лечении острой, хронической идиопатической и физической крапивницы. Однако отсутствие доказательной базы поставило под вопрос целесообразность их использования в лечении дерматозов, сопровождающихся зудом, так как они не дают центрального эффекта. В данной статье рассмотрены механизмы действия гистамина, его роль в развитии симптомов заболеваний кожи и определены основные положения выбора АГП на современном этапе в дерматологии.
Гистамин (2-(4-имидазолил) этиламин) является одним из низкомолекулярных моноаминов, синтезируется из L-гистидина и обладает широчайшим спектром действия в модификации ряда физиологических и патологических процессов: пролиферации и дифференцировки клеток, кроветворении, эмбриональном развитии, регенерации тканей и заживлении ран, мозговой деятельности (сон, ноцицепция, прием пищи и поведение), секреции гормонов гипофиза, регуляции функций желудочно-кишечного тракта и кровообращения (вазодилатация и артериальное давление), а также в модуляции воспалительных и иммунных реакций [1, 2].
Главным резервуаром гистамина в коже являются тучные клетки (ТК) и в меньшей степени — базофилы, которые под влиянием различных фармакологических или иммунных стимулов дегранулируют с выделением гистамина и других медиаторов воспаления. От 50 до 70% свободного гистамина преобразуется N-метилтрансферазой в N-метилгистамин. Остальной гистамин метаболизируется диаминооксидазой в имидазолуксусную кислоту. Действие гистамина на клетки-мишени осуществляется через специальные рецепторы. В настоящее время выделено четыре типа G-мембранных рецепторов-лигандов (h2R, h3R, h4R и h5R), которые экспрессированы в различных органах и тканях: h2R — в гладких мышцах бронхов и пищеварительной системы, сердце, сосудах и головной мозге, h3R — в слизистой оболочке желудка, матки, головном мозге, h4R — в гистаминергических нейронах, h5R — костном мозге и клетках периферической крови [3—5].
Остальной гистамин метаболизируется диаминооксидазой в имидазолуксусную кислоту. Действие гистамина на клетки-мишени осуществляется через специальные рецепторы. В настоящее время выделено четыре типа G-мембранных рецепторов-лигандов (h2R, h3R, h4R и h5R), которые экспрессированы в различных органах и тканях: h2R — в гладких мышцах бронхов и пищеварительной системы, сердце, сосудах и головной мозге, h3R — в слизистой оболочке желудка, матки, головном мозге, h4R — в гистаминергических нейронах, h5R — костном мозге и клетках периферической крови [3—5].
Либерация гистамина, его взаимодействие с рецепторами (в первую очередь с h2R), приводит к расширению сосудов и повышению проницаемости их стенок. Это способствует сгущению крови и отеку окружающих тканей, гиперсекреции желез, спазму гладких мышц. Клинически эти процессы выражаются появлением воспалительной реакции (эритема и зуд, волдыри и ангионевротический отек). Также активно обсуждается роль гистамина в экспрессии цитокинов и молекул адгезии в поздней фазе воспалительной реакции — миграции эффекторных клеток и формировании полиморфного инфильтрата [6, 7].
Участие гистамина в развитии воспаления очевидно при многих заболеваниях, но особенно в генезе аллергодерматозов.
Крапивница — гетерогенная группа заболеваний, развивающихся в результате действия широкого спектра факторов и характеризующихся появлением волдырей и ангионевротического отека. Крапивница является одной из сложных и неоднозначных проблем современной практической медицины. Результаты эпидемиологических исследований указывают на высокую распространенность (достигает 15—25%) указанной патологии в общей популяции [8, 9].
Многообразие клинических форм крапивницы объясняется тем, что в их основе лежат разные патогенетические механизмы, индуцированные триггерами различной природы. Выделяют иммунные (I—V типы реакций), неиммунные, аутоиммунные и смешанные механизмы развития крапивницы. I тип иммунных реакций (IgE-опосредованный) характерен для острой аллергической крапивницы, встречается чаще, чем типы II и III.
Результатом различных по генезу патофизиологических реакций при крапивнице является активация и дегрануляция ТК, которые определяются как основные эффекторные клетки для большинства форм заболевания. Стимуляция дегрануляции ТК осуществляется нейроактивными пептидами и, в частности, субстанцией Р (SP), вазоактивным пептидом (VIP) и соматостатином. Исследования микродиализа дермы с введением в кожу SP показали, что данный пептид индуцирует выделение гистамина в очень низкой концентрации (10 При активации ТК происходит высвобождение гистамина, лейкотриенов, цитокинов и хемокинов. Однако клинические симптомы крапивницы в первую очередь обусловлены действием гистамина — отек сосочкового слоя дермы при формировании волдырей и/или отек более глубоких слоев дермы и подкожной жировой клетчатки при развитии ангиоотека [11].
При активации ТК происходит высвобождение гистамина, лейкотриенов, цитокинов и хемокинов. Однако клинические симптомы крапивницы в первую очередь обусловлены действием гистамина — отек сосочкового слоя дермы при формировании волдырей и/или отек более глубоких слоев дермы и подкожной жировой клетчатки при развитии ангиоотека [11].
Атопический дерматит (АтД) является хроническим зудящим дерматозом, который возникает в результате сложного взаимодействия патофизиологических реакций: нарушение функциональной активности эпидермального барьера, дефекты иммунного ответа, специфическая сенсибилизация к раздражителям, дефицит антимикробных пептидов и отклонения в работе центральной и вегетативной нервной регуляции. Неотъемлемым симптомом АтД является зуд, который проявляется в форме гиперреактивности кожи в результате действия антигенов и ирритантов в низких концентрациях. Патофизиология зуда при АтД не изучена. В настоящее время считают, что индуцированное выделение гистамина из тучных клеток при АтД не является ведущим механизмом симптома, а данные о снижении активности зуда при использовании топических глюкокортикостероидов и ингибиторов кальцийневрина позволяют предположить, что основными его индукторами при этом заболевании являются вырабатываемые Т-лифмоцитами цитокины [12, 13].
Однако отсутствие роли гистамина в возникновении зуда и воспалительных реакций при АтД не доказано окончательно. Например, у пациентов с АтД нередко определяется уртикарный дермографизм. Было установлено, что стимуляция Н1R приводит к повышению Ca2+, цГМФ, NFκB, киназы и протеаз, роль которых в патофизиологии воспалительной реакции при данном дерматозе показана в исследованиях. В коже больных АтД обнаруживается повышенное количество ТК, увеличена концентрация гистамина в коже и плазме, повышен уровень спонтанного высвобождения гистамина из базофилов, увеличена концентрация h5R, а многолетний опыт применения антагонистов Н1R обусловил возобновление исследований по эффективности и целесообразности применения препаратов данной группы в комплексной терапии дерматоза [14, 15].
Аллергический контактный дерматит (АКД) характеризуется развитием воспаления кожи в ответ на воздействие веществ, способных вызывать специфическую аллергическую реакцию замедленного типа, обусловленную участием клеток иммунной системы.
 Для клинической картины АКД характерны зуд, жжение и покалывание кожи, интенсивная гиперемия, отечность, образование везикул, эрозий (в острой стадии), инфильтрация, шелушение, сухость кожи (в хронической стадии) [16, 17].
Для клинической картины АКД характерны зуд, жжение и покалывание кожи, интенсивная гиперемия, отечность, образование везикул, эрозий (в острой стадии), инфильтрация, шелушение, сухость кожи (в хронической стадии) [16, 17].В свою очередь интенсивным зудом, в возникновении которого определяется роль гистамина, сопровождаются красный плоский лишай, экзема, системный мастоцитоз, укусы насекомых и заболевания внутренних органов [18].
Антагонисты Н1-рецепторовПервые антигистаминные препараты были синтезированы физиологом и фармакологом D. Bouvet и A. Staub в 1942 г. Они показали, что эти соединения уменьшают выраженность анафилаксии у животных, за что в 1957 г. D. Bouvet получил Нобелевскую премию. Однако использование указанных соединений у больных оказалось невозможным из-за высокой токсичности. В начале 40-х годов XX века известным французским ученым H. Halpern в клиническую практику был введен фенбензамин, а затем пириламин — с этого началась эра применения АГП. В 80-е годы были синтезированы АГП нового поколения. В настоящее время известно более 40 представителей этого класса препаратов [19].
В 80-е годы были синтезированы АГП нового поколения. В настоящее время известно более 40 представителей этого класса препаратов [19].
Несмотря на столь длительный опыт и широкое использование антигистаминных препаратов в клинической практике, постоянно возникает ряд дискуссионных положений, касающихся их применения. Это возобновляет интерес к данным препаратам.
АГП (антагонисты Н1-рецепторов) представляют собой азотистые основания, содержащие алифатическую боковую цепь (как и в молекуле гистамина) замещенного этиламина, обеспечивающую противогистаминовую активность [20].
Одним из важнейших вопросов, касающихся антигистаминных препаратов, является их классификация, предложенная Европейской академией аллергологии и клинической иммунологии (EAACI, 2003). По этой классификации все АГП делятся на препараты «старого» и «нового» поколения. В клинической практике, в европейских и российских согласительных документах по-прежнему используют термин «антигистаминные препараты 1-го и 2-го поколения». В основе такого разделения лежит их способность вызывать седативный эффект [21].
В основе такого разделения лежит их способность вызывать седативный эффект [21].
Н1-антигистаминные препараты старого поколения были введены в клиническую практику, когда не существовало правил проведения клинических исследований и сбора информации о безопасности препаратов. В этой связи в настоящее время не существует научно обоснованных данных о реальном действии АГП старого поколения на организм, почти нет данных об их фармакокинетических и фармакодинамических свойствах, не проводились исследования в особых возрастных группах (пожилые и дети), а дозы препаратов были подобраны эмпирически [22, 23].
Ограничение использования АГП старого поколения на современном этапе обусловлено высоким удельным весом развития нежелательных явлений (НЯ). Наиболее важным и существенным НЯ является развитие седации в результате проникновения через ГЭБ и взаимодействия с 70% центральных H1-рецепторов, локализующихся на постсинаптической мембране гистаминергических нейронов. Эти соединения индуцируют седативное действие и подавляют когнитивные функции центральной нервной системы (ЦНС) (память, внимание, координация движения, способность к обучению и др.). Сон на фоне приема АГП старого поколения не является физиологичным, так как практически полностью угнетается REM-фаза сна и не вырабатывается рилизинг-фактор, который обеспечивает возможность бодрствования человека. Нарушение функции ЦНС наблюдается даже при использовании минимальных доз АГП старого поколения: хлорфинирамин 4 мг, дифенгидрамин 25 мг, прометазин 10 мг, трипролидин 5 мг [24, 25]. Таким образом, использование препаратов первой генерации для купирования зуда, например при АтД с целью седации, является нерациональным и необоснованным.
Эти соединения индуцируют седативное действие и подавляют когнитивные функции центральной нервной системы (ЦНС) (память, внимание, координация движения, способность к обучению и др.). Сон на фоне приема АГП старого поколения не является физиологичным, так как практически полностью угнетается REM-фаза сна и не вырабатывается рилизинг-фактор, который обеспечивает возможность бодрствования человека. Нарушение функции ЦНС наблюдается даже при использовании минимальных доз АГП старого поколения: хлорфинирамин 4 мг, дифенгидрамин 25 мг, прометазин 10 мг, трипролидин 5 мг [24, 25]. Таким образом, использование препаратов первой генерации для купирования зуда, например при АтД с целью седации, является нерациональным и необоснованным.
Помимо этого, антагонисты Н1R первой генерации обладают атропиноподобным действием, связанным с антихолинергическими свойствами препаратов, что клинически проявляется сухостью во рту и носоглотке, задержкой мочи, запорами, тахикардией и нарушениями зрения. Противорвотный и противоукачивающий эффект также, вероятно, связан с центральным холинолитическим действием препаратов. Ряд седативных АГП уменьшают симптомы паркинсонизма, что обусловлено центральным ингибированием эффектов ацетилхолина. Противокашлевое действие наиболее характерно для дифенгидрамина, оно реализуется за счет непосредственного действия на кашлевой центр в продолговатом мозге [26]. При этом α1-блокирующий эффект с периферической вазодилатацией, особенно присущий антигистаминам фенотиазинового ряда, может приводить к транзиторному снижению артериального давления у чувствительных лиц. Местноанестезирующее (кокаиноподобное) действие характерно для большинства АГП старого поколения (возникает вследствие снижения проницаемости мембран для ионов натрия). Вместе с тем они обладают системными хинидиноподобными эффектами, проявляющимися удлинением рефрактерной фазы и развитием желудочковой тахикардии. Тахифилаксия (снижение антигистаминной активности при длительном приеме) обусловливает необходимость чередования лекарственных средств каждые 2—3 нед [27].
Противорвотный и противоукачивающий эффект также, вероятно, связан с центральным холинолитическим действием препаратов. Ряд седативных АГП уменьшают симптомы паркинсонизма, что обусловлено центральным ингибированием эффектов ацетилхолина. Противокашлевое действие наиболее характерно для дифенгидрамина, оно реализуется за счет непосредственного действия на кашлевой центр в продолговатом мозге [26]. При этом α1-блокирующий эффект с периферической вазодилатацией, особенно присущий антигистаминам фенотиазинового ряда, может приводить к транзиторному снижению артериального давления у чувствительных лиц. Местноанестезирующее (кокаиноподобное) действие характерно для большинства АГП старого поколения (возникает вследствие снижения проницаемости мембран для ионов натрия). Вместе с тем они обладают системными хинидиноподобными эффектами, проявляющимися удлинением рефрактерной фазы и развитием желудочковой тахикардии. Тахифилаксия (снижение антигистаминной активности при длительном приеме) обусловливает необходимость чередования лекарственных средств каждые 2—3 нед [27].
Весомым преимуществом данных препаратов является наличие инъекционных форм, применение которых удобно и при ургентных состояниях, и при нарушении функции глотания и ангионевротическом отеке гортани [28].
Анализ последних данных по безопасности АГП привел к введению запрета на применение у детей до 6 лет любых Н1-антагонистов старого поколения на территории Канады и США. Также рассматривается вопрос о запрете безрецептурной продажи данных лекарственных средств во всех возрастных группах. Ситуация на территории России является крайне тревожной: лидирующие позиции по продажам (73%) сохраняют за АГП старого поколения, несмотря на все попытки привлечь внимание клиницистов к аспектам безопасности данных лекарственных средств. В мире этот показатель составляет менее 5% [22].
Современные АГП были синтезированы в конце 80-х годов. Преимуществом нового поколения является практически полное отсутствие седативного эффекта, высокая селективность к Н1-рецепторам, что исключает возникновение воздействия на холинергические и серотониновые рецепторы. Важным аспектом является наличие высокого сродства к h2R у данной категории препаратов, что обеспечивает длительный эффект и устраняет необходимость приема средств несколько раз в сутки; отсутствие метаболизации в печени (цетиризин, левоцетиризин, дезлоратадин, фексофенадин и биластин) позволяет принимать их вместе с пищей и комбинировать с другими препаратами, в том числе с теми, в метаболизме которых участвует цитохром Р-450. Важным аспектом является отсутствие формирования тахифилаксии, что позволяет использовать их в течение длительного периода, что важно при терапии и профилактике крапивницы, АтД. В экспериментальных исследованиях выявлено, что спектр фармакологической активности АГП нового поколения не ограничивается лишь связыванием с h2R. Они также подавляют высвобождение провоспалительных медиаторов (гистамина, лейкотриенов), снижают экспрессию адгезионных молекул (ICAM-1 и Р-селектина) и некоторых цитокинов (IL-4, IL-6, IL-8, IL-13), гранулоцитарно-макрофагального колониестимулирующего фактора.
Важным аспектом является наличие высокого сродства к h2R у данной категории препаратов, что обеспечивает длительный эффект и устраняет необходимость приема средств несколько раз в сутки; отсутствие метаболизации в печени (цетиризин, левоцетиризин, дезлоратадин, фексофенадин и биластин) позволяет принимать их вместе с пищей и комбинировать с другими препаратами, в том числе с теми, в метаболизме которых участвует цитохром Р-450. Важным аспектом является отсутствие формирования тахифилаксии, что позволяет использовать их в течение длительного периода, что важно при терапии и профилактике крапивницы, АтД. В экспериментальных исследованиях выявлено, что спектр фармакологической активности АГП нового поколения не ограничивается лишь связыванием с h2R. Они также подавляют высвобождение провоспалительных медиаторов (гистамина, лейкотриенов), снижают экспрессию адгезионных молекул (ICAM-1 и Р-селектина) и некоторых цитокинов (IL-4, IL-6, IL-8, IL-13), гранулоцитарно-макрофагального колониестимулирующего фактора.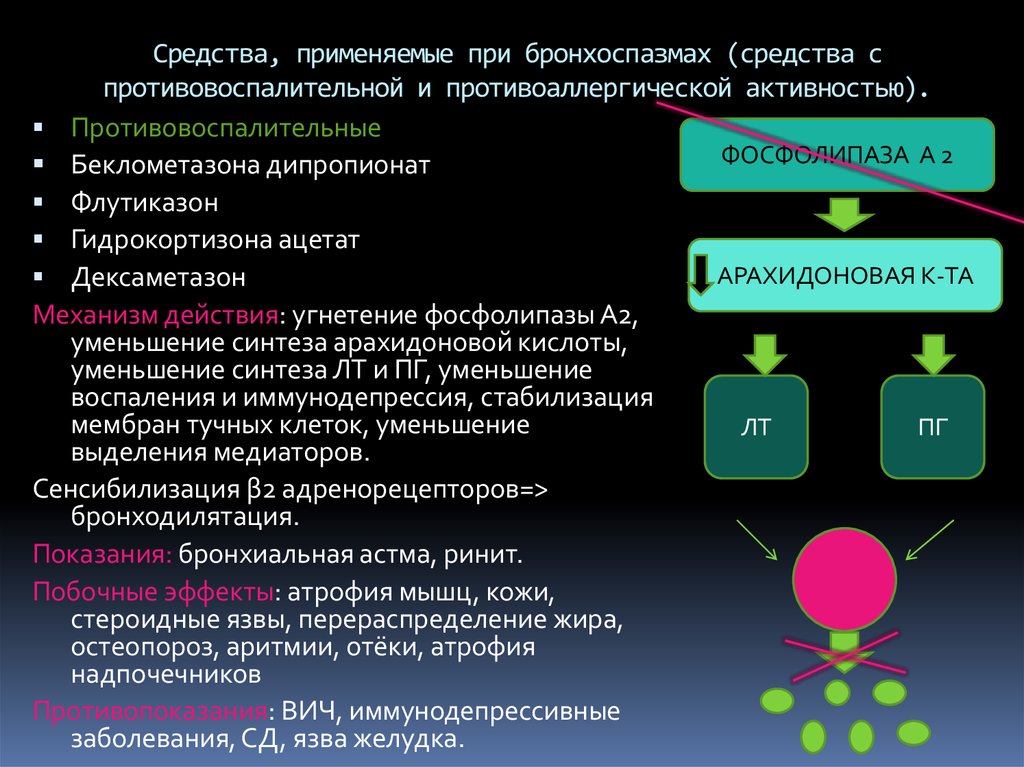 Все эти данные позволяют предполагать у современных АГП противовоспалительный эффект и обосновывают их использование в комплексной терапии воспалительных дерматозов [29, 30].
Все эти данные позволяют предполагать у современных АГП противовоспалительный эффект и обосновывают их использование в комплексной терапии воспалительных дерматозов [29, 30].
Препараты новой генерации соответствуют современным требованиям, предъявляемым к АГП (селективность, быстрый терапевтический эффект, длительный эффект, отсутствие тахифилаксии, взаимодействия с пищей, лекарственными препаратами, токсического действия, седативного эффекта, атропиноподобного действия, увеличения массы тела, кардиотоксического эффекта) [8]. Несмотря на то что синтезировано много Н1-антагонистов нового поколения, только 7 препаратов были изучены в масштабных исследованиях, которые соответствовали принципам доказательной медицины: цетиризин, дезлоратадин, фексофенадин, левоцетиризин, лоратадин, рупатадин и биластин [31].
Биластин является новейшим АГП, который в Российской Федерации был зарегистрирован в июле 2016 г. под торговым названием Никсар. Эффективность и переносимость биластина была изучена в исследованиях в Европе, Аргентине и Южной Африке при кратковременном (4 нед) и длительном (12 мес) применении. На сегодняшний день биластин относится к лидерам среди АГП новой генерации, что обусловлено его высокой селективностью к Н1R, отсутствием метаболизации (активный метаболит), доказанной эффективностью при симптоматической терапии крапивницы и аллергического ринита (включая интермиттирующий и персистирующий аллергический риноконъюнктивит), а также высоким профилем безопасности. Для него характерны низкий потенциал к лекарственным взаимодействиям, отсутствие способности потенцировать влияние алкоголя на ЦНС и потребности в коррекции дозы при нарушениях функции почек и/или печени [32—34].
На сегодняшний день биластин относится к лидерам среди АГП новой генерации, что обусловлено его высокой селективностью к Н1R, отсутствием метаболизации (активный метаболит), доказанной эффективностью при симптоматической терапии крапивницы и аллергического ринита (включая интермиттирующий и персистирующий аллергический риноконъюнктивит), а также высоким профилем безопасности. Для него характерны низкий потенциал к лекарственным взаимодействиям, отсутствие способности потенцировать влияние алкоголя на ЦНС и потребности в коррекции дозы при нарушениях функции почек и/или печени [32—34].
Цель настоящего исследования — определение эффективности и переносимости биластина (препарата Никсар) в терапии острой спонтанной крапивницы.
Материал и методы
В рамках клинического наблюдательного исследования были обследованы и пролечены 30 пациентов (23 женщины и 7 мужчин) в возрасте от 18 до 49 лет (средний возраст 27,36±4,32 года) с острой спонтанной крапивницей (ОСК). В рамках исследования проводился анализ анамнеза с целью определения триггеров возникновения ОСК и наличия сопутствующей аллергической патологии. Оценка тяжести течения крапивницы проводилась с использованием индекса UAS (urticaria activity score), который предполагает суммарную оценку в баллах основных симптомов заболевания (от 0 до 3 баллов по основным клиническим симптомам: зуду и количеству уртикарий) самим пациентом за сутки. Сумма баллов за сутки может составлять 6 баллов максимально. Сумма баллов 0—2 соответствует легкому течению ОСК; 3—4 — средней тяжести процесса; 5—6 — тяжелому течению [31] (табл. 1). Таблица 1. Определение степени активности крапивницы — индекс UAS
В рамках исследования проводился анализ анамнеза с целью определения триггеров возникновения ОСК и наличия сопутствующей аллергической патологии. Оценка тяжести течения крапивницы проводилась с использованием индекса UAS (urticaria activity score), который предполагает суммарную оценку в баллах основных симптомов заболевания (от 0 до 3 баллов по основным клиническим симптомам: зуду и количеству уртикарий) самим пациентом за сутки. Сумма баллов за сутки может составлять 6 баллов максимально. Сумма баллов 0—2 соответствует легкому течению ОСК; 3—4 — средней тяжести процесса; 5—6 — тяжелому течению [31] (табл. 1). Таблица 1. Определение степени активности крапивницы — индекс UAS
Критериями включения больных в исследования были: возраст пациентов от 18 до 60 лет, верифицированный диагноз ОСК, UAS>2, добровольное согласие на участие в исследовании. Критериями невключения в исследование были: хроническая крапивница, уртикарный васкулит, изолированный ангионевротический отек, наличие любых острых и декомпенсация хронических заболеваний, беременные и кормящие женщины, психические заболевания, участие в других клинических исследованиях.
Для определения переносимости фармакологического лечения ОСК определялись когнитивные функции при помощи корректурной пробы Бурдона. Для проведения теста использовались специальные бланки, в которых нарисованы рядом расположенные буквы, цифры, фигуры, все в хаотичном порядке. Пациенты в спокойной обстановке должны вычеркнуть определенные указанные цифры или буквы. На выполнение одного этапа тестирования отводится около 60 с, после чего пациент ставит вертикальную черту и подсчитывает все отмеченные знаки до черты. Результаты исследования оценивались по количеству пропущенных и неправильно зачеркнутых знаков или букв при помощи формул, учитывающих темп и правильность выполнения теста [35].
Оценка безопасности лечения проводилась на основании учета нежелательных явлений, по данным жалоб и объективного физикального обследования, а также динамики клинического анализа крови, мочи и биохимического анализа крови до и через 28 дней лечения. На последнем визите все больные заполняли опросник, в рамках которого им было предложено оценить по 5-балльной шкале эффективность терапии, удобство в применении биластина (препарат Никсар), переносимость лечения и вероятность использования данного лекарственного средства в случае рецидива дерматоза.
Результаты исследования были оценены с использованием методов вариационной статистики с помощью пакета статистических программ MS Exel 7, Statsoft Statistica 17.0. При обработке полученных данных использовались методы непараметрической статистики с использованием среднеарифметических значений и их ошибки по таблице Стьюдента. Статистически значимыми считали различия при p<0,05.
Клиническая характеристика больныхВ первую очередь проводилась регистрация данных по выявлению триггеров. В результате анкетирования было установлено, что наиболее часто причиной развития ОСК было употребление лекарственных препаратов — у 13 (43,33%) больных, реже — контакт с химическими аэрозолями — у 3 (10%) пациентов и пищевые продукты — у 4 (13,33%). У 10 (33,33%) пациентов выяснить причину развития крапивницы не удалось (рис. 1). Рис. 1. Распределение больных по выявлению триггеров ОСК.
Сопутствующая аллергическая патология была зарегистрирована у 11 (36,67%) пациентов: у 6 (20%) — АтД, у 2 (6,67%) — бронихиальная астма, у 8 (26,67%) — аллергический ринит, который у 4 больных сочетался с АтД и у 1 пациента — с бронихиальной астмой.
На этапе скрининга была проведена оценка степени тяжести ОСК. В результате анкетирования и клинического осмотра больных средние значения UAS у больных, вошедших в исследование, составили 4,01±0,94 балла, т. е. у большинства пациентов определялась средняя степень тяжести течения крапивницы — у 28 (93,33%), у 2 (6,67%) больных — тяжелая.
Всем больным проводилась монотерапия с использованием препарата Никсар по 1 таблетке (20 мг) в сутки в течение 28 дней. Обязательным условием в лечении было исключение установленных или возможных триггеров заболевания при отсутствии их выявления.
Результаты
Оценка результатов лечения с определением тяжести течения ОСК проводилась до лечения, на 3, 5 и 7-й дни лечения, далее — 1 раз в 7 дней с использованием индекса UAS (рис. 2). Рис. 2. Динамика средних значений индекса UAS в результате лечения.
Анализ динамики средних значений индекса UAS показал достоверное снижение активности ОСК уже на 3-й день терапии до 2,98±0,07 балла (снижение на 25,69%) (р<0,05). Через 1 нед лечения средние значения UAS составили 1,99±0,05 балла (снижение на 50,37%), через 14 дней — 1,01±0,02 балла (снижение на 74,81%), через 21 день — 0,45±0,02 балла (снижение на 88,78%) и на 28-й день — 0,12±0,01 балла (снижение на 97,01%) (р<0,05). В результате лечение ремиссия ОСК была констатирована у 28 (93,33%) больных, выраженное улучшение — у 2 (6,67%).
Через 1 нед лечения средние значения UAS составили 1,99±0,05 балла (снижение на 50,37%), через 14 дней — 1,01±0,02 балла (снижение на 74,81%), через 21 день — 0,45±0,02 балла (снижение на 88,78%) и на 28-й день — 0,12±0,01 балла (снижение на 97,01%) (р<0,05). В результате лечение ремиссия ОСК была констатирована у 28 (93,33%) больных, выраженное улучшение — у 2 (6,67%).
Проведение корректурной пробы Бурдона с целью изучения влияния использования биластина на когнитивную функцию у больных ОСК в результате лечения позволило установить, что проводимая терапия не способствовала снижению репродуктивности выполненных заданий и повышению ошибок (табл. 2). Таблица 2. Результаты корректурной пробы Бурдона
На каждом визите пациентов регистрировали Н.Я. Появление сонливости и головной боли было отмечено у 1 (3,33%) пациентки: это НЯ сохранялось в течение всего курса терапии, но носило легкий характер и не требовало прекращения применения препарата Никсар. Значимых клинических отклонений в результатах лабораторных исследований не было зарегистрировано ни у одного пациента.
Средний балл результатов тестирования по удовлетворенности пациентов от проведенного лечения составил 4,73±0,21 (рис. 3). Рис. 3. Результаты тестирования больных.
Опрос больных показал, что в среднем пациенты отметили хорошую эффективность и переносимость терапии (4,33±0,27 и 4,59±0,15 балла соответственно), при этом переносимость и вероятность повторного применения биластина (препарата Никсар) все больные оценили по наивысшему баллу.
Заключение
Важным аспектом в лечении больных в условиях современного ритма жизни является эффективность проводимой терапии, ее переносимость и безопасность. Монотерапия острой спонтанной крапивницы с использованием биластина (препарата Никсар) способствовала быстрому и достоверному снижению активности клинических симптомов, формированию ремиссии у 93,33% больных, при этом когнитивные нарушения в результате терапии отсутствовали, а частота НЯ была низкой. Все это характеризует данный лекарственный препарат как современное, эффективное и безопасное средство первой линии для лечения аллергических заболеваний кожи.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: [email protected]
Антигистаминные препараты в контроле аллергических заболеваний у детей | Кондюрина Е.Г., Зеленская В.В.
Аллергические заболевания относятся к числу наиболее распространенных в детской популяции. По данным эпидемиологических исследований, их удельный вес составляет от 10 до 35% в зависимости от характеристик региона; в педиатрической практике наиболее часто встречаются бронхиальная астма, аллергический ринит, атопический дерматит, аллергический конъюнктивит, крапивница, пищевая аллергия, а также их сочетания [1,3].
По современным представлениям, контроль заболеваний базируется на необходимости проведения элиминационных мероприятий, базисной терапии, применения противоаллергических препаратов и, по возможности, проведения специфической иммунотерапии [27]. Рациональное использование противоаллергических средств обеспечивает купирование острых проявлений патологии и предотвращает повторные обострения. Спектр имеющихся в арсенале врача антиаллергических медикаментов достаточно широк – антигистаминные, антилейкотриеновые, глюкокортикостероидные средства.
Спектр имеющихся в арсенале врача антиаллергических медикаментов достаточно широк – антигистаминные, антилейкотриеновые, глюкокортикостероидные средства.
В патогенезе развития симптомов аллергических заболеваний существенное место отводится гистамину, который является одним из главных медиаторов 1–го типа реакций гиперчувствительности. В аллергических реакциях из предварительно сенсибилизированных тучных клеток гистамин выделяется вместе с образующимися медиаторами аллергии – лейкотриенами и простагландинами. Гистамин реализует свои эффекты через поверхностные клеточные рецепторы, которых в настоящее время известно 4 типа. При этом наиболее значимыми являются Н1–рецепторы, преобладающие в коже, на гладкомышечных клетках, они ответственны за развитие ранней и поздней (отсроченной) фазы аллергического ответа. Гистамин является короткоживущей молекулой, но местное воспаление далее поддерживается последующей продукцией тучными клетками других медиаторов, в том числе лейкотриенов.
Существенная роль гистамина в патогенезе клинических симптомов аллергии привела к поиску путей подавления его активности в организме больного. Применение кортикостероидов, циклоспорина А подавляет высвобождение этого медиатора из тучных клеток; блокаторы гистаминовых рецепторов, антилейкотриеновые препараты предотвращают действие гистамина на клетки–мишени.
Разработка антигистаминных препаратов была начата в 40–е годы прошлого века. В настоящее время во всем мире насчитывается более 40 видов блокаторов Н1–гистаминовых рецепторов. В соответствии с существующими рекомендациями блокаторы Н1–гистаминовых рецепторов являются патогенетически оправданными средствами для лечения большинства аллергических заболеваний.
Традиционно среди антигистаминных средств выделяются препараты первого и второго поколения. Действие препаратов первого поколения (хлоропирамин, дифенгидрамин, прометазин и др.) основано на конкурентном блокировании Н1–рецепторов. Препараты дают быстрый эффект, имеют инъекционные формы, что позволяет использовать их в том числе для купирования неотложных состояний. Однако применение данной группы препаратов ограничено побочными эффектами, обусловленными их способностью проникать через гематоэнцефалический барьер и влиять на холино– и адренорецепторы и др. [2].
Однако применение данной группы препаратов ограничено побочными эффектами, обусловленными их способностью проникать через гематоэнцефалический барьер и влиять на холино– и адренорецепторы и др. [2].
Одним из наиболее часто применяемых препаратов второго поколения в педиатрии является цетиризин, который хорошо зарекомендовал себя в лечении и профилактике аллергических заболеваний у детей и взрослых [4]. Важным в педиатрической практике является наличие специальных форм, позволяющих точно дозировать препарат и иметь хороший уровень комплаентности. Возможность долгосрочного профилактического использования при аллергических заболеваниях у детей была доказана в единственном в педиатрии мультицентровом исследовании ETAC.
Поиск более эффективных форм антигистаминных средств привел к созданию препаратов на основе активных метаболитов, получаемых за счет трансформации исходного средства, что во многом увеличивает их эффективность и уменьшает количество побочных эффектов [5]. Цетиризин сам является активным метаболитом, оптимизация этого направления в клинической фармакологии привела к развитию учения об энантиомерах и появлению на рынке левовращающего оптического изомера цетиризина — левоцетиризина. Его фармакодинамика и фармакокинетика в настоящее время изучены достаточно хорошо [6,7].
Цетиризин сам является активным метаболитом, оптимизация этого направления в клинической фармакологии привела к развитию учения об энантиомерах и появлению на рынке левовращающего оптического изомера цетиризина — левоцетиризина. Его фармакодинамика и фармакокинетика в настоящее время изучены достаточно хорошо [6,7].
Левоцетиризин быстро всасывается в кишечнике, транспортируется в печень, а оттуда поступает в кровоток, не подвергаясь печеночному метаболизму, т.к. является конечным метаболитом. Препарат не взаимодействует с цитохромом P450, за счет чего не имеет конкурентного лекарственного взаимодействия. Левоцетиризин не обладает кардиотоксическим действием, имеет низкий объем распределения, за счет чего обнаруживается на клеточных мембранах. Препарат выводится из организма преимущественно почками в неизмененном виде.
В проведенных исследованиях было показано [8], что антигистаминные препараты второго поколения имеют большее взаимодействие с рецептором, что обеспечивает выраженность терапевтического эффекта. При применении левоцетиризина через 4 и 24 ч. занятость составляла 90 и 57%, для фексофенадина — 95 и 24%, для дезлоратадина — 71 и 43% соответственно.
При применении левоцетиризина через 4 и 24 ч. занятость составляла 90 и 57%, для фексофенадина — 95 и 24%, для дезлоратадина — 71 и 43% соответственно.
Избирательность левоцетиризина в отношении Н1–гистаминовых рецепторов в два раза выше по сравнению с цетиризином и в 600 раз выше, чем к другим рецепторам, что приводит к практическому отсутствию антихолинэргического и антисеротонинового действия [9]. Левоцетиризин обладает способностью существенно тормозить спонтанную и стимулированную гистамином секрецию медиаторов аллергического воспаления, что приводит к уменьшению клинических симптомов при аллергическом рините, крапивнице, зудящих дерматозах и бронхиальной астме [10,11].
Эффективность и безопасность левоцетиризина при лечении аллергического ринита и конъюнктивита подтверждена в серии контролируемых исследований [21,22]. Так, показано, что применение левоцетиризина у больных с персистирующим аллергическим ринитом с сенсибилизацией к пыльце трав и домашней пыли приводит к улучшению качества жизни и снижению стоимости лечения. Установлен также положительный эффект левоцетиризина при лечении крапивницы. Особо следует отметить, что результаты исследований свидетельствуют не только о клинической эффективности, но и о высоком профиле безопасности левоцетиризина как у взрослых, так и у детей [19–23]. Доказано, что серьезных гематологических, биохимических или ЭКГ–нарушений, а также негативного влияния препарата на физическое развитие, поведение или обучение детей отмечено не было. При этом частота побочных эффектов левоцетиризина не отличалась от плацебо даже при длительном его применении [16–18,24–26].
Установлен также положительный эффект левоцетиризина при лечении крапивницы. Особо следует отметить, что результаты исследований свидетельствуют не только о клинической эффективности, но и о высоком профиле безопасности левоцетиризина как у взрослых, так и у детей [19–23]. Доказано, что серьезных гематологических, биохимических или ЭКГ–нарушений, а также негативного влияния препарата на физическое развитие, поведение или обучение детей отмечено не было. При этом частота побочных эффектов левоцетиризина не отличалась от плацебо даже при длительном его применении [16–18,24–26].
В настоящее время в России зарегистрировано несколько препаратов левоцетиризина, одним из которых является Супрастинекс («Эгис», Венгрия). Супрастинекс выпускается в виде таблеток по 5 мг, а также в виде раствора для капель (в 1 мл раствора содержится 5 мг левоцетиризина). Капли Супрастинекса разрешены к применению для детей с 2–летнего возраста.
Режим дозирования Супрастинекса. Для детей старше 6 лет и взрослых рекомендован прием 5 мг препарата 1 раз в сутки (1 таблетка или 20 капель раствора за 1 прием). Для детей в возрасте от 2 до 6 лет рекомендуется использовать Супрастинекс в виде раствора для капель, при этом суточную дозу (2,5 мг) разделяют на два приема – по 5 капель раствора 2 раза/сут. Препарат следует принимать во время еды или натощак, запивая небольшим количеством воды. Особо следует отметить, что наличие педиатрической формы Супрастинекса существенно расширяет возможности медикаментозного контроля над аллергическими заболеваниями не только у взрослых, но и у детей при минимальном риске побочных и нежелательных явлений.
Для детей в возрасте от 2 до 6 лет рекомендуется использовать Супрастинекс в виде раствора для капель, при этом суточную дозу (2,5 мг) разделяют на два приема – по 5 капель раствора 2 раза/сут. Препарат следует принимать во время еды или натощак, запивая небольшим количеством воды. Особо следует отметить, что наличие педиатрической формы Супрастинекса существенно расширяет возможности медикаментозного контроля над аллергическими заболеваниями не только у взрослых, но и у детей при минимальном риске побочных и нежелательных явлений.
Таким образом строгое соблюдение элиминационных мероприятий, проведение базисной терапии и рациональное использование противоаллергических средств позволяет эффективно контролировать симптомы аллергии, определяет возможность проведения специфической иммунотерапии в период клинической ремиссии, что, в целом, и определяет позитивное влияние на течение заболевания.
Литература
1. Аллергический ринит и его влияние на астму, 2008. В сотрудничестве с Всемирной организацией здравоохранения // Рос.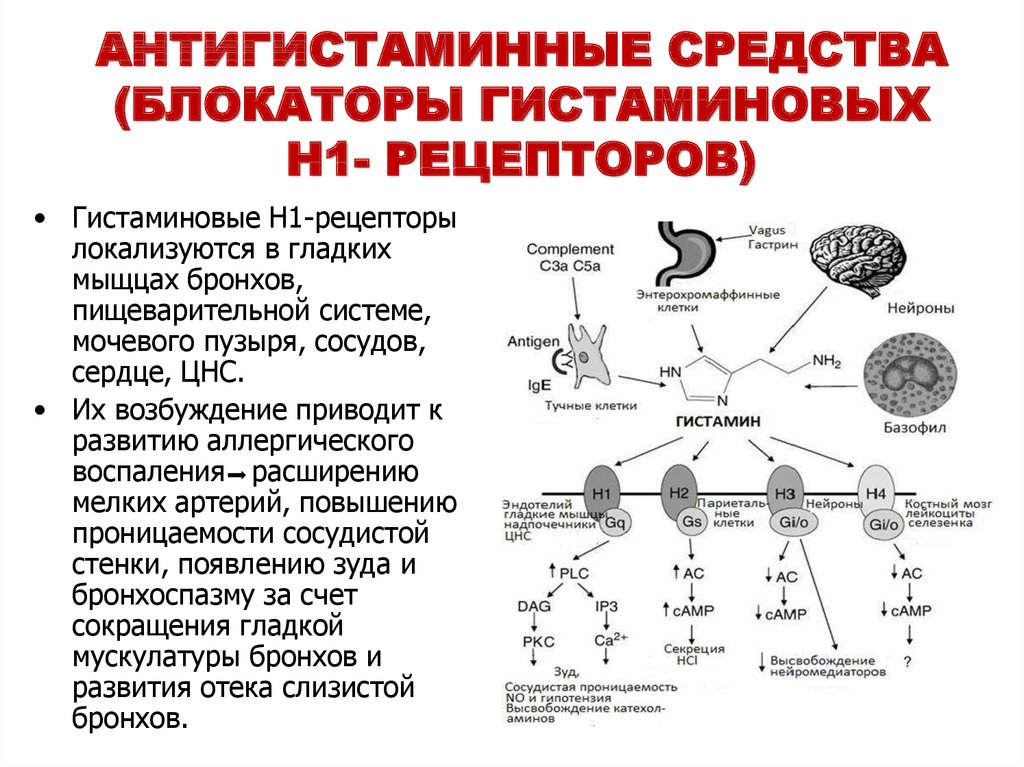 аллерголог. журн. – 2010. – Т. – С.74–86.
аллерголог. журн. – 2010. – Т. – С.74–86.
2. Международный консенсус в лечении аллергического ринита (версия Европейской академии аллергологии и клинической иммунологии, 2000) // Рос. ринол. –2000. –№ 3. –С. 5–23.
3. Ревякина В.А. Современный взгляд на проблему аллергических ринитов у детей// Леч. врач. –2001. – № 3. –С. 22–27.
4. Федоскова Т.Г., Ильина Н.И. Роль аллергических заболеваний в общеклинической практике // РМЖ (Клинические рекомендации и алгоритмы для практикующих врачей, социально–значимые заболевания). –2004. – Т. 12 (14). – С. 876–885.
5. Van Coevorden A.M., Coenraads P.J., Svensson A. et al. Overview of studies of treatments for hand eczema–the EDEN hand eczema survey // Br. J. Dermatol. –2004. –№ 2. –P. 446–451.
6. Chen C. Physicochemical, pharmacological and pharmacokinetic properties of the zwitterionic antihistamines cetirizine and levocetirizine // Curr. Med. Chem. –2008. –Vol.15 (21). –P. 2173–2191.
7. Klimek L. Levocetirizine: from scientific evidence to a potent modern–day treatment of today’s allergic patients // Drugs.Today (Barc). –2009. –Vol. 45 (3). –P. 213–225.
Levocetirizine: from scientific evidence to a potent modern–day treatment of today’s allergic patients // Drugs.Today (Barc). –2009. –Vol. 45 (3). –P. 213–225.
8. Abramovits W., Gupta A. Xyzal (levocetirizine dihydrochloride) // Skinmed. –2008. –Vol. 7 (2). –P. 84–85.
Gillard M., Christophe B., Wels B. et al. Н1 antagonists: receptor affinity versus selectivity // Inflamm. Res. –2003. –Vol. 52. (Suppl 1). – S.49–50.
9. Shih M. Y., Hsu J. Y., Weng Y. S., Fu L. S. Influence of cetirizine and levocetirizine on two cytokines secretion in human airway epithelial cells // Allergy Asthma Proc. –2008.– Vol. 29 (5). – P. 480–485
10. Grant A.J., Riethuisen J.–M., Moulaert B., De Vos C. A double–blind, randomized, single–dose, crossover comparison of levocetirizine with ebastine, fexofenadine, loratadine, mizolastine, and placebo: suppression of histamine–induced wheal–and–flare response during 24 hours in healthy male subjects// Ann. Allergy Asthma Immunol. – 2002.–Vol.88.–P.190–197.
– 2002.–Vol.88.–P.190–197.
11. Kapp A., Pichler W.J. Levocetirizine is an effective treatment in patients suffering from chronic idiopathic urticaria: a randomized, double–blind, placebo–controlled, parallel, multicenter study// Int. J. Dermatol. –2006.–Vol. 45(4).–P. 469–474.
12. Devalia J.L. et al. A randomized, double–blind, crossover comparison among cetirizine, levocetirizine, and ucb 28557 on histamine–induced cutaneous responses in healthy adult volunteers // Allergy. –2001. –Vol. 56.–P. 50–57.
13. Steinbrook R. Testing medications in children // N. Engl. J. Med.– 2002.– Vol. 347.–P. 1462–1470.
14. Kearns G.L., Abdel–Rahman S.M., Alander S.W. et al. Developmental pharmacology – drug disposition, action, and therapy in infants and children // N. Engl. J. Med.– 2003.– Vol. 349.– P. 1157–1167.
15. Pasquali M., Baiardini I., Rogkakou A. et al. Levocetirizine in persistent allergic rhinitis and asthma: effects on symptoms, quality of life and inflammatory parameters // Clin. Exp. Allergy.– 2006. – Vol.36. – P.1161–1167.
Exp. Allergy.– 2006. – Vol.36. – P.1161–1167.
16. de Blic J., Wahn U., Billard E. et al. Levocetirizine in children: evidenced efficacy and safety in a 6–week randomized seasonal allergic rhinitis trial // Pediatr. Allergy Immunol.– 2005. – Vol.16. – P.267–275.
17. Gandon J.M., Allain H. Lack of effect of single and repeated doses of levocetirizine, a new anthihistamine drug, on cognitive and psychomotor functions in healthy volunteers // J.Clin. Pharmacol.– 2002.– Vol. 54. –P. 51–58.
18. Ciprandi G., Cirillo I., Vizzaccaro A., Tosca M.A. Levocetirizine improves nasal obstruction and modulates cytokine pattern in patients with seasonal allergic rhinitis: a pilot study // Clin. Exp. Allergy.– 2004.–Vol. 34(6).– P. 958–964.
19. Larbig M., Stamm H., Hohlfeld J., Krug N. Levocetirizine but not desloratadine inhibits histamine–induced changes of nasal temperature measured by facial thermography // EAACI, 2003.
20. Bachert C. et al. XPERT(reg): Levocetirizine long term treatment in patients suffering from Persistent Allergic Rhinitis //Allergy. – 2003.–Vol. 58:77 (Abstract 239).
– 2003.–Vol. 58:77 (Abstract 239).
21. Walter Canonica G., Bousquet J., Van Hammee G. et.al.XPERT Study Group Levocetirizine improves health–related quality of life and health status in persistent allergic rhinitis // Respiratory medicine.– 2006.– Vol.100(10).–P.1706–1715.
22. Potter P.C. Paediatric Levocetirizine Study Group Efficacy and safety of levocetirizine on symptoms and health–related quality of life of children with perennial allergic rhinitis: a double–blind, placebo–controlled randomized clinical trial. Annals of allergy, asthma & immunology : official publication of the American College of Allergy // Asthma, Immunology.– 2005.–Vol. 95(2).–P.175–180.
23. ETAC. Early Treatment of the Atopic Child. First result. The UCB Institute of Allergy, 2001.
24. Simons FER on Behalf of the Early Prevention of Asthma in Atopic Children (EPAAC) Study Group. Safety of levocetirizine treatment in young atopic children: An 18–month study // Pediatr. Allergy. Immunol.– 2007. –Vol.18. –P. 535–542.
Allergy. Immunol.– 2007. –Vol.18. –P. 535–542.
25. Hugo P. Van Bever, Sudesh T. Samuel, Bee Wah Lee. Halting the Allergic March // WAO Journal. — 2008 . — P. 57–62.
26 Palmer C.N., Irvine A.D., Terron–Kwiatkowski A. et al. Common loss–of–function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nature Genetics. — 2006. — Vol.38(4). — P. 441–446.
Терапевтическая ценность совместного лечения глюкокортикоидами и антигистаминными препаратами. Обоснование и перспективы
1. Hench PS, Kendall EC, Slocumb CH, Polley HF. Влияние гормона коры надпочечников (17-гидрокси-11-дегидрокортикостерон: соединение Е) и гормона гипофиза надпочечников при артрите: предварительный отчет. Энн Реум Дис. 1949;8:97-104. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Мунк А. Биология глюкокортикоидов — историческая перспектива. 2001:17–33.
3.
Николаидес Н.К., Галата З., Кино Т., Хрусос Г.П., Чармандари Э.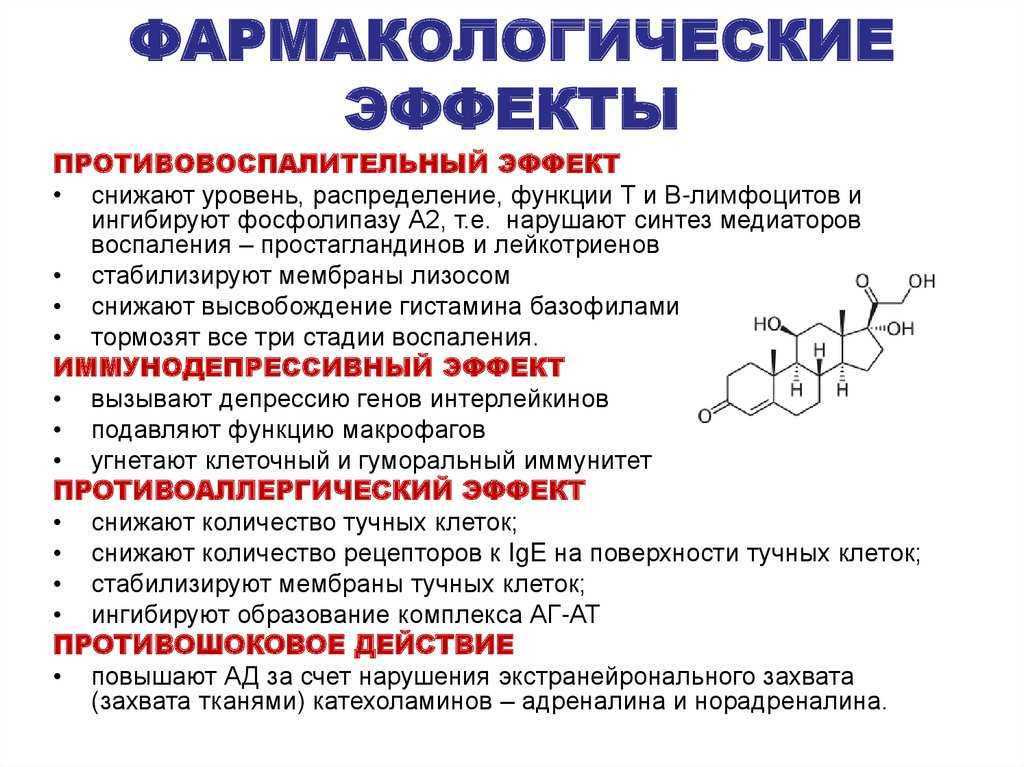 Глюкокортикоидный рецептор человека: молекулярная основа биологической функции. Стероиды. 2010;75:1-12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Глюкокортикоидный рецептор человека: молекулярная основа биологической функции. Стероиды. 2010;75:1-12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Либерман А.С., Будзинский М.Л., Сокн С., Гоббини Р.П., Штайнингер А., Арцт Э. Регуляторные и механистические действия глюкокортикоидов на Т и воспалительные клетки. Передний эндокринол. 2018;9:235. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Рен Т., Сидловски Дж.А. Противовоспалительное действие глюкокортикоидов – новые механизмы для старых препаратов. New Engl J Med. 2005;353:1711-1723. [PubMed] [Академия Google]
6. Сундал Н., Бриделанс Дж., Либерт С., Де Босшер К., Бек И.М. Селективная модуляция глюкокортикоидных рецепторов: новые направления с нестероидными каркасами. Фармакол Тер. 2015;152:28-41. [PubMed] [Google Scholar]
7. Schacke H, Docke WD, Asadullah K. Механизмы побочных эффектов глюкокортикоидов. Фармакол Тер. 2002;96:23-43. [PubMed] [Google Scholar]
8.
De Bosscher K, Haegeman G. Minireview: последние взгляды на противовоспалительное действие глюкокортикоидов. Мол Эндокринол. 2009 г.;23:281-291. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Minireview: последние взгляды на противовоспалительное действие глюкокортикоидов. Мол Эндокринол. 2009 г.;23:281-291. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Байула М., Бедини А., Балди Дж., Кавет М.Е., Говони П., Спампинато С. Мапракорат, селективный агонист глюкокортикоидных рецепторов, вызывает апоптоз эозинофилов, инфильтрирующих конъюнктиву при поздней фазе экспериментальной глазной аллергии. Разработка лекарственного препарата Ther. 2014;8:745-757. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Stock T, Fleshaker D, Wang X, Mukherjee A, Mebus C. Улучшение активности заболевания с помощью фосдагрокората (PF-04171327), частичного агониста глюкокортикоидного рецептора, у пациентов с ревматоидным артритом: рандомизированное исследование фазы 2. Int J Rheum Dis. 2017;20:960-970. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11.
Vandevyver S, Dejager L, Tuckermann J, Libert C. Новое понимание противовоспалительных механизмов глюкокортикоидов: новая роль трансактивации, опосредованной глюкокортикоидными рецепторами. Эндокринология. 2013;154:993-1007. [PubMed] [Google Scholar]
Эндокринология. 2013;154:993-1007. [PubMed] [Google Scholar]
12. Moncor F, Chatzopoulou A, Zappia CD, Houtman R, Meijer OC, Fitzsimons CP. Модель взаимодействия глюкокортикоидных рецепторов с корегуляторами предсказывает регуляцию транскрипции генов-мишеней. Фронт Фармакол. 2019;10:214. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Вейкум Э.Р., Кнузель М.Т., Ортлунд Э.А., Ямамото К.Р. Глюкокортикоидный рецептор контролирует транскрипцию: точность и пластичность посредством аллостерии. Nat Rev Mol Cell Biol. 2017;18:159-174. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Де Босшер К., Бек И.М., Ратман Д., Берге В.В., Либерт С. Активация глюкокортикоидного рецептора при остром воспалении: концепция SEDIGRAM. Trends Pharmacol Sci. 2016;37:4-16. [PubMed] [Академия Google]
15. Vandewalle J, Luypaert A, De Bosscher K, Libert C. Терапевтические механизмы глюкокортикоидов. Тенденции Эндокринол Метаб. 2018;29:42‐54. [PubMed] [Google Scholar]
16. Барнс П.Дж. Кортикостероиды: препараты, которые нужно победить. Евр Дж Фармакол. 2006;533:2-14. [PubMed] [Google Scholar]
Барнс П.Дж. Кортикостероиды: препараты, которые нужно победить. Евр Дж Фармакол. 2006;533:2-14. [PubMed] [Google Scholar]
17. Барнс П.Дж. Глюкокортикостероиды: современные и перспективные направления. Бр Дж. Фармакол. 2011;163:29-43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Парсонс ME, Ганеллин CR. Гистамин и его рецепторы. Бр Дж. Фармакол. 2006; 147 (Приложение 1): S127-S135. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Фигероа К., Шенкли Н. Сто лет исследований гистамина. Adv Exp Med Biol. 2010;709:1–9. [PubMed] [Google Scholar]
20. Баккер Р.А., Виланд К., Тиммерман Х., Леурс Р. Конститутивная активность рецептора гистамина Н(1) выявляет обратный агонизм антагонистов рецептора гистамина Н(1). Евр Дж Фармакол. 2000;387:R5-R7. [PubMed] [Google Scholar]
21.
Fitzsimons CP, Monczor F, Fernandez N, Shayo C, Davio C. Мепирамин, обратный агонист гистаминового h2-рецептора, преимущественно связывается с формой рецептора, связанной с G-белком, и секвестрирует G-белок. Дж. Биол. Хим. 2004;279: 34431-34439. [PubMed] [Google Scholar]
Дж. Биол. Хим. 2004;279: 34431-34439. [PubMed] [Google Scholar]
22. Bakker RA, Schoonus SB, Smit MJ, Timmerman H, Leurs R. Активация гистаминового H(1)-рецептора ядерного фактора-каппа B: роли G бета-гамма- и G-альфа(q/11)-субъединиц в конститутивных и агонистических – опосредованная сигнализация. Мол Фармакол. 2001;60:1133-1142. [PubMed] [Google Scholar]
23. Саймонс Ф.Е., Саймонс К.Дж. Гистамин и Н2-антигистаминные препараты: празднование столетия прогресса. J Аллергия Клин Иммунол. 2011;128:1139–1150.e4. [PubMed] [Академия Google]
24. Барто Л., Бенко Р. Следует ли повторно рассматривать антигистаминные препараты как противоастматические препараты в качестве адъювантов к антилейкотриенам? Евр Дж Фармакол. 2013;701:181-184. [PubMed] [Google Scholar]
25. Оверингтон Дж. П., Аль-Лазикани Б., Хопкинс А. Л. Сколько мишеней для наркотиков существует? Nat Rev Drug Discov. 2006; 5: 993–996. [PubMed] [Google Scholar]
26.
Zappia CD, Granja-Galeano G, Fernández N, et al. Влияние передачи сигналов рецептора гистамина h2 на активность глюкокортикоидного рецептора. Роль канонических и неканонических путей. Научный доклад 2015; 5:17476. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Влияние передачи сигналов рецептора гистамина h2 на активность глюкокортикоидного рецептора. Роль канонических и неканонических путей. Научный доклад 2015; 5:17476. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Наварро А., Валеро А., Росалес М.Дж., Муллол Дж. Клиническое применение пероральных антигистаминных препаратов и интраназальных кортикостероидов у пациентов с аллергическим ринитом. J Investig Allergol Clin Immunol. 2011;21:363-369. [PubMed] [Google Scholar]
28. Вольтерс ОД. Новые патенты фиксированных комбинаций назальных антигистаминных препаратов и кортикостероидов при аллергическом рините. Недавние лекарства от аллергии Pat Inflamm Discov. 2013;7:223-228. [PubMed] [Google Scholar]
29. Plaza Moral V. Comite Ejecutivo de G. [GEMA (4.0). Рекомендации по лечению астмы]. Арка Бронконемол. 2015;51(Приложение 1):2-54. [PubMed] [Академия Google]
30.
Брожек Дж.Л., Буске Дж., Агаче И. и др. Руководство по аллергическому риниту и его влиянию на астму (ARIA), редакция 2016 г. J Аллергия Клин Иммунол. 2017;140:950-958. [PubMed] [Google Scholar]
J Аллергия Клин Иммунол. 2017;140:950-958. [PubMed] [Google Scholar]
31. Буске Дж., Бахерт С., Бернштейн Дж. и др. Достижения в фармакотерапии для лечения аллергического ринита; MP29-02 (новый состав азеластина гидрохлорида и флутиказона пропионата в усовершенствованной системе доставки) заполняет пробелы. Эксперт Опин Фармаколог. 2015;16:913-928. [PubMed] [Google Scholar]
32. Бьермер Л., Вестман М., Холмстром М., Викман М.С. Комплексная патофизиология аллергического ринита: научное обоснование разработки альтернативного варианта лечения. Аллергия Астма Клин Иммунол. 2019;15:24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Hoare C, Li Wan Po A, Williams H. Систематический обзор методов лечения атопической экземы. Оценка медицинских технологий. 2000;4:1‐191. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34.
Kagawa Y, Izawa K, Yano H, Kamei C. Синергетические эффекты преднизолона и олопатадина на модели атопического дерматита у бесшерстных мышей. Фармакология. 2010;85:286-294. [PubMed] [Google Scholar]
Фармакология. 2010;85:286-294. [PubMed] [Google Scholar]
35. Бернабо Н., Барбони Б., Маккарроне М. Биологические сети в изучении сложности передачи клеточного сигнала: примеры капацитации сперматозоидов и эндоканнабиноидной системы. Comput Struct Biotechnol J. 2014; 11:11-21. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Йошикава Т., Канадзава Х. Перекрестные помехи клеточной передачи сигналов между несколькими рецепторами для исследования патофизиологии при многофакторных заболеваниях — что такое клинически значимые перекрестные помехи? Курр Мед Хим. 2013;20:1091-1102. [PubMed] [Google Scholar]
37. Schmidt P, Holsboer F, Spengler D. Бета(2)-адренергические рецепторы усиливают трансактивацию глюкокортикоидных рецепторов через бета-гамма-субъединицы G-белка и путь фосфоинозитид-3-киназы. Мол Эндокринол. 2001;15:553-564. [PubMed] [Google Scholar]
38.
Кино Т., Тиулпаков А., Ичиджо Т., Ченг Л., Козаса Т., Хрусос Г.П. G-белок бета взаимодействует с глюкокортикоидным рецептором и подавляет его транскрипционную активность в ядре. Джей Селл Биол. 2005;20(169):885-896. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Селл Биол. 2005;20(169):885-896. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Кифер Т.Л., Лай Л., Юань Л., Донг С., Буроу М.Э., Хилл С.М. Дифференциальная регуляция транскрипционной активности альфа-рецептора эстрогена, глюкокортикоидного рецептора и альфа-рецептора ретиноевой кислоты с помощью мелатонина опосредована различными G-белками. J Шишковидная рез. 2005;38:231-239. [PubMed] [Google Scholar]
40. Sainz RM, Mayo JC, Reiter RJ, Antolin I, Esteban MM, Rodriguez C. Мелатонин регулирует глюкокортикоидный рецептор: ответ на его антиапоптотическое действие в тимусе. ФАСЭБ Дж. 1999;13:1547-1556. [PubMed] [Google Scholar]
41. Hoijman E, Rocha Viegas L, Keller Sarmiento MI, Rosenstein RE, Pecci A. Участие белка Bax в предотвращении индуцированного глюкокортикоидами апоптоза тимоцитов мелатонином. Эндокринология. 2004;145:418-425. [PubMed] [Google Scholar]
42.
Presman DM, Hoijman E, Ceballos NR, Galigniana MD, Pecci A. Мелатонин ингибирует ядерную транслокацию глюкокортикоидного рецептора в тимоцитах мыши. Эндокринология. 2006;147:5452-5459. [PubMed] [Академия Google]
Эндокринология. 2006;147:5452-5459. [PubMed] [Академия Google]
43. Presman DM, Levi V, Pignataro OP, Pecci A. Мелатонин ингибирует глюкокортикоид-зависимое взаимодействие GR-TIF2 в клетках почек новорожденных хомяков (BHK). Мол Селл Эндокринол. 2012;349:214-221. [PubMed] [Google Scholar]
44. Юликоми Т., Виенонен А., Ахола Т.М. Рецептор 30, связанный с G-белком, подавляет экспрессию кофактора и препятствует транскрипционной активности глюкокортикоидов. Евр Дж Биохим. 2004; 271:4159-4168. [PubMed] [Google Scholar]
45. Li J, Hand LE, Meng QJ, Loudon AS, Bechtold DA. GPR50 взаимодействует с TIP60, модулируя передачу сигналов глюкокортикоидного рецептора. ПЛОС ОДИН. 2011;6:e23725. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46.
Лу Н.З., Уорделл С.Е., Бернстайн К.Л. и др. Международный союз фармакологов. LXV. Фармакология и классификация суперсемейства ядерных рецепторов: глюкокортикоидные, минералокортикоидные, прогестероновые и андрогенные рецепторы. Pharmacol Rev. 2006; 58:782–797. [PubMed] [Google Scholar]
Pharmacol Rev. 2006; 58:782–797. [PubMed] [Google Scholar]
47. Панула П., Чазот П.Л., Коварт М. и др. Международный союз фундаментальной и клинической фармакологии. XCVIII. Рецепторы гистамина. Pharmacol Rev. 2015;67:601-655. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Froidure A, Pilette C. Человеческие дендритные клетки при аллергической астме и рините. наук медицины. 2015;31:151-158. [PubMed] [Google Scholar]
49. Умланд С.П., Шлеймер Р.П., Джонстон С.Л. Обзор молекулярных и клеточных механизмов действия глюкокортикоидов при астме. Пульм Фармакол Тер. 2002;15:35-50. [PubMed] [Google Scholar]
50. Паздрак К., Куроски А. Функциональная протеомика для характеристики нарушенных клеточных ответов на глюкокортикоиды при астме. Adv Exp Med Biol. 2014;795:255-270. [PubMed] [Google Scholar]
51.
Цзян З., Чжу Л. Обновленная информация о молекулярных механизмах устойчивости к кортикостероидам при хронической обструктивной болезни легких. Пульм Фармакол Тер. 2016;37:1-8. [PubMed] [Google Scholar]
2016;37:1-8. [PubMed] [Google Scholar]
52. Шода Т., Футамура К., Орихара К. и др. Последние достижения в понимании роли эндотелиальных клеток сосудов при аллергическом воспалении. Аллергол Интерн. 2016;65:21-29. [PubMed] [Google Scholar]
53. Van Ganse E, Kaufman L, Derde MP, Yernault JC, Delaunois L, Vincken W. Эффекты антигистаминных препаратов при астме у взрослых: метаанализ клинических испытаний. Евр Респир Дж. 1997;10:2216-2224. [PubMed] [Google Scholar]
54. Олин Дж. Т., Векслер М. Е. Бронхиальная астма: патогенез и новые препараты для лечения. БМЖ. 2014;349:g5517. [PubMed] [Google Scholar]
55. Zappia CD, Soto A, Granja-Galeano G и др. Азеластин потенцирует антиастматический эффект дексаметазона на мышиной модели астмы. Фармакол Рез Перспект. 2019;e00531 10.1002/прп2.531. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56.
Рансохофф Р.М., Браун М.А. Врожденный иммунитет в центральной нервной системе. Дж. Клин Инвестиг. 2012;122:1164-1171. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Хуанг И, Генри С.Дж., Данцер Р., Джонсон Р.В., Годбаут Дж.П. Преувеличенное болезненное поведение и экспрессия провоспалительных цитокинов в головном мозге у старых мышей в ответ на интрацеребровентрикулярный липополисахарид. Нейробиол Старение. 2008;29:1744-1753. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Мрак Р.Е., Гриффин В.С. Глии и их цитокины в развитии нейродегенерации. Нейробиол Старение. 2005;26:349-354. [PubMed] [Google Scholar]
59. Амор С., Пуэнтес Ф., Бейкер Д., ван дер Валк П. Воспаление при нейродегенеративных заболеваниях. Иммунология. 2010;129: 154-169. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Фахури М. Роль иммунитета и воспаления в патофизиологии нейродегенеративных заболеваний. Нейродегенер Дис. 2015;15:63-69. [PubMed] [Google Scholar]
61.
Хенека М.Т., О’Бэнион М.К., Тервел Д., Куммер М.П. Нейровоспалительные процессы при болезни Альцгеймера. J Neural Transm. 2010;117:919-947. [PubMed] [Google Scholar]
2010;117:919-947. [PubMed] [Google Scholar]
62. Hirsch EC, Vyas S, Hunot S. Нейровоспаление при болезни Паркинсона. Расстройство, связанное с паркинсонизмом. 2012;18(Приложение 1):S210-S212. [PubMed] [Академия Google]
63. Скапер С.Д. Мозг как мишень воспалительных процессов и стратегии нейропротекции. Энн Н.Ю. Академия наук. 2007;1122:23–34. [PubMed] [Google Scholar]
64. Бауне БТ. Воспаление и нейродегенеративные расстройства: есть ли еще надежда на терапевтическое вмешательство? Курр Опин Психиатрия. 2015;28:148-154. [PubMed] [Google Scholar]
65. Hu W, Chen Z. Роль гистамина и лигандов его рецепторов в расстройствах центральной нервной системы: обновление. Фармакол Тер. 2017;175:116-132. [PubMed] [Академия Google]
Антигистаминные препараты усиливают противовоспалительное действие дексаметазона. Влияние на опосредованную глюкокортикоидными рецепторами экспрессию генов, связанных с воспалением
1. Furman D., Campisi J., Verdin E., Carrera-Bastos P. , Targ S., Franceschi C., Ferrucci L., Gilroy D.W., Fasano А., Миллер Г.В. и соавт. Хроническое воспаление в этиологии болезней на протяжении всей жизни. Нац. Мед. 2019; 25:1822–1832. doi: 10.1038/s41591-019-0675-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Targ S., Franceschi C., Ferrucci L., Gilroy D.W., Fasano А., Миллер Г.В. и соавт. Хроническое воспаление в этиологии болезней на протяжении всей жизни. Нац. Мед. 2019; 25:1822–1832. doi: 10.1038/s41591-019-0675-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Бутторфф К., Рудер Т., Бауман М. Множественные хронические заболевания в США. РЭНД Корпорация; Санта-Моника, Калифорния, США: 2017. [Google Scholar]
3. Барнс П. Дж. Как кортикостероиды контролируют воспаление: лекция на приз Quintiles 2005. Br. Дж. Фармакол. 2006; 148: 245–254. doi: 10.1038/sj.bjp.0706736. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Clark A.R., Belvisi M.G. Карты и легенды: Поиски диссоциированных лигандов глюкокортикоидного рецептора. Фармакол. тер. 2012; 134:54–67. doi: 10.1016/j.pharmthera.2011.12.004. [PubMed] [CrossRef] [Академия Google]
5. Николаидес Н.К., Галата З., Кино Т., Хрусос Г.П., Чармандари Э. Глюкокортикоидный рецептор человека: молекулярная основа биологической функции. Стероиды. 2010; 75:1–12. doi: 10.1016/j.steroids.2009.09.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Стероиды. 2010; 75:1–12. doi: 10.1016/j.steroids.2009.09.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Rhen T., Cidlowski J.A. Противовоспалительное действие глюкокортикоидов — новые механизмы действия старых препаратов. Н. англ. Дж. Мед. 2005; 353:1711–1723. doi: 10.1056/NEJMra050541. [PubMed] [CrossRef] [Google Scholar]
7. Огава С., Лозак Дж., Беннер С., Паскуаль Г., Тангирала Р.К., Вестин С., Хоффманн А., Субраманиам С., Дэвид М., Розенфельд М.Г. и др. Молекулярные детерминанты перекрестных помех между ядерными рецепторами и толл-подобными рецепторами. Клетка. 2005; 122: 707–721. doi: 10.1016/j.cell.2005.06.029. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Reily M.M., Pantoja C., Hu X., Chinenov Y., Rogatsky I. Взаимодействие GRIP1:IRF3 как мишень для глюкокортикоидных рецепторов иммуносупрессия. EMBO J. 2006; 25: 108–117. doi: 10.1038/sj.emboj.7600919. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Де Босшер К., Хегеман Г., Элеваут Д. Борьба с воспалением с помощью селективных модуляторов глюкокортикоидных рецепторов. Курс. мнение Фармакол. 2010;10:497–504. doi: 10.1016/j.coph.2010.04.007. [PubMed] [CrossRef] [Google Scholar]
Де Босшер К., Хегеман Г., Элеваут Д. Борьба с воспалением с помощью селективных модуляторов глюкокортикоидных рецепторов. Курс. мнение Фармакол. 2010;10:497–504. doi: 10.1016/j.coph.2010.04.007. [PubMed] [CrossRef] [Google Scholar]
10. Гласс С.К., Сайджо К. Пути трансрепрессии ядерных рецепторов, которые регулируют воспаление в макрофагах и Т-клетках. Нац. Преподобный Иммунол. 2010;10:365–376. doi: 10.1038/nri2748. [PubMed] [CrossRef] [Google Scholar]
11. Ньютон Р., Холден Н.С. Разделение трансрепрессии и трансактивации: неприятный развод для глюкокортикоидного рецептора? Мол. Фармакол. 2007; 72: 799–809. doi: 10.1124/моль.107.038794. [PubMed] [CrossRef] [Google Scholar]
12. Schäcke H., Rehwinkel H., Asadullah K. Диссоциированные лиганды глюкокортикоидных рецепторов: соединения с улучшенным терапевтическим индексом. Курс. мнение расследование Наркотики. 2005; 6: 503–507. [PubMed] [Google Scholar]
13. Клейман А., Хюбнер С., Родригес Паркитна Дж. М., Нойманн А. , Хофер С., Вейганд М. А., Бауэр М., Шмид В., Шютц Г., Либерт К., и другие. Димеризация глюкокортикоидных рецепторов необходима для выживания при септическом шоке за счет подавления интерлейкина-1 в макрофагах. FASEB J. 2012; 26: 722–729.. doi: 10.1096/fj.11-192112. [PubMed] [CrossRef] [Google Scholar]
, Хофер С., Вейганд М. А., Бауэр М., Шмид В., Шютц Г., Либерт К., и другие. Димеризация глюкокортикоидных рецепторов необходима для выживания при септическом шоке за счет подавления интерлейкина-1 в макрофагах. FASEB J. 2012; 26: 722–729.. doi: 10.1096/fj.11-192112. [PubMed] [CrossRef] [Google Scholar]
14. Tuckermann J.P., Kleiman A., Moriggl R., Spanbroek R., Neumann A., Illing A., Clausen B.E., Stride B., Förster I., Habericht A.J.R. , и другие. Макрофаги и нейтрофилы являются мишенями для подавления иммунитета глюкокортикоидами при контактной аллергии. Дж. Клин. Вкладывать деньги. 2007; 117:1381–1390. doi: 10.1172/JCI28034. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Vandevyver S., Dejager L., Van Bogaert T., Kleyman A., Liu Y., Tuckermann J., Libert C. Димеризация глюкокортикоидных рецепторов индуцирует MKP1 для защиты от TNF-индуцированного воспаления. Дж. Клин. Вкладывать деньги. 2012;122:2130–2140. doi: 10.1172/JCI60006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Чи Х., Флавелл Р.А. Ацетилирование MKP-1 и контроль воспаления. науч. Сигнал. 2008;1:pe44. doi: 10.1126/scisignal.141pe44. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Чи Х., Флавелл Р.А. Ацетилирование MKP-1 и контроль воспаления. науч. Сигнал. 2008;1:pe44. doi: 10.1126/scisignal.141pe44. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
17. Ayroldi E., Cannarile L., Migliorati G., Nocentini G., Delfino D.V., Riccardi C. Механизмы противовоспалительного действия глюкокортикоидов : Геномное и негеномное вмешательство в сигнальные пути MAPK. FASEB J. 2012; 26:4805–4820. doi: 10.1096/fj.12-216382. [PubMed] [CrossRef] [Академия Google]
18. Vandevyver S., Dejager L., Tuckermann J., Libert C. Новое понимание противовоспалительных механизмов глюкокортикоидов: новая роль трансактивации, опосредованной глюкокортикоидными рецепторами. Эндокринология. 2013; 154:993–1007. doi: 10.1210/en.2012-2045. [PubMed] [CrossRef] [Google Scholar]
19. Quax R.A., Manenschijn L., Koper J.W., Hazes J.M., Lamberts S.W.J., van Rossum E.F.C., Feelders R.A. Чувствительность к глюкокортикоидам в норме и при патологии. Нац. Преподобный Эндокринол. 2013;9: 670–686. doi: 10.1038/nrendo.2013.183. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1038/nrendo.2013.183. [PubMed] [CrossRef] [Google Scholar]
20. Thiele S., Ziegler N., Tsourdi E., De Bosscher K., Tuckermann J., Hofbauer L., Rauner M. Избирательная модуляция глюкокортикоидных рецепторов поддерживает минеральную плотность кости у мышей. Дж. Боун Шахтер. Рез. 2012;27:2242–2250. doi: 10.1002/jbmr.1688. [PubMed] [CrossRef] [Google Scholar]
21. Бойс Б.Ф., Син Л. Путь RANKL/RANK/OPG. Курс. Остеопорос. Отчет 2007; 5: 98–104. doi: 10.1007/s11914-007-0024-y. [PubMed] [CrossRef] [Академия Google]
22. Маклафлин Ф., Макинтош Дж., Хейс Б.П., Макларен А., Уингс И.Дж., Салмон П., Хамфрис Дж., Мелдрам Э., Фэрроу С.Н. Глюкокортикоид-индуцированная остеопения у мышей по оценке гистоморфометрии, микрокомпьютерной томографии и биохимических маркеров. Кость. 2002; 30: 924–930. doi: 10.1016/S8756-3282(02)00737-8. [PubMed] [CrossRef] [Google Scholar]
23. Hofbauer LC, Gori F., Riggs BL, Lacey DL, Dunstan CR, Spelsberg TC, Khosla S. Стимуляция лиганда остеопротегерина и ингибирование продукции остеопротегерина глюкокортикоидами в остеобластах человека. клетки линии: потенциальные паракринные механизмы остеопороза, вызванного глюкокортикоидами. Эндокринология. 1999;140:4382–4389. doi: 10.1210/эндо.140.10.7034. [PubMed] [CrossRef] [Google Scholar]
клетки линии: потенциальные паракринные механизмы остеопороза, вызванного глюкокортикоидами. Эндокринология. 1999;140:4382–4389. doi: 10.1210/эндо.140.10.7034. [PubMed] [CrossRef] [Google Scholar]
24. Zappia C.D., Granja-Galeano G., Fernández N., Shayo C., Davio C., Fitzsimons CP, Monczor F. Эффекты передачи сигналов гистаминового рецептора h2 на глюкокортикоидный рецептор активность. Роль канонических и неканонических путей. науч. Отчет 2015; 5:17476. doi: 10.1038/srep17476. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Zappia C.D., Soto A., Granja-Galeano G., Fenoy I., Fernandez N., Davio C.A., Shayo C., Fitzsimons C.P., Гольдман А., Монцор Ф. Азеластин усиливает антиастматический эффект дексаметазона на мышиной модели астмы. Фармакол. Рез. Перспектива. 2019;7:e00531. doi: 10.1002/prp2.531. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Заппиа К.Д., Монцор Ф. Терапевтическая ценность совместного лечения глюкокортикоидами и антигистаминными препаратами. Обоснование и перспективы. Фармакол. Рез. Перспектива. 2019;7:e00530. doi: 10.1002/prp2.530. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
Обоснование и перспективы. Фармакол. Рез. Перспектива. 2019;7:e00530. doi: 10.1002/prp2.530. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
27. Godowski P.J., Rusconi S., Miesfeld R., Yamamoto K.R. Мутанты глюкокортикоидного рецептора, которые являются конститутивными активаторами усиления транскрипции. Природа. 1987;325:365–368. doi: 10.1038/325365a0. [PubMed] [CrossRef] [Google Scholar]
28. Schmittgen T.D., Livak K.J. Анализ данных ПЦР в реальном времени сравнительным методом C(T). Нац. протокол 2008;3:1101–1108. doi: 10.1038/nprot.2008.73. [PubMed] [CrossRef] [Google Scholar]
29. Ghosh C.C., Ramaswami S., Juvekar A., Vu H.-Y., Galdieri L., Davidson D., Vancurova I. Геноспецифическая репрессия провоспалительных цитокинов в макрофагах человека, стимулированных ядерным IκBα J. Immunol. 2010;185:3685–3693. doi: 10.4049/jimmunol.0
0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 30. Гркович А., Джонсон К.А., Бучински М. В., Деннис Э.А. Липополисахарид-индуцированная экспрессия циклооксигеназы-2 в макрофагах U937 человека зависит от фосфатидной кислоты фосфогидролазы-1. Дж. Биол. хим. 2006; 281:32978–32987. doi: 10.1074/jbc.M605935200. [PubMed] [CrossRef] [Google Scholar]
В., Деннис Э.А. Липополисахарид-индуцированная экспрессия циклооксигеназы-2 в макрофагах U937 человека зависит от фосфатидной кислоты фосфогидролазы-1. Дж. Биол. хим. 2006; 281:32978–32987. doi: 10.1074/jbc.M605935200. [PubMed] [CrossRef] [Google Scholar]
31. Нисида Т., Такано М., Каваками Т., Нишино Н., Накаи С., Хираи Ю. Транскрипция гена интерлейкина 1 бета индуцируется с помощью PMA и ингибируется дексаметазоном в U937 ячеек. Биохим. Биофиз. Рез. коммун. 1988; 156: 269–274. doi: 10.1016/S0006-291X(88)80835-0. [PubMed] [CrossRef] [Google Scholar]
32. Schreiber J., Jenner R.G., Murray H.L., Gerber G.K., Gifford D.K., Young R.A. Координированное связывание членов семейства NF-KappaB в ответ клеток человека на липополисахарид. проц. Натл. акад. науч. США. 2006; 103: 5899–5904. doi: 10.1073/pnas.0510996103. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
33. Шариф О., Большаков В.Н., Рейнс С., Ньюхэм П., Перкинс Н.Д. Транскрипционное профилирование LPS-индуцированного ответа NF-KappaB в макрофагах. БМС Иммунол. 2007; 8:1. дои: 10.1186/1471-2172-8-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
БМС Иммунол. 2007; 8:1. дои: 10.1186/1471-2172-8-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Чеканска Э.М., Стоддарт М.Дж., Ричардс Р.Г., Хейс Дж.С. В поисках модели клеток остеобластов для исследований in vitro. Евро. Клетка. Матер. 2012; 24:1–17. doi: 10.22203/eCM.v024a01. [PubMed] [CrossRef] [Google Scholar]
35. Fitzsimons C.P., Monczor F., Fernández N., Shayo C., Davio C. Мепирамин, обратный агонист гистаминового h2-рецептора, преимущественно связывается с формой, связанной с G-белком. рецептора и связывает G-белок. Дж. Биол. хим. 2004; 279:34431–34439. doi: 10.1074/jbc.M400738200. [PubMed] [CrossRef] [Академия Google]
36. Bakker R.A., Schoonus S.B., Smit M.J., Timmerman H., Leurs R. Активация гистаминового H(1)-рецептора ядерного фактора-каппа B: роль G бета гамма- и G альфа(q/11)- субъединицы в конститутивной и опосредованной агонистами передаче сигналов. Мол. Фармакол. 2001;60:1133–1142. doi: 10.1124/мол.60.5.1133. [PubMed] [CrossRef] [Google Scholar]
37. Баккер Р.А., Николас М.В., Смит Т.Т., Бурштейн Э.С., Хакселл Ю., Тиммерман Х., Леурс Р., Бранн М.Р., Вайнер Д.М. Фармакология in vitro клинически используемых препаратов, действующих на центральную нервную систему, в качестве обратных агонистов Н(1)-рецепторов. Дж. Фармакол. Эксп. тер. 2007; 322: 172–179.. doi: 10.1124/jpet.106.118869. [PubMed] [CrossRef] [Google Scholar]
Баккер Р.А., Николас М.В., Смит Т.Т., Бурштейн Э.С., Хакселл Ю., Тиммерман Х., Леурс Р., Бранн М.Р., Вайнер Д.М. Фармакология in vitro клинически используемых препаратов, действующих на центральную нервную систему, в качестве обратных агонистов Н(1)-рецепторов. Дж. Фармакол. Эксп. тер. 2007; 322: 172–179.. doi: 10.1124/jpet.106.118869. [PubMed] [CrossRef] [Google Scholar]
38. Бурги В., Эчеверрия Э.Б., Заппиа К.Д., Диас Небреда А., Риполл С., Гомес Н., Шайо К., Давио К.А., Монцор Ф., Фернандес Н.К. Предвзятый агонизм гистаминового рецептора h2: десенсибилизация, интернализация и активация MAPK, вызванная антигистаминными препаратами. Евро. Дж. Фармакол. 2021;896:173913. doi: 10.1016/j.ejphar.2021.173913. [PubMed] [CrossRef] [Google Scholar]
39. Moncor F., Fernandez N., Fitzsimons CP, Shayo C., Davio C. Антигистаминергические средства и обратный агонизм: потенциальное терапевтическое применение. Евро. Дж. Фармакол. 2013; 715:26–32. doi: 10.1016/j.ejphar.2013.06.027. [PubMed] [CrossRef] [Академия Google]
40. John S., Johnson T.A., Sung M.-H., Biddie S.C., Trump S., Koch-Paiz C.A., Davis S.R., Walker R., Meltzer P.S., Hager G.L. Кинетическая сложность глобального ответа на глюкокортикоид действие рецептора. Эндокринология. 2009; 150:1766–1774. doi: 10.1210/en.2008-0863. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
John S., Johnson T.A., Sung M.-H., Biddie S.C., Trump S., Koch-Paiz C.A., Davis S.R., Walker R., Meltzer P.S., Hager G.L. Кинетическая сложность глобального ответа на глюкокортикоид действие рецептора. Эндокринология. 2009; 150:1766–1774. doi: 10.1210/en.2008-0863. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Bolton E.C., So A.Y., Chaivorapol C., Haqq C.M., Li H., Yamamoto K.R. Клеточно- и геноспецифическая регуляция первичных генов-мишеней андрогенным рецептором. Гены Дев. 2007;21:2005–2017. doi: 10.1101/gad.1564207. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Герц Дж., Савич Д., Варлей К.Е., Партридж Э.К., Сафи А., Джейн П., Купер Г.М., Редди Т.Е., Кроуфорд Г.Е., Майерс Р.М. Отличительные свойства специфичных для типа клеток и общих сайтов связывания факторов транскрипции. Мол. Клетка. 2013;52:25–36. doi: 10.1016/j.molcel.2013.08.037. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
43. Рогацкий И., Ван Дж.-К. , Деринк М.К., Нонака Д.Ф., Ходабахш Д.Б., Хак С.М., Даримонт Б.Д., Гарабедян М.Дж., Ямамото К.Р. Целенаправленное использование регуляторных поверхностей транскрипции глюкокортикоидным рецептором. проц. Натл. акад. науч. США. 2003; 100:13845–13850. doi: 10.1073/pnas.2336092100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Деринк М.К., Нонака Д.Ф., Ходабахш Д.Б., Хак С.М., Даримонт Б.Д., Гарабедян М.Дж., Ямамото К.Р. Целенаправленное использование регуляторных поверхностей транскрипции глюкокортикоидным рецептором. проц. Натл. акад. науч. США. 2003; 100:13845–13850. doi: 10.1073/pnas.2336092100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. So A.Y.-L., Chaivorapol C., Bolton E.C., Li H., Yamamoto K.R. Детерминанты клеточно- и ген-специфичной регуляции транскрипции глюкокортикоидным рецептором. Генетика PLoS. 2007;3:e94. doi: 10.1371/journal.pgen.0030094. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
45. Коллингвуд Т.Н., Урнов Ф.Д., Вольф А.П. Ядерные рецепторы: коактиваторы, корепрессоры и ремоделирование хроматина в контроле транскрипции. Дж. Мол. Эндокринол. 1999;23:255–275. doi: 10.1677/jme.0.0230255. [PubMed] [CrossRef] [Google Scholar]
46. Moncor F., Chatzopoulou A., Zappia C.D., Houtman R., Meijer O.C., Fitzsimons C.P. Модель взаимодействия глюкокортикоидных рецепторов с корегуляторами предсказывает регуляцию транскрипции генов-мишеней. Передний. Фармакол. 2019;10:214. doi: 10.3389/fphar.2019.00214. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Передний. Фармакол. 2019;10:214. doi: 10.3389/fphar.2019.00214. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Smoak K.A., Cidlowski J.A. Механизмы передачи сигналов глюкокортикоидных рецепторов при воспалении. мех. Старение Дев. 2004;125:697–706. doi: 10.1016/j.mad.2004.06.010. [PubMed] [CrossRef] [Google Scholar]
48. Цапруни Л.Г., Ито К., Адкок И.М., Панчард Н. Подавление экспрессии интерлейкина (ИЛ)-8, индуцированной липополисахаридом и фактором некроза опухоли-альфа, глюкокортикоидами включает изменения при ацетилировании промотора IL-8. клин. Эксп. Иммунол. 2007; 150:151–157. doi: 10.1111/j.1365-2249.2007.03484.x. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
49. Ниссен Р., Ямамото К. Глюкокортикоидный рецептор ингибирует NFκB, препятствуя серин-2 фосфорилированию карбоксиконцевого домена РНК-полимеразы II. Гены Дев. 2000;14:2314–2329. doi: 10.1101/gad.827900. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Ито К., Барнс П.Дж., Адкок И.М. Рекрутирование гистондеацетилазы 2 глюкокортикоидным рецептором ингибирует интерлейкин-1бета-индуцированное ацетилирование гистона h5 на лизинах 8 и 12. Мол. Клетка. биол. 2000;20:6891–6903. doi: 10.1128/MCB.20.18.6891-6903.2000. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Ито К., Барнс П.Дж., Адкок И.М. Рекрутирование гистондеацетилазы 2 глюкокортикоидным рецептором ингибирует интерлейкин-1бета-индуцированное ацетилирование гистона h5 на лизинах 8 и 12. Мол. Клетка. биол. 2000;20:6891–6903. doi: 10.1128/MCB.20.18.6891-6903.2000. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
51. Чо И.Дж., Ким С.Г. Новый митоген-активируемый протеинкиназа фосфатаза-1 и глюкокортикоидный рецептор (GR), взаимодействующий с протеин-1-зависимым комбинаторным механизмом трансрепрессия ГР. Мол. Эндокринол. 2009 г.;23:86–99. doi: 10.1210/me.2008-0257. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
52. Barrios-Rodiles M., Tiraloche G., Chadee K. Липополисахарид модулирует циклооксигеназу-2 транскрипционно и посттранскрипционно в макрофагах человека независимо от эндогенного IL-1 бета и ФНО-альфа. Дж. Иммунол. 1999; 163: 963–969. [PubMed] [Google Scholar]
53. Schäcke H., Döcke WD, Asadullah K. Механизмы побочных эффектов глюкокортикоидов. Фармакол. тер. 2002;96:23–43. doi: 10.1016/S0163-7258(02)00297-8. [PubMed] [CrossRef] [Google Scholar]
Фармакол. тер. 2002;96:23–43. doi: 10.1016/S0163-7258(02)00297-8. [PubMed] [CrossRef] [Google Scholar]
54. Whittier X., Saag K.G. Глюкокортикоид-индуцированный остеопороз. Реум. Дис. клин. Н. Ам. 2016;42:177–189. doi: 10.1016/j.rdc.2015.08.005. [PubMed] [CrossRef] [Google Scholar]
55. Hardy R.S., Zhou H., Seibel M.J., Cooper M.S. Глюкокортикоиды и кость: последствия эндогенного и экзогенного избытка и заместительной терапии. Эндокр. 2018; 39: 519–548. doi: 10.1210/er.2018-00097. [PubMed] [CrossRef] [Академия Google]
56. Биос-Дюплан М., Барух Б., Ди М., де Вернежуль М.-К., Саффар Ж.-Л. Гистамин способствует остеокластогенезу за счет дифференциальной экспрессии гистаминовых рецепторов на остеокластах и остеобластах. Являюсь. Дж. Патол. 2009; 174:1426–1434. doi: 10.2353/ajpath.2009.080871. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
57. Икава Ю., Йонекава Т., Окуни Ю., Курибаяси М., Фукино К., Уэно К. Сравнительное исследование активности гистамина при дифференцировке остеобластов и остеокластов.