Роль блокатора лейкотриеновых рецепторов в восстановлении носового дыхания у больных полипозным риносинуситом
Несмотря на большое количество исследований, посвященных вопросам лечения полипозного риносинусита (ПРС), одним из самых сложных и спорных вопросов этой проблемы остается поиск наиболее эффективных методов устранения назальной обструкции, позволяющих максимально длительно сохранить адекватность носового дыхания, вследствие нарушения которого в организме человека развивается как органная, так и тканевая гипоксия.
Опыт показывает, что хирургическое лечение полипоза является симптоматическим, стандартно устраняя «конечный» результат патологического процесса — нарушение носового дыхания, не прерывает развитие полипоза, а следовательно практически не влияет на продолжительность ремиссии. Число послеоперационных рецидивов остается высоким и нередко достигает 40—50% с частотой рецидивирования 2—3 и более раз в год [1—3].
Медикаментозное лечение ПРС в отличие от хирургического носит патогенетический характер, так как при этом имеет место возможность воздействовать на различные звенья развития заболевания [4—7].
Исследованиями последних десятилетий установлено, что при формировании полипозного процесса немаловажную роль играют аллергия и воспаление, при которых происходят синтез и высвобождение целого ряда медиаторов, включая лейкотриены, характерные для поздней (хронической) фазы аллергического воспаления. Лейкотриены опосредуют свое действие через рецепторы на поверхности клеток респираторного эпителия и являются идеальной мишенью для терапевтической блокады аллергической реакции со стороны как верхних, так и нижних дыхательных путей. Именно это звено патогенеза полипоза остается малоизученным и почти недоступным для медикаментозного воздействия [8, 9].
Современная концепция «единых дыхательных путей», согласно которой ПРС рассматривается как одна из составляющих системной патологии дыхательного тракта, послужила основанием для использования при ПРС антилейкотриеновых препаратов, созданных и рекомендованных для лечения и профилактики бронхиальной астмы, аллергического ринита и астматической триады [10—13].
Сведения литературы о терапевтической значимости блокатора лейкотриеновых рецепторов при назальной обструкции у больных ПРС немногочисленны, базируются на небольшом числе наблюдений и весьма противоречивы. Оценка же эффективности антагониста лейкотриеновых рецепторов, как правило, не лишена субъективизма.
Цель — клинико-лабораторное и морфологическое обоснование возможности и эффективности персонифицированной фармакологической коррекции назальной обструкции у больных с ПРС.
Пациенты и методы
В соответствии с поставленной целью на основании эндоскопических, клинико-лабораторных и морфологических показателей изучена эффективность фармакологического контроля назальной обструкции с помощью блокатора лейкотриеновых рецепторов у 87 больных с ПРС, в возрасте от 22 до 76 лет, основной жалобой которых было нарушение носового дыхания.
Из исследования были исключены пациенты с хроническими гнойно-полипозными формами синусита как риногенного, так и одонтогенного происхождения.
Возраст 53% больных не превышал 50 лет. Женщин было несколько больше — 54%, мужчин — 46%.
У 65,5% пациентов был диагностирован первичный полипоз, у 34,5% — рецидивирующий, с частотой рецидивирования 3 и более раз в год.
Среди исследуемых 25,3% страдали бронхиальной астмой и получали лечение в соответствии с федеральными клиническими рекомендациями по диагностике и лечению данной патологии без применения превентивной терапии антагонистами лейкотриеновых рецепторов. Остальным был поставлен диагноз: аллергический ринит.
Неоднократно были оперированы по поводу ПРС 34,5% больных.
Контрольную группу составили 20 практически здоровых людей в возрасте 21—26 лет без нарушения носового дыхания и признаков аллергии.
Для объективной оценки и систематизации риноскопических данных была использована классификация И.Б. Солдатова и соавт. [14], в которой распространенность полипозного процесса имеет 4 стадии. Согласно этой классификации, у подавляющего большинства больных (70,1%) объем полипозной ткани в полости носа соответствовал III—IV стадии.
Характеризуя распространенность полипоза в околоносовых пазухах по классификации С.З. Пискунова и Г.З. Пискунова [15], в которой авторы также выделяют 4 стадии, мы установили, что у 75,8% больных распространенность полипоза в околоносовых пазухах по данным компьютерной томографии (КТ) соответствовала I—II стадии, т. е. не коррелировала с данными эндоскопии и существенно не влияла на носовое дыхание.
Объективная оценка назальной обструкции и процессов, происходящих в организме больных с ПРС, осуществлялась на основании данных передней активной риноманометрии, кислотно-щелочного состояния крови и динамики концентрации в сыворотке крови лейкотриена С4 (LTС4
Именно эти свойства данного медиатора определили выбор LTС4 в качестве маркера аллергического воспаления и эффективности антогониста лейкотриеновых рецепторов при лечении назальной обструкции у больных ПРС.
Объективная оценка динамики носового дыхания производилась с помощью серийного прессотахоспирографа ПТС-14П-01 отечественного производства.
Нормативные значения суммарного потока вдыхаемого воздуха по данным контрольной группы составили 700 мл/с, суммарного сопротивления — 0,14 Па/см3/с.
Для характеристики уровня гипоксии исследовали парциальное давление кислорода (рО2) и углекислого газа (рСО2) в крови на автоматическом анализаторе газов, электролитов и параметров КО-оксометрии картриджного типа PapidLab 1200.
Нормативное значение напряжения СО2 крови по данным контрольной группы составило 38,5 ммоль/л, нормативное значение напряжения О2 — 39 ммоль/л.
Для объективной оценки динамики аллергического воспаления у больных ПРС определяли концентрацию LTС
Для анализа данных применяли статистический пакет Statistica 10 фирмы «StatSoft».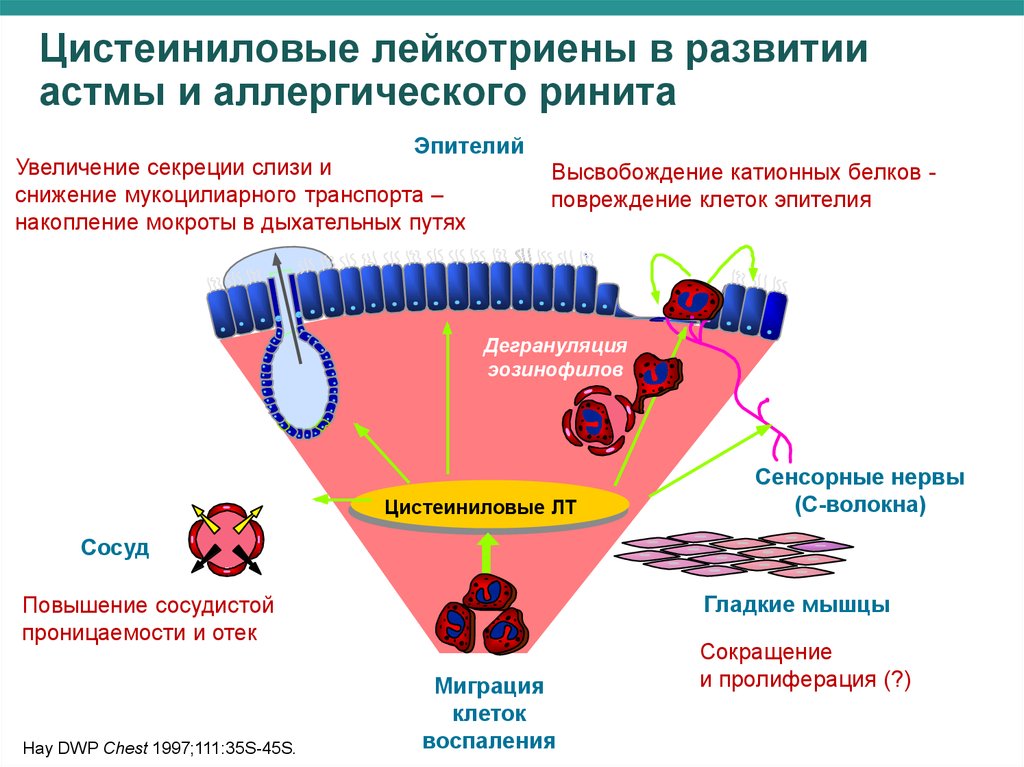 Использовались методы описательной статистики для определения средних значений, моды, стандартного отклонения, асимметрии, эксцесса и коэффициента вариации.
Использовались методы описательной статистики для определения средних значений, моды, стандартного отклонения, асимметрии, эксцесса и коэффициента вариации.
Для оценки значимости различий между средними выборочными значениями с учетом объема выборок и характера их распределения были использованы непараметрические методы: критерии Вилкоксона—Манна—Уитни, Крускала—Уоллиса и критерий χ
В качестве критериальной статистики использовалась верхняя область 5% распределений Вилкоксона, Крускала—Уоллиса и χ2 как более жесткая по сравнению с t-распределением для обеспечения большей точности оценок.
Несмотря на обилие научных работ, посвященных роли лейкотриенов в развитии многих заболеваний (бронхиальная астма, аллергический ринит, атопический дерматит, неспецифический язвенный колит и др.), в доступной нам литературе мы не встретили сообщений о количественных показателях концентрации лейкотриенов в сыворотке крови ни в норме, ни при патологии.
Результаты и обсуждение
Проведенные клинико-лабораторные исследования показали, что усиление назальной обструкции у больных с ПРС нарастало пропорционально росту концентрации в сыворотке крови LTС
Полученные результаты свидетельствовали о выраженности аллергического воспаления и были подтверждены гистологическим исследованием полипозной ткани, взятой при биопсии или удаленной при операции.
Морфологически определялась картина васкулита, резко выраженного полнокровия, краевого стояния лейкоцитов, лейкодиапедеза. В отечном основном веществе в большом количестве были видны рассеянные эозинофилы.
В отечном основном веществе в большом количестве были видны рассеянные эозинофилы.
Ввиду отсутствия до настоящего времени рекомендаций о длительности и дозировке применения монтелукаста натрия нами была определена схема лечения назальной обструкции у больных ПРС с непрерывным использованием минимальных доз (4—5 мг) препарата, рекомендованных для лечения аллергического ринита и бронхиальной астмы у детей в течение 18 мес [10, 18—20].
Терапевтический эффект блокатора лейкотриеновых рецепторов оценивался через 14 дней, 1 мес, 6 мес и 1 год по сравнению с исходными данными.
Установлено, что при использовании данного препарата у больных с ПРС наблюдалось уменьшение объема полипозной ткани, что существенно отразилось на состоянии носового дыхания и нашло свое отражение в показателях передней активной риноманометрии, кислотно-щелочного равновесия и концентрации в сыворотке крови LTС4.
Наиболее выраженный терапевтический эффект лечения наблюдался у больных с полипозом III—IV стадии (табл. 1, 2). Снижение концентрации LTС4 более интенсивно происходило в течение 1-го месяца.
1, 2). Снижение концентрации LTС4 более интенсивно происходило в течение 1-го месяца.
Таблица 1. Эффективность консервативного лечения назальной обструкции у больных с полипозом III стадии (n=43) Примечание. Здесь и в табл. 2: * — статистически значимые различия для p<0,05 по сравнению с состоянием до лечения.
Таблица 2. Эффективность консервативного лечения назальной обструкции у больных с полипозом IV стадии (n=18)
Через 2 нед у больных с III стадией полипоза концентрация LTС4 снизилась на 15,4±0,033%, через 1 мес от начала лечения — на 18,7±0,039%, достигнув значений II стадии полипоза. Через 6 мес концентрация лейкотриенов снизилась на 21,1±0,043%, а через 1 год — на 24,4±0,049% от первоначального значения.
Так же, как у больных с меньшей степенью распространенности полипоза, у больных с IV стадией снижение концентрации лейкотриена С4 наиболее интенсивно происходило в течение 1-го месяца лечения.
Через 2 нед концентрация LTС4 у больных с IV стадией снизилась на 30,9%, через 1 мес от начала лечения — на 43%, достигнув значений II стадии полипоза. Через 6 мес концентрация лейкотриенов снизилась на 45,5%, а через 1 год — на 46,9% от первоначального значения.
Через 6 мес концентрация лейкотриенов снизилась на 45,5%, а через 1 год — на 46,9% от первоначального значения.
Медленное снижение показателей кислотно-щелочного состояния при полипозе IV стадии свидетельствовало о глубине тканевой гипоксии.
В процессе лечения на фоне снижения концентрации LTС4 произошло качественное изменение состава взятой для исследования группы: если до лечения большинство (70,1%) больных составляли пациенты с III—IV стадией полипоза полости носа, то через 1 мес большинство (81,6%) больных имели I—II стадию полипоза.
Использование для лечения назальной обструкции полипозного генеза блокатора лейкотриеновых рецепторов позволило у 73,8% больных с III—IV стадией полипоза восстановить адекватность носового дыхания, не прибегая к хирургическому вмешательству, и добиться стабилизации процесса при динамическом наблюдении от 1,5 до 3 лет.
Эффективность использования блокатора лейкотриеновых рецепторов была подтверждена гистологически.
Установлено, что в результате лечения блокатором лейкотриеновых рецепторов как при первичном, так и рецидивирующем полипозе, в том числе и при наличии бронхиальной астмы, исчез экссудативный компонент аллергического воспаления, о чем свидетельствовало отсутствие отека, полнокровия, значительное уменьшение эозинофильной инфильтрации.
Полученные результаты послужили морфологическим обоснованием возможности и эффективности использования минимальных доз блокатора лейкотриеновых рецепторов для фармакологического контроля назальной обструкции у больных ПРС и легли в основу изобретения «Способ лечения и профилактики назальной обструкции у больных полипозным риносинуситом» (патент № 2499597 от 27.11.13).
Ввиду малой эффективности проводимого консервативного лечения в течение 2 мес 26 из 87 (29,9%) больным с ПРС была выполнена эндоназальная эндоскопическая полисинусотомия.
Выводы
1. Концентрация лейкотриена С4 в сыворотке крови при ПРС пропорциональна усилению назальной обструкции, в связи с чем LTС4 может служить маркером аллергического воспаления и эффективности блокатора лейкотриеновых рецепторов при лечении назальной обструкции у больных с ПРС.
2. Динамика морфологических изменений, происходящих в полипозной ткани при использовании блокатора лейкотриеновых рецепторов, является морфологическим обоснованием возможности и эффективности использования препаратов данной фармакологической группы для персонифицированной фармакологической коррекции назальной обструкции у больных с ПРС.
3. Использование блокатора лейкотриеновых рецепторов для фармакологической коррекции назальной обструкции у больных с ПРС позволило у 70,1% больных с полипозом полости носа восстановить адекватность носового дыхания, не прибегая к хирургическому вмешательству, и добиться стабилизации процесса при динамическом наблюдении от 1,5 до 3 лет.
4. Неэффективность проводимого консервативного лечения при хроническом ПРС указывает на необходимость комплексного подхода к лечению данного заболевания.
Авторы заявляют об отсутствии конфликта интересов.
Антагонисты лейкотриеновых рецепторов в достижении длительного контроля бронхиальной астмы (обзор эффективности монтелукаста)
Актуальность проблемы
Болезни органов дыхания включают разрозненную группу заболеваний, характеризующихся широкой распространенностью среди разных слоев населения и высоким уровнем инвалидизации. По данным Всемирной организации здравоохранения, во всем мире такими заболеваниями, как бронхиальная астма (БА) и аллергический ринит (АР) страдают около 300 и 400 млн человек соответственно, хронической обструктивной болезнью легких — 210 млн. На все остальные заболевания респираторной системы приходится немногим более 50 млн случаев. По количеству времени нетрудоспособного состояния ввиду болезни хроническая обструктивная болезнь легких и БА находятся на 10-м и 22-м местах среди всех заболеваний соответственно. В связи с этим разработка эффективных стратегий лечения пациентов с патологией органов дыхания является одной из приоритетных задач современной медицины.
По данным Всемирной организации здравоохранения, во всем мире такими заболеваниями, как бронхиальная астма (БА) и аллергический ринит (АР) страдают около 300 и 400 млн человек соответственно, хронической обструктивной болезнью легких — 210 млн. На все остальные заболевания респираторной системы приходится немногим более 50 млн случаев. По количеству времени нетрудоспособного состояния ввиду болезни хроническая обструктивная болезнь легких и БА находятся на 10-м и 22-м местах среди всех заболеваний соответственно. В связи с этим разработка эффективных стратегий лечения пациентов с патологией органов дыхания является одной из приоритетных задач современной медицины.
Контроль эффективности терапии БА
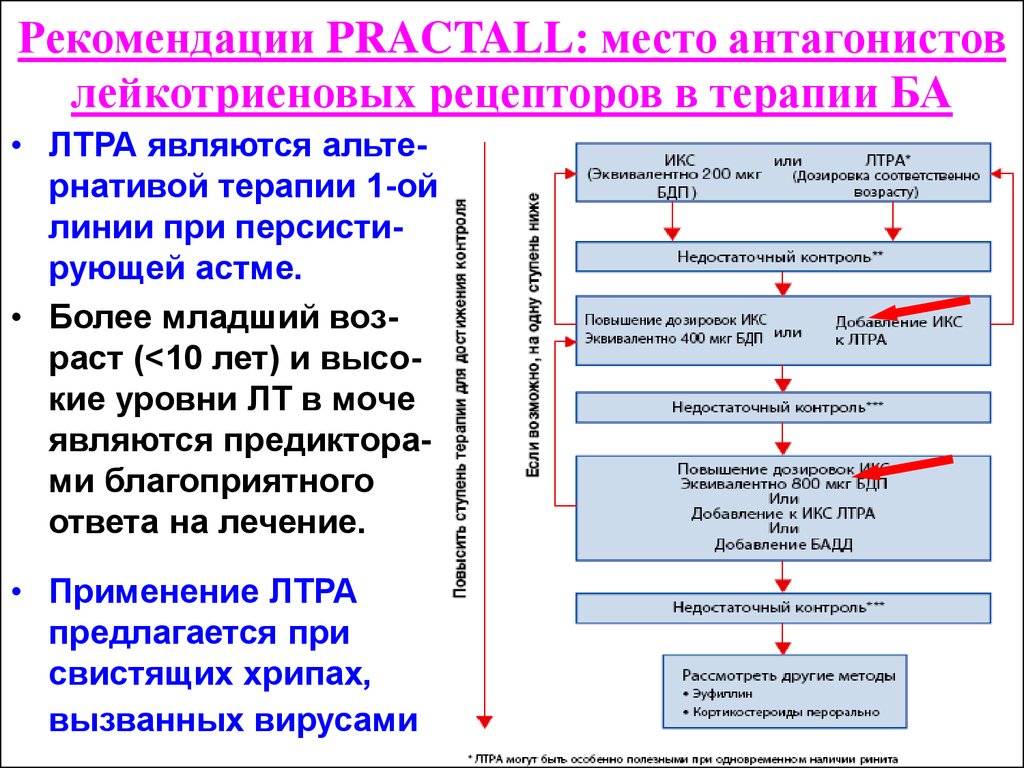
На сегодняшний день основным методом контроля БА как у взрослых, так и у детей является фармакологическая терапия. Для этого рекомендованы препараты с доказанной эффективностью при длительном применении: ингаляционные глюкокортикоиды (ИГ), кромоны, иммуномодуляторы, модификаторы активности лейкотриенов, агонисты β2— адренорецепторов, метилксантины. Проводимая терапия должна иметь высокий профиль безопасности.
Проводимая терапия должна иметь высокий профиль безопасности.
Согласно данным современных руководств, оценку эффективности контроля БА проводят на основании клинических показателей (отсутствие дневных и ночных приступов, необходимости экстренного применения препаратов, тяжелых обострений заболевания, ограничений в различных видах активности (включая возникновение симптомов после физической нагрузки), а также таких функциональных параметров, как объем форсированного выдоха за 1 с (ОФВ1) и пиковая объемная скорость выдоха (ПОСвыд) (табл. 1) (Kraft M. et al., 2001; British Thoracic Society, Scottish Intercollegiate Guidelines Network, 2008).
Таблица 1 Уровни контроля БА (модифицировано по: FitzGerald M. et al., 2012)
| Показатель | Контролируемая | Частично контролируемая (наличие хотя бы 1-й характеристики) | Неконтролируемая |
|---|---|---|---|
| Дневные симптомы | ≤2 раза в неделю | >2 раза в неделю | ≥3 из указанных характеристик для частично контролируемой БА |
| Ограничения в активности | Отсутствуют | Любые ограничения | |
| Ночные симптомы/пробуждения | Отсутствуют | Любые симптомы | |
| Применение препаратов неотложной помощи/облегчающих симптомы | ≤2 раза в неделю | >2 раза в неделю | |
| Функция легких (ОФВ1, ПОСвыд) | Норма | <80% ожидаемой | |
| Обострения | Отсутствуют | ≥1 в год | 1 на протяжении любой недели* |
Модификаторы активности лейкотриенов.
 Монтелукаст
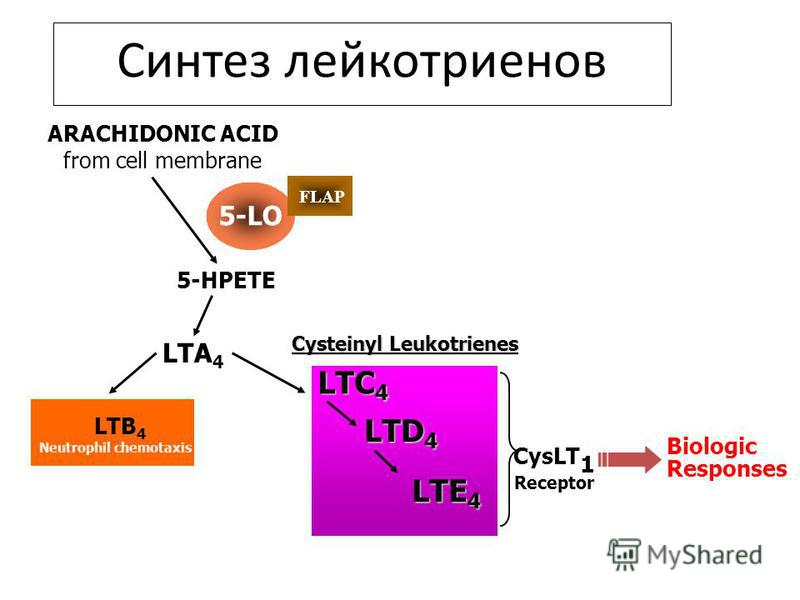
МонтелукастОсобый интерес в настоящее время представляет группа модификаторов активности лейкотриенов, применяемых главным образом в терапии при БА и АР. Лейкотриены, включая цистеиниловые (LTC4, LTD4, LTE4) и LTB4, являются провоспалительными медиаторами, синтезируемыми из арахидоновой кислоты по липоксигеназному пути. Лейкотриены относят к медиаторам ранней фазы аллергической реакции немедленного типа, участвующим в сокращении гладких мышц дыхательных путей, повышении сосудистой проницаемости, секреции слизи и плазматической экссудации (Hammarström S., 1983). Фармакологические исследования показали, что цистеиниловые лейкотриены активируют рецепторы по меньшей мере двух типов — CysLT1 и CysLT2 (Lynch K.R. et al., 1999).
Будучи мощными эндогенными бронхоконстрикторами, LTC4, LTD4 и LTE4 имеют схожую активность в плане сокращения гладких мышц, что подтверждается исследованиями с проведением бронхопровокации у здоровых добровольцев (Dahlén S. E., 2006). Первые же клинические испытания препаратов, блокирующих лейкотриеновые рецепторы, продемонстрировали протекторный эффект в отношении бронхокострикции (Smith L.J. et al., 1990; De Lepeleire I. et al., 1997).
E., 2006). Первые же клинические испытания препаратов, блокирующих лейкотриеновые рецепторы, продемонстрировали протекторный эффект в отношении бронхокострикции (Smith L.J. et al., 1990; De Lepeleire I. et al., 1997).
Модификаторы активности лейкотриенов представлены двумя классами препаратов — ингибиторами 5-липоксигеназы и антагонистами лейкотриеновых рецепторов (АЛР) (табл. 2). Механизм действия последних связан с селективным ингибированием CysLT1. В отличие от ингибиторов 5-липоксигеназы, эта группа препаратов не оказывает влияния на LTВ4.
Таблица 2 Основные фармакологические характеристики АЛР (модифицировано по: Montuschi P. et al., 2007)
| Препарат | Механизм действия | Показания | Область применения | Побочные эффекты | Комментарии |
|---|---|---|---|---|---|
| Монтелукаст | Антагонист рецепторов CysLT1 | БА АР | В качестве монотерапии у детей с умеренной персистирующей БА БА физического напряжения БА-АСК* Аллергическая БА В качестве дополнения к терапии ИГ | Головная боль Абдоминальная боль Возможна связь с синдромом Чарга — Стросса | Наиболее часто применяемый препарат данной группы |
| Зафирлукаст | Антагонист рецепторов CysLT1 | БА | БА физического напряжения БА-АСК В качестве дополнения к терапии ИГ | Головная боль Абдоминальная боль Повышение уровня печеночных ферментов Возможна связь с синдромом Чарга — Стросса | Первый одобренный антагонист рецепторов CysLT1 Наличие лекарственного и пищевого взаимодействия |
| Зилеутон | Ингибитор 5-липоксигеназы | БА | БА физического напряжения БА-АСК | Головная боль Абдоминальная боль Повышение уровня печеночных ферментов | Часто плохой комплаенс Гепатотоксичность |
Наиболее часто назначаемым АЛР в США и странах Европы является монтелукаст, одобренный к применению при БА и АР (Montuschi P. et al., 2007). В отличие от другого антагониста CysLT1 — зафирлукаста — данный препарат не проявляет лекарственного и пищевого взаимодействия. Для достижения оптимального эффекта достаточно его приема с частотой 1 раз в сутки (Dahlén S.E., 2006). У взрослых лиц биодоступность препарата при пероральном приеме составляет 64%, пик концентрации в плазме крови достигается в течение 3–4 ч (Diamant Z. et al., 2009; Компендиум 2012 — лекарственные препараты, 2012).
et al., 2007). В отличие от другого антагониста CysLT1 — зафирлукаста — данный препарат не проявляет лекарственного и пищевого взаимодействия. Для достижения оптимального эффекта достаточно его приема с частотой 1 раз в сутки (Dahlén S.E., 2006). У взрослых лиц биодоступность препарата при пероральном приеме составляет 64%, пик концентрации в плазме крови достигается в течение 3–4 ч (Diamant Z. et al., 2009; Компендиум 2012 — лекарственные препараты, 2012).
Монтелукаст при БА
Z. Diamant и соавторы (1999) изучили протекторный эффект монтелукаста в отношении раннего и позднего аллерген-индуцированного астматического ответа. Исследуемая выборка состояла из 12 больных БА мужского пола в возрасте 20–34 лет. Все испытуемые приняли три дозы монтелукаста (10 мг) или плацебо за 36 и 12 ч до и 12 ч — после экспозиции аллергена. Ответ на аллерген оценивали путем измерения ОФВ1. На протяжении каждого исследовательского периода проводили исследование мокроты, выделение которой индуцировали 4,5% раствором хлорида натрия за 24 ч до и после экспозиции аллергена. Как показали результаты, применение монтелукаста ассоциировано со значимым угнетением раннего и позднего аллерген-индуцированного астматического ответа (снижение области под кривой в течение 0–3 ч на 75,4% и в течение 3–8 ч — на 56,9%). Достоверных изменений количества эозинофилов в мокроте в группе монтелукаста и плацебо не отмечено, что, по мнению авторов, связано с недостаточной продолжительностью терапии.
Как показали результаты, применение монтелукаста ассоциировано со значимым угнетением раннего и позднего аллерген-индуцированного астматического ответа (снижение области под кривой в течение 0–3 ч на 75,4% и в течение 3–8 ч — на 56,9%). Достоверных изменений количества эозинофилов в мокроте в группе монтелукаста и плацебо не отмечено, что, по мнению авторов, связано с недостаточной продолжительностью терапии.
В двойном слепом рандомизированном исследовании T.F. Reiss и соавторов (1998) также продемонстрированы преимущества монтелукаста в терапии у больных хронической стабильной БА (n=681). Участников распределили на группы для применения монтелукаста или плацебо в течение 12 нед. Согласно полученным данным, монтелукаст способствовал значимому уменьшению выраженности обструкции дыхательных путей, что подтверждено увеличением ОФВ1 на 13,1% (в группе плацебо — 4,2%), утренней и вечерней ПОСвыд — на 24,0 и 15,9 л/мин соответственно (в группе плацебо — 4,6 и 4,2 л/мин соответственно). По мнению авторов, полученные результаты, в частности улучшение показателей вечерней ПОСвыд, свидетельствуют о том, что однократное применение монтелукаста обеспечивает протекторный эффект на протяжении суток. Кроме того, значимые отличия зарегистрированы в отношении дневных симптомов БА, необходимости применения агонистов β2— адренорецепторов и частоты ночных пробуждений.
По мнению авторов, полученные результаты, в частности улучшение показателей вечерней ПОСвыд, свидетельствуют о том, что однократное применение монтелукаста обеспечивает протекторный эффект на протяжении суток. Кроме того, значимые отличия зарегистрированы в отношении дневных симптомов БА, необходимости применения агонистов β2— адренорецепторов и частоты ночных пробуждений.
Согласно исследованию R.A. McIvor и соавторов (2009), монтелукаст с учетом его лучшей (по сравнению с ИГ) переносимости представляет альтернативу последним в лечении у больных БА легкой степени тяжести, недостаточно хорошо контролируемой низкими дозами ИГ. После 6-недельной терапии монтелукастом достигнуто статистически значимое (p<0,001) улучшение у пациентов с недостаточно контролируемой до этого БА на фоне приема ИГ. При этом удалось достичь повышения комплаенса с 41 до 88% (при терапии ИГ и монтелукастом соответственно). Удовлетворенность терапией с точки зрения врача и пациента увеличилась с 43 и 45% до 85 и 94% соответственно.
Кокрановский обзор, в котором сравнивали эффективность монотерапии АЛР и ИГ при БА позволяет говорить о преимуществах последних при большем количестве серьезных побочных эффектов (задержка роста у детей, остеопения и супрессия функции надпочечников). Преимущества ИГ имеют место, главным образом, у больных БА умеренной (но не легкой) степени тяжести (Chauhan B.F., Ducharme F.M., 2012).
Подтверждена клиническая эффективность комбинированной терапии монтелукастом и ИГ, а также ИГ и агонистами β2— адренорецепторов длительного действия. Так, в исследовании J.C. Virchow и соавторов (2010) с участием 1681 больного БА легкой и умеренной степени тяжести после 6 мес терапии указанными сочетаниями препаратов доля пациентов с неконтролируемой (57,5%) или недостаточно контролируемой (25,0%) БА достоверно уменьшилась до 17,6 и 21,7% соответственно. Схожие улучшения наблюдали и в отношении качества жизни пациентов и показателей ОФВ1.
В систематическом обзоре S.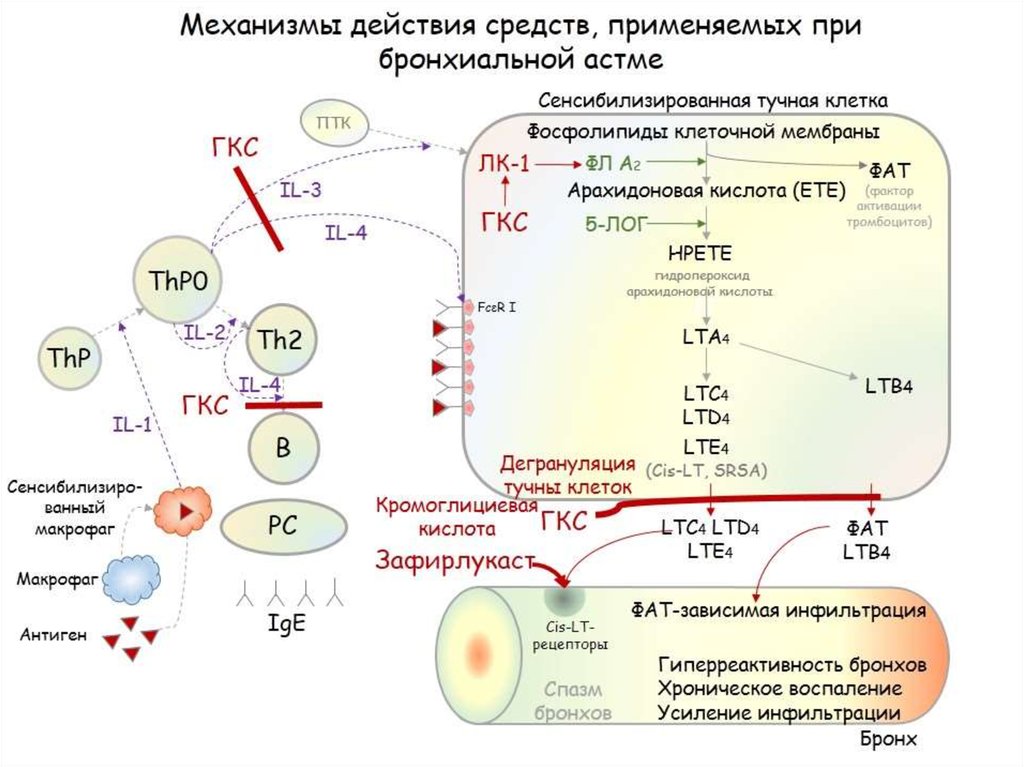 Joos и соавторы (2008) оценивали эффективность комбинированной терапии монтелукастом и ИГ по сравнению с монотерапией ИГ при БА легкой и умеренной степени тяжести. Проанализировав результаты 13 исследований, авторы пришли к выводу, что комбинированная терапия обладает более высокой эффективностью, нежели монотерапия ИГ. Добавление к ИГ салметерола позволяет достичь схожей эффективности, однако монтелукаст характеризуется лучшим профилем безопасности, что особенно важно с учетом длительности терапии БА.
Joos и соавторы (2008) оценивали эффективность комбинированной терапии монтелукастом и ИГ по сравнению с монотерапией ИГ при БА легкой и умеренной степени тяжести. Проанализировав результаты 13 исследований, авторы пришли к выводу, что комбинированная терапия обладает более высокой эффективностью, нежели монотерапия ИГ. Добавление к ИГ салметерола позволяет достичь схожей эффективности, однако монтелукаст характеризуется лучшим профилем безопасности, что особенно важно с учетом длительности терапии БА.
В исследовании C.F. Ramsay и соавторов (2011) 37 пациентов с обострением БА принимали монтелукаст (ежедневно перед сном в дозе 10 мг в течение 4 нед) и 36 — плацебо. Помимо этого, все испытуемые получали преднизолон (40 мг), а в случае необходимости — магния сульфат и/или аминофиллин внутривенно, а также применяли небулайзер с сальбутамолом. ПОСвыд у пациентов группы монтелукаста на следующее утро после приема препарата и при выписке была достоверно выше, чем в группе плацебо (рисунок). Средняя межгрупповая разница по этому показателю составила 57,4 л/мин (95% доверительный интервал (ДИ) 1,15–113,6 л/мин).
Средняя межгрупповая разница по этому показателю составила 57,4 л/мин (95% доверительный интервал (ДИ) 1,15–113,6 л/мин).
Рисунок
ПОСвыд (л/мин) у пациентов с обострением БА, принимавших монтелукаст в сравнении с плацебо (модифицировано по: Ramsay C.F. et al., 2011)
В ряде работ оценена эффективность монтелукаста при БА-АСК (в большинстве случаев с этой целью используют провокационную пробу с лизин-АСК, которая представляется более безопасной).
Эффективность монтелукаста у данной категории пациентов изучена как при его однократном, так и длительном приеме. D.K. Lee и соавторы (2004) оценили влияние монтелукаста в дозе 10 или 40 мг на функцию верхних отделов дыхательных путей после пробы с лизин-АСК. Выборка состояла из 12 добровольцев с БА-АСК, принявших монтелукаст или плацебо за 12 ч до провокационного теста. Оценка показателей спирометрии спустя 120 мин показала достоверные отличия в группе монтелукаста в виде снижения показателей назальной пиковой объемной скорости вдоха (ПОСвд) и назальной блокады по визуально- аналоговой шкале (ВАШ).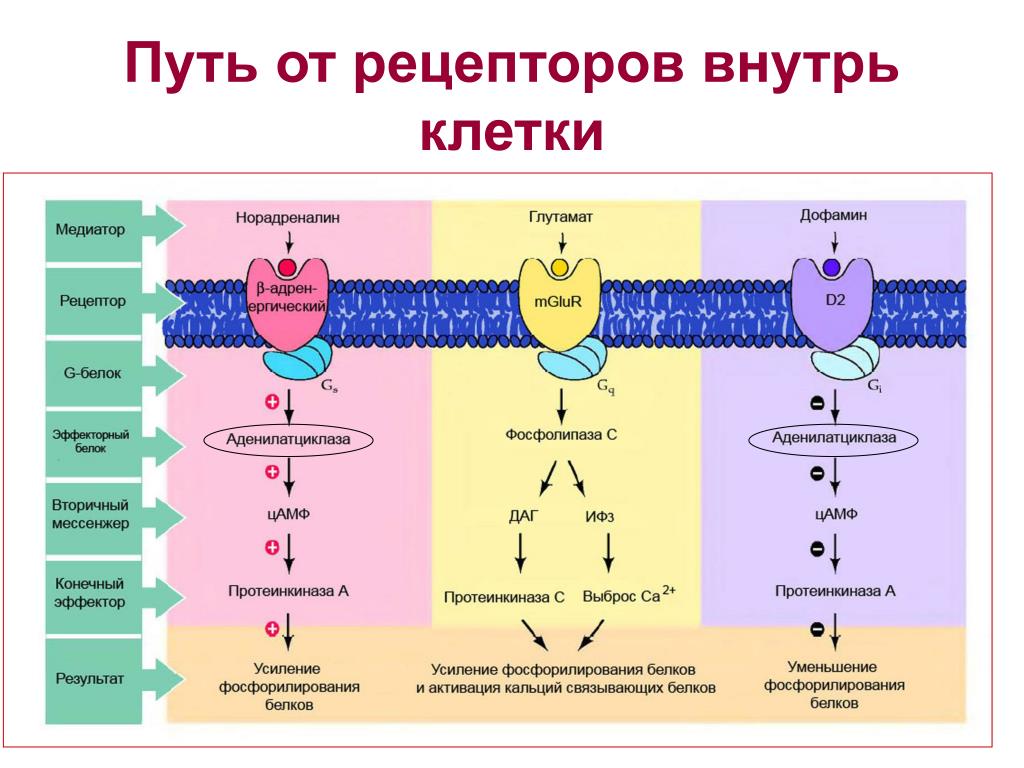 В то же время значимых межгрупповых различий в показателях ОФВ1 не отмечено. В целом в данном исследовании подтвержден протекторный эффект монтелукаста в дозе 10 мг и отсутствие необходимости повышения его дозы до 40 мг.
В то же время значимых межгрупповых различий в показателях ОФВ1 не отмечено. В целом в данном исследовании подтвержден протекторный эффект монтелукаста в дозе 10 мг и отсутствие необходимости повышения его дозы до 40 мг.
J.S. Park и соавторы (2010) также изучали протекторный эффект монтелукаста (10 мг) у данной категории пациентов, но при длительном применении. До терапии уменьшение ОФВ1 на фоне применения АСК составило 15–62%, после терапии этот показатель находился в пределах –9… 51% со статически достоверным снижением.
Краткая информация об указанных исследованиях представлена в табл. 3.
Таблица 3 Краткий обзор исследований эффективности монтелукаста при БА
| Исследование | Выборка | Исследуемая группа | Длительность терапии | Конечные точки | Результаты |
|---|---|---|---|---|---|
| Diamant Z. et al., 1999 | БА | Монтелукаст (n=6; М) Плацебо (n=6; П) | 2 сут | Ранний астматический ответ | М>П (достоверные (р<0,001) различия в пользу М) |
| Поздний астматический ответ | М>П (достоверные (р=0,003) различия в пользу М) | ||||
| Уровень эозинофилов в мокроте | Отсутствие достоверных различий | ||||
Reiss T. F. et al., 1998 F. et al., 1998 | Хроническая стабильная БА | Монтелукаст (n=408; М) Плацебо (n=273; П) | 12 нед | ОФВ1 | М>П (достоверные (p<0,001) различия в пользу М по всем изучаемым пунктам) |
| Симптомы БА | |||||
| Необходимость применения агонистов β2-адренорецепторов | |||||
| Обострения БА | |||||
| Контроль БА (дни) | |||||
| Уровень эозинофилов в периферической крови | |||||
| Ramsay C.F. et al., 2011 | Обострение БА | Монтелукаст (n=37; М) Плацебо (n=36; П) | 4 нед | ПОСвыд | М>П на утро после приема препарата и при выписке |
| ОФВ1 | М>П | ||||
| Количествово дней, проведенных в стационаре | Отсутствие достоверных различий | ||||
| Park J.S. et al., 2010 | БА-АСК | Монтелукаст (n=46; М) | 12 нед | ОФВ1 | Значимое повышение после терапии |
Lee D. K. et al., 2004 K. et al., 2004 | БА-АСК | Монтелукаст 10 мг (n=12; М10) Монтелукаст 40 мг (n=12; М40) Плацебо (n=12; П) | Однократный прием Кроссоверный дизайн со сменой терапии после периода вымывания | Снижение назальной ПОСвд (%) | М10 = М40>П |
| Назальная блокада по ВАШ | М10 = М40>П | ||||
| ОФВ1 | Отсутствие достоверных различий |
Эффективность монтелукаста (Лукаст® компании «Pharma International», Иордания) изучали и в Украине: в исследовании Ю.И. Фещенко и соавторов (2011), проведенном на базе ГУ «Национальный институт фтизиатрии и пульмонологии имени Ф.Г. Яновского НАМН Украины», его применяли у пациентов с БА (n=30), не получавших ИГ на протяжении последних 3 мес. Курс лечения составил 3 мес. Согласно полученным результатам, прием монтелукаста оказал положительное влияние на симптомы БА. Так, к концу 3-го месяца терапии отмечено достоверное уменьшение выраженности и количества ночных и дневных симптомов БА, а также необходимости в дневном применении сальбутамола почти в 3 раза. Также отмечено постепенное достоверное повышение утренней и вечерней ПОСвыд. Контроль БА по истечении 2 мес терапии достигнут у 13%, 3 мес — у 80% пациентов, что нашло отражение в улучшении показателей Опросника контроля бронхиальной астмы (Asthma Screening Questionnaire). Кроме того, на фоне терапии отмечено снижение ОФВ1 после бронхопровокационного теста. Кроме того, на фоне терапии среднее снижение ОФВ1 после проведения бронхопровокационного теста уменьшилось с 9,3 до 11,5%.
Так, к концу 3-го месяца терапии отмечено достоверное уменьшение выраженности и количества ночных и дневных симптомов БА, а также необходимости в дневном применении сальбутамола почти в 3 раза. Также отмечено постепенное достоверное повышение утренней и вечерней ПОСвыд. Контроль БА по истечении 2 мес терапии достигнут у 13%, 3 мес — у 80% пациентов, что нашло отражение в улучшении показателей Опросника контроля бронхиальной астмы (Asthma Screening Questionnaire). Кроме того, на фоне терапии отмечено снижение ОФВ1 после бронхопровокационного теста. Кроме того, на фоне терапии среднее снижение ОФВ1 после проведения бронхопровокационного теста уменьшилось с 9,3 до 11,5%.
Выводы
1. Полученные на сегодняшний день результаты исследований указывают на более высокую эффективность монтелукаста по сравнению с плацебо в отношении длительной терапии при хронической стабильной БА, атопической БА, БА-АСК и БА физического напряжения.
2. Получены доказательства эффективности монтелукаста в отношении обострений БА, что проявляется в виде улучшения показателей спирометрии (ОФВ1, ПОСвыд).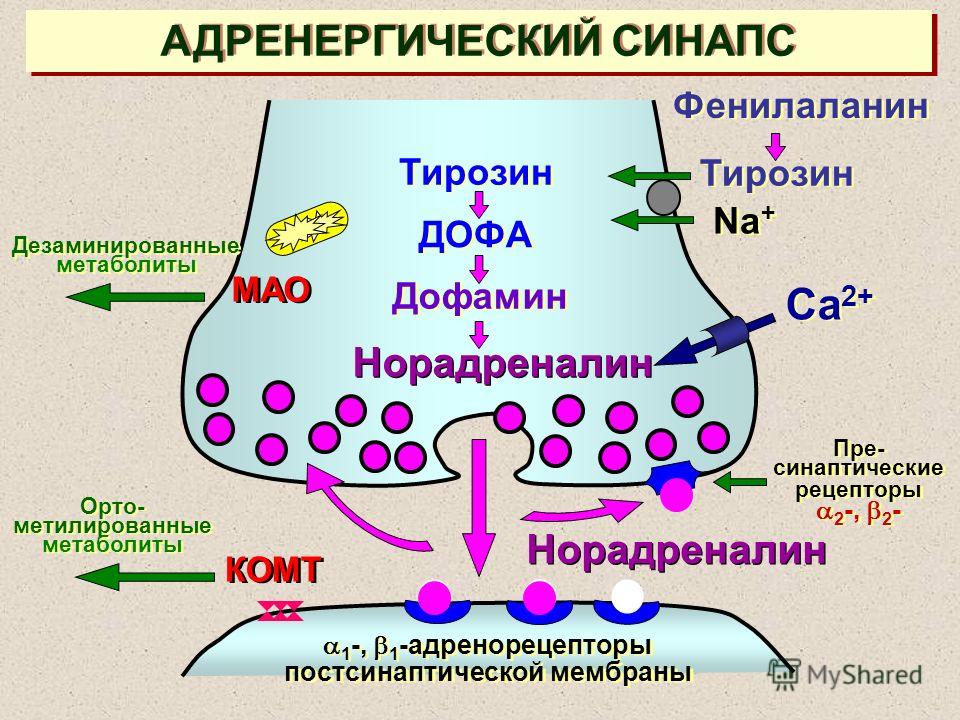
3. Существующая доказательная база сравнительной эффективности длительной монотерапии АЛР и ИГ не позволяет утверждать о превосходстве монтелукаста. Однако его добавление к ИГ при продолжительной терапии недостаточно контролируемой БА позволяет достичь лучших результатов, чем при применении других вариантов лечения. Согласно данным современных руководств, АЛР представляются единственной альтернативой ИГ для длительного контроля БА (British Thoracic Society, Scottish Intercollegiate Guidelines Network, 2008; FitzGerald M. et al., 2012).
Список использованной литературы
- Компендиум 2012 — лекарственные препараты (2012) Под ред. В.Н. Коваленко. МОРИОН, Киев, 2320 с.
- Фещенко Ю.И., Яшина Л.А., Полянская М.А. и др. (2011) Результаты исследования применения модификаторов лейкотриенов у больных бронхиальной астмой. Астма та алергія, 4: 5–12.
- British Thoracic Society, Scottish Intercollegiate Guidelines Network (2008) British Guideline of the Management of Asthma: a national clinical guideline (http://www.
 brit-thoracic.org.uk/Portals/0/Guidelines/AsthmaGuidelines/sign101%20Jan%202012.pdf).
brit-thoracic.org.uk/Portals/0/Guidelines/AsthmaGuidelines/sign101%20Jan%202012.pdf). - Chauhan B.F., Ducharme F.M. (2012) Anti-leukotriene agents compared to inhaled corticosteroids in the management of recurrent and/or chronic asthma in adults and children. Cochrane Database Syst. Rev., 5: CD002314.
- Dahlén S.E. (2006) Treatment of asthma with antileukotrienes: first line or last resort therapy? Eur. J. Pharmacol., 533(1–3): 40–56.
- De Lepeleire I., Reiss T.F., Rochette F. et al. (1997) Montelukast causes prolonged, potent leukotriene D4-receptor antagonism in the airways of patients with asthma. Clin. Pharmacol. Ther., 61(1): 83–92.
- Diamant Z., Grootendorst D.C., Veselic-Charvat M. et al. (1999) The effect of montelukast (MK-0476), a cysteinyl leukotriene receptor antagonist, on allergen-induced airway responses and sputum cell counts in asthma. Clin. Exp. Allergy, 29(1): 42–51.

- Diamant Z., Mantzouranis E., Bjermer L. (2009) Montelukast in the treatment of asthma and beyond. Expert Rev. Clin. Immunol., 5(6): 639–658.
- FitzGerald M., Bateman E.D., Boulet L.-P. et al., GINA Assembly (2012) Pocket guide for asthma management and prevention (for Adults and Children Older than 5 Years). Global initiative for asthma, 26 p.
- Hammarström S. (1983) Leukotrienes. Annu Rev. Biochem., 52: 355–377.
- Joos S., Miksch A., Szecsenyi J. et al. (2008) Montelukast as add-on therapy to inhaled corticosteroids in the treatment of mild to moderate asthma: a systematic review. Thorax, 63(5): 453–462.
- Kraft M., Pak J., Martin R.J. et al. (2001) Distal lung dysfunction at night in nocturnal asthma. Am. J. Respir. Crit. Care Med., 163(7): 1551–1556.
- Lee D.K., Haggart K., Robb F.M., Lipworth B.J. (2004) Montelukast protects against nasal lysine-aspirin challenge in patients with aspirin-induced asthma.
 Eur. Respir. J., 24(2): 226–230.
Eur. Respir. J., 24(2): 226–230. - Lynch K.R., O’Neill G.P., Liu Q. et al. (1999) Characterization of the human cysteinyl leukotriene CysLT1 receptor. Nature, 399(6738): 789–793.
- McIvor R.A., Kaplan A., Koch C., Sampalis J.S. (2009) Montelukast as an alternative to low-dose inhaled corticosteroids in the management of mild asthma (the SIMPLE trial): an open-label effectiveness trial. Can. Respir. J., 16 Suppl. A: 11A–21A.
- Montuschi P., Sala A., Dahlén S.E., Folco G. (2007) Pharmacological modulation of the leukotriene pathway in allergic airway disease. Drug Discov. Today, 12(9–10): 404–412.
- Park J.S., Jang A.S., Park S.W. et al. (2010) Protection of leukotriene receptor antagonist against aspirin-induced bronchospasm in asthmatics. Allergy Asthma Immunol. Res., 2(1): 48–54.
- Ramsay C.F., Pearson D., Mildenhall S., Wilson A.M. (2011) Oral montelukast in acute asthma exacerbations: a randomised, double-blind, placebo-controlled trial.
 Thorax, 66(1): 7–11.
Thorax, 66(1): 7–11. - Reiss T.F., Chervinsky P., Dockhorn R.J. et al. (1998) Montelukast, a once-daily leukotriene receptor antagonist, in the treatment of chronic asthma: a multicenter, randomized, double-blind trial. Montelukast Clinical Research Study Group. Arch. Intern. Med., 158(11): 1213–1220.
- Smith L.J., Geller S., Ebright L. et al. (1990) Inhibition of leukotriene D4-induced bronchoconstriction in normal subjects by the oral LTD4 receptor antagonist ICI 204,219. Am. Rev. Respir. Dis., 141(4 Pt. 1): 988–992.
- Virchow J.C., Mehta A., Ljungblad L., Mitfessel H.; MONICA study group (2010) Add-on montelukast in inadequately controlled asthma patients in a 6-month open-label study: the MONtelukast In Chronic Asthma (MONICA) study. Respir. Med., 104(5): 644–651.
Антагонисты лейкотриеновых рецепторов — StatPearls
Непрерывное обучение
Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов, показанными для профилактики и лечения хронической астмы. Лейкотриены являются эйкозаноидными медиаторами воспаления, производными арахидоновой кислоты. Ни монтелукаст, ни зафирлукаст не являются препаратами неотложной помощи во время острого астматического приступа. В этом мероприятии будут освещены механизм действия, профиль нежелательных явлений и мониторинг, актуальный для членов межпрофессиональной команды при лечении пациентов с астмой и связанными с ней состояниями с помощью антагонистов лейкотриеновых рецепторов.
Лейкотриены являются эйкозаноидными медиаторами воспаления, производными арахидоновой кислоты. Ни монтелукаст, ни зафирлукаст не являются препаратами неотложной помощи во время острого астматического приступа. В этом мероприятии будут освещены механизм действия, профиль нежелательных явлений и мониторинг, актуальный для членов межпрофессиональной команды при лечении пациентов с астмой и связанными с ней состояниями с помощью антагонистов лейкотриеновых рецепторов.
Цели:
Объясните механизм действия антагонистов лейкотриеновых рецепторов.
Опишите потенциальные побочные эффекты антагонистов лейкотриеновых рецепторов.
Рассмотрите соответствующий мониторинг для пациентов, принимающих антагонисты лейкотриеновых рецепторов.
Обобщить стратегии межпрофессиональной команды по улучшению координации помощи и коммуникации для улучшения лечения астмы антагонистами лейкотриеновых рецепторов и улучшения результатов.

Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Монтелукаст и зафирлукаст являются антагонистами цистеиниловых лейкотриеновых рецепторов.[1] Лейкотриены являются эйкозаноидными медиаторами воспаления, производными арахидоновой кислоты. Показаниями к применению монтелукаста являются профилактика и хроническое лечение астмы, предотвращение бронхоспазма, вызванного физической нагрузкой, и облегчение симптомов аллергического ринита.[2][3]
Монотерапия монтелукастом не рекомендуется в качестве терапии первой линии при аллергическом рините.[4] Вместо этого монотерапия интраназальным глюкокортикоидом является настоятельной рекомендацией при начальном лечении пациентов с умеренным/тяжелым сезонным аллергическим ринитом в возрасте 12 лет и старше, ранее не получавших лечения.[5] Роль монтелукаста в эффективном лечении экземы остается неубедительной [6].
Родители детей, страдающих астмой, предпочитают монтелукаст, потому что пероральная доза один раз в день более удобна, чем использование ингаляторов. Это также позволяет избежать клинических проблем, связанных с побочными эффектами длительного применения кортикостероидов, такими как задержка роста и метаболические нарушения.
Это также позволяет избежать клинических проблем, связанных с побочными эффектами длительного применения кортикостероидов, такими как задержка роста и метаболические нарушения.
Показания к применению Зафирлукаста включают профилактику и длительное лечение астмы у детей старше пяти лет и взрослых. Он используется не по прямому назначению при аллергическом рините и для профилактики бронхоспазма, вызванного физической нагрузкой.
Препаратом первой линии для профилактики бронхоспазма, вызванного физической нагрузкой, является ингаляционный бета-агонист короткого действия, такой как альбутерол. Ежедневное использование ингаляционных кортикостероидов или антагонистов лейкотриеновых рецепторов, таких как монтелукаст и зафирлукаст, рекомендуется пациентам с бронхоспазмом, вызванным физической нагрузкой, которые вдыхали профилактические бета-агонисты короткого действия, но продолжают иметь симптомы или у которых развивается толерантность к продолжительному использованию короткодействующих агонистов. бета-агонист.[7]
бета-агонист.[7]
Как монтелукаст, так и зафирлукаст не используются в качестве средств экстренной помощи во время острого астматического приступа.[8] Вместо этого ингаляционный бета-агонист вызывает немедленную бронходилатацию.
Механизм действия
Основным показанием к применению антагонистов лейкотриеновых рецепторов является лечение хронической астмы. Лейкотриены синтезируются из арахидоновой кислоты под действием 5-липоксигеназы во многих воспалительных клетках дыхательных путей.[9] Арахидоновая кислота высвобождается из фосфолипидов клеточной мембраны в основном с помощью фосфолипазы А2.[10] Циклооксигеназный путь продуцирует тромбоксан и простагландины из арахидоновой кислоты. Кортикостероиды ингибируют фосфолипазу А2 и последующий синтез эйкозаноидных медиаторов воспаления, включая как простагландины, так и лейкотриены. Нестероидные противовоспалительные препараты, такие как аспирин, ингибируют циклооксигеназы. Зилеутон ингибирует 5-липоксигеназу.
Существует две группы лейкотриенов: одна с аминокислотными фрагментами, а другая без них. [1] Лейкотриен B4 несет только гидроксильную часть и связывается с рецепторами BLT. Сигнальный путь через активацию рецептора BLT, связанного с G-белком, вызывает мощный ответ хемотаксиса. Цистеиниллейкотриены (LTC4, LTD4 и LTE4) имеют аминокислотный фрагмент и связываются с цистеиниллейкотриеновыми рецепторами (CysLT1 и CysLT2). Бронхоконстрикция, сосудистая проницаемость, рекрутирование эозинофилов и хроническое воспаление опосредуются связанной с G-белком активацией цистеиниллейкотриеновых рецепторов. Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов CysLT1, но не рецепторов CysLT2. Исследования показали, что эозинофилы являются основным источником цистеиниллейкотриенов, а цистеиниллейкотриены очень важны для рекрутирования эозинофилов.[11] Более ранние исследования показали, что цистеиниллейкотриены также играют важную роль в ремоделировании дыхательных путей при хронической астме.[12]
[1] Лейкотриен B4 несет только гидроксильную часть и связывается с рецепторами BLT. Сигнальный путь через активацию рецептора BLT, связанного с G-белком, вызывает мощный ответ хемотаксиса. Цистеиниллейкотриены (LTC4, LTD4 и LTE4) имеют аминокислотный фрагмент и связываются с цистеиниллейкотриеновыми рецепторами (CysLT1 и CysLT2). Бронхоконстрикция, сосудистая проницаемость, рекрутирование эозинофилов и хроническое воспаление опосредуются связанной с G-белком активацией цистеиниллейкотриеновых рецепторов. Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов CysLT1, но не рецепторов CysLT2. Исследования показали, что эозинофилы являются основным источником цистеиниллейкотриенов, а цистеиниллейкотриены очень важны для рекрутирования эозинофилов.[11] Более ранние исследования показали, что цистеиниллейкотриены также играют важную роль в ремоделировании дыхательных путей при хронической астме.[12]
Астма является наиболее распространенным хроническим заболеванием легких, характеризующимся обратимой бронхоконстрикцией, воспалением и ремоделированием дыхательных путей, что приводит к гиперреактивности. Симпатомиметические средства, такие как агонисты бета-адренергических рецепторов, являются терапевтическим выбором для лечения острой бронхоконстрикции. Они активируют бета-2 адренорецепторы и расслабляют гладкомышечные клетки дыхательных путей. К бета2-селективным агонистам короткого действия относятся альбутерол, левалбутерол, тербуталин, метапротеренол и пирбутерол. Они поддерживают бронходилатацию в течение 3-4 часов. К бета2-селективным агонистам длительного действия с 12-часовой продолжительностью действия относятся салметерол и формотерол. Пациенты, принимающие бета-агонисты сверхдлительного действия, такие как индакатерол, олодатерол и вилантерол, должны принимать бамбутерол только один раз в день. Поскольку бета-агонисты не ингибируют воспалительные реакции, они не могут использоваться в качестве монотерапии для контроля персистирующей астмы. Они часто являются вторым агентом, добавляемым к ингаляционным кортикостероидам.
Симпатомиметические средства, такие как агонисты бета-адренергических рецепторов, являются терапевтическим выбором для лечения острой бронхоконстрикции. Они активируют бета-2 адренорецепторы и расслабляют гладкомышечные клетки дыхательных путей. К бета2-селективным агонистам короткого действия относятся альбутерол, левалбутерол, тербуталин, метапротеренол и пирбутерол. Они поддерживают бронходилатацию в течение 3-4 часов. К бета2-селективным агонистам длительного действия с 12-часовой продолжительностью действия относятся салметерол и формотерол. Пациенты, принимающие бета-агонисты сверхдлительного действия, такие как индакатерол, олодатерол и вилантерол, должны принимать бамбутерол только один раз в день. Поскольку бета-агонисты не ингибируют воспалительные реакции, они не могут использоваться в качестве монотерапии для контроля персистирующей астмы. Они часто являются вторым агентом, добавляемым к ингаляционным кортикостероидам.
Основываясь на воспалительном механизме астмы, для лечения этого эндотипа астмы было разработано несколько фармакологических средств с различными механизмами действия. Воздействие аллергена стимулирует синтез IgE, управляемый CD4+ Т-хелперными клетками 2 типа. Антитела IgE связываются со своими рецепторами на тучных клетках ткани и базофилах крови.[14] При повторном воздействии аллергена аллерген сшивает антитела IgE на поверхности иммунных клеток. Он запускает высвобождение предварительно образованных медиаторов анафилаксии и синтез медиаторов воспаления. Кромолин или недокромил могут предотвращать дегрануляцию тучных клеток. Однако в настоящее время эти препараты обычно не используются для лечения астмы, поскольку они менее эффективны, чем ингаляционные кортикостероиды. Гистамин, триптаза и метаболиты арахидоновой кислоты, такие как лейкотриены C4 и D4 и простагландин D2, высвобождаются и вызывают острое сокращение гладких мышц и повышение проницаемости сосудов. Через три-шесть часов при поздней астматической реакции возникает более устойчивый бронхоспазм. Есть предположения, что цитокины, продуцируемые иммунным ответом 2-го типа, опосредуют поздний астматический ответ.
Воздействие аллергена стимулирует синтез IgE, управляемый CD4+ Т-хелперными клетками 2 типа. Антитела IgE связываются со своими рецепторами на тучных клетках ткани и базофилах крови.[14] При повторном воздействии аллергена аллерген сшивает антитела IgE на поверхности иммунных клеток. Он запускает высвобождение предварительно образованных медиаторов анафилаксии и синтез медиаторов воспаления. Кромолин или недокромил могут предотвращать дегрануляцию тучных клеток. Однако в настоящее время эти препараты обычно не используются для лечения астмы, поскольку они менее эффективны, чем ингаляционные кортикостероиды. Гистамин, триптаза и метаболиты арахидоновой кислоты, такие как лейкотриены C4 и D4 и простагландин D2, высвобождаются и вызывают острое сокращение гладких мышц и повышение проницаемости сосудов. Через три-шесть часов при поздней астматической реакции возникает более устойчивый бронхоспазм. Есть предположения, что цитокины, продуцируемые иммунным ответом 2-го типа, опосредуют поздний астматический ответ. [15]
[15]
Успехи в понимании молекулярной гетерогенности астмы выявили важность иммунного ответа типа 2, опосредованного Т-хелперами типа 2, в патологии эозинофильной астмы.[16] Омализумаб представляет собой моноклональное антитело, которое может снижать количество циркулирующего IgE. ИЛ-4, ИЛ-5 и ИЛ-13 опосредуют иммунный ответ типа 2. Меполизумаб с антителами против ИЛ-5 минимизирует количество и активность эозинофилов в слизистой оболочке дыхательных путей. Дупилумаб представляет собой антитело к рецептору ИЛ-4.
Введение
Монтелукаст вводят перорально, независимо от еды или приема пищи. Пациентам с астмой, а также астмой и аллергическим ринитом следует принимать одну дозу вечером. Для лечения аллергического ринита прием может быть как утренним, так и вечерним. Его следует принимать не менее чем за два часа до тренировки, чтобы предотвратить астму, вызванную физической нагрузкой. Пациенты не должны принимать другую дозу в течение 24 часов.
Зафирлукаст принимают внутрь. Его следует принимать через 2 часа после или за 1 час до еды, поскольку пища снижает биодоступность на 40%.
Его следует принимать через 2 часа после или за 1 час до еды, поскольку пища снижает биодоступность на 40%.
Побочные эффекты
Монтелукаст относительно хорошо переносится и в целом безопасен.[17] Наиболее часто наблюдаемыми побочными эффектами у пациентов в возрасте 15 лет и старше были головные боли, гриппозная инфекция, боль в животе, кашель и диспепсия. У детей могут возникнуть диарея, тошнота, ларингит, фарингит, синусит, отит и вирусная инфекция. Могут возникнуть нервно-психические расстройства, включая депрессию, агрессию, суицидальные мысли, бессонницу, тревогу и ночные кошмары.[18]
Аллергический гранулематозный ангиит (синдром Чарга-Стросса) также может коррелировать с применением монтелукаста, хотя причинно-следственная связь еще не установлена.[19][20] Имеются некоторые сообщения о серьезных нежелательных явлениях, связанных с ангионевротическим отеком, гиперчувствительностью, утомляемостью, спутанностью сознания, патологическими сновидениями, эпилепсией, агрессией, нарушением иммунной системы, кровоизлиянием, раздражением, увеличением количества эозинофилов, болью в конечностях и болью в животе. [18] В исследовании на животных он не оказывал тератогенного действия в дозах, значительно превышающих максимальную суточную дозу для человека.[17]
[18] В исследовании на животных он не оказывал тератогенного действия в дозах, значительно превышающих максимальную суточную дозу для человека.[17]
Зафирлукаст, как правило, хорошо переносится, и побочные эффекты минимальны.[21] Распространенными побочными эффектами являются головная боль, инфекция верхних дыхательных путей и желудочно-кишечные расстройства, такие как тошнота, рвота, диспепсия, боль в животе, диарея и недомогание.[21] Редко повышение активности печеночных ферментов, острый гепатит и гипербилирубинемия были связаны с зафирлукастом.[22][23]
Противопоказания
Как монтелукаст, так и зафирлукаст противопоказаны пациентам с гиперчувствительностью к препарату или любому компоненту их состава.
Противопоказания к применению зафирлукаста также включают пациентов с острой астмой или печеночной недостаточностью.
Противопоказания к применению монтелукаста включают тяжелую форму астмы. Пациентам с фенилкетонурией рекомендуется соблюдать осторожность, поскольку существует форма, содержащая фенилаланин.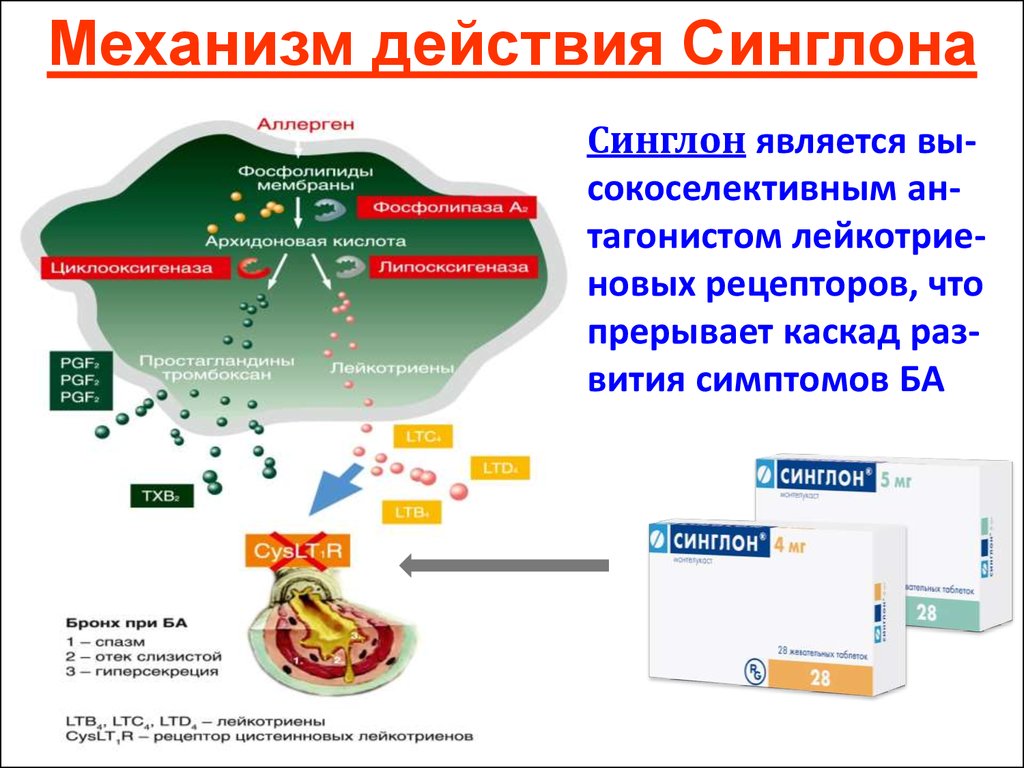
Мониторинг
Депрессия, агрессия и другие поведенческие изменения коррелируют с антагонистами лейкотриеновых рецепторов. Необходимо тщательное наблюдение за пациентами, получающими лечение антагонистами лейкотриеновых рецепторов.
Зафирлукаст может вызывать тяжелое, но редко острое поражение печени. Это основной субстрат фермента цитохрома P450 CYP2C9. Пациенты, получающие сопутствующую терапию такими препаратами, как алпелисиб, дабрафениб, энзалутамид, эритромицин, локсапин, лумакафтор, рифапентин, терфенадин и варфарин, нуждаются в наблюдении за потенциальными лекарственными взаимодействиями.
Токсичность
И монтелукаст, и зафирлукаст имеют широкий запас прочности. У пациентов, принявших передозировку, не было побочных симптомов, выздоровление проходило без осложнений, сыпи и расстройства желудка.[25][26]
При передозировке удалите неабсорбированные препараты с помощью активированного угля и при необходимости назначьте поддерживающую терапию.
Улучшение результатов бригады здравоохранения
В центр фармаконадзора Нидерландов Lareb и в глобальную базу данных отчетов ВОЗ о безопасности отдельных случаев поступили сообщения о нескольких побочных реакциях на лекарства. Наиболее частым побочным эффектом у всего населения была депрессия, а у детей в возрасте до 19 лет — агрессия.[18] Сообщалось о суицидальных мыслях, аномальном поведении, ночных кошмарах, головных болях, бессоннице и беспокойстве у пациентов, получавших монтелукаст. Кошмары могут возникать и пугать детей. Агрессивность и ненормальное поведение детей могут вызывать опасения у их родителей и учителей. Бессонница у взрослых может повлиять на безопасность пациентов и других лиц.
Астма — это хроническое заболевание легких. Даже у пациентов с хорошо налаженным режимом лечения могут возникать обострения астмы. Понимание факторов риска склонной к обострению астмы имеет решающее значение для предотвращения потенциально смертельных острых приступов астмы.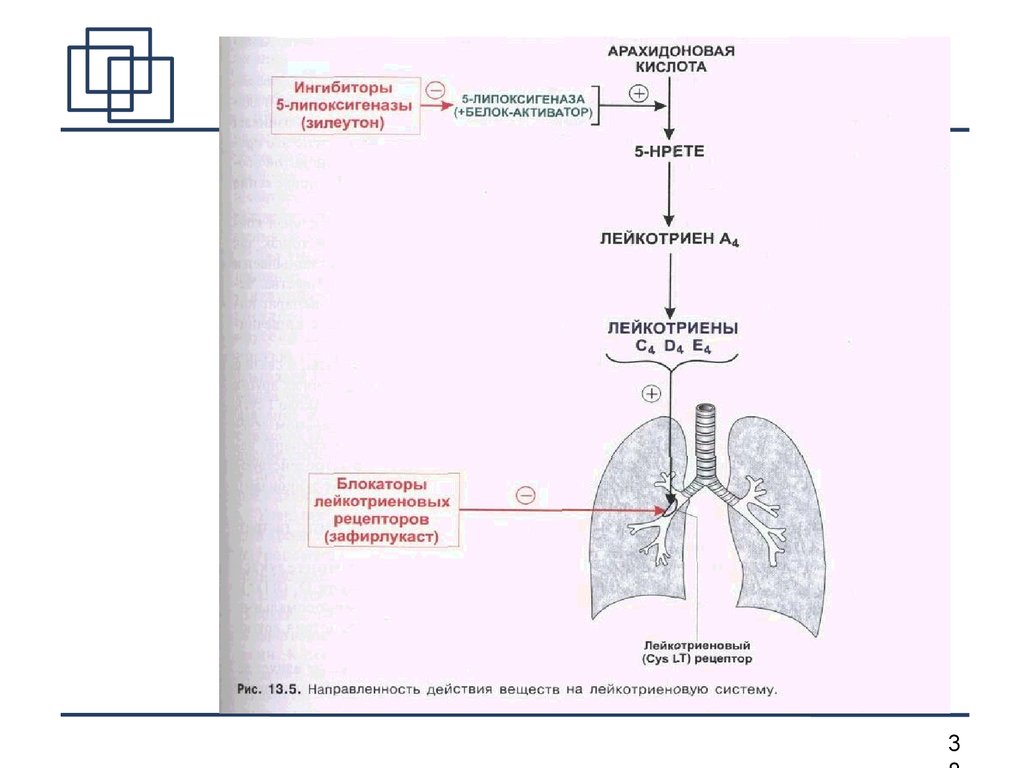 [27][28]
[27][28]
Как у афроамериканцев, так и у выходцев из Латинской Америки частота обострений выше. Плохое соблюдение режима лечения из-за плохого доступа пациентов к медицинской помощи и недостаточного образования и знаний о болезни подвергает пациентов большому риску острых обострений. Другие потенциально поддающиеся изменению факторы риска включают неконтролируемые аллергии, вирусные инфекции верхних дыхательных путей, ожирение, курение и гастроэзофагеальную рефлюксную болезнь [29].][30][31][32] Межпрофессиональный подход, включающий всех членов медицинской бригады, включая врачей (MD и DO), практикующих врачей среднего звена (NP и PA), специалистов, медсестер, фармацевтов и респираторных терапевтов, может снизить острые приступы астмы, взяв под контроль эти факторы риска. Межпрофессиональная медицинская бригада должна обучать своих пациентов или родителей и контролировать частоту побочных эффектов лекарств. Использование подхода межпрофессиональной команды к лечению пациентов в целом и использование антагонистов лейкотриеновых рецепторов у пациентов, которым будет полезна такая медикаментозная терапия. [Уровень 5]
[Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Джо-Ватанабе А., Окуно Т., Йокомизо Т. Роль лейкотриенов как потенциальных терапевтических мишеней при аллергических расстройствах. Int J Mol Sci. 22 июля 2019 г.; 20 (14) [Бесплатная статья PMC: PMC6679143] [PubMed: 31336653]
- 2.
Тамада Т, Ичиносе М. Антагонисты рецепторов лейкотриенов и противоаллергические препараты. Handb Exp Pharmacol. 2017;237:153-169. [PubMed: 27826703]
- 3.
Киттана Н., Хаттаб С., Зияде-Ислим А., Джарадат Н., Зайд А.Н. Монтелукаст, текущие показания и перспективы применения в будущем. Эксперт Respir Med. 2016 сен;10(9):943-56. [PubMed: 27485393]
- 4.
Зайдман М.Д., Гургель Р.К., Лин С.Ю., Шварц С.Р., Баруди Ф.М., Боннер Д.Р., Доусон Д.
 Е., Дайкевич М.С., Хакелл Дж.М., Хан Дж.К., Ишман С.Л., Круз Х.Дж., Малекзаде S, Mims JW, Omole FS, Reddy WD, Wallace DV, Walsh SA, Warren BE, Wilson MN, Nnacheta LC., Группа разработки рекомендаций по отоларингологии. ААО-ХНСФ. Клинические рекомендации: Аллергический ринит. Отоларингол Head Neck Surg. 2015 Февраль; 152 (1 Дополнение): S1-43. [В паблике: 25644617]
Е., Дайкевич М.С., Хакелл Дж.М., Хан Дж.К., Ишман С.Л., Круз Х.Дж., Малекзаде S, Mims JW, Omole FS, Reddy WD, Wallace DV, Walsh SA, Warren BE, Wilson MN, Nnacheta LC., Группа разработки рекомендаций по отоларингологии. ААО-ХНСФ. Клинические рекомендации: Аллергический ринит. Отоларингол Head Neck Surg. 2015 Февраль; 152 (1 Дополнение): S1-43. [В паблике: 25644617]- 5.
Эмерик А., Эмерик-Максимюк Ю., Янечек К. Новые рекомендации по лечению сезонного аллергического ринита. Постерий Дерматол Алергол. 2019 июнь;36(3):255-260. [Бесплатная статья PMC: PMC6640027] [PubMed: 31333340]
- 6.
Ferguson L, Futamura M, Vakirlis E, Kojima R, Sasaki H, Roberts A, Mori R. Антагонисты лейкотриеновых рецепторов при экземе. Cochrane Database Syst Rev. 2018 Oct 21;10(10):CD011224. [Бесплатная статья PMC: PMC6517006] [PubMed: 30343498]
- 7.
Parsons JP, Hallstrand TS, Mastronarde JG, Kaminsky DA, Rundell KW, Hull JH, Storms WW, Weiler JM, Cheek FM, Wilson KC, Anderson SD.
 , Подкомитет Американского торакального общества по упражнениям -индуцированная бронхоконстрикция. Официальное руководство по клинической практике Американского торакального общества: бронхоконстрикция, вызванная физической нагрузкой. Am J Respir Crit Care Med. 2013 01 мая; 187(9):1016-27. [PubMed: 23634861]
, Подкомитет Американского торакального общества по упражнениям -индуцированная бронхоконстрикция. Официальное руководство по клинической практике Американского торакального общества: бронхоконстрикция, вызванная физической нагрузкой. Am J Respir Crit Care Med. 2013 01 мая; 187(9):1016-27. [PubMed: 23634861]- 8.
Блейк К.В. Монтелукаст: данные клинических исследований по лечению астмы. Энн Фармакотер. 1999 декабря; 33 (12): 1299-314. [PubMed: 10630831]
- 9.
Rådmark O, Werz O, Steinhilber D, Samuelsson B. 5-липоксигеназа, ключевой фермент биосинтеза лейкотриенов в норме и при болезнях. Биохим Биофиз Акта. 2015 апрель; 1851 (4): 331-9. [PubMed: 25152163]
- 10.
Claar D, Hartert TV, Peebles RS. Роль простагландинов в аллергическом воспалении легких и бронхиальной астме. Эксперт Respir Med. 2015 Февраль;9(1):55-72. [Бесплатная статья PMC: PMC4380345] [PubMed: 25541289]
- 11.
Томпсон-Соуза Г.
 А., Гропилло И., Невес Дж.С. Цистеиниллейкотриены в биологии эозинофилов: функциональные роли и терапевтические перспективы при эозинофильных расстройствах. Front Med (Лозанна). 2017;4:106. [Бесплатная статья PMC: PMC5515036] [PubMed: 28770202]
А., Гропилло И., Невес Дж.С. Цистеиниллейкотриены в биологии эозинофилов: функциональные роли и терапевтические перспективы при эозинофильных расстройствах. Front Med (Лозанна). 2017;4:106. [Бесплатная статья PMC: PMC5515036] [PubMed: 28770202]- 12.
Hallstrand TS, Henderson WR. Новые сведения о роли лейкотриенов при астме. Курр Опин Аллергия Клин Иммунол. 2010 Февраль;10(1):60-6. [Бесплатная статья PMC: PMC2838730] [PubMed: 19915456]
- 13.
Falk NP, Hughes SW, Rogers BC. Лекарства от хронической астмы. Ам семейный врач. 2016 15 сентября; 94 (6): 454-62. [PubMed: 27637121]
- 14.
Olin JT, Wechsler ME. Бронхиальная астма: патогенез и новые препараты для лечения. БМЖ. 2014 24 ноября; 349:g5517. [PubMed: 25420994]
- 15.
Цислевич Г., Томкинсон А., Адлер А., Дуэз С., Шварце Дж., Такеда К., Ларсон К.А., Ли Дж.Дж., Ирвин К.Г., Гельфанд Э.В. Поздний, но не ранний астматический ответ зависит от ИЛ-5 и коррелирует с инфильтрацией эозинофилами.
 Джей Клин Инвест. 1999 августа; 104 (3): 301-8. [Бесплатная статья PMC: PMC408423] [PubMed: 10430611]
Джей Клин Инвест. 1999 августа; 104 (3): 301-8. [Бесплатная статья PMC: PMC408423] [PubMed: 10430611]- 16.
Fahy JV. Воспаление 2 типа при астме — присутствует у большинства, но отсутствует у многих. Нат Рев Иммунол. 2015 Янв; 15 (1): 57-65. [Бесплатная статья PMC: PMC43] [PubMed: 25534623]
- 17.
Hon KL, Leung TF, Leung AK. Клиническая эффективность и безопасность монтелукаста при бронхиальной астме. Каковы выводы клинических испытаний и метаанализов? Препарат Des Devel Ther. 2014;8:839-50. [Бесплатная статья PMC: PMC4079631] [PubMed: 25061277]
- 18.
Haarman MG, van Hunsel F, de Vries TW. Побочные реакции на монтелукаст у детей и взрослых. Фармакол Рез Перспект. 5(5) октября 2017 г. [Статья без PMC: PMC5625152] [PubMed: 28971612]
- 19.
Calapai G, Casciaro M, Miroddi M, Calapai F, Navarra M, Gangemi S. Побочное действие монтелукаста реакции: обзор описаний случаев в литературе.
 Фармакология. 2014;94(1-2):60-70. [PubMed: 25196099]
Фармакология. 2014;94(1-2):60-70. [PubMed: 25196099]- 20.
Гарсия-Маркос Л., Шустер А., Перес-Ярса Э.Г. Оценка пользы и риска антилейкотриенов при лечении астмы. Препарат Саф. 2003;26(7):483-518. [PubMed: 12735786]
- 21.
Twaites BR, Wilton LV, Shakir SA. Безопасность зафирлукаста: результаты постмаркетингового исследования с участием 7976 пациентов в Англии. Препарат Саф. 2007;30(5):419-29. [PubMed: 17472420]
- 22.
LiverTox: клиническая и исследовательская информация о лекарственном повреждении печени [Интернет]. Национальный институт диабета и болезней органов пищеварения и почек; Bethesda (MD): 4 июня 2019 г. Зафирлукаст. [Бесплатная статья PMC: PMC547852] [PubMed: 31643251]
- 23.
Wooltorton E. Лекарство от астмы зафирлукаст (Accolate): серьезные нарушения со стороны печени. CMAJ. 2004 г., 25 мая; 170 (11): 1668. [Бесплатная статья PMC: PMC408503] [PubMed: 15159361]
- 24.

Adkins JC, Brogden RN. Зафирлукаст. Обзор его фармакологии и терапевтического потенциала в лечении астмы. Наркотики. 1998 января; 55 (1): 121-44. [PubMed: 9463793]
- 25.
Cantrell FL, Farson-Collier M. Доброкачественное клиническое течение после большого приема монтелукаста у детей. J Toxicol Clin Toxicol. 2004;42(3):333-4. [PubMed: 15362605]
- 26.
Геллер М., Мело Л.Р., Коутиньо С.В. Успешный исход передозировки монтелукаста у ребенка с астмой. Энн Аллергия Астма Иммунол. 2000 март; 84 (3): 370. [PubMed: 10752926]
- 27.
Castillo JR, Peters SP, Busse WW. Обострения бронхиальной астмы: патогенез, профилактика и лечение. J Allergy Clin Immunol Pract. 2017 июль-август;5(4):918-927. [Бесплатная статья PMC: PMC5950727] [PubMed: 28689842]
- 28.
Адели М., Эль-Шарейф Т., Хендаус М.А. Обострение астмы, связанное с вирусными инфекциями: актуальное резюме. J Family Med Prim Care.
 2019 сен;8(9):2753-2759. [Бесплатная статья PMC: PMC6820381] [PubMed: 31681638]
2019 сен;8(9):2753-2759. [Бесплатная статья PMC: PMC6820381] [PubMed: 31681638]- 29.
Hammond C, Kurten M, Kennedy JL. Риновирус и астма: легендарная история несовместимости. Curr Allergy Asthma Rep. 2015 Feb;15(2):502. [Бесплатная статья PMC: PMC4327812] [PubMed: 25612798]
- 30.
Denlinger LC, Phillips BR, Ramratnam S, Ross K, Bhakta NR, Cardet JC, Castro M, Peters SP, Phipatanakul W, Aujla S, Bacharier LB, Bleecker ER, Comhair SA, Coverstone А., ДеБоер М., Эрзурум СК, Фейн С.Б., Файт М., Фитцпатрик А.М., Гаффин Дж., Гастон Б., Хасти А.Т., Хокинс Г.А., Ольгин Ф., Ирани А.М., Исраэль Э., Леви Б.Д., Ли Н., Мейерс Д.А., Мур В.К., Майерс Р., Опина М.Т., Петерс М.С., Шиблер М.Л., Соркнесс Р.Л., Тиг В.Г., Венцель С.Е., Вудрафф П.Г., Могер Д.Т., Фахи Дж.В., Джаржур Н.Н., Исследовательская программа тяжелой астмы Национального института сердца, легких и крови – 3 исследователя. Воспалительные и коморбидные особенности у пациентов с тяжелой астмой и частыми обострениями.
 Am J Respir Crit Care Med. 2017 01 февраля; 195(3):302-313. [Бесплатная статья PMC: PMC5328178] [PubMed: 27556234]
Am J Respir Crit Care Med. 2017 01 февраля; 195(3):302-313. [Бесплатная статья PMC: PMC5328178] [PubMed: 27556234]- 31.
Эриксон С.Е., Ирибаррен С., Толстых И.В., Блан П.Д., Эйснер М.Д. Влияние расы на лечение астмы и исходы в крупной интегрированной организации управляемой медицинской помощи. Arch Intern Med. 2007 г., 24 сентября; 167 (17): 1846-52. [PubMed: 17893305]
- 32.
Альварес Г.Г., Шульцер М., Юнг Д., Фицджеральд Дж.М. Систематический обзор факторов риска, связанных с почти фатальной и фатальной астмой. Can Respir J. 2005 г., июль-август; 12 (5): 265–70. [В паблике: 16107915]
Антагонисты лейкотриеновых рецепторов – StatPearls
Продолжение обучения
Монтелукаст и зафирлукаст являются антагонистами цистеиниловых лейкотриеновых рецепторов, показанными для профилактики и лечения хронической астмы. Лейкотриены являются эйкозаноидными медиаторами воспаления, производными арахидоновой кислоты. Ни монтелукаст, ни зафирлукаст не являются препаратами неотложной помощи во время острого астматического приступа. В этом мероприятии будут освещены механизм действия, профиль нежелательных явлений и мониторинг, актуальный для членов межпрофессиональной команды при лечении пациентов с астмой и связанными с ней состояниями с помощью антагонистов лейкотриеновых рецепторов.
Ни монтелукаст, ни зафирлукаст не являются препаратами неотложной помощи во время острого астматического приступа. В этом мероприятии будут освещены механизм действия, профиль нежелательных явлений и мониторинг, актуальный для членов межпрофессиональной команды при лечении пациентов с астмой и связанными с ней состояниями с помощью антагонистов лейкотриеновых рецепторов.
Цели:
Объясните механизм действия антагонистов лейкотриеновых рецепторов.
Опишите потенциальные побочные эффекты антагонистов лейкотриеновых рецепторов.
Рассмотрите соответствующий мониторинг для пациентов, принимающих антагонисты лейкотриеновых рецепторов.
Обобщить стратегии межпрофессиональной команды по улучшению координации помощи и коммуникации для улучшения лечения астмы антагонистами лейкотриеновых рецепторов и улучшения результатов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.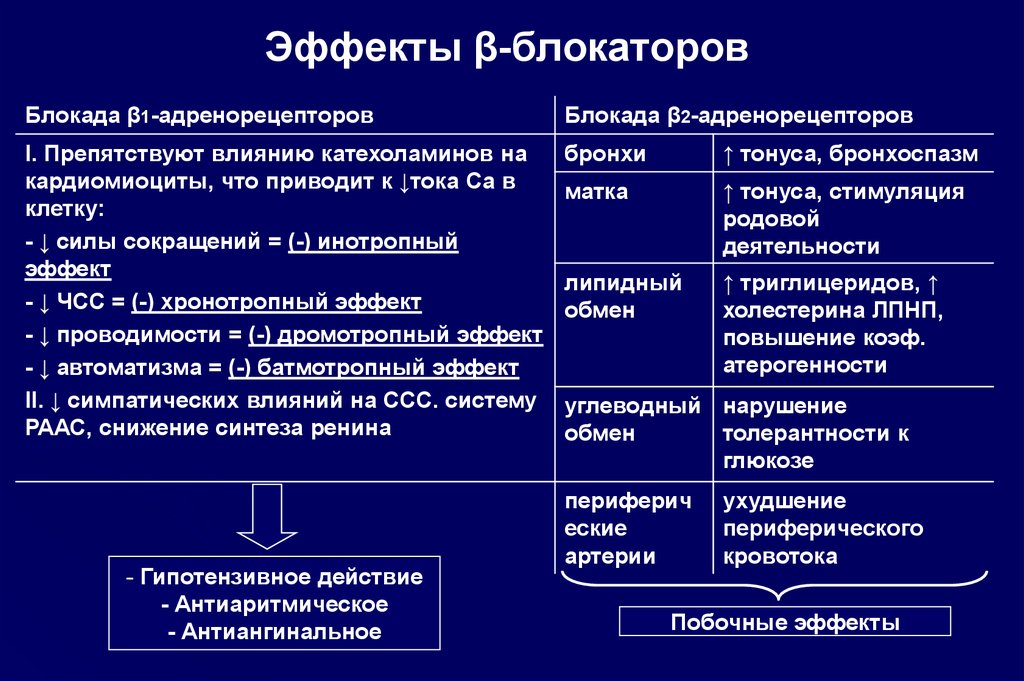
Показания
Монтелукаст и зафирлукаст являются антагонистами цистеиниловых лейкотриеновых рецепторов.[1] Лейкотриены являются эйкозаноидными медиаторами воспаления, производными арахидоновой кислоты. Показаниями к применению монтелукаста являются профилактика и хроническое лечение астмы, предотвращение бронхоспазма, вызванного физической нагрузкой, и облегчение симптомов аллергического ринита.[2][3]
Монотерапия монтелукастом не рекомендуется в качестве терапии первой линии при аллергическом рините.[4] Вместо этого монотерапия интраназальным глюкокортикоидом является настоятельной рекомендацией при начальном лечении пациентов с умеренным/тяжелым сезонным аллергическим ринитом в возрасте 12 лет и старше, ранее не получавших лечения.[5] Роль монтелукаста в эффективном лечении экземы остается неубедительной [6].
Родители детей, страдающих астмой, предпочитают монтелукаст, потому что пероральная доза один раз в день более удобна, чем использование ингаляторов. Это также позволяет избежать клинических проблем, связанных с побочными эффектами длительного применения кортикостероидов, такими как задержка роста и метаболические нарушения.
Это также позволяет избежать клинических проблем, связанных с побочными эффектами длительного применения кортикостероидов, такими как задержка роста и метаболические нарушения.
Показания к применению Зафирлукаста включают профилактику и длительное лечение астмы у детей старше пяти лет и взрослых. Он используется не по прямому назначению при аллергическом рините и для профилактики бронхоспазма, вызванного физической нагрузкой.
Препаратом первой линии для профилактики бронхоспазма, вызванного физической нагрузкой, является ингаляционный бета-агонист короткого действия, такой как альбутерол. Ежедневное использование ингаляционных кортикостероидов или антагонистов лейкотриеновых рецепторов, таких как монтелукаст и зафирлукаст, рекомендуется пациентам с бронхоспазмом, вызванным физической нагрузкой, которые вдыхали профилактические бета-агонисты короткого действия, но продолжают иметь симптомы или у которых развивается толерантность к продолжительному использованию короткодействующих агонистов. бета-агонист.[7]
бета-агонист.[7]
Как монтелукаст, так и зафирлукаст не используются в качестве средств экстренной помощи во время острого астматического приступа.[8] Вместо этого ингаляционный бета-агонист вызывает немедленную бронходилатацию.
Механизм действия
Основным показанием к применению антагонистов лейкотриеновых рецепторов является лечение хронической астмы. Лейкотриены синтезируются из арахидоновой кислоты под действием 5-липоксигеназы во многих воспалительных клетках дыхательных путей.[9] Арахидоновая кислота высвобождается из фосфолипидов клеточной мембраны в основном с помощью фосфолипазы А2.[10] Циклооксигеназный путь продуцирует тромбоксан и простагландины из арахидоновой кислоты. Кортикостероиды ингибируют фосфолипазу А2 и последующий синтез эйкозаноидных медиаторов воспаления, включая как простагландины, так и лейкотриены. Нестероидные противовоспалительные препараты, такие как аспирин, ингибируют циклооксигеназы. Зилеутон ингибирует 5-липоксигеназу.
Существует две группы лейкотриенов: одна с аминокислотными фрагментами, а другая без них. [1] Лейкотриен B4 несет только гидроксильную часть и связывается с рецепторами BLT. Сигнальный путь через активацию рецептора BLT, связанного с G-белком, вызывает мощный ответ хемотаксиса. Цистеиниллейкотриены (LTC4, LTD4 и LTE4) имеют аминокислотный фрагмент и связываются с цистеиниллейкотриеновыми рецепторами (CysLT1 и CysLT2). Бронхоконстрикция, сосудистая проницаемость, рекрутирование эозинофилов и хроническое воспаление опосредуются связанной с G-белком активацией цистеиниллейкотриеновых рецепторов. Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов CysLT1, но не рецепторов CysLT2. Исследования показали, что эозинофилы являются основным источником цистеиниллейкотриенов, а цистеиниллейкотриены очень важны для рекрутирования эозинофилов.[11] Более ранние исследования показали, что цистеиниллейкотриены также играют важную роль в ремоделировании дыхательных путей при хронической астме.[12]
[1] Лейкотриен B4 несет только гидроксильную часть и связывается с рецепторами BLT. Сигнальный путь через активацию рецептора BLT, связанного с G-белком, вызывает мощный ответ хемотаксиса. Цистеиниллейкотриены (LTC4, LTD4 и LTE4) имеют аминокислотный фрагмент и связываются с цистеиниллейкотриеновыми рецепторами (CysLT1 и CysLT2). Бронхоконстрикция, сосудистая проницаемость, рекрутирование эозинофилов и хроническое воспаление опосредуются связанной с G-белком активацией цистеиниллейкотриеновых рецепторов. Монтелукаст и зафирлукаст являются антагонистами цистеиниллейкотриеновых рецепторов CysLT1, но не рецепторов CysLT2. Исследования показали, что эозинофилы являются основным источником цистеиниллейкотриенов, а цистеиниллейкотриены очень важны для рекрутирования эозинофилов.[11] Более ранние исследования показали, что цистеиниллейкотриены также играют важную роль в ремоделировании дыхательных путей при хронической астме.[12]
Астма является наиболее распространенным хроническим заболеванием легких, характеризующимся обратимой бронхоконстрикцией, воспалением и ремоделированием дыхательных путей, что приводит к гиперреактивности.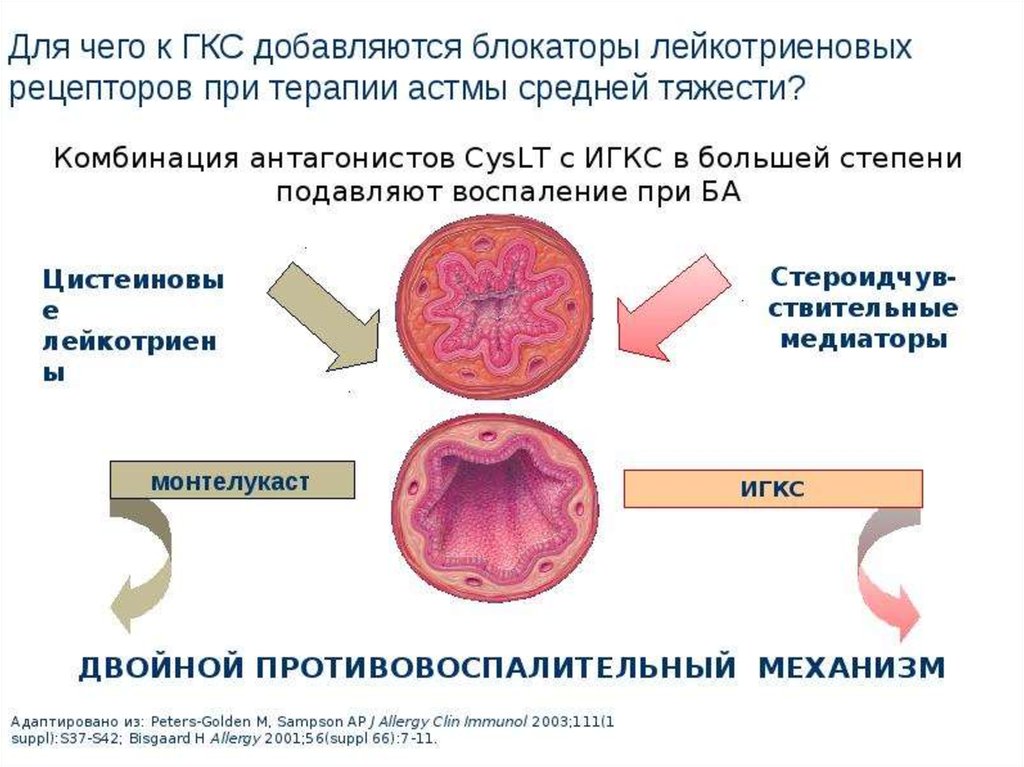 Симпатомиметические средства, такие как агонисты бета-адренергических рецепторов, являются терапевтическим выбором для лечения острой бронхоконстрикции. Они активируют бета-2 адренорецепторы и расслабляют гладкомышечные клетки дыхательных путей. К бета2-селективным агонистам короткого действия относятся альбутерол, левалбутерол, тербуталин, метапротеренол и пирбутерол. Они поддерживают бронходилатацию в течение 3-4 часов. К бета2-селективным агонистам длительного действия с 12-часовой продолжительностью действия относятся салметерол и формотерол. Пациенты, принимающие бета-агонисты сверхдлительного действия, такие как индакатерол, олодатерол и вилантерол, должны принимать бамбутерол только один раз в день. Поскольку бета-агонисты не ингибируют воспалительные реакции, они не могут использоваться в качестве монотерапии для контроля персистирующей астмы. Они часто являются вторым агентом, добавляемым к ингаляционным кортикостероидам.
Симпатомиметические средства, такие как агонисты бета-адренергических рецепторов, являются терапевтическим выбором для лечения острой бронхоконстрикции. Они активируют бета-2 адренорецепторы и расслабляют гладкомышечные клетки дыхательных путей. К бета2-селективным агонистам короткого действия относятся альбутерол, левалбутерол, тербуталин, метапротеренол и пирбутерол. Они поддерживают бронходилатацию в течение 3-4 часов. К бета2-селективным агонистам длительного действия с 12-часовой продолжительностью действия относятся салметерол и формотерол. Пациенты, принимающие бета-агонисты сверхдлительного действия, такие как индакатерол, олодатерол и вилантерол, должны принимать бамбутерол только один раз в день. Поскольку бета-агонисты не ингибируют воспалительные реакции, они не могут использоваться в качестве монотерапии для контроля персистирующей астмы. Они часто являются вторым агентом, добавляемым к ингаляционным кортикостероидам.
Основываясь на воспалительном механизме астмы, для лечения этого эндотипа астмы было разработано несколько фармакологических средств с различными механизмами действия. Воздействие аллергена стимулирует синтез IgE, управляемый CD4+ Т-хелперными клетками 2 типа. Антитела IgE связываются со своими рецепторами на тучных клетках ткани и базофилах крови.[14] При повторном воздействии аллергена аллерген сшивает антитела IgE на поверхности иммунных клеток. Он запускает высвобождение предварительно образованных медиаторов анафилаксии и синтез медиаторов воспаления. Кромолин или недокромил могут предотвращать дегрануляцию тучных клеток. Однако в настоящее время эти препараты обычно не используются для лечения астмы, поскольку они менее эффективны, чем ингаляционные кортикостероиды. Гистамин, триптаза и метаболиты арахидоновой кислоты, такие как лейкотриены C4 и D4 и простагландин D2, высвобождаются и вызывают острое сокращение гладких мышц и повышение проницаемости сосудов. Через три-шесть часов при поздней астматической реакции возникает более устойчивый бронхоспазм. Есть предположения, что цитокины, продуцируемые иммунным ответом 2-го типа, опосредуют поздний астматический ответ.
Воздействие аллергена стимулирует синтез IgE, управляемый CD4+ Т-хелперными клетками 2 типа. Антитела IgE связываются со своими рецепторами на тучных клетках ткани и базофилах крови.[14] При повторном воздействии аллергена аллерген сшивает антитела IgE на поверхности иммунных клеток. Он запускает высвобождение предварительно образованных медиаторов анафилаксии и синтез медиаторов воспаления. Кромолин или недокромил могут предотвращать дегрануляцию тучных клеток. Однако в настоящее время эти препараты обычно не используются для лечения астмы, поскольку они менее эффективны, чем ингаляционные кортикостероиды. Гистамин, триптаза и метаболиты арахидоновой кислоты, такие как лейкотриены C4 и D4 и простагландин D2, высвобождаются и вызывают острое сокращение гладких мышц и повышение проницаемости сосудов. Через три-шесть часов при поздней астматической реакции возникает более устойчивый бронхоспазм. Есть предположения, что цитокины, продуцируемые иммунным ответом 2-го типа, опосредуют поздний астматический ответ.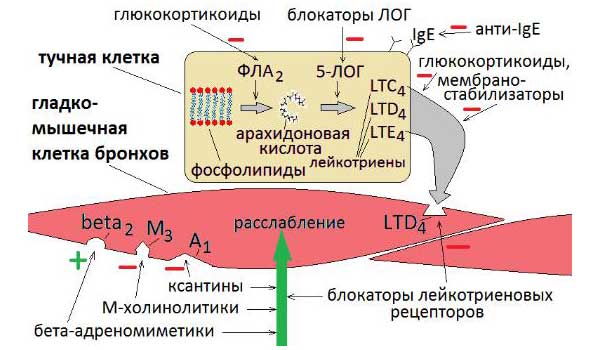 [15]
[15]
Успехи в понимании молекулярной гетерогенности астмы выявили важность иммунного ответа типа 2, опосредованного Т-хелперами типа 2, в патологии эозинофильной астмы.[16] Омализумаб представляет собой моноклональное антитело, которое может снижать количество циркулирующего IgE. ИЛ-4, ИЛ-5 и ИЛ-13 опосредуют иммунный ответ типа 2. Меполизумаб с антителами против ИЛ-5 минимизирует количество и активность эозинофилов в слизистой оболочке дыхательных путей. Дупилумаб представляет собой антитело к рецептору ИЛ-4.
Введение
Монтелукаст вводят перорально, независимо от еды или приема пищи. Пациентам с астмой, а также астмой и аллергическим ринитом следует принимать одну дозу вечером. Для лечения аллергического ринита прием может быть как утренним, так и вечерним. Его следует принимать не менее чем за два часа до тренировки, чтобы предотвратить астму, вызванную физической нагрузкой. Пациенты не должны принимать другую дозу в течение 24 часов.
Зафирлукаст принимают внутрь. Его следует принимать через 2 часа после или за 1 час до еды, поскольку пища снижает биодоступность на 40%.
Его следует принимать через 2 часа после или за 1 час до еды, поскольку пища снижает биодоступность на 40%.
Побочные эффекты
Монтелукаст относительно хорошо переносится и в целом безопасен.[17] Наиболее часто наблюдаемыми побочными эффектами у пациентов в возрасте 15 лет и старше были головные боли, гриппозная инфекция, боль в животе, кашель и диспепсия. У детей могут возникнуть диарея, тошнота, ларингит, фарингит, синусит, отит и вирусная инфекция. Могут возникнуть нервно-психические расстройства, включая депрессию, агрессию, суицидальные мысли, бессонницу, тревогу и ночные кошмары.[18]
Аллергический гранулематозный ангиит (синдром Чарга-Стросса) также может коррелировать с применением монтелукаста, хотя причинно-следственная связь еще не установлена.[19][20] Имеются некоторые сообщения о серьезных нежелательных явлениях, связанных с ангионевротическим отеком, гиперчувствительностью, утомляемостью, спутанностью сознания, патологическими сновидениями, эпилепсией, агрессией, нарушением иммунной системы, кровоизлиянием, раздражением, увеличением количества эозинофилов, болью в конечностях и болью в животе. [18] В исследовании на животных он не оказывал тератогенного действия в дозах, значительно превышающих максимальную суточную дозу для человека.[17]
[18] В исследовании на животных он не оказывал тератогенного действия в дозах, значительно превышающих максимальную суточную дозу для человека.[17]
Зафирлукаст, как правило, хорошо переносится, и побочные эффекты минимальны.[21] Распространенными побочными эффектами являются головная боль, инфекция верхних дыхательных путей и желудочно-кишечные расстройства, такие как тошнота, рвота, диспепсия, боль в животе, диарея и недомогание.[21] Редко повышение активности печеночных ферментов, острый гепатит и гипербилирубинемия были связаны с зафирлукастом.[22][23]
Противопоказания
Как монтелукаст, так и зафирлукаст противопоказаны пациентам с гиперчувствительностью к препарату или любому компоненту их состава.
Противопоказания к применению зафирлукаста также включают пациентов с острой астмой или печеночной недостаточностью.
Противопоказания к применению монтелукаста включают тяжелую форму астмы. Пациентам с фенилкетонурией рекомендуется соблюдать осторожность, поскольку существует форма, содержащая фенилаланин.
Мониторинг
Депрессия, агрессия и другие поведенческие изменения коррелируют с антагонистами лейкотриеновых рецепторов. Необходимо тщательное наблюдение за пациентами, получающими лечение антагонистами лейкотриеновых рецепторов.
Зафирлукаст может вызывать тяжелое, но редко острое поражение печени. Это основной субстрат фермента цитохрома P450 CYP2C9. Пациенты, получающие сопутствующую терапию такими препаратами, как алпелисиб, дабрафениб, энзалутамид, эритромицин, локсапин, лумакафтор, рифапентин, терфенадин и варфарин, нуждаются в наблюдении за потенциальными лекарственными взаимодействиями.
Токсичность
И монтелукаст, и зафирлукаст имеют широкий запас прочности. У пациентов, принявших передозировку, не было побочных симптомов, выздоровление проходило без осложнений, сыпи и расстройства желудка.[25][26]
При передозировке удалите неабсорбированные препараты с помощью активированного угля и при необходимости назначьте поддерживающую терапию.
Улучшение результатов бригады здравоохранения
В центр фармаконадзора Нидерландов Lareb и в глобальную базу данных отчетов ВОЗ о безопасности отдельных случаев поступили сообщения о нескольких побочных реакциях на лекарства. Наиболее частым побочным эффектом у всего населения была депрессия, а у детей в возрасте до 19 лет — агрессия.[18] Сообщалось о суицидальных мыслях, аномальном поведении, ночных кошмарах, головных болях, бессоннице и беспокойстве у пациентов, получавших монтелукаст. Кошмары могут возникать и пугать детей. Агрессивность и ненормальное поведение детей могут вызывать опасения у их родителей и учителей. Бессонница у взрослых может повлиять на безопасность пациентов и других лиц.
Астма — это хроническое заболевание легких. Даже у пациентов с хорошо налаженным режимом лечения могут возникать обострения астмы. Понимание факторов риска склонной к обострению астмы имеет решающее значение для предотвращения потенциально смертельных острых приступов астмы. [27][28]
[27][28]
Как у афроамериканцев, так и у выходцев из Латинской Америки частота обострений выше. Плохое соблюдение режима лечения из-за плохого доступа пациентов к медицинской помощи и недостаточного образования и знаний о болезни подвергает пациентов большому риску острых обострений. Другие потенциально поддающиеся изменению факторы риска включают неконтролируемые аллергии, вирусные инфекции верхних дыхательных путей, ожирение, курение и гастроэзофагеальную рефлюксную болезнь [29].][30][31][32] Межпрофессиональный подход, включающий всех членов медицинской бригады, включая врачей (MD и DO), практикующих врачей среднего звена (NP и PA), специалистов, медсестер, фармацевтов и респираторных терапевтов, может снизить острые приступы астмы, взяв под контроль эти факторы риска. Межпрофессиональная медицинская бригада должна обучать своих пациентов или родителей и контролировать частоту побочных эффектов лекарств. Использование подхода межпрофессиональной команды к лечению пациентов в целом и использование антагонистов лейкотриеновых рецепторов у пациентов, которым будет полезна такая медикаментозная терапия. [Уровень 5]
[Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Джо-Ватанабе А., Окуно Т., Йокомизо Т. Роль лейкотриенов как потенциальных терапевтических мишеней при аллергических расстройствах. Int J Mol Sci. 22 июля 2019 г.; 20 (14) [Бесплатная статья PMC: PMC6679143] [PubMed: 31336653]
- 2.
Тамада Т, Ичиносе М. Антагонисты рецепторов лейкотриенов и противоаллергические препараты. Handb Exp Pharmacol. 2017;237:153-169. [PubMed: 27826703]
- 3.
Киттана Н., Хаттаб С., Зияде-Ислим А., Джарадат Н., Зайд А.Н. Монтелукаст, текущие показания и перспективы применения в будущем. Эксперт Respir Med. 2016 сен;10(9):943-56. [PubMed: 27485393]
- 4.
Зайдман М.Д., Гургель Р.К., Лин С.Ю., Шварц С.Р., Баруди Ф.М., Боннер Д.Р., Доусон Д.
 Е., Дайкевич М.С., Хакелл Дж.М., Хан Дж.К., Ишман С.Л., Круз Х.Дж., Малекзаде S, Mims JW, Omole FS, Reddy WD, Wallace DV, Walsh SA, Warren BE, Wilson MN, Nnacheta LC., Группа разработки рекомендаций по отоларингологии. ААО-ХНСФ. Клинические рекомендации: Аллергический ринит. Отоларингол Head Neck Surg. 2015 Февраль; 152 (1 Дополнение): S1-43. [В паблике: 25644617]
Е., Дайкевич М.С., Хакелл Дж.М., Хан Дж.К., Ишман С.Л., Круз Х.Дж., Малекзаде S, Mims JW, Omole FS, Reddy WD, Wallace DV, Walsh SA, Warren BE, Wilson MN, Nnacheta LC., Группа разработки рекомендаций по отоларингологии. ААО-ХНСФ. Клинические рекомендации: Аллергический ринит. Отоларингол Head Neck Surg. 2015 Февраль; 152 (1 Дополнение): S1-43. [В паблике: 25644617]- 5.
Эмерик А., Эмерик-Максимюк Ю., Янечек К. Новые рекомендации по лечению сезонного аллергического ринита. Постерий Дерматол Алергол. 2019 июнь;36(3):255-260. [Бесплатная статья PMC: PMC6640027] [PubMed: 31333340]
- 6.
Ferguson L, Futamura M, Vakirlis E, Kojima R, Sasaki H, Roberts A, Mori R. Антагонисты лейкотриеновых рецепторов при экземе. Cochrane Database Syst Rev. 2018 Oct 21;10(10):CD011224. [Бесплатная статья PMC: PMC6517006] [PubMed: 30343498]
- 7.
Parsons JP, Hallstrand TS, Mastronarde JG, Kaminsky DA, Rundell KW, Hull JH, Storms WW, Weiler JM, Cheek FM, Wilson KC, Anderson SD.
 , Подкомитет Американского торакального общества по упражнениям -индуцированная бронхоконстрикция. Официальное руководство по клинической практике Американского торакального общества: бронхоконстрикция, вызванная физической нагрузкой. Am J Respir Crit Care Med. 2013 01 мая; 187(9):1016-27. [PubMed: 23634861]
, Подкомитет Американского торакального общества по упражнениям -индуцированная бронхоконстрикция. Официальное руководство по клинической практике Американского торакального общества: бронхоконстрикция, вызванная физической нагрузкой. Am J Respir Crit Care Med. 2013 01 мая; 187(9):1016-27. [PubMed: 23634861]- 8.
Блейк К.В. Монтелукаст: данные клинических исследований по лечению астмы. Энн Фармакотер. 1999 декабря; 33 (12): 1299-314. [PubMed: 10630831]
- 9.
Rådmark O, Werz O, Steinhilber D, Samuelsson B. 5-липоксигеназа, ключевой фермент биосинтеза лейкотриенов в норме и при болезнях. Биохим Биофиз Акта. 2015 апрель; 1851 (4): 331-9. [PubMed: 25152163]
- 10.
Claar D, Hartert TV, Peebles RS. Роль простагландинов в аллергическом воспалении легких и бронхиальной астме. Эксперт Respir Med. 2015 Февраль;9(1):55-72. [Бесплатная статья PMC: PMC4380345] [PubMed: 25541289]
- 11.
Томпсон-Соуза Г.
 А., Гропилло И., Невес Дж.С. Цистеиниллейкотриены в биологии эозинофилов: функциональные роли и терапевтические перспективы при эозинофильных расстройствах. Front Med (Лозанна). 2017;4:106. [Бесплатная статья PMC: PMC5515036] [PubMed: 28770202]
А., Гропилло И., Невес Дж.С. Цистеиниллейкотриены в биологии эозинофилов: функциональные роли и терапевтические перспективы при эозинофильных расстройствах. Front Med (Лозанна). 2017;4:106. [Бесплатная статья PMC: PMC5515036] [PubMed: 28770202]- 12.
Hallstrand TS, Henderson WR. Новые сведения о роли лейкотриенов при астме. Курр Опин Аллергия Клин Иммунол. 2010 Февраль;10(1):60-6. [Бесплатная статья PMC: PMC2838730] [PubMed: 19915456]
- 13.
Falk NP, Hughes SW, Rogers BC. Лекарства от хронической астмы. Ам семейный врач. 2016 15 сентября; 94 (6): 454-62. [PubMed: 27637121]
- 14.
Olin JT, Wechsler ME. Бронхиальная астма: патогенез и новые препараты для лечения. БМЖ. 2014 24 ноября; 349:g5517. [PubMed: 25420994]
- 15.
Цислевич Г., Томкинсон А., Адлер А., Дуэз С., Шварце Дж., Такеда К., Ларсон К.А., Ли Дж.Дж., Ирвин К.Г., Гельфанд Э.В. Поздний, но не ранний астматический ответ зависит от ИЛ-5 и коррелирует с инфильтрацией эозинофилами.
 Джей Клин Инвест. 1999 августа; 104 (3): 301-8. [Бесплатная статья PMC: PMC408423] [PubMed: 10430611]
Джей Клин Инвест. 1999 августа; 104 (3): 301-8. [Бесплатная статья PMC: PMC408423] [PubMed: 10430611]- 16.
Fahy JV. Воспаление 2 типа при астме — присутствует у большинства, но отсутствует у многих. Нат Рев Иммунол. 2015 Янв; 15 (1): 57-65. [Бесплатная статья PMC: PMC43 ] [PubMed: 25534623]
- 17.
Hon KL, Leung TF, Leung AK. Клиническая эффективность и безопасность монтелукаста при бронхиальной астме. Каковы выводы клинических испытаний и метаанализов? Препарат Des Devel Ther. 2014;8:839-50. [Бесплатная статья PMC: PMC4079631] [PubMed: 25061277]
- 18.
Haarman MG, van Hunsel F, de Vries TW. Побочные реакции на монтелукаст у детей и взрослых. Фармакол Рез Перспект. 5(5) октября 2017 г. [Статья без PMC: PMC5625152] [PubMed: 28971612]
- 19.
Calapai G, Casciaro M, Miroddi M, Calapai F, Navarra M, Gangemi S. Побочное действие монтелукаста реакции: обзор описаний случаев в литературе.
 Фармакология. 2014;94(1-2):60-70. [PubMed: 25196099]
Фармакология. 2014;94(1-2):60-70. [PubMed: 25196099]- 20.
Гарсия-Маркос Л., Шустер А., Перес-Ярса Э.Г. Оценка пользы и риска антилейкотриенов при лечении астмы. Препарат Саф. 2003;26(7):483-518. [PubMed: 12735786]
- 21.
Twaites BR, Wilton LV, Shakir SA. Безопасность зафирлукаста: результаты постмаркетингового исследования с участием 7976 пациентов в Англии. Препарат Саф. 2007;30(5):419-29. [PubMed: 17472420]
- 22.
LiverTox: клиническая и исследовательская информация о лекарственном повреждении печени [Интернет]. Национальный институт диабета и болезней органов пищеварения и почек; Bethesda (MD): 4 июня 2019 г. Зафирлукаст. [Бесплатная статья PMC: PMC547852] [PubMed: 31643251]
- 23.
Wooltorton E. Лекарство от астмы зафирлукаст (Accolate): серьезные нарушения со стороны печени. CMAJ. 2004 г., 25 мая; 170 (11): 1668. [Бесплатная статья PMC: PMC408503] [PubMed: 15159361]
- 24.

Adkins JC, Brogden RN. Зафирлукаст. Обзор его фармакологии и терапевтического потенциала в лечении астмы. Наркотики. 1998 января; 55 (1): 121-44. [PubMed: 9463793]
- 25.
Cantrell FL, Farson-Collier M. Доброкачественное клиническое течение после большого приема монтелукаста у детей. J Toxicol Clin Toxicol. 2004;42(3):333-4. [PubMed: 15362605]
- 26.
Геллер М., Мело Л.Р., Коутиньо С.В. Успешный исход передозировки монтелукаста у ребенка с астмой. Энн Аллергия Астма Иммунол. 2000 март; 84 (3): 370. [PubMed: 10752926]
- 27.
Castillo JR, Peters SP, Busse WW. Обострения бронхиальной астмы: патогенез, профилактика и лечение. J Allergy Clin Immunol Pract. 2017 июль-август;5(4):918-927. [Бесплатная статья PMC: PMC5950727] [PubMed: 28689842]
- 28.
Адели М., Эль-Шарейф Т., Хендаус М.А. Обострение астмы, связанное с вирусными инфекциями: актуальное резюме. J Family Med Prim Care.
 2019 сен;8(9):2753-2759. [Бесплатная статья PMC: PMC6820381] [PubMed: 31681638]
2019 сен;8(9):2753-2759. [Бесплатная статья PMC: PMC6820381] [PubMed: 31681638]- 29.
Hammond C, Kurten M, Kennedy JL. Риновирус и астма: легендарная история несовместимости. Curr Allergy Asthma Rep. 2015 Feb;15(2):502. [Бесплатная статья PMC: PMC4327812] [PubMed: 25612798]
- 30.
Denlinger LC, Phillips BR, Ramratnam S, Ross K, Bhakta NR, Cardet JC, Castro M, Peters SP, Phipatanakul W, Aujla S, Bacharier LB, Bleecker ER, Comhair SA, Coverstone А., ДеБоер М., Эрзурум СК, Фейн С.Б., Файт М., Фитцпатрик А.М., Гаффин Дж., Гастон Б., Хасти А.Т., Хокинс Г.А., Ольгин Ф., Ирани А.М., Исраэль Э., Леви Б.Д., Ли Н., Мейерс Д.А., Мур В.К., Майерс Р., Опина М.Т., Петерс М.С., Шиблер М.Л., Соркнесс Р.Л., Тиг В.Г., Венцель С.Е., Вудрафф П.Г., Могер Д.Т., Фахи Дж.В., Джаржур Н.Н., Исследовательская программа тяжелой астмы Национального института сердца, легких и крови – 3 исследователя. Воспалительные и коморбидные особенности у пациентов с тяжелой астмой и частыми обострениями.

