Как выявить бронхолегочную дисплазию у детей
Получить результаты анализов
- Главная
- Как распознать болезнь
- Детские болезни
- Бронхолегочная дисплазия у детей
Подробнее о враче
Бронхолегочная дисплазия у детей представляет собой хронический полиэтиологический патологический процесс, протекающий в дыхательной системе и характеризующийся деформацией грудной клетки, бронхиальной обструкцией и синдромом дыхательной недостаточности. Чаще всего его развитие наблюдается у младенцев, родившихся с массой менее 1,5 килограмма.
Причины бронхолегочной дисплазии
Возникновение данной патологии ассоциировано с:
- рождением младенца раньше 32-х акушерских недель;
- инфицированием плода в утробе матери цитомегаловирусом, хламидиями, микоплазмами, пневмоцистами, уреаплазмами;
- неправильным выполнением искусственной вентиляции легких;
- врожденной пневмонией;
- нарушением техники введения новорожденному ребенку лекарственного вещества, не допускающего спадания альвеол – сурфактанта;
- врожденной незрелостью надпочечных желез;
- дефицитом витаминов А и Е;
- нерациональными питанием новорожденных;
- отеком легких;
- наследственной предрасположенностью;
- легочной гипертензией.

Симптомы и первые признаки
Клинические проявления бронхолегочной дисплазии характеризуются:
- нарушением частоты дыхательных движений;
- излишней плаксивостью младенца;
- поверхностным дыханием;
- отказом от пищи;
- частым срыгиванием;
- одышкой;
- поражением сенсорной мембраны, формирующей внутреннюю поверхность глазного яблока – сетчатки;
- отчетливо слышными хрипами.
Диагностика
Дифференциальное диагностирование бронхолегочной дисплазии основано на результатах комплексного обследования маленького пациента, включающего:
- Сбор анамнестических данных, позволяющий установить срок родов и наличие факторов, способствующих развитию патологии.
- Тщательный объективный осмотр – для выявления характерной клинической симптоматики.
- Гемограмму – для обнаружения нормохромной гипо-регенераторной анемии, повышения численности эозинофилов и нейтрофилов.

- Биохимический анализ крови – для измерения уровня содержания калия, натрия, хлора, рН, мочевины и креатинина.
- Исследование газового состава крови – для выявления снижения парциального давления кислорода.
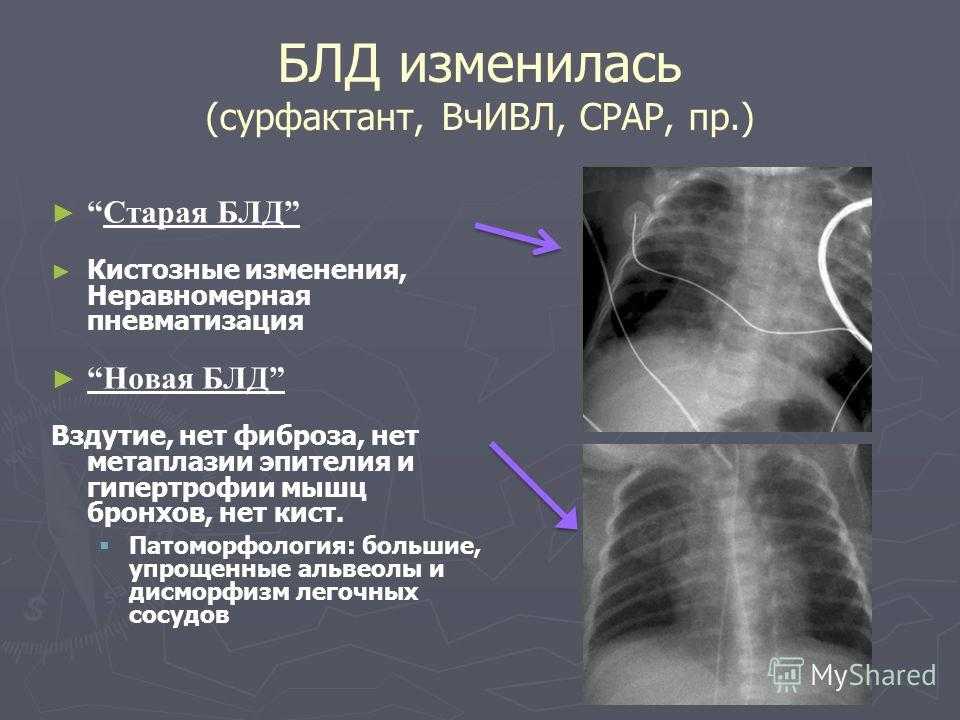
- Рентгеноскопия органов грудной клетки – для обнаружения признаков морфологических изменений легких, их стадии и степени тяжести.
- Компьютерной и магниторезонансной томографии легких – для детального оценивания структуры легочной паренхимы.
Лечение
При бронхолегочной дисплазии целями лечебных мероприятий являются:
- Кислородная поддержка.
- Обеспечение питания малыша, соответствующего его возрастной категории.
- Выполнение искусственной вентиляции легких.
- Стабилизация температуры тела младенца не ниже 36,5 ̊.
- Введение сурфактанта.
Для предотвращения возникновения осложнений применяются глюкокортикоиды, бронхолитические, муколитические и противовоспалительные средства, антибактериальные и диуретические препараты, бронходилататоры и противоастматики.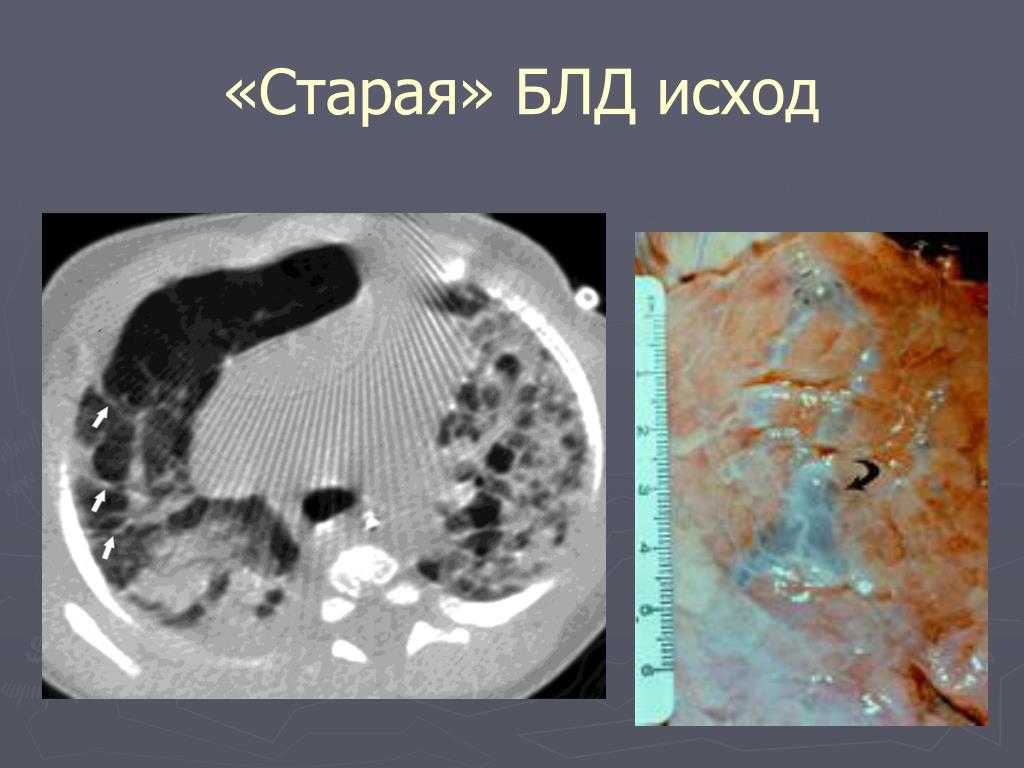
Респираторные последствия бронхолегочной дисплазии у детей, подростков и взрослых | Бойцова
1. Baraldi E., Filippone M. Chronic lung disease after premature birth. N. Engl. J. Med. 2007; 357: 1946–1955. DOI: 10.1056/NEJMra067279.
2. Greenough A, Kotecha S. Bronchopulmonary dysplasia: current models and concepts. Eur. Respir. Mon. 2006; 37: 217–233.
3. Coalson J.J. Pathology of bronchopumonary dysplasia. Semin. Perinatol. 2006; 30 (4): 179–184. DOI: 10.1053/j.semperi.2006.05.004.
4. Овсянников Д.Ю. Бронхолегочная дисплазия: естественное развитие, исходы и контроль. Педиатрия. 2011; 90 (1): 141–150.
5. Богданова А.В., Бойцова Е.В., Старевская С.В. и др. Клинические особенности и течение бронхолегочной дисплазии. Пульмонология. 2002; 1: 28–32.
6. May С., Kennedy C., Milner A.D. et al. Lung function abnormalities infants developing bronchopulmonary dysplasia. Arch. Dis. Child. 2011; 96: 1014–1019. DOI: 10.1136/adc.2011.212332.
7. Glowacka E.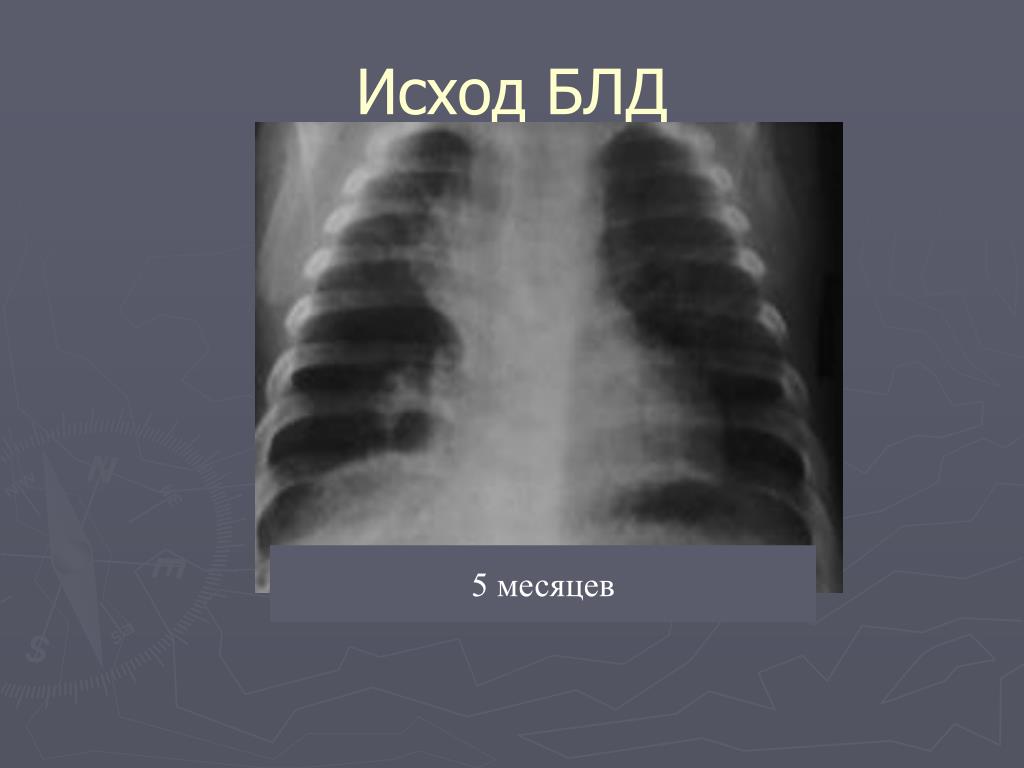 , Lis G. Bronchopulmonary dysplasia – early and long-term pulmonary sequelae. Pneumonol. Alergol. Pol. 2008; 76 (6): 437–445.
, Lis G. Bronchopulmonary dysplasia – early and long-term pulmonary sequelae. Pneumonol. Alergol. Pol. 2008; 76 (6): 437–445.
8. Kwinta P., Lis G., Klimek M. et al. The prevalence and risk factors of allergic and respiratory symptoms in a regional cohort of extremely low birth weight children (<1000 g). Italian J. Pediatr. 2013; 39 (4): 1–11. DOI: 10.1186/1824-7288-39-4.
9. Broughton S., Thomas M.R., Marston L. et.al. Very prematureely born infants wheezing at follow-up:lung function and risk factors. Arch. Dis. Child. 2007; 92 (9): 776–780. DOI: 10.1136/adc.2006.112623.
10. Wong P.M., Lees A.N., French N. et al. Emphysema in yang adult survors of moderate-to-severe bronchopulmonary dysplasia. Eur. Respir. J. 2008; 32: 321–328. DOI: 10.1183/09031936.00127107.
11. Howling S.J., Northway W.H. Jr, Hansell D.M. et al. Pulmonary sequelae of bronchopulmonary dysplasia survivors: high-resolution CT findings. Am. J. Roentgenol. 2000; 174 (5): 1323–1326. DOI: 10.2214/ajr. 174.5.1741323.
174.5.1741323.
12. Guimaraes H., Rocha G., Pissarra S. et al. Respiratory outcomes and atopy in school-age children who were preterm at birth, with and without bronchopulmonary dysplasia. Clinics. 2011; 66 (3): 425–430. DOI: 10.1590/s1807-59322011000300011.
13. Lamarche-Vadel A., Blondel B., Truffer P. et al. Re-hospitalization in infants younger than 29 weeks gestation in the EPIPAGE cohort. Acta. Pediatr. 2004; 93 (10): 1340–1345.
14. Peґrez G., Navarro Merino M. Bronchopulmonary dysplasia and prematurity. Short-and long-term respiratory changes. Ann. Pediatr. 2010; 72 (79): 1–16. DOI: 10.1016/j.anpedi.2009.09.010.
15. McLeod A., Ross P., Mitchell S. et al. Respiratory health in a total very low birthweight cohort and their classroom controls. Arch. Dis. Child. 1996; 74 (3): 188–194. DOI: 10.1136/adc.74.3.188.
16. Northway W.H. Jr, Moss R.B., Carlisle K.B. et al. Late pulmonary sequelae of bronchopulmonary dysplasia. N. Engl. J. Med. 1990; 323: 1793–1799. DOI: 10.1056/NEJM199012273232603.
DOI: 10.1056/NEJM199012273232603.
17. Been J.V., Lugtenberg M.J., Smets E. et al. Preterm birth and childhood wheezing disorders: a systematic review and meta-analysis. PLoS Med. 2014; 11 (1): 1–17. DOI: 10.1371/journal.pmed.1001596.
18. Mai X.M, Gaddlin P.O., Nilsson L. et al. Asthma, lung function and allergy in 12-year-old children with very low birth weight: a prospective study. Pediatr. Allergy Immunol. 2003; 14 (3): 184–192.
19. Siltanen M., Wehkalampi K., Hovi P. et al. Preterm birth reduces the incidence of atopy in adulthood. J. Allergy Clin. Immunol. 2011; 127: 935–942. DOI: 10.1016/j.jaci.2010.12.1107.
20. Mieskonen S.T., Malmberg L.P., Kari M.A. et al. Exhaled nitric oxide at school age in prematurely born infants with neonatal chronic lung disease. Pediatr. Pulmonol. 2002; 33 (5): 347–355.
21. Roiha H.L., Kuehni C.E., Zanolari M. et al. Alterations of exhaled nitric oxide in pre-term infants with chronic lung disease. Eur. Respir. J. 2007; 29: 251–258. DOI: 10.1183/09031936.00016106.
DOI: 10.1183/09031936.00016106.
22. Baraldi E., Bonetto G., Zacchello F. et al. Low exhaled nitric oxide in school-age children with bronchopulmonary dysplasia and airflow limitation. Am. J. Respir. Crit. Care Med. 2005; 171 (1): 68–72. DOI: 10.1164/rccm.200403-298OC.
23. Fawke J., Sooky L., Kirkby J. et al. Lung function and respiratory symptoms at 11 years in children born extremely preterm. Am. J. Respir. Crit. Care Med. 2010; 182 (2): 237–245. DOI: 10.1164/rccm.200912-1806OC.
24. Sue T.L., Stock Korhonen J.P., Laitinen J. et al. Respiratory outcome in school-aged, very-low-birth-weight children in the surfactant era. Acta. Pediatr. 2004; 93: 316–321.
25. Nixon P.A., Washburn L.K., Schechter M.S., O’Shea T.M. Follow-up study of a randomized controlled trial of postnatal dexamethasone therapy in very low birth weight infants: effects on pulmonary outcomes at 8–11 years of age. J. Pediatr. 2007; 150 (4): 345–350.
26. Landry J.S., Chan T., Lands L., Menzies D. Long-term impact of bronchopulmonary dysplasia on pulmonary function. Can. Respir. J. 2011; 18 (5): 265–270.
Long-term impact of bronchopulmonary dysplasia on pulmonary function. Can. Respir. J. 2011; 18 (5): 265–270.
27. Konefał H., Czeszyńska M.B., Merritt T.A. School-age spirometry in survivors of chronic lung disease of prematurity in the surfactant era. Ginekol. Pol. 2013; 84 (4): 286–292.
28. Halvorsen T., Skadberg B.T., Eide G.E .et al. Pulmonary outcome in adolescents of extreme preterm birth: a regional cohort study. Acta. Paediatr. 2004; 93 (10): 1294–1300.
29. Doyle L.W., Cheung M.M., Ford G.W. et al. Birth weight <1501 g and respiratory health at age 14. Arch. Dis. Child. 2001; 84 (1): 40–44.
30. Doyle L.W. Respiratory function at age 8–9 years in extremely low birthweight/very preterm children in Victoria in 1991–1992. Pediatr. Pulmonol. 2006; 41 (6): 570–576. DOI: 10.1002/ppul.20412.
31. Doyle L.W., Faber B., Callanan C. et al. Bronchopulmonary dysplasia in very low birth weight subjects and lung function in late adolescence. Pediatrics. 2006; 118 (1): 108–113. DOI: 10.1542/peds.2005-2522.
DOI: 10.1542/peds.2005-2522.
32. Vrijlandt E.J., Gerritsen J., Boezen H.M. et al. Lung function and exercise capacity in young adults born prematurely. Am. J. Respir. Crit. Care Med. 2006; 173 (8): 890–896. DOI: 10.1164/rccm.200507-1140OC.
33. de Kleine M.J., Roos C.M., Voorn W.J. et al. Lung function 8–18 years after intermittent positive pressure ventilation for hyaline membrane disease. Thorax. 1990; 45 (12): 941–946.
34. Narang I., Rosenthal M., Cremonesini D. et al. Longitudinal evaluation of airway function 21 years after preterm birth. Am. J. Respir. Crit. Care Med. 2008; 178 (1): 74–80. DOI: 10.1164/rccm.200705-701OC.
35. Mieskonen S., Eronen M., Malmberg L.P. et al. Controlled trial of dexamethasone in neonatal chronic lung disease: an 8-year follow-up of cardiopulmonary function and growth. Acta Paediatr. 2003; 92 (8): 896–904.
36. Mitchel S.H., Teague W.G. Reduced gas transfer and during and exercise in shhool-age survivors of bronchopulmonary dyplasia.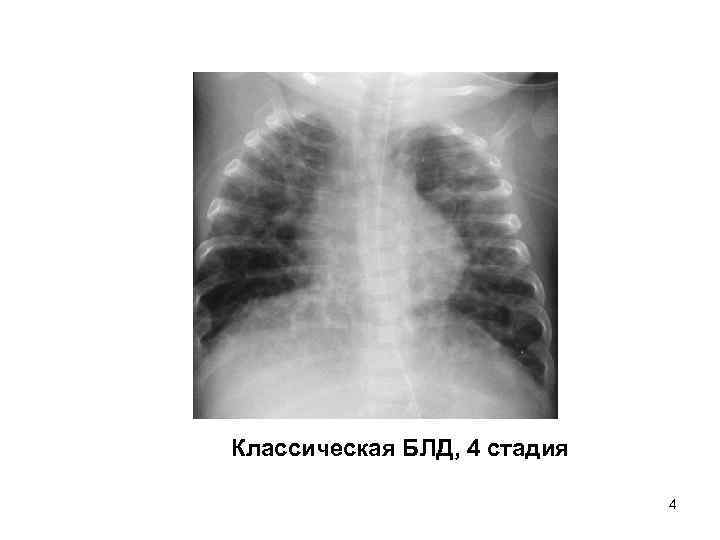 Am. J. Respir. Crit. Care Med. 1998; 157 (5, Pt 1): 1406–1412. DOI: 10.1164/ajrccm.157.5.9605025.
Am. J. Respir. Crit. Care Med. 1998; 157 (5, Pt 1): 1406–1412. DOI: 10.1164/ajrccm.157.5.9605025.
37. Parat S., Moriette G., Delaperche M.-F. et al. Long-term pulmonary functional outcome of bronchopulmonary dysplasia and birth. Pediatr. Pulmonol. 1995; 20 (5): 289–296.
38. Карнаушкина М.А., Струтынская А.Д., Овсянников Д.Ю. Недоношенность и перенесенная в раннем детстве инфекция нижних дыхательных путей как факторы риска развития хронической обструктивной бронхолегочной патологии у взрослых. Современные технологии в медицине. 2017; 9 (1): 129–134.
39. Овсянников Д.Ю., Кустова О.В., Зайцева Н.О. и др. Имидж-диагностика бронхолегочной дисплазии. Вопросы диагностики в педиатрии. 2011; 3 (4): 36–45.
40. Giacoia G.P., Venkataraman P.S., West-Wilson K.I., Faulkner M.J. Follow-up of school-age children with bronchopulmonary dysplasia. J. Pediatr. 1997; 130 (3): 400–408.
41. Aquino S.L., Schechter M.S., Chiles C. et al. High – resolution inspiratory and expiratory CT in older children and adult with bronchopulmonary dysplasia.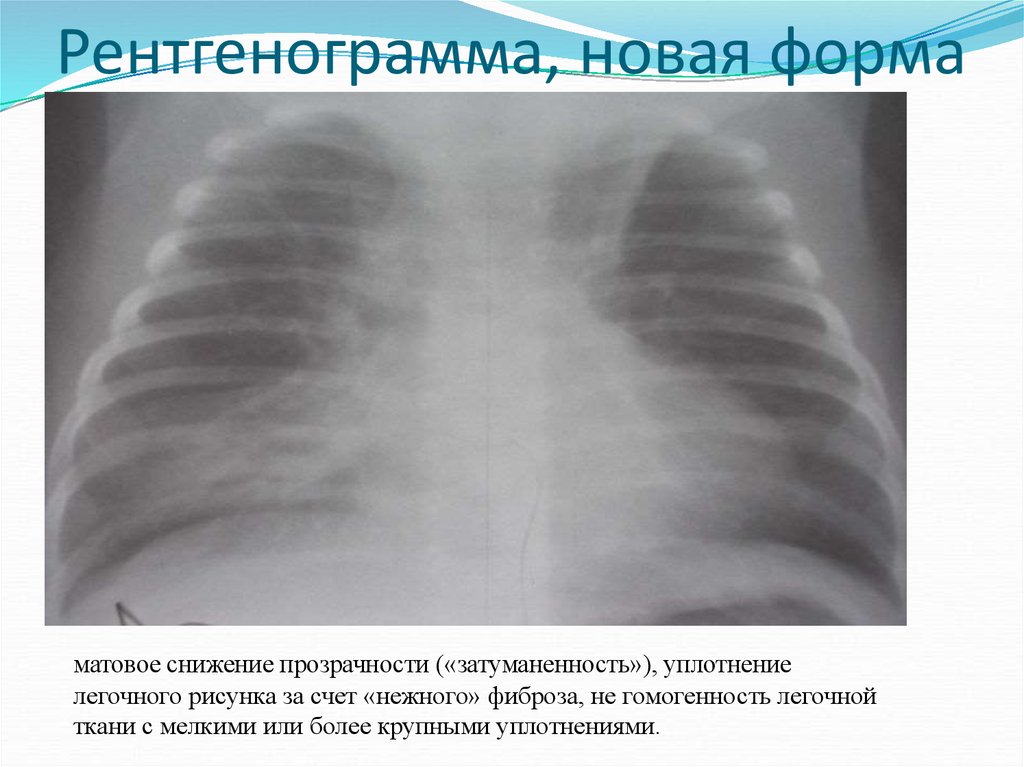 AJR Am. J. Roentgenol. 1999; 173: 963–967. DOI: 10.2214/ajr.173.4.10511158.
AJR Am. J. Roentgenol. 1999; 173: 963–967. DOI: 10.2214/ajr.173.4.10511158.
42. Howling S.J., Northway W.H. Jr, Hansell D.M. et al. Pulmonary sequelae of bronchopulmonary dysplasia survivors: high-resolution CT findings. AJR Am. J. Roentgenol. 2000; 174 (5): 1323–1326. DOI: 10.2214/ajr.174.5.1741323.
43. Aukland S.M., Halvorsen T., Fosse K.R. et al. High-resolution CT of the chest in children and young adults who were born prematurely: findings in a population-based study. AJR Am. J. Roentgenol. 2006; 187 (4): 1012–1018. DOI: 10.2214/AJR.05.0383.
44. Бойцова Е.В., Запевалова Е.Ю., Кирбятьева М.А. и др. Облитерирующий бронхиолит, как исход БЛД. В кн.: Пуринь В.И. (ред.). Областная детская больница: Клинико-диагностические и организационные проблемы. СПб; 2012: 123–129.
45. Карнаушкина М.А., Овсянников Д.Ю., Бойцова Е.В., Малявин А.Г. Хроническая обструктивная болезнь легких: возможный исход бронхолегочной дисплазии. Доктор.Ру. 2014; 2 (90): 10–16.
46. Bader D. , Ramos A.D., Lew C.D. et al. Childhood sequelae of infant lung disease: exercise and pulmonary function abnormalities after bronchopulmonary dysplasia. J. Pediatr. 1987; 110 (5): 693–699.
, Ramos A.D., Lew C.D. et al. Childhood sequelae of infant lung disease: exercise and pulmonary function abnormalities after bronchopulmonary dysplasia. J. Pediatr. 1987; 110 (5): 693–699.
47. Samet J.M., Tager I.B., Speizer F.E. The relation between respiratory illness and chronic air-flow obstruction in adulthood. Am. Rev. Respir. Dis. 1983; 127 (4): 508–523. DOI: 10.1164/arrd.1983.127.4.508.
48. The Global Strategy for the Diagnosis, Management and Prevention of COPD, 2012. http://www.goldcopd.org/
49. Stocks J., Samatha S. Early life influences on the development of chronic obstructive pulmonary disease. Ther. Adv. Respir. Dis. 2013; 7 (3): 161–173. DOI: 10.1177/1753465813479428.
50. Hilgendorff A., O’Reilly M.A. Bronchopulmonary dysplasia early changes leading to long-term consequences. Front Med. 2015; 12 (2): 2–10. DOI: 10.3389/fmed.2015.00002.
51. Reyburn B., Martin R.J., Prakash Y.S., MacFarlane P.M. Mechanisms of injury to the preterm lung and airway: implications for long-term pulmonary outcome. Neonatology. 2012; 101 (4): 345–352. DOI: 10.1159/000337355.
Neonatology. 2012; 101 (4): 345–352. DOI: 10.1159/000337355.
52. Bourbon J.R., Boucherat O., Boczkowski J. et al. Bronchopulmonary dysplasia and emphysema: in search of common therapeutic targets. Trends Mol. Med. 2009; 15 (4): 169–179. DOI: 10.1016/j.molmed.2009.02.003.
53. Чучалин А.Г. (ред.). Хроническая обструктивная болезнь легких. Практическое руководство. М.; 2004.
54. Speer C.P. Inflammation and bronchopulmonary dysplasia: A continuing story. Semin. Fetal. Neonatal. 2006; 11 (5): 354–362. DOI: 10.1016/j.siny.2006.03.004.
55. Cederqvist K., Sorsa T., Tervahartiala T., Maisi P. et al. Matrix metalloproteinases-2, -8, and -9 and TIMP-2 in tracheal aspirates from preterm infants with respiratory distress. Pediatrics. 2001; 108 (3): 686–692.
56. Давыдова И.В., Яцык Т.В., Бершова М.А., Басаргина М.А. Матриксные металопротеиназы как маркеры формирваниябронхолегочной дисплазии. Пульмонология. 2009; (4): 80–84.
57. Doyle L.W., Olinsky A., Faber B., Callanan C. Adverse effects of smoking on respiratory function in young adults born weighing less than 1000 grams. Pediatrics. 2003; 112 (3, Pt 1): 565–569.
Adverse effects of smoking on respiratory function in young adults born weighing less than 1000 grams. Pediatrics. 2003; 112 (3, Pt 1): 565–569.
Бронхолегочная дисплазия (БЛД): обзор, симптомы и лечение
Всеукраинская детская больница
Бронхолегочная дисплазия (БЛД) — это хроническая проблема с дыханием, возникающая у детей, рожденных преждевременно (недоношенными), легкие которых не полностью развиты. У младенцев с развитыми легкими кислород свободно проходит через воздушные мешочки в легких в кровоток. У недоношенных детей легкие развиты не полностью. Это означает, что им нужна помощь в дыхании дополнительным кислородом и дыхательный аппарат (механическая вентиляция легких), который может вызвать повреждение и воспаление в легких. Это вызывает ПРЛ ( 2009/6_lekcija/lekcija_3_5.jpg)
В наиболее тяжелых случаях БЛД легкие рубцуются и воспаляются. БЛД также можно назвать хроническим заболеванием легких.
Причины
Большинство случаев БЛД происходит у недоношенных детей, рожденных на сроке 32 недели или ранее, и
весят менее 4,5 фунтов. Они часто находятся на дыхательном аппарате в течение более длительного времени, поскольку легкие продолжают развиваться.
- Аппараты ИВЛ «дышат» для младенцев, чьи легкие еще не полностью сформированы. Машина
посылает кислород в их слабые легкие. Хотя для их выживания необходима механическая вентиляция легких, со временем давление вентиляции и дополнительное потребление кислорода могут вызвать рубцевание и отек легких. Это может привести к РДС. - Почти половина всех детей с низкой массой тела при рождении будет страдать той или иной формой респираторного дистресс-синдрома (РДС). Если симптомы продолжаются и ребенку требуется кислород на 36-й неделе скорректированной беременности (за 4 недели до первоначальной даты родов), это будет считаться БЛД.
- БЛД также может развиться из-за врожденных (присутствующих при рождении) дефектов легких, пневмонии или любого другого осложнения, вызывающего заболевание у вашего ребенка.
Признаки и симптомы
- Расширенные ноздри
- Быстрое дыхание
- хрюканье
- Шумное дыхание, кашель или свистящее дыхание
- Ретракции грудной клетки (вытягивание грудной клетки)
- Кислород или дыхательный аппарат на 36 неделе беременности с коррекцией
Диагностика
В большинстве случаев ПРЛ диагностируется в возрасте около одного месяца у недоношенных детей, которые все еще нуждаются в дополнительном кислороде и испытывают трудности с дыханием. БЛД может быть диагностировано на 36-й неделе беременности с коррекцией по потребности в кислороде или дыхательном аппарате.
Для диагностики ПРЛ могут потребоваться следующие тесты:
- Рентген грудной клетки – легкие при ПРЛ выглядят губчатыми, в то время как нормальные легкие выглядят прозрачными
- Эхокардиограмма (эхо) – исключает пороки сердца
- Анализы крови – показывают, сколько кислорода в крови и выявляют инфекции
Лечение
ПРЛ не лечится, но поддается лечению. Лечение направлено на поддержку дыхания и потребности в кислороде. Лечение позволяет детям с пограничным расстройством личности расти и развиваться.
Лечение направлено на поддержку дыхания и потребности в кислороде. Лечение позволяет детям с пограничным расстройством личности расти и развиваться.
- Младенцы с пограничным расстройством личности могут находиться в больнице от нескольких недель до нескольких месяцев. Стационарное лечение направлено на помощь при дыхании с помощью:
- Дыхательного аппарата.
- Можно использовать лекарства для улучшения функции легких, такие как Lasix®, albuterol или Flovent®. Они помогают вашему ребенку избавиться от лишней воды в легких и облегчают дыхание.
- Антибиотики для борьбы с инфекцией.
- Кислород, вводимый через назальную канюлю (трубку, которая вставляется прямо в ноздри). Это лечение может потребоваться в течение нескольких недель или месяцев в домашних условиях.
- Большинство младенцев отправляются домой на постоянной подаче кислорода. У них также будет пульсоксиметр для проверки уровня кислорода.

- У некоторых детей также есть монитор апноэ. Это проверяет, дышит ли ваш ребенок, когда он спит.
- Знайте название и номер телефона компании по уходу на дому, чтобы позвонить, если вам потребуются дополнительные запасы кислорода и монитора.
- Последующее наблюдение после выписки необходимо для поддержания развития мозга вашего ребенка. Это также помогает им достичь соответствующих возрасту вех. Можно использовать массаж, речь, музыку или физиотерапию.
- Трубка медицинского устройства может намотаться на шею ребенка. Это может привести к удушью (удушению) или смерти.
- НЕ оставляйте трубки медицинского устройства там, где младенцы или дети могут запутаться в них.
- Поговорите с лечащим врачом вашего ребенка:
- Если ваш ребенок раньше запутывался в трубке.
- Чтобы узнать, что можно сделать, чтобы трубка не намоталась на шею ребенка, например, держите трубку как можно дальше от ребенка.

- Любые другие опасения, связанные с риском удушения трубками медицинского устройства.
- Если ваш ребенок ранен трубкой медицинского устройства, сообщите об этом в FDA. Ваш отчет может предоставить информацию, которая поможет повысить безопасность пациентов. Веб-сайт для создания отчета: www.accessdata.fda.gov/scripts/medwatch/index.cfm?action=reporting.home
Чем заняться дома
- В сезон простуды и гриппа (с ноября по апрель) ваш ребенок должен как можно дольше оставаться дома.
- Часто инъекцию Synagis® делают ежемесячно, по крайней мере, в течение первой зимы в домашних условиях. Synagis® — это инъекция, которая делает RSV, респираторный вирус, менее тяжелым.
- Детям старше 6 месяцев необходимо сделать прививку от гриппа. Любой, кто контактирует с вашим ребенком, должен сделать прививку от гриппа и быть в курсе прививок, особенно от коклюша (коклюша) и Covid.
- Ни в коем случае не подвергайте ребенка воздействию табачного дыма.
 Вторичный и пассивный курение может быть опасным для вашего ребенка. Любое воздействие дыма может усугубить заболевание легких.
Вторичный и пассивный курение может быть опасным для вашего ребенка. Любое воздействие дыма может усугубить заболевание легких.- Ваш ребенок никогда не должен ездить в машине, в которой курили.
- Члены семьи, которые курят, должны принимать меры безопасности в отношении детей с пограничным расстройством личности. Им нужно переодеться и вымыть руки, руки и волосы перед тем, как взять на руки вашего ребенка.
Когда звонить своему поставщику медицинских услуг
Поскольку ПРЛ влияет на дыхание вашего ребенка, вам следует следить за:
- Изменениями в их обычном цвете тела
- Кашель сильнее обычного
- Кашель, который задерживает сон или прием пищи
- Дыхание чаще, чем обычно
- Жесткое, шумное дыхание с ретракциями и/или раздуванием носа
- Усталость, трудно проснуться
- Раздражителен и не может быть успокоен
- Плохое питание или проблемы с едой
- Прием пищи занимает более 30 минут
- Использование ингаляторов и дыхательных процедур чаще, чем обычно
Если вы заметили какие-либо из вышеперечисленных признаков, позвоните медсестре клиники ПРЛ по телефону (614) 722-4509.
Когда звонить 911
Звоните 911 в любое время, когда вашему ребенку угрожает жизнь. Немедленно позвоните, если ваш ребенок не может дышать или ему очень трудно дышать. При звонке убедитесь, что у вас есть список всех лекарств для вашего ребенка.
Если вашего ребенка доставили в отделение неотложной помощи или больницу
- Принесите копию истории болезни вашего ребенка и список лекарств.
- Сообщите персоналу службы неотложной помощи о любых особых потребностях поставщика медицинских услуг.
- Обязательно сообщите врачу отделения неотложной помощи, что ваш ребенок находится на лечении в Комплексном центре бронхолегочной дисплазии (клиника ПРЛ).
Последующее наблюдение
- Ваш ребенок должен находиться под пристальным наблюдением после выписки из отделения интенсивной терапии.
- В течение 1–2 недель после выписки из больницы для вашего ребенка назначат встречу с командой специалистов по ПРЛ.
 В это время группа медицинских работников осмотрит вашего ребенка. Они проверят потребности вашего ребенка в кислороде, его рост, диету и развитие.
В это время группа медицинских работников осмотрит вашего ребенка. Они проверят потребности вашего ребенка в кислороде, его рост, диету и развитие. - Лечащий врач вашего ребенка должен принять его дома в течение первой недели.
БЛД (бронхолегочная дисплазия) (PDF)
HH-I-248 © 2005 г., редакция 2021 г., Национальная детская больница
Вас также может заинтересовать
Блог
Путешествие в отделение интенсивной терапии: точка зрения одного недоношенного родителя
Состояние
Бронхолегочная дисплазия (БЛД)
Педиатрия по всей стране
Поиск прогностического биомаркера легочной гипертензии у детей с бронхолегочной дисплазией
Бронхолегочная дисплазия (БЛД): симптомы, диагностика и лечение
Всеукраинская детская больница
Обзор
Признаки и симптомы
Причины
Диагноз
Уход
Что такое бронхолегочная дисплазия?
Бронхолегочная дисплазия (БЛД), также известная как хроническое заболевание легких, вызывает длительные проблемы с дыханием у недоношенных детей.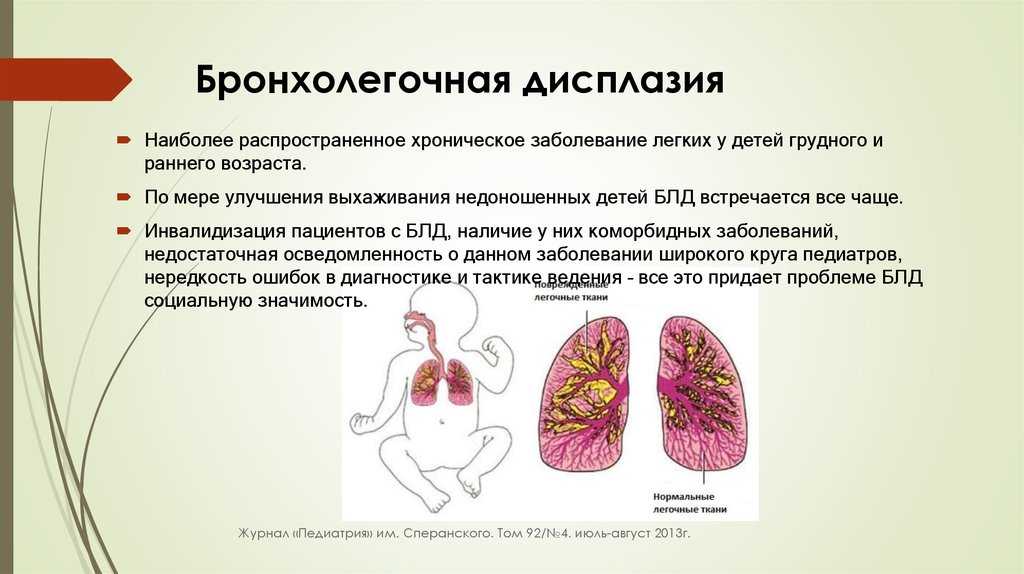 Состояние часто приводит к плохому росту и развитию.
Состояние часто приводит к плохому росту и развитию.
По оценкам, от 10 000 до 15 000 детей в США ежегодно заболевают ПРЛ. Лекарства нет, но его можно вылечить, и большинство детей проживут долгую и здоровую жизнь.
Каковы симптомы ПРЛ?
У детей с пограничным расстройством личности обычно проявляются признаки дыхательной недостаточности, в том числе:
- Учащенное дыхание
- Расширяющиеся ноздри
- хрюканье
- Потягивание за грудь (втягивание)
Что вызывает ПРЛ?
Когда дети рождаются недоношенными, их легкие часто не полностью развиты, и им требуется помощь при дыхании. Эта помощь при дыхании обычно исходит от механического вентилятора или кислорода. В большинстве случаев бронхолегочная дисплазия развивается после того, как недоношенный ребенок получает такую помощь при дыхании в течение определенного периода времени, потому что она может повредить их и без того хрупкие легкие.
БЛД также может быть вызвано другими состояниями, с которыми легкие ребенка еще не справляются, такими как:
- Врожденные (присутствующие при рождении) пороки развития легких
- Пневмония
- Другие инфекции
Как диагностируется ПРЛ?
Почти половине всех недоношенных (родившихся на 32-й неделе беременности или раньше) и детей с низкой массой тела при рождении (весом менее 4,5 фунтов) требуется вспомогательная вентиляция легких. БЛД обычно не диагностируется до достижения ребенком возраста 28 дней (36 недель после зачатия) и обычно только в том случае, если ему все еще требуется дополнительный кислород и/или продолжают проявляться признаки дыхательной недостаточности. Другие факторы, которые учитываются при постановке диагноза, включают:
- Недоношенность
- Инфекция
- Зависимость от вентилятора
- Воздействие кислорода
Для постановки диагноза могут быть использованы следующие тесты:
- Рентген грудной клетки : Легкие детей с респираторным дистресс-синдромом часто выглядят как матовое стекло, а дети с пограничным расстройством личности часто выглядят губчатыми.

- Анализы крови : Это показывает, сколько кислорода находится в кровотоке, и помогает выявить любую инфекцию.
- Эхокардиограмма : помогает исключить пороки сердца как причину проблем с дыханием у ребенка.
Как лечится ПРЛ?
Младенцы с пограничным расстройством личности могут находиться в больнице в течение нескольких недель или даже нескольких месяцев. Стационарное лечение направлено на поддержку дыхания и потребности в кислороде с помощью следующих средств:
- Механическая вентиляция легких
- Лекарства для поддержки функции легких
- Антибиотики для борьбы с инфекциями
Последующее наблюдение или амбулаторное лечение продолжают важную работу по развитию нервной системы, которая начинается, когда ребенок проходит лечение в стационаре, чтобы убедиться, что он соответствует возрастным вехам. Это лечение включает:
- Лечебный массаж
- Музыкальная терапия
- Логопедия
- Физиотерапия
Узнайте больше о нашем
Комплексный центр бронхолегочной дисплазии или Познакомьтесь с нашей командой
Вас также может заинтересовать
Блог
Путешествие в отделение интенсивной терапии: точка зрения одного недоношенного родителя
Финли — чемпион.