Дисбактериоз у новорожденных и грудных детей | Bifiform ru
В норме микрофлора кишечника состоит в среднем из 1 млн микробов на 1 мл содержимого. Нормальную микрофлору составляют 15-20 представителей анаэробных (бактерии, которые не могут жить в присутствии кислорода) и аэробных (способных существовать в присутствии кислорода) бактерий основных родов: бактероиды, бифидобактерии, лактобактерии и другие. Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Здоровая микрофлора участвует в пищеварительных процессах организма, усиливает активность пищеварительных ферментов, действует на моторику желудочно-кишечного тракта, способствует выработке витаминов, гормонов, аминокислот и повышает иммунитет.
Также микрофлора выполняет детоксикационную и антиаллергенную функции. Защитные функции кишечника сводятся к созданию барьера для размножения болезнетворных бактерий и разрушения аллергенов. Нормальная микрофлора также обладает антиоксидантными, антимутагенными и противораковыми функциями1,2
Формирование микрофлоры
Формирование и функционирование иммунной системы происходит в 2 этапа. Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Второй этап — начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
В становлении нормальной микрофлоры ребенка особенно важную роль играют бифидобактерии. Количество бифидобактерий в кишечнике ребенка, находящегося на грудном вскармливании, быстро нарастает в первые недели его жизни. В течение первого года жизни меняется видовой состав кишечной микрофлоры, что связано с различными периодами в жизни ребенка: периодом грудного вскармливания до введения прикорма, после введения прикорма, после появления в рационе твердой пищи, после прекращения грудного вскармливания.
Нормальная микрофлора ребенка
Микрофлора обусловливает защиту слизистой кишечника от внедрения патогенных микроорганизмов, поддерживает и активирует иммунную систему, участвует в обмене белков, липидов, углеводов, выполняет антиаллергическую функцию, участвует в синтезе аминокислот, витаминов, гормонов, влияет на пищеварительные функции желудочно-кишечного тракта 1.
Пробиотический комплекс Бифиформ Бэби можно давать даже новорожденным с первых дней жизни. Его основное назначение – формирование сбалансированной микрофлоры кишечника, в том числе, при различных проблемах, связанных с кормлением. Особый комплекс бактерий может способствовать профилактикекишечных расстройств различного характера, включая колики 4.
Нормальную микрофлору кишечника составляют множество видов микроорганизмов. Одни из значимых и изученных на сегодняшний день:
Бифидобактерии
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта человека. Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин. Способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D 6.
Лактобактерии
Уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие 6
Нарушения микрофлоры
Дисбактериоз является нарушением качественного и количественного состава микрофлоры кишечника. Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Дисбактериоз у грудных детей может проявляться в виде изменения частоты, состава и цвета стула, нарушения процессов переваривания пищи, повышенного газообразования, беспокойного поведения ребенка, плача, повышенной раздражительности, плохого аппетита и сна, ухудшение состояния кожного покрова и даже аллергических реакций 3.
Причины возникновения дисбактериоза у новорожденных и грудничков
В группе риска по нарушению баланса микрофлоры находятся дети, мамы которых имели различные осложнения в период беременности и родах, а также дети, находящиеся на искусственном вскармливании, недоношенные. Простудные заболевания, прием некоторых лекарственных препаратов (лечение антибиотиками) могут приводить к нарушениям баланса микрофлоры кишечника.
Сдача анализов
При возникновении симптомов недомогания у Вашего ребенка, обязательно проконсультируйтесь с врачом. Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Как правильно собрать кал для анализа на дисбактериоз:
Кал собирается в стерильную баночку, предварительно прокипяченную вместе с крышкой в течение 20 минут. Посуда для анализа, на основании результатов которого будет проводиться лечение дисбактериоза у грудных детей, должна храниться в холодильнике не более суток. Собранный в стерильную емкость анализ доставляется в лабораторию в течение 2 часов (не позднее). Результаты подготавливаются через 7-10 дней.
Для получения информации о том, где можно приобрести Бифиформ Бэби , посетите раздел «Где купить».
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
- Донских Е.Е. Микрофлора — Дисбактериоз у детей http://lekmed.ru/info/literatyra/disbakterioz-y-detei.html
- Корниенко Е.А., Мазанкова Л.Н., Горелов А.В. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины. Лечащий врач 2015.
- И.А. Беляева. Пробиотические добавки для коррекции младенческих колик: перспективы использоавния.
- Беляева И.А., Митиш М.Д., Катосова Л.К. Эффективность использования пробиотиков у недоношенных детей. РМЖ 2009.
- Рыбальченко О.В., Бондаренко В.М. Оценка микробиоты и пробиотических штаммов с позиций новых научных технологий. Фарматека №11, 2016
- Бельмер С.В., Малкоч А.В. Кишечная микрофлора и значение пребиотиков для ее функционирования. Лечащий врач 2006, 4
PP-BIB-RUS-0082
Как победить состояние дисбактериоза у детей?
Дисбактериоз в последнее время — весьма распространённое состояние у детей, особенно у грудничков. Оно доставляет дискомфорт малышам, ухудшая их общее состояние, самочувствие, мешает нормальному набору веса ребенка и причиняет массу беспокойств их родителям. Кроме того, микрофлора играет немаловажную роль в жизнедеятельности человека. Она регулирует перистальтику кишечника, поддерживает и стимулирует иммунную систему, синтезирует многие витамины, обеспечивает противовирусную защиту хозяина, нормализует обменные процессы, помогает усваивать многие микроэлементы и аминокислоты, помогает очищать организм от токсинов и препятствует проникновению чужеродных микробов в кровь. Всего в организме человека в кишечнике в высушенном виде находится 1,5 килограмма полезных микробов – это целый «орган». Их деятельность, значимость, можно сравнить с функцией двух органов печени и почек вместе взятых! О причинах возникновения дисбактериоза и методах борьбы с ним рассказывает заведующий отделением детской гастроэнтерологии Челябинской областной детской клинической больницы, врач высшей категории Вадим Земляков.
Оно доставляет дискомфорт малышам, ухудшая их общее состояние, самочувствие, мешает нормальному набору веса ребенка и причиняет массу беспокойств их родителям. Кроме того, микрофлора играет немаловажную роль в жизнедеятельности человека. Она регулирует перистальтику кишечника, поддерживает и стимулирует иммунную систему, синтезирует многие витамины, обеспечивает противовирусную защиту хозяина, нормализует обменные процессы, помогает усваивать многие микроэлементы и аминокислоты, помогает очищать организм от токсинов и препятствует проникновению чужеродных микробов в кровь. Всего в организме человека в кишечнике в высушенном виде находится 1,5 килограмма полезных микробов – это целый «орган». Их деятельность, значимость, можно сравнить с функцией двух органов печени и почек вместе взятых! О причинах возникновения дисбактериоза и методах борьбы с ним рассказывает заведующий отделением детской гастроэнтерологии Челябинской областной детской клинической больницы, врач высшей категории Вадим Земляков.
— Вадим Леонидович, дисбактериоз некоторые врачи считают болезнью. Каково Ваше мнение по этому поводу?
— Дисбактериоз – это состояние, которое может развиваться при различных заболеваниях или неблагоприятных окружающих условиях человека. Приведу простой пример: вы сидите на лекции или в кино, в зале душно нарастает количество углекислого газа в воздухе. В этой ситуации постепенно начинает развиваться состояние дисбактериоза. На работе отругал начальник, человек получил новую порцию стресса, усилилась моторика кишечника, положено начало к развитию состояния дисбактериоза. На нормальную кишечную флору, и не только кишечную, но и на флору всех полостных органов влияет: неправильное питание, плохая экология, изменение климата, различные ионизирующие излучения, которые окружают человека в повседневной жизни, воспалительные заболевания, прием лекарственных средств. Но это не болезнь – это изменение флоры (состояние временное) в зависимости от внешних условий воздействия.
— Дисбактериоз может быть только в кишечнике или этому подвержены все слизистые оболочки организма?
— Нарушенная кишечная флора будет отрицательно действовать на слизистую всех полостных органов в которых она имеется (полость рта, пищевод, желудок, кишечник, влагалище и др.). Здесь появляется цепочка взаимосвязей: болезнь слизистой кишки влияет на состояние микрофлоры, нарушенная микрофлора – на слизистую.
— По каким признакам родители могут определить, что у ребенка имеется состояние дисбактериоза?
— Родителям стоит задуматься, если у ребенка снижается аппетит, ребенок бледный с синюшными кругами под глазами и под носом. Если у ребенка периодически отмечается подташнивание, бурчание и боли в животе, меняется стул, в кале присутствует зелень или кусочки непереваренной пищи. Ребенок плохо прибавляет в весе, срыгивает, начинает часто болеть простудными заболеваниями. Возможно, вечером, а именно в семь часов, отмечается субфебрильная температура — 37,1-37,2.
 При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.
При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.— Насколько состояние кишечной флоры влияет на иммунитет ребенка?
— При изменении кишечной микрофлоры ребенка в худшую сторону происходит снижение иммунитета. Когда у ребенка появляются частые простудные заболевания, это тоже говорит о том, что органы пищеварения не позволяют иметь 100%-ный иммунитет. Ведь у человека иммунитет на 98% зависит от состояния микрофлоры толстой кишки. И когда она нарушается, иммунитет падает, а, значит, появляются частые простуды.
— То есть, если у родителей часто болеет ребенок, они должны задуматься о посещении гастроэнтеролога?
— Как один из моментов. Мы знаем, что многие болезни: кожи, зубов, слизистых, вплоть до бронхиальной астмы, – это порой осложнение болезней органов пищеварения. Когда мне задают подобные вопросы, я сразу вспоминаю один случай: выходит конферансье на сцену и говорит: «У меня сегодня что-то болит голова».
 Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.
Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.— Как врач определяет наличие у ребенка состояния дисбактериоза?
— Существуют различные методы исследования микробной флоры у человека. Очень важно при оценке анализа кала на дисбактериоз учитывать возраст пациента, принципы его питания, период посева: как его собирали, и когда был сдан кал. И без учета данных факторов нельзя правильно оценить полученный результат. Потому что цифры в конечном итоге будут разные. Приведу простой пример: если пациент употребляет больше кисломолочных продуктов, то у него бактерий coli будет значительно меньше, но это не значит, что это болезнь. Если он ест больше мяса, у него бактерий coliбудет больше, а бифидум меньше и так далее. Поэтому сам анализ нужно интерпретировать с учетом этих всех моментов.
— Когда ребенок сдает анализ, все эти факторы обследуются досконально?
— Нет, конечно.

— Тогда получается нельзя с точностью определить у ребенка наличие дисбактериоза?
— Без учета данных факторов нельзя. Поэтому многие родители, когда обращаются к нам за помощью, часто удивляются, почему мы спрашиваем все тонкости и подробности питания, которые в принципе никто никогда не спрашивает. Поэтому мы положительно отличаемся и в плане лечения, и в плане диагностики, и в плане результата. И поэтому к нам всегда огромная очередь.
— Какие методы лечения состояния дисбактериоза существуют и надо ли его вообще лечить?
— Лечить обязательно надо! Начинать лечение необходимо с основного заболевания, приведшего к этому состоянию или с той причины, которая привела к нему. Естественно, первично назначаются лекарственные препараты, которые воздействуют непосредственно на устранение основной причины. Предположим, у ребенка имеется гастрит, проводится его лечение и плюс назначаются препараты улучшающие микрофлору кишечника ребенка. Если ребенок находится в помещениях, где имеются различные домашние «приборы-излучатели» (телевизор, компьютер, микроволновая печь, радиотелефон, и другие, то, соответственно, их необходимо использовать, как можно реже.
 Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.
Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.— Врач сможет точно определить, отчего именно развился дисбактериоз?
— Чаще всего, мы видим причину.
— Существует ли профилактика дисбактериоза?
— В первую очередь необходимо следить за состоянием здоровья ребенка. Обязательно нужно придерживаться принципов здорового питания. В ежедневном рационе ребенка должна содержаться растительная клетчатка (овощи, фрукты, зерновые каши), которая способствует восстановлению кишечной микрофлоры. Естественно, набор должен быть полный: микроэлементы, витамины, ферменты. В рационе должна преобладать растительная пища, обязательно ребенку необходимо употреблять кисломолочные продукты и белки, в виде яиц, мяса, курицы, рыбы.
 Это будет способствовать восстановлению нормальной кишечной флоры.
Это будет способствовать восстановлению нормальной кишечной флоры.— Можно вести здоровый образ жизни, но ведь от стрессов и излучений уберечься гораздо сложнее. Какой выход в этом случае?
— Единственный – избавиться от источника негатива. Если, допустим, у вас стресс на работе, то нужно заменить место работы. И это абсолютно серьезно, ведь мы живем один раз. Быть в постоянном стрессе и лечиться от болезней – это не лучшее решение проблемы. Это просто бессмысленно. Не зря считают японцы, что место работы надо менять один раз в пять лет. И на каждом предприятии у них имеется комната разгрузки, в которой стоят муляжи начальников. Если начальник тебя обидел, заходишь в эту комнату и имеющейся там палкой лупишь по данному муляжу. Начальника, чей муляж разрушается быстрее остальных, увольняют с предприятия. Это и есть профилактика болезней у сотрудников и борьба за более высокую производительность на предприятии.
— Получается, что также не рационально жить в Челябинской области, где экология не самая лучшая?
— Безусловно, проживать у Средиземного моря или в горах Грузии гораздо полезнее, чем в Челябинской области.
 Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.
Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.— А какова роль наследственности в развитии болезней ЖКТ?
— Безусловно, большую роль в здоровье ребенка играет здоровье его родителей. Они передают ему предрасположенность к заболеваниям органов пищеварения. Если мама нездорова, то качество ее грудного молока будет низким, что является следующим фактором не в пользу ребенка.
— Во время грудного вскармливания мама должна соблюдать особый режим питания или диету?
— Питание должно быть полноценным и разнообразным.
— Какие продукты детям не рекомендуется употреблять в пищу?
— Существует пять основных вредных продуктов – это газированные напитки, майонез, кетчуп, чипсы и жевательная резинка. Это все продукты генной инженерии. Например, длительное использование жевательной резинки приводит к слабоумию (наличие в ней фенолов). Более того, она покрыта вредным вкусообразующим веществом. А частое ее использование ведет к нарушению пищевого рефлекса. И в следующий раз при глотании пищи желудок не будет готов к ее перевариванию.

— А какие продукты лучше не давать до трех лет?
— Все продукты до трех лет должны быть натуральными, не консервированными! Использовать их можно в сыром или вареном виде. Жареное и копченое, маринованное, шоколадное, естественно, нельзя. Хотя в последнее время надо уже говорить и о вредных привычках у детей раннего возраста, когда малышам матери начинают давать по чайной ложке водки на ночь, чтобы они лучше спали. А для аппетита детям стали давать пиво. Это встречается достаточно часто в последнее время. К нам поступают дети раннего возраста с циррозом печени, потому что мама, вскармливая ребенка грудью, употребляла алкогольные напитки и курила.
— Как вы относитесь к употреблению молока в питании детей?
— Учитывая тот факт, что идеально здоровых детей нет, употребление молока многим из них может быть не на пользу. Молоко может способствовать излишнему росту микрофлоры, а порой, организм ребенка не способен его переварить (лактазная недостаточность).
 Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.
Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.— Если ребенок вынужден принимать антибиотики, что нужно делать в профилактических целях, чтобы не развился дисбактериоз?
— Лучше всего прием антибиотиков сочетать с отваром трав, например, тысячелистника, подорожника, ромашки или душицы. Они на 80% снижают отрицательное воздействие антибиотиков на слизистую кишечника и его микрофлору.
— Как часто встречаются заболевания органов пищеварения?
— Заболевания желудочно-кишечного тракта у детей находятся на втором месте после респираторных инфекций. И это если учесть, что ребенок болеет ОРВИ 2-3 раза за год, а диагноз заболевания ЖКТ ставится однократно.
— Вы лечите детей только с области или из Челябинска тоже?
— ЧОДКБ обслуживает жителей Челябинской области вне зависимости от ее территорий, то есть сюда входит и Челябинск. Но учитывая тот факт, что в Челябинске имеются в достаточном количестве гастроэнтерологические койки и специалисты, диагностика тоже на высоком уровне, мы стараемся брать из Челябинска только самые тяжелые и сложные случаи.
 И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.
И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.— Каким образом дети попадают к вам?
— Они приезжают по направлению врачей из территорий области на консультативный прием в детскую областную поликлинику к специалисту-гастроэнтерологу. Осмотрев ребенка, и проведя необходимые исследования, врач решает необходимость его госпитализации или лечения в амбулаторных условиях. Вторым вариантом прибытия пациента в областную детскую поликлинику или на госпитализацию в отделение является осмотр врача-гастроэнтеролога «выездной поликлиники». Это когда наши специалисты консультируют детей по месту их проживания.
Ольга Мельчакова, информационное агентство «Уралпресс»
Дисбактериоз у детей
Дисбактериоз у детей – явление очень частое. К счастью, диагнозом дисбактериоз кишечника не является, то есть не входит в международную классификацию болезней. Тем не менее, дисбактериоз существует, и в особенности часто у детей.
Что же такое дисбактериоз?
Ребенок, как мы с Вами знаем уже из предыдущих статей, рождается в этом мире абсолютно стерильным. Важным моментом в формировании на коже новорожденного малыша и его слизистых оболочках поверхностной микрофлоры является прохождение ребенка по родовым путям матери и первый контакт с ее кожей, когда младенца акушеры должны выложить на мать. В первые часы жизни новорожденного начинается самое активное заселение поверхностей его тела множеством бактерий, которые в дальнейшем должны сформировать защитный слой везде, где возможен контакт наших с вами оболочек (кожи, слизистого эпителия) с возбудителями опасных инфекций.
Если в эти первые часы жизни в организм ребенка попадут помимо условно хороших бактерий еще и не очень хорошие, или патогенные бактерии, то у ребенка с самого момента его появления на свет будет нарушено состояние поверхностной защиты, иными словами, пленка может оказаться с дырками. Через эти слабые места в дальнейшем возможно попадание в организм различных аллергенов, вирусов и бактерий.
Точно также «дырки в защитной пленке» образуются в результате применения различных химиотерапевтических препаратов, прежде всего, антибиотиков.
Отсюда вывод: если мама ребенка во время беременности или во время лактации (кормления грудью), или же сам ребенок сразу после рождения получали антибиотики, дисбактериоз обеспечен.
А как следствие дисбактериоза возникают проблемы с аллергией, вплоть до непереносимости белка материнского молока. В настоящее время уже появились анализы на антитела IgE и IgG грудного ребенка к белку не только коровьего, но даже грудного материнского молока.
Как мы можем вылечить дисбактериоз?
Справедливости ради надо сказать, что вылечить дисбактериоз нельзя, поскольку это не болезнь, как уже написано выше. Но если в микробиологическом анализе кала на дисбактериоз высеиваются патогенные бактерии, то это – не дисбактериоз, а кишечная инфекция, которая лечится, увы, антибиотиками.
Во всех остальных случаях нарушения нормальной микрофлоры кишечника, запомните, дисбактериоз Не лечится антибиотиками!
В настоящее время принято очень много схем лечения дисбактериоза, которые включают различные бактериофаги – специальные вирусы, которые паразитируют на плохих микробах, во все схемы лечения дисбактериоза обязательно входят сорбенты – препараты, связывающие и выводящие из организма токсины патогенных бактерий, а также пищевые аллергены.
Но основным методом лечения дисбактериоза кишечника по-прежнему остается длительный прием пробиотиков, то есть колоний хороших, полезных бактерий, которые очень нужны для правильного пищеварения и профилактики аллергии у детей, кто бы и что Вам не говорил.
Лечение дисбактериоза – это длительный и сложный процесс, но стоит того, чтобы предотвратить у ребенка развитие хронического запора или остановить развитие атопического дерматита.
Самостоятельно нельзя начинать прием никаких препаратов для лечения дисбактериоза, так как любые препараты имеют и плюсы, и минусы, то есть возможные побочные эффекты, и только грамотный врач педиатр, аллерголог илигастроэнтеролог должны подобрать и контролировать необходимый курс лечения.
Дисбактериоз у детей, симптомы и лечение
Каждая вторая мама знакома с таким недугом, как дисбактериоз кишечника у детей. Особенно активно он прогрессирует при ослаблении иммунной системы малыша.
Дисбактериоз представляет собой сбой в работе кишечника из-за нарушения баланса полезных и «вредных» бактерий в желудочно-кишечном тракте. Устранение дисбактериоза кишечника у детей значительно повышает качество жизни как малыша, так и мамы.
Дисбактериоз – нарушение соотношения нормальной микрофлоры кишечника. Состояние редко имеет идиопатический характер, не является самостоятельным заболеванием. Развивается в любом возрасте, более уязвимы грудные дети. Чтобы противостоять дисбактериозу, стоит ознакомиться с провоцирующими его факторами и знать, что делать при дисбактериозе кишечника у ребенка
Причины дисбактериоза и кишечный иммунитет
Перед рождением ребенок находится в стерильных условиях, его кишечник также стерилен. После первого сосания груди и приема молозива поступают питательные вещества, иммунные комплексы, гормоны, полезные бактерии. В течение последующих 5–7 дней бактериальные клетки колонизируются, подавляется рост патогенных микроорганизмов. У ослабленных и недоношенных малышей дисбаланс кишечной микрофлоры может развиваться самостоятельно, без фонового заболевания
Причины дисбактериоза у детей до года:
- неправильное питание кормящей женщины,
- резкая отмена грудного вскармливания,
- снижение иммунного ответа,
- кормление искусственными смесями,
- заражение золотистым стафилококком,
- прием антибактериальных средств.
Этиология дисбактериоза у детей после 1 года связана с глистной инвазией, частыми простудными болезнями, ослаблением моторики и ферментативной недостаточностью кишечника, подверженностью стрессовому воздействию. Все перечисленные состояния ведут к снижению иммунной реакции.
Местный иммунитет в кишечнике играет колоссальную роль в борьбе с патогенной микрофлорой, вирусными и бактериальными агентами. Клеточные макрофаги расщепляют и поглощают поступившие антигены.
Последствия ослабления иммунитета и возникновения дисбактериоза
Первым признаком дисбактериоза кишечника у детей является нарушение отхождения кашицеобразного стула. Он становится жидким, с резким кислым запахом, цвет от бледно-желтого до болотно-зеленого или отмечаются стойкие запоры с болезненным актом дефекации.
Другие последствия:
- урчание в животике;
- повышенное газообразование;
- появление колик у малыша, сопровождающееся болями;
- аллергические высыпания на фоне интоксикации;
- отставание в физическом развитии – недостаток витаминов группы В, витаминов Е, Д.
При выявлении подобных признаков рекомендовано обращение в клинику к педиатру. Только специалист сможет объективно оценить состояние здоровья малыша.
Первый сигнал о дисбактериозе – появление сыпи разной локализации на теле, которая чешется и для которой характерен полиморфизм высыпания. Так проявляются аллергические реакции на коже.
Что делать при дисбактериозе у малышей?
Коррекция дисбактериоза кишечника у детей направлена на устранение причины и симптомов нарушения. Женщинам, желающим узнать, как помочь малышу при коликах и газах, желательно ознакомиться с советами доктора. Зачастую специалист назначает:
- бактериофаги;
- пероральные сорбенты;
- ферментативные средства;
- ветрогонные препараты;
- назначают пробиотики для малышей, чтобы заселить микрофлору, или пребиотики для стимуляции роста собственных колоний;
- иногда антибиотик;
- прием интерферонов.
Для коррекции дисбиоза также показаны прогулки на свежем воздухе, дополнение рациона питания пробиотическими продуктами и нормализация режима сна и отдыха детей
Как поддержать естественную микрофлору
Поддерживать естественную микрофлору кишечника могут помочь капли для приема внутрь – Аципол® Малыш, капли. Они относятся к биологически активным добавкам, в состав которых входит необходимое количество колониеобразующих организмов – лактобактерии, бифидобактерии.
Способ дозирования средства очень прост – есть насадка-дозатор. Разводить вещество не нужно, оно выпускается в суспензии. Согласно инструкции по применению, Аципол® Малыш, капли дают ребенку 1 раз в день по 5 капель, допускается добавление в смесь, воду.
Действие компонентов Аципол® Малыш, капли
Действие Аципол® Малыш, капли сходно с аналогичными средствами, относящимися к группе пробиотиков. Лактобактерии и бифидобактерии заселяют желудочно-кишечный тракт и оказывают благотворное влияние на организм.
Образующиеся колонии полезных бактерий вытесняет патогенную микрофлору. Результатом использования такого средства служит нормализация стула малыша, уменьшение болей в животике, снижение интоксикации.
Стоит отметить, что применение только Аципол® Малыш, капли при дисбактериозе кишечника у детей нецелесообразно, обязательна комплексная терапия с применением лекарственных препаратов, которые вам назначит специалист вместе с Аципол® Малыш, капли
При выявлении первых признаков дисбактериоза у ребенка следует обратиться за медицинской помощью к профилирующему специалисту. Причин развития патологического состояния много, только специалист может определить этиологию недуга и назначить адекватное лечение с учетом возраста ребенка и степени тяжести патологии.
симптомы, анализ, лечение в 2021 году
Есть ли жизнь в кишечнике?В человеческом организме есть немало мест, где очень «уютно» различным микроорганизмам. Они есть в носоглотке, легких, влагалище, кишечнике. При этом наличие маленьких жителей вовсе не означает, что человек чем-то болен. Если и микроорганизмы, и их «хозяин» чувствуют себя отлично, то такое мирное соседство называется симбиозом. Комбинацию бактерий для каждого определенного места их сосуществования принято называть микрофлорой.
Источник фото: http://alfa-med.su/
Если ее количественный и качественный состав позволяет организму пребывать в здоровом состоянии, то он считается оптимальным для данного человека и называется эубиозом. Если же в силу каких-то причин состав и свойства микрофлоры нарушаются, начинается дисбактериоз. Чаще всего этот термин употребляется для характеристики нарушений микрофлоры кишечника, хотя дисбактериоз может возникнуть и в других местах обитания микроорганизмов.
Ребенок рождается, попадая из стерильной среды в мир, где обитает множество бактерий. Первое заселение его организма маленькими обитателями – бактериями, грибками – происходит еще во время прохождения по родовым путям. Следующий этап – первое прикладывание к груди. С капельками материнского молозива малыш получает полезные бактерии – залог будущего крепкого иммунитета. Ведь микрофлора кишечника выполняет множество важных функций:
- участвует в производстве витаминов группы В, витамина К, никотиновой кислоты, стимулирует деятельность органов кроветворения;
- поддерживает газообмен в кишечнике в пределах нормы;
- участвует в синтезе аминокислот и фиксации азота воздуха;
- способствует обмену холина, мочевой кислоты, а также желчных и жирных кислот;
- повышает активность ферментов тонкого кишечника;
- выделяет специальные вещества, стимулирующие перистальтику кишечника, влияет на процессы всасывания воды;
- способствует оптимальному делению и обновлению клеток слизистой оболочки кишечника;
- стимулирует выработку лимфоидными клетками иммуноглобулинов и лизоцима, которые препятствуют проникновению в организм инфекций.
Но кроме полезных микроорганизмов (бифидо- и лактобактерий), в кишечнике также живут и условно-патогенные. Они тоже необходимы организму, но в определенных условиях могут вызывать различные заболевания. К ним относятся энтерококки, клебсиелла, стафилококки, стрептококки, грибы рода Кандида и другие. Если баланс между «хорошими» и «плохими» не нарушен, то ничего страшного не происходит. Но случается, что условно-патогенная флора начинает усиленно размножаться, подавляя полезную. Возникает дисбактериоз.
Миф, симптомы, болезнь или диагноз?Наверное, ни один диагноз не вызывает столько разногласий у медиков, как дисбактериоз. Одни вообще не верят в его существование, другие готовы обвинить его в самых различных болезнях – от атопического дерматита и язвы до кариеса.
Интересный факт: в международной классификации болезней, принятой ВОЗ, такой диагноз вообще отсутствует. Этот синдром может быть спутником многих заболеваний и не имеет специфической симптоматики. Нарушение микрофлоры – это последствие болезней, а не их причина. Поэтому лечить нужно не дисбактериоз, а заболевание, его вызвавшее.
Признаки, по которым мама может заподозрить у ребенка наличие дисбактериоза (частые поносы или запоры, срыгивания, метеоризм, кишечные колики, плохой аппетит и недобор веса), могут свидетельствовать как о другом заболевании желудочно-кишечного тракта, так и о ситуативных проблемах. Соответственно, когда уходит проблема – дисбактериоза кишечника тоже не будет.
Источник фото: http://medic-mir.ru/
Причины и следствияУ детей дисбактериоз связан с недостаточно сформированными защитными реакциями организма и факторами риска, которым подвергается малыш с момента рождения. Эти факторы зависят от возраста ребенка.
Возраст ребенка | Факторы риска развития дисбактериоза |
|---|---|
Новорожденный |
|
Ребенок грудного возраста |
|
Ребенок школьного возраста |
|
Вопреки распространенному мнению, применение антибиотиков по стандартной схеме (5 – 7 дней) и согласно возрастным нормам вызвать дисбактериоз у детей не может. Такое нарушение может возникнуть лишь в том случае, если курс антибиотика длительный (более 14 дней), сам препарат широкого спектра действия, а пациент страдает иммунными нарушениями. Во всех остальных случаях баланс флоры восстанавливается самостоятельно сразу же после отмены лечения.
Источник фото: http://facekid.ru
Анализ кала на дисбактериоз у грудничка, лечениеТак нужно ли сдавать такой популярный анализ на дисбактериоз? Практикующие медики говорят о том, что посев кала на дисбактериоз малоинформативен и, по меньшей мере, нерационален. Конечно, сдать его несложно. Но и показатели будут недостоверными по нескольким причинам:
- анализ не отображает истинную картину микрофлоры всего кишечника, показывает флору его последних отделов;
- некоторые бактерии на воздухе погибают, что отрицательно влияет на качество анализа;
- на результаты влияет то, в какое время суток собран кал, его количество и то, в какой лаборатории был проведен анализ;
- оценить «нормальность» флоры, руководствуясь результатами такого анализа, невозможно, поскольку бактерии, участвующие в процессе пищеварения, живут на стенках кишечника; материал для исследования поступает из просвета толстой кишки;
- норму эубиоза определить трудно, так как она зависит от очень многих показателей и индивидуальна для каждого человека.
Хотя у такого анализа есть свой плюс: он может показать, есть ли в кишечнике патогенные и условно-патогенные бактерии в большом количестве. Если при этом присутствует клиническая картина заболевания: ребенок страдает поносами, запорами, имеет плохой аппетит, в общем, выглядит нездоровым – лечение необходимо. Но перед этим следует определить причину возникновения дисбактериоза, провести тщательную диагностику. И, конечно, лечить не дисбактериоз как проявление болезни, а саму болезнь.
Если же ребенок в целом чувствует себя хорошо, то никакой необходимости ни в анализе, ни в лечении нет. При соблюдении следующих несложных правил состояние флоры должно самостоятельно прийти в норму:
- Кормить ребенка грудью как можно дольше (хотя бы 1 год).
- Следить за чистотой. Обязательное мытье рук: и мамы перед кормлением ребенка, и малыша перед едой.
- Старшему ребенку организовать рациональное питание. Он должен получать в достаточном количестве молочные и кисломолочные продукты, мясо и рыбу, фрукты и овощи. Избегайте избытка сладостей, жиров, да и избытка пищи в целом.
- Ежедневные прогулки на воздухе, купание, физкультура и закаливание.
Так называемое лечение дисбактериоза с помощью различных препаратов неэффективно. Пробиотики (полезные микроорганизмы) из таблетки, которые якобы должны заселить кишечник, погибают еще в пути под воздействием желудочного сока, желчи, ферментов поджелудочной железы и тонкого кишечника. Остаточные бактерии, которые все же поступают в кишечник, являются для него чужеродными и не приживаются.
Наиболее безвредным и эффективным путем коррекции дисбактериоза кишечника медики считают восстановление его собственной микрофлоры, сформированной на протяжении жизни ребенка. Хорошо при этом помогают пребиотики. Они не содержат бактерий, но служат питательной средой для них, благодаря чему происходит рост собственной полезной флоры и подавление патогенной. Пребиотики входят в состав многих продуктов для специального детского питания – смесей, каш, напитков. Но при этом маме следует учитывать, что выбор таких продуктов все же нужно обсудить с врачом.
Родители должны помнить: и в профилактике, и в лечении всех детских заболеваний главным является здравый смысл мамы и папы.
Сравнение цен на анализы для детей:
Автор: Брикульская Юлия. Медицинский эксперт проектов, медицинский тренер, практикующий врач-терапевт. Специально для Простобанк Консалтинг
Дисбактериоз у ребенка | Официальный сайт Huggies®
- Что такое дисбактериоз
- Дисбактериоз у детей: причины возникновения
- Дисбактериоз у ребенка: симптомы
- Лечение дисбактериоза у детей
- Немедикаментозное лечение дисбактериоза
Содержание:
Если у ребенка болит живот или плохо переваривается пища, врач часто ставит диагноз «дисбактериоз». Отечественные педиатры давно и успешно лечат детей от дисбактериоза, в то время как на западе такого слова не знают вовсе. Что же это за заболевание, как диагностировать и чем лечить дисбактериоз у ребенка?
Что такое дисбактериоз
Современные педиатры все чаще говорят, что дисбактериоз — это не болезнь, а состояние любых слизистых оболочек, при котором нарушен баланс микрофлоры. Чаще всего встречается дисбактериоз кишечника у детей — уменьшение полезной микрофлоры и размножение патогенных организмов.
Дисбактериоз у детей до года — очень распространенное явление. В норме в кишечнике человека присутствуют бифидо- и лактобактерии, они защищают кишечник от патологической флоры и токсинов, участвуют в пищеварении, позволяют полноценно усваивать белки, жиры, углеводы, витамины, различные кислоты.
Помимо полезных бактерий в кишечнике ребенка живут и условно-патогенные организмы (стафилококк, энтерококк и другие), которые в незначительном количестве не опасны, но размножаясь, могут вызывать признаки дисбактериоза у детей: тошноту, вздутие и боль в животе и так далее.
Дисбактериоз у детей: причины возникновения
Незрелость желудочно-кишечного тракта
Дисбактериоз у месячного ребенка чаще всего обусловлен несформированностью микрофлоры слизистых оболочек желудка и кишечника. Работа ЖКТ новорожденного еще только налаживается, и полезных бактерий для стабильной работы кишечника может не хватать.
Неправильное питание
Несоответствующее возрасту питание (частая смена смесей или слишком ранний ввод прикорма), а также употребление в пищу аллергенов (например, молочных продуктов при непереносимости лактозы) может способствовать развитию дисбактериоза.
Дисбактериоз после антибиотиков у ребенка
Если ребенок принимал антибиотики, естественная микрофлора его кишечника нарушается, так как антибиотики убивают любые бактерии, не разбирая, болезнетворные они или полезные.
Кишечные инфекции
Если функциональное нарушение пищеварения у грудного ребенка чаще всего вызвано незрелостью ЖКТ или погрешностями в питании, то дисбактериоз у ребенка 2 лет может быть следствием вирусной инфекции (ротавируса, дизентерии, сальмонеллеза), в результате которой в кишечник попали болезнетворные микробы.
Неблагоприятная экология
На состояние желудка и кишечника влияет и окружающая среда: загрязненный промышленными выхлопами воздух, химические отравления, недостаточно чистая питьевая вода могут спровоцировать развитие дисбактериоза.
Еще до обращения к врачу родители обычно понимают, что у ребенка дисбактериоз кишечника. Симптомы у детей проявляются довольно ярко и причиняют дискомфорт, особенно новорожденным и грудным малышам.
Дисбактериоз у ребенка: симптомы
Боли, чувство тяжести и вздутия в области живота, метеоризм;
расстройство стула: запоры или поносы;
остатки непереваренной пищи, слизь или крупинки в кале;
обильные срыгивания, отрыжка, а иногда и рвота;
шелушение и покраснение кожи, высыпания и опрелости, атопический дерматит;
выпадение волос, ломкость ногтей, кровоточивость десен;
неприятный запах изо рта;
белый или серый налет на языке;
темный налет на зубах;
плохой аппетит.
Многие заболевания ЖКТ имеют такие же симптомы, как симптомы дисбактериоза у детей. Лечение же должно быть различным, поэтому так важно правильно поставить диагноз.
Лечение дисбактериоза у детей
Для определения качественного и количественного состава микрофлоры кишечника необходимо сдать копрологический, биохимический и бактериологический анализ кала. В зависимости от того, какая условно-патогенная флора и в каких количествах будет обнаружена, врач-гастроэнтеролог подберет лечение.
Для борьбы с дисбактериозом применяются:
бактериофаги — препараты, уничтожающие бактерии-возбудители дисбактериоза;
пробиотики — препараты на основе живых микроорганизмов, позволяющие искусственно заселить кишечник полезной флорой;
пребиотики — неперевариваемые вещества (лактулоза, клетчатка), стимулирующие двигательную функцию кишечника;
пищеварительные ферменты — вещества, помогающие расщеплять и переваривать пищу.
При выборе препаратов учитывается и причина, вызвавшая дисбактериоз. Если виной расстройству кишечника — антибиотики, лечение будет одно, если аллергическая настроенность организма — другое.
Не выбирайте препараты для лечения микрофлоры кишечника самостоятельно. В аптеках их сейчас множество («Аципол», «Линекс», «Бифидумбактерин», «Бифиформ Малыш» и др.) и фармацевт обязательно посоветует вам что-нибудь, но неправильно подобранный препарат и неверная дозировка могут еще больше нарушить микрофлору кишечника.
Немедикаментозное лечение дисбактериоза
Заселяя кишечник ребенка полезной флорой, не забывайте и об основных принципах питания:
Сохраняйте грудное вскармливание
Дисбактериоз у грудных детей бывает реже, чем у детей на искусственном вскармливании, так как грудное молоко — источник полезных лактобактерий. Если сохранение или восстановление грудного вскармливания невозможно, применяйте лечебные смеси.
Придерживайтесь диеты
Если ребенок уже не питается грудным молоком, позаботьтесь о его диете: исключите из рациона сырые овощи, фрукты, белый хлеб, бобовые, молочные и другие продукты, повышающие газообразование. Основу рациона должны составлять крупы, нежирное мясо, кисломолочные продукты, из фруктов допускаются бананы и печеные яблоки.
Соблюдайте режим дня
При лечении дисбактериоза очень важно создать для ребенка спокойные и комфортные условия, исключить стрессы и уделить внимание здоровому сну, прогулкам, физической активности на свежем воздухе.
Лечение дисбактериоза у детей в Одинцово
В период внутриутробного развития желудочно-кишечный тракт (ЖКТ) плода стерилен. Там нет никаких бактерий и других микроорганизмов. После рождения ЖКТ ребенка заселяется бактериями, которые находятся в окружающей среде. В грудном молоке содержится бифидус-фактор, вещество, которое способствует росту бифидобактерий. Неудивительно, что бифидобактерии составляют 95-99% флоры кишечника детей на грудном вскармливании. Бифидобактерии, которые иногда называют еще пробиотиками, являются частью здоровой флоры кишечника. Бифидобактерии преобладают в кишечнике у грудного ребенка до тех пор, пока грудное молоко составляет бо́льшую часть питания ребенка.
Что такое дисбактериоз?
Дисбактериоз или дисбиоз – нарушение качественного или количественного баланса микроорганизмов в организме, в данном случае, в кишечнике. За рубежом дисбиоз именуется синдромом «избыточного роста бактерий». Это значит, что изменилась пропорция бактерий в кишечнике или там появились необычные для нормальной флоры микроорганизмы. Дисбактериоз часто связывают с лечением антибиотиками и кишечными инфекциями.
Диагностирование дисбактериоза проводится по симптомам или же анализом кала на дисбактериоз. Обычно, показанием к анализу на дисбактериоз является непреходящий в течение двух или трех суток понос. Среди других симптомов, которые служат поводом для лабораторных исследований на дисбактериоз могут быть зеленоватый стул, стул со слизью, запор (редкий стул у грудных детей часто ошибочно принимают за запор), пенистый стул, частички непереваренной пищи.
Когда нужно обратиться к врачу?
Обратитесь к врачу, если у ребенка наблюдается склонность к запорам или, наоборот, жидкий стул, повышенное газообразование, колики, беспокойство, низкий набор веса.
Что нужно знать и помнить кормящей маме?
Способствует возникновению дисбиоза ранний перевод на искусственное вскармливание, поэтому кормление грудью является самой настоящей страховкой здоровья желудочно-кишечного тракта ребенка в течение первых лет жизни. Грудное молоко способствует росту бифидобактерий, которые препятствуют колонизации кишечника болезнетворными бактериями, а также содержит антитела и факторы, которые защищают ребенка от болезни, даже если патогенным бактериям удалось прижиться в кишечнике. Кормление грудью помогает восстановить баланс микрофлоры кишечника ребенка после лечения антибиотиками, а также укрепляет общий иммунитет, защищает от инфекций.
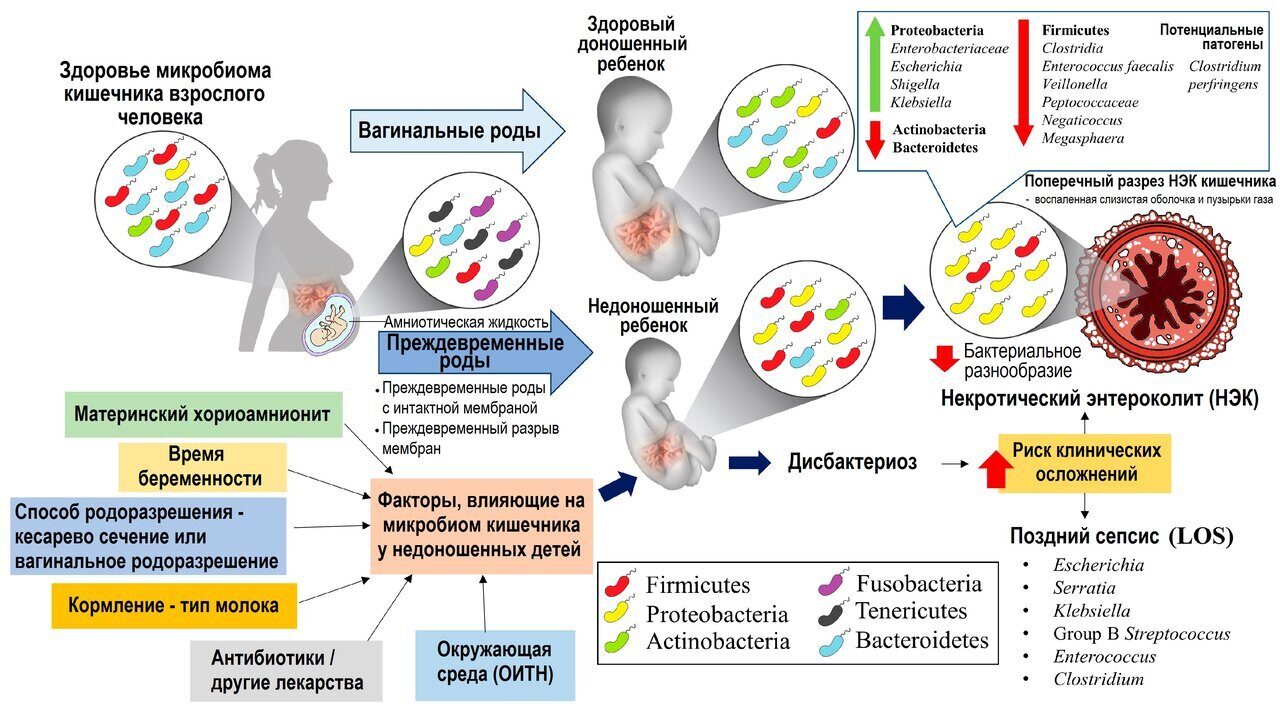
Дисбактериоз кишечника новорожденных | Журнал перинатологии
Домингес-Белло М.Г., Годой-Виторино Ф., Найт Р., Блазер М.Дж. Роль микробиома в развитии человека. Кишечник. 2019; 68: 1108–14.
CAS PubMed PubMed Central Google Scholar
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352: 539–44.
CAS PubMed PubMed Central Google Scholar
Ayres JS. Совместное поведение микробной толерантности в мутуализме микробиоты хозяина. Клетка. 2016; 165: 1323–31.
CAS PubMed PubMed Central Google Scholar
Санчес К.К., Чен Г.Й., Шибер AMP, Редфорд С.Е., Шохирев М.Н., Леблан М. и др. Совместная метаболическая адаптация хозяина может способствовать бессимптомной инфекции и способствовать снижению вирулентности кишечного патогена. Клетка. 2018; 175: 146–58.e15.
CAS PubMed PubMed Central Google Scholar
Сорбара МТ, Памер Э.Г. Межбактериальные механизмы устойчивости к колонизации и стратегии, используемые патогенами для их преодоления. Mucosal Immunol. 2019; 12: 1–9.
CAS PubMed PubMed Central Google Scholar
Ко А., Бэкхед Ф. От ассоциации к причинной связи: роль кишечной микробиоты и ее функциональных продуктов в метаболизме хозяина. Mol Cell. 2020; 78: 584–96.
CAS PubMed PubMed Central Google Scholar
Gevers D, Kugathasan S, Denson LA, Vazquez-Baeza Y, Van Treuren W., Ren B, et al. Микробиом, ранее не получавший лечения, при впервые возникшей болезни Крона. Клетка. Хост-микроб. 2014; 15: 382–92.
CAS PubMed PubMed Central Google Scholar
Клингберг Э., Магнуссон М.К., Стрид Х., Демингер А., Шталь А., Сундин Дж. И др. Различный состав микробиоты кишечника у пациентов с анкилозирующим спондилитом связан с повышенным уровнем кальпротектина в кале.Arthritis Res Ther. 2019; 21: 248.
CAS PubMed PubMed Central Google Scholar
Falony G, Joossens M, Vieira-Silva S, Wang J, Darzi Y, Faust K, et al. Популяционный анализ изменчивости микробиома кишечника. Наука. 2016; 352: 560–4.
CAS PubMed PubMed Central Google Scholar
Яцуненко Т.Р., Манари М.Дж., Трехан И., Домингес-Белло М.Г., Контрерас М., Магрис М. и др.Микробиом кишечника человека в зависимости от возраста и географии. Природа 2012; 486: 222–7.
CAS PubMed PubMed Central Google Scholar
Биттингер К., Чжао С., Ли И, Форд Э., Фридман Э.С., Ни Дж. И др. Бактериальная колонизация перепрограммирует метаболом кишечника новорожденных. Nat Microbiol. 2020; 5: 838–47.
CAS PubMed PubMed Central Google Scholar
Vangay P, Ward T, Gerber JS, Knights D. Антибиотики, детский дисбактериоз и болезни. Клетка. Хост-микроб. 2015; 17: 553–64.
CAS PubMed PubMed Central Google Scholar
Deshmukh HS, Liu Y, Menkiti OR, Mei J, Dai N, O’Leary CE, et al. Микробиота регулирует гомеостаз нейтрофилов и устойчивость хозяина к сепсису Escherichia coli K1 у новорожденных мышей. Nat Med. 2014; 20: 524–30.
CAS PubMed PubMed Central Google Scholar
Грачи MG, Гарретт WS. Кишечник. микробиота, метаболиты и иммунитет хозяина. Nat Rev Immunol. 2016; 16: 341–52.
CAS PubMed PubMed Central Google Scholar
Ольшак Т., Ан Д., Цейссиг С., Вера М.П., Рихтер Дж., Франке А. и др. Воздействие микробов в молодом возрасте оказывает стойкое влияние на функцию естественных Т-клеток-киллеров. Наука. 2012; 336: 489–93.
CAS PubMed PubMed Central Google Scholar
Cox LM, Yamanishi S, Sohn J, Alekseyenko AV, Leung JM, Cho I, et al. Изменение кишечной микробиоты во время критического периода развития имеет долгосрочные метаболические последствия. Клетка. 2014; 158: 705–21.
CAS PubMed PubMed Central Google Scholar
Кимура И., Миямото Дж., Оуэ-Китано Р., Ватанабе К., Ямада Т., Онуки М. и др. Микробиота кишечника матери во время беременности влияет на метаболический фенотип потомства мышей.Наука. 2020; 367: eaaw8429.
CAS PubMed PubMed Central Google Scholar
Гордон Х.А., Пести Л. Животные-гнотобиоты как инструмент в изучении микробных взаимоотношений хозяина. Бактериол. Ред. 1971; 35: 390–429.
CAS PubMed PubMed Central Google Scholar
Лучински П., Маквей Нойфельд К.А., Ориач К.С., Кларк Дж., Динан Т.Г., Крайан Дж. Ф.Выращивание в пузыре: использование стерильных животных для оценки влияния микробиоты кишечника на мозг и поведение. Int J Neuropsychopharmacol. 2016; 19: pyw020.
PubMed PubMed Central Google Scholar
Уилкс М. Бактерии и раннее развитие человека. Early Hum Dev. 2007; 83: 165–70.
PubMed PubMed Central Google Scholar
Гериг Дж. Л., Венкатеш С., Чанг Х. В., Хибберд М. С., Кунг В. Л., Ченг Дж. И др.Влияние продуктов, содержащих микробиоту, на животных-гнотобиотов и детей с недостаточным питанием. Наука. 2019; 365: eaau4732.
PubMed PubMed Central Google Scholar
Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–31.
PubMed PubMed Central Google Scholar
Safari Z, Джерард П. Связь между микробиомом кишечника и неалкогольной жировой болезнью печени (НАЖБП). Клетка. Mol Life Sci. 2019; 76: 1541–58.
CAS PubMed PubMed Central Google Scholar
Цзян Ц., Ли Дж., Хуанг П., Лю З., Чжао Б. Микробиота кишечника и болезнь Альцгеймера. J. Alzheimers Dis. 2017; 58: 1–15.
PubMed PubMed Central Google Scholar
Ли Ю.П., Чиу С.К., Лин Т.Дж., Хунг С.В., Хуанг В.С., Чиу С.К. и др. Моноколонизация мышей без микробов с помощью Bacteroides fragilis улучшает индуцированный азоксиметаном / декстрансульфатом натрия колоректальный рак, вызванный колитом. Immunopharmacol Immunotoxicol. 2019; 41: 207–13.
CAS PubMed PubMed Central Google Scholar
Tissier H. Recherches sur la flore кишечника дез nourrissons. C R Mem Soc Biol. 1899; 51: 943.
Google Scholar
Logan WR. Кишечная флора младенцев и детей раннего возраста. J Pathol. 1913; 18: 527–51.
Google Scholar
Гарридо Д., Бариле Д., Миллс Д.А. Молекулярная основа обогащения бифидобактериями желудочно-кишечного тракта младенцев. Adv Nutr. 2012; 3: 415С – 21С.
CAS PubMed PubMed Central Google Scholar
Ruiz-Moyano S, Totten SM, Garrido DA, Smilowitz JT, German JB, Lebrilla CB, et al.Изменения в потреблении олигосахаридов грудного молока младенческими кишечными штаммами Bifidobacterium breve. Appl Environ Microbiol. 2013; 79: 6040–9.
CAS PubMed PubMed Central Google Scholar
Живкович AM, German JB, Lebrilla CB, Mills DA. Гликобиом грудного молока и его влияние на микробиоту желудочно-кишечного тракта младенцев. Proc Natl Acad Sci USA. 2011; 108 (Приложение 1): 4653–8.
CAS Google Scholar
Хенрик Б.М., Хаттон А.А., Палумбо М.С., Касабури Дж., Митчелл Р.Д., Андервуд М.А. и др. Повышенный pH кала указывает на глубокое изменение микробиома кишечника грудного ребенка из-за сокращения бифидобактерий за последнее столетие. мСфера. 2018; 3: e00041–18.
PubMed PubMed Central Google Scholar
Litvak Y, Byndloss MX, Tsolis RM, Baumler AJ. Распространение дисбиотических протеобактерий: микробный признак дисфункции эпителия.Curr Opin Microbiol. 2017; 39: 1–6.
CAS Google Scholar
Milani C, Duranti S, Bottacini F, Casey E, Turroni F, Mahony J, et al. Первые микробные колонизаторы кишечника человека: состав, деятельность и последствия для здоровья микробиоты кишечника младенца. Microbiol Mol Biol Rev.2017; 81: e00036-17.
PubMed PubMed Central Google Scholar
La Rosa PS, Warner BB, Zhou Y, Weinstock GM, Sodergren E, Hall-Moore CM и др. Структурированное развитие бактериальных популяций в кишечнике недоношенных детей. Proc Natl Acad Sci USA. 2014; 111: 12522–7.
Google Scholar
Korpela K, Blakstad EW, Moltu SJ, Strommen K, Nakstad B, Ronnestad AE, et al. Развитие кишечной микробиоты и гестационный возраст у недоношенных новорожденных. Научный доклад 2018; 8: 2453.
PubMed PubMed Central Google Scholar
Ватанен Т., Плихта Д.Р., Сомани Дж., Мунк П.С., Артур Т.Д., Холл А.Б. и др. Геномная изменчивость и штамм-специфическая функциональная адаптация микробиома кишечника человека в раннем возрасте. Nat Microbiol. 2019; 4: 470–9.
CAS Google Scholar
Raman AS, Gehrig JL, Venkatesh S, Chang HW, Hibberd MC, Subramanian S, et al. Единица разреженного коваринга, которая описывает развитие здоровой и нарушенной микробиоты кишечника человека. Наука. 2019; 365: eaau4735.
PubMed PubMed Central Google Scholar
Younge NE, Newgard CB, Cotten CM, Goldberg RN, Muehlbauer MJ, Bain JR, et al. Нарушение созревания микробиоты и метаболома у крайне недоношенных детей с послеродовой задержкой роста. Научный доклад 2019; 9: 8167.
PubMed PubMed Central Google Scholar
Лю Дж, Ли Й, Фэн Й, Пан Л, Се З, Ян З и др.Структурное прогрессирование микробиоты кишечника, связанное с некротическим энтероколитом и поздним сепсисом у недоношенных детей: проспективное исследование в отделении интенсивной терапии новорожденных в Китае. PeerJ. 2019; 7: e7310.
PubMed PubMed Central Google Scholar
Галаццо Дж., Ван Бест Н., Бервоетс Л., Дапаа И.О., Савелкул PH, Хорнеф М.В. и др. Развитие микробиоты и ассоциации с режимом рождения, диетой и атопическими расстройствами в продольном анализе образцов стула, собранных с младенчества до раннего детства.Гастроэнтерология. 2020; 158: 1584–96.
CAS Google Scholar
Madan JC, Hoen AG, Lundgren SN, Farzan SF, Cottingham KL, Morrison HG, et al. Связь кесарева сечения и добавления смеси с кишечным микробиомом 6-недельных младенцев. JAMA Pediatr. 2016; 170: 212–9.
PubMed PubMed Central Google Scholar
Стюарт С.Дж., Аджами, штат Нью-Джерси, О’Брайен Д.Л., Хатчинсон Д.С., Смит Д.П., Вонг М.К. и др.Временное развитие микробиома кишечника в раннем детстве по данным исследования TEDDY. Природа. 2018; 562: 583–8.
CAS PubMed PubMed Central Google Scholar
Combellick JL, Shin H, Shin D, Cai Y, Hagan H, Lacher C, et al. Различия в фекальной микробиоте новорожденных, рожденных дома или в больнице. Научный доклад 2018; 8: 15660.
PubMed PubMed Central Google Scholar
Savage JH, Lee-Sarwar KA, Sordillo JE, Lange NE, Zhou Y, O’Connor GT и др. Диета во время беременности и младенчества и микробиом кишечника младенца. J Pediatr. 2018; 203: 47–54.e4.
PubMed PubMed Central Google Scholar
Лундгрен С.Н., Мадан Дж. К., Эмонд Дж. А., Моррисон Х. Г., Кристенсен BC, Карагас М. Р. и др. Диета матери во время беременности связана с микробиомом детского стула в зависимости от способа родов.Микробиом. 2018; 6: 109.
PubMed PubMed Central Google Scholar
Williams JE, Carrothers JM, Lackey KA, Beatty NF, Brooker SL, Peterson HK, et al. Между молочным, оральным и фекальным микробиомами в диадах мать-младенец существуют сильные многомерные отношения в течение первых шести месяцев после родов. J Nutr. 2019; 149: 902–14.
PubMed PubMed Central Google Scholar
Азад М.Б., Конья Т., Персо Р.Р., Гутман Д.С., Чари Р.С., Филд С.Дж. и др. Влияние антибиотиков во время родов, методов родов и грудного вскармливания на микробиоту кишечника в течение первого года жизни: проспективное когортное исследование. Int J Obstet Gynaecol. 2016; 123: 983–93.
CAS Google Scholar
Coker MO, Hoen AG, Dade E, Lundgren S, Li Z, Wong AD, et al. Конкретный класс антибиотиков во время родов связан с созреванием микробиоты кишечника младенца: проспективное когортное исследование.Int J Obstet Gynaecol. 2020; 127: 217–27.
CAS Google Scholar
Eck A, Rutten N, Singendonk MMJ, Rijkers GT, Savelkoul PHM, Meijssen CB, et al. Развитие микробиоты новорожденных и действие антибиотиков в раннем возрасте определяется двумя разными типами поселенцев. PloS ONE. 2020; 15: e0228133.
CAS PubMed PubMed Central Google Scholar
Гупта Р.В., Тран Л., Норори Дж., Феррис М.Дж., Эрен А.М., Тейлор С.М. и др. Блокаторы рецепторов гистамина-2 изменяют фекальную микробиоту у недоношенных детей. J Pediatr Gastroenterol Nutr. 2013; 56: 397–400.
CAS Google Scholar
Леви Э.И., Хоанг Д.М., Ванденплас Й. Влияние ингибиторов протонной помпы на микробиом у маленьких детей. Acta Paediatr. 2020; 109: 1531–8.
CAS Google Scholar
Vich Vila A, Collij V, Sanna S, Sinha T, Imhann F, Bourgonje AR, et al. Влияние часто используемых лекарств на состав и метаболическую функцию микробиоты кишечника. Nat Commun. 2020; 11: 362.
CAS PubMed PubMed Central Google Scholar
Джексон М.А., Верди С., Максан М.Э., Шин С.М., Зирер Дж., Бойер Р.Ц.и др. Связь микробиоты кишечника с распространенными заболеваниями и лекарствами, отпускаемыми по рецепту, в популяционной когорте.Nat Commun. 2018; 9: 2655.
PubMed PubMed Central Google Scholar
Iszatt N, Janssen S, Lenters V, Dahl C, Stigum H, Knight R, et al. Экологические токсиканты в грудном молоке норвежских матерей, а также состав и метаболиты кишечных бактерий у их младенцев в возрасте 1 месяца. Микробиом 2019; 7: 34.
PubMed PubMed Central Google Scholar
Лауэ Х.Э., Моройши Ю., Джексон Б.П., Палис Т.Дж., Мадан Дж.К., Карагас МР.Смеси питательных и токсичных элементов и микробиом кишечника в раннем постнатальном периоде в когорте продольных рождений в Соединенных Штатах. Environ Int. 2020; 138: 105613.
CAS Google Scholar
Маклин К., Джун С., Козырский А. Влияние курения матери на микробиоту кишечника младенца и его связь с избыточным весом ребенка: обзорный обзор. Мир J Pediatr. 2019; 15: 341–9.
Google Scholar
Tun HM, Konya T, Takaro TK, Brook JR, Chari R, Field CJ и др. Контакт с домашними пушистыми домашними животными влияет на микробиоту кишечника младенца в 3-4 месяца после различных сценариев рождения. Микробиом. 2017; 5: 40.
PubMed PubMed Central Google Scholar
D’Agata AL, Wu J, Welandawe MKV, Dutra SVO, Kane B, Groer MW. Влияние стресса ОИТН в раннем возрасте на развивающийся микробиом кишечника. Dev Psychobiol. 2019; 61: 650–60.
PubMed PubMed Central Google Scholar
Ho TTB, Groer MW, Kane B., Yee AL, Torres BA, Gilbert JA, et al. Дихотомическое развитие микробиома кишечника у недоношенных детей. Микробиом. 2018; 6: 157.
PubMed PubMed Central Google Scholar
Parra-Llorca A, Gormaz M, Alcantara C, Cernada M, Nunez-Ramiro A, Vento M и др. Микробиом кишечника недоношенных в зависимости от типа кормления: значение донорского грудного молока.Front Microbiol. 2018; 9: 1376.
PubMed PubMed Central Google Scholar
Taft DH, Salinero LK, Vongbhavit K, Kalanetra KM, Masarweh C, Yu A, et al. Бактериальная колонизация и гены устойчивости к противомикробным препаратам в трубках для энтерального питания новорожденных. FEMS Microbiol Ecol. 2019; 95: физ039.
CAS PubMed PubMed Central Google Scholar
Nogacka A, Salazar N, Suárez M, Milani C, Arboleya S, Solís G, et al.Влияние антимикробной профилактики во время родов на микробиоту кишечника и распространенность генов устойчивости к антибиотикам у доношенных новорожденных, родившихся через естественные родовые пути. Микробиом. 2017; 5: 93.
PubMed PubMed Central Google Scholar
Гаспаррини А.Дж., Крофтс Т.С., Гибсон М.К., Тарр П.И., Уорнер Б.Б., Дантас Г. Нарушение антибиотиками микробиома кишечника недоношенных детей и резистома. Кишечные микробы. 2016; 7: 443–9.
CAS PubMed PubMed Central Google Scholar
Гибсон М.К., Ван Б., Ахмади С., Бернхэм Калифорния, Тарр П.И., Уорнер Б.Б. и др. Динамика развития микробиоты кишечника недоношенных детей и резистома к антибиотикам. Nat Microbiol. 2016; 1: 16024.
CAS PubMed PubMed Central Google Scholar
Rutayisire E, Huang K, Liu Y, Tao F. Способ родов влияет на разнообразие и характер колонизации кишечной микробиоты в течение первого года жизни младенцев: систематический обзор.BMC Gastroenterol. 2016; 16:86.
PubMed PubMed Central Google Scholar
Dahl C, Stigum H, Valeur J, Iszatt N, Lenters V, Peddada S, et al. У недоношенных новорожденных есть различные микробиомы, которые не объясняются способом родов, продолжительностью грудного вскармливания или воздействием антибиотиков. Int J Epidemiol. 2018; 47: 1658–69.
PubMed PubMed Central Google Scholar
Tun MH, Tun HM, Mahoney JJ, Konya TB, Guttman DS, Becker AB. и другие. Послеродовое воздействие бытовых дезинфицирующих средств, микробиоты кишечника младенцев и последующий риск избыточного веса у детей. Can Med Assoc J. 2018; 190: E1097 – e107.
Google Scholar
Шоу К.А., Берта М., Хофмеклер Т., Чопра П., Ватанен Т., Шриватса А. и др. Дисбактериоз, воспаление и реакция на лечение: продольное исследование педиатрических субъектов с недавно диагностированным воспалительным заболеванием кишечника.Genome Med. 2016; 8: 75.
PubMed PubMed Central Google Scholar
Xia GH, You C, Gao XX, Zeng XL, Zhu JJ, Xu KY, et al. Индекс дисбактериоза инсульта (SDI) в микробиоме кишечника связан с травмой головного мозга и прогнозом инсульта. Фронт Neurol. 2019; 10: 397.
PubMed PubMed Central Google Scholar
Го Й, Чжан И, Герхард М., Гао Дж. Дж., Мехиас-Луке Р., Чжан Л. и др.Влияние Helicobacter pylori на микробиоту желудочно-кишечного тракта: популяционное исследование в Linqu, зоне высокого риска рака желудка. Кишечник. 2019. https://doi.org/10.1136/gutjnl-2019-319696.
Casen C, Vebo HC, Sekelja M, Hegge FT, Karlsson MK, Ciemniejewska E, et al. Отклонения в микробиоте кишечника человека: новый диагностический тест для определения дисбактериоза у пациентов с СРК или ВЗК. Пищевая Pharmacol Therap. 2015; 42: 71–83.
CAS Google Scholar
Мандл Т., Марсал Дж., Олссон П., Олссон Б., Андреассон К. Тяжелый кишечный дисбактериоз распространен при первичном синдроме Шегрена и связан с системной активностью заболевания. Arthritis Res Ther. 2017; 19: 237.
PubMed PubMed Central Google Scholar
Ватанен Т., Костич А.Д., д’Хеннезель Э., Сильяндер Х., Франзоса Э.А., Яссур М. и др. Вариабельность иммуногенности LPS микробиома способствует развитию аутоиммунитета у людей.Клетка. 2016; 165: 842–53.
CAS PubMed PubMed Central Google Scholar
Ватанен Т., Франзоза Э.А., Швагер Р., Трипати С., Артур Т.Д., Вехик К. и др. Микробиом кишечника человека при диабете типа 1 с ранним началом из исследования TEDDY. Природа. 2018; 562: 589–94.
CAS PubMed PubMed Central Google Scholar
Chua HH, Chou HC, Tung YL, Chiang BL, Liao CC, Liu HH, et al.Дисбактериоз кишечника с обилием ruminococcus gnavus ассоциируется с аллергическими заболеваниями у младенцев. Гастроэнтерология. 2018; 154: 154–67.
PubMed PubMed Central Google Scholar
Lee MJ, Kang MJ, Lee SY, Lee E, Kim K, Won S, et al. Нарушения генов микробиома кишечника у младенцев с атопическим дерматитом в зависимости от типа вскармливания. J Allergy Clin Immunol. 2018; 141: 1310–9.
CAS PubMed PubMed Central Google Scholar
Ламонт Р.Ф., Моллер Люф Б., Стенер Йоргенсен Дж. Воспалительные заболевания и нарушение обмена веществ у детей после воздействия антибиотиков во время беременности, антенатально, во время родов и новорожденных. F1000Res. 2020; 9: 144.
Google Scholar
Доухауэр Карпа К., Пол И.М., Леки Дж. А., Шунг С., Каркачи-Салли Н., Врана К. Е. и др. Обзор ретроспективной карты для выявления перинатальных факторов, связанных с пищевой аллергией. Нутр Дж. 2012; 11: 87.
PubMed PubMed Central Google Scholar
Metz TD, McKinney J, Allshouse AA, Knierim SD, Carey JC, Heyborne KD. Воздействие стрептококковой антибиотикопрофилактики группы B и индекс массы тела в раннем детстве в когорте вагинальных родов. J Matern Fetal Neonatal Med. 2020; 33: 3318–3323.
PubMed PubMed Central Google Scholar
Wohl DL, Curry WJ, Mauger D, Miller J, Tyrie K. Антибиотики во время родов и детский атопический дерматит. J Am Board Fam Med. 2015; 28: 82–9.
PubMed PubMed Central Google Scholar
Памми М., Коуп Дж., Тарр П.И., Уорнер Б.Б., Морроу А.Л., Май В. и др. Дисбактериоз кишечника у недоношенных детей, предшествующий некротическому энтероколиту: систематический обзор и метаанализ. Микробиом. 2017; 5:31.
PubMed PubMed Central Google Scholar
Olm MR, Bhattacharya N, Crits-Christoph A, Firek BA, Baker R, Song YS, et al.Некротическому энтероколиту предшествует усиленная репликация кишечных бактерий, клебсиелл и бактерий, кодирующих фимбрии. Sci Adv. 2019; 5: eaax5727.
CAS PubMed PubMed Central Google Scholar
Esmaeilizand R, Shah PS, Seshia M, Yee W., Yoon EW, Dow K. Воздействие антибиотиков и развитие некротического энтероколита у очень недоношенных новорожденных. Педиатр детского здоровья. 2018; 23: e56 – e61.
PubMed PubMed Central Google Scholar
Esaiassen E, Fjalstad JW, Juvet LK, van den Anker JN, Klingenberg C. Воздействие антибиотиков у новорожденных и ранние неблагоприятные исходы: систематический обзор и метаанализ. J Antimicrob. Chemother. 2017; 72: 1858–70.
CAS PubMed PubMed Central Google Scholar
Guillet R, Stoll BJ, Cotten CM, Gantz M, McDonald S, Poole WK, et al. Связь терапии h3-блокаторами и более высокой частоты некротического энтероколита у младенцев с очень низкой массой тела при рождении.Педиатрия. 2006; 117: e137–42.
PubMed Google Scholar
Hewitt KM, Mannino FL, Gonzalez A, Chase JH, Caporaso JG, Knight R, et al. Бактериальное разнообразие в двух отделениях интенсивной терапии новорожденных (ОИТН). PloS ONE. 2013; 8: e54703.
CAS PubMed PubMed Central Google Scholar
Бокулич Н.А., Миллс Д.А., Андервуд М.А. Поверхностные микробы в отделении интенсивной терапии новорожденных: изменения в процессе регулярной очистки и со временем.J Clin Microbiol. 2013; 51: 2617–24.
PubMed PubMed Central Google Scholar
Брукс Б., Олм М.Р., Файрек Б.А., Бейкер Р., Геллер-МакГрат Д., Реймер С.Р. и др. Развитие кишечного микробиома недоношенных детей является основным фактором, формирующим микробиом отделений интенсивной терапии новорожденных. Микробиом. 2018; 6: 112.
PubMed PubMed Central Google Scholar
Стюарт С.Дж., Эмблтон Н.Д., Маррс Э.Л., Смит Д.П., Фофанова Т., Нельсон А. и др. Продольное развитие кишечного микробиома и метаболома у недоношенных новорожденных с поздним началом сепсиса и у здоровых людей. Микробиом. 2017; 5: 75.
PubMed PubMed Central Google Scholar
Сингер JR, Blosser EG, Zindl CL, Silberger DJ, Conlan S, Laufer VA и др. Предотвращение дисбактериоза кишечного микробиома новорожденных мышей защищает от позднего сепсиса.Nat Med. 2019; 25: 1772–82.
CAS PubMed PubMed Central Google Scholar
Masi AC, Stewart CJ. Роль кишечного микробиома недоношенных при сепсисе и некротизирующем энтероколите. Early Hum Dev. 2019; 138: 104854.
PubMed PubMed Central Google Scholar
Хемми М.Х., Вольке Д., Шнайдер С. Связь между проблемами с плачем, сном и / или кормлением в младенчестве и долгосрочными поведенческими результатами в детстве: метаанализ.Arch Dis Child. 2011; 96: 622–9.
PubMed PubMed Central Google Scholar
Loughman A, Quinn T, Nation ML, Reichelt A, Moore RJ, Van TTH, et al. Детская микробиота при коликах: предиктивные ассоциации с проблемным плачем и последующим поведением ребенка. J Dev Orig Health Dis. 2020: 1–11. https://doi.org/10.1017/S2040174420000227.
Huttenhower C, Kostic AD, Xavier RJ. Воспалительное заболевание кишечника как модель трансляции микробиома.Иммунитет. 2014; 40: 843–54.
CAS PubMed PubMed Central Google Scholar
Mayer EA, Tillisch K, Gupta A. Ось кишечника / мозга и микробиота. J Clin исследования. 2015; 125: 926–38.
PubMed PubMed Central Google Scholar
Honda K, Littman DR. Микробиота в адаптивном иммунном гомеостазе и болезнях. Природа. 2016; 535: 75–84.
CAS PubMed PubMed Central Google Scholar
Schroeder BO, Bäckhed F. Сигналы от микробиоты кишечника к отдаленным органам в физиологии и болезнях. Nat Med. 2016; 22: 1079–89.
CAS PubMed PubMed Central Google Scholar
Леви М., Колодзейчик А.А., Тайс К.А., Элинав Э. Дисбактериоз и иммунная система. Nat Rev Immunol. 2017; 17: 219–32.
CAS PubMed PubMed Central Google Scholar
Марувада П., Леоне В., Каплан Л. М., Чанг Е.Б. Микробиом человека и ожирение: выход за рамки ассоциаций. Клетка. Хост-микроб. 2017; 22: 589–99.
CAS PubMed PubMed Central Google Scholar
Бах Дж.Ф. Гипотеза гигиены при аутоиммунных заболеваниях: роль патогенов и комменсалов. Nat Rev Immunol. 2018; 18: 105–20.
CAS PubMed PubMed Central Google Scholar
Браун JM, Хазен SL. Микробная модуляция сердечно-сосудистых заболеваний. Nat Rev.2018; 16: 171–81.
CAS Google Scholar
Tilg H, Zmora N, Adolph TE, Elinav E. Кишечная микробиота, питающая метаболическое воспаление. Nat Rev Immunol. 2020; 20: 40–54.
CAS PubMed PubMed Central Google Scholar
Iacob S, Iacob DG. Инфекционные угрозы, кишечный барьер и его троянский конь: дисбактериоз.Front Microbiol. 2019; 10: 1676.
PubMed PubMed Central Google Scholar
Fouhse JM, Yang K, More-Bayona J, Gao Y, Goruk S, Plastow G, et al. Воздействие амоксициллина на новорожденных изменяет долгосрочный иммунный ответ, несмотря на временное воздействие на кишечную микробиоту у поросят. Фронт Иммунол. 2019; 10: 2059.
CAS PubMed PubMed Central Google Scholar
Бомонт М., Паес С., Муссар Э., Кнудсен С., Каукиль Л., Эймард П. и др. Метаболиты кишечной микробиоты способствуют созреванию кишечного барьера при переходе от сосания к отъему. Кишечные микробы. 2020; 11: 1268–86.
PubMed PubMed Central Google Scholar
Suh SH, Choe K, Hong SP, Jeong SH, Mäkinen T., Kim KS, et al. Микробиота кишечника регулирует целостность молочных желез, индуцируя VEGF-C в макрофагах ворсинок кишечника.EMBO Rep.2019; 20: e46927.
PubMed PubMed Central Google Scholar
Kulkarni DH, McDonald KG, Knoop KA, Gustafsson JK, Kozlowski KM, Hunstad DA, et al. Пассажи антигена, связанные с бокаловидными клетками, ингибируются во время инфекции Salmonella typhimurium, чтобы предотвратить распространение патогена и ограничить реакцию на пищевые антигены. Mucosal Immunol. 2018; 11: 1103–13.
CAS PubMed PubMed Central Google Scholar
Abo H, Chassaing B, Harusato A, Quiros M, Brazil JC, Ngo VL, et al. Регулятор-1 дифференцировки эритроидов, индуцированный микробиотой в раннем возрасте, управляет пролиферацией и регенерацией стволовых клеток кишечника. Nat Commun. 2020; 11: 513.
CAS PubMed PubMed Central Google Scholar
Fung TC, Vuong HE, Luna CDG, Проновост Г.Н., Александрова А.А., Райли Н.Г. и др. Воздействие кишечного серотонина и флуоксетина модулирует бактериальную колонизацию кишечника.Nat Microbiol. 2019; 4: 2064–73.
PubMed PubMed Central Google Scholar
Canfora EE, Meex RCR, Venema K, Blaak EE. Метаболиты кишечных микробов при ожирении, НАЖБП и СД2. Обзоры природы. Эндокринология. 2019; 15: 261–73.
CAS PubMed PubMed Central Google Scholar
Lau WL, Vaziri ND. Микробные короткоцепочечные жирные кислоты кишечника и риск диабета.Нат Рев Нефрол. 2019; 15: 389–90.
PubMed PubMed Central Google Scholar
Санна С., ван Зуйдам Н.Р., Махаджан А., Курильщиков А., Вич Вила А., Воса У и др. Причинно-следственные связи между микробиомом кишечника, короткоцепочечными жирными кислотами и метаболическими заболеваниями. Нат Жене. 2019; 51: 600–5.
CAS PubMed PubMed Central Google Scholar
Де Ваддер Ф, Ковачева-Датчари П., Гонсалвес Д., Винера Дж., Зитоун С., Дюшампт А. и др.Метаболиты, вырабатываемые микробиотой, улучшают метаболизм через нервные цепи кишечника и мозга. Клетка. 2014; 156: 84–96.
PubMed PubMed Central Google Scholar
Далиле Б., Ван Ауденхове Л., Вервлиет Б., Вербеке К. Роль короткоцепочечных жирных кислот в коммуникации между микробиотой, кишечником и мозгом. Нат Рев Гастроэнтерол Гепатол. 2019; 16: 461–78.
PubMed PubMed Central Google Scholar
Parada Venegas D, De la Fuente MK, Landskron G, Gonzalez MJ, Quera R, Dijkstra G и др. Короткоцепочечные жирные кислоты (SCFAs), опосредуемые эпителиальной и иммунной регуляцией кишечника, и ее значение при воспалительных заболеваниях кишечника. Фронт Иммунол. 2019; 10: 277.
PubMed PubMed Central Google Scholar
Frese SA, Hutton AA, Contreras LN, Shaw CA, Palumbo MC, Casaburi G, et al. Стойкость добавок Bifidobacterium longum subsp.Infantis EVC001 у младенцев на грудном вскармливании. мСфера. 2017; 2: e00501–17.
PubMed PubMed Central Google Scholar
Zheng N, Gao Y, Zhu W., Meng D, Walker WA. Короткоцепочечные жирные кислоты, образующиеся при взаимодействии кишечных комменсальных бактерий с сцеженным грудным молоком, обладают противовоспалительным действием в незрелых энтероцитах человека. PloS ONE. 2020; 15: e0229283.
CAS PubMed PubMed Central Google Scholar
Waligora-Dupriet AJ, Dugay A, Auzeil N, Nicolis I, Rabot S, Huerre MR, et al. Короткоцепочечные жирные кислоты и полиамины в патогенезе некротического энтероколита: аспекты кинетики у гнотобиотических перепелов. Анаэроб. 2009; 15: 138–44.
CAS PubMed PubMed Central Google Scholar
Рой С.К., Менг К., Садовиц Б.Д., Коллиш-Сингул М., Епури Н., Саталин Дж. И др. Энтеральное введение смеси, ферментированной бактериями, новорожденным поросятам: высокоточная модель некротического энтероколита (NEC).PloS ONE. 2018; 13: e0201172.
PubMed PubMed Central Google Scholar
Meng D, Sommella E, Salviati E, Campiglia P, Ganguli K, Djebali K, et al. Индол-3-молочная кислота, метаболит триптофана, секретируемый Bifidobacterium longum подвид Infantis, оказывает противовоспалительное действие в незрелом кишечнике. Pediatr Res. 2020. https://doi.org/10.1038/s41390-019-0740-x.
Mukhopadhyay S, Wade KC, Puopolo KM.Препараты для профилактики и лечения сепсиса у новорожденных. Clin Perinatol. 2019; 46: 327–47.
PubMed PubMed Central Google Scholar
Кабальеро-Флорес Г., Сакамото К., Зенг М.И., Ван Й., Хаким Дж., Матус-Акуна В. и др. Иммунизация матери обеспечивает защиту потомства от прикрепляющегося и удаляющегося патогена за счет доставки IgG с грудным молоком. Клетка. Хост-микроб. 2019; 25: 313–23.e4.
CAS PubMed PubMed Central Google Scholar
Mukhopadhyay S, Sengupta S, Puopolo KM. Проблемы и возможности рационального использования антибиотиков среди недоношенных детей. Arch Dis Child. 2019; 104: F327 – f32.
Google Scholar
Шульман Дж., Диманд Р. Дж., Ли ХК, Дуэнас Г. В., Беннетт М. В., Гулд Дж. Б.. Использование антибиотиков в отделении интенсивной терапии новорожденных. Педиатрия. 2015; 135: 826–33.
PubMed PubMed Central Google Scholar
Шульман Дж., Профит Дж., Ли ХК, Дуэнас Дж., Беннетт М.В., Паруча Дж. И др. Варианты использования антибиотиков в неонатальном периоде. Педиатрия. 2018; 142: e20180115.
PubMed PubMed Central Google Scholar
Chi C, Buys N, Li C, Sun J, Yin C. Влияние пребиотиков на сепсис, некротический энтероколит, смертность, непереносимость кормления, время до полного энтерального питания, продолжительность пребывания в больнице и частоту стула в недоношенные дети: метаанализ.Eur J Clin Nutr. 2019; 73: 657–70.
CAS PubMed PubMed Central Google Scholar
Sun J, Marwah G, Westgarth M, Buys N, Ellwood D, Gray PH. Влияние пробиотиков на некротический энтероколит, сепсис, внутрижелудочковое кровотечение, смертность, продолжительность пребывания в больнице и прибавку в весе у очень недоношенных детей: метаанализ. Adv Nutr. 2017; 8: 749–63.
PubMed PubMed Central Google Scholar
Deshpande G, Jape G, Rao S, Patole S. Преимущества пробиотиков у недоношенных новорожденных в странах с низким и средним доходом: систематический обзор рандомизированных контролируемых испытаний. BMJ Open. 2017; 7: e017638.
PubMed PubMed Central Google Scholar
Dermyshi E, Wang Y, Yan C, Hong W, Qiu G, Gong X и др. «Золотой век» пробиотиков: систематический обзор и метаанализ рандомизированных и наблюдательных исследований недоношенных детей.Неонатология. 2017; 112: 9–23.
CAS PubMed PubMed Central Google Scholar
Olsen R, Greisen G, Schroder M, Brok J. Профилактические пробиотики для недоношенных детей: систематический обзор и метаанализ обсервационных исследований. Неонатология. 2016; 109: 105–12.
PubMed PubMed Central Google Scholar
Куанг Л., Цзян Ю. Эффект пробиотических добавок у беременных женщин: метаанализ рандомизированных контролируемых исследований.Br J Nutr. 2020; 123: 870–80.
CAS Google Scholar
Skonieczna-Zydecka K, Janda K, Kaczmarczyk M, Marlicz W., Loniewski I, Loniewska B. Влияние пробиотиков на симптомы, кишечную микробиоту и маркеры воспаления при детской колике: систематический обзор, метаанализ и мета-регрессия рандомизированных контролируемых исследований. J Clin Med. 2020; 9: 999.
CAS Google Scholar
van den Akker CHP, van Goudoever JB, Shamir R, Domellof M, Embleton ND, Hojsak I, et al. Пробиотики и недоношенные младенцы: позиционный документ Европейского общества педиатрической гастроэнтерологии, гепатологии и комитета по питанию по вопросам питания и Европейского общества детской гастроэнтерологии, гепатологии и рабочей группы по питанию по пробиотикам и пребиотикам. J Pediatr Gastroenterol Nutr. 2020; 70: 664–80.
Google Scholar
van den Akker CHP, van Goudoever JB, Szajewska H, Embleton ND, Hojsak I., Reid D., et al. Пробиотики для недоношенных детей: систематический обзор штаммов и сетевой метаанализ. J Pediatr Gastroenterol Nutr. 2018; 67: 103–22.
Google Scholar
Su GL, Ko CW, Bercik P, Falck-Ytter Y, Sultan S, Weizman AV, et al. Руководство AGA по клинической практике о роли пробиотиков в лечении желудочно-кишечных расстройств.Гастроэнтерология. 2020. https://doi.org/10.1053/j.gastro.2020.05.059.
Льюис З.Т., Шани Г., Масарве К.Ф., Попович М., Фрезе С.А., Села Д.А. и др. Подтверждение идентичности видов и подвидов бифидобактерий в коммерческих пробиотических продуктах. Pediatr Res. 2016; 79: 445–52.
CAS Google Scholar
Chiang MC, Chen CL, Feng Y, Chen CC, Lien R, Chiu CH. Lactobacillus rhamnosus сепсис, связанный с терапией пробиотиками у крайне недоношенных новорожденных: патогенез и обзор для клиницистов.J Microbiol Immunol Infect. 2020. https://doi.org/10.1016/j.jmii.2020.03.029
Pell LG, Loutet MG, Roth DE, Sherman PM. Аргументы против рутинного приема пробиотиков для профилактики НЭК. Curr Opin Pediatrics. 2019; 31: 195–201.
Google Scholar
Дисбактериоз у детей, рожденных путем кесарева сечения — FullText — Annals of Nutrition and Metabolism 2018, Vol. 73, Прил. 3
Абстрактные
Частота родов с помощью кесарева сечения в США увеличилась на 60% с 1996 по 2013 год и в настоящее время составляет> 30% родов [CDC, 2017].Цель этого обзора — представить текущее понимание как микробных факторов риска, которые увеличивают вероятность кесарева сечения, так и микробного дисбактериоза, который, как считается, является результатом кесарева сечения. Мы приводим примеры исследований влияния микробного дисбиоза в раннем возрасте на развитие младенцев и долгосрочные последствия для здоровья, а также рассматриваем эффективность и долгосрочные последствия микробиомной терапии для смягчения этого дисбиоза.Резкий рост частоты родов с помощью кесарева сечения делает необходимым понимание потенциала модуляции микробиоты для лечения дисбактериоза.
© 2018 S. Karger AG, Базель
Введение
Микробиота кишечника играет решающую роль в иммунном и метаболическом развитии младенцев, а способ доставки является основным определяющим фактором воздействия и колонизации в раннем возрасте [Madan et al., 2016]. Желудочно-кишечный тракт человека практически не колонизируется внутриутробно, поэтому воздействие микробов во время родов и в окружающей среде сразу после рождения является ключом к созданию микробиоты.В случае естественных родов младенец контактирует с влагалищным и кишечным содержимым матери [Rutayisire et al., 2016]. Влагалищные младенцы колонизированы микробами, включая Lactobacillus , Prevotella , Bacteroides , Escherichia / Shigella и Bifidobacterium [Dominguez-Bello et al., 2010], которые были идентифицированы во влагалище и др. образцы фекалий взрослых матерей. Микробный дисбиоз во время беременности часто связан с осложнениями, которые могут указывать на кесарево сечение, такими как преждевременные роды, крайние значения индекса массы тела (ИМТ) матери, инфекция, крайние размеры ребенка и гестационный диабет [Neu and Rushing, 2011].Роды с помощью кесарева сечения прерывают нормальный паттерн микробной колонизации; младенцы больше не подвергаются воздействию материнских вагинальных или кишечных микробов во время родов. Вместо этого в младенцах, перенесших кесарево сечение, преобладают кожные и ротовые бактерии человека, в том числе Staphylococcus , Streptococcus , Corynebacterium , Veillonella и Propionibacterium [Dominguez-Bello et al., 2010; Bäckhed et al., 2015]. Микробиота кишечника тесно связана с тренировкой врожденной иммунной системы, и ее нарушение в раннем возрасте может привести к инфекциям, сепсису и системным иммунным и метаболическим нарушениям, которые влияют на риск заболевания в течение всей жизни [Zhu et al., 2015]. Микробный дисбактериоз, вызванный кесаревым сечением, был связан с повышенным риском таких состояний, как астма [Couzin-Frankel, 2010], ожирение [Mueller et al., 2015], пищевая аллергия [Lieberman et al., 2018], диабет 1 типа (T1D) [Kostic, 2015], системные нарушения соединительной ткани, ювенильный артрит, воспалительное заболевание кишечника (IBD) и лейкемия [Sevelsted et al., 2015], как показано в таблице 1. Цель этого обзора — представить текущее понимание как микробных факторов риска, которые увеличивают вероятность кесарева сечения, так и микробного дисбактериоза, который, как считается, является его результатом.
Таблица 1.
Неполный список недавних исследований, изучающих связь родоразрешения с помощью кесарева сечения с долгосрочными последствиями для здоровья
Материнский микробиом во время беременности
Материнская микробиота может влиять на течение беременности и потенциально определять исходы для здоровья младенцев. Во время беременности в организме матери происходят радикальные физиологические колебания гормонов и иммунного статуса [Fox and Eichelberger, 2015]. Недавние исследования показали, что эти изменения совпадают с изменениями в микробиоме кишечника матери, причем значительные сдвиги происходят с первого по третий триместр [Koren et al., 2012]. В этот период численность типов, протеобактерий и актинобактерий увеличивается, а общее видовое богатство уменьшается [Koren et al., 2012]. Однако другие исследования показали, что микробиом кишечника и полости рта остается относительно стабильным во время беременности, в то время как микробиом влагалища претерпевает значительные изменения [Bisanz et al., 2015].
Понимание эффектов микробной колонизации во время беременности является ключевым моментом для потенциальных клинических применений, включая стратификацию риска на основе материнского микробиома.Известно, что определенные профили микробных сообществ влагалища коррелируют с исходами беременности, такими как преждевременные роды [Hyman et al., 2014; Haque et al., 2017; Стаут и др., 2017]. На микробиом матери влияет лечение антибиотиками [Bennet et al., 1986], заболевания пародонта [Michalowicz et al., 2006] и статус курения, и это связано с неблагоприятными исходами беременности [Paropkari et al., 2016]. Хотя долгое время считалось, что внутренняя часть амниотического мешка является стерильной средой и что первое воздействие микробов на ребенка происходит во время родов [Funkhouser and Bordenstein, 2013], недавние исследования охарактеризовали бактериальную ДНК в амниотической жидкости [DiGiulio et al., 2008], пуповинная кровь [Jiménez et al., 2005], меконий [Jiménez et al., 2008; Hu et al., 2013; Ardissone et al., 2014] и плаценты [Aagaard et al., 2014; Колладо и др., 2016]. Образцы микробиома с этих участков дают низкую биомассу, потенциально уязвимую для заражения из других источников ДНК [Kliman, 2014; Лаудер и др., 2016]. Кроме того, было трудно отличить живые бактериальные клетки от продуктов ДНК; хотя в некоторых отчетах для количественного определения бактерий в тканях плаценты использовались методы культивирования, оказалось, что не все плаценты содержат бактерии [Stout et al., 2013]. В целом, еще предстоит определить, является ли наличие внутриутробной микробиоты частью здоровой и нормальной беременности. Однако у некоторых других видов, таких как морские губки, домашние куры и черепахи, передача микробов от матери происходит до рождения ребенка [Funkhouser and Bordenstein, 2013]. Действительно, идентификация микробов в меконии предполагает, что кишечник плода может быть засеян бактериями еще до рождения [Neu, 2015]. Если передача микробов от матери до рождения действительно происходит при здоровой беременности, это может иметь широкие последствия для развития иммунной системы [Tamburini et al., 2016].
Причины кесарева сечения и сопутствующие факторы
Взаимосвязь хозяина и микробиоты оказывает явное влияние на здоровье: известно, что микробный дисбиоз вызывает широкий спектр заболеваний слизистой оболочки и системных иммуноопосредованных заболеваний, включая ВЗК [Bager et al., 2012 ], аутоиммунные состояния и аллергия [Kelly et al., 2007]. Однако осложнения, которые могут указывать на кесарево сечение, такие как преждевременные роды, экстремальный ИМТ матери, инфекция, крайние размеры ребенка и гестационный диабет, часто связаны с микробным дисбактериозом во время беременности [Neu and Rushing, 2011].Эти показания для кесарева сечения могут сами по себе повлиять на микробиоту и, следовательно, затруднить наше понимание микробиоты при проведении кесарева сечения.
Преждевременные роды как особый случай
Несмотря на усовершенствованные технологии и диагностику, преждевременные роды (определяемые как <37 недель беременности) по-прежнему представляют собой глобально значимое эпидемиологическое бремя [Purisch and Gyamfi-Bannerman, 2017]. Только в Соединенных Штатах Америки на преждевременные роды приходится примерно 1 из 10 родов, и у таких детей вероятность родов с помощью кесарева сечения выше [Racusin et al., 2016]. Это снижает их воздействие на материнские вагинальные и кишечные микробы и приводит к дифференцированному развитию иммунной системы, которая может формировать микробную колонизацию в их уже незрелом кишечнике.
Кроме того, они чаще подвергаются искусственному вскармливанию [Madan et al., 2016], инвазивным процедурам, антибиотикам [Yassour et al., 2016] и другим лекарствам, которые изменяют рН желудочно-кишечного тракта, и все это способствует измененная сборка микробного сообщества [Donders et al., 2010]. Наконец, у недоношенных детей, находящихся в отделении интенсивной терапии новорожденных (ОИТН) в течение длительного времени, преобладают микробы, связанные с окружением ОИТН, многие из которых несут гены устойчивости к антибиотикам [Brooks et al., 2014].
Ни одной причины преждевременных родов выявлено не было, но многие факторы риска включают микробный дисбиоз, включая восходящие урогенитальные инфекции [Goldenberg et al., 2008], нисходящие инфекции пародонта [Michalowicz et al., 2006] и аномальные вагинальные инфекции. микробиота [Donders et al., 2010].
Как упоминалось выше, в литературе предполагаются значительные различия в микробиоме влагалища у женщин с исходами доношенных и преждевременных родов, что подразумевает потенциальную диагностическую значимость [Haque et al., 2017]. Кроме того, эпидемиологические исследования установили корреляцию между флорой полости рта, заболеваниями пародонта и преждевременными родами [Michalowicz et al., 2006]. Исследования Hällström et al. [Hällström et al., 2004] обнаружили связь между измененной кишечной колонизацией и родоразрешением путем кесарева сечения у недоношенных детей, а также выявили изменения в фекальной микробиоте с началом некротического энтероколита.Несмотря на то, что недоношенные дети составляют значительную часть младенцев, рожденных с помощью кесарева сечения, существует множество смешивающих факторов, и для целей этого обзора мы будем рассматривать только доношенных детей, родившихся с помощью кесарева сечения.
Другие сопутствующие условия
К другим состояниям, которые приводят к увеличению частоты кесарева сечения, относятся экстремальный ИМТ матери, инфекция, гестационный диабет и размер ребенка. Высокий ИМТ матери объясняется не только генетическими факторами, но и микробным составом [Zhu et al., 2015]. Микробный дисбиоз кишечника может влиять на всасывание питательных веществ, воспаление и микробную транслокацию, а также на колонизацию кишечника плода и развитие метаболических тканей плода [Gohir et al., 2014]. Во время беременности женщины находятся в измененном иммунном состоянии и поэтому более восприимчивы к патогенам, таким как вирус иммунодефицита человека [Yee et al., 2018], гепатит C [Yi et al., 2018], вирус Зика [Magnani et al., 2018], Listeria monocytogenes , Plasmodium spp., Вирусы гриппа, Chlamydia trachomatis , группа B Streptococcus , Treponema pallidum и вирусы герпеса [Guo et al., 2018]. Эти патогены могут вызывать тяжелые синдромы в зависимости от времени инфицирования во время беременности [Vermillion and Klein, 2018]. Например, цитомегаловирус является наиболее распространенной врожденной инфекцией во всем мире, и прямое инфицирование плода может привести к нейросенсорному дефициту, неспособности к обучению, микроцефалии и психическим расстройствам [Racicot and Mor, 2017]. Когда цитомегаловирус является латентным или реактивируется у матери, даже без непосредственного заражения плода, это может привести к задержке роста плода, спонтанной потере беременности или преэклампсии — всем симптомам ранней плацентарной недостаточности [Racicot and Mor, 2017].Примечательно, что, хотя известно, что эти состояния нарушают материнскую микробиоту и увеличивают вероятность родоразрешения путем кесарева сечения, они могут дополнительно оказывать микробиологически опосредованное воздействие на здоровье младенца, независимо от способа родоразрешения.
Кесарево сечение и отдаленные результаты для здоровья
Как упоминалось ранее, микробиота человека может влиять на здоровье беременных и детей. В частности, микробиота младенцев и, следовательно, дисбактериоз, связанный с кесаревым сечением, могут играть роль в долгосрочных последствиях для здоровья, как показано на Рисунке 1.Хотя микробиота младенцев изучалась на разных участках тела, основная часть литературы и основное внимание нашего обзора посвящено микробиоте кишечника младенца и иммунным ответам на воздействие микробов.
Рис. 1.
Краткое изложение наших текущих представлений о факторах и условиях, связанных с кесаревым сечением. Развивающаяся микробиота кишечника, воздействие микробов из окружающей среды и генетика хозяина взаимодействуют, опосредуя иммунные реакции младенца.Некоторые показатели кесарева сечения, включая преждевременные роды, крайние значения индекса массы тела матери (ИМТ), инфекцию, крайние размеры ребенка и гестационный диабет, могут независимо вызывать микробный дисбактериоз и затруднять наше понимание последствий кесарева сечения. Микробный дисбактериоз, вызванный кесаревым сечением, связан с повышенным риском воспалительного заболевания кишечника (ВЗК) и широким спектром аутоиммунных, аллергических и метаболических состояний.
Иммунное и метаболическое здоровье
В последнее время было признано, что роль микробиоты кишечника важна для иммунного и метаболического развития в раннем возрасте.У младенцев, перенесших кесарево сечение, типичная передача микробов от матери к ребенку нарушена, поэтому иммунное и метаболическое развитие нарушено [Sevelsted et al., 2015a]. Это имеет важные последствия для долгосрочных иммуноопосредованных результатов для здоровья: у младенцев после кесарева сечения увеличилась частота СД1, ВЗК и аутоиммунных / аллергических состояний [Kelly et al., 2007].
Kostic Kostic, 2015 изучал динамику микробиома кишечника младенца человека в процессе прогрессирования СД1 в когорте из 33 финских и эстонских младенцев, генетически предрасположенных к СД1.Хотя они отметили большие различия в общем таксономическом составе между младенцами и внутри них с течением времени, было значительно меньше вариаций метаболического потенциала микробиома. Они также наблюдали снижение видового разнообразия, изменения функций провоспалительных генов и изменения уровней метаболитов в сыворотке и стуле у младенцев, у которых развился СД1. Наблюдаемые ими тенденции, отличающие прогрессирующих СД1 от непрогрессоров, могут иметь потенциальное диагностическое применение [Kostic, 2015].Кроме того, другие исследования также предположили, что патогенез и клиническое течение T1D являются результатом взаимодействия между генетической предрасположенностью, воздействием окружающей среды в раннем возрасте и врожденным иммунным ответом [Vehik and Dabelea, 2012].
Влияние кесарева сечения на заболевания, связанные с иммунитетом, все еще находится на стадии становления. Однако в другом исследовании изучалась когорта из 2 миллионов датских детей, родившихся в срок в период с 1997 по 2012 год, и было определено, что родоразрешение с помощью кесарева сечения является фактором риска иммунных заболеваний, включая астму, системные нарушения соединительной ткани, ювенильный артрит, ВЗК, иммунную недостаточность и т. Д. и лейкоз [Sevelsted et al., 2015а]. Результаты предполагают, что события в раннем возрасте могут диктовать иммунные нарушения, которые повышают риск заболеваний в более позднем возрасте.
Результаты для желудочно-кишечного тракта
Антибиотики широко используются во время беременности, а также до и непосредственно перед родами кесарева сечения для предотвращения инфекции. Однако исследования микробиома кишечника взрослых, не основанные на культуре, показывают, что воздействие антибиотиков может нарушать микробиоту желудочно-кишечного тракта в течение многих лет [Murgas Torrazza and Neu, 2011].Более того, рост устойчивости к антибиотикам у детей может привести к инфекциям и дисбактериозу кишечника [Medernach and Logan, 2018].
Микробные нарушения в желудочно-кишечном тракте связаны с болезнью Крона. В датском национальном когортном исследовании с участием 2,1 миллиона человек, родившихся в период 1973–2008 годов, в общей сложности 8 142 человека были диагностированы с ВЗК в возрасте до 36 лет. Основным фактором, связанным с повышенным риском ВЗК, было кесарево сечение. Доставка.Более того, большинство диагнозов ВЗК было поставлено после 15 лет, что означает, что дисбактериоз в результате кесарева сечения в начале жизни может иметь последствия для здоровья на протяжении всей жизни [Bager et al., 2012].
Риск атопии и аллергических заболеваний
Пищевая аллергия — глобальная проблема общественного здравоохранения, от которой страдают до 8% детей и до 5% взрослых в США, Великобритании, Канаде и Австралии. Хотя движущие силы аллергических заболеваний остаются неясными, данные указывают на взаимодействие генов с окружающей средой, которое начинается на раннем этапе развития [Lieberman et al., 2018]. В частности, было показано, что кесарево сечение увеличивает пищевую аллергию [Dominguez-Bello et al., 2016]. Кроме того, вероятность развития аллергии у младенца зависит от режима кормления (грудное молоко или смесь), который представляет собой первые связанные с питанием микробы, попадающие в организм человека [Cabrera-Rubio et al., 2012]. Таким образом, режим кормления играет важную роль в воздействии пищевых аллергенов и реакции на них на раннем этапе развития. Bager et al. [Bager et al., 2008] провели метаанализ 26 исследований, чтобы определить связь родоразрешения с помощью кесарева сечения с риском атопии и аллергических заболеваний.Они пришли к выводу, что кесарево сечение увеличивает риск аллергического ринита, астмы, госпитализации по поводу астмы и, возможно, пищевой аллергии / пищевой атопии, но не влияет на риск ингаляционной атопии или атопического дерматита.
Метаболический синдром
ИМТ матери может быть определяющим фактором микробного сообщества кишечника младенца в период лактации. Исследования показали, что грудное молоко от матерей с ожирением, как правило, содержит отчетливое и менее разнообразное микробное сообщество по сравнению с молоком от матерей с нормальным весом [Cabrera-Rubio et al., 2012]. Микробиота грудного молока также различается у матерей, родивших с помощью кесарева сечения, и вагинальных, что может быть связано с хирургическим вмешательством, наличием физиологического стресса или гормональных сигналов. Поскольку грудное молоко представляет собой один из наиболее важных послеродовых источников передачи микробов от матери ребенку, необходима дальнейшая работа для количественной оценки воздействия микробиоты грудного молока на кишечник ребенка. В исследовании «Матери и дети Северного Манхэттена» участвовали 436 диад мать-ребенок до 7 лет, чтобы изучить влияние использования антибиотиков матерью во втором или третьем триместре беременности.Результаты показали, что у детей, получавших антибиотики во втором или третьем триместре, риск ожирения был на 84% выше. Кесарево сечение было независимо связано с повышением риска детского ожирения на 46% независимо от использования антибиотиков и независимо от того, было ли кесарево сечение плановым или невыполнительным [Mueller et al., 2015].
Терапия по восстановлению микробиоты для младенцев
Нарушенная микробиота кишечника младенца может быть возвращена к исходному состоянию посредством повторного введения комменсальных бактерий вместе с грудным вскармливанием и / или с помощью пре / пробиотических препаратов [Neut et al., 1987; Азад и др., 2013]. Однако Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США еще не одобрило какие-либо пре / пробиотические препараты для лечения микробного дисбактериоза, вызванного кесаревым сечением. Тем не менее, продолжающееся клиническое испытание в Соединенном Королевстве (клинический идентификатор: ISRCTN116
) будет изучать, способствует ли краткосрочное ежедневное введение пробиотических добавок с Bifidobacterium infantis младенцам на грудном вскармливании с помощью кесарева сечения здоровой микробиоте кала, которая может поддерживаться при грудном вскармливании до отлучение от груди через 6 месяцев [«ISRCTN — ISRCTN116, 2018].Аналогичным образом, растущее число исследований Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США проверяет безопасность и эффективность пре / пробиотиков, направленных на лечение заболеваний, связанных с кесаревым сечением. Одним из примеров является недавнее испытание добавки Lactobacillus rhamnosus GG в раннем возрасте у младенцев с высоким риском астмы. Добавка способствовала тонкому, но важному таксономическому и метаболическому ремоделированию в кишечнике младенца, и Durack et al. [Durack et al., 2018] наблюдали увеличение количества регуляторных Т-клеток ex vivo в возрасте 6 месяцев, что свидетельствует об иммуномодуляции.Следует отметить, что эффективность этой добавки в профилактике астмы еще предстоит определить.
Еще одна стратегия восстановления здоровой микробиоты называется «вагинальный посев», когда младенцы после кесарева сечения подвергаются воздействию содержимого влагалища матери [Braegger et al., 2011]. Недавние результаты показывают, что микробиом кала, кожи и ротовой полости новорожденных, рожденных через естественные родовые пути, больше напоминает микробиом детей, родившихся через естественные родовые пути, чем детей, рожденных с помощью кесарева сечения [Dominguez-Bello et al., 2010]. Хотя эффективность и долгосрочные последствия для здоровья вагинального посева остаются неясными, эти результаты демонстрируют, что вагинальные микробы, передаваемые от матери, могут быть частично восстановлены при рождении у младенцев, рожденных с помощью кесарева сечения.Хотя эта стратегия ограничена, поскольку она не подвергает младенца воздействию кишечного содержимого матери, она закладывает основу для разработки новых микробных методов лечения и / или малых молекул для восстановления состава и развития здоровой детской микробиоты.
В целом связь между микробным дисбактериозом у младенцев, рожденных путем кесарева сечения, и долгосрочными последствиями для здоровья — это новая область исследований. В дальнейшем необходимо будет выяснить вовлеченные механизмы, такие как метаболические и иммунные пути, а также микробная функция, чтобы применить это исследование к персонализированной терапии на основе микробиома.
Заявление о раскрытии информации
Все авторы не имеют финансовых отношений, имеющих отношение к этой статье. Все авторы не сообщают о конфликте интересов.
Список литературы
- Аагаард К., Ма Дж., Энтони К. М., Гану Р., Петросино Дж., Версалович Дж.: Плацента содержит уникальный микробиом.Sci Transl Med 2014; 6: 237ra65.
- Костич А.Д. и др.: Динамика микробиома кишечника младенца человека в развитии и прогрессировании к диабету 1 типа. Cell Host Microbe 2015; 17: 260–273.
- Александрия А.Н., де ла Круз Д.М., Дэвис-Ричардсон А.Г., Речцигл К.Т., Ли Н., Дрю Дж.К., Мургас-Торрацца Р. и др.: Анализ микробиома мекония выявляет бактерии, связанные с преждевременным рождением.PLoS One 2014; 9: e
- .
- Azad MB, Konya T, Maughan H, Guttman DS, Field CJ, Chari RS, Sears MR и др.: Микробиота кишечника здоровых канадских младенцев: профили по способам родоразрешения и питанию младенцев в 4 месяца. CMAJ 2013; 185: 385–394.
- Бэкхед Ф., Росвалл Дж., Пэн Й., Фэн К., Цзя Х., Ковачева-Датчари П., Ли Й. и др.: Динамика и стабилизация микробиома кишечника человека в течение первого года жизни.Cell Host Microbe 2015; 17: 690–703.
- Bager P, Wohlfahrt J, Westergaard T: Кесарево сечение и риск атопии и аллергических заболеваний: метаанализы. Clin Exp Allergy 2008; 38: 634–642.
- Багер П., Симонсен Дж., Нильсен Н.М., Фриш М.: Кесарево сечение и риск воспалительного заболевания кишечника у детей: национальное когортное исследование.Воспаление кишечника 2012; 18: 857–862.
- Bennet R, Eriksson M, Nord CE, Zetterström R: Фекальная бактериальная микрофлора новорожденных во время интенсивной терапии и лечения пятью схемами антибиотиков. Pediatr Infect Dis 1986; 5: 533–539.
- Bernstein CN, Banerjee A, Targownik LE, Singh H, Ghia JE, Burchill C, Chateau D, Roos LL: Кесарево сечение не является фактором риска развития воспалительного заболевания кишечника: популяционный анализ.Клин Гастроэнтерол Гепатол 2016; 14: 50–57.
- Bisanz JE, Enos MK, PrayGod G, Seney S, Macklaim JM, Chilton S, Willner D, et al: Микробиота на нескольких участках тела во время беременности в сельском населении Танзании и влияние пробиотического йогурта с добавлением моринги. Appl Environ Microbiol 2015; 81: 4965–4975.
- Bonifacio E, Warncke K, Winkler C, Wallner M, Ziegler AG: Кесарево сечение и индуцированный интерфероном полиморфизм гена геликазы в сочетании повышают риск диабета 1 типа у детей. Диабет 2011; 60: 3300–3306.
- Braegger C, Chmielewska A, Decsi T, Kolacek S, Mihatsch W, Moreno L, Piescik M и др.: Дополнение детской смеси пробиотиками и / или пребиотиками: систематический обзор и комментарий комитета ESPGHAN по питанию.J Педиатр Гастроэнтерол Нутр 2011; 52: 238–250.
- Брукс Б., Фирек Б.А., Миллер С.С., Шарон И., Томас Б.К., Бейкер Р., Моровиц М.Дж., Банфилд Дж.Ф .: Микробы в отделении интенсивной терапии новорожденных напоминают микробы, обнаруживаемые в кишечнике недоношенных детей. Microbiome 2014; 2: 1.
- Cabrera-Rubio R, Collado MC, Laitinen K, Salminen S, Isolauri E, Mira A: Микробиом грудного молока изменяется в период лактации и определяется весом матери и способом родоразрешения.Am J Clin Nutr 2012; 96: 544–551.
- Cardwell CR, Stene LC, Joner G, Cinek O, Svensson J, Goldacre MJ, Parslow RC и др.: Кесарево сечение связано с повышенным риском развития сахарного диабета 1 типа в детстве: метаанализ обсервационных исследований. Диабетология 2008; 51: 726–735.
- CDC: Центры по контролю и профилактике заболеваний, 2017. https://www.cdc.gov/index.htm.
- Clausen TD, Bergholt T, Bouaziz O, Arpi M, Eriks son F, Rasmussen S, Keiding N, Løkkegaard EC: Лечение антибиотиками широкого спектра действия и последующий детский диабет 1 типа: общенациональное датское когортное исследование.PLoS One 2016; 11: e0161654.
- Collado MC, Rautava S, Aakko J, Isolauri E, Salminen S: Колонизация кишечника человека может быть инициирована внутриутробно различными микробными сообществами в плаценте и околоплодных водах. Sci Rep 2016; 6: 23129.
- Кузен-Франкель Дж .: Бактерии и астма: распутывание связей.Наука 2010; 330: 1168–1169.
- Дармассилейн К., Хайд М.Дж., Сантакумаран С., Гейл С., Моди Н.: Способ родов и индекс массы тела потомства, избыточный вес и ожирение во взрослой жизни: систематический обзор и метаанализ. PloS One 2014; 9: e87896.
- ДиДжиулио Д.Б., Ромеро Р., Амоган Х.П., Кусанович Дж. П., Бик Э.М., Готч Ф., Ким С.Дж., Эрез О., Эдвин С., Релман Д.А.: Распространенность, разнообразие и изобилие микробов в околоплодных водах во время преждевременных родов: молекулярное и культуральное исследование .PloS One 2008; 3: e3056.
- Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н., Найт Р. Режим доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S A 2010; 107: 11971–11975.
- Домингес-Белло М.Г., Де Жезус-Лабой К.М., Шен Н., Кокс Л.М., Амир А., Гонсалес А., Бокулич Н.А. и др.: Частичное восстановление микробиоты младенцев, рожденных после кесарева сечения, посредством вагинального микробного переноса. Nat Med 2016; 22: 250–253.
- Donders GG, Van Calsteren C, Bellen G, Reybrouck R, Van den Bosch T., Riphagen I, Van Lierde S: Связь между аномальной флорой влагалища и длиной шейки матки как факторами риска преждевременных родов.Ультразвук Obstet Gynecol 2010, Epub опережает печать.
- Дурак Дж., Кимес Н.Е., Лин Д.Л., Раух М., Маккин М., МакКоли К., Панцер А.Р., Мар Дж.С., Кабана М.Д., Линч С.В.: Задержка развития кишечной микробиоты у младенцев с высоким риском астмы может быть временно изменена добавлением лактобацилл.Nat Commun 2018; 9: 707.
- Фокс C, Eichelberger K: Материнский микробиом и исходы беременности. Fertil Steril 2015; 104: 1358–1363.
- Funkhouser LJ, Bordenstein SR: Мама знает лучше всех: универсальность передачи микробов от матери.PLoS Biol 2013; 11: e1001631.
- Гохир В., Рэтклифф Е.М., Слобода Д.М.: Из ошибок, которые формируют нас: материнское ожирение, микробиом кишечника и долгосрочный риск заболеваний. Pediatr Res 2014; 77: 196–204.
- Guo L, Qu P, Zhang R, Zhao D, Wang H, Liu R, Mi B, Yan H, Dang S: согласованный по шкале предрасположенности анализ связи между инфекциями при беременности и неблагоприятными исходами родов в сельских районах на северо-западе Китая.Sci Rep 2018; 8: 5154.
- Hällström M, Eerola E, Vuento R, Janas M, Tammela O: Влияние способа родоразрешения и некротизирующего энтероколита на микрофлору кишечника у недоношенных детей. Eur J Clin Microbiol Infect Dis 2004; 23: 463–470.
- Haque MM, Merchant M, Kumar PN, Dutta A, Mande SS: Разнообразие влагалищного микробиома в первом триместре: потенциальный индикатор риска преждевременных родов.Sci Rep 2017; 7: 16145.
- Ху Дж., Номура Й., Башир А., Фернандес-Эрнандес Х., Ицковиц С., Пей З., Стоун Дж., Лаудон Х., Петр I. На разнообразную микробиоту мекония влияет статус материнского диабета. PLoS One 2013; 8: e78257.
- Хуан Л., Чен Кью, Чжао Ю., Ван В., Фанг Ф, Бао И .: Связано ли плановое кесарево сечение с повышенным риском астмы? Метаанализ.»J Asthma 2015; 52: 16-25.
- Хайман Р.В., Фукусима М., Цзян Х., Фунг Э., Рэнд Л., Джонсон Б., Во KC, Каугей А.Б., Хилтон Дж.Ф., Дэвис Р.В., Джудис Л.С.: разнообразие микробиома влагалища коррелирует с преждевременными родами. Reprod Sci 2014; 1: 32–40.
- ISRCTN — ISRCTN116: Продвижение здорового кишечного микробиома при прибытии с плановым кесаревым сечением (PROMESA) путем добавления младенческих пробиотиков к новорожденным, находящимся на грудном вскармливании, 2018.
- Хименес Э., Фернандес Л., Марин М.Л., Мартин Р., Одриозола Дж. М., Нуэно-Палоп С., Нарбад А., Оливарес М., Хаус Дж., Родригес Дж. М.: Выделение комменсальных бактерий из пуповинной крови здоровых новорожденных, рожденных с помощью кесарева сечения. Curr Microbiol 2005; 51: 270–274.
- Хименес Э., Марин М.Л., Мартин Р., Одриозола Дж. М., Оливарес М., Хаус Дж., Фернандес Л., Родригес Дж. М .: Действительно ли меконий от здоровых новорожденных бесплоден? Res Microbiol 2008; 159: 187–193.
- Келли Д., Кинг Т., Аминов Р.: Важность микробной колонизации кишечника в раннем возрасте для развития иммунитета. Mutat Res 2007; 622: 58–69.
- Климан Х.Дж.: Комментарий по поводу «плацента таит в себе уникальный микробиом.”Научный перевод медицины 2014; 6: 254le4.
- Корен О., Гудрич Дж. К., Каллендер Т. К., Спор А, Лайтинен К., Бэкхед Х. К., Гонсалес А., Вернер Дж. Дж., Ангенент Л. Т., Найт Р., Бекхед Ф., Исолаури Е., Салминен С., Лей РЭ: Реконструкция микробиома кишечника и метаболизма хозяина. изменения во время беременности.Cell 2012; 150: 470–480.
- Гольденберг Р.Л., Калхейн Дж. Ф., Ямс Дж. Д., Ромеро Р.: Эпидемиология и причины преждевременных родов. Lancet 2008; 371: 75–84.
- Лаудер А.П., Рош А.М., Шерилл-Микс С., Бейли А., Лафлин А.Л., Биттингер К., Лейт Р., Эловиц М.А., Парри С., Бушман Ф.Д.: Сравнение образцов плаценты с контрольными показателями контаминации не дает доказательств отдельной микробиоты плаценты.Microbiome 2016; 4:29.
- Ли Х.Т., Чжоу Ю.Б., Лю Дж.М.: Влияние кесарева сечения на избыточный вес и ожирение потомства: систематический обзор и метаанализ. Int J Obes (Лондон) 2013; 37: 893–899.
- Либерман JA, Greenhawt M, Nowak-Wegrzyn A: Окружающая среда и пищевая аллергия.Ann Allergy Asthma Immunol 2018; 120: 455–457.
- Madan JC, Hoen AG, Lundgren SN, Farzan SF, Cottingham KL, Morrison HG, Sogin ML, Li H, Moore JH, Karagas MR: Ассоциация кесарева сечения и добавления смеси с кишечным микробиомом 6-недельных младенцев.JAMA Pediatr 2016; 170: 212–219.
- Magnani DM, Rogers TF, Maness NJ, Grubaugh ND, Beutler N, Bailey VK, Gonzalez-Nieto L, Gutman MJ, Pedreño-Lopez N, Kwal JM, Ricciardi MJ, Myers TA, Julander JG, Bohm RP, Gilbert MH, Schiro F, Aye PP, Blair RV, Martins MA, Falkenstein KP, Kaur A, Curry CL, Kallas EG, Desrosiers RC, Goldschmidt-Clermont PJ, Whitehead SS, Andersen KG, Bonaldo MC, Lackner AA, Panganiban AT, Burton DR, Watkins DI: Гибель плода и неудачная терапия антителами во время инфицирования беременных макак вирусом Зика.Nat Commun 2018; 9: 1624.
- Медернах Р.Л., Логан Л.К .: Растущая угроза устойчивости к антибиотикам у детей. Infect Dis Clin North Am 2018; 32: 1–17.
- Michalowicz BS, Hodges JS, DiAngelis AJ, Lupo VR, Novak MJ, Ferguson JE, Buchanan W, Bofill J, Papapanou PN, Mitchell DA, Matseoane S, Tschida PA: Лечение заболеваний пародонта и риск преждевременных родов.N Engl J Med 2006; 355: 1885–1894.
- Мюллер Н.Т., Уайатт Р., Хёпнер Л., Оберфилд С., Домингес-Белло М.Г., Виден Е.М., Хассун А., Перера Ф., Рандл А.: Пренатальное воздействие антибиотиков, кесарево сечение и риск детского ожирения. Int J Obes 2015; 39: 665–670.
- Mueller NT, Bakacs E, Combellick J, Grigoryan Z, Dominguez-Bello MG: Развитие микробиома младенца: мама имеет значение.Тенденции Мол Мед 2015; 21: 109–117.
- Murgas Torrazza R, Neu J: Развитие кишечного микробиома и его связь со здоровьем и болезнями новорожденного. J Perinatol 2011; 31 (добавление 1): S29 – S34.
- Negele K, Heinrich J, Borte M, von Berg A, Schaaf B., Lehmann I, Wichmann HE, Bolte G; LISA Study Group: Способ доставки и развитие атопического заболевания в течение первых 2 лет жизни.Pediatr Allergy Immunol 2004; 15: 48–54.
- Neu J: Аспекты развития микробиоты кишечника матери, плода и младенца и их влияние на долгосрочное здоровье. Matern Health Neonatol Perinatol 2015; 1: 6.
- Neu J, Rushing J: Кесарево сечение по сравнению с вагинальными родами: долгосрочные исходы для новорожденных и гипотеза гигиены.Clin Perinatol 2011; 38: 321–331.
- Neut C, Bezirtzoglou E, Romond C, Beerens H, Delcroix M, Noel AM: Бактериальная колонизация толстой кишки у новорожденных, рожденных путем кесарева сечения. Zentralbl Bakteriol Mikrobiol Hyg A 1987; 266: 330–337.
- Паропкари А.Д., Леблебичиоглу Б., Кристиан Л.М., Кумар П.С.: Курение, беременность и поддесневой микробиом.Sci Rep 2016; 6: 30388.
- Purisch SE, Gyamfi-Bannerman C: Эпидемиология преждевременных родов. Семин Перинатол 2017; 41: 387–391.
- Racicot K, Mor G: Риски, связанные с вирусными инфекциями во время беременности.J Clin Invest 12017; 27: 1591–1599.
- Racusin DA, Antony KM, Haase J, Bondy M, Aagaard KM: Способ родоразрешения у недоношенных новорожденных: имеет ли это значение? AJP Rep 2016; 6: e251 – e259.
- Rutayisire E, Huang K, Liu Y, Tao F Способ родоразрешения влияет на разнообразие и характер колонизации кишечной микробиоты в течение первого года жизни младенцев: систематический обзор.БМК Гастроэнтерол 2016; 16: 86.
- Sevelsted A, Stokholm J, Bønnelykke K, Bisgaard H: Кесарево сечение и хронические иммунные расстройства. Педиатрия 2015; 135: e92 – e98.
- Stene LC, Magnus P, Lie RT, Søvik O, Joner G: Нет связи между преэклампсией или кесаревым сечением и заболеваемостью диабетом 1 типа среди детей: крупное популяционное когортное исследование.Pediatr Res 2003; 54: 487–490.
- Stout MJ, Goetzinger KR, Tuuli MG, Cahill AG, Macones GA, Odibo AO: аналиты сыворотки первого триместра, характеристики матери и ультразвуковые маркеры для прогнозирования беременностей с риском преждевременных родов. Плацента 2013; 34: 14–19.
- Стаут MJ, Zhou Y, Wylie KM, Tarr PI, Macones GA, Tuuli MG: Тенденции влагалищного микробиома на ранних сроках беременности и преждевременные роды.Am J Obstet Gynecol 2017; 217: 356.e1–356.e18.
- Tamburini S, Shen N, Wu HC, Clemente JC: Микробиом в раннем возрасте: последствия для здоровья. Nat Med 2016; 22: 713–722.
- Thavagnanam S, Fleming J, Bromley A, Shields MD, Cardwell CR: метаанализ связи между кесаревым сечением и детской астмой.Clin Exp Allergy 2008; 38: 629–633.
- Вехик К., Дабелеа Д: Почему роды с использованием кесарева сечения связаны с диабетом 1 типа у детей? »Диабет 2012; 61: 36–37.
- Vermillion MS, Klein SL: Беременность и инфекция: использование патогенеза болезни для информирования стратегии вакцинации.NPJ Vaccines 20118; 3: 6.
- Яссур М., Ватанен Т., Сильяндер Х., Хямяляйнен А.М., Херконен Т., Риханен С.Дж., Франзоса Е.А., Вламакис Х., Хуттенхауэр С., Геверс Д., Ландер Е.С., Книп М.: Естественная история микробиома кишечника младенца и влияние лечения антибиотиками на бактериальный разнообразие и стабильность штаммов.Sci Transl Med 2016; 8: 343ra81–343ra81.
- Yee LM, McGregor DV, Sutton SH, Garcia PM, Miller ES: Связь между раскрытием материнского ВИЧ и факторами риска перинатальной передачи. J Perinatol 2018; 38: 639–644.
- Yi W, Pan CQ, Li MH, Wan G, Lv YW, Liu M, Hu YH, Zhang ZY, Xie Y: характеристики и предикторы обострения послеродового гепатита у женщин с хроническим гепатитом B.Am J Gastroenterol 2018; 113: 686–693.
- Юань С., Гаскинс А.Дж., Блейн А.И., Чжан С., Гиллман М.В., Миссмер С.А., Филд А.Е., Чаварро Дж. Э .: Связь между кесаревым сечением и риском ожирения у потомства в детстве, подростковом и раннем взрослом возрасте. JAMA Pediatr 2016; 170: e162385.
- Zhu T, Tang J, Zhao F, Qu Y, Mu D: Связь между материнским ожирением и оценкой по шкале Апгар у потомства или pH пуповины: систематический обзор и метаанализ. Sci Rep 2015; 5: 18386.
Автор Контакты
Мелисса Дсуза
Commense Inc.,
501 Boylston St. Suite 6102
Boston, MA 02116 (США)
Электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 24 июля 2018 г.,
Дата выпуска: июль 2018 г.
Количество страниц для печати: 9
Количество фигур: 1
Количество столов: 1
ISSN: 0250-6807 (печатный)
eISSN: 1421-9697 (онлайн)
Для дополнительной информации: https: // www.karger.com/ANM
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью любой системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
архивов клинической микробиологии | инсайт медицинское издательство
Импакт-фактор журнала: 0.72 *; 1,37 * (5-летний импакт-фактор)
Index Copernicus Value: 88,97
H Index: 3
Глобальный импакт-фактор: 0,564
Research Gate Journal Воздействие: 0,16
Архив клинической микробиологии (ISSN: 1989-8436) — это рецензируемый международный журнал, в состав редакционной коллегии которого входят всемирно признанные ученые. С быстрой публикацией статей во всех областях микробиологии и инфекционных болезней.Архив клинической микробиологии существует уже восьмой год, и он был включен в каталог Национальной медицинской библиотеки (NLM) (первый шаг, который будет проиндексирован в PubMed). Кроме того, он проиндексирован в Index Copernicus (ICV: 88.97), DeepDyve, Open J Gate, JournalSeek, EBSCO A-Z.
https://www.imedpub.com/submissions/archives-clinical-microbiology.html или отправьте в виде вложения по электронной почте в редакцию по адресу [электронная почта защищена]
Патогенные бактерии
Патогенные бактерии — это бактерии, которые при попадании в организм способны вызывать заболевание и распространяться через воду, воздух, почву, а также при физическом контакте.В основном бактерии безвредны и полезны, но некоторые из них являются патогенными.
Связанные журналы патогенных бактерий
Журнал гепатита, Журнал иммунологических методов лечения инфекционных заболеваний, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Журнал патологии и трансляционной медицины, Журнал патологии. Клинические исследования, отчеты о клинических случаях в клинической патологии, журнал Джейкобса по микробиологии и патологии, текущие отчеты по патобиологии, Международный журнал судебной медицины и патологии, Открытие патологии.
Вирусные болезни
Вирусные болезни — это инфекции, вызываемые вирусом или микроорганизмами. вирус, поражающий клетку, или формирование вирусной капсулы на поверхности клетки, которая может начать размножаться сама по себе и начинает распространяться, что приводит к вирусному заболеванию.
Связанные журналы вирусных заболеваний
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Вирусная болезнь, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в области вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Вирусология пищевых продуктов и окружающей среды, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Микобактериальные болезни
Микобактериальное заболевание — это инфекция одного типа, вызываемая скоплением микробов. Эти микобактериальные заболевания включают туберкулез, проказу, микобактерии язвы и Mycobacterium Para tuberculosis. Обычно их лечат такими лекарствами, как рифампицин, этамбутол и изониазид. Mycobacterium leprae лечится дапсоном.
Связанные журналы микобактериальных заболеваний
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и противовирусных исследований, Текущие отчеты о грибковых инфекциях, Журнал инвазивных грибковых инфекций, Отчеты о случаях медицинской микологии, Медицинские журнал микологии, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Бактериальная инфекция
Бактериальные инфекции — это инфекции, вызываемые бактериями. Инфекционная бактерия быстро размножается и выделяет токсичные химические вещества, которые повреждают ткани. Общие бактериальные инфекции включают пневмонию, ушные инфекции, диарею, инфекции мочевыводящих путей и кожные заболевания
Связанные журналы бактериальной инфекции
Журнал гепатита, Журнал иммунологических методов при инфекционных заболеваниях, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Патогены и болезни, Текущие отчеты по клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и окружающей среды , Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал исследований микробиологии.
Вирусная инфекция
Вирусные инфекции — это небольшой инфекционный организм, который меньше грибка или бактерии. Вирус прикрепляется к поверхности клетки и высвобождает свою вирусную ДНК или РНК внутри клеток, которые затем реплицируются сами по себе внутри клетки, чтобы сделать клетку более заразной и распространяться от одной клетки к другой, что приводит к вирусной инфекции.
Связанные журналы вирусной инфекции
Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая вирусология и вирусология окружающей среды, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Грибковая инфекция
Грибковые инфекции — это инфекция, которая обычно начинается в легких или на коже, прогрессирует медленно и редко бывает серьезной, если иммунная система не работает на выходных. Когда иммунная система выходит на выходные, она может быть очень агрессивной и быстро распространяться, что приводит к смерти.
Связанные журналы по грибковой инфекции
Медицинская микология: открытый доступ, журнал патологии и эпидемиологии, исследования первичного и приобретенного иммунодефицита, журнал вирусологических и противовирусных исследований, достижения в области антибиотиков и антител, отчеты о текущих грибковых инфекциях, журнал инвазивных грибковых инфекций, отчеты о случаях медицинской микологии, медицинская микология журнал, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Медицинская микробиология
Медицинская микробиология начинается с анализа иммунной системы, с помощью которой микроорганизмы или токсины проникают силой, чтобы победить клетки и встретиться с ними. Это исследование микроорганизмов или микробов, которые влияют на все аспекты нашей жизни, а также включают реакцию хозяина на микроорганизмы.
Родственные журналы медицинской микробиологии
Клиническая микробиология: Открытый доступ, Журнал новых инфекционных заболеваний, Журнал судебной патологии, Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Открытый журнал медицинской микробиологии, Журнал медицинской микробиологии, Международный журнал медицинской микробиологии, Медицина Микробиология и иммунология, Индийский журнал медицинской микробиологии, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Обзоры по медицинской микробиологии, Международный журнал медицинской микробиологии, Приложение, Письма по медицинской микробиологии.
Вирус гепатита
Гепатит — это заболевание печени, при котором печень набухает и воспаляется из-за вирусной инфекции, которая приводит к гепатиту. Состояние может проходить самостоятельно или прогрессировать до фиброза, цирроза или рака печени. Вирусная инфекция гепатита бывает пяти типов: гепатит A, B, C, D и E, а также может возникать в результате употребления алкоголя.
Связанные журналы вируса гепатита
Журнал гепатита, Журнал иммунологических методов при инфекционных заболеваниях, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Текущие отчеты гепатологии, Исследование и лечение гепатита, Вирусный гепатит на практике, Ежемесячный гепатит, Текущие отчеты о гепатите, Еженедельный гепатит, Журнал вирусного гепатита, Обзоры вирусного гепатита, Ежегодник гепатита B, Горячие темы в вирусном гепатите
Microbial Genomics
Микробная геномика — это исследование микроорганизмов, генетический материал которых содержит микробы.Анализ всего микробного генома дает представление о микробной оценке и разнообразии микробов, помимо филогении одного белка или гена.
Связанные журналы микробной геномики
Микробная и сравнительная геномика, Наука и технологии генома, Новые микробы и инфекции, Микробная информатика и эксперименты, Микробная биотехнология, Фабрики микробных клеток, Микробные выбросы: вирусы, бактерии, грибы, Микробная экология в здоровье и болезнях.
Золотистый стафилококк
Золотистый стафилококк — это бактерия, вызывающая болезни человека. Чаще всего абсцессы или целлюлит — это инфекции, вызванные золотистым стафилококком. Это происходит, когда кожа порезается или царапается, что позволяет бактериям проникнуть внутрь, а затем инфицировать. Это будет происходить в основном в ногах и руках.
Журналы, относящиеся к Staphylococcus aureus
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и противовирусных исследований, Патогены и болезни, Текущие отчеты клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и микробиологии окружающей среды, Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал микробиологических исследований.
Вирус иммунодефицита человека
Вирус иммунодефицита человека — это вирус, который атакует иммунную систему, заражая лейкоциты. Лейкоциты — важная часть иммунной системы, которая будет разрушена определенным вирусом, называемым ВИЧ, что приводит к нехватке лейкоцитов, что снижает иммунную силу.
Связанные журналы вируса иммунодефицита человека
Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, The lancet HIV, Журнал клинических исследований в области ВИЧ, СПИДа и профилактики, Исследования и лечение СПИДа, ВИЧ / СПИД (Окленд, Н.Z.), Журнал исследований СПИДа и ВИЧ (онлайн), Журнал эпидемиологии и эпидемиологии ВИЧ, СПИДа, Будущее лечение ВИЧ, Журнал профилактики ВИЧ / СПИДа у детей и молодежи, Исследования СПИДа и ретровирусы человека, Обзор ВИЧ и СПИДа.
Холера
Холера — инфекционное заболевание, вызывающее диарею. Vibrio cholera — это бактерия, вызывающая холеру, которая может быть обнаружена в загрязненной воде или пище и приводит к обезвоживанию из-за потери жидкости организма во время диареи.
Связанные журналы холеры
Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архивы воспаления, Текущие отчеты об инфекционных заболеваниях, Медицина путешествий и инфекционные заболевания, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Текущие клинические темы инфекционных заболеваний, Скандинавский журнал инфекционных заболеваний, Инфекционные добавки в клинической практике, Kansenshogaku zasshi.Журнал Японской ассоциации инфекционных заболеваний, Достижения в области детских инфекционных заболеваний, Междисциплинарные перспективы инфекционных заболеваний, Журнал глобальных инфекционных заболеваний, Американский журнал инфекционных заболеваний.
Болезнь, вызванная вирусом Эбола
Вирус Эбола — это вирус, вызывающий острое и серьезное заболевание, которое при отсутствии лечения часто заканчивается летальным исходом. Его иначе называют геморрагической лихорадкой Эбола, которая представляет собой смертельный вирус, вызывающий внутренние и внешние кровотечения в организме.
Связанные журналы болезни, вызванной вирусом Эбола
Архив клинической микробиологии, Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Современные мнения в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Ротавирусная инфекция
Инфекция, вызванная вирусом рота, является наиболее частой причиной тяжелой диареи, вызывающей обезвоживание. Она может распространяться через заражение рук, воды, пищи или любых предметов. Вирус попадает внутрь через пищевые продукты и распространяется через слизистые оболочки, что в конечном итоге приводит к диарее из-за инфекции.
Связанные журналы ротавирусной инфекции
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архив воспаления, вирусных заболеваний, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Современные мнения в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Дисбактериоз кишечника у детей с синдромом короткой кишки связан с нарушением исхода | Microbiome
Предпосылки
Детская кишечная недостаточность (IF) определяется как неспособность желудочно-кишечного тракта поддерживать адекватный рост, гидратацию и гомеостаз электролитов у детей без парентерального питания (PN). Синдром короткой кишки (SBS) — наиболее частая причина детской IF. Состояние вызвано массивной резекцией тонкой кишки из-за некротического энтероколита (НЭК) или заворота, а также врожденных пороков развития, таких как гастрошизис и атрезия тощей кишки.СБС новорожденных — заболевание с высокой заболеваемостью и смертностью [1]. Медицинское руководство SBS направлено на обеспечение полного энтерального / перорального кормления и отлучение от PN.
Кишечная микробиота, по-видимому, является основным фактором в определении успешного клинического исхода SBS, определяемого как независимость от лечения PN и кишечной адаптации. Изменения в микробиоте могут привести к серьезным осложнениям, таким как избыточный бактериальный рост в тонкой кишке (SBBO) и воспаление слизистой оболочки кишечника, что может предотвратить отлучение от ПП за счет нарушения абсорбционных функций кишечника [2,3].При SBBO у детей рекомендовано длительное лечение люминальными / пероральными антибиотиками [4,5]. Большинство случаев SBS возникает у новорожденных в период, когда стерильный кишечник обычно заселяется бактериями, достигая микробного профиля, характерного для желудочно-кишечного тракта взрослых, примерно в возрасте от 2 до 4 лет [6]. Нарушение сбалансированного микробного сообщества кишечника, то есть дисбактериоз, с повышенным относительным содержанием факультативных анаэробных бактерий Enterobacteriaceae в толстой кишке, наблюдается при воспалительном заболевании кишечника (ВЗК) на моделях мышей, у людей с болезнью Крона и у людей. НЭК у недоношенных детей [7,8].
На сегодняшний день нет сообщений о картировании кишечной микробиоты у детей с SBS. Здесь мы представляем первый отчет о микробном профиле у детей с SBS с использованием секвенирования гена 16S рРНК на платформе Illumina MiSeq.
Методы
Пациенты
Это исследование было одобрено региональным комитетом по этике медицинских исследований в Упсале (Dnr2012 / 002). Информированное письменное согласие на сбор образцов и последующие анализы было получено от родителей.Характеристики исследуемой группы и соответствующих здоровых братьев и сестер представлены в таблице 1. В исследование включены 11 детей в возрасте от 1,5 до 7 лет с диагнозом ИФ / СБС в неонатальном периоде, из которых двое относятся к группе тройняшек (2А и 3А) (таблица 1). Все дети, кроме одного, родились недоношенными. Ребенку 1А, 8А и 13А была проведена процедура удлинения кишечника с серийной поперечной энтеропластикой (STEP) [9]. Пятеро детей не были отлучены от ПП на момент исследования. Семь здоровых братьев и сестер служили контролем.Дети, получавшие ПП, получали пероральный и / или энтеральный прием безлактозной гидролизованной белковой смеси и соответствующий возрасту потребление твердой пищи со снижением содержания дисахаридов в соответствии с таблицей 1.
Таблица 1 Характеристика исследуемой группы и соответствующих здоровых братьев и сестерСбор данных и статистический анализ
Образцы фекалий собирали и хранили при -80 ° C до анализа.ДНК экстрагировали из каждого образца фекалий с помощью набора для выделения ультрачистой фекальной ДНК (MoBio, Naxo Ltd, Тарту, Эстония) в соответствии с инструкциями производителя.
Библиотеки для секвенированияполучали путем амплификации области V3-V4 гена 16S рРНК с использованием праймеров 341f-805r, описанных Hugerth et al . [10]. После первоначальной амплификации была проведена вторая ПЦР для присоединения адаптеров Illumina, а также штрих-кодов, которые позволяют мультиплексировать. Образцы были секвенированы с использованием IlluminaMiSeq, что дало в общей сложности 10 136 440 считываний 2 × 300 пар оснований со средним значением 307 165 считываний на образец.Последовательности праймеров были обрезаны, а считывания парных концов, полученные с помощью инструмента для секвенирования, были объединены с использованием SeqPrep версии 1.1 (https://github.com/jstjohn/SeqPrep) с параметрами по умолчанию и затем обработаны с помощью конвейера QIIME 1.8.0 ( Количественное понимание микробной экологии) [11]. Объединенные чтения были случайным образом разбиты на подвыборку до равной глубины 151 610 считываний на выборку, что было минимальным числом считываний среди выборок. Используя алгоритм UCLUST [12], встроенный в конвейер QIIME, последовательности были сгруппированы с 97% идентичностью по справочной базе данных Greengenes, что дало 4216 OTU (операционных таксономических единиц) [11].Для каждого образца; количество не одиночных OTU, а также наиболее доминирующих OTU с соответствующим описанием представлено в дополнительных данных (Дополнительный файл 1). Индексы разнообразия Шеннона были рассчитаны для детей с SBS, получавших и не принимавших PN, и проверены на значимость с помощью критерия суммы рангов Вилкоксона. Используя конвейер QIIME, были получены невзвешенные расстояния UniFrac, которые использовались для исследования бета-разнообразия путем построения координат PCA. Подробная информация о праймерах гена 16S рРНК, условиях амплификации и штрих-кодах образцов представлена в дополнительных данных (дополнительный файл 2).
Результаты
На рисунке 1 показано, что индекс разнообразия Шеннона значительно снижен у детей с SBS, все еще получающих PN, по сравнению с детьми, отлученными от PN. Ни у одного из детей, получавших ПП, не осталось ICV.
Рисунок 1Индекс разнообразия Шеннона у детей с SBS, все еще получающих PN, по сравнению с детьми, отлученными от PN.
У детей, все еще получающих PN, четверо из пяти (1A, 3A, 8A и 9A) были обследованы на предмет нескольких эпизодов подозрения на SBBO, также во время взятия пробы кала (Таблица 1).Их лечили пероральным метронидазолом, триметоприм-сульфаметоксазолом, гентамицином или амоксициллин-клавулановой кислотой. У этих пациентов Enterobacteriacae были наиболее многочисленным таксономическим семейством и полностью доминировали в микробном сообществе этих детей (рис. 2). У оставшегося пациента в этой группе (12A), все еще принимавшего PN и с пониженным индексом разнообразия Шеннона, было обнаружено относительное преобладание Lactobacillaceae , за которым следовали Enterobacteriacae. В целом, высокая относительная численность Enterobacteriacae была связана с SBS у 6 из 11 пациентов (1A, 3A, 8A, 9A, 11A и 12A). У оставшихся пяти пациентов с SBS, все без PN (2A, 4A, 13A, 16A и 18A), был более разнообразный состав микробиоты и более равномерное распределение таксономических семейств. Однако ни один из детей SBS, кроме одного (2А), не достиг показателей разнообразия Шеннона на том же уровне, что и контрольная группа (таблица 1). У одного из детей, все еще получающих PN (1A), верхняя и нижняя эндоскопия с биопсией выявила макроскопическое и гистопатологическое острое воспаление в желудке, двенадцатиперстной кишке, тонкой кишке и проксимальном отделе толстой кишки.У ребенка 3А, также получавшего ПП, верхняя эндоскопия с биопсией показала атрофию ворсинок тонкой кишки.
Рисунок 2Микробные сообщества у детей с SBS, получавших PN (1A, 3A, 8A, 9A, 12A), детей с SBS, отлученных от PN (2A, 4A, 11A, 13A, 16A, 18A) и братьев и сестер (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2). На рисунке показана относительная численность 19 наиболее распространенных таксономических семейств, на которую приходится не менее 84% численности во всех выборках.
На рисунке 3 представлены индексы разнообразия Шеннона, а на рисунке 4 — невзвешенные расстояния UniFrac у детей с SBS на PN (1A, 3A, 8A, 9A, 12A), дети SBS, отлученные от PN (2A, 4A, 11A, 13A). , 16A, 18A) и братьев и сестер (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2).
Рисунок 3Индекс разнообразия Шеннона у детей с SBS, получавших PN (1A, 3A, 8A, 9A, 12A), детей с SBS, отлученных от PN (2A, 4A, 11A, 13A, 16A, 18A) и братьев и сестер (2C1 , 2C2, 11C1, 11C2, 12C, 13C1, 13C2).
Рис. 4График PCoA, описывающий невзвешенное расстояние UniFrac между образцами. Попарные расстояния между всеми образцами проецируются на двумерное пространство, где ось PC1 описывает наивысшую степень вариации. Таким образом, считается, что образцы, которые сгруппированы близко друг к другу, имеют большую долю филогенетического дерева по сравнению с образцами, которые более разделены.
У нас была уникальная возможность изучить тройню, представляющую все три группы. Ребенок 2А и ребенок 3А были тройняшками мужского пола, рожденными на 23 неделе беременности. Оба мальчика в неонатальном периоде перенесли НЭК, что привело к резекции тонкой кишки (таблица 1). Третий тройняшек (2С2) остался здоровым. У ребенка 2А было резецировано только 2 см тонкой кишки, однако после обширной НЭК у него развился ИФ, и он стал зависимым от ПП. Во время лечения ПН у него не было признаков СБО. Его приучили к полноценному пероральному вскармливанию и без антибиотиков за 3 месяца до забора фекалий.Его кишечное бактериальное разнообразие было таким же, как у его здорового брата (SDI 4, 67 и 4, 97, соответственно).
Ребенок 12А лечился антибиотиками только в течение первых 2 недель постнатального периода, у него не было признаков SBBO, и отлучение от PN продвигалось, но медленно. Ее фекальное бактериальное разнообразие показало, что Lactobacillacae являются наиболее относительно многочисленным таксономическим семейством в соответствии с нашими предыдущими результатами (Рисунок 2) [13]. Мы смогли обнаружить Clostridium difficile у двух из десяти пациентов с SBS (пациенты 2A и 11A) и в очень низкой относительной численности (данные не показаны).
Выводы
Тенденция SBBO и воспаления кишечника к задержке или предотвращению отлучения от PN у этих детей с SBS, по-видимому, связана с микробным дисбиозом в кишечном тракте. Этот результат согласуется с предыдущим исследованием, показывающим, что введение ПП независимо связано с SBBO [14]. Влияние PN на изменение профиля из-за истощения микробиома маловероятно, поскольку нарушение всасывания при пероральном / энтеральном питании является основной проблемой при SBS.В целом наблюдаемые изменения микробиоты у детей с SBS, скорее всего, являются как причиной, так и следствием болезненного статуса ребенка. Ограничением исследования является небольшая исследовательская группа, и смешанные факторы, которые могут повлиять на результаты, — это возраст, длина кишечника и лечение антибиотиками. Тем не менее, когорта в настоящем исследовании представляет детей с SBS в клинической практике.
В нашем центре мы лечим SBBO пероральными антибиотиками в соответствии с рекомендациями других центров [4-6].Однако наиболее вероятно, что антибиотики в дальнейшем будут способствовать развитию дисбактериоза у этих детей. У детей с SBS нормальная колонизация нарушается из-за раннего и частого использования антибиотиков, а уменьшение бактериального разнообразия позволяет потенциальным патогенным бактериям разрастаться. Антибиотики были предложены для снижения устойчивости к колонизации против Enterobacteriacae , таких как Escherichia coli и Salmonella enterica , за счет повышения воспалительного тонуса слизистой оболочки кишечника [15].Чаще всего пробиотики используются для изменения кишечной микробиоты при SBS; однако существуют противоречивые данные и сообщения о пробиотической сепсисе [16].
Общее снижение бактериального разнообразия у наших детей с SBS согласуется с дисбактериозом кишечника у пациентов с IBD, младенцев с NEC, а также было описано в модели SBS у поросят [7,8,17,18]. Кроме того, у детей с рецидивирующей диареей, связанной с C. difficile-, наблюдается снижение калового разнообразия с уменьшением на Bacteriodetes и Firmicutes [19].У этих детей успешность трансплантации фекальной микробиоты (FMT) превышает 90%. Такое лечение также успешно использовалось в качестве дополнения к лечению ВЗК [19,20]. Следовательно, FMT может оказаться альтернативой лечения в тщательно отобранных случаях SBS с дисбактериозом. Однако, поскольку дети с SBS часто уязвимы из-за своего первоначального состояния здоровья, необходимо учитывать трудности и риски FMT. Хотя случаи серьезных побочных эффектов редки, одним из таких рисков является заражение донором, когда бессимптомные микроорганизмы, не вызывающие проблем у здорового донора, могут вызвать реакцию у реципиента.Кроме того, массовое появление новой микробиоты может также вызвать аутоиммунное заболевание, а также развитие бактерий и септический шок. Также следует проявлять особую осторожность при приеме FMT, если у пациента есть какие-либо признаки иммунодефицита [21].
Это первый отчет, описывающий микробный профиль кишечника у детей с SBS с использованием секвенирования следующего поколения. Мы наблюдали выраженный микробный дисбактериоз у детей с SBS, все еще получающих PN, по сравнению с детьми, отлученными от PN с повышенным относительным количеством протеобактерий, большинство из которых длительное время лечились антибиотиками.Наши результаты показывают, что дисбактериоз кишечника у детей с SBS связан с ухудшением исхода с длительной зависимостью от PN. В будущих исследованиях необходимо найти новые стратегии лечения дисбактериоза кишечника у этих детей.
Новая парадигма детского питания
6 -я Международная конференция и выставка по пробиотикам, функциональному и детскому питанию
02-03 октября 2017 г. Лондон, Великобритания
Дэвид Дж. Кайл
Evolve Biosystems, США
Основной доклад : J Prob Health
Аннотация :Постановка проблемы: грудное молоко было единственным источником питания для младенцев на протяжении миллионов лет и богато специфические олигосахариды (HMOs).В естественном микробиоме кишечника младенцев преобладает один вид бифидобактерий, исключительно конкурентоспособны при потреблении ОПЗ. Из-за непредвиденных последствий кормления смесью, использования антибиотиков и Кесарево сечение, этот естественный микробиом был радикально изменен, так что сегодня более 90% новорожденных в США дисбактериоз. Целью этой работы является разработка решения для спасения естественного микробиома от дисбактериоза с помощью раннее ремоделирование, которое возвращает микросреду толстой кишки в ее естественное состояние.Методология: рандомизированное параллельное контролируемое проспективное клиническое исследование (n = 68) было проведено в пяти исследованиях в Дэвисе, Калифорния, США. США со здоровыми доношенными детьми, находящимися на грудном вскармливании, зарегистрированными на четвертый день жизни. Половина когорты получала добавки ежедневно в течение 21 дня. с активированными Bifidobacteria infantis, и половина из них обеспечивала стандартный уход. Результаты: у всех младенцев, получавших добавки, независимо от способа родов, в микробиоме преобладали более 80% бактерий B. infantis. тогда как младенцы без добавок были лишены B.Infantis и 21 из 34 младенцев вообще не имели бифидобактерий. Различия в Также были отмечены зрелость стула, pH, микробиологические и химические различия. Заключение и значение: естественный микробиом hi-bif был утрачен за последние 50-80 лет в развитых странах. В возникающий в результате дисбактериоз может иметь значительное влияние на запрограммированное развитие иммунной системы и ее становление. метаболических уставок. Мы показали, что этот дисбактериоз можно исправить и восстановить микросреду с помощью добавление активированного B.Infantis.
Биография :Дэвид Дж. Кайл — генеральный директор Evolve Biosystems Inc., дочернего предприятия Института продуктов питания для здоровья Калифорнийского университета в Дэвисе. За свою карьеру он основал несколько компаний, в том числе Martek Biosciences Corp, где он руководил исследованиями и разработками и коммерческим развитием более 15 лет. Его продукты DHA и ARA теперь содержатся практически во всех детских смесях по всему миру. В 2011 году он был приобретен DSM за 1,2 миллиарда долларов. Он получил степень доктора биохимии в Университете Альберты, Канада.За свою выдающуюся карьеру он опубликовал более 80 научных статей и отредактировал две книги. В 2009 году он был занесен в Зал славы космических технологий США за вклад в науку и промышленность.
Нам необходимо решить проблему недостаточности кишечника у младенцев, предупреждают исследователи.
Новое рецензируемое исследование, опубликованное в Scientific Reports , показало, что 90% младенцев в США могут страдать от значительного дефицита важных бактерий, являющихся ключом к груди. переваривание молока и развитие иммунной системы.
Детали исследования
Исследователи из Стэнфордского университета, Университета Небраски и Evolve BioSystems собрали образцы фекалий у 227 младенцев в возрасте до шести месяцев во время визитов педиатра в пяти разных штатах: Калифорния, Джорджия, Орегон, Пенсильвания и Южная Каролина .
Исследовательская группа применила метагеномику дробовика для характеристики: (1) кишечных бактериальных сообществ здоровых младенцев в США в первые 6 месяцев жизни; (2) функции экосистемы путем определения метаболического потенциала кишечных микробиомов различных энтеротипов для метаболизма олигосахаридов грудного молока (HMOs) из грудного молока; и (3) носительство генов устойчивости к антибиотикам (ARG) у младенцев в разных штатах США.
Вышеупомянутые критерии использовались для классификации микробиомов как дисбиотических или нет, на основе концепции экосистемных услуг, адаптированной для оценки преимуществ, которые младенцы получают от функций, обеспечиваемых их кишечными микробиомами.
Образцы были проанализированы на наличие бактерий и их количество. Они также были протестированы на способность бактерий полностью использовать грудное молоко человека — признак наличия полезных для здоровья бактерий, а также на наличие в них генов устойчивости к антибиотикам.
Исследователи не включали образцы от младенцев с желтухой, от тех, кто активно проходил лечение антибиотиками, или от тех, у кого были диагностированы проблемы с всасыванием углеводов в кишечнике, из-за влияния таких условий на способность кишечника младенцев переносить из нормальных процессов.
Результаты
Исследование показало, что примерно у девяти из 10 младенцев отсутствуют Bifidobacterium longum subsp. Infantis (B. infantis) в микробиоме кишечника — тип бактерий, играющих критически важную роль в здоровье и развитии младенцев.Этот конкретный тип кишечных бактерий был широко задокументирован как оказывающий наиболее благотворное влияние на здоровье кишечника младенцев и обладающий способностью полностью раскрыть питательные свойства грудного молока, которое включает некоторые фракции олигосахаридов, которые не усваиваются другими способами.
«Подавляющее большинство младенцев испытывают дефицит этой ключевой кишечной бактерии с самых первых недель жизни, и это совершенно вне поля зрения большинства родителей и педиатров», — сказал соавтор исследования Карл Сильвестр, доктор медицины, . профессор хирургии и педиатрии и заместитель декана отдела исследований здоровья матери и ребенка Стэнфордского университета.
Что такое «здоровый»?По словам авторов, «Это исследование предлагает новую перспективу при рассмотрении младенцев в контексте здорового микробиома и его острых и долгосрочных последствий» , в связи с чем возникает вопрос: можно ли рассматривать младенцев здоровы, когда в них отсутствуют полезные бактерии и много потенциально патогенных бактерий?
«Совершенно верно. Мы склонны рассматривать здоровье как отсутствие болезней, но в этом случае младенцы могут выглядеть здоровыми и достигать вех своего развития, но микробиомы их кишечника нездоровы изнутри.Мы должны помнить, что первые месяцы жизни задали траекторию для многих аспектов нашего иммунного, метаболического и когнитивного здоровья, и все это связано с правильным развитием микробиома нашего кишечника. Вот почему так важен B. infantis. Когда B infantis переваривает HMO в кишечнике ребенка, он питает кишечные клетки ребенка, помогает герметизировать слизистую оболочку стенки кишечника и уменьшает воспаление. «Младенцы, лишенные B. infantis в микробиоме кишечника, лишены этих преимуществ, и мы считаем, что это одна из основных причин, почему мы наблюдаем рост аллергии, астмы, экземы и других заболеваний, таких как диабет 1 типа», — пояснил доктор.Ребека Дуар, главный научный сотрудник Evolve Biosystems и соавтор исследования.
Устойчивость к антибиотикам: следующая глобальная пандемия
Дуар сказал, что самым удивительным открытием, полученным в результате исследования, было то, что диета, похоже, не имела никакого эффекта.
«Мы склонны связывать грудное вскармливание с более высоким содержанием бифидобактерий, но мы не обнаружили этого. И младенцы, получавшие смесь, и грудное молоко, были дисбиотиками. Это открытие, вероятно, означает, что отсутствие B. infantis является проблемой поколений, и мы нарушили естественный перенос B.Infantis от мамы к ребенку, — сказал Дуар.
Она добавила, что еще одним удивительным и довольно мрачным открытием стало обнаружение генов устойчивости к антибиотикам, которые были специфичными для состояния. «Эти гены позволяют патогенам выжить при лечении антибиотиками, иногда называемых« супербактериями ». В Калифорнии мы обнаружили 20 генов устойчивости к антибиотикам, которые не были обнаружены у младенцев ни в одном другом месте, которое мы тестировали, и еще 17 были уникальны для младенцев из Южного Каролина. Это может означать, что устойчивость к антибиотикам развивается независимо в разных регионах, и младенцы подхватывают эти бактерии там, где они живут.Устойчивость к антибиотикам широко считается следующей глобальной пандемией. Если мы извлекли урок из этого исследования, мы действительно должны принять упреждающий подход к решению проблемы детского дисбактериоза прямо сейчас ».
Взгляд в будущее
«Это исследование дает наиболее четкую картину того, насколько широко распространена эта проблема, и подчеркивает необходимость с самого начала решать проблему дефицита B. infantis в кишечнике младенца», — предположил Сильвестр .
Хотя в отчете признается, что это B.Дефицит Infantis полностью вне поля зрения большинства родителей и педиатров, так что же они могут сделать?
Дуар предлагает родителям взять на себя ответственность за проведение тестирования микробиома через такие компании, как LabCorp, которые могут открыть окно в микробиом кишечника младенца.
«Повышенный pH в фекалиях, определяемый как 5,5 или выше, не только оказывает раздражающее действие на кожу, которое может проявляться в виде опрелостей, но также является признаком того, что B. infantis отсутствует, а ребенок страдает кишечными расстройствами. дисбактериоз, или то, что также называется кишечной недостаточностью новорожденных.Evivo (активированный B. infantis EVC001) — единственный детский пробиотик, который клинически доказал, что восстанавливает B. infantis в кишечнике младенца, уменьшает количество патогенных бактерий на 80%, снижает pH кала до рекомендуемых уровней и создает защитную среду в кишечнике младенца. Bifidobacterium (включая B. infantis) — это «дружественный» штамм бактерий, содержащийся во многих типах пробиотиков, продаваемых для младенцев, но Evivo (B. infantis EVC001) — единственный штамм, клинически доказано, что он ограничивает рост вредных бактерий в кишечнике ребенка. помогает направлять развитие иммунной системы как основу для здоровья на протяжении всей жизни », — поясняет изд. Дуар.
«Мы надеемся, что не будем останавливаться на проблеме, а начнем сосредотачиваться на доступных решениях», — сказал Дуар. «Ранее мы показали в клинических исследованиях, что B. infantis можно восстановить, и можно решить детский дисбактериоз кишечника. Теперь цель состоит в том, чтобы убедиться, что у всех младенцев есть B. infantis в микробиомах. ”
Наука о микробиоме: развивающаяся область
В последние годы произошел грандиозный прогресс в технологиях секвенирования и омики следующего поколения, что подтолкнуло науку о микробиоме к новым захватывающим рубежам в персонализированном питании.
Учитывая огромные успехи, Дуар сказала, что считает тестирование микробиома на младенцах стандартом лечения в будущем.
«Стоимость секвенирования, метода, используемого для считывания микробиома, резко снизилась за последнее десятилетие. По мере того, как технологии развиваются, и мы продолжаем узнавать о том, насколько наши микробиомы взаимосвязаны с нашим здоровьем, анализ микробиома, скорее всего, станет стандартом лечения. Ключевым моментом здесь является опыт интерпретации результатов, — сказал Дуар. «Микробиом невероятно сложен, и мы постоянно узнаем больше о том, какие функции он выполняет, и прогресс идет огромными темпами».
Источник: Scientific Reports
11, 1472 (2021) doi.org/10.1038/s41598-020-80583-9
«Метагеномное понимание структуры и функционирования сообщества микробиома младенца на нескольких участках в США »
Авторы: Г. Касабури и др.
Дисбактериоз кишечника — Педиатрия | Nutricia
По материалам Peterson and Round, 2014. 1
Что вызывает дисбактериоз кишечной микробиоты у младенцев?
Ранняя жизнь — критическое время для развития микробиома кишечника, поэтому кишечник младенца особенно уязвим для дисбактериоза. Есть несколько факторов, которые влияют на состав кишечного микробиома у младенцев, в том числе: 1,4-6
- Срок беременности
- Материнское окружение
- Способ родоразрешения (вагинальное или кесарево)
- Питание (грудное или искусственное вскармливание)
- Использование антибиотиков
- Диета
- Загрязнение воздуха
- Генетика
Генетические факторы и изменения в факторах окружающей среды могут изменить состав микробиома кишечника, что приведет к дисбактериозу. 1
Какая связь между дисбактериозом кишечной микробиоты и аллергией?
Сообщалось о дисбиозе кишечной микробиоты у младенцев с аллергическими состояниями, такими как аллергия на белок коровьего молока (CMPA). У здоровых младенцев, находящихся на грудном вскармливании, в кишечнике обычно преобладает группа полезных бактерий, известных как бифидобактерии. Эти бактерии сначала передаются от матери во время родов и с грудным молоком. 7–9
У младенцев с аллергическими заболеваниями факторы окружающей среды могут влиять на состав микробиоты кишечника.Младенцы с АБКМ часто имеют более низкие уровни бифидобактерий в микробиоте кишечника по сравнению со здоровыми младенцами, находящимися на грудном вскармливании. 9 В настоящее время считается, что дисбактериоз кишечника потенциально может привести к развитию аллергии и другим последствиям для здоровья в более позднем возрасте. 1
Может ли дисбактериоз кишечной микробиоты влиять на развитие иммунной системы?
Ранняя жизнь — критическое время как для развития иммунной системы, так и для кишечной микробиоты.Иммунная система развивается быстро в течение первых 1000 дней жизни, и хорошо известно, что между иммунной системой и микробиотой кишечника возникает перекрестное взаимодействие.
Таким образом, дисбактериоз кишечной микробиоты может повлиять на развитие иммунной системы, что может привести к аллергии, такой как CMPA, и другим последствиям для здоровья, таким как астма, метаболический синдром, сердечно-сосудистые заболевания и ожирение. 4,15–17
Может ли дисбактериоз кишечной микробиоты приводить к аллергическим заболеваниям, таким как аллергия на белок коровьего молока, у младенцев?
Считается, что дисбиоз кишечной микробиоты играет определенную роль в развитии пищевой аллергии, такой как аллергия на белок коровьего молока (АБКМ) в раннем возрасте.Несколько исследований показали, что дисбактериоз кишечника у младенцев может задерживать развитие оральной толерантности — процесса, при котором подавляется иммунный ответ на пищевой белок.
Нарушение пероральной толерантности может привести к развитию пищевой аллергии. 16 Дисбактериоз кишечника в раннем возрасте также был связан с развитием ряда заболеваний, включая астму, метаболический синдром, сердечно-сосудистые заболевания и ожирение. 17
Можем ли мы вернуть баланс к здоровой микробиоте кишечника?
Грудное молоко содержит как пребиотики природного происхождения, такие как олигосахариды грудного молока (HMO), так и полезные бактерии (пробиотики).Оба эти элемента помогают поддерживать здоровую микробиоту кишечника и поддерживать развитие иммунной системы. 16,17
Если грудное вскармливание невозможно, добавление уникальной комбинации пребиотиков и пробиотиков, известных как синбиотики, к детской смеси, восстанавливает баланс кишечного микробиома и способствует пероральной переносимости, потенциально снижая риск аллергических заболеваний. 20,23,24
Почему стоит рассмотреть уникальную смесь синбиотиков при аллергии на белок коровьего молока?
Растущее количество клинических данных свидетельствует о том, что уникальная смесь синбиотиков может иметь положительный эффект у младенцев с риском пищевой аллергии или живущих с ней, таких как АБКМ. 12,23,24 Признавая потенциальные преимущества пре- и пробиотиков, Группа рекомендаций Всемирной организации по аллергии предлагает рассмотреть вопрос о добавлении пре- и пробиотиков для младенцев с риском аллергии, если они не находятся на исключительно грудном вскармливании. 21,22
В настоящее время большинство детских смесей, содержащих пробиотики, включают виды Bifidobacterium и / или молочнокислые бактерии, такие как Lactobacillus views, 25 , которые обычно считаются безопасными и разрешенными для использования в пищевых продуктах в соответствии с Правилами Австралии и Новой Зеландии по пищевым стандартам.
В последнее десятилетие различные пребиотические смеси галактоолигосахаридов (GOS) и фруктоолигосахаридов (FOS) были изучены на предмет их положительного воздействия на младенцев с риском пищевой аллергии или живущих с ней. Клинические исследования пребиотических смесей для младенцев, состоящих из короткоцепочечной (sc) GOS и длинноцепочечной (lc) FOS, scGOS / lcFOS в соотношении 9: 1, напоминающих олигосахаридные компоненты грудного молока как по количеству, так и по разнообразию, показали преимущества, связанные с регулированием микробиоты кишечника и иммунной системы, снижением частоты инфекций и размягчением стула.
