Электрофорез для носа с хлористым кальцием при вазомоторном рините
Электрофорез для носа позволяет оказать терапевтическое воздействие на полость органа дыхания. Процедура проходит под воздействием постоянного электрического тока, который в сочетании с комплексным медикаментозным лечением и введением препаратов через кожу или слизистые оболочки оказывает благоприятное воздействие не только на пораженную зону, но и на весь организм. Такой метод лечения носовой пазухи считается одним из самых популярных способов для снижения симптомов длительного насморка.
Электрофорез при вазомоторном рините не только снижает силу и интенсивность воспалительного процесса, но и уменьшает отечность мягких тканей. Кроме этого, воздействие на пазухи таким способом позволяет купировать болевые ощущения и повышает иммунную систему организма, способствуя скорейшему выздоровлению. Помимо этого, эклектический ток снижает появление риска осложнений и улучшает кровообращение.
Как воздействует электрофорез
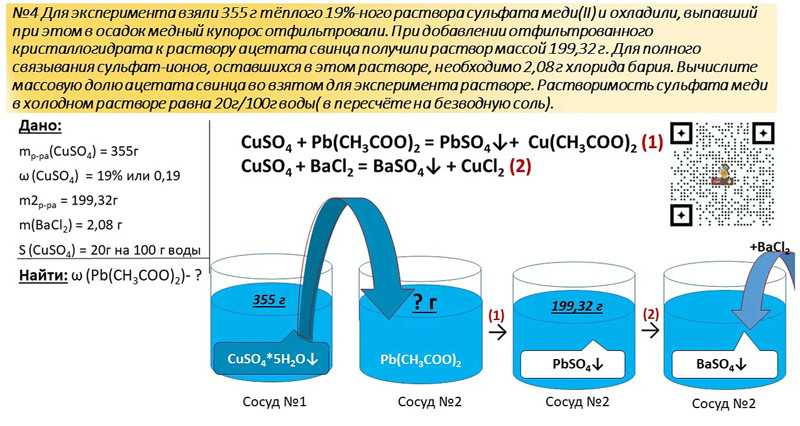
Если переводить термин «электрофорез» дословно, то слово обозначает перенос электрического тока. Физиотерапевтическая процедура характеризуется как движение ионов в электрическом поле, которая создается под внешним давлением. Применение электрофорезиса как лечебного метода на сегодняшний день особо популярно в медицине.
Физиотерапевтическая процедура характеризуется как движение ионов в электрическом поле, которая создается под внешним давлением. Применение электрофорезиса как лечебного метода на сегодняшний день особо популярно в медицине.
Интересно! В качестве лечебной методики электрофорез имеет несколько синонимов. В разных источниках, медицинский процесс может называться как ионофорез, ионотерапия, аэроионотерапия, электрофорезис, катафорез, ионтофорез, микроэлектрофорез, ионогальванизация или гальваноионотерапия.
Гальваноионотерапия производится на основе постоянного электрического тока.
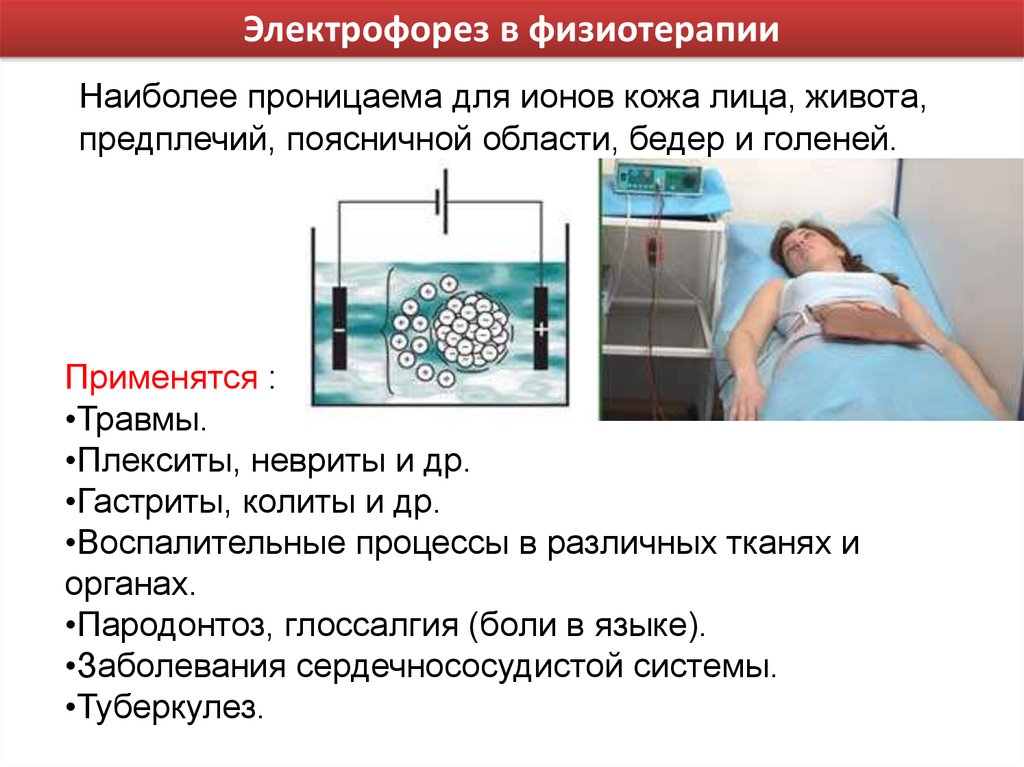
В медицине электрофорезис представляет воздействие на основе постоянного тока и действии медикаментозных средств, которые доставляются в очаг воспаления с помощью тока.
- непрерывный гальванический ток;
- диадинамический ток;
- синусоидальный модулированный ток переменного направления;
- флюктуирующий ток;
- постоянный ток, который не меняет своего течения.

Каждый из перечисленных методов позволяет улучшить состояние пациента. Поняв, что такое электрофорез носа, важно изучить принцип воздействия.
Действие тока и выбранного лекарственного вещества предельно прост. Медикаменты поступают в организм через сальные протоки, потовые железы или проникают в пространство между клеток в виде ионов. Однако, для достижения терапевтического эффекта курс гальваноионотерапии должен быть не менее пяти раз, так как лекарственная доза при процедуре небольшая. В организм поступает до десяти процентов полезных веществ.
Основная часть фармацевтического вещества остается в подкожной клетчатке и поступает в кровоток спустя длительный курс лечения. Врачи отмечают, что целебное воздействие может проявиться спустя сутки после процедуры.
Скапливаясь в пораженной зоне, лекарственные вещества воздействуют прямо на пораженные клетки. Таким образом, можно избавиться от воспаления намного быстрее, так как применяя медикаменты в виде инъекций или назальных спреев добиться такого же результата сложно.
Важно! Препараты, вводимые в организм таким способом практически не вызывают образования побочных симптомов.
Для чего нужен электрофорез носа
При правильном выполнении электрофорезиса, пациенты замечают улучшение самочувствия спустя три дня после начала лечения. К основным достоинствам процедуры относят:
- расслабление мышечного тонуса;
- успокоение пораженной зоны;
- снижение болевых ощущений;
- улучшение кровообращения в воспалившемся участке;
- повышение иммунной системы;
- ускорение процесса выздоровления;
- стимуляция естественной выработки полезных веществ в организме;
- системное воздействие на пораженные клетки;
- противовоспалительный эффект;
- снижение отечности слизистой оболочки в носовой полости;
- сосудорасширяющее действие, что позволяет восстановить носовое дыхание;
- электрофорез способствует выведению жидкости из тканей;
- расслабляющее воздействие на весь организм;
- питание органов;
- выработка полезных веществ в организме.

Среди других достоинств такой методики отмечают практически нулевой риск образования побочных действий лекарственных препаратов и снижение дозировок при лечении маленьких детей. Доставка полезных свойств лекарственного вещества происходит прямо в пораженную зону, что сохраняет структуру здоровых тканей и клеток.
Электрофорез не опасен при лечении для детей и беременных женщин.
Электрофорез можно применять при беременности, так как медикаменты проникают в кровоток гораздо медленнее, нежели при обычном применении лекарственных средств. Кроме этого, воздействие тока позволяет снизить количество принимаемых медикаментов, что особенно важно при развитии эмбриона.
Ограничения
Электрофорезис считается универсальным методом лечения многих заболеваний, однако, у него есть несколько противопоказаний.
Электрофорезис запрещено проводить при частых кровотечениях.
Нельзя применять электрический ток в лекарственных целях в следующих случаях:
- при опухоли в носовой полости или головном мозге;
- в случае нарушений работы сердца;
- при нарушениях дыхания из-за кардиостимулятора;
- в случае острого воспаления дыхательных путей;
- при сильно повышенной температуре;
- повышенные кровотечения;
- плохая свертываемость крови;
- различные нарушения чувствительности покровов;
- травмы и любые другие нарушения целостности кожных покровов;
- гиперчувствительность к электрическому току или аллергическая реакция на медикаменты.
Помните! При приеме антибиотиков перед началом лечения следует предупредить об этом лечащего врача!
Когда применяться электрофорезис
Лекарственный электрофорез обрел широкую популярность среди разных областей медицины. Электрофорез, как один из методов воздействия, назначается для терапии при следующих воспалениях дыхательных путей:
- воспаление легких;
- воспаление слизистой оболочки бронхов;
- заболевание слизистой оболочки глотки;
- воспаление трахеи;
- ринит;
- воспаление плевры;
- заболевание околоносовых пазух.
- воспаление ушей;
Как делать электрофорез на нос
Существует множество видов воздействия на пораженную зону при помощи электрического тока. При выборе электрофореза с хлористым кальцием в нос, врач должен предупредить, что глюконат кальция может вызвать раздражение в кишечном тракте, а также снижение артериального давления. Но такие симптомы возникают достаточно редко.
Но такие симптомы возникают достаточно редко.
В ходе лечения пациент не должен ощущать боли.
Основной эффект после лечения глюконата кальцием – это противовоспалительный и противоаллергический. Сразу после лечения укрепляются кровеносные сосуды, снижается проницаемость клеток, улучшается самочувствие, происходит дезинтоксикационное воздействие.
Механизм проведения процедуры:
- Первым делом врач промывает носовые пути солевым физраствором.
- После этого в каждую ноздрю вводится тампон, который предварительно смачивают в хлориде кальция.
- Второй электрод располагают на задней части позвоночного столба. Данную полость необходимо закрыть прокладкой для защитных функций.
- После этого прибор включают и устанавливают силу тока равную 2мА.
Вся процедура длится около двадцати минут. Время воздействия подбирается врачом и зависит от характера и формы воспаления.
Лечение вазомоторного ринита
Если пациенту назначили электрофорез при вазомоторном рините, действие аппарата аналогично.
Такая процедура позволит увеличить тонус кровеносных сосудов и улучшить функции слизистой оболочки в носовой полости. Лечение позволяет снизить отечность тканей и восстановить кровообращение в пораженной зоне.
При выборе лекарственного вещества при вазомоторном рините необходимо посоветоваться с врачом. Помимо хлорида кальция, специалист может назначить Антипирин, Тиамин, Новокаин, Пенициллин, Стрептоцид, Сульфотиофен.
В ходе лечения пациенту вставляют в носовые проходы турунды, смоченные в медикаменте и присоединяют электроды. При воздействии тока, лекарственный препарат расщепляется и проникает в очаг воспаления.
Для справки! Если пациент страдает от повышенной чувствительности оболочки носа, предварительно полость обрабатывают антисептическими растворами.
Беременность и электрофорез
Электрофорез в нос при беременности не запрещен. Наоборот, именно этот метод считается самым безвредным не только для будущей мамочки, но и для малыша. Электрофорезис могут назначить на разных сроках беременности как дополнительный метод лечения воспаления дыхательных путей.
Электрофорезис могут назначить на разных сроках беременности как дополнительный метод лечения воспаления дыхательных путей.
Электрофорез выступает как один из методов лечения гайморита, фронтита, синусита. Он не запрещен при беременности.
Для справки! Электрофорез позволяет снизить тонус матки и оказать благоприятное воздействие на весь организм.
Однако, несмотря на распространенность такого метода, электрофорез запрещен в случае частой рвоты, при сильных признаках токсикоза, в случае неважного самочувствия беременной, а также при частых кровотечениях из носа.
Заключение
Электрофорез – это только один из способов воздействия на очаг воспаления. Избавиться от заболевания дыхательных путей можно только при помощи комплексного лечения. Если же болезнь пустить на самотек, существует риск образования опасных последствий для жизни пациента.
Эндоназальный электрофорез в консервативной реабилитации больных с септальной перфорацией
Одним из сложных вопросов, с которым приходится сталкиваться оториноларингологу в своей практике, является лечение перфорации перегородки носа (ППН) [1]. На первый взгляд, в данной нозологической форме есть все необходимые «атрибуты». Разработанные классификации разделяют ППН по причине их возникновения, размеру и по локализации патологического процесса [2—4]. Предлагаемая лечебная тактика имеет стандартный выбор между хирургическими и консервативными методиками. Однако следует признать, что на сегодняшний день мы имеем колоссальный разрыв между теоретическим базисом и практикой в решении вопроса помощи больным, страдающими ППН. На наш взгляд, это связано с тем, что разработанные классификации имели лишь хирургическую направленность. Исключение составляет деление ППН по этиологическому признаку, призванное выявить ряд тяжелых заболеваний, ранним проявлением которых является спонтанный септальный дефект.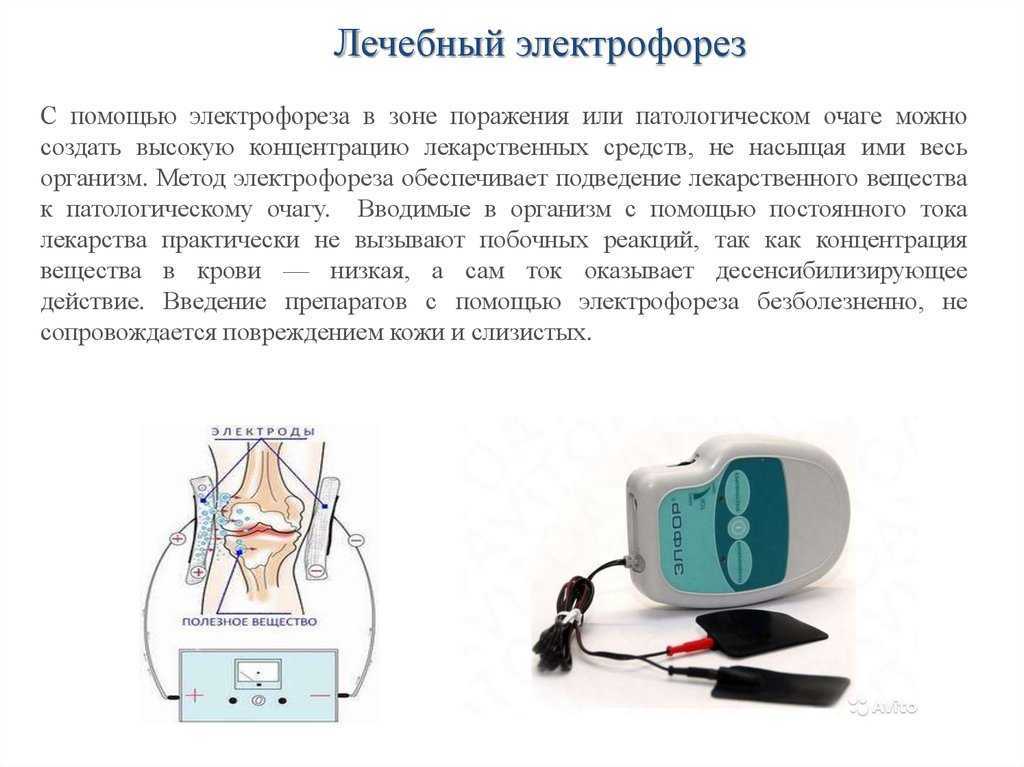
Целью работы явилось повышение эффективности консервативного лечения ППН посредством разработки методики, включающей септальное шинирование с возможностью длительного направленного лекарственного воздействия на поврежденные ткани перегородки носа с учетом специфики полученных морфологических данных.
Для достижения поставленной цели нами определен круг следующих задач:
На основании наличия жалоб больных, связанных с наличием септального дефекта, характера течения заболевания, эндоскопической и морфологической картины, разработать клиническую классификацию ППН.
На основании исследования клинико-морфологического состояния ППН перфорации перегородки носа разработать оригинальную методику консервативного ведения больных с СП, включающую в себя длительное экранирование тканей перегородки носа в области дефекта с возможностью проведения лечебных манипуляций и динамического эндоскопического контроля.
Провести комплексный сравнительный анализ эффективности применения оригинальной методики консервативного лечения больных с ППН перфорацией перегородки носа и традиционной симптоматической терапии.
На основании выявленных клинических особенностей СП разработать клинический алгоритм при этом виде патологии.
Нашу работу мы условно разделили на 3 этапа. Изучение типовых особенностей септальных дефектов мы проводили с 2006 по 2012 г. у 67 пациентов с ППН перфорацией перегородки носа, обратившихся за консультативной помощью в ГБУЗ МНПЦ оториноларингологии им. Л.И. Свержевского ДЗ Москвы. Женщин было 41, мужчин — 26. Возраст от 16 до 57 лет. Критериями исключения служили наличие аутоиммунных и неопластических заболеваний. Во всех случаях выявляли жалобы, присущие ППН, собирали подробный анамнез жизни и заболевания, проводили осмотр ЛОР-органов, эндоскопию полости носа и гистологическое исследование биопсийного материала, взятого нами из трех локусов тканей перегородки носа, окружающих септальный дефект.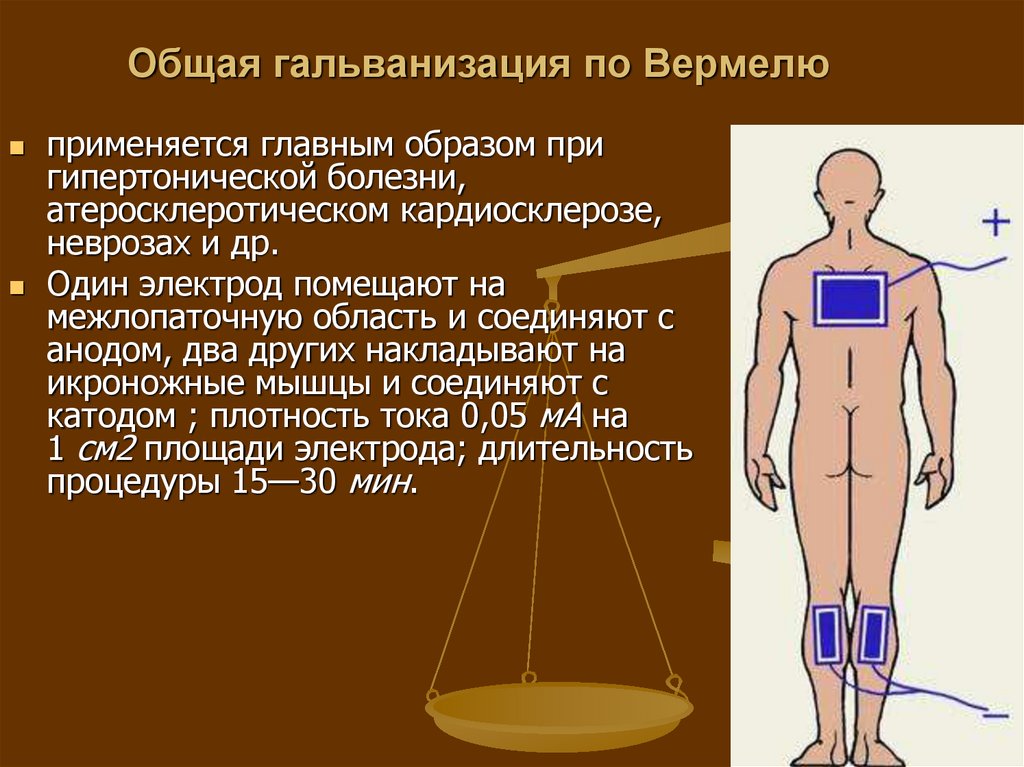 При эндоскопическом осмотре полости носа измеряли размеры СП и описывали визуальную картину тканей перегородки носа. Все больные консультированы иммунологом и ревматологом. Базовое лечение включало орошение полости носа физиологическим раствором, дополняемое внутриносовой инстилляцией раствора антисептика (мирамистин) и мазевой аппликацией (синтомициновая эмульсия 1%, метилурациловая мазь 10%). В период ремиссии заболевания всем больным рекомендовали увлажнять слизистую оболочку полости носа физиологическим раствором. О достижении клинической ремиссии заболевания свидетельствовал регресс жалоб пациента, воспалительных проявлений тканей, окружающих СП, и размер дефекта перегородки носа. С целью проведения статистического анализа для каждого исследуемого показателя мы разработали визуально-аналоговую шкалу (ВАШ). Для объективной оценки эффективности применяемого метода лечения в заживлении раневых поверхностей мы проводили цитологическое исследование мазков-отпечатков. Длительный срок наблюдения за больными (от 1 года до 3 лет) позволил нам также оценить продолжительность ремиссии и срок проводимого лечения.
При эндоскопическом осмотре полости носа измеряли размеры СП и описывали визуальную картину тканей перегородки носа. Все больные консультированы иммунологом и ревматологом. Базовое лечение включало орошение полости носа физиологическим раствором, дополняемое внутриносовой инстилляцией раствора антисептика (мирамистин) и мазевой аппликацией (синтомициновая эмульсия 1%, метилурациловая мазь 10%). В период ремиссии заболевания всем больным рекомендовали увлажнять слизистую оболочку полости носа физиологическим раствором. О достижении клинической ремиссии заболевания свидетельствовал регресс жалоб пациента, воспалительных проявлений тканей, окружающих СП, и размер дефекта перегородки носа. С целью проведения статистического анализа для каждого исследуемого показателя мы разработали визуально-аналоговую шкалу (ВАШ). Для объективной оценки эффективности применяемого метода лечения в заживлении раневых поверхностей мы проводили цитологическое исследование мазков-отпечатков. Длительный срок наблюдения за больными (от 1 года до 3 лет) позволил нам также оценить продолжительность ремиссии и срок проводимого лечения.
Нами было выявлено, что 53 (79,1%) пациента высказывали жалобы, которые были связаны с септальным дефектом: затрудненное носовое дыхание с образованием корок в полости носа, периодические носовые кровотечения, озвученное носовое дыхание. В 14 (20,9%) случаях жалоб не было или они не имели четкой связи с заболеванием. У этих больных ППН была как «случайная находка» при осмотре оториноларингологом. По данным анамнеза мы установили, что у 36 (53,7%) больных причиной перфорации было хирургическое вмешательство на перегородке носа, у 2 (3%) пациентов — работа на вредном производстве, у 29 (43,3%) больных явную причину заболевания нам установить не удалось.
На основании клинико-эндоскопической картины и результатов гистологического исследования состояния тканей, окружающих перфорацию, нами было определено 4 формы СП: интактная (невоспаленная), субатрофичная, эрозивно-язвенная и смешанная. Смешанная форма ППН нами была отмечена у 42 (62,7%) больных, субатрофичная — у 9 (13,4%), эрозивно-язвенная — у 12 (17,9%), интактная — у 4 (6%) пациентов. Невоспаленные окружающие ткани имели перфорации, которые локализовались в задних отделах перегородки носа. Особенностью эрозивно-язвенного повреждения тканей перегородки носа заключалось в том, что при гистологическом изучении 54 биоптатных препаратов в 100% случаев гистологическая картина соответствовала активному тканевому воспалению с явлениями поверхностного некроза (частично разрушенные эпителиальные клетки, кровенаполненность сосудов, выраженная макрофагальная инфильтрация с дегенеративным повреждением костной и хрящевой ткани). При гистологическом изучении тканей, взятых из субатрофичных локусов септального дефекта, в 37 (72,5%) случаях тканевое воспаление носило умеренный характер, фиброзная дегенерация отмечена в 51 (100%) исследовании.
Невоспаленные окружающие ткани имели перфорации, которые локализовались в задних отделах перегородки носа. Особенностью эрозивно-язвенного повреждения тканей перегородки носа заключалось в том, что при гистологическом изучении 54 биоптатных препаратов в 100% случаев гистологическая картина соответствовала активному тканевому воспалению с явлениями поверхностного некроза (частично разрушенные эпителиальные клетки, кровенаполненность сосудов, выраженная макрофагальная инфильтрация с дегенеративным повреждением костной и хрящевой ткани). При гистологическом изучении тканей, взятых из субатрофичных локусов септального дефекта, в 37 (72,5%) случаях тканевое воспаление носило умеренный характер, фиброзная дегенерация отмечена в 51 (100%) исследовании.
В результате длительного динамического наблюдения нами было выявлено, что у 24 (35,8%) больных ППН увеличилась в размере. У 3 (21,4%) пациентов ранее бессимптомное течение заболевания начало проявляться патогномоничной симптоматикой.
На основании комплексного исследования нами определены следующие клинические формы ППН, характеризующие течение заболевания, его проявления и морфологические особенности (см. таблицу).
таблицу).
На втором этапе нами разработана методика консервативного лечения ППН, в основе которой лежит стентирование перегородки носа оригинальными семиугольными сплинтами, изготовленные ЗАО МедСил (Мытищи). Отличительные признаки примененной нами методики шинирования заключались в том, что септальные стенты были изготовлены из композиций медицинского силикона на основе жидких каучуков марок LR 3003/20-60 «Wacer» (Германия), при этом один из стентов мы оборудовали щелевым манипуляционным каналом. Это позволило нам «разорвать порочный круг» влияния турбулентных потоков воздуха на ткани перегородки носа, окружающие септальный дефект. Щелевой манипуляционный канал, расположенный на уровне передних отделов ППН, позволяет осуществлять динамический эндоскопический контроль за состоянием поврежденных тканей и проводить лечебные процедуры (в том числе и физиотерапевтические). Септальные стенты мы фиксировали в полости носа по методике А.И. Крюкова и соавт. [6], при которой достигается полная иммобилизация перегородки носа. Данная конструкция позволила нам создать в области СП отграниченное (условно-закрытое) пространство, позволяющее лекарственному препарату длительно находиться в области дефекта и прицельно воздействовать на поврежденные ткани перегородки носа. Нами также разработан специальный активный электрод для проведения эндоназального электрофореза в зоне перфорации. Размеры рабочего элемента электрода соответствуют размерам манипуляционного канала септальной шины.
Данная конструкция позволила нам создать в области СП отграниченное (условно-закрытое) пространство, позволяющее лекарственному препарату длительно находиться в области дефекта и прицельно воздействовать на поврежденные ткани перегородки носа. Нами также разработан специальный активный электрод для проведения эндоназального электрофореза в зоне перфорации. Размеры рабочего элемента электрода соответствуют размерам манипуляционного канала септальной шины.
В тех случаях, когда края дефекта имели эрозии и изъязвления слизистой оболочки мы вводили препараты, обладающие антисептическим действием (раствор мирамистина и 1% синтомициновая эмульсия), и лекарственные вещества, стимулирующие регенерацию эпителия (метилурациловая мазь 10%). После заживления слизистой оболочки в области краев ППН мы проводили процедуру эндоназального электрофореза. Ватную турунду, пропитанную 2% раствором хлорида кальция, вводили через щелевой манипуляционный канал в отграниченное сплинтами пространство перфорации и устанавливали активный электрод, подключенный к аппарату Поток-1. Физиотерапевтическое лечение включало 5 процедур. При этом сила постоянного тока и время экспозиции мы подбирали индивидуально.
Физиотерапевтическое лечение включало 5 процедур. При этом сила постоянного тока и время экспозиции мы подбирали индивидуально.
Оригинальную методику консервативного лечения ППН применили у 26 больных (третий этап), находившихся под нашим динамическим наблюдением и получавших традиционное лечение заболевания. Женщин было 17, мужчин — 9. Возраст от 20 до 46 лет. Таким образом, под нашим наблюдением было 52 СП. Во всех случаях характер повреждения тканей перегородки носа носил смешанный характер. Критерием исключения были сопутствующие заболевания у пациента, служившие противопоказанием к проведению физиотерапевтического лечения. В зависимости от вида консервативного лечения больных нами было выделено 2 группы (по 26 единиц исследования в каждой). В 1-й группе мы применили традиционное симптоматическое лечение СП. Во 2-й группе нами использована оригинальная, патоморфологически обоснованная методика лечения ППН, включающая в себя превентивное септальное шинирование и дифференцированное лекарственное воздействие. Срок наблюдения составил от 1 года до 3 лет.
Срок наблюдения составил от 1 года до 3 лет.
Проводя динамический эндоскопический контроль состояния тканей перегородки носа нами было зарегистрировано, что локальные изъязвления и эрозии слизистой оболочки в области септального дефекта в 1-й группе зажили в 14 (53,8%) случаях, тогда как во 2-й группе восстановление поврежденных тканей достигнуто у всех (100%) пациентов (р<0,05). При этом срок лечения (время достижения клинического эффекта) в 1-й группе составил 18,3±1,49 сут, во 2-й группе — 12,5±0,72 сут (р<0,05). Изучив мазки-отпечатки, взятые нами с края СП, мы констатировали, что цитологические препараты 2-й группы характеризовались наличием большого количества рыхлых клеточных структур цилиндрического эпителия с укрупненными гиперхромными ядрами и светлым хроматином. При цитологическом исследовании мазков-отпечатков 1-й группы больных во всех препаратах выявлено большое число лейкоцитов (из них до 45% разрушенные), при этом подавляющее число (84—97%) нейтрофилов. В 100% исследований клетки цилиндрического эпителия встречались разрозненно с признаками дегенеративных изменений. В 7 (27%) препаратах нами зафиксированы чешуйки плоского эпителия.
В 7 (27%) препаратах нами зафиксированы чешуйки плоского эпителия.
Оценив динамику жалоб у пациентов 1-й группы, нами было зафиксировано, что 2 (7,7%) пациента перестали отмечать проявления ППН (0 баллов по ВАШ). В остальных случаях проявления СП, беспокоящие больных, уменьшились на 39,3% и составили 1,82±0,07 балла по ВАШ (р<0,05). Во 2-й группе у 5 (19,2%) больных результатом консервативного лечения было отсутствие жалоб, связанных с ППН. В остальных случаях проявления СП, беспокоящие больных, уменьшились на 68,7% и составили 0,94±0,11 балла по ВАШ (р<0,05). Длительный срок наблюдения за больными позволил нам оценить продолжительность периода ремиссии заболевания, который в 1-й группе составил 36,1±9,13 сут. У 2 пациентов 2-й группы мы добились стойкой ремиссии, у остальных длительность ремиссии составила 142,5±12,81 дня.
Проведенный сравнительный анализ полученных нами результатов показал, что оригинальный способ ведения больных с ППН, базирующийся на превентивном шинировании перегородки носа семиугольными сплинтами, один из которых оборудован щелевым манипуляционным каналом, является эффективной методикой консервативного лечения СП.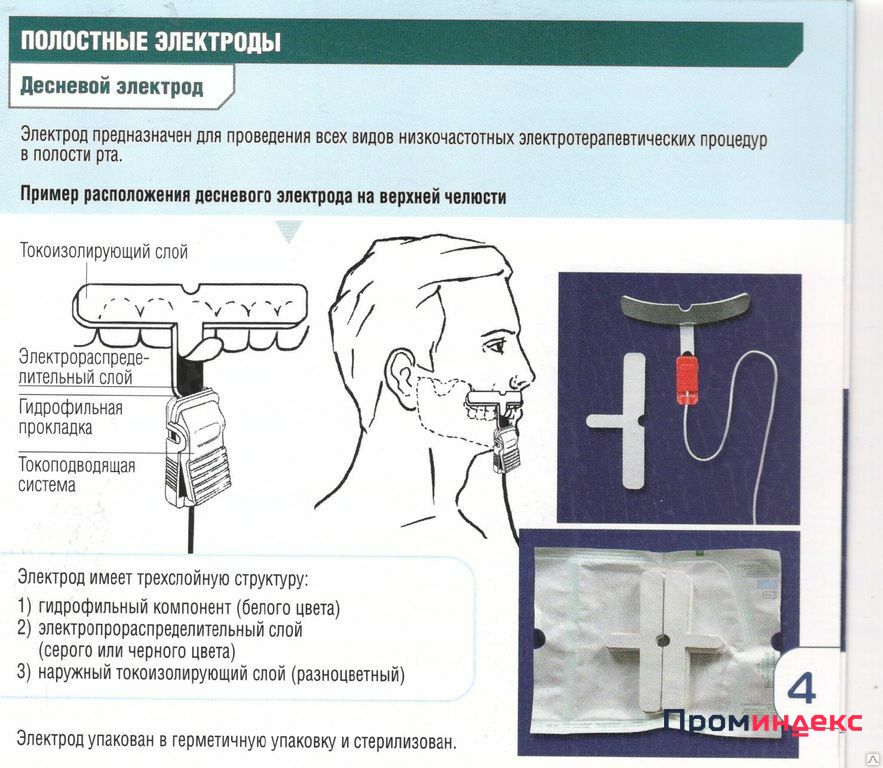 Целенаправленное воздействие лекарственных веществ в условиях исключения влияния турбулентных потоков воздуха приводит к полной регенерации поврежденных тканей в области септального дефекта, что в свою очередь удлиняет продолжительность ремиссии заболевания в 4 раза.
Целенаправленное воздействие лекарственных веществ в условиях исключения влияния турбулентных потоков воздуха приводит к полной регенерации поврежденных тканей в области септального дефекта, что в свою очередь удлиняет продолжительность ремиссии заболевания в 4 раза.
На основании полученных результатов мы разработали алгоритм ведения пациентов, страдающих ППН, который несет в себе следующие ключевые положения: пациенты с бессимптомными СП, характеризующиеся стабильным течением, не требуют лечения и должны находиться под динамическим наблюдением оториноларинголога; ППН, проявляющие себя клинически и имеющие тенденцию к увеличению размеров, требуют комплексного консервативного лечения с превентивным шинированием перегородки носа и проведением физиотерапии; показанием к пластическому закрытию объемных септальных дефектов является неэффективность консервативного лечения ППН; полное или частичное закрытие СП должно проводиться «спокойными» тканями.
Таким образом, предложенная нами оригинальная методика консервативного лечения септальных дефектов и разработанная нами классификация и алгоритм ведения больных, страдающий ППН, могут быть рекомендованы для практического применения в ЛОР-стационарах и амбулаторной оториноларингологической сети.
Состав протеогликанов хряща. Исследование с использованием процедур экстракции с высокой и низкой ионной силой
Сравнительное исследование
. 1973 г., март; 131 (3): 541–53.
дои: 10.1042/bj1310541.
Р. В. Мэйс, Р. М. Мейсон, Д. К. Гриффин
- PMID: 4269049
- PMCID: PMC1177501
- DOI: 10.1042/bj1310541
Бесплатная статья ЧВК
Сравнительное исследование
RW Mayes et al. Биохим Дж. 1973 март
Бесплатная статья ЧВК
. 1973 г., март; 131 (3): 541–53.
1973 г., март; 131 (3): 541–53.
дои: 10.1042/bj1310541.
Авторы
Р. В. Мэйс, Р. М. Мейсон, Д. К. Гриффин
- PMID: 4269049
- PMCID: PMC1177501
- DOI: 10.1042/bj1310541
Абстрактный
1. Фракция протеогликана (фракция субъединицы протеогликана) была приготовлена из экстрактов с 0,15 м-KCl (низкая ионная сила) и 0,5 м-LaCl(3), 2,0 м-CaCl(2) и 4,0 м-хлоридом гуанидиния. (с высокой ионной силой) бычьего носового хряща центрифугированием в градиенте равновесной плотности, по существу, как описано Hascall & Sajdera (1969). 2. Использование разного времени центрифугирования показало, что почти равновесные условия достигаются к 48 ч для фракций, приготовленных из экстрактов с высокой ионной силой. Фракции, выделенной из экстракта с низкой ионной силой, требовалось более длительное время центрифугирования для достижения равновесных условий. 3. Состав фракций протеогликанов из различных экстрактов сравнивали путем анализа содержания в них углеводов и аминокислот. Индексы различий рассчитывали на основе аминокислотного анализа для сравнения степени композиционной связи между белковыми компонентами протеогликанов. 4. Были обнаружены небольшие различия в составе протеогликанов, выделенных из различных экстрактов с высокой ионной силой. Содержание белка в фракциях экстракта CaCl(2) и экстракта хлорида гуанидиния показало наибольшую разницу в этом отношении, хотя их аминокислотный состав был сходным. 5. Фракция протеогликанов, выделенная из экстракта с низкой ионной силой, демонстрирует заметные отличия по составу от фракций, выделенных из экстрактов с высокой ионной силой.
2. Использование разного времени центрифугирования показало, что почти равновесные условия достигаются к 48 ч для фракций, приготовленных из экстрактов с высокой ионной силой. Фракции, выделенной из экстракта с низкой ионной силой, требовалось более длительное время центрифугирования для достижения равновесных условий. 3. Состав фракций протеогликанов из различных экстрактов сравнивали путем анализа содержания в них углеводов и аминокислот. Индексы различий рассчитывали на основе аминокислотного анализа для сравнения степени композиционной связи между белковыми компонентами протеогликанов. 4. Были обнаружены небольшие различия в составе протеогликанов, выделенных из различных экстрактов с высокой ионной силой. Содержание белка в фракциях экстракта CaCl(2) и экстракта хлорида гуанидиния показало наибольшую разницу в этом отношении, хотя их аминокислотный состав был сходным. 5. Фракция протеогликанов, выделенная из экстракта с низкой ионной силой, демонстрирует заметные отличия по составу от фракций, выделенных из экстрактов с высокой ионной силой. Содержание белка и глюкозамина было ниже, тогда как содержание гексуроновой кислоты и галактозамина было выше, чем у последнего. Он также демонстрирует значительные различия в своем аминокислотном составе. Соотношение глюкозамин:галактозамин во фракции из экстракта с низкой ионной силой указывает на то, что это может быть почти исключительно хондроитинсульфат-протеогликан. Его анализ тесно коррелирует с анализом низкомолекулярного протеогликана, выделенного из хряща гортани свиньи Tsiganos & Muir (19).69). 6. Фракции протеогликанов из экстрактов как с низкой, так и с высокой ионной силой мигрируют в виде одной полосы при зональном электрофорезе, проведенном в градиенте плотности сахарозы как при рН 4,0, так и при рН 7,0, хотя каждая из них показала признаки расширения полосы. во время электрофореза. Все фракции протеогликанов мигрировали с одинаковой электрофоретической подвижностью при рН 4,0 независимо от различий в составе между ними. 7. Обсуждаются различия между протеогликанами из экстрактов с низкой и высокой ионной силой, и высказывается мнение, что они могут быть связаны с ассоциацией между преимущественно хондроитинсульфат-протеогликанами и видами протеогликанов, обогащенными кератансульфатом.
Содержание белка и глюкозамина было ниже, тогда как содержание гексуроновой кислоты и галактозамина было выше, чем у последнего. Он также демонстрирует значительные различия в своем аминокислотном составе. Соотношение глюкозамин:галактозамин во фракции из экстракта с низкой ионной силой указывает на то, что это может быть почти исключительно хондроитинсульфат-протеогликан. Его анализ тесно коррелирует с анализом низкомолекулярного протеогликана, выделенного из хряща гортани свиньи Tsiganos & Muir (19).69). 6. Фракции протеогликанов из экстрактов как с низкой, так и с высокой ионной силой мигрируют в виде одной полосы при зональном электрофорезе, проведенном в градиенте плотности сахарозы как при рН 4,0, так и при рН 7,0, хотя каждая из них показала признаки расширения полосы. во время электрофореза. Все фракции протеогликанов мигрировали с одинаковой электрофоретической подвижностью при рН 4,0 независимо от различий в составе между ними. 7. Обсуждаются различия между протеогликанами из экстрактов с низкой и высокой ионной силой, и высказывается мнение, что они могут быть связаны с ассоциацией между преимущественно хондроитинсульфат-протеогликанами и видами протеогликанов, обогащенными кератансульфатом.
Похожие статьи
Электрофоретическая гетерогенность протеогликанов носового хряща крупного рогатого скота.
Роули П.Дж., Мейсон Р.М. Роули П.Дж. и соавт. Biochem J. 1976 Aug 1;157(2):357-67. дои: 10.1042/bj1570357. Биохим Дж. 1976. PMID: 134699 Бесплатная статья ЧВК.
Протеогликаны агрегируют в реберном хряще взрослого человека.
Пирсон Дж.П., Мейсон Р.М. Пирсон Дж. П. и соавт. Биохим Биофиз Акта. 1979 3 апреля; 583 (4): 512-26. doi: 10.1016/0304-4165(79)
-0. Биохим Биофиз Акта. 1979. PMID: 427224
Природа белковых фрагментов протеогликанов хрящей свиньи и быка.

Бакстер Э., Мьюир Х. Бакстер Э. и др. Biochem J. 1975 Sep;149(3):657-68. дои: 10.1042/bj1490657. Биохим Дж. 1975. PMID: 128355 Бесплатная статья ЧВК.
Биохимия суставного хряща. Природа протеогликанов и коллагена суставного хряща и их роль в старении и остеоартрозе.
Макдевитт, Калифорния. Макдевитт, Калифорния. Энн Реум Дис. 1973 г., июль; 32 (4): 364–78. doi: 10.1136/ard.32.4.364. Энн Реум Дис. 1973. PMID: 4269430 Бесплатная статья ЧВК. Обзор. Аннотация недоступна.
Выделение и очистка протеогликанов.
Федарко Н.С. Федарко Н.С. Опыт. 1993 г., 15 мая; 49(5):369-83. дои: 10.1007/BF01923582.
 Опыт. 1993.
PMID: 8500593
Обзор.
Опыт. 1993.
PMID: 8500593
Обзор.
Посмотреть все похожие статьи
Цитируется
Исследования стабильного легкого диабета, вызванного стрептозотоцином у крыс.
Уайтинг П.Х., Миддлтон Б., Томас Н., Хоторн Дж. Уайтинг Р.Х. и соавт. Br J Exp патол. 1982 г., август; 63 (4): 408-13. Br J Exp патол. 1982. PMID: 6758835 Бесплатная статья ЧВК.
Химическая и иммунохимическая характеристика казеинов и основных сывороточных белков кроличьего молока.
Dayal R, Hurlimann J, Suard YM, Kraehenbuhl JP. Дайал Р. и др. Biochem J. 1982 января 1; 201 (1): 71-9. дои: 10.1042/bj2010071. Биохим Дж. 1982. PMID: 6177316 Бесплатная статья ЧВК.

Гиалуроновая кислота в хрящах и агрегация протеогликанов.
Hardingham TE, Мьюир Х. Хардингем Т.Э. и соавт. Biochem J. 1974 Jun; 139(3):565-81. дои: 10.1042/bj13
. Биохим Дж. 1974. PMID: 4277512 Бесплатная статья ЧВК.
Экстракция белков-полисахаридов хряща растворами неорганических солей.
Мейсон Р.М., Мэйс Р.В. Мейсон Р.М. и др. Biochem J. 1973 Mar; 131(3):535-40. дои: 10.1042/bj1310535. Биохим Дж. 1973. PMID: 4269048 Бесплатная статья ЧВК.
Костный морфогенетический белок: обзор.
Альдингер Г.
 , Герр Г., Кюссветтер В., Райс Х.Й., Тилеманн Ф.В., Хольц Ю.
Алдингер Г. и соавт.
Инт Ортоп. 1991;15(2):169-77. дои: 10.1007/BF00179720.
Инт Ортоп. 1991.
PMID: 1917195
Обзор.
, Герр Г., Кюссветтер В., Райс Х.Й., Тилеманн Ф.В., Хольц Ю.
Алдингер Г. и соавт.
Инт Ортоп. 1991;15(2):169-77. дои: 10.1007/BF00179720.
Инт Ортоп. 1991.
PMID: 1917195
Обзор.
Просмотреть все статьи «Цитируется по»
Рекомендации
- ФРС проц. 1966 май-июнь;25(3):1047-52 — пабмед
- Дж. Биол. Хим. 1964 май; 239:1498-503 — пабмед
- Дж.
 Биол. Хим. 1966 25 декабря; 241 (24): 5949-54
—
пабмед
Биол. Хим. 1966 25 декабря; 241 (24): 5949-54
—
пабмед
- Дж.
- Природа. 1968 14 сентября; 219 (5159): 1166-8 — пабмед
- Анальная биохимия. 1968 24 октября; 25 (1): 30-9 — пабмед
Типы публикаций
термины MeSH
вещества
Стимулируемая гипоксией продукция фактора роста эндотелия сосудов в фибробластах полипов носа человека: влияние эпигаллокатехин-3-галлата на синтез индуцируемого гипоксией фактора-1α | Отоларингология | JAMA Отоларингология – Хирургия головы и шеи
Абстрактный
Объектив Проверить ингибирующее действие эпигаллокатехин-3-галлата (EGCG) на синтез индуцированного гипоксией фактора роста эндотелия сосудов (VEGF) в фибробластах полипов носа (НПФ).
Дизайн Из полипов носа было получено восемь первичных культур НПФ. Влияние EGCG на выработку фактора, индуцируемого гипоксией (HIF)-1α (наиболее мощный стимулятор VEGF) и VEGF НПФ в условиях гипоксии измеряли с помощью вестерн-блоттинга. Иммуногистохимическое окрашивание использовали для исследования экспрессии HIF-1α и VEGF in vivo в 20 срезах полипов носа.
Результаты Вестерн-блоттинг показал, что хлорид кобальта индуцирует синтез HIF-1α и VEGF в NPF в зависимости от времени, достигая плато через 4 и 8 часов соответственно после обработки. Эпигаллокатехин-3-галлат ослаблял уровень HIF-1α, индуцированный хлоридом кобальта, а также снижал продукцию VEGF, стимулированную хлоридом кобальта, путем подавления синтеза HIF-1α. Кроме того, олигомицин (специфический ингибитор HIF-1α) в сочетании с EGCG приводил к более глубокому ингибированию синтеза VEGF по сравнению с лечением только олигомицином или EGCG. Тем не менее синергетический эффект казался меньшим, чем сумма их индивидуальных действий. Иммуногистохимический анализ выявил наличие HIF-1α и VEGF в НПФ и мононуклеарных округлых клетках. Часто обнаруживали интимное расположение VEGF-позитивных фибробластов и пролиферирующих мелких капилляров.
Иммуногистохимический анализ выявил наличие HIF-1α и VEGF в НПФ и мононуклеарных округлых клетках. Часто обнаруживали интимное расположение VEGF-позитивных фибробластов и пролиферирующих мелких капилляров.
Выводы Фибробласты полипов носа вносят вклад в патогенез полипов носа, продуцируя VEGF для стимуляции ангиогенеза в условиях гипоксии. Эпигаллокатехин-3-галлат существенно снижает синтез HIF-1α и VEGF в НПФ.
Полипы носа являются наиболее часто встречающимися объемными образованиями в полости носа. 1 Хотя патогенез остается неясным, многие авторы считают полипы носа воспалительным заболеванием. 2 Недавно мы обнаружили связь между полипозом носа и инфильтрацией макрофагов, неотъемлемым элементом воспаления. 3 Мы также продемонстрировали активный синтез основных провоспалительных медиаторов, таких как интерлейкин 6 и циклооксигеназа-2, в фибробластах полипов носа, стимулированных фактором некроза опухоли α (NPF), что подтверждает важность стромальных клеток при полипозе носа. 4
4
Ангиогенез, процесс развития новых сосудистых сетей из капиллярных зачатков или отростков, исходящих из ранее существовавших сосудов, играет важную роль в прогрессировании опухоли 5 и многих хронических заболеваний, таких как ревматоидный артрит. 6 Ангиогенный процесс точно модулируется широким спектром проангиогенных (для увеличения кровеносных сосудов при необходимости) и антиангиогенных (для блокирования патологического ангиогенеза) факторов. Фактор роста эндотелия сосудов (VEGF) является одним из наиболее мощных ангиогенных факторов, способных стимулировать пролиферацию и миграцию эндотелиальных клеток и повышать проницаемость сосудов. 7 Демонстрируя повышенные уровни VEGF в культуре NPF человека, Matsune et al 8 и Sun et al 9 предложил роль VEGF в патогенезе носовых полипов.
Стимулы для экспрессии VEGF исходят главным образом из гипоксии, которая активирует VEGF за счет увеличения индуцируемого гипоксией фактора-1 (HIF-1), 10 гетеродимерного транскрипционного фактора, состоящего из α- и β-субъединиц. Доступность HIF-1 определяется в первую очередь HIF-1α, который регулируется чувствительным к кислороду способом путем деградации через убиквитин-протеасомный путь в условиях нормоксии, в отличие от стабильно экспрессируемой субъединицы HIF-1β. При гипоксии HIF-1α стабилизируется, перемещается в ядро, гетеродимеризуется с HIF-1β и активирует множественные гены, участвующие в ангиогенезе и других клеточных функциях. 11
Доступность HIF-1 определяется в первую очередь HIF-1α, который регулируется чувствительным к кислороду способом путем деградации через убиквитин-протеасомный путь в условиях нормоксии, в отличие от стабильно экспрессируемой субъединицы HIF-1β. При гипоксии HIF-1α стабилизируется, перемещается в ядро, гетеродимеризуется с HIF-1β и активирует множественные гены, участвующие в ангиогенезе и других клеточных функциях. 11
Зеленый чай получают путем заваривания листьев Camellia sinesis для инактивации полифенолоксидазы. Полифенолы являются основными компонентами заваренного зеленого чая, из которых эпигаллокатехин-3-галлат (EGCG) является наиболее распространенным и активным. 12 Считается, что антиоксидантные свойства EGCG поглотителя свободных радикалов в первую очередь ответственны за защитный эффект потребления чая от рисков рака, дегенерации нейронов и заболеваний коронарных артерий. 13 ,14 Сообщалось об ингибирующем эффекте EGCG на продукцию VEGF в нескольких линиях раковых клеток 15 ; однако подобное действие EGCG никогда не было продемонстрировано в НПФ. Это заслуживает дальнейшего изучения, поскольку может привести к разработке новой терапевтической стратегии для полипов носа. В этом исследовании мы продемонстрировали, что EGCG ингибирует синтез VEGF, индуцированный хлоридом кобальта (CoCl 2 ), возможно, за счет снижения синтеза HIF-1α в NPF.
Это заслуживает дальнейшего изучения, поскольку может привести к разработке новой терапевтической стратегии для полипов носа. В этом исследовании мы продемонстрировали, что EGCG ингибирует синтез VEGF, индуцированный хлоридом кобальта (CoCl 2 ), возможно, за счет снижения синтеза HIF-1α в NPF.
Методы
Образцы тканей
Полипы носа, преимущественно происходящие из решетчатого лабиринта и присутствующие в средних носовых ходах, были получены при функциональной эндоскопической хирургии пазух в модификации Мессерклингера-Штаммбергера для лечения двустороннего хронического синусита с синоназальным полипозом. Пациенты с одиночным полипом (антрохоанальный полип) или с другими заболеваниями, связанными с полипозом носа, такими как муковисцидоз, первичная цилиарная дискинезия и грибковый синусит, были исключены из этого исследования. Двусторонний хронический синусит с синоназальным полипозом диагностирован на основании анамнеза и данных клинического осмотра, эндоскопии носа и компьютерной томографии пазух. Ни у одного из пациентов не было в анамнезе назальной аллергии, астмы или гиперчувствительности к аспирину. У всех были нормальные сывороточные антиген-специфические IgE-антитела (анализ множественных аллерген-специфических IgE Opticon; Hitachi Diagnostics, Inc, Маунтин-Вью, Калифорния), и ни один из них не использовал регулярные местные или пероральные лекарства в течение 3 недель. Перед операцией было получено информированное согласие. Исследование было одобрено комитетом по этике больницы Национального Тайваньского университета, Тайбэй, Тайвань.
Ни у одного из пациентов не было в анамнезе назальной аллергии, астмы или гиперчувствительности к аспирину. У всех были нормальные сывороточные антиген-специфические IgE-антитела (анализ множественных аллерген-специфических IgE Opticon; Hitachi Diagnostics, Inc, Маунтин-Вью, Калифорния), и ни один из них не использовал регулярные местные или пероральные лекарства в течение 3 недель. Перед операцией было получено информированное согласие. Исследование было одобрено комитетом по этике больницы Национального Тайваньского университета, Тайбэй, Тайвань.
Клеточные культуры
Восемь первичных культур НПФ были получены из носовых полипов у 8 пациентов, соответственно, как описано ранее. 3 ,4,16 Вкратце, после удаления эпителиального слоя образцы погружали на ночь в модифицированную Дульбекко среду Игла (хлорид кальция, 265 мкг/мл, нитрат железа, 0,1 мкг/мл, хлорид калия, 400 мкг). /мл, сульфат магния, 200 мкг/мл, хлорид натрия, 6400 мкг/мл, бикарбонат натрия, 700 мкг/мл, фосфат натрия, 125 мкг/мл, феноловый красный, 15 мкг/мл, HEPES [ N -2-гидроксиэтилпиперазин- N -2-этансульфокислота] буфер [pH 7,4], 25 ммоль/л, D-глюкоза, 1 мг/мл), содержащий 10% фетальной телячьей сыворотки и антибиотики (пенициллин, 100 Ед/мл, стрептомицин 100 мкг/мл и амфотерицин В 0,5 мкг/мл). Образцы измельчали на фрагменты размером 1 мм 3 и накрывали стерилизованными покровными стеклами. После того как фибробласты мигрировали из тканевых эксплантатов и становились конфлюэнтными, клетки обрабатывали трипсином и пересевали. Клетки между пассажами с 3 по 6 высевали при плотности 5 × 10 9 .0228 5 /мл на чашках диаметром 10 см и обработанных различными стимуляторами. Перед различными обработками клетки выдерживали в бессывороточной среде (среда без эмбриональной телячьей сыворотки) в течение 24 часов. 3 ,4,16 Приведенные здесь данные являются средними из 8 экспериментов.
Образцы измельчали на фрагменты размером 1 мм 3 и накрывали стерилизованными покровными стеклами. После того как фибробласты мигрировали из тканевых эксплантатов и становились конфлюэнтными, клетки обрабатывали трипсином и пересевали. Клетки между пассажами с 3 по 6 высевали при плотности 5 × 10 9 .0228 5 /мл на чашках диаметром 10 см и обработанных различными стимуляторами. Перед различными обработками клетки выдерживали в бессывороточной среде (среда без эмбриональной телячьей сыворотки) в течение 24 часов. 3 ,4,16 Приведенные здесь данные являются средними из 8 экспериментов.
Вестерн-блот анализ
Вестерн-блоттинг выполняли, как описано ранее. 17 Вкратце, клетки лизировали в лизирующем буфере, фракционировали с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия и переносили на нитроцеллюлозные мембраны. Антитела против VEGF (R&D Systems, Inc, Миннеаполис, Миннесота) и HIF-1α (Upstate Biotechnology Inc, Лейк-Плэсид, Нью-Йорк) добавляли в концентрациях, рекомендованных производителями. Белки визуализировали с помощью иммуноглобулина, конъюгированного с пероксидазой хрена, и системы обнаружения с улучшенной хемилюминесценцией (Amersham Biosciences, Piscataway, New Jersey). Мембраны повторно исследовали с помощью антитела к β-актину после промывки буфером для удаления.
Белки визуализировали с помощью иммуноглобулина, конъюгированного с пероксидазой хрена, и системы обнаружения с улучшенной хемилюминесценцией (Amersham Biosciences, Piscataway, New Jersey). Мембраны повторно исследовали с помощью антитела к β-актину после промывки буфером для удаления.
Иммуногистохимический анализ
Срезы были взяты из области ножки всего полипа носа у каждого из 20 пациентов, включая 8 пациентов, полипы носа которых использовались для первичной культуры клеток. Срезы, вырезанные из блоков тканей, фиксированных 10% формалином и залитых в парафин, депарафинизировали, регидратировали и подвергали извлечению антигена с использованием микроволнового метода. После блокирования эндогенной пероксидазы перекисью водорода и неспецифического связывания с кроличьей сывороткой в ТРИС-буферном солевом растворе срезы инкубировали с антителами против VEGF человека (разведение 1:40; R&D Systems, Inc) или HIF-1α человека (разведение 1:50). ; Novus Biologicals, Inc, Литтлтон, Колорадо) в забуференном ТРИС солевом растворе на ночь. Срезы инкубировали с биотинилированными вторичными антителами и окрашивали с использованием диаминобензидина или 3-амино-9.-этилкарбазол. Контрастное окрашивание проводили гематоксилином Майера в течение 1 минуты.
; Novus Biologicals, Inc, Литтлтон, Колорадо) в забуференном ТРИС солевом растворе на ночь. Срезы инкубировали с биотинилированными вторичными антителами и окрашивали с использованием диаминобензидина или 3-амино-9.-этилкарбазол. Контрастное окрашивание проводили гематоксилином Майера в течение 1 минуты.
статистический анализ
Данные были подвергнуты дисперсионному анализу для множественных сравнений, а затем защищенному критерию наименьшего значимого различия Фишера. P < 0,05 считалось статистически значимым.
Полученные результаты
CoCl 2 СТИМУЛИРОВАННЫЙ СИНТЕЗ VEGF В НПФ
Количество VEGF, продуцируемого в НПФ, стимулированных CoCl 2 (500 мкмоль/л) в течение различных периодов инкубации, оценивали с помощью вестерн-блоттинга. Результаты показали, что CoCl 2 индуцирует синтез VEGF в НПФ. Увеличение уровней VEGF зависело от времени, достигая пика через 8 часов после лечения (рис.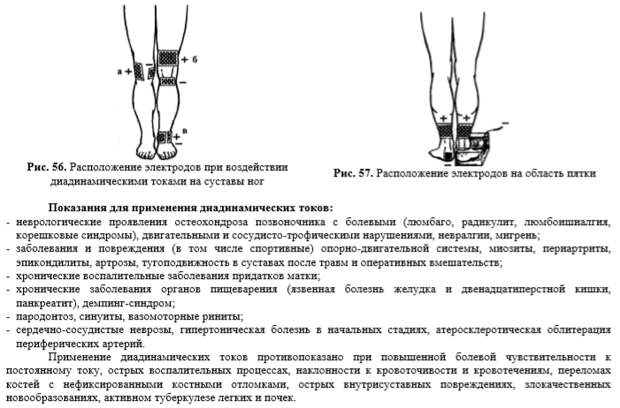 1).
1).
ЭГКГ СНИЖАЕТ УРОВЕНЬ CoCl 2 -СТИМУЛИРОВАННЫЙ HIF-1α
Клетки инкубировали с CoCl 2 (500 мкмоль/л) в течение различных периодов инкубации, и уровни HIF-1α определяли вестерн-блоттингом. Вестерн-блоттинг показал, что пиковый уровень HIF-1α в НПФ, обработанных CoCl 2 , наблюдался через 4 часа и после этого снижался (рис. 2А и С). Когда NPF инкубировали с CoCl 2 , отдельно или в комбинации с EGCG (10 мкг/мл) (за 3 часа до добавления CoCl 2 ) в течение 4 часов, анализировали уровни HIF-1α. Эпигаллокатехин-3-галлат значительно уменьшил CoCl 2 -индуцированный синтез HIF-1α (рис. 2B и D).
EGCG ABROGATED CoCl 2 -СТИМУЛИРОВАННОЕ ПРОИЗВОДСТВО VEGF ПУТЕМ СНИЖЕНИЯ СИНТЕЗА HIF-1α
Для подтверждения участия HIF-1α в синтезе VEGF после стимуляции CoCl 2 в последующем эксперименте применяли олигомицин, специфический ингибитор HIF-1α, 18 . Фибробласты назальных полипов инкубировали с CoCl 2 отдельно или в комбинации с EGCG (10 мкг/мл) или олигомицином (10 мкг/мл) (за 3 часа до добавления CoCl 9).0266 2 ) в течение 4 часов, и уровни HIF-1α оценивали с помощью вестерн-блоттинга. Результаты показали, что олигомицин значительно ослаблял уровень CoCl 2 -стимулированного VEGF. Эпигаллокатехин-3-галлат также снижал уровень VEGF, индуцированный CoCl 2 (рис. 3). По сравнению с лечением только олигомицином или ЭГКГ более выраженное ингибирование синтеза VEGF было получено при одновременном введении олигомицина и ЭГКГ. Однако синергизм был неполным, поскольку комбинированный эффект казался меньшим, чем сумма их индивидуального действия (рис. 3).
Фибробласты назальных полипов инкубировали с CoCl 2 отдельно или в комбинации с EGCG (10 мкг/мл) или олигомицином (10 мкг/мл) (за 3 часа до добавления CoCl 9).0266 2 ) в течение 4 часов, и уровни HIF-1α оценивали с помощью вестерн-блоттинга. Результаты показали, что олигомицин значительно ослаблял уровень CoCl 2 -стимулированного VEGF. Эпигаллокатехин-3-галлат также снижал уровень VEGF, индуцированный CoCl 2 (рис. 3). По сравнению с лечением только олигомицином или ЭГКГ более выраженное ингибирование синтеза VEGF было получено при одновременном введении олигомицина и ЭГКГ. Однако синергизм был неполным, поскольку комбинированный эффект казался меньшим, чем сумма их индивидуального действия (рис. 3).
ИММУНОЛОКАЛИЗАЦИЯ HIF-1α И VEGF В ПОЛИПАХ НОСЫ
При микроскопии присутствие HIF-1α было обнаружено в субэпителиальных фибробластах и мононуклеарных округлых клетках (рис. 4А и С). Фибробласты обычно имеют веретенообразную форму с овальным ядром без выраженного ядрышка, а иммуногистохимическое окрашивание вокруг HIF-1α локализуется в цитоплазме фибробластов.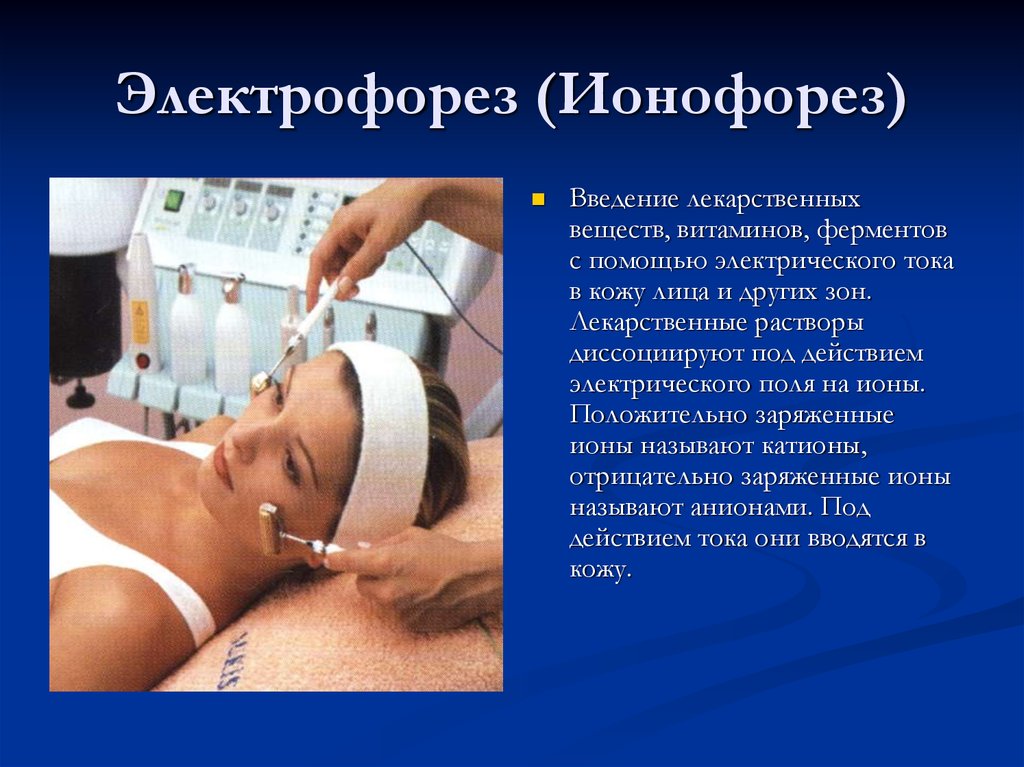 Мононуклеарные круглые клетки включают макрофаги, лимфоциты и плазматические клетки. Дифференциация этих клеток заключается в их строении: макрофаги обычно имеют обильную цитоплазму и являются самыми крупными из этих клеток, лимфоциты имеют скудную цитоплазму, а плазматические клетки имеют эксцентричное ядро и относительно такого же размера, как лимфоциты. Сосудистый эндотелиальный фактор роста был локализован в некоторых базальных клетках выстилающего эпителия, пухлых эндотелиальных клетках, выстилающих пролиферирующие капилляры, мононуклеарных округлых клетках и фибробластах. Часто обнаруживалось интимное расположение длинных веретенообразных VEGF-положительных фибробластов и пролиферирующих мелких капилляров (рис. 4B и D).
Мононуклеарные круглые клетки включают макрофаги, лимфоциты и плазматические клетки. Дифференциация этих клеток заключается в их строении: макрофаги обычно имеют обильную цитоплазму и являются самыми крупными из этих клеток, лимфоциты имеют скудную цитоплазму, а плазматические клетки имеют эксцентричное ядро и относительно такого же размера, как лимфоциты. Сосудистый эндотелиальный фактор роста был локализован в некоторых базальных клетках выстилающего эпителия, пухлых эндотелиальных клетках, выстилающих пролиферирующие капилляры, мононуклеарных округлых клетках и фибробластах. Часто обнаруживалось интимное расположение длинных веретенообразных VEGF-положительных фибробластов и пролиферирующих мелких капилляров (рис. 4B и D).
Комментарий
Способствуя пролиферации и миграции эндотелиальных клеток и повышая проницаемость сосудов, VEGF играет важную роль в опосредовании ангиогенеза в нормальных и патологических состояниях, таких как эмбриональное развитие, заживление ран и рост опухоли. 5 -7 Фактор роста эндотелия сосудов также участвует в хронических воспалительных и иммунологических процессах, приводящих впоследствии к образованию полипов в носу. 8 ,9 Результаты нашего исследования показали, что CoCl 2 индуцирует синтез VEGF в НПФ. В этой экспериментальной модели CoCl 2 использовали для инициирования гипоксических условий культивирования. Обработка культивируемых клеток CoCl 2 является хорошо зарекомендовавшим себя методом индукции изменений, подобных наблюдаемым при гипоксии. 19 ,20 Иммуногистохимия образцов полипов носа подтвердила экспрессию VEGF in vivo в NPF в дополнение к ранее описанным клеточным источникам VEGF, таким как эпителиальные клетки, эндотелиальные клетки и инфильтрирующие воспалительные клетки . 21 Кроме того, часто обнаруживали неоваскуляризацию рядом с VEGF-позитивными NPF. В совокупности наши результаты показывают, что NPF могут способствовать патогенезу полипоза носа, продуцируя VEGF для стимуляции ангиогенеза в полипах носа в условиях гипоксии.
5 -7 Фактор роста эндотелия сосудов также участвует в хронических воспалительных и иммунологических процессах, приводящих впоследствии к образованию полипов в носу. 8 ,9 Результаты нашего исследования показали, что CoCl 2 индуцирует синтез VEGF в НПФ. В этой экспериментальной модели CoCl 2 использовали для инициирования гипоксических условий культивирования. Обработка культивируемых клеток CoCl 2 является хорошо зарекомендовавшим себя методом индукции изменений, подобных наблюдаемым при гипоксии. 19 ,20 Иммуногистохимия образцов полипов носа подтвердила экспрессию VEGF in vivo в NPF в дополнение к ранее описанным клеточным источникам VEGF, таким как эпителиальные клетки, эндотелиальные клетки и инфильтрирующие воспалительные клетки . 21 Кроме того, часто обнаруживали неоваскуляризацию рядом с VEGF-позитивными NPF. В совокупности наши результаты показывают, что NPF могут способствовать патогенезу полипоза носа, продуцируя VEGF для стимуляции ангиогенеза в полипах носа в условиях гипоксии.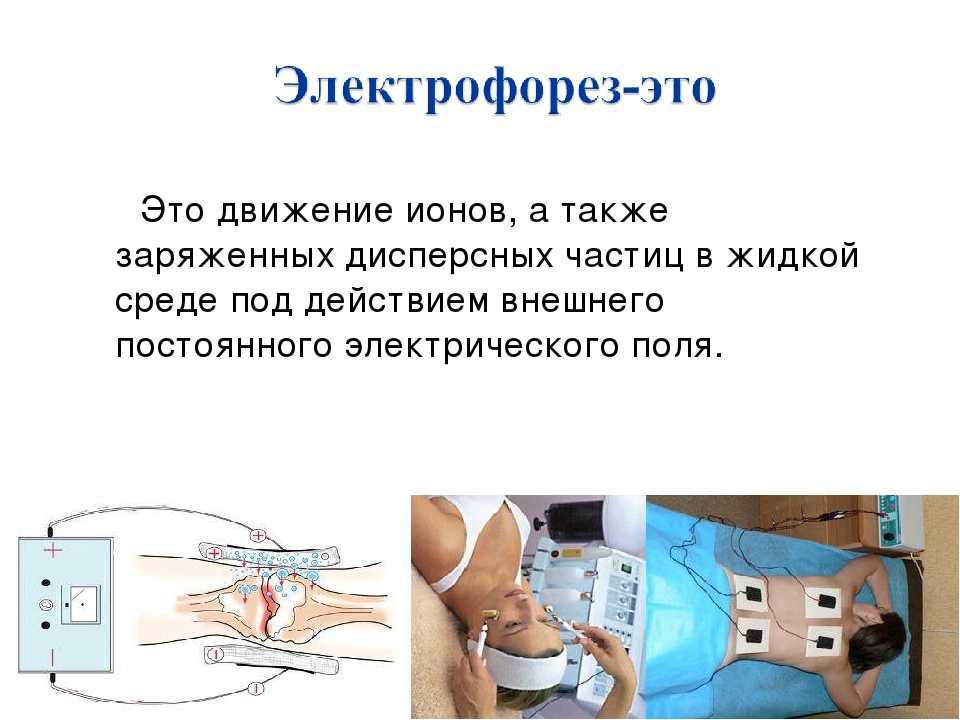
Вестерн-блот-анализ показал, что CoCl 2 стимулировал выработку HIF-1α в НПФ, а иммуногистохимическое окрашивание также показало присутствие in vivo HIF-1α в НПФ и мононуклеарных круглых клетках, что указывает на гипоксию полипов носа. Насколько нам известно, это первая демонстрация синтеза HIF-1α в NPF. При гипоксии HIF-1α перемещается в ядро, гетеродимеризуется с HIF-1β и активирует несколько генов, включая VEGF. 10 ,11 Наши результаты демонстрируют, что олигомицин, специфический ингибитор HIF-1α, ослабляет уровень CoCl 2 -стимулированного VEGF в НПФ, что дополнительно подтверждает участие HIF-1α в продукции VEGF, индуцированной гипоксией.
При использовании олигомицина в качестве ингибитора HIF-1α была подтверждена роль HIF-1α в CoCl 2 -стимулируемом производстве VEGF в НПФ. Влияние EGCG на индуцированную гипоксией продукцию VEGF и HIF-1α было исследовано впоследствии, и было обнаружено подавляющее действие на обе молекулы. О механизмах облегчения ЭГКГ на CoCl 2 -стимулированный синтез VEGF, одно из объяснений заключается в том, что EGCG может ингибировать продукцию VEGF за счет подавления HIF-1α или, возможно, за счет влияния CoCl 2 на культуру клеток при создании или опосредовании гипоксического эффекта. Поскольку в экспрессии VEGF, как сообщается, участвуют пути, отличные от HIF-1α, такие как белок-активатор-1 22 и ядерный фактор-каппа B 23 , другим сценарием является ингибирование EGCG на индуцированный гипоксией синтез VEGF путем изменения эффектов активирующий белок-1 или ядерный фактор-каппа B в дополнение к снижению уровня HIF-1α. Предложение заслуживает дальнейшего изучения, потому что результаты могут в определенной степени объяснять наше открытие о том, что комбинированный эффект EGCG и олигомицина на продукцию VEGF был выше, чем эффект, индуцированный каждым агентом по отдельности.
О механизмах облегчения ЭГКГ на CoCl 2 -стимулированный синтез VEGF, одно из объяснений заключается в том, что EGCG может ингибировать продукцию VEGF за счет подавления HIF-1α или, возможно, за счет влияния CoCl 2 на культуру клеток при создании или опосредовании гипоксического эффекта. Поскольку в экспрессии VEGF, как сообщается, участвуют пути, отличные от HIF-1α, такие как белок-активатор-1 22 и ядерный фактор-каппа B 23 , другим сценарием является ингибирование EGCG на индуцированный гипоксией синтез VEGF путем изменения эффектов активирующий белок-1 или ядерный фактор-каппа B в дополнение к снижению уровня HIF-1α. Предложение заслуживает дальнейшего изучения, потому что результаты могут в определенной степени объяснять наше открытие о том, что комбинированный эффект EGCG и олигомицина на продукцию VEGF был выше, чем эффект, индуцированный каждым агентом по отдельности.
В заключение, наши данные свидетельствуют о том, что NPF могут способствовать патогенезу полипов носа, продуцируя VEGF для стимуляции ангиогенеза в условиях гипоксии.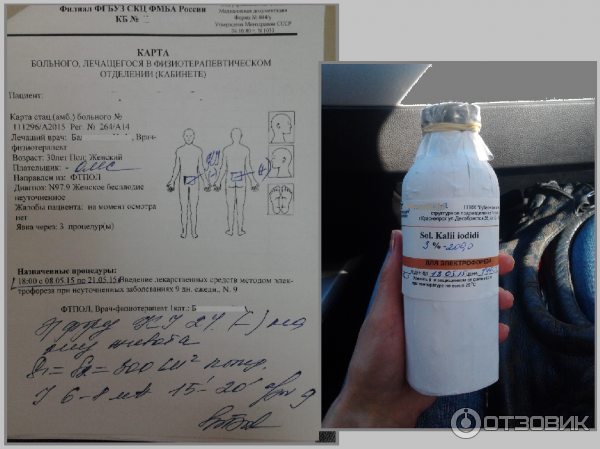 Эпигаллокатехин-3-галлат существенно снижает синтез HIF-1α и VEGF в культивируемых NPF. Однако реальные физические условия гораздо сложнее, чем система культивирования in vitro. Таким образом, необходимы дальнейшие клинические исследования для подтверждения возможности применения ЭГКГ в качестве терапевтического средства при полипозе носа.
Эпигаллокатехин-3-галлат существенно снижает синтез HIF-1α и VEGF в культивируемых NPF. Однако реальные физические условия гораздо сложнее, чем система культивирования in vitro. Таким образом, необходимы дальнейшие клинические исследования для подтверждения возможности применения ЭГКГ в качестве терапевтического средства при полипозе носа.
Корреспонденция: Чиа-Минг Лю, доктор медицинских наук, отделение отоларингологии, Государственная больница Тайваньского университета, 1 Chang-Teh St, Тайбэй, Тайвань 10016 ([email protected]).
Подано для публикации: 23 ноября 2006 г.; окончательная редакция получена 15 июня 2007 г.; принято 16 августа 2007 г.
Вклад авторов: Д-р Лю имел полный доступ ко всем данным исследования и берет на себя ответственность за целостность данных и точность анализа данных. Концепция и дизайн исследования 902:57: Лю. Сбор данных : Линь, Шунь, Кок, Ван, Сяо и Лю. Анализ и интерпретация данных : Линь, Шун, Кок, Сяо и Лю.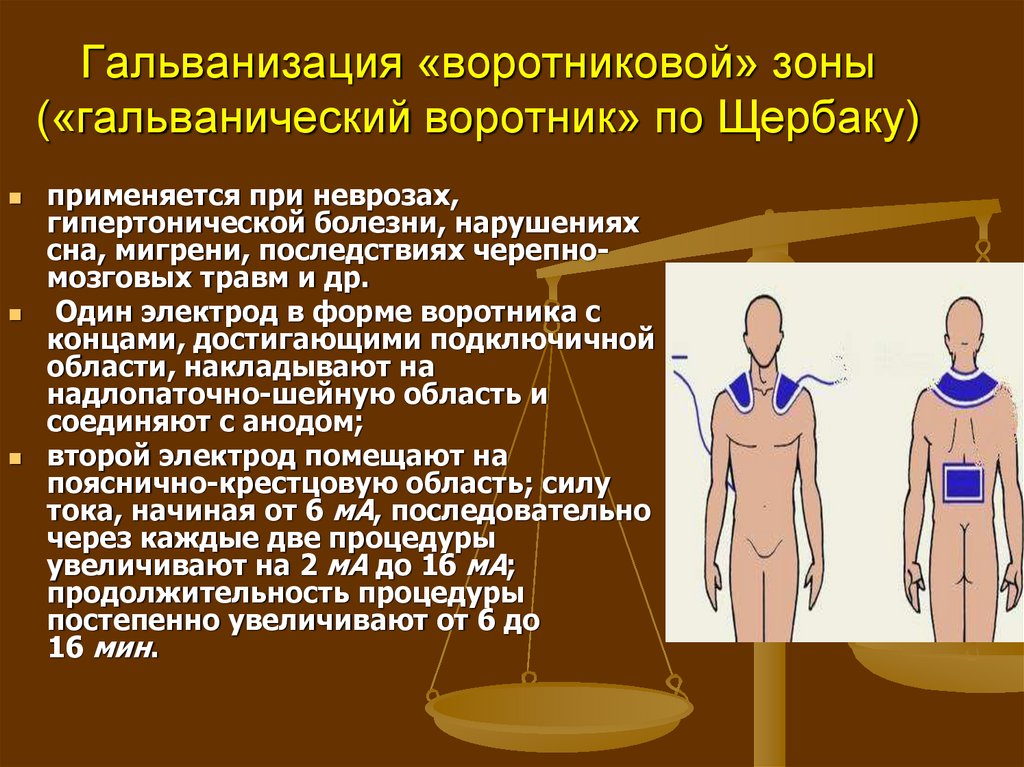 Составление рукописи : Линь, Шунь, Кок, Ван, Сяо и Лю. Критический пересмотр рукописи на предмет важного интеллектуального содержания : Шун и Лю. Статистический анализ : Линь, Кок и Сяо. Получено финансирование : Лин и Лю. Административное, техническое и материальное обеспечение 902:57: Шунь, Кок, Ван, Сяо и Лю. Надзор за исследованием : Шун и Лю.
Составление рукописи : Линь, Шунь, Кок, Ван, Сяо и Лю. Критический пересмотр рукописи на предмет важного интеллектуального содержания : Шун и Лю. Статистический анализ : Линь, Кок и Сяо. Получено финансирование : Лин и Лю. Административное, техническое и материальное обеспечение 902:57: Шунь, Кок, Ван, Сяо и Лю. Надзор за исследованием : Шун и Лю.
Раскрытие финансовой информации: Не сообщалось.
Финансирование/поддержка: Это исследование было поддержано грантами NSC-94-2314-B-002-170 (д-р Лин) и NSC 94-2314-B-002-244 (д-р Лю) от Национального научного совета, Тайвань.
Рекомендации
1.
Хоземанн Вгёде УВагнер W Эпидемиология, патофизиология полипоза носа и спектр хирургии эндоназальных пазух. Am J Отоларингол 1994;15 (2) 85- 98PubMedGoogle ScholarCrossref
2.
Lee CHRhee CSMin Экспрессия гена цитокина YG в полипах носа. Энн Отол Ринол Ларингол 1998;107 (8) 665- 670PubMedGoogle Scholar
3.
Шунь CTLin СХонг КИ и другие. Экспрессия гена CC хемокинового лиганда 2 в фибробластах полипов носа: возможное участие в патогенезе полипоза носа. Энн Отол Ринол Ларингол 2005;114 (11) 879- 885PubMedGoogle Scholar
4.
Лю CMHong КИШун КТ и другие. Индуцибельная экспрессия генов циклооксигеназы и интерлейкина-6 при полипозе носа. Arch Otolaryngol Head Neck Surg 2002;128 (8) 945- 951PubMedGoogle ScholarCrossref
5.
Carmeliet
Пи Джейн
РК Ангиогенез при раке и других заболеваниях.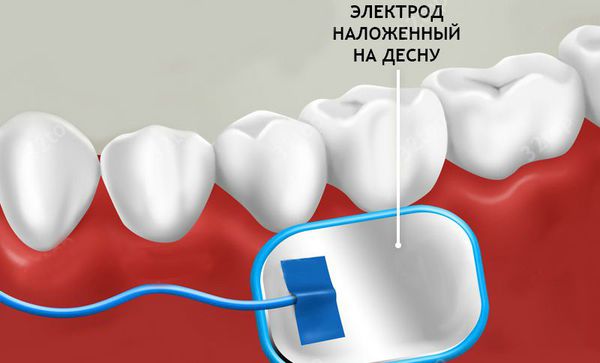 Природа 2000;407
(6801)
249- 257PubMedGoogle ScholarCrossref
Природа 2000;407
(6801)
249- 257PubMedGoogle ScholarCrossref
6.
Фолкман J Ангиогенез при раке, сосудистых, ревматоидных и других заболеваниях. Nat Med 1995;1 (1) 27- 31PubMedGoogle ScholarCrossref
7.
Феррара НГербер HPLeCouter J Биология VEGF и его рецепторов. Nat Med 2003;9 (6) 669- 676PubMedGoogle ScholarCrossref
8.
Мацунэ ССВс ДОхори Дж и другие. Ингибирование фактора роста эндотелия сосудов макролидами в культуре фибробластов полипов носа. Ларингоскоп 2005;115 (11) 1953– 1956PubMedGoogle ScholarCrossref
9.
Sun DMatsune Сохори JFukuiwa ТУшика М.Куроно Y TNF-α и эндотоксин усиливают индуцированную гипоксией продукцию VEGF культивируемыми фибробластами носа человека синергическим образом. Auris Nasus Гортань 2005;32 (3) 243- 249PubMedGoogle ScholarCrossref
10.
Банн ХФПойтон KO Кислородное зондирование и молекулярная адаптация к гипоксии. Физиол Ред. 1996; 76 (3) 839- 885PubMedGoogle Scholar
11.
Semenza GL, HIF-1 и опухолевая прогрессия: патофизиология и терапия. Тренды Mol Med 2002;8 (4) ((приложение 4)) S62- S67PubMedGoogle ScholarCrossref
12.
Балентин
DAWisweman
С. А.Боуэнс
LC Химия чайных флавоноидов. Crit Rev Food Sci Nutr 1997;37
(8)
693- 704PubMedGoogle ScholarCrossref
А.Боуэнс
LC Химия чайных флавоноидов. Crit Rev Food Sci Nutr 1997;37
(8)
693- 704PubMedGoogle ScholarCrossref
13.
Чанг ДжХХан ДжХХван ЭДж и другие. Двойные механизмы выживаемости клеток, индуцированной экстрактом зеленого чая (EGCG), в эпидермальных кератиноцитах человека. FASEB J 2003;17 (13) 1913- 1915PubMedGoogle Scholar
14.
Пианетти СГуо СКавана К.Цоненшейн Эпигаллокатехин-3-галлат полифенола зеленого чая ингибирует передачу сигналов Her-2/Neu, пролиферацию и трансформированный фенотип клеток рака молочной железы. Рак Рез 2002;62 (3) 652- 655PubMedGoogle Scholar
15.
Чжан
QTang
XLu
QZhang
ЗРао
JLe
AD Экстракт зеленого чая и (-)-эпигаллокатехин-3-галлат ингибируют индуцированное гипоксией и сывороткой накопление белка HIF-1alpha и экспрессию VEGF в клетках карциномы шейки матки и гепатомы человека. Мол Рак Тер 2006;5
(5)
1227- 1238PubMedGoogle ScholarCrossref
Мол Рак Тер 2006;5
(5)
1227- 1238PubMedGoogle ScholarCrossref
16.
Лю CMHong КИШун КТ и другие. Матриксная металлопротеиназа-1 и тканевой ингибитор экспрессии генов металлопротеиназы-1 и их дифференциальная регуляция провоспалительными цитокинами и простагландином в фибробластах полипов носа. Энн Отол Ринол Ларингол 2001;110 (12) 1129– 1136PubMedGoogle Scholar
17.
Линь СККок SHYeh FT и другие. MEK/ERK, преобразователь сигнала и активатор сигнальных путей транскрипции модулируют стимулированную онкостатином-М экспрессию CCL2 в остеобластах человека посредством общего транскрипционного фактора. Ревматоидный артрит 2004;50 (3) 785- 793PubMedGoogle ScholarCrossref
18.
Гонг Ягани FH Олигомицин ингибирует экспрессию HIF-1α в гипоксических опухолевых клетках. Am J Physiol Cell Physiol 2005; 288 (5) C1023- C1029PubMedGoogle ScholarCrossref
19.
Брукер ПУиццо НЖЧу CR Тоническая активация индуцируемого гипоксией фактора-1α в аваскулярном суставном хряще и значение для метаболического гомеостаза. Ревматоидный артрит 2005;52 (10) 3181- 3191PubMedGoogle ScholarCrossref
20.
Pham Ючида TP-плоскости С и другие. Гипоксия повышает экспрессию VEGF в клетках альвеолярного эпителия in vitro и in vivo. Am J Physiol Lung Cell Mol Physiol 2002;283 (5) L1133- L1142PubMedGoogle ScholarCrossref
21.
