Фаг | это… Что такое Фаг?
ТолкованиеПеревод
- Фаг
Бактериофа́ги (фаги) (от греч. φάγος — пожирать) — вирусы, избирательно поражающие бактериальные клетки. Чаще всего, бактериофаги размножаются внутри бактерий и вызывают их лизис. Как правило бактериофаг состоит из белковой оболочки и генетического материала — одноцепочечной или двуцепочечной РНК. Размер частиц приблизительно от 20 до 200 нанометров.
Содержание
- 1 История
- 2 Жизненный цикл вирулентных бактериофагов
- 3 Применение
- 3.1 В медицине
- 3.2 В биологии
- 4 Ссылки
История
Предположение, что бактериофаги имеют корпускулярную природу, было выдвинуто еще Ф. д’Эрелем. Однако, только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов.

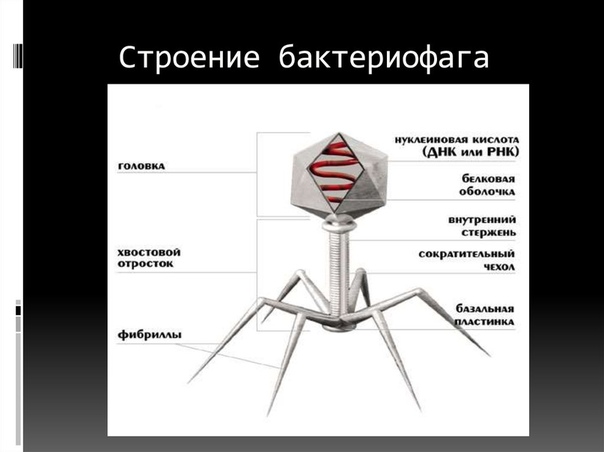
1 — головка, 2— хвост, 3 — нуклеиновая кислота, 4 — капсид, 5 —»воротничок», 6 — белковый чехол хвоста, 7— фибрилла хвоста, 8 — шипы, 9 — базальная пластинка
Жизненный цикл вирулентных бактериофагов
- Фаг приближается к бактерии, и хвостовые нити связываются с рецепторными участками на поверхности бактериальной клетки.
- Хвостовые нити изгибаются и «заякоривают» шипы и базальную пластинку на поверхности клетки; хвостовой чехол сокращается, заставляя полый стержень входить в клетку; этому способствует фермент лизоцим, который находится в базальной пластинке; таким образом нуклеиновая кислота (ДНК или РНК) вводится внутрь клетки.

- Нуклеиновая кислота фага кодирует синтез ферментов фага, используя для этого белоксинтезирующий аппарат хозяина.
- Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага подчиняет себе клеточный аппарат.
- Нуклеиновая кислота фага реплицируется и кодирует синтез новых белков оболочки.
- Новые частицы фага, образовавшиеся в результате спонтаной самосборки белковой оболочки вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим.
- Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200-1000 новых фагов; фаги инфицируют другие бактерии.
- Стадии 1-7 по времени занимают около 30 минут; этот период называется латентным периодом.
Применение
В медицине
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие.

Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
В биологии
Бактериофаги M13, T4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.
Ссылки
- Краткая медицинская энциклопедия
Wikimedia Foundation. 2010.
Игры ⚽ Нужно сделать НИР?
Синонимы:бактериофаг, вирус
- Фаг ламбда
- Фаггот
Полезное
Фаг | это… Что такое Фаг?
ТолкованиеПеревод
- Фаг
Бактериофа́ги (фаги) (от греч. φάγος — пожирать) — вирусы, избирательно поражающие бактериальные клетки.
 Чаще всего, бактериофаги размножаются внутри бактерий и вызывают их лизис. Как правило бактериофаг состоит из белковой оболочки и генетического материала — одноцепочечной или двуцепочечной РНК. Размер частиц приблизительно от 20 до 200 нанометров.
Чаще всего, бактериофаги размножаются внутри бактерий и вызывают их лизис. Как правило бактериофаг состоит из белковой оболочки и генетического материала — одноцепочечной или двуцепочечной РНК. Размер частиц приблизительно от 20 до 200 нанометров.Содержание
- 1 История
- 2 Жизненный цикл вирулентных бактериофагов
- 3 Применение
- 3.1 В медицине
- 3.2 В биологии
- 4 Ссылки
История
Предположение, что бактериофаги имеют корпускулярную природу, было выдвинуто еще Ф. д’Эрелем. Однако, только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представление о морфологии и основные особенности фагов основывались на результатах изучения фагов Т-группы — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма В. Однако, с каждым годом появлялись новые данные касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.

1 — головка, 2— хвост, 3 — нуклеиновая кислота, 4 — капсид, 5 —»воротничок», 6 — белковый чехол хвоста, 7— фибрилла хвоста, 8 — шипы, 9 — базальная пластинка
Жизненный цикл вирулентных бактериофагов
- Фаг приближается к бактерии, и хвостовые нити связываются с рецепторными участками на поверхности бактериальной клетки.
- Хвостовые нити изгибаются и «заякоривают» шипы и базальную пластинку на поверхности клетки; хвостовой чехол сокращается, заставляя полый стержень входить в клетку; этому способствует фермент лизоцим, который находится в базальной пластинке; таким образом нуклеиновая кислота (ДНК или РНК) вводится внутрь клетки.
- Нуклеиновая кислота фага кодирует синтез ферментов фага, используя для этого белоксинтезирующий аппарат хозяина.
- Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага подчиняет себе клеточный аппарат.
- Нуклеиновая кислота фага реплицируется и кодирует синтез новых белков оболочки.

- Новые частицы фага, образовавшиеся в результате спонтаной самосборки белковой оболочки вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим.
- Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200-1000 новых фагов; фаги инфицируют другие бактерии.
- Стадии 1-7 по времени занимают около 30 минут; этот период называется латентным периодом.
Применение
В медицине
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие.
Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
В биологии
Бактериофаги M13, T4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.

Ссылки
- Краткая медицинская энциклопедия
Wikimedia Foundation. 2010.
Игры ⚽ Нужно сделать НИР?
бактериофаг, вирус
- Фаг ламбда
- Фаггот
Полезное
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе и организацияхПоследнее обновление: 26 сентября 2022 г.
Введение
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6]. Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить как генерализованным, так и специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми. На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].
Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9]. ]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0034 [11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм может быть идентифицирован по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм может быть идентифицирован по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Несмотря на то, что бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Несмотря на то, что бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303. [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями.
 Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 2018 Feb 13;9(1) [PMC бесплатная статья: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт. Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Бесплатная статья PMC: PMC5319590] [PubMed: 28232776]
- 9.

Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный приложение? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК. Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 29050666]
- 13.

Fortier LC. Бактериофаги способствуют формированию видов Clostridioides (Clostridium) difficile . Фронт микробиол. 2018;9:2033. [Бесплатная статья PMC: PMC6127314] [PubMed: 30233520]
- 14.
Doore SM, Schrad JR, Dean WF, Dover JA, Parent KN. Фаги шигелл, выделенные во время вспышки дизентерии, обнаруживают необычные структуры и широкое видовое разнообразие. Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]
- 15.
Motlagh AM, Bhattacharjee AS, Goel R. Контроль биопленки с помощью природных и генетически модифицированных фагов. World J Microbiol Biotechnol. 2016 апр;32(4):67. [PubMed: 26931607]
- 16.
Schofield DA, Sharp NJ, Westwater C. Фаговые платформы для клинического обнаружения бактериальных патогенов человека. Бактериофаг. 2012 01 апреля; 2(2):105-283. [Бесплатная статья PMC: PMC3442824] [PubMed: 23050221]
- 17.
Wiśniewska K, Szewczyk A, Piechowicz L, Bronk M, Samet A, Swieć K.
 Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]
Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе и организацияхПоследнее обновление: 26 сентября 2022 г.
Введение
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина.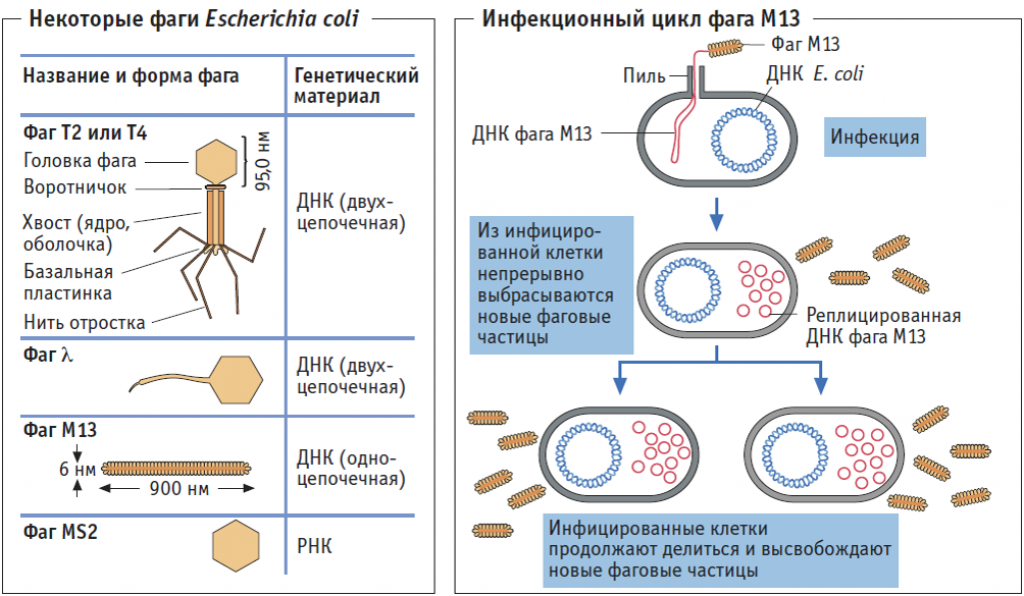 В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6]. Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить как генерализованным, так и специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми. На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].
Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9]. ]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0034 [11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм может быть идентифицирован по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм может быть идентифицирован по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Несмотря на то, что бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Несмотря на то, что бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303. [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями.
 Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 2018 Feb 13;9(1) [PMC бесплатная статья: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт. Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Бесплатная статья PMC: PMC5319590] [PubMed: 28232776]
- 9.

Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный приложение? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК. Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 29050666]
- 13.


