Ученые обнаружили интересные белки в геноме гигантского фага
Ученые из России и США изучили геном и провели протеомный анализ гигантского бактериофага AR9, заражающего бактерию Bacillus subtilis. Они продемонстрировали, что в геноме этого бактериофага закодированы необычные белки, родственные ферментам РНК-полимеразам клеточных организмов (бактерий, растений и животных).
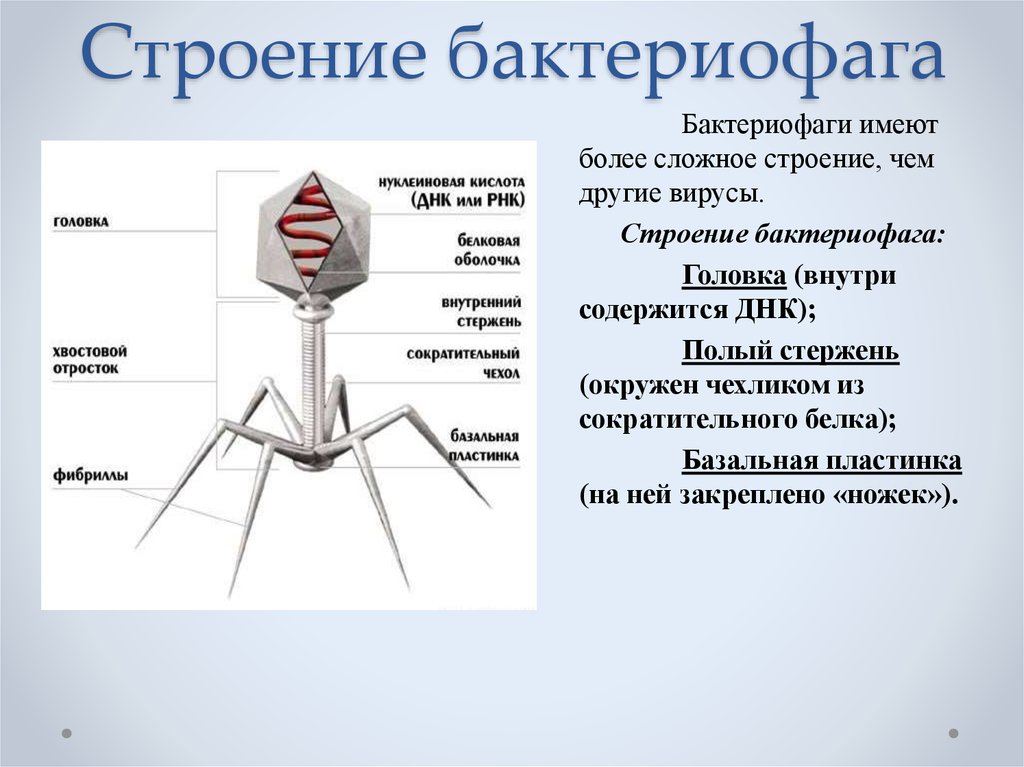
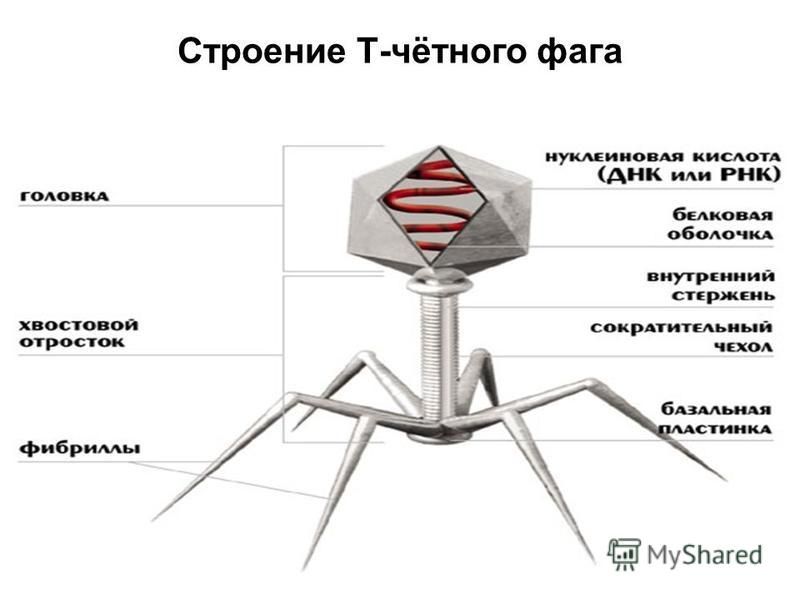
Бактериофаги или просто фаги – это вирусы, которые заражают бактерий. Фаги состоят из белков, образующих прочную капсулу, внутри которой хранится их генетическая информация в виде ДНК или РНК. Размножаются фаги внутри бактерий после того, как впрыскивают свой геном внутрь бактериальных клеток.
Количество фагов на нашей планете огромно и они представляют собой неиссякаемый источник различных ферментов, которые используются в биотехнологии. Зараженная фагами клетка погибает, а, фактически, умирает под действием белков фага (Рис. 1.). Поэтому, на основе многих белков фагов можно создавать новые антибиотики. Изучение фагов также сыграло центральную роль при формулировании «центральной догмы молекулярной биологии», которая описывает, каким образом осуществляется работа генов. Первым шагом реализации информации, закодированной в геноме каждого организма, является транскрипция, другими словами – чтение ДНК генов ферментом РНК-полимеразой. Все живые организмы, в том числе и бактериофаги, должны “читать свои гены”, однако, обычно фаги используют для этого РНК-полимеразу той бактерии, в которой они размножаются. Ученые из России показали, что бактериофаг AR9 уникален, так как использует только свои собственные уникальные РНК-полимеразы. Таким образом, развитие вируса протекает практически независимо от клетки-хозяина.
Изучение фагов также сыграло центральную роль при формулировании «центральной догмы молекулярной биологии», которая описывает, каким образом осуществляется работа генов. Первым шагом реализации информации, закодированной в геноме каждого организма, является транскрипция, другими словами – чтение ДНК генов ферментом РНК-полимеразой. Все живые организмы, в том числе и бактериофаги, должны “читать свои гены”, однако, обычно фаги используют для этого РНК-полимеразу той бактерии, в которой они размножаются. Ученые из России показали, что бактериофаг AR9 уникален, так как использует только свои собственные уникальные РНК-полимеразы. Таким образом, развитие вируса протекает практически независимо от клетки-хозяина.
Рис.1. Чашка Петри, заселенная бактериями Bacillus subtilis. Пятна – это зоны, в которых бактериофаг AR9 убил бактерий.
Мария Соколова, автор исследования и аспирантка в исследовательской группе Константина Северинова в Сколтехе рассказала о будущих направлениях работ в лаборатории “Гены, кодирующие РНК-полимеразы AR9, по-видимому, когда-то давно были захвачены у бактерий. Сейчас мы изучаем бихимический механизм работы одной из этих РНК-полимераз. Оказалось, что этот фермент по ряду признаков действительно принципиально отличается от РНК-полимераз клеточных организмов: бактерий, людей и т.д. Мы работаем над тем, чтобы определить структуру этого необычного фермента методами рентгеноструктурного анализа и крио-электронной микроскопии. Разрешение структуры (получение трехмерной молекулярной модели фермента) станет замечательным достижением нашего исследования и ответит на многие вопросы о механизме транскрипции и о происхождении необычных полимераз AR9” – говорит Мария.
Сейчас мы изучаем бихимический механизм работы одной из этих РНК-полимераз. Оказалось, что этот фермент по ряду признаков действительно принципиально отличается от РНК-полимераз клеточных организмов: бактерий, людей и т.д. Мы работаем над тем, чтобы определить структуру этого необычного фермента методами рентгеноструктурного анализа и крио-электронной микроскопии. Разрешение структуры (получение трехмерной молекулярной модели фермента) станет замечательным достижением нашего исследования и ответит на многие вопросы о механизме транскрипции и о происхождении необычных полимераз AR9” – говорит Мария.
Результаты работы опубликованы в журнале Virology .
* Сколковский институт науки и технологий (Сколтех) – негосударственное научно-образовательное учреждение в Сколково (Россия, Московская область). Созданный в 2011 году при участии Массачусетского технологического института (МТИ), институт готовит новые поколения исследователей и предпринимателей, развивает научные знания и содействует технологическим инновациям с целью решения важнейших проблем, стоящих перед Россией и миром в новом тысячелетии.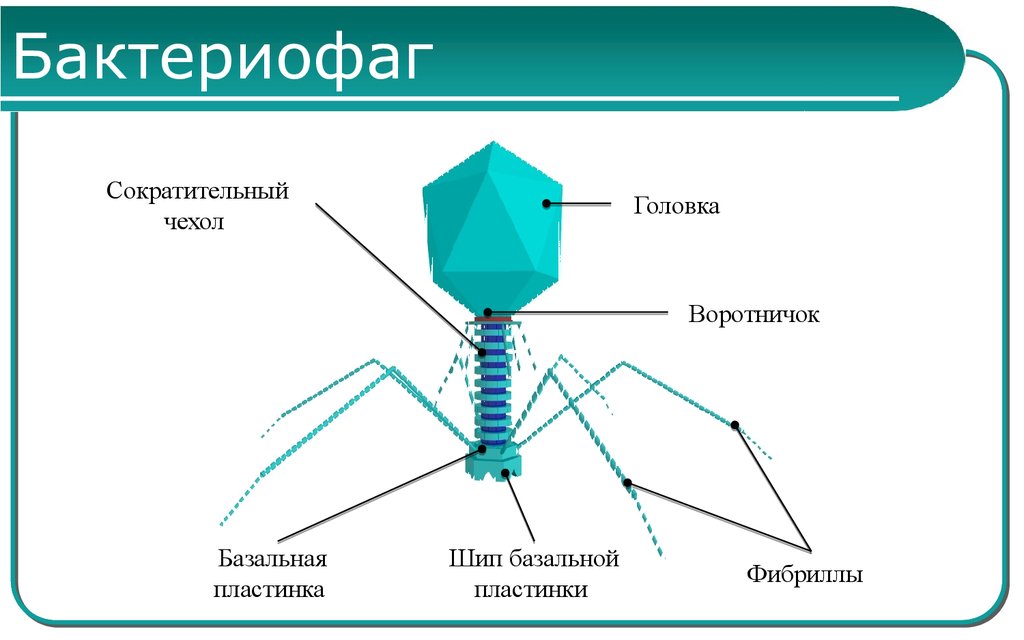 Сколтех строит свою работу, опираясь на опыт лучших российских и международных образовательных и исследовательских институтов. При этом особый акцент делается на преподавание навыков предпринимательской и инновационной деятельности.
Сколтех строит свою работу, опираясь на опыт лучших российских и международных образовательных и исследовательских институтов. При этом особый акцент делается на преподавание навыков предпринимательской и инновационной деятельности.
Контакты:
Skoltech Communications
+7 (495) 280 14 81
*protected email*
*protected email*
Бактериофаги в ассортименте аптеки
Если имеется крупная колония бактерий, где своих жертв найдут и следующие поколения фагов, то уничтожение бактерий литическими (убивающими, дословно — растворяющими) фагами идет быстро и непрерывно. Если потенциальных жертв мало или внешние условия не слишком подходят для эффективного размножения фагов, то преимущество получают фаги с лизогенным циклом развития. В этом случае после внедрения внутрь бактерии ДНК фага не сразу запускает механизм инфекции, а до поры до времени существует внутри клетки в пассивном состоянии, часто внедряясь в бактериальный геном.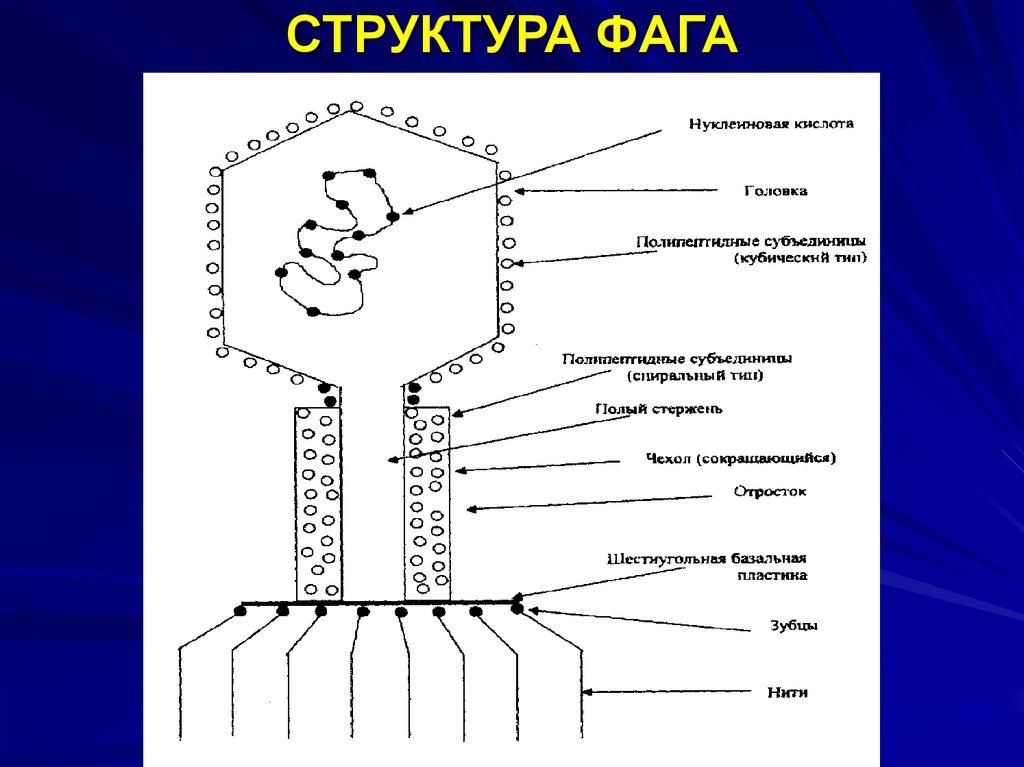 В таком состоянии профага вирус может существовать долго, проходя вместе с хромосомой бактерии циклы деления клетки. И лишь, когда бактерия попадает в благоприятную для размножения среду, активируется литический цикл инфекции. При этом, когда ДНК фага освобождается из бактериальной хромосомы, часто захватываются и соседние участки бактериального генома, а их содержимое в дальнейшем может перенестись в следующую бактерию, которую заразит бактериофаг. Этот процесс (трансдукция генов) считается важнейшим средством переноса информации между прокариотами — организмами без клеточных ядер.
В таком состоянии профага вирус может существовать долго, проходя вместе с хромосомой бактерии циклы деления клетки. И лишь, когда бактерия попадает в благоприятную для размножения среду, активируется литический цикл инфекции. При этом, когда ДНК фага освобождается из бактериальной хромосомы, часто захватываются и соседние участки бактериального генома, а их содержимое в дальнейшем может перенестись в следующую бактерию, которую заразит бактериофаг. Этот процесс (трансдукция генов) считается важнейшим средством переноса информации между прокариотами — организмами без клеточных ядер.
ПРИМЕНЕНИЕ БАКТЕРИОФАГОВ В МЕДИЦИНЕ
Исторически сложилось, что СССР занимал лидирующие позиции в области производства и применения лечебно-профилактических бактериофагов. Применение бактериофагов при лечении инфекционных заболеваний началось почти сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
Столетняя история фаготерапии бактериальных инфекций такова, что основные клинические испытания были проведены задолго до разработки надежной экспериментальной модели инфекционной патологии на лабораторных животных и внедрения в медицинскую практику для вновь регистрируемых лекарственных средств высоких стандартов двойного слепого плацебо-контролируемого исследование. С появлением антибиотиков интерес к фагам был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и вновь проводить их испытания. Этому способствует и развитие новых представлений в конце ХХ — начале ХХI в. как о молекулярной биологии, так и об экологических взаимоотношениях бактериофагов и их хозяев.
С появлением антибиотиков интерес к фагам был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и вновь проводить их испытания. Этому способствует и развитие новых представлений в конце ХХ — начале ХХI в. как о молекулярной биологии, так и об экологических взаимоотношениях бактериофагов и их хозяев.
Сейчас бактериофаги в медицинской практике применяется в диагностике, лечении и профилактике инфекционных заболеваний.
Фагодиагностика (фагоиндикация) – выделение бактериофагов из организма больного и объектов внешней среды (что косвенно свидетельствует о наличии в материале соответствующих бактерий). В процессе диагностики важно проводить фагоидентификацию, которая включает в себя:
— фагодифференцировку — установление вида (идентификация) бактерий по их чувствительности к известному фагу;
— фаготипирование – установление типа — внутривидовое типирование бактерий по их чувствительности к типовым бактериофагам (важно для эпидемиологического анализа заболевания – установление источника и путей распространения заболевания).
Фаготерапия – применение бактериофагов с целью лечения инфекционных заболеваний (например, пиобактериофаг, дизентирийный и синегнойный бактериофаги).
Фагопрофилактика – применение бактериофагов с целью предупреждения заболеваний в эпидемическом очаге (например, дизентерийный, сальмонеллезный и стафилококковый бактериофаги). В настоящее время фаги применяются для экстренной профилактики брюшного тифа и дизентерии. Под экстренной профилактикой понимается комплекс мероприятий для предотвращения развития болезни до и/или непосредственно после процесса инфицирования.
Достоинств у бактериофагов как потенциальных лекарств множество, но и недостатков не мало. К несомненным достоинствам относится, во-первых, их большое количество, на фоне этого всегда можно подобрать подходящий бактериофаг. Во‑вторых, бактериофаги строго специфичны, то есть они уничтожают только определенный вид микробов, не угнетая при этом нормальную микрофлору человека.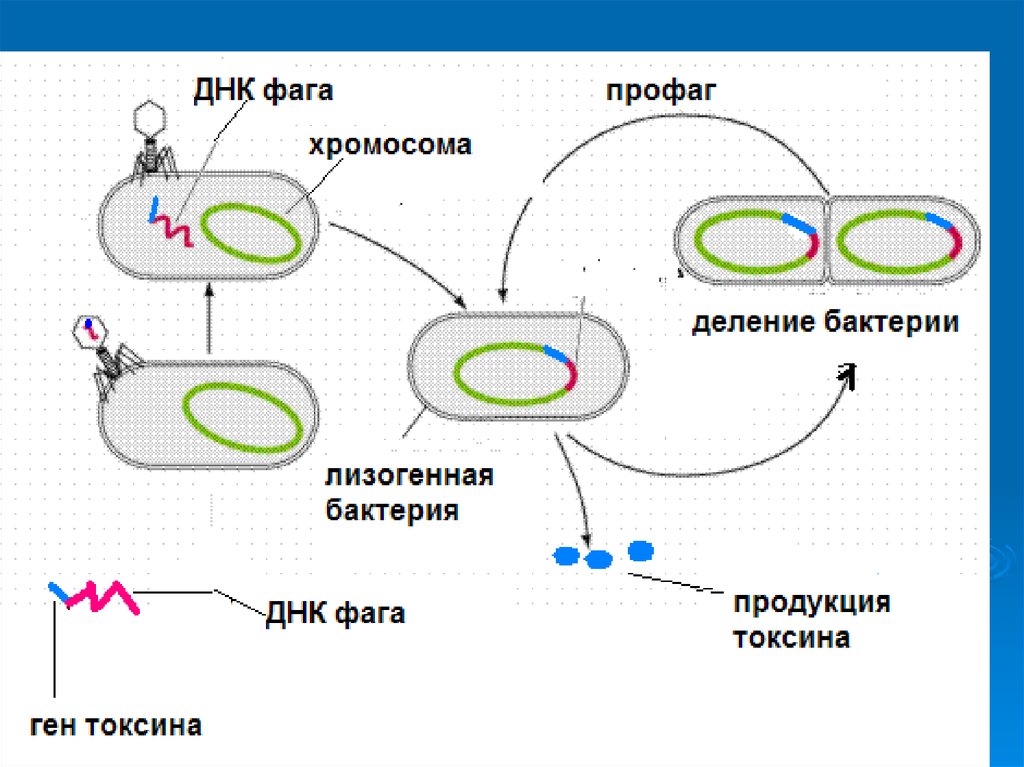 В-третьих, когда бактериофаг находит бактерию, которую должен уничтожить, он в процессе своего жизненного цикла начинает размножаться. Таким образом, не столь острым становится вопрос дозировки. В-четвертых, бактериофаги не вызывают побочных эффектов. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий.
В-третьих, когда бактериофаг находит бактерию, которую должен уничтожить, он в процессе своего жизненного цикла начинает размножаться. Таким образом, не столь острым становится вопрос дозировки. В-четвертых, бактериофаги не вызывают побочных эффектов. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий.
Проблемы применения бактериофагов проистекают из их достоинств. Прежде всего высокая специфичность бактериофагов требует точной диагностики патогенного микроба вплоть до штамма. Например, препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерово, так как болезнь могут вызывать разные штаммы бактерий. Фагодиагностика с использованием быстрых методов типирования внедряется медленно из-за дороговизны аппаратуры. В идеальных условиях терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная отечественная медицина практически не готова.
В идеальных условиях терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная отечественная медицина практически не готова.
Другой важный недостаток фагов — их биологическая природа. Кроме того, что бактериофаги для поддержания жизнеспособности требуют особых условий хранения и транспортировки, такой метод лечения открывает простор для множества спекуляций на тему «посторонней ДНК в человеке». И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто. Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение — проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, — на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника — то проблем не возникает.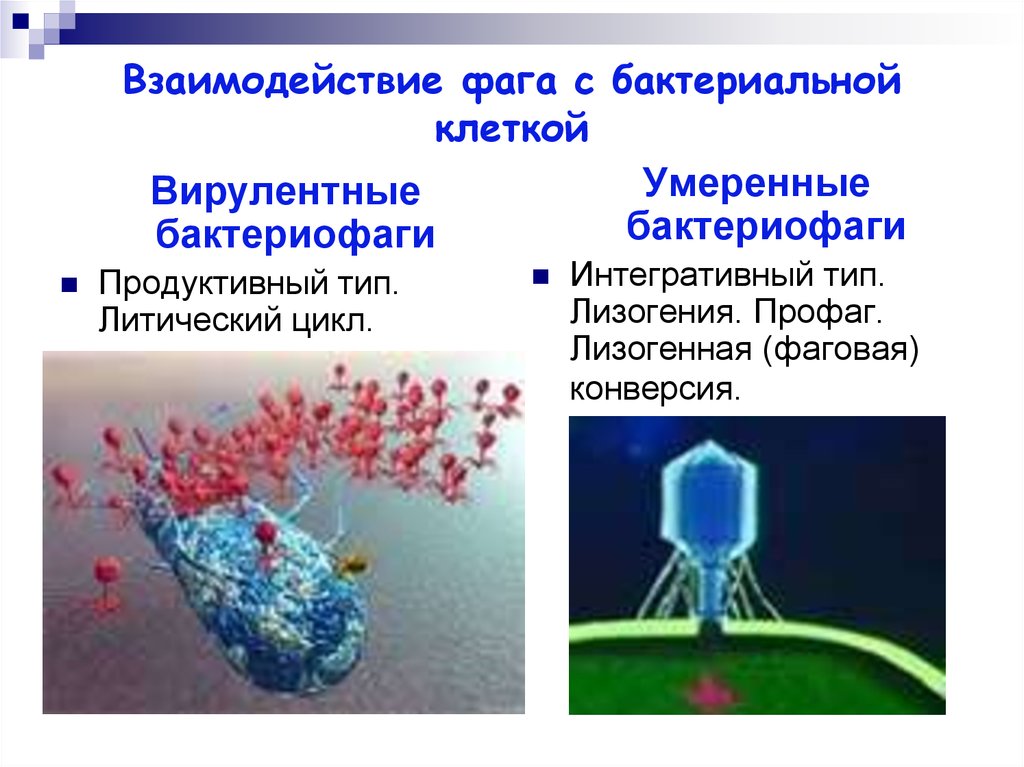 Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги бессильны и против тех микробов, которые развиваются внутри клеток, например, возбудителей туберкулеза и проказы. Через стенку человеческой клетки бактериофаг пробраться не может.
Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги бессильны и против тех микробов, которые развиваются внутри клеток, например, возбудителей туберкулеза и проказы. Через стенку человеческой клетки бактериофаг пробраться не может.
Сравнительные возможности терапии фагами и антибиотиками представлены в таблице ниже.
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе и организациях
Последнее обновление: 26 сентября 2022 г.
Введение
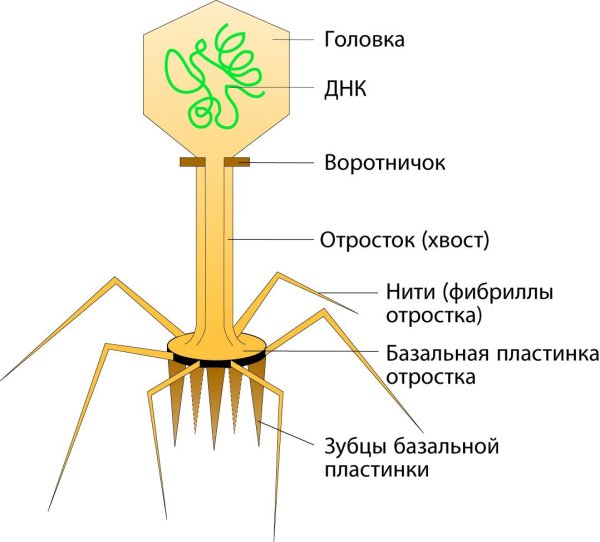
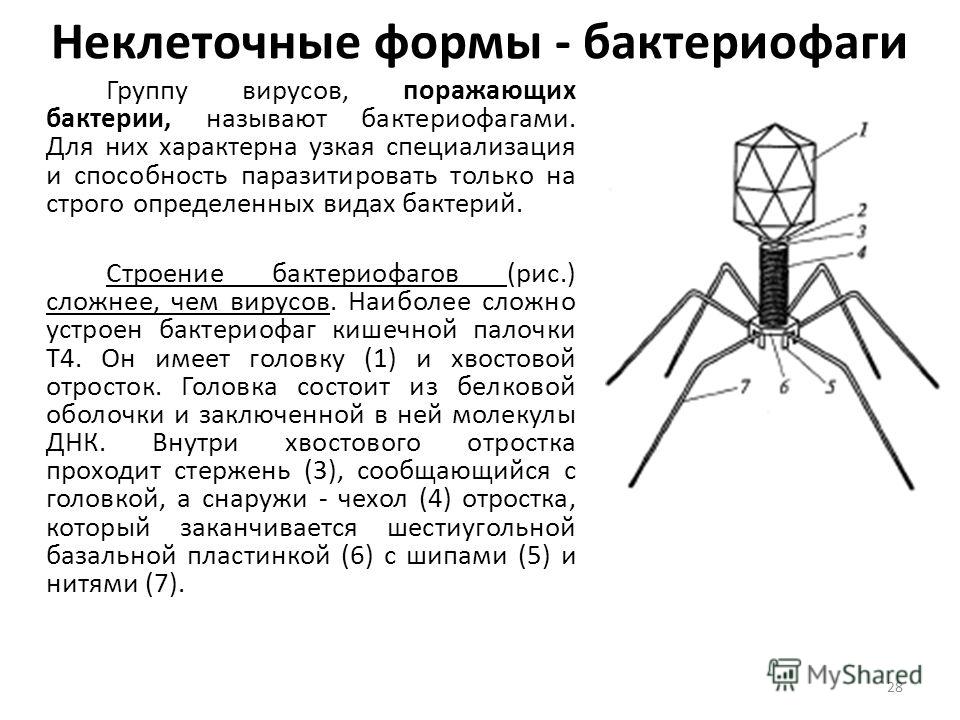
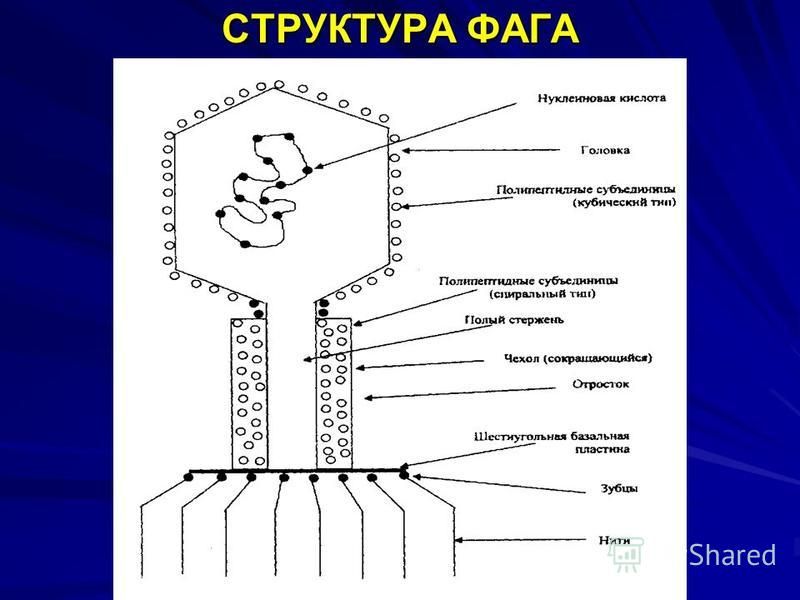
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках.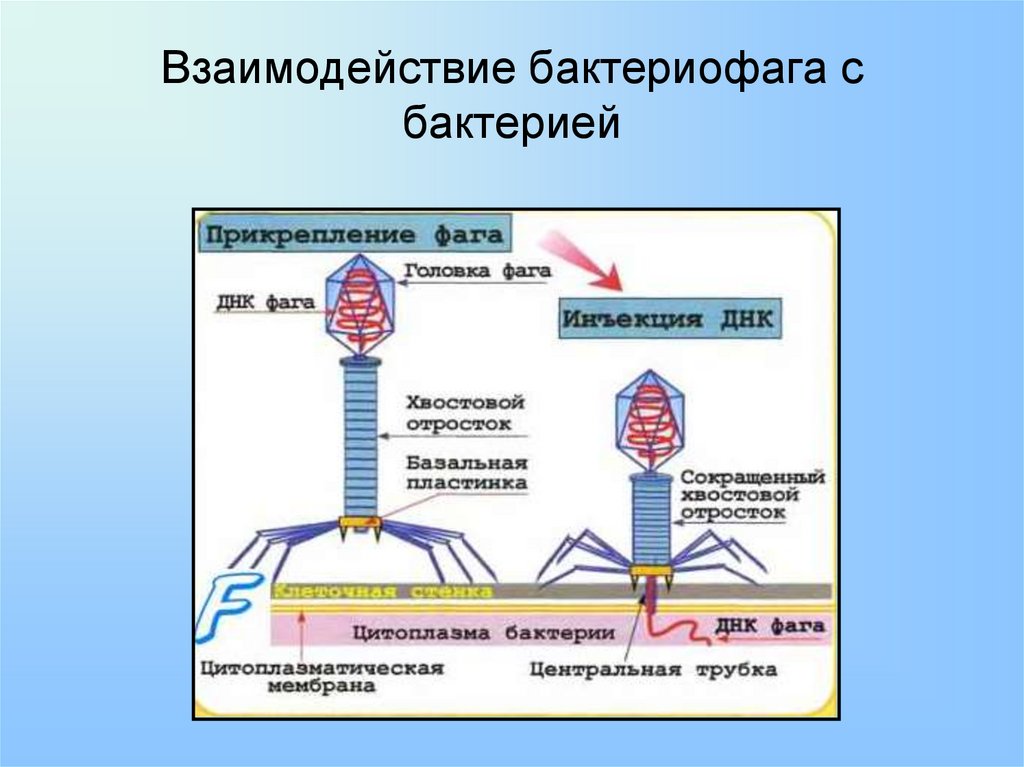 Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков.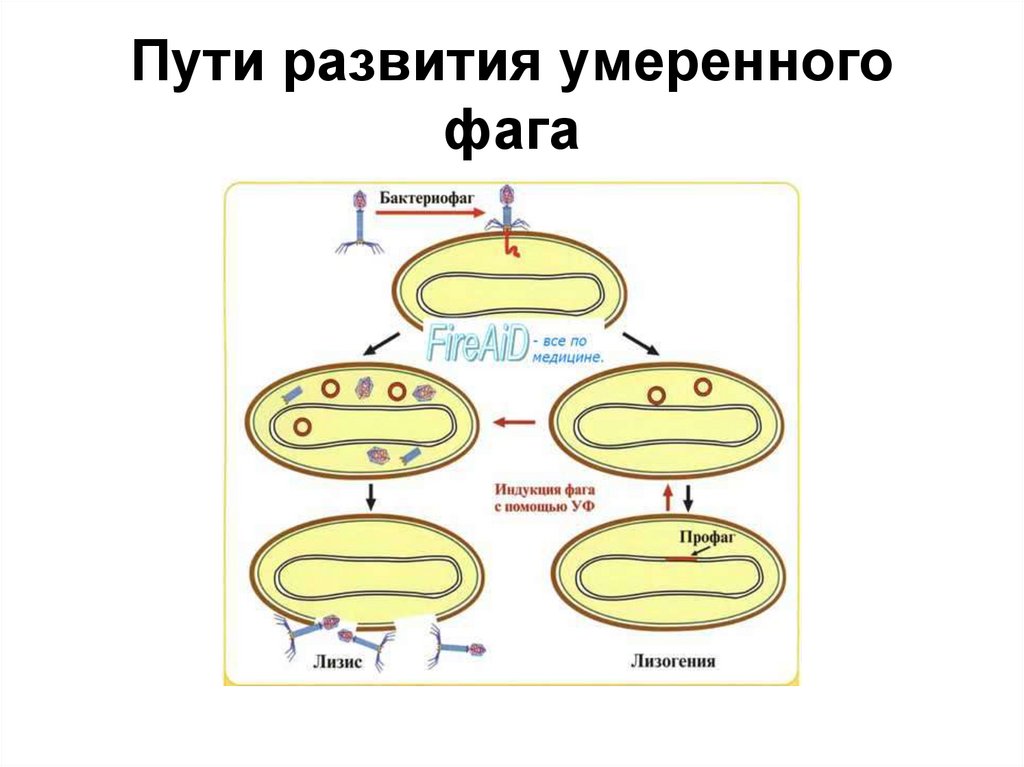 Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6].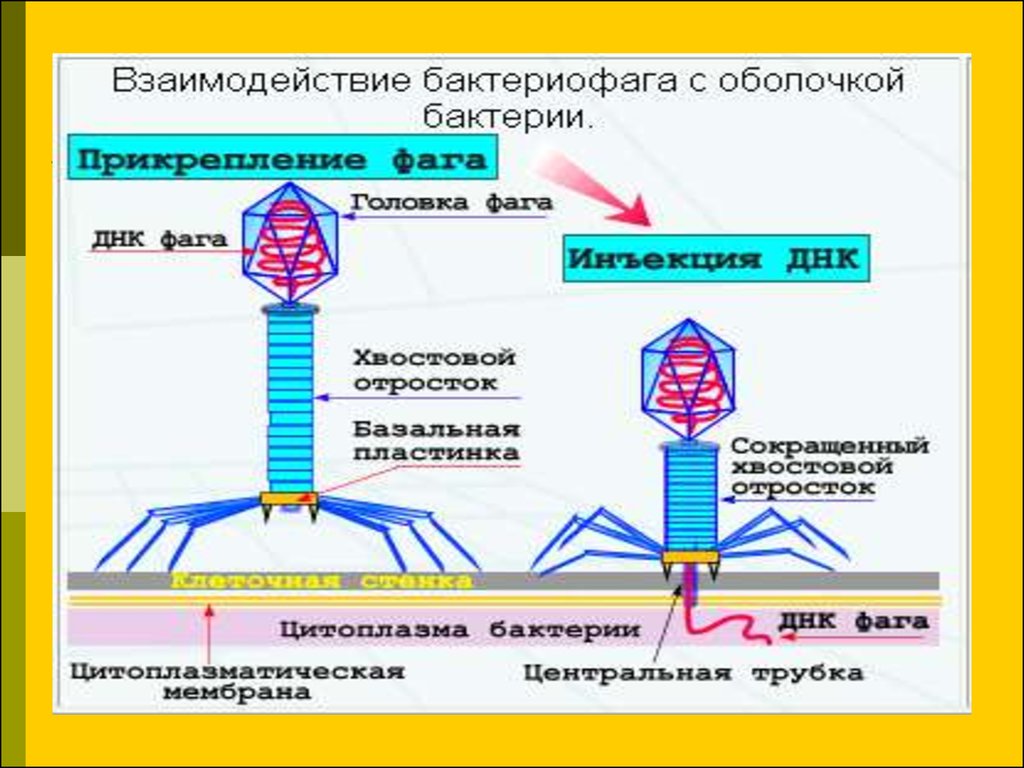 Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми.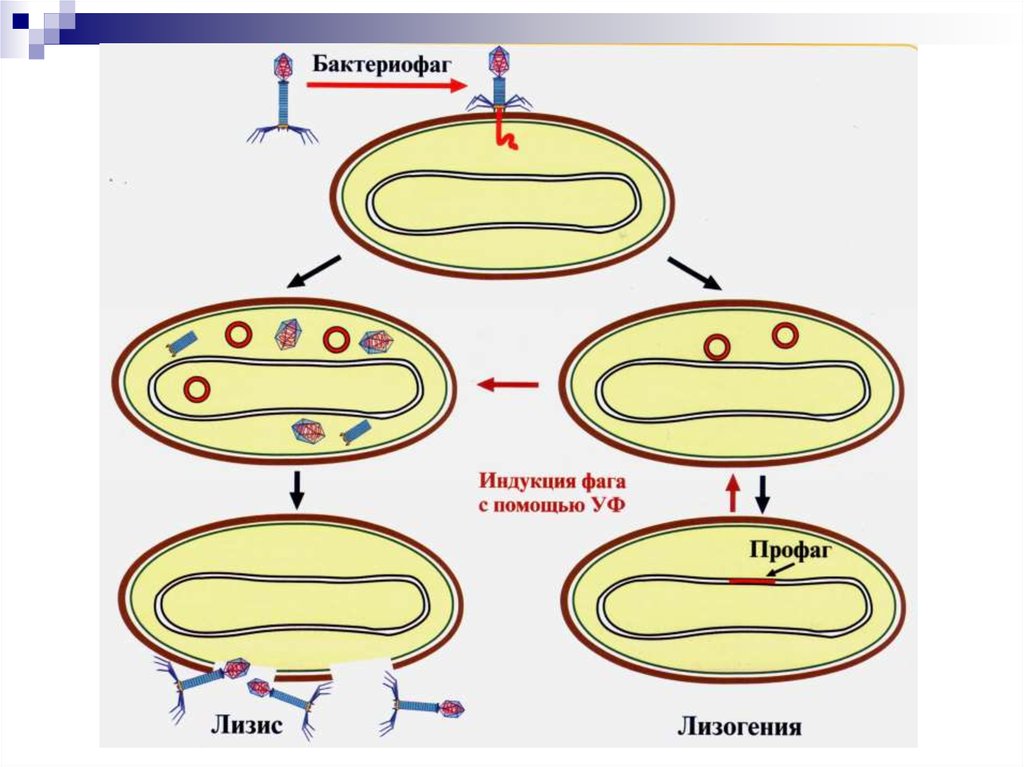 На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли.
На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли.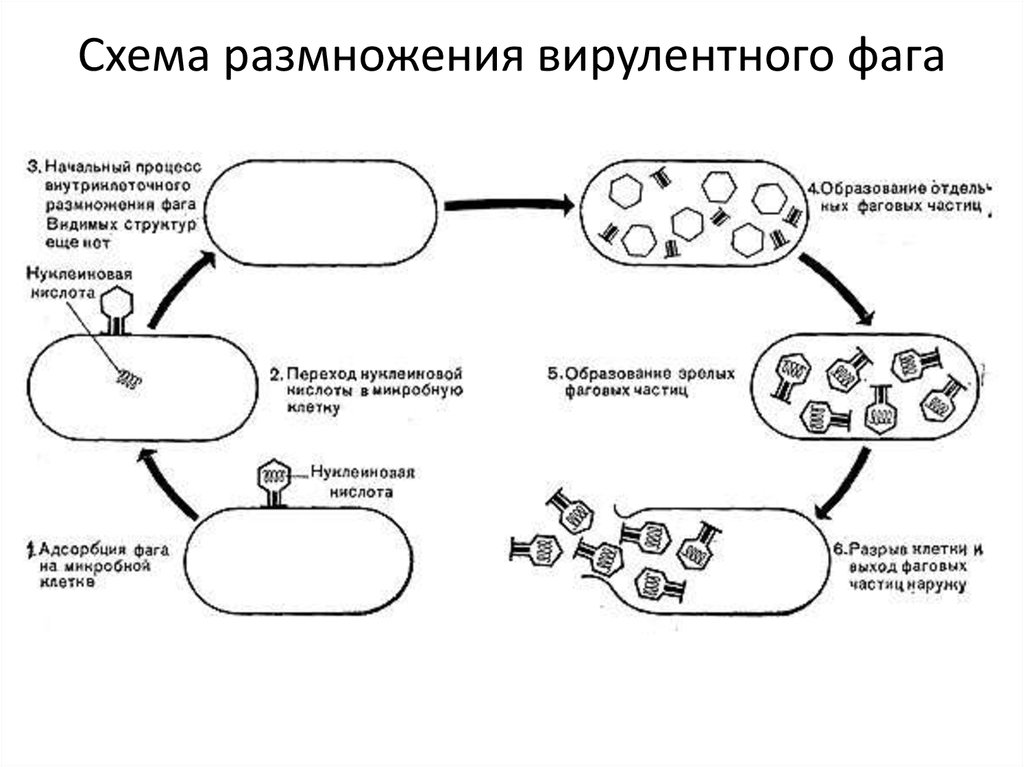 Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0034 [11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны.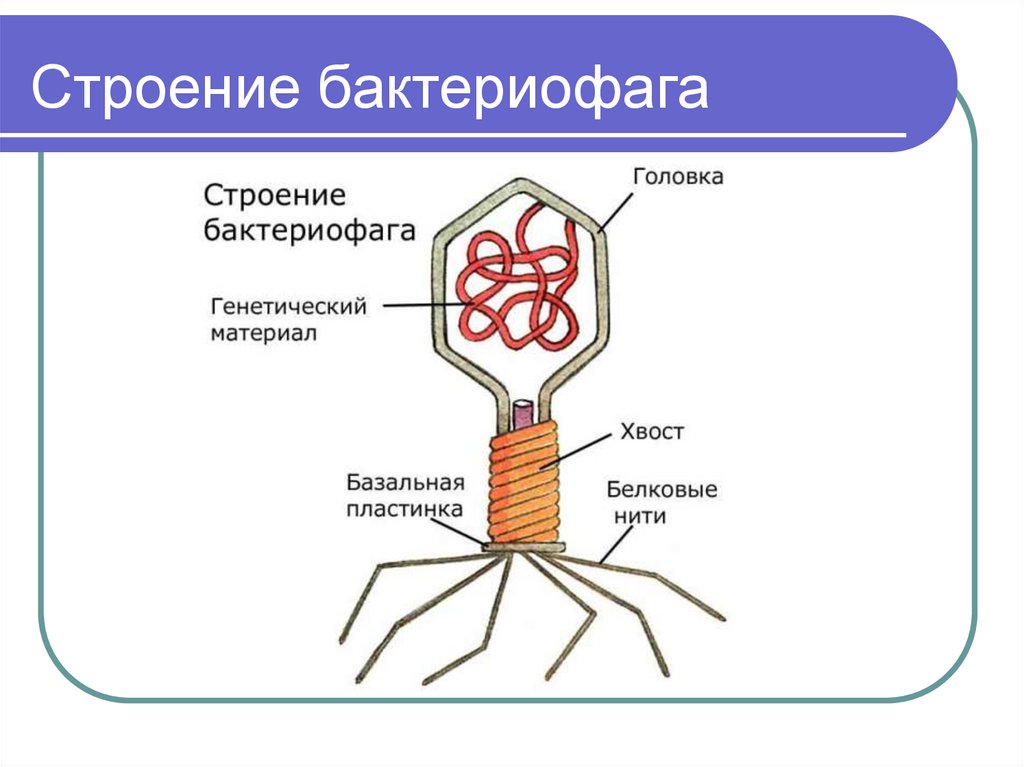 Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].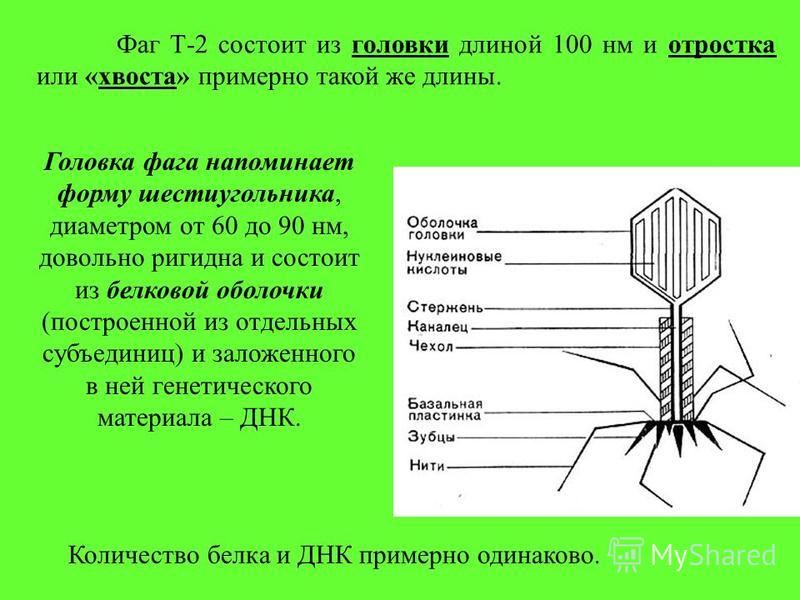
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование

Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303.
 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями. Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 2018 Feb 13;9(1) [PMC бесплатная статья: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт. Клеточный микроб-хозяин.
 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Бесплатная статья PMC: PMC5319590] [PubMed: 28232776]
- 9.
Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный приложение? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК. Биология и молекулярная эпидемиология дифтерийного токсина и гена tox.
 J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 29050666]
- 13.
Fortier LC. Бактериофаги способствуют формированию видов Clostridioides (Clostridium) difficile . Фронт микробиол. 2018;9:2033. [Бесплатная статья PMC: PMC6127314] [PubMed: 30233520]
- 14.
Doore SM, Schrad JR, Dean WF, Dover JA, Parent KN. Фаги шигелл, выделенные во время вспышки дизентерии, обнаруживают необычные структуры и широкое видовое разнообразие. Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]
- 15.
Motlagh AM, Bhattacharjee AS, Goel R. Контроль биопленки с помощью природных и генетически модифицированных фагов. World J Microbiol Biotechnol. 2016 апр;32(4):67. [PubMed: 26931607]
- 16.

Schofield DA, Sharp NJ, Westwater C. Платформы на основе фагов для клинического обнаружения бактериальных патогенов человека. Бактериофаг. 2012 01 апреля; 2(2):105-283. [Бесплатная статья PMC: PMC3442824] [PubMed: 23050221]
- 17.
Wiśniewska K, Szewczyk A, Piechowicz L, Bronk M, Samet A, Swieć K. Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе и организациях
Последнее обновление: 26 сентября 2022 г.
Введение
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках.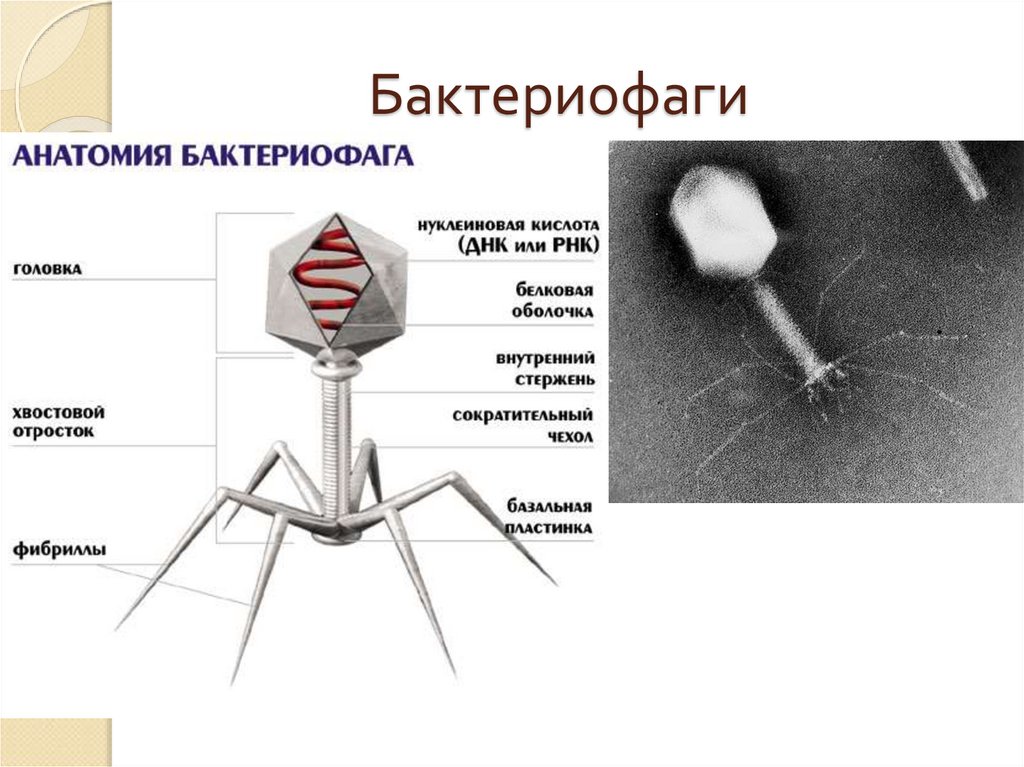 Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков.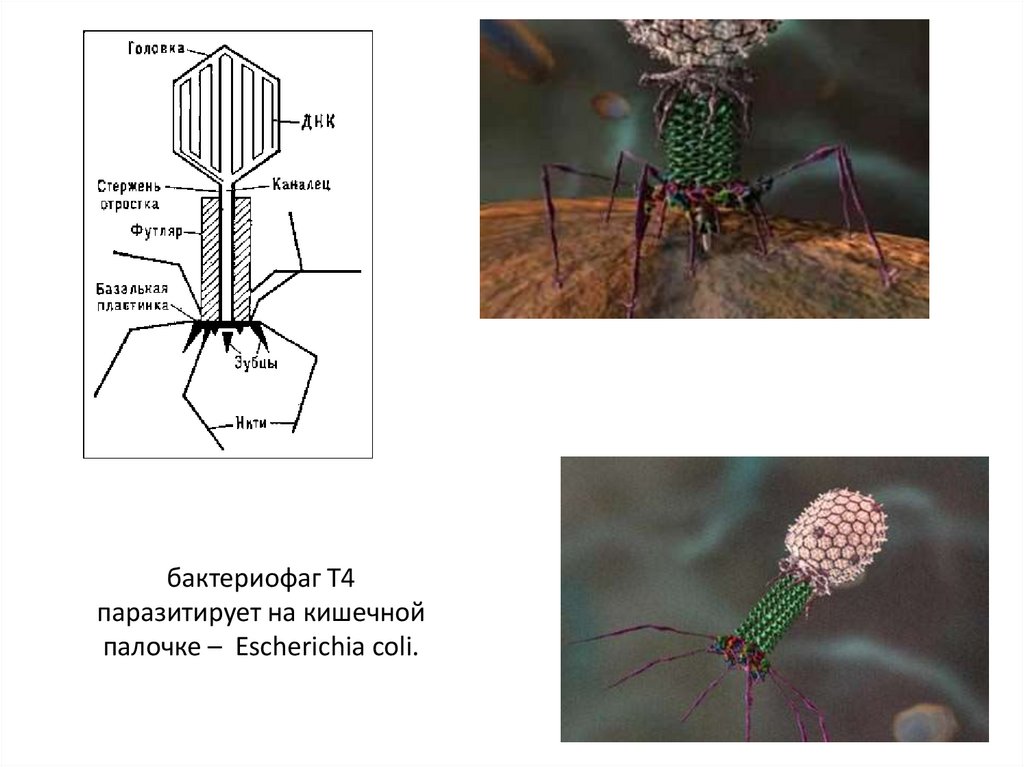 Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6].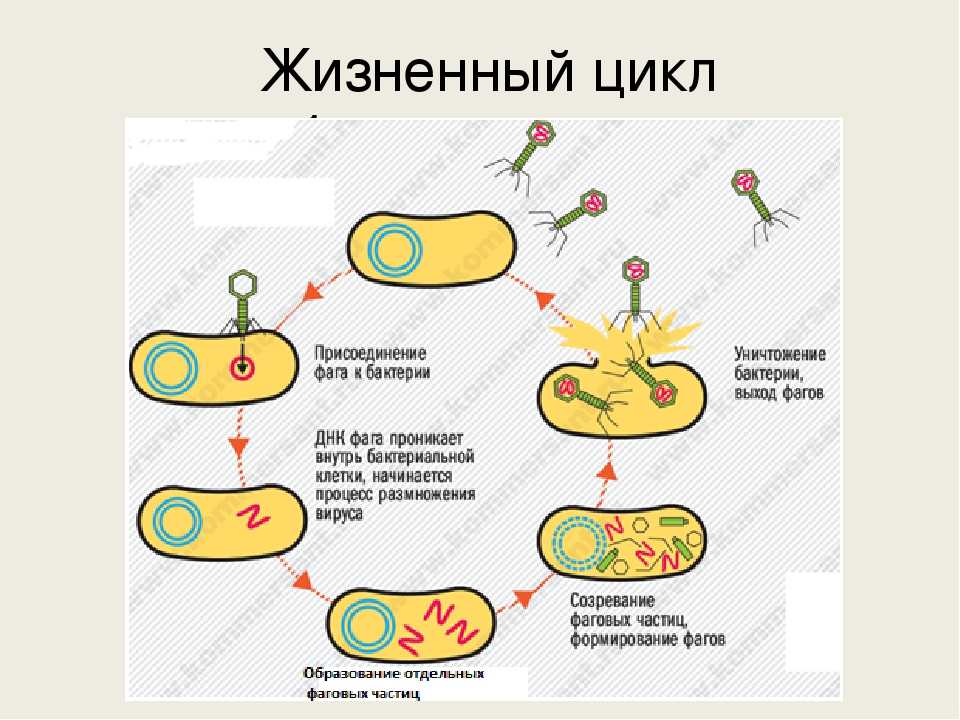 Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми.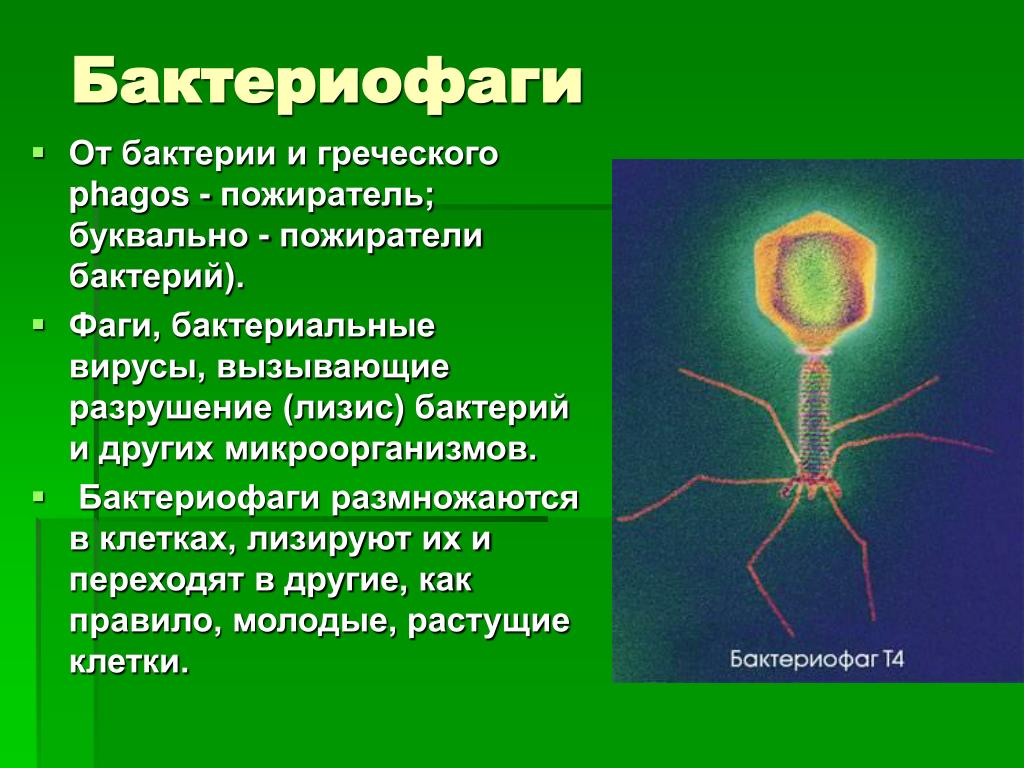 На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли.
На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0034 [11] , ботулинический нейротоксин в Clostridium botulinum
 Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].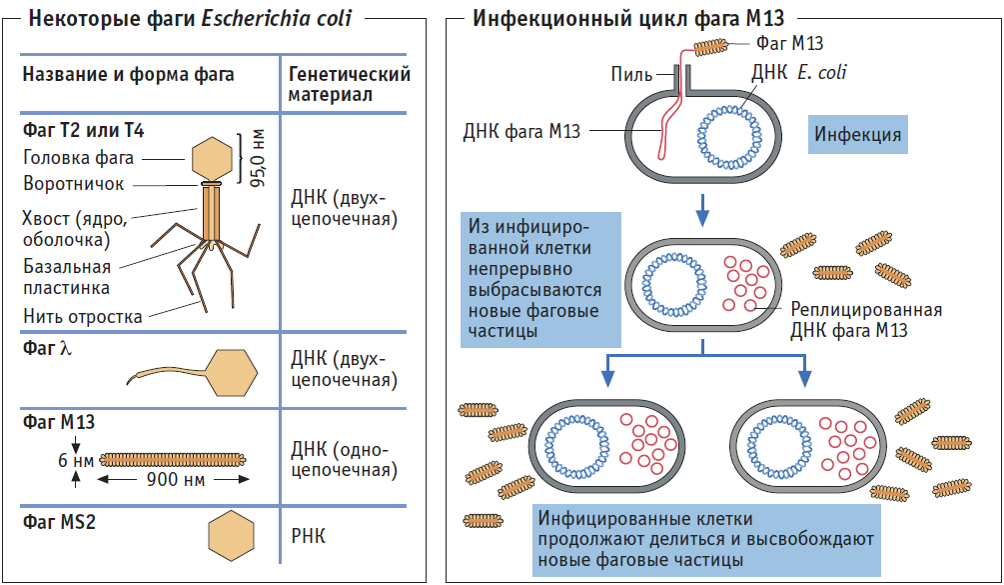
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303.
 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями. Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 2018 Feb 13;9(1) [PMC бесплатная статья: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт. Клеточный микроб-хозяин.
 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Бесплатная статья PMC: PMC5319590] [PubMed: 28232776]
- 9.
Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный приложение? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК. Биология и молекулярная эпидемиология дифтерийного токсина и гена tox.
 J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 29050666]
- 13.
Fortier LC. Бактериофаги способствуют формированию видов Clostridioides (Clostridium) difficile . Фронт микробиол. 2018;9:2033. [Бесплатная статья PMC: PMC6127314] [PubMed: 30233520]
- 14.
Doore SM, Schrad JR, Dean WF, Dover JA, Parent KN. Фаги шигелл, выделенные во время вспышки дизентерии, обнаруживают необычные структуры и широкое видовое разнообразие. Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]
- 15.
Motlagh AM, Bhattacharjee AS, Goel R. Контроль биопленки с помощью природных и генетически модифицированных фагов. World J Microbiol Biotechnol. 2016 апр;32(4):67. [PubMed: 26931607]
- 16.


 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]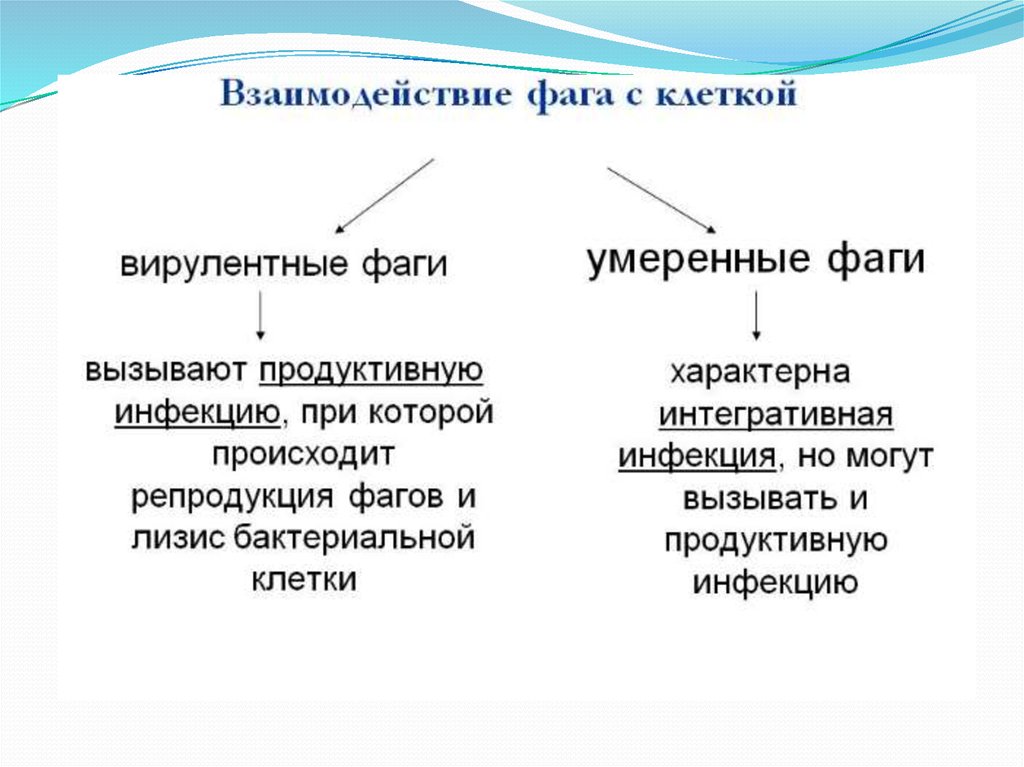 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]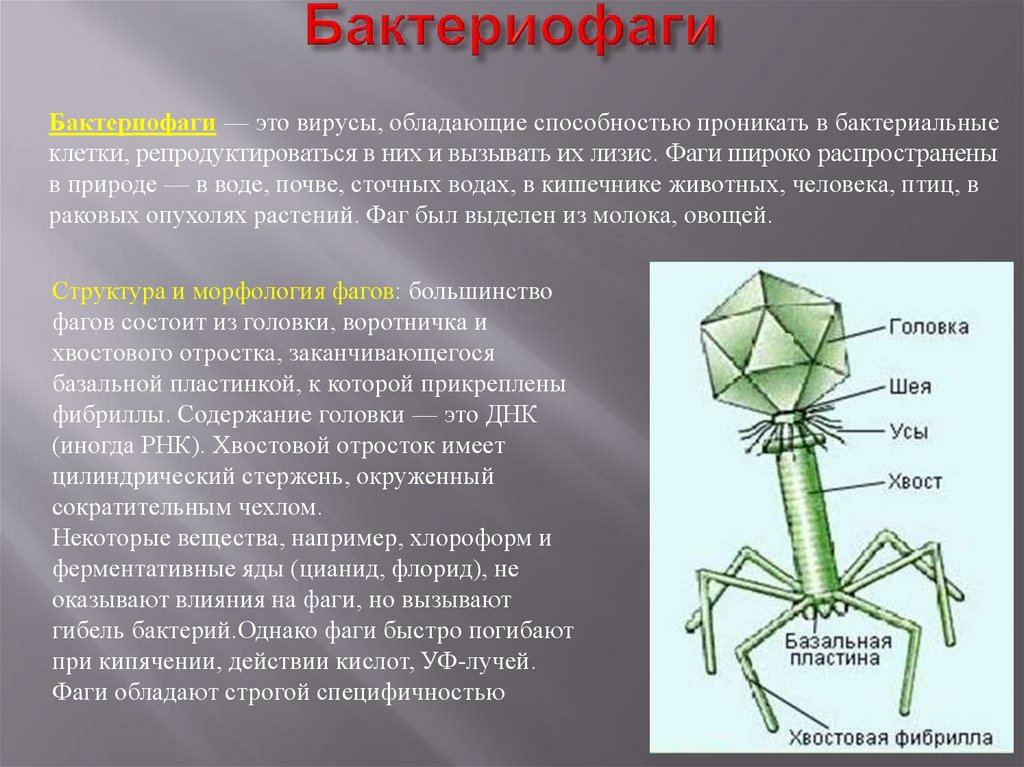 J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]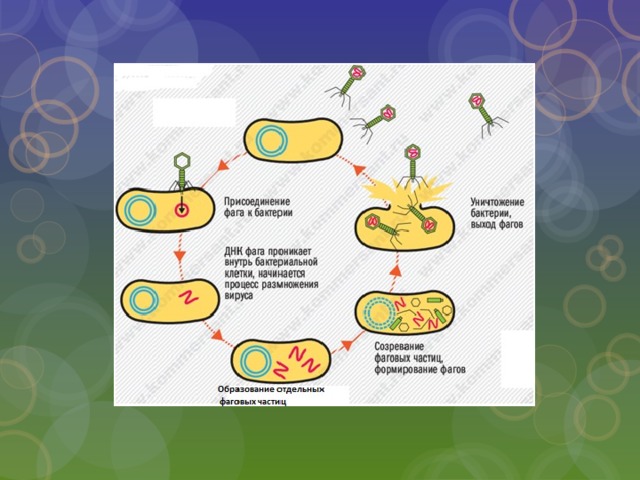
 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]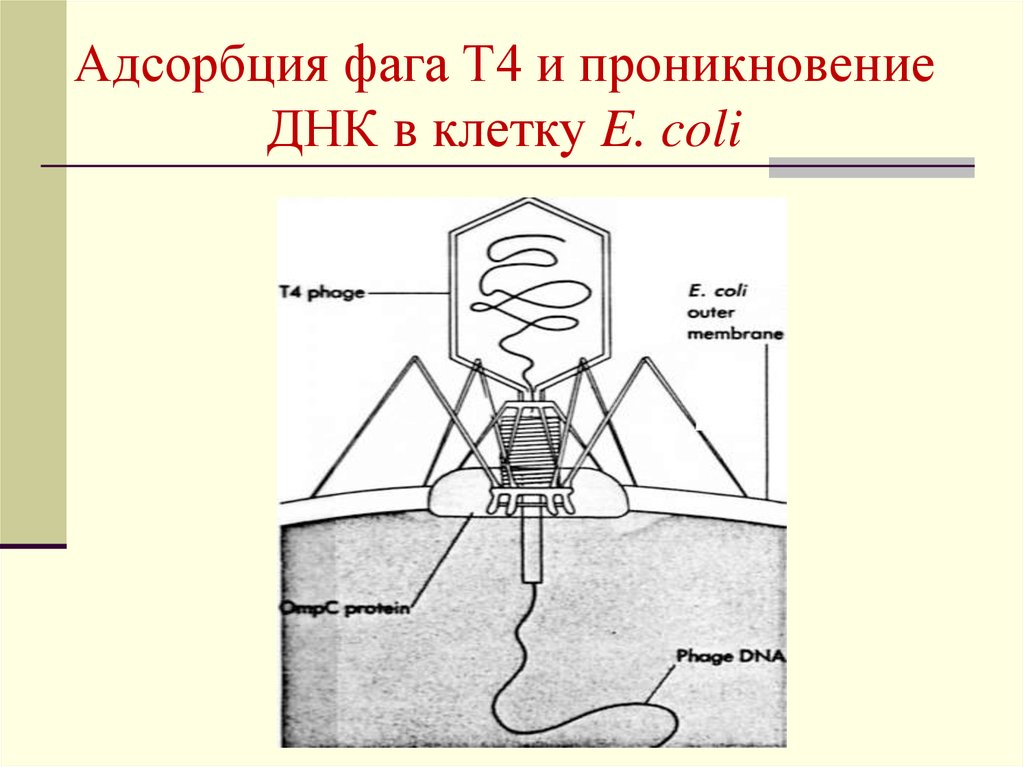 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]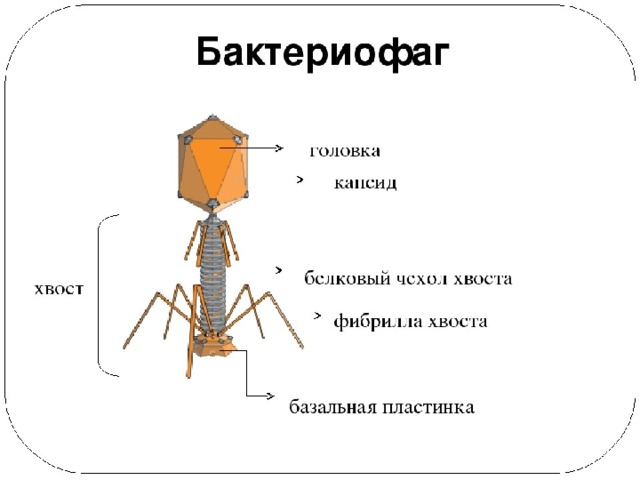 J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]