Интерферон для детей
В наши дни рождение здорового ребенка становится большой редкостью. Современная экология, пища, стрессы, да и вообще весь образ жизни, который ведут будущие родители, не способствуют появлению на свет ребенка без каких-либо заболеваний. Да, дети болели всегда, но не так часто и сильно, как сейчас. Да и сами мы стали какие-то слабые, подверженные всевозможным болезням. И все больше актуальности приобретает вопрос о том, как укрепить организм и защитить от вирусов. Сегодня педиатры все чаще отдают предпочтение интерферону. Познакомимся с ним поближе.
Препараты интерферона для детей
Сразу возникает вопрос: «В каком возрасте можно лечиться этим препаратом? Можно ли давать интерферон детям до года?». Чтобы на них ответить расскажем немного о самом препарате. Интерферон – иммуномодулятор (иммуномодуляторы – это натуральные или искусственные вещества, которые оказывают положительное регулирующее действие на всю иммунную систему организма), который является хорошим противовирусным и противоопухолевым препаратом. Назначается в периоды массовых вспышек гриппа и прочих инфекционных заболеваний. Интерферон подходит как для лечения начальных стадий ОРЗ и ОРВИ, так и для болезни уже набравшей силу.
Назначается в периоды массовых вспышек гриппа и прочих инфекционных заболеваний. Интерферон подходит как для лечения начальных стадий ОРЗ и ОРВИ, так и для болезни уже набравшей силу.
Также большим плюсом этого препарата является то, что он помогает выработке белков-интерферонов, которые в детском возрасте вырабатываются очень плохо, а в зимнее время еще хуже. Эти белки-интерфероны необходимы для того, чтобы оказывать сопротивление различным вирусам, атакующим наш организм. Поэтому интерферон можно использовать даже для грудных детей.
Интерферон выпускается в виде свечей, мазей и ампул с порошком.
Дозировка интерферона для детей
Как применять интерферон для детей? Лучше всего его использовать парентерально, так вещества не попадают в желудочно-кишечный тракт.
Интерферон для детей в ампулах
В целях профилактики интерферон закапывают детям по 5 капель, в нос, в каждую ноздрю, через каждые 6 часов. Такая процедура проводится пока не пройдет опасность заражения.
Если ребенок уже заболел, то проводится та же процедура, но чаще: капли закапывают каждые два часа, в первые три дня болезни.
Самым эффективным способом лечения для детей являются ингаляции интерфероном. 3 ампулы интерферона нужно развести в 10мл теплой воды (не выше 37°С) и далее все делать, как при обычной ингаляции. Но не увлекайтесь, такие ингаляции можно делать не больше двух раз в сутки.
Свечи интерферона для детей
Для новорожденных и недоношенных деток применяют свечи интерферона по 150000 МЕ (смотрите на упаковке) 2 раза в сутки, через каждые 12 часов на протяжении 5 дней. Чтобы вылечить ОРВИ достаточно всего одного курса.
Интерферон для детей мазь
Для профилактики ОРЗ необходимо смазывать носик два раза в день, каждые 12 часов. В качестве лечения интерфероновую мазь используют 2 раза в день по 0,5 г на протяжении 2 недель. Следующие 2-4 недели сокращают количество этих процедур до 3 раз в неделю. Также интерфероновой мазью можно смазывать миндалины и лечить стоматит.
Побочные действия интерферона
Используя препараты интерферона, не стоит забывать о том, что это все же лекарство, и у него есть побочные действия:
- озноб и повышение температуры тела;
- головные боли;
- головокружение;
- судороги;
- бессонница;
- учащенное сердцебиение;
- одышка;
- тошнота, рвота;
- аллергические реакции;
- изменение стула.
Также стоит знать, о том, что использование интерферона на протяжении долгого времени вызывает привыкание организмом, после чего препарат перестает быть эффективным.
У интерферона есть и противопоказания. Его нельзя применять при заболеваниях сердца и центральной нервной системы.
Каким бы хорошим и эффективным ни было этот препарат, все же не стоит принимать его самостоятельно, без консультации специалиста. Только врач сможет установить необходимый режим и дозу, зависящие от стадии и тяжести заболевания, а также от возраста вашего ребенка.
Статьи по теме:
Ринофлуимуцил для детей Ринофлуимуцил — назальный спрей, применяемый для лечения заложенности носа, отечности и обильного выделения слизи. Врачи нередко прописывают его и детям. О том, можно ли применять ринофлуимуцил малышам, в какой дозировке и как долго — мы расскажем в нашей статье. |
Слабительное для детей Пищеварительная система ребенка — очень деликатный механизм, нередко дающий сбои, проявляющиеся в виде запоров. Но не все слабительные средства, предлагаемые фармакологическими компаниями, подходят для малышей. О том, какие средства рекомендуют педиатры в качестве слабительных для детей — наша статья. |
|
Иммунал для детей Подрастая и увеличивая круг общения, ребенок все больше и больше подвергается риску возможных заболеваний. Ведь в садах и школах подхватить какую-либо инфекцию очень просто. | Сироп проспан для детей В сезон обострения острых респираторных заболеваний, сопровождающихся кашле, родители теряются перед ассортиментом средств для его лечения. На один препарат — сироп проспан — мы хотим обратить ваше внимание. Его эффективность и безопасность для детей доказана многочисленными исследованиями. |
как лечить? — ФИРН М
Детские инфекционные болезни — одна из важнейших проблем современной педиатрии. О том, чем опасны частые респираторные заболевания в детском возрасте, о роли интерферона в борьбе с вирусными инфекциями и о профилактике заболеваний мы поговорили с Виктором Валентиновичем Красновым — профессором, доктором медицинских наук, врачом высшей категории по специальности «инфекционные болезни».
— Виктор Валентинович, Вы посвятили много лет изучению детских инфекций и имеете богатейший опыт работы практикующим врачом. Сегодня хотелось бы поговорить с Вами об инфекционных заболеваниях, возникающих у детей в период сезонного подъёма заболеваемости. Скажите, пожалуйста, чем обусловлена повышенная восприимчивость детей к острым респираторным вирусным инфекциям?
Сегодня хотелось бы поговорить с Вами об инфекционных заболеваниях, возникающих у детей в период сезонного подъёма заболеваемости. Скажите, пожалуйста, чем обусловлена повышенная восприимчивость детей к острым респираторным вирусным инфекциям?
— Повышенная восприимчивость к инфекционным заболеваниям, преимущественно респираторного тракта, обусловлена особенностями детского иммунитета. В детском возрасте идет становление иммунной системы, прежде всего, адаптивного (приобретенного) иммунитета. Для того, чтобы в организме сформировались защитные механизмы в виде клеточного (преимущественно, лимфоциты) и гуморального (антитела-иммуноглобулины) иммунитета, должно произойти «знакомство» с самыми разными болезнетворными микроорганизмами и в ряде случаев такое «знакомство» происходит через болезнь. В частности, нормальный уровень иммуноглобулина A, который, прежде всего, предотвращает проникновение различных возбудителей инфекций через слизистые оболочки, формируется только к 10−12 годам.
— Очевидно, что частые респираторные вирусные заболевания не проходят для детей бесследно. Чем они опасны для ребёнка в раннем возрасте?
— Как уже было сказано, при заболеваниях в детском возрасте происходит формирование иммунной системы. Однако, когда ребенок начинает болеть часто, его иммунная система не успевает восстановиться и перестает реагировать адекватно. Обычные респираторные инфекции, в большинстве своем вирусной природы, осложняются активацией бактериальной микробной флоры, которая в норме постоянно присутствует у любого человека (не следует забывать, что мы живем в мире с огромным количеством микроорганизмов). В результате у ребенка развиваются различные осложнения — отиты, синуситы, бронхиты, пневмония и др. В этом случае часто назначаются антибиотики и ряд других лекарств, которые, в свою очередь, также оказывают отрицательное влияние на иммунитет. Назначение большого количества лекарственных препаратов (полипрагмазия) часто болеющим детям также является проблемой, поскольку у всех препаратов могут быть какие-либо побочные эффекты. Известно, что частые респираторные инфекции способствуют формированию бронхиальной астмы, а также формированию хронического течения других заболеваний. Наконец, у детей, которые болеют значительно чаще других, страдает социальная адаптация. Не следует сбрасывать со счетов и существенные материальные потери родителей в результате временной нетрудоспособности по уходу за больным ребенком и, собственно, затрат на лечение.
Известно, что частые респираторные инфекции способствуют формированию бронхиальной астмы, а также формированию хронического течения других заболеваний. Наконец, у детей, которые болеют значительно чаще других, страдает социальная адаптация. Не следует сбрасывать со счетов и существенные материальные потери родителей в результате временной нетрудоспособности по уходу за больным ребенком и, собственно, затрат на лечение.
— Поясните, пожалуйста, подробнее, что такое «полипрагмазия» и в чём заключается её опасность? Какие побочные эффекты она может вызвать?
— Полипрагмазия это одновременное назначение пациенту большого количества различных лекарственных средств (как правило, более трех). Такие назначения могут привести к трудно предсказуемым эффектам в результате взаимодействия препаратов между собой и оказывают отрицательное воздействие из-за наличия побочного влияния на детский организм.
— Получается, когда мы хотим побыстрее вылечить ребёнка и даём ему несколько препаратов одновременно, существует риск навредить его иммунитету, который и так страдает от рекуррентных заболеваний?
— Да, из-за вирусной инфекции и, в том числе, не всегда рационального лечения, возникает дисбаланс иммунного ответа. В результате могут возникнуть бактериальные осложнения, требующие назначения антибиотиков, которые, в свою очередь, усугубляют появившийся дисбаланс. Формируется так называемый порочный круг, с исходящими последствиями в виде повторяющихся заболеваний, протекающих с осложнениями.
— Можно ли как-то разорвать этот порочный круг?
Разорвать такой порочный круг в принципе возможно, прекратив череду часто повторяющихся респираторных инфекций. Добиться этого можно комплексом мероприятий. Какому-то ребенку достаточно перестать посещать детский сад — и он станет болеть значительно реже или вообще практически прекратит. Однако, если вновь начать посещать ДДУ, то и заболевания нередко возвращаются. Значит, одного этого шага далеко не всегда достаточно, да и многим родителям необходимо регулярно ходить на работу, а оставлять ребенка дома не с кем. В таком случае следует использовать препараты, которые могут предупредить заболевание ребенка, т. е. средства, обладающие профилактическим эффектом по отношению к респираторным заболеваниям. Одним из примеров таких средств являются препараты интерферона.
Однако, если вновь начать посещать ДДУ, то и заболевания нередко возвращаются. Значит, одного этого шага далеко не всегда достаточно, да и многим родителям необходимо регулярно ходить на работу, а оставлять ребенка дома не с кем. В таком случае следует использовать препараты, которые могут предупредить заболевание ребенка, т. е. средства, обладающие профилактическим эффектом по отношению к респираторным заболеваниям. Одним из примеров таких средств являются препараты интерферона.
— Вы упомянули интерферон. Расскажите, пожалуйста, подробнее, что это такое?
— В 1957 г. сотрудники британского Национального Института Медицинских Исследований англичанин Алик Айзекс и швейцарец Жан Линдеманн во время экспериментальных опытов открыли явление вирусной интерференции: зараженные вирусами клетки производили особый белок, который ингибировал рост этих вирусов и защищал «здоровые» неинфицированные клетки от вирусного проникновения. Обнаруженный белок получил название «интерферон». С этого момента человечество обрело мощное естественное средство в борьбе с вирусными инфекциями, началась так называемая «эра интерферона». В 1961 г. английский вирусолог Д.А. Тиррелл впервые исследовал на себе и на своих сотрудниках перспективу интраназального применения интерферона для профилактики респираторных заболеваний и гриппа. Предварительное закапывание в нос интерферона и последующее заражение вирусом Коксаки вызывало лишь легкое недомогание, но не заболевание, в то же время никаких побочных симптомов от применения интерферона у испытуемых не отмечалось. В СССР интерферон впервые был получен в 1960 году в Центральном институте усовершенствования врачей в лаборатории новых антибиотиков коллективом исследователей под руководством 3.В. Ермольевой. В 1962 году отечественными учеными интерферон впервые был успешно применен для профилактики и лечения тяжелой формы гриппа. В 1964 г. интерферон начали активно использовать в глазной клинике в терапии вирусного кератоконъюнктивита. Проведенные исследования подтвердили безопасность и эффективность интерферона при лечении вирусных конъюнктивитов.
С этого момента человечество обрело мощное естественное средство в борьбе с вирусными инфекциями, началась так называемая «эра интерферона». В 1961 г. английский вирусолог Д.А. Тиррелл впервые исследовал на себе и на своих сотрудниках перспективу интраназального применения интерферона для профилактики респираторных заболеваний и гриппа. Предварительное закапывание в нос интерферона и последующее заражение вирусом Коксаки вызывало лишь легкое недомогание, но не заболевание, в то же время никаких побочных симптомов от применения интерферона у испытуемых не отмечалось. В СССР интерферон впервые был получен в 1960 году в Центральном институте усовершенствования врачей в лаборатории новых антибиотиков коллективом исследователей под руководством 3.В. Ермольевой. В 1962 году отечественными учеными интерферон впервые был успешно применен для профилактики и лечения тяжелой формы гриппа. В 1964 г. интерферон начали активно использовать в глазной клинике в терапии вирусного кератоконъюнктивита. Проведенные исследования подтвердили безопасность и эффективность интерферона при лечении вирусных конъюнктивитов. Таким образом, открытие интерферона можно назвать эпохальным событием, наряду с открытием антибиотиков ставшим переломным моментом в лечении инфекционных заболеваний.
Таким образом, открытие интерферона можно назвать эпохальным событием, наряду с открытием антибиотиков ставшим переломным моментом в лечении инфекционных заболеваний.
— На сегодняшний день существуют лейкоцитарные и рекомбинантные интерфероны. В чём их принципиальное различие?
— Лейкоцитарный интерферон — это интерферон, который получают из препаратов донорской крови. В настоящее время препараты такого интерферона используют строго по жизненным показаниям, когда ожидаемая польза превышает возможный риск. А рекомбинантный интерферон вырабатывают кишечные палочки, в которые имплантирован ген человека, отвечающий за выработку этого белка. Такой интерферон, полученный генно-инженерным способом, более безопасный, поскольку абсолютно исключает передачу инфекций, которые могут попасть в организм человека с препаратами крови.
— Какую роль играет интерферон в борьбе с вирусными инфекциями?
— Интерфероны играют важную роль в противостоянии вирусным инфекциям. Семейство интерферонов представлено тремя типами, каждый из которых обладает противовирусным и иммуномодулирующим (нормализующим иммунный ответ) эффектами. Для противовирусного воздействия достаточно небольших концентраций интерферона. Не существует какой-либо разницы при воздействии экзогенных (привносимых извне), природных или рекомбинантных интерферонов на клетки организма в сравнении с эндогенными (образующимися в организме) интерферонами. Поэтому применение препаратов интерферона оправдано для противовирусного воздействия на слизистые оболочки, в том числе, при профилактике гриппа и ОРВИ, когда необходимо ускорить готовность клеток противостоять вирусной угрозе. Интерферон активен в отношении всех видов человеческих респираторных вирусов, поскольку не взаимодействует с ними, а блокирует механизм их воспроизведения. Кроме того, интерферон индуцирует выработку противовирусных антител. Эффект привыкания к интерферону отсутствует.
Семейство интерферонов представлено тремя типами, каждый из которых обладает противовирусным и иммуномодулирующим (нормализующим иммунный ответ) эффектами. Для противовирусного воздействия достаточно небольших концентраций интерферона. Не существует какой-либо разницы при воздействии экзогенных (привносимых извне), природных или рекомбинантных интерферонов на клетки организма в сравнении с эндогенными (образующимися в организме) интерферонами. Поэтому применение препаратов интерферона оправдано для противовирусного воздействия на слизистые оболочки, в том числе, при профилактике гриппа и ОРВИ, когда необходимо ускорить готовность клеток противостоять вирусной угрозе. Интерферон активен в отношении всех видов человеческих респираторных вирусов, поскольку не взаимодействует с ними, а блокирует механизм их воспроизведения. Кроме того, интерферон индуцирует выработку противовирусных антител. Эффект привыкания к интерферону отсутствует.
— Правда ли, что у часто болеющих детей могут возникать проблемы с выработкой собственного интерферона?
— Да, у детей с рекуррентными респираторными инфекциями (часто болеющих детей) изменён иммунный ответ, в том числе нарушается процесс образования интерферонов.
Как правило, при острой вирусной инфекции на вторые-третьи сутки собственного эндогенного интерферона ещё хватает у большинства больных, но примерно к пятым суткам происходит падение его уровня в организме. Нужен дополнительный источник интерферона, его поступление извне. В этой ситуации экзогенный интерферон защищает клетки от инфекции и мобилизует собственную защитную (иммунную) систему ребенка. Важно также отметить, что профилактическое применение препаратов интерферона предупреждает наши клетки об инфекции и делает их резистентными к ней до выработки собственных интерферонов.
— Каким образом можно помочь организму получать необходимое количество интерферона для поддержания иммунитета? Какой способ применения наиболее эффективен при вирусных заболеваниях?
— Существуют различные лекарственные формы интерферона: капли, спрей, ректальные суппозитории. Если говорить о профилактическом приеме интерферона, то однозначно надо использовать капли или спрей, следуя рекомендуемым схемам; ректальные суппозитории для профилактики неприемлемы. При лечении надо следовать рекомендациям врача. Но, как мне видится, должен присутствовать принцип «от более простых к более сложным», т. е. от препаратов с меньшей концентрацией действующего вещества, каковыми являются капли и спрей, к препаратам с более высоким содержанием интерферона — ректальным суппозиториям. При интраназальном применении интерферон будет действовать непосредственно в месте проникновения вирусов, что несомненно, повышает действенность и эффективность подобной терапии.
При лечении надо следовать рекомендациям врача. Но, как мне видится, должен присутствовать принцип «от более простых к более сложным», т. е. от препаратов с меньшей концентрацией действующего вещества, каковыми являются капли и спрей, к препаратам с более высоким содержанием интерферона — ректальным суппозиториям. При интраназальном применении интерферон будет действовать непосредственно в месте проникновения вирусов, что несомненно, повышает действенность и эффективность подобной терапии.
— В настоящее время для лечения ОРВИ и гриппа существует большое количество препаратов с широким спектром противовирусного действия. В том числе, с содержанием интерферона. Но далеко не все из них разрешено использовать у детей, тем более, первых лет жизни. На чём должен быть основан выбор лекарства для самых маленьких? Есть ли какое-то универсальное средство?
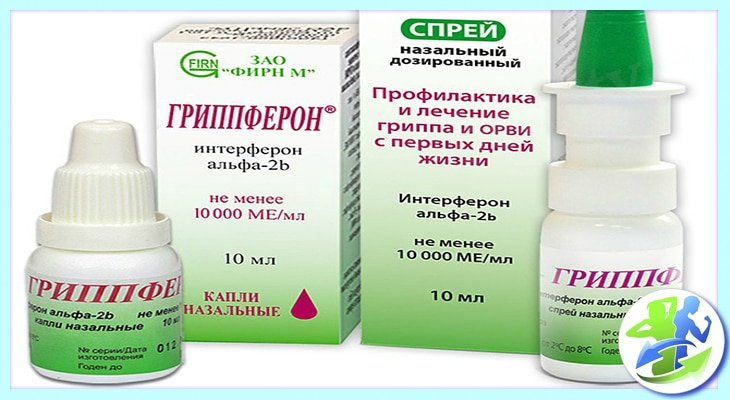
— Наиболее доступным и безопасным можно считать препарат для интраназального применения Гриппферон®, выпускаемый в форме капель и спрея. Более выраженное местное действие Гриппферона обусловлено тем, что в его состав входит оригинальная комбинация рекомбинантного интерферона с полимерными соединениями, составляющими водорастворимую вспомогательную часть препарата. Гриппферон разрешён к использованию на любых сроках беременности и детям с первых дней жизни.
Более выраженное местное действие Гриппферона обусловлено тем, что в его состав входит оригинальная комбинация рекомбинантного интерферона с полимерными соединениями, составляющими водорастворимую вспомогательную часть препарата. Гриппферон разрешён к использованию на любых сроках беременности и детям с первых дней жизни.
— Всех родителей беспокоит, насколько доказана эффективность и безопасность препаратов, которые они дают своим детям. Действительно ли Гриппферон® может помочь при остром вирусном респираторном заболевании и при этом не причинить вреда детскому организму?
— Многочисленные клинические исследования по использованию Гриппферона проводились у детей разного возрастаПричем, препарат применялся не только у новорожденных детей, но и у недоношенных с экстремально низкой массой тела, у беременных. Доказана лечебная и профилактическая эффективность Гриппферона в отношении ОРВИ и гриппа — более, чем в 7500 наблюдениях во время проведения клинических исследований. В целом ни в одном из наблюдений не было зарегистрировано осложнений и побочных эффектов.
В целом ни в одном из наблюдений не было зарегистрировано осложнений и побочных эффектов.
— Выходит, Гриппферон® можно применять для профилактики острых респираторных вирусных инфекций и гриппа у детей. Как в этом случае его следует принимать?
— С профилактической целью Гриппферон® используют в период сезонного подъема заболеваемости гриппом и ОРВИ в возрастной дозировке однократно утром с интервалом 24−48 часов. Особенно профилактика показана часто болеющим детям, детям с различными хроническими заболеваниями, включая аллергические. Очень важно, что Гриппферон® можно использовать с профилактической целью у беременных, поскольку различные заболевания, в том числе и острые респираторные инфекции, перенесенные во время беременности, могут привести к поражению плода и даже к тяжелым аномалиям его развития. В этом случае возможна или гибель плода, или рождение ребенка с различными отклонениями в здоровье.
— Какие ещё методы профилактики острых респираторных инфекций у детей Вы бы порекомендовали? Как правильно подготовить ребёнка к эпидемиологическому сезону?
— В холодный период времени года необходимо давать ребенку витаминно-минеральные комплексы. Важно, чтобы в них обязательно присутствовали витамины А, Е, С, Д, В6, В9 (принимаем во внимание их участие в формировании иммунного ответа!), а также микроэлементы — йод, кальций и железо. Кроме того, следует рекомендовать средства, способствующие поддержанию нормального состава микрофлоры кишечника — прежде всего, обеспечить рациональное питание. Ребенок должен получать достаточное количество овощей и фруктов, содержащих пищевые волокна, которые, в свою очередь, служат пищевым субстратом для нормофлоры, которая, по сути, является составляющей нашего иммунитета.
Важно, чтобы в них обязательно присутствовали витамины А, Е, С, Д, В6, В9 (принимаем во внимание их участие в формировании иммунного ответа!), а также микроэлементы — йод, кальций и железо. Кроме того, следует рекомендовать средства, способствующие поддержанию нормального состава микрофлоры кишечника — прежде всего, обеспечить рациональное питание. Ребенок должен получать достаточное количество овощей и фруктов, содержащих пищевые волокна, которые, в свою очередь, служат пищевым субстратом для нормофлоры, которая, по сути, является составляющей нашего иммунитета.
— Виктор Валентинович, благодарим Вас за подробные ответы на такие важные вопросы.
— Спасибо.
Пегилированный интерферон-α-2b для детей с рецидивирующей краниофарингиомой
Отчеты о клинических случаях
. 2012 Декабрь; 10 (6): 498-503. дои: 10.3171/2012.9.PEDS12225. Epub 2012 12 октября.
Джеки Ти Юнг 1 , Ян Ф. Поллак, Ашок Паниграхи, Регина I Джакацки
принадлежность
- 1 Отделение нейрохирургии, Медицинская школа Университета Питтсбурга, Питтсбург, Пенсильвания 15224, США.
- PMID: 23061825
- DOI: 10.3171/2012.9.ПЕДС12225
Отчеты о случаях заболевания
Jacky T Yeung et al. J Нейрохирург Педиатр. 2012 9 декабря0003 . 2012 Декабрь; 10 (6): 498-503.
дои: 10.3171/2012.9.PEDS12225. Epub 2012 12 октября.
Авторы
Джеки Ти Юнг 1 , Ян Ф. Поллак, Ашок Паниграхи, Регина И Джакацки
принадлежность
- PMID: 23061825
- DOI: 10.3171/2012.9.ПЕДС12225
Абстрактный
Объект: Предыдущие исследования системного и внутриочагового введения непегилированного интерферона показали его эффективность в отношении краниофарингиомы.
Методы: Пяти детям в возрасте от 9 до 15 лет с рецидивирующими краниофарингиомами лечили до 2 лет подкожными инъекциями ИП в дозе 1-3 мкг/кг/нед. Ответ опухоли оценивали с помощью МРТ.
Полученные результаты: Все пациенты имели стабильное заболевание или улучшение в ответ на ИП. У одного пациента развился рецидив после тотальной резекции (GTR). Первоначально она показала увеличение преимущественно кистозной опухоли через 3 месяца лечения, после чего последовал полный ответ. Ей не потребовалось никакого дополнительного вмешательства, и спустя 10 лет после начала лечения у нее не было признаков заболевания. У другого пациента возник рецидив через 3,3 года после субтотальной резекции (STR) и лучевой терапии. У него было полное исчезновение преимущественно кистозного компонента через 4 месяца лечения, а через 5 лет остается небольшая остаточная кальцифицированная масса. У третьего пациента возник рецидив после 3 GTR. У него был полный ответ после 7 месяцев лечения и по-прежнему нет признаков заболевания 19месяцев после начала лечения. У четвертого пациента возник рецидив после 2 STR. У него было 30% уменьшение размера опухоли после 4 месяцев лечения, которое сохранялось в течение 12 месяцев, после чего киста начала увеличиваться в размерах. У последнего пациента развился рецидив после GTR и стабилизация заболевания через 6 месяцев после начала лечения PI.
У другого пациента возник рецидив через 3,3 года после субтотальной резекции (STR) и лучевой терапии. У него было полное исчезновение преимущественно кистозного компонента через 4 месяца лечения, а через 5 лет остается небольшая остаточная кальцифицированная масса. У третьего пациента возник рецидив после 3 GTR. У него был полный ответ после 7 месяцев лечения и по-прежнему нет признаков заболевания 19месяцев после начала лечения. У четвертого пациента возник рецидив после 2 STR. У него было 30% уменьшение размера опухоли после 4 месяцев лечения, которое сохранялось в течение 12 месяцев, после чего киста начала увеличиваться в размерах. У последнего пациента развился рецидив после GTR и стабилизация заболевания через 6 месяцев после начала лечения PI.
Выводы: Использование ИП у детей с рецидивирующими краниофарингиомами может привести к значительному и длительному ответу и потенциально отсрочить или избежать необходимости лучевой терапии.
Похожие статьи
- Потеря поля зрения при рецидивирующей кистозной краниофарингиоме при одновременном лечении пегилированным интерфероном α-2b.
Тидеманн Л.М., Мэнли П., Смит Э.Р., Даги Л.Р. Тидеманн Л.М. и соавт. J Pediatr Hematol Oncol. 2016 янв;38(1):e26-8. doi: 10.1097/MPH.0000000000000468. J Pediatr Hematol Oncol. 2016. PMID: 26558808
- Фаза II оценки интерферона-альфа-2а при прогрессирующих или рецидивирующих краниофарингиомах.
Якацки Р.И., Коэн Б.Х., Джеймисон С., Мэтьюз В.П., Аренсон Э., Лонги Д.С., Хилден Дж., Корнелиус А., Нидл М., Хейлман Д., Боаз Дж.К., Люерссен Т.Г. Якацки Р.И. и соавт. Дж Нейрохирург. 2000 г., февраль; 92 (2): 255–60. doi: 10.3171/jns.2000.92.2.0255. Дж Нейрохирург. 2000. PMID: 10659012 Клиническое испытание.

- Кистозная краниофарингиома: внутриопухолевая химиотерапия альфа-интерфероном.
Dastoli PA, Nicácio JM, Silva NS, Capellano AM, Toledo SR, Ierardi D, Cavalheiro S. Дастоли П.А. и соавт. Арк Нейропсиквиатр. 2011 Февраль;69(1):50-5. doi: 10.1590/s0004-282×2011000100011. Арк Нейропсиквиатр. 2011. PMID: 21359423
- Послеоперационный внутричерепной посев краниофарингиом — отчет о трех случаях и обзор литературы.
Шмалиш К., Бесхорнер Р., Псарас Т., Онеггер Дж. Шмалиш К. и соавт. Acta Neurochir (Вена). 2010 г., февраль; 152(2):313-9; обсуждение 319. doi: 10.1007/s00701-009-0538-4. Epub 2009 27 октября. Acta Neurochir (Вена). 2010. PMID: 19859655 Обзор.
- Детские краниофарингиомы: классификация и лечение в зависимости от степени поражения гипоталамуса.
Пьюджет С., Гарнетт М., Рэй А., Гриль Дж., Хабранд Дж.Л., Бодарт Н., Зера М., Безерра М., Ренье Д., Пьер-Кан А., Сент-Роуз К. Пьюджет С. и др. Дж Нейрохирург. 2007 Январь; 106 (1 Приложение): 3-12. doi: 10.3171/пед.2007.106.1.3. Дж Нейрохирург. 2007. PMID: 17233305 Обзор.
Посмотреть все похожие статьи
Цитируется
- Современные подходы к лечению краниофарингиомы.
Диас М.Дж., Квак С.Х., Рут К.Т., Фадил А., Нгуен А., Ладехофф Л., Батчу С., Лакке-Уолд Б. Диас М.Дж. и соавт. Front Biosci (Landmark Ed). 2022 21 декабря; 27 (12): 328. doi: 10.31083/j.fbl2712328. Front Biosci (Landmark Ed). 2022. PMID: 36624954 Бесплатная статья ЧВК. Обзор.
- Оценка ответа при детской краниофарингиоме: рекомендации Рабочей группы по оценке ответа в детской нейроонкологии (RAPNO).

Хоффман Л.М., Джеймс С., Манкад К., Мирски Д.М., Тамрази Б., Тинкль С.Л., Клайн С., Рамасубраманян А., Малбари Ф., Мангум Р., Линдси Х., Хорн В., Дэниелс Д.Дж., Кеоле С., Гроссханс Д.Р., Янг Пуссен Т. , Packer R, Cavalheiro S, Bison B, Hankinson TC, Müller HL, Bartels U, Warren KE, Chintagumpala M. Хоффман Л.М. и соавт. Нейро Онкол. 2023 14 февраля; 25 (2): 224-233. дои: 10.1093/neuonc/noac221. Нейро Онкол. 2023. PMID: 36124689
- Лечение кистозных краниофарингиом: обновление.
Бьянки Ф., Бенато А., Массими Л. Бьянки Ф. и др. Adv Tech Стенд Нейрохирург. 2022;45:139-176. doi: 10.1007/978-3-030-99166-1_4. Adv Tech Стенд Нейрохирург. 2022. PMID: 35976449
- Медикаментозная терапия краниофарингиом.
Александраки К.
 И., Ксекуки П.
Александраки К.И. и соавт.
touchREV Эндокринол. 2021 ноябрь;17(2):121-132. doi: 10.17925/EE.2021.17.2.121. Epub 2021 8 ноября.
touchREV Эндокринол. 2021.
PMID: 35118458
Бесплатная статья ЧВК.
Обзор.
И., Ксекуки П.
Александраки К.И. и соавт.
touchREV Эндокринол. 2021 ноябрь;17(2):121-132. doi: 10.17925/EE.2021.17.2.121. Epub 2021 8 ноября.
touchREV Эндокринол. 2021.
PMID: 35118458
Бесплатная статья ЧВК.
Обзор. - Исследование фазы II пегинтерферона альфа-2b для пациентов с нерезектабельными или рецидивирующими краниофарингиомами: отчет Консорциума по опухолям головного мозга у детей.
Goldman S, Pollack IF, Jakacki RI, Billups CA, Poussaint TY, Adesina AM, Panigrahy A, Parsons DW, Broniscer A, Robinson GW, Robison NJ, Partap S, Kilburn LB, Onar-Thomas A, Dunkel IJ, Fouladi М. Голдман С. и соавт. Нейро Онкол. 2020 26 ноября; 22 (11): 1696-1704. doi: 10.1093/neuonc/noaa119. Нейро Онкол. 2020. PMID: 32393959 Бесплатная статья ЧВК. Клиническое испытание.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
- 9 0153
вещества
Глазные капли интерферона альфа-2b для местного применения для лечения плоскоклеточной неоплазии глазной поверхности: исследование сравнения доз
Текст статьи
Меню статьи- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Клинические науки
Глазные капли интерферона альфа-2b для местного применения для лечения плоскоклеточной неоплазии глазной поверхности: исследование сравнения доз
Бесплатно- A Галор,
- C L Карп,
- S Чхабра,
- S Барнс,
- E C Альфонсо
- 90 237 Bascom Palmer Eye Institute, Университет Майами, Майами, Флорида, США
- Переписка с доктором К.
 Л. Карпом, Bascom Palmer Eye Institute, 900 NW 17 Street, Miami, FL 33136, USA; ckarp{at}med.miami.edu
Л. Карпом, Bascom Palmer Eye Institute, 900 NW 17 Street, Miami, FL 33136, USA; ckarp{at}med.miami.edu
Abstract
Предыстория/цели Сравнить эффективность и профиль побочных эффектов двух доз интерферона альфа2b (IFNα2b) в виде глазных капель (1 миллион международных единиц (МЕ)/ мл против 3 млн МЕ/мл) при лечении плоскоклеточной неоплазии глазной поверхности (OSSN).
Методы Ретроспективная серия случаев.
Результаты За 11-летний период (1996–2007 гг.) было идентифицировано 35 глаз. Двадцать один глаз (19 пациентов) с конъюнктивальной интраэпителиальной неоплазией (CIN) лечили 1 миллион МЕ/мл местного IFN-α2b; 12 глаз (девять пациентов) с CIN получали 3 млн МЕ/мл. Два пациента с плоскоклеточным раком (SCC) лечились местным интерфероном, один — 1 миллион МЕ/мл и один — 3 миллиона МЕ/мл. Исходная демографическая информация статистически не отличалась между двумя группами. У пациентов с CIN местная терапия устранила заболевание в 81% глаз в группе 1 млн МЕ/мл по сравнению с 92%, в группе 3 млн МЕ/мл р=0,41. Медиана времени до разрешения OSSN составила 2,8 месяца в группе 1 млн МЕ/мл и 1,9 месяца в группе 3 млн МЕ/мл, р=0,55. Ни один глаз с плоскоклеточным раком не ответил на терапию интерфероном. Местная терапия хорошо переносилась. После медианы наблюдения в течение 24 месяцев в глазах, успешно леченных местной терапией, наблюдались три рецидива.
Медиана времени до разрешения OSSN составила 2,8 месяца в группе 1 млн МЕ/мл и 1,9 месяца в группе 3 млн МЕ/мл, р=0,55. Ни один глаз с плоскоклеточным раком не ответил на терапию интерфероном. Местная терапия хорошо переносилась. После медианы наблюдения в течение 24 месяцев в глазах, успешно леченных местной терапией, наблюдались три рецидива.
Заключение В нашем исследовании не было выявлено существенных различий между группами 1 млн МЕ/мл и 3 млн МЕ/мл для лечения CIN.
http://dx.doi.org/10.1136/bjo.2008.153197
Статистика с сайта Altmetric.com
Запрос разрешений
в службу RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
Традиционным методом лечения плоскоклеточной неоплазии глазной поверхности (OSSN) является хирургическое иссечение, часто с дополнительной криотерапией. Однако, учитывая риск рецидива заболевания и потенциальную недостаточность лимбальных стволовых клеток при повторных иссечениях, важное значение при лечении этого состояния приобрела медикаментозная терапия.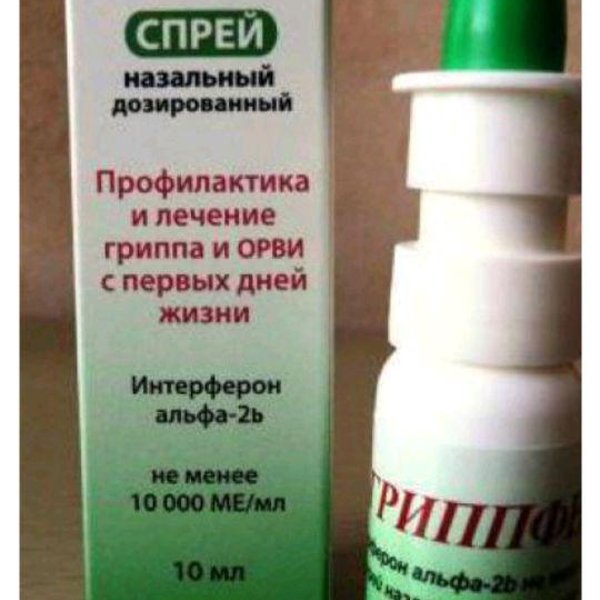 успешно лечить OSSN.1-12 Наряду с потенциальным предотвращением дефицита стволовых клеток, медикаментозная терапия имеет преимущество в лечении микроскопических заболеваний, которые могут присутствовать на всей поверхности глаза.
успешно лечить OSSN.1-12 Наряду с потенциальным предотвращением дефицита стволовых клеток, медикаментозная терапия имеет преимущество в лечении микроскопических заболеваний, которые могут присутствовать на всей поверхности глаза.
Интерфероны представляют собой группу встречающихся в природе белков, которые помогают иммунной системе справляться с эндогенными и экзогенными угрозами для организма. Интерфероны использовались для лечения многих заболеваний, включая гепатит,13, цервикальную интраэпителиальную неоплазию,14 и кожный плоскоклеточный рак.15 Местные капли и субконъюнктивальные инъекции интерферона-α2b (INF-α2b) использовались в качестве незарегистрированной терапии для лечения OSSN. .2 8 16 17
Ни в одном исследовании не оценивалась идеальная доза местных глазных капель INF-α2b. В аптеке Bascom Palmer Eye Institute (BPEI) готовят две стандартные дозы: 1 миллион и 3 миллиона международных единиц/мл (МЕ). Доза 1 миллион МЕ/мл была эмпирической дозой, используемой в нашем первоначальном исследовании. 16 Среднее время до разрешения опухоли составляло около 12 недель; это время было таким же, как и в других исследованиях с использованием этой дозы.2, 17, 18 Доза 3 миллиона МЕ/мл позже была увеличена в попытке сократить продолжительность лечения. Была выбрана доза 3 миллиона МЕ/мл, так как эта доза используется при субконъюнктивальных инъекциях. Стоимость дозы 3 млн МЕ/мл в нашем учреждении значительно выше, чем дозы 1 млн МЕ/мл. В то время как проспективное исследование было бы предпочтительнее для оценки эффективности и профиля побочных эффектов двух доз, такое исследование нецелесообразно, учитывая небольшое количество пациентов, получавших только местную терапию. Поэтому мы провели ретроспективный анализ, чтобы сравнить эффективность и профиль побочных эффектов доз 1 млн и 3 млн МЕ/мл, чтобы дать рекомендации по оптимальной дозе препарата при OSSN.
16 Среднее время до разрешения опухоли составляло около 12 недель; это время было таким же, как и в других исследованиях с использованием этой дозы.2, 17, 18 Доза 3 миллиона МЕ/мл позже была увеличена в попытке сократить продолжительность лечения. Была выбрана доза 3 миллиона МЕ/мл, так как эта доза используется при субконъюнктивальных инъекциях. Стоимость дозы 3 млн МЕ/мл в нашем учреждении значительно выше, чем дозы 1 млн МЕ/мл. В то время как проспективное исследование было бы предпочтительнее для оценки эффективности и профиля побочных эффектов двух доз, такое исследование нецелесообразно, учитывая небольшое количество пациентов, получавших только местную терапию. Поэтому мы провели ретроспективный анализ, чтобы сравнить эффективность и профиль побочных эффектов доз 1 млн и 3 млн МЕ/мл, чтобы дать рекомендации по оптимальной дозе препарата при OSSN.
Материалы и методы
Исследуемая группа
Институциональный наблюдательный совет Университета Майами рассмотрел и одобрил это исследование, которое проводилось в соответствии с принципами Хельсинкской декларации. В исследование были включены пациенты, которых лечили местными глазными каплями IFN-α2b для OSSN (интраэпителиальная неоплазия конъюнктивы (CIN) и плоскоклеточный рак (SCC)) во время BPEI. Поскольку все глазные капли IFN-α2b для местного применения изготавливаются в аптеке BPEI, пациенты были идентифицированы путем поиска рецептов глазных капель IFN-α2b для местного применения, выписанных в возрасте от 19 лет.96 и 2007. Мы решили включить всех пациентов, получавших лечение глазными каплями с интерфероном, как подтвержденных биопсией, так и клинически диагностированных. В анализ были включены пациенты с первичным или рецидивирующим OSSN. Пациенты были исключены из анализа, если они получали сопутствующую терапию MMC, если они получали субконъюнктивальные инъекции IFN-α2b или если глазные капли вводились в качестве адъюванта для завершения хирургического удаления. Оба глаза одного пациента были включены в анализ, если применимо. В нашем учреждении все пациенты лечатся каплями интерферона четыре раза в день.
В исследование были включены пациенты, которых лечили местными глазными каплями IFN-α2b для OSSN (интраэпителиальная неоплазия конъюнктивы (CIN) и плоскоклеточный рак (SCC)) во время BPEI. Поскольку все глазные капли IFN-α2b для местного применения изготавливаются в аптеке BPEI, пациенты были идентифицированы путем поиска рецептов глазных капель IFN-α2b для местного применения, выписанных в возрасте от 19 лет.96 и 2007. Мы решили включить всех пациентов, получавших лечение глазными каплями с интерфероном, как подтвержденных биопсией, так и клинически диагностированных. В анализ были включены пациенты с первичным или рецидивирующим OSSN. Пациенты были исключены из анализа, если они получали сопутствующую терапию MMC, если они получали субконъюнктивальные инъекции IFN-α2b или если глазные капли вводились в качестве адъюванта для завершения хирургического удаления. Оба глаза одного пациента были включены в анализ, если применимо. В нашем учреждении все пациенты лечатся каплями интерферона четыре раза в день. Местную терапию обычно продолжают примерно в течение 1 месяца после разрешения поражения.
Местную терапию обычно продолжают примерно в течение 1 месяца после разрешения поражения.
Сбор данных
Все данные были получены путем ретроспективного анализа карт и введены в стандартизированную компьютеризированную базу данных для последующего анализа. Собранные данные включали демографические характеристики, объективные данные до лечения, информацию о лечении и курс лечения после лечения. Основным критерием исхода было время до клинического разрешения опухоли.
Статистический анализ
Все статистические анализы проводились с использованием статистического пакета SPSS (SPSS, Чикаго). Частота демографических и клинических переменных была рассчитана для каждой группы лечения. Категориальные переменные сравнивались с использованием χ 2 тест. Непрерывные переменные анализировали путем сравнения медианных значений с использованием критерия Манна-Уитни. Все значения p двусторонние и номинальные. Кривые времени до события были рассчитаны с использованием метода Каплана-Мейера. Отношения рисков были рассчитаны с помощью моделирования пропорциональных рисков Кокса.
Отношения рисков были рассчитаны с помощью моделирования пропорциональных рисков Кокса.
Результаты
Исследуемая популяция при представлении
Тридцать три глаза с CIN лечились местным интерфероном. Их демографические данные приведены в таблице 1.
Таблица 1Демографические данные и характеристики поражений у пациентов с конъюнктивальной интраэпителиальной неоплазией (CIN)
Двадцать один глаз (19 пациентов) лечили 1 миллион МЕ/мл местного IFN-α2b; 12 глаз (девять пациентов) лечили 3 млн МЕ/мл местного IFN-α2b. Обе группы использовали глазные капли с интерфероном четыре раза в день, пока поражение не исчезло, а затем продолжали закапывать капли еще примерно в течение одного месяца. Статистически значимых различий между группами не было. Четыре глаза с CIN ранее лечили глазными каплями с интерфероном. У двух пациентов были опухоли, которые лечили только интерфероном; у обоих был полный ответ на лечение. Двум пациентам было выполнено хирургическое иссечение опухоли; После этого был назначен местный интерферон, потому что хирургические края были положительными на опухоль. В этих четырех глазах был рецидив опухоли, и пациентов затем лечили местным интерфероном и включали в наше исследование. Четыре пациента с двусторонним заболеванием лечили местным интерфероном, и каждый глаз анализировали отдельно. Один пациент получил два курса капель интерферона в один и тот же глаз. У этого пациента были две разные опухоли в разное время в одном и том же глазу, и каждый курс анализировался отдельно.
В этих четырех глазах был рецидив опухоли, и пациентов затем лечили местным интерфероном и включали в наше исследование. Четыре пациента с двусторонним заболеванием лечили местным интерфероном, и каждый глаз анализировали отдельно. Один пациент получил два курса капель интерферона в один и тот же глаз. У этого пациента были две разные опухоли в разное время в одном и том же глазу, и каждый курс анализировался отдельно.
Два пациента с SSC лечились местным интерфероном. В обоих случаях для излечения требовалось обширное хирургическое вмешательство, и пациенты хотели попробовать медикаментозное лечение. Один пациент в возрасте 92 лет хотел попробовать интерфероновые капли в качестве альтернативы хирургическому вмешательству; его лечили дозой 3 млн МЕ/мл. У другого пациента был диффузный SSC, который не поддавался хирургическому удалению; ему начали терапию интерфероном в дозе 1 млн МЕ/мл в надежде уменьшить опухоль, чтобы избежать энуклеации.
Информация о лечении
Только местная терапия успешно устраняла CIN у одинакового процента пациентов в обеих группах (81% глаз в группе 1 млн МЕ/мл против 92% в группе 3 млн МЕ/мл, p= 0,41).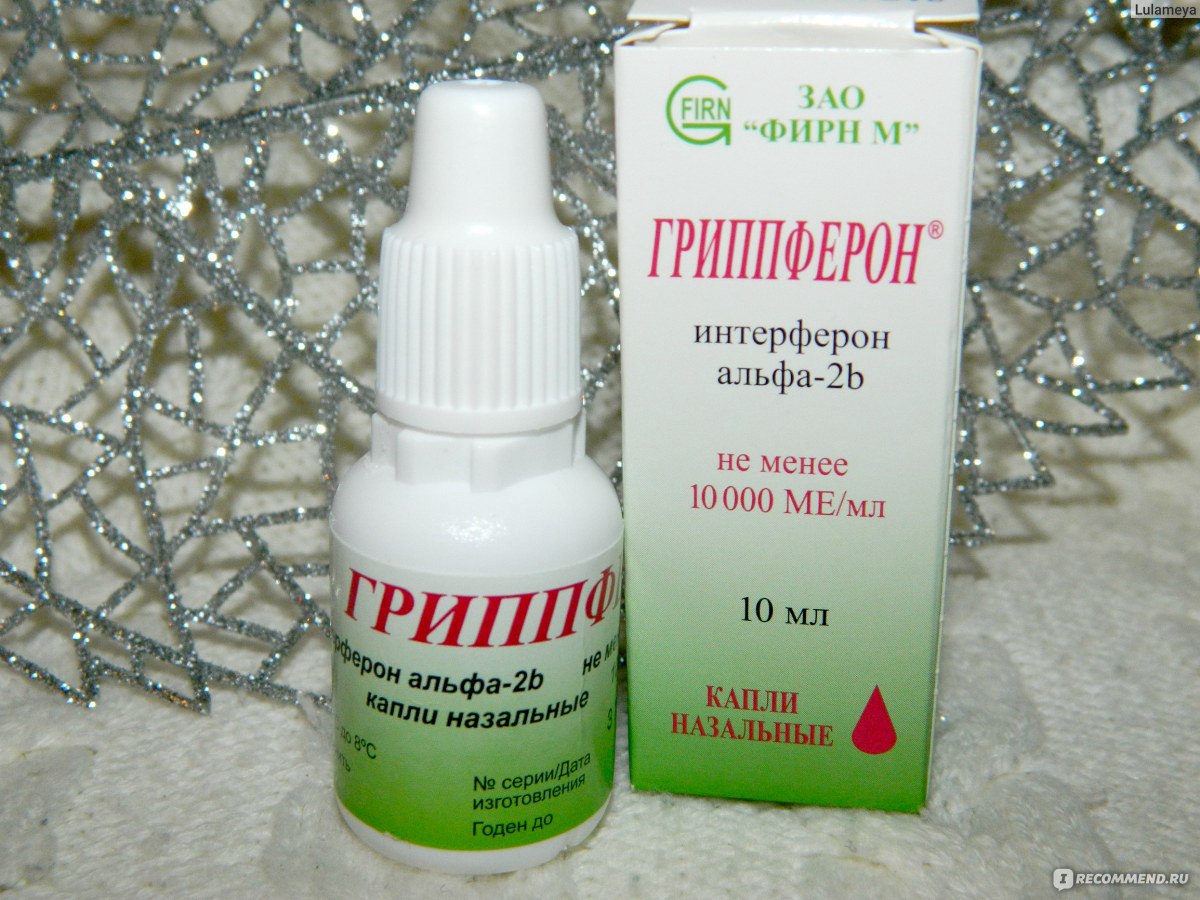 В то время как время до разрешения CIN существенно не отличалось между группами (медиана 2,8 месяца в группе 1 млн МЕ/мл и 1,9 месяца в группе 3 млн МЕ/мл), наблюдалась тенденция к более быстрому выведению в группе 3 млн МЕ/мл. группа (таблица 2, рисунок 1).
В то время как время до разрешения CIN существенно не отличалось между группами (медиана 2,8 месяца в группе 1 млн МЕ/мл и 1,9 месяца в группе 3 млн МЕ/мл), наблюдалась тенденция к более быстрому выведению в группе 3 млн МЕ/мл. группа (таблица 2, рисунок 1).
Информация о лечении пациентов, получавших местный интерферон по поводу конъюнктивальной интраэпителиальной неоплазии (CIN)
Рисунок 1 Глазные капли по 3 млн МЕ/мл (значение р=0,54). Местная терапия интерфероном хорошо переносилась, хотя наблюдалась тенденция к более выраженным побочным эффектам в группе, получавшей 3 млн МЕ/мл. Наиболее частыми побочными эффектами были зрительный дискомфорт и светобоязнь. Медиана времени лечения была больше, чем время до разрешения CIN (медиана 3,6 месяца в группе 1 млн МЕ/мл и 4,3 месяца в группе 3 млн МЕ/мл, p = 0,55), так как лечение обычно продолжается около месяц после разрешения поражения. В семи глазах с клиническим диагнозом CIN все поражения полностью исчезли при терапии интерфероном.
CIN в пяти глазах не ответил полностью на терапию глазными каплями интерферона; четыре из этих пяти глаз были рецидивирующим CIN. Пациенты с КИН в анамнезе хуже реагировали на терапию, чем пациенты без такого анамнеза (ОР 0,41, 95% ДИ (0,16–1,03), р=0,06). Неэффективность лечения требует адъювантной терапии; полное хирургическое удаление было использовано у двух пациентов, а глазные капли MMC были использованы в трех глазах (таблица 3). После дополнительной терапии на всех глазах достигнуто клиническое разрешение.
Таблица 3 Неудачи терапии и рецидивы заболевания у пациентов, получавших местное лечение интерфероном по поводу внутриэпителиального новообразования конъюнктивы (CIN) рецидив поражения CIN через 20, 21 и 28 месяцев после первоначального разрешения опухоли. Оба пациента с плоскоклеточным раком оказались безуспешными при местной терапии. 92-летнему пациенту было проведено хирургическое иссечение и продолжено местное лечение интерфероном после операции из-за положительных остаточных краев; пациенту с диффузным плоскоклеточным раком выполнена энуклеация. Ни у одного пациента не было рецидива заболевания.
Ни у одного пациента не было рецидива заболевания.
Обсуждение
Интерферон α является мощным белком с противоопухолевой активностью в отношении ряда видов рака, включая злокачественную меланому,19 гепатоцеллюлярную карциному20 и неоплазию шейки матки.21 22 часов лимбального поражения) или при поражениях, которые рецидивируют после первичного хирургического лечения. В настоящее время используются две формы терапии IFNα2b: субконъюнктивальные/периодальные инъекции и топическая капельная терапия. Использование местной терапии выгодно в отношении профиля ее побочных эффектов (т. е. отсутствие лихорадки, озноба, недомогания). Однако он требует более длительного лечения, является более дорогостоящим и не обеспечивает соблюдения пациентом режима лечения. Субконъюнктивальные инъекции обычно делаются еженедельно по цене около 65 долларов США за инъекцию, и пациенты получают в среднем шесть инъекций.8 Глазные капли MMC (0,02–0,04%) являются другим основным лекарственным средством, используемым в OSSN; их вводят четыре раза в день по цене около 180 долларов США за цикл, при этом клиническое выздоровление происходит в большинстве случаев после двух циклов.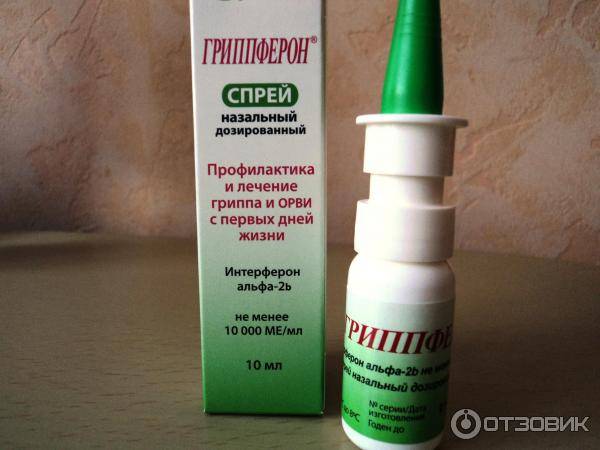 3 Однако местные побочные эффекты, включая боль и покраснение, более выражены при приеме ММС по сравнению с интерфероном.
3 Однако местные побочные эффекты, включая боль и покраснение, более выражены при приеме ММС по сравнению с интерфероном.
В нескольких сериях оценивалось использование местного интерферона для лечения CIN. Schechter и соавт. оценивали использование IFNα2b (большинство пациентов получали 1 миллион МЕ/мл четыре раза в день, меньшинство — 3 миллиона МЕ/мл четыре раза в день) в качестве единственного терапевтического средства на 28 глазах у 26 пациентов с CIN и обнаружили, что 96% глаз достигли полной ремиссии при терапии.17 У одного пациента был рецидив заболевания после прекращения терапии. Boehm и Huang оценили IFNα2b (1 млн МЕ/мл, четыре раза в день) у семи пациентов с предполагаемой рецидивирующей КИН и обнаружили, что шесть из семи пациентов успешно ответили на лечение.2 У двух пациентов развился рецидив после прекращения терапии.
В то время как время до разрешения поражения (медиана 2,4 месяца) и необходимая продолжительность лечения (медиана 3,8 месяца) были одинаковыми в нашем исследовании и в опубликованной литературе, процент пациентов с полным исчезновением поражения только при местной терапии был немного ниже в нашем исследовании. исследование (85%). Важно отметить, что в наше исследование были включены некоторые пациенты из когорты Шехтера. Меньший процент поражений, отвечающих на местный интерферон, может быть объяснен реферальным характером нашей практики. Мы видим много пациентов с обширными рецидивирующими поражениями, поскольку пациенты часто обращаются с целью избежать обширного иссечения/операции.
исследование (85%). Важно отметить, что в наше исследование были включены некоторые пациенты из когорты Шехтера. Меньший процент поражений, отвечающих на местный интерферон, может быть объяснен реферальным характером нашей практики. Мы видим много пациентов с обширными рецидивирующими поражениями, поскольку пациенты часто обращаются с целью избежать обширного иссечения/операции.
Побочные эффекты были легкими как в нашей когорте, так и в опубликованной литературе, что позволяет предположить, что местная терапия хорошо переносится. В исследованиях с применением местного интерферона сообщалось либо об отсутствии побочных эффектов лечения2, либо о легком точечном эпителиальном кератите4, либо о легкой гиперемии конъюнктивы и фолликулярном конъюнктивите16,17. Когда побочные эффекты развивались, они полностью исчезали в течение 1 месяца после прекращения терапии. В одной публикации сообщалось о развитии эпителиального микрокистозного отека, который сохранялся после прекращения терапии [23, 9]. 0003
0003
Ни в одном исследовании не проводилась специальная оценка оптимальной дозы терапии IFNα2b. Две дозы, составленные аптекой BPEI, составляют 1 и 3 миллиона МЕ/мл. Стоимость дозы в 3 миллиона МЕ/мл на момент написания этой статьи значительно выше, чем стоимость дозы в 1 миллион МЕ/мл (260 долларов США за флакон объемом 5 мл по сравнению со 120 долларами США). Нет данных о том, оправдана ли более высокая доза в отношении времени до разрешения поражения, рецидива заболевания и профиля побочных эффектов. Хотя наше исследование небольшое и, следовательно, имеет ограниченную мощность, наши результаты показывают, что не существует больших клинических различий в ответе опухоли между двумя дозами IFN-α2b. В группе 3 млн МЕ/мл может наблюдаться тенденция к более быстрому разрешению и усилению побочных эффектов. В свете этих общих соображений мы рекомендуем использовать дозу 1 миллион МЕ/мл при лечении CIN.
Как и во всех ретроспективных исследованиях, наши выводы следует интерпретировать с осторожностью из-за ограничений исследования. Наши выводы основаны на предположении, что исходные характеристики двух групп были схожими. Группы не были идентичными по многим факторам. Это могло исказить результаты, если очаги ЦИН в группе 3 млн МЕ/мл были более агрессивными, чем в группе 1 млн МЕ/мл. В анализ были включены пациенты как с первичным, так и с рецидивом заболевания. Хотя у равной доли пациентов в каждой группе было рецидивирующее заболевание, это могло также исказить наши результаты. Кроме того, большее количество пациентов с двусторонним поражением получали интерферон в дозе 3 млн МЕ/мл. Это приводит к смещению корреляции, поскольку ожидается, что глаза одного и того же пациента будут одинаково реагировать на лечение. Наконец, мы включили в наш анализ как подтвержденные биопсией, так и клинически диагностированные поражения; однако мы считаем это решение оправданным из-за высокой клинической точности диагностики CIN. Из-за небольшого количества глаз с CIN, получавших только местную терапию интерфероном, и ретроспективного характера исследования эти ограничения трудно устранить.
Наши выводы основаны на предположении, что исходные характеристики двух групп были схожими. Группы не были идентичными по многим факторам. Это могло исказить результаты, если очаги ЦИН в группе 3 млн МЕ/мл были более агрессивными, чем в группе 1 млн МЕ/мл. В анализ были включены пациенты как с первичным, так и с рецидивом заболевания. Хотя у равной доли пациентов в каждой группе было рецидивирующее заболевание, это могло также исказить наши результаты. Кроме того, большее количество пациентов с двусторонним поражением получали интерферон в дозе 3 млн МЕ/мл. Это приводит к смещению корреляции, поскольку ожидается, что глаза одного и того же пациента будут одинаково реагировать на лечение. Наконец, мы включили в наш анализ как подтвержденные биопсией, так и клинически диагностированные поражения; однако мы считаем это решение оправданным из-за высокой клинической точности диагностики CIN. Из-за небольшого количества глаз с CIN, получавших только местную терапию интерфероном, и ретроспективного характера исследования эти ограничения трудно устранить. Для подтверждения наших выводов потребуется более крупное многоцентровое исследование с большим количеством пациентов и более длительным наблюдением.
Для подтверждения наших выводов потребуется более крупное многоцентровое исследование с большим количеством пациентов и более длительным наблюдением.
ссылки
- ↵
- Путуллил А.М.,
- Колби К.А.
- ↵
- Boehm MD,
- Huang AJ
- ↵
- Frucht-Pery J,
- Sugar J,
- Baum J,
- и др.
- ↵
- Кобаяши А.,
- Ёсита Т.,
- Утияма К.,
- и др.
 Успешное лечение конъюнктивальной интраэпителиальной неоплазии интерфероном альфа-2b. Jpn J Ophthalmol 2002;46:215–17.
Успешное лечение конъюнктивальной интраэпителиальной неоплазии интерфероном альфа-2b. Jpn J Ophthalmol 2002;46:215–17. - ↵
- Маймудар П.А.,
- Эпштейн Р.Дж.
- ↵
- Прабхасават П.,
- Таринворакуп П.,
- Тесавибул Н.,
- и др.
- ↵
- Розенман Ю.,
- Фрухт-Пери Ю.
- ↵
- Vann RR,
- Karp CL
 Офтальмология 1999;106:91–7.
Офтальмология 1999;106:91–7. - ↵
- Yeatts RP,
- Engelbrecht NE,
- Curry CD,
- и др.
- ↵
- Yeatts RP,
- Ford JG,
- Stanton CA,
- и др.
- ↵
- Wilson MW,
- Hungerford JL,
- Джордж С.М.,
- и др.
- ↵
- Heigle TJ,
- Stulting RD,
- Palay DA
 Am J Ophthalmol 1997;124:397–9.
Am J Ophthalmol 1997;124:397–9. - ↵
- Шевалье С.,
- Павлоцкий Ю.М.
- ↵
- Чакалова Г.,
- Ганчев Г.
- ↵
- Эдвардс Л.,
- Берман Б.,
- Рапини Р.П.,
- и др.
- ↵
- Карп С.Л.,
- Мур Дж.К.,
- Роза Р.Х. мл.

- ↵
- Шехтер Б.А.,
- Корейши А.Ф.,
- Карп CL,
- и др.
- ↵
- Schechter BA,
- Schrier A,
- Nagler RS,
- и др.
- ↵
- Хаушильд А,
- Гогас Х,
- Тархини А,
- и др.
- ↵
- Vitale FV,
- Romeo P,
- Vasta F,
- и др.

- ↵
- Сантанам С,
- Декатрис М,
- О’Бирн К.
- ↵
- Декатрис М.,
- Сантанам С.,
- О’Бирн К.
- ↵
- Алдаве А.Дж.,
- Нгуен А.


 Чтобы укрепить иммунитет ребенка, врачи предлагают различные препараты. Один из них — иммунал для детей.
Чтобы укрепить иммунитет ребенка, врачи предлагают различные препараты. Один из них — иммунал для детей.