Лимфоидная ткань кишечника как основа иммунной системы пищеварительного тракта
Библиографическое описание:Норматов, Р. А. Лимфоидная ткань кишечника как основа иммунной системы пищеварительного тракта / Р. А. Норматов, Ю. В. Марьяновская. — Текст : непосредственный // Молодой ученый. — 2017. — № 20 (154). — С. 201-203. — URL: https://moluch.ru/archive/154/43637/ (дата обращения: 21.03.2023).
Желудочно-кишечный тракт — высокоспециализированный орган, которой участвует в поглощении переработки и усвоении питательных веществ. Кроме этого он выполняет другие не менее важные функции. Кишечник — важный орган иммунной системы: он постоянно контактирует с большим количеством веществ и агентов внешней среды, а также факторов, влияющих на жизнедеятельность всего организма. В статье представлена характеристика составных частей иммунной системы пищеварительного тракта и их роль в формировании иммунного ответа организма на антигенное воздействие.
Ключевые слова: антигены, иммуноглобулины, иммунокомпетентные клетки, иммунный ответ, лимфоидная ткань, пищеварительный тракт
Воздействие антигенов внешней среды является ключевым фактором в развитии защитных реакций против различных патогенных микроорганизмов и многих органических и неорганических веществ, в том числе канцерогенов [7].
Кишечник является основной зоной, где происходит сенсибилизация иммуноцитов, которые затем заселяют другие слизистые оболочки и служат отправной точкой для циркуляции клеток между различными органами. Иммунокомпетентные ткани пищеварительного тракта получили название лимфоидной ткани. Этой ткани принадлежит важная роль защите организма от антигенов. Следует заметить, что к механизмам защиты принадлежат так же секреция слизи и перистальтика кишечника.
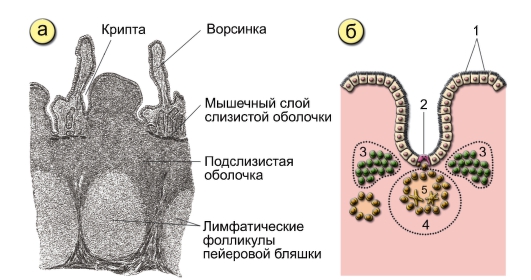
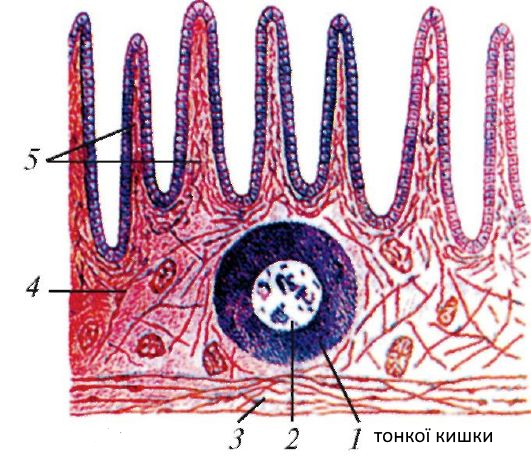
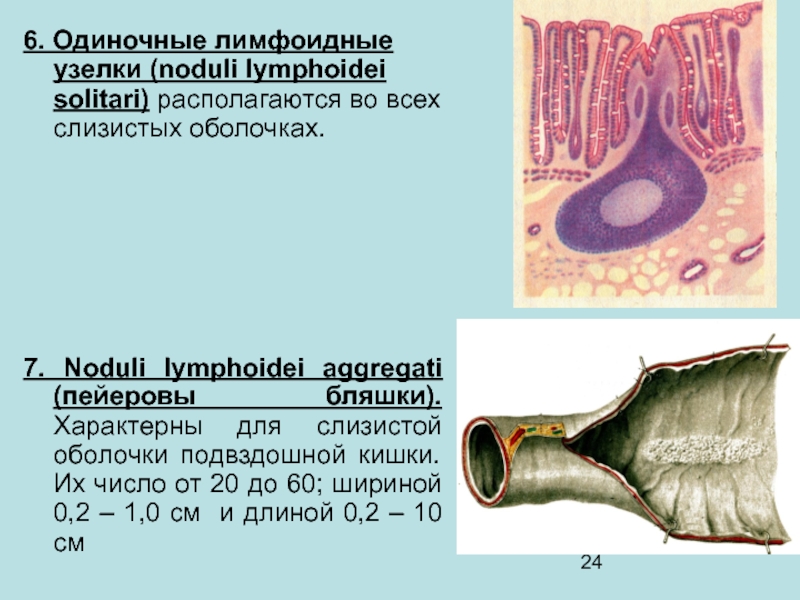
Лимфоидная ткань в стенке пищеварительного тракта существует в четырех анатомических зонах: 1) лимфоциты, расположенные базально, между эпителиальными клетками слизистой оболочки — интраэпителиальные лимфоциты; 2) лимфоциты, расположенные в соединительной ткани собственного слоя слизистой оболочки-лимфоциты собственного слоя; 3) специфические скопления лимфоидных клеток в слизистой оболочке тонкой кишки в частности в тощей кишке — пейеровы бляшки; 4) солитарные лимфоидные фолликулы слизистой оболочки [1, 5].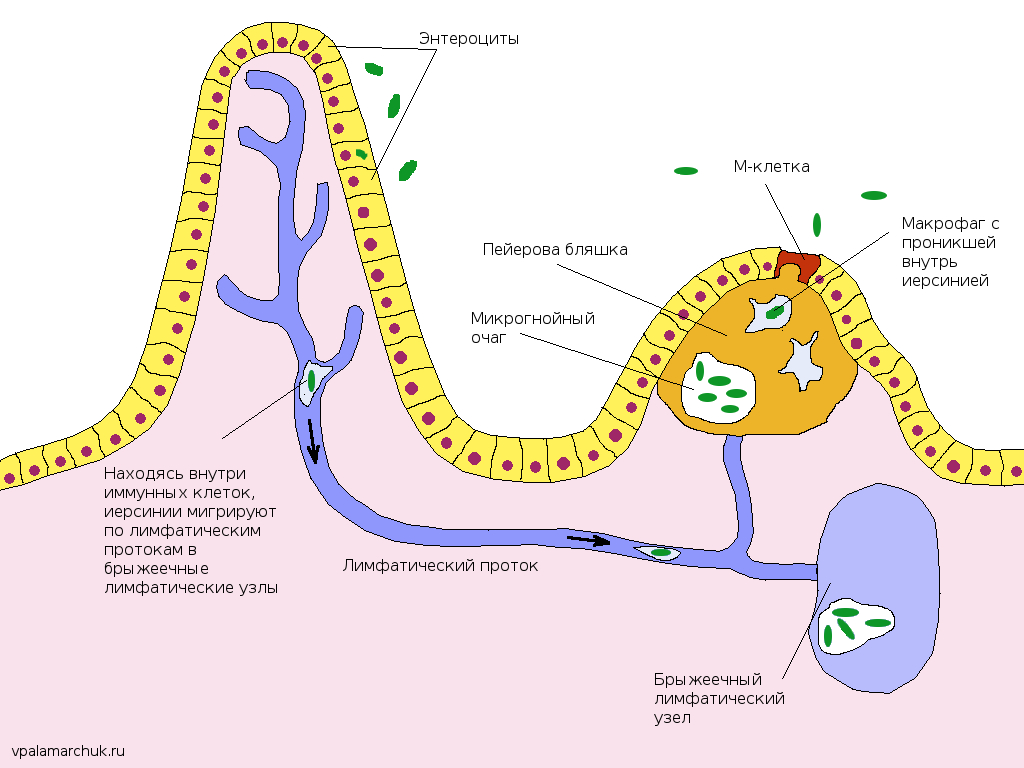
Важными составными частями иммунной системы пищеварительного тракта являются слюнные железы, лимфоидная ткань глотки, региональные лимфатические узлы и ретикуло-эндотелиальная ткань печени.
Интраэпителиальные лимфоциты локализуются базально между эпителиальными клетками слизистой оболочки, в особенности в тех местах, которые соприкасаются с внешней средой. Количество лимфоцитов данного типа в среднем составляет 21 на 100 эпителиальных клеток. Эти лимфоциты различны по своей форме и размерам, а также по содержанию гранул в цитоплазме. Они могут мигрировать в обоих направлениях через базальную мембрану. Гранулы интраэпителиальных лимфоцитов и тучных клеток сходны по своему строению и химическому составу, поэтому высказывается некое предположение эти лимфоциты это Т-лимфоциты, которые особым образом связаны с тучными клетками слизистой оболочки кишечника. Среди интраэпителиальных лимфоцитов выделены Т- и В-лимфоциты, но их точное подразделение на группы до сих пор неизвестно [1].
Лимфоциты собственного слоя хоть и изучались многими специалистами более интенсивно, чем интраэпителиальные лимфоциты, но данные о них весьма разрозненные и содержат много противоречий. Установлено что в слизистой оболочке тонкого кишечника человека их содержится до 11000 на мм. Среди лимфоцитов преобладают В-клетки, их численность более 50 %, содержащие поверхностный IgA. Оставшаяся часть В-лимфоцитов представлена клетками с поверхностными IgM и IgG. Т-лимфоциты тоже присутствуют, но об их подклассах практически ничего неизвестно, кроме того что они продуцируют антитела и могут проникать в слизистую кишки находящуюся в непосредственном контакте с бляшками [3].
Важнейшее свойство кишечника — феномен рециркуляции лимфоцитов. Сенсибилизированные антигенами (как пищевыми, так и инфекционными) лимфоциты пейеровых бляшек мигрируют в брыжеечные лимфатические узлы, а оттуда по лимфатическим сосудам через грудной проток и систему кровообращения направляются к собственному слою слизистой оболочки кишечника, главным образом в качестве клеток, секретирующих IgA.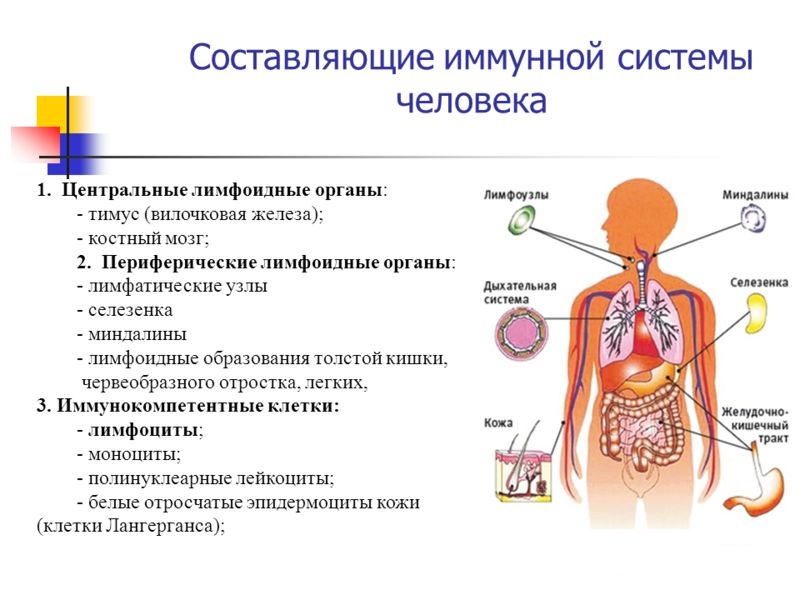
Попавшие в просвет кишечника или на слизистые оболочки антигены распознаются иммуноглобулинами памяти (IgG), после чего информация передается в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматическими клетками, ответственными за синтез IgА и IgМ. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Иммунная система «запоминает» антигены, чему способствуют генетические факторы, а также антитела класса IgG, передающиеся, например, от матери плоду во время беременности, и иммуноглобулины, поступающие в ЖКТ ребенка с грудным молоком.
Главная функция кишечных иммуноглобулинов (Ig) — иммунное отторжение у поверхности слизистой оболочки. Известно, что IgA преобладает среди иммуноглобулинов во всех секретах и в собственной пластинке кишечника. Секреторный IgA, выполняющий роль главного уничтожителя антигенов и иммуномодулятора слизистой оболочки ЖКТ, удерживается около эпителиальных клеток в результате взаимодействия с гликокаликсом, во многом благодаря присутствию микрофлоры кишечника. IgA занимает благоприятную позицию, препятствующую поглощению антигенов. Двумерная молекула IgA может функционировать как агглютинин, уменьшая прилипание бактерий к энтероцитам.
Особое значение в иммунологических функциях желудочно-кишечного тракта придается тонкой кишке, в которой организованная лимфоидная ткань представлена сгруппированными лимфатическими узелками, аппендиксом и лимфатическими узлами брижейки. Эти органы включают зону с фолликулярными структурами, содержащую в основном В-лимфоциты и интрафолликулярную (паракортикальную) зону, состоящую в основном из Т-лимфоцитов, расположенных вокруг высокоэндотелиальных венул. Эпителиальные структуры сгруппированных лимфатических узелков специализированы на поглощении антигенов макрофагами [2].
Эпителиальные структуры сгруппированных лимфатических узелков специализированы на поглощении антигенов макрофагами [2].
Пейеровы бляшки это структурно организованные и оформленные скопления лимфоидных клеток в подслизистом слое тонкой кишки. Так у человека они появляются по ходу всей тонкой кишки уже на 24-й недели внутриутробного развития. Пейеровы бляшки окружены М-клетками, которые лишены ворсинок и ответственны за транспортные и частично метаболические процессы. К ним относят способность транспортировать макромолекулы и частицы из просвета кишки в лимфоциты пейеровых бляшек. Бляшки плохо развиты у животных, выращиваемых в стерильных условиях. В пейеровых бляшках содержится до 40 % Т-лимфоцитов, которые располагаются в межфолликулярном пространстве [5, 6].
Наибольшая концентрация пейеровых бляшек отмечена в аппендиксе — червеобразном отростке слепой кишки. Известно, что он имеется далеко не у всех животных, например, его нет у кошек, но он присутствует у человека, обезьян, кроликов и ряда жвачных животных.
Солитарные лимфоидные фолликулы содержатся в слизистой оболочке и подслизистой основе кишечника. Но в отличие от пейеровых бляшек не имеют тесной связи с эпителием. Этот вид лимфатических образовании содержит Т-клетки, В-клетки, а также макрофаги. Сенсибилизированные лимфоциты в дальнейшем мигрируют в брыжеечные лимфатические узлы, а оттуда в грудной проток и систему кровоснабжения к собственному слою кишечника.
Важную роль играет система иммуногенеза в деятельности толстой кишки, непосредственно соприкасающейся с различными бактериальными антигенами. В ней содержится большое количество клеток, несущих Ig. Клетки, несущие IgА и IgМ, располагаются преимущественно в поверхностном эпителии, а несущие IgG — в базальных отделах слизистой оболочки толстой кишки.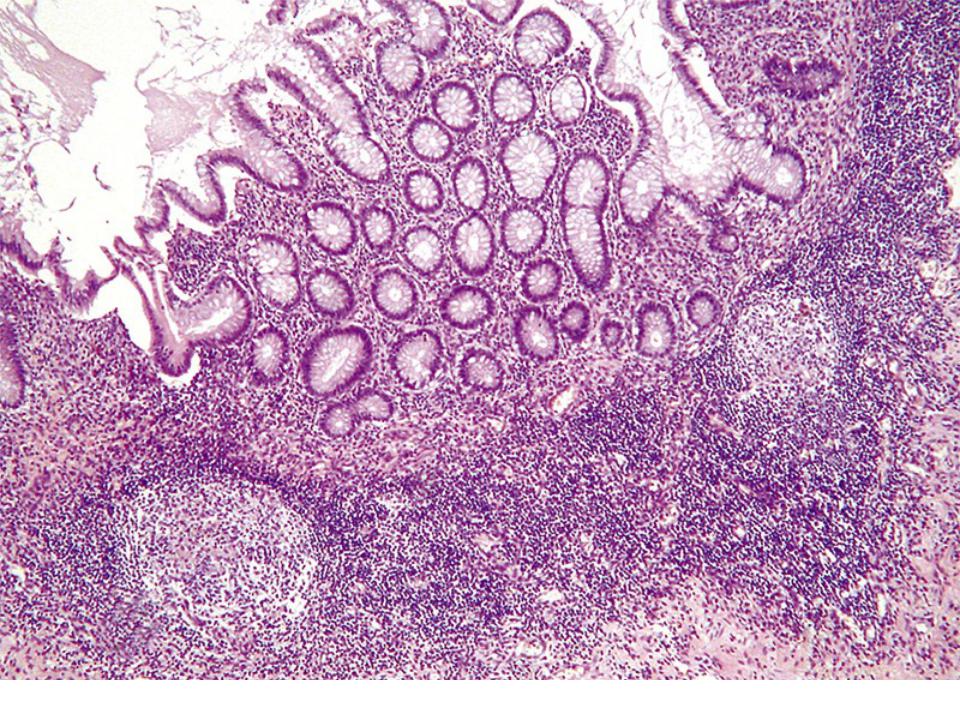
Слизистая оболочка здорового млекопитающего не может полностью заблокировать проникновение антигенов из полости кишечника в его стенку, а затем в циркулирующую кровь. Например, ботулинистический токсин, попав в кишечник, не задерживается в просвете кишки, а проходит через кишечную стенку в интерстинальную лимфу. Предполагают, что такой обходной путь миграции антигенов в обход системы IgA может быть неким приспособлением кишечника к защите от антигенов либо проявлением сложной многоступенчатой стратегии защиты кишечника от антигенов [4].
Таким образом, на всем протяжении кишечника лимфатические ткани и их элементы представлены весьма широко. Они разнообразны строению и функциям. Клеточный иммунитет кишечника в отличие от системы секретируемых им антител изучен недостаточно. Известно, что после перорального воздействия антигенов системные клеточные иммунные реакции выявляются редко. Возможно, когда здоровый организм получают безвредные антигены (например, антигены нормальной микрофлоры), в слизистой оболочке кишечника не развиваются реакции клеточного иммунитета. Или если иммунная реакция происходит, то иммунные клетки кишечника не могут сохранять в клетках памяти информацию об антигене. Это свидетельствует о наличии в кишечнике механизмов иммунной памяти, но они, в отличие от системного иммунного ответа, не носят долговременного характера.
Возможно, когда здоровый организм получают безвредные антигены (например, антигены нормальной микрофлоры), в слизистой оболочке кишечника не развиваются реакции клеточного иммунитета. Или если иммунная реакция происходит, то иммунные клетки кишечника не могут сохранять в клетках памяти информацию об антигене. Это свидетельствует о наличии в кишечнике механизмов иммунной памяти, но они, в отличие от системного иммунного ответа, не носят долговременного характера.
Литература:
- Галактионов В. Г. Эволюционная иммунология: учеб. пособие для вузов. М.: ИКЦ «Академкнига», 2005. 407 с.
- Кузник Б. И. Иммуногенез, гомеостаз и неспецифическая резистентность организма / Б. И. Кузник, Н. В. Васильев, Н. Н. Цыбиков. М.: Медицина, 1989. С. 191–200.
- Ройт А., Бростофф Дж., Мейбл Д. Иммунология. М.: Мир, 2000. 592 с.
- Скопичев В. Г. Физиолого-биохимические основы резистентности животных / В. Г. Скопичев, Н. Н. Максимюк. С.-Петербург: изд-во «Лань», 2009.
 352 с.
352 с. - Тейлор Д. Биология = Biological Science 1&2: В З т. Т.1 / Под ред. Р. Сопера; Пер.с англ.: Ю. Л. Амченкова и др. 3-е изд. М.: Мир, 2004. 454 с.
- Хаитов Р. М. и др. Иммунология: Учебник для вузов. М.: ГЭОТАР–Медиа, 2011. 311 с.
- Ребезов М. Б., Чупракова А. М., Зинина О. В., Максимюк Н. Н., Абуова А. Б. Оценка методов исследования ксенобиотиков.. Уральск, 2015.
Основные термины (генерируются автоматически): слизистая оболочка, лимфоцит, пищеварительный тракт, антиген, иммунная система, клетка, тонкая кишка, бляшка, внешняя среда, главная функция.
Нодулярная лимфоидная гиперплазия (НЛГ) / Заболевания / Клиника ЭКСПЕРТ
Нодулярная лимфоидная гиперплазия (НЛГ) ― довольно редкое доброкачественное заболевание, характеризующееся множественными узелками в слизистой оболочке различных отделов желудочно-кишечной трубки: тонкой и толстой кишки, а также желудка.
Распространенность этого заболевания до конца неизвестна, оно достаточно часто встречается у детей до 10 лет, однако иногда может наблюдаться и у взрослых лиц.
Классификация НЛГ
Выделяют две формы заболевания:
1) Фокальная НЛГ ― представлена отдельными очагами, локализованными чаще всего в терминальном отделе подвздошной кишки, прямой кишке и других участках желудочно-кишечного тракта
2) Диффузная НЛГ ― для этой формы характерно вовлечение больших участков желудочно-кишечной трубки (например, вся тонкая кишка).
Этиопатогенез НЛГ
Патогенетические механизмы развития НЛГ до сих пор остаются неясными. Однако существуют несколько теорий, которые отличаются друг от друга в зависимости от того, имеется ли у пациента ассоциированное иммунодефицитное состояние или нет.
Так, если у пациента подтвержден иммунодефицит, то образование узелков в слизистой оболочке может быть результатом скопления предшественников плазматических клеток (неспособных к полноценному созреванию В-лимфоцитов).
НЛГ при отсутствии нарушений иммунодефицита может быть связана с иммунной стимуляцией лимфоидной ткани кишечника. Эта гипотеза предполагает наличие постоянных раздражителей (триггеров) в просвете желудочно-кишечной трубки, чаще всего инфекционного происхождения. Повторяющаяся стимуляция иммунных клеток может привести к возможной гиперплазии лимфоидных фолликулов. Такой механизм может объяснить нередкую ассоциацию лямблиоза и Helicobacter pylori с НЛГ (см.ниже).
Эта гипотеза предполагает наличие постоянных раздражителей (триггеров) в просвете желудочно-кишечной трубки, чаще всего инфекционного происхождения. Повторяющаяся стимуляция иммунных клеток может привести к возможной гиперплазии лимфоидных фолликулов. Такой механизм может объяснить нередкую ассоциацию лямблиоза и Helicobacter pylori с НЛГ (см.ниже).
Клинические проявления НЛГ
Зачастую НЛГ не имеет никаких симптомов и является случайной находкой во время эндоскопического исследования желудка, толстой и тонкой кишки. Однако некоторые исследователи связывают НЛГ с желудочно-кишечными симптомами, такими как хроническая диарея, боль в животе, желудочно-кишечное кровотечение (оккультное или явное, из прямой кишки) и кишечная непроходимость (очень редко). У части пациентов может отмечаться потеря белка и снижение массы тела.
Насколько велик вклад НЛГ в возникновение симптомов, до сих пор остается неясным. Является ли это состояние первопричиной жалоб или НЛГ ― всего лишь случайная находка у пациента с желудочно-кишечной симптоматикой? Вопросов больше, чем ответов.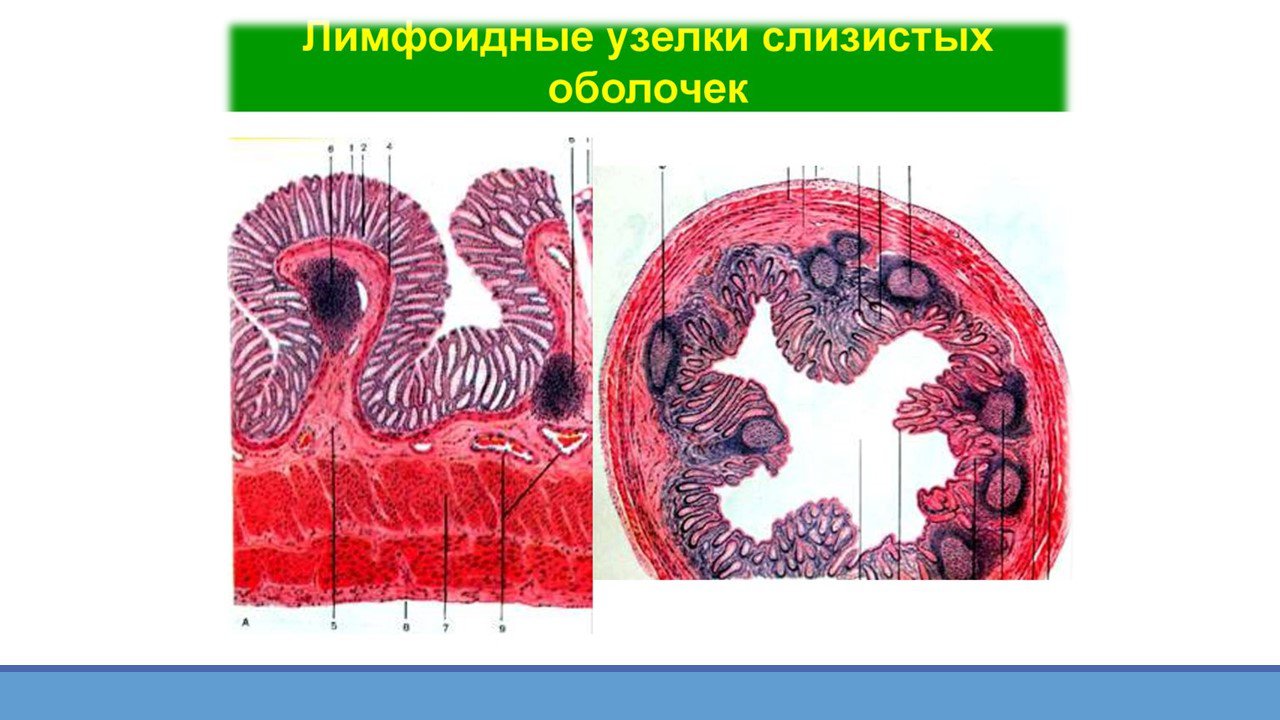
Ассоциированные с НЛГ заболевания и состояния
Достаточно часто по сравнению с другими лицами НЛГ выявляется у пациентов с иммунодефицитами. Так, 20% больных, страдающих общим вариабельным иммунодефицитом (ОВИД), имеют НЛГ. ОВИД ― заболевание, характеризующееся снижением уровней иммуноглобулинов различных субклассов (G, A, M), нарушенным иммунным ответом из-за снижения выработки антител. Пациенты часто страдают рецидивирующими бактериальными инфекциями дыхательных путей, аутоиммунными заболеваниями и имеют повышенный риск развития онкологических патологий. НЛГ при ОВИД обычно генерализованная, с вовлечением всей тонкой кишки.
НЛГ нередко ассоциирована с селективным дефицитом IgA, который выявляется у 1 из 300-700 лиц европеоидной расы. У таких людей отмечается снижение уровня IgA в крови ниже 0,7 г/л при нормальных или даже повышенных уровнях других иммуноглобулинов. Большинство лиц с селективным дефицитом IgA бессимптомны, однако у части из них встречаются рецидивирующие инфекции верхних дыхательных путей, аутоиммунные заболевания, аллергии и желудочно-кишечные патологии (целиакия, НЛГ).
НЛГ может быть ассоциирована с лямблиозом как у лиц с нормальным иммунным ответом, так и с иммунодефицитом. Триада НЛГ + лямблиоз + снижение уровня гамма-глобулинов известна как синдром Германа (англ. Herman’s syndrome).
Инфекция Helicobacter pylori может быть причиной развития НЛГ с вовлечением желудка и 12-перстной кишки.
НЛГ также нередко встречается у лиц с ВИЧ-инфекцией, может быть ассоциирована с семейным аденоматозом толстой кишки и синдромом Гарднера.
Существуют данные о возможной ассоциации синдрома раздраженного кишечника (СРК) с НЛГ. При этом рядом авторов НЛГ рассматривается как проявление малоактивного воспаления в слизистой оболочке толстой кишке у пациентов с СРК.
Осложнения НЛГ
НЛГ ― заболевание доброкачественное, и крайне редко приводит к развитию осложнений. Однако описаны случаи кишечной непроходимости у лиц с распространенным процессом в тонкой кишке, а также кишечных кровотечений..
Известно, что у лиц с НЛГ повышается риск лимфопролиферативных заболеваний (лимфомы), однако точный риск не установлен.
Диагностика НЛГ
Существует два основных метода диагностики НЛГ:
1) Эндоскопический ― выявление узелков различных размеров (2-10 мм, в среднем 5 мм) на слизистой оболочке желудка, тонкой кишки, толстой/прямой кишки. Такие узелки (чаще всего в виде выступающих папул) могут быть обнаружены при гастроскопии (ЭГДС), колоноскопии, энтероскопии или капсульной эндоскопии.
На фото ― НЛГ в 12-перстной кишке.
2) Гистологический метод ― выявление в слизистой оболочке и в поверхностной части подслизистого слоя увеличенных (гиперплазированных) лимфоидных фолликулов, которые обычно формируют группы, и могут практически сливаться между собой.
Дифференциальный диагноз
Дифференциальный диагноз ЛНГ проводится с лимфопролиферативными заболеваниями (лимфома тонкой кишки, желудка). При локализации НЛГ в толстой кишке ее элементы (узелки) могут напоминать аденоматозные полипы.
Важно помнить, что у некоторых пациентов при проведении илеоколоноскопии в подвздошной кишке могут также выявляться лимфоидные фолликулы. В этой зоне концентрация лимфоидных фолликулов максимальная по сравнению с другими отделами кишечной трубки. При этом в отличие от НЛГ узелки (те самые лимфоидные фолликулы) небольших размеров (1-3 мм, реже больше), они располагаются отдельно друг от друга, не сливаясь, между ними видны участки нормальной слизистой. Эти изменения не следует рассматривать как патологию, они ― вариант нормы.
В этой зоне концентрация лимфоидных фолликулов максимальная по сравнению с другими отделами кишечной трубки. При этом в отличие от НЛГ узелки (те самые лимфоидные фолликулы) небольших размеров (1-3 мм, реже больше), они располагаются отдельно друг от друга, не сливаясь, между ними видны участки нормальной слизистой. Эти изменения не следует рассматривать как патологию, они ― вариант нормы.
Лечение НЛГ
Сама по себе ЛНГ не требует лечения. В случае, если имеются ассоциированные заболевания (лямблиоз, инфекция Helicobacter pylori), следует провести терапию, направленную на удалению возбудителя.
Прогноз НЛГ
Прогноз НЛГ в целом благоприятный, в большинстве случаев требуется лишь динамическое наблюдение за пациентом.
Изолированные лимфоидные фолликулы в толстой кишке: точки переключения между воспалением и колоректальным раком?
1. Nascimbeni R, Di Fabio F, Di Betta E, Mariani P, Fisogni S, Villanacci V. Морфология колоректальных лимфоидных агрегатов при раке, дивертикулярных и воспалительных заболеваниях кишечника.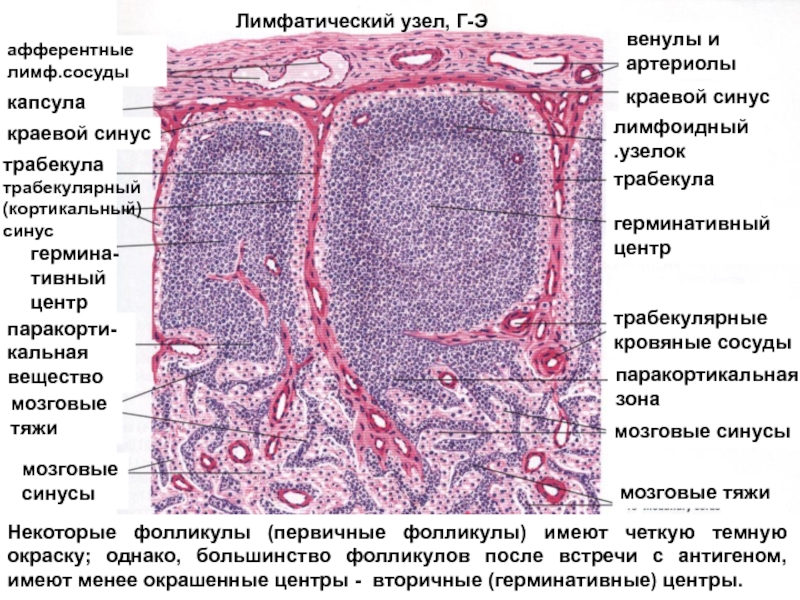 Мод Патол. 2005; 18: 681–685. [PubMed] [Google Scholar]
Мод Патол. 2005; 18: 681–685. [PubMed] [Google Scholar]
2. Sipos F, Muzes G, Valcz G, Galamb O, Tóth K, Leiszter K, Krenács T, Tulassay Z, Molnár B. Экспрессия рецептора фактора роста, связанного с регенерацией, и экспрессия эпителиального маркера в лимфоидных агрегатах язвенного колита. Scand J Гастроэнтерол. 2010;45:440–448. [PubMed] [Академия Google]
3. Dieu-Nosjean MC, Antoine M, Danel C, Heudes D, Wislez M, Poulot V, Rabbe N, Laurans L, Tartour E, de Chaisemartin L, et al. Отдаленная выживаемость больных немелкоклеточным раком легкого с внутриопухолевыми лимфоидными структурами. Дж. Клин Онкол. 2008; 26:4410–4417. [PubMed] [Google Scholar]
4. Шайя Дж., Блэк Д., Хаммер А.Дж., Бойд Дж., Сослоу Р.А. Обычно оцениваемые морфологические особенности коррелируют со статусом микросателлитной нестабильности при раке эндометрия. Хум Патол. 2008; 39: 116–125. [PubMed] [Академия Google]
5. Wada Y, Nakashima O, Kutami R, Yamamoto O, Kojiro M. Клинико-патологическое исследование гепатоцеллюлярной карциномы с лимфоцитарной инфильтрацией.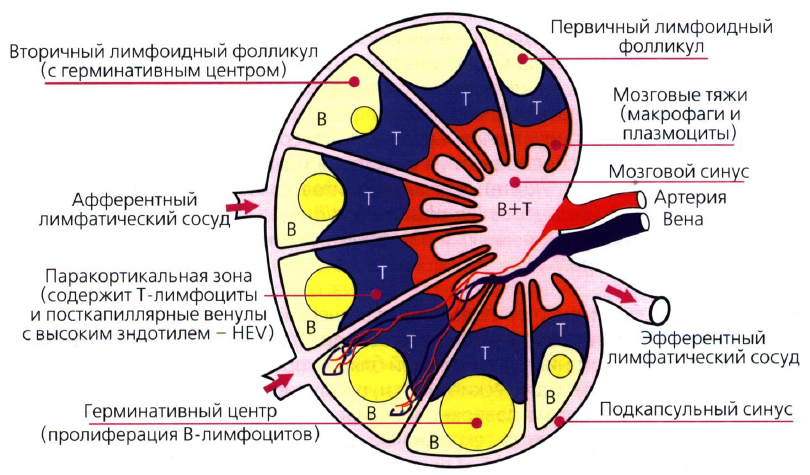 Гепатология. 1998; 27: 407–414. [PubMed] [Google Scholar]
Гепатология. 1998; 27: 407–414. [PubMed] [Google Scholar]
6. Paulsen JE, Steffensen IL, Olstørn HB, Alexander J. Распространенное расположение очагов плоских диспластических аберрантных крипт вблизи лимфоидных фолликулов в толстой кишке крыс, получавших азоксиметан. Противораковый Рез. 2006; 26: 1803–1807. [PubMed] [Google Scholar]
7. Hardman WE, Cameron IL. Крипты толстой кишки, расположенные над лимфоидными узелками у крыс, получавших 1,2-диметилгидразин, гиперпластичны и подвержены высокому риску образования аденокарциномы. Канцерогенез. 1994;15:2353–2361. [PubMed] [Google Scholar]
8. Наусс К.М., Локнискар М., Павлина Т., Ньюберн П.М. Морфология и распределение опухолей толстой кишки, индуцированных 1,2-диметилгидразин дигидрохлоридом, и их связь с лимфоидной тканью кишечника у крыс. J Natl Cancer Inst. 1984; 73: 915–924. [PubMed] [Google Scholar]
9. Fu KI, Sano Y, Kato S, Fujii T, Koba I, Yoshino T, Ochiai A, Yoshida S, Fujimori T. Распространенность и локализация лимфоидных фолликулов в ранних колоректальных новообразованиях. Мир J Гастроэнтерол. 2005; 11: 6863–6866. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мир J Гастроэнтерол. 2005; 11: 6863–6866. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Саксена С.К., Томпсон Дж.С., Шарп Дж.Г. Роль организованных кишечных лимфоидных агрегатов в регенерации кишечника. J Invest Surg. 1997; 10: 97–103. [PubMed] [Google Scholar]
11. You S, Ohmori M, Peña MM, Nassri B, Quiton J, Al-Assad ZA, Liu L, Wood PA, Berger SH, Liu Z, et al. Аномалии развития в множественных пролиферативных тканях мышей Apc(Min/+). Int J Exp Pathol. 2006; 87: 227–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Raclot G, Devalland C, Potet F, Bernard F, Monath C. [Карцинома толстой кишки, возникающая de novo рядом с лимфоидным фолликулом] Gastroenterol Clin Biol. 1991;15:775–776. [PubMed] [Google Scholar]
13. Heel KA, McCauley RD, Papadimitriou JM, Hall JC. Обзор: Пейеровы бляшки. J Гастроэнтерол Гепатол. 1997; 12:122–136. [PubMed] [Google Scholar]
14. Sipos F, Muzes G, Galamb O, Spisák S, Krenács T, Tóth K, Tulassay Z, Molnár B. Возможная роль изолированных лимфоидных фолликулов в восстановлении слизистой оболочки толстой кишки. Патол Онкол Рез. 2010; 16:11–18. [PubMed] [Google Scholar]
Возможная роль изолированных лимфоидных фолликулов в восстановлении слизистой оболочки толстой кишки. Патол Онкол Рез. 2010; 16:11–18. [PubMed] [Google Scholar]
15. Neutra MR, Mantis NJ, Kraehenbuhl JP. Сотрудничество эпителиальных клеток с организованными лимфоидными тканями слизистой оболочки. Нат Иммунол. 2001; 2: 1004–1009.. [PubMed] [Google Scholar]
16. О’Брайен Л.М., Фитцпатрик Э., Бэрд А.В., Кэмпион Д.П. Взаимодействие эозинофилов с нервами и пластичность нейронов в лимфоидной ткани, ассоциированной с кишечником крысы (GALT), в ответ на кишечный паразитизм. J Нейроиммунол. 2008; 197:1–9. [PubMed] [Google Scholar]
17. Neutra MR, Frey A, Kraehenbuhl JP. Эпителиальные М-клетки: ворота для инфекции слизистой оболочки и иммунизации. Клетка. 1996; 86: 345–348. [PubMed] [Google Scholar]
18. Niedergang F, Kraehenbuhl JP. Много шума из-за М-клеток. Тенденции клеточной биологии. 2000; 10: 137–141. [PubMed] [Академия Google]
19. Azzali G. Структура, лимфатическая васкуляризация и миграция лимфоцитов в лимфоидной ткани, ассоциированной со слизистой оболочкой. Immunol Rev. 2003; 195:178–189. [PubMed] [Google Scholar]
Immunol Rev. 2003; 195:178–189. [PubMed] [Google Scholar]
20. Baird AW, Cuthbert AW. Вовлечение нейронов в реакции гиперчувствительности 1 типа в эпителии кишечника. Бр Дж. Фармакол. 1987; 92: 647–655. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. O’Malley KE, Sloan T, Joyce P, Baird AW. Реакции гиперчувствительности I типа на слизистой оболочке кишечника крыс, инфицированных Fasciola hepatica. Иммунол от паразитов. 1993;15:449–453. [PubMed] [Google Scholar]
22. Вылчанова Л., Кейси М.А., Крабб Г.В., Кеннеди В.Р., Браун Д.Р. Анатомические доказательства кишечных нейроиммунных взаимодействий в пейеровых бляшках. J Нейроиммунол. 2007; 185:64–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Chiocchetti R, Mazzuoli G, Albanese V, Mazzoni M, Clavenzani P, Lalatta-Costerbosa G, Lucchi ML, Di Guardo G, Marruchella G, Furness JB. Анатомические доказательства иннервации пейеровых бляшек подвздошной кишки энтеральной нервной системой: потенциальный путь прионной нейроинвазии? Сотовые Ткани Res. 2008; 332: 185–19.4. [PubMed] [Google Scholar]
2008; 332: 185–19.4. [PubMed] [Google Scholar]
24. Freemont AJ, Ford WL. Функциональные и морфологические изменения посткапиллярных венул в связи с лимфоцитарной инфильтрацией в БЦЖ-индуцированные гранулемы кожи крыс. Джей Патол. 1985; 147:1–12. [PubMed] [Google Scholar]
25. Кавендер Д.Е., Хаскард Д.О., Джозеф Б., Зифф М. Интерлейкин 1 увеличивает связывание В- и Т-лимфоцитов человека с монослоями эндотелиальных клеток. Дж Иммунол. 1986; 136: 203–207. [PubMed] [Google Scholar]
26. Перри М.Е., Мустафа Ю., Браун К.А. Микрососуды небной миндалины человека и ее роль в хоминге лимфоцитов. Adv Оториноларингол. 1992;47:11–15. [PubMed] [Google Scholar]
27. Kvietys PR, Sandig M. Диапедез нейтрофилов: парацеллюлярный или трансцеллюлярный? Новости физиол. 2001; 16:15–19. [PubMed] [Google Scholar]
28. Чемберлен Г., Фокс Дж., Эштон Б., Миддлтон Дж. Краткий обзор: мезенхимальные стволовые клетки: их фенотип, способность к дифференцировке, иммунологические особенности и потенциал для самонаведения. Стволовые клетки. 2007; 25: 2739–2749. [PubMed] [Google Scholar]
Стволовые клетки. 2007; 25: 2739–2749. [PubMed] [Google Scholar]
29. Витмер А.Н., Дай Дж., Вейх Х.А., Вренсен Г.Ф., Шлингеманн Р.О. Экспрессия рецепторов фактора роста эндотелия сосудов 1, 2 и 3 в покоящемся эндотелии. J Гистохим Цитохим. 2002; 50: 767–777. [PubMed] [Академия Google]
30. Waldner MJ, Wirtz S, Jefremow A, Warntjen M, Neufert C, Atreya R, Becker C, Weigmann B, Vieth M, Rose-John S, et al. Передача сигналов рецептора VEGF связывает воспаление и онкогенез при колит-ассоциированном раке. J Эксперт Мед. 2010; 207: 2855–2868. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Rafii S, Lyden D. Терапевтическая трансплантация стволовых клеток и клеток-предшественников для васкуляризации и регенерации органов. Нат Мед. 2003; 9: 702–712. [PubMed] [Google Scholar]
32. Takahashi T, Kalka C, Masuda H, Chen D, Silver M, Kearney M, Magner M, Isner JM, Asahara T. Мобилизация костного мозга, индуцированная ишемией и цитокинами. эндотелиальные клетки-предшественники неоваскуляризации. Нат Мед. 1999;5:434–438. [PubMed] [Google Scholar]
Нат Мед. 1999;5:434–438. [PubMed] [Google Scholar]
33. MacDermott RP, Sanderson IR, Reinecker HC. Центральная роль хемокинов (хемотаксических цитокинов) в иммунопатогенезе язвенного колита и болезни Крона. Воспаление кишечника Dis. 1998; 4: 54–67. [PubMed] [Google Scholar]
34. Spyridonidis A, Schmitt-Gräff A, Tomann T, Dwenger A, Follo M, Behringer D, Finke J. Химеризм эпителиальной ткани после трансплантации гемопоэтических клеток человека — реальное явление. Ам Джей Патол. 2004; 164:1147–1155. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Körbling M, Katz RL, Khanna A, Ruifrok AC, Rondon G, Albitar M, Champlin RE, Estrov Z. Гепатоциты и эпителиальные клетки донорского происхождения у реципиентов стволовых клеток периферической крови. N Engl J Med. 2002; 346: 738–746. [PubMed] [Google Scholar]
36. Okamoto R, Yajima T, Yamazaki M, Kanai T, Mukai M, Okamoto S, Ikeda Y, Hibi T, Inazawa J, Watanabe M. Поврежденный эпителий регенерируется клетками костного мозга.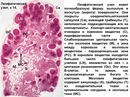 в желудочно-кишечном тракте человека. Нат Мед. 2002; 8: 1011–1017. [PubMed] [Академия Google]
в желудочно-кишечном тракте человека. Нат Мед. 2002; 8: 1011–1017. [PubMed] [Академия Google]
37. Гулд В.Е., Блум К.Дж., Франке В.В., Уоррен В.Х., Молл Р. Увеличение количества цитокератин-положительных клеток интерстициального ретикулума (CIRC) при реактивных, воспалительных и неопластических лимфаденопатиях: гиперплазия или индуцированная экспрессия? Арка Вирхова. 1995; 425: 617–629. [PubMed] [Google Scholar]
38. Sipos F, Molnár B, Zágoni T, Berczi L, Tulassay Z. Рост пролиферации и апоптоза эпителиальных клеток специфически коррелирует с воспалительной активностью воспалительных заболеваний кишечника: язвенный колит показывает специфические p53- и изменения экспрессии EGFR. Расстройство прямой кишки. 2005; 48: 775–786. [PubMed] [Академия Google]
39. Sipos F, Galamb O, Herszényi L, Molnár B, Solymosi N, Zágoni T, Berczi L, Tulassay Z. Повышенная экспрессия рецептора инсулиноподобного фактора роста 1, рецептора фактора роста гепатоцитов и белка теломеразы при легком язвенном колите. Scand J Гастроэнтерол. 2008; 43: 289–298. [PubMed] [Google Scholar]
Scand J Гастроэнтерол. 2008; 43: 289–298. [PubMed] [Google Scholar]
40. Pawelek JM, Chakraborty AK. Теория метастазирования раковых клеток и лейкоцитов. Adv Рак Res. 2008; 101: 397–444. [PubMed] [Google Scholar]
41. Pawelek JM, Chakraborty AK. Слияние опухолевых клеток с клетками костного мозга: объединяющее объяснение метастазирования. Нат Рев Рак. 2008; 8: 377–386. [PubMed] [Академия Google]
42. van Nierop K, de Groot C. Фолликулярные дендритные клетки человека: функция, происхождение и развитие. Семин Иммунол. 2002; 14: 251–257. [PubMed] [Google Scholar]
43. Park CS, Choi YS. Как фолликулярные дендритные клетки тесно взаимодействуют с В-клетками в зародышевом центре? Иммунология. 2005; 114: 2–10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Kapasi ZF, Qin D, Kerr WG, Kosco-Vilbois MH, Shultz LD, Tew JG, Szakal AK. Предшественники фолликулярных дендритных клеток (ФДК) в первичных лимфоидных тканях. Дж Иммунол. 1998;160:1078–1084. [PubMed] [Google Scholar]
45. Lindhout E, de Groot C. Фолликулярные дендритные клетки и апоптоз: жизнь и смерть в зародышевом центре. Histochem J. 1995; 27:167–183. [PubMed] [Google Scholar]
Lindhout E, de Groot C. Фолликулярные дендритные клетки и апоптоз: жизнь и смерть в зародышевом центре. Histochem J. 1995; 27:167–183. [PubMed] [Google Scholar]
46. Humphrey JH, Grennan D, Sundaram V. Происхождение фолликулярных дендритных клеток у мышей и механизм захвата ими иммунных комплексов. Евр Дж Иммунол. 1984; 14: 859–864. [PubMed] [Google Scholar]
47. Муньос-Фернандес Р., Бланко Ф.Дж., Фреча С., Мартин Ф., Киматраи М., Абадия-Молина А.С., Гарсия-Пачеко Х.М., Оливарес Э.Г. Фолликулярные дендритные клетки родственны предшественникам стромальных клеток костного мозга и миофибробластам. Дж Иммунол. 2006; 177: 280–289.. [PubMed] [Google Scholar]
48. Якубзик С., Богунович М., Бонито А.Дж., Куан Э.Л., Мерад М., Рэндольф Г.Дж. Мигрирующие по лимфе дендритные клетки тканевого происхождения являются второстепенными составляющими стационарных лимфатических узлов. J Эксперт Мед. 2008; 205: 2839–2850. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Diao J, Zhao J, Winter E, Cattral MS. Набор и дифференцировка обычных предшественников дендритных клеток в опухолях. Дж Иммунол. 2010; 184:1261–1267. [PubMed] [Google Scholar]
Diao J, Zhao J, Winter E, Cattral MS. Набор и дифференцировка обычных предшественников дендритных клеток в опухолях. Дж Иммунол. 2010; 184:1261–1267. [PubMed] [Google Scholar]
50. Auffray C, Fogg DK, Narni-Mancinelli E, Senechal B, Trouillet C, Saederup N, Leemput J, Bigot K, Campisi L, Abitbol M, et al. CX3CR1+ CD115+ CD135+ общие предшественники макрофагов/ДК и роль CX3CR1 в их ответе на воспаление. J Эксперт Мед. 2009 г.;206:595–606. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Le Borgne M, Etchart N, Goubier A, Lira SA, Sirard JC, van Rooijen N, Caux C, Aït-Yahia S, Vicari A, Kaiserlian D, и другие. Дендритные клетки, быстро рекрутируемые в эпителиальные ткани через CCR6/CCL20, ответственны за перекрестное примирование CD8+ Т-клеток in vivo. Иммунитет. 2006; 24:191–201. [PubMed] [Google Scholar]
52. Пауэлл Д.В., Миффлин Р.К., Валентич Д.Д., Кроу С.Е., Саада Д.И., Вест А.Б. Миофибробласты. II. Субэпителиальные миофибробласты кишечника. Am J Physiol. 1999;277:С183–С201. [PubMed] [Google Scholar]
1999;277:С183–С201. [PubMed] [Google Scholar]
53. Joyce NC, Haire MF, Palade GE. Морфологические и биохимические доказательства сети сократительных клеток в слизистой оболочке кишечника крысы. Гастроэнтерология. 1987; 92: 68–81. [PubMed] [Google Scholar]
54. Андох А., Бамба С., Фудзияма Ю., Бриттан М., Райт Н.А. Субэпителиальные миофибробласты толстой кишки при воспалении и восстановлении слизистой оболочки: вклад стволовых клеток костного мозга в регенеративный ответ кишечника. J Гастроэнтерол. 2005;40:1089–1099. [PubMed] [Google Scholar]
55. Уоллес Дж.Л., Грейнджер Д.Н. Клеточные и молекулярные основы защиты слизистой оболочки желудка. FASEB J. 1996; 10: 731–740. [PubMed] [Google Scholar]
56. Подольский Д.К. Заживление эпителия: решение проблемы с двух сторон. J Гастроэнтерол. 1997; 32: 122–126. [PubMed] [Google Scholar]
57. Бриттан М., Чанс В., Элиа Г., Поулсом Р., Элисон М.Р., Макдональд Т.Т., Райт Н.А. Регенеративная роль костного мозга после экспериментального колита: вклад в неоваскулогенез и миофибробласты. Гастроэнтерология. 2005;128:1984–1995. [PubMed] [Google Scholar]
Гастроэнтерология. 2005;128:1984–1995. [PubMed] [Google Scholar]
58. Fritsch C, Simon-Assmann P, Kedinger M, Evans GS. Цитокины модулируют фенотип фибробластов и эпителиально-стромальные взаимодействия в кишечнике крыс. Гастроэнтерология. 1997; 112: 826–838. [PubMed] [Google Scholar]
59. Бриттан М., Райт Н.А. Стволовые клетки в структуре желудочно-кишечного тракта и развитие новообразований. Кишка. 2004; 53: 899–910. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Танака Ф., Томинага К., Очи М., Танигава Т., Ватанабэ Т., Фудзивара Ю., Охта К., Оситани Н., Хигучи К., Аракава Т. Экзогенное введение мезенхимы стволовые клетки облегчают колит, вызванный декстрансульфатом натрия через оказывает противовоспалительное действие на поврежденные ткани у крыс. Жизнь наук. 2008; 83: 771–779. [PubMed] [Google Scholar]
61. Valcz G, Krenács T, Sipos F, Leiszter K, Tóth K, Balogh Z, Csizmadia A, Műzes G, Molnár B, Tulassay Z. Роль мезенхимального ствола, полученного из костного мозга Клетки в эпителиальной регенерации толстой кишки. Патол Онкол Рез. 2011; 17:11–16. [PubMed] [Google Scholar]
Патол Онкол Рез. 2011; 17:11–16. [PubMed] [Google Scholar]
62. De Wever O, Demetter P, Mareel M, Bracke M. Стромальные миофибробласты являются драйверами инвазивного роста рака. Инт Джей Рак. 2008;123:2229–2238. [PubMed] [Google Scholar]
63. Стенсон В.Ф. Толл-подобные рецепторы и восстановление кишечного эпителия. Курр Опин Гастроэнтерол. 2008; 24:103–107. [PubMed] [Google Scholar]
64. Ракофф-Нахум С., Паглино Дж., Эслами-Варзанех Ф., Эдберг С., Меджитов Р. Распознавание комменсальной микрофлоры толл-подобными рецепторами необходимо для гомеостаза кишечника. Клетка. 2004; 118: 229–241. [PubMed] [Google Scholar]
65. Li M, Carpio DF, Zheng Y, Bruzzo P, Singh V, Ouaaz F, Medzhitov RM, Beg AA. Существенная роль пути NF-каппа B / Toll-подобного рецептора в индукции экспрессии генов воспаления и восстановления тканей некротическими клетками. Дж Иммунол. 2001; 166:7128–7135. [PubMed] [Академия Google]
66. Бег А.А. Эндогенные лиганды Toll-подобных рецепторов: значение для регуляции воспалительных и иммунных реакций.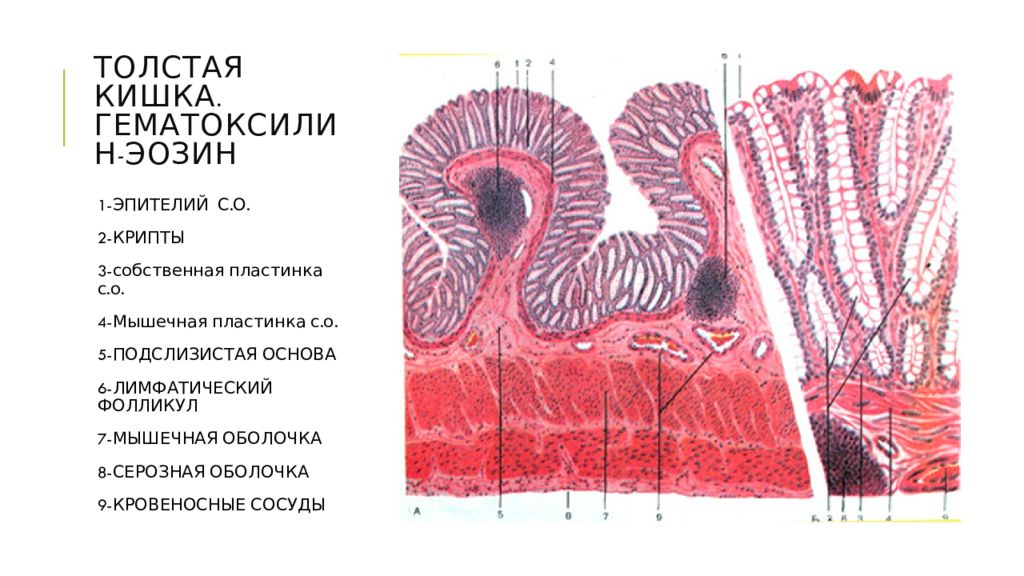 Тренды Иммунол. 2002; 23: 509–512. [PubMed] [Google Scholar]
Тренды Иммунол. 2002; 23: 509–512. [PubMed] [Google Scholar]
67. Taylor KR, Trowbridge JM, Rudisill JA, Termeer CC, Simon JC, Gallo RL. Фрагменты гиалуроновой кислоты стимулируют эндотелиальное распознавание повреждения посредством TLR4. Дж. Биол. Хим. 2004; 279:17079–17084. [PubMed] [Google Scholar]
68. Majors AK, Austin RC, de la Motte CA, Pyeritz RE, Hascall VC, Kessler SP, Sen G, Strong SA. Стресс эндоплазматического ретикулума вызывает отложение гиалуроновой кислоты и адгезию лейкоцитов. Дж. Биол. Хим. 2003; 278:47223–47231. [PubMed] [Академия Google]
69. Tang XY, Zhu YQ, Wei B, Wang H. Экспрессия и функциональное исследование TLR4 при карциноме толстой кишки человека. Am J Med Sci. 2010; 339:319–326. [PubMed] [Google Scholar]
70. Zhou B, Zhou H, Ling S, Guo D, Yan Y, Zhou F, Wu Y. Активация PAR2 и/или TLR4 способствует пролиферации и миграции клеток SW620 посредством фосфорилирования ЭРК1/2. Oncol Rep. 2011; 25:503–511. [PubMed] [Google Scholar]
71. Гассер М., Гримм М., Ким М., Розенвальд А., Гермер КТ, Ваага-Гассер А. Толл-подобный рецептор (TLR) 7 и экспрессия TLR8 в клетках CD133+ при колоректальном раке и роль для индуцированных воспалением TLR в онкогенезе и опухолевой прогрессии. Дж. Клин Онкол. 2010;28:15с. [PubMed] [Академия Google]
Гассер М., Гримм М., Ким М., Розенвальд А., Гермер КТ, Ваага-Гассер А. Толл-подобный рецептор (TLR) 7 и экспрессия TLR8 в клетках CD133+ при колоректальном раке и роль для индуцированных воспалением TLR в онкогенезе и опухолевой прогрессии. Дж. Клин Онкол. 2010;28:15с. [PubMed] [Академия Google]
72. Onishi S, Miyata H, Inamoto T, Qi WM, Yamamoto K, Yokoyama T, Warita K, Hoshi N, Kitagawa H. Иммуногистохимическое исследование замедленного прогрессирования эпителиального апоптоза в ассоциированном с фолликулами эпителии крысиной пейеровой бляшки. J Vet Med Sci. 2007;69:1123–1129. [PubMed] [Google Scholar]
73. Renes IB, Verburg M, Bulsing NP, Ferdinandusse S, Büller HA, Dekker J, Einerhand AW. Защита эпителия крипт и ворсин, ассоциированных с пейеровыми бляшками, от повреждения, вызванного метотрексатом, основана на его четкой регуляции пролиферации. Джей Патол. 2002;198: 60–68. [PubMed] [Google Scholar]
74. Cadigan KM, Nusse R. Передача сигналов Wnt: общая тема в развитии животных.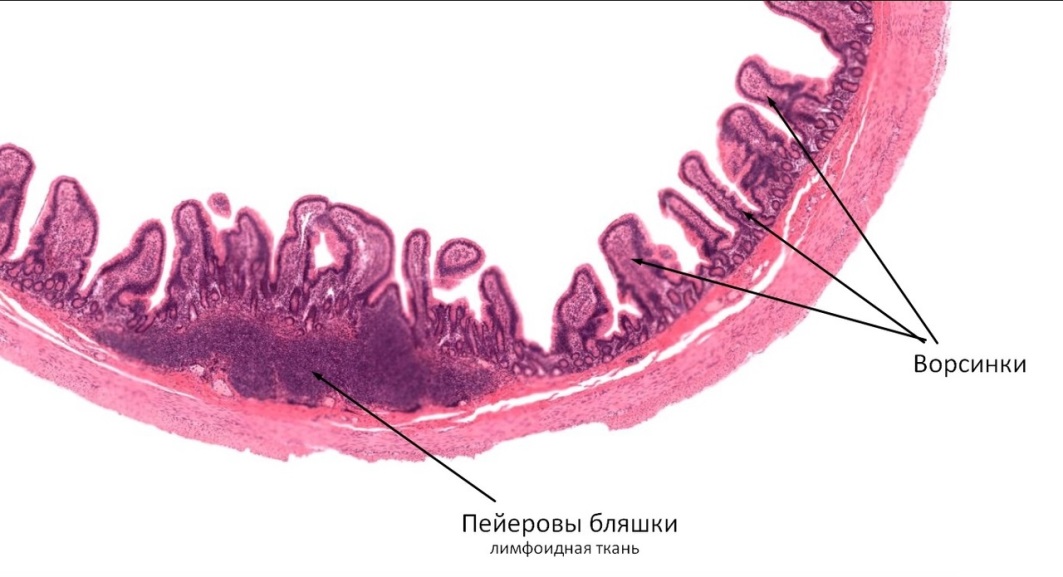 Гены Дев. 1997; 11:3286–3305. [PubMed] [Google Scholar]
Гены Дев. 1997; 11:3286–3305. [PubMed] [Google Scholar]
75. DasGupta R, Fuchs E. Множественные роли активированных транскрипционных комплексов LEF/TCF во время развития и дифференцировки волосяных фолликулов. Разработка. 1999; 126:4557–4568. [PubMed] [Google Scholar]
76. Korinek V, Barker N, Moerer P, van Donselaar E, Huls G, Peters PJ, Clevers H. Истощение компартментов эпителиальных стволовых клеток в тонком кишечнике мышей, лишенных Tcf-4. . Нат Жене. 1998;19:379–383. [PubMed] [Google Scholar]
77. Haegebarth A, Clevers H. Передача сигналов Wnt, lgr5 и стволовые клетки в кишечнике и коже. Ам Джей Патол. 2009; 174: 715–721. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Ouji Y, Yoshikawa M, Shiroi A, Ishizaka S. Wnt-10b, секретируемый лимфоцитами, способствует дифференцировке эпителиальных клеток кожи. Biochem Biophys Res Commun. 2006; 342:1063–1069. [PubMed] [Google Scholar]
79. Малхотра С., Кинкейд П.В. Молекулы, родственные Wnt, и равновесие сигнальных путей в гемопоэзе. Клеточная стволовая клетка. 2009 г.;4:27–36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клеточная стволовая клетка. 2009 г.;4:27–36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. O’Leary AD, Sweeney EC. Лимфогландулярные комплексы толстой кишки: строение и распределение. Гистопатология. 1986; 10: 267–283. [PubMed] [Google Scholar]
81. Майкл-Робинсон Дж.М., Бимер-Хюттманн А., Пурди Д.М., Уолш М.Д., Симмс Л.А., Байден К.Г., Янг Дж.П., Леггетт Б.А., Ясс Дж.Р., Рэдфорд-Смит Г.Л. Инфильтрирующие опухоль лимфоциты и апоптоз являются независимыми признаками колоректального рака, стратифицированными в соответствии со статусом микросателлитной нестабильности. Кишка. 2001; 48: 360–366. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Nozoe T, Korenaga D, Futatsugi M, Saeki H, Ohga T, Sugimachi K. Экспрессия Cyclin A в поверхностной плоскоклеточной карциноме пищевода и сосуществующем инфильтрированном лимфоцитарном фолликуле. Рак Летт. 2002; 188: 221–229. [PubMed] [Google Scholar]
83. Gutfeld O, Prus D, Ackerman Z, Dishon S, Linke RP, Levin M, Urieli-Shoval S. Экспрессия сывороточного амилоида A в нормальной, диспластической и неопластической слизистой оболочке толстой кишки человека. : значение роли в онкогенезе толстой кишки. J Гистохим Цитохим. 2006; 54: 63–73. [PubMed] [Академия Google]
Экспрессия сывороточного амилоида A в нормальной, диспластической и неопластической слизистой оболочке толстой кишки человека. : значение роли в онкогенезе толстой кишки. J Гистохим Цитохим. 2006; 54: 63–73. [PubMed] [Академия Google]
84. Тьери Ж.П. Эпителиально-мезенхимальные переходы в развитии и патологии. Curr Opin Cell Biol. 2003; 15: 740–746. [PubMed] [Google Scholar]
85. Rubio D, Garcia S, De la Cueva T, Paz MF, Lloyd AC, Bernad A, Garcia-Castro J. Трансформация мезенхимальных стволовых клеток человека связана с мезенхимально-эпителиальным переходом. Разрешение ячейки опыта. 2008; 314: 691–698. [PubMed] [Google Scholar]
86. Приндулл Г., Зипори Д. Экологическое руководство по пластичности нормальных и опухолевых клеток: эпителиальные мезенхимальные переходы как парадигма. Кровь. 2004;103:2892–2899. [PubMed] [Google Scholar]
87. Kang Y, Massagué J. Эпителиально-мезенхимальные переходы: поворот в развитии и метастазирование. Клетка. 2004; 118: 277–279. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
88. Spees JL, Olson SD, Ylostalo J, Lynch PJ, Smith J, Perry A, Peister A, Wang MY, Prockop DJ. Дифференцировка, слияние клеток и слияние ядер во время восстановления эпителия ex vivo стволовыми клетками взрослого человека из стромы костного мозга. Proc Natl Acad Sci USA. 2003; 100: 2397–2402. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Ван Арнам Дж.С., Херцог Э., Гроув Дж., Бруша Э., Зиглер Э., Свенсон С., Краузе Д.С. Приживление эпителиальных клеток костного мозга. Стволовые клетки, ред. 2005; 1:21–27. [PubMed] [Google Scholar]
90. Sheng W, Wang G, La Pierre DP, Wen J, Deng Z, Wong CK, Lee DY, Yang BB. Версикан опосредует мезенхимально-эпителиальный переход. Мол Биол Селл. 2006;17:2009–2020. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Hirose J, Kawashima H, Yoshie O, Tashiro K, Miyasaka M. Versican взаимодействует с хемокинами и модулирует клеточные реакции. Дж. Биол. Хим. 2001; 276: 5228–5234. [PubMed] [Академия Google]
92. Mesker WE, Liefers GJ, Junggeburt JM, van Pelt GW, Alberici P, Kuppen PJ, Miranda NF, van Leeuwen KA, Morreau H, Szuhai K, et al. Наличие большого количества стромы и подавление SMAD4 предсказывают худшую выживаемость пациентов с раком толстой кишки I-II стадии. Сотовый Онкол. 2009; 31: 169–178. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Mesker WE, Liefers GJ, Junggeburt JM, van Pelt GW, Alberici P, Kuppen PJ, Miranda NF, van Leeuwen KA, Morreau H, Szuhai K, et al. Наличие большого количества стромы и подавление SMAD4 предсказывают худшую выживаемость пациентов с раком толстой кишки I-II стадии. Сотовый Онкол. 2009; 31: 169–178. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Pohl M, Radacz Y, Pawlik N, Schoeneck A, Baldus SE, Munding J, Schmiegel W, Schwarte-Waldhoff I, Reinacher-Schick A. SMAD4 опосредует мезенхимальный — реверсия эпителия в клетках карциномы толстой кишки SW480. Противораковый Рез. 2010;30:2603–2613. [PubMed] [Академия Google]
Количество и распределение лимфоидных фолликулов в толстой кишке человека.
- Список журналов
- Джей Анат
- т.149; 1986 декабрь
- PMC1261644
J Анат. 1986 декабрь; 149: 189–194.
1986 декабрь; 149: 189–194.
PMCID: PMC1261644
PMID: 3693106
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности
Abstract
Плотность лимфоидных фолликулов слизистой оболочки была определена в толстой кишке пяти жертв внезапной смерти. Образцы фиксировали в уксусной кислоте, что делало фолликулы видимыми макроскопически. Расчетное общее количество фолликулов в толстой кишке колебалось от 12761 до 18432. Средняя плотность фолликулов составила 18,4 на см2 в слепой кишке, 15,0 на см2 в толстой кишке и 25,4 на см2 в прямой кишке. Эти результаты показывают, что в прошлом плотность лимфоидных фолликулов сильно недооценивалась, когда за норму принималось от трех до пяти фолликулов на см2. Обсуждается причина этого серьезного несоответствия, а также его влияние на диагностику лимфоидной гиперплазии.
Полный текст
Полный текст доступен в виде отсканированной копии оригинальной печатной версии. Получите копию для печати (файл PDF) полной статьи (1,2M) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей. Ссылки на PubMed также доступны для Selected References .
Ссылки на PubMed также доступны для Selected References .
189
190
191
192
193
194
Изображения в этой статье
Нажмите на изображение, чтобы увидеть большую версию.
Избранные ссылки
Эти ссылки находятся в PubMed. Возможно, это не полный список литературы из этой статьи.
- Бронен Р.А., Глик С.Н., Теплик С.К. Диффузные лимфоидные фолликулы толстой кишки, ассоциированные с карциномой толстой кишки. AJR Am J Рентгенол. 1984 г., январь; 142 (1): 105–109. [PubMed] [Google Scholar]
- Burbige EJ, Sobky RZ. Эндоскопическая картина толстокишечных лимфоидных узелков: вариант нормы. Гастроэнтерология. 1977 г., март; 72 (3): 524–526. [PubMed] [Академия Google]
- Капитанио М.А., Киркпатрик Дж.А. Лимфоидная гиперплазия толстой кишки у детей. Рентгеновские наблюдения. Радиология. 1970 г., февраль; 94 (2): 323–327. [PubMed] [Google Scholar]
- Crooks DJ, Brown WR.
 Распространение узелковой лимфоидной гиперплазии кишечника при дефиците иммуноглобулинов. Клин Радиол. 1980 ноябрь; 31 (6): 701–706. [PubMed] [Google Scholar]
Распространение узелковой лимфоидной гиперплазии кишечника при дефиците иммуноглобулинов. Клин Радиол. 1980 ноябрь; 31 (6): 701–706. [PubMed] [Google Scholar] - Де Смет А.А., Туберген Д.Г., Мартель В. Узловая лимфоидная гиперплазия толстой кишки, связанная с дисгаммаглобулинемией. AJR Am J Рентгенол. 1976 сентября; 127 (3): 515–517. [PubMed] [Google Scholar]
- Ell SR, Frank PH. Спектр лимфоидной гиперплазии: толстокишечные проявления саркоидоза, инфекционного мононуклеоза и болезни Крона. Гастроинтест Радиол. 1981;6(4):329–332. [PubMed] [Google Scholar]
- Kelvin FM, Max RJ, Norton GA, Oddson TA, Rice RP, Thompson WM, Garbutt JT. Лимфоидно-фолликулярный рисунок толстой кишки у взрослых. AJR Am J Рентгенол. 1979 г., ноябрь; 133 (5): 821–825. [PubMed] [Google Scholar]
- Laufer I, deSa D. Лимфоидный фолликулярный рисунок: нормальная особенность толстой кишки у детей. AJR Am J Рентгенол. 1978 января; 130 (1): 51–55. [PubMed] [Google Scholar]
- Riddlesberger MM, Jr, Lebenthal E.