Особенности микоплазменной инфекции при вспышечной и спорадической заболеваемости у детей
В последние годы в детских коллективах отмечается стойкая тенденция к росту вспышек и спорадической заболеваемости респираторным микоплазмозом.
Цель. Изучить особенности течения микоплазменных пневмоний при вспышках и спорадических заболеваниях.
Материалы и методы. Обследовано 55 детей с микоплазменной пневмонией из очага инфекции и 90 детей с различными формами респираторного микоплазмоза при спорадической заболеваемости, госпитализированных в стационар за последние три года. Этиология заболевания подтверждалась выявлением ДНК микоплазмы в мазках из зева и носа и IgM к M.Pneumonia в сыворотке крови.
Результаты и обсуждение. Микоплазменная пневмония у детей протекает с лихорадкой, значительными аускультативными изменениями со стороны легких при умеренно выраженной интоксикации.
Особенностью респираторного микоплазмоза при вспышке является преобладание среднетяжелых форм пневмонии с наличием катарального синдрома у каждого второго ребенка, поражение ЖКТ в 34,4% наблюдений, развитие артралгий -у 20% обследованных. При спорадической заболеваемости чаще госпитализировались дети с обструктивным синдром, дыхательной недостаточностью. Внелегочные проявления регистрировались в 4 раза реже, чем при вспышке респираторного микоплазмоза в детском коллективе.
Заключение. Респираторный микоплазмоз сохраняет выраженную осенне-зимнюю сезонность и типичные клинические симптомы. Чаще болеют дети школьного возраста. Анализ вспышки респираторного микоплазмоза выявил редкое развитие обструктивного синдрома при пневмонии, преобладание среднетяжелых форм заболевания с внелегочными проявлениями болезни и катаральным синдромом.
При спорадической заболеваемости микоплазменной пневмонией госпитализируются паценты с более тяжелым течением болезни и явлениями дыхательной недостаточности за счет обструктивного синдрома..jpg)
Острые респираторные инфекции являются лидером в структуре детской инфекционной заболеваемости. В Российской Федерации острые респираторные заболевания (ОРЗ)
составляют 90% детской патологии, при этом наиболее подвержены развитию ОРЗ дети, посещающие организованные коллективы [1, 2]. По данным Воронежской областной детской клинической больницы, за последние 5 лет сохраняется устойчивая тенденция к росту числа детей, госпитализированных в стационар с острыми респираторными инфекциями. За этот период рост составил около 30% [3]. В этиологической структуре острых респираторных заболеваний на долю микоплазмозов приходится от 7 до 30% [4]. Как правило, микоплазменную инфекцию связывают с развитием бронхитов и атипичных пневмоний, но в настоящее время доказана роль 
терапии, учитывая узкий спектр чувствительности возбудителя.
Микоплазменная инфекция имеет выраженную эпидемическую сезонность, которая приходится на осенне-зимнее время, а также носит циклический характер с подъемами заболеваемости каждые 3-5 лет [5, 6]. В периоды роста циркуляции возбудителя отмечается значимый подъем заболеваемости микоплазменной пневмонией у детей школьного возраста (до 60% пневмоний у детей имеют микоплазменную этиологию), возможны вспышки микоплазменной инфекции в закрытых детских коллективах. По данным Всемирной организации здравоохранения, в мире регистрируется около 155 миллионов случаев пневмоний у детей, при этом из них 1,4 миллиона детей умирает. В Российской Федерации приходится от 10 до 30 случаев пневмонии на 1000 детского населения [7]. Пневмонии, наряду с патологией ЛОР-органов, являются наиболее частыми осложнениями заболеваний верхних дыхательных путей, но если речь идет об атипичных возбудителях, поражение легких может быть первичным очагом инфекции [8].
В настоящее время имеет место выраженный рост и распространенность заболеваемости микоплазменной инфекцией, в 2012-2013 годах в Москве и Московской области зарегистрирован ряд вспышек микоплазменной инфекции, выявлено 99 заболевших детей [9, 10]. По данным нашего стационара, доля респираторного микоплазмоза в структуре острых респираторных заболеваний возросла за 4 года с 10,9% до 27,4%. В 2013 году были зафиксированы вспышки респираторного микоплазмоза в трех районах Воронежской области.
Цель исследования
Изучить особенности течения микоплазменных пневмоний при вспышках и спорадических заболеваниях.
Материалы и методы
Под нашим наблюдением находилось 55 детей с микоплазменной пневмонией из очага инфекции и 90 детей с различными формами респираторного микоплазмоза при спорадической заболеваемости, поступившие в стационар за последние три года.
Всем детям проводилось общеклиническое исследование, биохимическое исследование крови, рентгенография органов грудной клетки. Этиология заболевания подтверждалась методом ПЦР – выявление ДНК микоплазмы в мазках из зева и носа, цитоскопией мазков из зева и носа, серологическими методами: определением IgM и IgG к хламидиям и микоплазме (savyon diagnostics версия М1262-01Е09-07/09). Исследование проводилось при госпитализации на 8,6±1,7 день заболевания, при этом у 65,5% при первичном обследовании специфические антитела не обнаруживались, при повторном исследовании крови на 12,0±2,4 день у всех пациентов определялись IgM к
Этиология заболевания подтверждалась методом ПЦР – выявление ДНК микоплазмы в мазках из зева и носа, цитоскопией мазков из зева и носа, серологическими методами: определением IgM и IgG к хламидиям и микоплазме (savyon diagnostics версия М1262-01Е09-07/09). Исследование проводилось при госпитализации на 8,6±1,7 день заболевания, при этом у 65,5% при первичном обследовании специфические антитела не обнаруживались, при повторном исследовании крови на 12,0±2,4 день у всех пациентов определялись IgM к
Результаты и обсуждение
В октябре 2013 года в одной из школ Воронежской области зафиксирована вспышка микоплазменной инфекции. На прилегающей к школе территории имел место резкий скачок заболеваемости детей острыми респираторными инфекциями, о чем свидетельствует рост вызовов участкового педиатра на дом. На отдельных участках их количество увеличилось на 73,5%.

Половину заболевших детей (54,5%) беспокоили головные боли, которые преимущественно (72,7%) возникали в первые два дня болезни. У каждого третьего ребенка с головной болью регистрировалась повторная рвота, что не исключает поражения центральной нервной системы при микоплазмозе, но из-за отсутствия менингеального симптомо-комплекса и кратковременности клинических проявлений (1-2 дня), люмбальная пункция не проводилась.
Катарально-респираторный синдром проявлялся в виде катарального фарингита у 20% (11) детей, ринита –25,4% (14),ларингита –30,9%, отита или евстахиита –27,3% пациентов (15).
К 4-6 дню заболевания у детей выявлялись аускультативные изменения в легких, у 54,5% было ослабление дыхания, у 78,2% выслушивалась крепитация или влажные мелкопузырчатые хрипы.
Явлений дыхательной недостаточности у наблюдаемых детей не было, бронхообструктивный синдромитакже не диагностировался. При анализе рентгено-графических данных у одного ребенка выявлен очаговый процесс, поражение одного сегмента легкого было у 33,7%, наиболее часто встречались полисегментарные пневмонии –52,1%, инфильтративные изменения доли легкого выявлялись у 10,6% детей, у одного ребенка развился плеврит на фоне полисегментарной пневмонии.
Из внелегочных проявлений респираторного микоплазмоза отмечались миалгии –11,0% (6), артралгии –20% (11), у 34,4% (19) отмечены нарушения со стороны желудочно-кишечного тракта в первые дни болезни: гастрит –9% (5), энтерит–20 % (11), явления гастроэнтерита –5,4% (3). Результат комплексного обследования на энтеропатогенные бактериальные и вирусные агенты был отрицательным.
Результат комплексного обследования на энтеропатогенные бактериальные и вирусные агенты был отрицательным.
Со стороны периферической крови умеренный лейкоцитоз (до 13,1×109/л) регистрировался только у 7,2% (4) детей, у остальных количество лейкоцитов соответствовало возрастной норме, но у всех больных отмечен резкий сдвиг лейкоцитарной формулы влево, значительное ускорение СОЭ –максимально до 44 мм/ч. Основные биохимические показатели крови не были изменены, у 65,4% (36) детей имело место 2–-х кратное повышение уровня С-реактивного белка относительно нормы
Клиническое и рентгенологическое выздоровление наступало на 12,7±2,5 день пребывания в стационаре. У 9% (5) детей разрешение пневмонии затягивалось до 19,2±1,7 дней.
Проведен анализ спорадических случаев респираторного микоплазмоза у 90 госпитализированных детей. Заболевание протекало в форме пневмонии у 27,8% (25) детей. Среди них мальчиков и девочек было 60 и 40% соответственно. Наиболее часто микоплазменную пневмонию переносили дети школьного возраста, младший школьный возраст – 32%, дети среднего звена – 28%. Дети первого года жизни и в возрасте от года до трех лет составили по 8%, от 3 до 7 лет – 20%. Наиболее выраженная сезонность отмечалась в 2012/13 годах – 55% детей с респираторным микоплазмозом госпитализированы в октябре-сентябре, в то время как на другие месяцы пришлось не более 7,5% детей. В 2014 году отмечалось расширение сезона, респираторный микоплазмоз с одинаковой частотой встречался в осеннее и зимнее время – по 35%.
Дети первого года жизни и в возрасте от года до трех лет составили по 8%, от 3 до 7 лет – 20%. Наиболее выраженная сезонность отмечалась в 2012/13 годах – 55% детей с респираторным микоплазмозом госпитализированы в октябре-сентябре, в то время как на другие месяцы пришлось не более 7,5% детей. В 2014 году отмечалось расширение сезона, респираторный микоплазмоз с одинаковой частотой встречался в осеннее и зимнее время – по 35%.
Дети с микоплазменной пневмонией госпитализировались на 6,24±2,3день болезни. У всех детей имело место повышение температуры тела: у 56% – до гипертермических цифр, у 32% – в пределах фебрильных цифр, субфебрилитет был у 8% детей, у одного ребенка заболевание протекало на фоне нормальной температуры. Продолжительность лихорадки составила 7,95±3,1 сутки. Катаральный синдром встречался у 28% и проявлялся в виде ринита. У половины пациентов (52%) в дебюте заболевания начинался сухой кашель, который к 5,8±2,1 дню становился влажным, продуктивным. У 44% с первого дня болезни формировался влажный, продуктивный кашель, который сохранялся в течение 8,3±3,2 дней.
У большинства детей при поступлении отмечались клинические проявления дыхательной недостаточности: у 68% (17) – первой степени, у 8% (2) – второй степени. У 24% (6) детей диагностированы явления бронхообструкции.
При поступлении только у одного ребенка не было аускультативных изменений со стороны легких, у остальных детей регистрировались сухие или влажные мелкопузырчатые хрипы, крепитация. Изменения сохранялись в течение 6,76±4,3 дней. При проведении рентгенографии органов грудной клетки у 32% детей было сегментарное поражение легких, у 36% – полисегментарная пневмония, у 28% – долевая пневмония, у одного ребенка была поли-сегментарная плевропневмония.
При сравнении течения микоплазменной пневмонии у детей дошкольного и школьного возраста, была получена достоверная разница только по частоте развития явлений дыхательной недостаточности: 89% – у детей дошкольного возраста и 68,75% – у школьников (р<0,05).
Только у одного ребенка было поражение тонкого кишечника, у двух детей отмечалась пятнисто-папулезная экзантема, при этом аллергологический анамнез у данных детей отягощен не был. Анализ лабораторных данных показал, что в общем анализе крови у 40% детей выявлен лейкоцитоз, у 76% (19) – отмечался сдвиг лейкоцитарной формулы влево, у всех детей имела место резко повышенная скорость оседания эритроцитов, максимально до 53 мм/ч. В общем анализе мочи у трети детей выявлена транзиторная лейкоцитурия. Выздоровление детей наступало на 13,96±4,1 день пребывания в стационаре.
Анализ лабораторных данных показал, что в общем анализе крови у 40% детей выявлен лейкоцитоз, у 76% (19) – отмечался сдвиг лейкоцитарной формулы влево, у всех детей имела место резко повышенная скорость оседания эритроцитов, максимально до 53 мм/ч. В общем анализе мочи у трети детей выявлена транзиторная лейкоцитурия. Выздоровление детей наступало на 13,96±4,1 день пребывания в стационаре.
Заключение
Таким образом, можно отметить, что респираторный микоплазмоз имеет выраженную осенне-зимнюю сезонность. Наиболее часто заболевание развивается у детей школьного возраста, преимущественно среднего звена (11–15 лет). При респираторном микоплазмозе серологическое обследование методом ИФА целесообразно проводить не ранее 11-12 дня болезни, так как у 65,5% обследованных детей на первой неделе заболевания специфические антитела класса М выявить не удается.
Для микоплазменной пневмонии не характерен выраженный токсикоз, хотя заболевание преимущественно протекает с фебрильной температурой. Особенностью клинических проявлений микоплазменной пневмонии в описанной нами вспышке является отсутствие бронхообструктивного синдрома и дыхательной недостаточности, частое развитие внелегочных проявлений микоплазмоза. Поступление детей в этот же эпидемический сезон при спорадической заболеваемости показало более тяжелое течение респираторного микоплазмоза с частым развитием при пневмонии обструкции бронхов, дыхательной недостаточности, особенно у дошкольников. При этом внелегочные проявления инфекции встречались в 4 раза реже, чем при вспышке в детском коллективе. Проведенный анализ свидетельствует о том, что при вспышечной заболеваемости возможно более детальное изучение всех проявлений болезни. В то же время при обследовании госпитализированных детей при спорадической заболеваемости чаще выявляются наиболее тяжелые клинические синдромы.
Особенностью клинических проявлений микоплазменной пневмонии в описанной нами вспышке является отсутствие бронхообструктивного синдрома и дыхательной недостаточности, частое развитие внелегочных проявлений микоплазмоза. Поступление детей в этот же эпидемический сезон при спорадической заболеваемости показало более тяжелое течение респираторного микоплазмоза с частым развитием при пневмонии обструкции бронхов, дыхательной недостаточности, особенно у дошкольников. При этом внелегочные проявления инфекции встречались в 4 раза реже, чем при вспышке в детском коллективе. Проведенный анализ свидетельствует о том, что при вспышечной заболеваемости возможно более детальное изучение всех проявлений болезни. В то же время при обследовании госпитализированных детей при спорадической заболеваемости чаще выявляются наиболее тяжелые клинические синдромы.
Литература
- Кокорева С.П., Сахарова Л.А., Куприна Н.П. Этиологическая
характеристика и осложнения острых респираторных
инфекций у детей. Вопросы современной педиатрии. 2008.
Вопросы современной педиатрии. 2008.
Т. 7. № 1. С. 47-50.
- Bartlett J. G. Management of respiratory tract infection – 3rd. –
Philadelphia, 2001. – P. 178–182.
- Кокорева С.П., Трушкина А.В., Разуваев О.А. Оптимизация
этиотропной терапии острых респираторных вирусных
инфекций у детей. Детские инфекции. 2013. Т. 12. № 4.С. 42-46.
- Fraaij P. L. A., Visser E. G., Hoogenboezem T., Hop W. C. J., van
Adricgem L. N. A., Weber F., Moll H. A., Broekman B., Berger M.
Y., van Rijsoort-Vos T., van Belkum A., Schutten M., van Rossum
- M. C. Published: Carriage of Mycoplasma pneumoniae in
the Upper respiratory Tract of Symptomatic and Asymptomatic
Children: An Observational Study: May 14, 2013. DOI: 10.1371/
journal.pmed.1001444
- Hauksdottir G.
 S., Jonsson T., Sigurdardottir V., Love A.
S., Jonsson T., Sigurdardottir V., Love A.
Seroepidemiology of Mycoplasma pneumonia infections in
Iceland // Scan. J. Epidemiol. 1998, 30(2): 177-80.
- Ito I., Ishida T., Osawa M., Arita M., et al. Culturally verified
Mycoplasma pneumonia in Japan: a long-term observation from
1979-1999. Epidemiol. Infekt. Dis. 1998, 30 (2): 177-80.
- Козлов Р.С. Пневмококки: уроки прошлого – взгляд в будущее.
– Смоленск: МАКМАХ, 2010 – 128 с.
- Нагаева Т.А., Фурманова Е.А., Пономарева Д.А. Роль
матриксной металлопротеиназы-9 при патологии
миндалин и аденоидов у часто болеющих детей. Лечение и
профилактика 2015, №1(13), с. 48-51.
- Целипанова Е.Е., Россошанская Н. В. Вспышки пневмонии
микоплазменной этиологии у детей Московской области.
Лечение и профилактика. 2014, №4(12), с. 64-66.
- Гадлия Д.Д., Бакрадзе М.Д., Таточенко В.К., Петровская
М. ., Хохлова Т.А., Зубкова И. В. Вспышка микоплазменной
инфекции Фарматека № 11 (304), 2015 с. 63-67.
Рубрики: Статьи для докторовМикоплазма пневмония у детей
Микоплазма пневмония у детей.
В органах дыхания человека поддаются развитию 5 типов возбудителя микоплазма. Одной из опасных считается микоплазма пневмония у детей. Было зафиксировано около 20% эпизодов, когда микробы данного типа вызывали воспаление органов дыхания. Больше всего заражаются дети до 15-летнего возраста.
Болезнь переходит воздушно-капельным путем, причем особо опасны капли крупного размера. Чаще всего по развивающимся признакам болезни только врач с опытом способен выявить пневмонию, которая была вызвана микоплазмой. Болезнь легких на этапе развития напоминает вирусную инфекцию. Данный вид воспаления практически не имеет специфических симптомов. Время инкубации может составлять от 7 до 21 дня.
Данный вид воспаления практически не имеет специфических симптомов. Время инкубации может составлять от 7 до 21 дня.
Характерные особенности болезни
Микоплазменная пневмония у детей относится к воспалению легких атипичной формы. Возбудителем заболевания является микоплазма пневмония. Развитие микоплазмома начинается с катаральных проявлений, потому нередко становится причиной неправильного диагностирования и несвоевременного посещения врача.
Болезнь чаще возникает за стенами больниц, за что и получила название внебольничная. Около 50% случаев заражения именно этой пневмонии. Зачастую недуг поражает детей и подростков. Чаще можно заразиться в детских учреждениях.
Бывают случаи, когда пневмония возникает сразу после рождения малыша. Это врожденная форма микоплазмоза. У новорожденного она развивается очень тяжело. Может возникнуть и генерализованная форма недуга, при которой поражаются внутренние органы.
Различают очаговую и долевую микоплазменную пневмонию. Для очаговой болезни характерно поражение незначительного участка легкого (несколько долек органа). Долевой пневмонии свойственно вовлечение в процесс поражения всей доли легкого. Чаще всего воспалительный процесс односторонний.
Для очаговой болезни характерно поражение незначительного участка легкого (несколько долек органа). Долевой пневмонии свойственно вовлечение в процесс поражения всей доли легкого. Чаще всего воспалительный процесс односторонний.
Особенность течения пневмонии заключается в частой хронизации процесса, по причине запоздалого лечения и генерализацией микоплазменной инфекции в раннем возрасте у детей. Это объясняется строением микроорганизма, напоминающего по структуре отдельные собственные клетки. Потому выработка защитных антител происходит поздно, с возможным поражением собственной ткани, вызывая аутоиммунные процессы у взрослых, детей.
Если не лечить заболевание, могут возникнуть серьезные последствия.
Категории рискаОпасность заболеть воспалением легких, которое вызвано микоплазмой, обусловлено защитной силой организма человека, возрастной категорией. Зачастую заражению пневмонией предрасположены дети. Исходя из различных групп детей по возрасту, можно наблюдать различную стадию предрасположенности заражению органов дыхания.
- У малышей до 3-х летнего возраста болезнь протекает достаточно легко, без проявлений признаков.
- Дети от 3-х лет имеют ярко выраженную клиническую картину.
- В школьном возрасте до 15-ти лет болезнь проявляется намного чаще.
Заражение происходит через воздух. Микоплазмы с потоком вдыхаемого воздуха попадают в верхние пути дыхания с прохождением далее в бронхи, легкие. Источник заражения – больной человек либо носитель, без проявления признаков.
Микоплазма размножается в альвеолах, что способствует формированию интернационального типа пневмонии, при которой возникает утолщение перегородок посередине альвеол. После перенесенной болезни у детей появляется иммунитет на 10 лет.
Факторы развития недуга следующие:
- иммунодефицит;
- хронические болезни в тяжелой форме;
- переохлаждение;
- плохое питание.
При проникновении микоплазмы в организм у ребенка возникают признаки следующих болезней:
- фарингит;
- ларингит;
- бронхиолит;
- синусит;
- ринит.

Проникая ниже в легкие, бронхи, болезнь способствует развитию бронхопневмонии.
Изначально пневмония у детей не проявляется специфическими признаками и зачастую схожа с признаками гриппа.
- Болит голова.
- Температура, озноб.
- Присутствует насморк.
- Болит горло.
- Сухой надрывной кашель, с возможным выделением у малыша мокроты в виде белого цвета пены.
В зависимости от течения пневмонии поднимается температура, кашель, выраженный и частый, бывает, проявляется одышка.
При первичном посещении специалиста при прослушивании органов дыхания, физикальные симптомы пневмонии могут не проявляться ярко. Изначально они вообще не проявляются. Основной признак – это влажные хрипы в органах дыхания, похожие на хрипы со свистом, как при астме.
При сопротивлении бронхов кашель может присутствовать у детей 2-3 недели. Признаки отравления могут выражаться слабо. Отличие микоплазменной пневмонии в том, что при ней часто присутствуют признаки, возникающие вне легкого.
Отличие микоплазменной пневмонии в том, что при ней часто присутствуют признаки, возникающие вне легкого.
- Высыпания на коже.
- Болит живот.
- Боль в мышцах и суставах.
- Покалывание.
Высыпания проявляются у детей в 12-15% случаев. Сыпь пятнисто-пупулезная, уртикарная.
Некоторые больные дети имеют смешанную этиологию. Это указывает на присоединение вторичной бактериальной инфекции. Тяжелое течение замечено у сливной пневмонии, когда мелкие очаги соединяются между собой и затрагивают несколько сегментов легкого либо целую долю.
У половины больных детей наблюдают увеличенную печень. Работа органа нарушается. Увеличение селезенки возникает в редких случаях. У дошкольников нередко увеличиваются лимфоузлы.
Как вылечить болезнь?Лечебный процесс у детей проводится после установления диагноза и исключения иных болезней органов дыхания.
Диагностика включает ряд исследований.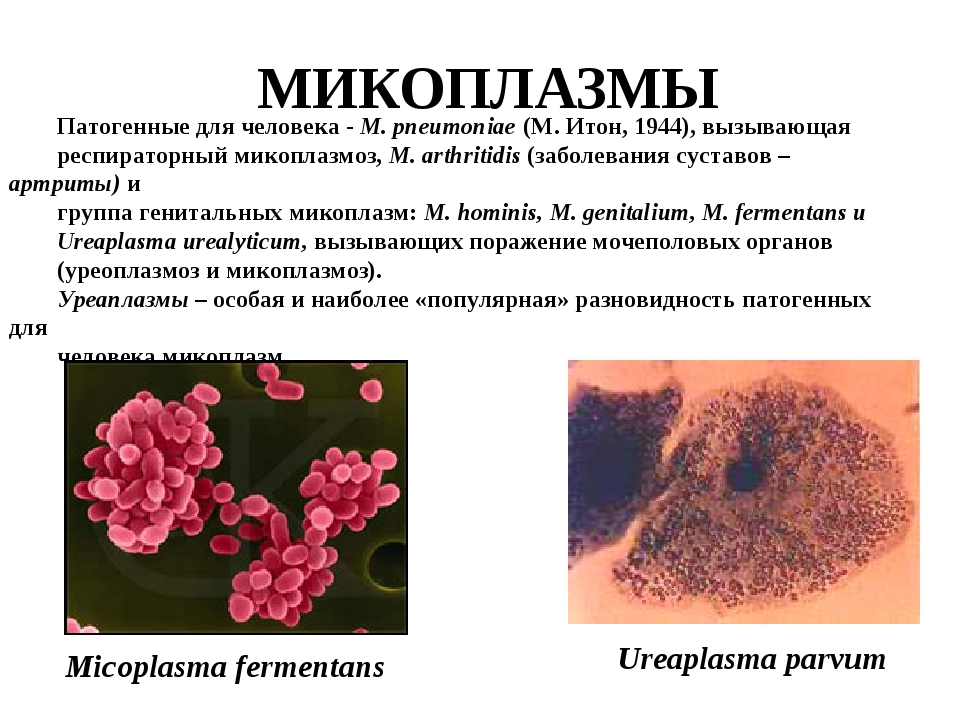
- Рентгенография грудной клетки.
- Компьютерная томография.
- Физикальное исследование.
- Исследование слизи, чтобы уточнить вид возбудителя.
- Осмотр зева, анализ мочи и крови.
На рентгеновском изображении при сегментарном воспалении органов дыхания видны очаговые инфильтраты в нижних сегментах нечетких контуров, также интерстициальные нарушения. При исследовании слизи микоплазмы не выявляют.
Лечение больных детей микоплазменной пневмонии направлено на прием антибактериальных средств.
- Тетрациклины – доксициклин.
- Макролиды – азитромицин, эритромицин.
Перед назначением этих препаратов врач опирается на возраст ребенка. Так, доксициклином лечить детей до 12 лет нельзя, так и старших по возрасту детей, у которых масса тела меньше 45 кг.
Для новорожденных детей, макролиды намного безопаснее фторхинолонов, тетрациклинов. Лечение заключается в нарушении процесса синтеза белка в клетке чувствительного микроорганизма.
Так как антибиотики пенициллиновой и цефалоспориновой группы малоэффективны, их не назначают детям.
Лечение детей не проходит без осуществления ряда рекомендаций:
- обильное питье;
- постельный режим;
- дезинтоксикация организма;
- физиопроцедуры;
- массаж.
Помимо данных процедур и приема антибиотиков, лечение проходит с приемом отхаркивающих лекарств, это сиропы, микстуры.
Если лечение правильное, отсутствуют осложнения, тогда выздоровление можно наблюдать спустя 2 недели от начала терапии соответствующими препаратами.
ОсложненияОчень часто дети сталкиваются с геморрагическими поражениями слизистой оболочки, кожи, высыпаниями и воспалением конъюнктивы. Часть представленных симптомов проходит самостоятельно к концу 2 недели заболевания.
При осложнениях кардиального характера возникает миокардит, перикардит. Встречаются такие болезни редко.
Также дети подвержены таким симптомам, как рвота, тошнота, понос. Они проявляются в 25% случаев микоплазменной пневмонии.
Бывают осложнения на суставы, которые выражаются возникновением артрита.
После перенесенного микоплазменного воспаления органов дыхания рекомендуют диспансерное наблюдение у врача — пульманолога на протяжении 1-2 месяцев.
назад
ФАРМАТЕКА » Вспышка микоплазменной инфекции
В статье дан обзор частоты и диагностических признаков инфекций микоплазмой и хламидиями у детей. Подчеркивается важность клинической диагностики пневмоний и бронхитов этой этиологии, поскольку высокая частота носительства возбудителей и запоздалое нарастание титров антител затрудняют ориентацию в диагнозе в начале болезни. Клинические проявления вызванных микоплазмой пневмоний и бронхитов достаточны для правильного эмпирического выбора антибиотика; значение в диагностике имеет и отсутствие эффекта лечения пневмонии β-лактамным препаратом. Препаратами выбора для лечения «атипичных» инфекций являются макролиды.
Диагностика острой пневмонии разработана, а критерии, позволяющие заподозрить и установить данный диагноз, четко сформулированы. Несмотря на это, приходится часто сталкиваться с диагностическими ошибками и нерациональной терапией, которые наблюдаются чаще в амбулаторной практике. Помимо диагностики пневмонии как таковой существенное влияние на результаты лечения оказывает своевременное определение ее этиологии: разделение внебольничной пневмонии на группы типичных (с абсолютным преобладанием пневмококковой этиологии) или атипичных (среди которых чаще встречается микоплазмоз, реже – респираторный хламидиоз).
Осенью 2012 г. (сентябрь–октябрь) в Москве наблюдалась вспышка острых респираторных инфекций с поражением нижних дыхательных путей, вызванных микоплазменной инфекцией. Характерные вспышки происходят с регулярной периодичностью в 3–5 лет. Вызванные микоплазмой бронхиты и пневомонии наблюдаются в осенние месяцы, когда вообще учащаются инфекции, в т.ч. вызванные Mycoplasma pneumoniae [1, 2].
Атипичные возбудители в этиологии поражения нижних дыхательных путей занимают достаточно важное место, особенно пневмоний у детей старше 4–6 лет. Так, в Нидерландах и Италии у детей с рентгенологически подтвержденной пневмонией с помощью полимеразной цепной реакции (ПЦР) M. pneumoniae была выявлена в 2,4 и 11,3% соответственно, чаще в возрасте после 4 лет, среди них 63% составляли школьники и подростки [3, 4].
В Финляндии M. pneumoniae была выявлена в 14% случаев у детей с пневмонией в возрасте до 5 лет и в 42% – у детей старшего возраста. В аналогичном исследовании в Техасе M. pneumoniae была выявлена в 14% случаев у детей до 5 лет и в 22% – у детей старшего возраста [5, 6]. Проспективное исследование пневмоний у детей в Японии выявило M. pneumoniae у 41% больных, чаще старше 4 лет [7].
Приведенные данные показывают, что атипичные возбудители, в первую очередь микоплазма, занимают существенное место среди возбудителей пневмонии, особенно у детей школьного возраста и подростков.
Инфекционное заболевание, вызываемое микоплазмами, протекает обычно по типу инфекции нижних дыхательных путей (бронхит или острая микоплазменная пневмония) с острым началом, длительной лихорадкой без токсикоза, упорным кашлем, обилием мелкопузырчатых, влажных, разлитых (одно- или двусторонних) хрипов с преобладанием на стороне поражения. Групповая вспышка пневмонии среди детей в замкнутом коллективе всегда должна натолкнуть врачей на мысль о возможности микоплазменной инфекции. Комплексная оценка физикальных и рентгенологических данных достаточно надежна для целенаправленного выбора адекватного антибактериального средства, а отсутствие эффекта от пенициллинотерапии может служить доказательством микоплазменной пневмонии.
К основным лабораторным методам диагностики микоплазменной инфекции относится иммуноферментный анализ (ИФА) для определения титров иммуноглобулинов М (IgM) и G к M. pneumoniae, ПЦР для выявления антигена возбудителя в материале.
Определение ДНК бактерий методом ПЦР – это наиболее чувствительный и точный метод выявления микоплазм. Однако по результатам проведенного исследования в Нидерландах, частота наличия М. pneumoniae, выявленная методом ПЦР у больных детей, существенно не отличалась от носительства у здоровых детей (21,2 и 16,2% соответственно) [8]. Таким образом, ввиду частого носительства M. pneumoniae у здоровых детей в течение длительного времени этот метод является малоспецифичным.
Однако по результатам проведенного исследования в Нидерландах, частота наличия М. pneumoniae, выявленная методом ПЦР у больных детей, существенно не отличалась от носительства у здоровых детей (21,2 и 16,2% соответственно) [8]. Таким образом, ввиду частого носительства M. pneumoniae у здоровых детей в течение длительного времени этот метод является малоспецифичным.
Диагностическое значение может иметь обнаружение антител класса IgM, однако антитела к микоплазме в течение 1-й недели от начала болезни появляются всего у 21% больных (на 2-й неделе – у 56%, на 3-й – у 100%) [9].
Нарастание антител IgM в титре 1:8 и более и/или появление антител IgG в титре 1:64 и более является достоверным, но ретроспективным анализом.
Таким образом, выявление маркеров микоплазменной инфекции у ребенка, не имеющего соответствующей клинико-рентгенологической картины пневмонии, не позволяет ставить этиологический диагноз (а тем более служить доказательством наличия пневмонии). Неправильная интерпретация может приводить к гипердиагностике микоплазменной инфекции и необоснованному назначению антибактериальной терапии, в то же время отрицательные данные исследований приводят к запоздалому установлению этиологии.
У больных, перенесших микоплазмоз в прошлом, определяются только антитела типа IgG. При наличии микоплазмоза концентрация специфических антител во второй сыворотке больше, чем в первой, но точные диагностические критерии не разработаны.
С учетом этих положений диагностика «атипичных» инфекций у детей требует прежде всего учета клинических данных, поскольку даже в случае обнаружения патогена в материале из верхних дыхательных путей его роль как возбудителя не определена [10].
Бронхиты, вызванные M. рneumoniae, чаще встречаются у детей школьного возраста. При этом часто диагностируются клинические признаки обструкции без признаков аллергии или бронхиальной астмы.
Пневмония, вызванная M. pneumoniae, чаще наблюдается у подростков. Для нее характерно острое начало с повышением температуры до 39°С и выше, что обычно сочетается с нетяжелым состоянием. Это часто ведет к позднему (на 9–12-й день) обращению к врачу. Характерны кашель, масса мелкопузырчатых хрипов, чаще асимметричных, покраснение конъюнктив при скудных катаральных симптомах, изменения на рентгенограмме в виде негомогенного инфильтрата. Число лейкоцитов может быть нормальным или слегка повышенным и умеренно повышенная СОЭ.
Число лейкоцитов может быть нормальным или слегка повышенным и умеренно повышенная СОЭ.
В диагностике микоплазменной пневмонии учет клинических признаков заболевания, отличающих их от типичных пневмонии, является залогом правильного выбора стартовой терапии.
Распространенный бронхит с крепитацией, обилием мелкопузырчатых хрипов, часто ассиметричных, характерен для пневмоний, вызванных M. pneumoniae (атипичных), и имеет диагностическое значение.
Нередко на основании клинико-рентгенологических изменений не удается точно определить этиологию пневмонии. В этих случаях только отсутствие быстрого эффекта от применения β-лактамов (амоксициллина/клавуланата, цефалоспиринов) подтверждает диагноз атипичной пневмонии и служит показанием к смене терапии на макролид.
Целью исследования стало изучение клинического течения и особенностей серологической диагностики микоплазменной инфекции у детей.
Материал и методы
Исследование было проведено на базе отделения диагностики и восстановительного лечения ФГБНУ «Научный центр здоровья детей».
Клиническими критериями постановки диагноза внебольничной пневмонии служили наличие постоянной или упорно повторяющейся температуры тела от 38°С и выше без существенных нарушений общего состояния, скудные катаральные явления, конъюнктивит без выпота, обилие мелкопузырчатых хрипов или крепитация с двух сторон или чаще всего ассиметричных, наличие тени на рентгенограмме – обычно негомогенной с размытыми границами, часто двусторонней, отсутствие воспалительных изменений в общем анализе крови.
Бронхиты, вызванные микоплазмой, имели сходную картину с пневмонией той же этиологии. Рентгенография позволила исключить пневмонию – выявлялось лишь усиление мелких элементов легочного рисунка.
Мы предоставляем данные о 21 ребенке, поступившем во время подъема микоплазменной заболеваемости осенью 2012 г. Для верификации микоплазмоза проводилось серологическое исследование крови на антитела к микоплазме.
У 10 детей микоплазменная этиология была подтверждена лабораторно. По клинико-рентгенологическим данным у 7 детей был выставлен диагноз «бронхит», у 14 детей – «пневмония».
По клинико-рентгенологическим данным у 7 детей был выставлен диагноз «бронхит», у 14 детей – «пневмония».
Микоплазменная инфекция в возрасте до 3 лет отмечалась у 2 детей, от 4–9 лет – у 8, с 9 до 17 лет – у 11 детей, что характерно для этой формы пневмонии.
У 3 детей наблюдалось субфебрильное повышение температуры тела, у 13 детей фебрильная лихорадка (38–39°С), у 5 пациентов – 39°С и выше. Таким образом, преобладание больных с высокой лихорадкой типично для микоплазмоза (табл. 1).
Несмотря на то что у большинства детей была длительная лихорадка до поступления в стационар, симптомы интоксикации не были выражены, по крайне мере они волновали родителей меньше, чем лихорадка.
Для всех детей был характерен частый кашель, не вызывающий большого дискомфорта. У всех детей отмечено покраснение конъюнктив (без зуда в области глаз).
Клинических признаков бронхообструкции у наблюдаемых детей не было. Аускультативная картина зависела от сроков начала лечения.
У 5 детей с пневмонией, поступивших на 7–9-е сутки, хрипы не прослушивались, имело место ослабление дыхания в зоне пневмонического инфильтрата.
У двоих детей, поступивших в поздние сроки, прослушивались лишь проводные хрипы с двух сторон. Влажные мелкопузырчатые хрипы над зоной поражения определялись у 7 детей, поступивших до 7-го дня. У всех детей с бронхитом выслушивались мелкопузырчатые хрипы с двух сторон. Вне зависимости от сроков начала заболевания рассеянные хрипы, часто напоминающие крепитацию, выслушивались у 4 детей.
Число лейкоцитов до 15×109/л отмечено у 7 детей с бронхитом и у 10 – с пневмонией.
Повышение уровня С-реактивного белка (СРБ) в крови до 30 мг/л наблюдалось у 7 детей, от 30–60 мг/л – у 4, больше 60 мг/л – у 3 детей. Уровень прокальцитонина (ПКТ) не превышал 1 нг/мл у всех больных.
Рентгенологические изменения, позволившие ставить диагноз «пневмония», были выявлены у 14 детей.
У 7 больных отмечено усиление легочного рисунка, не сопровождавшееся достаточно отчетливой инфильтрацией, что позволило поставить диагноз «бронхит». Из 14 детей с пневмоническими участками неплотные инфильтрации с видимым бронхососудистым рисунком на их фоне имели место у 8 детей, у 3 пациентов выявлены плотные альвеолярные инфильтраты.
Для определения этиологической роли атипичных возбудителей в развитии внебольничной пневмонии изучались частота выявления и уровень специфических антител изотипов IgM, IgA и IgG в динамике заболевания.
Из 7 детей, обследованных на 1-й неделе болезни, только у 2 выявлены специфические IgM-антитела к микоплазме. Из 2 больных с положительными IgM-антителами на 1-й неделе парную сыворотку мы взяли у одного ребенка. При этом антитела сохранялись на прежнем уровне. Из 5 пациентов без наличия антител на 1-й неделе заболевания парные сыворотки были исследованы у одного ребенка: отмечено появление IgM-антител на 2-й неделе болезни.
Из 14 пациентов, первично обследованных на 2-й неделе болезни, у 11 детей выявлялись IgM-антитела. Из этих 11 больных повторно обследованы 5 детей, у всех отмечено появление IgG-антител при сохранении IgM. Парные сыворотки были исследованы на 3 детях, не имевших антител на 2-й неделе болезни: у всех появились антитела класса IgM во второй сыворотке крови.
Таким образом, у 10 из 21 обследованного серологически больного при повторном тестировании была подтверждена микоплазменная этиология заболевания (на основании наличия IgM в отсутствие IgG на 1-й и 2-й неделях и появление IgG при сохранении IgM-класса антител).
У 7 детей, обследованных однократно, были выявлены IgM-антитела (из них у 2 пациентов при высокоположительных антителах класса IgM определялись IgG-антитела в низких титрах). Учитывая сроки обследования, мы можем предполагать у этих 7 больных микоплазменную этиологию болезни с достаточной степенью вероятности, особенно с учетом положительного ответа на лечение.
В группу также были включены 4 больных, обследованных на 1-й неделе заболевания с отрицательными серологическими результатами, которые не реагировали на β-лактамы, но быстро купировались на фоне терапии макролидами (табл. 2)
Дополнительным подтверждением микоплазменной этиологии пневмонии был быстрый эффект от назначенной терапии макролидами (снижение температуры, отмечалось улучшение самочувствия, появление аппетита).
Лечение в клинике проводилось джозамицином в дозе 40 мг/кг массы тела в сутки в течение 7 дней.
Антибактериальную терапию до поступления в стационар получали 16 из 21 ребенка, 13 детей в течение первых пяти дней заболевания получали антибиотики пенициллинового и цефалоспоринового рядов, 3 больных получали макролиды (2 ребенка – джозамицин, 1 – азитромицин) и 5 пациентов поступили в отделение без антибактериальной терапии. Лишь у 3 детей оказалось достаточным продолжение терапии макролидами в условиях стационара тем же препаратом, что и на догоспитальном этапе. Во всех остальных случаях потребовалась смена антибиотика на джозамицин.
У всех больных был отмечен положительный эффект от антибактериальной терапии: снижение температуры до нормальной или субфебрильной в течение первых суток от начала терапии. Кашель и хрипы в легких купировались в течение 4–5 дней.
Результаты исследования и обсуждение
Из 21 ребенка у 10 детей диагноз микоплазменной инфекции был подтвержден лабораторно с помощью ИФА. У 7 детей, обследованных однократно с выявленными IgM-антителами, диагноз был установлен с учетом сроков обследования, положительного ответа на лечение макролидами. Еще 4 больным диагноз верифицирован на основании типичной клинической картины заболевания, рентгенологических данных; в пользу микоплазменной инфекции говорило и отсутствие эффекта от применения β-лактамов.
У 7 детей, обследованных однократно с выявленными IgM-антителами, диагноз был установлен с учетом сроков обследования, положительного ответа на лечение макролидами. Еще 4 больным диагноз верифицирован на основании типичной клинической картины заболевания, рентгенологических данных; в пользу микоплазменной инфекции говорило и отсутствие эффекта от применения β-лактамов.
Большинство детей с микоплазмозом (19 из 21) были старше 3 лет, что типично для этой инфекции. Преобладание больных с высокой лихорадкой характерно для микоплазменной пневмонии, как и наличие сухого конъюнктивита, который в нашем случае был диагностирован у всех больных. В большинстве случаев заболевание сопровождалось асимметричными влажными мелкопузырчатыми хрипами, иногда с крепитацией. У 5 пациентов с пневмонией, поступивших на 7–9-е сутки; хрипы не прослушивались, имело место ослабление дыхания в зоне пневмонического инфильтрата.
Рентгенологические изменения, позволившие установить диагноз «пневмония», были выявлены у 14 детей. У 7 больных отмечалось усиление легочного рисунка, не сопровождавшееся достаточно отчетливой инфильтрацией, что позволило поставить диагноз бронхит». Из 14 детей с пневмоническими участками неплотные инфильтрации с усилением бронхососудистого рисунка имели место у 8 детей (см. рисунок), а у 3 были выявлены плотные альвеолярные инфильтраты. Таким образом, для микоплазменной инфекции было характерно либо отсутствие инфильтрации, либо негомогенная неплотная инфильтрация, не закрывавшая собой бронхососудистый рисунок.
У 7 больных отмечалось усиление легочного рисунка, не сопровождавшееся достаточно отчетливой инфильтрацией, что позволило поставить диагноз бронхит». Из 14 детей с пневмоническими участками неплотные инфильтрации с усилением бронхососудистого рисунка имели место у 8 детей (см. рисунок), а у 3 были выявлены плотные альвеолярные инфильтраты. Таким образом, для микоплазменной инфекции было характерно либо отсутствие инфильтрации, либо негомогенная неплотная инфильтрация, не закрывавшая собой бронхососудистый рисунок.
Общий анализ крови выявил низкий или умеренно повышенный уровень лейкоцитов: у всех больных он не превышал 15×109/л.
Лечение микоплазменной инфекции включило джозамицин в дозе 40 мг/кг/сут в течение 7–10 дней, а 2 детей –азитромицин в соответствующей дозировке. У всех больных был отмечен положительный эффект от антибактериальной терапии.
Таким образом, диагностика атипичных инфекций у детей требует учета клинических данных, несмотря на расширяющийся арсенал лабораторных методик.
 , Kimura K., Komiyama O., Nonoyama M., Kobayashi I., Kato T., Sunakawa K. Prospective surveillance for atypical pathogens in children with community-acquired pneumonia in Japan. Infect. Chemother. 2006;12(1):36–41.
, Kimura K., Komiyama O., Nonoyama M., Kobayashi I., Kato T., Sunakawa K. Prospective surveillance for atypical pathogens in children with community-acquired pneumonia in Japan. Infect. Chemother. 2006;12(1):36–41. Scand. J. Infect. Dis. 2009;41(4):313–16.
Scand. J. Infect. Dis. 2009;41(4):313–16.
Д.Д. Гадлия – аспирант 2-го года обучения в отделении диагностики и восстановительного лечения ФГБНУ Научный центр здоровья детей, Москва; e-mail: [email protected]
М.Д. Бакрадзе – ФГБНУ Научный центр здоровья детей, Москва
В.К. Таточенко – ФГБНУ Научный центр здоровья детей, Москва
М.И. Петровская– ФГБНУ Научный центр здоровья детей, Москва
Т.А. Хохлова – ФГБНУ Научный центр здоровья детей, Москва
И.В. Зубкова – ФГБНУ Научный центр здоровья детей, Москва
симптомы, диагностика и лечение микоплазмоза
Микоплазмоз – это заболевание, вызываемое микоплазмами – микробами, занимающими промежуточную ступеньку между одноклеточными организмами (протистами) и многоклеточными бактериями и вирусами. Микоплазма считается условно-патогенным микроорганизмом, то есть она может присутствовать в человеческом организме, но заболевание вызывает лишь при определённых условиях.Насчитывается более 10 разновидностей микоплазмы, обитающих в человеке, но только несколько из них способны стать причиной заболевания. Одна из этих опасных разновидностей (Mycoplasma pneumoniae) – вызывает респираторный микоплазмоз и атипичную пневмонию. Остальные являются урогенитальными инфекциями. Поэтому обычно микоплазмоз рассматривается в числе заболеваний мочеполовой системы.
Причины микоплазмоза
Носителями микоплазм могут быть и мужчины и женщины, но острое течение микоплазмоза чаще встречается у женщин. Как правило, микоплазмоз проявляется на фоне снижения иммунитета. Факторами, способствующими развитию микоплазмоза, являются:
- переохлаждение;
- стрессы;
- беременность;
- роды;
- аборт;
- сложные гинекологические операции;
- воспалительные процессы мочеполовой системы. Микоплазмоз часто присоединяется к другим заболеваниям. При развитии воспаления мочеполовой системы микоплазмы выявляется в 60-90% случаев, тогда как у здоровых людей микоплазмы выявляются только в 5-15% случаев.
Mycoplasma pneumoniae, являющаяся возбудителем ОРЗ, передаётся воздушно-капельным путем, типичным для группы респираторных заболеваний.
Микоплазмы, являющиеся урогенитальными инфекциями, передаются половым путём, у детей возможно внутриутробное заражение.
Осложнения урогенитального микоплазмоза
Микоплазмоз у женщин может привести к развитию таких заболеваний, как сальпингит, вагинит, цервицит, эндометрит. При беременности микоплазменная инфекция становится причиной многоводия, аномалий плаценты, других осложнений и может стать причиной невынашивания ребёнка. У мужчин возможны осложнения в виде простатита. Также микоплазмоз способен вызвать уретрит, пиелонефрит и некоторые другие заболевания.
Симптомы микоплазмоза
Респираторный микоплазмоз по симптоматике не отличается от других ОРЗ.
Урогенитальный микоплазмоз проявляется такими симптомами, как:
Выделения из половых путей
Для микоплазмоза характерны прозрачные выделения из половых путей. Они могут наблюдаться как у женщин (из влагалища), так и у мужчин – из уретры по утрам.
Подробнее о симптоме
Дискомфорт при мочеиспускании
При мочеиспускании больные микоплазмозом могут ощущать дискомфорт и жжение.
Боль
Микоплазмоз может проявляться болью в паху или нижней части живота. Боль, как правило, тянущая. У женщин боль может принимать острый характер во время или после полового акта.
Болезненность и увеличение мошонки у мужчин
У мужчин при микоплазмозе может быть покраснение в области мошонки. Сама мошонка увеличивается в размерах и становится болезненной. Это свидетельствует о микоплазменном поражении яичек.
Методы диагностики микоплазмоза
Присутствие микоплазм в организме выявляется с помощью лабораторных исследований.
Важно не только выявить наличие микоплазмы, но и оценить степень её влияния на воспалительный процесс, то есть установить, что имеет место именно микоплазмоз. Поэтому обычно при наличии симптомов воспаления, проводятся анализы широкого спектра, позволяющие выявить различные виды возбудителей. Лечение назначается в зависимости от того, что показали результаты исследований.
Микроскопическое исследование
Проводится микроскопическое исследование мазка на флору. Исследование позволяет выявить широкий спектр присутствующих возбудителей (бактерии, грибы, трихомонады). Это помогает врачу назначить наиболее эффективное лечение.
ПЦР-диагностика
Серологический анализ крови
Иммуноферментный анализ используется преимущественно для выявления Mycoplasma pneumoniae (возбудителя респираторного микоплазмоза).
Подробнее о методе диагностики
Чтобы точно продиагностировать заболевание, запишитесь на прием к специалистам сети «Семейный доктор».
Методы лечения микоплазмоза
Лечение микоплазмоза должны пройти оба партнёра, поскольку в противном случае вероятно повторное заражение.
В курс лечения урогенитального микоплазмоза, как правило, входят:
Антибактериальная терапия
Используются антибиотики, эффективные именно против микоплазмы. Лечение должно назначаться врачом, самовольно использовать антибиотики не следует. Результат должен быть подтверждён лабораторными исследованиями, исчезновение симптомов микоплазмоза не означает излечения. Нельзя самовольно прекращать принимать препарат или менять схему его приёма.
Местная терапия
Местная терапия проводится совместно с антибактериальной. Применяются свечи, спринцевание, инсталляции. Используются этиотропные, противовоспалительные препараты и ферменты.
Иммуностимулирующая терапия
Поскольку развитие микоплазмоза обычно происходит на фоне пониженного иммунитета, в курс лечения обязательно включается иммуноориентированная терапия. Также после лечения антибиотиками необходимо восстановить нормальную микрофлору, для чего назначаются пробиотики.
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Оцените, насколько был полезен материал
Спасибо за оценку
Похожие заболевания
Все заболеванияАнтибиотики для лечения респираторных инфекций, вызванных бактерией Mycoplasma pneumoniae, у детей
Вопрос обзора
Этот обзор стремился ответить на вопрос о том, эффективны ли антибиотики в лечении инфекций нижних дыхательных путей (ИНДП), вызванных бактерией Mycoplasma pneumoniae ( М. pneumoniae ) у детей.
Актуальность
M. pneumoniae является бактериальным возбудителем, часто ответственным за развитие инфекций нижних дыхательных путей (ИНДП) у детей. Инфекция может протекать по-разному, и наиболее распространенными респираторными проявлениями являются острый бронхит, пневмония или стридор [свистящее, шумное дыхание]. Заболевание, как правило, разрешается самостоятельно, симптомы могут длиться в течение нескольких недель, но иногда заболевание может привести к тяжелой пневмонии. Антибиотики часто назначают детям с ИНДП, вызванной M.pneumoniae.
Даты поиска
Мы провели поиск клинических испытаний, опубликованных по июль 2014 года.
Характеристика исследований
Рандомизированные контролируемые испытания (РКИ), сравнивающие либо два типа антибактериальной терапии, или антибиотик против плацебо, у детей с пневмонией.
Основные результаты
Мы выявили семь исследований (1912 детей). В каждом исследовании было несколько детей, у которых обнаружили M.pneumoniae, но мы не могли извлечь соответствующие данные по эффективности или неблагоприятным событиям, имеющие отношение только к детям с M.pneumoniae.
Качество доказательств
В целом, качество доказательств по каждому из главных/основных исходов было очень низким, поскольку по отношению к любым исходам данных было недостаточно. Таким образом, в настоящее время, нет достаточных доказательств, чтобы окончательно показать, что антибиотики эффективны у детей с ИНДП, вызванными M.pneumoniae ,
Группа компаний ИНФРА-М
Респираторный микоплазмоз в настоящее время остается одной из наиболее изучаемых и обсуждаемых проблем педиатрической пульмонологии. Mycoplasma pneumoniae обладает наибольшей патогенностью среди других представителей своего семейства. Возбудитель считается вторым по значимости этиологическим фактором при внебольничной пневмонии (ВП) у детей после 5 лет [1, 3, 12], обусловливает атипичное и нередко более тяжелое течение неспецифических поражений легких [3, 7], является триггером обострения хронической бронхолегочной патологии, в том числе бронхиальной астмы [11]. Микоплазменная инфекция преобладает у детей школьного возраста и регистрируется у 9,8% детей в возрасте до 1 года, у 21,1% – 1-2 лет, у 44,4% – 3-6 лет и у 61,6% детей старше 7 лет. [16]. Источником респираторного микоплазмоза является больной человек (вопрос о роли бактерионосителей до конца не ясен), причем инфицирование происходит лишь при тесном контакте, что обусловлено нестойкостью возбудителя в окружающей среде. Поэтому типичными для Mycoplasma pneumoniae являются семейные очаги инфекции, но в отличие от других респираторных инфекций, микоплазменная распространяется медленно, в течение 1-3 недель, иногда 4 недели, даже в пределах одной семьи. Наиболее высокий уровень заболеваемости отмечается в организованных коллективах, например, если говорить о детях, то в школах [3, 12, 16, 17, 20]. Максимальный подъем заболеваемости отмечается в осенне-зимний период. При этом через каждые 4-8 лет наблюдаются эпидемические вспышки [2, 4, 17, 18, 20].
Клинические проявления микоплазменной инфекции весьма разнообразны и могут характеризоваться как субклиническим, так и манифестным течением. Манифестные формы респираторного микоплазмоза у детей наиболее часто проявляются острыми воспалительными изменениями верхних дыхательных путей, протекающими в форме фарингита, реже – ринита, синусита, среднего отита и ларингита [3, 7, 16, 20]. Клинические проявления микоплазменных поражений верхних дыхательных путей имеют мало специфических черт и практически не отличаются от аналогичных заболеваний другой, нередко вирусной этиологии, т.е. протекают как обычные острые респираторные инфекции.
Инфекция нижних отделов органов дыхания сопровождается развитием воспаления бронхов и легких. При этом наиболее частой клинической формой заболевания является бронхит [3, 7, 15]. Однако при эпидемическом подъеме заболеваемости частота развития микоплазменных пневмоний значительно возрастает. Так, установлено, что в этот период до 40-60% всех ВП у детей школьного возраста имеют микоплазменную этиологию, в закрытых коллективах данный показатель возрастает до 70% [1, 4, 15,16].
Клинический дебют такой пневмонии напоминает развитие инфекции верхних дыхательных путей, но с более выраженной лихорадкой. Cимптомы интоксикации выражены неярко, что является одним из немногих специфических признаков микоплазменной пневмонии. Кроме этого, через несколько дней от начала заболевания появляется сухой, навязчивый и/или приступообразный кашель, который может отмечаться в течение длительного времени – до нескольких недель. Кашель постепенно становится продуктивным и более редким. В легких при этом могут выслушиваться рассеянные сухие и разнокалиберные влажные хрипы. При рентгенологическом обследовании в легких выявляют двусторонние очаги негомогенной инфильтрации, которые чаще наблюдаются в нижних отделах легких, но могут быть и односторонние инфильтративные тени. Плевральная реакция ограничивается в основном междолевой плеврой. В гемограмме изменения минимальные – редко может выявляться умеренный лейкоцитоз. Заболевание, как правило, протекает нетяжело, характеризуется гладким течением и отсутствием дыхательной недостаточности или слабой ее выраженностью [3, 7, 16, 18, 20].
Отсутствие четких клинических, рентгенологических и гематологических критериев верификации микоплазменной пневмонии увеличивает значимость и необходимость лабораторного подтверждения данного диагноза.
В настоящее время лабораторная диагностика респираторного микоплазмоза считается оптимальной, если используется современная комбинация методов, направленных на выявление в исследуемых материалах (мазок из ротоглотки, назофарингеальная слизь, мокрота, плевральный экссудат и др.) возбудителя методом ИФА или его генома в ПЦР, а также специфических антител IgМ, IgA и IgG в сыворотке крови. Одновременное использование двух методов исследования (ПЦР и серологического) позволяет выявить большинство случаев микоплазменной инфекции [7, 10, 13]. При этом методом выбора является мультиплексная ПЦР в режиме «реального времени», позволяющая с высокой чувствительностью определить не только уровень микробной нагрузки, но и фрагменты генома нескольких возбудителей в одном образце.
Еще одним важным и проблемным вопросом респираторного микоплазмоза является адекватная антибактериальная терапия. Этому в настоящее время придается особое значение в связи с ростом устойчивости бактериальных возбудителей к антимикробным средствам. В педиатрической практике с учетом биологических особенностей возбудителя и безопасности препаратов, которые могут использоваться для лечения микоплазменной инфекции, в том числе и у детей до 8 лет, основными остаются макролиды, в более старшем возрасте допустимы хинолоны и тетрациклины.[1, 6, 16, 20].
К сожалению, необоснованно интенсивное назначение макролидов при острых респираторных инфекциях в амбулаторной педиатрической практике без учета их этиологии, привело к росту устойчивости к макролидам не только пневмококка, но и Mycoplasma pneumoniae [19]. Резистентность к макролидным антибиотикам, в основном у детей, начали регистрировать с 2000-х годов, в России – с 2005 года [8]. Наиболее высокие ее уровни отмечены в последнее время в Китае, Южной Корее и других странах Азиатско-Тихоокеанского региона [9, 14, 19, 21].
Все вышесказанное нашло отражение в рекомендациях по лечению респираторного микоплазмоза у детей. По мнению зарубежных и отечественных специалистов, в странах с низким уровнем резистентности макролиды остаются препаратами первой очереди. При высоком уровне устойчивости микоплазм к макролидным антибиотикам рекомендована альтернативная терапия тетрациклинами (для детей старше 8 лет) и в случае особой необходимости – фторхинолонами, хотя сохраняются возрастные ограничения [1, 6, 14, 20].
По данным, представленным О.В.Островской и соавт. [5], в г. Хабаровске cреднегодовые показатели частоты выявления Mycoplasma pneumoniae у детей с внебольничными пневмониями варьировали в разные годы от 2,2 до 16,2%. Подъем выявляемости микоплазм носил сезонный характер, начинался с последних летних месяцев, достигал наибольших значений в сентябре-октябре (в разные годы от 10 до 50% исследованных случаев) и постепенно уменьшался к февралю-марту следующего года. В эти периоды подъема наблюдались школьные и семейные очаги инфекции, регистрировались больные пневмонией, фарингитами, бронхитами, а также – бактерионосители. Отмечено медленное и продолжительное развитие вспышки в течение 6 мес. Элиминация возбудителя у инфицированных и заболевших происходила в течение 1-4 мес [3–5].
Вспышки респираторного микоплазмоза были зафиксированы в Хабаровском крае (г. Хабаровск, п. Ванино) в августе 2004 – феврале 2005 г., в октябре-ноябре 2016 г. (г. Хабаровск, пос. Новый Ургал [2, 4]. С середины сентября 2017 г. в городе вновь наблюдался подъем заболеваемости пневмониями, особенно среди школьников. По нашим данным частота выявления ДНК возбудителя в этот период составила 15,01% у детей с бронхолегочной патологией, обследованных амбулаторно и в стационаре, среди больных с подтвержденным диагнозом ВП – 38,04%. В этот период было изучено 7 очагов респираторного микоплазмоза (n=26), один из которых представлен ниже в качестве клинического примера.
Клиническое наблюдение 1. Ребенок К.А. 17 лет (06.05.2000 г.) поступил 10.10.2017 г. в педиатрическое отделение НИИ ОМиД с жалобами на повышение температуры тела до 40ºС, влажный неэффективный кашель, боль в грудной клетке при кашле с иррадиацией в подмышечную область. Болен с середины сентября 2017 г.: с 14.09. по 25.09.17 перенес острую респираторную инфекцию, получал симптоматическую терапию и циклоферон. Выписан, посещал занятия в школе. Однако с 02.10.17 отмечено ухудшение: повторное повышение температуры тела до субфебрильных цифр, появление слабости, симптомов интоксикации. 06.10.17 зафиксировано повышение температуры до 40ºС, осмотрен педиатром, назначен флемоксин в возрастной дозировке 500 мг 3 раза в день. На фоне антибактериальной терапии положительной динамики не наблюдалось. 09.10.17 повторно осмотрен участковым педиатром и инфекционистом для исключения инфекционной патологии (менингит). Антибиотик заменен на супракс – 400 мг 1 раз в день (получил однократно). 10.10.17 на обзорной рентенограмме грудной клетки выявлены инфильтративные изменения в средней доле правого легкого, с реакцией междолевой плевры. В связи с тяжестью состояния (фебрильная температура более 5 дней, выраженные симптомы интоксикации) с учетом объема инфильтрации в легких и неэффективностью амбулаторно проведенной антибиотикотерапии, направлен на стационарное лечение. В анамнезе у ребенка однократно зарегистрирован отек Квинке половых органов, лица и губ при контакте с лошадиной шерстью. Привит по возрасту, без реакций. Острые респираторные инфекции до 8 раз в год. При поступлении состояние средней тяжести, температура тела 37,5ºС, слабость, положение тела пассивное, кожные покровы бледные, периорбитальный цианоз, сухость губ и слизистых. Число дыханий 18 в мин., одышки нет. В легких при перкуссии укорочение звука справа, аускультативно – дыхание везикулярное, ослаблено справа по краю лопатки, хрипов нет. ЧСС 100 в 1 мин., АД 110/70 мм рт. ст. Со стороны других органов и систем патологических отклонений не выявлено. Предварительный диагноз: ВП правосторонняя среднедолевая, острая, средней степени тяжести острого течения, предположительно пневмококковой этиологии. Плеврит серозный междолевой, синпневмонический. Проведено обследование: клинический анализ крови при поступлении: гемоглобин – 165 г/л, эритроциты – 5,57×1012/л, СОЭ – 8 мм/час, лейкоциты – 8,5×109/л, палочкоядерные – 6%, сегментоядерные – 56%, эозинофилы – 3%, лимфоциты – 27%, моноциты – 8%, тромбоциты – 210×109 г/л. ЭКГ от 04.10.17 (амбулаторно): ритм синусовый реулярный с ЧСС 94 уд/мин, отклонение электрической оси сердца вправо, блокада правой ножки пучка Гиса. Умеренные изменения в миокарде. Другие анализы без патологических изменений
С учетом ранее проведенной терапии с первых суток назначен цефтриаксон в/в через кубитальный катетер (из расчета 60 мг/кг в сутки) 1,0 × 2 раза в день, с муколитической целью – амброксол 30 мг × 3 раза в день, ультразвуковые ингаляции с 0,9% NaCl × 2 раза в день. На 3-й день пребывания в стационаре ввиду тяжести состояния, сохраняющихся подъемов температуры до фебрильных цифр, размеров инфильтративных изменений в легких и наличия плеврита, выраженной интоксикаци, произведена корректировка антибактериальной терапии – назначен комбинированный курс (аминогликозиды+цефалоспорины): сульзонцеф 1,0 × 2 раза в день + амикацин (из расчета 10 мг/кг) 300 мг × 2 раза в день в/в. В анализе мазка из ротоглотки от 12.11.17 методом ПЦР обнаружена ДНК Mycoplasma pneumoniae. На основании проведенного клинического, лабораторного и инструментального обследования был установлен клинический диагноз: Пневмония внебольничная, очаговая справа в средней доле, затяжного течения, средней степени тяжести, вызванная Mycoplasma pneumoniae. Синпневмонический плеврит. (J15.7).
15.10.17 в месте ведения периферического катетера появилась умеренная болезненность и гиперемия а также на коже обеих рук мелкопятнистая сыпь по типу контактного дерматита без тенденции к слиянию элементов и зуда. Катетер удален. Антибактериальную терапию решено продолжить путем в/м введения препаратов. Дополнительно, для купирования болевого синдрома при кашле (проявления плеврита) назначен диклофенак 50 мг × 3 раза в день и для уменьшения проявлений экзантемы супрастин 2,0 × 2 раза в день в/м. Эрадикация Mycoplasma pneumoniae проведена азитромицином 500 мг в день с 17.10 по 27.10.17. На фоне проведенного лечения состояние ребенка улучшилось: интоксикационный синдром и синдром воспалительных изменений легочной ткани купированы, нормализовалась температура, кашель отсутствует. Гемограмма от 27.10.17 без патологии. На рентенограмме от 30.10.17 в прямой и правой боковой проекциях: легочный рисунок усилен справа за счет сосудистого компонента. Инфильтративных теней нет. Синусы свободные. Органы средостения не изменены. Заключение: очаговая пневмония в средней доле правого легкого в стадии разрешения. Выписан под наблюдение участкового педиатра 30.10.17. Число проведенных в стационаре койко-дней составило 20.
Учитывая наступление сезона подъема заболеваемости микоплазменной инфекцией, для исключения возможного формирования семейного очага респираторного микоплазмоза, всем членам семьи проведено исследование мазков из ротоглотки методом ПЦР на наличие атипичных возбудителей Chlamydophila et Mycoplasma pneumoniae. Результат анализа от 15.10.17 – отрицательный. Семья состоит из 4 человек, с пациентом в одной квартире проживают бабушка в возрасте 64 лет, мать – 42 лет и сестра – 15 лет.
Клиническое наблюдение 2. 25.10.2017 г. госпитализирована сестра описанного ранее больного, К.Е. 15 лет (24.04.2002 г.) с жалобами на слабость, боли в горле, повышение температуры до 37,5ºС. Девочка больна с 20.10.17, когда снизился аппетит, появились боли в горле, повысилась температура тела до фебрильных цифр. 23.10.17 осмотрена участковым педиатром. Учитывая семейный эпиданамнез назначен азитромицин (получила однократно) и симтоматическая терапия. На фоне лечения сохранялась субфебрильная температура. 25.10.17 при повторном осмотре на участке заподозрена пневмония. На обзорной рентгенограмме выявлена воспалительная инфильтрация справа в S6. Направлена на стационарное лечение в НИИ ОМиД. Аллергологический анамнез не отягощен. Из перенесенных ранее заболеваний – острый бронхит и острая респираторная инфекция 2-3 раза в год. При поступлении: состояние средней тяжести за счет симптомов интоксикации (снижение аппетита, слабость, бледность), воспалительных изменений в легких. Кожные покровы бледные, периорбитальный цианоз. Слизистая ротоглотки гиперемирована, небные миндалины не увеличены, чистые. Носовое дыхание свободное. Одышки нет, число дыханий 19 в минуту. Перкуссия легких: укорочение справа. Дыхание жесткое, в нижних отделах справа ослаблено. Результаты лабораторного обследования от 26.10.17: общий анализ крови – лейкопения 3,4×109/л, остальные показатели в норме. Общий анализ мочи, копрограмма, биохимический анализ, острофазовые показатели крови без патологических изменений. Диагностика пневмотропных возбудителей методом ПЦР в мазке из ротоглотки от 26.11.17 – ДНК Mycoplasma pneumoniae положительная.
Таким образом, учитывая данные проведенного обследования, эпиданамнез, ребенку установлен клинический диагноз: Пневмония внебольничная, очаговая справа в средней доле, острого течения, средней степени тяжести, вызванная Mycoplasma pneumoniae.
Получала лечение: цефотаксим 1000 мг 3 раза в день в/м с 25.10 по 03.11.17, азитромицин по 500 мг внутрь 1 раз в день в течение 7 дней (по 31.11.17 включительно), вибрационный массаж, постуральный дренаж. Физиотерапия – ЭВТ на грудную клетку. Состояние пациентки после 9 койко-дней пребывания в стационаре значительно улучшилось. На контрольной рентгенограмме органов грудной клетки от 03.11.17 зафиксировано разрешение пневмонии в нижней доле правого легкого. Ребенок выписан для последующего наблюдения и реабилитации на участке.
31.10.2017 года в лабораторию молекулярно-генетических методов исследования НИИ обратилась мать, представленных ранее детей К.М.А, 42 лет, для обследования на Mycoplasma pneumoniae. Из анамнеза выяснено, что в течение последних двух недель ее беспокоил сухой кашель, повышение температуры до субфебрильных цифр в вечернее время, слабость. Женщина была обследована рентгенологически и осмотрена терапевтом в поликлинике по месту жительства. На рентгенограмме органов грудной клетки от 27.10.17 выявлена очаговая инфильтрация легочной ткани в средней доле правого легкого. Дополнительно 30.10.17 был сделан анализ сыворотки крови методом ИФА, в котором выявлены специфические IgG и IgA к Mycoplasma pneumoniae, IgM –отрицательные. Таким образом, у пациентки диагностирована внебольничная пневмония правосторонняя очаговая, острого течения, с учетом данных семейного эпиданамнеза, этиологически обусловленная микоплазменной инфекцией. С 27.10.17 назначена антибактериальная терапия офлоксацином по 400 мг 2 раза в день внутрь, курсом до 7 дней Лечение проводилось амбулаторно. В мазке из ротоглотки от 31.10.17 методом ПЦР обнаружена ДНК Mycoplasma pneumoniae.
Таким образом, в описанном нами примере у 3 из 4-х членов одной семьи диагностирована одна из наиболее серьезных форм респираторного микоплазмоза – внебольничная пневмония. При этом прослеживаются наиболее типичные эпидемиологические признаки микоплазменной инфекции – сезонность (осенне-зимний подъем заболеваемости), медленное распространение и развитие болезни при тесном контакте внутри семьи (в течение 3-х недель), возраст пациентов (старшие школьники и взрослые). Клиническая картина ВП в каждом случае имела свои особенности. Так, в первом наблюдении заболевание протекало более продолжительно и тяжело. Это было обусловлено отягощенным преморбидным фоном – ранее перенесенной вирусной инфекцией, имеющимися иммунологическими отклонениями (аллергия и высокий инфекционный индекс – острые респираторные инфекции более 8 раз в году). Отсутствие лабораторного подтверждения микоплазменной этиологии пневмонии в первые дни болезни не позволило применить адекватную схему антибактериальной терапии несмотря на количество использованных препаратов. Только после назначения макролидов (азитромицин) были купированы все симптомы заболевания. В двух других случаях своевременное применение рекомендованных антибиотиков дало более быстрый лечебный эффект.
Достоверность молекулярной диагностики респираторного микоплазмоза влияет на необходимость и обоснованность применения антибактериальной терапии для лечения инфекции и быстрой элиминации возбудителя у членов одной семьи. Вопрос о назначении антимикробной терапии с профилактической целью в семейных очагах микоплазменной инфекции остается нерешенным и требует дальнейшего изучения.
Определение антител класса G ( IgG) к микоплазме пневмонии (Mycoplasma pneumoniae) в крови
Антитела класса IgG к Mycoplasma pneumoniae появляются в крови в течение первых 2-4 недель заболевания и сохраняются повышенными длительное время, не обеспечивая иммунитета к инфекции.
Общая информация об инфекции
Микоплазмы — это группа весьма разнообразных и характерных по морфологии грамотрицательных бактерий размером 150−200 нм. Они не имеют плотной клеточной стенки и покрыты трёхслойной цитоплазматической мембраной. В зависимости от вызываемых ими патологических процессов у человека микоплазмы разделяют на шесть групп:
1. Микоплазмы — возбудители респираторных заболеваний, основной возбудитель Mycoplasma pneumoniaе.
2. Микоплазмы, связанные с заболеваниями мочеполового тракта, основные возбудители Mycoplasma hominis и Ureaplasma urealyticum.
3. Микоплазмы — возбудители ревматоидных процессов.
4. Микоплазмы — возбудители сложных воспалительных синдромов.
5. Микоплазмы, связанные с разнообразными по их локализации воспалительными процессами.
6. Микоплазмы — условные сапрофиты, выявляемые в выделениях практически здоровых людей.
Наибольший интерес в клинической практике представляют возбудители первых двух групп заболеваний.
Mycoplasma pneumoniae вызывает у человека респираторный микоплазмоз — группа антропонозных инфекционно–воспалительных заболеваний органов дыхания. Больной микоплазмозом заразен для окружающих на протяжении десяти дней, а если болезнь приобретает хронический характер, то этот период увеличивается до 13 недель. Заражение происходит воздушно-капельным путем, но иногда можно заразиться и посредством бытовых контактов (рукопожатия, предметы обихода), что чаще всего бывает в детских коллективах. Инкубационный период заболевания составляет 1-2 недели.
Клиническими проявлениями респираторного микоплазмоза являются: першение в горле, кашель, температура до 38°C, покраснение слизистой оболочки рта и глотки, заложенность носа. Все это напоминает грипп, только при гриппе болезнь развивается бурно, за 1-2 дня, а в случае респираторного микоплазмоза это длительный процесс, следующей фазой которого станет развитие микоплазменной пневмонии.
Показания для назначения данного исследования
1. При дифференциальной диагностике острых респираторных заболеваний, протекающих со сходными симптомами (длительный кашель, фарингит, синусит, отит).
2. При бронхиальной астме, астматическом бронхите или острой пневмонии, если известно, что эти заболевания не связаны с гриппом или другими ОРЗ.
Литература:
Кишкун А.А. Иммунологические исследования и методы диагностики инфекционных заболеваний в клинической практике. — М.: ООО «Медицинское информационное агентство», 2009. С. 535-545.
Mycoplasma pneumoniae Infections — HealthyChildren.org
Некоторые легочные инфекции, включая многие случаи легкой пневмонии (также называемой ходячей пневмонией), вызываются организмом под названием Mycoplasma pneumoniae. Он передается от человека к человеку с выделениями, такими как мокрота из дыхательных путей, и имеет инкубационный период от 2 до 3 недель. Передача этого организма обычно происходит при тесном контакте. Вспышки произошли и являются обычным явлением в летних лагерях и колледжах, а также внутри домашних хозяйств среди членов семьи.
В то время как M pneumoniae инфекции редко встречаются у детей младше 5 лет, они являются основной причиной пневмонии у детей школьного возраста и молодых людей. Эпидемии этого заболевания в общинах происходят каждые 4-7 лет.
Признаки и симптомы
M pneumoniae Инфекции вызывают симптомы, обычно легкие. У некоторых детей со временем они могут ухудшиться. Наиболее частые симптомы —
.- Бронхит
Инфекции верхних дыхательных путей, включая боль в горле, а иногда и инфекции уха.
У детей с этой инфекцией также может быть высокая температура, продолжительная слабость, а в некоторых случаях — головные боли и сыпь.Их кашель может измениться с сухого на мокрый. В редких случаях у детей может развиться круп и инфекция носовых пазух (синусит).
Когда звонить педиатру
Если эти симптомы, включая жар, длятся более нескольких дней, обратитесь к педиатру.
Как ставится диагноз?
Ваш педиатр проведет медицинское обследование вашего ребенка. Врач может назначить анализ крови на антитела к M pneumoniae или холодовых агглютининах, , которые представляют собой особый тип антител.В настоящее время разрабатываются специальные тесты для выявления микроорганизмов в образцах из горла и дыхательных путей, но они пока недоступны.
Лечение
В большинстве случаев бронхит и заболевания верхних дыхательных путей, связанные с инфекциями M pneumoniae , протекают в легкой форме и проходят самостоятельно без лечения антибиотиками. Однако антибиотики, такие как эритромицин, азитромицин или доксициклин, могут быть назначены при более серьезных симптомах, связанных с пневмонией и ушными инфекциями.
Каков прогноз?
Эта инфекция часто вызывает хрипы у детей с астмой или реактивными дыхательными путями. Большинство людей полностью выздоравливают от этой инфекции, даже если не используются антибиотики. Смертность довольно низкая.
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать лечение по-разному, исходя из индивидуальных фактов и обстоятельств.
Клинические проявления у младенцев и детей с инфекцией Mycoplasma pneumoniae
PLoS One. 2018; 13 (4): e0195288.
, курирование данных, формальный анализ, расследование, написание — первоначальный черновик, 1, * , расследование, методология, проверка, написание — обзор и редактирование, 2 , концептуализация, методология, надзор, написание — рецензирование и редактирование , 2 и, Концептуализация, Методология, Управление проектами, Надзор, Написание — просмотр и редактирование 1Миа Йоханна Сондергаард
1 Отделение педиатрии, Госпиталь Нордшелланд, Хиллерод, Дания
Мартин Барфред Фриис
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Деннис Шредер Хансен
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Inger Merete Jørgensen
1 Отделение педиатрии, больница Нордшелланд, Хиллерод, Дания
Оливер Шильдген, редактор
1 Отделение педиатрии, больница Нордшелланд, Хиллерод, Дания
2 Отделение клинической микробиологии, больница Херлев, Херлев, Дания
Kliniken der Stadt Köln gGmbH, ГЕРМАНИЯ
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Поступила 21.10.2016; Принято 14 февраля 2018 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника ссылки на эту статью. другими статьями в PMC.Abstract
Предпосылки
Mycoplasma pneumoniae — частая причина внебольничной пневмонии у детей старшего возраста.Легочные и внелегочные симптомы, связанные с M . Сообщается о pneumoniae, инфекциях. М . pneumoniae — это в основном эпидемия в Дании с рецидивами каждые 4-7 тыс. лет.
Цели
Ретроспективно, описать эпидемиологию и клинические особенности у младенцев и детей во время M . pneumoniae эпидемия в 2010 и 2011 годах.
Методы
Все дети в возрасте до 16 лет, прошедшие тестирование на M .Включено pneumoniae за период 01.02.2010–31.01.2012. Медицинские карты, а также рентгенологические данные были проанализированы для всех детей с M . пневмония . Для части когорты был проведен апостериорный анализ сопутствующих вирусных инфекций.
Результаты
134 из 746 детей дали положительный результат на M . pneumoniae с помощью ПЦР или серологии. Положительные тесты были обнаружены у 65% детей семи лет и старше, у 30% детей от 2 до 6 лет и у 4% детей младше 2 лет.Сопутствующая вирусная инфекция была обнаружена в 27% исследованных образцов. Клиническими проявлениями были кашель, симптомы астмы и субфебрильная температура. Внелегочные симптомы были обычным явлением и проявлялись в виде тошноты / рвоты у 33% детей и кожных проявлений у 25%. 84% детей сделали рентген грудной клетки, и у 94% из них были получены положительные рентгенологические данные.
Заключение
М . pneumoniae также поражали младенцев и детей младшего возраста, и симптомы были аналогичны инфекциям респираторными вирусами, но также наблюдались тяжелые инфекции нижних дыхательных путей.Во время надвигающейся эпидемии оценка внелегочных проявлений может быть полезной при диагностике M . pneumoniae инфекций.
Введение
Mycoplasma pneumoniae ( M . pneumoniae ) является важной причиной инфекций дыхательных путей, особенно у детей и молодых людей, и, по оценкам, составляет до 30-40% внебольничных инфекций. пневмония (ВП) [1–4]. Легочные проявления — это, как правило, трахеобронхит и пневмония, сопровождающиеся кашлем, но также и хрипом.Считается, что маленькие дети не так восприимчивы к M . pneumoniae в школьном возрасте [5,6]. В Дании M . pneumoniae в основном эпидемия с частотой рецидивов каждые 4-7 тыс. лет [7].
Дания испытала M . Эпидемия pneumoniae , пик которой пришелся на осень 2010 г. и снова на осень 2011 г. Statens Serum Institut (SSI), отвечающий за национальную систему эпиднадзора в Дании, охарактеризовал ее как две волны одной и той же эпидемии [7].
Осознание того, что дети дошкольного возраста и даже младенцы могут быть восприимчивыми и иметь клинические симптомы из M . pneumoniae Инфекция развивалась в течение последних лет, о ней сообщалось в исследованиях, проведенных в Европе и Австралии [8–14]. С клинической точки зрения важно установить, является ли M . pneumoniae играет важную роль в развитии инфекций нижних дыхательных путей и обострений, подобных астме, у детей раннего и младшего возраста.В последние годы проблема коинфекций и бессимптомного носительства М . pneumoniae и, следовательно, гипердиагностика M . pneumoniae методом ПЦР обсуждались [15].
Целью данного исследования было описание и характеристика модели M . pneumoniae в условиях больницы, а также для оценки возможных возрастных клинических проявлений у младенцев, маленьких детей и детей старшего возраста, госпитализированных с диагнозом M . pneumoniae инфекция. Исследование было начато после того, как мы испытали сдвиг в клинической картине нашего M . pneumoniae больных во время эпидемии. Литература в этой области обширна, с различными мнениями, как уже упоминалось, о патогенности бактерий и показаниях к лечению, а также о значении инфекций у детей дошкольного возраста. Наш отчет — еще один кирпичик в понимании этого возбудителя.
Материалы и методы
Мы разработали ретроспективный анализ всех детей младше 16 лет, поступивших в педиатрическое отделение больницы Нордшелланд, Хиллерод, Дания, которые были исследованы на предмет M . pneumoniae либо с помощью полимеразной цепной реакции (ПЦР), либо с помощью серологии (тест на антитела M . pneumoniae и тест на холодовые агглютинины). Период исследования — с 01.02.2010 по 31.01.2012. Мы собрали результаты ПЦР и результаты образцов крови как в нашей местной микробиологической лаборатории (ПЦР), так и в SSI (ПЦР и серология). Данные сопоставлялись по номеру социального страхования, чтобы избежать двойной выборки. ПЦР проводилась на мазках из ротоглотки, которые хранились и транспортировались охлажденными в лабораторию.Диагностика М . pneumoniae был основан на коммерчески доступном наборе для ПЦР в реальном времени (RT-PCR) (Minerva Biolabs Venor R Mp Mycoplasma pneumoniae -Diagnostic Kit for qPCR type I), нацеленного на ген цитоадгезии P1. ПЦР представляла собой мультиплексный анализ, также нацеленный на Chlamydophila pneumoniae / psittaci . Анализ проводили в соответствии с описанием производителя. Короче говоря, 10 мкл образца добавляли к 14,4 мкл мастер-смеси, содержащей 14 мкл буфера, 0.2 мкл Taq-полимеразы и 0,2 мкл урацил-N-гликозилазы. ОТ-ПЦР выполняли в следующих условиях на аппарате Stratagene Mx 3005P RT-PCR: 10 минут при 95 ° C, затем 45 циклов по 30 секунд при 95 ° C, 30 секунд при 55 ° C и 30 секунд при 60 ° C. . М . pneumoniae был обнаружен в фильтре FAM.
Серологические тесты были выполнены внешним коммерческим поставщиком (SSI) на основе M . pneumoniae специфические антитела IgM (MPT) вместе с холодовыми агглютининами (KAT).Титр как MPT, так и KAT выше или равный 64 считался положительным тестом. Поскольку титры KAT падают быстрее после перенесенной инфекции, его использовали для повышения вероятности продолжающейся инфекции. По оценкам, 95% людей в возрасте до 20 лет имеют положительные титры KAT в ответ на M . Инфекция pneumoniae (тест-информация SSI).
Дети, у которых в течение трех месяцев были получены два или более положительных результата ПЦР-теста, рассматривались как один и тот же инфекционный эпизод и включались только один раз.
Детей направили терапевты или отделение неотложной помощи больницы. Дежурный врач заказал M . pneumoniae отбор проб согласно клинической оценке.
Демографические и клинические данные были собраны для 134 детей, у которых был положительный результат теста на M . pneumoniae , по обзору медицинской карты. Карты 612 детей с отрицательными тестами не проверялись. Медицинский анамнез систематически просматривался с использованием компьютеризированных медицинских карт, радиологических отчетов и лабораторных отчетов.Анализируемые характеристики включали демографические данные (возраст, пол, история болезни до госпитализации), клинические проявления (легочные и внелегочные симптомы, клиническое обследование; частота дыхания, аускультация, температура, сатурация кислорода), результаты радиологического исследования, биохимия (С-реактивный белок ( СРБ), количество лейкоцитов при поступлении) сопутствующие инфекции, осложнения и лечение. Для анализа данных дети были разделены на возрастные группы: младше двух лет (далее в тексте — младенцы), от 2 до 6 лет и от 7 до 15 лет (дети школьного возраста).
Для дальнейшего ответа на вопрос о сопутствующих вирусных инфекциях, апостериорный анализ исходного замороженного образца ротоглоточного мазка из 49 из M . pneumoniae положительных когорт, были протестированы с помощью ПЦР с использованием имеющегося в продаже набора (диапазон R-генов Biomerieux Respiratory MWS) для широкого спектра респираторных вирусов (включая респираторно-синцитиальный вирус (RSV), грипп A и B, метапневмовирус человека, риновирус , вирус парагриппа, коронавирус, бокавирус и аденовирус).Короче говоря, ПЦР выполняли в четырех двойных сплетениях; 10 мкл образца добавляли к 15 мкл основной смеси, содержащей буфер, обратную транскриптазу и смесь праймер / зонд. ОТ-ПЦР выполняли в следующих условиях на аппарате Stratagene Mx 3005P RT-PCR: 5 минут при 50 ° C, 15 минут при 95 ° C, затем 45 циклов по 10 секунд при 95 ° C, 40 секунд при 60 ° C. ° C и 25 секунд при 72 ° C. Al-мишени были обнаружены в фильтре FAM или HEX.
Образцы, положительные после более чем 35 Ct-циклов, были повторно оценены для подтверждения истинно положительного результата.
Этический комитет региона Ховедстаден (номер протокола: H-2-2012-132), а также Датское агентство по защите данных одобрили исследование. Это одобрение включало согласие на просмотр медицинских записей без информированного согласия пациентов.
Статистический анализ проводился в STATA 10.0, программных пакетах SPSS версии 22 и Microsoft Excell. Chi 2 -тест, точный критерий Фишера или тест Z-score использовались для категориального анализа данных и двухвыборочного T-теста для числовых данных.Значение p <0,05 считалось значимым.
Результаты
Эпидемиологические данные
Из 885 пациентов протестировано на M . pneumoniae в период исследования, 139 были исключены из-за возраста (старше 15 лет), двойного отбора проб или повторных проб в течение трех месяцев. В исследование были включены 746 детей с инфекциями дыхательных путей (ИРО), и 134 ребенка имели положительный тест на M . пневмония . Из 740 М . pneumoniae ПЦР-анализов, 132 были положительными, а из 20 серологических тестов 3 были положительными. Четырнадцать детей были протестированы как с помощью ПЦР в реальном времени, так и с помощью серологии.
показывает количество детей, протестированных на M . pneumoniae и число положительных случаев по месяцам. Пик эпидемии пришелся на октябрь 2010 г. и снова в октябре-декабре 2011 г. Число M . pneumoniae положительных случаев были 50 (из 386) в первом эпидемическом сезоне и 84 (из 360) во втором периоде эпидемии, причем частота положительных случаев (0,13 против 0,23) в более позднем периоде была значительно выше. (p = 0,0002, chi 2 -тест).В целом 18% детей, протестированных на M. pneumonia, дали положительный результат.
Количество положительных и отрицательных M . pneumoniae анализов по годам и месяцам.
Наивысшая скорость М . pneumoniae положительных образцов было у детей школьного возраста (65%), но особенно у детей дошкольного возраста (30%), и даже у шести детей в возрасте до двух лет (4%) было M . pneumoniae положительных тестов.
Клиническая картина, рентгенологические данные и лабораторные исследования
Характеристики пациентов с разбивкой по возрастным группам представлены в.
Таблица 1
Симптомы, внелегочные симптомы, объективные признаки, биохимические и рентгенологические данные у детей с Mycoplasma pneumoniae.
| <2 лет | 2–6 лет | 7–15 лет | Всего | <2 лет | 2–6 лет | 7–15 лет | Всего | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Объективные признаки: | ||||||||||||||||
| Кол-во детей | (%) Вт | 0 | 52 | 57 | 52 | |||||||||||
| Мужской (%) | 67 | 60 | 53 | 56 | Температура ° C (медиана) 9037 [I6QR] | 38.5 [37,4: 39,4] | 37,8 [37,3: 38,5] | 37,9 [37,5: 38,8] | 37,9 [37,4: 38,8] | |||||||
| Симптоматические дни до госпитализации (среднее) * | 4 | 12 | 10 | 10 | Аускультация — хрипы (%) | 33 | 24 | 23 | 24 | |||||||
| Дни госпитализации (среднее) ** | 2 | 2 | 2,3 | 2,2 | Аускультация — треск / снижение шума дыхания (%) | 100 | 47 | 57 | 56 | |||||||
| Симптомы: | Лабораторные исследования: Y | |||||||||||||||
| Кашель (%) | 100 | 100 | 99 | [IQR]) | 33 [слишком мало] | 28.5 [17,5: 40,3] | 25 [16,5: 32,5] | 28 [16,3: 39,3] | ||||||||
| Свистящее дыхание (%) | 50 | 17 | 16 | 17 | Количество лейкоцитов (среднее ]) | 17,0 [слишком мало] | 8,1 [5,8: 11,9] | 10,3 [8,3: 12,7] | 9,3 [6,2: 12,2] | |||||||
| Ринорея (%) | 40 | 19 | 15 | Количество нейтрофилов (среднее [IQR]) | 9,6 [слишком мало] | 5.3 [3,9: 9,3] | 6,6 [5,1: 8,3] | 5,8 [4,0: 8,9] | ||||||||
| Боль в горле (%) | 0 | 18 | 26 | 22 | Количество лимфоцитов (медиана IQR]) | 5,2 [слишком мало] | 1,5 [1,1: 1,8] | 2,2 [1,7: 2,9] | 1,7 [1,3: 2,5] | |||||||
| Симптомы крупа (%) | 0 | 0 | 5 | 3 | ||||||||||||
| Внелегочные симптомы: | 0 | |||||||||||||||
| Лихорадка ≥ 38 ° C (%) | 83 | 94 | 90 | 91 | Корневая аденопатия (исключительно) (%) | 33 | 13 | 33 | 33 | 904 01 8 | ||||||
| Кожные проявления (все) X (%) | 33 | 18 | 24 | 23 | Долевая инфильтрация (%) | 33 | 81 | 82 | 81 | 82 | ||||||
| Крапивница (%) | 17 | 0 | 13 | 9 | Ателектаз (%) | 0 | 16 | 19 | 18 | |||||||
| (синдром Стивена | ) | 0 | 2 | 2 | Плевральный выпот (%) | 0 | 9 | 9 | 9 | |||||||
| Тошнота и / или рвота (%) | 33 | 33 | 33 | 33 | 31 | Эмпиема (нет) | 0 | 0 | 1 | 1 |
Дети до двух лет были госпитализированы значительно раньше после появления симптомов s, чем у детей старшего возраста, (p = 0.01, двухвыборочный t-критерий). 61% детей выписаны из стационара в день поступления.
Наиболее частым респираторным проявлением был кашель (100%) вместе с возрастной степенью хрипов (). При поступлении в больницу у 92% младенцев и детей был диагностирован эпизод болезненных симптомов со стороны легких, продолжающийся не менее трех дней. У значительно большего числа детей младшего возраста (младше трех лет) объективное свистящее дыхание и кашель (симптомы астмы), чем у детей старшего возраста (p = 0.01, тест Z-score). Перенесенное и клинически значимое хроническое заболевание диагностировано у 10% детей. Из них 4/13 (31%) имели ранее диагностированную и текущую астму и имели тяжелое обострение во время M . pneumoniae инфекция.
Большинству пациентов (84%) сделали рентген грудной клетки, и 96% из них имели положительные рентгенологические данные (). Среди младенцев и маленьких детей чаще встречалась исключительно внутригрудная лимфаденопатия, в то время как у детей старшего возраста обычно имелась значительная периферическая инфильтрация на рентгенограмме грудной клетки ().Дети с ателектазом находились в больнице значительно дольше; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была такой же для детей с СРБ более 50 мг / л (POCT (Point of Care Testing), часть определения значимой пневмонии у взрослых) ниже 50 мг / л (18% против 19%, p> 0,05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (Табель).В целом 20% детей имели повышенный уровень СРБ более 50 мг / л, и все они были старше трех лет.
В общей сложности лечение антибиотиками прошли 120 детей. Большинство из них получали кларитромицин в соответствии с местными рекомендациями. Шестьдесят четыре пациента, или 46%, лечились по подозрению. Из них 53% получали другие антибиотики (бета-лактам) до M . pneumoniae тестирование. 56 пациентов (42%) начали лечение после получения положительного результата теста.Только шесть детей получали антибиотики из группы макролидов дважды из-за подозрений на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и оказался отрицательным.
Наиболее частым внелегочным проявлением была тошнота с рвотой или без нее, о которой сообщила треть всех детей. У 23% всех детей была сыпь того или иного типа, а у 9% — крапивница. У грудных детей кожные проявления наблюдались в 33% случаев. У двоих детей развился синдром Стивена Джонсона (SJS) с симптомами со стороны слизистой оболочки, возникшими до или одновременно с началом лечения антибиотиками.
В общей сложности 37 детей одновременно были протестированы с посевом мокроты на наличие других бактериальных патогенов. В 41% из них была диагностирована коинфекция. Наиболее распространенными бактериями были Moraxella catarrhalis , Haemophilus influenzae и S . пневмония . В соответствии с методологическими установками, все дети были протестированы на Chlamydophila pneumoniae. ни один из них не оказался положительным.
Только двое детей были протестированы на вирусные инфекции во время клинической подготовки.Апостериорный анализ 49 мазков из ротоглотки показал, что 27% из них имели однократную или смешанную вирусную коинфекцию (RSV (1 ребенок), грипп A (2), метапневмовирус человека (1), риновирус (2), коронавирус). (3), бокавирус (2) и аденовирус (5)). Четверо детей дали положительный результат ПЦР на два вируса, а также на M . пневмония . показывает, в том же отношении, что и клинические характеристики детей с неизвестной вирусной инфекцией, без нее и без нее. Данные свидетельствуют о том, что значительно больше детей со смешанной инфекцией M . pneumoniae и респираторный вирус имели ринорею (p = 0,02) и хрипы (тенденция, p = 0,07) по сравнению с теми, которые были положительными только для M . пневмония . Мы не смогли выявить других различий между двумя группами, включая отсутствие радиологических расхождений.
Таблица 2
Симптомы, внелегочные симптомы, объективные признаки и рентгенологические данные у детей с Mycoplasma pneumoniae с сопутствующей вирусной инфекцией или без нее.
| MP-положительный и вирусный | MP-положительный и вирусный отрицательный | MP-положительный и вирус неизвестен | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <2 лет | 2–15 лет | <2 лет 2 | –15 лет<2 лет | 2–15 лет | ||||||||||||
| Количество детей | 3 | 10 | 0 | 36 | 3 | 82 | ||||||||||
| 33 | 50 | — | 64 | 100 | 51 | |||||||||||
| Симптоматические дни до госпитализации (среднее) | 4 | 16 | — | 9.1 | 2,7 | 9,8 | ||||||||||
| Дни госпитализации (средние) | 1,8 | 2,5 | — | 2,4 | 1,7 | 2,2 | 9037 | |||||||||
| Симптомы : | ||||||||||||||||
| Кашель (%) | 100- | |||||||||||||||
| Свистящее дыхание (%) | 50 | 50 * | — | 19 * | 50 | 10 | ||||||||||
| Ринорея ** (%) | 71 | 900— | 7 ** | 67 | 14 | |||||||||||
| Боль в горле (%) | NA | 22 | — | 27 | 0 | 20 | ||||||||||
| Симптомы крупа (%) | 0 | 0 | — | 0 | 0 | 7 | 9040 9040 | |||||||||
| Внелегочные симптомы : | 90 — 90 — 90 — 90 — 9040 97 | 67 | 93 | |||||||||||||
| Кожные проявления (все) X (%) | 67 | 0 | — | 14 | 0 | 29 | ||||||||||
| 33 | 0 | — | 3 | 0 | 12 | |||||||||||
| Синдром Стивена Джонсона (нет) | 0 | 0 | — | 1 | 0 | 1 | ||||||||||
| Тошнота и / или рвота (%) | 0 | 11 | — | 39 | 67 | |||||||||||
| Объективные знаки : | 9037a1 | — | 53 | 0 | 57 | |||||||||||
| Температура ° C (средняя) | 38.4 | 38,1 | — | 38,2 | 38,2 | 37,9 | ||||||||||
| Аускультация — хрипы (%) | 33 | 20 | — | 75 24 | 9075 9075 потрескивание / снижение шума дыхания (%)100 | 60 | — | 52 | 67 | 44 | ||||||
| : | ||||||||||||||||
| внутригрудная аденопатия (исключительно) (%) | 50 | 13 | 7 | 7 | 7 | 7 | инфильтрация (%)50 | 63 | — | 86 | NA | 85 | ||||
| Ателектаз (%) | 0 | 13 | — | 25 | NA | 19 | ||||||||||
| Плевральный выпот (%) | 0 | 0 | — | 0 | — 7 | |||||||||||
| Empyema (нет) | 0 | 0 | — | 0 | NA | 1 | ||||||||||
| 903 903 903 | ||||||||||||||||
| <2 лет | 2–6 лет | 7–15 лет | Всего | <2 лет | 2–6 лет | 7–15 лет | Всего | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Объективные признаки: | ||||||||||||||||
| Кол-во детей | (%) Вт | 0 | 52 | 57 | 52 | |||||||||||
| Мужской (%) | 67 | 60 | 53 | 56 | Температура ° C (медиана) 9037 [I6QR] | 38.5 [37,4: 39,4] | 37,8 [37,3: 38,5] | 37,9 [37,5: 38,8] | 37,9 [37,4: 38,8] | |||||||
| Симптоматические дни до госпитализации (среднее) * | 4 | 12 | 10 | 10 | Аускультация — хрипы (%) | 33 | 24 | 23 | 24 | |||||||
| Дни госпитализации (среднее) ** | 2 | 2 | 2,3 | 2,2 | Аускультация — треск / снижение шума дыхания (%) | 100 | 47 | 57 | 56 | |||||||
| Симптомы: | Лабораторные исследования: Y | |||||||||||||||
| Кашель (%) | 100 | 100 | 99 | [IQR]) | 33 [слишком мало] | 28.5 [17,5: 40,3] | 25 [16,5: 32,5] | 28 [16,3: 39,3] | ||||||||
| Свистящее дыхание (%) | 50 | 17 | 16 | 17 | Количество лейкоцитов (среднее ]) | 17,0 [слишком мало] | 8,1 [5,8: 11,9] | 10,3 [8,3: 12,7] | 9,3 [6,2: 12,2] | |||||||
| Ринорея (%) | 40 | 19 | 15 | Количество нейтрофилов (среднее [IQR]) | 9,6 [слишком мало] | 5.3 [3,9: 9,3] | 6,6 [5,1: 8,3] | 5,8 [4,0: 8,9] | ||||||||
| Боль в горле (%) | 0 | 18 | 26 | 22 | Количество лимфоцитов (медиана IQR]) | 5,2 [слишком мало] | 1,5 [1,1: 1,8] | 2,2 [1,7: 2,9] | 1,7 [1,3: 2,5] | |||||||
| Симптомы крупа (%) | 0 | 0 | 5 | 3 | ||||||||||||
| Внелегочные симптомы: | 0 | |||||||||||||||
| Лихорадка ≥ 38 ° C (%) | 83 | 94 | 90 | 91 | Корневая аденопатия (исключительно) (%) | 33 | 13 | 33 | 33 | 904 01 8 | ||||||
| Кожные проявления (все) X (%) | 33 | 18 | 24 | 23 | Долевая инфильтрация (%) | 33 | 81 | 82 | 81 | 82 | ||||||
| Крапивница (%) | 17 | 0 | 13 | 9 | Ателектаз (%) | 0 | 16 | 19 | 18 | |||||||
| (синдром Стивена | ) | 0 | 2 | 2 | Плевральный выпот (%) | 0 | 9 | 9 | 9 | |||||||
| Тошнота и / или рвота (%) | 33 | 33 | 33 | 33 | 31 | Эмпиема (нет) | 0 | 0 | 1 | 1 |
Дети до двух лет были госпитализированы значительно раньше после появления симптомов s, чем у детей старшего возраста, (p = 0.01, двухвыборочный t-критерий). 61% детей выписаны из стационара в день поступления.
Наиболее частым респираторным проявлением был кашель (100%) вместе с возрастной степенью хрипов (). При поступлении в больницу у 92% младенцев и детей был диагностирован эпизод болезненных симптомов со стороны легких, продолжающийся не менее трех дней. У значительно большего числа детей младшего возраста (младше трех лет) объективное свистящее дыхание и кашель (симптомы астмы), чем у детей старшего возраста (p = 0.01, тест Z-score). Перенесенное и клинически значимое хроническое заболевание диагностировано у 10% детей. Из них 4/13 (31%) имели ранее диагностированную и текущую астму и имели тяжелое обострение во время M . pneumoniae инфекция.
Большинству пациентов (84%) сделали рентген грудной клетки, и 96% из них имели положительные рентгенологические данные (). Среди младенцев и маленьких детей чаще встречалась исключительно внутригрудная лимфаденопатия, в то время как у детей старшего возраста обычно имелась значительная периферическая инфильтрация на рентгенограмме грудной клетки ().Дети с ателектазом находились в больнице значительно дольше; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была такой же для детей с СРБ более 50 мг / л (POCT (Point of Care Testing), часть определения значимой пневмонии у взрослых) ниже 50 мг / л (18% против 19%, p> 0,05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (Табель).В целом 20% детей имели повышенный уровень СРБ более 50 мг / л, и все они были старше трех лет.
В общей сложности лечение антибиотиками прошли 120 детей. Большинство из них получали кларитромицин в соответствии с местными рекомендациями. Шестьдесят четыре пациента, или 46%, лечились по подозрению. Из них 53% получали другие антибиотики (бета-лактам) до M . pneumoniae тестирование. 56 пациентов (42%) начали лечение после получения положительного результата теста.Только шесть детей получали антибиотики из группы макролидов дважды из-за подозрений на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и оказался отрицательным.
Наиболее частым внелегочным проявлением была тошнота с рвотой или без нее, о которой сообщила треть всех детей. У 23% всех детей была сыпь того или иного типа, а у 9% — крапивница. У грудных детей кожные проявления наблюдались в 33% случаев. У двоих детей развился синдром Стивена Джонсона (SJS) с симптомами со стороны слизистой оболочки, возникшими до или одновременно с началом лечения антибиотиками.
В общей сложности 37 детей одновременно были протестированы с посевом мокроты на наличие других бактериальных патогенов. В 41% из них была диагностирована коинфекция. Наиболее распространенными бактериями были Moraxella catarrhalis , Haemophilus influenzae и S . пневмония . В соответствии с методологическими установками, все дети были протестированы на Chlamydophila pneumoniae. ни один из них не оказался положительным.
Только двое детей были протестированы на вирусные инфекции во время клинической подготовки.Апостериорный анализ 49 мазков из ротоглотки показал, что 27% из них имели однократную или смешанную вирусную коинфекцию (RSV (1 ребенок), грипп A (2), метапневмовирус человека (1), риновирус (2), коронавирус). (3), бокавирус (2) и аденовирус (5)). Четверо детей дали положительный результат ПЦР на два вируса, а также на M . пневмония . показывает, в том же отношении, что и клинические характеристики детей с неизвестной вирусной инфекцией, без нее и без нее. Данные свидетельствуют о том, что значительно больше детей со смешанной инфекцией M . pneumoniae и респираторный вирус имели ринорею (p = 0,02) и хрипы (тенденция, p = 0,07) по сравнению с теми, которые были положительными только для M . пневмония . Мы не смогли выявить других различий между двумя группами, включая отсутствие радиологических расхождений.
Таблица 2
Симптомы, внелегочные симптомы, объективные признаки и рентгенологические данные у детей с Mycoplasma pneumoniae с сопутствующей вирусной инфекцией или без нее.
| MP-положительный и вирусный | MP-положительный и вирусный отрицательный | MP-положительный и вирус неизвестен | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <2 лет | 2–15 лет | <2 лет 2 | –15 лет<2 лет | 2–15 лет | |||||||||
| Количество детей | 3 | 10 | 0 | 36 | 3 | 82 | |||||||
| 33 | 50 | — | 64 | 100 | 51 | ||||||||
| Симптоматические дни до госпитализации (среднее) | 4 | 16 | — | 9.1 | 2,7 | 9,8 | |||||||
| Дни госпитализации (средние) | 1,8 | 2,5 | — | 2,4 | 1,7 | 2,2 | 9037 | ||||||
| Симптомы : | |||||||||||||
| Кашель (%) | 100- | ||||||||||||
| Свистящее дыхание (%) | 50 | 50 * | — | 19 * | 50 | 10 | |||||||
| Ринорея ** (%) | 71 | 900— | 7 ** | 67 | 14 | ||||||||
| Боль в горле (%) | NA | 22 | — | 27 | 0 | 20 | |||||||
| Симптомы крупа (%) | 0 | 0 | — | 0 | 0 | 7 | 9040 9040 | ||||||
| Внелегочные симптомы : | 90 — 90 — 90 — 90 — 9040 97 | 67 | 93 | ||||||||||
| Кожные проявления (все) X (%) | 67 | 0 | — | 14 | 0 | 29 | |||||||
| 33 | 0 | — | 3 | 0 | 12 | ||||||||
| Синдром Стивена Джонсона (нет) | 0 | 0 | — | 1 | 0 | 1 | |||||||
| Тошнота и / или рвота (%) | 0 | 11 | — | 39 | 67 | ||||||||
| Объективные знаки : | 9037a1 | — | 53 | 0 | 57 | ||||||||
| Температура ° C (средняя) | 38.4 | 38,1 | — | 38,2 | 38,2 | 37,9 | |||||||
| Аускультация — хрипы (%) | 33 | 20 | — | 75 24 | 9075 9075 потрескивание / снижение шума дыхания (%)100 | 60 | — | 52 | 67 | 44 | |||
| : | |||||||||||||
| внутригрудная аденопатия (исключительно) (%) | 50 | 13 | 7 | 7 | 7 | 7 | инфильтрация (%)50 | 63 | — | 86 | NA | 85 | |
| Ателектаз (%) | 0 | 13 | — | 25 | NA | 19 | |||||||
| Плевральный выпот (%) | 0 | 0 | — | 0 | — 7 | ||||||||
| Empyema (нет) | 0 | 0 | — | 0 | NA | 1 | |||||||
| 903 903 903 | |||||||||||||
