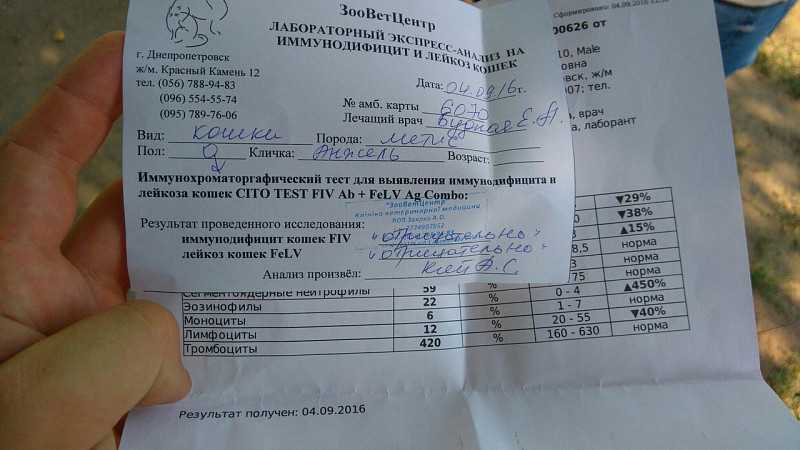
Бактериальная инфекция по анализу крови
27.11.2019
Общий анализ крови (ОАК) — это лабораторный метод, позволяющий объективно оценить качественный и количественный состав клеток крови для диагностики различных заболеваний. Подсчет количества лейкоцитов (WBC), процентное соотношение лейкоцитов (лейкоцитарная формула) и СОЭ (скорость оседания эритроцитов) — основные параметры, отражающие активность вирусных и бактериальных инфекций.
Лейкоциты WBC – «белые рыцари» иммунной системы. Лейкопоэз (образование лейкоцитов) происходит в красном костном мозге. В зависимости от морфологических особенностей (размер клетки, форма ядра, наличие специфических гранул) и функции, которую они выполняют, лейкоциты разделяют на две группы: гранулоциты (нейтрофильные, базофильные и эозинофильные лейкоциты), агранулоциты (моноциты, лимфоциты).
· Нейтрофилы (NE) В сосудистом русле в норме циркулируют два типа NE: палочкоядерные (молодые) и сегментоядерные (зрелые).
· Эозинофилы (EO)- ведущие форменные элементы в борьбе с паразитами (простейшие, гельминты), принимают участие в аллергических реакциях.
· Базофилы (BA)- принимают участие в аллергических реакциях, а также в регуляции кровообращения посредством секреции гормоноподобных веществ: гистамин, серотонин и гепарин.
· Лимфоциты (LYM)- играют центральную роль во всех иммунологических реакциях организма. Благодаря рецепторам на поверхности клеток, они способны различать «свое» и «чужое». Основная функция LYM- синтез защитных антител и обеспечение иммунной памяти.
· Моноциты (MON)- агранулоцитарные клетки, которые находятся в крови несколько суток, затем покидают кровоток перемещаясь в ткани, где выполняют свою функцию как макрофаги, фагоцитируя частицы более крупных размеров, чем нейтрофилы, а иногда и целые микробные агенты.
· Плазматические клетки (Плазмоциты)- клетки лимфоидной ткани, развивающиеся из клеток – предшественниц В-лимфоцитов, ответственные за выработку антител, в ответ на стимуляцию чужеродными антигенами. В норме в крови плазмоциты не циркулируют.
· СОЭ- определяется интенсивностью и скоростью склеивания эритроцитов в кровеносном русле. Этот параметр косвенно указывает на наличие патологического процесса, например, воспаления, в организме.
Для расшифровки анализа все перечисленные показатели важно оценивать в комплексе, а не по-одному. К тому же, для правильной интерпретации изменений в ОАК необходимо учитывать возрастные особенности лейкоцитарной формулы.
Рис.1
При рождении ребенка количество нейтрофилов(NE) преобладает над содержанием лимфоцитов (LYM). На 4-5 дни величина NE и LYM находится приблизительно на одном уровне (Первый перекрест). Далее, начиная со 2-го месяца жизни ребенка, число NE снова уменьшается, а LYM — возрастает, следом показатель NE нарастает, а LYM снижается. Затем, в 4 года количество клеток примерно одинаково (Второй перекрест). Наконец, к четырнадцатилетнему возрасту, процентное соотношении лейкоцитов (WBC) соответствует показателям взрослого человека.
Затем, в 4 года количество клеток примерно одинаково (Второй перекрест). Наконец, к четырнадцатилетнему возрасту, процентное соотношении лейкоцитов (WBC) соответствует показателям взрослого человека.
В таблице представлены показатели процентного соотношения WBC.
|
WBC, 109 /л |
EO, % |
BA, % |
NE, % |
LYM, |
MON, % |
||
|
юные |
Палочко-ядерные |
Сегменто-ядерные |
|||||
|
4. |
1-4 |
0-0.5 |
0-1 |
2-5 |
55-68 |
25-30 |
6-8 |
Признаки бактериальной инфекции по анализу крови.
Человеческий организм постоянно сталкивается с внешними угрозами в виде патогенных микроорганизмов. При подготовке к возможному повреждению в крови быстро образуется мобильный пул циркулирующих нейтрофилов, в результате ускоренного выхода гранулоцитов из красного костного мозга, прекращения выхода нейтрофилов в ткани и мобилизацией пристеночного пула элементов.
При острых бактериальных инфекциях количество этих элементов в крови резко увеличивается, могут появляться менее зрелые клетки. (Сдвиг влево). Интенсивное разрушение зрелых нейтрофилов в тканях приводит к активной продукции костным мозгом более юных клеток. В крови увеличивается количество как самих лейкоцитов, так и отдельной фракции – нейтрофилов.
Чем выше количество этих клеток, тем более активен воспалительный процесс в организме. Нередко эти изменения помогают выявить признаки бактериальной инфекции по анализу крови у взрослых. При воспалительном процессе бактериальной этиологии, характерно повышение в плазме крови некоторых воспалительных белков (фибриногена, церулоплазмина, иммуноглобулинов). Некоторые из этих белков присоединяются к эритроцитам, следовательно, СОЭ увеличивается в разы.
Анализ крови при вирусной инфекции.
Вирусу для репликации необходима полноценная клетка организма, которую он использует как полигон для производства собственного генома, поэтому вирус находит и поражает определенные клетки, содержащие на своей поверхности специфические рецепторы.
В связи с этим, при острых вирусных заболеваниях в ОАК увеличиваться количество лимфоцитов и/или моноцитов. Общее количество лейкоцитов обычно снижено или в пределах возрастной нормы.
Однако при патологическом процессе вирусной этиологии анализ крови может соответствовать и нормальным показателям здорового человека, а при течении бактериального процесса количество лейкоцитов и абсолютное число нейтрофилов не всегда являются надежным маркером. Именно поэтому для назначения эффективного и адекватного лечения каждый случай должен оцениваться врачом индивидуально.
Кроме того, в настоящее время можно защитить себя и своих родных от многих вирусных и бактериальных инфекций с помощью эффективной и безопасной вакцинации.
Автор: врач-ординатор Университетской клиники H-Clinic Пушик Елена Павловна
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Коннов Данила Сергеевич
Возврат к списку
Как по анализу крови определить тип инфекции: объясняют специалисты
Анализы крови специалисты используют как надёжный способ определения типа инфекции при ОРВИ. Интерпретацией результатов, постановкой диагноза, назначением лечения должен заниматься врач, но для себя весьма полезно понимать, болеете ли вы в данный момент. С просьбой провести ликбез по «расшифровке» анализа крови «Абзац» обратился к специалистам.
ОАК (общий анализ крови) чуть ли не самым первым назначается в случае практически любого заболевания (при ОРВИ обычно это происходит примерно на третий-четвёртый день после появления симптомов – слабости, повышения температуры тела). С помощью ОАК можно получить информацию о количестве и качестве клеток крови – числе эритроцитов, лейкоцитов, тромбоцитов, их размерах и характеристиках, уровне гемоглобина, СОЭ, лейкоцитарной формуле и прочем. Об этом «Абзацу» рассказала к.м.н., врач клинической лабораторной диагностики, медицинский директор лаборатории «СИТИЛАБ» Ирина Терещенко:
Об этом «Абзацу» рассказала к.м.н., врач клинической лабораторной диагностики, медицинский директор лаборатории «СИТИЛАБ» Ирина Терещенко:
«Отклонения конкретных показателей врач способен соотнести с заболеваниями. По результатам ОАК специалист подберёт спектр исследований для развёрнутой диагностики, уже зная, в каких органах или системах может скрываться проблема».
По мнению собеседницы «Абзаца», лучше отдать предпочтение максимально развёрнутому исследованию – с лейкоцитарной формулой и подсчётом СОЭ (скорости оседания эритроцитов), поскольку это одни из самых важных показателей при ОРВИ.
Врач-терапевт многопрофильного медицинского центра «Центравиамед» Евгения Кисиль согласилась с коллегой – при получении результата анализа она рекомендует первым делом обращать внимание на СОЭ:
«Её уровень отражает степень воспалительной реакции: чем выше СОЭ, тем сильнее воспаление».
Однако, как пояснили врачи, СОЭ – достаточно чувствительный, но неспецифичный метод исследования. Скорость оседания эритроцитов повышается (ускоряется) при множестве патологий (например, при острых и хронических инфекциях, воспалительных заболеваниях любой этиологии, аллергии, физических травмах, аутоиммунных процессах, интоксикации, онкологических процессах), поэтому показатель интерпретируется в комплексе с другими результатами лабораторных исследований.
Скорость оседания эритроцитов повышается (ускоряется) при множестве патологий (например, при острых и хронических инфекциях, воспалительных заболеваниях любой этиологии, аллергии, физических травмах, аутоиммунных процессах, интоксикации, онкологических процессах), поэтому показатель интерпретируется в комплексе с другими результатами лабораторных исследований.
Лейкоцитарная формула показывает процентное соотношение различных видов лейкоцитов в сыворотке крови (нейтрофилов, лимфоцитов, моноцитов, эозинофилов, базофилов). Эти показатели важны, если стоит цель определить источник воспалительного процесса, пояснила Терещенко:
- нейтрофилы повышаются при инфекциях, воспалении, остром стрессе
- количество эозинофилов растёт на фоне аллергических реакций, при паразитарных заболеваниях, а также при онкологии
- базофилы увеличиваются при хронических аллергических реакциях, лимфогранулематозе, неспецифическом язвенном колите
- повышенный уровень лимфоцитов может указывать на вирусные инфекции, заболевания иммунной системы, патологии надпочечников
- уровень моноцитов растёт при бактериальных инфекциях, злокачественных заболеваниях
Фото: ТАСС/ Петр Ковалев«Изменение каждого показателя указывает на несколько возможных проблем.
Чтобы выбрать правильный алгоритм дальнейшей диагностики, поставить окончательный диагноз и назначить лечение, необходим опытный специалист», – подчеркнула врач клинической лабораторной диагностики.
Многие пациенты надеются, что общий анализ крови при симптомах ОРВИ раскроет им природу заболевания. Но не всё так просто, как кажется на первый взгляд, поскольку существуют общие тенденции, обратили внимание собеседницы «Абзаца».
Например, при вирусной инфекции немного снижаются или остаются в норме лейкоциты, а при оценке сдвига лейкоцитарной формулы наблюдается повышение лимфоцитов и моноцитов при одновременном снижении нейтрофилов. При бактериальной инфекции обычно происходит наоборот – растёт число лейкоцитов, а вместе с тем увеличивается количество нейтрофилов.
«Абсолютное большинство респираторных инфекций имеют вирусную природу. И в ОАК мы будем наблюдать вышеописанные изменения в той или иной степени. А это значит, что применение антибактериальных препаратов на данной стадии с первых дней болезни неоправданно», – подчеркнула Кисиль.
Заподозрить присоединение бактериальной инфекции можно, если заболевание приобретает затяжной характер – в течение пяти дней держится температура 38,5°C (или же она то снижается до нормы, то через один-два дня поднимается снова), из носа появляются выделения жёлтого или жёлто-зелёного цвета.
В этом случае, по мнению терапевта, врач доказательной медицины может задуматься о назначении антибактериальных препаратов. Для начала он повторно назначит сдать ОАК, чтобы подтвердить бактериальную инфекцию.
«Самое характерное изменение ОАК при бактериальной инфекции – повышение нейтрофилов (как в абсолютном количестве, так и в процентном соотношении), рост СОЭ (это будет свидетельствовать об усилении заболевания в целом)», – рассказала Кисиль.
Только если видны клинические проявления бактериальной инфекции и имеется подтверждение по крови, врач примет решение о назначении антибактериальных препаратов (для этого будет выписан аптечный рецепт).
В таком случае врачу нужно будет изучить биохимические маркеры воспаления. Самым информативным тут считается анализ на СРБ (С-реактивный белок). Как и в случае с СОЭ, по СРБ не получится определить место воспалительного очага и его первопричину (они неспецифически отражают уровень воспаления), однако он показывает, насколько сильно воспаление в организме.
«Если уровень СРБ критично высок, это может послужить поводом для госпитализации пациента», – предупредила терапевт.
По ОАК невозможно сказать, является ли человек заразным, однозначно заявили собеседницы «Абзаца». Так как вирусные инфекции передаются в основном респираторным или воздушно-капельным путём, большую роль в определении контагиозности человека имеет наличие у него выделений (насморк, кашель, чихание).
Не стоит забывать, что максимальная контагиозность наблюдается в первые дни заболевания, поэтому при первых симптомах ОРВИ важно максимально сократить социальную активность – это поможет снизить риски дальнейшего распространения инфекции и позволит человеку не переносить болезнь на ногах.
Ранее глава Роспотребнадзора призвала тестировать на грипп всех людей с признаками ОРВИ. О том, что об этом думают эксперты, читайте на «Абзаце».
Редакция «Абзаца» предупреждает: мнения и рекомендации специалистов не приравниваются к медицинским назначениям. Имеются противопоказания. Всегда в индивидуальном порядке консультируйтесь со своим лечащим врачом.
Противовирусная активность Quercus persica L.: высокая эффективность и низкая токсичность
Adv Biomed Res. 2013; 2: 36.
Опубликовано онлайн 2013 март. Примечания к статье Информация об авторских правах и лицензиях Отказ от ответственности
Справочная информация:
Лекарственно-устойчивый штамм вируса простого герпеса типа 1 (HSV-I) повысил интерес к использованию натуральных веществ.
Цели:
Это исследование было направлено на определение минимальной ингибирующей концентрации водно-спиртового экстракта традиционно используемого травяного растения, Quercus persica L. , на репликацию HSV-1 на клетках почек детенышей хомячка (BHK).
, на репликацию HSV-1 на клетках почек детенышей хомячка (BHK).
Настройка:
Исследование проводилось в Шахрекордском университете медицинских наук, Иран.
Дизайн:
Это было экспериментальное исследование.
Материалы и методы:
Клетки ВНК выращивали в монослойной культуре с модифицированной Дульбекко средой Игла (DMEM) с добавлением 5% эмбриональной телячьей сыворотки и высевали на 48-луночные культуральные планшеты. Пятидесятипроцентная цитотоксическая концентрация (CC50%) Q. persica L. на клетках ВНК. Затем оценивали 50% ингибирующую концентрацию (IC50%) экстракта при репликации HSV-1 как в межклеточном, так и внеклеточном случаях.
Статистический анализ:
Статистическая пробит-модель использовалась для статистического анализа. Дозозависимый эффект противовирусной активности экстрактов определяли методом линейной регрессии.
Результаты:
Q. persica L. не оказывал цитотоксического действия на эту клеточную линию. Между концентрацией экстракта и гибелью клеток была выявлена значительная связь ( P <0,01). IC50 Q. persica L. на ВПГ-1 до и после прикрепления к клеткам BHK составляли 1,02 и 0,257 мкг/мл соответственно. Между концентрацией этого экстракта и ингибированием цитопатического эффекта (CPE) была выявлена значительная взаимосвязь ( P <0,05). Антиоксидантная емкость экстракта составила 67,5%.
Между концентрацией экстракта и гибелью клеток была выявлена значительная связь ( P <0,01). IC50 Q. persica L. на ВПГ-1 до и после прикрепления к клеткам BHK составляли 1,02 и 0,257 мкг/мл соответственно. Между концентрацией этого экстракта и ингибированием цитопатического эффекта (CPE) была выявлена значительная взаимосвязь ( P <0,05). Антиоксидантная емкость экстракта составила 67,5%.
Выводы:
Водно-спиртовой экстракт Q. persica L. потенциально является подходящим и многообещающим противогерпетическим растительным лекарственным средством.
Ключевые слова: Желудь, противовирусный, цитопатический эффект, фитотерапия, ингибирующая концентрация, способ действия
Инфекции, вызванные вирусом простого герпеса типа 1 (ВПГ-1), очень распространены, и этот вирус является важным патогеном для человека. ВПГ-1 первоначально реплицируется в мукоэпителиальных клетках, вызывает заболевание в месте инфекции, а затем устанавливает латентную инфекцию иннервирующих нейронов.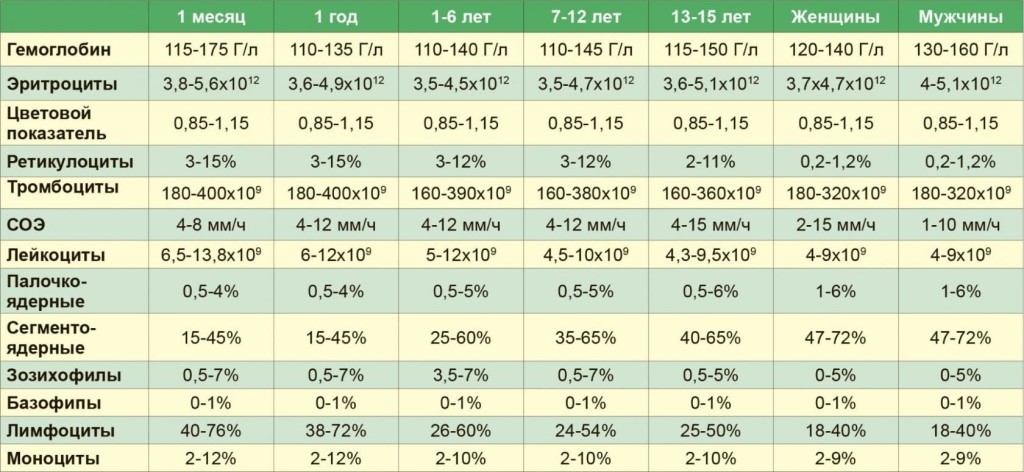 Наиболее распространенные вирусные инфекции включают гингивостоматит и фарингит.[1] После установления латентного периода ВПГ-1 вызывает рецидивирующие инфекции, чаще всего лабиальный герпес. Герпетический кератит приводит к необратимому рубцеванию, повреждению роговицы и слепоте. ВПГ-1 также вызывает энцефалит, приводящий к разрушению височной доли, судорогам и очаговым неврологическим нарушениям.[2]
Наиболее распространенные вирусные инфекции включают гингивостоматит и фарингит.[1] После установления латентного периода ВПГ-1 вызывает рецидивирующие инфекции, чаще всего лабиальный герпес. Герпетический кератит приводит к необратимому рубцеванию, повреждению роговицы и слепоте. ВПГ-1 также вызывает энцефалит, приводящий к разрушению височной доли, судорогам и очаговым неврологическим нарушениям.[2]
С 1970-х годов ацикловир был доступным эффективным лекарством и до сих пор остается наиболее часто используемым препаратом для лечения ВПГ-1.[3] Этот агент используется для сокращения курса и уменьшения тяжести этих клинических симптомов и может подавлять сам вирус. Другие противогерпетические средства, лицензированные в настоящее время для лечения инфекций, вызванных вирусом герпеса, включают ацикловир и его производные, фоскарнет и цидофовир, все из которых ингибируют ДНК-полимеразы вируса герпеса. Некоторые из этих противовирусных средств могут вызывать токсические побочные эффекты. Кроме того, большое значение имеет появление штаммов вируса, устойчивых к обычно используемым препаратам против вируса герпеса, особенно у пациентов с ослабленным иммунитетом.[5] Таким образом, срочно необходимы новые противовирусные препараты с различными механизмами действия.[6] Лекарственные растения использовались в течение многих лет для лечения болезней человека, и ряд растительных лекарственных средств превратился в терапевтические средства. В Иране произрастает большое количество различных лекарственных растений, таких как Quercus persica с антимикробной активностью.[7]
Кроме того, большое значение имеет появление штаммов вируса, устойчивых к обычно используемым препаратам против вируса герпеса, особенно у пациентов с ослабленным иммунитетом.[5] Таким образом, срочно необходимы новые противовирусные препараты с различными механизмами действия.[6] Лекарственные растения использовались в течение многих лет для лечения болезней человека, и ряд растительных лекарственных средств превратился в терапевтические средства. В Иране произрастает большое количество различных лекарственных растений, таких как Quercus persica с антимикробной активностью.[7]
Q. persica — дерево рода Quercus «дуб», из которого существует около 600 видов. Род произрастает в северном полушарии и включает листопадные и вечнозеленые виды, произрастающие от холодных широт до тропической Азии и Америки.
Большая область лесов на северо-западе Ирана покрыта различными видами дуба, в основном с преобладанием Q. persica .[8] В этом регионе листья дуба являются важным источником корма для коз в периоды год, когда качество и количество пастбищных трав ограничено. Сообщается, что виды Quercus содержат высокие уровни дубильных веществ как в гидролизуемых [9] и конденсированные[10] формы.
Сообщается, что виды Quercus содержат высокие уровни дубильных веществ как в гидролизуемых [9] и конденсированные[10] формы.
Дуб является важным источником древесины и волокна. Плод дуба представляет собой орех, называемый желудем, в чашеобразной структуре, известной как купула. Каждый желудь обычно содержит одно семя, реже два или три. Плоды дуба содержат крахмал, белок, масло и дубильные вещества. Этот фрукт полезен при лечении анемии, диареи и т. д., а также при кормлении скота.
Желудь использовался в Европе, Азии, Северной Африке, на Ближнем Востоке и в Северной Америке в течение последних 6000 лет.[11] Желуди являются важным источником крахмала, масла и белка для североамериканских индейцев, особенно на востоке и западе, где наклонная топография ограничивала производство зерновых культур. В настоящее время желуди по-прежнему потребляют, особенно в Корее, Китае и Японии. Желуди от природы богаты дубильными веществами,[14] амилозой, амилопектином и веществами с высокой молекулярной массой и вязкостью. [15] Более поздние исследования нескольких Quercus зр. обнаружили желуди, содержащие 48–85% углеводов (сухой вес большинства сортов превышает 72%), [16,17] и содержание крахмала 59% (сухой вес) [18], при этом крахмал имеет цвет от бежевого до желто-коричневого. 17] Также сообщалось об активности амилазы на желудевом крахмале.[19]
[15] Более поздние исследования нескольких Quercus зр. обнаружили желуди, содержащие 48–85% углеводов (сухой вес большинства сортов превышает 72%), [16,17] и содержание крахмала 59% (сухой вес) [18], при этом крахмал имеет цвет от бежевого до желто-коричневого. 17] Также сообщалось об активности амилазы на желудевом крахмале.[19]
Было показано, что Q. persica обладает антибактериальной активностью, а также противовирусным эффектом. Однако нет научных данных, подтверждающих эффективность этого растения при вирусных инфекциях. Таким образом, это исследование было направлено на оценку in vitro противовирусная активность Quercqus persica L. против HSV-1 с использованием клеток BHK.
Реактив Фолина-Дениса
Этот реактив готовили свежим путем добавления 10 г вольфрамата натрия и 2 г фосфорно-молибденовой кислоты в 75 мл дистиллированной воды в подходящей колбе с последующим добавлением 5 мл фосфорной кислоты. Смесь кипятили с обратным холодильником в течение 2 часов и доводили водой до 1 литра. Реагент был защищен от воздействия света.
Реагент был защищен от воздействия света.
Раствор карбоната натрия
350 г карбоната натрия растворяют в 1 л воды при 70-80°С и фильтруют через стекловату, оставляя на ночь.
Стандартный раствор дубильной кислоты
100 мг дубильной кислоты растворяют в 100 мл дистиллированной воды.
Рабочий стандартный раствор
5 мл исходного раствора разбавляли до 100 мл дистиллированной водой. 1 мл содержит 50 мкг дубильной кислоты.
Препарат экстракта
Q. persica L. плоды провинции Чахармахал и Бахтиари были приобретены в продуктовом магазине города Шахрекорд. Плоды были охарактеризованы ботаником (Мортаза Рафиян), а образец хранился в отделе гербария в Исследовательском центре лекарственных растений Шахрекордского университета медицинских наук, Иран, номер гербария: 325).
Затем плоды промывали, сушили и измельчали в порошок. К порошкообразным плодам Q. persica L. добавляли 500 мл 70% этанола и инкубировали в течение 48 ч при комнатной температуре.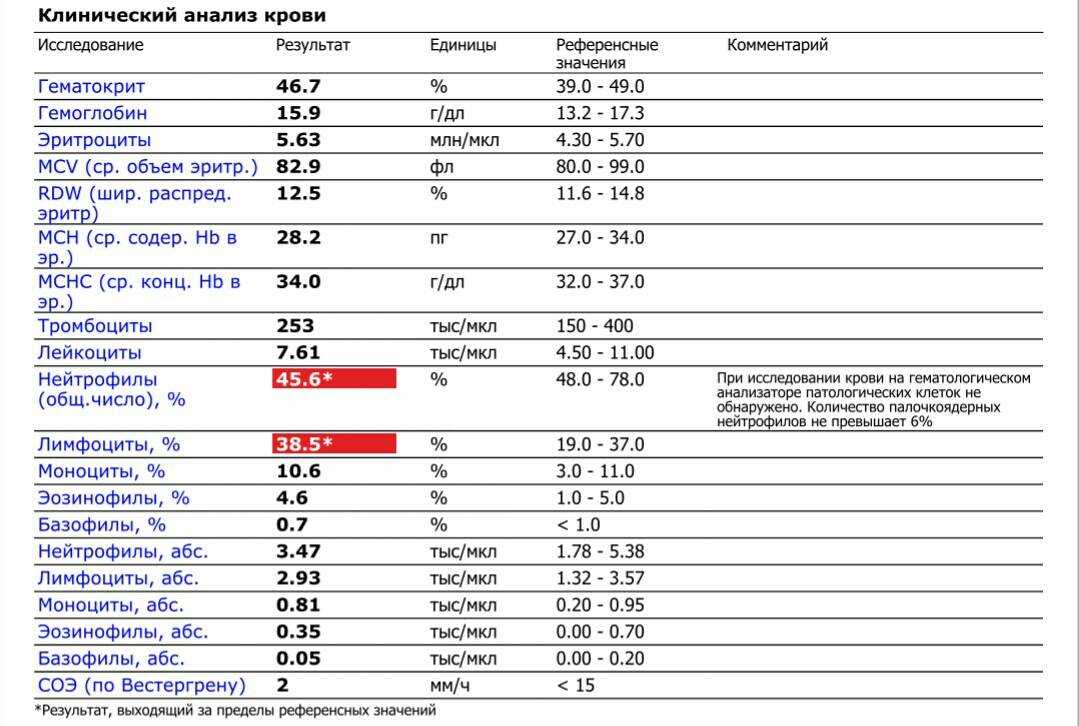 Затем смесь фильтровали и растворитель (этанол) отделяли от раствора перегонкой при 40°С. Пять миллилитров раствора инкубировали в течение 48 ч при 40°С до высыхания кости. Извлекаемость составила 38%.
Затем смесь фильтровали и растворитель (этанол) отделяли от раствора перегонкой при 40°С. Пять миллилитров раствора инкубировали в течение 48 ч при 40°С до высыхания кости. Извлекаемость составила 38%.
Высушенный экстракт растворяли в концентрации 20 мг/мл в воде, содержащей 10% диметилсульфоксида. Этот маточный препарат фильтровали через фильтр 0,45 и хранили при –20°С до использования.
Экстракт стандартизировали путем измерения антиоксидантной активности, общего содержания флавоноидов, дубильных веществ и общего количества фенольных соединений в экстракте Q. persica L..
Антиоксидантная активность
Q. persica L. Антиоксидантная активность экстракта определялась с использованием метода тиоцианата железа, как описано ранее.[20] Вкратце, 500 мкг экстракта растворяли в этаноле и добавляли к реакционной смеси, содержащей 2,88 мл 2,5% линолевой кислоты и 9мл 40 мМ фосфатного буфера. Смесь инкубировали при 40°С в течение 96 ч и каждые 12 ч по 0,1 мл разбавляли 9,7 мл 75%-ного этанола, 0,1 мл тиоцианата аммония и 0,1 мл FeCl 2 .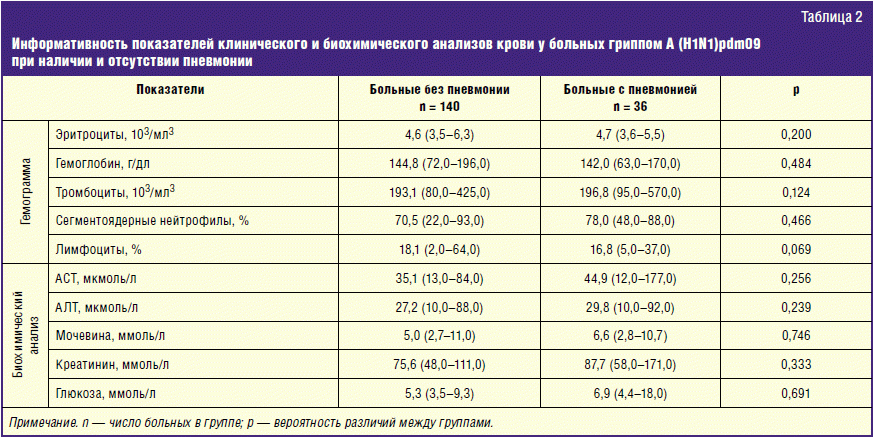 Поглощение образцов измеряли при 500 нм и определяли процент ингибирования (способность ингибировать образование пероксида в линолевой кислоте) с использованием следующего уравнения (высокий процент ингибирования указывает на высокую антиоксидантную активность). В качестве отрицательного контроля использовали этанол с образцом и без реагентов.
Поглощение образцов измеряли при 500 нм и определяли процент ингибирования (способность ингибировать образование пероксида в линолевой кислоте) с использованием следующего уравнения (высокий процент ингибирования указывает на высокую антиоксидантную активность). В качестве отрицательного контроля использовали этанол с образцом и без реагентов.
Процент ингибирования = [1– (абсорбция образца)/(абсорбция контроля] × 100.
Определение общих флавоноидных соединений
Q. persica L. экстракт Общее количество флавоноидных соединений в экстракте определяли с использованием колориметрического метода, как описано Чангом и его коллегами. ацетата калия и 2.8 мл дистиллированной воды и оставляли при комнатной температуре на 30 мин.Оптическую плотность реакционной смеси измеряли при 415 нм, приготовленной с использованием растворов рутина с концентрацией от 25 до 500 ppm в метаноле.Опыт повторяли 3 раза. Общее количество флавоноидов выражали в эквиваленте рутина (мг/г), который является общепринятым эталонным соединением.
Определение таниновых соединений в экстракте
Q. persica L.Таниновые соединения в экстракте определяли колориметрически с реактивом Фолина-Дениса, используя метод, описанный в [22]. Вкратце, использовали следующую процедуру:
5 г порошкообразного материала и 75 мл воды переносили в коническую колбу на 250 мл и кипятили в течение 30 мин. Затем центрифугировали при 2000 об/мин в течение 20 мин. Супернатант собирали в мерную колбу вместимостью 100 мл и доводили объем.
0,1 мл экстракта образца переносили в мерную колбу на 10 мл, содержащую 7,5 мл воды.
Добавляли 5 мл реактива Фолина-Дени и 1 мл раствора карбоната натрия и разбавляли до 10 мл водой. Поглощение считывали при 700 нм через 30 мин.
Если абсорбция превышала 0,7, образец разбавляли 1 + 4.
Бланк готовили с водой вместо образца.
Стандартный график был построен с использованием 0-100 мг дубильной кислоты.
Содержание танина в образцах рассчитывали как эквиваленты дубильной кислоты по стандартной диаграмме.
Определение общего содержания фенольных соединений в экстракте
Q. persica L. Общее количество фенольных соединений в экстракте определяли колориметрически с помощью реактива Фолина-Чокальтеу с использованием метода, описанного Кимом и его сотрудниками.[23] Вкратце, 5 мл экстракта или галловой кислоты (стандартное фенольное соединение) смешивали с реактивом Folin Ciocalteu (1:10, разбавленный дистиллированной водой) и водным раствором Na 9.0138 2 CO 3 (4 мл, 1 М). Смеси выдерживали в течение 15 мин и определяли общее количество фенолов колориметрически при 765 нм. Стандартную кривую строили с использованием растворов 0, 50, 100, 150, 200, 250 мг/л галловой кислоты в метаноле: вода (50:50, об./об.). Общие значения фенола выражали в эквиваленте галловой кислоты (мг/г), который является обычным эталонным соединением. Эксперимент повторяли трижды.
Эксперимент повторяли трижды.
Культура клеток и вирусы
Клетки почек детенышей хомячка (BHK) использовались в этом исследовании. Клетки выращивали в среде DMEM с добавлением глутамина, антибиотиков и 10% эмбриональной бычьей сыворотки (FBS). Поддерживающая среда содержала 1% FBS (MEM). Лабораторный штамм HSV-1 F из Американской коллекции типов культур (ATCC) использовали в этом анализе для определения связывания и ингибирования после связывания HSV-1 с клетками. Вирус хранили при температуре -70°C до использования.
Анализ цитотоксичности
Цитотоксичность определяли по ингибированию роста BHK, как описано ранее.[6] Вкратце, клетки ВНК высевали с плотностью 5×10 4 клеток/лунку в 48-луночные планшеты и инкубировали при 37°С в течение 2 дней. Культуральную среду заменяли на свежую среду, содержащую тестируемые соединения в различных концентрациях, и клетки дополнительно инкубировали в течение 2 дней. Клетки обрабатывали трипсином и количество жизнеспособных клеток определяли по исключению трипанового синего.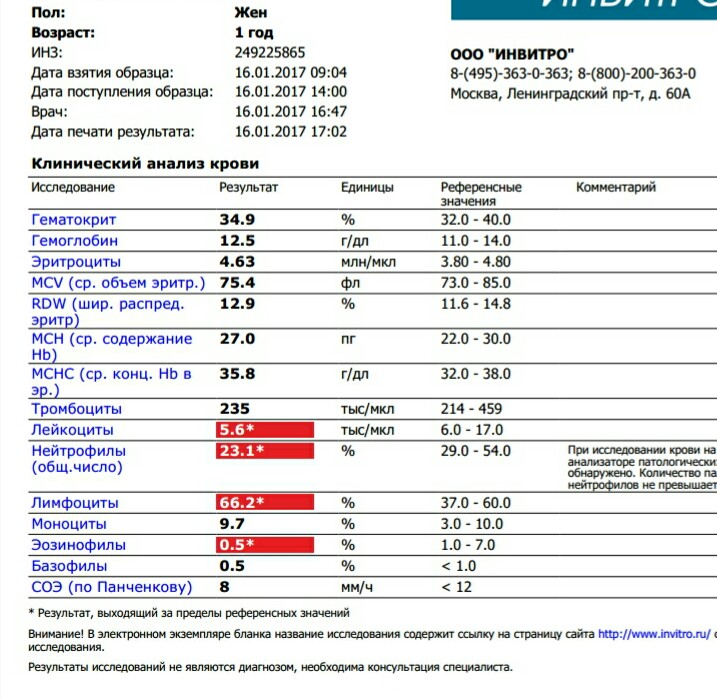 Концентрацию соединения, которая снижала жизнеспособность клеток на 50%, определяли по стандартной кривой отношения процентной жизнеспособности клеток к концентрации соединения с использованием программного обеспечения SPSS15 и статистического метода Probit.
Концентрацию соединения, которая снижала жизнеспособность клеток на 50%, определяли по стандартной кривой отношения процентной жизнеспособности клеток к концентрации соединения с использованием программного обеспечения SPSS15 и статистического метода Probit.
Ингибирование связывания HSV-1 с клетками BHK растительными экстрактами
В этом эксперименте использовали модифицированную процедуру для оценки ингибирования связывания HSV-1 с клетками BHK экстрактами трав, как описано ранее. Вкратце, анализ связывания проводили при 4°C, чтобы позволить вирусу связываться с клеточными рецепторами, но не проникать в клетку. Таким образом, все планшеты охлаждали на льду и инкубировали при 4°С в течение 30 мин. Серийные двукратные разведения растительного экстракта смешивали с охлажденным штаммом F ВПГ-1 и добавляли к клеткам ВНК в титрационных микропланшетах. Зараженные и неинфицированные лунки использовали в качестве положительного и отрицательного контроля соответственно. Планшеты инкубировали при 4°С в течение 2 ч, чтобы позволить вирусу связываться с клетками. Все лунки промывали четыре раза холодным фосфатно-солевым буфером (PBS) для удаления экстрактов и несвязавшегося вируса. В каждую лунку добавляли модифицированную среду Игла (MEM) с добавлением 3% фекальной телячьей сыворотки и планшеты инкубировали при 37°C в течение 48 ч до появления цитопатического эффекта (CPE). В последующем рассчитывали степень ЦПД в лунках по стандартной шкале в сравнении с контролем. Концентрацию 50% ингибирования (IC50%) определяли по кривой зависимости ингибирования СРЕ от концентрации каждого экстракта.
Все лунки промывали четыре раза холодным фосфатно-солевым буфером (PBS) для удаления экстрактов и несвязавшегося вируса. В каждую лунку добавляли модифицированную среду Игла (MEM) с добавлением 3% фекальной телячьей сыворотки и планшеты инкубировали при 37°C в течение 48 ч до появления цитопатического эффекта (CPE). В последующем рассчитывали степень ЦПД в лунках по стандартной шкале в сравнении с контролем. Концентрацию 50% ингибирования (IC50%) определяли по кривой зависимости ингибирования СРЕ от концентрации каждого экстракта.
Постсвязывающее ингибирование HSV-1 с клетками BHK растительными экстрактами
Для оценки постсвязывающего ингибирования экстрактов с HSV-1 клетки BHK выращивали в титрационных микропланшетах. Планшеты охлаждали на льду в течение 30 мин и инокулировали охлажденной суспензией ВПГ-1. Планшеты инкубировали при 4°C в течение 2 ч, чтобы позволить вирусу связаться с клеточными рецепторами, и промывали четыре раза холодным PBS для удаления любых несвязавшихся вирусов. Температуру планшетов доводили до 37°С и обрабатывали восемью последовательными двукратными разведениями экстрактов лекарственных растений. Затем в каждую лунку добавляли МЕМ с 3% фекальной телячьей сывороткой и планшеты инкубировали при 37°С в течение 48 ч до появления ЦПД. Степень ЦПД в лунках рассчитывали по стандартной шкале в сравнении с контролем. IC50% определяли по кривой зависимости ингибирования СРЕ от концентрации каждого экстракта.
Температуру планшетов доводили до 37°С и обрабатывали восемью последовательными двукратными разведениями экстрактов лекарственных растений. Затем в каждую лунку добавляли МЕМ с 3% фекальной телячьей сывороткой и планшеты инкубировали при 37°С в течение 48 ч до появления ЦПД. Степень ЦПД в лунках рассчитывали по стандартной шкале в сравнении с контролем. IC50% определяли по кривой зависимости ингибирования СРЕ от концентрации каждого экстракта.
Статистика
Статистическая Пробит-модель и SPSS использовались в этом исследовании для статистического анализа. Дозозависимый эффект противовирусной активности экстрактов определяли методом линейной регрессии.
Антиоксидантная способность, флавоноиды, фенольные и дубильные соединения
Q. persica L. Антиоксидантная способность (процент ингибирования или способность ингибировать образование пероксида в линолевой кислоте) составила 67,5%. Количество дубильных веществ, флавоноидов и фенольных соединений в экстракте составило 123, 56,4 и 216 мг/г 9 .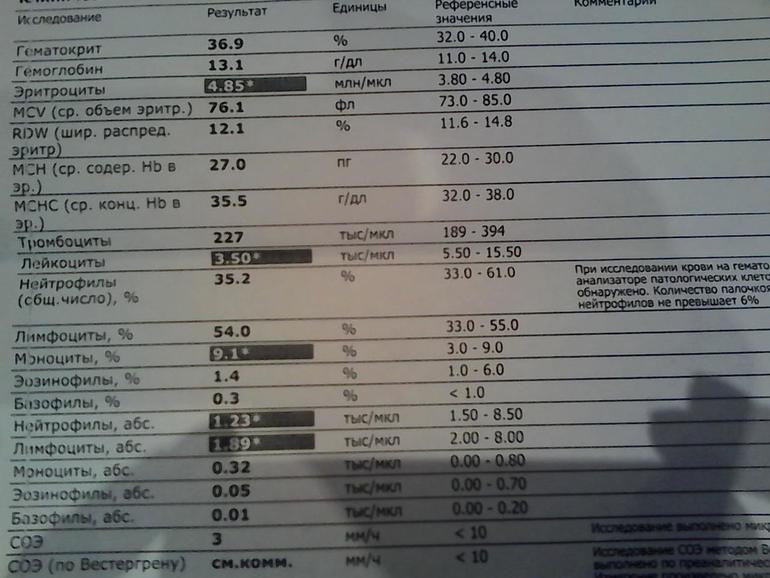 порошок 0030 Q. persica соответственно.
порошок 0030 Q. persica соответственно.
Цитотоксичность экстрактов на клетках BHK
На основании пробит-анализа неожиданно оказалось, что Q. persica L. не показал цитотоксического действия на эту клеточную линию при концентрации до 200 мг/мл. Анализ показал значительную взаимосвязь между концентрацией экстракта и гибелью клеток: чем больше увеличивалась концентрация экстракта, тем больше было показано гибели клеток ( P <0,01).
Анти-HSV-1 активность
Q. persica л. на ВПГ-1 до и после прикрепления к клеткамНа основании пробит-анализа IC50 Q. persica L. на ВПГ-1 до и после прикрепления к клеткам ВНК составляла 1,02 и 0,257 мкг/мл соответственно [] . Исходя из модели, с увеличением концентрации экстракта увеличивался процент ингибирования цитопатического эффекта (ЦПЭ) ( P <0,05). На основании этих результатов Q. persica L. показали сильную активность против HSV-1.
Открыть в отдельном окне
Ингибирующая концентрация экстракта на ВПГ-1 до и после прикрепления к клеткам ВНК.
В настоящее время растет интерес к использованию натуральных продуктов для лечения и профилактики заболеваний. В настоящее время в связи с индукцией резистентности возбудителей к химическим препаратам и преобладанием смертельных исходов различных инфекций активно ведется поиск биологически активных экстрактов на основе традиционно используемых растений.[25]
Вирусы герпеса человека встречаются во всем мире и являются одними из наиболее частых причин вирусных инфекций, особенно у пациентов с ослабленным иммунитетом.[25]
В течение последних двух десятилетий благодаря разработке сильнодействующих противовирусных соединений, нацеленных на эти вирусы, удалось лучше понять репликацию и болезнетворное состояние вирусов простого герпеса типов 1 и 2 (ВПГ-1 и ВПГ-2). .
Большинство противовирусных препаратов обладают токсичностью. Кроме того, более широкое и продолжительное использование этих соединений в клинических условиях, особенно для лечения пациентов с ослабленным иммунитетом, привело к возникновению резистентности вирусов к большинству этих препаратов. [26]
[26]
Механизм ингибирования вируса большинством растительных экстрактов включает ингибирование адсорбции вируса на поверхности клетки и нарушение постабсорбции вирусных частиц, включая проникновение, снятие оболочки и репликацию вируса внутри клетки-хозяина. [27,28] Это исследование. была направлена на оценку in vitro противовирусной активности водно-спиртового экстракта Q. persica L. против ВПГ-1. Этот растительный экстракт имеет долгую историю использования в качестве традиционной фитотерапии, а также для лечения воспалительных заболеваний.[29]]
В этом исследовании Q. persica L. неожиданно проявил активность in vitro против HSV-1 без цитотоксичности, поскольку не проявлял цитотоксического действия на эту клеточную линию вплоть до концентрации 200 мг/мл. Этот экстракт продемонстрировал высокую степень защиты за счет ингибирования репликации ВПГ-1, на что указывает относительное отсутствие или снижение ЦПД в анализе ингибирования вируса до и после прикрепления к клеткам в концентрациях 1,02 и 0,257 соответственно []. Было высказано предположение, что компоненты плодов овса на основе танинов оказывают заметное влияние на репликацию вируса с различными механизмами и с минимальной цитотоксичностью.[30] Поскольку экстракт, использованный в этом исследовании, является компонентом, богатым танинами, его эффекты можно отнести к этому компоненту.
Было высказано предположение, что компоненты плодов овса на основе танинов оказывают заметное влияние на репликацию вируса с различными механизмами и с минимальной цитотоксичностью.[30] Поскольку экстракт, использованный в этом исследовании, является компонентом, богатым танинами, его эффекты можно отнести к этому компоненту.
Результаты, полученные по проценту ингибирования ЦПД при применении экстракта с предварительной обработкой вирусом экстракт имел приемлемую вирулицидную активность (1,02 мкг/мл) либо за счет прямого действия на вирус, либо за счет образования комплекса с вирусом, препятствуя адсорбируется на своих сайтах связывания на клетках, что, скорее всего, предотвращает прикрепление вируса к клеточным сайтам связывания [], что согласуется с некоторыми опубликованными результатами.[31] Q. persica L. также продемонстрировал высокую степень ингибирующего действия на репликацию ВПГ-1 после прикрепления к клетке, о чем свидетельствует процент ингибирования СРЕ []. Эти результаты согласуются с результатами исследования эфирного масла, обладающего противовирусной активностью против устойчивого к ацикловиру штамма HSV-1 (HSV-1-Acv). Это эфирное масло способно оказывать прямое вирулицидное действие на ВПГ, воздействуя на мишени, расположенные в конце цикла репликации вируса.[31]
Эти результаты согласуются с результатами исследования эфирного масла, обладающего противовирусной активностью против устойчивого к ацикловиру штамма HSV-1 (HSV-1-Acv). Это эфирное масло способно оказывать прямое вирулицидное действие на ВПГ, воздействуя на мишени, расположенные в конце цикла репликации вируса.[31]
Для использования в этом исследовании экстракт готовили на 80% этаноле и после сушки тестировали без дополнительной очистки. Было высказано предположение, что более тщательная очистка экстракта может повысить его противовирусную активность.[32] Поскольку экстракт не был полностью очищен, он, вероятно, проявлял частичную противовирусную активность, и должна быть возможность повысить активность против ВПГ-1 путем очистки экстракта.
Как правило, многие противовирусные соединения можно найти в растительных источниках, которые обладают способностью ингибировать ДНК- и РНК-вирусы человека, вызывающие серьезные заболевания у людей, не повреждая и не затрагивая клетки-хозяева. Благодаря этому исследованию мы надеемся открыть путь для нескольких исследований в этой области многообещающей эффективности растительных экстрактов, которые можно использовать с коммерческими терапевтическими агентами или без них против вирусных инфекций человека.
Благодаря этому исследованию мы надеемся открыть путь для нескольких исследований в этой области многообещающей эффективности растительных экстрактов, которые можно использовать с коммерческими терапевтическими агентами или без них против вирусных инфекций человека.
Результаты этого исследования показали высокий уровень фенольных соединений, особенно дубильных веществ, в экстракте Q. persica L., которые обладают антиоксидантной активностью. На самом деле есть несколько опубликованных отчетов, указывающих на противовирусный,[33] антибактериальный[34] и противовоспалительный[35] потенциал Q. persica L. Эти эффекты Q. persica L. были приписаны его фенольным содержания, в частности, его флавоноидных и танниновых соединений. [21,36] Следует признать, что преимущества фитохимических веществ выходят далеко за рамки как их содержания фенолов, так и антиоксидантных способностей.[24,25] Научные исследования Q. persica L. быстро развиваются во многих направлениях. Необходимы дальнейшие исследования на молекулярном уровне для точного выяснения механизма действия Q. persica L.
Необходимы дальнейшие исследования на молекулярном уровне для точного выяснения механизма действия Q. persica L.
. Наши результаты представляют собой растительный экстракт с высокой потенциальной активностью против ВПГ-1 с низкой цитотоксичностью, что, скорее всего, связано с его фенольные соединения, особенно его дубильные соединения. Следовательно, это был бы многообещающий кандидат для разработки нового агента против HSV-1 без цитотоксичности или с минимальной цитотоксичностью.
Источник поддержки: Заместитель по научной работе Университета медицинских наук им. Шахрекорда.
Конфликт интересов: Не объявлено.
1. Хан М.Т., Атер А., Томпсон К.Д., Гамбари Р. Экстракты и молекулы лекарственных растений против вирусов простого герпеса. Противовирусный рез. 2005; 67: 107–19. [PubMed] [Google Scholar]
2. Уитли Р.Дж., Ройзман Б. Вирусные инфекции простого герпеса. Ланцет. 2001; 357:1513–8. [PubMed] [Google Scholar]
3. Brady RC, Bernstein DI. Лечение инфекций, вызванных вирусом простого герпеса. Противовирусный рез. 2004; 61: 73–81. [PubMed] [Академия Google]
Brady RC, Bernstein DI. Лечение инфекций, вызванных вирусом простого герпеса. Противовирусный рез. 2004; 61: 73–81. [PubMed] [Академия Google]
4. Whitley RJ, Levin M, Barton N, Hershey BJ, Davis G, Keeney RE, et al. Инфекции, вызванные Herpes simplex у хозяина с ослабленным иммунитетом: естественное течение и местная терапия ацикловиром. J заразить дис. 1984; 150: 323–9. [PubMed] [Google Scholar]
5. Де Клерк Э. Противовирусные препараты в современной клинической практике. Джей Клин Вирол. 2004; 30:115–33. [PubMed] [Google Scholar]
6. Kurokawa M, Ochiai H, Nagasaka K, Neki M, Xu H, Kadota S, et al. Противовирусные традиционные лекарственные средства против вируса простого герпеса (ВПГ-1), полиовируса и вируса кори in vitro и их терапевтическая эффективность при инфекции ВПГ-1 у мышей. Противовирусный рез. 1993; 22: 175–88. [PubMed] [Google Scholar]
7. Teimouri M, Korori S, Moraghebi F, Matinizadeh M. Сравнение антибактериальной активности quercus persica и quercus ilex. Иранская компания J Pharm Res. 2004; 3: 76–7. [Google Scholar]
Иранская компания J Pharm Res. 2004; 3: 76–7. [Google Scholar]
8. Фаттахи М. Изучение дубравы Загроса и важнейшего фактора ее разрушения. Научно-исследовательский институт леса и пастбищ (RIFR) 1994:135. [Академия Google]
9. Маккар ХП. Эффекты и судьба танинов у жвачных животных, адаптация к танинам и стратегии преодоления пагубных последствий кормления кормами, богатыми танинами. Малый Ром Res. 2003; 49: 241–56. [Google Scholar]
10. Маккар Х.П., Даура Р.К., Сингх Б. Уровни танина в листьях некоторых видов дуба на разных стадиях зрелости. J Sci Food Agric. 1991; 54: 513–9. [Google Scholar]
11. Бейнбридж Д.А. Quercus, многоцелевое дерево для умеренного климата. Международные древесные культуры J. 1986;3:291–8. [Google Scholar]
12. Goodrum PD. Еда индейцев, желудевый хлеб. Пак хист. 1973; 17: 77–80. [Google Scholar]
13. Бейнбридж Д.А. Использование желудей в пищу в Калифорнии: прошлое, настоящее и будущее, Симпозиум по многоцелевому управлению лиственными породами Калифорнии. 1986: 12–4. [Google Scholar]
1986: 12–4. [Google Scholar]
14. Накабаяши Т. Дубильные вещества фруктов и овощей. Адсорбция полифенолов нерастворимым поливинилпирролидоном (polyclar) Jpn J Food Sci Technol. 1972; 19: 84–90. [Академия Google]
15. Херст Э.Л., Джонс Дж.К., Рудье А.Дж. Структура желудевого крахмала. J Chem Soc. 1948; 104: 1779–83. [PubMed] [Google Scholar]
16. Ofcarcik RP, Burns EE. Химические и физические свойства отборных желудей. Дж. Пищевая наука. 1971; 36: 576–58. [Google Scholar]
17. Ким Джо, Ли МДж. Изучение некоторых физико-химических свойств желудевого крахмала. Kor J Food Sci Technol. 1976; 8: 230–5. [Google Scholar]
18. Саффарзаде А., Винче Л., Чапо Дж. Определение химического состава семян желудя (Quercus branti), Pistacia atlantica и Pistacia khinjuk как нетрадиционных кормов. Acta Agraria Kaposváriensis. 1999;3:59–69. [Google Scholar]
19. Кекос Д., Макрис Б.Дж. Производство и характеристика амилазы из Calvatia gigantea. Appl Environ Microbiol.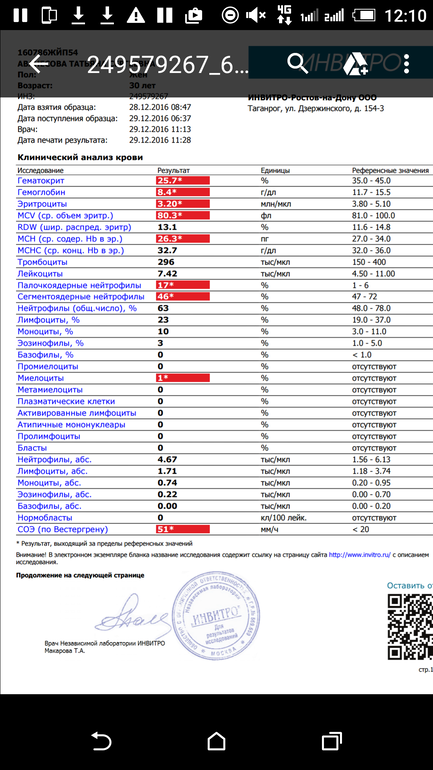 1983; 45: 935–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
1983; 45: 935–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Masude T, Isobe J, Jitoe A, Nakamati N. Антиоксидантные куркуминоиды из корневищ Curcuma xanthorrhiza. Фитохимия. 1992; 31:3645–7. [Google Scholar]
21. Chang C, Yang M, Wen H, Chern J. Оценка общего содержания флавоноидов в прополисе двумя взаимодополняющими колориметрическими методами. J Анал с едой и наркотиками. 2002; 10: 178–82. [Академия Google]
22. Шандерл Ш. Нью-Йорк: Академическая пресса; 1970. Методы анализа пищевых продуктов; п. 709. [Google Scholar]
23. Kim DO, Jeong SW, Lee CY. Антиоксидантная способность фенольных фитохимических веществ из различных сортов сливы. Пищевая хим. 2003; 51: 321–6. [Google Scholar]
24. Ferrea G, Canessa A, Sampietro F, Crudani M, Romussi G, Bassetti D. In vitro Активность экстракта Combretum micranthum против вируса Herpes simplex типов 1 и 2. Antiviral Res. 1993; 21: 317–25. [PubMed] [Академия Google]
25. Rabindran R, Muthulakshmi P, Ganapathy T, Doraiswamy S. Индукция устойчивости риса к рисовому вирусу Tungro с использованием экстракта ростков семян (Vigna unguiculata Walp. Sub sp. unguiculata) Madras Agric J. 2003; 90: 286– 8. [Google Scholar]
Индукция устойчивости риса к рисовому вирусу Tungro с использованием экстракта ростков семян (Vigna unguiculata Walp. Sub sp. unguiculata) Madras Agric J. 2003; 90: 286– 8. [Google Scholar]
26. Вильярреал ЕС. Современные и потенциальные методы лечения герпесвирусных инфекций. Прог Наркотик Рес. 2003; 60: 263–307. [PubMed] [Google Scholar]
27. Amoros M, Lurton E, Boustie J, Girre L. Сравнение активности прополиса и 3-метил-бут-2-энилкафферата против вируса простого герпеса. J Nat Prod. 1994;57:644–7. [PubMed] [Google Scholar]
28. Баракат А.Б., Шоман С.А., Дина Н., Омар Р., Альфарук Р. Противовирусная активность и механизм действия Dianthus caryophyllus L. и Lupinus termes L. Экстракты семян против простого герпеса in vitro и заражение вирусами гепатита А. J Microbiol Антимикроб. 2010;2:23–9. [Google Scholar]
29. Мулиаван С.Ю., Шамала Деви Л.С., Хашим О., Юсоф Р. Ингибирующий потенциал экстракта Quercus lusitanica в отношении репликации вируса Денге 2 типа. Общественное здравоохранение J Trop Med из Юго-Восточной Азии. 2006; 37: 132–5. [PubMed] [Академия Google]
Общественное здравоохранение J Trop Med из Юго-Восточной Азии. 2006; 37: 132–5. [PubMed] [Академия Google]
30. Buzzini P, Arapitsas P, Goretti M, Branda E, Turchetti B, Pinelli P. Антимикробная и противовирусная активность гидролизуемых танинов. Mini Rev Med Chem. 2008; 8: 1179–87. [PubMed] [Google Scholar]
31. Keyaerts E, Vijgen L, Pannecouque C, Van DE, Peumans W, Egberink H, et al. Лектины растений являются мощными ингибиторами коронавирусов, влияя на две мишени в цикле репликации вируса. Противовирусный рез. 2007; 75: 179–87. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Дейг Э.Ф., Эресманн Д.В., Хэтч М.Т., Ридлингер Д.Дж. Ингибирование репликации вируса герпеса экстрактами морских водорослей. Противомикробные агенты Chemother. 1974; 6: 524–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Баба М., Пауэлс Р., Бальзарини Дж., Арноут Дж., Десмитер Дж., Де Клерк Э. Сульфатированные полисахариды являются мощными и селективными ингибиторами различных оболочечных вирусов, включая простой герпес.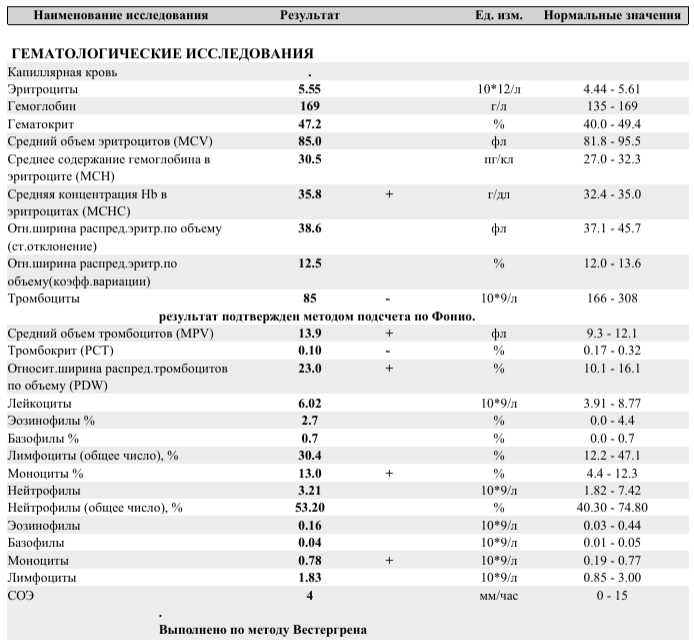 вирус, цитомегаловирус, вирус везикулярного стоматита и вирус иммунодефицита человека. Противомикробные агенты Chemother. 1988;32:1742–1745. [Бесплатная статья PMC] [PubMed] [Google Scholar]
вирус, цитомегаловирус, вирус везикулярного стоматита и вирус иммунодефицита человека. Противомикробные агенты Chemother. 1988;32:1742–1745. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Muliawan Y, Shamala SY, Devi LS, Hashim O, Yusof R. Ингибирующий потенциал экстракта Quercus lusitanica в отношении репликации вируса денге 2 типа. Общественное здравоохранение J Trop Med из Юго-Восточной Азии. 2006; 37: 132–5. [PubMed] [Google Scholar]
35. Киаростами К.Х. Оценка антибактериального действия Quercus persica и Quercus castaneifolia в культуре тканей и совершенном растении. J Sci. 1998; 11:1–8. [Google Scholar]
36. Chang C, Yang M, Wen H, Chern J. Оценка общего содержания флавоноидов в прополисе двумя взаимодополняющими колориметрическими методами. J Анал с едой и наркотиками. 2002; 10: 178–82. [Академия Google]
Польза, дозировка, побочные эффекты и многое другое
Кора дуба ( Quercus alba ) происходит от деревьев семейства Fagaceae , обычно белых сортов дуба, произрастающих в Северной Америке.
Его получают из внутренней коры и круглых наростов, известных как галлы, которые образуются на дереве.
Кору дуба можно высушить и измельчить в порошок для местного и перорального применения, и на протяжении всей истории она использовалась в медицинских целях(1).
Считается, что местное применение подавляет воспаление и успокаивает зудящую кожу, а чай из дубовой коры используется для лечения диареи, простуды, ангины, бронхита, потери аппетита и артрита.
Считается, что различные природные соединения в коре дуба, особенно дубильные вещества, отвечают за заявленные лечебные свойства (2).
Интересно, что высокое содержание танина в некоторых винах обычно является результатом выдержки вина в дубовых бочках (3).
Кора дуба продается в виде порошка, чая, пилюль и жидкого экстракта. Он доступен без рецепта в Соединенных Штатах и может иметь маркировку белого дуба или различных разновидностей его рода Quercus , в том числе robur , cortex sessilifora и pedunculata (4).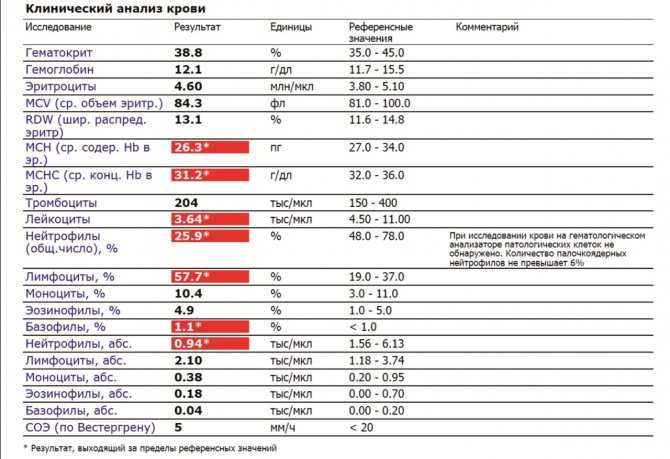
Основное применение коры дуба связано с лечением воспалительных состояний, таких как кровоточивость десен и геморрой. Он также используется для лечения острой диареи.
Тем не менее, существует очень мало исследований, подтверждающих предлагаемые преимущества.
Раздражение кожи
Кора дуба может содержать до 20% дубильных веществ в зависимости от типа и времени сбора (5).
Дубильные вещества действуют как вяжущие средства или агенты, которые связываются с белками кожи, сужая ткани тела, тем самым сужая поры и высушивая раздраженные участки (6).
В частности, было показано, что дубильные вещества в коре дуба ингибируют высвобождение воспалительных соединений. Они также могут проявлять антибактериальные свойства за счет связывания с белками, участвующими в росте бактерий (5, 7).
Эти специфические свойства дубильных веществ определяют возможное местное использование коры дуба при лечении раздражений кожи и ран.
Геморрой или вздутие вен вокруг анальной области иногда лечат купанием в воде, смешанной с порошком коры дуба, чтобы высушить язвы (8).
Кора дуба благодаря своим вяжущим и антибактериальным свойствам также используется для лечения ран, раздражения десен и зубов, а также при ожогах с риском инфицирования. Его можно полоскать горлом, пить или наносить местно (9).
Одно исследование в пробирке показало, что мазь, состоящая из коры дуба и других экстрактов, эффективна против устойчивых к лекарствам бактерий, включая Staphylococcus aureus (10).
Однако невозможно определить, была ли кора дуба или один из других экстрактов ответственны за эти антибактериальные эффекты.
Таким образом, необходимы более обширные исследования, чтобы понять безопасность и эффективность дубовой коры.
Несмотря на то, что использование коры дуба для снятия раздражения кожи может быть широко распространено, исследований по ее использованию для этой цели мало. В некоторых случаях кора дуба может даже усугубить раздражение, особенно при использовании на поврежденной коже (8).
Диарея
Считается, что в дополнение к местному применению дубовая кора оказывает целебное действие при приеме внутрь.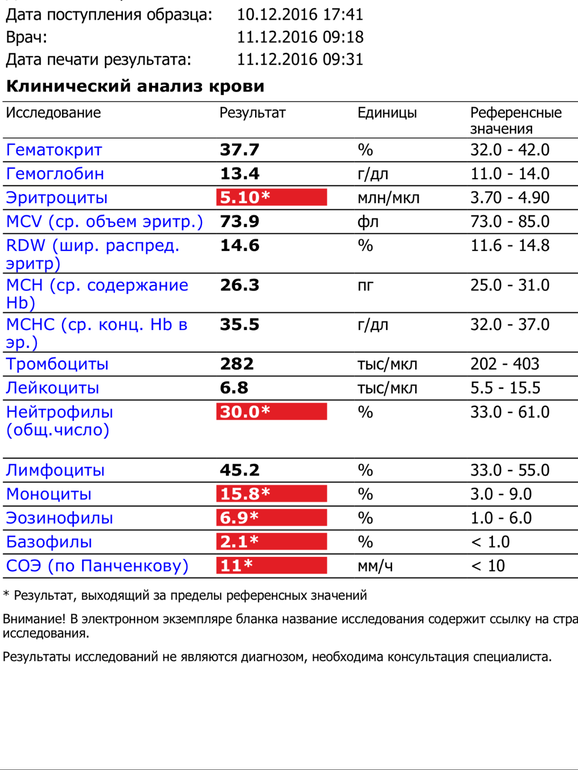
Чай из дубовой коры, в частности, используется для лечения диареи из-за его антибактериальных свойств (5).
Исследования в пробирке показывают, что кора дуба может помочь в борьбе с бактериями, вызывающими расстройство желудка и жидкий стул, включая E.coli . Соединения танина также могут укреплять слизистую оболочку кишечника и предотвращать водянистый стул (11, 12).
Кроме того, исследования на людях поддерживают использование дубильных веществ для лечения диареи.
Одно исследование с участием 60 детей с острой диареей показало, что у тех, кто получал добавки с танинами вместе с режимом регидратации, через 24 часа наблюдалось значительно меньше стула по сравнению с их исходным уровнем (13).
Однако не было существенной разницы в средней продолжительности диареи после лечения между теми, кто получал добавку и регидратацию, по сравнению с теми, кто только что получил регидратацию (13).
Хотя эти результаты интересны, ни одно исследование не было специально посвящено соединениям в коре дуба.
Таким образом, неясно, является ли длительное употребление чая из дубовой коры и других продуктов безопасным и эффективным при лечении диареи.
Антиоксидантная активность
Некоторые соединения коры дуба, такие как эллагитаннины и робурин, могут действовать как антиоксиданты. Антиоксиданты защищают ваш организм от основных повреждений, вызванных реактивными молекулами, называемыми свободными радикалами (2).
Считается, что антиоксидантная активность этих соединений улучшает здоровье сердца и печени и, возможно, оказывает противораковое действие (2).
Одно исследование эллагитаннинов из коры дуба показало, что у крыс, получавших экстракт коры дуба в течение 12 недель при соблюдении диеты с высоким содержанием жиров и углеводов, наблюдалось улучшение функции сердца и печени по сравнению с крысами, не получавшими экстракт (14).
Другое исследование с участием 75 взрослых с временной печеночной недостаточностью показало, что у тех, кто принимал экстракт древесины дуба в течение 12 недель, показатели маркеров функции печени значительно улучшились по сравнению с теми, кто не принимал добавку (15).
Однако доступность эллагитаннинов и их побочных продуктов в организме зависит от человека. Таким образом, кора дуба не может давать одинаковые преимущества для всех (16).
Необходимы более обширные исследования, чтобы понять безопасность длительного использования продуктов из коры дуба.
На сегодняшний день недостаточно исследований для выявления всех возможных побочных эффектов чая из коры дуба, пищевых добавок и лосьонов.
Кора дуба обычно считается безопасной при приеме в течение коротких периодов времени, особенно 3–4 дня для лечения острой диареи и 2–3 недели при непосредственном нанесении на кожу (17).
Личные сообщения предполагают, что пероральные формы коры дуба могут вызывать расстройство желудка и диарею. Между тем, местные аппликации коры дуба могут привести к раздражению кожи или ухудшению таких состояний, как экзема, особенно при использовании на поврежденной или поврежденной коже (18).
Кроме того, высокие дозы и/или длительное употребление коры дуба могут ухудшить функцию почек и печени.
Одно исследование на крысах показало, что дозы 15 мг экстракта коры дуба на фунт (33 мг на кг) массы тела приводят к повреждению почек (19).
Из-за отсутствия исследований по использованию коры дуба для человека рекомендуемая дозировка отсутствует.
Инструкции по пилюлям, настойкам, чаям и лосьонам из коры дуба сильно различаются.
Для лучшего усвоения в некоторых инструкциях рекомендуется не принимать добавки коры дуба или чаи с едой.
По данным Европейского агентства по лекарственным средствам, ниже приведены общерекомендуемые дозы коры дуба для различных целей — как для внутреннего, так и для наружного применения (17).
Внутреннее применение- Пероральные добавки: до 3 г в день
- Чаи (от диареи): 1 чашка (250 мл) чая из дубовой коры до 3 раз в день или эквивалент 3 грамма в день
- Продолжительность: 3–4 дня
Наружное применение
- Ванны (при геморрое или кожных раздражениях): 5 г дубовой коры, прокипяченные в 4 чашках (1 л) воды перед добавлением в ванну
- Ополаскиватели для кожи или полоскания боли в горле): 20 граммов коры дуба, сваренных в 4 стаканах (1 литре) воды
- Продолжительность: 2–3 недели
Как приготовить чай из коры дуба
форма чайного пакетика.
Для этого заварите пакетик чая в 1 стакане (250 мл) горячей воды. Вы также можете вскипятить до 3 граммов (3/4 чайной ложки) высушенной коры дуба в нескольких чашках воды, процедить и выпить.
Сообщений о передозировке корой дуба нет.
Тем не менее, важно следовать указаниям на этикетке. Поскольку есть опасения по поводу длительного использования коры дуба, обязательно проконсультируйтесь с врачом, прежде чем принимать ее.
Сообщений о взаимодействии коры дуба с другими препаратами или добавками не поступало.
Однако лучше не принимать кору дуба с добавками железа, так как дубильные вещества могут препятствовать усвоению железа (17).
Чай из дубовой коры, добавки и лосьоны следует хранить при комнатной температуре в прохладном, сухом месте. Срок годности этих продуктов варьируется и должен быть указан на этикетке.
Недостаточно информации о безопасности препаратов коры дуба для беременных и кормящих женщин.
Таким образом, кора дуба не должна использоваться этими группами населения (17).

 0-9.0
0-9.0
