Нейтрофилы палочкоядерные
Палочкоядерный нейтрофил — юная разновидность нейтрофилов. У него S-образное ядро (в отличие от сегментоядерного). Палочкоядерные нейтрофилы представляют собой один из последних этапов дифференцировки нейтрофильного ряда гранулоцитов (зернистых лейкоцитов) в сегментоядерные нейтрофилы. В крови содержится только 1–6 % палочкоядерных нейтрофилов из общего числа лейкоцитов. Наличие палочкоядерных нейтрофилов в русле крови объясняется тем, что они завершают миелопоэз непосредственно в сосудах. Палочкоядерные нейтрофилы присутствуют в крови непродолжительно. У них быстро сегментируется ядро (происходит дозревание), и они превращаются в сегментоядерные.
Клиническое значение имеет так называемый «сдвиг (смещение) лейкоцитарной формулы вправо или влево». Под сдвигом понимают изменение соотношения сегментоядерных и палочкоядерных (зрелых и юных) нейтрофилов.
Сдвиг формулы влево — увеличение доли юных (палочкоядерных) нейтрофилов в сосудах периферической крови, появление метамиелоцитов и миелоцитов. Такая картина периферической крови наиболее типична для любого воспалительного процесса и особенно выражена в острой стадии.
Сдвиг формулы вправо — уменьшение или исчезновение палочкоядерных (юных) нейтрофилов за счет числа сегментоядерных (зрелых) нейтрофилов с гиперсегментированными ядрами. Это характерно для мегалобластных анемий, хронической недостаточности почек и печени, постгемотрансфузионного синдрома.
Анализатор АМП контролирует изменения в лейкоцитарной формуле на протяжении всей болезни, позволяя наблюдать динамику воспалительного процесса и вносить коррективы в лечение. За 10 мин на амбулаторном приеме можно неинвазивно получить данные исследования.
Пройти комплексную диагностику на аппарате АМП Вы можете в одной из клиник Вашей страны. Выберите клинику перейдя по ссылке: https://biopromin.info/index. php?type=clinics
php?type=clinics
Норма: 1-6 %.
Почему понижены нейтрофилы и что с этим делать
Нейтрофилы — это один из видов белых кровяных телец (лейкоцитов). Все лейкоциты помогают организму бороться с инфекциями. Конкретно нейтрофилы особенно важны при бактериальных заболеваниях, например ангине или бронхите.
Сниженный уровень нейтрофилов в крови называют нейтропенией. Это состояние означает, что ваша иммунная система ослабла и не может эффективно противостоять бактериям. То есть вы более уязвимы для всевозможных инфекций.
Какой уровень нейтрофилов считается низким
Нейтропению диагностируют, если количество нейтрофилов в крови оказывается менее 1 500 на микролитр. Некоторые врачи считают , что порог составляет 1 800 на микролитр.
По степени тяжести состояние характеризуют так:
- 1 000–1 500/мкл — лёгкая нейтропения;
- 500–1 000/мкл — умеренная;
- менее 500/мкл — тяжёлая.
Как узнать, что нейтрофилы понижены
Часто люди с нейтропенией даже не догадываются о том, что в их крови не хватает белых кровяных телец: лёгкая форма не имеет симптомов. В более сложных случаях нарушение может проявлять себя:
- то и дело повторяющимися бактериальными инфекциями: отитами, гингивитами, кожными воспалениями;
- отёчностью;
- регулярными и на первый взгляд необъяснимыми повышениями температуры.
Однако по симптомам нейтропению устанавливают крайне редко. В большинстве случаев снижение уровня нейтрофилов обнаруживается случайно — при анализе крови, который делают по каким‑то другим причинам.
Впрочем, даже если первое исследование показало, что нейтрофилов недостаточно, о нейтропении говорить рано. Количество лейкоцитов в крови может меняться с течением времени, то повышаясь, то снижаясь, и это абсолютно нормально. Поэтому лечащий врач предложит вам повторить общий анализ крови, прежде чем поставит диагноз.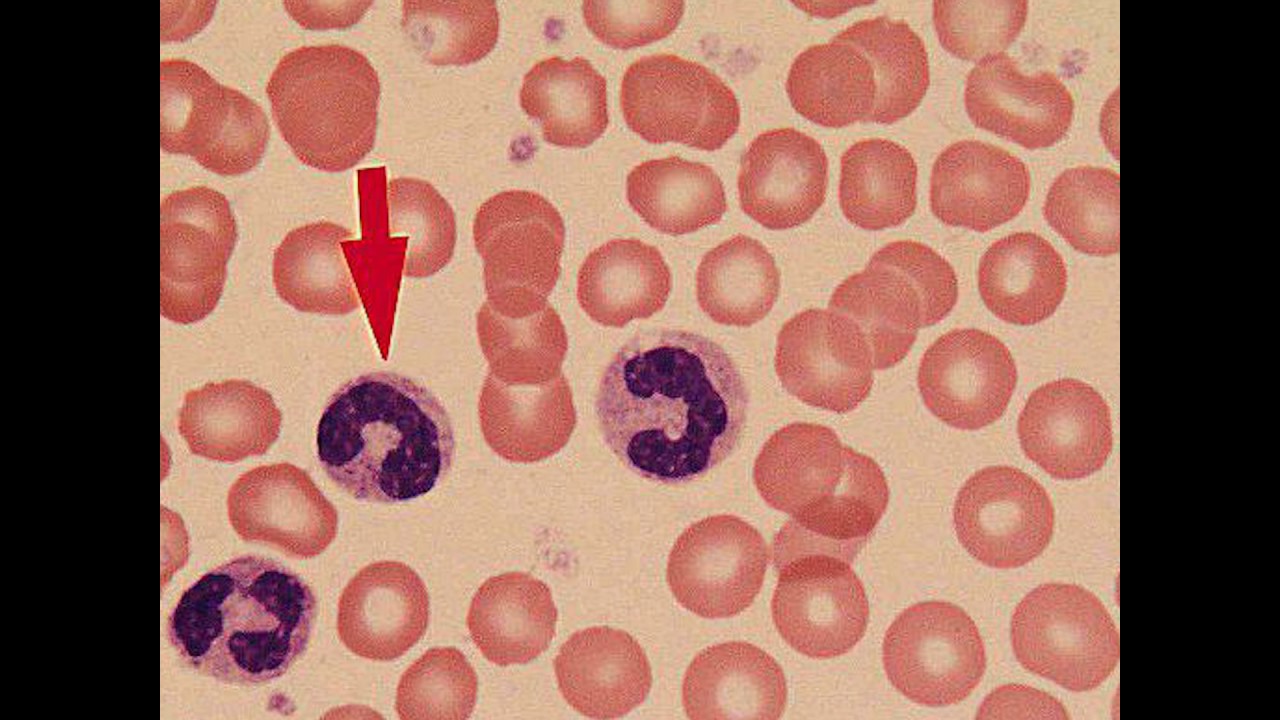
Когда надо срочно обращаться за помощью
В тяжёлых случаях дефицита нейтрофилов даже «родные» бактерии — те, что живут в здоровом желудочно‑кишечном тракте или, положим, на слизистой рта, — могут вызвать серьёзное заболевание. А любая инфекция способна почти молниеносно стать смертельной.
Как можно быстрее свяжитесь со своим врачом или, в зависимости от состояния, вызывайте скорую, если на фоне диагностированной нейтропении наблюдаете один, а тем более сразу несколько из перечисленных симптомов :
- Лихорадка. О ней говорят, если температура поднялась выше 38 °C.
- Озноб и потливость.
- Навязчивый или сильный кашель, если его не было ранее. Также опасным признаком является усиление уже существующего кашля.
- Одышка.
- Боль во рту.
- Боль в горле.
- Любые заметные изменения в мочеиспускании: резь, боль, раздражение кожи и слизистой, изменение цвета и консистенции мочи.
- Диарея.
- Рвота.
- Покраснение или отёк вокруг малейшей царапины или пореза.
- Выделения из влагалища, которых не было ранее.
- Жёсткая шея. Об этом признаке говорят, если вам больно поворачивать или наклонять голову либо вы не можете откинуть её назад.
- Ощутимая боль в любой части тела (ноге, руке, животе, грудной клетке), если её не было ранее.
Почему понижены нейтрофилы
Нейтропения возникает , когда нейтрофилы расходуются или разрушаются быстрее, чем костный мозг успевает их производить. Либо же если он сам по себе не способен вырабатывать их в достаточном количестве. Это может быть вызвано разными заболеваниями или состояниями.
Вот самые распространённые причины , из‑за которых понижается уровень нейтрофилов в крови.
1. Инфекции
Нейтрофилы падают при следующих заболеваниях:
- Мононуклеоз (вирус Эпштейна — Барр).
- Гепатиты. Чаще всего трёх типов: А, В, С, в острой и хронической формах.
- Ветрянка.

- Корь.
- Туберкулёз.
- Болезнь Лайма.
- Сальмонеллёзная инфекция.
- ВИЧ/СПИД.
- Сепсис (заражение крови).
2. Некоторые аутоиммунные заболевания
К ним относятся:
- Ревматоидный артрит.
- Системная красная волчанка.
- Гранулематоз с полиангиитом.
- Болезнь Крона.
3. Заболевания костного мозга и крови
Например, апластическая анемия, миелодиспластические синдромы, миелофиброз (необычный тип рака костного мозга) или лейкемия — рак крови.
4. Химиотерапия, применяемая при лечении рака
Такие процедуры необходимы: они уничтожают злокачественные образования. Однако вместе с раковыми клетками под раздачу попадают и здоровые, нейтрофилы в том числе.
5. Приём некоторых лекарств
Понизить уровень нейтрофилов могут:
- Препараты, которые применяют для лечения избыточной активности щитовидной железы (гипертиреоза).
- Антибиотики, включая распространённые, например на основе пенициллина.
- Противовирусные средства.
- Противовоспалительные лекарства. В частности, те, что используют для терапии язвенного колита или ревматоидного артрита.
- Антипсихотические средства.
- Препараты для лечения сердечной аритмии.
6. Недостаток витаминов или минералов
Уровень нейтрофилов может понизиться, если вы не получаете в нужном количестве витамин В12, фолиевую кислоту или медь.
7. Влияние недоизученных факторов
Иногда нейтропения бывает врождённой. А в некоторых случаях её причины и вовсе установить не получается — тогда говорят об идиопатическом (неизвестной природы) нарушении.
Что делать с нейтропенией
Некоторые типы нейтропении в терапии не нуждаются : они рассматриваются как индивидуальная особенность. Другие успешно корректируются отменой лекарств, вызвавших такой побочный эффект, или, например, лечением основного инфекционного заболевания — ветрянки, кори, гепатита.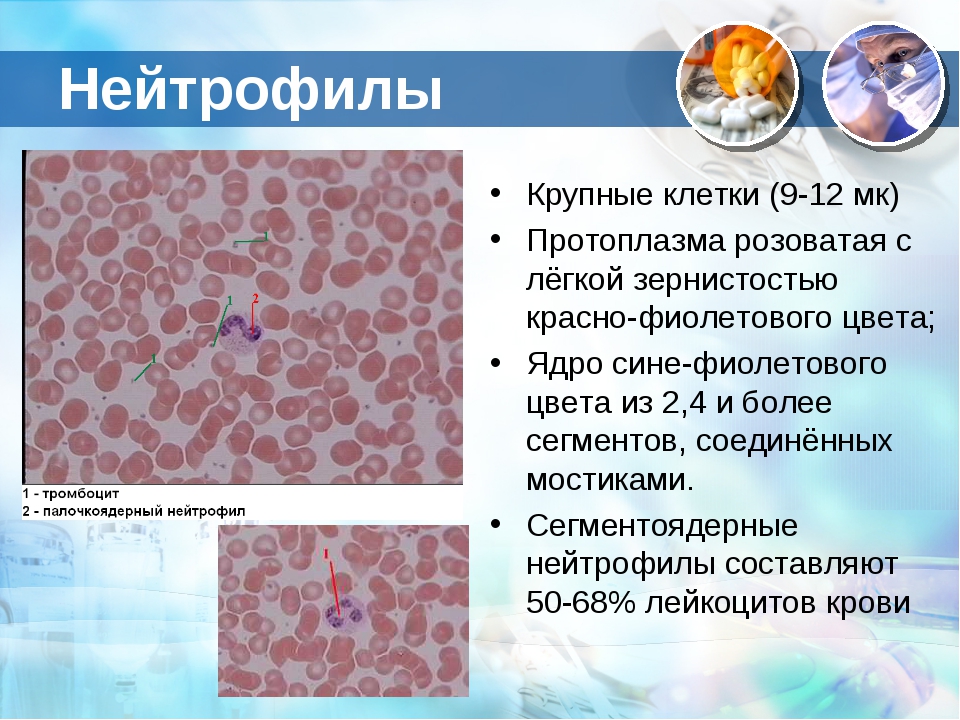
Однако решать, что делать в вашем конкретном случае, должен только квалифицированный врач — терапевт или другой специалист, который обнаружил нарушение.
Читайте также 🩸🧬🦠
Нейтрофіли та онкогенез
Резюме. В огляді наведено дані про роль нейтрофілів периферичної крові і нейтрофілів, які інфільтрують пухлини, у протипухлинних та пухлиностимулюючих процесах, які відбуваються при розвитку багатьох видів раку. Наведено характеристику двох основних фенотипів Н1 і Н2 клітин, обговорюються їх функції і механізми переходу від Н1 клітин з протипухлинною активністю в Н2 клітини, які стимулюють проліферацію пухлинних клітин, ангіогенез і метастазування. Наведено дані про функціонально важливі цитокіни та хемокіни, що виділяються пухлинними клітинами, мікрооточенням, лімфоцитами і самими нейтрофілами, які стимулюють вироблення кістковим мозком нейтрофілів і спричиняють накопичення цих клітин у пухлинному вогнищі, розвиток нейтрофілії в крові. Описано основні функціональні молекули нейтрофілів, такі як нейтрофільна еластаза, катепсин, матриксна металопротеїназа-9, аргіназа 1 та ін., з якими зв’язуються протуморогенні властивості Н2 нейтрофілів. Багато процесів, викликані як Н1, так і Н2 нейтрофілами, ще недостатньо вивчені. Коротко зазначається про існування сьогодні багатьох підходів до генерації та активації нейтрофілів з протипухлинними властивостями і гальмування нейтрофілів, які стимулюють ріст пухлин.
Резюме. В обзоре приведены данные о роли нейтрофилов периферической крови и нейтрофилов, инфильтрирующих опухоли, в противоопухолевых и опухольстимулирующих процессах, которые происходят при развитии многих видов раков. Приведена характеристика двух основных фенотипов Н1 и Н2 клеток, обсуждаются их функции и механизмы перехода от Н1 клеток с противоопухолевой активностью в Н2 клетки, стимулирующие пролиферацию опухолевых клеток, ангиогенез и метастазирования.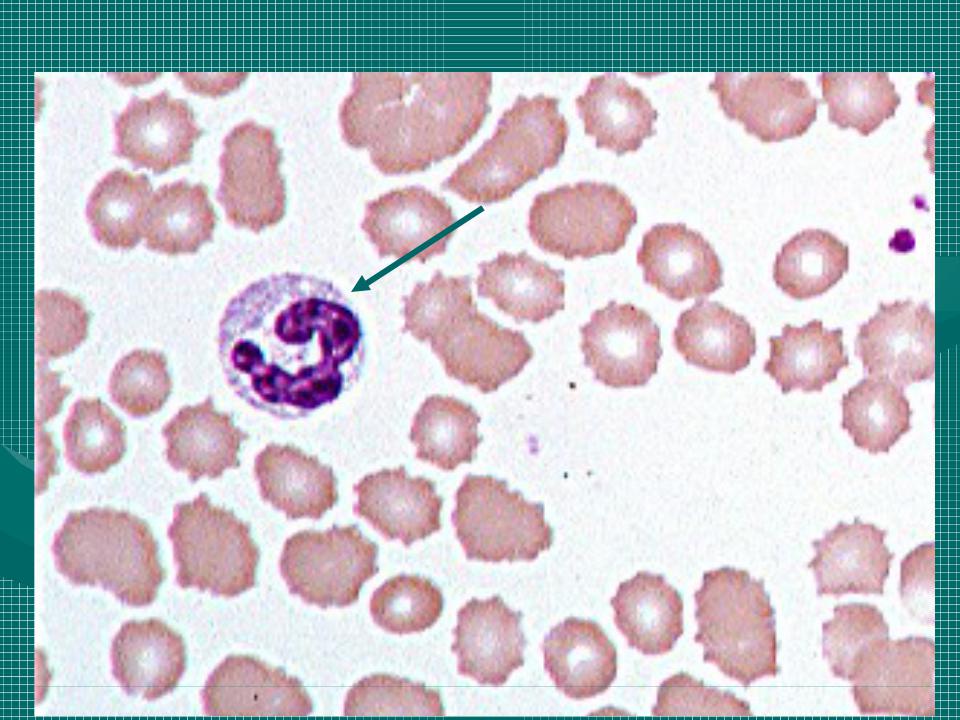
Получено 09.02.2018
Принято в печать 16.03.2018
Введение
Общеизвестно, что нейтрофилы являются наиболее распространенными лейкоцитами крови и считаются первой линией защиты при воспалении и инфекциях [1]. Проникшие в организм микроорганизмы вызывают воспалительную реакцию, которая привлекает нейтрофилы из кровообращения в ткани. Там нейтрофилы разрушают микроорганизм с помощью ряда механизмов, главным образом за счет фагоцитоза, высвобождения противомикробных веществ и образования внеклеточных ловушек нейтрофилов [1, 2]. Активированные нейтрофилы также выделяют различные протеиназы в окружающую ткань, вызывая повреждения возбудителей и зачастую собственных тканей [3]. Кроме того, нейтрофилы способны продуцировать множество цитокинов и хемокинов, которые могут влиять на воспалительную реакцию, а также иммунный ответ организма [4, 5].
Помимо этой классической роли нейтрофилов в антимикробной защите, также выявлено накопление нейтрофилов во многих типах опухолей. Первоначально считалось, что эти связанные с опухолью нейтрофилы (опухольинфильтрирующие нейтрофилы — ОН) являются простыми свидетелями, потому что трудно представить, что нейтрофилы, будучи короткоживущими клетками, могут влиять на такое хроническое и прогрессирующее заболевание, как рак.
Однако большее число клинических наблюдений и лабораторных исследований показали, что наличие нейтрофилов в опухолях часто коррелирует с плохим прогнозом. Это хорошо доказано при целом ряде опухолей, в частности при бронхоальвеолярной карциноме [10], почечно-клеточной карциноме [12] и плоскоклеточной карциноме головы и шеи [13], а также меланоме [11]. Во всех этих случаях нейтрофилы проявляют другой фенотип, который может быть неблагоприятным для исхода заболевания. Механизмы формирования и реализации этого фенотипа нейтрофилов только начинают выяснять, но предполагается, что некоторые из них связаны с генотоксичностью, ангиогенезом и иммуносупрессией [8]. Следовательно, ОН могут быть полезны или вредны для хозяина [14]. Эти два типа нейтрофилов, четко описанные у мышей, были названы Н1 и Н2 [15] подобно противоопухолевым и опухольстимулирующим макрофагам (М1 и М2) [16]. Положение о том, что нейтрофилы могут являться действительно важными клетками в развитии рака у человека, детально обсуждается в ряде обзоров [16–18].
Стимуляция образования нейтрофилов. У многих пациентов с распространенным раком выявлены повышенные уровни нейтрофилов в крови. Как опухоли индуцируют нейтрофилию, окончательно неизвестно, но синтез опухолевыми клетками гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), возможно, является одним из механизмов стимуляции продукции нейтрофилов костным мозгом [19].
Предполагается, что отношение числа нейтрофилов в крови к другим типам лейкоцитов служит фактором прогноза для больных раком. Так, например, отношение нейтрофилов к лимфоцитам (НЛО) было введено как прогностический фактор для больных колоректальным раком [25]. Из-за своей простоты определения НЛО показало, что является легкодоступным и недорогим биомаркером для многих типов опухолей, включая немелкоклеточный рак легкого [26], гепатоцеллюлярную карциному [24], карциному носоглотки [27], колоректальный рак [26], меланому [11] и рак грудной железы [28, 29]. Высокий уровень НЛО коррелирует с неблагоприятной общей выживаемостью при многих солидных опухолях [30–32].
В то же время, несмотря на данные многих исследований, часть которых упомянута выше, нейтрофилия (большее количество нейтрофилов в крови как следствие повышенного выхода клеток из костного мозга) не всегда является плохим показателем прогрессирования рака. При некоторых типах опухолей, например раке желудка, повышенный уровень нейтрофилов в крови сопряжен с положительным прогнозом [33]. Это означает, что нейтрофилы могут в некоторых случаях контролировать развитие рака. Способность нейтрофилов непосредственно убивать опухолевые клетки как in vitro, так и in vivo зарегистрирована давно [34–36]. Также сообщалось, что нейтрофилы от животных с экспериментальными опухолями обладают повышенной цитотоксической активностью [7]. Нейтрофилы, выделенные из крови здоровых людей, оказывают прямое цитотоксическое действие на некоторые линии опухолевых клеток [40]. Таким образом, точная роль нейтрофилов в развитии опухолевого роста различных типов рака является спорным вопросом [7, 14, 37] и не до конца изученной, что требует дальнейших исследований.
Также сообщалось, что нейтрофилы от животных с экспериментальными опухолями обладают повышенной цитотоксической активностью [7]. Нейтрофилы, выделенные из крови здоровых людей, оказывают прямое цитотоксическое действие на некоторые линии опухолевых клеток [40]. Таким образом, точная роль нейтрофилов в развитии опухолевого роста различных типов рака является спорным вопросом [7, 14, 37] и не до конца изученной, что требует дальнейших исследований.
Типы нейтрофилов. В дополнение к увеличенному количеству нейтрофилов в крови отмечено повышение уровня в крови незрелых миелоидных клеток на ранних стадиях дифференцировки, что выявлено в нескольких типах опухолей [38], включая пациентов с терминальной стадией рака легкого, грудной железы и желудочно-кишечного тракта [39]. Эти незрелые клетки костномозгового происхождения, представляющие гетерогенную популяцию, фенотипически разделяли на гранулоцитарные (G-MDSC) и моноцитарные (Mo-MDSC) подгруппы [40–42]. Их выявляют в большом количестве в селезенке экспериментальных животных с опухолями, где они представляют иммунодепрессивный фенотип, что приводит к прогрессированию опухолей [43, 44]. G-MDSC характеризуются незрелой морфологией нейтрофилов и фенотипом CD33/CD11b/HLA-DR/CD15 у людей [45]. Они выявлены в периферической крови пациентов с глиобластомой [46], множественной миеломой, лимфомой Ходжкина [47], раком головы и шеи [48].
Эти G-MDSC могут осуществлять иммуносупрессию различными механизмами. Основной механизм включает в себя производство активных форм кислорода (АФК) при дыхательной вспышке этих клеток. У больных онкологического профиля пероксид водорода (H2O2), продуцируемый активированными гранулоцитами, снижал экспрессию CD3 цепи Т-клеточного рецептора и уменьшал выработку цитокинов Т-клетками пациентов [49]. Эти окисленные Т-клетки человека имели дефектный хемотаксис. Более того, АФК, продуцируемые MDSC, могут приводить к блокаде также CD8 T-клеток и с помощью другого механизма, в частности пероксинитрита [50].
Как отмечалось выше, в зависимости от фенотипа нейтрофилы можно классифицировать как Н1 или Н2 [15], и подобно инфильтрирующим опухоль макрофагам (M1) клетки Н1 проявляют провоспалительную и противоопухолевую функции. Напротив, клетки M2 и Н2 обладают протуморогенной активностью [16]. Установлено, что ОН отличаются от циркулирующих нейтрофилов, а также от G-MDSC в костном мозге и селезенке мышей. Мышиные CD11b/Ly6G нейтрофилы, выделенные из опухоли и активированные трансформирующим фактором роста бета (TGF-β), были гиперсегментированы и более цитотоксичны к опухолевым клеткам, экспрессировали более высокие уровни провоспалительных цитокинов [15]. Напротив, истощение этих нейтрофилов из крови угнетало рост опухоли и сопровождалось активацией внутриопухолевых CD8 Т-клеток [15]. В подтверждение идеи о разных фенотипах нейтрофилов проведены исследования на двух моделях рака у мышей (карцинома легкого Льюиса и мезотелиома AB12), у которых нейтрофилы были выявлены прежде всего на периферии опухолевого узла на ранних стадиях развития опухоли. Эти ОН были более цитотоксичны по отношению к опухолевым клеткам и продуцировали более высокие уровни фактора некроза опухоли альфа (TNF-α), NO и H2O2. Напротив, ОН на поздних стадиях развития этих опухолей уже не проявляли таких свойств и демонстрировали протуморогенный фенотип [51]. Эти результаты исследований свидетельствуют, что нейтрофилы, попадая в опухоль, со временем становятся клетками, способными стимулировать рост опухолей [51]. Следовательно, ОН, полученные от мышей с растущими опухолями, могут иметь как противоопухолевый (Н1), так и протуморогенный (Н2) фенотип, который способен поддерживать рост опухоли и подавлять противоопухолевые иммунные реакции [14, 37], зависящие от микроокружения опухоли [17].
Несмотря на эту классификацию ОН у мышей, природа и функция ОН, находящихся в опухолях человека, остаются еще малоизученными, но уже получены результаты, подтверждающие такое деление ОН. Так, в исследованиях биопсийного материала опухоли легкого человека ОН составляли 5–25% всех клеток в опухоли [65]. Эти ОН представляли активированный фенотип (CD62L/CD54) с экспрессией отчетливого репертуара рецепторов хемокинов, которые включали CCR5, CCR7, CXCR3 и CXCR4 [65]. Кроме того, ОН продуцировали большее количество провоспалительных факторов MCP-1, IL-8, MIP-1α и IL-6, чем нейтрофилы в крови. ОН также стимулировали пролиферацию Т-клеток и выделение интерферона-гамма (IFN-γ). Эти результаты показывают, что на ранних стадиях рака легкого ОН не являются иммунодепрессантами, а скорее всего стимулируют ответы Т-клеток [52]. В исследовании [53] изучена роль хронического воспаления, в частности IL-23 и IL-17, при раке толстой кишки человека. Авторы выявили, что врожденные γδT (γδT17) клетки являются основным клеточным источником IL-17 при колоректальном раке. Эти активированные клетки индуцировали клетки γδT17 секретировать IL-8, TNF-α и GM-CSF, что приводит к накоплению нейтрофилов в опухоли. Эти ОН характеризовались CD45/Lin/HLADR/CD11b/CD33/CD66b и имели типичную полиморфноядерную морфологию. Они были описаны как G-MDSC [66]. Эти ОН (G-MDSC) продуцировали намного больше аргиназы-1 (ARG1) и АФК, чем аутологичные нейтрофилы в крови, и ингибировали пролиферацию активированных аутологичных Т-клеток и продукцию IFN-γ [53]. Результаты приведенных исследований указывают, что и в опухолях человека могут быть нейтрофилы с двойной функцией. В ранних стадиях развития опухоли ОН, по-видимому, способны стимулировать противоопухолевые иммунные реакции, особенно Т-клеток [52], на поздних этапах роста опухоли ОН уже становятся иммунодепрессивными клетками [54]. Сегодня остается еще много неясных вопросов. Например, являются ли ОН в ранних стадиях роста опухолей незрелыми нейтрофилами с противоопухолевыми свойствами, или ОН — это зрелые нейтрофилы, которые меняют фенотип со временем при прогрессировании опухоли, как предполагают ряд исследователей [17, 51]. Уже идентифицировано несколько субпопуляций нейтрофилов в крови как мышей с опухолями, так и людей, больных раком, и описывается несколько вариантов взаимосвязей этих клеток в связи с прогрессированием рака [54].
Эти ОН представляли активированный фенотип (CD62L/CD54) с экспрессией отчетливого репертуара рецепторов хемокинов, которые включали CCR5, CCR7, CXCR3 и CXCR4 [65]. Кроме того, ОН продуцировали большее количество провоспалительных факторов MCP-1, IL-8, MIP-1α и IL-6, чем нейтрофилы в крови. ОН также стимулировали пролиферацию Т-клеток и выделение интерферона-гамма (IFN-γ). Эти результаты показывают, что на ранних стадиях рака легкого ОН не являются иммунодепрессантами, а скорее всего стимулируют ответы Т-клеток [52]. В исследовании [53] изучена роль хронического воспаления, в частности IL-23 и IL-17, при раке толстой кишки человека. Авторы выявили, что врожденные γδT (γδT17) клетки являются основным клеточным источником IL-17 при колоректальном раке. Эти активированные клетки индуцировали клетки γδT17 секретировать IL-8, TNF-α и GM-CSF, что приводит к накоплению нейтрофилов в опухоли. Эти ОН характеризовались CD45/Lin/HLADR/CD11b/CD33/CD66b и имели типичную полиморфноядерную морфологию. Они были описаны как G-MDSC [66]. Эти ОН (G-MDSC) продуцировали намного больше аргиназы-1 (ARG1) и АФК, чем аутологичные нейтрофилы в крови, и ингибировали пролиферацию активированных аутологичных Т-клеток и продукцию IFN-γ [53]. Результаты приведенных исследований указывают, что и в опухолях человека могут быть нейтрофилы с двойной функцией. В ранних стадиях развития опухоли ОН, по-видимому, способны стимулировать противоопухолевые иммунные реакции, особенно Т-клеток [52], на поздних этапах роста опухоли ОН уже становятся иммунодепрессивными клетками [54]. Сегодня остается еще много неясных вопросов. Например, являются ли ОН в ранних стадиях роста опухолей незрелыми нейтрофилами с противоопухолевыми свойствами, или ОН — это зрелые нейтрофилы, которые меняют фенотип со временем при прогрессировании опухоли, как предполагают ряд исследователей [17, 51]. Уже идентифицировано несколько субпопуляций нейтрофилов в крови как мышей с опухолями, так и людей, больных раком, и описывается несколько вариантов взаимосвязей этих клеток в связи с прогрессированием рака [54]. Показано, что циркулирующие в крови нейтрофилы от животных с опухолями распределяли на субпопуляции (фракции) при разделении их в различных градиентах плотности фиколла. Одна субпопуляция состояла из «нормальных» нейтрофилов с высокой плотностью, которую выделяли на градиенте с высокой плотностью фиколла. Другая субпопуляция имела нейтрофилы с меньшей плотностью, которые находились вместе со слоем мононуклеарных лимфоидных клеток низкой плотности [55]. У здоровых мышей, не имеющих опухоли, большинство нейтрофилов были высокой плотности, а у животных с опухолями прогрессивно возрастало количество нейтрофилов с низкой плотностью, и они становились доминирующим типом нейтрофилов в циркуляции [54]. Эти нейтрофилы обладали меньшей цитотоксичностью и имели меньшую экспрессию различных хемокинов (CXCL1, CXCL2, CXCL10, CCL2 и CCL3) и хемокиновых рецепторов (CXCR2 и CCR5), что свидетельствовало о снижении их провоспалительных возможностей. Предполагается, что нейтрофилы с низкой плотность являются незрелыми нейтрофилами. Важно отметить, что TGF-β способен индуцировать трансформацию нейтрофилов с высокой плотностью от мышей с опухолями в нейтрофилы с низкой плотностью, и в то же время этот фактор не влиял на нейтрофилы крови животных без опухолей [54]. Это указывает на то, что для такого изменения ОН у животных с раком необходимы и другие стимулы, помимо TGF-β. На основании этих результатов авторы предложили гипотезу, согласно которой три субпопуляции нейтрофилов могут присутствовать в крови при раке: нормальные нейтрофилы высокой плотности, незрелые нейтрофилы низкой плотности (G-MDSC) и крупные зрелые нейтрофилы низкой плотности. Эти типы клеток обладают разной функциональностью и пластичностью. Так, нейтрофилы с высокой плотностью являются противоопухолевыми, а низкой — клетками, способными стимулировать рост опухоли [67], они могут изменяться под влиянием различных хемокинов и цитокинов в микроокружении опухоли [17].
Показано, что циркулирующие в крови нейтрофилы от животных с опухолями распределяли на субпопуляции (фракции) при разделении их в различных градиентах плотности фиколла. Одна субпопуляция состояла из «нормальных» нейтрофилов с высокой плотностью, которую выделяли на градиенте с высокой плотностью фиколла. Другая субпопуляция имела нейтрофилы с меньшей плотностью, которые находились вместе со слоем мононуклеарных лимфоидных клеток низкой плотности [55]. У здоровых мышей, не имеющих опухоли, большинство нейтрофилов были высокой плотности, а у животных с опухолями прогрессивно возрастало количество нейтрофилов с низкой плотностью, и они становились доминирующим типом нейтрофилов в циркуляции [54]. Эти нейтрофилы обладали меньшей цитотоксичностью и имели меньшую экспрессию различных хемокинов (CXCL1, CXCL2, CXCL10, CCL2 и CCL3) и хемокиновых рецепторов (CXCR2 и CCR5), что свидетельствовало о снижении их провоспалительных возможностей. Предполагается, что нейтрофилы с низкой плотность являются незрелыми нейтрофилами. Важно отметить, что TGF-β способен индуцировать трансформацию нейтрофилов с высокой плотностью от мышей с опухолями в нейтрофилы с низкой плотностью, и в то же время этот фактор не влиял на нейтрофилы крови животных без опухолей [54]. Это указывает на то, что для такого изменения ОН у животных с раком необходимы и другие стимулы, помимо TGF-β. На основании этих результатов авторы предложили гипотезу, согласно которой три субпопуляции нейтрофилов могут присутствовать в крови при раке: нормальные нейтрофилы высокой плотности, незрелые нейтрофилы низкой плотности (G-MDSC) и крупные зрелые нейтрофилы низкой плотности. Эти типы клеток обладают разной функциональностью и пластичностью. Так, нейтрофилы с высокой плотностью являются противоопухолевыми, а низкой — клетками, способными стимулировать рост опухоли [67], они могут изменяться под влиянием различных хемокинов и цитокинов в микроокружении опухоли [17].
Очевидно, высокий уровень нейтрофилов в опухоли происходит под действием нейтрофил-притягивающих хемокинов, которые могут продуцироваться не только иммунными клетками, но и опухолевыми клетками, в частности интерлейкином-8 (IL-8/CXCL8).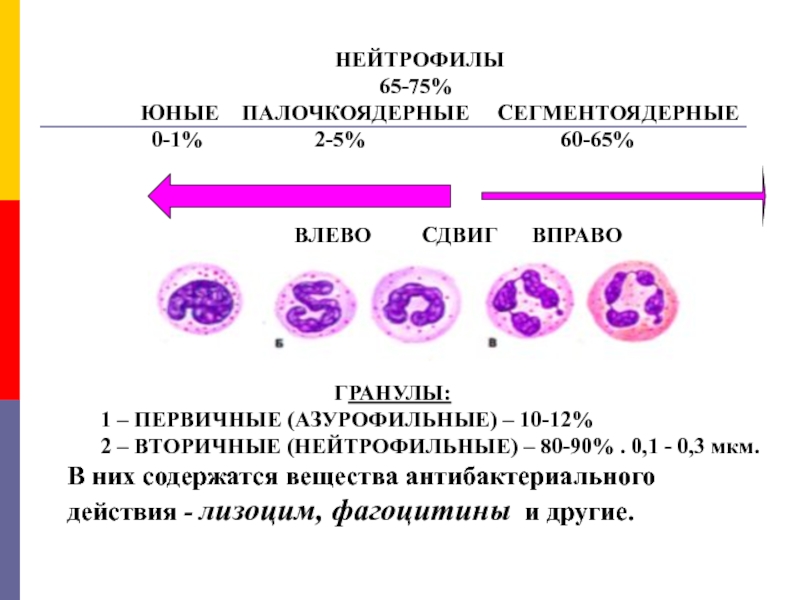 Другим хемокином, который также участвует в рекрутировании нейтрофилов в опухоли, является хемокин GCP-2/CXCL6. В мышиной модели меланомы специфические моноклональные антитела против CXCL6 уменьшали количество ОН, а также размер опухоли [56]. Кроме того, из карциноматозных опухолей человека выделен и идентифицирован фактор ингибирования миграции (MIF), уровень которого был высокий в опухолях с бóльшим содержанием ОН и низкой выживаемостью этих пациентов [57]. Используя те же рецепторы CXCR1 и CXCR2, нейтрофилы могут также реагировать и на другие хемокины, такие как CXCL1, CXCL2, CXCL5, CXCL6 и CXCL7 [58]. Не исключено, что нейтрофилы активируют сами себя по механизму положительной обратной связи, высвобождая нейтрофильные хемокины, которые привлекают больше нейтрофилов в опухоль, подобно миграции нейтрофилов в очаги инфекции [59]. При исследовании 919 пациентов с гепатоцеллюлярной карциномой выявлено, что CXCL5 сверхэкспрессируется у пациентов с рецидивирующими опухолями, уровни CXCL5 коррелировали с большим накоплением в опухоли нейтрофилов и с меньшей общей выживаемостью [60]. В частности, известно, что активированные Т-клетки продуцируют GM-CSF, CXCL1, CXCL2, TNF-α и IFN-γ [59]. Эти факторы могут прямо или косвенно привлекать больше нейтрофилов к опухоли. Хотя конкретные механизмы влияния активированных Т-клеток на миграцию нейтрофилов в опухоль изучены недостаточно.
Другим хемокином, который также участвует в рекрутировании нейтрофилов в опухоли, является хемокин GCP-2/CXCL6. В мышиной модели меланомы специфические моноклональные антитела против CXCL6 уменьшали количество ОН, а также размер опухоли [56]. Кроме того, из карциноматозных опухолей человека выделен и идентифицирован фактор ингибирования миграции (MIF), уровень которого был высокий в опухолях с бóльшим содержанием ОН и низкой выживаемостью этих пациентов [57]. Используя те же рецепторы CXCR1 и CXCR2, нейтрофилы могут также реагировать и на другие хемокины, такие как CXCL1, CXCL2, CXCL5, CXCL6 и CXCL7 [58]. Не исключено, что нейтрофилы активируют сами себя по механизму положительной обратной связи, высвобождая нейтрофильные хемокины, которые привлекают больше нейтрофилов в опухоль, подобно миграции нейтрофилов в очаги инфекции [59]. При исследовании 919 пациентов с гепатоцеллюлярной карциномой выявлено, что CXCL5 сверхэкспрессируется у пациентов с рецидивирующими опухолями, уровни CXCL5 коррелировали с большим накоплением в опухоли нейтрофилов и с меньшей общей выживаемостью [60]. В частности, известно, что активированные Т-клетки продуцируют GM-CSF, CXCL1, CXCL2, TNF-α и IFN-γ [59]. Эти факторы могут прямо или косвенно привлекать больше нейтрофилов к опухоли. Хотя конкретные механизмы влияния активированных Т-клеток на миграцию нейтрофилов в опухоль изучены недостаточно.
Нейтрофильные молекулы. Большой объем клинических данных показывает, что нейтрофилы участвуют в развитии рака и прогрессировании опухолей. В большинстве случаев увеличенное количество ОН ассоциируется с прогрессирующей болезнью и плохим прогнозом для больных онкологического профиля. Установлено, что такая отрицательная ассоциация характерна для ряда солидных опухолей, таких как меланома, гепатоцеллюлярная карцинома, немелкоклеточная карцинома легкого, глиома, аденокарцинома и рак толстой кишки [37, 61]. Предполагается, что в стимуляцию онкогенеза включаются те же молекулы, которые нейтрофилы используют для уничтожения микроорганизмов и модуляции воспаления [7].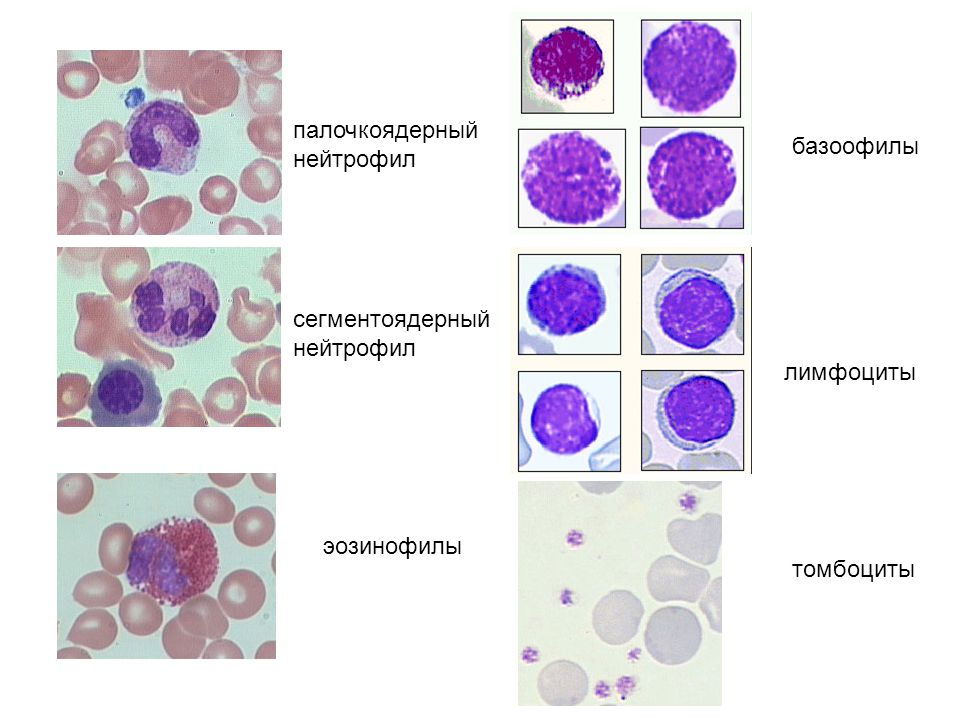 Важными молекулами, которые могут влиять на темп роста и инвазивность опухолей, являются гранулярные белки, деградирующие в матриксе протеиназы, реактивные виды кислорода, хемокины и цитокины [7]. В последнее время появились сообщения, описывающие, как ОН используют эти молекулы для воздействия на пролиферацию опухолевых клеток, ангиогенез, метастазы и иммунный надзор. Среди этих молекул следует выделить такие, как нейтрофильная эластаза (NE), катепсин, матриксная металлопротеиназа (MMP)-9 и др.
Важными молекулами, которые могут влиять на темп роста и инвазивность опухолей, являются гранулярные белки, деградирующие в матриксе протеиназы, реактивные виды кислорода, хемокины и цитокины [7]. В последнее время появились сообщения, описывающие, как ОН используют эти молекулы для воздействия на пролиферацию опухолевых клеток, ангиогенез, метастазы и иммунный надзор. Среди этих молекул следует выделить такие, как нейтрофильная эластаза (NE), катепсин, матриксная металлопротеиназа (MMP)-9 и др.
NE представляет собой основной белок азурофильных гранул, который выделяется при клеточной дегрануляции нейтрофилов. NE — сериновая протеаза с широким спектром субстратов. Помимо своей роли в воспалении и уничтожении бактерий, NE проявляет различные протуморогенные эффекты как in vivo, так и in vitro [62]. Выявлено, что NE непосредственно стимулирует пролиферацию опухолевых клеток A459, когда мышиные нейтрофилы культивировали вместе с клеточной линией карциномы легкого [62, 63]. Кроме того, также установлено, что NE стимулирует миграцию опухолевых клеток. Нейтрофилы человека при культивировании с клетками аденокарциномы поджелудочной железы стимулировали миграцию клеток опухоли из монослоя. NE также повышала миграционную способность раковых клеток пищевода [64].
Катепсин G представляет собой пептидазу из азурофильных гранул, которая участвует в деградации фагоцитированных микроорганизмов и ремоделировании белков внеклеточного матрикса [98]. Кроме того, катепсин G может стимулировать ангиогенез и миграцию опухолевых клеток [65–67]. На модели метастазирования рака грудной железы в костную ткань также показано, что катепсин G усиливает передачу сигналов TGF-β и повышает уровень сосудистого эндотелиального фактора роста (VEGF) для стимуляции ангиогенеза [66].
MMP-9 — желатиназа B — высвобождается из вторичных (специфических) гранул и, как установлено, приводит к пролиферации опухолей кожи человека вирусом папилломы человека 16-го типа (HPV-16). Кроме того, иммуногистохимическое исследование MMP-9 в плоскоклеточных опухолях карциномы показало, что MMP-9 присутствовала только в опухолевых инфильтрирующих лейкоцитах, а не в самих опухолевых клетках. Показано, что MMP-9 ингибирует апоптоз опухолевых клеток при раке легкого [68]. Таким образом, ММП-9 ответственна за усиление роста опухоли как за счет увеличения пролиферации клеток, так и уменьшения их апоптоза. Другим важным эффектом MMP-9, который поддерживает рост опухоли, является ангиогенез. Протеолитическое высвобождение VEGF из тканевого матрикса при действии MMPs считается необходимым условием ангиогенеза in vivo [68, 69]. Ангиогенный эффект MMP-9 зарегистрирован в нескольких моделях рака — меланоме, аденокарциноме поджелудочной железы [70–72].
Кроме того, иммуногистохимическое исследование MMP-9 в плоскоклеточных опухолях карциномы показало, что MMP-9 присутствовала только в опухолевых инфильтрирующих лейкоцитах, а не в самих опухолевых клетках. Показано, что MMP-9 ингибирует апоптоз опухолевых клеток при раке легкого [68]. Таким образом, ММП-9 ответственна за усиление роста опухоли как за счет увеличения пролиферации клеток, так и уменьшения их апоптоза. Другим важным эффектом MMP-9, который поддерживает рост опухоли, является ангиогенез. Протеолитическое высвобождение VEGF из тканевого матрикса при действии MMPs считается необходимым условием ангиогенеза in vivo [68, 69]. Ангиогенный эффект MMP-9 зарегистрирован в нескольких моделях рака — меланоме, аденокарциноме поджелудочной железы [70–72].
Прямое доказательство того, что нейтрофилы являются основным, ассоциированным с опухолью лейкоцитарным типом, экспрессирующим MMP-9, предоставлено в исследовании с использованием человеческих ксенотрансплантатов и сингенных опухолей в эксперименте на мышах [73]. Когда опухоли или изолированные из них макрофаги или нейтрофилы были дважды окрашены для выявления MMP-9 и соответствующих антигенов макрофагов или нейтрофилов, только ОН содержали большое количество MMP-9 [74, 75]. Кроме того, подсчитано, что 1•10 нейтрофилов в крови или ОН могут высвобождать приблизительно 100–200 нг проМMP-9 в течение 1–2 ч инкубации. Напротив, для макрофагов 1•10 потребуется несколько недель для получения такого же количества проММР-9 [73, 74]. Следовательно, MMP-9, полученная из нейтрофилов, ответственна за усиление ангиогенеза за счет высвобождения VEGF из внеклеточного матрикса, что отмечается при многих типах опухолей. С внеклеточным матриксом связывают и другие процессы онкогенеза, например метастазирование опухолей [75, 76].
Нейтрофилы являются эффективными производителями АФК для уничтожения микроорганизмов. АФК также может косвенно способствовать росту опухоли. Во-первых, нейтрофилы генерируют пероксид водорода (H2O2), который затем превращается в гипохлорид (HOCl) с помощью миелопероксидазы. HOCl затем может активировать несколько MMPs, включая MMP-2, -7, -8 и -9. Кроме того, HOCl может блокировать ингибитор МMP-1 и таким образом потенцировать протеолитическую активность MMPs [77, 78].
HOCl затем может активировать несколько MMPs, включая MMP-2, -7, -8 и -9. Кроме того, HOCl может блокировать ингибитор МMP-1 и таким образом потенцировать протеолитическую активность MMPs [77, 78].
Выделенная из гранул нейтрофилов ARG1 способна разрушать внеклеточный аргинин, незаменимую аминокислоту для активации Т-клеток. Таким образом, дегрануляция нейтрофилов может оказывать иммуносупрессивный эффект в опухолях, ингибируя опухольинфильтрирующие Т-клетки таким же образом, как описано для G-MDSC [79]. Показано, что истощение ОН у опухольсодержащих животных увеличило число активированных CD8 T-клеток, способствовало уменьшению размера опухолей и удлиняло время жизни животных [15].
Нейтрофилы могут также продуцировать цитокины или факторы роста, которые увеличивают туморогенный потенциал раковых клеток [5]. Это пока что установлено для двух цитокинов — онкостатина-M [79–81] и для фактора роста гепатоцитов [10, 82, 83]. Раковые клетки грудной железы могут стимулировать нейтрофилы к выделению онкостатина-М, IL-6-подобного цитокина. Онкостатин-М, в свою очередь, стимулировал клетки рака грудной железы секретировать VEGF [84]. Аналогично, клетки гепатоцеллюлярной карциномы стимулировали нейтрофилы высвобождать фактор роста гепатоцитов (HGF). В свою очередь, этот фактор стимулировал инвазивный рост опухолевых клеток [85].
Нейтрофилы также могут влиять на миграционный потенциал раковых клеток. При нескольких типах рака показано, что нейтрофилы способствуют метастазированию плоскоклеточного рака кожи [86], меланомы [87], аденокарциномы [88] и рака грудной железы [89]. Способ, которым нейтрофилы повышают миграционную активность опухолевых клеток, может включать несколько различных механизмов. Циркулирующие опухолевые клетки непосредственно прилипают к сосудистому эндотелию, приводя к экстравазации для создания новых метастазов. В месте образования метастатического очага клетками рака легкого отмечалась их тесная связь с нейтрофилами [90]. В этом процессе нейтрофилы усиливают задержку опухолевых клеток, и, как следствие, возникает больше метастазов [91]. Показано прямое взаимодействие между клетками нейтрофилов и клетками карциномы грудной железы путем взаимодействия молекул адгезии ICAM-1 в опухолевых клетках и β2-интегринов на нейтрофилах. Нейтрофилы связывали опухолевые клетки с участием интегринов и индуцировали кластеризацию ICAM-1 в опухолевой клетке [91]. Это активировало в опухолевой клетке сигнальный путь с участием фокальной адгезии киназы (FAK) и p38-MAPK, что привело к усиленной миграции [89]. Вследствие этого повышенная миграция, как показано in vivo, приводила к увеличению количества метастазов в печени [92]. Раковые клетки непосредственно прикреплялись поверх адгезированных нейтрофилов, которые выступали в качестве мостика при взаимодействии между опухолевыми клетками и паренхимой печени, что ускоряло развитие метастазов [93].
Показано прямое взаимодействие между клетками нейтрофилов и клетками карциномы грудной железы путем взаимодействия молекул адгезии ICAM-1 в опухолевых клетках и β2-интегринов на нейтрофилах. Нейтрофилы связывали опухолевые клетки с участием интегринов и индуцировали кластеризацию ICAM-1 в опухолевой клетке [91]. Это активировало в опухолевой клетке сигнальный путь с участием фокальной адгезии киназы (FAK) и p38-MAPK, что привело к усиленной миграции [89]. Вследствие этого повышенная миграция, как показано in vivo, приводила к увеличению количества метастазов в печени [92]. Раковые клетки непосредственно прикреплялись поверх адгезированных нейтрофилов, которые выступали в качестве мостика при взаимодействии между опухолевыми клетками и паренхимой печени, что ускоряло развитие метастазов [93].
Несмотря на большое количество доказательств отрицательной роли нейтрофилов во время прогрессирования опухоли, имеются также четкие свидетельства положительной роли нейтрофилов в канцерогенезе. Как упоминалось ранее, нейтрофилы могут проявлять противоопухолевую активность в различных формах. Фактически, противоопухолевая способность нейтрофилов установлена давно, более трех десятилетий назад. Нейтрофилы могут непосредственно уничтожать опухолевые клетки как in vitro [36], так и in vivo [37]. Нейтрофилы потенцируют этот противоопухолевый эффект, когда они активированы. Важность ОН типа Н1 в противоопухолевых реакциях также подчеркивается экспериментальными исследованиями о том, что истощение уровня нейтрофилов в крови приводит к увеличению роста опухоли [15, 93, 94]. Очевидно, что нейтрофилы обладают потенциалом непосредственного уничтожения опухолевых клеток. Механизмы, посредством которых нейтрофилы выполняют эту функцию, многочисленны и еще не полностью изучены, но они включают в себя многие уже известные механизмы антиинфекционной защиты [7].
ЗАКЛЮЧЕНИЕ
Таким образом, согласно представленным выше кратким сведениям подчеркивается двойной противоопухолевый и протуморальный потенциал нейтрофилов и предполагается, что нейтрофилы могут быть использованы для усиления различных противоопухолевых реакций в организме.
Хотя во многих случаях наличие нейтрофилов в опухолях оказывает негативное влияние на течение раковой болезни, эти клетки, несомненно, обладают способностью разрушать опухолевые клетки. Сегодня рассматривается около десяти новых терапевтических стратегий и подходов для усиления противоопухолевого потенциала нейтрофилов или блокирования доступа ОН к растущим опухолям, такие как активация нейтрофилов интерфероном, синтез и накопление высоких уровней провоспалительных цитокинов в опухоли, которые могут убивать опухолевые клетки, блокирование инфильтрации нейтрофилами опухоли и многие другие. Как указывалось выше, в некоторых опухолях образуются хемокины, главным образом IL-8, которые привлекают нейтрофилы в опухолевый очаг. Показано, что применение антагонистов IL-8 (таких как полностью гуманизированное нейтрализующее моноклональное антитело ABX-IL8) к IL-8 уменьшает рост опухоли, метастазы и ангиогенез меланомы и рака легкого [95]. Наличие двух фенотипов Н1 и Н2 нейтрофилов, предполагает также, что, влияя на микроокружение опухоли, можно манипулировать ОН и генерировать большее количество противоопухолевых нейтрофилов. Также получены многообещающие результаты с использованием моноклональных терапевтических антител, индуцирующих нейтрофилы для выполнения антителозависимой цитотоксичности и высвобождения цитокинов, которые модулируют иммунный противоопухолевый ответ [96, 97].
На развитие опухоли оказывают влияние многие типы клеток организма, в том числе ОН. Точная роль ОН до конца не установлена, и ее предстоит еще выяснить. В настоящее время широко изучаются разные способы привлечения их в опухоль и превращения Н1 нейтрофилов в противоопухолевые эффекторные клетки. Научиться переворачивать «монеты» нейтрофилов на «выигрышную сторону», как считают E. Uribe-Querol и C. Rosales [98], а именно, заставить действовать их как противоопухолевые эффекторные клетки, является вызовом и задачей для будущих исследований, что, возможно, позволит усовершенствовать существующие методы лечения рака.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Borregaard N. (2010) Neutrophils, from marrow to microbes. Immunity, 33(5): 657–670. doi: 10.1016/j.immuni.2010.11.011.
2. Kolaczkowska E., Kubes P. (2013) Neutrophil recruitment and function in health and inflammation. Nat. Rev. Immunol., 13(3): 159–175. doi: 10.1038/nri3399.
3. Pham C.T.N. (2006) Neutrophil serine proteases: specific regulators of inflammation. Nat. Rev. Immunol., 6(7): 541–550. doi: 10.1038/nri1841.
4. Scapini P., Lapinet-Vera J.A., Gasperini S. et al. (2000) The neutrophil as a cellular source of chemokines. Immunol. Rev., 177: 195–203. doi: 10.1034/j.1600-065x.2000.17706.
5. Tecchio C., Scapini P., Pizzolo G., Cassatella M.A. (2013) On the cytokines produced by human neutrophils in tumors. Sem. Cancer Biol., 23(3): 159–170. doi: 10.1016/j.semcancer.2013.02.004.
6. Mantovani A., Allavena P., Sica A., Balkwill F. (2008) Cancer-related inflammation. Nature, 454 (7203): 436–444. doi: 10.1038/nature07205.
7. Бережная Н.М., Чехун В.Ф. (2005) Иммунология злокачественного роста. Наукова думка, Киев, 791 с.
8. Gregory A.D., Houghton A.M. (2011) Tumor-associated neutrophils: new targets for cancer therapy. Cancer Res., 71(7): 2411–2416. doi: 10.1158/0008-5472.can-10-2583.
9. Mantovani A., Cassatella M.A., Costantini C., Jaillon S. (2011) Neutrophils in the activation and regulation of innate and adaptive immunity. Nat. Rev. Immunol., 11(8): 519–531. doi: 10.1038/nri3024.
10. Wislez M., Rabbe N., Marchal J. et al. (2003) Hepatocyte growth factor production by neutrophils infiltrating bronchioloalveolar subtype pulmonary adenocarcinoma: role in tumor progression and death. Cancer Res., 63(6): 1405–1412.
11. Schmidt H., Bastholt L., Geertsen P. et al. (2005) Elevated neutrophil and monocyte counts in peripheral blood are associated with poor survival in patients with metastatic melanoma: a prognostic model. Brit. J. Cancer, 93(3): 273–278. doi: 10.1038/sj.bjc.6602702.
doi: 10.1038/sj.bjc.6602702.
12. Jensen H.K., Donskov F., Marcussen N. et al. (2009) Presence of intratumoral neutrophils is an independent prognostic factor in localized renal cell carcinoma. J. Clin. Oncol., 27(28): 4709–4717. doi: 10.1200/jco.2008.18.9498.
13. Trellakis S., Bruderek K., Dumitru C.A. et al. (2011) Polymorphonuclear granulocytes in human head and neck cancer: enhanced inflammatory activity, modulation by cancer cells and expansion in advanced disease. Int. J. Cancer, 129(9): 2183–2193. doi: 10.1002/ijc.25892.
14. Fridlender Z.G., Albelda S.M. (2012) Tumor-associated neutrophils: friend or foe? Carcinogenesis, 33(5): 949–955. doi: 10.1093/carcin/bgs123.
15. Fridlender Z.G., Sun J., Kim S. et al. (2009) Polarization of tumor-associated neutrophil phenotype by TGF-β: ‘N1’ versus ‘N2’ TAN. Cancer Cell, 16(3): 183–194. doi: 10.1016/j.ccr.2009.06.017. [PMC free article].
16. Galdiero M.R., Garlanda C., Jaillon S. et al. (2013) Tumor associated macrophages and neutrophils in tumor progression. J. Cell. Physiol., 228(7): 1404–1412. doi: 10.1002/jcp.24260.
17. Sionov R.V., Fridlender Z.G., Granot Z. (2014) The multifaceted roles neutrophils play in the tumor microenvironment. Cancer Microenviron., 1–34. doi: 10.1007/s12307-014-0147-5.
18. Swierczak A., Mouchemore K.A., Hamilton J.A., Anderson R.L. (2015) Neutrophils: important contributors to tumor progression and metastasis. Cancer and Metastasis Rev., 34(4): 735–751. doi: 10.1007/s10555-015-9594-9.
19. McGary C.T., Miele M.E., Welch D.R. (1995) Highly metastatic 13762NF rat mammary adenocarcinoma cell clones stimulate bone marrow by secretion of granulocyte-macrophage colony-stimulating factor/interleukin-3 activity. Am. J. Pathol., 147(6): 1668–1681.
20. Lechner M.G., Liebertz D.J., Epstein A.L. (2010) Characterization of cytokine-induced myeloid-derived suppressor cells from normal human peripheral blood mononuclear cells. J. Immunol., 185(4): 2273–2284.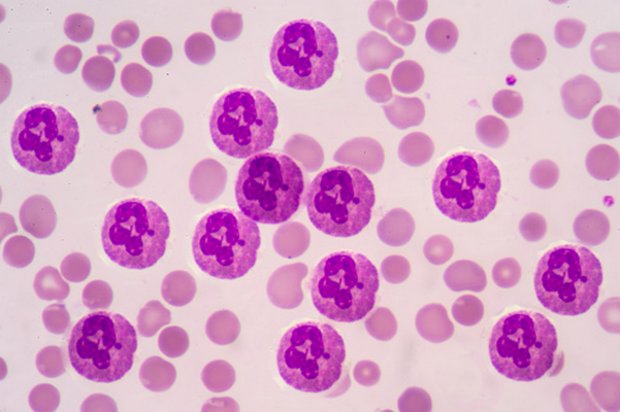 doi: 10.4049/jimmunol.1000901.
doi: 10.4049/jimmunol.1000901.
21. Atzpodien J., Reitz M. (2008) Peripheral blood neutrophils as independent immunologic predictor of response and long-term survival upon immunotherapy in metastatic renal-cell carcinoma. Cancer Biother. Radiopharm., 23(1): 129–134. doi: 10.1089/cbr.2007.0429.
22. Bellocq A., Antoine M., Flahault A. et al. (1998) Neutrophil alveolitis in bronchioloalveolar carcinoma: induction by tumor-derived interleukin-8 and relation to clinical outcome. Am. J. Pathol., 152(1): 83–92.
23. Reid M.D., Basturk O., Thirabanjasak D. et al. (2011) Tumor-infiltrating neutrophils in pancreatic neoplasia. Modern Pathol., 24(12): 1612–1619. doi: 10.1038/modpathol.2011.113.
24. Halazun K.J., Hardy M.A., Rana A.A. et al. (2009) Negative impact of neutrophil-lymphocyte ratio on outcome after liver transplantation for hepatocellular carcinoma. Ann. Surg., 250(1): 141–151. doi: 10.1097/SLA.0b013e3181a77e59.
25. Walsh S.R., Cook E.J., Goulder F. et al. (2005) Neutrophil-lymphocyte ratio as a prognostic factor in colorectal cancer. J. Surg. Oncol., 91(3): 181–184. doi: 10.1002/jso.20329.
26. Peng B., Wang Y.-H., Liu Y.-M., Ma L.-X. (2015) Prognostic significance of the neutrophil to lymphocyte ratio in patients with non-small cell lung cancer: a systemic review and meta-analysis. Int. J. Clin. Exp. Med., 8(3): 3098–3106.
27. Malietzis G., Giacometti M., Kennedy R.H. et al. (2014) The emerging role of neutrophil to lymphocyte ratio in determining colorectal cancer treatment outcomes: a systematic review and meta-analysis. Ann. Surg. Oncol., 21(12): 3938–3946. doi: 10.1245/s10434-014-3815-2.
28. Krenn-Pilko S., Langsenlehner U., Thurner E.-M. et al. (2014) The elevated preoperative derived neutrophil-to-lymphocyte ratio predicts poor clinical outcome in breast cancer patients. Brit. J. Cancer, 110(10): 2524–2530. doi: 10.1038/bjc.2014.163.
29. Pistelli M., De Lisa M., Ballatore Z. et al. (2015) Pre-treatment neutrophil to lymphocyte ratio may be a useful tool in predicting survival in early triple negative breast cancer patients. BMC Cancer, 15, article 195. doi: 10.1186/s12885-015-1204-2.
BMC Cancer, 15, article 195. doi: 10.1186/s12885-015-1204-2.
30. Guthrie G.J.K., Charles K.A., Roxburgh C.S.D. et al. (2013) The systemic inflammation-based neutrophil-lymphocyte ratio: experience in patients with cancer. Crit. Rev. Oncol. Hematol., 88(1): 218–230. doi: 10.1016/j.critrevonc.2013.03.010.
31. Templeton A.J., McNamara M.G., Šeruga B. et al. (2014) Prognostic role of neutrophil-to-lymphocyte ratio in solid tumors: a systematic review and meta-analysis. J. Nat. Cancer Institute, 106(6). doi: 10.1093/jnci/dju124.dju124.
32. Paramanathan A., Saxena A., Morris D.L. (2014) A systematic review and meta-analysis on the impact of pre-operative neutrophil lymphocyte ratio on long term outcomes after curative intent resection of solid tumours. Surg. Oncol., 23(1): 31–39. doi: 10.1016/j.suronc.2013.12.001.
33. Caruso R.A., Bellocco R., Pagano M. et al. (2002) Prognostic value of intratumoral neutrophils in advanced gastric carcinoma in a high-risk area in Northern Italy. Modern Pathol., 15(8): 831–837. doi: 10.1097/01.mp.0000020391.98998.6b.
34. Pickaver A.H., Ratcliffe N.A., Williams A.E., Smith H. (1972) Cytotoxic effects of peritoneal neutrophils on a syngeneic rat tumour. Nature: New biology, 235(58): 186–187.
35. Gerrard T.L., Cohen D.J., Kaplan A.M. (1981) Human neutrophil-mediated cytotoxicity to tumor cells. J. Natl Cancer Inst., 66(3): 483–488 (19820701) 50:160;62::aid-cncr282050011362;3.0.co;2-0.
36. Katano M., Torisu M. (1982) Neutrophil-mediated tumor cell destruction in cancer ascites. Cancer, 50(1): 62–68. doi: 10.1002/1097-0142.
37. Brandau S., Dumitru C.A., Lang S. (2013) Protumor and antitumor functions of neutrophil granulocytes. Seminars in Immunopathology, 35(2): 163–176. doi: 10.1007/s00281-012-0344-6.
38. Almand B., Clark J.I., Nikitina E. et al. (2001) Increased production of immature myeloid cells in cancer patients: a mechanism of immunosuppression in cancer. J. Immunol., 166(1): 678–689. doi: 10.4049/jimmunol.166.1.678.
doi: 10.4049/jimmunol.166.1.678.
39. Choi J., Suh B., Ahn Y. et al. (2012) CD15+/CD16 human granulocytes from terminal cancer patients: granulocytic myeloid-derived suppressor cells that have suppressive function. Tumor Biology, 33(1): 121–129. doi: 10.1007/s13277-011-0254-6.
40. Peranzoni E., Zilio S., Marigo I. et al. (2010) Myeloid-derived suppressor cell heterogeneity and subset definition. Curr. Opin. Immunol., 22(2): 238–244. doi: 10.1016/j.coi.2010.01.021.
41. Raber P.L., Thevenot P., Sierra R. et al. (2014) Subpopulations of myeloid-derived suppressor cells impair T cell responses through independent nitric oxide-related pathways. Int. J. Cancer, 134(12): 2853–2864. doi: 10.1002/ijc.28622.
42. Youn J.-I., Nagaraj S., Collazo M., Gabrilovich D.I. (2008) Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol., 181(8): 5791–5802. doi: 10.4049/jimmunol.181.8.5791.
43. Gabrilovich D.I., Nagaraj S. (2009) Myeloid-derived suppressor cells as regulators of the immune system. Nat. Rev. Immunol., 9(3): 162–174. doi: 10.1038/nri2506.
44. Nagaraj S., Schrum A.G., Cho H.-I. et al. (2010) Mechanism of T cell tolerance induced by myeloid-derived suppressor cells. J. Immunol., 184(6): 3106–3116. doi: 10.4049/jimmunol.0902661.
45. Favaloro J., Liyadipitiya T., Brown R. et al. (2014) Myeloid derived suppressor cells are numerically, functionally and phenotypically different in patients with multiple myeloma. Leukemia & Lymphoma, 55(12): 2893–2900. doi: 10.3109/10428194.2014.904511.
46. Raychaudhuri B., Rayman P., Huang P. et al. (2015) Myeloid derived suppressor cell infiltration of murine and human gliomas is associated with reduction of tumor infiltrating lymphocytes. J. Neuro-Oncology, 122: 293–301. doi: 10.1007/s11060-015-1720-6.
47. Gallamini A., Di Raimondo F., La Nasa G. et al. (2013) Standard therapies versus novel therapies in Hodgkin lymphoma. Immunol. Letters, 155(1–2): 56–59. doi: 10.1016/j.imlet.2013.09.011.
doi: 10.1016/j.imlet.2013.09.011.
48. Trellakis S., Bruderek K., Hütte J. et al. (2013) Granulocytic myeloid-derived suppressor cells are cryosensitive and their frequency does not correlate with serum concentrations of colony-stimulating factors in head and neck cancer. Innate Immunity, 19(3): 328–336. doi: 10.1177/1753425912463618.
49. Schmielau J., Finn O.J. (2001) Activated granulocytes and granulocyte-derived hydrogen peroxide are the underlying mechanism of suppression of T-cell function in advanced cancer patients. Cancer Res., 61(12): 4756–4760.
50. Nagaraj S., Gupta K., Pisarev V. et al. (2007) Altered recognition of antigen is a mechanism of CD8+ T cell tolerance in cancer. Nat. Med., 13(7): 828–835. doi: 10.1038/nm1609.
51. Mishalian I., Bayuh R., Levy L. et al. (2013) Tumor-associated neutrophils (TAN) develop pro-tumorigenic properties during tumor progression. Cancer Immunol., Immunother., 62(11): 1745–1756. doi: 10.1007/s00262-013-1476-9.
52. Eruslanov E.B., Bhojnagarwala P.S., Quatromoni J.G. et al. (2014) Tumor-associated neutrophils stimulate T cell responses in early-stage human lung cancer. J. Clin. Invest., 124(12): 5466–5480. doi: 10.1172/JCI77053.
53. Wu P., Wu D., Ni C. et al. (2014) γδT17 cells promote the accumulation and expansion of myeloid-derived suppressor cells in human colorectal cancer. Immunity, 40(5): 785–800. doi: 10.1016/j.immuni.2014.03.013.
54. Sagiv J.Y., Michaeli J., Assi S. et al. (2015) Phenotypic diversity and plasticity in circulating neutrophil subpopulations in cancer. Cell Reports, 10(4): 562–573. doi: 10.1016/j.celrep.2014.12.039.
55. García-García E., Uribe-Querol E., Rosales C. (2013) A simple and efficient method to detect nuclear factor activation in human neutrophils by flow cytometry. J. Vis. Exp. (74). doi: 10.3791/50410.e50410 [PMC free article] [PubMed] [Cross Ref10.1016/j.celrep.2014.12.039].
56. Verbeke H., Struyf S., Berghmans N. et al. (2011) Isotypic neutralizing antibodies against mouse GCP-2/CXCL6 inhibit melanoma growth and metastasis.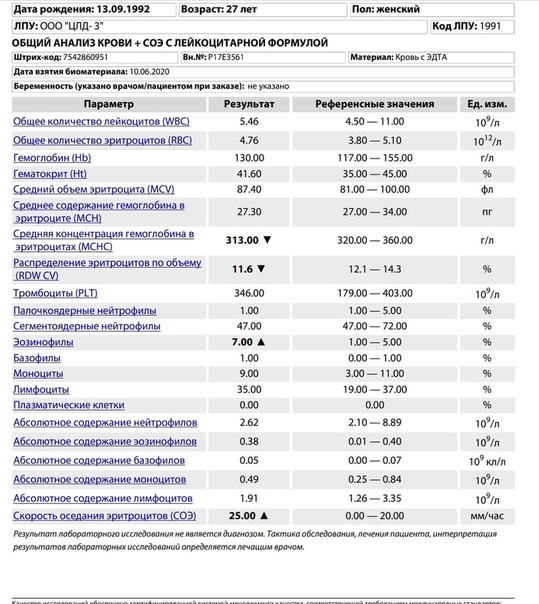 Cancer Letters, 302(1): 54–62. doi: 10.1016/j.canlet.2010.12.013.
Cancer Letters, 302(1): 54–62. doi: 10.1016/j.canlet.2010.12.013.
57. Dumitru C.A., Gholaman H., Trellakis S. et al. (2011) Tumor-derived macrophage migration inhibitory factor modulates the biology of head and neck cancer cells via neutrophil activation. Int. J. Cancer, 129(4): 859–869. doi: 10.1002/ijc.25991. [PubMed] [Cross Ref.].
58. Lazennec G., Richmond A. (2010) Chemokines and chemokine receptors: new insights into cancer-related inflammation. Trends Mol. Med., 16(3): 133–144. doi: 10.1016/j.molmed.2010.01.003. [PMC free article] [PubMed] [Cross Ref.].
59. Kobayashi Y. (2008) The role of chemokines in neutrophil biology. Front. Bioscie., 13(7): 2400–2407. doi: 10.2741/2853. [PubMed] [Cross Ref.].
60. Okabe H., Beppu T., Ueda M. et al. (2012) Identification of CXCL5/ENA-78 as a factor involved in the interaction between cholangiocarcinoma cells and cancer-associated fibroblasts. Int. J. Cancer, 131(10): 2234–2241. doi: 10.1002/ijc.27496.
61. Dumitru C.A., Moses K., Trellakis S. et al. (2012) Neutrophils and granulocytic myeloid-derived suppressor cells: immunophenotyping, cell biology and clinical relevance in human oncology. Cancer Immunol., Immunother., 61(8): 1155–1167. doi: 10.1007/s00262-012-1294-5.
62. Houghton A.M., Rzymkiewicz D.M., Ji H. et al. (2010) Neutrophil elastase-mediated degradation of IRS-1 accelerates lung tumor growth. Nat. Med., 16(2): 219–223. doi: 10.1038/nm.2084.
63. Wada Y., Yoshida K., Tsutani Y. et al. (2007) Neutrophil elastase induces cell proliferation and migration by the release of TGF-α, PDGF and VEGF in esophageal cell lines. Oncol. Reports, 17(1): 161–167.
64. Segal A.W. (2005) How neutrophils kill microbes. Ann. Rev. Immunol., 23: 197–223. doi: 10.1146/annurev.immunol.23.021704.115653.
65. Morimoto-Kamata R., Mizoguchi S.-I., Ichisugi T., Yui S. (2012) Cathepsin G induces cell aggregation of human breast cancer MCF-7 cells via a 2-step mechanism: Catalytic site-independent binding to the cell surface and enzymatic activity-dependent induction of the cell aggregation. Mediators Inflamm., 2012: 13. doi: 10.1155/2012/456462.456462.
Mediators Inflamm., 2012: 13. doi: 10.1155/2012/456462.456462.
66. Wilson T.J., Nannuru K.C., Futakuchi M., Singh R.K. (2010) Cathepsin G-mediated enhanced TGF-β signaling promotes angiogenesis via upregulation of VEGF and MCP-1. Cancer Letters, 288(2): 162–169. doi: 10.1016/j.canlet.2009.06.035.
67. Yui S., Osawa Y., Ichisugi T., Morimoto-Kamata R. (2014) Neutrophil cathepsin G, but not elastase, induces aggregation of MCF-7 mammary carcinoma cells by a protease activity-dependent cell-oriented mechanism. Mediators Inflamm., 2014: 12. doi: 10.1155/2014/971409.971409.
68. Acuff H.B., Carter K.J., Fingleton B. et al. (2006) Matrix metalloproteinase-9 from bone marrow-derived cells contributes to survival but not growth of tumor cells in the lung microenvironment. Cancer Res., 66(1): 259–266. doi: 10.1158/0008-5472.can-05-2502.
69. Ebrahem Q., Chaurasia S.S., Vasanji A. et al. (2010) Cross-talk between vascular endothelial growth factor and matrix metalloproteinases in the induction of neovascularization in vivo. Am. J. Pathol., 176(1): 496–503. doi: 10.2353/ajpath.2010.080642.
70. Hawinkels L.J.A.C., Zuidwijk K., Verspaget H.W. et al. (2008) VEGF release by MMP-9 mediated heparan sulphate cleavage induces colorectal cancer angiogenesis. Eur. J. Cancer, 44(13): 1904–1913. doi: 10.1016/j.ejca.2008.06.031.
71. Coillie E.V., Aelst I.V., Wuyts A. et al. (2001) Tumor angiogenesis induced by granulocyte chemotactic protein-2 as a countercurrent principle. Am. J. Pathol., 159(4): 1405–1414. doi: 10.1016/s0002-9440(10)62527-8.
72. Bergers G., Brekken R., McMahon G. et al. (2000) Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis. Nat. Cell Biol., 2(10): 737–744. doi: 10.1038/35036374.
73. Deryugina E.I., Zajac E., Juncker-Jensen A. et al. (2014) Tissue-infiltrating neutrophils constitute the major in vivo source of angiogenesis-inducing MMP-9 in the tumor microenvironment. Neoplasia, 16(10): 771–788. doi: 10.1016/j.neo.2014.08.013.
doi: 10.1016/j.neo.2014.08.013.
74. Deryugina E.I., Quigley J.P. (2015) Tumor angiogenesis: MMP-mediated induction of intravasation- and metastasis-sustaining neovasculature. Matrix Biology, 44.
75. Бережная Н.М., Чехун В.Ф. (2016) Физиологическая система соединительной ткани и онкогенез. Экстрацеллюлярный матрикс и метастазирование. Онкология, 18(3): 164–176.
76. Чехун В.Ф., Бережная Н.М. (2017) Физиологическая система соединительной ткани и онкогенез. Формирование резистентности к химиопрепаратам. Онкология, 19(3): 156–170.
77. De Larco J.E., Wuertz B.R.K., Furcht L.T. (2004) The potential role of neutrophils in promoting the metastatic phenotype of tumors releasing interleukin-8. Clin. Cancer Res., 10(15): 4895–4900. doi: 10.1158/1078-0432.ccr-03-0760.
78. Shabani F., McNeil J., Tippett L. (1998) The oxidative inactivation of tissue inhibitor of metalloproteinase-1 (TIMP-1) by hypochlorous acid (HOCl) is suppressed by anti-rheumatic drugs. Free Radical Res., 28(2): 115–123. doi: 10.3109/10715769809065797.
79. Cross A., Edwards S.W., Bucknall R.C., Moots R.J. (2004) Secretion of oncostatin M by neutrophils in rheumatoid arthritis. Arthritis Rheum., 50(5): 1430–1436. doi: 10.1002/art.20166.
80. Goren I., Kämpfer H., Müller E. et al. (2006) Oncostatin M expression is functionally connected to neutrophils in the early inflammatory phase of skin repair: implications for normal and diabetes-impaired wounds. J. Invest. Dermatol., 126(3): 628–637. doi: 10.1038/sj.jid.5700136.
81. Grenier A., Combaux D., Chastre J. et al. (2001) Oncostatin M production by blood and alveolar neutrophils during acute lung injury. Lab. Invest., 81(2): 133–141. doi: 10.1038/labinvest.3780220.
82. Grenier A., Chollet-Martin S., Crestani B. et al. (2002) Presence of a mobilizable intracellular pool of hepatocyte growth factor in human polymorphonuclear neutrophils. Blood, 99(8): 2997–3004. doi: 10.1182/blood.v99.8.2997.
83. Matsushima A. , Ogura H., Koh T. et al. (2004) Hepatocyte growth factor in polymorphonuclear leukocytes is increased in patients with systemic inflammatory response syndrome. J. Trauma, 56(2): 259–264. doi: 10.1097/01.ta.0000111752.60500.da.
, Ogura H., Koh T. et al. (2004) Hepatocyte growth factor in polymorphonuclear leukocytes is increased in patients with systemic inflammatory response syndrome. J. Trauma, 56(2): 259–264. doi: 10.1097/01.ta.0000111752.60500.da.
84. Queen M.M., Ryan R.E., Holzer R.G. et al. (2005) Breast cancer cells stimulate neutrophils to produce oncostatin M: potential implications for tumor progression. Cancer Res., 65(19): 8896–8904. doi: 10.1158/0008-5472.can-05-1734.
85. Imai Y., Kubota Y., Yamamoto S. et al. (2005) Neutrophils enhance invasion activity of human cholangiocellular carcinoma and hepatocellular carcinoma cells: an in vitro study. J. Gastroenterol. Hepatol., 20(2): 287–293. doi: 10.1111/j.1440-1746.2004.03575.x.
86. Loukinova E., Dong G., Enamorado-Ayalya I. et al. (2000) Growth regulated oncogene-alpha expression by murine squamous cell carcinoma promotes tumor growth, metastasis, leukocyte infiltration and angiogenesis by a host CXC receptor-2 dependent mechanism. Oncogene, 19(31): 3477–3486. doi: 10.1038/sj.onc.1203687.
87. Schaider H., Oka M., Bogenrieder T. et al. (2003) Differential response of primary and metastatic melanomas to neutrophils attracted by IL-8. Int. J. Cancer, 103(3): 335–343. doi: 10.1002/ijc.10775.
88. Welch D.R., Schissel D.J., Howrey R.P., Aeed P.A. (1989) Tumor-elicited polymorphonuclear cells, in contrast to ‘normal’ circulating polymorphonuclear cells, stimulate invasive and metastatic potentials of rat mammary adenocarcinoma cells. Proceedings of the National Academy of Sciences of the United States of America, 86(15): 5859–5863. doi: 10.1073/pnas.86.15.5859.
89. Strell C., Lang K., Niggemann B. et al. (2010) Neutrophil granulocytes promote the migratory activity of MDA-MB-468 human breast carcinoma cells via ICAM-1. Exp. Cell Res., 316(1): 138–148. doi: 10.1016/j.yexcr.2009.09.003.
90. Crissman J.D., Hatfield J., Schaldenbrand M. et al. (1985) Arrest and extravasation of B16 amelanotic melanoma in murine lungs. A light and electron microscopic study. Lab. Invest., 53(4): 470–478.
A light and electron microscopic study. Lab. Invest., 53(4): 470–478.
91. Huh S.J., Liang S., Sharma A. et al. (2010) Transiently entrapped circulating tumor cells interact with neutrophils to facilitate lung metastasis development. Cancer Res., 70(14): 6071–6082. doi: 10.1158/0008-5472.can-09-4442.
92. Spicer J.D., McDonald B., Cools-Lartigue J.J. et al. (2012) Neutrophils promote liver metastasis via Mac-1-mediated interactions with circulating tumor cells. Cancer Res., 72(16): 3919–3927. doi: 10.1158/0008-5472.CAN-11-2393.
93. Kousis P.C., Henderson B.W., Maier P.G., Gollnick S.O. (2007) Photodynamic therapy enhancement of antitumor immunity is regulated by neutrophils. Cancer Res., 67(21): 10501–10510. doi: 10.1158/0008-5472.can-07-1778.
94. Suttmann H., Riemensberger J., Bentien G. et al. (2006) Neutrophil granulocytes are required for effective Bacillus Calmette-Guérin immunotherapy of bladder cancer and orchestrate local immune responses. Cancer Res., 66(16): 8250–8257. doi: 10.1158/0008-5472.can-06-1416.
95. Huang S., Mills L., Mian B. et al. (2002) Fully humanized neutralizing antibodies to interleukin-8 (ABX-IL8) inhibit angiogenesis, tumor growth, and metastasis of human melanoma. Am. J. Pathol., 161(1): 125–134. doi: 10.1016/s0002-9440(10)64164-8.
96. Otten M.A., Leusen J.H.W., Rudolph E. et al. (2007) FcR γ-chain dependent signaling in immature neutrophils is mediated by FcαRI, but not by FcγRI. J. Immunol., 179(5): 2918–2924. doi: 10.4049/jimmunol.179.5.2918.
97. Bakema J.E., Ganzevles S.H., Fluitsma D.M. et al. (2011) Targeting FcαRI on polymorphonuclear cells induces tumor cell killing through autophagy. J. Immunol., 187(2): 726–732. doi: 10.4049/jimmunol.1002581.
98. Uribe-Querol E., Rosales C. (2015) Neutrophils in Cancer: Two Sides of the Same Coin. J. Immunol. Res., 2015: 983698. Pub. online 2015 Dec. 24. doi: 10.1155/2015/983698.
Адрес:
Лисяный Николай Иванович
04050, Киев, ул. П. Майбороды, 32
П. Майбороды, 32
ГУ «Институт нейрохирургии
им. акад. А.П. Ромоданова НАМН Украины»
Тел.: (044) 483-01-93
E-mail: [email protected]
Correspondence:
Lisyaniy Mykola
32 P. Mayborody str., Kyiv 04050
SI «Institute of Neurosurgery named after acad. A.P. Romodanov
NAMS of Ukraine»
Tel.: 044 483-01-93
E-mail: [email protected]
Общий анализ крови | Поликлиника Медицинский Комплекс
Каждый человек хоть раз в жизни сдавал кровь на общий анализ. Этот анализ берут у новорожденных в роддомах, и затем мы сталкиваемся с ним, приходя в поликлинику на профосмотр или консультацию к врачу.
Общий анализ крови (ОАК) – это лабораторно-диагностические исследование крови которое состоит из подсчета клеток крови (лейкоцитов, эритроцитов, тромбоцитов), морфологических исследований(определение размеров и формы клеток), лейкоцитарной формулы, измерение гемоглобина, величины гематокрита.
Что можно узнать из общего анализа крови?
Эритроциты (форменные элементы крови, содержащие гемоглобин, участвующие в транспорте кислорода и углекислого газа). Гемоглобин (дыхательный пигмент крови, состоящий из белковой части — глобин и железосодержащей части — гемо) и цветной показатель показывают картину красной крови. Заниженные показатели гемоглобина и эритроцитов показывают на наличие анемии. В зависимости от цветного показателя их насчитывают несколько типов. Существуют две причины возникновения анемии: кровопотери или уменьшение эритроцитов (за счет уменьшения их количества или изменения формы) и гемоглобина.
СОЭ (скорость оседания эритроцитов) — неспецифический показатель. Увеличение СОЭ может возникнуть физиологически (в пожилом возрасте или при беременности, менструации или в послеродовом периоде) и патологически (злокачественные опухоли, аутотомные заболевания, кровопотери, травмы, переломы, интоксикации и т.д.). Резкое увеличение СОЭ вместе с увеличением лейкоцитов говорит об активном воспалительном процессе. Заниженные результаты СОЭ могут появиться при голодании, приеме кортикостероидов, беременности, гипергидратации. Так же сильное снижение СОЭ может говорить о некоторых заболеваниях системы крови, при котором происходит увеличение эритроцитов и повышении вязкости крови.
Заниженные результаты СОЭ могут появиться при голодании, приеме кортикостероидов, беременности, гипергидратации. Так же сильное снижение СОЭ может говорить о некоторых заболеваниях системы крови, при котором происходит увеличение эритроцитов и повышении вязкости крови.
Лейкоциты — форменные элементы крови участвующие в иммунном ответе. Увеличение количества лейкоцитов дает нам понять о присутствии воспалительного процесса в организме. При значительном повышении лейкоцитов вместе с увеличением СОЭ возможно подозрение на злокачественные заболевания крови — лейкозы. Разобраться и классифицировать лейкозы поможет врач гематолог. Уменьшение количества лейкоцитов показывает на снижение иммунной функции организма (человек в таких случаях очень уязвим перед болезнями).
Лейкоцитарная формула — это совокупность разновидностей лейкоцитов (эозинофилы, базофилы, палочкоядерные и сегментоядерные нейтрофилы, лимфоциты и моноциты).
Повышение эозинофилов говорит о наличии аллергических процессах, паразитарных заболеваниях, гельминтозах или эозинофильных инфильтратах в легких.
Базофилы — малоизученные клетки, но появление их может свидетельствовать о нарушении функции щитовидной железы.
Палочкоядерные нейтрофилы позволяют выявить воспалительный процесс. И чем больше будет насчитано палочкоядерных нейтрофилов, тем активнее выражен воспалительный процесс.
Увеличение сегментоядерных нейтрофилов говорит о бактериальной инфекции в организме.
Повышение лимфоцитов свидетельствует о наличии вирусной инфекции (есть исключения).
Количество моноцитов может увеличиваться и при вирусной инфекции и бактериальной. Как с лимфоцитозом, так и без него.
Лейкоцитарная формула сложна и в ней много нюансов. Разобраться в динамике, соотношениях клеток, изменениях, и в связи с клинической картиной может только врач.
Тромбоциты-клетки участвующие в гемостазе(механизм обеспечивающий остановку кровотечений).
При уменьшении количества тромбоцитов время кровотечения увеличивается, сосуды становятся ломкие, поэтому на коже появляются красноватые точки или синяки, появляется кровоточивость десен, и могут возникнуть внутренние кровотечения. Увеличение тромбоцитов (тромбоцитоз). Существует первичный и реактивный тромбоцитоз. Первичный тромбоцитоз возникает из-за дефекта гемопоэтических стволовых клеток. Реактивный тромбоцитоз появляется при патологическом процессе (рассматривают как доброкачественное нарушение).
Увеличение тромбоцитов (тромбоцитоз). Существует первичный и реактивный тромбоцитоз. Первичный тромбоцитоз возникает из-за дефекта гемопоэтических стволовых клеток. Реактивный тромбоцитоз появляется при патологическом процессе (рассматривают как доброкачественное нарушение).
Гематокрит-соотношение эритроцитов и плазмы крови. Увеличение гемотокрита появляется: при новообразовании почек, легочной недостаточности, врожденных пороках сердца, эритремии, ожоговой болезни, перитоните, дегидратации организма и т. д. Снижение гемотокрита отмечено при анемии, гипергидратация, беременность (11 триместр).
О том, как подготовится к сдаче крови на общий анализ, вас проконсультирует врач, написавший направление.
Специализированное научно-практическое издания для ветеринарных врачей и студентов ветеринарных ВУЗов.
TogglerВыпуски журнала по годам
Контакты журналаvetpeterburg
Подпишись на новости Вы можете подписаться на нашу новостную рассылку.
Для этого нужно заполнить форму, указав ваш почтовый e-mail.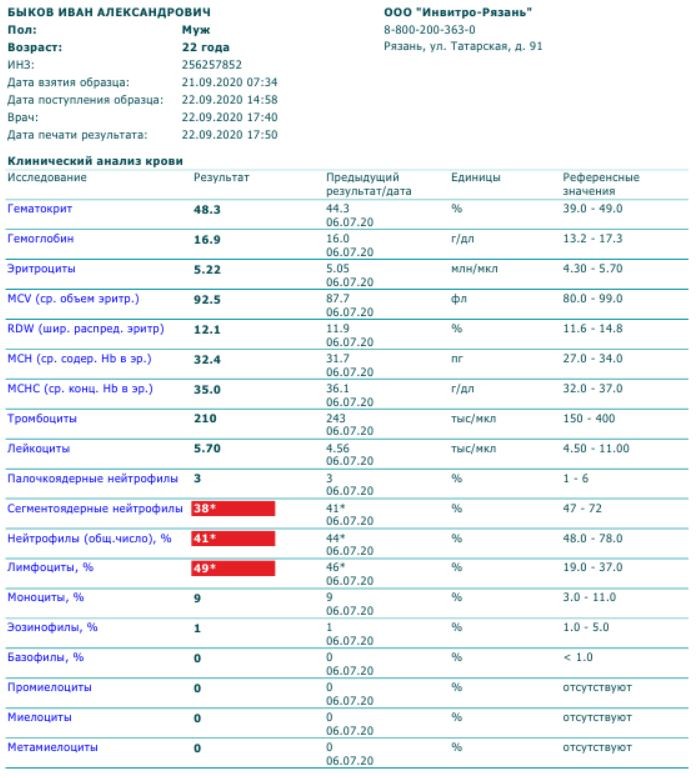
Рассылка осуществляется не более 5-6 раз в год.
Администрация сайта никогда ни при каких обстоятельствах не разглашает и не передает другим лицам данные о пользователях сайта.
Покупка бумажной версии Чтобы приобрести бумажную версию журнала необходимо оформить заказ и оплатить его онлайн.
Доставка выполняется Почтой России.
Стоимость экземпляра журнала указанна с учетом доставки.
По вопросам рассылки в другие странны обращайтесь к заместителю главного редактора: [email protected].
Предзаказ Доставка для клиник
Для ветеринарных клиник г. Санкт-Петербурга и Лен. области.
Доставка производится курьером на адрес клиники в количестве одного экземпляра.
Для оформления доставки необходимо заполнить форму. Подписка на доставку оформляется один раз и действует до тех пор, пока представитель вашей организации не подаст заявку на отмену доставки.
Оформить доставку
Гематологические изменения при кожных патологиях собак
Масимов Эдуард Нусратович
Ветеринарный врач, дерматолог, эндокринолог, терапевт
Кандидат биологических наук
Интерес к гематологическим исследованиям определяется той ролью, которую кровь выполняет в физиологических функциях организма животного, и изменениями, которые проявляются в ней при патологических процессах. Если изменения крови в той или иной степени отражаются на состоянии органов и тканей, которые она питает, то и состояние этих органов изменяется циркулирующей кровью, в зависимости от ее физико — химических и морфологических показателей. Однако при кожных патологиях собак этот важнейший показатель не достаточно изучен.
Для изучения морфологических изменений в составе периферической крови при различных поражениях кожи собак были сформированы в 4 группы по 8 голов каждой: контрольная группа, клинически здоровые собаки; группа собак больных пиодермией; группа собак больных дерматомикозом; группа собак больных демодекозом.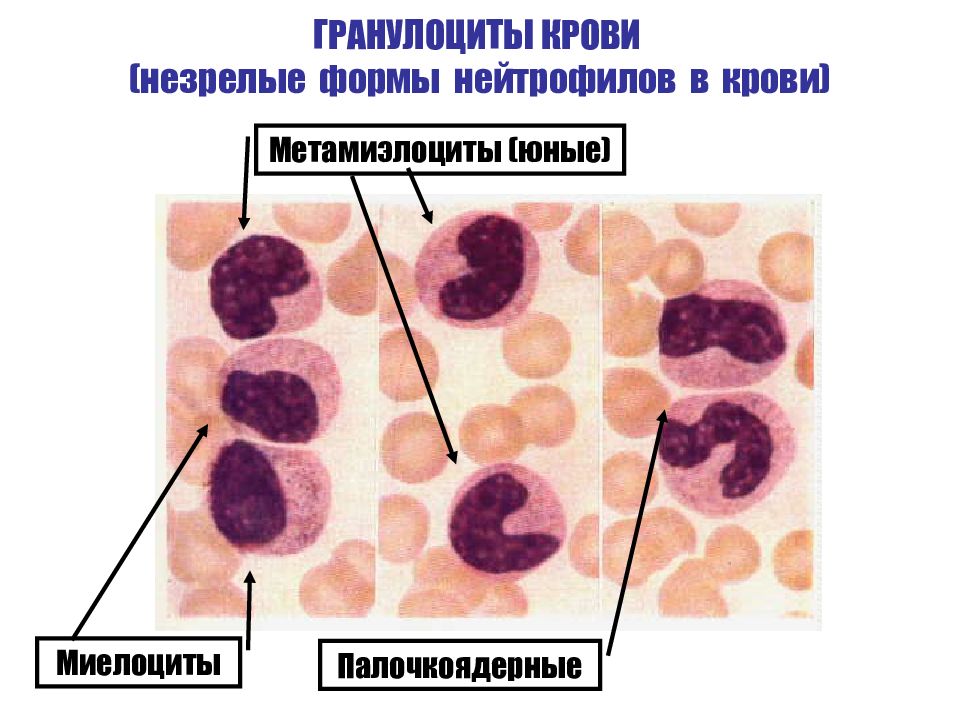
В крови всех животных определяли количество гемоглобина, эритроцитов, лейкоцитов и вычисляли процентное соотношение лейкоцитов и лейкограмм. Результаты этих исследований приедены в таблице.
Анализ данных таблицы показывает, что при пиодермиях и демодекозе происходит лейкоцитоз — количество лейкоцитов в первом случае составляет почти 14 тыс/мкл, а во втором — 12,6(+1,6) при норме от 8,5 до 10,5 тыс/мкл. В обоих случаях нами отмечен нейтрофильный лейкоцитоз — количественное увеличение юных и палочкоядерных нейтрофилов. При пиодермиях собак среднее количество юных нейтрофилов составило 6%(норма 2%), а при демодекозе 9%. Наблюдается также увеличение количества и палочкоядерных нейтрофилов(18 и 14% соответственно, при норме 1 — 6%), за счет уменьшения сегментоядерных нейтрофилов(30 и 13% соответственно, при норме 43 -70%).
Результаты гематологических исследований
| Группы собак |
Гемоглобин |
Эритроциты |
Лейкоциты |
Б |
Э |
Ю |
П |
С |
Л |
М |
|
Контрольная – клинически здоровые |
15,4 +0,2 |
7, 4 +0,6 |
9,5+ 0,2 |
— |
4 |
— |
5 |
56 |
33 |
2 |
|
Больные пиодермией |
15,2 +0,2 |
6,9 + 0,3 |
13,8 +0,2 |
1 |
5 |
6 |
18 |
30 |
39 |
1 |
|
Больные дерматомикозом |
14,0 +0,4 |
7,6 +0,1 |
9,6+0,8 |
— |
6 |
0 |
4 |
63 |
24 |
3 |
|
Больные демодекозом |
14,3 + 0,4 |
7,3+ 0,2 |
12,6 +1,6 |
— |
12 |
9 |
14 |
13 |
48 |
4 |
|
Норма |
11 -17 |
5,8- 6,4 |
8,5 -10,5 |
0-1 |
2-9 |
0-2 |
1-6 |
48-72 |
21-40 |
1-5 |
Б -базофильные лейкоциты; Э — эозинофильные лейкоциты; Ю — юные нейтрофилы; П — палочкоядерные нейтрофилы; С — сигментоядерные нейтрофилы; Л — лимфоциты; М — моноциты.
Таким образом, при пиодермиях и демодекозе наблюдаемая нейтрофилия характеризуется не только количественными изменениями, но и появлением в циркулирующей крови многочисленных палочкообразных нейтрофилов, т.е. ядерным сдвигом «влево».
Общеизвестно, что интенсивность регенерации белых кровяных телец (лейкоцитов) в костном мозге прямо пропорциональна раздрожению. Так, при демодекозе наряду со сдвигом ядра «влево», нами отмечены эозинофильный лейкоцитоз(48% при норме 21 — 40%).
При исследовании крови больных дерматомикозом собак особых морфологических и количественных изменений не выявлено. Таким образом, наиболее выраженные изменения в лейкограмме установлены при дермодекозе и пиодермии. В обоих случаях отмечено резкое увеличение юных и палочкообразных нейтрофилов, что говорит о сдвиге ядра «влево». Кроме этого, при дермодекозе также отмечено увеличение количества эозонофилов, что характерно для аллергических состоянии организма больных собак.
Вернуться к списку
Клинический случай вирусного иммунодефицита кошки
1. Hartmann K. Clinical Aspects of Feline Retroviruses: AReview. Viruses. 2012; 4: 2684–2710.
2. Barr A.C. Fiv and fiv-related diseases. In Textbook of veterinary internal medicine, 5th ed.; Ettinger S.J., Feldman E.C. Eds. WB Saunders: Philadelphia, 2000: 433–438.
3. Levy J.K., Scott H.M., Lachtara J.L., Crawford P.C. Seroprevalence of feline leukemia virus and feline immunodeficiency virus infection among cats in north america and risk factors for seropositivity. J AmVetMedAssoc. 2006; 228: 371–376.
4. Torres A.N., Mathiason C.K., Hoover E.A. Re-examination of feline leukemia virus: Host relationships using realtime pcr. Virology. 2005; 332: 272–283.
5. Pepin A.C., Tandon R., Cattori V., Niederer E., Riond B., Willi B., Lutz H., Hofmann-Lehmann R. Cellular segregation of feline leukemia provirus and viral rna in leukocyte subsets of long-term experimentally infected cats. VirusRes. 2007; 127: 9–16.
Cellular segregation of feline leukemia provirus and viral rna in leukocyte subsets of long-term experimentally infected cats. VirusRes. 2007; 127: 9–16.
6. Hofmann-Lehmann R., Huder J.B., Gruber S., Boretti F., Sigrist B., Lutz H. Feline leukaemia provirus load during the course of experimental infection and in naturally infected cats. J GenVirol. 2001; 82: 1589– 1596.
7. Gleich S., Hartmann K. Hematology and serum biochemistry of feline immunodeficiency virusinfected and feline leukemia virus-infected cats. J VetInternMed. 2009; 23: 552–558.
8. Shelton G.H., Linenberger M.L. Hematologic abnormalities associated with retroviral infections in the cat. SeminVetMedSurg (SmallAnim). 1995; 10: 220–233.
9. Brown M.R., Rogers K.S. Neutropenia in dogs and cats: A retrospective study of 261 cases. J AmAnimHospAssoc. 2001; 37: 131–139.
10. Dietrich I. Feline Tetherin Efficiently Restricts Release of Feline Immunodeficiency Virus but Not Spreading of Infection / I. Dietrich, E.L. McMonagle et al. Journal of virology. 2011: 5840–5852.
11. Zhang Z. Determinants of FIV and HIV Vif sensitivity of feline APOBEC3 restriction factors / Zeli Zhang, GuQinyong et al. Retrovirology. 2016; 13: 46.
Отвечая на ваши вопросы | Наблюдатель в медицинской лаборатории
Q
Иногда мы слышим жалобы педиатров о том, что мы сообщаем о слишком большом количестве полос в наших ручных дифференциалах. Наша лаборатория придерживается критериев классификации CAP, которые требуют видеть нить, чтобы называть сегмент, сегмент. Если ядро свернуто само по себе и трудно увидеть, что под ним, мы выбираем более зрелую клетку.
O Наш медицинский директор попросил нас изменить наши критерии сегментов и диапазонов, чтобы мы вызывали меньше диапазонов.Этот запрос, хотя и инициирован запросом врача, в первую очередь основан на наших результатах тестирования квалификации в области цитогематологии штата Нью-Йорк, где мы регулярно попадаем в верхнюю границу допустимого диапазона для диапазонов.
Я не смог найти ссылку для классификации сегментов и полос, которая не основана на критериях CAP. Чтобы переобучить наших специалистов, было бы очень полезно сослаться на авторитетный источник. Мы будем благодарны за любую помощь с этим запросом.
А
Нейтрофилы преобладают в нормальной периферической крови взрослых и могут быть обнаружены в двух формах: сегментированные нейтрофилы (1,800-7,800 / мкл) и палочкоядерные нейтрофилы (0-700 / мкл). 1 Хотя их традиционно считают двумя отдельными категориями, в отношении их полезности в клиническом ведении пациентов возникают споры. 2
Коллегия американских патологов определяет полосовой нейтрофил (ударную или посохную клетку) следующим образом: «Полосы такого же размера или немного меньше, чем метамиелоциты.Ядро расположено по центру или эксцентрично и имеет отступ более чем на половину расстояния от самого дальнего края ядра. Ядро может иметь форму полосы, сосиски, букв C или U или может иметь дольчатую форму. В случае дольчатой формы перемычка или перешеек между долями должны быть достаточно широкими, чтобы иметь два отчетливых параллельных темных края со светлым ядерным материалом между ними ». 3
Другие источники определяют диапазоны аналогичным образом. 2,4-6 И все же другие предлагают более мягкое определение: «сужение от половины до двух третей ядерной ширины как адекватное свидетельство дольчатости и классифицируют такие клетки как полиморфноядерные.” 7
Независимо от определения или того, как традиционно классифицируются полосы, в настоящее время считается, что «подсчет полос — это неспецифический, неточный и неточный лабораторный тест». 2 Кроме того, в рекомендации Института клинических и лабораторных стандартов (CLSI) говорится, что «включение« полос »в качестве отдельной категории лейкоцитов не подтверждается медицинскими данными». 8
8
Комитет по ресурсам CAP по гематологии и клинической микроскопии не поддерживает идею использования подсчета полос как часть ведения пациентов.Тем не менее, педиатры и неонатологи по-прежнему часто обращаются к педиатрам и неонатологам, когда имеешь дело с риском заражения. 9
Референсные интервалы могут сильно различаться из-за межлабораторных и внутрилабораторных вариаций, а также статистических ограничений, связанных с отбором проб на подсчет клеток (100-200 клеток). Хотя повышенное присутствие палочкоядерных нейтрофилов может наблюдаться при различных заболеваниях, таких как бактериальные и вирусные инфекции, воспалительные процессы, новообразования и другие заболевания, лейкоциты и абсолютное количество нейтрофилов могут служить лучшим диагностическим инструментом. 2,10,11 Следует также отметить, что когда неясно, является ли клетка сегментированным нейтрофилом или полосой, рекомендуется отнести ее к первой классификации. 6
Список литературы
- Клиническая диагностика и лечение Генри с помощью лабораторных методов, 22-е. Сондерс Эльзевьер: Филадельфия. (2011) Приложение A5-9. 1501-1503.
- Cornbleet PJ. Клиническая польза от подсчета полос. Клиники в Лаборатории Мед .2002; 22 (1): 101-136.
- Стекло EF. Гранулоцитарные (миелоидные) клетки. Цветной атлас гематологии: иллюстрированное практическое руководство, основанное на проверке квалификации. Нортфилд, Иллинойс: Колледж американских патологов. 1998.22-26.
- Mathur SC, Schexneider KI, Hutchison RE. В книге Генри «Клиническая диагностика и лечение с помощью лабораторных методов», 22-е. Сондерс Эльзевьер: Филадельфия. 2011. Глава 31. 536-556.
- Glasser L, Fiederlein RL. Функциональная дифференциация нормальных нейтрофилов человека. Кровь . 1987; 69: 937-944.
- NCCLS h30-А. Ссылка лейкоцитов Дифференциальный подсчет (пропорциональный) и оценка инструментальных методов.
 NCCLS 12 (1): 1-60 (март 1992 г.) Примечание: изменение названия на Институт клинических и лабораторных стандартов (2005 г.).
NCCLS 12 (1): 1-60 (март 1992 г.) Примечание: изменение названия на Институт клинических и лабораторных стандартов (2005 г.). - Грир Дж. П., Ферстер Дж., Роджерс Дж. М., Скубитц К. М.. Нейтрофильные лейкоциты. Клиническая гематология , Том 1, 12-е изд. Липпенкотт-Уильямс: Филадельфия. Глава 9. 2009: 170-213.
- Koepke JA, et al. Клиническая лаборатория и институт стандартов.Дифференциальный подсчет контрольных лейкоцитов (WBC) (пропорциональный) и оценка инструментальных методов, 2-е изд. 2007; h30-A2; 27 (4).
- Колледж американских патологов. Отчеты о подсчете полос и клиническая полезность. CAP Сегодня . 2010 (11).
- Кларк Г. Отказ от группы — практическая рекомендация CCQLM. Канадская коалиция за качество в лабораторной медицине, 2006 г. (5).
- http://www.cpsa.ab.ca/Libraries/pro_qofc_alqep_critiques/CCQLM_Band.pdf? sfvrsn = 0. По состоянию на 10 августа 2014 г.
- Al-Gwaiz LA, Babay HH. Диагностическая ценность абсолютного количества нейтрофилов, количества полос и морфологических изменений нейтрофилов в прогнозировании бактериальных инфекций. Мед Принц Практик . 2007; 16: 344-347.
квартал
Когда в осадке центрифугированной мочи видны упакованные лейкоциты, какая процедура используется для количественного определения других элементов, обнаруженных в моче, таких как бактерии, эпителии, эритроциты и т. Д.? Допустимо ли разбавление физиологическим раствором? Есть ли справочный источник для этой процедуры?
А
Микроскопия мочи стала ценным диагностическим инструментом с начала 1800-х годов. 1 Лучшая практика проведения анализа мочи требует свежей мочи; Менее чем через два часа после сбора при охлаждении некоторые мочевые элементы сохраняются в течение более длительных периодов времени, хотя могут образовываться аморфные и / или кристаллические материалы. Гипотоническая или щелочная моча может вызвать лизис любых присутствующих лейкоцитов. 2
Гипотоническая или щелочная моча может вызвать лизис любых присутствующих лейкоцитов. 2
Основной анализ мочи выполняется с помощью полосок с реагентами для определения физико-химических свойств мочи, а также других элементов. В соответствии с протоколом, установленным лабораторией, положительный результат мочи можно исследовать путем центрифугирования 12 мл хорошо перемешанной мочи при 400xg в течение пяти минут в охлаждаемой (4 ° C) центрифуге. 4 Супернатант отсасывают (не декантируют), а осадок ресуспендируют в 250 мкл нативной мочи, каплю которой затем исследуют под микроскопом. 4 Для количественной оценки можно использовать гемоцитометр. 4,5 Использование фиксированных объемов мочи необходимо для расчета точного количества частиц. Ручная оценка осадка мочи может быть дополнительно улучшена за счет использования суправитальных красителей, таких как окраска кристаллическим фиолетовым / сафранином О и фазовая мискроскопия. 2
Для концентрированной мочи можно исследовать нецентрифугированные образцы.В литературе конкретно не рассматривается разведение образцов мочи. Присутствие одного лейкоцита на поле с малым увеличением (10X) в нецентрифугированном образце составляет приблизительно 3X10 3 лейкоцитов / мл в моче. Наличие 30 лейкоцитов на поле с малым увеличением позволяет предположить, что моча содержит> 10 5 лейкоцитов на мл мочи и соответствует инфекции мочевыводящих путей. 5
Достижения в технологии анализа мочи повысили чувствительность, воспроизводимость и точность, а также сократили трудоемкую ручную подготовку и исследование осадка мочи.Несколько технологий были внедрены в автоматизацию анализа мочи. Автоматические считыватели полосок с реагентами могут стандартизировать интерпретацию изменений цвета с помощью фотометрии отражения и обычно используются во многих лабораториях. 4
Кроме того, в настоящее время используются несколько полностью автоматизированных систем анализа мочи. 6-9 В одном из типов используется технология покадровой видеосъемки для захвата сотен кадров цифровых изображений клеток, дрожжей, бактерий, слепков и кристаллов.Эти изображения можно сохранить и просмотреть соответственно, чтобы определить количество и тип присутствующих частиц.
6-9 В одном из типов используется технология покадровой видеосъемки для захвата сотен кадров цифровых изображений клеток, дрожжей, бактерий, слепков и кристаллов.Эти изображения можно сохранить и просмотреть соответственно, чтобы определить количество и тип присутствующих частиц.
В другой системе использовалась технология проточной цитометрии. Когда элементы мочевыводящих путей проходят через кювету с ламинарным потоком, лазерное освещение обеспечивает события прямого угла и бокового рассеяния, которые используются для идентификации и количественного определения белых и эритроцитов, бактерий, эпителиальных клеток и слепков, а также для определения присутствия дрожжей, кристаллов, дисморфофобии. Эритроциты и патологические слепки. 6,7 Поскольку используются фиксированные размеры образцов мочи, высокоточные оценки с помощью обоих методов могут предоставить ранее недоступную клиническую информацию.Знание количества присутствующих клеток и бактерий особенно полезно при отслеживании серийных образцов пациентов, проходящих лечение. 2
Следует отметить, что при центрифугировании образцы могут терять определенные элементы, особенно эритроциты и лейкоциты. 3 Последовательность подготовки осадка мочи — фиксированный объем мочи для центрифугирования, скорость центрифуги, размер центрифужной пробирки и надлежащая аспирация надосадочной жидкости — все это способствует изменчивости оценки осадка. Полностью автоматизированные системы анализа мочи предлагают более быстрый, точный и последовательный способ проведения анализа большого объема с минимальной технической помощью.
Список литературы
- Фогацци Г.Б., Гаригали Г. Клиническое искусство и наука о микроскопии мочи. Текущее мнение в Nephrolog Hyperten .2003; 12: 625-632.
- Макферсон Р.А., Бен-Эзра Дж. Базовое исследование мочи. В книге Генри «Клиническая диагностика и лечение с помощью лабораторных методов», 22-е.
 Эльсевер-Сондерс: Филадельфия, 2011. Глава 28.445-479.
Эльсевер-Сондерс: Филадельфия, 2011. Глава 28.445-479. - Европейская конфедерация лабораторной медицины. Европейские рекомендации по анализу мочи. Сканд Дж. Клин Лаб Инвест .2000; 60: 1-96.
- Блок DR, Lieske JC. Автоматический анализ мочи в клинической лаборатории. MLO . 2012; 44 (10): 8-12.
- Мушер Д.М., Торстейнссон С.Б., Аирола В.М. Количественный анализ мочи: диагностика инфекции мочевыводящих путей у мужчин. J Amer Med Assoc .1976; 226 (18): 2069-2072.
- Бен-Эзра Дж., Борк Л., Макферсон РА. Оценка работы автоматического анализатора анализа мочи Sysmex UF-100. Clin Chem . 1998; 44 (1): 92-95.
- Ottiger C, Huber AR. Количественный анализ частиц мочи: комплексный подход для оптимального сочетания автоматизации с UF-100 и микроскопического обзора с камерой для клеток KOVA. Clin Chem . 2003; 49 (4): 617-623.
- Wah DT, Wises PK, Бутч AW. Аналитические характеристики автоматического анализатора микроскопии мочи iQ200 и сравнение с ручным подсчетом с использованием камер для клеток Фукса-Розенталя. Ам Дж. Клин Патол . 2005; 123: 290-296.
- Chen YL, Chang MK, Chen YJ, Chang BC. Сравнение методов гемоцитометра Нойбауэра, обычного SY, локализованного SY и автоматического проточного цитометра F-100 для анализа мочи. Лаборатория Мед . 2009; 40 (4): 227-231.
Нейтрофилы: сестринское дело 2020 Реанимационное лечение
Предпосылки
Нейтрофилы (полиморфноядерные нейтрофилы [PMNs], сегменты, полисы), самые многочисленные и важные лейкоциты в реакции организма на воспаление, представляют собой первичную защиту от микробной инвазии через фагоцитоз.Эти клетки также могут вызывать повреждение тканей, высвобождая ферменты и эндогенные пирогены.
Незрелые нейтрофилы называются «уколами» или «полосами». Термин «полоса» происходит от появления ядра, которому не хватает лопастной формы зрелой клетки. Зрелые нейтрофилы называются PMN на основании характерной сегментации ядра.
Зрелые нейтрофилы называются PMN на основании характерной сегментации ядра.
Этот тест определяет наличие нейтрофилии или нейтропении. Нейтрофилия — это увеличение абсолютного количества нейтрофилов в ответ на вторжение организмов и опухолевых клеток. Нейтропения возникает, когда в костном мозге вырабатывается слишком мало нейтрофилов, слишком много нейтрофилов хранится на краю кровеносных сосудов или используется слишком много нейтрофилов.
Нормальные контрольные значения для взрослых
- Абсолютное количество нейтрофилов (АНК): от 3000 до 7000 / мм 3 или от 3 до 7 × 10 9 / л
- ANC у взрослых чернокожих: от 1,2 до 6,6 × 10 9 / L
- Дифференциал: 50% от общего количества лейкоцитов
- От 0% до 3% от общего числа PMN — это ударные или полосовые соты
Возможные причины нейтрофилии
(> 8.0 × 10 9 / L или 8000 / мм 3 ; для чернокожих американцев:> 7,0 × 10 9 / л или 7000 / мм 3 )
- Острые, локализованные и общие бактериальные инфекции. Также грибковые и спирохетические и некоторые паразитарные и риккетсиозные инфекции.
- Воспаление и некроз тканей
- Метаболические отравления
- Химические вещества и лекарства, вызывающие разрушение тканей
- Острое кровотечение, острая гемолитическая трансфузионная реакция, гемолитическая анемия
- Миелопролиферативное заболевание
- Злокачественные новообразования
- Некоторые вирусные и паразитарные инфекции
Отношение сегментоядерных нейтрофилов к полосовым нейтрофилам
Обычно от 1% до 3% PMN представляют собой ленточные формы (незрелые нейтрофилы).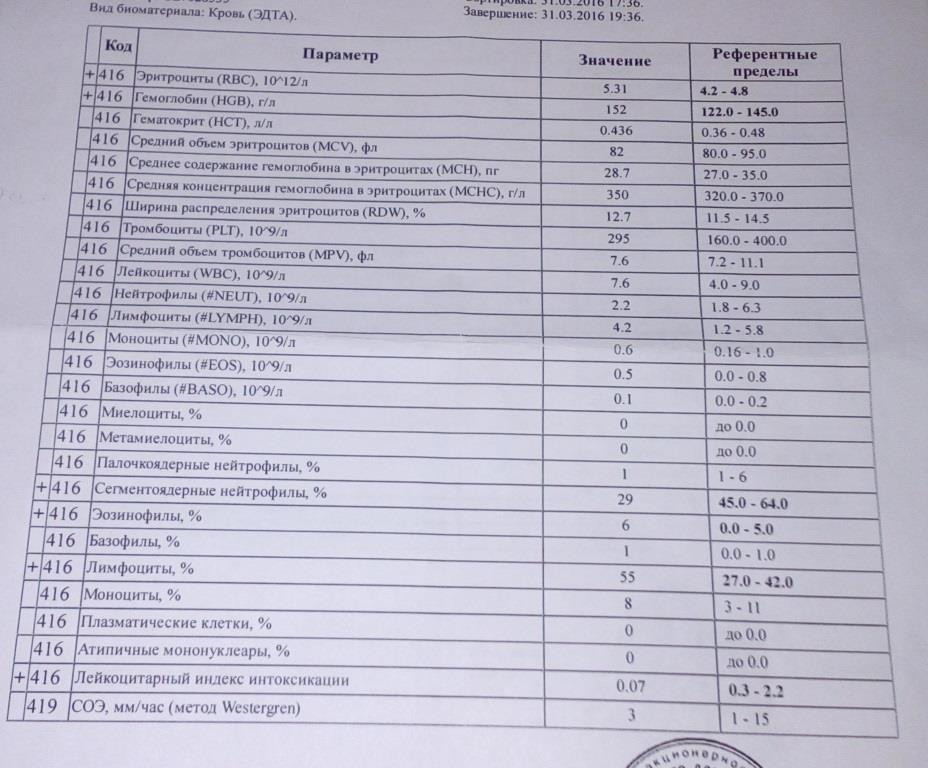
- Дегенеративный сдвиг влево: при некоторых подавляющих инфекциях наблюдается увеличение полосовых форм без лейкоцитоза (плохой прогноз).
- Регенеративный сдвиг влево: при бактериальных инфекциях наблюдается увеличение полосовых форм с лейкоцитозом (хороший прогноз).
- Сдвиг вправо: уменьшение полостных клеток с повышенным содержанием сегментоядерных нейтрофилов может возникать при заболеваниях печени, мегалобластной анемии, гемолизе, лекарствах, раке и аллергиях.
- Гиперсегментация нейтрофилов без полостных клеток обнаруживается при мегалобластных анемиях и хронической морфиновой зависимости.
Возможные причины нейтропении
(<1,800 / мм 3 или <1,8 × 10 9 / л; чернокожие американцы: <1000 / мм 3 или <40% дифференциального подсчета)
- Причины, связанные со сниженным или неэффективным образованием нейтрофилов:
- Наследственные нарушения стволовых клеток и генетические нарушения клеточного развития
- Острые подавляющие бактериальные инфекции и сепсис
- Вирусные инфекции
- Некоторые риккетсиозные и паразитарные болезни
- Наркотики, химические вещества, ионизирующее излучение, яды
- Болезни кроветворения
- Причины, связанные со снижением выживаемости нейтрофилов:
- Инфекции, в основном у лиц с небольшими запасами костного мозга или без них, пожилые люди
- Коллагеновые сосудистые заболевания с антинейтрофильными антителами
- Аутоиммунные заболевания, такие как системная красная волчанка
- Гиперчувствительность к лекарствам
- Секвестрация селезенки
Клиническое предупреждение
Агранулоцитоз (выраженная нейтропения и лейкопения) часто приводит к летальному исходу. Пациенты с агранулоцитозом должны быть защищены от инфекции с помощью указанных мер предосторожности, связанных с передачей инфекции, с уделением особого внимания соблюдению правил гигиены рук.
Пациенты с агранулоцитозом должны быть защищены от инфекции с помощью указанных мер предосторожности, связанных с передачей инфекции, с уделением особого внимания соблюдению правил гигиены рук.
Источник: Fischbach FT, Fischbach MA. Руководство Фишбаха по лабораторным и диагностическим исследованиям . 10-е изд. Филадельфия, Пенсильвания: Уолтерс Клувер; 2018.
Хроническая нейтропения | Центр гемофилии и тромбоза штата Индиана
Когда количество клеток, борющихся с бактериями, хронически низкое
Нейтрофилы — это белые кровяные тельца.Они образуются вместе со всеми другими типами клеток крови в костном мозге. Костный мозг — это красная мягкая губчатая часть внутри костей.
Нейтрофилы выполняют очень специфическую задачу: идентифицировать и уничтожать микробы бактерий. Нейтрофилы циркулируют по всем тканям организма (ротовая полость, кишечник, кожа, легкие и т. Д.).
Нейтропения (нуклеопени-а) — это низкое количество циркулирующих в крови клеток, борющихся с бактериями. Это может увеличить риск заражения.
Нейтрофилы измеряются с помощью теста CBC (общий анализ крови).Нейтрофилы перечислены в дифференциальной части (называемой «разница») полного анализа крови. Это анализ крови для подсчета количества клеток каждого типа в крови.
Нейтрофилы — убийцы бактерий — существуют разные типы нейтрофилов, все с немного разными функциями:
- гранулоциты
- полиморфноядерные нейтрофилы
- сегментированных нейтрофилов
- полосчатые нейтрофилы
Нейтрофилы обычно составляют от 1/3 до 2/3 всего семейства белых кровяных телец.Другие клетки семейства белых кровяных телец, такие как лимфоциты, моноциты, эозинофилы и базофилы, не особенно полезны в борьбе с бактериальными инфекциями.
Это общее количество нейтрофилов в организме человека, которое определяет, достаточно ли борцов с бактериями, чтобы справиться с инфекцией.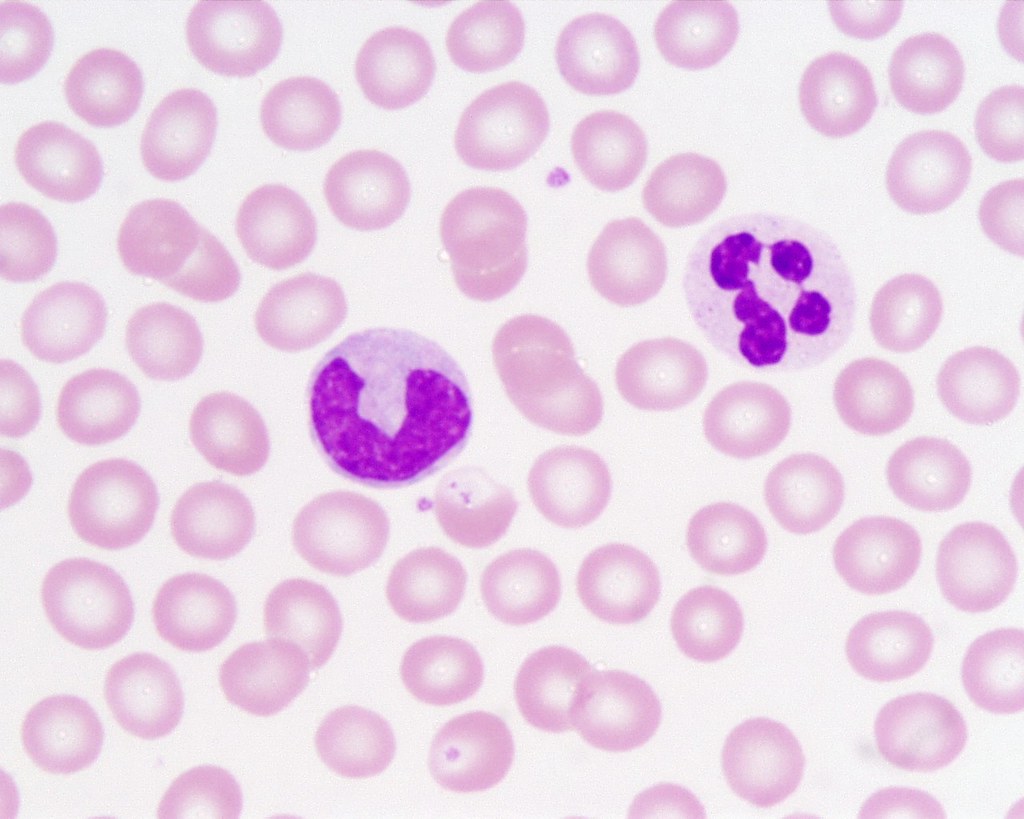 Этот индекс борьбы с инфекцией называется абсолютным числом нейтрофилов (АНК). Поскольку некоторые люди называют нейтрофилы гранулоцитами, вы можете услышать индекс борьбы с инфекцией, называемый абсолютным количеством гранулоцитов (AGC).ANC и AGC говорят об одном и том же: о вашей способности бороться с бактериальными инфекциями.
Этот индекс борьбы с инфекцией называется абсолютным числом нейтрофилов (АНК). Поскольку некоторые люди называют нейтрофилы гранулоцитами, вы можете услышать индекс борьбы с инфекцией, называемый абсолютным количеством гранулоцитов (AGC).ANC и AGC говорят об одном и том же: о вашей способности бороться с бактериальными инфекциями.
Нормальный ДРП для кавказцев (взрослых и детей старше двух лет) — что-либо выше 1500. Для афроамериканцев нормальный показатель выше 1000.
ANC рассчитывается путем умножения общего процента нейтрофилов (сложение всех поли / сегментов и полос / уколов) на общее количество лейкоцитов (WBC).
- Легкая нейтропения (АНК между 500 и 1000) обычно не является проблемой.
- Тяжелая нейтропения (АНК ниже 500) всегда вызывает беспокойство из-за повышенного риска бактериальных инфекций.
- Диапазон значений ANC 200-500 может включать: инфекции уха и горла, кожные фурункулы, язвы во рту, воспаление десен или инфекции мочевыводящих путей
- ANC ниже 200 опасных и опасных для жизни инфекций. Некоторые из них включают: пневмонию, менингит, заражение крови или септический шок.
Причины
Нейтропения может быть вызвана некоторыми вирусными инфекциями или некоторыми лекарствами. В этих случаях нейтропения чаще всего носит временный характер.
Хроническая нейтропения определяется как продолжающаяся более 2 месяцев. Со временем это может исчезнуть или остаться на всю жизнь. Некоторые люди рождаются с ней (врожденная нейтропения), а у других она развивается в раннем детстве.
Циклическая нейтропения — это когда количество нейтрофилов в норме большую часть времени, но предсказуемо падает с регулярными интервалами или циклами примерно каждые три недели.
Доброкачественная нейтропения в детском возрасте чаще всего обнаруживается случайно, так как в целом дети чувствуют себя хорошо.АНК для ребенка с доброкачественной нейтропенией может быть ниже 500, но когда они заражаются, их костный мозг способен выделять достаточно нейтрофилов в циркулирующую кровь, чтобы поднять АНК и бороться с инфекцией.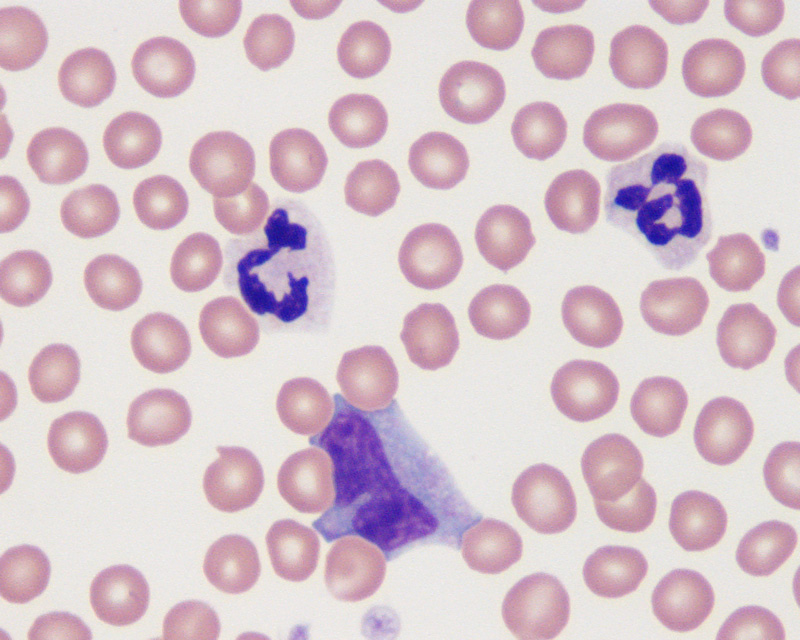
Аутоиммунная нейтропения, вероятно, вызвана выработкой антител, которые прикрепляются к нейтрофилам и вызывают их разрушение в кровотоке. Похоже, что нет проблем со способностью костного мозга вырабатывать нейтрофилы.
Лечение
Есть лекарства, которые стимулируют костный мозг вырабатывать больше нейтрофилов.Чаще всего используется препарат под названием «11 гранулоцитарный колониестимулирующий фактор» (11 GCSFI или просто GCSF). Чаще всего его вводят в виде крошечной инъекции под кожу, подобно тому, как диабетики принимают инсулин. Количество нейтрофилов обычно остается высоким только во время приема лекарства. Некоторым людям нужно принимать лекарство каждый день, другие могут принимать его несколько раз в неделю. Регулярно принимая GCSF, можно избежать самых тяжелых инфекций.
На что я должен смотреть? Признаки инфекции включают:
- Лихорадка> 101 F (38.5 С)
- Боль, покраснение, отек суставов или лимфатических узлов
- Покраснение, отек или болезненные язвы или слезы во рту или в области гениталий
Вы должны немедленно сообщить об этих симптомах своему врачу или медсестре (даже если вы заметили их посреди ночи).
Если возникают незначительные инфекции, их можно лечить антибиотиками перорально и / или местными аппликациями на кожу. При более серьезных инфекциях необходимо будет вводить антибиотики внутривенно в больнице.
Что я могу сделать?
Общее здоровье и благополучие
- Незамедлительно сообщите о симптомах (особенно о лихорадке> 101)
- Будьте в курсе вакцинаций, посещений врача и стоматологической помощи
- Позаботьтесь о зубах и деснах
- Принять все дозы назначенных лекарств
- Если используются прикроватные увлажнители воздуха, очищайте их ежедневно и промывайте разбавленным отбеливателем еженедельно.
- Проконсультируйтесь с врачом перед тем, как давать какие-либо травы или добавки
- Очистить царапины и порезы водой с мылом с последующим нанесением бетадина или неоспорина
- Не оставляйте пластыри дольше 24 часов
- Избегайте применения суппозиториев и измерения ректальной температуры
Гигиена
- Душ ежедневно.
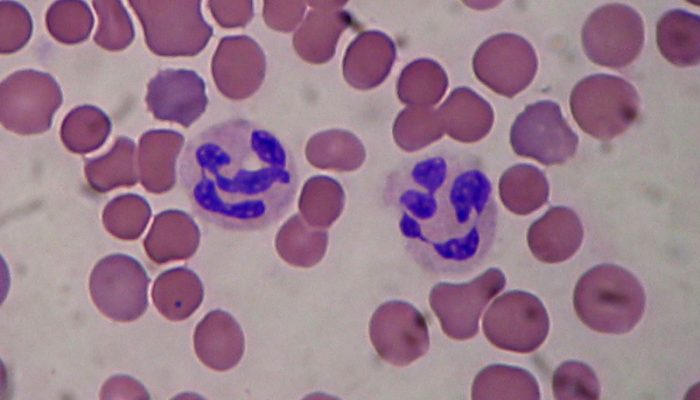 Ограничьте время принятия ванн до 10 минут
Ограничьте время принятия ванн до 10 минут - Часто мойте руки, особенно перед едой
- Следите за чистотой области детских пеленок. Для девушек, которые принимают ванну с пеной: не более 10 минут (предпочитают душ)
Меры предосторожности при питании
- Тщательно готовьте мясо / рыбу / птицу / яйца
- Избегайте салатных баров в ресторанах
- Тщательно вымыть фрукты и овощи
- Выбирайте фрукты и овощи, которые можно очистить или тщательно промыть
- Избегайте фаст-фуда и ферментированных чаев
Здоровый образ жизни
- Избегайте заплесневелых участков, сена, измельченной мульчи и навоза от любых животных
- Замена воздушных / печных фильтров ежемесячно
- Провести испытание колодезной воды
- Не чистить аквариумы, клетки / туалеты для домашних животных
- Держать открытые игровые песочницы закрытыми
- Сделайте прививки домашним животным
- Поговорите со своим врачом или медсестрой о домашних животных, чтобы их избегать
IHTC стремится предоставлять квалифицированную помощь младенцам, детям, подросткам и взрослым с хронической нейтропенией.Как центр передового опыта в лечении нарушений свертываемости и свертываемости крови, IHTC предлагает высокий уровень скоординированной помощи пациентам с этим заболеванием. Мы также обеспечиваем оперативную связь с вашим местным поставщиком медицинских услуг относительно нашего плана лечения и вашего прогресса. Команда IHTC сотрудничает с национальными экспертами, и пациенты могут участвовать в научных исследованиях.
В IHTC работают врачи, являющиеся экспертами в лечении хронической нейтропении и оказывающие поддержку пациентам с этим заболеванием.Поскольку у каждого пациента может быть разная скорость прогрессирования заболевания и разные симптомы, очень важно, чтобы вас осмотрел врач, знакомый с признаками и методами лечения хронической нейтропении. Мы можем помочь вам с диагностикой, тестированием и лечением; и может предоставить диетические, генетические и общие консультации в зависимости от ваших конкретных потребностей. Для получения дополнительной информации свяжитесь с нами по телефону 877.CLOTTER (877.256.8837).
Мы можем помочь вам с диагностикой, тестированием и лечением; и может предоставить диетические, генетические и общие консультации в зависимости от ваших конкретных потребностей. Для получения дополнительной информации свяжитесь с нами по телефону 877.CLOTTER (877.256.8837).
Band Cell — обзор
Дети младше 3 месяцев
Риск серьезной бактериальной инфекции зависит от возраста.Хотя лонгитюдные исследования показывают, что в течение первых 3 месяцев жизни только 1-2% детей обращаются за медицинской помощью по поводу лихорадки, большая часть таких младенцев с лихорадкой страдает серьезными бактериальными инфекциями, чем дети более старшего возраста. 12–15 Риск наиболее высок в период новорожденности и в течение первого месяца (и повышается у недоношенного ребенка).
В проспективном исследовании исследователи из Рочестера определили факторы, связанные с низким риском серьезной бактериальной инфекции у детей младше 3 месяцев с лихорадкой. 16 Среди 233 новорожденных, родившихся в срок без перинатальных осложнений или основных заболеваний, не получавших антибиотики и госпитализированных с лихорадкой, 144 (62%) считались маловероятными с серьезной бактериальной инфекцией и выполнили все следующие критерии: (1) отсутствие клинических признаков инфекции уха, кожи, костей или суставов; (2) количество лейкоцитов (WBC) от 5000 до 15000 / мм 3 ; (3) <1500 ленточных ячеек / мм 3 ; и (4) нормальные результаты анализа мочи.Только у 1 из этих 144 младенцев (0,7%) была «серьезная» бактериальная инфекция ( Salmonella гастроэнтерит), и ни у одного не было бактериемии. Напротив, среди 89 младенцев, которые не соответствовали этим критериям, 22 (25%) имели серьезную бактериальную инфекцию ( P <0,0001) и 9 (10%) имели бактериемию ( P < 0,0005).
Последующие расследования в значительной степени подтвердили результаты исследования в Рочестере. 17–20 Хотя исследователи использовали несколько иные критерии для определения младенцев с лихорадкой и низким риском серьезной бактериальной инфекции, все они обнаружили, что риск серьезного бактериального заболевания в группе, определяемой как группа низкого риска, действительно очень низок.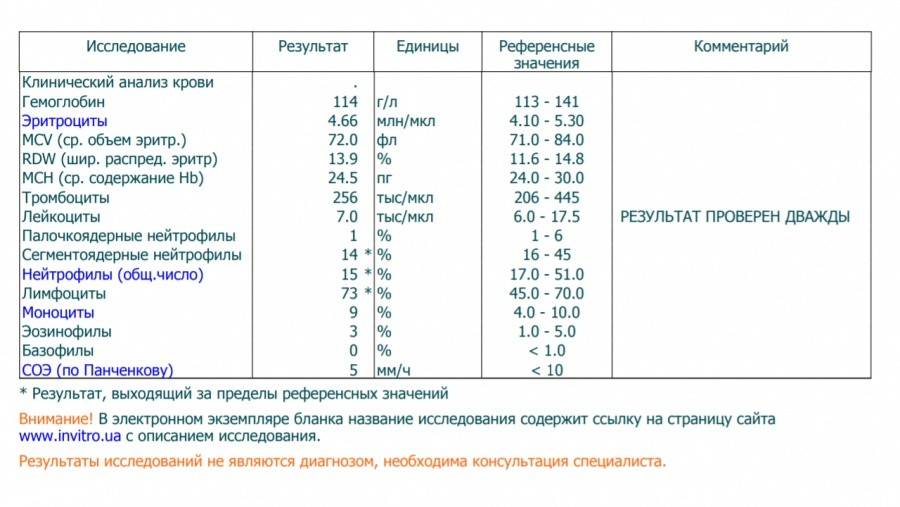 .В метаанализе исследований детей с лихорадкой в возрасте до 3 месяцев риски «серьезного бактериального заболевания», бактериемии и менингита составили 24,3%, 12,8% и 3,9% соответственно у младенцев «высокого риска» и 2,6%. %, 1,3% и 0,6%, соответственно, у младенцев «низкого риска». 15 Отрицательная прогностическая ценность серьезных бактериальных заболеваний младенцев, удовлетворяющих критериям низкого риска, колебалась от 95% до 99% (и составляла 99% для бактериемии и 99,5% для менингита). 15 Таким образом, клиническая и лабораторная оценка может использоваться для выявления немногим более 50% младенцев с лихорадкой в возрасте до 3 месяцев с очень низким риском серьезных бактериальных инфекций.
.В метаанализе исследований детей с лихорадкой в возрасте до 3 месяцев риски «серьезного бактериального заболевания», бактериемии и менингита составили 24,3%, 12,8% и 3,9% соответственно у младенцев «высокого риска» и 2,6%. %, 1,3% и 0,6%, соответственно, у младенцев «низкого риска». 15 Отрицательная прогностическая ценность серьезных бактериальных заболеваний младенцев, удовлетворяющих критериям низкого риска, колебалась от 95% до 99% (и составляла 99% для бактериемии и 99,5% для менингита). 15 Таким образом, клиническая и лабораторная оценка может использоваться для выявления немногим более 50% младенцев с лихорадкой в возрасте до 3 месяцев с очень низким риском серьезных бактериальных инфекций.
Наблюдательное исследование более 3000 младенцев в возрасте до 3 месяцев с лихорадкой > 38 ° C, получавших лечение практикующими врачами и представленное в рамках сети педиатрических исследований в офисных условиях, показало, что большинство (64%) не были госпитализированы. 3,21 Практикующие врачи индивидуализировали управление и полагались на клиническую оценку; «Руководящие принципы» соблюдались только в 42% эпизодов. 3,21,22 Результаты детей отличные. Если бы эти рекомендации были соблюдены, результаты не улучшились бы, но было бы проведено значительно больше лабораторных анализов и больше госпитализаций. 3
Риск серьезной бактериальной инфекции еще больше снизился благодаря заметному снижению заболеваемости стрептококками группы B с ранним началом благодаря эффективной перинатальной антимикробной профилактике колонизированных беременных женщин. 23 Риск серьезных бактериальных инфекций также ниже у детей с лихорадкой, у которых выявлена вирусная инфекция. 24
stab нейтрофил — перевод на французский — примеры английский
Присоединяйтесь к Reverso, это бесплатно и быстро !
английскийарабский Немецкий английский испанский Французский иврит Итальянский Японский нидерландский язык Польский португальский румынский русский турецкий китайский язык
ФранцузскийСинонимы арабский Немецкий английский испанский Французский иврит Итальянский Японский нидерландский язык Польский португальский румынский русский турецкий китайский язык
Эти примеры могут содержать грубые слова, основанные на вашем поиске.
Эти примеры могут содержать разговорные слова, основанные на вашем поиске.
гранулоцитарно-нейтрофильный несегментарныйПредложите пример
Другие результаты
Относительное количество палочкоядерных нейтрофилов, увеличилось до 5,5% и сегментированных нейтрофилов до 70%.
Изменения в количестве лейкоцитов наблюдались через 48 часов после воздействия, которые характеризовались увеличением количества лейкоцитов из-за увеличения количества ударов и сегментированного количества нейтрофилов , которые не превышали нормальных уровней.
Модификации лейкоцитов, которые наблюдались в течение 48 часов после выставки, наблюдались за увеличением количества лейкоцитов, связанных с количеством накопленных нейтрофилов, сегментов и несегментов , которые не прошли. Возможно неприемлемый контентРазблокировать
Примеры используются только для того, чтобы помочь вам перевести слово или выражение, которое вы искали в различных контекстах.Они не выбираются и не проверяются нами и могут содержать неприемлемые термины или идеи. Сообщите, пожалуйста, примеры, которые нужно редактировать или не отображать. Грубые или разговорные переводы обычно отмечаются красным или оранжевым цветом. Нет результатов для этого значения. Показать больше примеровРезультатов: 2. Точное: 0. Затраченное время: 117 мс.
HistoLab3a.htm
ГИСТОЛОГИЧЕСКАЯ ЛАБОРАТОРИЯ VII — СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМАУМЕТЬ ИДЕНТИФИЦИРОВАТЬ:
артериола
артерия
капилляр
сердечная мышца
эндо-, мио- и эпикард
эластическая артерия
внутренняя и внешняя эластические пластинки
волокно Пуркинье
tunica platinum, media, and adventitia vasi
vasi.vasa vasorum)
вена
венула
Слайд № 170 (Артерия, вена и нерв) Есть несколько особенностей, которые позволяют различать артерии и вены. Артерии иметь более толстую более регулярную оболочку носителя. В гистологических препаратах они чаще сохраняют свой круглый профиль при поперечной резке раздел. Вены часто выглядят «сплющенными» или сплющенными. при тех же обстоятельствах.Кроме того, средства массовой информации вены намного тоньше, чем в артериях, а адвентиция самый толстый слой.
Определить три слоя артерий и вен и обратите внимание на разницу в толщине.
Слайд № 174 В очень больших сосудах добавочный слой (внешний слой) будет содержать кровеносные сосуды (vasa vasorum) которые снабжают стенку сосуда.Вегетативные нервы встречаются во всех сосуды, но не видны без специальных методов окрашивания. (т.е. не ищите нервов!)
Слайд № 90 (Эластичная артерия) Это участок всего часть аорты человека. Обратите внимание на большую составляющую эластичного волокна в оболочке media (средний слой) по сравнению к мышечной артерии на предыдущем слайде. С какой стороны сечение люминальная сторона? [подсказка: определить туника интима (внутренний слой)]
Слайды № 27 и № 28 и Слайды № 177 и № 179 Проверьте себя на этих слайдах, пока вы не почувствуете себя комфортно различать артерии и артериолы из вен и венул.Помните, их внешний вид будет зависеть от того, были ли они разрезаны продольно, поперечно, наклонно или по касательной (см. рисунок сразу после таблицы содержания).
Это изображение артериолы в продольном сечении.
Артериола в разрезе.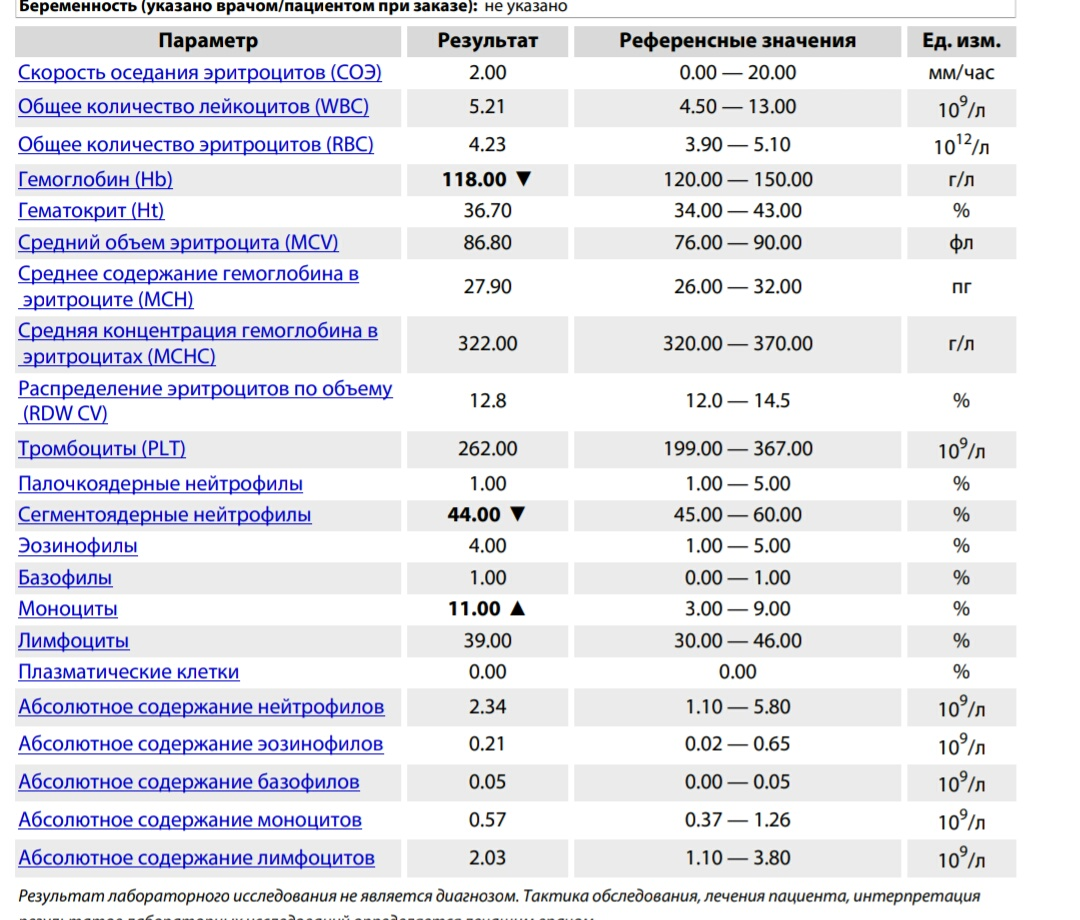
В различных текстах сосуды называются артериолами, если они имеют две, три, или до семи слоев гладкой мускулатуры. У этого судна есть около пять слоев гладкой мускулатуры, так что артериола в одном текст и небольшая мышечная артерия в другом.
Мы назовем любую малую артерию до пяти слоев гладкая мускулатура артериола.
Капиллярный
Как видно в просвечивающем электронном микроскопе (ТЕМ)
Слайд № 107 Обзор морфологии сердечной мышцы и Волокна Пуркинье.
HISTOLOGY LAB VIII — КРОВИ И РАЗВИТИЕ КРОВИ
УМЕТЬ ИДЕНТИФИЦИРОВАТЬ:
эритроцит
гранулоцит
лейкоцит
лимфоцит
моноцит
мегакариоцит,
тромбоцит
элоцитофил или нутрито- миелоцито- миелоцито- миелоцитофилы
полосатая (ударная) клетка (нутри-, эозино- или базофильная)
сегментированный (зрелый) гранулоцит (нутро-, эозино- или базофил)
специфические гранулы
базофильный эритробласт
полихроматофильный 905 нуклеофильный эритрофильный
нормобласт
периферическая кровь
Слайд № 15 Мазок крови человека, окраска Райта.Во время сканирования по мазку становится очевидно, что эритроцитов больше всего многочисленный тип клеток периферической крови. На основании морфологического критериев, используйте объектив с высокой степенью сухости, чтобы различать следующие клетки крови (тогда, если хотите, присмотритесь к своему масляная иммерсионная линза):
Эритроциты (эритроциты ) — от 7 до 9 ед. диаметр, без ядра, округлой формы.
диаметр, без ядра, округлой формы.
Периферическая зона эритроцитов окрашивается в глубокий оранжево-красный цвет, тогда как
центральная зона кажется бледной и временами бесцветной.Размер
центральной зоны и общей интенсивности окрашивания
эритроцит пропорционален содержанию гемоглобина.
Тромбоциты — диаметром от 1 до 3 мкм.
Тромбоциты представляют собой цитоплазматические фрагменты, происходящие из мегакариоцитов.
Обычно они окрашиваются в голубой цвет и содержат гранулы красного или пурпурного цвета.
Эти фрагменты имеют тенденцию образовывать небольшие агрегаты, хаотично разбросанные.
по всему мазку крови.
ВЫШЕ
Микрофотографии от Bloom & Fawcett, Учебник гистологии, издание одиннадцатое
НИЖЕ
Микрофотографии Аллена Л.Колокол
I. Гранулоциты
Все клетки этой категории содержат вторичные (специфические) гранулы.
Характеристики окрашивания вторичных гранул очень специфичны.
для каждого типа ячеек, тем самым облегчая идентификацию
три разных типа гранулоцитов. Еще одно отличительное
Особенностью является наличие многолепесткового ядра. Есть три
типы гранулоцитов.
нейтрофилы (полиморфноядерные лейкоциты; ПЯН) —
Диаметр от 10 до 15 мкм.
Эти клетки составляют 70% лейкоцитов и обычно имеют от 2 до
5 ядерных долей соединены тонкими нитями хроматина. Нейтрофилов
являются самыми многочисленными из всех лейкоцитов, поэтому их легче всего
идентифицировать. Цитоплазма от розового до серого из-за нейтрального
окрашивание конкретных гранул (т. е. не окрашивают). Нейтрофилов
действуют как поглотители во внесосудистой ткани, разрушая
бактерии или другие инфекционные организмы, попадающие в организм.
Нейтрофилы также называют полиморфноядерными лейкоцитами (PMN).
в некоторых лабораториях, хотя следующие два типа клеток
также имеют многодольчатые ядра.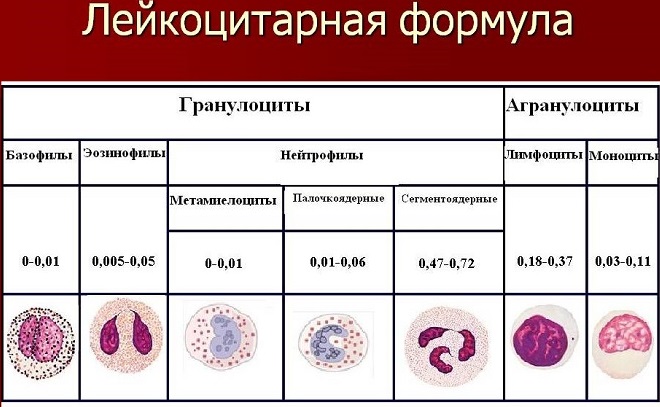
Эозинофилы — диаметр от 10 до 15 мкм
Эозинофилы составляют от 2,0 до 4,0% лейкоцитов. Эти клетки
обычно содержат двулопастное (двухлепестковое) ядро и цитоплазму
полный ярко окрашенных эозинофильных (оранжево-красных) специфических гранул.
Эозинофилы действуют как фагоциты для уничтожения личинок.
паразитов, вторгшихся в ткани i.е. при трихинеллезе, шистосомозе,
и, по-видимому, играют роль в аллергических реакциях. Прочие функции
эозинофилов включают фагоцитоз комплексов антиген-антитело.
Базофилы — диаметр от 10 до 15 мкм.
Базофилы составляют примерно от 0,5 до 1,0% лейкоцитов
и поэтому их труднее найти в обычном мазке крови.
Ядро состоит из 2–3 долей, но обычно не так дольчатое.
как нейтрофилы. Цитоплазма полна темно-пурпурных специфических
гранулы. Базофилы также фагоцитируют, но в основном функционируют.
как тучные клетки (т.е. их гранулы содержат гистамин и гепарин
которые играют важную роль в возникновении острого воспалительного процесса.
отклик).
II. Агранулоциты
Как следует из названия, эти лейкоциты обычно не имеют различимого
цитоплазматические гранулы.
Лимфоциты — диаметр от 9 до 14 мкм
Лимфоциты составляют 20-25% агранулоцитов и могут
быть маленькими, средними или большими по размеру.Ядро округлой формы или
овальной формы и обычно такого же размера, как эритроцит. Хроматин
плотно упакован без видимых ядрышек. По сравнению с
ядра других клеток, ядро лимфоцита почти всегда появляется
размазанный. Цитоплазма скудная, окрашена в бледно-голубой цвет. Лимфоциты
состоят из двух субпопуляций: Т-лимфоциты и В-лимфоциты,
которые имеют отличительные функциональные отличия. Однако они
выглядят морфологически идентичными в окрашенных мазках крови
ты используешь.Некоторые лимфоциты мигрируют в соединительные ткани.
и стать плазменными клетками.
Цитоплазма скудная, окрашена в бледно-голубой цвет. Лимфоциты
состоят из двух субпопуляций: Т-лимфоциты и В-лимфоциты,
которые имеют отличительные функциональные отличия. Однако они
выглядят морфологически идентичными в окрашенных мазках крови
ты используешь.Некоторые лимфоциты мигрируют в соединительные ткани.
и стать плазменными клетками.
Моноциты — Диаметр от 12 до 20 мкм
Моноциты составляют 3-8% агранулоцитов. Этот большой
клетка имеет слегка окрашенное ядро, которое часто выглядит подковообразным
или в форме почки. Хроматин выглядит кружевным, ядрышки
обычно не проявляется.Ядро немного похоже на «мозг».
Обильная окраска цитоплазмы и нередко содержат вакуоли.
(небольшие, чистые участки). Эти области помогают различать моноциты
из крупных лимфоцитов. Часто присутствуют мелкие плотные гранулы.
(Да! Даже если они называются агранулоцитами.) Моноциты мигрируют
в соединительную ткань и становятся макрофагами.
Развитие крови
Слайды № 99 и 172 ( Мазок красного костного мозга, человек).Вы должны уметь определять стадии гранулоцитарной (миелоцитарный) и эритроцитарный серии развития.
Гранулоциты
Все стадии клеток гранулоцитарного ряда, кроме миелобластов, в цитоплазме будет какая-то гранула. Развивающиеся нейтрофилы являются самыми многочисленными. Развивающиеся эозинофилы и базофилы встречаются реже, и их труднее найти.
Миелобласт — Диаметр от 16 до 20 мкм
Эти клетки редко видны и их трудно различить
из проэритробластов эритроцитарного ряда.Выдающиеся ядрышки
и скудная базофильная цитоплазма — два отличительных признака. Не пытайтесь идентифицировать эту ячейку.
Промиелоцит — Диаметр от 15 до 25 мкм
Отличительными чертами клеток на стадии промиелоцитов являются
(1) крупный размер, (2) округлое, зазубренное ядро и (3) многочисленные
азурофильные (темно-синие, пурпурные) или первичные гранулы в цитоплазме. Не пытайтесь идентифицировать эту ячейку.
Измененный рисунок из вашего текста.Обратите внимание на различия в маркировке базофильных эритробластов, ранних и
Поздний метамиелоцит (полоса или удар), нормобласт, и ретикулоцитов
Миелоцит — диаметр от 15 до 30 мкм
Это первая стадия, на которой можно различить
нейтрофилов, эозинофилов и базофилов по наличию специфических
гранулы в цитоплазме. Форма ядра изменчива,
но обычно с отступом и смещением от центра.Цитоплазма
усеян азурофильными и специфическими гранулами. Большинство из
клетки на этой стадии являются нейтрофильными, поскольку нейтрофилы
самый многочисленный вид зрелых гранулоцитов. Клетки в миелоците
ступень также может иметь четкий ореол, граничащий с углублением
ядро представитель обширного аппарата Гольджи.
Метамиелоцит —
От 10 до 16 мкм в диаметре
Эти клетки также могут быть нейтрофильными, эозинофильными или
базофильная разновидность и похожа на клетки миелоцита
за исключением того, что они (1) меньше по размеру и (2) демонстрируют
глубоко вдавленное ядро в форме почки.
Форма ленты («Stab») — 10-15 мк
Клетки на этой стадии имеют длинное истонченное ядро с параллельными
стороны: то есть напоминает толстую полосу, протянутую через центр
клетки, а чаще подковы. Остальная часть клетки
все еще показывает другие характеристики зрелого нейтрофила.
Сегментированный
Форма — (зрелая клетка)
Это зрелая форма, обнаруженная в предыдущей периферической крови
горка.Отличительная черта — наличие нескольких
Ядерные доли соединены тонкими нитевидными тяжами хроматина.
Серия эритроцитов
Отличительные характеристики ячеек данной серии это отсутствие цитоплазматических гранул и, кроме первая и последняя стадии — центрально расположенное хорошо округленное ядро.. Опять же, просто определите подчеркнутых ячеек.
Проэритробласт Не пытайтесь идентифицировать эту клетку.
Базофильный
эритробласт — диаметр от 12 до 18 мкм
Наиболее выдающейся особенностью клеток на этой стадии является глубокая
базофильная цитоплазма. Ядро круглое, с слипшимся хроматином.
и находится в центре города. Эти клетки может быть трудно различить
на некоторых из ваших слайдов.
Полихроматофильный эритробласт — от 10 до 12 ед.
диаметр
Эти клетки меньше, а ядерный материал более конденсирован.
чем на предыдущем этапе. За счет повышенного синтеза гемоглобина,
цитоплазма теперь окрашивается от сине-серого до серо-зеленого. Очередной раз,
обратите внимание на округлую форму ядра.
Нормобласт (ортохроматофильный эритробласт)
— от 9 до 11 мкм диаметром
Называются нормобластами, потому что цитоплазма приближается к «нормальной».
Картина окрашивания зрелых эритроцитов: i.е. красно-оранжевый из-за
к концентрации гемоглобина. Ядро намного меньше
и более плотный (пикнотический) на периферии клетки, готовый к
экструдированный.
Ретикулоцит — диаметр от 8 до 9 единиц
Эти клетки являются безъядерными и неотличимы от зрелых
эритроциты стандартным окрашиванием Райта. При лечении суправиталом
краситель, цитоплазматические рибосомы и остаточный ретикулярный каркас
очевидны. ( Вы не можете найти эти клетки, но должны знать, что
они есть.)
Эритроцит — диаметр от 7 до 8 мкм
Эти зрелые функциональные клетки двояковогнутые, безъядерные и эозинофильные.
Они содержат небольшой участок центральной бледности (бледное окрашивание в
центр).
Прочее ячеек то возможно видно в красный кость костный мозг препараты :
Мегакариоциты — очень крупные клетки (примерно 50 до 100 ед) с извитым ядром.Кусочки разрыва цитоплазмы выходят из этих клеток и попадают в кровоток в виде тромбоциты. Из-за своего размера эти клетки наиболее заметны при сканирование слайда на малой мощности.
Лимфоциты и предшественники моноцитов — нет займитесь этими клетками сейчас.
Плазменные клетки и Макрофаги — см. Лабораторию по соединительному элементу ткань.
GO НАЗАД (Содержание)
stab% 20neutrophil — определение английского языка, грамматика, произношение, синонимы и примеры
У нас пока нет определений.Корень
Хирургическая техника Вправление перелома на переломном столе. Удар надрез. Невиданный интрамедуллярный гвоздь.
спрингер
Человек, который ел, остался со мной, а затем назад зарезал меня, я хочу знать, кто он!
OpenSubtitles2018.v3
Значит, он ударил тебе ножом в шею?
OpenSubtitles2018.v3
Каждую неделю в этой дыре происходит шесть убийств и 23 ножевых ранений и .
OpenSubtitles2018.v3
Парень пришел с ножевым ранением и умер от сердечного приступа.
opensubtitles2
Фрэнсис Мерес говорит, что Марлоу « зарезал до смерти непристойным слугой, его соперником в его непристойной любви» в качестве наказания за его «эпикуризм и атеизм».
WikiMatrix
Я зарезал посыльного с медальоном, и он сбежал
opensubtitles2
По словам Шерцера в качестве командира боевой группы «Фулриеде» ( Stab Panzergrenadier-Regiment 165) в составе Panzer-AOK 5.
WikiMatrix
Исследовательская торакотомия, риски которой невелики по сравнению с тампонадой перикарда, обычно показана при колотых ранениях сердца.
спрингер
Когда вы убиваете короля … вы не убиваете его ножом в темноте
opensubtitles2
OpenSubtitles2018.v3
Расстроенный восприятием того, что ему отказали в мести, Рэпп неоднократно наносил ножевым ранениям террориста, которого он преследовал, который уже мертв из засады, прежде чем его вытащили U.С. сил.
WikiMatrix
OpenSubtitles2018.v3
OpenSubtitles2018.v3
Полученная таким образом китайская лекарственная композиция может быть использована для лечения колотых ран, ожогов, ожогов и различных травм с быстрым эффектом, короткими курсами лечения и уменьшением боли у пациента.
патенты-wipo
Нет, я говорю, что если прикосновение к ним в этом месте погрузит их в сон, может быть, заколоть их было бы чертовски хорошим способом убить их.
OpenSubtitles2018.v3
OpenSubtitles2018.v3
Найдите никчемного сукина сына, который зарезал того мальчика!
OpenSubtitles2018.v3
Я дам тебе 10 баксов, чтобы ударил меня по лицу прямо сейчас.
OpenSubtitles2018.v3
В студию ко мне пришла Stab
opensubtitles2
Сначала они не могли найти эту классную булавку, которую она носила, потому что она была глубоко врезана из-за удара .
